EVALUASI RISIKO SEMI-QUANTITATIVE KADAR HISTAMIN IKAN TUNA PADA PROSES PEMBONGKARAN DI TRANSIT
DAN PENGOLAHAN PRODUK TUNA LOIN BEKU
PUSPITA KURNIA HARDIANA C34050164
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
EVALUASI RISIKO SEMI-QUANTITATIVE KADAR HISTAMIN IKAN TUNA PADA PROSES PEMBONGKARAN DI TRANSIT
DAN PENGOLAHAN PRODUK TUNA LOIN BEKU
SKRIPSI
PUSPITA KURNIA HARDIANA C34050164
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : EVALUASI RISIKO SEMI-QUANTITATIVE KADAR HISTAMIN IKAN TUNA PADA PROSES PEMBONGKARAN DI TRANSIT DAN PENGOLAHAN PRODUK TUNA LOIN BEKU
Nama : Puspita Kurnia Hardiana
NRP : C34050164
Menyetujui,
Pembimbing I Pembimbing II
Ir. Wini Trilaksani, M.Sc Bambang Riyanto, S.Pi, M.Si NIP. 19610128 198601 2 001 NIP. 19690631 199802 1 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Linawati Hardjito, MS NIP. 19620528 198703 2 003
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Evaluasi Risiko
Semi-quantitative Kadar Histamin Ikan Tuna pada Proses Pembongkaran di Transit dan Pengolahan Produk Tuna Loin Beku” adalah hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Agustus 2009
Puspita Kurnia Hardiana C34050164
KATA PENGANTAR
Pertama-tama penulis panjatkan puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Evaluasi Risiko Semi-quantitative Kadar Histamin Ikan Tuna pada Proses Pembongkaran di Transit dan Pengolahan Produk Tuna Loin Beku” ini dengan baik. Skripsi ini merupakan salah satu syarat
untuk memperoleh gelar Sarjana Perikanan di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Ir. Wini Trilaksani, M.Sc dan Bapak Bambang Riyanto, S.Pi, M.Si selaku dosen pembimbing skripsi, atas segala bimbingan dan pengarahan dalam penyusunan skripsi ini.
2. Ibu Ir. Komariah Tampubolon, MS dan Ibu Dra. Pipih Suptijah, MBA selaku dosen penguji, atas segala saran dan masukan bagi penulis.
3. Ibu Dr. Ir. Linawati Hardjito, MS selaku ketua Departemen Teknologi Hasil Perairan.
4. Bapak Dr. Ir. Agoes M. Jacoeb, Dipl. Biol selaku komisi pendidikan Departemen Teknologi Hasil Perairan atas segala bantuan dan kesabarannya. 5. Kedua orang tua penulis di rumah, atas ketulusan cinta, kasih sayang,
dukungan moril dan materiil serta kepercayaan dan doa yang telah diberikan pada penulis, semoga selalu dalam lindungan Allah SWT.
6. Ibu Farida selaku pemilik PT Makmur Jaya Sejahtera serta Bapak William Wijaya dan Bapak Marjadi selaku General Manager PT Makmur Jaya Sejahtera yang telah memberikan kesempatan kepada penulis untuk melaksanakan penelitian di perusahaan.
7. Bapak M. Zaenuddin selaku QC Manager PT Makmur Jaya Sejahtera serta
Bapak J. Slamet dan Bapak M. Yunus selaku Production Manager PT Makmur Jaya Sejahtera atas segala bimbingan dan pengarahannya selama
8. Mbak Sulis, mbak Ety, mbak Titin, mbak Mince, mbak Ria, mbak Nina, mbak Yanti, mas Ari serta seluruh staff dan karyawan PT Makmur Jaya
Sejahtera atas bantuannnya selama penulis melaksanakan penelitian di PT Makmur Jaya Sejahtera.
9. Ahong selaku pemilik PT Mulia Sejahtera Mandiri (transit 14) atas izin yang diberikan kepada penulis untuk melaksanakan penelitian di transit 14.
10. Bapak Ir. H. R. Una Rusmana, MM selaku kepala Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan (BPMPHPK DKI Jakarta) dan Ibu Sri Haryati, S.Pi, M.Si selaku kepala bagian pengujian mutu Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan (BPMPHPK DKI Jakarta) atas izin yang diberikan kepada penulis untuk melaksanakan penelitian di BPMPHPK DKI Jakarta.
11. Mbak Helma, mbak Ayu, mbak Elis, bu Yuli, pak Wahyu, pak Kur, mas Pur, mas Vandy, mas Gigi, mas Ucup, mas Agung, mas Kukuh, mas Woko, mas Adi, mbak Lely, mbak Tita, Ira (Unibraw) serta seluruh staff bagian pengujian mutu Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan (BPMPHPK DKI Jakarta) atas segala bantuannya selama penulis melaksanakan penelitian di BPMPHPK DKI Jakarta.
12. “Alcatraz Community” (Tri Miranti, Dian Ifkarul Izzah, Riski Andriyanti, Windi Agusmiati, Lidia Puspa Agustiani, Diah Rany PS, Salsabila Yazthi, Astiani Tri Wulandari, Dian Amallia, Safinah Surya Hakim, Khairani Putri, Nur Wahyuni) atas rasa persaudaraan dan kebersamaannya selama ini.
13. Ika Zaharani, Melda Aniyalisa, Safrina Dyah, Purwati Ningsih, Istifa Rini,
Dewi Mariana, Anggi Novriani, Martca Roseta, Anne Prasastyane, Uut Tri Utami, Evi Purnama Sari, Sofia Halimi, Prilisa Syukrontyas, Ary Apriland, Stefanus, Fathu Rahman, M. Zaenuri, Fuad Wahdan, Rustamaji, Brinadho, M. Irfan, dan “THPers’42” yang lain atas kebersamaan, keceriaan, dan persaudaraan yang indah ini, “All of you are my best friend.”
15. Mas dan keluarga di Muara Baru, atas segala bantuan selama penulis melaksanakan penelitian di Muara Baru.
16. Semua pihak yang telah membantu penulis dalam penyusunan skripsi ini yang tidak dapat penulis sebutkan satu per satu.
Penulis menyadari bahwa skripsi ini masih terdapat kekurangan. Oleh karena itu, kritik dan saran yang bersifat membangun dari semua pihak sangat penulis harapkan demi perbaikan. Akhir kata, semoga skripsi ini dapat bermanfaat dan dapat memberikan informasi yang berguna bagi semua pihak yang memerlukan.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Sragen, Jawa Tengah pada tanggal 14 November 1986. Penulis merupakan anak tunggal dari ayah Mustofa dan ibu Sri Linggarjati Ningsih.
Penulis memulai jenjang pendidikan formal di SD N 12 Purwodadi (tahun 1993-1999), selanjutnya penulis melanjutkan pendidikannya di SLTP N 1 Purwodadi (tahun 1999-2002). Pendidikan menengah atas ditempuh penulis di SMA N 1 Purwodadi (tahun 2002-2005). Pada tahun 2005, penulis diterima di Institut Pertanian Bogor melalui jalur USMI
(Undangan Seleksi Masuk IPB) dan pada tahun 2006 penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan seperti Himpunan Mahasiswa Teknologi Hasil Perikanan (Himasilkan) periode 2008-2009, Badan Eksekutif Mahasiswa (BEM) FPIK periode 2006-2007, UKM Uni Konservasi Fauna (UKF) IPB, dan OMDA Persatuan Mahasiswa Purwodadi (Permadi). Penulis juga aktif sebagai asisten mata kuliah ikhtiologi tahun ajaran 2007/2008 dan 2008/2009, diversifikasi dan pengembangan produk perairan tahun ajaran 2008/2009, serta asisten mata kuliah teknologi pemanfaaatan hasil samping dan limbah tahun ajaran 2008/2009. Selain itu, penulis juga aktif dalam kepanitiaan berbagai kegiatan kemahasiswaan di Institut Pertanian Bogor. Penulis juga pernah mengikuti pelatihan Hazard
Analysis Critical Control Point (HACCP) dan ISO 22000:2005 yang diadakan di Institut Pertanian Bogor serta telah melaksanakan praktek lapang di PT Era Mandiri Cemerlang, Muara Baru - Jakarta Utara. Prestasi yang pernah diraih penulis selama masa perkuliahan adalah menjadi finalis dalam Pekan Ilmiah Mahasiswa Nasional (PIMNAS) XXII 2009 di Universitas Brawijaya, Malang.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 5
2. TINJAUAN PUSTAKA ... 6
2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus Sp.) ... 6
2.2 Komposisi Gizi Ikan Tuna ... 7
2.3 Tuna Loin Beku ... 8
2.4 Perubahan Fisik Daging Ikan ... 12
2.5 Kemunduran Mutu Ikan ... 13
2.6 Histamin ... 17
2.6.1 Histamin pada ikan tuna... 17
2.6.1.1 Pembentukan histamin selama autolisis... 18
2.6.1.2 Aktivitas bakteri... 19
2.6.2 Reaksi fisiologis histamin... 21
2.7 Risk Assessment. ... 22
2.7.1 Qualitatative risk assessment ... 25
2.7.2 Semi-quantitative risk assessment ... 26
2.7.3 Quantitative risk assessment ... 26
3. METODOLOGI ... 28
3.1 Waktu dan Tempat ... 28
3.2 Alat dan Bahan ... 28
3.3 Metode Penelitian ... 29
3.3.1 Tahap pengamatan proses pembongkaran ikan tuna di transit dan pengolahan produk tuna loin beku ... 29
3.3.2 Tahap penilaian sanitasi higiene tempat pembongkaran ikan (transit) dan penilaian kelayakan dasar Unit Pengolahan Ikan (UPI).. ... 31
3.3.3 Tahap penilaian risiko (risk assessment) kadar histamin ... 32
3.3.3.1 Hazard identification (identifikasi bahaya) ... 32
3.3.3.2 Exposure assessment (penilaian paparan) ... 33
3.3.3.4 Risk characterization (karakterisasi risiko) ... 35
4.1.2.8 Penentuan mutu dan penimbangan I (grading and weighing) ... 50
EVALUASI RISIKO SEMI-QUANTITATIVE KADAR HISTAMIN IKAN TUNA PADA PROSES PEMBONGKARAN DI TRANSIT
DAN PENGOLAHAN PRODUK TUNA LOIN BEKU
PUSPITA KURNIA HARDIANA C34050164
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
EVALUASI RISIKO SEMI-QUANTITATIVE KADAR HISTAMIN IKAN TUNA PADA PROSES PEMBONGKARAN DI TRANSIT
DAN PENGOLAHAN PRODUK TUNA LOIN BEKU
SKRIPSI
PUSPITA KURNIA HARDIANA C34050164
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : EVALUASI RISIKO SEMI-QUANTITATIVE KADAR HISTAMIN IKAN TUNA PADA PROSES PEMBONGKARAN DI TRANSIT DAN PENGOLAHAN PRODUK TUNA LOIN BEKU
Nama : Puspita Kurnia Hardiana
NRP : C34050164
Menyetujui,
Pembimbing I Pembimbing II
Ir. Wini Trilaksani, M.Sc Bambang Riyanto, S.Pi, M.Si NIP. 19610128 198601 2 001 NIP. 19690631 199802 1 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Linawati Hardjito, MS NIP. 19620528 198703 2 003
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Evaluasi Risiko
Semi-quantitative Kadar Histamin Ikan Tuna pada Proses Pembongkaran di Transit dan Pengolahan Produk Tuna Loin Beku” adalah hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Agustus 2009
Puspita Kurnia Hardiana C34050164
KATA PENGANTAR
Pertama-tama penulis panjatkan puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “Evaluasi Risiko Semi-quantitative Kadar Histamin Ikan Tuna pada Proses Pembongkaran di Transit dan Pengolahan Produk Tuna Loin Beku” ini dengan baik. Skripsi ini merupakan salah satu syarat
untuk memperoleh gelar Sarjana Perikanan di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Ir. Wini Trilaksani, M.Sc dan Bapak Bambang Riyanto, S.Pi, M.Si selaku dosen pembimbing skripsi, atas segala bimbingan dan pengarahan dalam penyusunan skripsi ini.
2. Ibu Ir. Komariah Tampubolon, MS dan Ibu Dra. Pipih Suptijah, MBA selaku dosen penguji, atas segala saran dan masukan bagi penulis.
3. Ibu Dr. Ir. Linawati Hardjito, MS selaku ketua Departemen Teknologi Hasil Perairan.
4. Bapak Dr. Ir. Agoes M. Jacoeb, Dipl. Biol selaku komisi pendidikan Departemen Teknologi Hasil Perairan atas segala bantuan dan kesabarannya. 5. Kedua orang tua penulis di rumah, atas ketulusan cinta, kasih sayang,
dukungan moril dan materiil serta kepercayaan dan doa yang telah diberikan pada penulis, semoga selalu dalam lindungan Allah SWT.
6. Ibu Farida selaku pemilik PT Makmur Jaya Sejahtera serta Bapak William Wijaya dan Bapak Marjadi selaku General Manager PT Makmur Jaya Sejahtera yang telah memberikan kesempatan kepada penulis untuk melaksanakan penelitian di perusahaan.
7. Bapak M. Zaenuddin selaku QC Manager PT Makmur Jaya Sejahtera serta
Bapak J. Slamet dan Bapak M. Yunus selaku Production Manager PT Makmur Jaya Sejahtera atas segala bimbingan dan pengarahannya selama
8. Mbak Sulis, mbak Ety, mbak Titin, mbak Mince, mbak Ria, mbak Nina, mbak Yanti, mas Ari serta seluruh staff dan karyawan PT Makmur Jaya
Sejahtera atas bantuannnya selama penulis melaksanakan penelitian di PT Makmur Jaya Sejahtera.
9. Ahong selaku pemilik PT Mulia Sejahtera Mandiri (transit 14) atas izin yang diberikan kepada penulis untuk melaksanakan penelitian di transit 14.
10. Bapak Ir. H. R. Una Rusmana, MM selaku kepala Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan (BPMPHPK DKI Jakarta) dan Ibu Sri Haryati, S.Pi, M.Si selaku kepala bagian pengujian mutu Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan (BPMPHPK DKI Jakarta) atas izin yang diberikan kepada penulis untuk melaksanakan penelitian di BPMPHPK DKI Jakarta.
11. Mbak Helma, mbak Ayu, mbak Elis, bu Yuli, pak Wahyu, pak Kur, mas Pur, mas Vandy, mas Gigi, mas Ucup, mas Agung, mas Kukuh, mas Woko, mas Adi, mbak Lely, mbak Tita, Ira (Unibraw) serta seluruh staff bagian pengujian mutu Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan (BPMPHPK DKI Jakarta) atas segala bantuannya selama penulis melaksanakan penelitian di BPMPHPK DKI Jakarta.
12. “Alcatraz Community” (Tri Miranti, Dian Ifkarul Izzah, Riski Andriyanti, Windi Agusmiati, Lidia Puspa Agustiani, Diah Rany PS, Salsabila Yazthi, Astiani Tri Wulandari, Dian Amallia, Safinah Surya Hakim, Khairani Putri, Nur Wahyuni) atas rasa persaudaraan dan kebersamaannya selama ini.
13. Ika Zaharani, Melda Aniyalisa, Safrina Dyah, Purwati Ningsih, Istifa Rini,
Dewi Mariana, Anggi Novriani, Martca Roseta, Anne Prasastyane, Uut Tri Utami, Evi Purnama Sari, Sofia Halimi, Prilisa Syukrontyas, Ary Apriland, Stefanus, Fathu Rahman, M. Zaenuri, Fuad Wahdan, Rustamaji, Brinadho, M. Irfan, dan “THPers’42” yang lain atas kebersamaan, keceriaan, dan persaudaraan yang indah ini, “All of you are my best friend.”
15. Mas dan keluarga di Muara Baru, atas segala bantuan selama penulis melaksanakan penelitian di Muara Baru.
16. Semua pihak yang telah membantu penulis dalam penyusunan skripsi ini yang tidak dapat penulis sebutkan satu per satu.
Penulis menyadari bahwa skripsi ini masih terdapat kekurangan. Oleh karena itu, kritik dan saran yang bersifat membangun dari semua pihak sangat penulis harapkan demi perbaikan. Akhir kata, semoga skripsi ini dapat bermanfaat dan dapat memberikan informasi yang berguna bagi semua pihak yang memerlukan.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Sragen, Jawa Tengah pada tanggal 14 November 1986. Penulis merupakan anak tunggal dari ayah Mustofa dan ibu Sri Linggarjati Ningsih.
Penulis memulai jenjang pendidikan formal di SD N 12 Purwodadi (tahun 1993-1999), selanjutnya penulis melanjutkan pendidikannya di SLTP N 1 Purwodadi (tahun 1999-2002). Pendidikan menengah atas ditempuh penulis di SMA N 1 Purwodadi (tahun 2002-2005). Pada tahun 2005, penulis diterima di Institut Pertanian Bogor melalui jalur USMI
(Undangan Seleksi Masuk IPB) dan pada tahun 2006 penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan seperti Himpunan Mahasiswa Teknologi Hasil Perikanan (Himasilkan) periode 2008-2009, Badan Eksekutif Mahasiswa (BEM) FPIK periode 2006-2007, UKM Uni Konservasi Fauna (UKF) IPB, dan OMDA Persatuan Mahasiswa Purwodadi (Permadi). Penulis juga aktif sebagai asisten mata kuliah ikhtiologi tahun ajaran 2007/2008 dan 2008/2009, diversifikasi dan pengembangan produk perairan tahun ajaran 2008/2009, serta asisten mata kuliah teknologi pemanfaaatan hasil samping dan limbah tahun ajaran 2008/2009. Selain itu, penulis juga aktif dalam kepanitiaan berbagai kegiatan kemahasiswaan di Institut Pertanian Bogor. Penulis juga pernah mengikuti pelatihan Hazard
Analysis Critical Control Point (HACCP) dan ISO 22000:2005 yang diadakan di Institut Pertanian Bogor serta telah melaksanakan praktek lapang di PT Era Mandiri Cemerlang, Muara Baru - Jakarta Utara. Prestasi yang pernah diraih penulis selama masa perkuliahan adalah menjadi finalis dalam Pekan Ilmiah Mahasiswa Nasional (PIMNAS) XXII 2009 di Universitas Brawijaya, Malang.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 5
2. TINJAUAN PUSTAKA ... 6
2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus Sp.) ... 6
2.2 Komposisi Gizi Ikan Tuna ... 7
2.3 Tuna Loin Beku ... 8
2.4 Perubahan Fisik Daging Ikan ... 12
2.5 Kemunduran Mutu Ikan ... 13
2.6 Histamin ... 17
2.6.1 Histamin pada ikan tuna... 17
2.6.1.1 Pembentukan histamin selama autolisis... 18
2.6.1.2 Aktivitas bakteri... 19
2.6.2 Reaksi fisiologis histamin... 21
2.7 Risk Assessment. ... 22
2.7.1 Qualitatative risk assessment ... 25
2.7.2 Semi-quantitative risk assessment ... 26
2.7.3 Quantitative risk assessment ... 26
3. METODOLOGI ... 28
3.1 Waktu dan Tempat ... 28
3.2 Alat dan Bahan ... 28
3.3 Metode Penelitian ... 29
3.3.1 Tahap pengamatan proses pembongkaran ikan tuna di transit dan pengolahan produk tuna loin beku ... 29
3.3.2 Tahap penilaian sanitasi higiene tempat pembongkaran ikan (transit) dan penilaian kelayakan dasar Unit Pengolahan Ikan (UPI).. ... 31
3.3.3 Tahap penilaian risiko (risk assessment) kadar histamin ... 32
3.3.3.1 Hazard identification (identifikasi bahaya) ... 32
3.3.3.2 Exposure assessment (penilaian paparan) ... 33
3.3.3.4 Risk characterization (karakterisasi risiko) ... 35
4.1.2.8 Penentuan mutu dan penimbangan I (grading and weighing) ... 50
4.2.1 Penyimpangan minor ... 57
4.2.2 Penyimpangan mayor ... 58
4.2.3 Penyimpangan serius ... 60
4.2.4 Penyimpangan kritis ... 60
4.3 Tahap Penilaian Risiko (Risk Assessment) Kadar Histamin ... 60
4.3.1 Hazard identification (identifikasi bahaya)... 61
4.3.2 Exposure assessment (penilaian paparan) ... 64
4.3.2.1 Kadar histamin, TVB, TPC, dan bakteri pembentuk histamin pada proses pembongkaran ikan tuna di transit dan pengolahan tuna loin beku di PT Makmur Jaya Sejahtera... 65
4.3.2.1.1 Kadar histamin TVB, TPC, dan jumlah bakteri pembentuk histamin pada proses pembongkaran ikan tuna di transit... 65
4.3.2.1.2 Kadar histamin TVB, TPC, dan jumlah bakteri pembentuk histamin pada proses pengolahan tuna loin beku di PT Makmur Jaya Sejahtera... 74
4.3.2.1.3 Hasil pengujian kadar histamin produk tuna loin beku di Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan DKI Jakarta (BPMPHPK DKI Jakarta)... 80
4.3.2.2 Konsumsi ikan yang mengandung histamin... 81
4.3.2.3 Frekuensi dan durasi kejadian keracunan histamin... 82
4.3.3 Hazard characterization (karakterisasi bahaya) ... 83
4.3.4 Risk characterization (karakterisasi risiko) ... 86
4.4 Tahap Sintesis Hasil Pengkajian Penilaian Risiko (Risk Assessment) Kadar Histamin ... 91
5. KESIMPULAN DAN SARAN ... 94
5.1 Kesimpulan ... 94
5.2 Saran ... 95
DAFTAR TABEL
Nomor Teks Halaman
1. Komposisi nilai gizi beberapa jenis ikan tuna dan tuna like-species... 8 2. Persyaratan mutu dan keamanan pangan tuna loin beku
(SNI-01-4104.1-2006)... 12 3. Jenis-jenis dan spesifikasi bakteri pembentuk histamin yang terdapat
pada ikan laut... 21 4. Tingkat bahaya histamin per 100 g daging ikan... 22 5. Perbedaan klasifikasi kualitas mutu (grade) ikan tuna... 45 6. Data tingkat konsumsi seafood di Amerika Serikat Tahun 2003-2007. 82 7. Penilaian risiko secara semi kuantitatif dari bahaya histamin pada
ikan tuna segar bagi penduduk Jepang... 87 8. Penilaian risiko secara semi kuantitatif dari bahaya histamin pada
produk tuna loin beku bagi penduduk Amerika Serikat... 89 9. Rangkuman hasil pengkajian penilaian risiko (risk assessment) kadar
histamin... 93
DAFTAR GAMBAR
Nomor Teks Halaman
1. Ikan tuna (Thunnus Sp.)... 6 2. Penampang membujur daging merah ikan tuna berdasarkan lapisan 8 lemak... 3. Perubahan myoglobin pada daging segar... 13 4. Proses perubahan yang terjadi pada ikan setelah mati... 16 5. Reaksi perubahan histidin menjadi histamin... 18 6. Hubungan antara komponen dalam risk analysis... 23 7. Diagram alir hubungan empat komponen dalam risk assessment... 32 8. Daging ikan tuna dengan berbagai kualitas mutu (grade)... 44 9. Histogram rata-rata kadar histamin pada proses pembongkaran ikan
tuna di transit... 66 10. Histogram rata-rata kadar TVB pada proses pembongkaran ikan tuna di transit... 68 11. Histogram nilai rata-rata log TPC pada proses pembongkaran ikan tuna di transit... 70 12. Histogram nilai rata-rata log jumlah bakteri pembentuk histamin pada proses pembongkaran ikan tuna di transit... 72 13. Histogram perbandingan nilai rata-rata log jumlah bakteri pembentuk
histamin dan nilai rata-rata log TPC pada proses pembongkaran ikan tuna di transit... 73 14. Histogram rata-rata kadar histamin pada proses pengolahan tuna loin
beku... 74 15. Histogram rata-rata kadar TVB pada proses pengolahan tuna loin beku 76 16. Histogram nilai rata-rata log TPC pada proses pengolahan tuna loin
beku... 77 17. Histogram nilai rata-rata log jumlah bakteri pembentuk histamin pada
proses pengolahan tuna loin beku... 78 18. Histogram perbandingan nilai rata-rata log jumlah bakteri pembentuk
histamin dan nilai rata-rata log TPC pada proses pengolahan tuna loin
beku... 79 19. Histogram rata-rata hasil analisis kadar histamin produk tuna loin
beku pada bulan September 2008 sampai dengan bulan Februari 2009
DAFTAR LAMPIRAN
Nomor Halaman
1. Denah ruang PT Makmur Jaya Sejahtera (lantai 1)... 102 2. Denah ruang PT Makmur Jaya Sejahtera (lantai 2)... 103 3. Daftar penilaian sanitasi higiene tempat pembongkaran ikan (transit).. 104 4. Daftar penilaian kelayakan dasar Unit Pengolahan Ikan (UPI)... 106 5. Sertifikat Kelayakan Pengolahan (SKP) PT Makmur Jaya Sejahtera.... 119 6. Sertifikat penerapan HACCP PT Makmur Jaya Sejahtera... 120 7. Prosedur pengolahan yang baik (Good Manufacturing Practices atau
GMP) produk tuna loin beku... 121 8. Prosedur pelaksanaan standar sanitasi (Sanitation Standard Operating
Procedures atau SSOP) ... 127 9. Diagram alir proses pengolahan tuna loin beku... 133 10. Harvest vessel receiving log... 134 11. Record of receiving raw material... 135 12. Record of internal laboratory analysis (raw material tuna)... 136 13. Record of internal laboratory analysis (water and ice test)... 137 14. Record of internal laboratory analysis (swabbing test)... 138 15. Histamin test record... 139 16. Record of external laboratory analysis (water test)... 140 17. Record of external laboratory analysis (ice test)... 141 18. Record of process temperature... 142 19. Record of cold storage and air blast freezer temperature... 143 20. Record of daily sanitation control... 144 21. Record of internal calibration... 147 22. Hasil pengukuran suhu dan waktu selama proses pembongkaran ikan
tuna di transit 14 (PT Mulia Sejahtera Mandiri) dan pengolahan produk tuna loin beku di PT Makmur Jaya Sejahtera... 148 23. Data mentah hasil analisis kadar histamin, TVB, TPC, dan jumlah
bakteri pembentuk histamin pada sampel ikan tuna... 149 24. Data rata-rata hasil analisis kadar histamin, TVB, TPC, dan jumlah
26. Contoh perhitungan kadar Total Volatile Base (TVB)... 157 27. Hasil analisis statistik data kadar histamin, TVB, TPC, dan jumlah
1. PENDAHULUAN
1.1 Latar Belakang
Laut Indonesia yang memiliki luas lebih kurang 5,8 juta km2 dengan garis pantai sepanjang 81.000 km memiliki potensi sumberdaya yang cukup besar, terutama sumberdaya perikanan laut baik dari segi kuantitas maupun diversitas. Potensi lestari sumberdaya ikan laut Indonesia diperkirakan 6,4 juta ton per tahun yang tersebar di seluruh wilayah perairan Indonesia dan perairan ZEEI (Zona Ekonomi Eksklusif Indonesia), dengan jumlah tangkapan yang diperbolehkan (JTB) sebesar 5,12 juta ton per tahun atau sekitar 80% dari potensi lestari (Departemen Kelautan dan Perikanan (DKP) 2005a).
Ikan tuna (Thunnus Sp.) merupakan salah satu komoditas perikanan Indonesia yang memiliki nilai ekonomis tinggi dan mampu menembus pasar internasional. Potensi ikan tuna di perairan Indonesia masih cukup besar. Hal ini ditunjukkan dengan volume produksi ikan tuna pada tahun 2007 yaitu sebesar 191.558 ton. Volume produksi ikan tuna ini naik sebesar 20,17% bila dibandingkan dengan volume produksi ikan tuna tahun 2006 (DKP 2008a). Volume ekspor ikan tuna, cakalang dan tongkol pada tahun 2007 sebesar 121.316 ton. Volume ekspor ini naik sebesar 32,12% bila dibandingkan dengan volume ekspor ikan tuna, cakalang dan tongkol tahun 2006. Sedangkan nilai ekspornya mencapai US$ 304.348.000 pada tahun 2007 atau naik sebesar 21,47% dari tahun 2006 (DKP 2008b).
Lebih dari 60% hasil tangkapan tuna Indonesia diekspor sebagai produk tuna segar dan beku, terutama ke Jepang, Uni Eropa dan Amerika Serikat. Akan tetapi, upaya pengembangan ekspor ikan tuna dihadapkan pada tingginya tarif bea masuk (TBM) yang diberlakukan oleh negara-negara maju khususnya Uni Eropa. Saat ini Indonesia harus membayar TBM untuk ekspor ikan tuna segar dan beku ke UE sebesar 18% dan untuk ikan tuna kalengan sebesar 24% (Putro 2008).
serta masalah non-perdagangan (non-trade concerns), seperti “dolphin issue” dan isu-isu kelestarian lingkungan lainnya. Bahkan dengan semakin meningkatnya peran organisasi manajemen perikanan regional (Regional Fisheries Management Organization) seperti IOTC (Indian Ocean Tuna Commission), CCSBT (Commission for the Conservation of Southern Bluefin Tuna), dan ICCAT (International Commission for the Conservation of Atlantic Tuna), telah menimbulkan hambatan baru terhadap kelancaran ekspor ikan tuna dari Indonesia. Hal ini tercermin dari munculnya pembatasan melalui kuota atau bahkan penolakan terhadap ekspor ikan tuna dari Indonesia sebagai akibat dari belum masuknya Indonesia dalam berbagai organisasi manajemen perikanan regional tersebut (Putro 2008).
Laporan Rapid Alert System for Food and Feed (RASFF) UE menunjukkan pada tahun 2007 terdapat 7 kasus penolakan tuna Indonesia dengan 4 kasus diantaranya disebabkan oleh kadar histamin yang melebihi standar. RASFF merupakan salah satu kontrol sistem terhadap produk pangan, termasuk perikanan yang masuk dan beredar di Uni Eropa (EC 2007). Penolakan tuna Indonesia juga terjadi di pasar Amerika. Laporan Food and Drug Administration (FDA) Amerika Serikat dalam Import Refusal Report (IRR) menunjukkan kasus penolakan tuna Indonesia selama tahun 2008 yaitu sebanyak 7 kasus disebabkan oleh kandungan histamin yang melebihi standar, sedangkan 171 kasus lainnya disebabkan oleh faktor lain seperti Salmonella, kotoran (filthy), dan lain-lain (FDA 2008).
Berbagai jenis bakteri yang mampu menghasilkan enzim histidin dekarboksilase (HDC) termasuk famili Enterobacteriaceae dan
Bacillaceae (Staruszkiewicz 2002 dalam Allen 2004). Umumnya spesies Bacillus, Citrobacter, Clostridium, Escherichia, Klebsiella, Lactobacillus, Pediococcus, Photobacterium, Proteus, Pseudomonas, Salmonella, Shigella, dan Streptococcus menunjukkan aktivitas dekarbokasilase asam amino (Kanki et al. 2002 dalam Allen 2004). Hasil penelitian Behling dan Taylor (1982) menunjukkan Proteus morganii, Klebsiella pneumoniae dan Enterobacter aerogenes merupakan
bakteri yang mampu menghasilkan histamin dalam jumlah besar yaitu > 100 mg/100 ml setelah diinkubasi menggunakan TFIB (Tuna Fish Infusion
Broth) pada suhu > 15 oC selama < 24 jam, sedangkan Hafnia alvei, Escherichia coli dan Citrobacter freundii menghasilkan histamin dalam jumlah kecil yaitu < 25 mg/100 ml setelah diinkubasi menggunakan TFIB pada suhu ≥ 30 oC selama ≥ 48 jam.
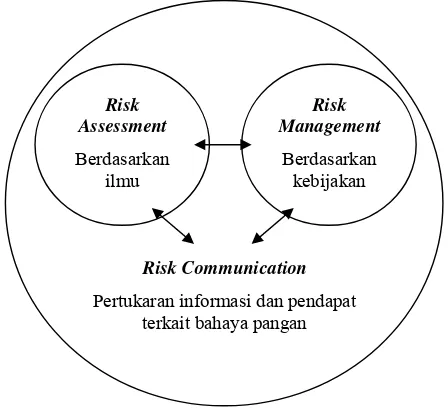
Risk analysis terdiri atas tiga komponen, yaitu risk assessment, risk management, dan risk communication. Risk assessment adalah karakterisasi
potensial risiko bahaya menggunakan pendekatan ilmiah, termasuk menyangkut perkiraan besarnya risiko dan efek dari keluaran atau hasil yang ada (WHO 1998). Penggunaan risk assessment sangat penting dan sudah dikenal di berbagai negara. Selama beberapa tahun ini, di dunia terjadi peningkatan risiko dalam hubungannya dengan keamanan pangan secara umum dan keamanan dari produk-produk perikanan pada khususnya (Sumner et al. 2004).
Penelitian mengenai konsep risk assessment pada industri perikanan khususnya industri perikanan tuna di Indonesia telah dilakukan oleh Darmo (2008), yang memfokuskan pada bahaya histamin dan hasil yang diperoleh
menunjukkan bahwa ranking atau tingkat risiko bahaya histamin pada produk tuna Indonesia termasuk ke dalam kategori sedang untuk konsumen di Amerika Serikat dan Indonesia. Hasil tersebut juga didukung oleh penelitian yang dilakukan oleh Fadly (2009) dan Wicaksono (2009) yang menerapkan konsep risk assessment dengan fokus bahaya histamin, masing-masing pada ikan tuna segar dengan berbagai kualitas mutu ekspor dan pada proses pengolahan tuna loin beku. Hasilnya juga menunjukkan bahwa ranking atau tingkat risiko bahaya histamin pada ikan tuna dan produk tuna Indonesia termasuk ke dalam kategori sedang untuk konsumen di Amerika Serikat. Pada penelitian yang dilakukan oleh Darmo (2008), pada tahap exposure assessment (penilaian paparan) tidak dilakukan analisis bakteri pembentuk histamin. Selain itu, pada penelitian yang dilakukan oleh Darmo (2008), Fadly (2009) dan Wicaksono (2009) tersebut juga tidak dilakukan penilaian rangking atau tingkat risiko bahaya histamin pada ikan tuna untuk konsumen di negara tujuan ekspor Jepang.
Rekomendasi CAC untuk menerapan konsep risk analysis pada industri perikanan khususnya perikanan tuna di Indonesia masih belum banyak dilakukan, sehingga diperlukan suatu upaya perbaikan sistem manajemen mutu pada industri
perikanan tuna di Indonesia oleh pihak-pihak yang terkait, baik oleh pelaku industri perikanan tuna maupun oleh pemerintah agar dapat meningkatkan
di Indonesia masih perlu dilakukan untuk mengantisipasi permasalahan bahaya peningkatan kadar histamin baik pada proses pembongkaran ikan tuna segar di transit maupun pada proses pengolahan produk tuna loin beku di perusahaan pengolahan ikan tuna, sehingga dapat diketahui efektivitasnya dan selanjutnya dapat diterapkan dalam industri perikanan tuna di Indonesia untuk menghasilkan produk tuna yang berkualitas dan layak menembus pasar internasional.
Pada penelitian ini dilakukan penerapkan konsep semi-quantitative risk assessment dengan fokus bahaya histamin pada ikan tuna segar di transit dan pada proses pengolahan tuna loin beku di perusahaan pengolahan ikan tuna dengan studi kasus di transit pendaratan ikan tuna dan perusahaan pengolahan ikan tuna yang berbeda dengan penelitian yang sudah dilakukan sebelumnya. Penilaian rangking atau tingkat risiko bahaya histamin ikan tuna pada penelitian ini dilakukan pada konsumen di negara tujuan ekspor ikan tuna segar dan produk tuna loin beku, yaitu Jepang dan Amerika Serikat.
1.2 Tujuan
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus Sp)
Klasifikasi ikan tuna menurut Saanin (1984) adalah sebagai berikut:
Phylum : Chordata
Subphylum : Vertebrata Class : Teleostei
Subclass : Actinopterygii Ordo : Perciformes Subordo : Scombridei Family : Scombridae Genus : Thunnus
Species : Thunnus obesus (bigeye tuna, tuna mata besar) T. alalunga (albacore, tuna alcar)
T. tonggol (longtail tuna, tuna ekor panjang) T. albacares (yellowfin tuna, madidihang)
T. macoyii (southern bluefin tuna, tuna sirip biru selatan) T. thynnus (northern bluefin tuna, tuna sirip biru utara) T. atlanticus ( blackfin tuna, tuna sirip hitam)
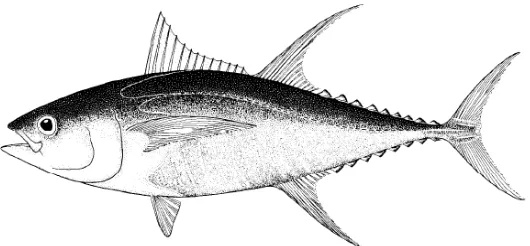
Gambar 1. Ikan Tuna (Thunnus Sp.) (Collette dan Nauen 1983)
sering digolongkan sebagai cakalang, sedangkan tongkol umumnya digunakan untuk jenis eastern little tuna (Euthynnus spp.), frigate and bullet tuna (Auxis spp.) dan longtail tuna (Thunnus tonggol) (DKP 2005a).
Deskripsi ikan tuna secara umum adalah kepala simetris, bergaris rusuk lengkap, bersisik lingkaran (cycloid), rangka terdiri atas tulang sejati dan bertutup insang, badan berbentuk cerutu, jari-jari lemah sirip ekor bercabang pada pangkalnya, sirip-sirip kecil di belakang sirip punggung dan sirip dubur ada. Tulang rahang atas depan dan tulang-tulang hidung tidak membentuk cula, sirip punggung dua, yang pertama berjari-jari mengeras, dan yang kedua mempunyai bagian yang berjari-jari keras serta bagian yang berjari-jari lemah kadang-kadang berlembaran seperti sirip-sirip kecil di belakang sirip dubur, sirip-sirip perut terdiri atas satu jari-jari keras dan lima jari-jari lemah serta kadang-kadang dua garis rusuk (Saanin 1984).
Pergerakan (migrasi) kelompok ikan tuna di wilayah perairan Indonesia mencakup wilayah perairan pantai, teritorial dan Zona Ekonomi Ekslusif (ZEE) Indonesia. Keberadaan tuna di suatu perairan sangat bergantung pada beberapa hal yang terkait dengan spesies tuna, kondisi hidro-oseanografi perairan. Di wilayah perairan ZEE Indonesia, migrasi jenis ikan tuna di perairan Indonesia merupakan bagian dari jalur migrasi tuna dunia karena wilayah Indonesia terletak pada lintasan perbatasan perairan antara Samudera Hindia dan Samudera Pasifik. Migrasi kelompok tuna yang melintasi wilayah perairan pantai dan teritorial terjadi karena perairan tersebut berhubungan langsung dengan pengaruh perairan kedua samudera tersebut sehingga beberapa wilayah perairan pantai dan teritorial memiliki sumberdaya perikanan tuna yang besar (DKP 2005b).
2.2 Komposisi Gizi Ikan Tuna
Tabel 1. Komposisi gizi beberapa jenis ikan tuna dan tuna like-species
Sumber: Infofish (2002)
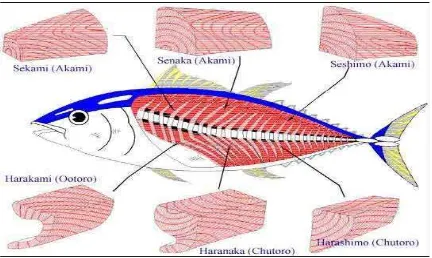
Kandungan lemak ikan tuna berbeda nyata pada bagian tubuh yang satu dengan yang lain, misalnya antara daging merah dengan daging putih (Stansby dan Olcott 1963). Berdasarkan lapisan lemaknya, daging tuna dibagi menjadi tiga bagian, yaitu: otoro, chutoro, dan akami. Otoro dan chutoro
merupakan jenis-jenis toro, yang memiliki kadar lemak sekitar 25%. Otoro berwarna pink, merupakan bagian yang terbaik dan termahal untuk bahan
baku sashimi, kemudian diikuti oleh chutoro yang berwarna pink gelap. Bagian daging tuna yang terletak agak di pusat ikan dan berwarna lebih merah dengan kandungan lemak 14% lebih rendah disebut akami. Bagian ini memiliki harga paling murah diantara bagian tubuh ikan tuna yang lainnya (Infofish 1991). Penampang membujur daging merah ikan tuna berdasarkan lapisan lemak dapat dilihat pada Gambar 2.
2.3 Tuna Loin Beku
Definisi tuna loin beku mengacu pada Standar Nasional Indonesia (SNI) 01-4104.1-2006 adalah produk olahan hasil perikanan dengan bahan baku tuna segar atau beku yang mengalami perlakuan sebagai berikut: penerimaan, penyiangan atau tanpa penyiangan, pencucian, pembuatan loin, pengulitan dan perapihan, sortasi mutu, pembungkusan (wrapping), pembekuan, penimbangan, pengepakan, pelabelan, dan penyimpanan.
Bahan baku yang digunakan untuk pembuatan tuna loin beku adalah tuna madidihang (yellowfin tuna/Thunnus albacores), tuna mata besar (bigeye tuna/Thunnus obesus), tuna sirip biru (bluefin tuna/Thunnus thynnus dan Thunnus maccoyii), dan tuna albakora (albacore/Thunnus alalunga). Bahan baku berupa ikan tuna segar atau beku yang sudah atau belum disiangi. Bahan baku berasal dari perairan yang tidak tercemar. Bahan baku harus bersih, bebas dari setiap bau yang menandakan pembusukan, bebas dari tanda dekomposisi dan pemalsuan, bebas dari sifat-sifat alamiah lain yang dapat menurunkan mutu serta tidak membahayakan kesehatan. Secara organoleptik, bahan baku mempunyai karakteristik kesegaran sebagai berikut:
- Kenampakan: mata cerah, cemerlang - Bau : segar
- Tekstur : elastis, padat, kompak
Bahan baku ikan tuna segar yang menunggu proses lebih lanjut disimpan dalam wadah yang baik dan tetap dipertahankan suhunya dengan menggunakan es curai sehingga suhu pusat bahan baku mencapai suhu maksimal 4,4 oC, saniter, dan higienis (SNI 01-4104.2-2006).
Adapun cara penanganan dan pengolahan ikan tuna loin beku untuk bahan baku tuna segar mengacu pada SNI 01-4104.3-2006, adalah sebagai berikut: 1. Penerimaan
2. Penyiangan atau tanpa penyiangan
Apabila ikan yang diterima masih dalam keadaan utuh, ikan disiangi dengan cara membuang kepala dan isi perut. Penyiangan dilakukan secara cepat, cermat, dan saniter sehingga tidak menyebabkan pencemaran pada tahap berikutnya dengan suhu pusat produk maksimal 4,4 oC.
3. Pencucian
Ikan tuna dicuci dengan hati-hati menggunakan air bersih dingin yang mengalir secara cepat, cermat, dan saniter untuk mempertahankan suhu pusat produk maksimal 4,4 oC.
4. Pembuatan loin
Pembuatan loin dilakukan dengan cara membelah ikan menjadi empat bagian secara membujur. Proses pembuatan loin dilakukan secara cepat, cermat, dan saniter dan tetap mempertahankan suhu pusat produk 4,4 oC.
5. Pengulitan dan perapihan
Tulang, daging merah, dan kulit yang ada pada loin dibuang hingga bersih. Pengulitan dan perapihan dilkukan secara cepat, cermat, dan saniter serta tetap mempertahankan suhu produk 4,4 oC.
6. Sortasi mutu
Sortasi mutu dilakukan dengan memeriksa loin apakah masih terdapat tulang, duri, daging merah, dan kulit secara manual. Sortasi dilakukan secara hati-hati, cepat, cermat, dan saniter dengan suhu pusat maksimal 4,4oC.
7. Pembungkusan (wrapping)
Loin yang sudah rapih selanjutnya dikemas dalam plastik secara individual vakum dan tidak vakum secara cepat. Proses pembungkusan dilakukan secara cepat, cermat, dan saniter serta tetap mempertahankan suhu pusat produk maksimal 4,4 oC.
8. Pembekuan
9. Penimbangan
Loin ditimbang satu per satu dengan menggunakan timbangan yang sudah dikalibrasi. Penimbangan dilakukan dengan cepat, cermat, dan saniter serta tetap mempertahankan suhu pusat produk maksimal -18 oC.
10. Pengepakan
Loin yang telah dilepaskan dari pan pembeku, kemudian dikemas dengan plastik dan dimasukkan dalam master karton secara cepat, cermat, dan saniter. 11. Pengemasan
Produk akhir dikemas dengan cepat, cermat secara saniter dan higienis, pengemasan dilakukan dalam kondisi yang dapat mencegah terjadinya kontaminasi dari luar terhadap produk.
12. Pelabelan dan pemberian kode
Setiap kemasan produk tuna loin beku yang akan diperdagangkan agar diberi tanda dengan benar dan mudah dibaca, mencantumkan bahasa yang dipersyaratkan disertai keterangan sekurang-kurangnya sebagai berikut:
a. Jenis produk b. Berat bersih produk
c. Nama dan alamat lengkap unit pengolahan secara lengkap d. Bila ada bahan tambahan lain diberi keterangan bahan tersebut e. Tanggal, bulan, dan tahun produksi
f. Tanggal, bulan, dan tahun kadaluwarsa 13. Penyimpanan
Penyimpanan tuna loin beku dalam gudang beku (cold storage) dengan suhu maksimal -25 oC dengan fluktuasi suhu maksimal ± 2 oC. Penataan produk dalam gudang beku diatur sedemikian rupa sehingga memungkinkan sirkulasi udara dapat merata dan memudahkan pembongkaran.
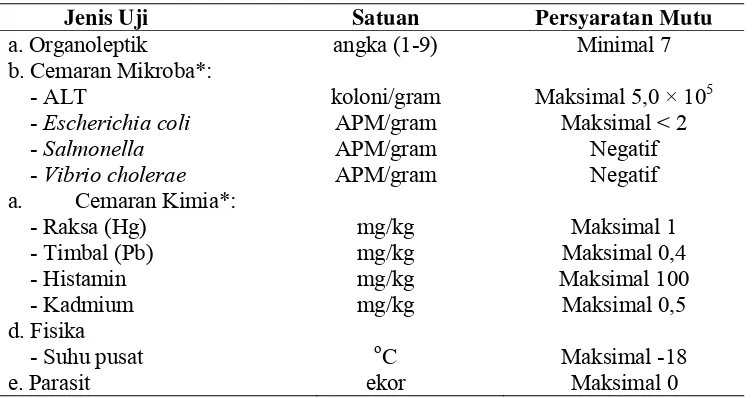
Tabel 2. Persyaratan mutu dan keamanan pangan tuna loin beku
(SNI 01-4104.1-2006)
Jenis Uji Satuan Persyaratan Mutu
a. Organoleptik angka (1-9) Minimal 7
b. Cemaran Mikroba*:
Sumber: Badan Standardisasi Nasional Indonesia (2006a) * Apabila diperlukan
Keterangan:
ALT : Angka Lempeng Total APM : Angka Paling Memungkinkan
2.4 Perubahan Fisik Daging Ikan
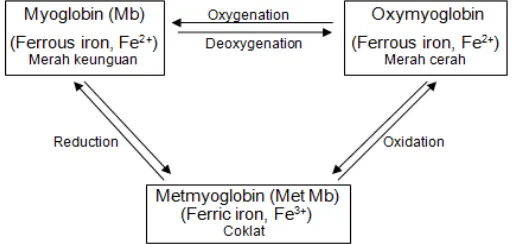
Warna daging segar ditentukan oleh perbandingan tiga bentuk utama myoglobin, yaitu oxymyoglobin, metmyoglobin, dan reduced myoglobin. Ketika ikan mati, oksigen tidak tersedia pada jaringan daging, oleh karena itu terjadi perubahan oxymyoglobin menjadi myoglobin. Pada tahap ini juga terjadi perubahan pH, temperatur, tekanan osmotik, dan potensial oksidasi-reduksi (Eskin 1990). Myoglobin merupakan protein larut air yang mengikat oksigen
untuk metabolisme aerobik dalam otot. Myoglobin terdiri atas protein dan cincin porphyrin non protein dengan pusat ion besi (Fe2+). Ion besi yang
teroksidasi dapat mengubah warna daging menjadi merah cerah. Selain itu, air (H2O), karbon monoksida (CO), oksigen (O2), dan nitric oxide (NO) juga dapat terikat dengan ion besi sehingga warna daging berubah (Boles dan Ronald 2007).
pembentukan warna coklat pada metmyoglobin yang dapat terjadi dengan mudah, namun tidak demikian dengan reaksi kebalikannya yang sulit terjadi (Boles dan Ronald 2007).
Pembentukan metmyoglobin terjadi pada kondisi temperatur tinggi dan pH rendah, serta dipengaruhi oleh sinar ultraviolet dan bakteri aerobik (Seideman et al. 1984 dalam Eskin 1990). Giddings (1977) dalam Eskin (1990) menambahkan bahwa pembentukan metmyoglobin diiringi dengan hilangnya elektron pada molekul besi (Fe) yang menyebabkan perubahan ferrous (Fe2+) menjadi ferric (Fe3+). Perubahan myoglobin pada daging segar dapat dilihat pada Gambar 3.
Gambar 3. Perubahan myoglobin pada daging segar (Eskin 1990)
2.5 Kemunduran Mutu Ikan
Kemunduran mutu ikan dapat diketahui dari perubahan fisik, kimia, dan enzimatis. Perubahan fisik ikan merupakan indikasi yang paling mudah untuk mengetahui tingkat kesegaran ikan, yaitu dengan melihat warna daging, apabila ikan berwarna merah segar maka mutu ikan masih baik (Eskin 1990).
a. Hiperaemia (pre rigor)
Tahap hiperaemia secara biokimia ditandai dengan menurunnya kadar Adenosin Tri Phosphat (ATP) dan kreatin fosfat seperti halnya pada reaksi aktif glikolisis serta lendir yang terlepas dari kelenjar-kelenjarnya di dalam kulit ikan. Pelepasan lendir dari kelenjar lendir ini merupakan reaksi alami ikan terhadap keadaan yang tidak menyenangkan. Jumlah lendir yang terlepas dan menyelimuti tubuh ikan dapat sangat banyak hingga mencapai 1,2-5% dari berat tubuhnya (Eskin 1990).
b. Rigor mortis
Perubahan selanjutnya, ikan memasuki tahap rigor mortis. Tingkat rigor ditandai dengan mengejangnya tubuh ikan yang merupakan hasil
perubahan-perubahan biokimia yang kompleks di dalam otot ikan. Tubuh ikan yang mengejang berhubungan dengan terbentuknya actomyosin yang berlangsung
lambat pada tahap awal dan menjadi cepat pada tahap selanjutnya (Zaitsev et al. 1969).
Tingkat rigor ini berlangsung sekitar 1 sampai 12 jam sesaat setelah ikan mati. Pada umumnya ikan mempunyai proses rigor yang pendek, kira-kira 1 sampai 7 jam setelah ikan mati. Lamanya tingkat rigor dipengaruhi oleh
kandungan glikogen dalam tubuh ikan dan temperatur lingkungan (Zaitsev et al. 1969). Kandungan glikogen yang tinggi menunda datangnya proses rigor sehingga menghasilkan produksi daging dengan kualitas tinggi dan pH rendah. Pencapaian pH serendah mungkin dalam jaringan ikan merupakan hal yang penting karena dapat mencegah pertumbuhan bakteri dan untuk memperoleh warna daging yang diinginkan (Eskin 1990).
proses rigor mortis maka ikan semakin cepat membusuk (Food and Agriculture Organization (FAO) 1995).
c. Autolisis
Indikasi awal proses pembusukan ikan adalah terjadinya kehilangan karakteristik dari bau dan rasa ikan, yang berkaitan dengan degradasi secara
autolisis. Autolisis adalah proses penguraian protein dan lemak oleh enzim (protease dan lipase) yang terdapat di dalam daging ikan. Salah satu ciri-ciri terjadinya perubahan secara autolisis adalah dihasilkannya amoniak sebagai hasil akhir pada jaringan tubuh. Penguraian protein dan lemak dalam autolisis menyebabkan perubahan rasa, tekstur, dan penampakan ikan (FAO 1995).
Autolisis dimulai bersamaan dengan penurunan pH. Mula-mula protein terpecah menjadi molekul-molekul makro yang menyebabkan peningkatan dehidrasi lalu pecah lagi menjadi polipeptida, pepton, dan akhirnya menjadi asam amino. Disamping asam amino, autolisis juga menghasilkan sejumlah kecil pirimidin dan purin, basa yang dibebaskan pada waktu pemecahan asam nukleat. Bersamaan dengan itu, hidrolisis lemak menghasilkan asam lemak bebas dan gliserol. Autolisis akan merubah struktur daging sehingga kekenyalan menurun (Zaitsev et al. 1969). Autolisis tidak dapat dihentikan walaupun dalam suhu yang sangat rendah. Biasanya proses autolisis akan selalu diikuti dengan meningkatnya jumlah bakteri. Semua hasil penguraian enzim selama proses autolisis merupakan media yang sangat cocok untuk pertumbuhan bakteri dan mikroba lainnya (FAO 1995).
d. Pembusukan oleh bakteri
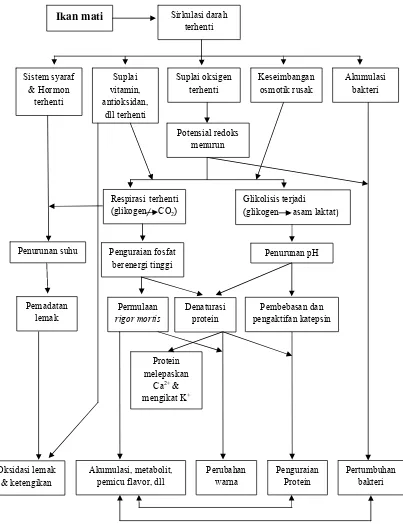
hampir bersamaan dengan autolisis dan kemudian berjalan sejajar (Eskin 1990). Proses perubahan yang terjadi pada ikan setelah mati ditunjukkan pada Gambar 4.
Gambar 4. Proses perubahan yang terjadi pada ikan setelah mati Lawrie (1985) dalam Eskin (1990)
Oksidasi lemak & ketengikan
Kecepatan penguraian zat-zat dalam tubuh ikan tergantung dari sifat daging ikan. Ikan yang banyak mengandung histidin akan cenderung lebih
cepat rusak dibandingkan ikan yang tidak banyak mengandung histidin. Disamping senyawa protein dan senyawa Non Protein Nitrogen (NPN), bakteri juga dapat menguraikan lemak, yaitu hidrolisis trigliserida dan oksidasi lemak yang menghasilkan peroksida, aldehid, dan keton. Penguraian lemak lebih lambat jika dibandingkan dengan penguraian protein dan senyawa Non Protein Nitrogen (NPN). Perubahan yang paling umum dari senyawa Non Protein Nitrogen (NPN) adalah perubahan TMAO menjadi TMA, dekarboksilasi histidin menjadi histamin, serta dekomposisi urea menghasilkan amonia (Zaitsev et al. 1969).
2.6 Histamin
Histamin merupakan komponen amin biogenik yaitu bahan aktif yang diproduksi secara biologis melalui proses dekarboksilasi dari asam amino bebas serta terdapat pada berbagai bahan pangan seperti ikan, daging merah, keju, dan makanan fermentasi (Keer et al. 2002). Histamin merupakan komponen yang kecil, mempunyai berat molekul rendah yang terdiri atas cincin imidazol dan sisi rantai etilamin. Histamin juga merupakan komponen yang tidak larut air. Histamin merupakan salah satu amin biogenik yang mempunyai pengaruh terhadap efek fisiologis manusia (Shahidi dan Botta 1994).
2.6.1 Histamin pada ikan tuna
Histamin merupakan indikator utama keracunan scombrotoxin. Scombrotoxin adalah toksin yang dihasilkan terutama oleh ikan-ikan famili Scombroidae seperti tuna, cakalang, tongkol, marlin, mackerel, dan sejenisnya (Lehane dan Olley 2000).
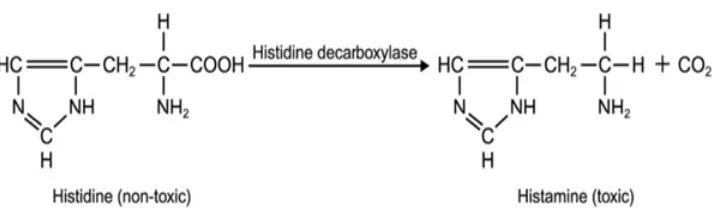
perombakan histidin menjadi histamin adalah faktor waktu, temperatur, jenis dan banyaknya mikroflora bakteri yang terdapat dalam tubuh ikan (Sims et al. 1992). Satuan kadar histamin dalam daging ikan dapat dinyatakan dalam mg/100 g; mg % atau ppm (mg/1000 g). Kandungan histidin bebas pada jaringan ikan tuna lebih tinggi dibandingkan dengan spesies ikan lainnya sehingga meningkatkan potensi peningkatan kadar histamin, khususnya untuk penyimpanan dan penanganan yang salah (Ababouch et al. 1985 dalam Keer et al. 2002). Reaksi perubahan histidin menjadi histamin dapat dilihat pada Gambar 5.
Gambar 5. Reaksi perubahan histidin menjadi histamin (McLauchlin et al. 2005)
Proses dekarboksilasi histidin menjadi histamin dapat terjadi melalui dua cara yaitu autolisis dan aktivitas bakteri.
2.6.1.1 Pembentukan histamin selama autolisis
2.6.1.2 Aktivitas bakteri
Setelah ikan mati, sistem pertahanan tubuhnya tidak bisa lagi melindungi dari serangan bakteri, dan bakteri pembentuk histamin mulai tumbuh dan memproduksi enzim dekarboksilase yang akan menyerang histidin dan asam amino bebas lainnya pada daging ikan. Enzim ini mengubah histidin dan asam amino bebas lainnya menjadi histamin yang mempunyai karakter lebih bersifat alkali. Histamin umumya dibentuk pada temperatur tinggi (>20 oC). Pendinginan dan pembekuan yang cepat, segera setelah ikan mati merupakan tindakan yang sangat penting dalam strategi mencegah pembentukan scombrotoxin (histamin). Histamin tidak akan terbentuk bila ikan selalu disimpan dibawah suhu 5 oC. Pembekuan yang terlalu lama (24 minggu) diduga akan menginaktifkan bakteri pembentuk enzim dekarboksilase dan diduga pula dapat mengurangi pembentukan histamin. Penelitian lebih lanjut menyebutkan bahwa kenaikan pembentukan histamin dapat terus berjalan walaupun dalam keadaan penyimpanan beku (Taylor dan Alasalvar 2002).
Selama proses kemunduran mutu, bakteri memproduksi enzim dekarboksilase yang akan mengubah histidin bebas dan asam amino lain pada
daging ikan menjadi histamin dan amin biogenik lain seperti putresin (dari ornitin), kadaverin (dari lisin), dan spermidin dan spermin (dari arginin)
(Eitenmiller dan De Souza 1984 dalam Lehane dan Olley 2000).
Bakteri pembentuk histamin secara alami terdapat pada otot, insang, dan isi perut ikan. Kemungkinan besar insang dan isi perut merupakan sumber bakteri ini karena jaringan otot ikan segar biasanya bebas dari mikroorganisme (Omura et al. 1978). Bakteri ini akan menyebar ke seluruh bagian tubuh selama proses penanganan. Penyebaran bakteri biasanya terjadi pada saat proses pembuangan insang (gilling) dan penyiangan (gutting) (Sumner et al. 2004). Banyak penelitian menyebutkan bahwa bakteri pembentuk histamin adalah bakteri mesofilik, tetapi bakteri pembentuk histamin dapat tumbuh pada daging ikan sardine pada temperatur <5 oC (Ababouch et al. 1991 dalam Shahidi dan Botta 1994).
Bacillaceae (Staruszkiewicz 2002 dalam Allen 2004). Umumnya spesies Bacillus, Citrobacter, Clostridium, Escherichia, Klebsiella, Lactobacillus, Pediococcus, Photobacterium, Proteus, Pseudomonas, Salmonella, Shigella, dan Streptococcus menunjukkan aktivitas dekarbokasilase asam amino (Kanki et al. 2002 dalam Allen 2004). Hasil penelitian Behling dan Taylor (1982) menunjukkan Proteus morganii, Klebsiella pneumoniae dan Enterobacter aerogenes merupakan
bakteri yang mampu menghasilkan histamin dalam jumlah besar yaitu > 100 mg/100 ml setelah diinkubasi menggunakan TFIB (Tuna Fish Infusion
Broth) pada suhu > 15 oC selama < 24 jam, sedangkan Hafnia alvei, Escherichia coli dan Citrobacter freundii menghasilkan histamin dalam jumlah kecil yaitu < 25 mg/100 ml setelah diinkubasi menggunakan TFIB pada suhu ≥ 30 oC selama ≥ 48 jam.
Bakteri pembentuk histamin dapat tumbuh pada kisaran suhu yang luas. Pertumbuhan bakteri pembentuk histamin berlangsung lebih cepat pada temperatur yang tinggi (21,1 oC) daripada temperatur rendah (7,2 oC) (FDA 2001). Laporan-laporan mengenai suhu optimum dan batas suhu terendah untuk pembentukan histamin sangat bervariasi. Menurut Kim et al. (1999) dalam Keer et al. (2002), suhu optimum pembentukan histamin adalah pada suhu 25 oC. Menurut Yoguchi et al. (1990) dalam Dwiyitno et al. (2004), penyimpanan pada suhu 25 oC selama 24 jam dapat meningkatkan kandungan histamin hingga 120 mg/100 g. Sedangkan menurut Fletcher et al. (1996), pembentukan histamin pada suhu 0-5 oC sangat kecil bahkan dapat diabaikan. Hasil penelitian Price et al. (1991) juga menunjukkan bahwa pembentukan histamin akan terhambat pada suhu 0 oC atau lebih rendah. Oleh karena itu, Food and Drug Administration (FDA) menetapkan batas kritis suhu untuk
pertumbuhan histamin pada tubuh ikan yaitu 4,4 oC (FDA 2001).
Karakteristik mikroflora yang ada dapat dipengaruhi oleh kebiasaan makan, lokasi geografis, musim, temperatur air, dan lain-lain.
Bakteri pembentuk histamin sulit dideteksi secara langsung, karena jumlahnya sedikit dibandingkan bakteri lain pada ikan segar yang ditangkap. Oleh karena itu, untuk mendeteksi bakteri-bakteri tersebut digunakan media khusus, yang disebut agar diferensial Niven. Bakteri pembentuk histamin akan membentuk koloni berwarna ungu dengan latar belakang medium berwarna kuning. Histamin yang terbentuk akan meningkatkan pH medium, sehingga terjadi perubahan warna kuning menjadi ungu (Niven et al. 1981). Jenis-jenis bakteri pembentuk histamin yang terdapat pada ikan laut dan spesifikasinya dapat dilihat pada Tabel 3.
Tabel 3. Jenis-jenis dan spesifikasi bakteri pembentuk histamin yang terdapat pada ikan laut
Bakteri Spesifikasi
Hafnia sp. Gram-negatif, fakultatif anaerobik (Hafnia alvei) Klebsiella sp. Gram-negatif, fakultatif anaerobik (Klebsiella
pneumoniae)
Escherichia coli Gram-negatif, fakultatif anaerobik
Clostridium sp. Gram-positif, anaerobik (Clostridium perfringens) Lactobacillus sp. Gram-positif, fakultatif anaerobik (Lactobacillus 30a) Enterobacter spp. Gram-negatif, fakultatif anaerobik (Enterobacter
aerogenes)
Proteus sp. Gram-negatif, fakultatif anaerobik (Proteus morganii) Sumber: Eitenmiller et al. (1982)
2.6.2 Reaksi fisiologis histamin
Histamin pada ikan yang busuk dapat menimbulkan keracunan jika
terdapat sekitar 100 mg dalam 100 g sampel daging ikan yang diuji (Kimata 1961). Menurut Anonim (1982) dalam Rodriguez-Jerez et al. (1994),
histamin dapat menyebabkan keracunan makanan ketika konsentrasinya di dalam ikan telah mencapai lebih dari 50 mg/100 g. Karena histamin merupakan salah satu bahaya dalam pangan maka ditetapkan suatu standar sebagai batas toleransi maksimum bagi histamin yang terkandung pada daging ikan. Tinggi rendahnya standar ini berbeda-beda tergantung negara tujuan ekspor.
Food and Drug Administration (FDA) menetapkan bahwa untuk ikan tuna, mahi-mahi, dan ikan sejenis, 5 mg histamin/100 g daging ikan merupakan level yang harus diwaspadai dan sebagai indikator terjadinya dekomposisi, sedangkan 50 mg histamin/100 g daging ikan merupakan level yang membahayakan atau dapat menimbulkan keracunan. Oleh karena itu, jika ditemukan ikan dengan kandungan 5 mg histamin/100 g daging ikan pada satu unit, maka kemungkinan pada unit yang lain, level histamin dapat mencapai lebih dari 50 mg/100 g (FDA 2002). Tingkat bahaya histamin per 100 g daging ikan dapat dilihat pada Tabel 4.
Tabel 4. Tingkat bahaya histamin per 100 g daging ikan Kadar histamin per 100 g Tingkat bahaya
Kurang dari 5 mg Aman dikonsumsi
5-20 mg Kemungkinan toksik
20-100 mg Berpeluang toksik
Lebih dari 100 mg Toksik
Sumber: Shalaby (1996) dalam Sumner et al. (2004)
2.7 Risk Assessment
Risk analysis terdiri atas tiga komponen, yaitu risk assessment, risk management, dan risk communication. Risk assessment adalah karakterisasi
pelaksanaan pengawasan keamanan pangan untuk memastikan pelaksanaan kebijakan dan konsep keamanan bahan pangan berjalan dengan baik dan benar (WHO 1998). Hubungan dari setiap komponen di dalam risk analysis dapat dilihat pada Gambar 6.
Gambar 6. Hubungan antara komponen dalam risk analysis (WHO 1998)
Menurut Center for Food Safety and Applied Nutrition (CFSAN) (2002), risk assessment merupakan suatu sistem untuk menganalisis risiko dari bahaya pada suatu produk. Analisis risk assessment harus mengacu pada permasalahan mengenai suatu bahaya dari suatu produk, misalnya adalah permasalahan mengenai berbagai penolakan ekspor suatu negara akibat adanya bahaya dalam produk tertentu.
Dalam aplikasinya, risk assessment terdiri atas empat komponen (Sumner et al. 2004) yaitu:
a. Hazard identification (identifikasi bahaya)
Hazard identification merupakan identifikasi agen biologi, kimia dan fisik yang dapat menyebabkan pengaruh kesehatan yang merugikan ketika terdapat dalam suatu makanan. Ini sebagai langkah pertama dalam menganalisis risiko dan merupakan proses pencarian untuk menganalisa bahaya yang nyata pada makanan tertentu, misalnya Clostridium botulinum yang teridentifikasi sebagai bahaya pada ikan kaleng, ikan asap, atau vacum-packed seafoods. Sehingga identifikasi bahaya
Risk Communication
Pertukaran informasi dan pendapat terkait bahaya pangan Risk
Assessment
Berdasarkan ilmu
Risk Management
(hazard identification) merupakan pencarian pendahuluan untuk mencari sumber-sumber bahaya.
b. Exposure assessment (penilaian paparan)
Exposure assessment merupakan evaluasi kualitatif dan atau kuantitatif dari kemungkinan adanya agen kimia, biologi, dan fisika yang masuk melalui makanan seperti halnya dari sumber lain yang terkait. Dalam penjelasannya diperlukan data dalam dua area, yaitu ukuran konsumsi makanan yang memiliki potensi bahaya dan tingkatan kontaminasi dari mikroorganisme atau toksin pada saat konsumsi. Untuk mendapatkan data tersebut, kita harus mengetahui mikroorganisme atau toksin mulai dari persiapan sampai pengolahan dan memperkirakan perubahan yang masuk dari rantai bahaya secara keseluruhan. c. Hazard characterization (karakterisasi bahaya)
Hazard characterization merupakan evaluasi kualitatif dan atau kuantitatif dari efek yang merugikan kesehatan dalam hubungannya dengan agen biologi, kimia, dan fisik yang mungkin terdapat dalam makanan. Tujuan dari evaluasi risiko mikrobiologi berhubungan dengan mikroorganisme atau racun
(toksin) dari mikroorganime tersebut. Ada dua faktor penting dalam hazard characterization yaitu gambaran dari efek bahaya (mikroorganisme atau
toksinnya) dan dosis yang dapat diterima (dose-response).
d. Risk characterization (karakterisasi risiko)
Risk characterization merupakan proses penentuan secara kualitatif dan atau kuantitatif yang mencakup ketidakpastian, kemungkinan kejadian dan keparahan dari potensi yang merugikan kesehatan yang diketahui atau dikenal
dalam suatu populasi yang ditentukan berdasarkan hazard identification, exposure assessment, dan hazard characterization. Ketika menggunakan risk characterization maka kita harus menggabungkan hazard identification, exposure assessment, dan hazard characterization untuk menetapkan perkiraan risiko yang akan muncul.
Risk estimate adalah suatu keluaran dari risk characterization untuk menduga risiko dari suatu bahaya. Risiko ini mungkin timbul dari perkiraan secara kualitatif (tinggi, sedang, dan rendah) sampai perkiraan secara kuantitatif, dengan memprediksi jumlah orang yang diperkirakan akan terjangkit penyakit karena produk-produk tertentu dengan mengkaitkan bahaya-bahaya yang ada. Secara berurutan, kita dapat menggolongkan risiko atau bahaya secara kuantitatif dengan memberikan ranking atau nilai dari risiko itu dengan angka-angka tertentu, misalnya nilai 0-100.
Sumner et al. (2004) juga mengklasifikasikan risk assessment ke dalam tiga kategori, yaitu: qualitative risk assessment, semi-quantitative risk assessment, dan quantitative risk assessment. Ketiga kategori tersebut menghasilkan informasi yang berguna dan pemilihan kategori bergantung pada kecepatan dan kompleksitas dari kebutuhan yang dinilai (assessment).
2.7.1 Qualitative risk assessment
Analisis bahaya atau risiko didasarkan pada data yang pembentukannya tidak cukup secara kuantitatif, namun dapat menggolongkan data atau kategori risiko tersebut secara deskriptif. Metode risk assessment secara kualitatif ini sangat sederhana dan cepat untuk dilakukan, tetapi dapat dilakukan secara subjektif, yang dapat mengurangi nilainya. Setiap dokumen rencana HACCP
biasanya akan menggunakan sistem penilaian risiko (risk assessment) secara kualitatif khususnya pada lembar analisis bahaya (Sumner et al. 2004).
menganalisanya. Penilaian risiko ini didasarkan pada hubungan antara exposure assessment yang di dalamnya terkait kemungkinan dan kejadian yang timbul dengan karakterisasi dari bahaya dan efek yang timbul. Sebagai contoh untuk memperkirakan kasus ciguatera yang terjadi pada dua golongan masyarakat yang berbeda yaitu masyarakat atoll di kepulauan Pasifik dan masyarakat di United Kingdom. Untuk kasus yang terjadi di kepulauan Pasifik dapat dikatakan kemungkinan dari bahaya ciguatera tersebut memiliki peluang
yang tinggi, sedangkan untuk kasus yang terjadi di United Kingdom, dapat dikatakan memiliki peluang yang rendah. Hal ini disebabkan masih kuatnya hubungan epidemiologi pada masyarakat atoll di kepulauan Pasifik, dimana bahaya ciguatera harus diterima sebagai kenyataan pada kehidupan sehari-hari sedangkan untuk masyarakat di United Kingdom, peluang terjadinya
bahaya tersebut jarang terjadi dari ikan-ikan karang yang diimpor (Sumner et al. 2004).
2.7.2 Semi-quantitative risk assessment
Semi-quantitatif risk assessment dapat dilakukan dengan cara memadukan analisis risk assessment secara kuantitatif dan kualitatif dan mengekspresikannya ke dalam bilangan numerik. Pada level rendah, sedang, dan tinggi tersebut kita dapat mengekspresikannya dalam angka-angka (numeric) sebelum data-data tersebut diolah lebih lanjut, dengan kata lain analisis ini merupakan gabungan dari analisis kualitatif dan kuantitatif untuk menganalisa bahaya yang ada (Sumner et al. 2004).
2.7.3 Quantitative risk assessment
oleh Lindqvist and Westoo (2000) untuk menganalisis konsumsi ikan asap di Swedia. Berdasarkan hasil analisis tersebut diketahui bahwa konsumsi ikan asap di negara tersebut dapat menyebabkan penyakit dengan kemungkinan sebanyak 47-2800 kasus atau bahaya dengan nilai tengah 168.
3. METODOLOGI
3.1 Waktu dan Tempat
Penelitian “Evaluasi Risiko Semi-quantitative Kadar Histamin Ikan Tuna pada Proses Pembongkaran di Transit dan Pengolahan Produk Tuna Loin Beku”
dilakukan pada bulan Februari sampai dengan Maret 2009, bertempat di PT Mulia Sejahtera Mandiri (transit 14), PT Makmur Jaya Sejahtera Muara Baru - Jakarta Utara, dan Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan DKI Jakarta (BPMPHPK DKI Jakarta).
3.2 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini, antara lain: daftar penilaian higiene tempat pembongkaran ikan (transit) dan daftar penilaian kelayakan dasar Unit Pengolahan Ikan (UPI) yang mengacu pada Peraturan Direktur Jenderal Pengolahan dan Pemasaran Hasil Perikanan No. PER.011/DJ-P2HP/2007 tentang Pedoman Teknis Penerapan Sistem Jaminan Mutu dan Keamanan Hasil Perikanan (Lampiran 3 dan 4), risk assessment spreadsheet yang mengacu pada Ross and Sumner (2002) (Lampiran 28 dan 29), cool box, pisau, talenan, timbangan digital, homogenizer, water bath, labu ukur 100 ml dan 50 ml, gelas piala, tabung erlenmeyer, magnetic stirer, corong kaca, kertas saring, kolom kromatografi (panjang 20 cm dan diameter 7 mm), tabung reaksi, pipet mikro, pipet volumetrik, pipet tetes, kuvet, spektrofluorometer, cawan conway, buret, cawan petri, botol pengencer, bunsen, pH indikator, autoklaf, inkubator, alat penghitung koloni (coloni counter), dan stopwatch.
Bahan-bahan yang digunakan dalam penelitian ini, antara lain: sampel daging ikan tuna yellowfin (Thunnus albacares) atau ikan tuna big eye (Thunnus obesus) dari berbagai kualitas mutu, yaitu mutu A, B, C, D, sampel ikan tuna pada proses pembentukan loin dan produk akhir tuna loin beku serta es curai. Bahan-bahan yang digunakan untuk analisis kadar histamin,
antara lain: metanol pro analys, glass wool, resin penukar ion (dowex 1-x800-100-mesh), aquades, larutan HCl 1 N dan 0,1 N, NaOH 1 N,
Total Volatile Base (TVB), antara lain: larutan TCA 7% dan 5%, larutan K2CO3, asam borat 2%, vaseline, indikator conway, dan larutan HCL 0,02 N. Bahan-bahan yang digunakan untuk analisis Total Plate Count (TPC), antara lain: larutan Butterfield’s Phospate Buffered, dan media Plate Count Agar (PCA). Sedangkan bahan-bahan yang digunakan untuk analisis jumlah bakteri pembentuk
histamin, antara lain: larutan Butterfield’s Phospate Buffered dan media modifikasi niven agar yang terdiri atas: 0,1% trypton, 0,3% yeast extract,
1,8% L-histidin monohydrochlorid monohydrat, 0,1% CaCO3, 0,5% NaCl, 2,5% agar, dan 0,003% phenol red.
3.3 Metode Penelitian
Penelitian ini terdiri atas empat tahap yaitu: tahap pengamatan proses pembongkaran ikan tuna di transit dan pengolahan produk tuna loin beku,
tahap penilaian sanitasi higiene tempat pembongkaran ikan (transit) dan penilaian
kelayakan dasar Unit Pengolahan Ikan (UPI), tahap penilaian risiko (risk assessment) kadar histamin, dan tahap sintesis hasil pengkajian efektivitas
penilaian risiko (risk assessment) kadar histamin sebagai kesimpulan dari penilaian risiko (risk assessment) kadar histamin pada proses pembongkaran ikan tuna di transit dan pengolahan produk tuna loin beku di unit pengolahan ikan tuna.
3.3.1. Tahap pengamatan proses pembongkaran ikan tuna di transit dan pengolahan produk tuna loin beku
Proses pembongkaran ikan tuna yang dilakukan di transit 14 (PT Mulia Sejahtera Mandiri) diamati berdasarkan tahapan prosesnya serta
diamati faktor sanitasi dan higiene dalam proses pembongkaran ikan tuna
di transit 14. Proses pengolahan tuna loin beku yang dilakukan di PT Makmur Jaya Sejahtera juga diamati berdasarkan tahapan prosesnya,