SINTESIS, PEMURNIAN, DAN PENCIRIAN LAUROIL
KLORIDA DARI ASAM LAURAT
DWI WIDYASTUTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DWI WIDYASTUTI. Sintesis, Pemurnian, dan Pencirian Lauroil Klorida dari Asam Laurat. Dibimbing oleh KOMAR SUTRIAH dan MUHAMMAD FARID.
Klorida asam (RCOCl) adalah salah satu senyawa halida asam dan merupakan senyawa antara untuk sintesis turunan asam lemak, yaitu sebagai bahan asilasi. Lauroil klorida merupakan produk reaksi substitusi halogenasi asam laurat menggunakan tionil klorida (SOCl2). Penggunaan tionil klorida memiliki keuntungan, yaitu hasil samping
yang terbentuk berwujud gas, rendemennya lebih besar, dan mudah digunakan. Percobaan ini melalui 4 tahapan, yaitu sintesis, pemvakuman, pemurnian, dan pencirian oleh perangkat spektofotometer inframerah transformasi fourier (FTIR). Optimalisasi reaksi dilakukan dengan meragamkan waktu sintesis, yaitu 0.5, 1.5, 3, dan 5 jam, serta nisbah mol asam laurat_tionil klorida 1:1.2, 1:3, dan 1:5. Parameter yang digunakan untuk mengetahui tingkat keberhasilan sintesis adalah dengan teknik perbandingan 1800/1700 dengan mengukur nisbah absorbans senyawa pada bilangan gelombang 1800 cm-1 dan 1700 cm-1. Bilangan gelombang 1800 cm-1 mewakili serapan IR karbonil pada lauroil klorida, sedangkan bilangan gelombang 1700 cm-1 mewakili IR karbonil pada asam laurat. Aplikasi dari teknik ini dilakukan dengan membandingkan tinggi puncak serapan di 1800 cm-1 dan 1700 cm-1 dengan cara menarik garis dari masing-masing garis dasar spektrum (baseline). Kondisi optimum sintesis lauroil klorida didapatkan pada waktu reaksi 1.5 jam dan nisbah mol asam laurat_tionil klorida 1:3. Akan tetapi, rendemen tertinggi didapatkan pada saat kondisi waktu reaksi 1.5 jam dan nisbah mol 1:5, yaitu sebesar 95.64%. Teknik sintesis terbaik adalah dengan menambahkan asam laurat ke dalam tionil klorida.
ABSTRACT
DWI WIDYASTUTI. Synthesis, Purification, and Characterization Lauroyl Chloride from Lauric Acid. Supervised by KOMAR SUTRIAH and MUHAMMAD FARID.
Acid chloride (RCOCl) is one of acid halides and particularly used as intermediate compound for making fatty acid derivatives, which is well known as acylating agent. Lauroyl chloride is produced by substitution of halogenation lauric acid using thionyl chloride (SOCl2). Thionyl chloride has advantages that only gaseous by-
product is formed, give a good yield, and easy to use. This research was conducted through 4 steps which, i.e synthesizing, vacuuming, purifying, and characterizing by Fourier-Transformed Infrared (FTIR). Reaction optimalization was conducted by time variation (0.5, 1.5, 3, and 5 hours), and mole ratio (1:1.2, 1:3, and 1:5). The successful degree of synthesis was measured by comparison technique 1800/1700 at 1800 and 1700 cm-1 wave number. The 1800 cm-1 wave number represented IR carbonyl absorbance of lauroyl chloride, mean while 1700 cm-1 wave number represented IR carbonyl absorbance of lauric acid. The technique application was conducted by comparing the absorbance peak length at 1800 and 1700 cm-1. The optimum condition of lauroyl chloride synthesis occurred at 1.5 hours and 1:3 mole ratio of lauric acid_thionyl chloride. However, the highest yield occurred at 1.5 hours and 1:5 mole ratio of lauric acid_thionyl chloride, which is 95.64%. The best technique for synthesis was conducted by adding lauric acid into thionyl chloride.
SINTESIS, PEMURNIAN, DAN PENCIRIAN LAUROIL
KLORIDA DARI ASAM LAURAT
DWI WIDYASTUTI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Sintesis, Pemurnian, dan Pencirian Lauroil Klorida dari Asam Laurat
Nama : Dwi Widyastuti
NIM : G44202069
Menyetujui:
Pembimbing I, Pembimbing II,
Drs. Komar Sutriah, M.Si Drs. Muhammad Farid
NIP 131950979 NIP 132002064
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuann Alam Institut Pertanian Bogor,
Dr. Drh. Hasim, DEA
NIP 131578806
PRAKATA
Alhamdulillahirobbilalamin. Berjuta syukur tercurahkan kepada Sang Maha Pengasih dan Penyayang, Allah SWT atas limpahan karunia-Nya yang tak berbatas sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Sintesis, Pemurnian, dan Pencirian Lauroil Klorida dari Asam Laurat“. Karya ini disusun berdasarkan hasil penelitian dari bulan September 2006 sampai Juli 2007, di Laboratorium Kimia Organik dan Laboratorium Terpadu, Departemen Kimia FMIPA IPB.
Terima kasih penulis ucapkan kepada Drs. Komar Sutriah, M.Si, dan Drs. Muhammad Farid atas limpahan ilmu, bimbingan, pendanaan, dan motivasi selama melakukan penelitian. Terima kasih juga penulis ucapkan kepada Dr Zainal Alim Mas’ud, DEA dan Budi Arifin S.Si, yang telah banyak memberi saran dan arahan. Selain itu penghargaan penulis sampaikan kepada Bapak, Ibu, dan Mamas yang telah memberikan doa, dukungan, semangat, dan kasih sayang kepada penulis, Seluruh staf dan laboran kimia organik dan Laboratorium Terpadu, kak Noviyan Darmawan atas Sofware IR-nya, pak Sabur atas pinjaman alatnya, om Em atas pinjaman alat rotavapornya,Ujel, Antie, dan Sarah atas persahabatan yang luar biasa, teh Ai atas motivasinya, Me-run atas pinjaman cartridge-nya, Mexindo 10 crew, Teddy yang selalu membantu merangkai alat sintesis, Obie, Steven, Tesar, Tuti, dan teman-teman 39 atas persahabatan, perhatian, ilmu, semangat yang diberikan, kebersamaan yang indah, serta semua pihak yang telah memberikan dukungan kepada penulis. Tidak lupa kepada pak Happy Trenggono dan pak Samsul Arifin atas motivasi dan pelatihan yang begitu luar biasa.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2007
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 13 Mei 1984 sebagai anak kedua dari tiga bersaudara dari pasangan H. Sukamno dan Hj. Sumiarni.
DAFTAR ISI
Halaman
DAFTAR GAMBAR...vii
DAFTAR LAMPIRAN...vii
PENDAHULUAN...1
TINJAUAN PUSTAKA Klorida Asam...1
Asam Laurat...2
Lauroil Klorida...2
Sintesis Klorida Asam...3
Komponen Radas Sintesis...3
FTIR...3
Distilasi Vakum...4
BAHAN DAN METODE Bahan dan Alat...5
Metode...5
HASIL DAN PEMBAHASAN Percobaan Awal Sintesis...5
Optimalisasi Waktu Sintesis...8
Penentuan Nisbah Mol...9
SIMPULAN DAN SARAN Simpulan...10
Saran...10
DAFTAR PUSTAKA...10
DAFTAR GAMBAR
Halaman
1 Struktur asam laurat...2
2 Struktur lauroil klorida... 3
3 Radas sintesis klorida asam...3
4 Perangkat destilasi vakum... 4
5 Spektrum FTIR asam laurat (a) dan hasil sintesis dengan waktu reaksi 1.5 jam (b), 3 jam (c), dan 6.5 jam (d)...6
6 Spektum FTIR ragam sampel 1.75 g (a) dan 2.5 g (b)...7
7 Spektrum FTIR palmitoil klorida...7
8 Spektrum FTIR hasil sintesis dengan teknik penetesan ”tetes demi tetes”...7
9 Spektrum FTIR hasil sintesis dengan waktu reaksi 0.5 jam (a), 1.5 jam (b), dan 3 jam (c)...8
10 Spektrum FTIR hasil sintesis dengan waktu reaksi 5 jam...9
11 Grafik pengaruh waktu reaksi terhadap nisbah 1800/1700 ...9
12 Spektrum FTIR hasil sintesis dengan nisbah mol 1:3 (a), dan 1:5 (b)...9
13 Spektrum FTIR hasil sintesis dengan nisbah mol 1:1.2 ...10
14 Grafik pengaruh nisbah mol asam laurat-tionil klorida terhadap nisbah 1800/1700...10
DAFTAR LAMPIRAN
Halaman 1 Diagram alir penelitian (sampel dengan waktu reaksi 1.5 jam dan nisbah mol 1:5)...132 Senyawaan yang dapat dihasilkan oleh klorida asam...14
3 Mekanisme reaksi pembentukan klorida asam...15
4 Data percobaan awal...16
5 Data optimalisasi waktu sintesis...16
6 Data penentuan nisbah mol...16
7 Perangkat sintesis klorida asam………...17
PENDAHULUAN
Minyak sawit merupakan salah satu hasil pertanian yang sangat potensial untuk dikembangkan. Indonesia merupakan negara penghasil minyak sawit terbesar kedua di dunia setelah Malaysia. Minyak sawit menjadi salah satu komoditas ekspor andalan penghasil devisa negara. Untuk itu, pemerintah memberikan prioritas yang tinggi terhadap pengembangan dan perluasan industri yang mengolah hasil pertanian. Untuk meningkatkan kontribusi minyak sawit terhadap kebutuhan dunia, diperlukan inovasi dalam proses maupun penggunaan minyak sawit tersebut.
Ketaren (1986) menyatakan bahwa komposisi asam lemak minyak sawit antara lain asam laurat, miristat, palmitat, stearat, oleat, kaprilat, kaproat, dan linoleat. Derivatisasi asam lemak dalam minyak sawit menjadi klorida asam merupakan salah satu bentuk inovasi dari minyak sawit.
Perkembangan industri yang pesat saat ini berakibat pada tingginya kebutuhan terhadap senyawa kimia yang sangat berguna dalam penerapannya di industri. Oleh karena itu, dibutuhkan senyawa kimia yang mampu bereaksi dengan cepat sehingga proses produksi dapat berjalan lebih efisien. Salah satu caranya ialah melalui pembentukan zat antara. Zat antara yang sering digunakan adalah klorida asam.
Klorida asam mempunyai gugus pergi Cl yang mudah diserang oleh air. Oleh karena itu, tidak diharapkan klorida asam terdapat di alam, khususnya dalam sel tumbuhan atau hewan. Namun, derivat asam ini sangat berharga dalam sintesis senyawa organik lain karena sangat reaktif (Fessenden & Fessenden 1986). Gugus pergi Cl merupakan suatu nilai tambah karena mudah digantikan oleh gugus lain. Pembentukan senyawa antara dengan gugus pergi yang baik diharapkan dapat mempercepat jalannya reaksi sehingga akan relatif lebih cepat dan efisien jika dibandingkan dengan menggunakan trigliserida atau asam lemak. Amaludin (2007) menyatakan bahwa konversi asam lemak menjadi amina sekunder melalui lintas klorida asam dan amina primer menjadi prosedur alternatif yang dipilih, hal ini dikarenakan kecepatan dan kemudahan proses yang dilakukan. Aplikasi klorida asam sebagai senyawa perantara terdapat dalam industri pangan, kertas, antiseptik, insektisida, cat, plastik, farmasi, tekstil, pelarut, dan lain-lain.
Sudarmiko (1995) melaporkan pembuatan lauroil klorida dari reaksi antara asam laurat dengan tionil klorida pada suhu ± 50 °C selama 6.5 jam, lalu menjadi 80 °C selama 1.5 jam menghasilkan lauroil klorida sebesar 97.4%. Penelitian ini bertujuan mensintesis lauroil klorida yang berasal dari asam laurat serta menentukan waktu optimum dan nisbah mol asam laurat berbanding tionil klorida yang tepat dari sintesis tersebut. Produk sintesis dimurnikan dengan distilasi vakum dan dicirikan dengan Spektrofotometer Inframerah Transformasi Fourier (FTIR).
TINJAUAN PUSTAKA
Klorida Asam
Halida asam (RCOX) adalah turunan asam lemak, karena tergantinya gugus hidroksil oleh halogen. Klorida asam (RCOCl) adalah salah satu senyawa halida asam yang paling banyak diketahui dan merupakan senyawa antara untuk sintesis turunan asam lemak lain, antara lain sebagai bahan asilasi untuk sintesis ester, amida, dan anhidrida asam. Lampiran 2 menunjukkan senyawaan yang dapat dihasilkan oleh klorida asam.
Klorida asam sangat reaktif. Adanya gugus Cl yang terikat pada karbon positif karbonil, sehingga lebih mudah ditukar-gantikan daripada bila terikat pada karbon alkil (Fessenden & Fessenden 1986). Oksigen dan klorin merupakan gugus penarik elektron yang kuat sehingga karbon lebih bermuatan positif. Hal ini berarti nukleofil yang lemah pun dapat menyerang karbon. Fenomena inilah yang menyebabkan klorida asam sangat berguna sebagai zat antara untuk sintesis kimia lebih lanjut.
Mekanisme reaksi antara suatu klorida asam dan nukleofil mengisyaratkan bahwa
penukargantian Cl- tidaklah sesederhana
reaksi SN2. Reaksi klorida asam meliputi dua tahapan, yaitu adisi nukleofil pada gugus karbonil dan eliminasi ion klorida. Reaksi ini disebut substitusi asil nukleofil yang berarti substitusi nukleofil pada suatu karbon asil (RCO-) (Fessenden & Fessenden 1986).
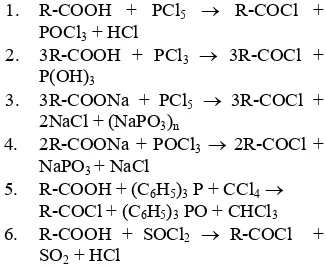
Pada senyawaan berklorin, gugus Cl mudah menggantikan gugus hidroksil. Senyawa berklor itu adalah fosforus triklorida, fosforus pentaklorida, fosforus oksiklorida, dan tionil klorida. Beberapa jalur sintesis klorida asam, antara lain:
1. R-COOH + PCl5 → R-COCl +
POCl3 + HCl
2. 3R-COOH + PCl3 → 3R-COCl +
P(OH)3
3. 3R-COONa + PCl5 → 3R-COCl +
2NaCl + (NaPO3)n
4. 2R-COONa + POCl3→ 2R-COCl +
NaPO3 + NaCl
5. R-COOH + (C6H5)3 P + CCl4→ R-COCl + (C6H5)3 PO + CHCl3
6. R-COOH + SOCl2 → R-COCl +
SO2 + HCl
Setiap jalur sintesis tersebut memiliki kelebihan dan kekurangan. Penggunaan PX (fosforus halida) dihadapkan pada kontaminasi produk oleh fosforus yang nantinya sulit dipisahkan. Oleh karena itu, tionil klorida sering digunakan karena lebih mudah pembuatannya, rendemennya lebih besar, dan produk samping reaksi bersifat atsiri (SO2 dan HCl) (Sudarmiko 1995). Selain itu, sisa reagen juga mudah dihilangkan. Tionil klorida adalah larutan berwarna agak kekuningan, menguap di udara, dan titik didihnya 78.8 °C. Pada suhu 150 °C, reagen ini mengalami penguraian menjadi sulfur klorida, sulfur dioksida, dan klor (Sudarmiko 1995).
Sejumlah reaksi dapat berlangsung dengan konfigurasi tetap terjaga (retensi), yaitu bahan semula dan produknya berkonfigurasi sama. Salah satu reaksi yang menunjukkkan hal itu ialah penggantian OH oleh Cl melalui perlakuan dengan tionil klorida (SOCl2). Reaksi tersebut mengikuti persamaan laju derajat kedua, tetapi tidak dengan ragam SN2 karena akan mengakibatkan pembalikan konfigurasi pada produk (Sykes 1989).
Konversi asam karboksilat menjadi klorida asam berlangsung melalui reaksi substitusi asil nukleofilik. Elektron bebas oksigen pada asam karboksilat bertindak sebagai nukleofilik
menyerang atom sulfur dari SOCl2
membentuk tetrahedral atom sulfur (ion oksonium). Pada intermediet terjadi eliminasi
Cl- dari ion oksonium dan deprotonasi
anhidrida asam membentuk klorosulfit. Gugus C=O pada klorosulfit sangat aktif terhadap serangan nukleofilik walau reaksi lebih lemah dan Cl- cukup nukleofilik membentuk C-Cl.
Klorida asam didapat setelah C=O klorosulfit terbentuk kembali disertai pelepasan SO2 dan HCl. Mekanisme reaksi pembentukan klorida asam ditunjukkan pada Lampiran 3.
Asam Laurat
Asam laurat atau asam dodekanoat merupakan asam lemak jenuh yang tersusun atas 12 atom C (Gambar 1). Asam lemak ini merupakan salah satu di antara tiga asam lemak jenuh yang tersebar luas di alam, selain asam stearat dan palmitat. Asam laurat sebagian besar terdapat pada lemak
Lauraceae. Beberapa jenis lemak Lauraceae
seperti Litsea longifolia mengandung asam laurat sebanyak 88 % dari total asam lemak. Selain itu, sebanyak 45-50 % asam laurat juga ditemukan pada lemak Palmae. Sumber utama asam lemak ini adalah minyak kelapa dan minyak inti sawit.
Gambar 1 Struktur asam laurat.
Sifat-sifat fisik asam laurat antara lain berwujud padat pada suhu ruang, berwarna putih, mudah mencair jika dipanaskan, memiliki bobot molekul 200.32 g/mol, titik
leleh 42_45 °C, titik didih 225 °C (100
mmHg), indeks bias 1.4323, bobot jenis 0.833 (Hawley 1981). Asam laurat tidak larut dalam air (0.0055 g/100 g air pada 20 °C), larut dalam dietil eter serta sedikit larut dalam etanol (1 g/2 mL) dan propanol (1 g/2.5 mL) (Markley KS 1960). Asam laurat larut dalam lemak karena karakter gugus hidrokarbon lebih besar dibandingkan dengan karakter gugus karboksilnya.
Asam laurat digunakan sebagai bahan baku utama dalam industri sabun. Selain itu, asam laurat juga digunakan dalam industri pembuatan lauroil klorida, lauril alkohol, lauramida, dan lauronitril.
Lauroil Klorida
Lauroil klorida (C11H23COCl) merupakan produk reaksi substitusi halogenasi asam
laurat menggunakan SOCl2. Senyawa ini
SINTESIS, PEMURNIAN, DAN PENCIRIAN LAUROIL
KLORIDA DARI ASAM LAURAT
DWI WIDYASTUTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DWI WIDYASTUTI. Sintesis, Pemurnian, dan Pencirian Lauroil Klorida dari Asam Laurat. Dibimbing oleh KOMAR SUTRIAH dan MUHAMMAD FARID.
Klorida asam (RCOCl) adalah salah satu senyawa halida asam dan merupakan senyawa antara untuk sintesis turunan asam lemak, yaitu sebagai bahan asilasi. Lauroil klorida merupakan produk reaksi substitusi halogenasi asam laurat menggunakan tionil klorida (SOCl2). Penggunaan tionil klorida memiliki keuntungan, yaitu hasil samping
yang terbentuk berwujud gas, rendemennya lebih besar, dan mudah digunakan. Percobaan ini melalui 4 tahapan, yaitu sintesis, pemvakuman, pemurnian, dan pencirian oleh perangkat spektofotometer inframerah transformasi fourier (FTIR). Optimalisasi reaksi dilakukan dengan meragamkan waktu sintesis, yaitu 0.5, 1.5, 3, dan 5 jam, serta nisbah mol asam laurat_tionil klorida 1:1.2, 1:3, dan 1:5. Parameter yang digunakan untuk mengetahui tingkat keberhasilan sintesis adalah dengan teknik perbandingan 1800/1700 dengan mengukur nisbah absorbans senyawa pada bilangan gelombang 1800 cm-1 dan 1700 cm-1. Bilangan gelombang 1800 cm-1 mewakili serapan IR karbonil pada lauroil klorida, sedangkan bilangan gelombang 1700 cm-1 mewakili IR karbonil pada asam laurat. Aplikasi dari teknik ini dilakukan dengan membandingkan tinggi puncak serapan di 1800 cm-1 dan 1700 cm-1 dengan cara menarik garis dari masing-masing garis dasar spektrum (baseline). Kondisi optimum sintesis lauroil klorida didapatkan pada waktu reaksi 1.5 jam dan nisbah mol asam laurat_tionil klorida 1:3. Akan tetapi, rendemen tertinggi didapatkan pada saat kondisi waktu reaksi 1.5 jam dan nisbah mol 1:5, yaitu sebesar 95.64%. Teknik sintesis terbaik adalah dengan menambahkan asam laurat ke dalam tionil klorida.
ABSTRACT
DWI WIDYASTUTI. Synthesis, Purification, and Characterization Lauroyl Chloride from Lauric Acid. Supervised by KOMAR SUTRIAH and MUHAMMAD FARID.
Acid chloride (RCOCl) is one of acid halides and particularly used as intermediate compound for making fatty acid derivatives, which is well known as acylating agent. Lauroyl chloride is produced by substitution of halogenation lauric acid using thionyl chloride (SOCl2). Thionyl chloride has advantages that only gaseous by-
product is formed, give a good yield, and easy to use. This research was conducted through 4 steps which, i.e synthesizing, vacuuming, purifying, and characterizing by Fourier-Transformed Infrared (FTIR). Reaction optimalization was conducted by time variation (0.5, 1.5, 3, and 5 hours), and mole ratio (1:1.2, 1:3, and 1:5). The successful degree of synthesis was measured by comparison technique 1800/1700 at 1800 and 1700 cm-1 wave number. The 1800 cm-1 wave number represented IR carbonyl absorbance of lauroyl chloride, mean while 1700 cm-1 wave number represented IR carbonyl absorbance of lauric acid. The technique application was conducted by comparing the absorbance peak length at 1800 and 1700 cm-1. The optimum condition of lauroyl chloride synthesis occurred at 1.5 hours and 1:3 mole ratio of lauric acid_thionyl chloride. However, the highest yield occurred at 1.5 hours and 1:5 mole ratio of lauric acid_thionyl chloride, which is 95.64%. The best technique for synthesis was conducted by adding lauric acid into thionyl chloride.
SINTESIS, PEMURNIAN, DAN PENCIRIAN LAUROIL
KLORIDA DARI ASAM LAURAT
DWI WIDYASTUTI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Sintesis, Pemurnian, dan Pencirian Lauroil Klorida dari Asam Laurat
Nama : Dwi Widyastuti
NIM : G44202069
Menyetujui:
Pembimbing I, Pembimbing II,
Drs. Komar Sutriah, M.Si Drs. Muhammad Farid
NIP 131950979 NIP 132002064
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuann Alam Institut Pertanian Bogor,
Dr. Drh. Hasim, DEA
NIP 131578806
PRAKATA
Alhamdulillahirobbilalamin. Berjuta syukur tercurahkan kepada Sang Maha Pengasih dan Penyayang, Allah SWT atas limpahan karunia-Nya yang tak berbatas sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Sintesis, Pemurnian, dan Pencirian Lauroil Klorida dari Asam Laurat“. Karya ini disusun berdasarkan hasil penelitian dari bulan September 2006 sampai Juli 2007, di Laboratorium Kimia Organik dan Laboratorium Terpadu, Departemen Kimia FMIPA IPB.
Terima kasih penulis ucapkan kepada Drs. Komar Sutriah, M.Si, dan Drs. Muhammad Farid atas limpahan ilmu, bimbingan, pendanaan, dan motivasi selama melakukan penelitian. Terima kasih juga penulis ucapkan kepada Dr Zainal Alim Mas’ud, DEA dan Budi Arifin S.Si, yang telah banyak memberi saran dan arahan. Selain itu penghargaan penulis sampaikan kepada Bapak, Ibu, dan Mamas yang telah memberikan doa, dukungan, semangat, dan kasih sayang kepada penulis, Seluruh staf dan laboran kimia organik dan Laboratorium Terpadu, kak Noviyan Darmawan atas Sofware IR-nya, pak Sabur atas pinjaman alatnya, om Em atas pinjaman alat rotavapornya,Ujel, Antie, dan Sarah atas persahabatan yang luar biasa, teh Ai atas motivasinya, Me-run atas pinjaman cartridge-nya, Mexindo 10 crew, Teddy yang selalu membantu merangkai alat sintesis, Obie, Steven, Tesar, Tuti, dan teman-teman 39 atas persahabatan, perhatian, ilmu, semangat yang diberikan, kebersamaan yang indah, serta semua pihak yang telah memberikan dukungan kepada penulis. Tidak lupa kepada pak Happy Trenggono dan pak Samsul Arifin atas motivasi dan pelatihan yang begitu luar biasa.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2007
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 13 Mei 1984 sebagai anak kedua dari tiga bersaudara dari pasangan H. Sukamno dan Hj. Sumiarni.
DAFTAR ISI
Halaman
DAFTAR GAMBAR...vii
DAFTAR LAMPIRAN...vii
PENDAHULUAN...1
TINJAUAN PUSTAKA Klorida Asam...1
Asam Laurat...2
Lauroil Klorida...2
Sintesis Klorida Asam...3
Komponen Radas Sintesis...3
FTIR...3
Distilasi Vakum...4
BAHAN DAN METODE Bahan dan Alat...5
Metode...5
HASIL DAN PEMBAHASAN Percobaan Awal Sintesis...5
Optimalisasi Waktu Sintesis...8
Penentuan Nisbah Mol...9
SIMPULAN DAN SARAN Simpulan...10
Saran...10
DAFTAR PUSTAKA...10
DAFTAR GAMBAR
Halaman
1 Struktur asam laurat...2
2 Struktur lauroil klorida... 3
3 Radas sintesis klorida asam...3
4 Perangkat destilasi vakum... 4
5 Spektrum FTIR asam laurat (a) dan hasil sintesis dengan waktu reaksi 1.5 jam (b), 3 jam (c), dan 6.5 jam (d)...6
6 Spektum FTIR ragam sampel 1.75 g (a) dan 2.5 g (b)...7
7 Spektrum FTIR palmitoil klorida...7
8 Spektrum FTIR hasil sintesis dengan teknik penetesan ”tetes demi tetes”...7
9 Spektrum FTIR hasil sintesis dengan waktu reaksi 0.5 jam (a), 1.5 jam (b), dan 3 jam (c)...8
10 Spektrum FTIR hasil sintesis dengan waktu reaksi 5 jam...9
11 Grafik pengaruh waktu reaksi terhadap nisbah 1800/1700 ...9
12 Spektrum FTIR hasil sintesis dengan nisbah mol 1:3 (a), dan 1:5 (b)...9
13 Spektrum FTIR hasil sintesis dengan nisbah mol 1:1.2 ...10
14 Grafik pengaruh nisbah mol asam laurat-tionil klorida terhadap nisbah 1800/1700...10
DAFTAR LAMPIRAN
Halaman 1 Diagram alir penelitian (sampel dengan waktu reaksi 1.5 jam dan nisbah mol 1:5)...132 Senyawaan yang dapat dihasilkan oleh klorida asam...14
3 Mekanisme reaksi pembentukan klorida asam...15
4 Data percobaan awal...16
5 Data optimalisasi waktu sintesis...16
6 Data penentuan nisbah mol...16
7 Perangkat sintesis klorida asam………...17
PENDAHULUAN
Minyak sawit merupakan salah satu hasil pertanian yang sangat potensial untuk dikembangkan. Indonesia merupakan negara penghasil minyak sawit terbesar kedua di dunia setelah Malaysia. Minyak sawit menjadi salah satu komoditas ekspor andalan penghasil devisa negara. Untuk itu, pemerintah memberikan prioritas yang tinggi terhadap pengembangan dan perluasan industri yang mengolah hasil pertanian. Untuk meningkatkan kontribusi minyak sawit terhadap kebutuhan dunia, diperlukan inovasi dalam proses maupun penggunaan minyak sawit tersebut.
Ketaren (1986) menyatakan bahwa komposisi asam lemak minyak sawit antara lain asam laurat, miristat, palmitat, stearat, oleat, kaprilat, kaproat, dan linoleat. Derivatisasi asam lemak dalam minyak sawit menjadi klorida asam merupakan salah satu bentuk inovasi dari minyak sawit.
Perkembangan industri yang pesat saat ini berakibat pada tingginya kebutuhan terhadap senyawa kimia yang sangat berguna dalam penerapannya di industri. Oleh karena itu, dibutuhkan senyawa kimia yang mampu bereaksi dengan cepat sehingga proses produksi dapat berjalan lebih efisien. Salah satu caranya ialah melalui pembentukan zat antara. Zat antara yang sering digunakan adalah klorida asam.
Klorida asam mempunyai gugus pergi Cl yang mudah diserang oleh air. Oleh karena itu, tidak diharapkan klorida asam terdapat di alam, khususnya dalam sel tumbuhan atau hewan. Namun, derivat asam ini sangat berharga dalam sintesis senyawa organik lain karena sangat reaktif (Fessenden & Fessenden 1986). Gugus pergi Cl merupakan suatu nilai tambah karena mudah digantikan oleh gugus lain. Pembentukan senyawa antara dengan gugus pergi yang baik diharapkan dapat mempercepat jalannya reaksi sehingga akan relatif lebih cepat dan efisien jika dibandingkan dengan menggunakan trigliserida atau asam lemak. Amaludin (2007) menyatakan bahwa konversi asam lemak menjadi amina sekunder melalui lintas klorida asam dan amina primer menjadi prosedur alternatif yang dipilih, hal ini dikarenakan kecepatan dan kemudahan proses yang dilakukan. Aplikasi klorida asam sebagai senyawa perantara terdapat dalam industri pangan, kertas, antiseptik, insektisida, cat, plastik, farmasi, tekstil, pelarut, dan lain-lain.
Sudarmiko (1995) melaporkan pembuatan lauroil klorida dari reaksi antara asam laurat dengan tionil klorida pada suhu ± 50 °C selama 6.5 jam, lalu menjadi 80 °C selama 1.5 jam menghasilkan lauroil klorida sebesar 97.4%. Penelitian ini bertujuan mensintesis lauroil klorida yang berasal dari asam laurat serta menentukan waktu optimum dan nisbah mol asam laurat berbanding tionil klorida yang tepat dari sintesis tersebut. Produk sintesis dimurnikan dengan distilasi vakum dan dicirikan dengan Spektrofotometer Inframerah Transformasi Fourier (FTIR).
TINJAUAN PUSTAKA
Klorida Asam
Halida asam (RCOX) adalah turunan asam lemak, karena tergantinya gugus hidroksil oleh halogen. Klorida asam (RCOCl) adalah salah satu senyawa halida asam yang paling banyak diketahui dan merupakan senyawa antara untuk sintesis turunan asam lemak lain, antara lain sebagai bahan asilasi untuk sintesis ester, amida, dan anhidrida asam. Lampiran 2 menunjukkan senyawaan yang dapat dihasilkan oleh klorida asam.
Klorida asam sangat reaktif. Adanya gugus Cl yang terikat pada karbon positif karbonil, sehingga lebih mudah ditukar-gantikan daripada bila terikat pada karbon alkil (Fessenden & Fessenden 1986). Oksigen dan klorin merupakan gugus penarik elektron yang kuat sehingga karbon lebih bermuatan positif. Hal ini berarti nukleofil yang lemah pun dapat menyerang karbon. Fenomena inilah yang menyebabkan klorida asam sangat berguna sebagai zat antara untuk sintesis kimia lebih lanjut.
Mekanisme reaksi antara suatu klorida asam dan nukleofil mengisyaratkan bahwa
penukargantian Cl- tidaklah sesederhana
reaksi SN2. Reaksi klorida asam meliputi dua tahapan, yaitu adisi nukleofil pada gugus karbonil dan eliminasi ion klorida. Reaksi ini disebut substitusi asil nukleofil yang berarti substitusi nukleofil pada suatu karbon asil (RCO-) (Fessenden & Fessenden 1986).
Pada senyawaan berklorin, gugus Cl mudah menggantikan gugus hidroksil. Senyawa berklor itu adalah fosforus triklorida, fosforus pentaklorida, fosforus oksiklorida, dan tionil klorida. Beberapa jalur sintesis klorida asam, antara lain:
1. R-COOH + PCl5 → R-COCl +
POCl3 + HCl
2. 3R-COOH + PCl3 → 3R-COCl +
P(OH)3
3. 3R-COONa + PCl5 → 3R-COCl +
2NaCl + (NaPO3)n
4. 2R-COONa + POCl3→ 2R-COCl +
NaPO3 + NaCl
5. R-COOH + (C6H5)3 P + CCl4→ R-COCl + (C6H5)3 PO + CHCl3
6. R-COOH + SOCl2 → R-COCl +
SO2 + HCl
Setiap jalur sintesis tersebut memiliki kelebihan dan kekurangan. Penggunaan PX (fosforus halida) dihadapkan pada kontaminasi produk oleh fosforus yang nantinya sulit dipisahkan. Oleh karena itu, tionil klorida sering digunakan karena lebih mudah pembuatannya, rendemennya lebih besar, dan produk samping reaksi bersifat atsiri (SO2 dan HCl) (Sudarmiko 1995). Selain itu, sisa reagen juga mudah dihilangkan. Tionil klorida adalah larutan berwarna agak kekuningan, menguap di udara, dan titik didihnya 78.8 °C. Pada suhu 150 °C, reagen ini mengalami penguraian menjadi sulfur klorida, sulfur dioksida, dan klor (Sudarmiko 1995).
Sejumlah reaksi dapat berlangsung dengan konfigurasi tetap terjaga (retensi), yaitu bahan semula dan produknya berkonfigurasi sama. Salah satu reaksi yang menunjukkkan hal itu ialah penggantian OH oleh Cl melalui perlakuan dengan tionil klorida (SOCl2). Reaksi tersebut mengikuti persamaan laju derajat kedua, tetapi tidak dengan ragam SN2 karena akan mengakibatkan pembalikan konfigurasi pada produk (Sykes 1989).
Konversi asam karboksilat menjadi klorida asam berlangsung melalui reaksi substitusi asil nukleofilik. Elektron bebas oksigen pada asam karboksilat bertindak sebagai nukleofilik
menyerang atom sulfur dari SOCl2
membentuk tetrahedral atom sulfur (ion oksonium). Pada intermediet terjadi eliminasi
Cl- dari ion oksonium dan deprotonasi
anhidrida asam membentuk klorosulfit. Gugus C=O pada klorosulfit sangat aktif terhadap serangan nukleofilik walau reaksi lebih lemah dan Cl- cukup nukleofilik membentuk C-Cl.
Klorida asam didapat setelah C=O klorosulfit terbentuk kembali disertai pelepasan SO2 dan HCl. Mekanisme reaksi pembentukan klorida asam ditunjukkan pada Lampiran 3.
Asam Laurat
Asam laurat atau asam dodekanoat merupakan asam lemak jenuh yang tersusun atas 12 atom C (Gambar 1). Asam lemak ini merupakan salah satu di antara tiga asam lemak jenuh yang tersebar luas di alam, selain asam stearat dan palmitat. Asam laurat sebagian besar terdapat pada lemak
Lauraceae. Beberapa jenis lemak Lauraceae
seperti Litsea longifolia mengandung asam laurat sebanyak 88 % dari total asam lemak. Selain itu, sebanyak 45-50 % asam laurat juga ditemukan pada lemak Palmae. Sumber utama asam lemak ini adalah minyak kelapa dan minyak inti sawit.
Gambar 1 Struktur asam laurat.
Sifat-sifat fisik asam laurat antara lain berwujud padat pada suhu ruang, berwarna putih, mudah mencair jika dipanaskan, memiliki bobot molekul 200.32 g/mol, titik
leleh 42_45 °C, titik didih 225 °C (100
mmHg), indeks bias 1.4323, bobot jenis 0.833 (Hawley 1981). Asam laurat tidak larut dalam air (0.0055 g/100 g air pada 20 °C), larut dalam dietil eter serta sedikit larut dalam etanol (1 g/2 mL) dan propanol (1 g/2.5 mL) (Markley KS 1960). Asam laurat larut dalam lemak karena karakter gugus hidrokarbon lebih besar dibandingkan dengan karakter gugus karboksilnya.
Asam laurat digunakan sebagai bahan baku utama dalam industri sabun. Selain itu, asam laurat juga digunakan dalam industri pembuatan lauroil klorida, lauril alkohol, lauramida, dan lauronitril.
Lauroil Klorida
Lauroil klorida (C11H23COCl) merupakan produk reaksi substitusi halogenasi asam
laurat menggunakan SOCl2. Senyawa ini
(Hawley 1981). Lauroil klorida larut dalam pelarut eter. Lauroil klorida digunakan sebagai inisiator polimerisasi, reagen anti enzim, dan pembentuk busa. Selain itu, lauroil klorida juga berperan sebagai senyawa antara dalam sintesis lauroil peroksida. Struktur lauroil klorida ditunjukkan oleh Gambar 2.
O
Cl
Gambar 2 Struktur lauroil klorida.
Sintesis Klorida Asam
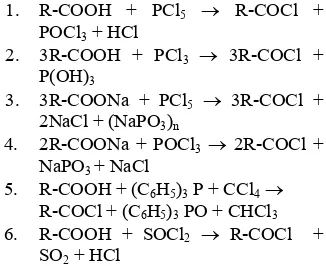
Rabjohn dalam bukunya yang berjudul
Organic Syntheses menyatakan bahwa sintesis klorida asam tidaklah sesederhana sintesis senyawa lain pada umumnya. Dalam metode ini, digunakan perangkat yang cukup rumit (Gambar 3). Sebanyak 70 g (0.25 mol) asam lemak ditempatkan dalam corong penetes (dropping funnel) H (Gambar 3). Distilasi tionil klorida dimulai dan diaturkan; bagian dasar kolom berisi uap dan direfluks dengan konstan dan tetap. Asam diteteskan di atas kolom selama 35 menit (120 g per jam). Produk klorida asam yang dihasilkan dikumpulkan pada labu penampung (I) dan mengandung sekitar 25_27% tionil klorida. Produk di labu penampung (I) dipanaskan dalam penangas uap pada tekanan yang direduksi hingga komponen volatil telah hilang. Klorida asam kasar akan digunakan untuk tujuan lebih lanjut. Setelah itu, hasil sintesis didistilasi vakum sehingga diperoleh produk cair berwarna putih dengan indeks bias pada 25 °C (nD
25
)1.4580-1.4613.
Komponen Radas Sintesis
Radas sintesis pada Gambar 3 tersusun atas perangkat gelas dengan ukuran standar 24/40 dan berpangkal pada dua cincin. Reaktor terdiri atas sebuah kolom dengan panjang 50 cm, diameter dalam 2 cm, kolom distilasi berukuran 1/8 inci, dan dibungkus dengan plester pemanas fleksibel (A) 275 watt. Plester pemanas tersebut memiliki panjang 6 ft., lebar ½ inci, dan berlapis kawat timah yang terhubung ke transformer variabel seperti powerstat (pembangkit listrik) 220 volt. Di dekat dasar kolom terdapat plester pemanas yang melapisi pipa penghubung (B) dengan labu berleher tiga (C). Penggunaan sambungan K yang dibungkus dengan plester
pemanas dapat menghilangkan tionil klorida berlebih dan khususnya menguntungkan bagi klorida asam (seperti oleoil klorida) yang sensitif terhadap panas. Aliran produk dari reaktor biasanya mengandung 40_50% tionil klorida yang direduksi 1½ atau lebih. Uap dialirkan dengan memanaskan cairan hingga mendidih dalam reservoir yang digunakan untuk sirkulasi via (B) melalui kolom dengan pemanasan yang cukup pada kolom dan bagian (K); tionil klorida yang berlebih keluar melalui sisi (D) yang terhubung dengan kondensor Friedrichs (E). Dasar kondensor dihubungkan dengan bagian berbentuk Y dengan keluaran F untuk aliran gas dan kembali ke (G) dengan menyentuh permukaan cairan dalam reservoir. Di bagian atas kolom terdapat corong penetes 250 mL (H) yang berguna untuk memasukkan reaktan ke dalam kolom. Di bagian dasar kolom terdapat labu 500 mL (I) untuk menampung produk.
Gambar 3 Radas sintesis klorida asam
(Rabjohn 1963).
Spektrofotometri Inframerah Transformasi Fourier (FTIR)
FTIR menggunakan karakteristik vibrasi dalam molekul untuk menghasilkan spektrum sidik jari yang fitur-fiturnya didefinisikan dari gugus fungsi yang ada dalam sampel. Adanya kekhasan dalam spektrum FTIR yang disertai dengan kemudahan, kecepatan, serta reprodusibilitas data yang dihasilkannya, menjadikan FTIR sebagai metode pilihan untuk mengklasifikasikan sampel (Darusman
dikategorikan ke dalam IR jauh (4_400 cm-1),
sedang (400_4000 cm-1), dan dekat
(4000_14000 cm-1) (Nuance 2004).
Inframerah sedang adalah daerah yang umum untuk sidik jari senyawa organik. Daerah ini terdiri atas banyak penyerapan spektrum yang menandai karakteristik vibrasi spesies yang diamati.
Thor dan Terryberry (2005) menyatakan bahwa spektroskopi FTIR dapat digunakan dalam analisis kuantitatif komponen kimia dalam sistem dengan penyiapan sampel yang mudah, serta kecepatan memperoleh data dan tingkat keterulangan yang tinggi. FTIR mengukur vibrasi dominan gugus fungsi dan ikatan yang memiliki kepolaran yang tinggi. Data spektrometer FTIR berasal dari pengukuran frekuensi ketika sampel menyerap radiasi dan intensitas dari sampel. Secara umum, FTIR dapat dikategorikan menjadi dua kategori, yaitu analisis kualitatif yang bertujuan mengidentifikasi komponen dan kuantitatif dengan cara mengukur intensitas serapan (absorbans) yang dinyatakan sebagai konsentrasi komponen.
Dunn dan David (2005) menyatakan bahwa spektroskopi FTIR adalah teknik analisis yang cepat, non_destruktif, dan tidak membutuhkan reagen. Prinsip FTIR adalah sampel berinteraksi dengan sinar (radiasi elektromagnetik) dan ikatan kimia pada panjang gelombang tertentu akan menyerap sinar dan akan bervibrasi. Vibrasi ini dapat berupa vibrasi tekuk atau ulur. Absorbans atau vibrasi ini dihubungkan dengan gugus fungsi dari molekul untuk identifikasi senyawa yang tidak diketahui.
Analisis dengan FTIR hanya
membutuhkan sedikit sampel (0,5-20 μl).
Walaupun demikian, FTIR memiliki beberapa kekurangan, yaitu perangkat IR dapat menyerap air. Hal ini dapat diatasi dengan melakukan dehidrasi ketika penyiapan sampel
atau dapat pula menggunakan Attenuated
Total Reflectance (ATR). Perangkat FTIR Perkin Elmer Spectrum One Versi 5.0.1 yang digunakan dalam penelitian ditunjukkan dalam Lampiran 8.
Distilasi Vakum
Distilasi merupakan metode pemisahan senyawa berdasarkan perbedaan titik didih dan proses ini dilakukan pada tekanan normal. Distilasi dapat diklasifikasikan menjadi distilasi sederhana, vakum, fraksional, dan uap. Pada penelitian ini akan digunakan
distilasi vakum sebagai metode pemurnian senyawa klorida asam.
Distilasi vakum adalah distilasi pada tekanan yang direduksi. Distilasi vakum digunakan untuk memurnikan senyawa yang memiliki titik didih di atas 200 °C, senyawa yang akan terdekomposisi jika dipanaskan pada tekanan normal, atau senyawa yang dapat bereaksi dengan oksigen di udara (Pavia 1982). Sebagai contoh, gliserol mendidih dengan dekomposisi pada suhu 290 °C dan tekanan 760 mmHg, tetapi dapat didistilasi tanpa terdekomposisi pada tekanan di bawah 12 mmHg dengan titik didih 180 °C.
Perangkat distilasi vakum dalam skala laboratorium menggunakan labu Claisen berleher dua untuk meletakkan pipa kapiler dan termometer. Tujuan utama dari konstruksi ini adalah untuk menghindari kontaminasi mekanik distilat yang disebabkan oleh goncangan yang kuat dan pembusaan. Hal ini merupakan kesulitan yang dihadapi dalam distilasi vakum dibandingkan dengan distilasi sederhana. Labu Claisenbiasanya dipanaskan dalam penangas minyak atau pasir untuk memastikan pemanasan yang konstan. Suhu
penangas biasanya 15_25 °C lebih tinggi
daripada suhu uap distilasi.
Ali et al. (2002) menyatakan bahwa efisiensi pemurnian senyawa menggunakan distilasi vakum bergantung pada laju penguapan senyawa, pergerakan uap untuk kondensasi, dan perpindahan distilat. Kapasitas pompa vakum, metode pemanasan dan pendinginan senyawa yang akan didistilasi berperan dalam menentukan parameter optimum dari proses distilasi. Gambar 4 menunjukkan perangkat distilasi vakum.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain asam laurat, tionil klorida, dan NaOH 40%.
Alat-alat yang digunakan antara lain labu leher tiga, radas refluks, eksikator, pompa vakum, radas distilasi vakum, corong tetes, termometer, neraca analitik, pipet Mohr, lempeng pemanas, gelas piala, pengaduk magnetik, dan FTIR Perkin Elmer Spectrum One Versi 5.0.1.
Metode (Sudarmiko 1995)
Penelitian ini dimulai dengan ragam waktu reaksi meliputi 0.5, 1.5, 3, dan 6.5 jam. Setelah didapatkan klorida asam, dilakukan optimasi waktu dengan ragam 0.5, 1.5, 3, dan 5 jam, serta nisbah mol asam laurat:tionil klorida 1:1.2, 1:3, dan 1:5. Berikut ini merupakan contoh sintesis yang dilakukan dengan waktu reaksi 1.5 jam dengan nisbah mol 1:5.
Tionil klorida sebanyak 4.1000 g (2.5 mL) dimasukkan ke dalam labu dasar bulat berleher tiga yang dilengkapi dengan corong tetes, pendingin, pengaduk magnetik, dan termometer. Susunan perangkat sintesis ditunjukkan dalam Lampiran 7. Sebanyak 1.3433 g asam laurat ditambahkan sedikit demi sedikit sambil diaduk kuat pada suhu ± 50 °C selama 1.5 jam. Pemanasan diteruskan pada suhu 80 °C selama 1.5 jam untuk menghilangkan tionil klorida yang berlebih.
Gas SO2 dan HCl yang terbentuk dalam
campuran dihilangkan dengan cara divakum, yang dilanjutkan dengan distilasi vakum. Rendemen dan spektrum IR_nya dianalisis. Perlakuan yang sama juga dilakukan terhadap waktu sintesis dan nisbah mol yang lain. Bagan alir penelitian ditunjukkan pada Lampiran 1.
HASIL DAN PEMBAHASAN
Percobaan Awal Sintesis
Percobaan pertama sintesis lauroil klorida dilakukan pada suhu 50 °C selama 30 menit. Hasilnya menunjukkan bahwa klorida asam yang terbentuk tidak murni. Hal ini diketahui dari wujud klorida asam yang seharusnya berupa cairan bukan padatan. Hal ini diduga karena masih terdapat asam laurat yang belum bereaksi sempurna dengan tionil klorida.
Percobaan selanjutnya dilakukan dengan meragamkan waktu reaksi yang digunakan yaitu 1.5, 3, dan 6.5 jam. Percobaan ini dilakukan dengan mereaksikan asam laurat dan tionil klorida pada suhu 50 °C selama ragam waktu yang ditentukan (misal 6.5 jam) dan suhu 80 °C selama 1.5 jam. Reaksi ini
menggunakan suhu ± 50 °C agar SOCl2
menguap sedangkan asam laurat habis bereaksi. Jika asam laurat berlebih, pereaksi dapat bereaksi dengan produk klorida asam menjadi anhidrida asam yang tidak diinginkan. Penggunaan suhu 80 °C pada pemanasan selanjutnya bertujuan menghilangkan tionil klorida yang berlebih.
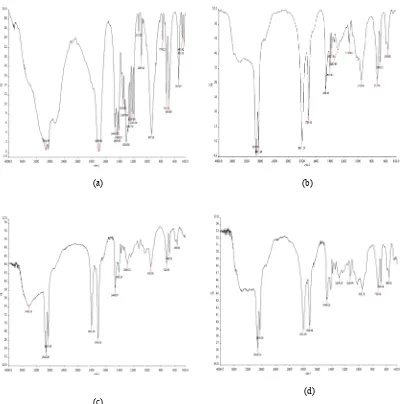
Konversi asam lemak ke klorida asam ditunjukkan oleh hilangnya serapan pita lebar dan kuat di sekitar 3300_2500 cm-1 pada spektrum IR_nya. Hal ini dapat dilihat pada spektrum IR asam laurat (Gambar 5a) yang berbeda dengan spektrum hasil sintesis dengan waktu reaksi 1.5 jam (Gambar 5b), 3 jam (Gambar 5c), dan 6.5 jam (Gambar 5d). Serapan yang hilang tersebut merupakan ciri khas dari gugus hidroksil asam karboksilat karena adanya ikatan hidrogen. Sementara serapan gugus C=O (karbonil) pada klorida asam lebih kuat dan bergeser ke bilangan gelombang yang lebih besar. Geseran kimia yang besar ini timbul karena kemampuan Cl dalam menarik rapatan elektron dari ikatan
hidrogen α didekatnya lebih besar
dibandingkan dengan O atau N (Fessenden & Fessenden 1986). Pergeseran serapan IR karbonil untuk asam lemak dijumpai pada bilangan gelombang 1700-1725 cm-1 dengan intensitas yang cukup kuat, sedangkan pada klorida asam frekuensinya lebih tinggi daripada serapan karbonil untuk derivat asam lainnya (Amaludin 2007).
Silverstein et al. (1991) menyatakan
bahwa gugus karboksil merupakan salah satu gugus fungsional yang paling mudah dideteksi oleh spektroskopi IR karena timbulnya vibrasi C=O yang disertai munculnya serapan O-H yang terpusat di sekitar 3000 cm-1. Klorida asam memperlihatkan serapan vibrasi ulur
C=O pada bilangan gelombang 1810_1775
cm-1.
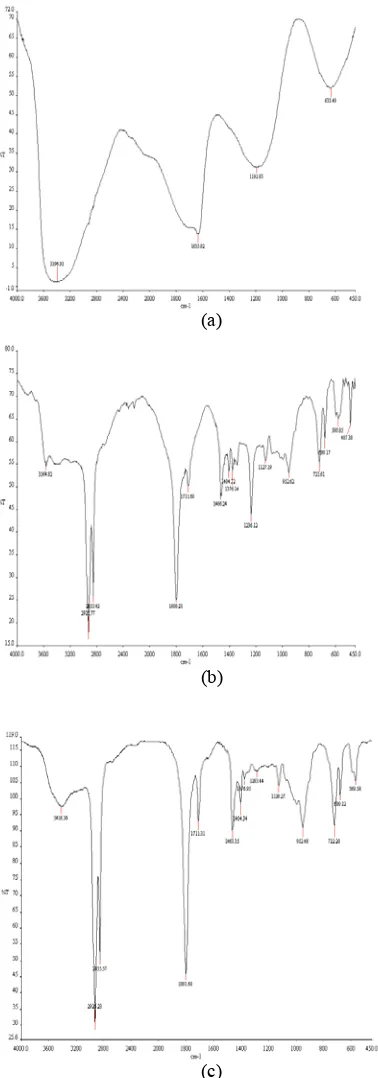
ragam yang menggunakan asam laurat 1 g. Hal ini dikarenakan klorida asam yang terbentuk berubah wujud menjadi padatan berwarna hitam, dengan kata lain sampel tersebut sudah rusak karena tingginya suhu dari proses distilasi, yaitu sebesar 145 °C. Penggunaan suhu tersebut bertujuan untuk memisahkan lauroil klorida dengan asam laurat yang tidak bereaksi karena lauroil klorida mendidih pada 145 °C. Distilasi vakum dipilih karena dapat menurunkan titik didih lauroil klorida sehingga diharapkan pada
suhu 99_109 °C, lauroil klorida tersebut sudah dapat dipisahkan (Rabjohn 1963). Hasil pencirian FTIR dari ragam sampel 1.75 g dan 2.5 g ditunjukkan oleh Gambar 6.Sudarmiko (1995) menyatakan bahwa hasil sintesis belum murni sampai tahap pemvakuman karena masih ada campuran asam laurat. Hasil yang murni baru didapatkan setelah sampai pada tahap distilasi.
(a)
(b)
(d) (c)
Gambar 6 Spektum FTIR ragam sampel 1.75 g (a) dan 2.5 g (b).
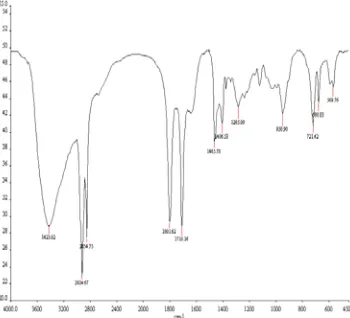
Gambar 7 Spektrum FTIR palmitoil klorida (Amaludin 2007).
Percobaan selanjutnya menggunakan teknik penetesan yang berbeda dari percobaan terdahulu. Tionil klorida ditambahkan tetes demi tetes untuk melihat sejauh mana tingkat kesempurnaan dari reaksi. Diharapkan semakin lama jarak waktu penetesan maka reaksi lebih sempurna sehingga peluang terjadinya tumbukan antar molekul semakin besar dan tidak memungkinkan terbentuknya anhidrida asam. Hasil pencirian FTIR dari sampel dengan teknik penetesan yang berbeda ditunjukkan oleh Gambar 8. Hasil pengujian tersebut menunjukkan sudah terbentuknya senyawa lauroil klorida. Hal ini diketahui dengan terbentuknya serapan pada bilangan gelombang 1800.51 cm-1 yang lebih dominan dibandingkan dengan serapan uluran C=O di 1712.89 cm-1. Akan tetapi, serapan tersebut terlalu lebar, sedangkan seharusnya berupa puncak yang tajam, sebagaimana ditunjukkan oleh spektrum FTIR palmitoil klorida (Gambar 7).
Kegagalan sintesis pada percobaan sebelumnya dieliminasi dengan mengubah metode sintesis, yaitu tionil klorida diletakkan didasar labu dan asam laurat yng dimasukkan perlahan-lahan. Teknik ini digunakan untuk menghindari produk samping berupa anhidrida asam.
Optimalisasi Waktu Sintesis
Ragam waktu reaksi yang digunakan untuk optimalisasi ialah 0.5, 1.5, 3, dan 5 jam dengan nisbah mol asam laurat_tionil klorida 1:5. Data optimalisasi waktu sintesis di sajikan dalam Lampiran 5.
Sintesis dengan waktu reaksi 0.5 jam menghasilkan rendemen tertinggi, yaitu sebesar 96.37%. Akan tetapi, senyawa yang dihasilkan tidak murni karena berupa cairan beku yang mengindikasikan masih banyak terdapat asam laurat. Sintesis dengan waktu reaksi 1.5 dan 3 jam menghasilkan senyawa lauroil klorida dengan rendemen berturut-turut sebesar 95.64% dan 94.55%. Ketiga hasil sintesis tersebut ditunjukkan oleh Gambar 9.
Waktu reaksi 5 jam menunjukkan adanya efek termodinamika yaitu reaksi tersebut menghasilkan anhidrida asam yang lebih stabil secara termodinamika. Hal ini ditunjukkan dengan terdapatnya dua puncak pada bilangan gelombang 1830_1800 cm-1 dan 1775_1740 cm-1 untuk uluran C=O.
Kendali kesetimbangan/termodinamika berperan terhadap reaksi yang menggunakan suhu tinggi atau dengan waktu reaksi yang lebih lama. Klorida asam yang memiliki tingkat kestabilan yang sangat kecil akan cenderung memiliki energi yang besar sehingga tingkat keteraturannya pun akan
semakin kecil (ΔS>0). Pengaruh
termodinamika mengakibatkan klorida asam lebih reaktif dibandingkan dengan anhidrida asam sehingga tidak stabil.
Rendemen yang didapat pada waktu sintesis 5 jam sebesar 80.98%. Rendemen tertinggi diperoleh pada waktu reaksi 1.5 jam, yaitu sebesar 95.64%. Tingginya nilai rendemen yang didapat dipengaruhi oleh kecepatan laju reaksi. Pertambahan laju reaksi merupakan akibat meningkatnya jumlah molekul yang bertumbukan sehingga rendemennya juga semakin tinggi. Hasil pemantauan dengan FTIR dari sintesis dengan waktu reaksi 5 jam ditunjukkan oleh Gambar 10.
(a)
(b)
(c)
Gambar 10 Spektrum FTIR hasil sintesis dengan waktu reaksi 5 jam.
Hasil pemantauan FTIR dari optimalisasi waktu sintesis dijadikan patokan dalam percobaan selanjutnya dalam menentukan nisbah mol asam laurat_SOCl2 yang tepat dari reaksi. Oleh karena itu, digunakan teknik perbandingan 1800/1700 dengan mengukur nisbah serapan gugus fungsi pada bilangan
gelombang 1800 cm-1 dan 1700 cm-1.
Bilangan gelombang 1800 cm-1 mewakili
serapan IR karbonil pada lauroil klorida,
sedangkan bilangan gelombang 1700 cm-1
mewakili IR karbonil pada asam laurat. Aplikasi dari teknik ini dilakukan dengan membandingkan tinggi puncak serapan di 1800 cm-1 dan 1700 cm-1 dengan cara menarik garis dari masing-masing garis dasar spektrum (baseline). Pengaruh waktu reaksi terhadap nisbah 1800/1700 disajikan dalam Gambar 11.
Gambar 11 Grafik pengaruh waktu reaksi terhadap nisbah 1800/1700.
Hasil optimalisasi menunjukkan bahwa nisbah 1800/1700 tertinggi diperoleh pada waktu reaksi 1.5 jam, yaitu sebesar 5.44. Hal ini berarti bahwa pada waktu reaksi 1.5 jam
terjadi kesetimbangan reaksi (ΔG = 0)
sebelum titik belok. Dengan demikian, waktu reaksi 1.5 jam digunakan sebagai patokan waktu reaksi yang akan digunakan dalam penentuan nisbah mol.
Penentuan Nisbah Mol
Penentuan nisbah mol asam laurat_tionil klorida menggunakan ragam 1:1.2, 1:3, dan 1:5. Data penentuan nisbah mol di sajikan dalam Lampiran 6. Spektrum IR hasil sintesis menunjukkan terbentuknya lauroil klorida pada nisbah mol 1:3 dan 1:5 dengan rendemen berturut-turut adalah 93.15 dan 95.64%. Hasil pencirian FTIR sintesis tersebut ditunjukkan oleh Gambar 12.
(a)
(b)
Gambar 12 Spektrum FTIR hasil sintesis dengan nisbah mol 1:3 (a), dan 1:5 (b). 0 1 2 3 4 5 6
0 2 4 6
Waktu (jam )
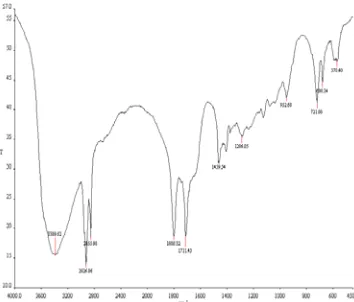
Senyawa yang dihasilkan pada sintesis dengan nisbah mol 1:1.2 adalah anhidrida asam. Dari hasil ini dapat dilihat bahwa semakin banyak jumlah tionil klorida yang digunakan, maka akan semakin memperkecil peluang terbentuknya anhidrida asam dan memaksimalkan fungsi asam laurat sebagai pereaksi pembatas. Rendemen yang diperoleh pada nisbah mol 1:1.2 adalah 90.25%. Hasil pencirian FTIR ditunjukkan oleh Gambar 13.
Gambar 13 Spektrum FTIR hasil sintesis dengan nisbah mol 1:1.2.
Gambar 14 memperlihatkan bahwa meningkatnya konsentrasi SOCl2 berbanding lurus dengan kenaikan nisbah 1800/1700 dan mencapai titik optimum pada nisbah mol 1:3 tetapi cenderung landai menuju nisbah mol 1:5. Hal ini disebabkan semakin tinggi konsentrasi reaktan, maka peluang terjadinya tumbukan antarmolekul semakin besar. Untuk melakukan suatu reaksi, molekul-molekul harus saling bertumbukan satu dengan yang lainnya. Konsep umum ini merupakan dasar teori tumbukan dari kinetika kimia yang menyatakan bahwa kecepatan reaksi sebanding dengan jumlah tumbukan yang terjadi di antara molekul-molekul zat yang melakukan reaksi per satuan waktu. Hal ini menunjukkan bahwa kecepatan reaksi bergantung dari konsentrasi pereaksi.
0.00 1.00 2.00 3.00 4.00 5.00 6.00
0 1 2 3 4
Nisbah mol asam laurat-tionil klorida
N is b ah 1 800/ 1 700
Gambar 14 Grafik pengaruh nisbah mol asam laurat-tionil klorida terhadap nisbah 1800/1700.
SIMPULAN DAN SARAN
Simpulan
Kondisi optimum sintesis lauroil klorida didapatkan pada waktu reaksi 1.5 jam dan nisbah mol asam laurat_tionil klorida 1:3. Akan tetapi, rendemen tertinggi didapatkan pada saat kondisi waktu reaksi 1.5 jam dan nisbah mol 1:5, yaitu sebesar 95.64%. Cara sintesis terbaik adalah dengan menambahkan asam laurat ke dalam tionil klorida.
Saran
Perlu dilakukan penelitian lanjutan mengenai aplikasi dari lauroil klorida sebagai senyawa perantara. Perlu dicari lebih lanjut mengenai senyawa yang mampu mempertahankan kereaktifan dari lauroil klorida sehingga senyawa tersebut dapat digunakan dalam jangka waktu yang lama.
DAFTAR PUSTAKA
Ali ST, Rao JV, Varma KS, Prakash TL. 2002. Purification of cadmium up to 5N+ by vacuum distillation. Bull Mater Sci. 25:479–481.
Amaludin SD. 2007. Konversi asam karboksilat rantai panjang ke amina sekunder rantai karbon ganjil [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Darusman LK et al. 2005. The exploration of the potency of FTIR spectroscopy and chemometrics for extract bioactivity prediction and rapid analysis of bioactive content of medicinal plants. Prosiding Simposium Nasional Kimia Bahan Alam XV. Bogor: Institut Pertanian Bogor.
Dunn WB, David IE. 2005. Metabolomics: current analytical platforms and
methodologies. Trends in Anal Chem
24:285-294.
Fessenden RJ, Fessenden JS. 1986. Kimia
Organik. Jilid ke_2. Ed ke-3. Pudjaatmaka AH, penerjemah.
Terjemahan dari: Organic Chemistry
Jakarta: Erlangga.
Hawley GG. 1981. The Condensed Chemical
Dictionary. Ed ke-10. New York: Van Nostrand Reinhold.
Ketaren S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI Pr. Markly KS. 1960. Fatty Acid. Ed ke-2. New
York: Interscience Publishers.
Nuance. 2004. What is FT-IR?. [terhubung berkala] http:/// www.northwestern.edu/nuance/what is FT-IR [8 Februari 2006].
Pavia DL et al. 1982. Introduction to Organic Laboratory Techniques (A Microscale Approach). Ed ke-2. Florida: Saunders College.
Rabjohn N. 1963. Organic Syntheses. Volume ke_. 4. New York: Wiley.
Silverstein RM, Bassler GC, Morrill TC. 1991. Spectrometric Identification of Organic Compounds. Ed Ke-4. Hartomo AJ, penerjemah. Jakarta: Erlangga.
Sudarmiko N. 1995. Sintesis, isolasi, dan karakterisasi sifat aktif permukaan ester sukrosa laurat [skripsi]. Bogor; Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sykes P. 1989. Penuntun Mekanisme Reaksi
Kimia Organik. Ed ke-6. Jakarta: Gramedia.
Thor G, Terryberry J. 2005. Solving drug discovery with metabolomic and metabonomics: New aspecs of the “omic” revolution. D&MD Publication. 4:1-4
Lampiran 2 Senyawaan yang dapat dihasilkan oleh klorida asam
R C C l O
R C C l O
R C C l O
R C C l O
R C C l O
R C C l O
R C C l O
R C C l O
H2O
R 'O H
C6H6
A lC l3
R C O2H
R C O C R '
O O
R C C l O
C l2
R C N R '2
O
R C C6H5
O
R C R '2
O H
R C H O
R C H C lC H C l O
R C R ' O
+ a s a m k a r b o k s ila t
+ R C O2R ' e s te r
a m id a
a n h id r id a
a r il k e to n
a lk o h o l te r s ie r
k e to n
a ld e h id a
k lo r id a a s a m α −k lo r o +
+
+
+
+ R '2N H
R 'C O2
-( 1 ) 2 R 'M g X
( 2 ) H2O , H+
R '2C d a ta u L i C u R '2
( 1 ) L iA lH ( O R ')3
Lampiran 4 Data percobaan awal
Keterangan : * = Hasil sintesis rusak karena destilasi.
** = Teknik penetesan ”tetes demi tetes” metode biasa.
Lampiran 5 Data optimalisasi waktu sintesis
Lampiran 6 Data penentuan nisbah mol
No Nisbah Bobot (g) Waktu Bentuk Rendemen Senyawa yang
Laurat : SOCl2
As. Laurat SOCl2 Reaksi
(jam)
Fisik (%) Dihasilkan
(FTIR)
1 1 : 1.2 5.7424 4.1000 1.5 Cairan bening
kekuningan
90.25 anhidrida asam
2 1 : 3 2.3245 4.1000 1.5 Cairan bening
kekuningan
93.15 Klorida asam
3 1 : 5 1.3433 4.1000 1.5 Cairan bening
kekuningan
95.64 Klorida asam
No Nisbah Bobot (g) Waktu Bentuk Rendemen Senyawa yang
Laurat : SOCl2
As. Laurat
SOCl2 Reaksi
(jam)
Fisik (%) dihasilkan
(FTIR)
1 1 : 1.37 10.0063 8.2000 0.5 Cairan beku - -
2 1 : 1.37 10.0078 8.2000 0.5 Cairan beku - -
*3 1 : 6.88 1.0046 4.1000 6.5 Cairan bening
kekuningan
- -
4 1 : 3.90 1.7652 4.1000 6.5 Cairan bening
kekuningan
- anhidrida asam
5 1 : 2.75 2.5041 4.1000 6.5 Cairan bening
kekuningan
- anhidrida asam
6 1 : 1.37 5.0035 4.1000 1.5 Cairan bening
kekuningan
84.51 anhidrida asam
7 1 : 1.37 5.0103 4.1000 3 Cairan bening
kekuningan
94.21 anhidrida asam
8 1 : 1.37 5.0258 4.1000 6.5 Cairan bening
kekuningan
95.25 anhidrida asam
** 9
1 : 6.88 1.0096 4.1000 6.5 Cairan bening
kekuningan
95.01 Klorida asam
** 10
1 : 5.13 1.3470 4.1000 1.5 Cairan bening
kekuningan
94.73 Klorida asam
No Nisbah Bobot (g) Waktu Bentuk Rendemen Senyawa yang
Laurat : SOCl2
As. Laurat SOCl2 Reaksi
(jam)
Fisik (%) dihasilkan
(FTIR)
1 1 : 5 1.3903 4.1000 0.5 Cairan beku 96.37 Asam laurat
2 1 : 5 1.3433 4.1000 1.5 Cairan bening
kekuningan
95.64 Klorida asam
3 1 : 5 1.3899 4.1000 3 Cairan bening
kekuningan
94.55 Klorida asam
4 1 : 5 1.3861 4.1000 5 Cairan bening
kekuningan
Lampiran 7 Perangkat sintesis klorida asam