LAJU ADSORPSI ISOTERMAL β
- KAROTEN DARI METIL
ESTER MINYAK SAWIT DENGAN MENGGUNAKAN
ATAPULGIT DAN MAGNESIUM SILIKAT SINTETIK
Oleh
REYNALDI ELMIR ARISURYA
F34104075
2009
Reynaldi Elmir Arisurya. F34104075.Laju Adsorpsi Isotermal β-Karoten dari Metil Ester Minyak Sawit dengan Menggunakan Atapulgit dan Magnesium Silikat Sintetik. Di bawah bimbingan Prayoga Suryadarma. 2009.
RINGKASAN
Ketersediaan sumber energi khususnya energi fosil semakin mengalami penurunan seiring dengan meningkatnya kebutuhan energi dunia. Meningkatnya kebutuhan akan minyak bumi menyebabkan semakin menipisnya kandungan minyak di bumi. Salah satu energi alternatif yang dapat digunakan sebagai solusi mengatasi krisis energi adalah biodiesel. Biodiesel dapat dihasilkan melalui reaksi transesterifikasi antara trigliserida (minyak sawit) dengan metanol menjadi metil ester dan gliserol dengan bantuan katalis.
Penggunaan metil ester saat ini telah berkembang sebagai bahan bakar biodiesel. Metil ester berbasis minyak sawit merupakan bahan bakar cair alternatif yang dipandang berpotensi besar untuk dikembangkan dan mampu menjawab kebutuhan bahan bakar solar nasional yang tinggi. Hal ini di dukung dengan jumlah produksi CPO nasional yang sangat besar. Pengalihan penggunaan metil ester sebagai biodiesel inilah yang memicu pertumbuhan industri oleokimia di Indonesia. Pada proses produksi biodiesel, pemurnian dilakukan untuk menghilangkan komponen pengotor seperti air, sabun, asam lemak bebas, gliserol, basa (NaoH) termasuk komponen vitamin di dalamnya yaitu pigmen warna karotenoid. Padahal karotenoid dalam bentuk β-karoten memiliki banyak kegunaan bagi kesehatan manusia serta untuk kepentingan lainnya sehingga perlu dilakukan pemisahan β-karoten dengan teknik tertentu dalam industri metil ester agar diperoleh nilai tambah yang tinggi bagi industri. Banyak metode yang dapat digunakan untuk memperoleh konsentrat karotenoid antara lain metode saponifikasi, ektraksi pelarut, adsorpsi, distilasi molekuler serta fluida superkritik.
Adsorpsi merupakan metode yang lebih sering dipakai untuk pemisahan β -karoten. Berbagai jenis adsorben digunakan untuk mengadsorpsi komponen β -karoten. Salah satu adsorben yang memiliki keunggulan dan selektif dibandingkan dengan adsorben lain adalah atapulgit. Atapulgit merupakan mineral senyawaan yang mengandung silika, aluminum dan magnesium. Selain itu, atapulgit merupakan salah satu adsorben yang bersifat semi polar dan memiliki kemapuan penyerapan yang sangat baik.
aktivasi (Ea) dapat ditentukan dengan cara memplotkan nilai konstanta laju adsorpsi (k) dan suhu (T) dengan menggunakan persamaan Arrhenius.
Nilai konstanta laju adsorpsi mengalami peningkatan seiring dengan meningkatnya suhu. Nilai konstanta laju adsorpsi dengan menggunakan atapulgit untuk masing masing suhu 65 , 80 dan 90 °C adalah 0.0236 min-1 0.0332 min-1, 0.0515 min -1, sedangkan nilai konstanta laju adsorpsi dengan menggunakan magnesium silikat sintetik untuk masing-masing suhu 65 °C , 80 °C dan 90 °C adalah 0.0146 min-1, 0.0266 min-1, 0.0442 min-1.
Reynaldi Elmir Arisurya. F34104075.Isothermal Adsorption rate of β-carotene from Palm Oil Methyl Ester by Using Attapulgite and Synthetic Magnesium Sillicate. Under the Supervision of Prayoga Suryadarma. 2009.
SUMMARY
The availability of energy source especially fossil fuel is decreasing as the global energy needs increases. The increasing needs of petroleum has led to the reduction of this energy source. One of the alternative energy which can solve the energy crisis id biodiesel. It is resulted from treansesterification reaction between trigliserida dan methanol which turn into methyl ester and gliserol by using catalyst.
The use of methyl ester has developed as biodiesel fuel. Palm Oil based metyl ester id an alternative liquid fuel which id considered potential to develop and able to fulfill the national needs of diesel. It is supportes by the high national production of CPO. The shift of the metyl ester use as biodiesel triggers the growth of oleochemical industries in Indonesia. In the production process of biodiesel, purifying is conducted to leave out such impurities as water, soap, free fatty acids, gliserol, base (NaOH) including vitamin component, caroteneoid color pigment. Krotenoid in form of β-carotene is useful for human health and other needs. Therefore, it is important to separate β-carotene by certain technique in methyl ester industries in order to obtained high added value for the industry. Such methods can be used to get carotene concentrate as saponification, mulecular distilation and supercritic fluid methods.
Adsorption is a method often used to separate β-carotene by using many kinds of adsorbent. One of the adsorbents which is qualified and selective compared to other adsorbents is attapulgite. It is a mineral cantaining silica, alumunium, and magnesium. In addition, attapulgite is one of the semi polar adsorbents which and able to adsorp well.
The objective of this research is to determine the adsorption rate contanta (k) as well as activation energy (Ea) as a kinetics parameter of β-carotene adsorption. Isothermal adsorption process of β-carotene is conducted in three different temperature condition : 65 °C, 80 °C and 90 °C. Adsorption equilibrium is obtained when the concentration of β-carotene in methyl ester doesn’t decline as the adsorption time increases. The parameter which is determined when the equilibrium condition is reached is adsorption time t (minute) and concentration value of β-carotene in methyl ester c (µg.ml). Adsorption rate contanta is determined from the result of linear regression between metyhl ester Absorbance value at t (A) and contact time between adsorbent and methyl ester. isoterm model which can explain the adsorption process is isoterm model of Brimberg. Energy activation (Ea) can be determined by plotting the constant value of adsorption rate (k) and temperature (T) by using Arrhenius equation.
Constant value rate of adsorption which is obtanied from attapulgite in the each temperature of 65, 80 and 90 °C are 0.0236 min-10.0332 min-1, 0.0515 min
-1
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul “ Laju Adsorpsi Isotermal ß-karoten dari Metil Ester Minyak Sawit dengan
Menggunakan Atapulgit dan Magnesium Silikat Sintetik” adalah hasil karya saya sendiri dengan arahan dosen Pembimbing Akademik, kecuali yang dengan jelas ditunjukan rujukannya.
Bogor, September 2009 Yang membuat pernyataan,
LAJU ADSORPSI ISOTERMAL
β-KAROTEN DARI METIL
ESTER MINYAK SAWIT DENGAN MENGGUNAKAN
ATAPULGIT DAN MAGNESIUM SILIKAT SINTETIK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
REYNALDI ELMIR ARISURYA
F34104075
2009
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
LAJU ADSORPSI ISOTERMAL
β
-KAROTEN DARI METIL ESTERMINYAK SAWIT DENGAN MENGGUNAKAN ATAPULGIT DAN
MAGNESIUM SILIKAT SINTETIK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
REYNALDI ELMIR ARISURYA
F34104075
Dilahirkan pada tanggal 31 Agustus 1986 di Bogor
Tanggal lulus : Juli 2009
Menyetujui, Bogor, September 2009
Prayoga Suryadarma, S.TP, MT
Penulis dilahirkan di Bogor pada tanggal 31 Agustus 1986. Penulis merupakan anak kedua dari tiga bersaudara, putra dari pasangan Amirudin Aidin Beng dan Tartini. Pada Tahun 1998, penulis menyelesaikan pendidikan sekolah dasar di SDN Pengadilan III Bogor. Penulis menyelesaikan pendidikan sekolah menengah pertama di SLTPN 2 Bogor pada tahun 2001. Penulis kemudian melanjutkan pendidikan di SMUN 2 Bogor dan lulus pada tahun 2004.
Pada tahun 2004, penulis melanjutkan pendidikan tinggi di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI).
Semasa kuliah penulis pernah aktif dalam organisasi kemahasiswaan Himpunan Mahasiswa Teknologi Industri (Himalogin) dan pernah menjabat sebagai staf Divisi Human Resources Development (HRD) periode 2005-2006. Penulis juga aktif dalam beberapa kepanitiaan seperti Hari Warga Industri (HAGATRI) 2006, SPORTIN 2006, seminar Blue Ocean Strategy (2006) dan Agroindustry Days (2006).
Penulis Melaksanakan Praktek Lapang pada tahun 2007 dengan topik ”Mempelajari Aspek Teknologi Proses Produksi dan Penanganan Limbah Susu
Bubuk di PT. Sugizindo, Citereup, Bogor. Dalam Rangka menyelesaikan tugas akhir, penulis melakukan penelitian yang dituangkan dalam skripsi berjudul“Laju Adsorpsi Isotermal ß-karoten dari Metil Ester Minyak Sawit dengan Menggunakan Atapulgit dan Magnesium Silikat Sintetik”.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Laju Adsorpsi Isotermal ß-karoten dari Metil Ester Minyak Sawit dengan
Menggunakan Atapulgit dan Magnesium Silikat Sintetik”. Skripsi ini disusun
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Suatu kehormatan tersendiri bagi penulis, selama penelitian dan penyusunan skripsi ini banyak mendapatkan arahan dan bantuan dari berbagai pihak.
Ucapan terima kasih penulis sampaikan kepada :
1. Prayoga Suryadarma, S.TP, MT selaku dosen pembimbing yang telah banyak memberikan arahan dan bimbingan pada saat penelitian dan dalam penyusunan skripsi ini.
2. Dr. Ir. Sapta Raharja, DEA dan Dr. Ir. Suprihatin selaku dosen penguji yang telah memberikan saran dalam penyempurnaan skripsi ini.
2. Ayah, ibu serta seluruh keluarga, untuk motivasi, dukungan dan semangat. 3. Teman sebimbingan (Zuni, Ika, Yayan, Bambang dan Rita), atas bantuan dan
kerja samanya
4. Magdalena Kristin Sejati untuk dukungan, kasih sayang dan semangat. 5. Mbak Yeni dan Mbak Ani atas bantuan dan dukungan.
6. TIN 41 dan semua pihak yang telah memberikan bantuan dan dukungannya selama penulis menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan, sehingga kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga skripsi ini bermanfaat bagi penulis dan bagi semua pihak yang memerlukan.
Bogor, September 2009
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. METIL ESTER ... 3
B. KAROTENOID ... 5
C. ADSORBEN ... 8
D. ADSORPSI ... 11
E. LAJU ADSORPSI ... 15
III. METODOLOGI ... 18
A. BAHAN DAN ALAT ... 18
B. METODOLOGI PENELITIAN ... 19
1. Tahapan Penelitian ... 19
(a) Karakterisasi Awal ... 20
(b) Penentuan Laju Pengadukan Optimum ... 20
(c) Penentuan Kondisi Kesetimbangan Adsorpsi ... 20
1) Penentuan Konstanta Laju Adsorpsi (k) ... 21
2) Penentuan Energi Aktivasi (Ea) ... 22
(e) Penentuan Kualitas Adsorpsi ... 23
2. Prosedur Percobaan ... 23
IV. HASIL DAN PEMBAHASAN ... 25
A. KARAKTERISASI AWAL ... 25
1. Karakterisasi Metil Ester ... 25
2. Karakterisasi Adsorben ... 26
B. LAJU PENGADUKAN OPTIMUM ... 27
C. KONDISI KESETIMBANGAN ... 28
D. LAJU ADSORPSI ... 33
1. Konstanta Laju Adsorpsi ... 33
2. Energi Aktivasi ... 35
E. KUALITAS ADSORPSI ... 37
V. KESIMPULAN DAN SARAN ... 42
A. KESIMPULAN ... 42
B. SARAN ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Tabel 1. Syarat mutu biodiesel……… 4
Tabel 2. Komponen-komponen dalam atapulgit ………. 9
Tabel 3. Karakteristik atapulgit ... 10
Tabel 4. Perbedaan antara adsorpsi fisika dengan adsorpsi kimia ... 13
Tabel 5. Penentuan nilai energi aktivasi ... 22
Tabel 6. Karakterisitk awal metil ester ... 25
Tabel 7. Karakteristik atapulgit dan magnesium silikat sintetik... 26
Tabel 8. Nilai konsentrasi β-karoten dalam metil ester pada kondisi ketetimbangan untuk masing-masing kondisi suhu dan jenis adsorben... 30
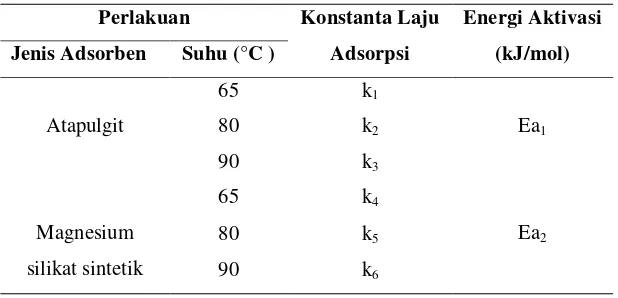
Tabel 9. Konstanta laju adsorpsiβ-karoten dari metil ester dengan menggunakan Atapulgit dan Magnesium silikat sintetik ... 34
Tabel 10. Energi aktivasi pada reaksi adsorpsiβ-karoten dari metil ester dengan menggunakan atapulgit dan magnesium silikat sintetik ... 37
DAFTAR GAMBAR
Gambar 1. Reaksi transesterifikasi pembentukan metil ester ... 3
Gambar 2. Struktur dasar karotenoid ... 6
Gambar 3. Strukturβ-karoten ... 6
Gambar 4. Kurva hubungan antara kosentrasi solut pada larutan dan yang ... 14
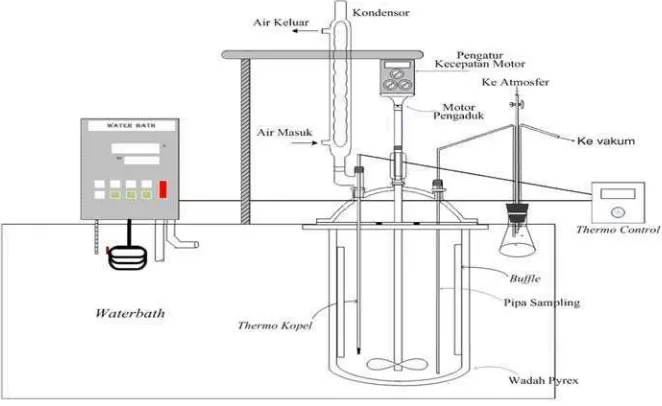
Gambar 5. Rangkaian reaktor ... 18
Gambar 6. Diagram alir tahapan penelitian ... 19
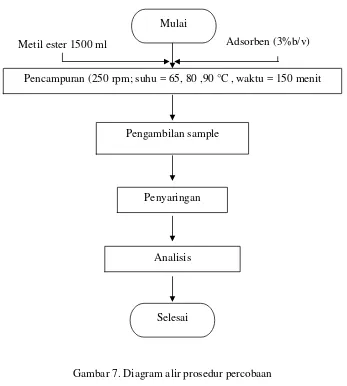
Gambar 7. Diagram alir prosedur percobaan ... 24
Gambar 8. Hubungan antara nilai β-karoten yang teradsorp dengan laju pengadukan ... 27
Gambar 9. Hubungan antara penurunan nilai konsentrasi β -karoten dalam metil ester dengan waktu adsorpsi. ... 29
Gambar 10. Ikatan Van der waals antaraβ-karoten dengan adsorben ... 32
Gambar 11. Regresi linear hubungan antara suhu (1/T) dengan ln k dengan menggunakan atapulgit ... 36
Gambar 12. Regresi linear hubungan antara suhu (1/T) dengan ln k dengan menggunakan magnesium silikat sintetik ...36
Gambar 13. Penurunan kadar basa (NaOH) dalam metil ester selama proses adsorpsi dengan menggunakan atapulgit ... 40
Gambar 14. Penurunan kadar basa (NaOH) dalam metil ester selama proses adsorpsi dengan menggunakan magnesium silikat sintetik... 40
DAFTAR LAMPIRAN
Lampiran 1. Kurva standard konsentrasi ß-karoten ... 47 Lampiran 2. Prosedur analisis ... 48 Lampiran 3. Skema reaktor ... 52 Lampiran 4. Foto reaktor proses adsorpsi ß-karoten dari metil ester
tipe tangki berpengaduk... 53 Lampiran 5. Perubahan warna metil ester dan adsorben ……… 54 Lampiran 6. Perhitungan konstanta laju adsorpsi (k) dan energi
aktivasi (Ea)……… 55
Lampiran 7. Data hasil penelitian ………. 56 Lampiran 8. Data hasil perhitungan konstanta laju adsorpsi adsorpsi
I. PENDAHULUAN
A. LATAR BELAKANG
Ketersediaan sumber energi khususnya energi fosil semakin mengalami penurunan seiring dengan meningkatnya kebutuhan energi dunia. Meningkatnya kebutuhan akan minyak bumi menyebabkan semakin menipisnya kandungan minyak di bumi. Salah satu energi alternatif yang dapat digunakan sebagai solusi mengatasi krisis energi adalah biodiesel. Biodiesel dapat dihasilkan melalui reaksi transesterifikasi antara trigliserida (minyak sawit) dengan metanol menjadi metil ester dan gliserol dengan bantuan katalis.
Metil ester berbasis minyak sawit merupakan bahan bakar cair alternatif yang dipandang berpotensi besar untuk dikembangkan dan mampu menjawab kebutuhan bahan bakar solar nasional yang tinggi. Hal ini di dukung dengan jumlah produksi CPO nasional yang sangat besar. Pengalihan penggunaan metil ester sebagai biodiesel inilah yang memicu pertumbuhan industri oleokimia di Indonesia.
Metil ester kasar yang dihasilkan masih mengandung berbagai macam komponen pengotor seperti vitamin, gliserol, asam lemak bebas, sabun, sisa basa (NaoH), dan juga air (Darmoko et al., 2001). Komponen-komponen tersebut dapat menurunkan kualitas biodiesel yang dihasilkan. Sehingga dalam industri biasanya dilakukan proses pemurnian dengan tujuan untuk menghilangkan komponen pengotor tersebut sehingga kualitas biodiesel dapat ditingkatkan.
Proses pemurnian biasanya dilakukan dengan melakukan pemisahan terhadap komponen-komponen pengotor. Karotenoid dalam bentuk β-karoten memiliki banyak kegunaan bagi kesehatan manusia serta untuk kepentingan lainnya sehingga perlu dilakukan pemisahan dan pengambilan kembali β -karoten dalam proses pemurnian dengan teknik tertentu dalam industri biodiesel agar diperoleh nilai tambah yang tinggi bagi industri.
molekuler serta fluida superkritik. Belum terdapat metode standar untuk ektraksi karoteoid. Namun untuk mendapatkan hasil yang optimal, sebaiknya digunakan bahan yang segar, tidak rusak dan contoh yang mewakili (Gross, 1991).
Adsorpsi merupakan metode yang lebih sering dipakai untuk pemisahan β-karoten. Berbagai jenis adsorben digunakan untuk mengadsorpsi komponen β-karoten. Salah satu adsorben yang memiliki keunggulan dan selektif dibandingkan dengan adsorben lain adalah atapulgit. Atapulgit merupakan mineral senyawaan Al, Mg, dan Si dengan struktur kristal yang berongga (Lansbarkis, 2000).
Model isoterm Brimberg dapat digunakan untuk menentukan laju adsorpsi (Ribeiro et al., 2001). Karekteristik kemampuan penyerapan komponen β-karoten dapat diketahui dari laju adsorpsinya. Selain itu, dilakukan penentuan Energi aktivasi sebagai parameter untuk mengetahui efektifitas dari adsorben yang digunakan dalam proses adsorpsi. Sehingga diharapkan β-karoten yang terdapat dalam metil ester mampu diperoleh secara optimum .
B. TUJUAN
II. TINJAUAN PUSTAKA
A. METIL ESTER
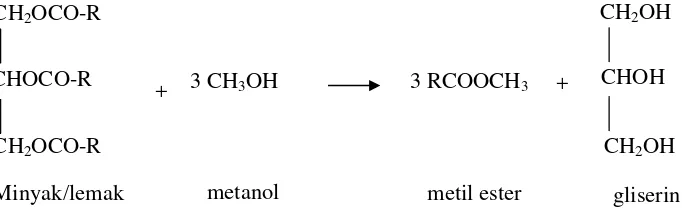
Metil ester merupakan ester asam lemak yang dibuat melalui proses esterifikasi asam lemak dengan metil alkohol, berbentuk cairan. Metil ester dapat dihasilkan melalui proses transesterifikasi trigliserida (minyak/lemak). Reaksi transesterifikasi antara minyak/lemak dengan metanol dinyatakan dalam persamaan reaksi berikut.
Gambar 1. Reaksi transesterifikasi pembentukan metil ester
Proses transesterifikasi minyak atau lemak dipengaruhi oleh beberapa faktor, yaitu suhu, lama hidrolisis, kecepatan pengadukan, jenis dan konsentrasi katalis serta perbandingan metanol-asam lemak. Metil ester yang dihasilkan dari reaksi transesterifikasi langsung trigliserida dengan metanol masih mengandung campuran ester yang berhubungan dengan residu asam lemak dalam trigliserida. Sehingga diperlukan pemurnian minyak karena adanya asam lemak bebas, fosfolipid, residu protein dan garam-garam logam (Hui, 1996).
Dalam bentuk metil ester maka berat molekul, titik beku, titik didih, dan viskositas minyak akan menjadi lebih rendah. Disamping itu senyawa gliserin yang merupakan produk samping hasil degradasi minyak nabati dapat dipisahkan pada proses pembuatan metil ester, sehingga tidak menyebabkan terbentuknya deposit pada mesin apabila digunakan sebagai bahan bakar alternatif / biodiesel (Darmoko et al., 2001). Syarat mutu dari metil ester (biodiesel) dapat dilihat pada Tabel 1.
Tabel 1. Syarat mutu biodiesel (metil ester)
No. Parameter Satuan Nilai
1 Massa jenis pada 40 °C kg/m3 850–890
2 Viskositas kinematik pd 40 °C mm2/s (cSt) 2,3–6,0
3 Angka setana min. 51
4 Titik nyala (mangkok tertutup) °C min. 100
5 Titik kabut °C maks. 18
6 Korosi lempeng tembaga (3 jam pada 50 °C)
maks. no 3
7 Residu karbon - dalam contoh asli
- dalam 10 % ampas distilasi
%-massa
maks 0,05 (maks. 0,3)
8 Air dan sedimen %-vol. maks. 0,05*
9 Temperatur distilasi 90 % °C maks. 360
10 Abu tersulfatkan %-massa maks.0,02
11 Belerang ppm-m (mg/kg) maks. 100
12 Fosfor ppm-m (mg/kg) maks. 10
13 Angka asam mg-KOH/g maks.0,8
14 Gliserol bebas %-massa maks. 0,02
15 Gliserol total %-massa maks. 0,24
16 Kadar ester alkil %-massa min. 96,5
17 Angka iodium %-massa
(g-I2/100 g)
maks. 115
18 Uji Halphen Negatif
Metil ester digunakan sebagai produk industri disebabkan karena beberapa faktor (Milyawaki, 1998, Derksen & Cuperus, 1996 dan Gervasio, 1996), antara lain :
1. Pemakaian energi untuk memproduksi metil ester melalui proses transesterifikasi lebih rendah dibandingkan untuk memproduksi asam lemak.
2. Transesterifikasi tanpa menggunakan air, sehingga gliserin yang dihasilkan bebas air, sedangkan gliserin dari hidrolisis lemak mengandung sejumlah besar air.
3. Bila dibutuhkan destilat fraksional, destilasi menggunakan ester lebih efisien dibandingkan dengan asam lemak.
4. Metil ester dapat diproses dengan peralatan karbon baja dengan kondisi yang lebih ringan dibandingkan peralatan Stainless steel mahal untuk memproduksi asam lemak.
5. Biaya produksi turunan asam lemak lainnya seperti alkohol ester, alkohol asam lemak dan ester sukrosa lebih rendah menggunakan metil ester sebagai bahan baku dibandingkan dengan asam lemak sebagai bahan baku. 6. Metil ester lebih stabil dan tidak menyebabkan korosi, sehingga biaya penanganan dan perawatannya tidak begitu mahal, warna lebih disukai, dapat dimurnikan dan didestilasi pada suhu rendah.
B. KAROTENOID
Karotenoid merupakan kelompok pigmen yang berwarna kuning, jingga, merah jingga, dan bersifat larut dalam minyak. Struktur dasar karotenoid terdiri dari ikatan hidrokarbon tidak jenuh yang dibentuk oleh 40 atom C atau 8 unit isoprena dan memiliki dua buah gugus cincin. Karotenoid dibagi menjadi empat golongan, yaitu (1) karotenoid hidrokarbon C40H56seperti alfa,
beta, gamma karoten dan likopen; (2) xantofil dan derivat karoten yang mengandung oksigen dan hikdroksil antara lain kriptosantin, C40H55OH dan
lutein, C40H54(OH)2; (3) asam karotenoid yang mengandung gugus karboksil;
Gambar 2. Struktur dasar karotenoid (Lehninger, 1982)
Karotenoid merupakan senyawa lipida yang tidak tersabunkan, larut dengan baik dalam pelarut-pelarut organik seperti karbon disulfida, benzena, kholoform, aseton, metanol, etanol, eter dan petroleum eter, tetapi tidak larut dalam air (Ketaren, 2005). Penyebab warna merah pada minyak sawit adalah adanya kandungan pigmen karotenoid yang sebagian besar terdiri dari β -karoten yang sebenarnya sangat dibutuhkan oleh tubuh sebagai prekusor vitamin A (Muchtadi, 1992).
Minyak sawit kasar mengandung komponen karotenoid antara 500 –700 ppm (Choo, 2006). Kritchecvsky et al. (2002) mengatakan bahwa total karotenoid pada minyak sawit kasar sebanyak 550 µg/g dengan kadar β -karoten sebanyak 68,2%. Dari setiap satu ton minyak sawit terkandung 240 gram karotenoid yang terdiri dari 36% γ-karoten dan 54%β-karoten.
yang dilarutkan pada heksana mempunyai serapan maksimum pada panjang gelombang 446 nm.
Komponen karotenoid larut dalam pelarut non polar seperti heksana dan petroleum eter sedangkan kelompok xantofil larut dalam pelarut polar seperti alkohol (Gross, 1991). Menurut Meyer (1966), sifat fisika dan kimia karotenoid adalah larut dalam minyak dan tidak larut dalam air, larut dalam kloroform, benzena, karbon disulfida, dan petroleum eter, tidak larut dalam etanol dan metanol dingin, tahan terhadap panas apabila dalam keadaan vakum, peka terhadap oksidasi, auto oksidasi dan cahaya serta mempunyai ciri khas absorpsi cahaya. Sifat-sifat penting tersebut diperlukan sebagai dasar untuk pemisahan karotenoid dari bahan lain.
Reaksi oksidasi dapat menyebakan hilangnya warna karotenoid dalam makanan (Schwart dan Elbe, 1996). Reaksi oksidasi karotenoid juga dipicu oleh suhu yang relatif tinggi. Karotenoid mengalami kerusakan oleh pemanasan pada suhu di atas 60 °C (Naibaho, 1983). Selanjutnya panas akan mendekomposisi karotenoid dan mengakibatkan perubahan stereoisomer. Ikatan ganda pada karotenoid menyebabkan percepaan laju oksidasi karena sinar dan katalis logam, seperti tembaga, besi dan mangan (Watfford, 1980). 1. Pengaruh Panas Terhadap Karotenoid
Karotenoid mengandung ikatan ganda sehingga mudah teroksidasi oleh sinar dan katalis logam (tembaga, besi, mangan). Bila teroksidasi, aktivitas karotenoid akan menurun karena terjadinya perubahan isomer dari bentuk trans menjadi cis (Iwasaki dan Murakhosi, 1992). Aktivitas biologis isomer cis karoten ini sekitar 15-75% (Onyewu, 1985).
mudah menguap. Degradasi β-karoten menghasilkan 6 jenis senyawa mudah menguap yang utama, yaitu 2-metil heksana, 3-metil heksana, heptana, siklo-oktanona, toluene dan (orto, meta atau para) xilena.
2. Pengaruh Proses Netralisasi Terhadap Karotenoid
Penggunaan NaOH pada proses netralisasi dapat menghilangkan fosfatida, protein, resin dan suspensi dalam minyak yang tidak dapat dihilangkan dalam proses pemisahan gum. Selain itu komponen minor yang ada di dalam minyak berupa sterol, klorofil, vitamin E dan karotenoid dapat dikurangi. Pigmen karotenoid yang larut dalam minyak akan menentukan warna dari karotenoid. Semakin encer larutan alkali yang digunakan maka jumlah larutan alkali yang dibutuhkan untuk netralisasi akan semakin besar, hal ini menyebabkan minyak netral yang dihasilkan berwarna lebih pucat sehingga semakin banyak karotenoid yang hilang (Ketaren, 2005).
Wulandari (2000) melakukan netralisasi minyak sawit menggunakan NaOH pada suhu 30–40 °C selama 30 menit dan diperoleh minyak sawit netral yang mengandung karotenoid 249 ppm. Selanjutnya Meridian (2000) melalukan netralisasi minyak sawit pada kondisi yang sama dengan total karotenoid yang diperoleh sebanyak 257 ppm.
C. ADSORBEN
1. Attapulgit
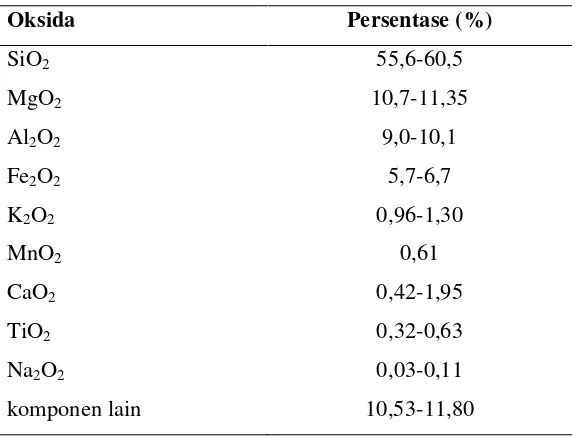
Atapulgit adalah jenis mineral silika magnesium aluminium dalam bentuk kristal, serta memiliki struktur khusus rantai berlapis. Atapulgit memiliki sifat koloid yang sangat baik diantaranya dispersi permukaan yang spesifik, tahan terhadap suhu yang tinggi, tahan terhadap garam dan alkali, dan memiliki kemampuan adsorpsi dan decoloring yang baik. Rumus molekul dari atapulgit adalah Mg5Si8O20(HO)2(OH2)4•4H2O (Grim,
1989).
Tabel 2. Komponen-komponen dalam atapulgit
Oksida Persentase (%)
SiO2 55,6-60,5
MgO2 10,7-11,35
Al2O2 9,0-10,1
Fe2O2 5,7-6,7
K2O2 0,96-1,30
MnO2 0,61
CaO2 0,42-1,95
TiO2 0,32-0,63
Na2O2 0,03-0,11
komponen lain 10,53-11,80
Sumber :www.cnhymc.com(2003)
Tabel 3. Karakteristik atapulgit
Karakteristik Nilai
Nilai Koloid (ml/15 g) 55-65
Volume ekspansi (ml/g) 4-6
Luas permukaan spesifik (m2/g) 400-500
Jumlah total permukaan ion (mg ekuivalen/100gr) 25-50 Kapasitas dcoloring (setelah perlakuan) >170
Magnesium silikat sintetik memiliki luas permukaan 619 m2/g dengan struktur menyerupai silika gel. Senyawa ini akan menjerap asam lemak bebas menggunakan ikatan hidrogen yang terjadi antara gugus karbonil (C=O) asam lemak dengan permukaan gugus silanol (Si-O-H) pada senyawa tersebut. Adsorpsi yang terjadi digolongkan ke dalam adsorpsi fisik. Adsorpsi kimia baru dapat terjadi bila proses adsorpsi dilakukan pada suhu tinggi. Suhu tinggi akan mengakibatkan ion karboksilat membentuk ikatan ion dengan oksida logam pada permukaan magnesium silikat sintetik (Yateset al., 1997).
Magnesium silikat sintetik digunakan dalam pencucian kering biodiesel, yaitu pencucian biodiesel tanpa menggunakan air. Kelebihan pencucian kering tersebut adalah biayanya lebih murah, waktu yang diperlukan lebih singkat, lebih ramah lingkungan, dan kualitas biodiesel yang dihasilkan lebih baik (Kram, 2008).
total gliserol, metanol, klorofil, air, serta sedimen pada biodiesel (Bryan, 2005).
2. Aktivasi Adsorben
Aktivitas permukaan dari setiap adsorben berbeda pada sisi yang satu dengan sisi lainnya begitu pula dari batch yang satu ke batch yang lainnya akibatnya hasil yang diperoleh menjadi tidak optimal. Perlakuan pendahuluan terhadap adsorben perlu dilakukan sehingga dapat menghilangkan perbedaan aktivitas tersebut (Adnan, 1997). Aktivasi terhadap atapulgit dapat dilakukan dengan beberapa perlakuan seperti perlakuan panas dan juga perlakuan asam.
Berdasarkan teori ada dua cara perlakuan dalam meningkatkan aktivitas adsorben, yaitu pemanasan dan pengasaman. Aktivasi dengan pemanasan bertujuan agar air yang terikat di celah-celah molekul dapat teruapkan, sehingga porositas adsorben meningkat. Aktivasi secara pengasaman adalah aktivasi dengan menggunakan asam mineral (misalkan HCL atau H2SO4) pada konsentrasi tertentu yang dapat mempertinggi daya
pemurnian karena asam mineral tersebut larut atau bereaksi dengan komponen berupa garam Ca dan Mg yang menutupi pori-pori adsorben. Selain itu asam mineral akan melarutkan Al2O3 sehingga dapat menaikan
perbandingan jumlah SiO2 dan Al2O3dari (2-3) : 1 menjadi (5-6) : 1.
aktivasi asam dapat mempertinggi sifat adsorben dengan meningkatkan sifat kimia dan fisiknya tanpa menghancurkan struktur lapisan mineral liatnya. Peningkatan sifat fisiko kimia tersebut diantaranya adalah luas permukaan spesifik dan ukuran volume pori-porinya (Adnan, 1997).
D. ADSORPSI
kesetimbangan distribusi dari satu atau lebih larutan antara fasa cair dan partikel. Pemisahan dari suatu larutan tunggal antara cairan dan fasa yang diserap membuat pemisahan larutan dari fasa curah cair dapat dilangsungkan. Fasa penyerap disebut sebagai adsorben. Bahan yang banyak digunakan sebagai adsorben adalah karbon aktif,molecular sieves dan silika gel (Treybal, 1980).
Proses adsorpsi adalah proses pemisahan dimana komponen tertentu dari suatu fasa fluida berpindah ke permukaan zat padat yang menyerap (adsorben) Hal ini disebabkan karena partikel zat padat tersebut mempunyai daya tarik terhadap zat-zat terlarut maupun pada zat pelarutnya yang sangat bergantung pada kekuatan tipe interaksi, yaitu interaksi ion-dipol, interaksi dipol-dipol, ikatan hidrogen, dipol dengan dipol tereduksi dan ikatan Van der walls. Sehingga apabila larutan mengalir melalui permukaan yang aktif maka proses adsorpsi dan desorpsi dapat terjadi. Proses adsorpsi dapat digambarkan sebagai proses dimana molekul meninggalkan larutan dan menempel pada permukaan zat adsorben akibat kimia dan fisika (McCabeet al.,1989).
Kecepatan adsorpsi sangat dipengaruhi oleh perbedaan konsentrasi, luas permukaan adsorben, suhu, tekanan (untuk gas), ukuran partikel dan porositas adsorben. Selain itu, ukuran molekul bahan yang akan diadsorpsi serta viskositas campuran yang akan dipisahkan juga berpengaruh terhadap kecepatan adsorpsi. Suatu adsorben dipandang sebagai suatu adsorben yang baik untuk adsorpsi dilihat dari sisi waktu. Lama operasi terbagi menjadi dua, yaitu waktu penyerapan hingga komposisi diinginkan dan waktu regenerasi / pengeringan adsorben. Makin cepat dua varibel tersebut, berarti makin baik unjuk kerja adsorben tersebut Tingkat adsorpsi naik diikuti dengan kenaikan temperatur dan turun diikuti dengan penurunan temperatur (Benefield, 1982).
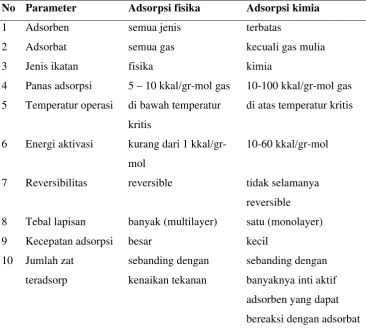
molekul adsorben dengan molekul adsorbat. Proses ini pada umumnya menurunkan kapasitas dari adsorben karena gaya adhesinya yang kuat sehingga proses ini tidak reversibel (Bernasconi et al., 1995). Perbedaan antara adsorpsi fisika dengan kimia dapat dilihat pada Tabel 4.
No Parameter Adsorpsi fisika Adsorpsi kimia
1 Adsorben semua jenis terbatas
2 Adsorbat semua gas kecuali gas mulia
3 Jenis ikatan fisika kimia
4 Panas adsorpsi 5–10 kkal/gr-mol gas 10-100 kkal/gr-mol gas 5 Temperatur operasi di bawah temperatur
kritis
di atas temperatur kritis
6 Energi aktivasi kurang dari 1 kkal/gr-mol
10-60 kkal/gr-mol
7 Reversibilitas reversible tidak selamanya
reversible 8 Tebal lapisan banyak (multilayer) satu (monolayer)
9 Kecepatan adsorpsi besar kecil Sumber : Bernasconiet al., 1995.
pemucat dan penyabun dimana konsentrasi karoten yang diperoleh mencapai 40% dari konsentrasi awal.
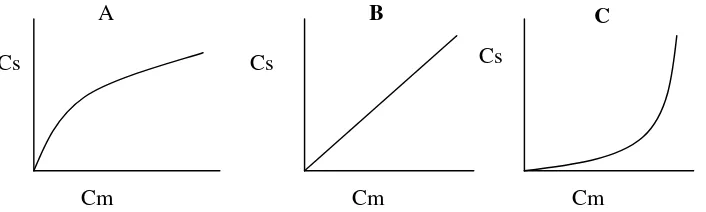
Isoterm adsorpsi adalah hubungan kesetimbangan antara konsentrasi dalam fase fluida dan konsentrasi di dalam partikel adsorben pada suhu tertentu. Untuk zat cair, konsentrasi biasanya dinyatakan dalam satuan massa seperti bagian per juta (ppm). Konsentrasi adsorbat pada zat padat dinyatakan sebagai massa yang teradsorpsi per satuan massa adsorben semula (McCabeet al., 1989). Gambar 4. menunjukkan hubungan antara konsentrasi zat yang ada
dalam larutan (Cm) dan yang teradsorpsi (Cs).
Gambar 4. Kurva hubungan antara kosentrasi solut pada larutan dan yang teradsorpsi (A) kurva konveks, (B) kurva garis lurus, (C) Kurva konkaf. Cs = kosentrasi zat yang teradsorpsi, Cm = konsentrasi zat dalam larutan
Kurva yang menggambarkan hubungan antara Cm dan Cs dinamakan dengan isoterm adsorpsi. Isoterm yang berbentuk konveks seperti yang terlihat dalam Gambar 4A, dapat terjadi karena ada variasi aktivitas dari permukaan yang ada, yang mengakibatkan dihasilkannya hubungan yang tidak linier.. Kurva isoterm yang berbentuk garis lurus (Gambar 4B) merupakan keadaan yang dikehendaki, dimana permukaan tidak akan terjadi menjadi jenuh dengan zat yang diadsorpsi. Slope dari kurva isoterm yang berupa garis lurus ini akan merupakan koefisien distribusi dan tidak tergantung dari besarnya konsentrasi. Kurva isoterm yang berbentuk konkaf (Gambar 4C) dihasikan dari reaksi yang terjadi sedemikian sehingga menyebabkan dapat mempercepat proses adsorpsi secara keseluruhannya. Kurva isoterm yang berbentuk konveks akan menghasilkan puncak yang condong ke depan, kurva isoterm yang lurus
Cm Cm Cm
Cs Cs Cs
memberikan bentuk puncak yang ideal, sedangkan yang konkaf akan memberikan benuk puncak yang condong ke belakang (McCabeet al., 1989).
Puncak yang berbentuk condong (tailing) biasanya terjadi karena adsorben yang terlalu aktif dan juga disebabkan oleh permukaan yang di beberapa bagian tidak mempunyai sisi aktif. Hal ini dapat disebabkan adsorben yang tidak murni dan karena adanya pengaruh geometris pemukaannya, sehingga bagian permukaan lebih reaktif dan disebut reactive site. Hal ini dapat dikurangi dengan menutup sisi aktif dengan zat lain atau
dengan menaikan suhu. Cara lain adalah dengan mengurangi banyaknya sampel yang dipisahkan, diatur tidak melebihi bagian linier dari kurva konveks (Adnan, 1997).
E. LAJU ADSORPSI
Laju reaksi kimia merupakan laju penurunan konsentrasi pereaksi atau peningkatan konsentrasi hasil reaksi per satuan waktu. Laju reaksi akan menentukan ukuran keaktifan dan kestabilan yang diberikan oleh sistem. Jumlah variabel yang diamati mempengaruhi laju reaksi. Faktor-faktor yang mempengaruhi yaitu 1) konsentrasi reaktan, produk dan katalis, 2) faktor lingkungan seperti suhu, tekanan, dan oksigen, 3) panjang gelombang dan intensitas cahaya, dan 4) faktor fisik seperti viskositas (Petrucci, 1992).
Laju reaksi berkaitan erat dengan terjadinya reaksi kimia dari suatu zat dalam membentuk hasil reaksi. Reaksi kimia terjadi sebagai akibat adanya tumbukan antara molekul-molekul dari zat yang bereaksi. Akan tetapi akibat adanya distribusi energi kinetik molekul-molekul yang bertumbukan, maka hanya sebagian tumbukan molekul-molekul yang efektif yang menghasilkan reaksi. Hal ini kemudian menunjukkan adanya suatu energi yang harus dimiliki oleh molekul sehingga mampu bereaksi. Energi tersebut adalah energi aktivasi. Hanya sebagian molekul-molekul atau fraksi molekul yang teraktifkan, yaitu molekul-molekul yang memiliki energi kinetik melebihi energi aktivasi, yang dapat menghasilkan tumbukan yang efektif sehingga mampu bereaksi. Semakin tinggi nilai energi aktivasi, semakin kecil fraksi molekul yang teraktifkan dan semakin lambat reaksi berlangsung. Selain itu, tumbukan molekul yang menghasilkan reaksi juga tergantung dari orientasi molekul tersebut. Oleh karena itu, laju reaksi dipengaruhi oleh fraksi molekul yang teraktifkan dan orientasi dari molekul tersebut (Petrucci, 1992; Saeni, 1989).
Energi aktivasi juga berarti energi yang harus disimpan dalam spesies antara (intermediate species). Spesies antara merupakan kelanjutan gambaran mengenai terjadinya tumbukan, yaitu kompleks teraktifkan yang terbentuk selama tumbukan. Spesies ini ada dalam waktu singkat, dan kemudian terurai, dapat menjadi pereaksi-pereaksi awal (dalam hal ini tidak terjadi reaksi) atau menjadi molekul-molekul hasil reaksi. Pada kompleks teraktifkan ini terdapat ikatan lama yang meregang mendekati putus, dan ikatan baru hanya terbentuk sebagian. Hanya molekul-molekul yang memiliki energi kinetik yang besar yang dapat membentuk kompleks teraktifkan dan kemudian terurai menjadi molekul-molekul hasil reaksi. Molekul-molekul tersebut berarti memiliki energi kinetik yang melewati energi aktivasi (Petrucci, 1992; Saeni, 1989).
10C akan meningkatkan laju reaksi menjadi dua atau tiga kali semula (Petrucci, 1992; Saeni, 1989).
Peningkatkan laju reaksi juga dapat dilakukan dengan mendapatkan jalan reaksi dengan energi aktivasi yang rendah. Katalis dalam suatu reaksi kimia berperan untuk mendapatkan jalan reaksi alternatif tersebut. Katalis akan mengarahkan reaksi menuju jalan reaksi dengan energi aktivasi yang rendah. Katalis ini tidak mengalami perubahan selama reaksi karena katalis tidak menjadi pereaksi, sehingga tidak dikonsumsi dan jumlahnya kecil. Selain itu, katalis tidak merubah kondisi kesetimbangan, yaitu kondisi dimana laju pereaksi menjadi hasil reaksi sama dengan laju kebalikannya. Hal ini terjadi karena katalis memberikan pengaruh yang sama terhadap peningkatan laju pereaksi menjadi hasil dan laju kebalikannya sehingga kondisi kesetimbangannya juga menjadi sama (Petrucci, 1992; Saeni, 1989).
Hubungan antara fraksi molekul yang teraktifkan, orientasi molekul, suhu, dan energi aktivasi dengan laju reaksi (dalam hal ini konstanta laju reaksi), kemudian secara kuantitatif dirumuskan oleh Svante Arrhenius (1889) menjadi sebuah persamaan yang dikenal dengan persamaan Arrhenius. Persamaan Arrhenius tersebut adalah sebagai berikut:
III. METODOLOGI
A. BAHAN DAN ALAT
1. Bahan
Bahan yang digunakan dalam penelitian ini adalah metil ester yang diperoleh dari PUSPITEK Tanggerang, atapulgit yang diperoleh dari Engelhard Coorporation USA, magnesium silikat sintetik yang diperoleh dari Dallas USA, heksan, dan isopropanol. Bahan yang digunakan untuk analisis adalah alkohol netral 95%, kalium hidroksida beralkohol (KOH) 0,1N, HCL dan phenolpthalein.
2. Alat
B. METODE PENELITIAN
Metode penelitian dibagi menjadi dua bagian yaitu tahapan penelitian dan prosedur percobaan. Tahapan penelitian menjelaskan tentang langkah-langkah yang harus dilalui untuk mencapai tujuan penelitian, sedangkan prosedur percobaan merupakan urutan kegiatan dan tata cara secara teknis tentang percobaan yang akan dikerjakan.
1. Tahapan Penelitian
Penelitian ini terdiri dari 5 tahapan, yaitu karakterisasi metil ester dan adsorben, penentuan laju pengadukan optimum, penentuan kondisi kesetimbangan proses adsorpsi, penentuan konstanta laju adsorpsi (k) dan energi aktivasi (Ea), dan penentuan kualitas adsorpsi. Diagram alir tahapan penelitian dapat dilihat pada Gambar 6.
Karakterisasi awal Mulai
Penetuan kondisi kesetimbangan proses adsorpsi
Penentuan konstanta laju adsorpsi (k) dan energi aktivasi (Ea)
Penentuan kualitas adsorpsi
Selesai
Penentuan laju pengadukan Optimum
(a) Karakterisasi Awal
Karakterisasi awal dilakukan untuk mengetahui karakteristik metil ester dan adsorben yang akan digunakan dalam proses adsorpsi β-Karoten. Parameter karakteristik metil ester yang digunakan adalah Bilangan asam, kadar air dan index bias. Sedangkan parameter karakteristik adsorben yang digunakan adalah warna, bentuk dan ukuran partikel.
(b) Penentuan Laju Pengadukan Optimum
Laju pengadukan optimum dilakukan pada kondisi suhu 80 °C , dengan menggunakan konsentrasi adsorben 3 %(b/v) dengan lama waktu reaksi selama 60 menit dan variasi laju pengadukan yang digunakan antara 50 – 450 rpm. Laju pengadukan optimum dicapai ketika pada kecepatan pengadukan tertentu diperoleh persentase penyerapan β-karoten yang paling tinggi.
(c) Penentuan Kondisi Kesetimbangan Adsorpsi
Kondisi kesetimbangan adsorpsi terjadi ketika konsentrasi β -karoten yang terdapat di dalam metil ester tidak lagi mengalami penurunan dengan peningkatan lama waktu adsorpsi. Parameter yang ditentukan pada saat tercapai kondisi kesetimbangan adalah lama waktu adsorpsi t (menit) dan juga nilai konsentrasi β-karoten dalam metil ester c (µg/ml). Penentuan kondisi kesetimbangan dilakukan pada tiga suhu yang berbeda yaitu 65 °C , 80 °C , dan 90 °C .
Konsentrasi penyerapan β-karoten di dalam adsorben (q) dapat ditentukan dengan menggunakan model isoterm adsorpsi yang sesuai pada data percobaan. q dapat dihitung dengan menggunakan persamaan :
q =
(c
o-c
t) X
V mDimana q adalah konsenrasi penyerapan β-karoten di dalam adsorben (µg/g),
c
omerupakan konsentrasi awal β-karoten dalam metil ester (µg/ml),c
tmerupakan konsentrasi β-karoten pada lama adsorpsi tertentu (µg/ml), V adalah volume metil ester (ml) dan m adalah massa adsorben yang digunakan. Selanjutnya dapat diketahui hubungan antara konsentrasi penyerapan β-karoten dalam adsorben (q) dengan konsentrasi β-karoten dalam metil ester(d) Penentuan Laju Adsorpsi
Parameter yang akan ditentukan dalam proses adsorpsi ini adalah konstanta laju adsorpsi (k) dan energi aktivasi (Ea).
1) Penentuan Konstanta Laju Adsorpsi
Konstanta laju adsorpsi (k) dapat ditentukan dengan cara memplotkan nilai adsorbansi dari metil ester pada waktu tertentu (A) dan waktu kontak antara adsorben dan metil ester (t) dengan menggunakan persamaan Brimberg. Model Brimberg dapat dilihat pada persamaan dibawah ini :
ln (C/Co) = -k(t)0.5 ...(3)
Dimana t adalah waktu kontak antara adsorben dengan metil ester, C adalah konsentrasi pigmen β-karoten dalam metil ester pada waktu tertentu, Co adalah konsentrasi awal pigmen β-karoten dalam metil ester dan k adalah konstanta laju adsorpsi. Berdasarkan hukum Beer-Lambert nilai absorbansi memiliki proporsi yang sama dengan konsentrasi pigmen β-karoten dalam metil ester sehingga model Brimberg dapat ditulis dalam bentuk persamaan berikut ini :
Dimana A merupakan absorbansi dari metil ester pada waktu t tertentu dan Ao merupakan absorbansi dari metil ester sebelum proses adsorpsi. Regresi linear antara ln (A) dan (t)0,5 akan menghasilkan sebuah garis lurus dimana slopenya sama dengan nilai konstanta laju adsorpsi (k).
2) Penentuan Energi Aktivasi (Ea)
Energi aktivasi (Ea) dapat ditentukan dengan cara memplotkan nilai konstanta laju adsorpsi (k) dan suhu (T) dengan menggunakan persamaan Arrhenius. Plot antara ln k dengan 1/T menghasilkan bentuk linear dari model Arhenius yang dapat dilihat pada persamaan di bawah ini :
Dimana k merupakan konstanta laju adsorpsi, T merupakan Suhu mutlak (Kelvin), Ea adalah energi aktivasi (kJ/mol), R merupakan konstanta tetapan gas (1,987 cal/K.mol), dan Ao merupakan konstanta proporsionalitas (besarnya bergantung dari frekuensi tumbukan dan orientasi molekul selama tumbukan). Penentuan energi aktivasi dapat dilihat pada Tabel 5.
Tabel 5. Penentuan nilai energi aktivasi
(e) Penentuan Kualitas Adsorpsi
Kualitas adsorpsi terdiri atas selektivitas adsorpsi. Selektivitas adsorpsi dapat diketahui berdasarkan penyerapan komponen β-karoten, penyerapan sisa basa, penurunan bilangan asam dan indek bias. Penentuan nilai absorbansi β-karoten dilakukan dengan menggunakan spektrofotometer
2. Prosedur Percobaan
Metil ester 1500 ml
Mulai
Pencampuran (250 rpm; suhu = 65, 80 ,90 °C , waktu = 150 menit
Pengambilan sample
Penyaringan
Analisis
Selesai
Gambar 7. Diagram alir prosedur percobaan
IV. HASIL DAN PEMBAHASAN
A. KARAKTERISTIK AWAL
1. Karakteristik Metil Ester
Metil ester yang digunakan dalam penelitian ini diperoleh dari PUSPITEK, kabupaten Tanggerang. Karakterisasi dilakukan untuk mengetahui sifat fisiko kimia dari metil ester yang akan digunakan dalam penelitian. Hasil analisis karakterisasi metil ester disajikan pada Tabel 6.
Tabel 6. Karakteristik metil ester
KARAKTERISTIK NILAI SNI (2006)
Bilangan Asam (mgKOH/g) 0.97 maks.0,8
Indeks Bias 1.6237
-Kadar Air (%) 0.13 maks. 0,05
Bilangan asam dipergunakan untuk mengukur jumlah asam lemak bebas yang terdapat dalam metil ester. Hasil karakterisasi pada Tabel 6 menunjukkan nilai awal bilangan asam dari metil ester yang dipergunakan adalah sebesar 0.97 mg KOH/g. Nilai ini lebih besar dibandingkan dengan nilai standar, yaitu sebesar 0.80 mg KOH/g.
molekul cairan. Semakin tinggi asam lemak bebas yang terkandung dalam metil ester maka akan semakin rendah nilai indeks bias yang diperoleh. Adanya sisa basa dalam metil ester juga berpengaruh pada nilai indeks bias yang rendah. Asam lemak bebas dan sisa basa merupakan komponen pengotor yang menurunkan nilai indeks bias metil ester
Kadar air merupakan banyaknya air yang terkandung dalam bahan yang dinyatakan dalam persen. Hasil karakteristik pada Tabel 6 menunjukkan nilai kadar air metil ester sebesar 0.13 %. Nilai ini lebih tinggi dibandingkan dengan nilai standar kadar air yaitu sebesar 0.05 %. Kadar air yang lebih tinggi dari standar dapat meyebabkan terjadinya proses hidrolisa yang akan menyebabkan meningkatnya asam lemak bebas dalam metil ester.
2. Karakteristik Adsorben
Adsorben yang digunakan adalah atapulgit yang diperoleh dari Engelhard Coorporation USA dan magnesium silikat sintetik yang diperoleh dari Dallas USA. Karakterisasi terhadap adsorben yang dilakukan meliputi warna visual, bentuk serta ukuran partikel bahan. Hasil karakterisasi dapat dilihat pada Tabel 7.
Tabel 7. Karakteristik atapulgit dan magnesium silikat sintetik
Berdasarkan Tabel 7 dapat diketahui bahwa atapulgit memiliki warna putih keabuan dengan bentuk berupa serbuk dan memiliki ukuran partikel sebesar 150 mesh. Magnesium silikat sintetik memiliki warna putih
Jenis Adsorben
Karaktesistik
Warna Bentuk Ukuran Partikel
Atapulgit Putih Keabuan Serbuk 150 mesh
Magnesium silikat sintetik
Ukuran partikel dan luas permukaan merupakan karakteristik penting bagi masing-masing adsorben sesuai dengan fungsinya sebagai adsorben. Ukuran partikel masing-masing adsorben mempengaruhi tingkat adsorpsi. Tingkat adsorpsi naik dengan adanya penurunan ukuran partikel. Kapasitas total adsorpsi masing-masing adsorben tergantung pada luas permukaannya. Semakin kecil ukuran butir, maka semakin besar permukaan sehingga dapat menjerap β-karoten makin banyak. Secara umum kecepatan adsorpsi ditujukan oleh kecepatan difusi zat terlarut ke dalam pori-pori partikel adsorben. Ukuran partikel yang baik untuk proses penjerapan antara -100 / +200 mesh (Bernasconiet al., 1995).
B. LAJU PENGADUKAN OPTIMUM
Laju pengadukan merupakan variabel yang mempengaruhi peristiwa fisik dari proses adsorpsiβ-karoten dari metil ester. Pengadukan adalah proses pencampuran bahan secara fisik. Proses ini akan membuat adsorben melayang dalam larutan (McCabe et al., 1999). Hal tersebut dapat meningkatkan kemungkinan terjadinya adsorpsi, terutama untuk adsorben dengan partikel halus. Hasil pengadukan yang baik menurut Bernasconi et al. (1995) bisa dicapai bila bahan mengalir secara turbulen (mengalir ke segala penjuru).
Nilai optimum laju pengadukan ditentukan berdasarkan hubungan antara peningkatan laju pengadukan dengan peningkatan jumlah β-karoten yang teradsorp. Hasil penentuan laju pengadukan optimum dapat dilihat pada Gambar 8.
Tidak dipengaruhi difusi eksteral Dipengaruhi
difusi eksteral
Berdasarkan kurva hubungan yang disajikan pada Gambar 8, dapat diketahui bahwa laju pengadukan optimum dicapai pada kecepatan pengadukan 250 rpm, dimana pada kecepatan pengadukan tersebut diperoleh nilai persentase β-karoten teradsorp paling tinggi sehingga peningkatan laju pengadukan tidak berpengaruh lagi terhadap jumlahβ-karoten yang teradsorp selama proses adsorpsi. Berdasarkan Gambar 8, laju pengadukan yang lebih tinggi dari 250 rpm menyebabkan kemampuan adsorben dalam mengadsorp karotenoid menjadi menurun karena pengadukan yang tertalu cepat dapat menyebabkan proses tumbukan tidak terjadi secara optimal sehingga jumlah β-karoten yang teradsorp semakin menurun. Laju pengadukan merupakan salah satu faktor yang mempengaruhi proses adsorpsi dari luar. Dengan penentuan laju pengadukan optimum, diharapkan faktor dari luar, terutama difusi eksternal, sudah tidak mempengaruhi hasil proses adsorpsi.
C. KONDISI KESETIMBANGAN
Fasa kesetimbangan antara cairan dan fasa yang diserap oleh satu atau lebih komponen dalam proses adsorpsi merupakan faktor yang menentukan di dalam kinerja proses adsorpsi tersebut. Peningkatan kapasitas stoikiometrik adsorben memiliki pengaruh yang lebih besar daripada peningkatan laju perpindahan. Adsorpsi melibatkan proses perpindahan massa dan menghasilkan kesetimbangan distribusi dari satu atau lebih larutan antara fasa cair dan partikel. Kondisi kesetimbangan dapat diartikan keadaan dimana dua proses yang berlawanan terjadi dengan laju yang sama. Sistim yang setimbang dapat terjadi ketika nilai tertentu tidak mengalami perubahan dengan berubahnya waktu (Petrucci, 1992).
150
atapulgit pada suhu 65 derajat C atapulgit pada suhu 80 derajat C atapulgit pada suhu 90 derajat C magnesol pada suhu 65 derajat C magnesol pada suhu 80 derajat C magnesol pada suhu 90 derajat C
Proses adsorpsi β-karoten dari metil ester merupakan suatu proses penyerapan komponen pigmen warna kemerahan yang ada pada metil ester pada permukaan adsorben. Hubungan antara penurunan nilai konsentrasi β -karoten dalam metil ester dengan lama adsorpsi dapat dilihat pada Gambar 9.
Gambar 9. Hubungan Penurunan konsentrasi β-karoten dalam metil ester dengan lama waktu adsorpsi
Berdasarkan Gambar 9 dapat diketahui bahwa nilai konsentrasi β -karoten dalam metil ester semakin menurun dengan semakin meningkatnya waktu adsorpsi. Selama proses adsorpsi, terjadi penurunan konsentrasi β -karoten di dalam metil ester serta terjadi peningkatan jumlah β-karoten yang terserap di dalam adsorben seiring dengan semakin meningkatnya waktu proses adsorpsi.
-karoten. Proses penyerapan β-karoten dalam metil ester dapat dilihat dari perubahan warna metil ester dan juga adsorben baik sebelum dan setelah proses adsorpsi. Gambar perubahan warna pada metil ester serta pada adsorben atapugit dan magnesium silikat sintetik sebelum dan sesudah adsorpsi dapat dilihat pada lampiran 5.
Kondisi kesetimbangan pada masing-masing suhu reaksi dan jenis adsorben berbeda. Nilai konsentrasi β-karoten dalam metil ester yang diperoleh pada saat kondisi kesetimbangan dapat dilihat pada Tabel 8.
Tabel 8. Nilai konsentrasi β-karoten dalam metil ester pada kondisi kesetimbangan untuk masing-masing kondisi suhu dan jenis adsorben
Berdasarkan Tabel 8 dapat diketahui bahwa pada kedua jenis adsorben, semakin tinggi suhu yang digunakan maka waktu yang diperlukan untuk mencapai kondisi kesetimbangan semakin cepat dan konsentrasi β-karoten dalam metil ester semakin menurun. Berdasarkan Tabel 8, proses adsorpsi yang menggunakan atapulgit dengan suhu 65 °C, 80 °C, dan 90 °C, berturut-turut kondisi kesetimbangan tercapai pada menit ke 90, 60 dan 30 dimana jumlah β-karoten yang tersisa dalam metil ester adalah sebesar 251, 243, dan 236 µg/ml. Sedangkan pada proses adsorpsi dengan menggunakan magnesium silikat sintetik pada suhu 65 °C, 80 °C, dan 90 °C, berturut-turut kondisi kesetimbangan tercapai pada menit ke 90, 60 dan 30 dimana jumlah β-karoten yang tersisa dalam metil ester adalah sebesar 191, 184, dan 177 µg/ml. Hal ini
dengan semakin meningkatnya suhu. Hal ini dapat disebabkan karena suhu sangat berpengaruh terhadap proses adsorpsi yang terjadi. Suhu yang semakin tinggi menyebabkan kemampuan penyerapan (porositas) dari adsorben meningkat.
Berdasarkan Tabel 8, konsentrasi awal β-karoten dalam metil ester berbeda pada proses adsorpsi menggunakan atapulgit dengan magnesium silikat sintetik, perbedaan ini disebabkan karena metil ester tidak di simpan dalam satu wadah yang sama. Namun jumlah yang mampu diserap oleh masing-masing adsorben dapat diketahui dengan melihat konsentrasi awal metil ester yang digunakan. Jumlah β-karoten yang mampu terserap oleh atapulgit lebih banyak daripada oleh magnesium silikat sintetik. Hal ini dapat disebabkan karena perbedaan struktur pori maupun komposisi dari kedua jenis adsorben. Struktur pori adalah faktor utama dalam proses adsorpsi. Distribusi ukuran pori menentukan distribusi molekul yang masuk dalam partikel adsorben untuk diadsorp. Molekul yang berukuran besar dapat menutup jalan masuk ke dalam micropore sehingga membuat area permukaan yang tersedia untuk mengadsorp menjadi sia-sia. Karena bentuk molekul yang tidak beraturan dan pergerakan molekul yang konstan, pada umumnya molekul yang lebih dapat menembus kapiler yang ukurannya lebih kecil juga. Struktur pori berhubungan dengan luas permukaan, semakin kecil pori-pori adsorben, mengakibatkan luas permukaan semakin besar. Dengan demikian kecepatan adsorpsi bertambah.
Proses adsorpsi terjadi akibat terbentuknya ikatan antara lapisan silika pada struktur adsorben dengan molekul β-karoten. Atapulgit mengandung 66.1% SiO2, 12.6% MgO, dan 9.8% Al2O2. Sedangkan magnesium silikat
sintetik mengandung 15% MgO dan 67% SiO2. Silika mengandung bahan
Gugus kurang polar ini yang berfungsi di dalam proses adsorpsi secara fisik pada pengikatan β-karoten. Jenis ikatan yang diduga terjadi antara adsorben (baik atapulgit maupun magnesium silikat sintetik) denganβ-karoten adalah ikatan Van der waals, dimana ikatan ini relatif lemah. Ikatan Van der waals yang terjadi antara β-karoten dengan adsorben (baik atapulgit maupun magnesium silikat sintetik) dapat dilihat pada Gambar 10.
Ikatan Van der waals merupakan antaraksi dipol-dipol secara kolektif. Antaraksi dipol-dipol ini menimbukan tarik-menarik antara muatan yang berlainan tanda dan tolak-menolak antara muatan yang sama. Molekul non polar saling ditarik oleh antaraksi dipol-dipol yang lemah yang disebut gaya london. Gaya Van der waals merupakan gaya terlemah walaupun merupakan gaya yang paling universal. Energinya sekitar 0.4 sampai 40 kJ/mol (Companion, 1991).
Proses adsorpsi pada suhu yang rendah, lebih disebabkan oleh ikatan intermolekular daripada pembentukan ikatan kimia baru. Ikatan yang terbentuk antara adsorben dan zat warna relatif lemah dan disebut dengan ikatan Van der waals (Hui, 1996). Pengamatan tersebut mengindikasikan bahwa mekanisme adsorpsinya adalah secara fisik. Swern (1982) menambahkan cukup untuk menyatakan adsorpsi sebagai fenomena permukaan, bergantung dari adanya afinitas spesifik antara adsorben dan zat yang diadsorpsi.
Penggunaan atapulgit pada proses adsorpsi β-karoten dari metil ester lebih baik dibandingkan dengan penggunaan magnesium silikat sintetik.
Si Oδ- Siδ+
Karena jumlah β-karoten yang mampu diserap oleh atapulgit lebih banyak dari pada magnesium silikat sintetik. Hal ini disebabkan karena atapulgit merupakan adsorben yang mampu menyerap zat khususnya zat warna seperti β-karoten, sedangkan magnesium silikat sintetik merupakan adsorben yang secara khusus dikomersialkan untuk proses penghilangan basa (NaOH). Sehingga kemampuan magnesium silikat sintetik untuk menyerap dan mengikat β-karoten lebih rendah dibandingkan dengan atapulgit. Selain itu, atapulgit memiliki oksida Al2O3yang berpotensi mengikat senyawa β-karoten
dengan adsorpsi kimia. Namun secara umum, baik pada penggunaan atapulgit maupun magnesium silikat sintetik, semakin tinggi suhu yang digunakan maka konsentrasi β-karoten yang terserap dalam kedua jenis adsorben tersebut semakin meningkat.
D. LAJU ADSORPSI
Laju adsorpsi merupakan perubahan konsentrasi pereaksi atau produk pada proses adsorpsi. Seiring dengan bertambahnya waktu reaksi, maka jumlah zat pereaksi akan makin sedikit, sedangkan produk makin banyak. Laju adsorpsi dinyatakan sebagai laju berkurangnya pereaksi atau laju bertambahnya produk pada proses adsorpsi. Parameter yang digunakan adalah konstanta laju adsorpsi (k) dan energi aktivasi (Ea). Pada penentuan parameter tersebut digunakan model isoterm adsorpsi Brimberg.
1. Konstanta Laju Adsorpsi
Tabel 9. Konstanta laju adsorpsi β-karoten dari metil ester dengan menggunakan Atapulgit dan Magnesium silikat sintetik
Perlakuan Konstanta Laju Adsorpsi
Berdasarkan Tabel 9 dapat diketahui bahwa nilai konstanta laju adsorpsi mengalami peningkatan seiring dengan meningkatnya suhu. Nilai konstanta laju adsorpsi yang paling besar pada penggunaan atapulgit dan magnesium silikat sintetik terjadi pada kondisi suhu 90 °C dimana nilai konstanta laju adsorpsi pada penggunaan atapulgit lebih tinggi apabila dibandingkan dengan nilai konstanta laju adsorpsi pada penggunaan magnesol yaitu sebesar 0.0515 k min-1untuk atapulgit dan 0.0442 k min-1 untuk magnesol.
Peningkatan fraksi molekul yang memiliki energi kinetik melebihi energi aktivasi dilakukan dengan meningkatkan suhu. Peningkatan suhu dapat meningkatkan frekuensi tumbukan antara molekul yang kemudian membentuk suatu kompleks teraktifkan. Selain iu, peningkatan suhu mampu memperbesar pori-pori pada adsorben sehingga dapat meningkatkan kemampuan adsorpsinya. Peningkatan fraksi molekul yang teraktifkan ini menyebabkan meningkatnya laju reaksi. Oleh karena itu, suhu berpengaruh terhadap laju reaksi, yaitu dapat meningkatkan laju reaksi. Untuk kebanyakan reaksi, dengan meningkatnya suhu sebesar 10
C akan meningkatkan laju reaksi menjadi dua atau tiga kali semula (Petrucci, 1992; Saeni, 1989).
terjadinya tumbukan antar zat pereaksi makin banyak, sehingga reaksi makin cepat. Umumnya kenaikan suhu sebesar 10 0C menyebabkan kenaikan laju reaksi sebesar dua sampai tiga kali. Kenaikan laju reaksi ini dapat dijelaskan dari gerak molekulnya. Molekul-molekul dalam suatu zat kimia selalu bergerak-gerak. Oleh karena itu, kemungkinan terjadi tabrakan antar molekul yang ada.
2. Energi Aktivasi
Energi minimum yang harus dimiliki oleh partikel pereaksi sehingga menghasilkan tumbukan efektif disebut energi pengaktifan (Ea = energi aktivasi). Reaksi yang dapat berlangsung pada suhu rendah berarti memiliki energi pengaktifan yang rendah. Sebaliknya, reaksi yang memiliki energi pengaktifan besar hanya dapat berlangsung pada suhu tinggi. Energi pengaktifan dapat dianggap sebagai energi penghalang (barier) antara pereaksi dan produk.
Hanya sebagian molekul-molekul atau fraksi molekul yang teraktifkan, yaitu molekul-molekul yang memiliki energi kinetik melebihi energi aktivasi, yang dapat menghasilkan tumbukan yang efektif sehingga mampu bereaksi. Semakin tinggi nilai energi aktivasi, semakin kecil fraksi molekul yang teraktifkan dan semakin lambat reaksi berlangsung. Selain itu, tumbukan molekul yang menghasilkan reaksi juga tergantung dari orientasi molekul tersebut. Oleh karena itu, laju reaksi dipengaruhi oleh fraksi molekul yang teraktifkan dan orientasi dari molekul tersebut (Petrucci, 1992; Saeni, 1989).
Berdasarkan Gambar 11 dan 12 diperoleh nilai kemiringan (slope) dan juga nilai koefisien determinasi (r2). Kemiringan (slope) yang dihasilkan dari regresi linear digunakan untuk memperoleh nilai energi aktivasi. Kemiringan dikalikan dengan konstanta tetapan gas (R) akan menghasilkan nilai energi aktivasi. Nilai Energi aktivasi pada proses adsorpsi β-karoten dengan menggunakan kedua jenis adsorben dapat dilihat pada Tabel 10.
Gambar 12. Regresi linear hubungan antara suhu (1/T) dengan ln k dengan menggunakan atapulgit (r2= 0.9928 ; kemiringan = 5373.5)
Tabel 10. Energi aktivasi pada reaksi adsorpsi β-karoten dari metil ester dengan menggunakan atapulgit dan magnesium silikat sintetik
Berdasarkan Tabel 10, Nilai energi aktivasi pada proses adsorpsi menggunakan atapulgit adalah sebesar 31.08 kJ/mol sedangkan pada proses adsorpsi menggunakan magnesium silikat sintetik adalah sebesar 44.84 kJ/mol. Jika suhu dinaikkan, maka kalor yang diberikan akan menambah energi kinetik partikel pereaksi. Sehingga pergerakan partikel-partikel pereaksi makin cepat, makin cepat pergerakan partikel-partikel akan menyebabkan terjadinya tumbukan antar zat ereaksi makin banyak, sehingga reaksi makin cepat. Molekul-molekul dalam suatu zat kimia selalu bergerak-gerak. Oleh karena itu, kemungkinan terjadi tabrakan antar molekul yang ada. Tetapi tabrakan itu belum berdampak apa-apa bila energi yang dimiliki oleh molekul-molekul itu tidak cukup untuk menghasilkan tabrakan yang efektif.
Nilai energi aktivasi menggunakan atapulgit lebih rendah daripada dengan menggunakan magnesium silikat sintetik. Hal ini menunjukkan bahwa proses adsorpsi β-karoten dengan menggunakan atapulgit lebih mudah dan cepat terjadi dibandingkan dengan menggunakan magnesium silikat sintetik. Sehingga molekul dalam atapulgit tidak memerlukan energi yang besar dalam proses adsorpsi β-karoten dari metil ester serta mampu bekerja lebih efektif dibandingkan dengan magnesium silikat sintetik. Nilai energi aktivasi juga dapat menunjukan karakteristik dari ikatan antara adsorben dan adsorbat. Apabila nilai energi aktivasinya rendah menunjukan ikatan yang terjadi pada adsorpsi fisik lemah.
E. KUALITAS ADSORPSI
Kualitas adsorpsi dapat dilihat berdasarkan kemampuan suatu adsorben
Jenis adsorben Ea (kJ/mol)
Atapulgit 31.08
Beberapa parameter yang dapat menunjukkan kualitas dari metil ester diantaranya adalah jumlah β-karoten yang teradsorp, bilangan asam, indeks bias, kadar air serta penurunan kadar basa dalam metil ester. Nilai parameter yang menunjukkan kualitas dari metil ester dapat dilihat pada Tabel 11.
Tabel 11. Nilai parameter kualitas
Berdasarkan Tabel 11 dapat dilihat bahwa jumlah β-karoten yang mampu diadsorp oleh atapulgit adalah sebesar 84.4559 µg/ml sedangkan yang mampu diserap oleh magnesium silikat sintetik adalah sebesar 55.9989 µg/ml. Jumlah β-karoten yang mampu diadsorp oleh atapulgit lebih banyak dibandingkan dengan jumlah β-karoten yang diserap oleh magnesium silikat sintetik. Hal ini menunjukkan bahwa atapulgit memiliki kemampuan penyerapan yang lebih baik dibandingkan dengan magnesium silikat sintetik. Disamping itu, bilangan asam mengalami penurunan selama proses adsorpsi terjadi. Penurunan bilangan asam disebabkan dari peningkatan kemampuan penyerapan adsorben pada suhu yang lebih tinggi sehingga mampu menyerap asam lemak bebas selama proses adsorpsi. Proses penyerapan Asam lemak bebas pada metil ester minyak sawit disebabkan melalui pembentukan ikatan hidrogen antara gugus karbonil asam lemak (C=O) dengan gugus silanol (Si-Parameter Kondisi (90 °C , 150 menit) Karakteristik
Indeks bias mengalami peningkatan selama proses adsorpsi. Semakin panjang rantai karbon dan semakin banyak ikatan rangkap maka indeks bias akan semakin besar. Indeks bias juga dipengaruhi oleh faktor-faktor seperti kadar asam lemak bebas, proses oksidasi dan suhu. Penurunan bilangan asam yang terjadi selama proses adsorpsi berpengaruh terhadap indeks bias. Nilai indeks bias mengalami peningkatan dengan menurunnya kandungan asam lemak bebas dalam metil ester minyak sawit. Tingkat kemurnian metil ester tersebut naik seiring dengan peningkatan nilai indeks bias. Menurunnya jumlah komponen pengotor seperti asam lemak bebas selama proses adsorpsi, menyebabkan metil ester menjadi lebih murni yang diindikasikan dengan semakin meningkatnya nilai indeks bias.
Kadar air metil ester mengalami penurunan selama proses adsorpsi. Kadar air metil ester minyak sawit mengalami penurunan setelah dilakukan proses adsorpsi. Adanya pengurangan kadar air kemungkinan terjadi karena molekul air terikat pada adsorben. Bagian polar dari adsorben, terutama bagian oktahedral atapulgit, dapat mengikat molekul air yang juga bersifat polar. Air dapat menyebabkan proses adsorpsi oleh adsorben menjadi tidak maksimal. Sehingga biasanya dilakukan proses aktivasi salah satunya dengan pemanasan yang bertujuan agar air yang terikat di celah-celah molekul dapat teruapkan, sehingga porositas adsorben meningkat. Berdasarkan Tabel 11 dapat diketahui bahwa kadar air metil ester pada proses adsorpsi dengan menggunakan magnesium silikat sintetik lebih rendah dibandingkan dengan menggunakan atapulgit. Hal ini menunjukkan magnesium silikat sintetik mampu menyerap air lebih banyak daripada atapulgit.
Berdasarkan Gambar 13 dan 14 dapat dilihat penurunan jumlah basa dalam metil ester selama proses adsorpsi berlangsung. Jumlah awal basa (NaOH) dalam metil ester adalah sebanyak 814.27 ppm dan setelah proses adsorpsi menggunakan atapulgit dan magnesium silikat sintetik berlangsung jumlahnya berkurang menjadi 0. Penurunan jumlah basa dalam metil ester menghasilkan nilai yang sama pada kedua jenis adsorben dan pada ketiga suhu
- 2 0 0
Gambar 14. Penurunan kadar basa (NaOH) dalam metil ester selama proses adsorpsi dengan menggunakan magnesium silikat sintetik
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Nilai konstanta laju adsorpsi mengalami peningkatan seiring dengan meningkatnya suhu. Nilai konstanta laju adsorpsi dengan menggunakan atapulgit untuk masing masing suhu 65 , 80 dan 90 °C adalah 0.0236 min-1 0.0332 min-1, 0.0515 min -1, sedangkan nilai konstanta laju adsorpsi dengan menggunakan magnesium silikat sintetik untuk masing-masing suhu 65 °C , 80 °C dan 90 °C adalah 0.0146 min-1, 0.0266 min-1, 0.0442 min-1.
Proses adsorpsi dengan menggunakan atapulgit berlangsung lebih cepat dibandingkan dengan menggunakan magnesium silikat sintetik karena nilai energi aktivasinya lebih rendah. Nilai energi aktivasi pada proses adsorpsi dengan menggunakan atapulgit adalah sebesar 31.08 kJ/mol sedangkan dengan menggunakan magnesium silikat sintetik sebesar 44.85 kJ/mol.
B. SARAN