PROTOZOA DAN CACING PARASITIK PADA IKAN SIDAT
(Anguilla spp.) ASAL DANAU LINDU SULAWESI TENGAH
ARIF RAHMAN JABAL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Protozoa dan Cacing Parasitik pada Ikan Sidat (Anguilla spp.) Asal Danau Lindu Sulawesi Tengah adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut pertanian Bogor.
Bogor, Februari 2015
RINGKASAN
Arif Rahman Jabal. Protozoa dan Cacing Parasitik pada Ikan Sidat (Anguilla spp.) Asal Danau Lindu Sulawesi Tengah. Dibimbing oleh Umi Cahyaningsih dan Risa Tiuria
Danau Lindu terletak di kawasan Taman Nasional Lore Lindu, berjarak sekitar 77 km arah utara dari Palu, Ibukota Sulawesi Tengah. Dataran Lindu berada pada ketinggian 950 m dpl. Jenis ikan yang terdapat di danau Lindu yaitu ikan gabus, belut yang merupakan penghuni asli danau Lindu, sedangkan ikan tawes, ikan mas, ikan gurame dan ikan mujair merupakan ikan hasil introduksi sejak tahun 1950-an.
Populasi ikan sidat umunya terdapat di sungai-sungai Sulawesi Tengah, Danau Poso dan muara sungai Teluk Palu, sedangkan populasi ikan sidat asal Danau Lindu belum banyak informasi dibandingkan ikan sidat asal Danau Poso. Ikan sidat memiliki potensi yang sangat besar untuk dikembangkan karena banyak diminati Jepang, Hongkong, Jerman, dan Italia. Harga jual ikan sidat sangat berpengaruh terhadap kualitas dan kesehatan ikan seperti infeksi endoparasit.
Protozoa dan cacing parasitik dapat menimbulkan kerugian ekonomis dan dapat mengakibatkan kematian. Infeksi parasit menyebabkan penurunan tingkat fekunditas dan mempengaruhi perkembangan benih ikan. Selain itu, beberapa jenis cacing parasitik ikan juga dapat menginfeksi manusia (zoonosis). Salah satu jenis cacing parasitik ikan yang bersifat zoonosis adalah Anisakis simplex.
Pengambilan sampel penelitian ikan sidat di Danau Lindu Kecamatan Lindu Kabupaten Sigi Provinsi Sulawesi Tengah dan pemeriksaan ikan sidat di Laboratorium Helminthologi dan Protozoologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor. Metode yang dilakukan meliputi koleksi sampel ikan sidat, pemeriksaan sampel ikan, pengamatan, pengukuran dan identifikasi parasit.
Prosedur yang harus dilakukan sebelum pemeriksaan parasit adalah mematikan ikan sampel dengan menusukkan jarum tepat pada bagian medulla oblongata. Kemudian dicatat panjang dan bobot setiap sampel ikan. Pemeriksaan lendir kulit, permukaan kulit, insang, sirip, dan usus. Pemeriksaan protozoa menggunakan perwarnaan Giemza, cacing trematoda dan cestoda menggunakan pewarnaan Semichon Acetocarmine (pewarnaan permanen) dan cacing nematoda menggunakan pewarnaan minyak cengkeh dan KOH (pewarnaan semi permanen). Morfologi dan morfometri pada parasit menggunakan mikroskop stereo dan binokuler. Pengukuran panjang dan lebar badan parasit menggunakan mikroskop mikrometer untuk membantu identifikasi jenis cacing dan protozoa.
sp., Glugea sp.dan cacing parasitik yang menginfeksi ikan sidat yaitu Anisakis simplex, Anguillicola sp., and Digenea
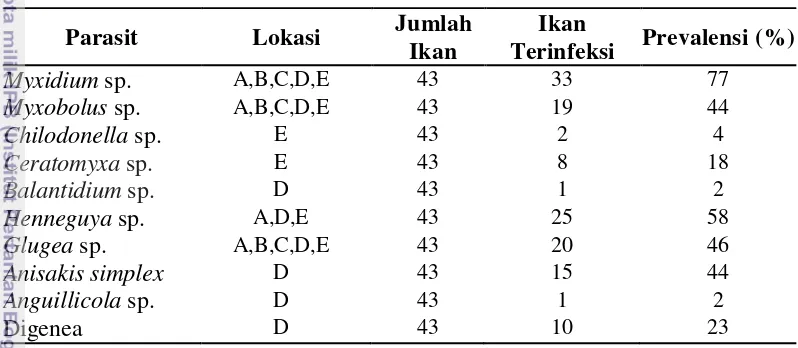
Protozoa parasitik yang menginfeksi ikan sidat yaitu Myxidium sp., Myxobolus sp., Henneguya sp., Ceratomyxa sp., Chilodonella sp., Balantidium sp., Glugea sp. dan cacing parasitik yang menginfeksi ikan sidat yaitu Anisakis simplex, Anguillicola sp., dan Digenea. Prevalensi protozoa parasitik tertinggi yaitu Myxidium sp. sebesar 77%, diikuti Henneguya sp. 58%, dan prevalensi cacing parasitik tertinggi yaitu Anisakissimplex 44%, dan Digenea 23%.
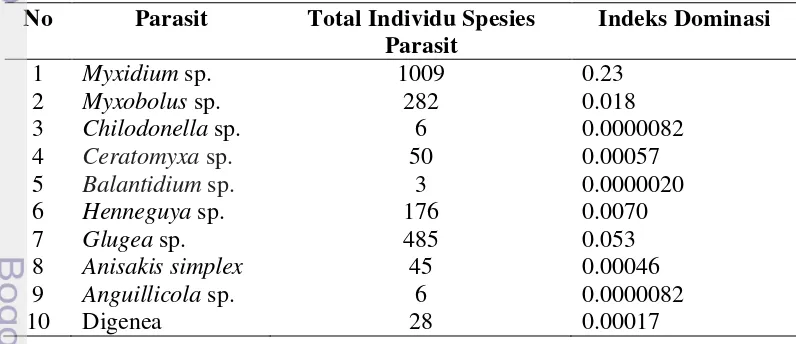
Indeks dominansi mendeskripsikan tentang jumlah keseluruhan protozoa dan cacing parasitik yang terdapat pada ikan sidat asal Danau Lindu. Nilai dominansi tertinggi yaitu Myxidium sp. sebesar 0,23 diantara protozoa yang menginfeksi ikan sidat dan cacing Anisakis simplex memiliki nilai dominansi tertinggi sebesar 0.00046 diantara cacing parasitik lain. Nilai dominansi protozoa dan cacing parasitik pada ikan sidat berkisar antara 0.0000020–0.23, indeks tersebut mendekati 0 (nol). Indeks dominansi Simpson menunjukkan bahwa tingkat dominansi protozoa dan cacing parasitik tidak ada yang mendominasi di antara parasit lainnya pada ikan sidat.
Pemeriksaan protozoa dan cacing parasitik terbagi atas lendir kulit, kulit, sirip, insang dan usus. Uji chi-square (χ2= hit 444.98 > χ2 tab 9.49) menunjukkan perbedaan habitat protozoa dan cacing parasitik pada organ-organ tubuh sidat. Insang dan usus merupakan organ yang disukai protozoa dan cacing parasitik dengan melihat jumlah individu tiap protozoa dan cacing parasitik yang banyak dibandingkan dengan lendir kulit, kulit, dan sirip.
SUMMARY
Arif Rahman Jabal. Protozoan and Helmint parasitic on eels (Anguilla spp.) from Lindu Lake Central Sulawesi. Supervised by UMI CAHYANINGSIH and RISA TIURIA.
The Lindu Lake is located in the area of Lore Lindu National Park, about 77 miles north from Palu, Capital city of Central Sulawesi Province. Lindu plateau at an altitude of 950 m above sea level. Gabus and belut were original fish in Lindu Lake, while tawes, gurame and mujair were introduction species since the 1950s.
Generally the population of eel there are in rivers in central Sulawesi, Poso Lake, and estuary of Palu bay, while the population information of eel from Lindu Lake is scarce. The eel has great potential as food because it’s much interested by Japan, Hongkong, German, and Italy. However it’s price are influence by quality and fish healty. The eel should be not infected by endoparasites.
Protozoan and Helminth parasites can cause economic losses and death of eel. The infection parasites caused to decrease in the level fecundity and affected the development juvenile fishes. In addition, some helminth parasites on fish also infected to human (zoonosis). One species helminth parasites on fishes that potentially zoonosis is Anisakis simplex.
Sampling site conducted in Lindu Lake sub-district Lindu, Sigi Regency, Central Sulawesi Province and the examination was done in Helmintology laboratory and Protozoology laboratory, Veterinary Medicine Faculty, Bogor Agricultural University. Experiment were covered by collected eels sample, examination fishes, observation, measurement and identification of parasites.
Each fish was recorded on length and weight data. The Examination in skin mucus, surface of the skin, gills, fins, and intestines of eels. Protozoan stained by giemsa stain, trematode and cestode stained by Semichon Acetocarmine
stain (permanent staining), nematode used cengkeh oil and KOH (semi permanent staining). The morphology and morphomethric parasites uses stereo microscope and binoculer microscope. The measurement of length and witdh parasites used micrometer microscope to identify the species of helminth and protozoan.
A total of 43 eels were examined with 30-50 cm length, 30.10-273.50 grams weight and total average weight is 98.98 grams. Eels were infected protozoan and helminth parasitic was 34 eels with the percentage 79% of the total eels. Protozan parasitic were infected it is Myxidium sp., Myxobolus sp.,
Henneguya sp., Ceratomyxa sp., Chilodonella sp., Balantidium sp., Glugea sp. and helminth parasitic were infected eels is Anisakissimplex, Anguillicola sp., and Digenea. The highest prevalence of protozoan parasitic was Myxidium sp. 77%, then Henneguya sp. 58%, and highest prevalence helminth parasitic was Anisakis simplex 44% , then Digenea 23%.
helminth parasites on eels ranges among 0.0000020–0.23, The index close to 0 (nol). Index dominance-Simpson showed a level dominance protozoan and helminth were not dominance between other parasites on eels.
The examined protozoan and helminth parasites devided into mucus of skin, surface of the skin, gills, fins, and intestines of eels. The chi-square test was (χ2= hit 444.98 > χ2 tab 9.49), it is showed different habitats protozoan and helminth parasites in body organs eels. Gills and intestines of eels was organs preference protozoan and helminth parasites because a total individual protozoa and helminth parasites much in two organs it, compared total parasites in mucus of skin, surface of the skin, and fins.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
PROTOZOA DAN CACING PARASITIK PADA IKAN SIDAT
(Anguilla spp.) ASAL DANAU LINDU SULAWESI TENGAH
ARIF RAHMAN JABAL
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Parasitologi dan Entomologi Kesehatan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan juli 2014 sampai November 2014 ini ialah protozoa dan cacing parasitik pada ikan sidat, dengan judul Protozoa dan Cacing Parasitik pada Ikan Sidat (Anguilla spp.) Asal Danau Lindu Sulawesi Tengah. Penelitian ini terlaksana atas bantuan dana dan fasilitas dari Direktorat Jenderal Pendidikan Tinggi (DIKTI).
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. drh. Umi Cahyaningsih, MS dan Ibu Dr. drh. Risa Tiuria, MS selaku pembimbing, serta Bapak drh. Fadjar Satrija, M.Sc, PhD yang telah banyak memberi saran. Disamping itu, penulis mengucapkan terima kasih kepada Ketua Program Studi Ibu Prof. Dr. drh. Upik Kesumawati Hadi, seluruh staf pengajar Program Studi Parasitologi dan Entomologi Kesehatan (PEK) yang telah memberikan ilmu pengetahuan selama penulis menuntut ilmu di PEK IPB, dan tidak lupa penulis ucapkan terima kasih kepada seluruh staf dan pegawai Laboratorium Bagian Parasitologi dan Entomologi Kesehatan FKH IPB.
Penulis juga mengucapkan terima kasih kepada segenap Mahasiswa Pascasarjana Parasitologi dan Entomologi Kesehatan yaitu Nur Qomaria, S.Si, Elfira Septiani, S.Si, drh. Arifin Budiman, M.Si, drh. Yanti Almet, M.Si, dan teman-teman PEK yang telah memberikan dukungan, dan kebahagiaan pertemanan. Terima kasih banyak kepada teman-teman Asrama Sulawesi Tengah IPB, Himpunan Mahasiswa Pascasarjana Sulawesi Tengah IPB Bogor, IKA Biologi FMIPA Universitas Tadulako. Tulisan ini Penulis persembahkan khusus kepada Ayahanda Drs. Muh. Ruslim dan Ibunda Nur Intang, S.Pd, dan Arini Ratnasari yang selalu memberikan dukungan dan bantuan selama ini, serta keluarga besar yang selalu memberikan kasih sayang dan doa yang tidak pernah ada akhirnya sehingga Penulis dapat menyelesaikan pendidikan ini. Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi kita semua.
Bogor, April 2015
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA
Perairan Danau Lindu 2
Karakteristik Ikan sidat 3 Parasit pada Ikan Sidat 6
Zoonosis 9
METODE
Lokasi Penelitian 11
Waktu Penelitian 11
Metode Penelitian 11
Analisis Data 13
HASIL DAN PEMBAHASAN
Keragaman Protozoa dan Cacing Parasitik 15 Prevalensi Protozoa dan Cacing Parastik 18
Indeks Dominansi 21
Tingkat Kesukaan 21
SIMPULAN DAN SARAN 22
DAFTAR PUSTAKA 23
DAFTAR TABEL
1 Distribusi Geografi Spesies Ikan Sidat 3 2 Ukuran Panjang dan Lebar Parasit pada Ikan Sidat 15 3 Tingkat Prevalensi Protozoa dan Cacing Parasitik
yang Menginfeksi Ikan Sidat 19 4 Indeks Dominansi Protozoa dan Cacing Parasit pada Ikan Sidat 22
5 Tingkat Kesukaan Protozoa dan Cacing Parasit pada Organ Ikan Sidat 23
DAFTAR GAMBAR
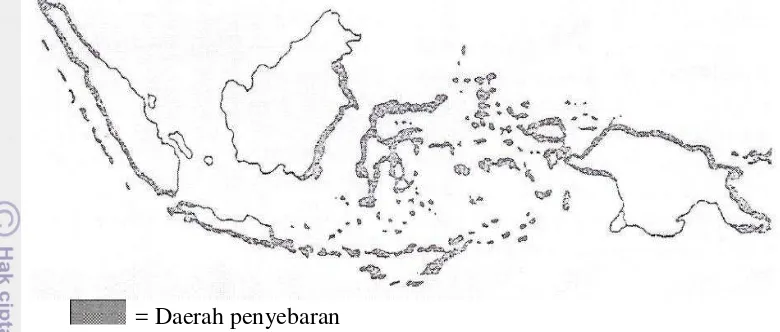
1 Distribusi Ikan Sidat di Indonesia 4
2 Morfologi Ikan Sidat 4
1
I PENDAHULUAN
Latar belakang
Taman Nasional Lore Lindu (TNLL) diresmikan pada tahun 1993, merupakan salah satu lokasi perlindungan hayati di Sulawesi yang termasuk salah satu Cagar Biosfir di Indonesia. Danau Lindu terletak di kawasan Taman Nasional Lore Lindu Sulawesi Tengah, berjarak sekitar 77 km arah utara dari Palu, Ibukota Sulawesi Tengah. Dataran Lindu berada pada ketinggian 950 m dpl. Menurut Tenge (2009) jenis ikan yang terdapat di danau Lindu yaitu ikan gabus, belut yang merupakan penghuni asli danau Lindu, sedangkan ikan tawes, ikan mas, ikan gurame dan ikan mujair merupakan ikan hasil introduksi sejak tahun 1950-an.
Menurut Ndobe (2010), populasi ikan sidat umumya terdapat di sungai-sungai Sulawesi Tengah, danau Poso dan muara sungai-sungai teluk Palu. Populasi ikan sidat asal Danau Lindu belum banyak informasi dibandingkan dengan Danau Poso. Ikan sidat memiliki potensi yang sangat besar untuk dikembangkan karena banyak diminati Jepang, Hongkong, Jerman, dan Italia. Harga jual ikan sidat sangat berpengaruh terhadap kualitas dan kesehatan ikan seperti infeksi endoparasit.
Protozoa dan cacing parasitik dapat menimbulkan kerugian ekonomis dan dapat mengakibatkan kematian. Infeksi parasit menyebabkan penurunan tingkat fekunditas, mempengaruhi perkembangan benih ikan (Grabda 1991). Selain itu, beberapa jenis cacing parasitik ikan juga dapat menginfeksi manusia (zoonosis), salah satunya adalah Anisakis simplex.
Beberapa penelitian terdahulu melaporkan tentang parasit pada ikan sidat seperti, Aguilar et al. (2005) mengatakan bahwa terdapat 20 spesies parasit yang terdiri atas tujuh protozoa, 12 cacing dan satu kopepoda pada ikan sidat (Anguilla anguilla L) asal Spanyol. Menurut Smales et al. (2007) menemukan cacing
Acanthocephalus reunionensis pada ikan sidat yang hanya ditemukan pada ikan sidat di Pulau Reunion Kepulauan Mascarene, bagian barat Samudra Hindia. Menurut Kristmundsson dan Helgason (2007) terdapat empat spesies protozoa ditemukan di air tawar dan laut Islandia. Eimeria anguillae terdeteksi satu di usus sidat air tawar dan satu dari sidat laut. Trichodina jadranica sering ditemukan pada insang sidat asal air tawar dan laut seperti Trichodina fultoni pada kulit dan insang sidat pada ikan sidat asal air tawar dan laut. Chilodonellahexasticha, pada insang dan kulit, hanya ditemukan pada sidat asal air tawar dan empat spesies myxozoa, Myxidium giardi, Myxobolus kotlani dan dua Zschokkella spp. Menurut Tumbol (2011) protozoa parasit pada ikan sidat (Anguilla marmorata) yaitu
Trichodina sp., Myxobulus sp., Vorticella sp., Crustacea parasit yaitu Lerneae sp., dan cacing parasitik yaitu Oxyurida, Capillaria sp., Acanthocephalus sp.,
Gyrodactylus sp. pada ikan sidat budidaya Sulawesi Utara.
2
infeksi protozoa dan cacing parasitik pada ikan sidat. Penelitian ikan sidat (Anguilla spp.) mengenai protozoa dan cacing parasitik pada ikan sidat belum ada informasi yang berasal dari Danau Lindu Sulawesi Tengah.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui prevalensi, indeks dominansi dan tingkat kesukaan protozoa dan cacing parasitik pada organ ikan sidat.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat dijadikan dasar untuk melakukan pencegahan dan pengobatan terhadap penyakit parasit pada ikan sidat asal Danau Lindu Sulawesi Tengah.
2 TINJAUAN PUSTAKA
Perairan Danau Lindu
Sulawesi termasuk dalam kawasan Wallaceae yang meliputi Pulau Sulawesi, sebagian Maluku, kepulauan Banda dan Kepulauan Nusa Tenggara Barat. Sulawesi termasuk salah satu pulau besar di Indonesia yang memiliki karakteristik geomorfologi yang kompleks. Kompleksitas ini berkaitan dengan hasil dari pergerakan tiga lempeng benua yaitu Indo-Australia, lempeng pasifik, dan lempeng Eurasia. Wilayah ini menjadi tempat hidup bagi fauna Oriental dan Australia serta menjadi tempat evolusi berbagai jenis fauna endemik (Coates et al.
2000). Menurut Whitten et al. (1987), Kottelat (1990), dan Soertoto (1995) Sulawesi memiliki 69 jenis ikan air tawar dan 52 jenis diantaranya adalah ikan endemik. Perairan umum Sulawesi Tengah terdapat sekitar 26 buah sungai dengan luas 11.725, 68 ha dan lima buah danau dengan luas 36.895 ha. Menurut Mc Kinnon (1994) tingkat endemisitas yang tinggi ditemukan di perairan Sulawesi tengah (Danau Poso), dan Sulawesi selatan (Danau Matano dan Danau Towuti).
3
(Osphronemus goramy), dan sepat (Trichogaster pectoralis). Penebaran ikan berikutnya diketahui tahun 2001 ditebarkan kembali sekitar 160.000 ekor bibit ikan nila (Oreochromis niloticus).
Karakteristik Ikan Sidat
Distribusi Ikan Sidat
Distribusi ikan sidat sangat luas yakni di daerah tropis dan sub tropis. Ikan sidat di dunia paling sedikit terdapat 17 spesies (Tesch, 1977), dan paling sedikit enam jenis diantaranya yakni: Anguilla marmorata, A. celebensis, A. ancentralis, A. borneensis, A. bicolor bicolor dan A. bicolor pacifica terdapat di Indonesia (Tabel l). Jenis ikan tersebut terdistribusi di daerah-daerah yang berbatasan dengan laut dalam yakni di pantai selatan Pulau Jawa, pantai barat P. Sumatera, pantai timur P. Kalimantan, seluruh pantai P. Sulawesi, Kepulauan Maluku, Bali, Nusa Tenggara Barat dan Nusa Tenggara Timur hingga pantai utara Papua (Gambar 1). Ikan sidat hidup di perairan estuaria (laguna) dan perairan tawar seperti sungai, rawa dan danau serta persawahan dari dataran rendah hingga dataran tinggi (Affandi 2005).
Tabel 1 Distribusi geografi spesies ikan sidat (Tomiyama and Hibya, 1977)
Jenis Distribusi
A. anguilla Inggris,Jerman,Belanda, Perancis, Italia
A. rostrata Amerika (timur), Kana
A. japonica Jepang. Cina
A. reinhardii Australia
A. marmorata Afrika, Indonesia
A. celebencis Filipina, Indonesia
A. megastoma Kaledonia Baru
A. ancentralis Indonesia
A. borneensis Indonesia
A. nebulosa nebulosa Srilangka
A. mossambica Afrika
A. bicolor bicolor Indonesia, Srilangka
A. bicolor pasifica Indonesia
A. obscura Kaledonia Baru
A. dieffenbachia Australia
A. autralis australis Australia
4
= Daerah penyebaran
Gambar 1 Distribusi ikan sidat di Indonesia
Klasifikasi dan Ciri-Ciri
Ikan sidat mempunyai bentuk morfologis yang relatif serupa dengan belut tetapi keduanya memiliki ordo yang berbeda, menurut Deelder (1984), Ikan sidat mempunyai klasifikasi sebagai berikut :
Kelas : Teleostei Subkelas : Actynopterigii Ordo : Anguilliformes Subordo : Anguilloidei Famili : Anguillidae
Genus : Anguiila Shaw, 1803
Gambar 2 Ikan Sidat (McCosker et al. 2003)
Ikan sidat di Indonesia mempunyai nama lokal yang berbeda-beda yaitu moa, ikan menguling, ikan uling, ikan lubang, ikan lumbon, ikan larak, ikan lelus, ikan ganteng, ikan embu, ikan denong, ikna laro, dan ikan luncah (Kottelat et al.
1993). Khusus untuk daerah Sulawesi Tengah, Ikan Sidat dikenal dengan istilah “masapi dan sugili” (Gambar 1).
5
Siklus Hidup
Siklus hidup ikan sidat memiliki tigafase hidup di lingkungan yang sangat besar perbedaanya yaitu estuaria dan sungai dan sebagian besar siklus hidupnya berada di air tawar. Umur ikan sidat di alam bisa mencapai 5 sampai 10 tahun, sedangkan apabila dibudidayakan bisa berkembang lebih cepat dan mencapai umur lebih panjang (Ganie 1996). Suhu di Jepang untuk budidaya ikan sidat berkisar antara 13ºC hingga 30ºC, sedangkan di Eropa suhu untuk budidaya ikan sidat berkisar antara 8ºC hingga 23ºC (Lovell 1989). Ikan sidat memijah di laut dalam pada kedalaman sekitar 400-500 meter di bawah permukaan air laut, suhu air 16ºC - 17ºC dan salinitas air sekitar 35‰ (Usui 1991; Kafuku dan Ikenoue 1983).
Menurut Usui (1991) telur ikan sidat yang telah dibuahi akan naik dan melayang mendekati permukaan air. Telur ini dilapisi selaput kapsul (chorion) yang tipis dan berdiameter sekitar 1.2 mm (Deelder 1984). Setelah 24 jam, telur akan menetas menjadi pre-larva yang tipis dengan panjang kira-kira 5 mm dan bersifat planktonis, berwarna sangat bening, dan bentuknya menyerupai daun disebut lectocephale. Dalam pertumbuhannya larva ini terbawa oleh arus ke berbagai tempat. Selama itu larva mengalami sedikitnya delapan kali perubahan bentuk tubuh sehingga seperti ikan sidat dewasa yang disebut elver, tubuh
leptocephale memendek dan menebal hingga akhirnya berbentuk bulat dan mulai mengandung pigmen pada tubuh.
Adanya rangsangan bau air tawar diduga menyebabkan larva ikan sidat berenang menuju pantai dan masuk ke sungai melalui muara. Elver pada saat memulai perjalanannya masuk ke muara sungai, berwarna bening. Setelah berada disungai warna tubuh ikan ini setahap demi setahap akan berubah menjadi gelap kemudian warnanya akan menjadi semakin gelap setelah 2 sampai 4 minggu.
Ikan sidat semakin dewasa ditandai dengan warna hitam pada bagian punggung dan perak keputihan pada bagian perut. Ikan sidat dewasa yang akan memijah pada saat menuruni sungai untuk menuju ke laut, warna tubuhnya seperti logam mengkilap pada bagian samping, sedangkan bagian perut berwarna sedikit keunguan. Ikan sidat jantan jenis Anguilla japonica dikatakan testis berkembang sempurna setelah berumur 3 sampai 4 tahun, dan pada ikan jenis Anguilla mossambica umur 4.5 sampai 8.5 tahun dan ikan sidat betina jenis Anguilla japonica telah siap memijah setelah berumur 4 sampai 6 tahun, dan jenis Anguilla mossambica pada umur 6.5 sampai 8.5 tahun. Setelah memijah ikan sidat ini akan mati di laut (Kafuku dan Ikenoue 1983).
Pakan Alami Sidat
6
Sidat bersifat omnivora pada fase leptocephalus dan karnivora pada saat dewasa (silver eel). Sebagai karnivora, sidat memakan ikan dan binatang air yang berukuran lebih kecil dari bukaan mulutnya, sidat juga bisa memakan sesamanya (kanibalisme). Saat fase leptocephalus, sidat bersifat omnivora, memakan organisme-organisme invertebrata. Sidat bisa memakan hewan-hewan kecil seperti anak kepiting, anak-anak ikan, cacing kecil, anak kerang atau siput dan tanaman air yang masih lembut.
Parasit pada Ikan Sidat
Parasit adalah organisme yang hidup dalam tubuh inang serta merugikan. Kelompok parasit dibagi menjadi dua yaitu endoparasit dan ektoparasit (Soulsby 1982). Parasit praktis menempati tubuh inang definitif yang menyediakan tempat tinggal dan makanan bagi parasit (Noble & Noble 1989). Infeksi cacing parasitik menimbulkan kerusakan jaringan, anemia, menganggu metabolisme tubuh dan kehilangan bobot badan (Woo 2006). Sebagian besar cacing digolongkan dalam endoparasit seperti cacing Digenea dan Nematoda. Pada ikan, Monogenea digolongkan ke dalam ektoparasit sedangkan Digenea, Nematoda, Cestoda dan Acantocephala digolongkan ke dalam endoparasit.
Protozoa
Ikan-ikan muda lebih rentan terhadap serangan protozoa dibandingkan dengan ikan-ikan dewasa. Parasitisme pada protozoa bersifat ektoparasit, endoparasit, fakultatif dan obligat (Moller 1989, Kabata 1985). Protozoa pada ikan dapat ditemukan di sirip, kulit, insang, rongga mulut, hidung, sistem saraf, sitem skeletal, saluran pencernaan dan urat daging. Spesies protozoa sangat banyak sehingga dibagi menjadi tiga golongan berdasarkan alat gerak yang dimiliki atau berdasarkan pada keberadaan spora, yaitu Ciliophora, Sarcomastigophora dan Sporozoa (Kabata 1985).
Ciliophora dicirikan oleh adanya alat gerak berupa silia yang pendek, modifikasi sekunder silia atau gabungan keduanya. Ciliophora terdiri dari dua kelas yaitu, Kinetofragminophorea dan Oligohymenophorea. Kinetofragminophorea contohnya Chilodonella dan Brooklynella.
Oligohymenohorea contohnya Ichtyophtyrius multifilis, Cryptocaryon,
Trichodina, da Epistylis. Ciliophora bersifat ektoparasit pada ikan.
Sarcomastigophora dicirikan oleh adanya flagella sebagai alat gerak. Flagella berukuran lebih panjang dan kuat dibandingkan silia tetapi jumlahnya lebih sedikit. Sacrcomastigophora terdiri dari tiga kelas yaitu Phytomastigophorea, Zoomastogophorea dan Lobosea. Phytomastigophorea contohnya Amyloodinium dan Crepidoodinium. Zoomastigophorea contohnya
Trypanosoma, Trypanoplasma dan Cryptobia. Lobosea contohnya Entamoeba
7
Kelompok Sporozoa antara lain terdiri dari Apicomplexa, Myxozoa dan Microspora. Golongan Sporozoa tidak memiliki alat gerak. Identifikasi dilakukan berdasarkan ukuran, jumlah dan bentuk spora. Apicomplexa terdiri dari satu kelas yaitu Sporozoa, contohnya Haemogregarina, Eimeria dan Goussia. Microspora dan Myxozoa terdiri dari satu kelas yaitu Microsporea dan Myxosporea. Contoh Myxosporea antara lain Kudoa, Henneguya, dan Ceratomyxa. Microsporea contohnya Glugea, Pleistophora, dan Nosema (Moller 1989).
Nematoda
Nematoda adalah cacing gilig yang dilapisi kutikula (Buchmann & Bresciani 2001). Menurut Arthur & Mayo (1997) melaporkan bahwa ikan famili Carangidae di Filipina ditemukan larva Anisakis, Camalanus marinus, C. carangis, C. paracarangis, Metabronema magnum.
Sebagian dari Nematoda bersifat ovipar kecuali genera Camallanus,
Philometra, dan Skrjabillanus karena larva berkembang dalam empat stadium dan pada stadium tersebut organ seksual menjadi dewasa. Siklus hidup nematoda membutuhkan inang antara sebelum mendapatkan inang definitif. Ikan merupakan inang antara atau inang definitif nematoda. Ikan terinfeksi nematoda karena memakan crustacea seperti Copepoda, Amphipoda, Euphausiacea, dan Decapoda (Grabda 1991).
Monogenea
Monogenea termasuk ke dalam sub kelas Trematoda. Monogenea adalah cacing yang tidak membutuhkan inang antara dalam siklus hidupnya dan kebanyakan ditemukan sebagai parasit di ikan (Urquhart 1996). Kabata (1985) menjelaskan bahwa monogenea adalah salah satu parasit yang sebagian besar menyerang bagian luar tubuh ikan, terutama kulit dan insang, jarang menyerang bagian dalam tubuh ikan.
8
1989). Contoh Monogenea pada ikan sidat yaitu Pseudodactylogyrus anguillae, Pseudodactylogyrus bini.
Digenea
Parasit ini berbentuk pipih dengan batil hisap muskuler seperti mangkuk, biasanya tanpa kait, dengan lubang genital yang bermuara ke permukaan ventral antara batil-batil hisap serta sebuah lubang ekskretori posterior. Digenea memiliki lapisan luar (epikutikula) yang tidak berinti, sinsitial dan dihubungkan oleh tabung-tabung sitoplasmik sempit. Parasit ini biasanya terdiri dari dua batil hisap yakni mulut dan batil hisap yang terletak di ventral terkadang di posterior tubuh. Cacing Monostoma hanya memiliki satu batil hisap, cacing amphistoma memiliki
oral suker dan acetabulum di posterior cacing, dan cacing diastoma memiliki oral suker dan acetabulum (Noble & Noble 1989).
Kebanyakan digenea menjadi dewasa di saluran pencernaan hewan vertebrata dengan mengambil bahan makanan dan mukus dari saluran pencernaan inangnya. Pada kondisi kurang menguntungkan digenea mampu berada di dinding mukosa (submukosa) sehingga sering mengakibatkan kerusakan pada saluran pencernaan, saluran empedu dan berada di darah inang yang dapat menyebabkan anemia (Grabda 1991).
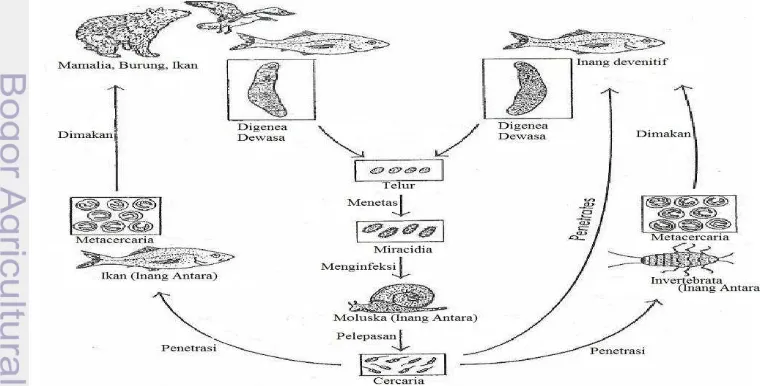
Digenea pada ikan biasanya bersifat hermaprodit untuk menyesuaikan kondisi siklus hidupnya yang banyak berpindah tempat atau inang antara sehingga sedikit yang mampu mencapai inang definitif. Siklus hidup digenea dimulai dari telur yang hidup bebas di perairan menetas melalui terbukanya operkulum menjadi mirasidium. Kemudian menembus permukaan kulit inang antara pertama siput atau moluska yang akan berkembang menjadi serkaria. Serkaria tersebut menuju perairan untuk mendapatkan inang antara kedua ikan atau krustasea dan berkembang menjadi metaserkaria dalam tubuhnya (Gambar 2). Bila ikan atau krustasea ini dikonsumsi oleh satwa lain seperti burung atau anjing, atau bahkan oleh manusia dalam kondisi mentah atau kurang matang, dapat mengakibatkan kecacingan. Digenea pada ikan sidat yaitu Deropristis inflate, Lecithochirium musculus,Podoctyloides brevis, Stegodexamene anguillae, Nicolla gallica.
9
Zoonosis
Zoonosis ialah penyakit yang dapat menular dari hewan ke manusia. Kejadiannya mencakup hal yang kompleks karena tidak saja terbatas pada hubungan antara manusia dengan ternak peliharaan tetapi juga dengan hewan liar. Anisakiasis adalah penyakit parasit cacing zoonosis pada ikan yang dapat menular ke manusia. Penyakit cacingan ini dari jenis cacing nematoda. Cacing tersebut merupakan parasit yang paling banyak menginfeksi ikan, baik ikan air laut maupun air tawar.
Beberapa spesies cacing pipih bersifat zoonosis seperti Chlonorchis sinensis dan Paragonimus westermanii yang memerlukan inang antara yaitu siput dan inang definitif dalam siklus hidupnya. Stadium infektif masuk ke dalam tubuh manusia bila ikan dimakan dalam keadaan mentah atau kurang matang.
Ikan sebagai sumber utama penyebaran parasit Trematoda, Acanthocephala, dan Nematoda pada manusia. Beberapa kasus alergi timbul akibat larva cacing parasitik yang ada pada ikan yang dikonsumsi secara mentah atau kurang matang. Dampak dari keberadaan cacing pada manusia adalah reaksi alergen dari cacing parasit. Alergen nematoda (Ascaridoid) merupakan protein yang sangat stabil dan dapat mempertahankan struktur, aktifitas biokimiawi, dan sifat-sifat alergenisitasnya bila didinginkan setelah mengalami denaturasi (Kennedy 2000). Alergen tersebut tetap ada dalam tubuh kita walaupun larva cacing tersebut mati. Reaksi yang timbul akibat terserang parasit yaitu reaksi alergis yang meliputi urtikaria, anafilaksis, dermatitis, gastroenteritis eosinofilik, sampai gejala asma (Bircher et al. 2000).
Infeksi cacing dan protozoa dapat dideteksi melalui antibodi IgE yang spesifik terhadap serangan parasit (Yman 2000). Imunoglobulin E ini merupakan reaksi tanggap kebal inang terhadap alergen dari parasit. Menurut Geetanjali et al.
(2002) mengatakan bahwa cacing parasit nematoda memiliki potensi sebagai indikator lingkungan perairan dan status kesehatan satwa liar. Parasit zoonotik seperti Anisakis simplex memiliki potensi dijadikan indikator perairan, atau kondisi kesehatan satwa liar yang ada di perairan tersebut.
Anisakiasis pada Manusia
Konsumsi seafood dan produk makanan hasil laut terutama ikan, makin meningkat. Jenis makanan itu mendapat tempat di hati pencinta kuliner karena alasan tingginya kandungan protein, rasanya yang sedap serta biasanya disajikan dalam keadaan segar. Jepang, Spanyol dan negara-negara Skandinavia dikenal sebagai konsumen nomor satu jenis makanan-makanan produk laut (Audicana dan Kennedy2008).
Anisakiasis pada manusia umumnya bersifat akut dan gejala anisakiasis seperti alergi karena konsumsi seafood, dan sering didiagnosis sebagai alergi dan menyebabkan salah penanganan (Audicana dan Kennedy 2008, Armentia et al.
2006, Gracia-Bara et al. 2001).
10
mamalia laut, kemudian menjadi larva stadium satu (L1) dan berkembang menjadi larva stadium dua (L2). Larva stadium dua infektif menetas yang kemudian dimakan oleh inang antara satu, biasanya berupa invertebrata laut seperti udang-udangan (Crustacea), Copepoda, Amphipoda, ubur-ubur, dan ikan kecil. Larva menembus dinding usus kemudian masuk ke dalam rongga tubuh atau dalam jaringan-jaringan disekitamya. Inang antara satu dimakan oleh inang antara dua (ikan), larva menembus dinding usus dan jaringan disekitarnya. Pada tubuh inang, larva stadium dua berkembang menjadi larva stadium tiga (L3). Menurut Sakanari and McKerrow (1990) jika ikan yang mengandung L3 ini dimakan oleh mamalia laut yang merupakan inang definitif Anisakis sp., maka siklus hidupnya akan sempurna (Gambar 3). Manusia bukan inang denitif larva Anisakis simplex tetapi menjadi inang insidental, jika mengkonsumsi ikan laut mentah, kurang matang, diasap, dibekukan, diasinkan atau diasamkan yang mengandung larva anisakid dalam dagingnya (Sindermannn 1990). Larva tersebut termakan oleh manusia, kemudian masuk melalui saluran pencernaan manusia dan menembus dinding lambung atau usus sehingga mengakibatkan granuloma eosinofilik yang parah
Gambar 4 Siklus hidup A. simplex (Audicana dan Kennedy 2008)
11
Welfare2004). Kasus Anisakiasis yang paling banyak dilaporkan di Eropa dan di Jepang.
Richardson et al. (1982) menemukan larva anisakis dengan panjang 2 cm dalam keadaan hidup pada muntahan seorang pasien setelah makan steak salmon merah. Tahun 1990, dilaporkan adanya 56 larva Anisakissimplex di dalam perut seorang pasien yang berusia 58 tahun di Jepang setelah 8 jam makan "Sashimi" (irisan ikan mentah) yang berasal dari ikan bonito Katsuwonus pelamis L. (Kagei dan Isogaki 1992).
Pada satu kasus infeksi berat larva empat A. simplex dilaporkan terjadi radang usus buntu akut sehingga membutuhkan tindakan pembedahan dan pengangkatan intestinal yang mengalami pembengkakan. Pada jaringan ditemukan beberapa larva L4 A. simplex yang masih hidup. Seorang wanita berusia 28 tahun di Florida terpaksa harus dilakukan pembedahan perut karena terjadi obstruksi total usus akibat terbentuk nodul granular pada mesenterium usus halus yang berisi larva Anisakis. Gejala klinis berupa nyeri abdomen akut, mual dan muntah persisten yang terasa sekitar dua minggu setelah memakan sushi (Roland et al. 2008).
3 METODE
Lokasi Penelitian
Pengambilan sampel ikan sidat di Danau Lindu Kecamatan Lindu Kabupaten Sigi Provinsi Sulawesi Tengah dan pemeriksaan ikan sidat di Laboratorium Helminthologi dan Protozoologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Waktu Penelitian
Koleksi sampel di Danau Lindu dilaksanakan pada bulan Juli sampai Agustus 2014 dan pemeriksaan ikan sidat di Laboratorium Helminthologi dan Protozoologi mulai dari bulan September sampai November 2014.
Metode Penelitian
12
meliputi koleksi sampel ikan sidat, pemeriksaan sampel ikan, pengamatan, pengukuran dan identifikasi parasit.
Koleksi Ikan Sidat
Ikan sidat dipancing di sekitar danau Lindu sebanyak 43 ekor. Ikan dimasukkan dalam plastik yang berisi oksigen dan selanjutnya dibawa ke laboratorium, diaklimatisasi 1-2 hari ke dalam akuarium, dan diukur panjang dan bobotnya.
Pemeriksaan Sampel Ikan
Prosedur pemeriksaan ikan dilakukan di laboratorium, kemudian dicatat panjang dan bobot setiap sampel ikan. Pemeriksaan pada bagian lendir kulit, permukaan kulit, insang, sirip, dan usus ikan sidat. Sampel ikan sidat (Anguilla
spp.) dipreparasi dengan mematikan ikan dengan menusukkan jarum tepat pada bagian medulla oblongata. Bagian abdomen ikan disayat memanjang mulai dari kloaka sampai operculum ikan. Insang dipisahkan selanjutnya dimasukkan ke dalam cawan petri yang telah berisi larutan NaCl fisiologis. Usus telah disayat dimasukkan ke dalam NaCl fisiologis kemudian dilihat di bawah mikroskop stereo. Spesimen yang belum teramati disimpan kembali pada lemari pendingin bersuhu 4ºC. Cacing parasitik yang dikoleksi dari insang dan usus ikan kemudian diisolasi dan disimpan pada botol yang telah diberi larutan NaCl fisiologis selama 8 jam di lemari pendingin bersuhu 4ºC, selanjutnya dipindahkan ke dalam etanol 70% untuk dilakukan proses pewarnaan (Soulsby 1973).
Pengamatan protozoa dilakukan dengan membuat preparat ulas tipis lendir kulit, permukaan kulit, sirip, insang dan usus dengan pewarnaan Giemsa 10%. Pembuatan preparat ulas tipis yang telah diperoleh diletakkan di atas gelas objek untuk dibuat preparat ulas tipis. Kemudian dikeringkan selama 1-2 menit, dengan diangin-anginkan lalu difiksasi menggunakan metanol selama 5-15 menit dan dikeringkan beberapa saat. Preparat yang telah kering diletakkan di rak pewarnaan, didiamkan sebentar lalu preparat ditetesi dengan Giemsa 10% dan didiamkan selama 30 menit sampai 1 jam. Selanjutnya preparat diangkat dari rak pewarnaan dan dibilas dengan aquades atau air yang mengalir lalu didiamkan.
Teknik pewarnaan semi permanen menggunakan KOH dan minyak cengkeh yang diaplikasikan untuk pewarnaan nematoda. Tahapan pewarnaannya yaitu penipisan dan penghilangan lapisan kutikula cacing yang dilakukan dengan cara merendam spesimen dalam KOH 10% selama 1-3 menit sampai lapisan kutikula terlihat tembus pandang. Setelah itu spesimen dipindahkan ke dalam minyak cengkeh selama kurang lebih 30 detik sampai 1 menit sampai organ-organ tubuh terlihat jelas. Kemudian cacing didehidrasi dengan dimasukkan ke dalam alkohol bertingkat (70%, 85%, 95%) masing- masing selama 15 sampai 30 detik. Spesimen yang telah didehidrasi di-mounting dengan entelan sebagai media fiksasi.
13
etanol 70% kemudian direndam dalam larutan Acetocarmine selama 15-20 menit sampai warna terserap, warna spesimen akan berubah menjadi merah cerah. Setelah perendaman spesimen dibilas dengan ethanol 70% dan direndam dalam larutan asam alkohol (ethanol 70% dan HCl). Kemudian dilakukan dehidrasi pada spesimen dengan menggunakan alkohol bertingkat (70%, 85%, 95%, 100%) dengan cara merendamnya selama 5 menit pada setiap konsentrasi alkohol. Setelah itu spesimen direndam di dalam xylol sampai spesimen terlihat tembus pandang. Langkah terakhir adalah spesimen di-mounting dengan entelan sebagai media fiksasi (Soulbsy 1982).
Pengamatan dan Pengukuran
Morfologi dan morfometri pada parasit menggunakan mikroskop stereo dan binokuler. Pengukuran panjang dan lebar badan parasit menggunakan mikroskop mikrometer untuk membantu identifikasi jenis cacing dan protozoa.
Identifikasi Parasit
Identifikasi parasit menggunakan mikroskop dan buku-buku identifikasi seperti Woo (1995) dan Grabda (1991).
Analisis Data
Analisis data dilakukan secara diskriptif untuk melihat variabel yang telah ditetapkan sebagai berikut.
Tingkat Prevalensi
Menurut Bush et al. (1997), prevalensi adalah persentase jumlah ikan terinfeksi parasit dibandingkan dengan jumlah ikan yang diperiksa, dan dirumuskan sebagai berikut:
Ketrangan:
n : Jumlah ikan yang terinfeksi parasit N : Jumlah ikan yang diperiksa
Prevalensi (%) = n x 100% N
14
Indeks Dominansi
Menurut Odum (1983), indeks dominansi digunakan untuk spesies parasit terhadap habitat tubuh sidat yaitu :
Keterangan:
D : Indeks dominansi
Ni : Jumlah individu tiap spesies parasit N : Jumlah total seluruh individu parasit
Kriteria penilaian indeks dominansi yaitu semakin tinggi persentase dominansi individu, maka individu tersebut lebih mendominasi dari pada individu lainnya. Jika dominansi mendekati 1, maka keanekaragamannya rendah dan kelimpahannya tinggi atau mendominasi dari jenis lain. Jika nilai dominasi mendekati 0, maka keanekaragaman tinggi dan kelimpahannya rendah atau tidak ada yang mendominasi.
Tingkat Kesukaan
Menurut Gazperz (1999) menggunakan uji Chi-kuadrat yaitu:
Keterangan:
O : Frekuensi pengamatan E : Frekuensi harapan
Tingkat kesukaan diukur atau ditentukan berdasarkan tingkat keberadaan jenis parasit pada organ tertentu, untuk mengetahui kesukaan tiap spesies parasit pada bagian-bagian organ ikan.
4 HASIL DAN PEMBAHASAN
Sebanyak 43 ekor ikan sidat yang diperiksa dengan ukuran panjang 30-50 cm dan berat 30.10-273.50 gram dengan rata-rata 98.98 gram. Ikan yang terinfeksi protozoa dan cacing parasitik sebanyak 34 ekor dengan persentase 79% dari total ikan.
D = ∑
15
Keragaman Protozoa dan Cacing Parasitik
Protozoa parasitik yang ditemukan pada ikan sidat yaitu Myxidium sp. menggolongkan ke dalam Filum Myxozoa Family Myxidiidae (Eiras et al. 2011). Caffara et al. (2009) mengklasifikasikan Myxobolus sp. ke dalam filum Myxozoa
Famili Myxobolidae. Menurut Qodri (1952) menggolongkan Henneguya sp. ke dalam Filum Myxozoa Famili Myxobolidae. Ceratomyxa sp. tergolong ke dalam Filum Myxozoa Famili Ceratomyxidae (Gunter et al. 2009). Chilodonella sp. digolongkan dalam Filum Ciliophora Famili Chilodonellidae (Padua et al. 2013), Balantidium sp. tergolong ke dalam Filum Ciliophora, Famili Trichostomatidae (Ming et al. 2013), dan menurut Azeem et al. (2015) mengklasifikasikan Glugea
sp.ke dalam Filum Microspora Famili Gluguidea (Gambar 5).
Gambar 5 Pewarnaan giemsa (a) Myxidium sp.,(b) Ceratomyxa sp., (c)
Myxobolus sp., (d) Henneguya sp.,(e) Balantidium sp.,(f) Glugea
sp.,(g) Chilodonella sp. pada pembesaran 100x.
a
b
c
d
e
f
16
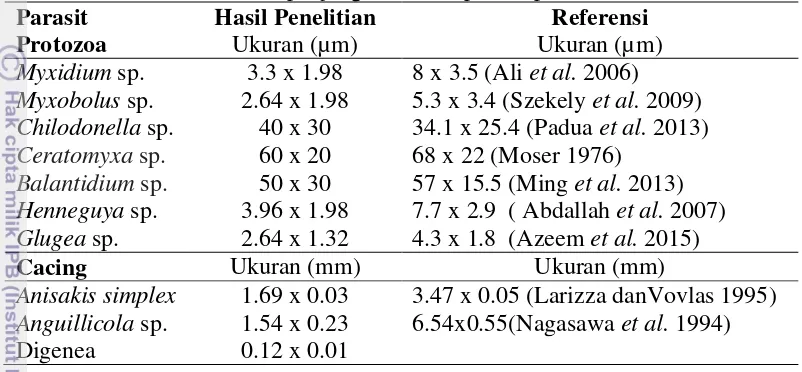
Protozoa Myxidium sp. merupakan protozoa yang terbanyak ditemukan di ikan sidat dengan ukuran panjang dan lebar 3.3x1.98 µm, Glugea sp. 2.64x1.32 µm dan Myxobolus sp. 2.64x1.98 µm. Cacing Anisakis simplex yang terbanyak diantara cacing lain dan memiliki ukuran 1.69 x 0.03 mm (Tabel 2).
Tabel 2 Ukuran panjang dan lebar parasit pada ikan sidat
Parasit Hasil Penelitian Referensi
Anisakissimplex 1.69 x 0.03 3.47 x 0.05 (Larizza danVovlas 1995)
Anguillicola sp. 1.54 x 0.23 6.54x0.55(Nagasawa et al. 1994) Digenea 0.12 x 0.01
Siklus hidup Myxidium sp. seperti Myxobolus sp., Henneguya sp., Ceratomyxa sp., dan Kudoa sp. Parasit keluar dari ikan melalui saluran urinari. Spora protozoa tersebut bertahan hidup di air dan dapat mengendap selama bertahun-tahun. Ketika spora yang tertelan oleh cacing rambut (Tubifex tubifex), berkembang menjadi spora Triactinomyxon.
Protozoa Chilodonella sp. berbentuk oval, berukuran 40-60 µm dengan lekukan di bagian posterior tubuh. Siklus hidup secara langsung, parasit ini ditemukan di insang dan kulit pada beberapa jenis ikan. Protozoa berkembang biak dengan cara pembelahan biner pada kulit. Parasit ini tergolong ektoparasit dan tidak dapat melakukan penetrasi di kulit. Biasanya infeksi tanpa gejala tetapi beberapa ikan menjadi lemah ketika berada pada suhu 5-10°C.
Prevalensi Glugea sp. pada ikan sidat asal Danau Lindu sebesar 46% Dampak yang ditimbulkan parasit ini seperti terbentuknya nodul berwarna coklat kehitaman pada jaringan adiposa dan organ viseral terutama pada dinding usus dan caecae pyloric. Menurut Marzouk et al. (2010) prevalensi Glugea sp. pada ikan kerapu mencapai 88.8%.
17
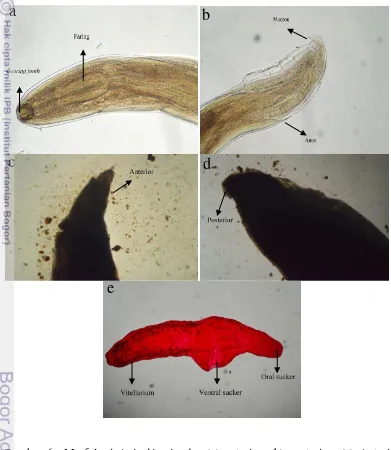
Cacing parasitik yang tergolong nematoda yaitu Anisakis simplex Famili Anisakidae (Gambar 5), Anguillicola sp. dengan Family Anguillicoloidae (Gambar 6). Menurut Larizza dan Vovlas (1995) mengatakan morfologi larva
Anisakis simplex stadium tiga dengan ciri-ciri pada bagian anterior memiliki
Booring tooth, excretory pore dan pada bagian posterior terdapat anus, mucron dan rectal glands. Taraschewski et al. (1987) mendeskripsikan cacing
Anguillicola sp. memiliki tingkat ketebalan dan transparan, sehingga memungkinkan terlihat organ bagian dalam.
Gambar 6 Morfologi Anisakis simplex (a) anterior, (b) posterior, (c) Anterior
Anguillicola sp., (d) Posterior Anguillicola sp. pewarnaan minyak cengkeh dan KOH, (e) Digenea, pewarnaan semichon acetocarmine,
pembesaran 40x.
a
b
c
d
18
Prevalensi Protozoa dan Cacing Parastik
Prevalensi protozoa parasit tertinggi yaitu Myxidium sp. sebesar 77%, menurut Williams & Bunkley-Williams (1996) prevalensi tersebut masuk dalam kategori usually (70%-89%). Prevalensi Henneguya sp. sebesar 58% menginfeksi lendir, insang dan usus, menurut Williams & Bunkley-Williams (1996) prevalensi tersebut tergolong ke dalam frequently (50-69%). Cacing parasit Anisakis simplex
sebesar 44%, Williams & Bunkley-Williams (1996) menggolongkan prevalensi tersebut ke dalam commonly sebesar 30-49%. (Tabel 3).
Tabel 3 Tingkat prevalensi protozoa dan cacing parasitik yang menginfeksi ikan sidat
A: Lendir kulit, B: Kulit, C: Sirip, D: Usus, E: Insang.
Faktor yang mempengaruhi terjadinya infeksi antara lain pola makan ikan, daya tahan ikan dan kondisi lingkungan ikan. Kondisi kualitas air Danau Lindu dengan pH 6.28. Menurut Afrianto dan Liviawaty (1992) menyatakan bahwa sebagian besar organisme dapat beradaptasi dengan baik pada lingkungan perairan dengan pH antara 5-9. Pengukuran nilai DO (dissolved oxygen) adalah 2.57 mg/l ini menunjukkan tidak dapat ditoleransi organisme akuatik. Menurut Lee et al.
(1978), menyatakan bahwa kandungan DO kualitas perairan tersebut tercemar sedang (2.0-4.4 mg/l). Pengukuran suhu air danau Lindu termasuk rendah yaitu 29ºC. Menurut Suitha dan Suhaeri (2008) ikan sidat dapat beradaptasi pada suhu 12-31ºC.
19
Prevalensi Protozoa Parasitik
Myxidium sp. adalah parasit Myxozoa yang tersebar luas pada ikan budidaya dan habitat alami yang menyebabkan kerugian ekonomi yang besar. Prevalensi protozoa parasit Myxidium sp. sebesar 77%. Sidat yang terinfeksi Myxidium sp. secara klinis menunjukkan bintik-bintik putih kecil yang tersebar di kulit (1-4 mm), ikan mengalami lesi pada bagian tubuh yang terinfestasi, terjadi perubahan warna menjadi gelap, daya renang ikan menjadi lambat, dan bergesekan dengan benda keras. Infestasi berat pada insang mengakibatkan gangguan pernapasan dan penurunan pertumbuhan. Secara mikroskopis kista hitam pada insang mengandung spora (El-ashram 2007). Menurut Silva et al. (1993) prevalensi
Myxidium sp. sebesar 54% pada insang dan kulit ikan sidat (A. Anguila).
Prevalensi Myxobolus sp adalah 46%, parasit ini menyebabkan terbentuknya bintil berwarna putih (1-3 mm) yang terletak di jaringan subcutaneous sirip sidat. Pecahnya kista mengakibatkan pendarahan dan ulkus. Melanomakropag banyak ditemukan pada bagian ikan yang terinfeksi (El-ashram 2007). Melanomakrofag adalah sel pada ikan yang berbentuk bulat padat yang memiliki jumlah pigmen bervariasi. Biasanya terdapat pada ikan yang sehat, akan tetapi jumlahnya meningkat pada ikan yang stres berat, oleh sebab itu melanomakrofag sebagai indikator stres pada ikan (Noga 2010). Menurut Aguilar et al. (2005) menyebutkan prevalensi Myxobolus berkisar 26.5-34,5% pada ikan sidat. Menurut El-ashram (2007) melaporkan prevalensi parasit pada ikan sidat yang berasal dari alam sebesar 7.5%.
Chilodonella sp. ditemukan pada permukaan kulit, insang, dan sirip (Padua
et al. 2013). Prevalensi Chilodonella sp. sebesar 4%, Parasit ini tidak memiliki inang yang spesifik, siklus hidup secara monoxenic, dan menyebabkan lesi yang parah pada inang. C.hexasticha parasit pada Ikan lele (Ictalurus punctatus) dan ikan mas (Carassius auratus) yang dapat menyebabkan pembelahan sel epitel secara berlebihan, fusi lamella pada insang, peradangan, pendarahan, edema, dan nekrosis (Hoffman et al. 1974). Menurut Mood et al. (2011) melaporkan infeksi parasit tersebut sebesar 1%.
Prevalensi Ceratomyxa sp. pada penelitian ini sebesar 18%, secara klinis infeksi mengindikasikan ikan menjadi lemah, penurunan berat, ikan menjadi kehitaman, asites, exopthalmia, pustula pada ginjal dan pada bagian internal parasit tersebut dapat menghambat kerja saluran pencernaan, hati, kandung empedu, limpa, gonad, ginjal, jantung, insang, dan otot. Parasit ini dapat mengakibatkan kematian yang disebabkan oleh lubang pada usus dan membuka peluang terjadinya infeksi bakteri. Potensi infeksi meningkat ketika suhu air yang tinggi, debit air yang rendah, dan infeksi C. shasta relatif tinggi. Menurut True
et al. (2012) prevalensinya sebesar 54% pada ikan sidat.
Tingkat prevalensi protozoa parasit Henneguya sp. adalah 58%, Sel darah merah tidak terdapat di sekitar bintik-bintik kista Henneguya pada insang. Kadang bintik-bintik itu berwarna putih atau sekalipun tak berwarna ditandai dengan tidak adanya filamen insang. Menurut Work et al. (2008) pada ikan Big Eyed Scad
(Selar crumenophthalmus) sebesar 22%. Menurut Abraham et al. (2011) sebesar 54% pada ikan Chrysichthys nigrodigitatus.
20
yang menyebakan penyakit, dan satu parasit ditemukan pada kerokan mukosa yang diperoleh dari bagian posterior midgut. Balantidium sp. adalah organisme komensal yang melokalisasi di lumen usus dan memperoleh makanan di usus dengan bantuan bakteri usus, karena protozoa tersebut tidak mampu menembus mukosa usus. Namun, faktor yang menekan perlawanan inang memungkinkan parasit tersebut mampu menginvasi mukosa dan menyebabkan luka yang terbuka dan sukar sembuh (ulserasi).
Prevalensi Glugea sp. pada ikan sidat asal Danau Lindu sebesar 46%. Dampak yang ditimbulkan parasit ini seperti terbentuknya nodul berwarna coklat kehitaman pada jaringan adiposa dan organ visceral terutama pada dinding usus dan caecae pyloric. Menurut Marzouk et al. (2010) prevalensi pada ikan kerapu tertinggi mencapai 88.8%.
Prevalensi Cacing Parasitik
Prevalensi Anisakis simplex cukup tinggi sebesar 44%. Nematoda parasitik ini tidak menimbulkan lesi pada ikan. Anisakis simplex (Anisakiasis) dapat menginfeksi manusia melalui food born disease karena cacing tersebut masih bisa bertahan hidup pada suhu kurang dari 70ºC dan temperatur kurang dari -20 ºC dracunculoid (A.crassus) yaitu mengisap darah inangnya. Tanda-tanda klinis anguilliculosis adalah hilangnya nafsu makan pada ikan, kurus, berkurangnya kemampuan berenang dan ikan menjadi ringan karena perut menjadi kembung. Anus terlihat bengkak berwarna kemerahan merupakan ciri patognomonik pada sidat yang terinfeksi A. Crassus (El-ashram 2007). Menurut El-dosoky (2001) melaporkan prevalensi cacing tersebut adalah 9.9% pada ikan sidat.
Prevalensi cacing parasit digenea pada ikan sidat asal Danau Lindu sebesar 23%. Cacing parasitik digenea memiliki dua inang dalam siklus hidupnya. Reproduksi seksual digenea menghasilkan telur-telur cacing yang keluar bersamaan dengan feses ikan dan hidup bebas di perairan hingga menemukan inang antara yang sesuai (Cribb et al. 2002). Semua digenea memiliki alat penghisap oral (anterior) di sekitar mulut dan terdapat alat penghisap ventral di tengah tubuhnya. Infeksi cacing parasitik digenea hanya sedikit menimbulkan kerusakan berat pada pencernaan ikan (Kabata 1985, Blair 1977). Cacing parasitik digenea berukuran kecil (dengan panjang sekitar 12 mm), bergerak dan tidak menimbulkan bekas luka, juga tidak menempel terlalu dalam pada organ tubuh inang (Chambers et al. 2001).
21
parah pada usus menimbulkan sumbatan mekanik. Menurut Stefansson (2000)
kecenderungan sidat yang berukuran kecil memakan krustasea kecil (Paracyclops fimriatus) secara berlebihan sangat mendukung kelangsungan siklus hidup cacing tersebut. Cestoda yang menginfeksi sidat dilaporkan menyebabkan kerusakan jaringan usus, penyumbatan mekanik dan menyerap nutrisi inang defenitif (Woo 1995, Paperna 1996, El-dosoky 2001).
Indeks Dominansi
Indeks dominansi mendeskripsikan tentang jumlah keseluruhan protozoa dan cacing parasitik yang terdapat pada ikan sidat asal Danau Lindu. Nilai dominansi tertinggi yaitu Myxidium sp. sebesar 0.23 diantara protozoa yang menginfeksi ikan sidat dan cacing Anisakis simplex memiliki nilai dominansi tertinggi sebesar 0.00046 diantara cacing parasitik lain (Tabel 4). Nilai dominansi protozoa dan cacing parasitik pada ikan sidat berkisar antara 0.0000020–0.23, indeks tersebut mendekati 0 (nol). Indeks dominansi Simpson menunjukkan bahwa tingkat dominansi protozoa dan cacing parasitik tidak ada yang mendominasi di antara parasit lainnya pada ikan sidat. Menurut Ludwig dan Reynolds (1988) menyatakan bahwa kisaran nilai dominansi 0-0.50 menunjukkan dominansi yang rendah.
Tabel 4 Indeks dominansi protozoa dan cacing parasit pada ikan sidat
No Parasit Total Individu Spesies Parasit
8 Anisakissimplex 45 0.00046
9 Anguillicola sp. 6 0.0000082
10 Digenea 28 0.00017
Tingkat Kesukaan
22
parasitik dengan melihat jumlah individu tiap protozoa dan cacing parasitik yang banyak dibandingkan dengan lendir kulit, kulit, dan sirip.
Tabel 5 Jumlah protozoa dan cacing parasit pada organ tubuh ikan sidat berdasarkan tingkat kesukaan
Parasit Lendir kulit Kulit Sirip Usus Insang
Myxidium sp. 56 227 30 113 583
Myxobolus sp. 43 7 2 214 16
Chilodonella sp. 6
Ceratomyxa sp. 50
Balantidium sp. 3
Henneguya sp. 2 72 102
Glugea sp. 87 73 125 200
Anisakissimplex 45
Anguillicola sp. 6
Digenea 28
5 SIMPULAN DAN SARAN
Simpulan
Keragaman protozoa dan cacing parasitik pada ikan sidat yaitu Myxidium
sp., Myxobolus sp., Chilodonella sp., Ceratomyxa sp., Balantidium sp.,
Henneguya sp., Glugea sp., Anisakis simplex, Anguillicola sp., dan Digenea. Prevalensi parasit tertinggi pada ikan sidat asal Danau Lindu adalah Myxidium sp. sebesar 77%. Protozoa dan cacing parasitik pada ikan sidat tidak ada yang mendominasi diantara parasit lain. Tingkat kesukaan protozoa dan cacing mempunyai perbedaan habitat pada organ inang. Parasit zoonosis pada ikan sidat asal Danau Lindu yaitu Anisakis simplex dengan prevalensi 44%.
Saran
23
DAFTAR PUSTAKA
Abdallah VD, Azevedo RK, Luque JL, Bomfim TCB. 2007. Two new species of Henneguya Thélohan, 1892 (Myxozoa,Myxobolidae), parasitic on the gills of Hoplosternum littorale (Callichthyidae) and Cyphocharax gilbert (Curimatidae) from Guandu River, State of Rio de Janeiro, Brazil. Parasitol Latinoam. 62: 35–41.
Abraham JT, Akpan PA, Effiom OE. 2011. Prevalence of Henneguya chrysicthys
(Flagellated Protozoa: Cyst) and haeatological changes due to the infection in Chrysichthys nigrodigitatus. Internet afrrev. 124-134.
Acha PN, Szyfres B. 2003. Zoonosis and communicable disease common to man and animals parasitoses. Washington DC: Pan American Health Organization.
Affandi R. 2005. Strategi Pemanfaatan Sumberdaya Ikan Sidat, Anguilla spp. di Indonesia. JII. (5)2.
Afrianto E, Liviawaty. 1992. Pengendalian Hama dan Penyakit Ikan. Yogyakarta (ID): Penerbit Kanisius.
Aguilar A, Alvarez MF, Leiro JM, Sanmartın ML. 2005. Parasite populations of the european eel (Anguilla Anguilla L.) in the river Ulla and Tea (Galicia, Northwest Spain). Aquaculture. 294:85-94.
Armentia A, Martin-Gil FJ, Pascual C, Martin-Esteban M, Callejo A, Martinez C. 2006. Anisakis simplex allergy after eating chicken meat. J Invest Allergol Clin Immunol 16 (4): 258-63.
Arthur JR, Te BQ. 2006. Checklist of the Parasites of Fishes of Vietnam. Roma: FAO Fisheries Technical Papers.
Audicana TM, Kennedy MW. 2008. Anisakis simplex: from obscure infectious worm to inducer of immune hypersensitivity. Clin Microbiol Rev. 21(2): 360-79
Aoyama J. 2009. Life history and evolution of migration in catadromous eels (Anguilla sp.). Aqua-Bio Science Monograph. 2(1): 1-42.
Azeem AS, Baki A, Quraishy S, Rocha S, Dkhil MA, Casal G, Azevedo C. 2015. Ultrastructure and phylogeny of Glugea nagelia sp. n. (Microsporidia: Glugeidae), infecting the intestinal wall of the yellowfin hind,
Cephalopholis hemistiktos (Actinopterygii: Serranidae), from the Red Sea.
Folia parasitol.
Blair D. 1977. A key to cercariae of british strigeoids (Digenea) for which the life-cycle are known, and notes on the characters used. J Helminthol. 51: 155-166.
Buchmann K, Bresciani J. 2001. An Introduction to Parasitic Diseases of Freshwater Trout. Denmark: DSR Publisher.
24
Caffara M, Raimondi E, Florio D, Marcer F, Quaglio F, Fioravanti ML. 2013. The life cycle of Myxobolus lentisuturalis (Myxozoa: Myxobolidae), from gold fish (Carassius auratus auratus), involves a Raabeia-type actinospore.
Folia Parasitol. 56(1): 6-12.
Chambers CB, Carlisle MS, Dove ADM, Cribb TH. 2001. A description of
Lecithocladium invisorn (Digenea: Hemiuridae) and the pathology associated with two species of Hemiuridae in acanthurid fish. Parasitol Res. 87(8): 666–673.
Cribb TH, Chisholm LA, Bray RA. 2002. Invited review diversity in the Monogenea and Digenea: does lifestyle matter. Int J Parasitol. 32(3): 321– 328.
Coates BJ, Bishop KD, Gardner G. 2000. Panduan lapangan burung-burung di Kawasan Wallacea. Bogor: Bird Life International-Indonesian Programme & Dove Publication Pty.
Dawes. 1946. The trematode. England(UK): Cambridge University Press.
Deelder CL. 1984. Synopsis of biological data on eel Anguilla Anguilla (Linnaeus 1758). FAO Fish Syn Rep 1.73p.
El-ashram AMM. 2007. Studies on parasitic Disease Among Wild and Cultured Eel Fish (Anguilla Anguilla). SCVMJ. 12(2).
El-Dosoky EA. 2001. Studies on some factors affecting the health and survival of eel. Egypt: Fish Disease and Management Dept. Zagazig University. Eiras J, Saraiva A, Cruz F, Santos MJ, Fiala I. 2011. Synopsis of the Species of
Myxidium Butschli,1882 (Myxozoa:Myxosporea: Bivalvulida). Syst Parasitol. 80: 81-116.
Gaspersz V. 1991. Metode perancangan percobaan untuk ilmu-ilmu pertanian, ilmu-ilmu teknik, dan biologi. Bandung (ID): Armico.
Geetanjali, Malhotra SK, Malhotra A, Ansari Z, Chatterji A. 2002. Role of Nematodes as bioindicators in marine and freshwater habitats. Curr Sci.
82: 505–507.
Gunter NL, Whipps CM, Adlard RD. 2009. Ceratomyxa (Myxozoa: Bivalvulida): robust taxon or genus of convenience. Parasitol. 39: 1395–1405.
Hoffman GL, Kazubski SL, Mitchell AJ, Smith CE. 1974. Chilodonella hexasticha (Kiernili, 1909) (Protozoa, Ciliata) from North American warm water fish. J Fish Dis. 2: 153–157.
Hoffman GL. 1967. Parasite of North American freshwater fishes. USA (US): University of California Press Berkeley and Los Angeles California. Kabata Z. 1985. Parasites and diseases of cultured in the tropics. USA (US):
Taylor & Francis Inc. Philadelphia.
Kafuku dan Ikenoue. 1983. Modern method of aquaculture Japan. Japan:
25
Kagei A, Isogaki I. 1992. A case of acute abdominal syndrome caused by the presence of a large number of Anisakis simplex larvae. Int J Parasitol.
22:251–253.
Kennedy MW. 2000. The nematode polyprotein allergens/antigens. Parasitol Today. 16(9): 373-80.
Kottelat M. 1990. The ricefishes (Oriziidae) of Malili Lakes, Sulawesi, Indonesia with description of a new species. Ichtiol Explor Freshwater.
Kristmundsson A, Helgason S. 2007. Parasite communities of eels Anguilla anguilla in freshwater and marine habitats in Iceland in comparison with other parasite communities of eels in Europe. Folia Parasitol. 54: 141– 153.
Lasee B. 2004. National wild fish health survey laboratory procedures manual, second edition. USA (US): Fish and Wildlife Service.
Larizza A, Vovlas N. 1995. Morfhological observation on third-stage of Anisakis simplex (Anisakidae: Nematoda) from Adriatic and Iobian waters. J Helminthol Soc Wash. 62(2): 260-264.
Ludwig JAD, Reynolds JV. 1988. Statistical ecology a primer in methods and computing. New York: John Wiley and Sons.
Lukman. 2007. Danau Lindu: keteduhan yang merindu. Bogor (ID): LIPI. Lovell. 1989. Nutrition and feeding of fish., New York: Van Nostrand-Reinhold. Lee GF, Jones R, Saleh F, Mariani G, Homer D, Butler J, Bandyopadhyay P.
1978. Final report: evaluation of the elutriate test as a method of predicting contaminant release during open water disposal of dredged sediment and environmental impact of open water dredged material disposal. USA (US): University Texas at Dallas.
Marzouk MS, Anter OM, Ali MM, Kenawy AM, Mahmaud MA. 2010. Studies on epizootic microsporidian in wild dusky grouper (Epinephelus guaza) from Mediterranean sea at Matrouh governote, Egypt. Egypt J Aquat Biol & Fish. 1:1-12.
McKinnon K. 1994. Nature’s treasure house. The wildlife of Indonesia. Jakarta (ID): PT. Gramedia.
McCosker JE, Bustamante RH, Wellington GM. 2003. The freshwater eel,
Anguilla marmorata, discovered in galápagos. San Francisco: California Academy of Sciences.
Ming L, Weidong L, Zhang L, Wang C. 2013. Balantidium honghuensis n. sp. (Ciliophora: Trichostomatidae) from the rectum of Rana nigromaculata
and R. limnocharis from Honghu Lake, China . Korean J Parasitol. (5)4: 427-431.
Miyazaki I. 1991. An illustrated book of helmintic zoonosis. Tokyo: International Medical Foundation of Japan.
Mood SM. Shohreh P, Sahandi J. 2011. A survey on ectoparasite of cold water fish farms in Mazandaran Province, Iran. HVM BIOFLUX . (3):3.
Molnar K, Reinhardt M. 1978. Intestinal lesions in grasscarp Ctenopharyngodon idella (Valenciennes) infected with Balantidium ctenopharyngodonis
Chen. J Fish. 1:151-156.
26
Moser M. 1976. Ceratomyxa anoplopoma sp.n. (Protozoa, Myxosporida) from the sablefish, Anoplopoma fimbria. Can J Zool. 54: 1405-1406.
Muller R. 2001. Worms and human disease second edition. New York: CABI Publishing.
Nagasawa K, Kim YG, Hirose H. 1994. Anguillicola crassus and A. globiceps
(Nematoda: Dracunculoidea) parasitic in the swimbladder of eel (Anguilla japonica and A. Anguilla) in East Asia: a review. Folia Parasitol. 41:127-137
National Institute of Infectious Diseases and Tuberculosis and Infectious Diseases Control Division, Ministry of Health, Labour and Welfare. 2004. Foodborne helminthiases as emerging diseases in Japan. Infect. Agents SurveillaenceRep. 25: 214-215.
Ndobe S. 2010. Struktur ukuran glass eel ikan sidat (Anguilla marmorata) di muara sungai Palu, Kota Palu, Sulawesi Tengah. Med Lit Sulteng.
3(2):144-150.
Noga EJ. 2010. Fish Disease: diagnosis and treatment.Wiley Blackwell Iowa. Noble ER, Noble GA. 1989. Parasitology: the biology of animal parasites.
London: Lea & Fibiger.
Olson RE. 1981. Effect of low temperature on the development of microsporidian
Glugea stephani in english Sole (Parophrys vetulus). J Wildlife Dis.
17(4):559-562.
Nurwidayanty, Kurniawan. 2007. Koleksi refrensi Shistomiasis di dataran tinggi Lindu Kabupaten Donggala Sulawesi Tengah. J Vek Pen. 1(1).
Odum HT. 1983. Ekologi system. Yogyakarta (ID): Gadjah Mada University Press.
Puranik P, Bhate A. 2007. Animal forms and functions: invertebrata. India: Sarup and sons darya ganj New Delhi
Padua SB, Martins ML, Carrijo-Mauad JR, Ishikawa MM, Jeronimo GT, Dias-Neto J, Pilarski F. 2013. First record of Chilodonella hexasticha
(Ciliophora: Chilodonellidae) in brazilian cultured fish: A morphological and pathological assessment. Vet Parasitol.(191) 154–160.
Paperna. 1996. Parasites infections and disease of fish in Africa Committee for inland fisheries of Africa. FAO Tehnical Papers. 13:122-143.
Richardson BJ, Baverstock PR, Adams M. 1986. Allozyme electrophoresis. A handbook for animal systematics andpopulation studies. Sydney: Academic Press.
Qadri SS. 1952. Protozoal parasites of freshwater fish [THESIS]. London: University of London.
Sakanari JA, McKerrow JH. 1990. Identification of the secreted neutral proteases from Anisakis simplex. J Parasitol. 76: 625–630.
Sindermann CJ. 1990. Pripical diseases of marine fish and shellfish. New York: Academic Press Inc.
Silva CE, Grazina FPS, Carralho VM. 1993. Parasite and parasitoses of the uropean Eel in Portugal. Euro Aquac Soct. 19: 219.
Smales LR, Sasal P, Taraschewski H. 2007. Acanthocephalus reunionensis N. sp.