PEMBERIAN PROBIOTIK, PREBIOTIK DAN SINBIOTIK
UNTUK MENINGKATKAN RESPON IMUN UDANG VANAME
Litopenaeus vannamei TERHADAP INFEKSI Vibrio harveyi
IKO IMELDA ARISA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Pemberian Probiotik, Prebiotik dan Sinbiotik untuk Meningkatkan Respon Imun Udang Vaname Litopenaeus vannamei terhadap Infeksi Vibrio harveyi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, November 2011
Iko Imelda Arisa
ABSTRACT
IKO IMELDA ARISA. Application of probiotic, prebiotic and synbiotic to enchance the immune response of shrimp Litopenaeus vannamei against Vibrio harveyi infection. Under direction of WIDANARNI and MUNTI YUHANA.
Probiotic, prebiotic and synbiotic are now widely used in aquaculture and showed their capability in controlling the bacterial disease. The aim of this study was to the test the effectiveness of probiotic, prebiotic and synbiotic in enhancing the immune response of shrimp againts Vibrio harveyi infection. This research comprised of 5 treatments, namely: control P0(+), control P0(-), 1% probiotic (P1), 2% prebiotic (P2) and synbiotic (1% probiotic+2% prebiotic: P3). Probiotic SKT-b (dose 106 CFU/ml) was supplemented into bacterial feed. Prebiotic used in this study was oligosaccharides derived from sweet potato varietie of Sukuh (2% of the feed weight). Shrimp used in this study was Litopenaeus vannamei larvae (±3.5 g in weight). Shrimp were cultured aquaria 60x35x30 cm3 filled with 40 L seawater for 28 days. Immune response parameters observed including total hemocyte, phagocytic activity and phenoloxidase activity (PO). Each parameter was observed 9 times, i.e at 0, 7 and 14 day of culture and after a challenge test, i.e at the 6, 12, 24, 72, 120 and 168 hours post infection. Post-test results showed that the highest survival P3 treatment (100%), followed by P1(90%), P2(83%), and P0(+)(60%) showed by respectively. The results of the immune response observed during the study showed the highest in P3 (total hemocyte 3,36±0,05-9,32±0,05x106 cells/ml, phagocytic activity of 16,48±0,14-77,55±0,22% and PO activity 0,128±0,03-0,591±0,01) and the lowest was P0(+) (total hemocyte 3,15±0,16-4,53±0,33x106 cell/ml; phagocytic activity 10,15±0,10-20,78±0,34% and PO activity 0,128±0,03-0,181±0,03). From this study, we concluded that the addition synbiotic into the feed can improve the immune response of shrimp better than the other treatments.
RINGKASAN
IKO IMELDA ARISA. Pemberian Probiotik, Prebiotik dan Sinbiotik untuk Meningkatkan Respon Imun Udang Vaname Litopenaeus vannamei terhadap Infeksi Vibrio harveyi. Dibimbing oleh WIDANARNI dan MUNTI YUHANA
Litopenaeus vannamei merupakan udang introduksi yang saat ini banyak dibudidayakan di Indonesia. Namun, kendala yang dihadapi dalam usaha budidaya udang diantaranya adalah penyakit. Penyakit bakterial yang paling sering ditemukan menyerang udang adalah penyakit vibriosis yang disebabkan oleh infeksi bakteri Vibrio spp. Upaya pengendalian penyakit umumnya menggunakan antibiotik dan bahan kimia. Namun, saat ini penggunaan antibiotik sudah dibatasi dan dilarang karena dapat menimbulkan strain patogen yang resisten terhadap antibiotik tersebut. Oleh karena itu, salah satu alternatif yang dilakukan untuk menanggulangi penyakit vibriosis melalui pemberian probiotik, prebiotik atau sinbiotik. Penelitian ini bertujuan untuk menguji efektivitas pemberian probiotik, prebiotik dan sinbiotik dalam meningkatkan respon imun udang vaname terhadap infeksi bakteri Vibrio harveyi.
Penelitian ini dilaksanakan selama 3 bulan, mulai dari bulan Maret-Mei 2011, di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Tahapan penelitian meliputi produksi prebiotik (ekstraksi oligosakarida) dan uji probiotik, prebiotik dan sinbiotik pada udang. Penelitian ini terdiri dari 5 perlakuan dengan 3 ulangan, yaitu: kontrol P0 (-); kontrol P0 (+); perlakuan P1 (probiotik 1%); perlakuan P2 (prebiotik 2%) dan perlakuan P3 (sinbiotik: probiotik 1% dan prebiotik 2%).
Hasil pengujian pemberian probiotik, prebiotik dan sinbiotik pada udang menunjukkan penambahan probiotik (P1), prebiotik (P2) dan sinbiotik (P3) ke dalam pakan memberikan hasil yang lebih baik dibandingkan dengan kontrol (P0) untuk setiap parameter. Kelangsungan hidup udang tertinggi pasca infeksi bakteri patogen V. harveyi diperoleh pada perlakuan sinbiotik yaitu sebesar 100%, kemudian diikuti perlakuan probiotik sebesar 90%, prebiotik sebesar 83% dan kontrol positif sebesar 60%. Pemberian probiotik, prebiotik dan sinbiotik memberikan pengaruh terhadap jumlah total bakteri Vibrio di usus dan respon imun udang baik sebelum maupun setelah infeksi bakteri patogen V. harveyi.
kelangsungan hidup bakteri disini lebih baik. Vibrio hijau terbanyak terdapat pada perlakuan P0 (+) sebanyak 32,0 x 103 CFU/ml diduga karena pada perlakuan ini tidak diberi probiotik dan prebiotik, sehingga koloni bakteri Vibrio hijau disini sebagian besar adalah bakteri V. harveyi yang diinfeksikan dan tumbuh baik di dalam tubuh udang.
Hasil pengamatan respon imun selama penelitian juga menunjukkan bahwa perlakuan P3 memberikan hasil terbaik (total hemosit 3,36±0,05-9,32±0,05x106 sel/ml, indeks fagositik 16,48±0,14-77,55±0,22% dan aktivitas PO 0,128±0,03-0,591±0,01) dan terendah pada perlakuan P0 (+) (total hemosit 3,15±0,16-4,53±0,33x106 sel/ml; indeks fagositik 10,15±0,10-20,78±0,34%; dan aktivitas PO 0,128±0,03-0,181±0,03). Dari hasil penelitian ini dapat disimpulkan bahwa penambahan sinbiotik ke dalam pakan mampu meningkatkan respon imun udang lebih baik dibandingkan perlakuan lainnya sehingga menghasilkan kelangsungan hidup tertinggi.
Kata kunci: probiotik, prebiotik, sinbiotik, Vibrio harveyi, Litopenaeus vannamei
© Hak Cipta milik IPB, Tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PEMBERIAN PROBIOTIK, PREBIOTIK DAN SINBIOTIK
UNTUK MENINGKATKAN RESPON IMUN UDANG VANAME
Litopenaeus vannamei TERHADAP INFEKSI Vibrio harveyi
IKO IMELDA ARISA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Proposal : Pemberian Probiotik, Prebiotik dan Sinbiotik untuk Meningkatkan Respon Imun Udang Vaname Litopenaeus vanname terhadap Infeksi Vibrio harveyi
Nama : Iko Imelda Arisa
NIM : C151090191
Disetujui Komisi Pembimbing
Dr. Ir. Widanarni, M.Si Dr. Munti Yuhana, S.Pi, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof. Dr. Ir. Enang Harris, MS Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulisan tesis dengan judul ”Pemberian Probiotik, Prebiotik dan Sinbiotik untuk Meningkatkan Respon Imun Udang Vaname Litopenaeus vannamei terhadap Infeksi Vibrio harveyi dapat diselesaikan dengan baik.
Ucapan terimakasih yang tak terhingga penulis sampaikan secara khusus kepada Ibu Dr. Ir. Widanarni, M.Si dan Dr. Munti Yuhana, S.Pi, M.Si selaku komisi pembimbing atas waktu, kebijaksanaan, tuntunan, kesabaran, serta masukan hingga tesis ini dapat diselesaikan.
Penulis juga mengucapkan terimakasih kepada:
1. Kedua orang tua penulis, Ayahanda Ir. Arizal Munif dan Ibunda Habsah, SP; adik-adikku Edo Edward Arizal dan Ayu Ariyuana Arisa serta nenekku tercinta yang telah memberikan cinta dan kasih sayang, doa serta semangat yang tiada henti kepada penulis.
2. Ibu Dr. Sri Nuryati, S.Pi, M.Si selaku penguji luar komisi atas segala masukan dan arahan.
3. Teman-teman Akuakultur 2009 (Tanbiyaskur, Safrizal Putra, Dian Febriani, Rahman, Zuraida, Erna Thalib, Wahyuni Fanggi Tasik, Riri Erzaneti, Muliani, Jenny Abidin, Eulis Marlina, Anwar Hasan, Aras Syazili, Muznah Toatobun, Dewi Purpaningsih, Novi Mayasari, Reza Samsudin, Alfabetian Condro Haditomo, Jakomina Metungun, Mariana Beruatjaan, Jacqueline Sahetapy), Muliari, Maria Ulfah, Suri Purnama Febri, Indah Rizki, Putri Mudhlika Lestarina, Ghyta Rian Septiany, Damayanti dan Dwi Febrianti.
4. Staf dan pegawai di departemen Budidaya Perairan FPIK IPB.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, karena keterbatasan pengetahuan dan wawasan penulis. Oleh karena itu, penulis mengharapkan saran, masukan dan kritikan untuk perbaikan serta kesempurnaan penulisan selanjutnya. Semoga tesis ini dapat bermanfaat.
Bogor, November 2011
RIWAYAT HIDUP
Penulis dilahirkan di Lubuk Gapuy Aceh Besar pada tanggal 24 Januari 1986, putri pertama dari tiga bersaudara pasangan Bapak Ir. Arizal Munif dan Ibu Habsah, SP.
Pendidikan sekolah dasar diselesaikan oleh Penulis pada Tahun 1998 di SD Negeri Teladan Lubuk, Sekolah Lanjutan Tingkat Pertama pada Tahun 2001 di SLTP Negeri 1 Ingin Jaya Aceh Besar dan Sekolah Menengah Umum pada Tahun 2004 di SMU Negeri 3 Banda Aceh. Sejak Juli 2004 Penulis tercatat sebagai mahasiswi di Program Studi Ilmu Kelautan, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Syiah Kuala dan berhasil lulus Tahun 2009.
DAFTAR ISI
Vibrioharveyi dan penyakit Udang Berpendar ... 7
Probiotik dalam Akuakultur ... 8
Prebiotik dalam Akuakultur ... 9
Sinbiotik dalam Akuakultur ... 10
METODE PENELITIAN ... 13
Waktu dan Tempat ... 13
Udang Uji dan Bakteri Probiotik ... 13
Produksi Prebiotik (Oligosakarida) ... 13
Pembuatan tepung ubi jalar ... 13
Ekstraksi oligosakarida (Muchtadi 1989) ... 14
Pengukuran konsentrasi oligosakarida (total padatan terlarut) ... 15
Perlakuan dan Rancangan Penelitian ... 16
Pelaksanaan Penelitian ... 16
HASIL DAN PEMBAHASAN ... 21
Kelangsungan Hidup ... 21
Populasi Bakteri dalam Usus ... 22
Respon Imun Udang ... 23
Total hemosit ... 23
Diferensial hemosit ... 25
Indeks fagositik ... 28
Aktivitas phenoloksidase ... 29
Laju Petumbuhan Harian ... 31
Kualitas Air ... 33
KESIMPULAN DAN SARAN ... 35
Kesimpulan ... 35
Saran... 35
DAFTAR PUSTAKA ... 37 LAMPIRAN
DAFTAR TABEL
Halaman
1. Total bakteri Vibrio di usus ... 22 2. Kisaran kualitas air media pemeliharaan udang vaname selama
DAFTAR GAMBAR
Halaman
1. Mekanisme sistem pertahanan pada krustasea (Smith et al.2003) ... 7 2. Tahapan pembuatan tepung ubi jalar ... 14 3. Ekstraksi oligosakarida ubi jalar ... 15 4. Tingkat kelangsungan hidup udang vaname selama perlakuan
penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang dengan bakteri patogen V. harveyi (B) ... 21
5. Total hemosit udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang
dengan bakteri patogen V. harveyi (B)... 24 6. Jumlah sel hialin udang vaname selama perlakuan penambahan
probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang
dengan bakteri patogen V. harveyi (B) ... 26 7. Jumlah sel granular udang vaname selama perlakuan penambahan
probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang
dengan bakteri patogen V. harveyi (B) ... 27
8. Indeks fagositik udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang
dengan bakteri patogen V. harveyi (B) ... 28
9. Aktivitas phenoloksidase (PO) udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang dengan bakteri patogen V. harveyi (B) ... 30
10.Laju pertumbuhan harian (SGR) udang vaname selama 2 minggu perlakuan penambahan probiotik, prebiotik dan sinbiotik dan 2
DAFTAR LAMPIRAN
Halaman
1. Analisis statistik kelangsungan hidup udang ... 43
2. Analisis statistik total hemosit ... 44
3. Analisis statistik sel hialin dan sel granular ... 48
4. Analisis statistik indeks fagositik ... 56
5. Analisis statistik aktivitas phenoloksidase (PO) ... 60
PENDAHULUAN
Latar Belakang
Udang vaname Litopenaeusvannamei merupakan udang introduksi yang saat ini banyak dibudidayakan di Indonesia. Udang ini memiliki beberapa keunggulan dibandingkan udang windu (Penaeus monodon) yaitu responsif terhadap pakan yang diberikan, dapat dibudidayakan dengan padat tebar tinggi dan relatif lebih tahan terhadap serangan penyakit. Berbagai keunggulan yang dimiliki udang vaname tersebut menyebabkan permintaan akan udang ini semakin tinggi. Untuk memenuhi permintaan ini, maka sistem budidaya intensif tidak dapat dihindarkan. Namun, dampak intensifikasi kegiatan budidaya tersebut menyebabkan daya dukung lingkungan budidaya buruk dan berpeluang terjadinya penyakit.
Penyakit yang menyerang udang vaname umumnya disebabkan oleh infeksi bakteri dan virus (Sharma etal. 2010). Salah satu penyakit infeksi bakteri adalah penyakit vibriosis yang disebabkan oleh Vibrio spp. Upaya pengendalian umum yang telah dilakukan yaitu penggunaan antibiotik dan bahan kimia, namun cara ini tidak selalu efektif untuk mengatasi masalah tersebut bahkan dapat menimbulkan masalah baru yang lebih berbahaya. Menurut Moriarty (1999) penggunaan antibiotik untuk membunuh bakteri menimbulkan strain patogen yang resisten terhadap antibiotik. Oleh karena itu, salah satu alternatif yang dapat dilakukan untuk menanggulangi penyakit vibriosis adalah melalui aplikasi probiotik, prebiotik dan sinbiotik.
air laut mampu menekan serangan bakteri V. harveyi penyebab penyakit vibriosis pada udang, sehingga kelangsungan hidup udang meningkat (Widanarni et al. 2003).
Aplikasi probiotik memiliki beberapa kelemahan diantaranya kompetisi nutrien, kemampuan hidup dan kolonisasi. Jika bakteri probiotik tidak mendapat jumlah nutrien yang cukup untuk kehidupannya, ditambah terjadinya perubahan lingkungan yang ekstrim dalam saluran pencernaan, maka bakteri probiotik akan cepat mengalami pencucian (wash out)(Lisal 2005). Oleh karena itu, diperlukan pendekatan lain untuk mengatasi keterbatasan tersebut seperti aplikasi prebiotik.
Prebiotik merupakan bahan pangan yang tidak dapat dicerna dan secara langsung memberikan efek menguntungkan bagi inangnya dengan cara merangsang pertumbuhan dan aktivitas dari satu atau beberapa aktivitas bakteri di dalam kolon (Schrezenmeir & Vrese 2001). Jadi, aplikasi prebiotik berfungsi sebagai nutrien yang dibutuhkan bakteri probiotik untuk mempertahankan hidupnya dalam saluran pencernaan, sehingga dapat mengatasi keterbatasan-keterbatasan dalam aplikasi probiotik. Pencampuran prebiotik dengan bakteri probiotik disebut sinbiotik.
Schrezenmeir & Vrese (2001), menyatakan sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup. Aplikasi probiotik dan prebiotik akan meningkatkan status kesehatan, resistensi terhadap penyakit, perbaikan pertumbuhan, memperbaiki morfologi usus dan keseimbangan mikroba (Merrifield et al. 2010). Penelitian Li
et al. (2009), menunjukkan bahwa penambahan probiotik Bacillus OJ (PB) dengan konsentrasi 108 CFU/g pakan dan 0,2% isomaltooligosaccharides (IMO) dapat meningkatkan resistensi udang terhadap penyakit WSSV dengan meningkatkan respon imun udang dan menyeimbangkan mikroflora usus sehingga mampu meningkatkan penyerapan nutrisi. Penelitian ini diharapkan dapat memberikan informasi mengenai peranan probiotik, prebiotik dan sinbiotik dalam meningkatkan sistem imun udang terhadap infeksi bakteri Vibrio harveyi.
Perumusan Masalah
Kecenderungan umum dalam penanggulangan penyakit saat ini adalah mulai ditinggalkannya pemakaian antibiotik dan bahan kimia, bahkan dilarang pemakaiannya untuk alasan isu resistensi bakteri dan keamanan pangan. Oleh karena itu, perlu sebuah kajian lain yang diharapkan mampu mengatasi hal tersebut yaitu dengan meningkatkan respon imun udang terhadap penyakit melalui aplikasi probiotik, prebiotik dan sinbiotik.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efektivitas pemberian probiotik, prebiotik dan sinbiotik dalam meningkatkan respon imun udang vaname terhadap infeksi bakteri V. harveyi.
Manfaat Penelitian
Manfaat dari penelitian ini diharapkan pemberian probiotik, prebiotik dan sinbiotik sebagai alternatif dalam penanggulangan penyakit vibriosis melalui peningkatan respon imun.
Hipotesis
TINJAUAN PUSTAKA
Sistem Imun Tubuh Udang
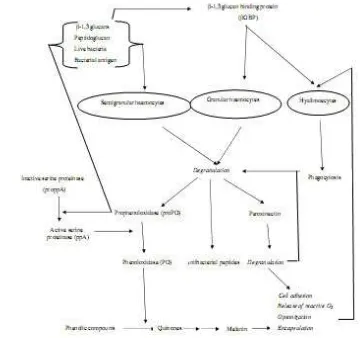
Sistem pertahanan tubuh utama pada udang terdiri dari dua bagian yaitu sistem pertahanan tubuh seluler dan sistem pertahanan humoral. Sistem pertahanan seluler meliputi fagositosis sel-sel hemosit, nodulasi dan encapsulasi. Sistem pertahanan humoral mencakup phenoloksidase (PO), propenoloksidase (ProPO), lektin dan aglutinin. Kedua sistem pertahanan ini bekerja sama memberikan perlindungan tubuh terhadap infeksi organisme patogen dari lingkungan. ProPO diaktifkan oleh prophenoloxidase activating enzyme (PPA). Sedangkan PPA ini bisa diaktifkan oleh lipopolisakarida. ProPO dan PPA ini merupakan protein yang berlokasi di granular hemosit. Akibat dari pengaktifan proPO menjadi PO dihasilkan protein faktor opsonin yang merangsang fagositosis hialosit (Johansson dan Soderhall 1989).
Meningkatnya ketahanan tubuh udang dapat diketahui dari meningkatnya aktivitas fagositosis sel-sel hemosit. Fagositosis merupakan mekanisme pertahanan non spesifik yang secara umum dapat melindungi adanya serangan patogen. Hemosit merupakan faktor yang sangat penting dalam sistem pertahanan seluler yang bersifat non spesifik. Kemampuan hemosit dalam aktivitas fagositosis yang dapat meningkat pada kejadian infeksi, menunjukkan pertahanan tubuh yang bersifat seluler. Dengan adanya infeksi tersebut akan merangsang sistem pertahanan non spesifik seluler untuk menangkal serangan penyakit. Mekanisme aktivitas hemosit pada udang terdiri dari mekanisme penjeratan (encapsulasi) terhadap suatu materi asing, mekanisme fagositosis gabungan terbentuk dari beberapa hemosit yang membentuk kumpulan lebih besar dan kumpulan hemosit membentuk suatu lapisan terpigmentasi (Fontaine dan Lightner 1974).
10-20 m merupakan sel dengan perbandingan inti lebih sedikit dari sitoplasma dan memiliki granul sub mikron dan mikron serta adanya granul refractile. Semi granular memperlihatkan kapasitas mengenali dan merespons partikel unsur atau molekul asing atau dikenal sebagai sel aktif dalam enkapsulasi. Granul berukuran 12-25 m merupakan sel dengan perbandingan inti lebih rendah dari sitoplasma berisi butiran halus dan bertanggung jawab mengaktifkan sistem prophenoloksidase (sistem proPO) (Ramu and Zakaria 2000). Sel semi granular dan granular melakukan fungsi sistem proPO sedangkan sel hialin melakukan fagositosis dalam imunitas krustasea (Wang and Chen 2006).
Faktor-faktor yang berperan penting dalam respon terhadap partikel asing pada mekanisme sistem pertahanan tubuh udang dapat dilihat pada Gambar 1. Pada mekanisme pertahanan udang terlihat bahwa hemosit yang bersirkulasi berperan penting tidak hanya secara langsung dalam menghambat dan membunuh agen infeksi tetapi juga secara tidak langsung melalui sintesis dan eksositosis sejumlah molekul bioaktif (Smith etal. 2003 ).
Gambar 1 Mekanisme sistem pertahanan pada krustasea (Smith et al. 2003)
Vibrio harveyi dan Penyakit Udang Berpendar
Vibrio harveyi adalah bakteri yang hidup di lingkungan perairan laut, dan termasuk bakteri yang dapat berpendar (Baumann et al. 1994). Pada umumnya bakteri V. harveyi bersifat oportunistik yaitu organisme yang dalam keadaan normal ada dalam lingkungan pemeliharaan dan berkembang dari sifat saprofitik menjadi patogenik apabila kondisi lingkungan dan inang memburuk (Lavilla-Pitogo et al. 1990). Tahap pelekatan bakteri patogen pada inang merupakan prasyarat yang akan menentukan keberhasilan bakteri tersebut dalam kolonisasi dan mensekresikan faktor-faktor virulensi (Bloemberg et al. 1993). Haris dan Owens (1999) mengatakan bahwa virulensi V. harveyi berkaitan dengan protein yang diatur secara bersama oleh mekanisme quorumsensing interseluler.
Quorum sensing adalah suatu proses komunikasi sel-sel bakteri yang melibatkan produksi dan deteksi dari sekresi molekul sinyal yang disebut
autoinducers. Tiga autoinducers V. harveyi adalah AI-1 (3-hydroxybutanoyl homoserine lactone), AI-2 [(2S,4S)-2-methyl-2,3,3,4- etrahydroxytetrahydrofuran -borate], dan CAI-1 [(S)-3-hydroxytridecan-4-satu] (Swem et al. 2008). Gullian et al. (2004) menyatakan bahwa populasi V. harveyi di udang dapat ditekan dengan cara mengintroduksikan bakteri tertentu yang diisolasi dari hepatopankreas udang sehat.
Probiotik dalam Akuakultur
Menurut Fuller (1992), probiotik adalah mikroba hidup yang ditambahkan ke dalam pakan yang dapat memberikan pengaruh menguntungkan bagi hewan inang dengan memperbaiki keseimbangan mikroba ususnya. Pada hewan akuatik, selain saluran pencernaan, air di sekeliling organisme tersebut juga memegang peranan penting. Oleh karena itu, probiotik untuk hewan akuatik adalah agen mikroba hidup yang memberikan pengaruh menguntungkan pada inang dengan memodifikasikan komunitas mikroba atau berasosiasi dengan inang, menjamin perbaikan dalam penggunaan pakan atau memperbaiki nilai nutrisinya dan memperbaiki respon inang terhadap penyakit (Verschuere et al. 2000).
Probiotik dalam akuakultur sering digunakan karena kemampuannnya memproduksi senyawa anti mikroba. Probiotik yang berada di saluran pencernaan dapat menghambat kerja bakteri patogen yang merusak saluran pencernaan. Interaksi antara mikroba dengan inang tidak terbatas pada saluran pencernaan, bakteri probiotik juga dapat aktif pada insang, kulit tubuh inang atau lingkungan sekitarnya. Interaksi yang intensif antara mikroba dan inang dalam akuakultur menjadikan sejumlah probiotik tidak hanya berhasil diisolasi dari saluran pencernaan tetapi dapat juga diisolasi dari lingkungan budidaya (Irianto, 2003).
imun (kekebalan); (5) perbaikan kualitas air; dan (6) interaksi dengan fitoplankton.
Gullian et al. (2004) menemukan bahwa bakteri probiotik Bacillus P64 dan Vibrio P62 yang berasal dari hepatopankreas udang sehat memiliki kemampuan sebagai probiotik dan imunostimulasi pada udang vaname. Li et al. (2008), bakteri probiotik Arthrobacter XE-7 mampu melindungi udang L. vannamei melalui stimulasi respon imun maupun pembentukan mekanisme
competitiveecxlucion.
Probiotik yang digunakan dalam penelitian ini adalah bakteri Vibrio SKT-b (Widanarni, 2003) yang telah teruji kemampuannya dalam menghambat pertumbuhan bakteri V. harveyi dan meningkatkan kelangsungan hidup larva udang windu pada berbagai stadia pada uji invivo (Widanarni et al. 2009). Vibrio
SKT-b merupakan bakteri dari genus Vibrio bersifat Gram negatif, bentuk batang pendek, koloninya berwarna kuning pada media TCBS dan menyebar pada media SWC-agar, mampu memproduksi protease dan amilase, serta tidak memproduksi khitinase. Probiotik Vibrio SKT-b dapat memanfaatkan glukosa dan sukrosa, tetapi tidak dapat memanfaatkan laktosa. Hasil karakterisasi fisiologi dan biokimia serta analisis sekuen sebagian gen 16S-rRNA menunjukkan bahwa isolat ini termasuk spesies Vibrio alginolyticus dengan indeks kemiripan 88% (Widanarni 2003).
Prebiotik dalam Akuakultur
Prebiotik adalah bahan pakan yang tidak dapat dicerna oleh inang di dalam saluran pencernaannya, tetapi dapat dimanfaatkan oleh satu atau beberapa bakteri yang menguntungkan inang untuk kelangsungan hidupnya sehingga mampu memperbaiki keseimbangan usus inang (Li et al. 2004). Schrezenmeir dan Vrese (2001) menyatakan bahwa prebiotik tidak dapat dipisahkan dengan probiotik karena target prebiotik adalah memacu pertumbuhan bakteri probiotik.
Mekanisme kerja dari prebiotik adalah prebiotik (senyawa oligosakarida) yang tidak dapat dicerna dalam saluran pencernaan akan didegradasi atau difermentasi oleh bakteri usus. Fermentasi oligosakarida oleh bakteri akan menghasilkan energi metabolisme dan asam lemak rantai pendek (Tomomatsu
1994). Prebiotik dalam usus besar akan difermentasi oleh bakteri probiotik dan akan menghasilkan short chain fatty acid (SCFA) dalam bentuk asam asetat, propionat, butirat, serta karbondioksida dan hidrogen (Cummings et al. 2001).
Bahan makanan dapat diklasifikasikan sebagai prebiotik jika memiliki syarat yaitu : (1) tidak dihidrolisa dan tidak diserap dibagian atas traktus gastrointestinal sehingga dapat mencapai kolon tanpa mengalami perubahan struktur dan tidak diekskresikan dalam feses. (2) substrat yang selektif untuk satu atau sejumlah mikroflora komensal yang menguntungkan dalam kolon sehingga memacu pertumbuhan bakteri baik yang aktif melakukan metabolisme, (3) mampu merubah mikroflora kolon menjadi komposisi yang menguntungkan kesehatan (Collins dan Gibson 1999; Gibson dan Fuller 2000). Beberapa bahan yang berpotensi sebagai prebiotik adalah rafinosa, oligosakarida, galaktooligosakarida, galaktosa, laktosukrosa, isomalto-oligosakarida, gluko-oligosakarida, xylo-oligosakarida (Manning dan Gibson 2004).
Sang dan Fotedar (2010) menyatakan pemberian mannan oligosakarida (MOS) dalam pakan untuk juvenil udang lobster (Panulirus ornatus, Fabricius 1798) meningkatkan pertumbuhan, kelangsungan hidup, kondisi fisiologis, kesehatan usus dan respon imun.
Prebiotik yang akan digunakan dalam penelitian ini adalah ekstrak oligosakarida yang berasal dari ubi jalar varietas sukuh. Hasil peneltian Marlis (2008), menunjukkan bahwa konsentrasi gula pada tepung ubi jalar varietas sukuh terdiri dari fruktosa 0,17%; glukosa 0,25%; sukrosa 1,42%; maltose 3,12%; maltotriosa 0,12%. Tepung ubi jalar yang mengalami pengolahan memiliki potensi prebiotik karena masih mengandung oligosakarida yaitu rafinosa dan maltotriosa.
Sinbiotik dalam Akuakultur
Roberfroid (1995) bahwa sinbiotik merupakan aplikasi gabungan dari probiotik dan prebiotik yang memberikan keunggulan kompetitif bagi probiotik terhadap
sumber energi fermentasi yang tinggi dibandingkan dengan kompetisi populasi
endogenous, sehingga secara efektif dapat meningkatkan kelangsungan hidup dan
pelekatan (implantasi) dari suplemen makanan mikroba hidup dalam saluran
pencernaan dari inang.
Pemberian imunostimulan baik prebiotik (Bio-Mos® dan -1,3-D-glucan) atau probiotik dalam pakan meningkatkan pertumbuhan, kelangsungan hidup dan respon imun dari udang (Ngo dan Fotedar 2009). Selanjutnya Li et al. (2009) melaporkan bahwa aplikasi sinbiotik dari prebiotik dan probiotik pada udang telah terbukti secara signifikan meningkatkan kelangsungan hidup udang yang ditantang dengan virus WSSV, memodulasi mikrobiota gastro-intestinal dan merangsang respon imun. Penelitian lainnya mengenai aplikasi sinbiotik dilakukan oleh Daniels et al (2010) yaitu pemberian probiotik Bacillus spp ditambahkan prebiotik oligosakarida (MOS) pada lobster (Homarus gammarus L) meningkatkan perumbuhan dan kelangsungan hidup udang.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Maret-Mei 2011 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Udang Uji dan Bakteri Probiotik
Udang uji yang digunakan pada penelitian ini adalah udang vaname L. vannamei dengan berat rata-rata + 3,5 g. Udang dipelihara pada akuarium berukuran 60x35x30 cm3 yang diisi air sebanyak 40 liter dengan kepadatan 10 ekor/akuarium selama 28 hari. Sebelum digunakan dalam perlakuan, udang diadaptasikan terlebih dahulu selama 7 hari dan diberikan pakan komersil dengan kadar protein 40% sebanyak 5 kali sehari. Bakteri probiotik yang digunakan dalam penelitian ini yaitu bakteri Vibrio alginolyticus SKT-b (Widanarni et al.
2003).
Produksi Prebiotik (Oligosakarida) Pembuatan tepung ubi jalar
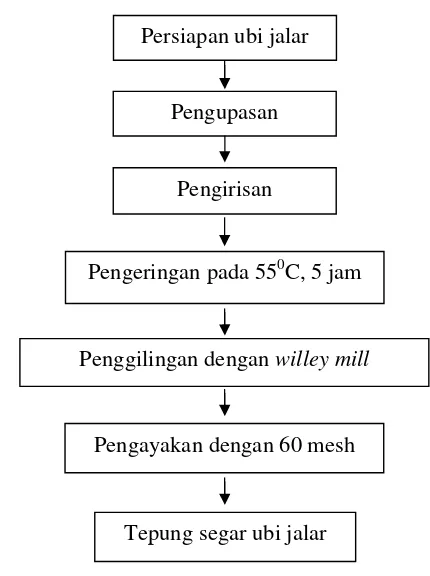
Ubi jalar segar dibersihkan dan dikupas, lalu diiris dengan menggunakan pisau pada ketebalan ±1 mm. Setelah itu, ubi jalar tersebut dikeringkan dalam oven pengering suhu 550C selama 5 jam atau hingga irisan ubi jalar dapat dipatahkan dengan tangan. Irisan ubi jalar kemudian digiling dengan willey mill
Gambar 2. Tahapan pembuatan tepung ubi jalar.
Ekstraksi oligosakarida (Muchtadi 1989)
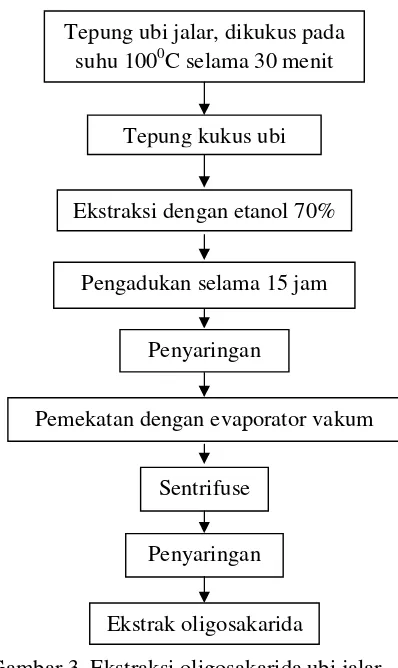
Sebanyak 500 gram tepung ubi jalar ditambahkan air dengan perbandingan 1:1 (w/v) dan dikukus pada suhu 1000C selama 30 menit. Hasil pengukusan tersebut dikeringkan dalam oven pada suhu 550C selama 18 jam. Tepung ubi jalar digiling dan disaring dengan ayakan hingga tepung kukus ubi jalar dapat terkumpul. Pada proses ekstraksi, sebanyak 100 gram tepung kukus ubi jalar disuspensikan ke dalam 1 L etanol 70% dan diaduk selama 15 jam menggunakan
magnetic stirer pada suhu ruang. Penyaringan dilakukan dengan menggunakan kertas saring Whatman no.1 dan residu dibilas dengan menggunakan etanol 70%. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 400C. Hasil pemekatan disentrifuse pada 5000 rpm selama 10 menit untuk mengendapkan kotoran, sehingga ekstrak mudah disterilisasi dengan kertas saring. Tahapan ekstraksi oligosakarida dapat dilihat pada Gambar 3.
Persiapan ubi jalar
Pengupasan
Pengirisan
Pengeringan pada 550C, 5 jam
Penggilingan dengan willey mill
Pengayakan dengan 60 mesh
Gambar 3. Ekstraksi oligosakarida ubi jalar.
Pengukuran konsentrasi oligosakarida (total padatan terlarut)
Total padatan terlarut (TPT) diukur berdasarkan metode Apriyantono et al.
(1989). Pengukuran TPT bertujuan untuk mengetahui kepekatan padatan terlarut prebiotik yang diperlukan pada pengujian in vivo. Cawan porselin dikeringkan selama 2 jam dalam oven bersuhu 1000C, kemudian didinginkan dalam desikator hingga diperoleh berat tetap. Cawan tersebut kemudian ditimbang (a gram). Sebanyak 1 ml oligosakarida yang diekstraksi dari ubi jalar ditempatkan dalam cawan porselen tersebut dan ditimbang (b gram). Kemudian dimasukan ke dalam oven selama 24 jam dengan suhu 1000C. Setelah kering, cawan didinginkan dalam desikator selama 10 menit atau hingga berat cawan stabil, kemudian cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dari hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan. Rumus yang digunakan untuk menghitung TPT yaitu sebagai berikut:
Tepung kukus ubi
Ekstraksi dengan etanol 70%
Pengadukan selama 15 jam
Penyaringan
Pemekatan dengan evaporator vakum
Sentrifuse
Penyaringan
Ekstrak oligosakarida Tepung ubi jalar, dikukus pada
TPT= x 100%
Keterangan: a = berat cawan sebelum diisi ekstrak oligosakarida b = berat cawan setelah diisi ekstrak oligosakarida
c = berat cawan sebelum diisi ekstrak oligosakarida dan dioven 24 jam
Perlakuan dan Rancangan Penelitian
Pengujian ini bertujuan untuk membandingkan efektivitas dari probiotik, prebiotik dan sinbiotik terhadap kelangsungan hidup, respon imun dan pertumbuhan udang vaname. Pengujian ini terdiri dari 5 perlakuan dan 3 kali ulangan sebagai berikut :
P0 (-) : Pemberian pakan tanpa penambahan probiotik dan prebiotik serta tidak diinfeksi bakteri V. harveyi (kontrol (-))
P0 (+) : Pemberian pakan tanpa penambahan probiotik dan prebiotik namun diinfeksi bakteri V. harveyi (kontrol (+))
P1 : Pemberian pakan dengan penambahan probiotik sebesar 1% (Wang 2007) dan diinfeksi bakteri V. harveyi
P2 : Pemberian pakan dengan penambahan prebiotik sebesar 2% (Mahious et al 2006) dan diinfeksi bakteri V. harveyi
P3 : Pemberian pakan dengan penambahan sinbiotik (1% probiotik + 2% prebiotik) dan diinfeksi bakteri V. harveyi
PelaksanaanPenelitian
Uji probiotik, prebiotik dan sinbiotik pada udang
Bakteri probiotik (SKT-b) dengan konsentrasi 106 CFU/ml sebanyak 1% dan prebiotik dengan TPT 5% (Marlis 2008) sebanyak 2% (Mahious et al. 2006) dicampurkan ke dalam pakan dengan menambahkan kuning telur sebesar 2% sebagai perekat. Pencampuran dilakukan dengan cara disemprotkan secara merata menggunakan spuit (Wang 2007), setelah itu pakan dikering-anginkan.
14 hari masa pemeliharaan. Pada hari ke-15 udang dipuasakan dan selanjutnya pada hari ke-16 udang diuji tantang dengan injeksi V. harveyi 0,1 ml/ekor dengan konsentrasi 106 CFU/ml yang merupakan dosis LD50. Setelah di uji tantang, udang dipelihara selama 14 hari dan dilakukan pengamatan mengenai kematian udang. Parameter kualitas air yang diamati selama penelitian meliputi suhu, pH, DO dan amoniak (NH3). Parameter suhu diamati setiap hari, sedangkan DO, pH dan amoniak dilakukan 3 kali yaitu awal, tengah dan akhir penelitian. Untuk menjaga kualitas air pada wadah pemeliharaan, maka dilakukan penyiponan setiap hari sebanyak 10% dari total volume air tiap akuarium.
Parameter Pengamatan
Parameter yang diamati dalam penelitian meliputi tingkat kelangsungan hidup udang, jumlah bakteri dalam usus, parameter respon imun dan
pertumbuhan.
Kelangsungan hidup (survival rate)
Kelangsungan hidup udang diamati 2 minggu selama pemberian probiotik, prebiotik dan sinbiotik serta 2 minggu setelah uji tantang dengan bakteri patogen
V. harveyi. Tingkat kelangsungan hidup udang dihitung dengan menggunakan rumus sebagai berikut:
Keterangan:
SR = Tingkat kelangsungan hidup
Nt = Jumlah udang yang hidup pada akhir pengamatan (ekor) No = Jumlah udang pada awal pengamatan
Populasi bakteri di usus
Populasi bakteri yang dihitung adalah total bakteri Vibrio dalam usus. Organ diambil dan ditimbang, lalu dimasukkan ke dalam larutan PBS dengan perbandingan 1:9. Selanjutnya, organ digerus sampai homogen dengan larutan PBS, lalu diambil sebanyak 0,1 ml dan dilakukan pengenceran bertingkat kemudian dituang dalam cawan petri dengan metode agar tuang pada media TCBS dengan 2 ulangan dan diinkubasi selama 24-48 jam. Pada media TCBS, koloni Vibrio SKT-b berwarna kuning sedangkan koloni V. harveyi berwarna hijau berpendar.
Respon Imun
Pengukuran parameter respon imun udang dilakukan sebanyak 9 kali yaitu hari ke 0, 7 dan 14 setelah perlakuan probiotik, prebiotik dan sinbiotik, serta pada jam ke-6, 12, 24, 72 dan 168 setelah uji tantang. Parameter respon imun yang diukur adalah total hemosit, diferensial hemosit, indeks fagositik dan aktivitas phenoloksidase.
Total hemosit (Blaxhall dan Daishley 1973)
Hemolim diambil sebanyak 0,1 ml dibagian pangkal kaki jalan ke 5 dengan syringe 1 ml yang sudah berisi antikoagulan Na-sitrat sebanyak 0,3 ml, kemudian dihomogenkan selama 5 menit. Tetesan pertama hemolim pada syringe dibuang, selanjutnya hemolim diteteskan ke haemositometer dan dihitung jumlah selnya per ml dibawah mikroskop cahaya dengan perbesaran 40 kali. Total hemosit dihitung dengan menggunakan rumus :
! Keterangan:
FP = Faktor Pengenceran
Diferensial hemosit (Martin dan Graves 1995)
Hemolim yang telah diambil dari udang uji diteteskan pada gelas objek dan dibuat ulasan, kemudian dikeringudarakan dan difiksasi dengan metanol 100% selama 5 menit. Setelah itu dikeringudarakan kembali dan diwarnai dengan larutan giemsa 10% selama 10 menit, dicuci dalam air mengalir selama 30 detik dan dibiarkan kering. Preparat diamati menggunakan mikroskop cahaya dengan perbesaran 100 kali dan dibedakan menurut jenisnya yaitu sel hialin, semi granular dan granular. Persentase jenis hemosit dihitung dengan menggunakan rumus :
! " # " $ % # "
Indeks fagositik (Anderson dan Siwicki 1993)
dikeringkan. Fiksasi dengan metanol 100% selama 5 menit dan diwarnai dengan giemsa selama 15 menit. Indeks fagositik diukur berdasarkan persentase sel-sel fagosit yang melakukan fagositosis. Indeks fagositik dihitung dengan menggunakan rumus :
&"' ( ) # * ( )# * ( ) " ( )
Aktivitas phenoloksidase (PO) (Liu dan Chen 2004)
Aktivitas phenoloksidase diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Pengukuran PO dikerjakan berdasarkan prosedur yang dikemukakann oleh Liu dan Chen (2004). Pertama, 0,1 ml campuran hemolim ditambah 0,9 ml antikoagulan disentrifuse pada 1000 rpm selama 20 menit pada temperatur 4 0C. Kemudian supernatan dikeluarkan dan pellet disuspensikan kembali secara perlahan-lahan ke dalam larutan cacodylate-citrate buffer (0,01 M sodium cacodylate; 0,45 M sodium choride; 0,10 M trisodium citrate, pH 7) dan disentrifuse kembali. Pellet kemudian diambil dan disuspensikan dalam 200 µl cacodylate buffer (0,01 M sodium cacodylate; 0,45 M sodium choride; 0,01 M calcium chloride; 0,26 M magnesium chloride; pH 7). Setelah itu, 100 µl aliquot diinkubasi dengan 50 µl trypsin (1 mg/ml cacodylate buffer) sebagai aktifator selama 10 menit pada temperatur 25-26 0C. Selanjutnya ditambahkan 50 µl L-DOPA (3mg/ml cocadylate buffer), setelah 5 menit, ditambahkan 800 µl cacodylate buffer. Optical density (OD) diukur dengan menggunakan spektrofotometer pada panjang gelombang 490 nm. Larutan standar mengandung 100 µl suspensi hemosit, 50 µl cacodylate buffer (pengganti trypsin) dan 50 µl L-DOPA digunakan untuk mengukur background aktivitas PO pada semua larutan uji. OD dari aktivitas PO pada semua kondisi uji dinyatakan sebagai formasi dopacrome dalam 50 µl hemolim.
Laju pertumbuhan harian (SpecificGrowthRate)
Laju pertumbuhan harian dihitung dengan menggunakan formula dibawah ini (Huisman 1987):
+ ,-1 .0./ 2 3
Keterangan :
SGR = Laju pertumbuhan harian (SpecificGrowthRate) (%) Wt = Bobot rata-rata udang pada akhir perlakuan (g) Wo = Bobot rata-rata udang pada awal pemeliharaan (g) t = Periode pemeliharaan (hari)
Analisis Statistik
Penelitian ini menggunakan rancangan percobaan berupa Rancangan Acak Lengkap yang terdiri dari lima perlakuan dan tiga ulangan. Data yang diperoleh dianalisis dengan menggunakan program SPSS 17. Untuk melihat perbedaan perlakuan maka dilakukan uji lanjut dengan uji Duncan pada selang kepercayaan 95%.
HASIL DAN PEMBAHASAN
Kelangsungan Hidup
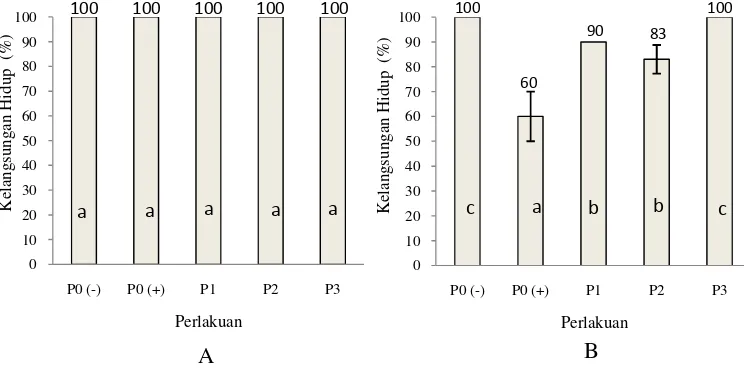
Selama penelitian, tingkat kelangsungan hidup udang vaname diamati dalam dua tahap yaitu pada akhir perlakuan pemberian probiotik, prebiotik dan sinbiotik serta pasca uji tantang dengan bakteri V. harveyi (Gambar 4)
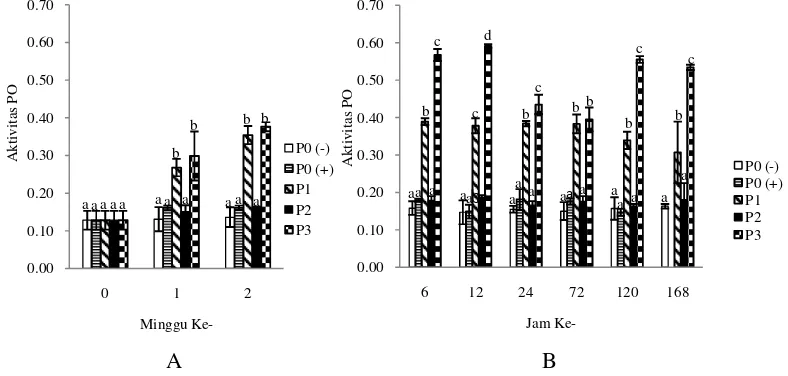
Gambar 4 Tingkat kelangsungan hidup udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang dengan bakteri patogen V. harveyi (B).
Hasil pengamatan tingkat kelangsungan hidup udang vaname selama 14 hari perlakuan probiotik, prebiotik dan sinbiotik tidak berbeda nyata untuk semua perlakuan dengan nilai masing-masing 100%. Namun, pasca infeksi bakteri patogen V.harveyi diketahui bahwa perlakuan P0(+) berbeda nyata (P>0,05) dengan perlakuan P0(-), P1, P2 dan P3 (Gambar 4 dan Lampiran 1). Kelangsungan hidup tertinggi diperoleh pada perlakuan P0(-) dan P3 yaitu sebesar 100%, lalu diikuti perlakuan P1 (90%), P2 (83%) dan P0(+) (60%). Tingginya kelangsungan hidup pada perlakuan P3, P1 dan P2 diduga karena sinbiotik, probiotik dan prebiotik yang diberikan dapat meningkatkan respon imun udang dalam menghadapi serangan V. harveyi.
Populasi Bakteri dalam Usus
Keberhasilan probiotik, prebiotik dan sinbiotik dalam meningkatkan populasi bakteri di dalam saluran pencernaan udang vaname digambarkan dengan jumlah total bakteri di usus. Hasil pengamatan akhir perlakuan pakan menunjukkan adanya peningkatan jumlah bakteri Vibrio di dalam usus setelah pemberian probiotik, prebiotik dan sinbiotik (Tabel 1). Hasil ini menunjukkan bahwa penambahan probiotik, prebiotik dan sinbiotik dalam pakan mampu menstimulir pertumbuhan, aktivitas dan dominansi bakteri. Nayak (2010) menyatakan bahwa pemberian probiotik yang didukung dengan pemberian nutrien lain (prebiotik) secara selektif mampu mendorong aktivitas pertumbuhan dari satu atau lebih mikroorganisme tertentu pada inang.
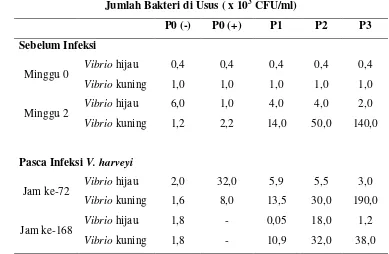
Tabel 1 Total bakteri Vibrio di usus
Jumlah Bakteri di Usus ( x 103 CFU/ml)
P0 (-) P0 (+) P1 P2 P3
Sebelum Infeksi
Minggu 0 Vibrio hijau 0,4 0,4 0,4 0,4 0,4
Vibrio kuning 1,0 1,0 1,0 1,0 1,0
Minggu 2 Vibrio hijau 6,0 1,0 4,0 4,0 2,0
Vibrio kuning 1,2 2,2 14,0 50,0 140,0
Pasca Infeksi V. harveyi
Jam ke-72 Vibrio hijau 2,0 32,0 5,9 5,5 3,0
Vibrio kuning 1,6 8,0 13,5 30,0 190,0
Jam ke-168 Vibrio hijau 1,8 - 0,05 18,0 1,2
Vibrio kuning 1,8 - 10,9 32,0 38,0 *- tidak ada udang sampel
perlakuan ini adanya penambahan probiotik Vibrio SKT-b koloni kuning dan prebiotik sehingga kelangsungan hidup bakteri disini lebih baik. Vibrio hijau terbanyak terdapat pada perlakuan P0(+) sebanyak 32,0 x 103 CFU/ml diduga karena pada perlakuan ini tidak diberi probiotik dan prebiotik, sehingga koloni bakteri Vibrio hijau disini sebagian besar adalah bakteri V. harveyi yang diinfeksikan dan tumbuh baik di dalam tubuh udang.
Respon Imun Udang
Kelangsungan hidup udang pasca infeksi V. harveyi menunjukkan perbedaan yang signifikan antara perlakuan pemberian probiotik, prebiotik, sinbiotik dan kontrol positif. Kelangsungan hidup udang yang tinggi umumnya dapat menggambarkan status kesehatan udang yang baik. Respon imun yang menggambarkan status kesehatan udang dapat ditunjukkan oleh beberapa pengukuran parameter respon imun yaitu total hemosit, diferensial hemosit, indeks fagositik dan aktivitas phenoloksidase (PO).
Total hemosit
Hemosit memainkan peranan penting dalam sistem imun krustasea. Hemosit berperan dalam fagositosis, enkapsulasi, degranulasi dan agregasi nodular terhadap patogen atau partikel asing (Sahoo et al. 2008). Berdasarkan Gambar 5 terlihat adanya peningkatan total hemosit pada minggu ke-1 dan ke-2 selama perlakuan probiotik, prebiotik dan sinbiotik. Peningkatan jumlah total hemosit minggu 1 dan 2 tertinggi diperoleh pada perlakuan P3 sebesar 4,37±0,13 (106 sel/ml) dan 5,74±0,03 (106 sel/ml). Hasil uji statistik perlakuan, P3 berbeda nyata dengan P0(-), P0(+), P1 dan P2 (P<0,05). Hal ini membuktikan bahwa pemberian sinbiotik dalam pakan berpengaruh signifikan terhadap peningkatan jumlah hemosit yang berarti peningkatan status kesehatan udang. Penelitian Ngo dan Fotedar (2009) mengenai pemberian imunostimulan baik prebiotik (Bio-Mos® dan -1,3-D glucan) atau probiotik (Pseudomonas synxantha dan P. aeruginosa) dalam pakan pada udang Penaeus latisulcatus dapat meningkatkan pertumbuhan, kelangsungan hidup dan respon imun.
Gambar 5 Total hemosi prebiotik da patogen V. h
Pasca infeksi bak jam ke-6, 12 dan 24 terj 24 tertinggi diperoleh p sel/ml); 8,6±0,08 (10
V.harveyi yaitu perlaku 5,59±0,07 (106 se/ml), P (106 se/ml) dan terus me Penurunan hemosit pada telah berkurang didalam pada jam ke-120 dan 16
mosit udang vaname selama perlakuan penambahan dan sinbiotik (A) dan pasca uji tantang denga
. harveyi (B).
bakteri patogen V. harveyi secara umum terlihat ba erjadi peningkatan hemosit. Total hemosit jam ke
pada perlakuan P3 berturut turut sebesar 8,06± 106 se/ml) dan 9,32±0,05 (106 se/ml). Hasil u
6, 12 dan 24 total hemosit pada perlakuan P0 (+ , P3 (P<0,05), kecuali pada jam ke-12 P0 (+) da 5). Peningkatan jumlah hemosit pada jam ke-6, 1 i patogen V. harveyi, tubuh udang memproduks untuk pertahanannya melawan patogen/benda a
mengalami penurunan drastis pada jam ke-72 pas akuan P0(+) sebesar 3,41±0,05 (106 se/ml), P ), P2 sebesar 4,87±0,04 (106 se/ml), P3 sebesar
mengalami peningkatan kembali pada jam ke-120 ada jam ke-72 diduga virulensi bakteri patogen am tubuh udang dan peningkatan kembali jumla 168 diduga tubuh udang telah kembali normal
). kontrol negatif; P0 (+). kontrol positif; P1. pr rebiotik; P3. sinbiotik. Jam ke-168 tidak ada lag el pada perlakuan P0(+). Huruf superskrip yang b njukkan hasil yang berbeda nyata (P<0,05)
memproduksi sel-sel hemosit. Selain itu, penurunan jumlah sel-sel hemosit dapat juga dipengaruhi oleh kegiatan molting udang (Moullac et al. 1998).
Diferensial hemosit
Berdasarkan bentuk, ukuran dan inti selnya, hemosit dapat dibedakan menjadi 3 jenis sel yaitu sel hialin (agranular), semi granular dan granular. Namun, pengamatan jumlah sel diferensial hemosit pada penelitian ini hanya dibedakan menjadi sel hialin dan sel granular (sel semi granular digabung dengan sel granular karena sama-sama memiliki granul) untuk memudahkan membedakan sel-sel dibawah mikroskop. Dalam respon imun udang, sel semi granular berperan dalam aktivitas fagositosis, enkapsulasi, proPO dan sitotoksis (Smith et al. 2003). Peningkatan total hemosit sebelum uji tantang dalam penelitian ini berarti meningkatkan peluang terbentuknya sel-sel hemosit yaitu sel hialin dan sel granular yang memiliki fungsi masing-masing.
Persentase jumlah sel hialin selama pengamatan dalam penelitian berkisar 20,08-46,13%. Hasil uji statistik menunjukkan perlakuan P1, P2 dan P3 berbeda nyata terhadap P0(-) dan P0(+) sebelum infeksi V.harveyi (P<0,05). Persentase tertinggi jumlah sel hialin baik minggu 1 maupun minggu 2 diperoleh pada perlakuan P3 sebesar 39,90±0,03 dan 46,13±0,06%. Peningkatan sel hialin ini biasanya dihubungkan dengan peningkatan resistensi terhadap patogen (Moullac
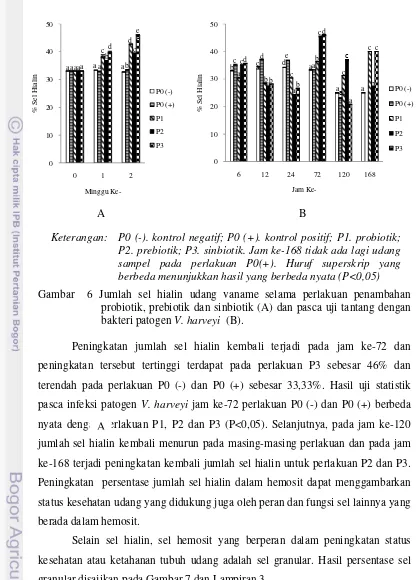
et al. 1998). Johansson et al. (2000) mengatakan bahwa sel hialin berperan melakukan fagositosis dalam imunitas. Hasil persentase jumlah sel hialin selama penelitian disajikan pada Gambar 6 dan Lampiran 3
Pasca infeksi V. harveyi terjadi penurunan jumlah sel hialin pada jam ke-6, 12 dan 24 pada perlakuan P1, P2 dan P3. Jumlah sel hialin terendah terdapat pada jam ke-24 pada perlakuan P2 sebesar 24,28±0,04% dan tertinggi pada perlakuan P1 sebesar 30,39±0,04%. Hasil uji statistik pasca infeksi jam ke-6, perlakuan P0 (+) tidak berbeda nyata dengan perlakuan P2 (P>0,05), namun berbeda nyata dengan P0(-), P1 dan P3 (P<0,05). Uji statistik jam ke-12 perlakuan P1 dan P3 berbeda nyata dengan perlakuan P0 (-), P0 (+) dan P2 (P<0,05).
Gambar 6 Jumlah sel hialin udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang dengan bakteri patogen V. harveyi (B).
Peningkatan jumlah sel hialin kembali terjadi pada jam ke-72 dan peningkatan tersebut tertinggi terdapat pada perlakuan P3 sebesar 46% dan terendah pada perlakuan P0 (-) dan P0 (+) sebesar 33,33%. Hasil uji statistik pasca infeksi patogen V. harveyi jam ke-72 perlakuan P0 (-) dan P0 (+) berbeda nyata dengan perlakuan P1, P2 dan P3 (P<0,05). Selanjutnya, pada jam ke-120 jumlah sel hialin kembali menurun pada masing-masing perlakuan dan pada jam ke-168 terjadi peningkatan kembali jumlah sel hialin untuk perlakuan P2 dan P3. Peningkatan persentase jumlah sel hialin dalam hemosit dapat menggambarkan status kesehatan udang yang didukung juga oleh peran dan fungsi sel lainnya yang berada dalam hemosit.
Selain sel hialin, sel hemosit yang berperan dalam peningkatan status kesehatan atau ketahanan tubuh udang adalah sel granular. Hasil persentase sel granular disajikan pada Gambar 7 dan Lampiran 3.
Keterangan: P0 (-). kontrol negatif; P0 (+). kontrol positif; P1. probiotik; P2. prebiotik; P3. sinbiotik. Jam ke-168 tidak ada lagi udang sampel pada perlakuan P0(+). Huruf superskrip yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
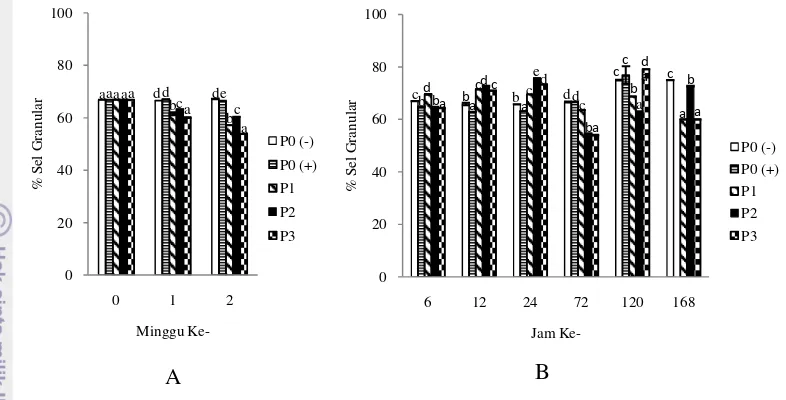
Gambar 7 Jumlah sel granular udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca uji tantang dengan bakteri patogen V. harveyi (B)
Hasil uji statistik jumlah sel granular minggu 1 dan 2 perlakuan P0, P1, P2, dan P3 berbeda nyata (P<0,05). Jumlah sel granular selama penelitian perlakuan pemberian probiotik, prebiotik dan sinbiotik berkisar 57,19±0,05-79,17±0,04%. Persentase jumlah sel granular dalam hemosit berkaitan erat dengan persentase jumlah sel hialin. Penurunan persentase jumlah sel hialin dalam hemosit akan berdampak pada peningkatan jumlah sel granular, sebaliknya peningkatan jumlah sel hialin akan berdampak pada penurunan persentase jumlah sel granular. Pasca infeksi V.harveyi jumlah sel granular tertinggi terdapat pada jam ke-120 pada perlakuan P3 sebesar 79,17% dan terendah terdapat pada jam ke-72 pada perlakuan P3 sebesar 54,00%.
Berdasarkan grafik pada Gambar 7 secara umum dapat dilihat bahwa pasca infeksi V.harveyi terjadi penurunan jumlah sel granular pada jam ke-72 pada masing-masing perlakuan. Li et al. (2008) mengatakan jumlah sel hialin dan sel granular L. vannamei yang diinjeksi V. alginolyticus 1,8 x 105 CFU/udang mengalami penurunan jumlah sel berturut-turut 18% dan 33% setelah 12 jam
A B
Keterangan: P0 (-). kontrol negatif; P0 (+). kontrol positif; P1. probiotik; P2. prebiotik; P3. sinbiotik. Jam ke-168 tidak ada lagi udang sampel pada perlakuan P0(+). Huruf superskrip yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
infeksi. Waktu yang dip
diperlukan sel hialin dan granular untuk mencap ada spesies bakteri, dosis yang diberikan, spesies g uji.
sitosis merupakan reaksi pertahanan seluler pali ni sebagai upaya untuk mempertahankan diri dari menghancurkan antigen secara nonspesifik mela
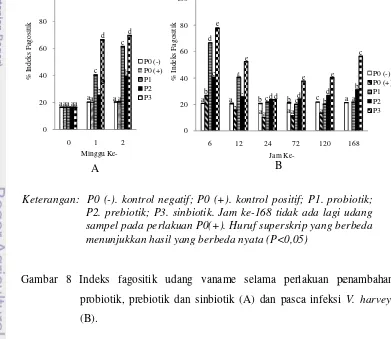
ata yang diperoleh selama dua minggu perlakuan ik, indeks fagositik terus meningkat dengan ni apat pada perlakuan P3 sebesar 69,78±0,28% (Ga
fagositik udang vaname selama perlakuan pe , prebiotik dan sinbiotik (A) dan pasca infeksi
B
kontrol negatif; P0 (+). kontrol positif; P1. prob biotik; P3. sinbiotik. Jam ke-168 tidak ada lagi u pada perlakuan P0(+). Huruf superskrip yang be
ukkan hasil yang berbeda nyata (P<0,05)
Pasca infeksi V. harveyi, kemampuan sel hemosit memfagosit mengalami peningkatan yang paling tinggi pada jam ke-6 dan kemudian jam berikutnya mulai mengalami penurunan serta kembali meningkat pada jam ke-120 dan 168. Penurunan aktivitas fagosistosis pada udang disebabkan oleh berkurangnya sel-sel fagositik dalam hemolim. Sel-sel fagositik dapat berkurang dalam hemolim karena dalam aktivitas fagositosis, sel-sel fagositik sebagian akan hancur bersama dengan bakteri setelah melewati berbagai proses fagositosis. Peningkatan indeks fagositik tertinggi pada jam ke-6 diduga karena hemosit mulai beraksi melawan patogen V. harveyi yang masuk ke tubuh udang sebelum bakteri mengeluarkan virulensinya. Hasil uji statistik menunjukkan indeks fagositik berbeda nyata antara perlakuan P1 dan P3 dengan P0 dan P2 (P<0,05) pasca infeksi. Indeks fagositik perlakuan P3 tertinggi pada setiap jam pengamatan, hal ini mengindikasikan bahwa respon imun pada perlakuan P3 lebih baik. Li et al. (2009) menyatakan peningkatan aktivitas fagositosis pada Litopenaeus vannamei yang diberi probiotik Bacillus OJ dan isomaltooligosakarida lebih tinggi (28%) dibandingkan kontrol (23%).
Aktivitas phenoloksidase (PO)
Phenoloksidase merupakan enzim yang berperan dalam proses melanisasi pada krustasea sebagai respon terhadap penyerang asing. Peningkatan aktivitas phenoloksidase dari hasil pengamatan mengindikasikan bahwa bakteri probiotik mampu menstimulasi hemosit udang hingga terbentuknya aktivitas phenoloksidase. Perlakuan sinbiotik memiliki aktivitas PO yang lebih tinggi dibandingkan perlakuan lainnya. Hasil uji statistik aktivitas PO berbeda nyata antara P0(-), P0(+), P2 dengan P1, P3 (P<0,05). Kisaran aktivitas PO selama perlakuan pemberian probiotik, prebiotik dan sinbiotik sebesar 0,131±0,03-0,376±0,01 (Gambar 9 dan Lampiran 5). Meningkatnya aktivitas PO akan meningkatkan kemampuan udang untuk lebih mengenal partikel asing yang masuk kemudian dilakukan fagositosis. Meningkatnya aktivitas fagositosis mengindikasikan peningkatan daya tahan tubuh udang melawan patogen yang masuk ke dalam tubuhnya.
Gambar 9 Aktivitas phenoloksidase (PO) udang vaname selama perlakuan penambahan probiotik, prebiotik dan sinbiotik (A) dan pasca infeksi
V. harveyi (B).
Berdasarkan grafik pada Gambar 9, diketahui selama 2 minggu perlakuan probiotik, prebiotik dan sinbiotik terjadi kenaikan aktivitas PO. Setelah infeksi V. harveyi secara umum juga masih terjadi peningkatan aktivitas PO sampai jam ke-12 dan setelah itu turun pada jam ke 24 dan 72. Hal ini diduga pada jam ke-6 sampai 12 pasca infeksi V. harveyi, aktivitas PO terus naik karena sebagai perlawanan terhadap benda asing/patogen. Aktivitas PO tertinggi diperoleh pada perlakuan P3 dan kemudian diikuti perlakuan P1. Hal ini karena pada perlakuan pakan P3 dan P1 sama-sama diberi probiotik SKT-b, diduga bakteri probiotik ini mampu menstimulasi hemosit udang hingga terbentuknya aktivitas phenoloksidase. Rengpipat et al. (2000) melaporkan adanya peningkatan pada aktivitas phenoloksidase ketika udang Penaeusmonodon diberi bakteri probiotik
Bacillus S11. Demikian juga Li et al. (2009) mengatakan adanya peningkatan aktivitas PO pada Litopenaeus vannamei yang diberi probiotik Bacillus OJ dan isomaltooligosakarida dari 1,1 menjadi 1,5.
Keterangan: P0 (-). kontrol negatif; P0 (+). kontrol positif; P1. probiotik; P2. prebiotik; P3. sinbiotik. Huruf superskrip yang berbeda menunjukkan hasil yang berbeda nyata (P<0,05)
Laju Pertumbuhan Harian
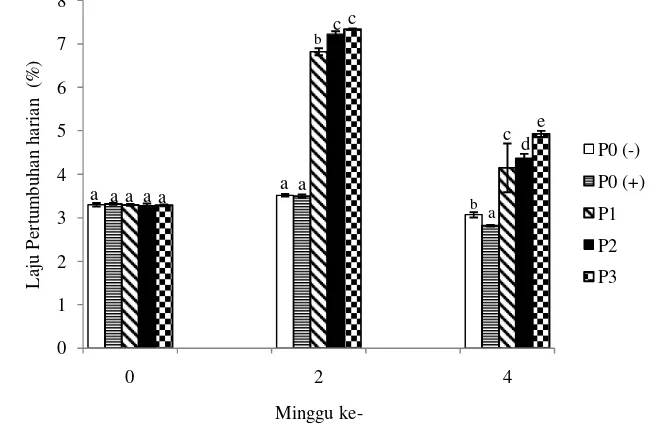
Pertumbuhan merupakan pertambahan ukuran baik bobot maupun panjang dalam suatu periode atau waktu tertentu. Hasil penelitian menunjukkan bahwa pemberian probiotik, prebiotik dan sinbiotik memacu pertumbuhan udang (Gambar 10).
Gambar 10 Laju pertumbuhan harian (SGR) udang vaname selama 2 minggu perlakuan penambahan probiotik, prebiotik dan sinbiotik dan 2 minggu setelah infeksi V. harveyi. (minggu ke- 0, 2 dan 4).
Laju pertumbuhan udang selama 4 minggu pemeliharaan (2 minggu perlakuan pemberian probiotik, prebiotik dan sinbiotik dan 2 minggu pasca infeksi bakteri patogen V. harveyi), udang yang diberi probiotik, prebiotik dan sinbiotik pertumbuhannya lebih baik daripada kontrol (Gambar 10 dan lampiran 6). Hal ini diduga pemberian probiotik, prebiotik dan sinbiotik pada udang mampu meningkatkan mikroflora usus sehingga pakan dapat dimanfaatkan dengan baik untuk pertumbuhan dengan menghasilkan enzim pencernaan. Chamberlain et al. (2001) mengatakan bahwa enzim-enzim yang dihasilkan bakteri akan meningkatkan proses pencernaan spesies akuakultur.
Berdasarkan grafik laju pertumbuhan harian di atas dapat dilihat bahwa persen laju pertumbuhan tertinggi terdapat pada minggu ke-2 yaitu selama
pemberian probiotik, prebiotik dan sinbiotik untuk semua perlakuan. Nilai laju pertumbuhan bobot harian tertinggi dari 5 perlakuan pakan diperoleh pada perlakuan pakan dengan penambahan sinbiotik (P3) sebesar 7,34±0,02 % yang berarti bahwa pemberian sinbiotik lebih mampu meningkatkan pertumbuhan udang vaname dibandingkan pemberian probiotik dan prebiotik. Selanjutnya, secara berturut-turut laju pertumbuhan harian udang minggu ke-2 dari tinggi ke rendah adalah pada perlakuan dengan penambahan prebiotik (P2) sebesar 7,22±0,05%, perlakuan dengan penambahan probiotik (P1) sebesar 6,82 ± 0,08%, perlakuan dengan pakan kontrol negatif (P0(-)) sebesar 3,52±0,03% dan perlakuan dengan pakan kontrol positif (P0 (+)) sebesar 3,5±0,04%. Hasil uji statistik laju pertumbuhan udang berbeda nyata antara perlakuan P0(-) dan P0(+) dengan P1, P2 dan P3 (P<0,05).
Tingginya laju pertumbuhan pada perlakuan sinbiotik diduga karena pemberian sinbiotik (probiotik + prebiotik) lebih mampu menstimulir pertumbuhan bakteri menguntungkan yang membantu pencernaan di dalam usus inang (baik bakteri probiotik Vibrio SKT-b yang diberikan maupun bakteri menguntungkan lainnya yang sudah terlebih dahulu ada di dalam usus), sehingga disini pemanfaatan nutrien dari pakan lebih optimal. Penelitian Daniels et al.
(2010) menyatakan bahwa pemberian probiotik Bacillus spp. ditambah prebiotik
mannan oligosaccharides (MOS) pada lobster (Homarus gammarus L) dapat meningkatkan laju pertumbuhan harian udang (6,59±0,10%/hari) dibandingkan pemberian Bacillus spp. (5,09±0,11%/hari), pemberian MOS (5,27±0,09%/hari) dan kontrol (4,25±0,20%/hari).
pertumbuhan harian udang minggu ke-4 dari tinggi ke rendah adalah pada perlakuan dengan penambahan sinbiotik (P3) sebesar 4,93±0,07%, prebiotik (P2) sebesar 4,37±0,10%, perlakuan dengan penambahan probiotik (P1) sebesar 4,15±0,56 %, perlakuan dengan pakan kontrol negatif (P0(-)) sebesar 3,07±0,06% dan perlakuan dengan pakan kontrol positif (P0 (+)) sebesar 2,82±0,02%.
Kualitas Air
Kualitas air yang diamati selama penelitian adalah suhu, oksigen terlarut (DO), pH, salinitas dan Total Amoniak Nitrogen (TAN). Pengukuran dilakukan pada awal, tengah dan akhir penelitian. Kisaran nilai parameter kualitas air selama penelitian disajikan pada Tabel 2 berikut ini.
Tabel 2. Kisaran kualitas air media pemeliharaan udang vaname selama penelitian
Parameter kualitas air
Kualitas air selama
penelitian SNI 2006
Suhu (0C) 26 – 28 28,5- 31,5
pH 7,21 - 7,44 7,5 - 8,5
Salinitas (ppt) 25 – 26 15 - 35
DO (mg/l) 5,1 - 5,7 > 3,5
TAN (ppm) 0.004 - 0,007 < 0,01
Berdasarkan Tabel 2 diatas terlihat bahwa kualitas air media pemeliharaaan udang vaname selama penelitian masih berada pada kisaran yang ideal untuk pemeliharaan udang vaname.
KESIMPULAN DAN SARAN
Kesimpulan
Penambahan probiotik, prebiotik dan sinbiotik dalam pakan mampu meningkatkan respon imun udang vaname. Penambahan sinbiotik dalam pakan menghasilkan kelangsungan hidup 100% dan respon imun tertinggi (total hemosit 3,36±0,05-9,32±0,05 (106 sel/ml); indeks fagositik 16,48±0,14-77,55±0,22%; dan aktivitas phenoloksidase 0,128±0,03-0,591±0,01) dibandingkan kontrol positif yang menghasilkan kelangsungan hidup 60% dan respon imun terendah (total hemosit 3,15±0,16-4,53±0,33x106 sel/ml; indeks fagositik 10,15±0,10-20,78±0,34%; dan aktivitas phenoloksidase 0,128±0,03-0,181±0,03).
Saran
DAFTAR PUSTAKA
Anderson DP and Siwicki AK. 1993. Basic Haemotology and Serology for Fish Health Program. Paper Presented in Second Symposium on Disease in Asian Aquaculture ”Aquatic Animal Health and the Eviroment” Phuket, Thailand. 25-29th October 1993.
[AOAC] Association of Official Agriculture Chemists 1999. Official Methods of Analysis. 16th ed Volume II. Maryland.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, Budiyanti. 1989. Petunjuk Laboratorium Pengujian Pangan. Bogor: IPB Press.
Baumann P, Furniss AL, Lee JV. 1994. Facultative Anaerobic Gram Negative Rods. Di dalam: Holt JG, Krieg NR, Sneath PHA, Staley JT, Wilkins ST, editor. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltimore: The Williams and Wilkins. Hal 175-289.
Blaxhall PC and Daisley KW. 1973. Routine Haematological Methods for Use with Fish Blood. JournalFishBiology 5:577-581.
Bloemberg GV, Toole GAO, Lugtenberg BJJ, Kolter R. 1993. Green Fluorescent Protein as a Marker for Pseudomonas spp. Appl Environ Microbiol
63:4543-4551.
Chamberlain G, Avnimelech Y, Mclntosh RP, Velasco M. 2001. Advantages of Aerated Microbial Reuse Systems with Balanced C/N: Nutrient Transformation and Water Quality Benefits. The Advocate April 2001: 53-56.
Collins WW and Gibson GR. 1999. Prebiotic, Probiotic and Synbiotic: Approaches for Modulating the Microbial Ecology of the Gut. Am. J Clin. Nutr 69(5):1052S-1057S.
Daniels CL, Merrifield DL, Boothroyd DP, Davies SJ, Factor JR, Arnold KE. 2010. Effect of Dietary Bacillus spp. and Mannan Oligosaccharides (MOS) on European Lobster (Homarus gammarus L.) Larvae Growth Performance, Gut Morphology and Gut Microbiota. Aquaculture 304: 49-57.
Dohail MA, Roshada H, Mohammed AP. 2009. Effect of the Probiotic
Lactobacillus acidophilus on the Growth Performance Haematology Parameters and Immunoglobulin Concentration in African Catfish (Clarias gariepinus, Burchell 1822) Fingerling. Aquaculture Research 40: 1642-1652.
Fuller R. 1992. History and Development of Probiotic. didalam Fuller R, editor. Probiotic the Scientic Basis. London ChapmanandHall 1-8.
Fontaine CT and Lightner DV. 1974. Observation on Phagocytosis and Elimination of Carmine Particle Injected into the Abdominal Musculature of the White Shrimp. J. Invertebrate Pathology 5:11-40.
Gatesoupe FJ. 1999. Review the Use of Probiotics in Aquaculture. Aquaculture
180:147–165.
Gibson, GR and Roberfroid MB. 1995. Dietary Modulation of the Human Colonic
Microbiota: Introducing the Concept of Prebiotics. J. Nutr 125: 1401–
1412.
Gibson GR and Fuller R. 2000. Aspects of in Vitro and in Vivo Research Approaches Directed Toward Identifying Probiotics and Prebiotics for Human Use. J. Nutr 130:319S-395S.
Gullian M, Thompson F, Rodriguez J. 2004. Selection of Probiotic and Study of Their Immunostimulatory Effect in Penaeus vannamei. Aquaculture 233: 1-14.
Harris LJ and Owens L. 1999. Production of Exotoxins by Two Luminous Vibrio harveyi Strains Known to be Primary Pathogens of Penaeus monodon
Larvae. Dis Aquat Org 38:11-22s.
Huisman EA. 1987. Principles of Fish Production. Department of Fish Culture and Fisheries, Wageningen Agriculture University, Netherland. 170p.
Irianto, A. 2003. Probiotik Akuakultur. Gajah Mada University Press. Yogyakarta.
Johansson MW and Soderhall K. 1989. Cellular Immunity in Crustaceans and the proPO System. Parasitology Today 5: 171-176.
Johansson MW, Keyser P, Sritunyalucksana K, Soderhall K. 2000. Crustacean Haemosytes and Haematopoiesis. Aquaculture 191 : 45-92.
Lavilla-Pitogo CR, Baticados MCL, Cruz-Lacierda ER, De La Pena LD. 1990. Occurrence of Luminous Bacterial Diseases of Penaeus monodon Larvae in the Philiphines. Aquaculture 91:1-13.
Li CC, Yeh ST, Chen JC. 2008. The Immune Response of White Shrimp
Litopenaeus vannamei Following Vibrio alginolyticus Injection.