Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
PEMERIKSAAN KETERSEDIAAN HAYATI
DARI TABLET IBUPROFEN PADA HEWAN KELINCI
SKRIPSI
Oleh:
RIKHA SARAH
NIM 060824053
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
LEMBAR PENGESAHAN
SKRIPSI
PEMERIKSAAN KETERSEDIAAN HAYATI DARI TABLET IBUPROFEN PADA HEWAN KELINCI
OLEH:
RIKHA SARAH
NIM 060824053
Medan, Agustus 2009 Disetujui Oleh: Disahkan Oleh:
Pembimbing I, Dekan,
(Prof.Dr.M.Timbul Simanjuntak,MSc.,Apt.) (Prof.Dr.Sumadio Hadisahputra,Apt.) NIP 195212041980021001 NIP 195311281983031002
Disetujui Oleh:
Pembimbing II,
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
KATA PENGANTAR
Segala puji dan syukur penulis ucapkan ke hadirat Allah SWT atas segala nikmat dan rahmat yang tak terhingga sehingga penulis dapat melaksanakan penelitian dan menyelesaikan penulisan skripsi yang berjudul “Pemeriksaan Ketersediaan Hayati dari Tablet Ibuprofen pada Hewan Kelinci”. Skripsi ini
disusun untuk melengkapi salah satu syarat mencapai gelar sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Terima kasih yang tiada terhingga dan penghargaan yang setinggi-tingginya penulis sampaikan kepada ayahanda Khairul dan ibunda Rita Sufleni atas segala doa, kasih saying dan dukungan moril serta materil yang diberikan kepada penulis selama ini.
Dengan segala ketulusan hati penulis juga menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan yang telah memberikan pengarahan dan bimbingan dalam menyelesaikan skripsi ini.
2. Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt. dan Bapak Drs. Fathur Rahman M.Si., Apt., yang telah membimbing penulis hingga selesainya penulisan skripsi ini.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
4. Bapak Prof. Dr. Jansen Silalahi, M.App Sc., Apt. selaku penasehat akademik yang selalu memberikan bimbingan kepada penulis selama masa perkuliahan.
5. Bapak staf dan para asisten Laboratorium Biofarmasi dan Laboratorium Farmakologi Fakultas Farmasi USU yang telah memberikan fasilitas laboratorium selama penulis melakukan penelitian.
6. Saudara-saudara penulis M. Iqsas Fadillah, M. Radifan, Aina Mardiah dan seluruh keluarga yang selalu memberikan bantuan, kasih sayang dan doa yang tiada hentinya kepada penulis.
7. Sahabat-sahabat penulis dan rekan-rekan mahasiswa farmasi ekstensi stambuk 2006 Leli, Helvi, Nanda, Kak Aing, Fatimah, Tati, Bang Umri, Bang Ipul, Bang Rusman serta seluruh pihak yang telah memberikan bantuan, motivasi dan inspirasi bagi penulis selama masa perkuliahan sampai penyusunan skripsi. Semoga Allah SWT memberikan balasan yang berlipat ganda atas jasa-jasa besar mereka.
Penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari kesempurnaan, sehingga penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Agustus 2009 Penulis
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
ABSTRAK
Istilah ketersediaan hayati zat aktif suatu obat timbul sejak adanya ketidaksetaraan terapetik diantara sediaan bermerek dagang yang mengandung zat aktif yang sama dan dalam bentuk sediaan yang sama, serta diberikan dengan dosis yang sama.
Ibuprofen adalah satu dari obat paling aman untuk pengobatan nyeri, inflamasi dan demam. Ibuprofen merupakan obat yang termasuk ke dalam kelompok AINS (anti inflamasi non steroid). Tujuan dari penelitian ini adalah untuk mengetahui ketersediaan hayati dari tablet ibuprofen pada kelinci dan mengetahui bioekivalensi dari ibuprofen generik Indofarma dan ibuprofen merek dagang (Proris®).
Penelitian dilakukan dengan menggunakan metode eksperimental di laboratorium menggunakan alat ukur spektrofotometer ultraviolet dengan mengukur kadar ibuprofen dalam plasma, menggunakan metode Cross Over
Design yang dianalisa dengan uji T menggunakan program SPSS.
Hasil penelitian menunjukkan bahwa sediaan tablet ibuprofen generik memiliki Cmaks = 260,64 mcg/ml, tmaks = 4 jam, dan AUC = 1211,63 jam.mcg/ml.
Sedangkan untuk ibuprofen merek dagang memiliki Cmaks = 252,96 mcg/ml, tmaks
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
ABSTRACT
Active matter bioavailability term of drugs began since existence of therapeutic un-equivalence between brand preparation containing the same active ingredient, in the same preparation, and the same dose.
Ibuprofen is one of the most safe drug for pain, inflammation and fever. Ibuprofen is drug which included into NSAID.
Intention of this research was to know bioavailability of ibuprofen tablet in rabbit and knew bioequivalence from Indofarma generic ibuprofen and (Proris®) brand ibuprofen. Research was done by using experimental method in laboratory applied ultraviolet spectrophotometer by determining ibuprofen in plasma, using Cross Over Design method and applied T test analysis with SPSS.
The result showed that Indofarma generic ibuprofen tablet had Cmax =
260,64 mcg/ml, tmax = 4 hours, and AUC = 1211,63 mcg/ml.hr. While for
(Proris®) brand ibuprofen had Cmax = 252,96 mcg/ml, tmax = 4,58 hours, and AUC
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
DAFTAR ISI
Halaman
JUDUL... i
LEMBAR PENGESAHAN... ii
ABSTRAK ... iii
ABSTRACT ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Tujuan Penelitian ... 5
BAB II TINJAUAN PUSTAKA... 6
2.1 Ibuprofen... 6
2.2 Biofarmasetik... 6
2.3 Bioavailabilitas... 6
2.4 Bioekivalensi... 7
BAB III METODOLOGI PENELITIAN ... 7
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
3.2 Bahan ... 7
3.3 Hewan Percobaan ... 7
3.4 Prosedur Kerja ... 7
3.4.1 Pembuatan Larutan Heparin 1000 I.U ... 7
3.4.2 Pembuatan Larutan Induk Baku Ibuprofen ... 8
3.4.3 Penentuan Kurva Absorpsi Ibuprofen ... 8
3.4.4 Pembuatan Kurva Kalibrasi Ibuprofen ... 8
3.4.5 Penentuan Konsentrasi Ibuprofen dalam Plasma dengan Pemberian Peroral ... 8
BAB IV HASIL DAN PEMBAHASAN ... 10
4.1 Kurva Absorpsi Ibuprofen dalam Plasma ... 10
4.2 Kurva Kalibrasi Ibuprofen dalam Plasma ... 11
4.3 Hasil Penentuan Kadar Ibuprofen dalam Plasma ... 12
4.4 Penentuan Ketersediaan Hayati ... 14
4.5 Penentuan Bioekivalensi ... 16
4.6 Analisis Data ... 17
BAB V KESIMPULAN DAN SARAN ... 19
5.1 Kesimpulan ... 19
5.2 Saran ... 19
DAFTAR PUSTAKA ... 20
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
DAFTAR TABEL
Tabel Halaman 2.1 Pemberian Ibuprofen pada Kelinci dengan Metode Cross Over
Design... 8 3.1 Data Parameter Ketersediaan Hayati Ibuprofen dalam Plasma ... 13 3.2 Data Perhitungan Bioekivalensi Obat ... 16 3.3 Data Statistik Pengujian Ibuprofen Generik dan Ibuprofen Merek
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
DAFTAR GAMBAR
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
DAFTAR LAMPIRAN
Lampiran Halaman
1 Diagram Rancangan Percobaan ... 21
2 Hasil Penentuan Kurva Kalibrasi Ibuprofen dalam Plasma ... 22
3 Data Kadar Ibuprofen Generik dalam Plasma ... 23
4 Data Kadar Ibuprofen Merek Dagang dalam Plasma ... 24
5 Data Rata-rata Kadar Ibuprofen dalam Plasma ... 25
6 Pengujian Ibuprofen Generik dan Ibuprofen Merek Dagang secara SPSS Menggunakan Independent Samples T Test ... 26
7 Data Deskripsi Kadar Ibuprofen Generik dan Ibuprofen Merek Dagang... 27
8 Data Deskripsi Parameter Kadar Ibuprofen Generik dan Ibuprofen Merek Dagang... 28
9 Contoh Perhitungan Konsentrasi Ibuprofen dalam Plasma ... 29
10 Contoh Perhitungan Data Farmakokinetik dalam Plasma ... 30
11 Perhitungan Dosis Kesetaraan pada Hewan ... 31
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Absorpsi sistemik suatu obat dari tempat ekstravaskuler dipengaruhi oleh sifat-sifat anatomik dan fisiologik tempat absorpsi serta sifat-sifat fisikokimia produk obat. Sewaktu obat mengalami absorpsi sistemik berbagai proses fisiologik normal yang berkaitan dengan distribusi dan eliminasi biasanya tidak dipengaruhi oleh formulasi obat (Shargel dan Yu, 2005).
Istilah ketersediaan hayati zat aktif suatu obat timbul sejak adanya ketidaksetaraan terapetik di antara sediaan bermerek dagang yang mengandung zat aktif yang sama dan dalam bentuk sediaan yang sama, serta diberikan dengan dosis yang sama. Studi biofarmasetika menyatakan bahwa metode fabrikasi dan formulasi akan mempengaruhi ketersediaan hayati suatu obat (Shargel dan Yu, 2005).
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
baik sebagai zat aktif tunggal ataupun kombinasi beberapa zat aktif dari suatu bentuk obat (Masri, 2006).
Ibuprofen adalah satu dari obat paling aman untuk pengobatan nyeri, inflamasi dan demam. Hal ini karena ia memiliki toleransi yang cukup luas dan seringkali lebih efektif dibandingkan dengan aspirin dan parasetamol pada banyak pengobatan nyeri (Rainsford, 2005). Ibuprofen diabsorpsi dengan cepat dalam saluran cerna, kadar serum tertinggi terjadi dalam 1-2 jam setelah pemberian oral, waktu paruh 1,8-2 jam (Siswandono dan Soekardjo, 2000), dengan rute pemberian per oral tersedia dalam bentuk tablet, kapsul, kaplet, dan suspensi (ISFI, 2007).
Ibuprofen merupakan obat yang termasuk ke dalam kelompok AINS (anti inflamasi non steroid). Obat ini digunakan untuk menyembuhkan nyeri, demam dan peradangan. Ibuprofen memiliki efek samping umum antara lain ruam, diare, telinga berdengung, mual, sakit kepala, sembelit, pening, rasa panas, nyeri perut. Efek samping lain yang ditimbulkan adalah demam, menimbulkan rasa gatal, bintik merah dan bengkak, lelah (Ogbru, 2007).
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Identifikasi baku pembanding ibuprofen menurut Farmakope Indonesia edisi keempat (1995) adalah dengan menggunakan spektrum serapan inframerah dan spektrum serapan ultraviolet dalam NaOH 0,1 N pada panjang gelombang serapan maksimum lebih kurang 264 nm dan 273 nm. Menurut Sultan, dkk (2005) Ibuprofen dalam plasma dapat ditentukan dengan metode kromatografi cair kinerja tinggi fase terbalik dengan sistem gradien menggunakan fase gerak amonium asetat pH 3,7 dan asetonitril pada panjang gelombang 227 nm. Terdapat beberapa metode analisa yang dipublikasikan untuk kuantitasi dari enantiomer ibuprofen pada cairan biologis, yaitu dengan metode kromatografi gas dan kromatografi cair kinerja tinggi (Rainsford, 2005).
Berdasarkan hal-hal tersebut di atas, peneliti tertarik untuk memeriksa ketersediaan hayati pada tablet ibuprofen generik Indofarma dan ibuprofen merek dagang (Proris®) sebagai model dengan kelinci sebagai hewan percobaan. 1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka yang menjadi perumusan masalah dalam penelitian ini adalah:
a. informasi apakah yang dapat diberikan oleh ketersediaan hayati dari tablet ibuprofen pada kelinci?
b. apakah ibuprofen generik bioekivalen dengan ibuprofen merek dagang?
1.3 Hipotesis
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
a. ketersediaan hayati dapat memberikan informasi tentang kecepatan dan jumlah obat dalam darah dengan mengetahui Cmaks tmaks danAUC dari
ibuprofen
b. sediaan ibuprofen generik bioekivalen dengan ibuprofen merek dagang
1.4 Tujuan Penelitian
Berdasarkan hipotesis di atas, maka yang menjadi tujuan dalam penelitian ini adalah:
a. mengetahui ketersediaan hayati dari tablet ibuprofen pada kelinci
b. mengamati apakah sediaan ibuprofen generik bioekivalen dengan ibuprofen merek dagang
1.5 Manfaat Penelitian
Penelitian ini dapat memberikan informasi tentang ketersediaan hayati (bioavailabilitas) dari ibuprofen dan informasi mengenai bioekivalensi ibuprofen generik dengan ibuprofen merek dagang.
1.6 Kerangka Pikir Penelitian
Variabel Bebas Variabel Terikat Parameter
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
BAB II
TINJAUAN PUSTAKA
2.1 Ibuprofen
a. Rumus Molekul : C13H18O2
b. Berat Molekul : 206,28
c. Pemerian : Serbuk hablur, putih hingga hampir putih, berbau khas lemah
d. Kelarutan : Praktis tidak larut dalam air, sangat mudah larut dalam etanol, dalam metanol, dalam aseton dan dalam
kloroform, sukar larut dalam etil asetat (Depkes RI, 1995).
e. Farmakologi
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
- Efek Samping : Dispepsia, muntah, mual, perdarahan pada pencernaan,
peptic ulcers, hematuria, hipersensitifitas, perforasi,
agranulositosis, dan trombositopenia (Sweetman, 2005). Ibuprofen merusak pertahanan mukosa melalui kolaborasi racun dan enzim, dengan mengubah imunitas dan dengan meningkatkan pengeluaran antral gastrin yang dapat meningkatkan sekresi asam (Sukandar, dkk., 2008).
2.2 Biofarmasetika
Biofarmasetika adalah pengkajian faktor-faktor fisiologis dan farmasetik yang mempengaruhi pelepasan obat dan absorpsi dari bentuk sediaan. Sifat-sifat fisika kimia dari obat dan bahan-bahan penambahan menetapkan laju pelepasan obat dari bentuk sediaan dan transport berikutnya melewati membran-membran biologis, sedangkan fisiologis dan kenyataan biokimia menentukan nasibnya dalam tubuh. Penyampaian optimal dari pusat aktif ke tempat aksi tergantung pada pengertian dari interaksi spesifik antara variabel-variabel formulasi dan variabel-variabel biologis (Aiache, 1993).
2.3 Bioavailabilitas
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
metabolisme lintas pertama). Bioavailabilitas merupakan salah satu unsur penting dalam farmakokinetik. Bioavailabilitas harus dipertimbangkan saat menghitung dosis untuk rute pemberian selain intravena.
Bioavailabilitas adalah ukuran dari obat aktif secara terapetik yang mencapai sirkulasi sistemik. Bioavailabilitas disimbolkan dengan huruf ‘F’.
Bioavailabilitas absolut membandingkan bioavailabilitas (dinilai sebagai AUC, daerah di bawah kurva) dari obat aktif dalam sirkulasi sistemik yang mengikuti rute pemberian selain secara intravena dengan bioavailabilitas dari obat yang sama secara intravena. Bioavailabilitas absolut merupakan hasil dari obat yang diabsorpsi melalui rute pemberian selain intravena yang dibandingka n dengan pemberian secara intravena pada obat yang sama. Perbandingannya harus pada dosis yang normal jika digunakan dosis yang berbeda. Hasilnya diperoleh dengan membagikan AUC dari tiap pemberian.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Oleh karena itu, suatu obat yang diberikan secara intravena akan mempunyai suatu kemutlakan bioavailabilitas 1 (F=1) sementara obat yang diberi oleh rute lain pada umumnya mempunyai bioavailabilitas absolut kurang dari satu.
Bioavailabilitas absolut adalah bioavailabilitas yang mengukur (diperkirakan sebagai area di bawah kurva, atau AUC) dari suatu obat tertentu ketika dibandingkan dengan rumus lain dari obat yang sama, pada umumnya ditetapkan standard, atau melalui pemberian suatu rute yang berbeda. Ketika standard terdiri dari obat yang diberikan melalui secara intravena, ini dikenal sebagai bioavailabilitas absolut.
Bioavailabilitas absolut suatu obat, ketika diberikan melalui rute ekstravaskuler, pada umumnya kurang dari satu ( yaitu. F<1). Berbagai faktor fisiologis mengurangi ketersediaan obat sebelum masuk ke dalam peredaran darah.
Faktor-faktor yang mempengaruhinya adalah : 1. Sifat fisis obat (hidrofobisitas, pKa, daya larut)
2. Formulasi obat (pelepasan segera, penggunaan bahan tambahan, metode pembuatan, pelepasan yang dimodifikasi, pelepasan yang ditunda, extended release, sustained release, dll.)
3. Obat yang diberikan bersama makanan atau saat puasa 4. Pengosongan lambung
5. Induksi enzim/hambatan oleh obat/makanan lain
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
2.4 Bioekivalensi
Alasan utama dilakukannya studi bioekivalensi oleh karena produk obat yang dianggap ekivalen farmasetik yang sebanding pada penderita. Persyaratan bioekivalensi diberlakukan oleh FDA atas dasar sebagai berikut:
1. Adanya fakta dari percobaan klinik yang terkendali dengan baik atau pengamatan terkendali pada penderita yang menyatakan bahwa berbagai produk obat tidak memberi efek terapetik yang sebanding.
2. Adanya fakta dari studi bioekivalensi yang terkendali dengan baik yang menyatakan bahwa produk-produk tersebut bukan merupakan produk obat yang bioekivalen.
3. Adanya fakta bahwa produk-produk obat memperlihatkan rasio terapetik yang sempit dan konsentrasi efektif minimum dalam darah, serta penggunaannya secara aman dan efektif memerlukan titrasi dosis yang cermat dan memerlukan pemantauan penderita.
4. penetapan secara medik oleh yang berwenang menyatakan bahwa suatu kekurangan bioekivalensi akan menyebabkan suatu efek yang tidak dikehendaki yang membahayakan dalam pengobatan atau pencegahan suatu penyakit atau kondisi-kondisi yang parah.
5. Sifat-sifat fisikokimia sebagai berikut:
a. Bahan obat aktif mempunyai kelarutan rendah dalam air, misal lebih kecil dari 5 mg/ml.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
c. Ukuran partikel dan/atau luas permukaan bahan obat aktif merupakan hal yang sangat menentukan bioavailabilitas obat tersebut.
d. Bentuk struktur tertentu dari bahan obat aktif (misal bentuk polimorf, solvat, kompleks dan modifikasi kristal) melarut sangat kecil, sehingga mempengaruhi absorpsi.
e. Produk-produk obat yang mempunyai perbandingan bahan tambahan yang besar terhadap bahan aktif, misal lebih besar dari 5:1.
f. Bahan inaktif tertentu (misal bahan tambahan hidrofilik atau hidrofobik dan lubrikan) mungkin diperlukan untuk absorpsi bahan aktif atau bagian terapetik atau dapat mempengaruhi absorpsi.
6. Sifat farmakokinetik sebagai berikut:
a. Bahan obat aktif, bagian terapetik, atau prekursornya diabsorpsi dalam jumlah besar pada bagian tertentu saluran cerna atau diabsorpsi pada suatu tempat terbatas.
b. Derajat absorpsi bahan aktif, bagian yang berkhasiat atau prekursornya kecil (misal, lebih kecil dari 50 % dibandingkan terhadap suatu dosis intravena) begitu pula bila diberikan dalam bentuk murni (misal larutan).
c. Terjadi metabolisme cepat dari bagian terapetik di dalam dinding usus atau hati selama proses absorpsi (metabolisme orde kesatu), sehingga laju absorpsi biasanya tidak berpengaruh terhadap efek terapetik dan/atau toksisitas produk obat.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
e. Bahan obat aktif atau bagian terapetik tidak stabil dalam bagian tertentu saluran cerna dan memerlukan penyalutan atau formulasi tertentu (misal, dapar, salut enterik, dan salut film ) untuk memastikan absorpsi yang cukup.
f. Produk obat yang mengikuti kinetika yang bergantung dosis
(dose-dependent kinetics) dalam atau dekat rentang terapetiknya, dan laju
serta jumlah absorpsi mempengaruhi bioekivalensi (Shargel, 2005). 2.5 Absorpsi
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
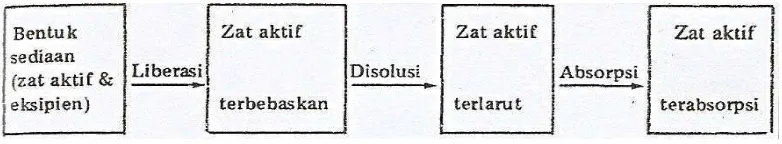
Gambar 1. Fase Biofarmasetik Obat (Joenoes, 2002).
Obat yang terbebaskan dari bentuk sediaannya belum tentu diabsorpsi, jika obat tersebut terikat pada kulit atau mukosa disebut adsorpsi. Jika obat sampai tembus ke dalam kulit, tetapi belum masuk ke kapiler disebut penetrasi. Jika obat meresap/menembus dinding kapiler dan masuk ke dalam saluran darah disebut absorpsi (Joenoes, 2002).
Perpindahan obat dari suatu bentuk sediaan dosis oral ke dalam sirkulasi sistemik bisa dicapai dengan tiga langkah yaitu:
a. Penghantaran obat pada tempat absorpsinya b. Obat dalam bentuk larutan
c. Penembusan obat ke dalam sirkulasi sistemik (Syukri, 2002).
Absorpsi obat adalah langkah utama untuk disposisi obat dalam tubuh dari sistem LADME (Liberasi-Absorpsi-Distribusi-Metabolisme-Ekskresi). Bila pembebasan obat dari bentuk sediaannya (liberasi) sangat lamban, maka disolusi dan juga absorpsinya lama, sehingga dapat mempengaruhi efektivitas obat secara keseluruhan (Joenoes, 2002).
2.5.1 Faktor-faktor yang mempengaruhi absorpsi obat
a. Ukuran partikel obat
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
b. Pengaruh daya larut obat
Pengaruh daya larut obat/bahan aktif tergantung pada:
- Sifat kimia: modifikasi kimiawi obat - Sifat fisik: modifikasi fisik obat - Prosedur dan teknik pembuatan obat
- Formulasi bentuk sediaan/galenik dan penambahan eksipien (Joenoes, 2002). c. Beberapa faktor lain fisiko-kimia obat
- pKa dan derajat ionisasi obat
Konsentrasi relatif bentuk ion/molekul bergantung pada pKa obat dan juga pada pH lingkungannya. Kebanyakan obat berupa asam lemah atau basa lemah; oleh karena absorpsi dengan cara difusi pasif hanya terjadi dalam bentuk tidak terionisasi atau molekul, maka perbandingan obat yang tidak terionisasi sangat menentukan absorpsi. pKa obat merupakan faktor penting, apakah obat itu bila diberikan per oral diabsorpsi lebih banyak di lambung atau lebih banyak di usus (Joenoes, 2002).
- Koefisien partisi lemak/air (Joenoes, 2002). 2.6 Ikatan Obat pada Protein plasma
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Senyawa yang terdapat dalam plasma salah satu diantaranya adalah protein plasma yang merupakan senyawa dengan ukuran molekul besar. Protein yang terdapat dalam plasma dapat dibagi menjadi dua kelompok besar yaitu albumin dan globulin (Sadikin, 2002).
Protein yang terkandung dalam serum dan plasma tidak sama. Plasma meliputi semua jaringan dari tubuh, termasuk elemen selular dari darah. Diduga bahwa obat dalam plasma berada pada kondisi yang equilibrium yang dinamis dengan jaringan, sehingga perubahan konsentrasi obat dalam plasma akan menggambarkan perubahan konsentrasi obat di jaringan (Shargel, 2005).
Ikatan antara zat aktif dan protein plasma tidak terlalu kuat, tetapi fenomena tersebut berperan pada penyebaran zat aktif dalam jaringan, karena konsentrasi zat aktif dalam cairan interstisial ekstraseluler dapat lebih rendah dari konsentrasi dalam plasma (Aiache, 1993).
Ikatan zat aktif dan protein pada umumnya mengikuti hukum aksi masa, jadi terdapat keseimbangan bolak-balik antara bentuk bebas dengan bentuk terikat yang merupakan ketersediaan obat dalam plasma dan jumlah setiap bentuk beragam tergantung pada senyawanya. Jumlah bentuk bebas awalnya tergantung pada difusi zat aktif yang masuk ke dalam plasma serta aktivitas dan lamanya dalam peredaran. Gradien konsentrasi hanya tergantung pada konsentrasi bentuk bebas dalam plasma dan difusi (pasif atau sederhana) yang terus terjadi hingga tercapai keseimbangan dengan bentuk bebas dalam semua cairan seluler atau ekstraseluler (Aiache, 1993).
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
terikat tidak aktif, tetapi ikatan ini hanya bersifat sementara. Bila sebagian bentuk bebas dimetabolisme dan atau ditiadakan, maka bentuk terikat akan melepaskan bentuk bebasnya. Jadi ikatan plasma memperbaiki efek farmakologik dengan memperpanjang efek obat dan mengurangi intensitas efek awal (Aiache, 1993). 2.7 Spektrofotometri
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang sering digunakan dalam analisis farmasi meliputi spektroskopi ultraviolet, cahaya tampak, inframerah dan srapan atom. Untuk serapan ultraviolet, daerah spektrumnya adalah 190 nm hingga 380 nm, sedangkan untuk serapan cahaya tampak, daerah spektrumnya adalah 380 nm hingga 780 nm (Depkes RI, 1995). 2.7.1 Hukum Lambert-Beer
Daya dari suatu berkas radiasi akan berkurang sehubungan dengan jarak yang ditempuhnya melalui medium penyerap. Daya tersebut juga akan berkurang sehubungan dengan kadar molekul atau ion yang terserap dalam medium tersebut (Depkes RI, 1995).
Hukum Lambert-Beer adalah hubungan linieritas antara absorban dengan konsentrasi larutan analit. Biasanya hukum Lambert-Beer ditulis dengan:
A = . b. C
A = absorban (serapan)
= koefisien ekstingsi molar (M-1
cm-1) b = tebal kuvet (cm)
C = konsentrasi (M)
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
C = konsentrasi (gram/100 ml) Hubungan antara E dan adalah:
E =
Pada percobaan, yang terukur adalah transmitan (T), yang didefinisikan sebagai berikut:
T = I/Io I = intensitas cahaya setelah melewati sampel Io = intensitas cahaya awal
Hubungan antara A dan T adalah
A = -log T = -log (I/Io) (Dachriyanus, 2004) Jika absorbansi suatu seri konsentrasi larutan diukur pada panjang
gelombang, suhu, kondisi pelarut yang sama; dan absorbansi masing-masing larutan diplotkan terhadap konsentrasinya maka suatu garis lurus akan teramati sesuai dengan persamaan A = abc. Grafik ini disebut dengan plot hukum Lambert-Beer dan jika garis yang dihasilkan merupakan suatu garis lurus maka dapat dikatakan bahwa hukum Lambert-Beer dipenuhi pada kisaran konsentrasi yang diamati (Rohman, 2007).
2.7.2 Spektra Elektronik
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
BAB III
METODOLOGI PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode eksperimental di laboratorium. Data dianalisis secara Uji T menggunakan program SPSS (Statistical Product and Service Solution) 12.
3.1 Alat
Alat-alat yang digunakan adalah politube, beaker glass, vortex, sentrifuge, spektrofotometer (UV mini 1240 Shimadzu), stopwatch, labu tentukur, botol
aquadest, gelas ukur, neraca analitik, animal box, spuit, pisau cukur, NGT, vial
dan alat lain yang dibutuhkan. 3.2 Bahan
Bahan yang digunakan adalah ibuprofen BPFI, sediaan tablet 200 mg ibuprofen generik Indofarma dan ibuprofen merek dagang Proris®, aquadest, etanol p.a, dan heparin (Fahrenheit).
3.3 Hewan Percobaan
Hewan yang digunakan adalah kelinci jantan dengan berat 1,5-2 kg. 3.4 Prosedur Kerja
3.4.1 Pembuatan Larutan Heparin 1000 I.U
Dipipet 2 ml heparin 5000 I.U. lalu ditambahkan dengan NaCl 0,9% sampai volume 10 ml (Cocchetto dan Bjornsson, 1983).
3.4.2 Penyiapan Plasma
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
3. Darah ditampung sebanyak 90 ml dari 4 kelinci, dimasukkan ke dalam tabung yang telah berisi heparin, dinginkan ke dalam wadah yang berisi es selama 10 menit, kemudian disentrifuge 3000 rpm selama 10 menit.
4. Supernatan diambil dan dipergunakan untuk pembuatan kurva absorbsi dan kurva kalibrasi ibuprofen.
3.4.3 Pembuatan Larutan Induk Baku Ibuprofen
Ditimbang seksama 4 mg ibuprofen baku, kemudian dipindahkan ke dalam politube 10 ml. Dilarutkan dengan plasma dan dicukupkan ad 4 ml, dicampur dengan bantuan vortex hingga homogen, sehingga diperoleh larutan dengan konsentrasi 1000 mcg/ml, diamkan 5 menit.
3.4.4 Penentuan Kurva Absorpsi Ibuprofen
Dari larutan induk baku dipipet 0,2 ml, dimasukkan ke dalam politube, dicukupkan dengan plasma hingga 2 ml, dicampur dengan bantuan vortex. Diamkan 5 menit, tambahkan etanol p.a 4 ml, dicampur dengan vortex dan disentrifuge selama 8 menit 3000 rpm. Setelah disentrifuge, supernatan dipisahkan dan dimasukkan ke dalam vial sebagai wadah, lalu dimasukkan ke dalam kuvet untuk diukur dengan spektrofotometer ultraviolet pada panjang gelombang 200-400 nm.
3.4.5 Pembuatan Kurva Kalibrasi Ibuprofen
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
disentrifuge, supernatan dipisahkan dan dimasukkan ke dalam vial sebagai wadah, lalu dimasukkan ke dalam kuvet untuk diukur dengan spektrofotometer ultraviolet pada panjang gelombang 230 nm.
3.4.6 Penentuan Konsentrasi Ibuprofen dalam Plasma dengan Pemberian
Peroral
Pengujian dilakukan dengan metode Cross Over Design menggunakan 6 kelinci. Pemberian ibuprofen pada hewan kelinci dengan metode ini dapat dilihat pada tabel 3.1 berikut ini:
Tabel 3.1 Pemberian ibuprofen pada kelinci dengan metode
Cross Over Design (Sinurat, 2005)
A = Tablet ibuprofen 200 mg (generik)
B = Tablet ibuprofen 200 mg (merek dagang: Proris®) Prosedur penentuan konsentrasi ibuprofen dalam plasma:
1. Bulu telinga kelinci dicukur hingga bersih.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
disentrifuge selama 8 menit, 3000 rpm. Pisahkan supernatan. Digunakan sebagai blanko.
3. Sediaan A dan B diberikan per oral. Darah diambil sebanyak 4 ml dengan variasi waktu 30, 60, 120, 240, 480 menit (pemilihan variasi waktu didapatkan dari hasil orientasi) dan diperlakukan sama seperti blanko. Kemudian diukur dengan spektrofotometer ultraviolet dengan panjang gelombang 230 nm.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Kurva Absorbsi Ibuprofen dalam Plasma
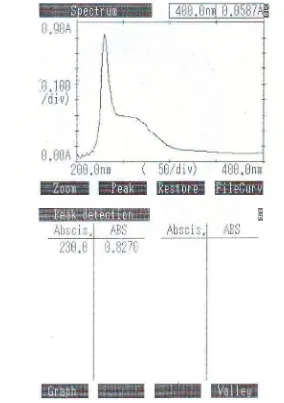
Panjang gelombang serapan maksimum larutan ibuprofen dalam plasma diperoleh melalui grafik absorbsi vs panjang gelombang yang merupakan hasil pengukuran 100 mcg/ml larutan ibuprofen dalam plasma pada panjang gelombang 200-400 nm yang dapat dilihat pada gambar 4.1 berikut ini:
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Dari kurva absorpsi diketahui bahwa panjang gelombang maksimum Ibuprofen dalam plasma berada pada 230 nm. Hal ini berbeda dengan yang tercantum pada Sultan, dkk (2005) dimana panjang gelombang maksimum ibuprofen menggunakan metode kromatografi cair kinerja tinggi fase terbalik sistem gradien dengan fase gerak amonium asetat pH 3,7 dan asetonitril adalah 227 nm. Ini kemungkinan terjadi karena adanya perbedaan metode pengukuran yang digunakan. Selanjutnya pengukuran kalibrasi dan penentuan kadar dilakukan pada panjang gelombang tersebut.
4.2Kurva Kalibrasi Ibuprofen dalam Plasma
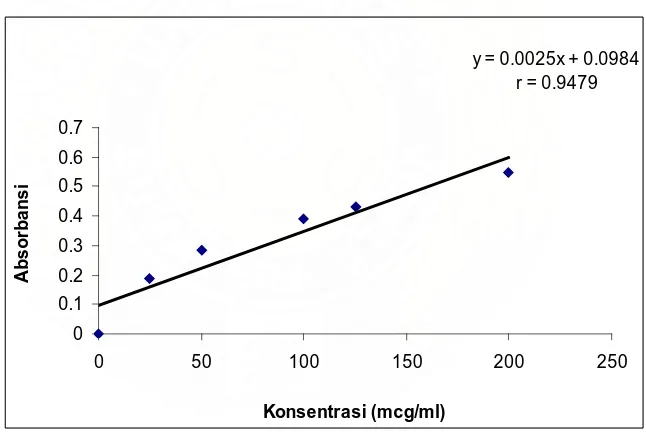
Gambar kurva kalibrasi dapat dilihat pada gambar 4.2 di bawah ini:
Gambar 4.2 Kurva kalibrasi ibuprofen dalam plasma
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
sempurna (mendekati 1). Namun masih menunjukkan korelasi yang dapat diterima antara konsentrasi dan absorbansi karena r yang didapatkan adalah 0,9479 (0,95) (Shargel dan Yu, 2005).
4.3Hasil Penentuan Kadar Ibuprofen dalam Plasma
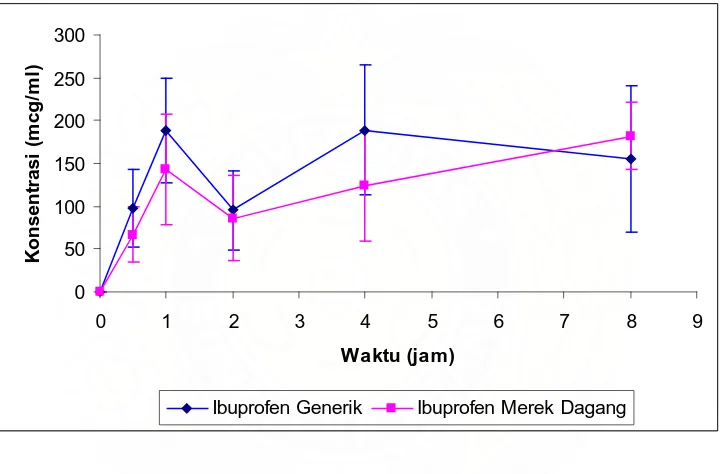
Pengukuran tablet ibuprofen dalam plasma menggunakan spektrofotometer ultraviolet pada panjang gelombang 230 nm dapat dilihat pada gambar 4.3 berikut ini:
Ibuprofen Generik Ibuprofen Merek Dagang
Gambar 4.3 Kurva kadar Ibuprofen Generik dan Ibuprofen Merek Dagang (Mean ± SEM)
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
jam ke-8. Menurut Anonim, (2006) pada manusia puncak plasma ibuprofen dicapai antara 1-2 jam. Perbedaan ini mungkin disebabkan karena adanya perbedaan pada bahan tambahan pada sampel yang digunakan. Pengaruh dari metode pengukuran yang digunakan juga memungkinkan terjadinya perbedaan. Hal ini seperti yang disebutkan oleh Rohman (2007) penggunaan kromatografi cair kinerja tinggi akan memberikan hasil yang lebih baik karena kromatografi cair kinerja tinggi merupakan metode yang memberikan sensitifitas dan spesifisitas yang tinggi.
Hal ini juga mungkin terjadi karena adanya pengaruh dari sediaan itu sendiri dimana ibuprofen adalah suatu campuran rasemik, yaitu suatu campuran yang mengandung sepasang enantiomer dalam jumlah sama, yaitu enantiomer R dan enantiomer S (Melissa dan Tanujaya, 2009).
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
2005). Namun secara statistik kurva kadar ibuprofen generik dan ibuprofen merek dagang tidak berbeda.
4.4Penentuan Ketersediaan Hayati
Parameter dalam penentuan ketersediaan hayati untuk data plasma adalah: a. Waktu konsentrasi plasma (darah) mencapai puncak (tmaks)
b. Konsentrasi plasma puncak (Cmaks)
c. Area di bawah kurva kadar obat dalam plasma-waktu (AUC) (Shargel dan Yu, 1995).
Data mengenai rata-rata nilai parameter ketersediaan hayati dan standar eror untuk masing-masing sediaan dapat dilihat pada tabel 4.1 berikut ini:
Tabel 4.1 Data parameter ketersediaan hayati ibuprofen dalam plasma
Obat
Dari data di atas diperoleh grafik parameter ketersediaan hayati ibuprofen dalam plasma yang terlihat pada gambar 4.4 di bawah ini:
0
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Ibprofen Generik Ibuprofen Merek Dagang
0
Ibuprofen Generik Ibuprofen Merek Dagang
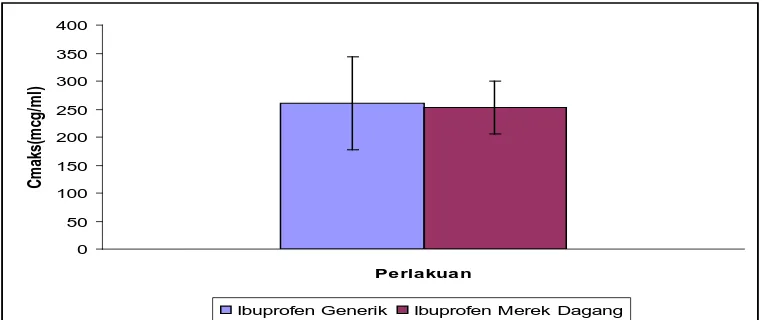
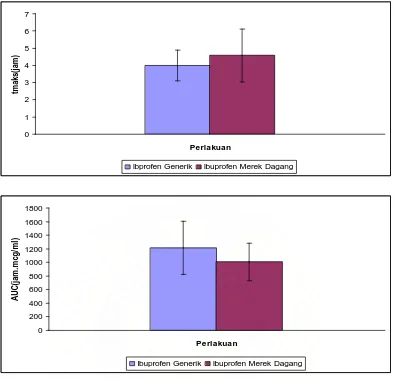
Gambar 4.4 Kurva parameter ketersediaan hayati ibuprofen generik dan ibuprofen merek dagang (Mean ± SEM, n = 6)
Keterangan:
IG = Ibuprofen Generik
IMD = Ibuprofen Merek Dagang
Cmaks = konsentrasi maksimum ibuprofen
tmaks = waktu yang dibutuhkan untuk mencapai konsentrasi maksimum
AUC = luas area di bawah kurva
Dari hasil di atas dapat dilihat bahwa Cmaks dari tablet ibuprofen generik
dalam plasma lebih besar dibandingkan Cmaks dari ibuprofen merek dagang,
berturut-turut adalah 260,64 mcg/ml dan 252,96 mcg/ml. Adapun tmaks ibuprofen
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
ini berarti ibuprofen merek dagang memerlukan waktu yang lebih lama untuk mencapai konsentrasi maksimum dibandingkan dengan ibuprofen generik. Jika dilihat dari nilai AUC yang diperoleh dengan menggunakan rumus trapesium pada tablet ibuprofen generik dan ibuprofen merek dagang berturut-turut adalah 1211,63 jam.mcg/ml dan 1006,34 jam.mcg/ml. Dari data ini dapat dilihat bahwa jumlah (kadar) obat yang diabsorbsi di dalam darah pada tablet ibuprofen generik lebih besar dibandingkan dengan ibuprofen merek dagang, karena AUC, area di bawah kurva kadar obat dalam plasma-waktu adalah suatu ukuran dari jumlah ketersediaan hayati suatu obat. AUC mencerminkan jumlah total obat aktif yang mencapai sirkulasi sistemik (Shargel dan Yu, 2005).
4.5Penentuan Bioekivalensi
Untuk mengetahui apakah suatu obat ekivalen atau tidak perlu diketahui terlebih dahulu ketersediaan hayati (bioavailabilitas) relatif dari kedua obat yang dibandingkan.
Ketersediaan hayati (bioavailabilitas) relatif dari kedua sediaan ini diperoleh dengan menggunakan rumus:
Bioavailabilitas Relatif (BR): (AUCgenerik)/(Dosisgenerik)
(AUCProris®)/(DosisProris®)
: 1211,63/10,86 mg/kg 1006,34/10,86 mg/kg
: 1,2
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Maka, hasil perhitungan tersebut dapat dilihat pada tabel 4.2 di bawah ini: Tabel 4.2 Data perhitungan bioekivalensi obat
BR tmaks Cmaks
1,2 0,87 1,03
Dari tabel di atas dapat dilihat bahwa kedua sediaan bioekivalen, karena ketiga parameter ketersediaan hayati memenuhi syarat. Kesimpulan yang sama dapat dilihat dari tabel pengujian parameter ketersediaan hayati untuk ibuprofen generik dan ibuprofen merek dagang secara statistik.
4.6Analisis Data
Data dianalisis dengan Independent Samples T Test menggunakan program SPSS. Tabel pengujian parameter ketersediaan hayati untuk ibuprofen generik dan ibuprofen merek dagang secara statistik pada tabel berikut ini:
Tabel 4.3 Data statistik pengujian Ibuprofen Generik dan Ibuprofen Merek Dagang
Perlakuan N Rata-rata Std.deviasi Rata-rata
Std.Eror
IG = Ibuprofen Generik
IMD = Ibuprofen Merek Dagang
Cmaks = konsentrasi maksimum ibuprofen
tmaks = waktu yang dibutuhkan untuk mencapai konsentrasi maksimum
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Dari data statistik di atas dapat dilihat bahwa tidak ada perbedaan antara ibuprofen generik dan ibuprofen merek dagang, dimana nilai signifikansi untuk masing-masing parameter ketersediaan hayati (Cmaks, tmaks, AUC) lebih besar dari
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
a. Sediaan tablet ibuprofen generik memiliki Cmaks = 260,64 mcg/ml, tmaks
= 4 jam, dan AUC = 1211,63 jam.mcg/ml. Sedangkan untuk ibuprofen merek dagang memiliki Cmaks = 252,96 mcg/ml, tmaks = 4,58 jam, dan AUC
= 1006,34 jam.mcg/ml.
b. Dari data yang diperoleh sediaan ibuprofen generik bioekivalen dengan ibuprofen merek dagang (p > 0,05).
5.2Saran
a. Disarankan pada peneliti selanjutnya untuk menggunakan kromatografi cair kinerja tinggi sebagai alat ukur.
b. Agar dilakukan penelitian lebih lanjut mengenai sifat fisikokimia dan stabilitas dari ibuprofen dalam plasma.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
DAFTAR PUSTAKA
Anonim, (2006). Motrin (Ibuprofen)-Clinical Pharmacology. Tanggal akses: Agustus 2008.
http://www.druglib.com/.
Cocchetto, D. M. and Bjornsson, T. D. (1983). Methods for Vascular Access and
Collection of Body Fluids from The Laboratory Rat. Journal of Pharmaceutical
Sciences. 72(5). Hal. 465.
Depkes RI. (1995). Farmakope Indonesia. Edisi keempat, Jakarta: Departemen Kesehatan RI. Hal. 450.
Makoid, MC. (1999). Basic Pharmacokinetics. http://kiwi.creighton.edu/pkinbook/. Masri, M. (2006). Ketersediaan Hayati Obat. Tanggal akses: Juli 2008.
http ://www.portalkalbe.com.
Melissa dan Tanujaya. (2009). Tanggal akses: 28 Mei 2009. Pengaruh Bentuk
Rasemik Suatu Obat Terhadap Efeknya dalam Tubuh. http ://www.aaps.org.
ISFI. (2007). ISO Indonesia. Volume 42. Jakarta: PT Ikrar Mandiri.
http ://www.medicinenet.com.
Rainsford, KD. (2005). Ibuprofen. A Critical Bibliographic Review. London: Taylor and Francis. Page: 1, 38, 79.
Rohman, A. (2007. Kimia Farmasi Analisis. Cetakan pertama. Yogyakarta: Pustaka Pelajar. Hal: 406.
Shargel, L., dan Yu, A.B.C. (2005). Biofarmasetika dan Farmakokinetika
Terapan. Cetakan Kedua. Penerjemah: Fasich dan S. Sjamsiah.Surabaya:
Airlangga University Press. Hal: 16, 85, 175.
Sinurat, D. (2005). Studi Pelepasan Ketersediaan Hayati dan Efek terhadap Iritasi terhadap Lambung dengan Kapsul Alginat yang Mengandung Aspirin Dibanding dengan Tablet Ascardia. . Tesis Jurusan Farmasi FMIPA USU Medan.
Siswandono dan Soekardjo,B. (2000). Kimia Medisinal. Edisi Kedua. Surabaya: Airlangga University Press. Hal: 300, 303.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Determination of Non Steroidal Anti-Inflammatory Drug (NSAIDs in Pharmaceutical Formulation and Biological Samples (Blood, plasma, Erythrocytes) by HPLC-UV-MS and µ-HPLC. Current Medicinal
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 1 Diagram rancangan percobaan
Ibuprofen Generik Indofarma
Ibuprofen Merek Dagang (Proris®)
Percobaan In vivo pengambilan darah kelinci
dengan variasi waktu
Spektrofotometri
Hasil
Pemisahan dengan sentrifugasi
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 3 Hasil penentuan kurva kalibrasi ibuprofen dalam plasma
Konsentrasi
(mcg/ml)
Absorbansi
Rata-rata
1 2 3 Absorbansi
0 0 0 0 0
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 4 Data kadar ibuprofen generik dalam plasma
Waktu
(jam)
Konsentrasi
(mcg/ml) Jumlah Rata-rata
0 0 0 0 0 0 0 0 0
0,5 220,32 146,04 219,76 0 0 0 586,12 97,68667
1 208,88 363,44 313,56 222,4 24 0 1132,28 188,7133
2 223,28 0,32 0 255,4 29,28 63 571,28 95,21333
4 152,76 547,76 138,28 195,52 30,32 70,52 1135,16 189,1933
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 5 Data kadar ibuprofen merek dagang dalam plasma
Waktu
(jam)
Konsentrasi
(mcg/ml) Jumlah Rata-rata
0
0 0 0 0 0 0 0 0
0,5
84,68 0 150,2 0 167 0 401,88 66,98 1
208,88 426,08 33,36 40 116,32 72,96 857,6 142,9333 2
25,04 218,64 263,6 0 0 6,04 513,32 85,55333 4
445 56,04 92,32 71,32 63,96 17,2 745,84 124,3067 8
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 6 Data rata-rata kadar ibuprofen dalam plasma
Waktu (jam)
ibuprofen generik ibuprofen merek dagang Rata-rata
konsentrasi
Rata-rata Std. Error
Rata-rata Konsentrasi
Rata-rata Std. Error
0 0 0 0 0
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 7 Pengujian Ibuprofen Generik dan Ibuprofen Merek Dagang secara SPSS menggunakan Independent Samples T Test
Group Statistics
1.690 .223 .080 10 .937 7.67333 95.38982 -204.87 220.22
.080 8.034 .938 7.67333 95.38982 -212.13 227.48
8.980 .013 -.327 10 .750 -.58333 1.78146 -4.5527 3.38601
-.327 8.027 .752 -.58333 1.78146 -4.6890 3.52236
.359 .562 .428 10 .678 205.29167 479.49835 -863.10 1273.7
.428 9.043 .679 205.29167 479.49835 -878.62 1289.2 Equal t-test for Equality of Means
Keterangan:
IG = Ibuprofen Generik
IMD = Ibuprofen Merek Dagang
Cmaks = konsentrasi maksimum ibuprofen
tmaks = waktu yang dibutuhkan untuk mencapai konsentrasi maksimum
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 8 Data deskripsi kadar ibuprofen generik dan ibuprofen merek dagang
Descriptives
6 .0000 .00000 .00000 .0000 .0000 .00 .00
6 .0000 .00000 .00000 .0000 .0000 .00 .00
12 .0000 .00000 .00000 .0000 .0000 .00 .00
6 97.6867 110.3693 45.0581 -18.1388 213.5122 .00 220.3 6 66.9800 78.36047 31.9905 -15.2543 149.2143 .00 167.0 12 82.3333 92.65648 26.7476 23.4622 141.2045 .00 220.3 6 188.71 148.5939 60.6632 32.7736 344.6531 .00 363.4 6 142.93 156.5642 63.9171 -21.3707 307.2374 .00 426.1 12 165.82 147.4788 42.5735 72.1198 259.5269 .00 426.1 6 95.2133 114.4693 46.7319 -24.9148 215.3415 .00 255.4 6 85.5533 121.6846 49.6775 -42.1468 213.2534 .00 263.6 12 90.3833 112.7474 32.5474 18.7471 162.0196 .00 263.6 6 189.19 185.3935 75.6866 -5.3652 383.7519 30.32 547.8 6 124.31 159.0276 64.9227 -42.5825 291.1959 17.20 445.0 12 156.75 168.1270 48.5341 49.9272 263.5728 17.20 547.8 6 155.43 209.9642 85.7175 -64.9172 375.7705 .00 436.6 6 182.20 97.18368 39.6751 80.2120 284.1880 70.40 314.4 12 168.81 156.6114 45.2098 69.3072 268.3195 .00 436.6 IG
IG = Ibuprofen Generik
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 9 Data deskripsi parameter Ibuprofen Generik dan Ibuprofen Merek Dagang
Descriptive Statistics
6 152.88 2819.36 1211.6317 390.32045 956.08593 6 288.58 2200.36 1006.3400 278.51143 682.21088
6 2.00 8.00 4.0000 .89443 2.19089
6 .50 8.00 4.5833 1.54065 3.77381
6 30.32 547.76 260.6400 82.46249 201.99103 6 86.60 426.08 252.9667 47.94951 117.45182 6
AUC IG AUC IMD tmaks IG tmaks IMD Cmaks IG Cmaks IMD Valid N (listwise)
Statistic Statistic Statistic Statistic Std. Error Statistic
N Minimum Maximum Mean Std.
D i ti
Keterangan:
IG = Ibuprofen Generik
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 10 Contoh perhitungan konsentrasi ibuprofen dalam plasma
Diambil contoh perhitungan data dari ibuprofen generik pada kelinci kedua. Konsentrasi ibuprofen dalam plasma dihitung dengan menggunakan persamaan regresi Y = 0,0025 x + 0,0984. Pada saat t = 4 jam diperoleh serapan 1,4678 maka konsentrasi ibuprofen dalam plasma:
= 1,4678 – 0,0984 0,0025
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 11 Contoh perhitungan data farmakokinetik dalam plasma
Diambil contoh perhitungan data farmakokinetik dari ibuprofen generik pada kelinci kedua. Dari kurva hubungan konsentrasi ibuprofen versus waktu ditentukan konsentrasi maksimum (Cmaks) dan waktu yang diperlukan untuk
mencapai kadar maksimum (tmaks).
Konsentrasi maksimum yang diperoleh adalah 547,76 mcg/ml dengan tmaks 4
jam. Luas area di bawah kurva (AUC) dihitung dengan cara sebagai berikut: AUC 0-8 jam dihitung menggunakan metode luas trapesium.
AUC 0-8jam = [Cn + Cn-1] [t2 – t1] = 2819,36 jam.mcg/ml.
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.
Lampiran 12 Perhitungan dosis kesetaraan pada hewan
Berat kelinci : 1,5 kg
Dosis ibuprofen : 200 mg
Berat rata-rata manusia Indonesia : 60 kg Jadi, untuk manusia dengan berat 60 kg, dosis ibuprofen:
70/60 x 200 mg = 233,3 mg
Dosis kesetaraan manusia dengan kelinci : 0,07 Maka : 233,3 x 0,07 = 16,3 mg
Rikha Sarah : Pemeriksaan Ketersediaan Hayati Dari Tablet Ibuprofen Pada Hewan Kelinci, 2009.