RINGKASAN
INDRA BAGUS PRIASTOMO. Alternatif Media Kultur dan Model Infeksi Agen Parasit Leucocytozoon caulleryi Menggunakan Telur Embrio Tertunas. Dibawah bimbingan UMI CAHYANINGSIH.
Penelitian ini dirancang untuk mengetahui penggunaan telur embrio tertunas sebagai media kultur dan model infeksi agen parasit Leucocytozoon caulleryi. Pemeriksaan yang dilakukan meliputi persentase parasitemia dan diferensial leukosit embrio ayam. Penelitian ini menggunakan 24 telur embrio tertunas sebagai media kultur parasit fase gametosit dengan menggunakan rute inokulasi melalui membran korioalantois dan kantung alantois. Inokulasi dilakukan pada umur embrio 13 hari dan ulas darah embrio dilakukan pada umur embrio 16, 17, 18, dan 19 hari. Penelitian ini menggunakan rancangan kelompok lengkap teracak dengan ulangan sebanyak tiga kali. Hasil penelitian menunjukan perbedaan nyata pada parasitemia yang diinokulasi melalui membran korioalantois dan kantung alantois. Membran korioalantois menunjukan persentase parasitemia lebih tinggi dibandingkan rute kantung alantois. Nilai diferensial leukosit menunjukan perbedaan nyata pada perbedaan rute inokulasi dan umur embrio. Limfosit merupakan diferensial leukosit tertinggi pada embrio ayam diikuti dengan heterofil, monosit, basofil, dan eosinofil.
ABSTRACT
INDRA BAGUS PRIASTOMO. Embryonated Egg as Alternative Cultivation Media and Infection Model of Parasite Leucocytozoon caulleryi. Under direction :
UMI CAHYANINGSIH.
This research was designed to understand utilization of embryonated egg as cultivation media and infection model of parasite Leucocytozoon caulleryi. An examination included percentage of parasitemia and leukocyte differential of chicken embryo. This research used 24 embryonated egg which were inoculated with gametocytes of L. caulleryi via chorioallantoic membrane (CAM) and allantoic cavity (AC) route. Inoculation were done at 13 days old and blood smear of embryo were done at 16, 17,18, and 19 days old. The result showed significant
different of inoculation route and each embryonated egg’s age. Inoculation route
via CAM showed higher parasitemia than AC. The highest of parasitemia were showed at 19 days old of embryonated egg (6 days post-inoculation) both CAM and AC. Percentage of leukocyte differential showed significant different of both
inoculation route and embryo’s egg on 16, 17, 18, and 19 days old. Both CAM
and AC route showed same percentage of lymphocyte as the highest percentage followed by heterophil, monocyte, basophil, and eosinophil. Thus, embryonated egg could be used as alternative cultivation media with chorioallantoic membrane as better inoculation route and infection model which was showed by imune response from leukocyte differential.
ALTERNATIF MEDIA KULTUR DAN MODEL INFEKSI
PARASIT
Leucocytozoon caulleryi
MENGGUNAKAN TELUR
EMBRIO TERTUNAS
INDRA BAGUS PRIASTOMO
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Alternatif Media Kultur dan Model infeksi Parasit Leucocytozoon caulleryi Menggunakan Telur Embrio Tertunas adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Juli 2012
Indra Bagus Priastomo
RINGKASAN
INDRA BAGUS PRIASTOMO. Alternatif Media Kultur dan Model Infeksi Agen Parasit Leucocytozoon caulleryi Menggunakan Telur Embrio Tertunas. Dibawah bimbingan UMI CAHYANINGSIH.
Penelitian ini dirancang untuk mengetahui penggunaan telur embrio tertunas sebagai media kultur dan model infeksi agen parasit Leucocytozoon caulleryi. Pemeriksaan yang dilakukan meliputi persentase parasitemia dan diferensial leukosit embrio ayam. Penelitian ini menggunakan 24 telur embrio tertunas sebagai media kultur parasit fase gametosit dengan menggunakan rute inokulasi melalui membran korioalantois dan kantung alantois. Inokulasi dilakukan pada umur embrio 13 hari dan ulas darah embrio dilakukan pada umur embrio 16, 17, 18, dan 19 hari. Penelitian ini menggunakan rancangan kelompok lengkap teracak dengan ulangan sebanyak tiga kali. Hasil penelitian menunjukan perbedaan nyata pada parasitemia yang diinokulasi melalui membran korioalantois dan kantung alantois. Membran korioalantois menunjukan persentase parasitemia lebih tinggi dibandingkan rute kantung alantois. Nilai diferensial leukosit menunjukan perbedaan nyata pada perbedaan rute inokulasi dan umur embrio. Limfosit merupakan diferensial leukosit tertinggi pada embrio ayam diikuti dengan heterofil, monosit, basofil, dan eosinofil.
ABSTRACT
INDRA BAGUS PRIASTOMO. Embryonated Egg as Alternative Cultivation Media and Infection Model of Parasite Leucocytozoon caulleryi. Under direction :
UMI CAHYANINGSIH.
This research was designed to understand utilization of embryonated egg as cultivation media and infection model of parasite Leucocytozoon caulleryi. An examination included percentage of parasitemia and leukocyte differential of chicken embryo. This research used 24 embryonated egg which were inoculated with gametocytes of L. caulleryi via chorioallantoic membrane (CAM) and allantoic cavity (AC) route. Inoculation were done at 13 days old and blood smear of embryo were done at 16, 17,18, and 19 days old. The result showed significant
different of inoculation route and each embryonated egg’s age. Inoculation route
via CAM showed higher parasitemia than AC. The highest of parasitemia were showed at 19 days old of embryonated egg (6 days post-inoculation) both CAM and AC. Percentage of leukocyte differential showed significant different of both
inoculation route and embryo’s egg on 16, 17, 18, and 19 days old. Both CAM
and AC route showed same percentage of lymphocyte as the highest percentage followed by heterophil, monocyte, basophil, and eosinophil. Thus, embryonated egg could be used as alternative cultivation media with chorioallantoic membrane as better inoculation route and infection model which was showed by imune response from leukocyte differential.
©Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
ALTERNATIF MEDIA KULTUR DAN MODEL INFEKSI
PARASIT
Leucocytozoon caulleryi
MENGGUNAKAN TELUR
EMBRIO TERTUNAS
INDRA BAGUS PRIASTOMO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Alternatif Media Kultur dan Model Infeksi Leucocytozoon caulleryi Menggunakan Telur Embrio Tertunas.
Nama : Indra Bagus Priastomo NIM : B04062761
Disetujui :
Tanggal Lulus :
Dr. drh. Umi Cahyaningsih, MS Dosen Pembimbing
Diketahui,
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia yang diberikan sehingga penelitian dan skripsi ini dapat diselesaikan. Penelitian ini telah dilaksanakan pada bulan September hingga Desember 2010
dan diberi judul “Alternatif Media Kultur dan Model Infeksi Parasit
Leucocytozoon caulleryi Menggunakan Telur Embrio Tertunas”.
Atas selesainya skripsi ini, penulis menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Kedua orang tua, adik, dan keluarga besar yang tak henti-hentinya mendoakan, atas segala kasih sayang, pengorbanan dan dukungan yang diberikan.
2. Dr. drh. Umi Cahyaningsih selaku dosen pembimbing skripsi yang telah meluangkan waktunya yang berharga untuk mengarahkan, memberikan motivasi, membagi ilmu dan senantiasa sabar dalam membimbing penulis. 3. Prof. drh. Dondin Sajuthi, MST, PhD selaku pembimbing akademik yang senantiasa memberikan perhatian dan arahan selama menjalani masa perkuliahan.
4. Drh. Akhmad Arif Amin, drh. Retno Wulansari, drh. Wahono Esthi Setyaningtyas, drh. Okti Nadia Putri, selaku dosen penilai seminar dan penguji sidang yang telah membantu penulis, mengarahkan, memberikan masukan, dan membagi ilmu, serta bimbingan bagi penulis.
5. Teman–teman aesculapius FKH 43, IAAS Local Committee IPB, Keluarga Besar IAAS National Committee, IAAS National, dan semua pihak yang telah membantu, mendukung dan memberikan kontribusi dalam penulisan skripsi ini baik secara langsung maupun tidak langsung, yang tidak dapat disebutkan satu per satu.
Semoga skripsi ini dapat digunakan dan dimanfaatkan dengan semestinya. Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dengan nama lengkap Indra Bagus Priastomo lahir di Jember pada tanggal 25 Maret 1988 dari ayah Rustomo dan ibu Menik Sri Indari. Penulis merupakan anak pertama dari empat bersaudara.
Penulis lulus dari SDN Kepatihan 17 Jember, Kabupaten Jember, Jawa Timur pada tahun 2000 dan kemudian melanjutkan pendidikan di SMP Negeri 1 Jember serta lulus pada tahun 2003. Pada tahun 2006, penulis menyelesaikan pendidikan dari SMU Negeri 2 Jember dan diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) serta memilih mayor Kedokteran Hewan.
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
PENDAHULUAN ... Latar Belakang ... 1
... Tujuan Penelitian ... 3
... Manfaat Penelitian ... 3
... Hipotesis Penelitian ... 4
TINJAUAN PUSTAKA Leucocytozoon sp ... 5
Telur Embrio Tertunas ... 7
Leukosit ... 12
METODE PENELITIAN Tempat dan Waktu Penelitian ... 18
Persiapan Ayam Donor Leucocytozoon ... 18
Penentuan Dosis Parasit ... 18
Penghitungan Jumlah Sel Darah Merah ... 18
Penghitungan Persentase Parasitemia ... 19
Persiapan Telur Embrio Tertunas dan Inokulasi Leucocytozoon ... 19
Pemanenan Parasit ... 20
Analisis Data ... 20
Rancangan Percobaan ... 21
HASIL DAN PEMBAHASAN ... 22
SIMPULAN DAN SARAN ... 31
DAFTAR PUSTAKA ... 32
DAFTAR TABEL
Halaman
Nilai persentase diferensial leukosit pada ayam yang baru menetas ... 13 Rata-rata persentase prasitemia pada telur embrio tertunas yang diinokulasi
dengan L. caulleryi ... 22 Rata-rata persentase diferensial leukosit pada telur embrio tertunas yang
diinfeksi L. caulleryi dengan rute inokulasi membran korioalantois dan
ruang alantois ... 26 1
2
DAFTAR GAMBAR
Halaman
Struktur anatomi saluran reproduksi ayam betina ... 8
Perkembangan embrio hari ke-5 dan ke-10 ... 11
Perkembangan embrio hari ke-15 dan ke-20 ... 11
Limfosit unggas ... 13
Monosit unggas ... 14
Heterofil unggas ... 15
Eosinofil unggas ... 15
Basofil unggas ... 16
Rute inokulasi telur embrio tertunas melalui membran korioalantois dan ruang alantois ... 20
Rata-rata persentase limfosit embrio yang diinokulasi L caulleryi ... 25
Rata-rata persentase heterofil embrio yang diinokulasi L caulleryi ... 27
Rata-rata persentase monosit embrio yang diinokulasi L caulleryi ... 28
Rata-rata persentase basofil embrio yang diinokulasi L caulleryi ... 29
PENDAHULUAN
Latar Belakang
Peningkatan jumlah penduduk dunia mencapai 1,1% dalam 10 tahun terakhir, menjadikan permintaan pasokan pangan meningkat. Peningkatan pasokan pangan dunia meliputi permintaan kebutuhan pada sektor peternakan dengan salah satu komoditas yaitu unggas. Sektor peternakan unggas memasok 30% dari total konsumsi daging sehingga menyebabkan perdagangan unggas dunia mengalami peningkatan hingga mencapai 9,2 juta ton per tahun, dengan peningkatan mencapai 5,3% tiap tahunnya (FAO 2007).
Peningkatan produksi unggas mengalami kendala diakibatkan peningkatan kasus kejadian penyakit yang seringkali dialami oleh peternak unggas di Indonesia. Sebagai salah satu negara tropis, Indonesia memiliki kerentanan terhadap kejadian leucocytozoonosis. Leucocytozoonis merupakan penyakit yang diakibatkan parasit Leucocytozoon sp yang dapat menyebabkan penurunan produksi hingga 25-75% (Purwanto et al. 2010). Leucocytozoon merupakan parasit yang bersifat obligat dan intraseluler pada darah dan jaringan, serta dapat menghancurkan sel pada tubuh inang. Beragam spesies Leucocytozoon dapat menginfeksi famili unggas secara luas pada unggas produksi, unggas peliharaan, maupun unggas liar (Hill 2008). Siklus hidup Leucocytozoon terdiri dari siklus seksual yang terjadi di inang definitif seperti ayam, bebek, bahkan penguin. Siklus aseksual terjadi pada inang antara yaitu Simulium dan Cullicoides (Earle et al.
1992; Evans dan Otter 1998; dan Hill 2008).
Kejadian leucocytozoonosis tersebar di seluruh dunia dan bersifat dinamis tergantung pada host susceptibility, keberadaan vektor, dan preferensi vektor untuk spesies tertentu (Desser dan Bennet 1993). Daerah pegunungan yang memiliki banyak aliran sungai memberikan lingkungan berkembangbiak optimal untuk vektor Leucocytozoon yaitu Simulium dan Culicoides. Kejadian penyakit juga lebih sering terjadi di peternakan yang terletak di dekat danau, rawa, ataupun sungai (Stadller dan Carpenter 1996).
sedangkan kasus kronis menyerang pada ayam tua terutama ayam petelur (Whiterman dan Bickford 1989). Infestasi Leucocytozoon sp dapat terjadi tanpa disertai gejala klinis maupun disertai gejala klinis. Gejala klinis pada ayam yang terserang leucocytozoonosis meliputi depresi, hilang nafsu makan, muntah darah, dan kelumpuhan hingga mengakibatkan kematian. Serangan yang tidak disertai dengan gejala klinis umumnya berupa penurunan produksi telur maupun bobot badan ayam (Purwanto et al. 2010). Raidal dan Jaensch (2000) melaporkan bahwa terdapat gejala pada sistem syaraf pusat yang diduga akibat dari formasi skizon sehingga menghambat kapiler otak. Biliverdinuria juga terjadi akibat dari dekstruksi eristrosit dan inflamasi hepatik hingga nekrosis.
Kerugian yang ditimbulkan akibat infeksi Leucocytozoon menyebabkan perlu dilakukan pencegahan maupun pengobatan pada kasus leucocytozoonosis. Pencegahan dapat dilakukan dengan membatasi vektor parasit dan menjaga kebersihan kandang. Penggunaan pyrimetamine dan sulfonamide bersifat efektif untuk mencegah infeksi, namun untuk pengobatan masih memiliki hambatan dikarenakan prevalensi parasit darah pada unggas tidak bersifat spesifik-spesies yang tetap, namun lebih dikarenakan siklus parasitemia, faktor lingkungan, dan juga populasi (Tella et al. 1999 dan Springer 1991). Hal ini menyebabkan parasitemia dapat terjadi setiap saat, namun gejala klinis muncul pada saat inang mengalami imunosupresi. Hal inilah yang membuat sulit dilakukan pencegahan dan pengendalian Leucocytozoon. Infestasi kronis Leucocytozoon juga masih belum dipahami secara mendalam sehingga masih diduga bahwa stress sebagai penyebab primer kejadian penyakit ini.
Hambatan dalam pengobatan dan pencegahan leucocytozoonosis memerlukan penelitian lebih lanjut tentang sifat, karakter, dan tingkat patogenitas dari parasit. Penelitian memerlukan penggunaan kultur parasit dan model infeksi sebagai salah satu usaha dalam untuk memproduksi antigen yang digunakan sebagai uji serologik dan imnunogen untuk pencegahan penyakit (Sunaga et al.
Telur embrio tertunas telah banyak digunakan sebagai media kultur dan model infeksi beragam parasit. Telur embrio tertunas telah berhasil dikembangkan sebagai alternatif model infeksi pada Aspergillus fumigatus, Neospora caninum, Trypanosoma cruzy (Jacobsen et al. 2010; Mansourian et al. 2009; Mello dan Deane 1976). Telur embrio tertunas juga telah digunakan sebagai pengujian bahan obat dan ekstrak herbal seperti ekstrak benalu teh (Murtini et al. 2006). Takamutsu et al. (1984) telah berhasil melakukan kultur Leucocytozoon fase sporozoit pada telur embrio tertunas dengan inokulasi melalui membran korioalantois.
Pengujian menggunakan telur embrio tertunas memiliki keunggulan dibandingkan dengan kultur sel dikarenakan tidak menggunakan media dan kondisi laboratorium yang rumit sehingga biaya yang dibutuhkan relatif murah. Telur berembrio sebagai sistem biologis yang dinamis diharapkan menggambarkan kondisi in vivo. Kondisi in vivo yang dimaksud yaitu adanya metabolisme dan perkembangan sel-sel embrio di dalam telur yang berkembang secara terus-menerus. Baik parasit maupun zat kimia tertentu dapat diinokulasi ke dalam telur. Efek parasit dan zat kimia yang terhadap embrio tergantung pada umur embrio dan aplikasi rute pemberian (Johston et al. 1997).
Tujuan Penelitian
Tujuan dilakukan penelitian ini untuk memperoleh informasi tentang penggunaan telur embrio tertunas sebagai alternatif media kultur dan model infeksi Leucocytozoon caulleryi.
Manfaat Penelitian
Hipotesis Penelitian
1. Penelitian ini menduga bahwa telur embrio tertunas dapat dijadikan sebagai alternatif media kultur dengan rute inokulasi membran korioalantois atau ruang alantois berdasarkan persentase parasitemia darah pada umur embrio tertentu. 2. Penelitian ini menduga bahwa telur embrio tertunas memiliki respon imun
TINJAUAN PUSTAKA
Leucocytozoon caulleryi
Leucocytozoon merupakan parasit darah dan jaringan yang telah ditemukan pada unggas sejak 200 tahun yang lalu oleh Danilewsky pada tahun 1884. Pertama kalinya, Leucocytozoon ditemukan pada burung hantu dengan hanya gametosit yang terlihat pada bagian perifer pembuluh darah. Khusus parasit
Leucocytozoon terdapat perbedaan dengan parasit darah lainnya dimana dapat ditemukan parasit pada sel darah putih (Fallis dan Desser 1977). Transmisi parasit disebabkan oleh vektor Simulidae dan Cullicidae. Kejadian penyakit umumnya terjadi pada peternakan yang terletak di dekat danau, rawa, maupun sungai. Penyakit ini juga seringkali terjadi ketika perubahan suhu udara menjadi lebih hangat (Stadller dan Carpenter 1996).
Gejala klinis yang diakibatkan dari infestasi parasit Leucytozoon meliputi anorexia, penurunan produksi, lethargy, dan hilangnya keseimbangan. Gejala klinis lainnya yaitu anemia dan leukositosis. Kejadian yang bersifat akut umumnya terjadi pada unggas muda, sedangkan kejadian kronis terjadi pada unggas tua (Whiterman dan Bickford 1989).
Kontrol kejadian penyakit umumnya dilakukan pencegahan yang dilakukan dengan membatasi populasi dari paparan vektor. Diagnosa leucocytozoonosis dilakukan dengan deteksi keberadaan parasit fase gametosit pada darah perifer melalui ulas darah (Campbell 1995).
Morfologi
Morfologi pada inang definitif fase gametosit Leucocytozoon yang terlihat pada hasil ulas darah perifer merupakan cara yang dilakukan untuk membedakan dan melakukan identifikasi spesies Leucocytozoon. Umumnya Leucocytozoon
perbedaan morfologi pada spesies L. caulleryi yang menginfeksi ayam, gametosit pada spesies ini berbentuk melingkar dan nukleus sel terdorong keluar dengan sedikit perubahan bentuk dan terkadang terdorong keluar dari sel darah (Fallis dan Desser 1977).
Siklus hidup
Siklus hidup Leucocytozoon terdiri dari 2 siklus yaitu siklus aseksual dan siklus seksual. Siklus aseksual terjadi pada inang seperti ayam, bebek, atau unggas lainnya. Sedangkan siklus seksual terjadi pada vektor yaitu Cullicidae dan Simulidae (Tampubolon 1992).
Perkembangan parasit aseksual terjadi ketika masuknya sporozoit dari gigitan vektor Simulidae atau Cullicidae pada unggas. Sporozoit yang masuk melalui luka gigitan vektor akan masuk ke dalam sel jaringan dan berkembang dalam fase aseksual yang disebut skizon. Skizogoni merupakan fase terbentuknya ribuan merozoit. Fase skizogoni terjadi di dalam sel parenkim hati, sel epitel ginjal, dan sel retikuloendotel tubuh seperti ginjal dan kelenjar limfe. Terdapat perbedaan proses skizogoni pada tiap-tiap spesies parasit, namun umumnya skizogoni terjadi pada sel parenkim hati (Fallis dan Desser 1977).
Merozoit terbentuk setelah 4 hari pasca-infeksi yang dimulai dari pembelahan inti secara berulang pada skizon. Skizon dengan pembelahan inti yang berulang akan mengalami invaginasi sitoplasma dan membentuk sitomer dengan banyak inti, lalu pembelahan inti dan sitoplasma akan dilanjutkan hingga sitomer dan dihasilkan ribuan merozoit tak berinti sebesar 1 mikron. Beberapa spesies, skizon dapat mengalami ruptur sebelum terjadinya pembentukan merozoit secara lengkap. Ruptur dari skizon dengan beberapa inti pada sitomer disebut dengan sinsitia. Hal ini juga menunjukan bahwa parasit kurang beradaptasi pada tubuh inang.
Proses seksual terjadi setelah masuknya gametosit pada tubuh vektor melalui hisapan nyamuk atau lalat dari darah unggas yang terinfeksi
Leucocytozoon. Awal dari fase seksual yaitu terbentuknya gametosit jantan dan betina yang disebut juga fase gametogoni. Pembentukan makrogametosit dan mikrogametosit terjadi di saluran pencernaan vektor dan lebih distimulasi oleh perubahan kadar oksigen dan karbondioksida dibandingkan perubahan temperatur pada saat perpindahan parasit dari unggas ke tubuh vektor. Proses pendewasaan gametosit terjadi setelah parasit keluar dari darah dan distimulasi oleh lepasnya membran sel darah merah unggas. Proses pendewasaan pada mikrogamet terjadi ketika inti sel megalami kondensasi dan berubah menjadi massa yang lebih padat. Proses tersebut mengawali pembentukan flagella yang merupakan alat gerak untuk menuju makrogamet.
Zigot terbentuk setelah proses fertilisasi antara makrogamet dan mikrogamet berflagella dan dalam beberapa jam berubah bentuk menjadi ookinet motil dengan ukuran mencapai 30 mikron. Ookinet melakukan migrasi menembus dinding saluran cerna untuk menghindari proses pencernaan darah pada saluran cerna vektor. Ookinet yang tidak dapat menembus dinding saluran cerna akan mengalami ruptur 3-4 hari sesudahnya. Ookinet yang mampu menembus dinding usus vektor, akan mematangkan diri menjadi ookista dan melakukan migrasi ke saluran air liur (Fallis dan Desser 1977).
Telur Embrio Tertunas
Pembentukan embrio
Unggas memiliki perbedaan dalam sistem perkembangan embrio dengan mamalia. Perkembangan embrio pada unggas terjadi pada telur (in ovo) yang berada diluar tubuh induk. Kondisi perkembangan embrio yang terjadi diluar tubuh sehingga memungkinkan dilakukan intervensi pada embrio unggas (Ricks
et al. 2003). Proses perkembangan pada unggas terutama ayam terjadi secara cepat dan membutuhkan waktu 21 hari inkubasi hingga menjadi individu.
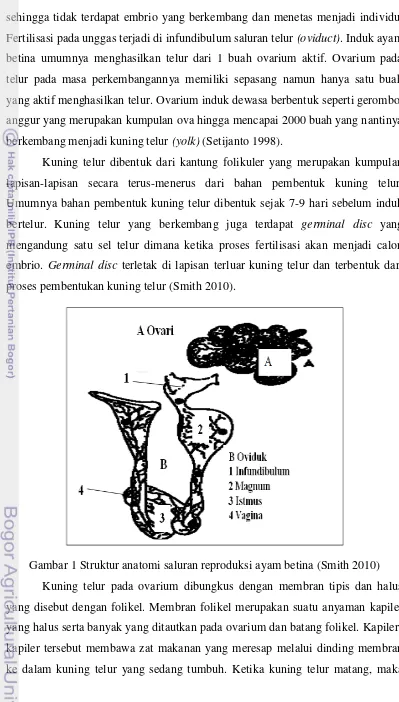
sehingga tidak terdapat embrio yang berkembang dan menetas menjadi individu. Fertilisasi pada unggas terjadi di infundibulum saluran telur (oviduct). Induk ayam betina umumnya menghasilkan telur dari 1 buah ovarium aktif. Ovarium pada telur pada masa perkembangannya memiliki sepasang namun hanya satu buah yang aktif menghasilkan telur. Ovarium induk dewasa berbentuk seperti gerombol anggur yang merupakan kumpulan ova hingga mencapai 2000 buah yang nantinya berkembang menjadi kuning telur (yolk) (Setijanto 1998).
Kuning telur dibentuk dari kantung folikuler yang merupakan kumpulan lapisan-lapisan secara terus-menerus dari bahan pembentuk kuning telur. Umumnya bahan pembentuk kuning telur dibentuk sejak 7-9 hari sebelum induk bertelur. Kuning telur yang berkembang juga terdapat germinal disc yang mengandung satu sel telur dimana ketika proses fertilisasi akan menjadi calon embrio. Germinal disc terletak di lapisan terluar kuning telur dan terbentuk dari proses pembentukan kuning telur (Smith 2010).
folikel-folikel mengalami ruptur dan membentuk garis yang disebut dengan stigma, daerah yang tidak mengandung pembuluh darah dan folikelnya sangat tipis. Proses ini menyebabkan kuning telur keluar dari ovarium dan prosesnya disebut dengan ovulasi (Setijanto 1998).
Kuning telur yang telah keluar dari ovarium akan ditangkap oleh infundibulum. Kuning telur akan berada di dalam infundibulum selama 10-20 menit dan proses fertilisasi akan terjadi di infundibulum jika ayam betina dikawinkan dengan pejantan. Setelah berada di infundibulum dan terjadi proses fertilisasi, kuning telur akan masuk dan bergerak ke dalam magnum dan menerima albumin tebal (putih telur). Setelah 2-3 jam di dalam magnum, telur akan bergerak ke arah istmush selama 1-1,5 jam untuk mendapatkan lapisan membran-membran kulit telur. Selanjutnya telur akan berpindah ke dalam uterus dan mendapatkan lapisan kerabang yang berbahan dasar kalsium karbonat, serta pigmen oofin yang memberikan warna pada kulit telur. Lapisan tali tipis pada kuning telur yang disebut juga kalaza akan tampak di uterus. Kalaza berfungsi untuk menjaga kuning telur tetap berada di tengah serta menjaga posisi germinal disc untuk selalu di lapisan terluar kuning telur.
Proses di dalam uterus terjadi hingga 20 jam lamanya dan telur yang telah berkembang penuh akan masuk ke dalam vagina selama 5-10 menit sebelum telur dikeluarkan dari tubuh induk melalui kloaka. Telur juga mendapatkan substansi yang berlendir dan tipis yang disebut dengan kutikula. Lapisan kutikula akan melapisi pori-pori kulit telur dan melindungi kulit telur dari bakteri. Telur akan berubah posisi menjadi horizontal sehingga telur dari vagina akan masuk ke kloaka dan dikeluarkan secara sekaligus. Kulit telur akan segera mengeras setelah berada di udara bebas.
Perkembangan Embrio Telur
pada lingkungan dengan suhu kisaran 38°C-39°C. Pembelahan pertama selesai pada saat telur telah mencapai istmush. Pembelahan lainnya akan berlanjut setiap 20 menit hingga membentuk gastrula.
Sesaat setelah telur dikeluarkan dari tubuh induk yaitu waktu antara bertelur hingga inkubasi, telur mengalami perubahan suhu dari suhu tubuh induk ke suhu lingkungan. Perubahan suhu menyebabkan perkembangan embrio terhenti hingga suhu lingkungan stabil kembali dalam suhu inkubasi sekitar 38°C -39°C (Grimes 2002). Awal dari masa inkubasi, embrio akan mengalami perkembangan seluler yang diawali dengan diferensiasi sel. Beberapa sel akan berkembang menjadi organ vital dan sel-sel lainnya.
Hari pertama pasca-inkubasi, germinal disc akan berkembang menjadi prekursor pembentukan organ viscera yaitu foregut. Selain itu, terbentuk juga
blood islands atau pulau darah yang nantinya akan membentuk sistem sirkulasi darah, prekursor pembentukan jaringan syaraf, dan pembentukan mata.
Hari kedua masa inkubasi, pulau-pulau darah yang terbentuk akan saling berikatan satu sama lain dan membentuk sistem vaskular, disertai pembentukan organ jantung. Setelah 44 jam inkubasi, organ jatung dan jaringan vaskular akan berhubungan sehingga jantung mulai berdetak. Sistem sirkulasi pernafasan juga terbentuk menjadi 2 sistem sirkulasi, yaitu sistem embrionik bagi embrio dan sistem viteline yaitu sistem sirkulasi pada telur (Smith 2010).
Akhir dari masa perkembangan embrionik, terbentuk 2 jenis sistem vaskular darah ekstra-embrionik, yaitu sistem viteline sebagai transpor nutrisi dari kuning telur ke embrio. Sebelum hari ke-4, sistem tersebut mengalirkan darah beroksigen. Sistem vaskular darah lainya berasal dari sirkulasi alantois yang berfungsi sebagai sistem sirkulasi respirasi dan penyimpanan produk eksresi ke alantois. Ketika telur menetas, kedua sistem tersebut tidak berfungsi kembali. Perkembangan syaraf juga berkembang dan terbentuk otak bagian depan, pembentukan telinga, dan awal pembentukan lensa mata.
terbentuk yang akan menjadi organ respirasi dan ekskresi selama perkembangan embrio di dalam telur. Nutrisi dari albumin dan kalsium dari cangkang telur juga ditransportasikan melalui alantois. Hari keempat inkubasi, semua organ yang dibutuhkan telah terbentuk dan dapat diidentifikasi sehingga perkembangan terus berlanjut secara cepat.
Gambar 2 Perkembangan embrio hari ke-5 dan ke-10 (Smith 2010)
Gambar 3 Perkembangan embrio hari ke-15 dan ke-20 (Smith 2010)
Hari ke-21, ayam akan keluar dari cangkang telur dengan memecah cangkang pada bagian kantung udara. Kantung alantois yang sebelumnya sebagai alat respirasi selama proses inkubasi akan mengering dan pernafasan berlangsung menggunakan paru-paru. Setelah menetas, ayam dapat bertahan hingga 72 jam tanpa makan dikarenakan cadangan nutrisi yang berasal dari kuning telur yang menempel pada tubuh ayam pada hari ke-19. Kuning telur mengandung cadangan nutrisi yang cukup tinggi seperti protein, lemak, vitamin, mineral, dan air untuk beberapa jam setelah menetas. Kuning telur akan dikonsumsi secara bertahap hingga hari kesepuluh setelah menetas (Smith 2010).
Leukosit
Darah terdiri dari sel-sel yang terendam di dalam cairan yang disebut plasma. Sebagain besar sel-sel darah berada di dalam pembuluh-pembuluh, namun leukosit dapat menembus dinding pembuluh darah untuk mengatasi terjadinya infeksi. Leukosit atau sel darah putih merupakan suatu unit aktif dari pertahanan tubuh hewan dan manusia. Sel darah putih menurut tempat berkembang dan diferensiasi dibagi menjadi unsur mieloid dan unsur limfoid (Frandson 1986). Unsur mieloid terdiri dari granulosit yang dalam kondisi normal dihasilkan di dalam sumsum tulang (jaringan mieloid). Unsur limfoid terdiri dari limfosit dan monosit yang berkembang pada jaringan limfoid seperti timus, limpa, dan bursa fabricius pada unggas (Ganong 2002).
Hewan yang terpapar oleh bakteri, virus, parasit, dan benda asing akan mengaktifkan sistem pertahanan yang akan melawan berbagai macam patogen toksik dan infeksius. Sistem ini terdiri dari sel darah putih dan sel jaringannya. Semua sel akan bekerja secara bersama dengan merusak patogen dengan cara fagositosis, membentuk antibodi, dan mengaktifkan limfosit untuk menghancurkan patogen (Guyton dan Hall 2008).
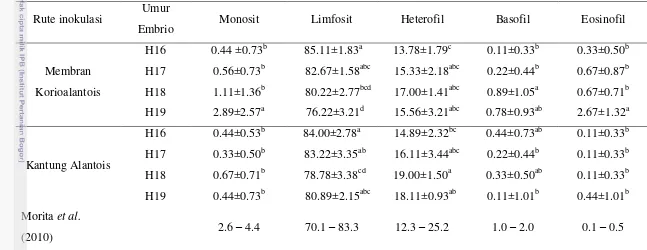
karena memiliki nukelus dan memiliki kemampuan untuk bergerak secara independen. Selain itu, sel-sel darah putih memiliki masa hidup yang bervariasi, mulai dari beberapa jam untuk granulosit, hingga beberapa bulan untuk monosit, bahkan beberapa tahun untuk limfosit. Sel darah putih juga bersifat non-fungsional di dalam aliran arah dan hanya diangkut menuju jaringan ketika dibutuhkan (Frandson 1986). Menurut Morita et al. (2010), nilai diferensial leukosit pada ayam yang baru menetas adalah sebagai berikut:
Tabel 1 Nilai persentase diferensial leukosit pada ayam yang baru menetas
Diferensial Leukosit Persentase (%)
Limfosit 70.1 – 83.3
Monosit 2.6 – 4.4
Heterofil 12.3 – 25.2
Basofil 1.0 – 2.0
Eosinofil 0.1 – 0.5
Limfosit
Limfosit merupakan leukosit yang tidak bergranul atau agranulosit. Limfosit memiliki variasi ukuran dan memiliki nukleus yag relatif besar yang dikelilingi sejjumlah sitoplasma. Limfosit terdiri dari 2 jenis yaitu limfosit besar dengan diameter 12-16 m dan limfosit kecil dengan diameter 9-12 m. Limfosit besar memiliki lebih banyak sitoplasma, berinti besar, dan pucat. Limfosit kecil memiliki inti besar dan menyerap warna, dan sitoplasmanya biru pucat.
Gambar 4 Limfosit unggas (Phillips 2010)
mekanisme kekebalan spesifik dengan 3 tipe sel meliputi limfosit B, limfosit T, dan null cells (McBride 2002).
Monosit
Monosit merupakan sel darah putih yang tidak bergranul dan memiliki sitoplasma yang besar. Monosit berbentuk sel mononuklear dengan jumlah normal lebih sedikit dibandingkan dengan limfosit. Monosit mempunyai ukuran sel yang besar dan memiliki variasi bentuk berupa lingkaran hingga rhomboit (Phillips 2010).
Gambar 5 Monosit unggas (Phillips 2010)
Monosit memiliki kemampuan fagositik, yaitu memakan benda asing seperti bakteri, sebagaimana heterofil. Apabila heterofil berperan dalam mengatasi infeksi akut, maka monosit bekerja dalam keadaan infeksi yang tidak terlalu akut. Monosit dibentuk di dalam sumsum tulang yang nantinya akan disebarkan dan beredar di dalam darah hingga 72 jam. Sel-sel monosit selanjutnya akan masuk ke dalam jaringan dan membentuk makrofag. Makrofag akan mampu berada di jaringan hingga berbulan-bulan bahkan bertahun-tahun hingga musnah akibat kemampuan fagositiknya (Frandson 1986).
Heterofil
Granul dari heterofil sedikit tersamarkan dengan nukleus dengan wana biru yang kuat (Phillips 2010).
Gambar 6 Heterofil unggas (Phillips 2010)
Heterofil termasuk dalam jajaran pertama sistem kekebalan tubuh ketika melawan infeksi dengan cara migrasi menuju daerah-daerah yang sedang mengalami infeksi dengan menembus dinding endotel dan menghancurkan agen. Jumlah heterofil yanng meningkat menunjukan kejadian infeksi akut. Heterofil memiliki masa hidup yang singkat, dimana setelah melakukan tugasnya akan mati dan melepas faktor kemotaktik untuk menarik heterofil lainnya. Masa hidup normal dalam sirkulasi darah mencapai 4-8 jam, kemudian 4-5 jam berikutnya berada pada jaringan. Masa hidup heterofil mampu beredar dalam aliran darah hingga 12 jam (Tizard 1988).
Eosinofil
Eosinofil merupakan sel darah putih yang berbentuk lingkaran dan memiliki granul. Sitoplasma eosinofil bersifat basofilik dengan banyak granul yang bersifat eosinofilik. Granul eosinofil tampak lebih terang dibandingkan dengan heterofil pada ulas darah yang sama. Pewarnaan inti sel eosinofil berwarna ungu kebiru-biruan dan memiliki kemiripan dengan inti sel heterofil (Phillips 2010).
Eosinofil dalam kondisi normal hanya mencapai 2% dari jumlah leukosit darah. Eosinofil dibentuk di dalam sumsum tulang belakang dan memiliki waktu hidul relatif singkat. Eosinofil mempunyai sifat fagositik yang lemah dan kemotaksis. Eosinofil akan meningkat dalam aliran darah ketika terjadi infeksi parasit dan eosinofil akan bermigrasi ke bagian jaringan yang terinfeksi parasit. Tizard (1988) menyatakan bahwa eosinofil tidak seefisien dalam fagositosis, namun eosinofil cocok untuk menyerang dan menghancurkan larva cacing. Meskipun banyak parasit yang berukuran lebih besar dari eosinofil, namun fagositosis akan dilakukan dengan cara melekatkan diri pada molekul permukaan parasit dan melepaskan bahan-bahan yang dapat membunuh parasit tersebut (Guyton dan Hall 2008).
Basofil
Basofil merupakan granulosit yang bersifat polimorfnuklear-basofil. Diameter antara 10-15m, memiliki inti 2 gelambir, dan tidak berarturan. Granulnya berwarna biru tua hingga ungu dan manutupi inti yang cerah (Dellman dan Brown 1992). Identifikasi basofil dapat mudah diamati dari bentuknya lingkaran, memiliku granul dengan sifat basofilik yang kuat, dan inti sel yang tidak berlobus (Phillips 2010).
Gambar 8 Basofil unggas (Phillips 2010)
METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan di laboratorium Protozologi, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilakukan pada bulan September-Desember 2010.
Persiapan ayam donor Leucocytozoon
Ayam sakit berumur 1 bulan dengan gejala demam dan anemia diambil dari farm dan dipelihara dengan memberikan pakan komersial dan air minum ad libitum. Pemeriksaan terhadap parasitemia dilakukan setiap hari. Pemeriksaan parasitemia dilakukan dengan melakukan ulas darah. Ayam sebelumnya diposisikan dorsal recumbency dan sayap dikembangkan sehingga dapat dilakukan pengambilan darah melalui vena brachialis. Ulas darah dilakukan dengan menggunakan gelas objek dan dilanjutkan dengan pewarnaan menggunakan Giemsa 10%, dan dilakukan pemeriksaan menggunakan mikroskop cahaya. Jika dinyatakan positif adanya Leucocytozoon sp, maka dapat digunakan untuk kultur parasit.
Penentuan dosis parasit
Dosis parasit dilakukan dengan menghitung jumlah sel darah merah dan tingkatan parasetimia pada ayam terinfeksi. Dosis yang dibutuhkan adalah parasitemia 102/ml darah untuk menghasilkan dosis infektif pada telur embrio tertunas (Takamutsu et al. 1984). Rumus yang digunakan adalah sebagai berikut :
Dosis parasit : Jumlah sel darah merah ( /l ) x persentase parasitemia (%)
Penghitungan jumlah sel darah merah
dua. Pencampuran dilakukan dengan menggerakan hematositometer seperti angka delapan hingga beberapa kali. Setelah tercampur sempurna, larutan di buang sebanyak 2 tetes, lalu dengan menggunakan kamar hitung, larutan dimasukan ke dalam kamar hitung dan ditutup dengan cover glass. Setelah tertutup dengan
cover glass, butir darah merah dihitung menggunakan mikroskop dengan perbesaran 400 kali.
Penghitungan persentase parasitemia
Penghitungan parasitemia dilakukan dengan menghitung eritrosit terinfeksi dalam 1000 eritrosit pada preparat ulas secara manual dengan tiga kali ulangan.
Persiapan telur embrio tertunas dan inokulasi Leucocytozoon
Telur embrio tertunas umur 10 hari diletakan dalam inkubator dengan suhu 37°C dan tingkat kelembaban 50-60%. Telur sebelumnya disesuaikan pada inkubator terlebih dahulu sebelum dilakukan inokulasi protozoa. Pemeriksaan tanda vital kehidupan dilakukan dengan metode candling. Inokulasi dilakukan dengan menggunakan dua rute berbeda yaitu membran korioalantois dan ruang alantois. Sebelum dilakukan okulasi, cangkang telur dibersihkan menggunakan alkhohol 70% lalu dibuat lubang pada area yang mendekati rute dengan menggunakan dentis’s drill. Setelah terbentuk lubang, dilakukan inokulasi dengan memasukan agen parasit menggunakan syringe 0,1 ml dan bekas lubang ditutup menggunakan stiker marker. Seluruh proses dilakukan di dalam laminar air flow
untuk mencegah kontaminasi pada telur. Setelah itu, telur yang telah diinokulasi dengan protozoa, dilakukan monitoring dengan menggunakan candling (Jacobsen
et al. 2010).
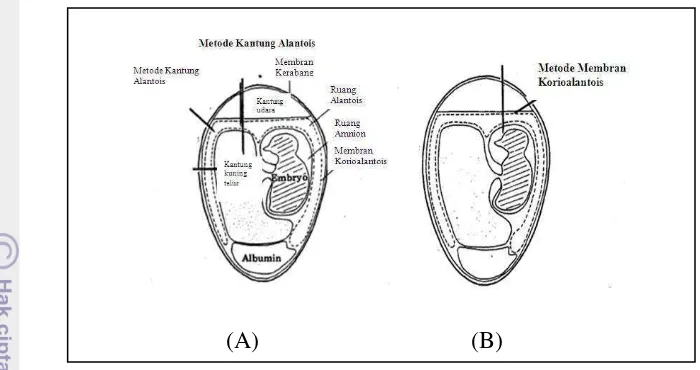
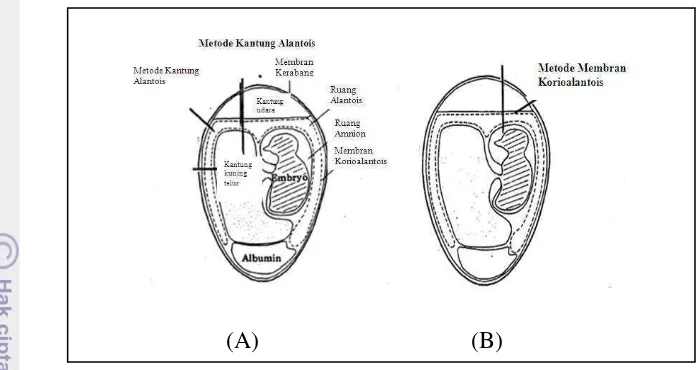
Gambar 9 Rute inokulasi telur embrio tertunas melalui kantung alantois (A) dan membran koriolalantois (B) (Cunningham 1973).
Rute membran korioalantois dilakukan dengan menggunakan teknik “top
route membrane choriooallantoic”. Teknik ini dilakukan dengan cara candling
embrio, lalu dilakukan pemberian tanda antara membran korioalantois dan kantung udara atas untuk lokasi lubang. Setelah itu dibuat lubang menggunakan
dentist’s drill dan aplikasi inokulasi dilakukan dengan menggunakan needle
ukuran 26-28 G.
Pemanenan parasit
Pemanenan darah pada media kultur dilakukan secara desktruktif dengan mengambil darah telur embrio tertunas (TET). Darah pada embrio dipanen dengan membuka terlebih dahulu cangkang telur. Cangkang telur TET umumnya terdapat pembuluh darah, dan dilakukan pengambilan ulas darah pada bagian kapiler darah di perifer cangkang telur. Setelah dilakukan ulas darah, dilakukan pewarnaan menggunakan Giemsa 10% dan dilakukan penghitungan persentase jumlah parasit pada hasil ulas darah.
Analisis data
Data hasil pengamatan diolah dengan menggunakan ANOVA (Analysis of Varian). Kemudian dilanjutkan dengan uji Duncan Multiple range Test dengan
taraf 5% bila berbeda nyata pada perlakukan yang diberikan. Data ditampilkan dalam bentuk tabel dan diagram.
Rancangan percobaan
Percobaan ini dilakukan dengan menggunakan rancangan kelompok lengkap teracak (RKLT) dengan 2 faktor yaitu rute inokulasi dan umur embrio. Faktor rute inokulasi terdapat 2 taraf yaitu rute melalui membran korioalantois dan kantung alantois. Umur embrio terdapat 4 taraf yaitu umur embrio 16 hari (H16), 17 hari (H17), 18 hari (H18), dan 19 hari (H19), inokulasi dilakukan pada embrio umur 13 hari. Peubah yang diamati yaitu persentase parasitemia dan persentase diferensial leukosit yang terdiri dari limfosit, monosit, heterofil, basofil, dan eosinofil.
HASIL DAN PEMBAHASAN
Parasitemia
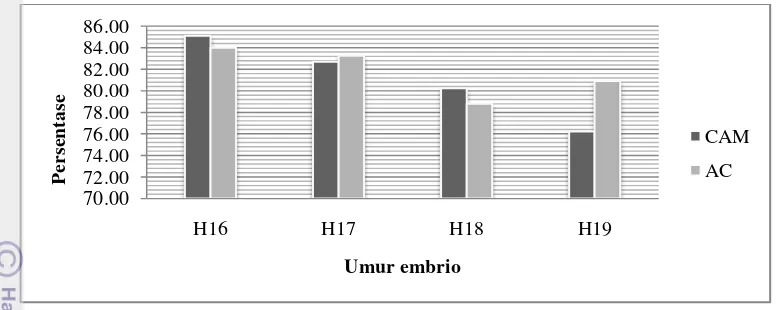
Hasil penelitian menunjukan bahwa semua rute inokulasi baik melalui membran korioalantois maupun kantung alantois dapat menginfeksi semua telur tertunas (TET). Namun terdapat perbedaan nilai parasitemia ulas darah embrio ayam pada beragam umur TET yang ditunjukan pada Tabel 2.
Tabel 2 Rata-rata persentase parasitemia pada telur embrio tertunas yang diinokulasi dengan L. caulleryi.
Keterangan : Angka yang diikuti huruf superskrip berbeda menunjukan berbeda nyata pada taraf
p<0.05% (H16=3 hari pasca infeksi, H17=4 hari pasca-infeksi, H18=5 hari pasca-infeksi, dan
H19=6 hari pasca-infeksi).
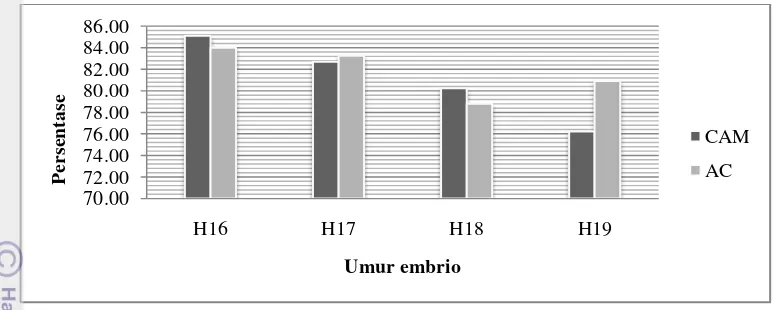
Berdasarkan tabel 2, didapatkan bahwa nilai parasitemia pada umur telur yang sama menunjukan nilai lebih tinggi untuk rute infeksi melalui membran korioalantois dibandingkan dengan rute infeksi melalui kantung alantois. Nilai parasitemia pada rute membran korioalantois (CAM) terendah pada saat umur embrio H16 (hari ke-3 pascainfeksi) yaitu 0.14% dan semakin meningkat pada umur embrio 17,18, dan 19 hari secara berurut-turut yaitu 0.33%, 0.35%, dan 1.33%. Sebaliknya, tidak ditemukan parasitemia pada rute infeksi melalui kantung alantois hingga hari ke-5 pascainfeksi (H16,H17, dan H18) dan ditemukan parasitemia dengan nilai relatif rendah pada hari ke-4 pascainfeksi pada umur embrio 19 hari yaitu 0.04%.
Perbedaan nilai parasitemia pada masing-masing rute inokulasi dapat disebabkan perbedaan karakterikstik pada membran korioalantois dan kantung
Umur TET Rute inokulasi
Membran Korio-alantois (CAM) Kantung Alantois (AC)
H16 0.14±0.11c 0.00±0.00d
H17 0.33±0.04b 0.00±0.00d
H18 0.35±0.12b 0.00±0.00d
alantois. Membran korioalantois dan kantung alantois pada tahap embrional ayam berfungsi sebagai media pertukaran nutrisi dan gas sehingga terdapat banyak vaskularisasi darah (Cunningham 1973). Namun, kantung alantois juga berfungsi sebagai organ ekskresi sehingga pada umur embrio 13 hari, kantung alantois menerima hasil buangan dari ginjal yang menyebabkan perubahan kondisi alantois yang sedikit alkali atau basa (Cuningham 1973). Kondisi kantung alantois yang basa diduga sebagai penyebab sedikitnya parasit yang dapat berkembangbiak pada rute infeksi melalui kantung alantois.
Inokulasi parasit melalui kantung alantois juga menyebabkan darah berparasit akan tercampur dengan cairan alantois. Cairan alantois merupakan bagian dari cairan albumin yang sebagian besar terdiri dari air (Etches 1996). Senyawa yang terlarut dalam cairan alantois akan berdifusi masuk ke dalam cairan amnion. Selanjutnya, cairan akan diserap masuk ke dalam embrio melalui mulut dan trakhea sehingga tidak terjadi penumpukan parasit dalam embrio (Jochemsen dan Jeurissen 2002). Hal ini diduga menyebabkan pengenceran dosis parasit sehingga parasit yang berkembang relatif sedikit.
Membran korioalantois merupakan gabungan membran korion dan alantois yang memiliki banyak vaskularisasi darah. Selain itu, membran korioalantois juga memiliki membran tipis dan bening yang terdiri dari 2 lapis epitel yang dipisahkan oleh jaringan ikat (Ribatti et al. 2000). Hal ini dapat memudahkan parasit untuk mencapai endotel lebih cepat dibandingkan rute infeksi melalui kantung alantois. Ribatti et al. (2000) juga menyatakan bahwa membran korioalantois memiliki banyak vaskularisasi yang berfungsi sebagai transpor nutrisi dari kuning telur dan albumin ke embrio sehingga pada penelitian ini, parasit dapat berkembang dan tersebar lebih cepat ke dalam embrio ayam.
Peningkatan nilai persentase parasitemia pada masing-masing umur embrio terjadi secara signifikan dari hari ke-2 hingga ke-4 pasca-kultur baik pada inokulasi melalui rute membran korioalantois maupun kantung alantois. Persentase parasitemia didapatkan dari hasil ulas darah keberadaan gametosit
menjadi gametosit dewasa (Fallis dan Desser 1977). Hal inilah yang menyebabkan peningkatan fase gametosit parasit dari hari ke-2 hingga hari ke-6 pasca-okulasi parasit.
Pengaruh Umur Embrio Terhadap Respon Leukosit
Proses pendewasaan respon imun berkembang pada saat tahap embrional, sehingga perlu dilakukan pemeriksaan lebih lanjut terhadap nilai diferensial leukosit yang didapatkan dari hasil ulas darah embrio. Hasil dari pengamatan diferensial leukosit pada rute inokulasi parasit yang berbeda secara umum didapatkan persentase tertinggi berturut-turut yaitu limfosit, heterofil, dan monosit, serta diikuti oleh basofil dan eosinofil yang nilainya relatif tidak berbeda. Hasil dari penghitungan persentase diferensial leukosit sebagai berikut:
Limfosit
Berdasarkan tabel 3 dan gambar 10, persentase limfosit pada embrio ayam yang diinokulasi parasit menunjukan nilai yang berbeda nyata pada faktor rute inokulasi maupun faktor umur embrio (p<0.05). Nilai persentase limfosit menunjukan nilai leukosit tertinggi dibandingkan jenis leukosit lainnya. Menurut McBride (2002), limfosit merupakan leukosit yang bertindak sebagai pertahanan imun spesifik dan awal dari reaksi adaptasi respon kekebalan berupa antigen. Antigen dapat berasal dari benda asing seperti bakteri, virus, dan parasit bahkan dapat juga bagian dari mekanisme imun tubuh. Keberadaan parasit Leucocytozoon
Gambar 10 Rata-rata persentase limfosit embrio yang diinokulasi L caulleryi. CAM: chorio-allantoic membrane, AC: Allantoic cavity. H16=3 hari pasca infeksi, H17=4 hari pasca infeksi, H18=5 hari pasca infeksi, dan H19=6 hari pasca infeksi
Tabel 3 Rata-rata persentase diferensial leukosit pada telur embrio tertunas yang diinfeksi Leucocytozoon caulleryi dengan rute inokulasi melalui membran korioalantois dan ruang alantois.
Rute inokulasi Umur
Embrio Monosit Limfosit Heterofil Basofil Eosinofil
Membran Korioalantois
H16 0.44 ±0.73b 85.11±1.83a 13.78±1.79c 0.11±0.33b 0.33±0.50b H17 0.56±0.73b 82.67±1.58abc 15.33±2.18abc 0.22±0.44b 0.67±0.87b H18 1.11±1.36b 80.22±2.77bcd 17.00±1.41abc 0.89±1.05a 0.67±0.71b H19 2.89±2.57a 76.22±3.21d 15.56±3.21abc 0.78±0.93ab 2.67±1.32a
Kantung Alantois
H16 0.44±0.53b 84.00±2.78a 14.89±2.32bc 0.44±0.73ab 0.11±0.33b H17 0.33±0.50b 83.22±3.35ab 16.11±3.44abc 0.22±0.44b 0.11±0.33b H18 0.67±0.71b 78.78±3.38cd 19.00±1.50a 0.33±0.50ab 0.11±0.33b H19 0.44±0.73b 80.89±2.15abc 18.11±0.93ab 0.11±1.01b 0.44±1.01b Morita et al.
(2010) 2.6 – 4.4 70.1 – 83.3 12.3 – 25.2 1.0 – 2.0 0.1 – 0.5
Keterangan : Angka yang diikuti huruf superskrip berbeda menunjukan berbeda nyata pada taraf p<0.05% (H16=3 hari pasca infeksi, H17=4 hari pasca
Heterofil
Berdasarkan tabel 3 dan gambar 11, persentase heterofil dari embrio tertunas yang diinokulasi parasit melalui kantung alantois memiliki nilai yang lebih tinggi dibandingkan inokulasi melalui membran korioalantois (p<0.05). Heterofil pada unggas memiliki fungsi yang sama seperti neutrofil pada mamalia dimana keberadaan heterofil tidak menunjukan adanya antigen spesifik. Heterofil memiliki fungsi penting pada fase terjadinya infeksi akut (Brooks et al. 1996). Jika dibandingkan dengan nilai parasitemia pada kedua rute inokulasi, inokulasi melalui kantung alantois memiliki nilai parasitemia lebih rendah dibandingkan rute inokulasi membran korioalantois. Hal ini diduga dipengaruhi kerja dari heterofil sebagai pertahanan terhadap masuknya parasit dengan melakukan fagosit (McBride 2002).
Gambar 11 Rata-rata persentase heterofil embrio yang diinokulasi L caulleryi. CAM: chorio-allantoic membrane, AC: Allantoic cavity. H16=3 hari pasca infeksi, H17=4 hari pasca infeksi, H18=5 hari pasca infeksi, dan H19=6 hari pasca infeksi
Penelitian yang dilakukan Morita et al. 2009 dan Morita et al. 2010 didapatkan bahwa terdapat perubahan tidak terdapat perbedaan yang nyata pada nilai heterofil pada masa embrio tertunas dengan nilai antara 12.3-25.2%. Penelitian yang dilakukan menunjukan bahwa nilai heterofil berada dalam kisaran normal yaitu 13.78-19%. Persentase heterofil meningkat dari umur embrio 16 hingga 18 hari dan menurun pada umur ke-19 hari pada kedua jenis rute inokulasi. Peningkatan jumlah heterofil terjadi sebagai pertahanan tidak spesifik terhadap
parasit Leucocytozoon yang semakin meningkat seiring dengan bertambah umur embrio.
Monosit
Berdasarkan tabel 3 dan gambar 12, persentase monosit pada rute inokulasi parasit melalui membran korioalantois lebih tinggi dibandingkan rute kantung alantois (p<0.05). Persentase monosit meningkat pada rute inokulasi parasit melalui membran korioalantois dari umur embrio 16 hari sebesar 0.44% dan meningkat secara bertahap hingga hari ke-19 menjadi 2.89%. Persentase monosit pada rute inokulasi kantung alantois tidak berbeda nyata (p<0.05) namun memiliki kecenderungan relatif meningkat dari umur embrio 16 hari (0.44%) hingga umur 18 hari (0.67%) dan kembali turun pada umur 19 hari menjadi 0.44%.
Gambar 12 Rata-rata persentase monosit embrio yang diinokulasi L caulleryi. CAM: chorio-allantoic membrane, AC: Allantoic cavity. H16=3 hari pasca infeksi, H17=4 hari pasca infeksi, H18=5 hari pasca infeksi, dan H19=6 hari pasca infeksi.
Monosit mempunyai fungsi fagositosis dan menjadi makrofag ketika keluar dari endotel darah. Fagositosis monosit mempunyai sifat sama seperti heterofil namun monosit bekerja pada kondisi infeksi yang tidak terlalu akut (Frandson 1986). Persentase monosit yang semakin tinggi diduga dikarenakan peningkatan parasitemia. Morita et al. (2009) menyatakan peningkatan monosit terjadi pada perkembangan embrio ayam hingga umur 18 hari dan semakin menurun hingga embrio tertunas menetas. Hal ini terjadi sebagai respon
menurunnya fungsi kekebalan tidak spesifik sebagai persiapan paparan terhadap lingkungan luar setelah telur menetas.
Basofil
Berdasarkan tabel 3 dan gambar 13, persentase basofil pada dua rute inokulasi memiliki nilai relatif rendah dibandingkan dengan diferensial leukosit lainnya. Persentase basofil pada rute membran korioalantois mengalami peningkatan dari umur embrio 16 hari (0.11%) mencapai puncak pada umur ke-18 hari (0.89%) dan kembali turun pada umur 19 hari (0.78%). Persentase basofil pada rute kantung alantois relatif rendah sehingga perubahan fluktuatif tidak terlalu berpengaruh terhadap nilai persentasi basofil.
Gambar 13 Rata-rata persentase basofil embrio yang diinokulasi L caulleryi. CAM: chorio-allantoic membrane, AC: Allantoic cavity. H16=3 hari pasca infeksi, H17=4 hari pasca infeksi, H18=5 hari pasca infeksi, dan H19=6 hari pasca infeksi.
Eosinofil
Berdasarkan tabel 3 dan gambar 14, persentase eosinofil pada rute membran korioalantois lebih tinggi dibandingkan dengan rute kantung alantois (p<0.05). Persentase eosinofil berdasarkan umur embrio semakin meningkat berbeda nyata pada rute inokulasi parasit melalui membran korioalantois dari umur embrio 16 hari (0.33%) meningkat secara bertahap hingga umur 19 hari (2.67%) (p<0.05). Sebaliknya pada rute inokulasi kantung alantois menunjukan tidak berbeda nyata, walaupun persentase eosinofil relatif meningkat seiring dengan bertambahnya umur embrio.
Gambar 14 Rata-rata persentase eosinofil embrio yang diinokulasi L caulleryi. CAM: chorio-allantoic membrane, AC: Allantoic cavity. H16=3 hari pasca infeksi, H17=4 hari pasca infeksi, H18=5 hari pasca infeksi, dan H19=6 hari pasca infeksi.
SIMPULAN DAN SARAN
Simpulan
1. Telur embrio tertunas dapat dijadikan media alternatif kultur dan model infeksi parasit Leucocytozoon caulleryi dengan rute inokulasi melalui membran korioalantois memiliki nilai parasitemia lebih tinggi dibandingkan rute inokulsi melalui kantung alantois.
2. Embrio pada telur embrio tertunas telah mengalami respon imun akibat inokulasi parasit dilihat dari pemeriksaan diferensial leukosit dengan persentase tertinggi berturut-turut yaitu limfosit, heterofil, monosit, basofil, dan eosinofil.
Saran
DAFTAR PUSTAKA
Adriawan F. 2005. Teknik Biakan Babesia canis Secara In Vitro Dengan Konsentrasi Serum 40%. [Skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Brooks RL, Arbtan DJ, Andreasen CB. 1996. Functional Comparation of Avian Heterophils with Human and Canine Neutrophil. Comparation Haematology International 6: 153-159
Campbell TW. 1995. Avian Hematology and Cytology. Iowa: Iowa State University Press.
Cunningham CH. 1973. A Laboratory Guide in Virology 7th Ed. Minneapollis: Burgess Publishing Co.
Dellman HD, Brown EM. 1992. Histlogi Veteriner. Ed ke-3. Jakarta: UI Press. Desser SS, Bennet GF. 1993. The Genera Leucocytozoon, Haemoproteus, and
Hepatocystis. Di dalam: JP Kreiner, editor. Parasitic Protozoa Vol 3.
Ohio: Academic Press.
Earle RA, Bennet GF, Brossy JJ. 1992. First African Record of Leucocytozoon tawaki (Apicomplexa: Leucocytozoidea) from Jackass Penguin
Spheniscus demersus. South African Journal of Zoology 27: 89-90.
Etches RJ. 1996. Reproduction of Poultry. United Kingdom: University Press.
Evans M, Otter A. 1998. Fatal Combined Infection of Haemoproteus noctuae and
Leucocytozoon ziemanni in juvenile snowy owls (Nyctea sandiaca).
Veterinary Record 143(3): 72-76.
Fallis AM, Desser SS. 1977. On Species of Leucocytozoon, Haemoproteus, and
Hepatocystis. Di dalam JP Kreier, editor. Parasitic Protozoa Vol 3. San Francisco: Academic Press.
Fallis AM, Khan SS. 1974. On Species of Leucocytozoon. Advance Parasitoogy
Ganong WF. 2002. Buku Ajar Fisiologi Kedokteran Ed ke-20. Didalam Widjajahkusumah DHM, editor. Jakarta : EGC.
Grimes SE. 2002. A Basic Laboratory Manual for Small-Scale Production and Testing of I-2 NewCastle Disease Vaccine. Roma : FAO Publication. Guyton DC, Hall JE. 2008. Texbook of Medical Physiology. 11th Edition.
Philadelphia : WB Saunders Company.
Hill AG. 2008. An Investigation of Leucocytozoon in Endangered Yellow-Eyed Penguin (Megadyptes antipodes) [Thesis]. New Zealand: Master Veterinay Science Programme, Massey University.
Johston DA, Liu H, O’Connel T, Phelps P, Bland M, Tyczkowski J, Kemper, Harding T, Avakian A, Haddad E, Whitfill C, Gildersleeve R, Rick CA. 1997. Applications in ovo technology. Poultry Science 76: 165–178. Jacobsen ID, Grosse K, Slesiona S, Hube B, Berndt A, Brock M. 2010.
Embryonated Egg as an Alternative Model to Investigate Aspergillus fumigatus Virulence. Infection and Immunity 78(7):2995-3006.
Jochemsen P, Jeuressen SHM. 2002. The localization of and uptake of in ovo injected soluble and particulate subtances in the chicken. Poultry Science
81: 1811-1817
Matjik AA, Sumertajaya MM. 2002. Perancangan percobaan dengan aplikasi SAS dan Minitab. Bogor : IPB Press.
Mansourian M, Tafti AK, Namavari M. 2009. Histopathological and Clinical Investigation in Neospora caninum Experimentally Infected on Broiler Chicken Embryonated Eggs. Veterinary Parasitology 166:185-190. McBride DF. 2002. The Immune System : The Defenders of the Body. Di dalam:
Duncan LL, editor. Learning Veterinary Terminology. Missouri : Mosby, Inc.
Mello MN, Deane MP. 1976. Pattern Development of Trypanosoma cruzi in the Embryonated Egg. Annnual Tropical Medicine Parasitology 70: 380-388.
Morita VS, Boleli IC, Cargnelutti FA. 2009. Hematological values and body, heart, and liver weights of male and female broiler embryos of young and old breeder egss. Revista Brasileria de Ciencia Avicola 11(1): 7-15. Morita VS, Boleli IC, Oliveira JA. 2010. Hematological and Incubation
Murtini S, Murwani R, Satrija F, Malole MBM. 2006. Penetapan Rute dan Dosis Inokulasi pada Telur Ayam Berembrio sebagai Media Uji Khasiat Ekstrak Benalu Teh (Scurulla oortiana). JITV 11(2): 137-143.
Phillips KM. 2010. Psitacine Blood Collection and Hematology : Basics for Veterinary Practitioner. Seminars in Avian and Excotic Pet Medicine
(3)1: 5-13.
Purwanto B, Lestariningsih L, Setyawan H. 2010. Leucocytozoonosis, dari Gejalanya sampai Penanganannya. Majalah Poultry. Edisi Juli 2010 Raidal SR, Jaensch SM. 2000. Central Nervous Disease and Blindness in Nankeen
Kestrels (Falco cenchroides) Due to a Novel Leucocytozoon-like Infection. Avian Pathology 29:51-56.
Ribbati DA, Vacca A, Roncali L, Dammaco F. 2000. The chick embryo chorrioalllantoic membrane as model for in vivo research on anti-angiogenesis. Current Pharma Biotechnology 1: 73-82.
Ricks CA, Mendu N, Phelps PV. 2003. The Embryonated Egg : A Practical Target for Genetic Based Advances to Improve Poultry Production.
Poultry Science 82:931-938.
Schulzt RD, Florence C, Dunne HW. 1971. Occurrence of Blood Cells and serum Protein in Bovine Fetuses and Calves. Canandian Journal Comparation Medicine 35: 93-98.
Setijanto H. 1998. Anatomi unggas. Diktat Ajar Anatomi Veteriner. Bogor: Fakultas Kedokteran Hewan IPB.
Smith TW. 2010. Avian Embryo. Extention Service of Missisipi State University and USDA.
Staddler CK, Carpenter JW. 1996. Parasites of Backyard Game Birds. Avian and Exotic Pet Medicine 5(4):85-96.
Springer WT. 1991. Other Blood and Tissue Protozoa, in Poultry. Di dalam : BW Calnek, CW Beard, dan HJ Barnes, editor. Disease of Poultry (9th Ed). Ames Iowa : Iowa University Press.
Sunaga F, Namikawa K, Kanno Y. 2002. Continous In Vitro Culture of Erytrocyte Stages of Babesia gibsoni and Virulence of the Cultivated Parasite. Japan Veterinary Medicine Science 64(7):571-575.
Takamatsu H, Fujisaki K, Kitaoka S, Ishii T, Fujita J. 1984. Cultivation
Tampubolon MP. 1992. Protozoologi. Pusat Antar Universitas Ilmu Hayat, Institut Pertanian Bogor.
Tella JL. Blanco G, Forero MG, Gajon A, Donajar JA, Hiraldo F. 1999. Habitat, World Demogarphic Range, and Embryonic Development of Host Explain The Prevalence of Avian Heamatozoa at Small and Phylogenic Scales. Procedding of the National Academic Science, USA 96 : 1785-1789
Tizard I. 1988. Pengantar Imunologi Veteriner. Ed ke-3. Hardjosworo S, penerjemah. Surabaya : Universitas Airlangga. Terjemahan dari : An Introductionary of Veterinary Imunology.
PENDAHULUAN
Latar Belakang
Peningkatan jumlah penduduk dunia mencapai 1,1% dalam 10 tahun terakhir, menjadikan permintaan pasokan pangan meningkat. Peningkatan pasokan pangan dunia meliputi permintaan kebutuhan pada sektor peternakan dengan salah satu komoditas yaitu unggas. Sektor peternakan unggas memasok 30% dari total konsumsi daging sehingga menyebabkan perdagangan unggas dunia mengalami peningkatan hingga mencapai 9,2 juta ton per tahun, dengan peningkatan mencapai 5,3% tiap tahunnya (FAO 2007).
Peningkatan produksi unggas mengalami kendala diakibatkan peningkatan kasus kejadian penyakit yang seringkali dialami oleh peternak unggas di Indonesia. Sebagai salah satu negara tropis, Indonesia memiliki kerentanan terhadap kejadian leucocytozoonosis. Leucocytozoonis merupakan penyakit yang diakibatkan parasit Leucocytozoon sp yang dapat menyebabkan penurunan produksi hingga 25-75% (Purwanto et al. 2010). Leucocytozoon merupakan parasit yang bersifat obligat dan intraseluler pada darah dan jaringan, serta dapat menghancurkan sel pada tubuh inang. Beragam spesies Leucocytozoon dapat menginfeksi famili unggas secara luas pada unggas produksi, unggas peliharaan, maupun unggas liar (Hill 2008). Siklus hidup Leucocytozoon terdiri dari siklus seksual yang terjadi di inang definitif seperti ayam, bebek, bahkan penguin. Siklus aseksual terjadi pada inang antara yaitu Simulium dan Cullicoides (Earle et al.
1992; Evans dan Otter 1998; dan Hill 2008).
Kejadian leucocytozoonosis tersebar di seluruh dunia dan bersifat dinamis tergantung pada host susceptibility, keberadaan vektor, dan preferensi vektor untuk spesies tertentu (Desser dan Bennet 1993). Daerah pegunungan yang memiliki banyak aliran sungai memberikan lingkungan berkembangbiak optimal untuk vektor Leucocytozoon yaitu Simulium dan Culicoides. Kejadian penyakit juga lebih sering terjadi di peternakan yang terletak di dekat danau, rawa, ataupun sungai (Stadller dan Carpenter 1996).
sedangkan kasus kronis menyerang pada ayam tua terutama ayam petelur (Whiterman dan Bickford 1989). Infestasi Leucocytozoon sp dapat terjadi tanpa disertai gejala klinis maupun disertai gejala klinis. Gejala klinis pada ayam yang terserang leucocytozoonosis meliputi depresi, hilang nafsu makan, muntah darah, dan kelumpuhan hingga mengakibatkan kematian. Serangan yang tidak disertai dengan gejala klinis umumnya berupa penurunan produksi telur maupun bobot badan ayam (Purwanto et al. 2010). Raidal dan Jaensch (2000) melaporkan bahwa terdapat gejala pada sistem syaraf pusat yang diduga akibat dari formasi skizon sehingga menghambat kapiler otak. Biliverdinuria juga terjadi akibat dari dekstruksi eristrosit dan inflamasi hepatik hingga nekrosis.
Kerugian yang ditimbulkan akibat infeksi Leucocytozoon menyebabkan perlu dilakukan pencegahan maupun pengobatan pada kasus leucocytozoonosis. Pencegahan dapat dilakukan dengan membatasi vektor parasit dan menjaga kebersihan kandang. Penggunaan pyrimetamine dan sulfonamide bersifat efektif untuk mencegah infeksi, namun untuk pengobatan masih memiliki hambatan dikarenakan prevalensi parasit darah pada unggas tidak bersifat spesifik-spesies yang tetap, namun lebih dikarenakan siklus parasitemia, faktor lingkungan, dan juga populasi (Tella et al. 1999 dan Springer 1991). Hal ini menyebabkan parasitemia dapat terjadi setiap saat, namun gejala klinis muncul pada saat inang mengalami imunosupresi. Hal inilah yang membuat sulit dilakukan pencegahan dan pengendalian Leucocytozoon. Infestasi kronis Leucocytozoon juga masih belum dipahami secara mendalam sehingga masih diduga bahwa stress sebagai penyebab primer kejadian penyakit ini.
Hambatan dalam pengobatan dan pencegahan leucocytozoonosis memerlukan penelitian lebih lanjut tentang sifat, karakter, dan tingkat patogenitas dari parasit. Penelitian memerlukan penggunaan kultur parasit dan model infeksi sebagai salah satu usaha dalam untuk memproduksi antigen yang digunakan sebagai uji serologik dan imnunogen untuk pencegahan penyakit (Sunaga et al.
Telur embrio tertunas telah banyak digunakan sebagai media kultur dan model infeksi beragam parasit. Telur embrio tertunas telah berhasil dikembangkan sebagai alternatif model infeksi pada Aspergillus fumigatus, Neospora caninum, Trypanosoma cruzy (Jacobsen et al. 2010; Mansourian et al. 2009; Mello dan Deane 1976). Telur embrio tertunas juga telah digunakan sebagai pengujian bahan obat dan ekstrak herbal seperti ekstrak benalu teh (Murtini et al. 2006). Takamutsu et al. (1984) telah berhasil melakukan kultur Leucocytozoon fase sporozoit pada telur embrio tertunas dengan inokulasi melalui membran korioalantois.
Pengujian menggunakan telur embrio tertunas memiliki keunggulan dibandingkan dengan kultur sel dikarenakan tidak menggunakan media dan kondisi laboratorium yang rumit sehingga biaya yang dibutuhkan relatif murah. Telur berembrio sebagai sistem biologis yang dinamis diharapkan menggambarkan kondisi in vivo. Kondisi in vivo yang dimaksud yaitu adanya metabolisme dan perkembangan sel-sel embrio di dalam telur yang berkembang secara terus-menerus. Baik parasit maupun zat kimia tertentu dapat diinokulasi ke dalam telur. Efek parasit dan zat kimia yang terhadap embrio tergantung pada umur embrio dan aplikasi rute pemberian (Johston et al. 1997).
Tujuan Penelitian
Tujuan dilakukan penelitian ini untuk memperoleh informasi tentang penggunaan telur embrio tertunas sebagai alternatif media kultur dan model infeksi Leucocytozoon caulleryi.
Manfaat Penelitian
Hipotesis Penelitian
1. Penelitian ini menduga bahwa telur embrio tertunas dapat dijadikan sebagai alternatif media kultur dengan rute inokulasi membran korioalantois atau ruang alantois berdasarkan persentase parasitemia darah pada umur embrio tertentu. 2. Penelitian ini menduga bahwa telur embrio tertunas memiliki respon imun