PRAKATA
Puji syukur atas Kehadirat Allah SWT yang senantiasa memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini sebagai salah satu syarat memperoleh gelar Sarjana Sains pada Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor. Shalawat dan salam disampaikan kepada Nabi Muhammad SAW beserta keluarga, sahabat, dan pengikutnya yang tetap berada di jalan-Nya hingga akhir zaman.
Penulis mengucapkan terima kasih kepada Ibu Sri Sugiarti Ph.D dan Ibu Dr. Eti Rohaeti, MS selaku pembimbing atas segala saran, kritik, dorongan, dan bimbingannya selama penelitian dan dalam penyusunan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Bapak Sawal, Bapak Mulyadi, Bapak Caca, dan Teteh Nurul selaku staf laboran di Laboratorium Kimia Anorganik, atas fasilitas, bantuan, serta masukan yang diberikan. Ungkapan terima kasih juga penulis berikan kepada keluarga tercinta, atas nasihat, semangat, bantuan materi, dan doanya. Selain itu, penulis mengucapkan terima kasih kepada teman-teman seperjuangan penelitian di Laboratorium Kimia Anorganik, terutama Linda, Ade, dan Evan atas saran, kritik, dan semangat selama penelitian. Terima kasih kepada keluarga besar Rumah Eldeweis atas kebersamaan dan keceriaan selama ini serta terimakasih kepada rekan-rekan kimia 45 atas dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2013
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Alat dan Bahan 2
Prosedur Kerja 2
Preparasi Metakaolin 2
Sintesis Zeolit X 3
Sintesis Nanokomposit Zeolit X/TiO2 3
Penentuan Panjang Gelombang Maksimum Biru Metilena 3
Uji Adsorpsi 4
Pembuatan Kurva Standar Biru Metilena 4
Uji Fotodegradasi 4
HASIL DAN PEMBAHASAN 4
Zeolit X dan Nanokomposit Zeolit X/TiO2 4
Karakteristik Zeolit X dan Nanokomposit Zeolit X/TiO2 5
Kapasitas Adsorpsi 9
Isoterm Adsorpsi Zeolit dan Nanokomposit 11
Hasil Pengujian Fotodegradasi 12
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1 Kode sampel pembuatan zeolit X 3
2 Hasil identifikasi zeolit 6
3 Komposisi bahan baku dan hasil sintesis menggunakan SEM-EDX 9 4 Koefisien determinasi dan tetapan isoterm adsorpsi biru metilena oleh
zeolit dan nanokomposit 11
5 Reaksi yang terjadi pada pengujian fotodegradasi 13
DAFTAR GAMBAR
1 Difraktogram Zeolit ZS1 5
2 Perbandingan difraktogram NC3 dengan ZS3. 6
3 Morfologi kaolin perbesaran 2000x 7
4 Metakaolin perbesaran 2000x 7
5 Morfologi ZS3 perbesaran 2500x 8
6 Morfologi NC3 perbesaran 5000x 8
7 Kapasitas penjerapan ZS1, ZS2 dan ZS3 10
8 Perbandingan kapasitas penjerapan antara ZS3 dan NC3 11 9 BM pada filtrat interaksi tanpa radiasi UV: (A) tanpa sampel, (B)
TiO2, (C) NC3 dan (D) ZS3 12
10 BM pada filtrat interaksi dengan radiasi UV: (E) tanpa sampel, (F)
TiO2, (G) NC3 dan (H) ZS3 12
11 Spektrum UV-Vis filtrat sampel di tempat gelap. BM (G1), BM + TiO2 (G2), BM + ZS3 (G3) dan BM + NC3 (G4). 13 12 Spektrum UV-Vis filtrat sampel dibawah sinar UV. BM (V1), BM +
TiO2 (V2), BM + ZS3 (V3) dan BM + NC3 (V4). 13
5 Difraktogram XRD sampel nanokomposit 20
6 JCPDS zeolit A (Na)dan LTA 21
7 JCPDS Zeolit X 22
8 Referensi SEM Zeolit A dan Zeolit X 22
9 Hasil SEM-EDX kaolin 23
10 Hasil SEM-EDX metakaolin 23
14 Penentuan pola isoterm adsorpsi BM oleh ZS2 26 15 Penentuan pola isoterm adsorpsi BM oleh ZS3 27 16 Penentuan pola isoterm adsorpsi BM oleh NC3 28 17 Penentuan panjang gelombang maksimum larutan biru metilena 29
18 Kurva standar larutan biru metilena 29
19 Data penentuan kapasitas adsorpsi BM pada ZS1 30 20 Data penentuan kapasitas adsorpsi BM pada ZS2 30 21 Data penentuan kapasitas adsorpsi BM pada ZS3 30 22 Data penentuan kapasitas adsorpsi BM oleh NC3 31
PENDAHULUAN
Zeolit merupakan mineral alami yang tersusun dari kerangka silika-alumina tetrahedral yang dihubungkan oleh atom oksigen untuk membentuk kerangka zeolit. Tiap atom Al pada kerangka zeolit bersifat negatif dan akan dinetralkan oleh ikatan dengan kation yang mudah dipertukarkan. Kation yang mudah dipertukarkan yang ada pada kerangka zeolit ini berpengaruh dalam proses adsorpsi (Ozkan dan Ulku 2008). Selain jenis kation, kemampuan adsorpsi zeolit juga dipengaruhi oleh perbandingan Si/Al dan geometri pori-pori zeolit, termasuk luas permukaan dalam, distribusi ukuran pori dan bentuk pori (Gruszkiewicz et al. 2005).
Zeolit ada dua macam, yaitu zeolit alam dan sintetis. Zeolit alam sudah banyak dimanfaatkan di berbagai bidang, seperti: bidang pertanian digunakan sebagai pupuk, di bidang lingkungan untuk pengolahan air dan di bidang industri sebagai penukar kation, adsorben dan katalis. Zeolit alam memiliki beberapa kelemahan, antara lain, adanya pengotor, ukuran pori yang bervariasi, dan adanya struktur amorf. Kelemahan zeolit alam ini mendorong peneliti untuk membuat zeolit sintetis yang memiliki tingkat homogenitas tinggi dengan ukuran pori yang dapat dikendalikan sesuai kehendak (Banon dan Suharto 2008). Indonesia banyak membutuhkan zeolit sintetis untuk proses–proses kimia di industri seperti sebagai katalis, penukar ion, dan adsorben dalam pengolahan limbah. Sintesis zeolit sintetis dibuat dari berbagai sumber bahan baku, terutama dari bahan yang dapat ditingkatkan nilai ekonomisnya. Bahan baku pembuatan zeolit adalah bahan yang mengandung silika dan alumina. Salah satu bahan yang dapat digunakan adalah kaolin. Hal ini disebabkan karena kaolin mengandung SiO2 dan Al2O3 yang merupakan bahan dasar untuk menyintesis zeolit (Barreer 1978). Kaolin umumnya digunakan sebagai pengisi kertas, plastik, karet, cat, keramik, insektisida, zat aditif makanan, dan industri kosmetik (Murray 1960).
Salah satu zeolit sintetis yang memiliki penjerapan maksimum yaitu zeolit X. Zeolit X memiliki pori yang besar dengan kadar silika rendah yang menyebabkan sifat adsorpsinya optimum dan sangat baik digunakan sebagai adsorben zat warna, dengan nisbah Si/Al 1-1,5. Kaolin memiliki nisbah Si/Al < 1, oleh karena itu untuk menyintesis zeolit X dibutuhkan sumber silika lain, yaitu natrium silikat (water glass, Na2SiO3). Peningkatan kualitas penjerapan zeolit X dilakukan dengan pembuatan nanokomposit zeolit X/TiO2 sehingga diperoleh material yang bersifat adsortif dan fotodegratatif. Zeolit memiliki kemampuan menyerap zat warna lalu digabungkan dengan TiO2 yang memiliki sifat fotokatalis sehingga dihasilkan adsorben yang dapat menjerap sekaligus mampu mengurai bahan yang terjerap (misalnya suatu senyawa toksik) menjadi senyawa yang aman di lingkungan. Oleh karena itu, metode alternatif yang digunakan adalah metode adsorpsi-fotodegradasi yang relatif murah tapi cukup efektif dalam penanggulangan sebagian besar polutan zat warna.
Perumusan Masalah
ion, dan adsorben dalam pengolahan limbah. Oleh karena itu, perlu dilakukan penelitian zeolit sintetis. Zeolit di sintesis menggunakan kaolin dan water glass sebagai sumber silika. Peningkatan kualitas penjerapan zeolit dilakukan dengan pembuatan nanokomposit zeolit/TiO2 guna mengurangi pencemaran limbah zat warna.
Tujuan Penelitian
Penelitian ini bertujuan menyintesis zeolit X dan nanokomposit zeolit X/TiO2 dari bahan dasar kaolin dan water glass serta melakukan pencirian dengan spektroskopi XRD, SEM dan uji adsorpsi serta fotodegradasi terhadap zat warna biru metilena.
Manfaat Penelitian
Penelitian ini bermanfaat memperoleh data cara menanggulangi polutan zat warna melalui adsorpsi oleh zeolit X yang disintesis dari kaolin dan water glass serta adsorpsi oleh nanokomposit zeolit X/TiO2 yang diharapkan memiliki sifat fotokatalis sehingga dapat digunakan untuk proses adsorpsi-fotodegradasi.
METODE
Alat dan Bahan
Alat-alat yang digunakan adalah alat-alat gelas, botol plastik (polipropilen), oven, tanur, neraca analitik, kertas pH, lampu UV, spektrofotometer UV-Vis, difraktometer sinar X (XRD), dan mikroskop elektron susuran (SEM). Bahan-bahan yang digunakan pada penelitian ini, antara lain kaolin dari Bangka Belitung, water glass, titanium oksida (TiO2), biru metilena, NaOH dan air destilata.
Prosedur Kerja
Penelitian ini terdiri atas empat tahap (Lampiran 1). Tahap pertama mencakup preparasi metakaolin (MK). Tahap kedua meliputi pembuatan zeolit dan nanokomposit zeolit X/TiO2, tahap ketiga adalah penentuan kapasitas adsorpsi, dan tahap terakhir adalah uji fotodegradasi menggunakan lampu UV pada panjang gelombang 365 nm.
Preparasi Metakaolin
telah berubah menjadi metakaolin dianalisis menggunakan SEM untuk mengetahui morfologinya (Thammavong 2003).
Sintesis Zeolit X
Sebanyak 2 g sampel metakaolin (hasil kalsinasi 700C) ditambahkan larutan NaOH dengan konsentrasi 1,5 N sebanyak 40 mL. Campuran tersebut kemudian ditambahkan 4 mL water glass yang dimasukkan dalam botol polipropilen dan didiamkan (ageing) pada suhu 40C selama 6 jam. Setelah itu, sampel dipanaskan dalam oven pada suhu 100C selama 24 jam. Produk disaring dan dicuci dengan air destilata dan dikeringkan kembali dalam oven 100C selama 6 jam. Produk padat yang diperoleh dikarakterisasi dengan XRD dan SEM. Zeolit kemudian disintesis lagi dengan prosedur yang sama seperti diatas dengan variasi NaOH 2,5 N dan waktu ageing 24 jam sehingga diperoleh kombinasi komposisi pada Tabel 1 (Thammavong 2003).
Tabel 1 Kode sampel pembuatan zeolit X
Kode sampel Komposisi dan waktu ageing
ZS1 MK + NaOH 1,5 N + water glass (ageing 24 jam) ZS2 MK + NaOH 2,5 N + water glass (ageing 24 jam) ZS3 MK + NaOH 2,5 N + water glass (ageing 6 jam)
Sintesis Nanokomposit zeolit X/TiO2
Pembuatan anokomposit zeolit X/TiO2 diawali dari sejumlah penambahan metakaolin dan TiO2, dengan nisbah 85:15 dalam 2 g. Sintesis nanokomposit zeolit X/TiO2 kemudian disintesis berdasarkan prosedur dan komposisi pada sintesis zeolit ZS3, yaitu sebanyak 20 mL NaOH 2,5 N ditambahkan 1 mL water glass dan diageing selama 6 jam pada suhu 40C. Setelah itu, campuran dipanaskan dalam oven pada suhu 100C selama 24 jam. Sampel disaring dan dicuci dengan air destilata hingga mencapai pH netral. Selanjutnya, endapan yang diperoleh dipanaskan kembali pada suhu 100C selama 24 jam. Hasil yang diperoleh kemudian dianalisis menggunakan XRD dan SEM (Hediana 2011).
Penentuan Panjang Gelombang Maksimum Biru Metilena
Larutan biru metilena 2 mg/L dipayar pada panjang gelombang 200-700 nm dengan spektrofotometer UV-Vis hingga diperoleh spektrum absorpsi biru metilena dan puncak serapan atau nilai absorbansi tertinggi. Panjang gelombang yang menghasilkan absorbansi tertinggi terhadap biru metilena adalah panjang gelombang maksimum biru metilena, digunakan untuk pengukuran selanjutnya.
Uji Adsorpsi
pengukuran konsentrasi metilena biru menggunakan spektrofotometer UV-Vis (Hediana 2011).
Pembuatan Kurva Standar Biru Metilena
Larutan biru metilena yang dibuat pada konsentrasi (0,5; 1; 1,5; 2; 2,5; dan 3 mg/L) diukur serapannya pada panjang gelombang maksimum. Setelah itu dibuat kurva hubungan antara konsentrasi dengan absorbansi, dan ditentukan persamaan linearnya. Persamaan linear ini digunakan untuk menghitung konsentrasi metilena biru pada larutan sampel (Hediana 2011).
Uji Fotodegradasi
Sebanyak 0,1 g TiO2, zeolit sintetis dan nanokomposit ditimbang masing-masing lalu ditambahkan 15 mL larutan biru metilena dengan konsentrasi 12,5 mg/L, kemudian diradiasi sinar UV pada panjang gelombang 365 nm selama 6 jam untuk melihat kemampuan campuran kedua material tersebut dalam menguraikan zat warna. Filtrat kemudian diukur serapannya pada pemayaran panjang gelombang 200 sampai 700 nm (Hediana 2011).
HASIL DAN PEMBAHASAN
Zeolit X dan Nanokomposit Zeolit X/TiO2
Kaolin dan water glass digunakan sebagai bahan baku pembuatan zeolit X. Pemilihan bahan ini didasarkan atas jumlahnya yang melimpah dan harganya yang relatif murah. Kaolin yang digunakan terlebih dahulu dikalsinasi pada suhu 700ºC. Menurut Janjira (2002), metakaolin akan terbentuk pada suhu kalsinasi 700ºC atau lebih. Namun jika kalsinasi dilakukan pada suhu ≥ 1050ºC maka yang akan terbentuk adalah mulit, sedangkan jika suhu kasinasi terlalu rendah maka yang akan terbentuk adalah hidroksi sodalit (Chandrasekar 1999). Kalsinasi bertujuan menghilangkan gugus hidroksil yang terikat secara kimia. Proses dehidroksilasi kaolin menghasilkan metakaolin.
2Al2Si2O5(OH)4 → 2Al2Si2O7 +4H2O
Selanjutnya, metakaolin direaksikan dengan NaOH 1,5 N dan 2,5 N. Tujuannya untuk melarutkan Si dan Al yang terkandung dalam metakaolin (Jozefaciuk dan Bowanko 2002), kemudian dipanaskan pada suhu 40ºC selama 24 jam. Pemanasan ini bertujuan mempercepat proses pembentukan inti kristal zeolit X. Selanjutnya, dipanaskan lagi pada suhu 100ºC selama 24 jam untuk menyempurnakan pembentukan kristal zeolit.
Zeolit yang dihasilkan kemudian dicuci dengan air destilata hingga pH netral. Pencucian ini bertujuan untuk menghilangkan material yang tidak menjadi bagian dari penyusun zeolit yang mungkin ada di permukaan dan larut dalam air. Zeolit kemudian dikeringkan dalam oven pada suhu 100ºC selama 6 jam, yang bertujuan menguapkan air yang terperangkap dalam pori-pori kristal zeolit sehingga
jumlah pori dan luas permukaan spesifiknya bertambah (Suardana 2005). Zeolit sintetis yang dihasilkan berupa serbuk putih kekuningan.
Pembuatan nanokomposit zeolit X/TiO2 bertujuan meningkatkan sifat individu dari zeolit, baik dari segi kekuatan, struktur atau stabilitas, sehingga dapat bersinergi dalam menghilangkan zat warna. Nanokomposit dibuat dengan perlakuan yang sama seperti sintesis zeolit, hanya saja pada nanokomposit diberikan bahan TiO2 yaitu semikonduktor yang sering digunakan sebagai katalis dalam penanganan polutan dan zat warna. Titanium oksida paling banyak digunakan sebagai bahan fotokatalis karena paling stabil, tahan terhadap korosi, memiliki sifat ampifilik, dan harganya relatif murah (Wijaya et al. 2005). Nanokomposit zeolit X/TiO2 hasil sintesis berupa serbuk putih.
Karakteristik Zeolit dan Nanokomposit Zeolit/TiO2
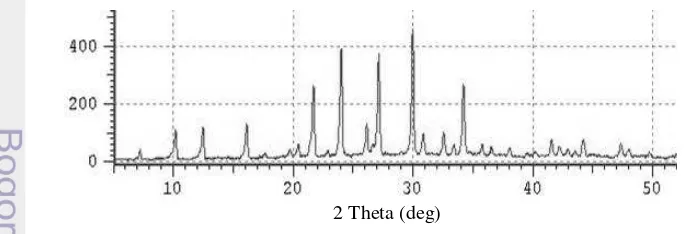
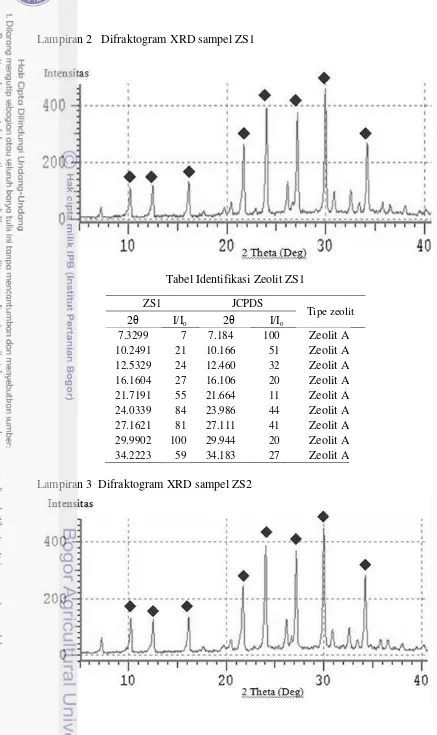
Zeolit hasil sintesis dikarakterisasi menggunakan teknik difraksi sinar-X (XRD) untuk mengetahui struktur kristal serta kemurnian dari zeolit tersebut. Hasil difraktogram ZS1 ditunjukkan pada Gambar 1. Zeolit ZS1 memiliki puncak khas, yaitu pada sudut 2θ = 7,32º; 10,25º; 12,53º; 16,16º; 21,72º; 24,03º; 27,16º; 29,99º dan 34,22º dengan kristalinitas sebesar 64,03%. Berdasarkan Joint Committee on Powder Difraction Standards (JCPDS), ZS1 memiliki pola spektra sudut-sudut 2θ yang mendekati zeolit A meskipun intensitasnya berbeda (Lampiran 2). Puncak khas ZS1 tersebut terdeteksi sebagai Zeolit A, yaitu pada sudut 2θ sebesar 7,18º; 10,16º; 12,46º; 16,10º; 21,66º; 23,98º; 27,11º; 29,94º dan 34,18º. Zeolit X yang tidak terbentuk dapat disebabkan karena penambahan silika atau water glass dalam proses sintesis yang tidak mencukupi dalam pembentukan kerangka zeolit X. Zeolit A dan zeolit X sama-sama merupakan zeolit silika rendah. Perbedaan kedua zeolit tersebut terdapat pada ukuran porinya. Zeolit A memiliki pori yang kecil, yaitu < 0,45 nm, sedangkan zeolit X memiliki ukuran pori yang lebih besar, yaitu > 0,55 nm (Flanigen 1991).
Gambar 1 Difraktogram Zeolit ZS1
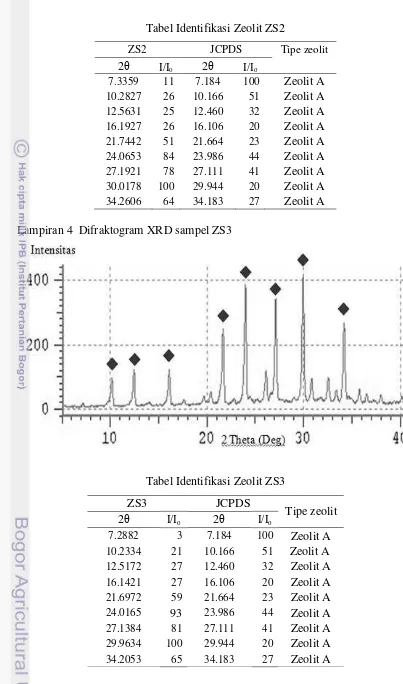
Hasil karakteristik zeolit sintetis ZS2 dan ZS3 juga teridentifikasi sebagai zeolit A. Pola difraktogram sudut-sudut 2θ-nya mendekati zeolit A dengan intensitas berbeda (Lampiran 3 dan 4). Derajat kristalinitas zeolit sintetis tertinggi, yaitu pada sampel ZS3 sebesar 65,96%. Semakin besar derajat kristalinitas maka bahan semakin bersifat kristal. Peningkatan derajat kristalinitas juga
2 Theta (deg) intensitas
mengindikasikan struktur ZS3 lebih teratur dibandingkan zeolit ZS1 dan ZS2 (Tabel 2).
Tabel 2 Hasil identifikasi zeolit
Sampel
kondisi tipe zeolit yang dihasilkan
Nanokomposit zeolit/TiO2 dibuat berdasarkan kondisi sintesis ZS3 karena memiliki persen derajat kristalinitas yang tinggi. Perbandingan pola difraksi ZS3 dan nanokomposit ditampilkan pada Gambar 2. Keberadaan TiO2 yang terikat di dalam NC3 ditunjukkan oleh 2θ sebesar 25,14 Å. Menurunnya intensitas jumlah puncak karakteristik ZS3 pada keseluruhan NC3 hasil sintesis menunjukkan adanya penurunan kristalinitas, yaitu dari derajat kristalinitas sebesar 65,96% menjadi 64,56%. Berdasarkan JCPDS, difraktogram NC3 teridentifikasi sebagai zeolit X (Lampiran 5). Diduga bahwa TiO2 menggangu proses pembentukan kristal zeolit, selain itu zeolit X yang terbentuk merupakan struktur yang metastabil.
Gambar 2 Perbandingan difraktogram NC3 dengan ZS3.
Kaolin, metakaolin, dan zeolit hasil sintesis ZS3 juga dikarakterisasi menggunakan SEM untuk mengetahui morfologi permukaan adsorben dan bentuk kristal. Kaolin memiliki tekstur permukaan kasar dan bentuk kristal persegi tak beraturan yang cenderung membentuk agregat. Ukutan partikel kaolin bervariasi dari 6 µm - 20 µm (Gambar 3). Metakaolin memiliki tekstur permukaan kasar dan berbentuk lapisan yang terdiri dari kristal lembaran persegi tak beraturan serta cenderung beragregat. Ukuran partikel metakaolin bervariasi sekitar 2 µm - 18 µm (Gambar 4).
Gambar 3 Morfologi kaolin perbesaran 2000x
Gambar 4 Metakaolin perbesaran 2000x
Zeolit sintetis ZS3 memiliki struktur permukaan berongga serta berbentuk persegi, sesuai dengan morfologi zeolit A. Wujud kristal relatif tidak beraturan dan cenderung beragregat membentuk partikel yang lebih besar. Ukuran partikel ZS3 bervariasi sekitar 2 µm - 5 µm (Gambar 5). Nanokomposit zeolit/TiO2 (NC3) memiliki struktur persegi enam dan permukaan yang halus, sesuai dengan morfologi zeolit X (Lampiran 8). Ukuran partikel nanokomposit NC3 bervariasi sekitar 0,5 µm - 2 µm (Gambar 6). Walaupun ukuran nanokomposit yang dihasilkan adalah mikrometer (µm), namun karena TiO2 memiliki ukuran 10 nm sehingga dapat dikatakan bahwa material yang terbentuk merupakan nanokomposit.
Gambar 5 Morfologi ZS3 dengan perbesaran 2500x
Gambar 6 Morfologi NC3 dengan perbesaran 5000x
Tabel 3 Komposisi bahan baku dan hasil sintesis menggunakan SEM-EDX Nisbah Si/Al untuk zeolit A dan zeolit X, yaitu 1 dan 1,25. ZS3 memiliki nisbah yang sesuai dengan zeolit A, sedangkan pada NC3 yang telah teridentifikasi sebagai zeolit X memiliki nisbah Si/Al < 1. Lebih rendahnya nisbah Si/Al pada nanokomposit NC3 dapat disebabkan karena Si dan Al yang terlarut tidak membentuk zeolit, melainkan SiO2 dan Al2O3 yang terkristalkan.
.
Kapasitas Adsorpsi
Kapasitas adsorpsi zeolit terhadap biru metilena
Pengukuran serapan sinar oleh standar biru metilena 2 ppm pada pemayaran 200 sampai 700 nm menunjukkan panjang gelombang maksimum pada 664 nm dengan nilai absorbansi yaitu 0,226. Pengukuran pada panjang gelombang maksimum ini (664 nm) akan memberikan kepekaan dan ketelitian yang paling tinggi pada spektrofotometer. Hal ini sesuai yang dilaporkan Mouzdahir et al. (2007) panjang gelombang maksimum biru metilena adalah 663 nm.
Hasil pengujian kemampuan zeolit dalam menjerap zat warna biru metilena (BM) menunjukkan bahwa kapasitas adsorpsi bertambah besar seiring dengan meningkatnya konsentrasi awal larutan BM. Menurut Mouzdahir et al. (2007), hal ini terjadi karena semakin besar konsentrasi awal BM yang diberikan, akan semakin banyak pula BM yang terjerap pada zeolit. Hal ini terjadi bila keberadaan tapak aktif sampel zeolit masih memungkinkan untuk menjerap BM yang konsentrasi atau jumlahnya semakin meningkat. Kemampuan penyerapan BM dapat dilihat dari nilai kapasitas adsorpsi (q).
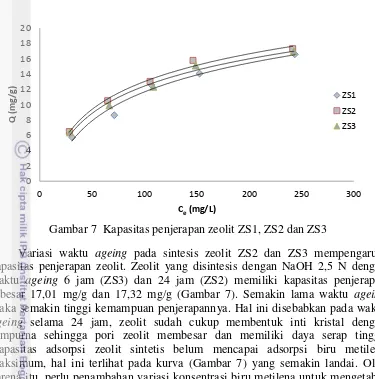
Zeolit ZS2 yang disintesis dengan NaOH 2,5 N memiliki kapasitas penjerapan tertinggi, yaitu 17,32 mg/g, sedangkan ZS1 yang disintesis dengan NaOH 1,5 N dengan waktu ageing yang sama, yaitu 24 jam memiliki kapasitas penjerapan BM terendah, yaitu 16,60 mg/g (Gambar 7). Zeolit yang dibentuk dengan konsentrasi NaOH lebih tinggi memiliki kapasitas penjerapan yang lebih baik terhadap zat warna. Hal ini disebabkan semakin tinggi konsentrasi NaOH maka semakin banyak silika yang terlarut. Pelarutan silika menyebabkan nisbah Si/Al menurun sehingga meningkatkan kapasitas adsorpsi.
Gambar 7 Kapasitas penjerapan zeolit ZS1, ZS2 dan ZS3
Variasi waktu ageing pada sintesis zeolit ZS2 dan ZS3 mempengaruhi kapasitas penjerapan zeolit. Zeolit yang disintesis dengan NaOH 2,5 N dengan waktu ageing 6 jam (ZS3) dan 24 jam (ZS2) memiliki kapasitas penjerapan sebesar 17,01 mg/g dan 17,32 mg/g (Gambar 7). Semakin lama waktu ageing maka semakin tinggi kemampuan penjerapannya. Hal ini disebabkan pada waktu ageing selama 24 jam, zeolit sudah cukup membentuk inti kristal dengan sempurna sehingga pori zeolit membesar dan memiliki daya serap tinggi. Kapasitas adsorpsi zeolit sintetis belum mencapai adsorpsi biru metilena maksimum, hal ini terlihat pada kurva (Gambar 7) yang semakin landai. Oleh karena itu, perlu penambahan variasi konsentrasi biru metilena untuk mengetahui kapasitas adsorpsi maksimum dari zeolit sintetis ini.
Kapasitas adsorpsi nanokomposit terhadap biru metilena
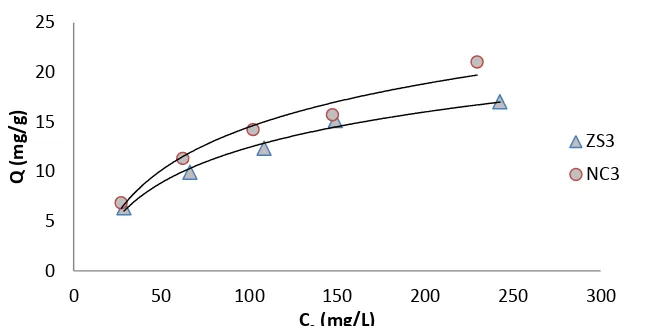
Pengujian ini bertujuan mengetahui kemampuan adsorpsi zeolit setelah dikombinasikan dengan TiO2. Perbandingan kapasitas adsorpsi antara zeolit dan nanokomposit dapat dilihat pada Gambar 8. Data lengkap penentuan kapasitas adsorpsi BM oleh ZS3 dan NC3 disajikan pada Lampiran 17 dan 18. Berdasarkan Gambar (8) terlihat bahwa NC3 memiliki kapasitas adsorpsi lebih tinggi terhadap BM dibanding ZS3. Hal ini diduga karena keberadaan TiO2 mampu merubah struktur dari kerangka zeolit yakni menyebabkan rongga zeolit semakin besar akibat terbentuknya penyangga Ti. Selain itu, hal ini juga dapat disebabkan karena pengukuran kapasitas adsorpsi dilakukan diruangan yang terbuka (terang), diduga sebagian BM mengalami degradasi oleh TiO2.
Gambar 8 Perbandingan kapasitas penjerapan antara ZS3 dan NC3
Isoterm Adsorpsi Zeolit dan Nanokomposit Zeolit/TiO2
Penentuan isoterm dilihat dari nilai koefisien determinasi (R2) yang tertinggi. Berdasarkan Tabel 4, tipe isoterm Langmuir dan Freundlich memiliki nilai koefisien determinasi yang tidak berbeda nyata (Lampiran 13-16). Hal ini menunjukkan variasi konsentrasi biru metilena yang dilakukan pada penelitian ini belum dapat menunjukkan tipe isoterm yang diikuti oleh adsorpsi biru metilena olet zeolit maupun nanokomposit yang disintesis.
Tabel 4 Koefisien determinasi dan Tetapan Isoterm adsorpsi biru metilena oleh zeolit dan nanokomposit menggambarkan jumlah yang dijerap atau kapasitas adsorpsi maksimum untuk membentuk satu lapisan yang sempurna pada permukaan adsorben. Berdasarkan data yang diperoleh, nilai Xm nanokomposit lebih besar daripada zeolit sintetis lainnya. Hal ini menunjukkan jumlah BM yang dijerap oleh nanokomposit lebih banyak dari zeolit. Nilai KL merupakan tetapan yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben. ZS2 memiliki nilai KL paling besar, hal ini berarti molekul biru metilena lebih kuat terikat pada ZS2 dibanding sampel lainnya.
Gambar 10 BM pada filtrat
Uji fotodegradasi terhadap nanokomposit zeolit/TiO2 bertujuan mengetahui kemampuannya dalam menguraikan zat warna di bawah radiasi sinar UV panjang gelombang 365 nm. Zeolit memiliki kemampuan menyerap zat warna, sedangkan TiO2 menguraikan zat warna. Oleh karena itu, kombinasi keduanya di dalam nanokomposit diharapkan dapat menghilangkan zat warna secara efisien sekaligus mengubahnya menjadi senyawa yang aman di lingkungan. Pemilihan biru metilena pada penelitian ini karena interaksinya dengan air akan menghasilkan ion BM yang bermuatan positif. Kation yang dihasilkan ini kemudian dapat dijerap zeolit yang memiliki muatan negatif. Sifat fotokatalis nanokomposit diuji dengan membandingkan warna BM perlakuan penyinaran UV menggunakan 0,1 g sampel yang terdiri dari zeolit, nanokomposit serta TiO2 dan 15 mL larutan BM 12,5 mg/L. Pengujian ini dilakukan selama 6 jam.
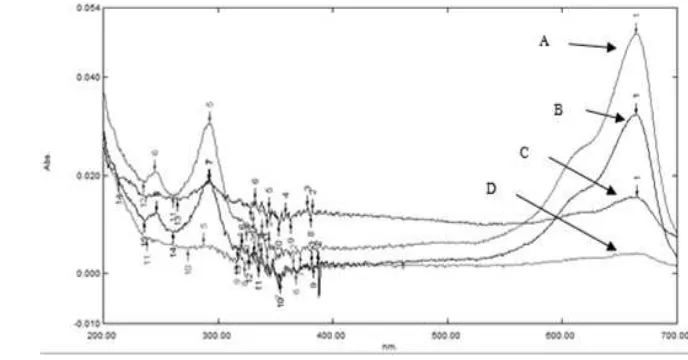
Hasil perlakuan yang diamati secara visual dapat dilihat pada perubahan warna biru metilena. Berdasarkan Gambar 9 dan 10, menunjukkan warna dari BM yang tidak direaksikan dengan bahan penjerap tidak berubah. Begitu pula pada sampel TiO2, tidak ada perubahan warna. Hal ini dapat disimpulkan bahwa TiO2 tanpa sinar UV tidak dapat menguraikan molekul zat warna BM. Sampel zeolit (C) dan nanokomposit zeolit/TiO2 (D) terjadi perubahan warna. Hal ini mengindikasikan bahwa reaksi yang terjadi antara BM dengan zeolit dan nanokomposit zeolit/TiO2 adalah adsorpsi. Hasil reaksi dengan sinar UV (Gambar 10), BM yang dicampurkan zeolit (G) dan nanokomposit zeolit/TiO2 (H) terjadi perubahan warna, yaitu menjadi tidak berwarna. Namun, hal ini belum menunjukkan adanya fotodegradasi karena intensitas warna pada sampel G dan H sama, sehingga masih kemungkinan proses yang terjadi hanyalah adsorpsi.
Gambar 11 Spektrum UV-Vis filtrat sampel di tempat gelap: (A) BM, (B) BM + TiO2, (C) BM + ZS3 dan (D) BM + NC3.
Gambar 12 Spektrum UV-Vis filtrat sampel dibawah sinar UV: (E) BM, (F) BM + TiO2, (G) BM + ZS3 dan (H) BM + NC3.
Spektrum penyerapan BM di daerah UV-Vis diperlihatkan pada Gambar (11) dan (12). Spektrum A dan E adalah spektrum absorpsi UV-Vis larutan BM konsentrasi 12,5 mg/L. Spektrum A dan E menunjukkan karakteristik puncak khas dari BM yaitu 664 nm. Spektrum B dan F masih terdeteksi adanya BM, dengan konsentrasi yang lebih rendah daripada A dan E, menunjukkan sebagian BM sudah teradsorpsi. Spektrum C dan G yang berisi sampel ZS3 menunjukkan bahwa pada G filtrat sudah tidak terdeteksi kandungan BM-nya, dengan kata lain telah mengadsorpsi BM dengan sempurna. Spektrum D dan H menunjukkan bahwa tanpa dan dengan sinar UV, larutan BM sudah teradsorpsi sempurna. Spektrum H, selain terjadi adsorpsi juga terjadi fotodegradasi, hal ini disebabkan TiO2 mampu mengurai senyawa biru metilena sehingga tidak ada lagi warna biru
baik pada filtrat maupun endapan. Filtrat H yang diperoleh telah berubah menjadi senyawa lain yang bila degradasinya sempurna akan menghasilkan karbondioksida dan air.
Selain pengujian filtrat, perlu pengamatan tambahan pada endapan sampel TiO2, ZS3 dan NC3 yang dapat digunakan sebagai indikator terjadinya proses adsorpsi-fotodegradasi (Gambar 13 dan 14). Endapan yang berwarna biru menunjukkan bahwa pada sistem hanya terjadi proses adsorpsi, sedangkan bila endapan berwarna putih, maka pada sistem terjadi proses adsorpsi-fotodegradasi. Hasil uji fotodegradasi BM menunjukkan bahwa TiO2 yang disinari UV menghasilkan endapan yang berwarna putih. Hal ini dikarenakan TiO2 mampu mengurai senyawa BM sehingga tidak ada lagi warna biru baik pada filtrat maupun endapan. Nanokomposit dengan UV ternyata tidak menghasilkan endapan berwarna putih, namun masih berwarna biru. Bila warna endapannya dibandingkan dengan nanokomposit dalam gelap, terlihat warna birunya lebih pudar karena selain terjadi adsorpsi, NC3 juga mengalami fotodegradasi.
Perubahan warna filtrat pada sampel nanokomposit zeolit/TiO2 yang disinari UV dari berwarna menjadi tidak berwarna menunjukkan struktur molekul zat warna BM telah berubah menjadi suatu senyawa yang tidak berwarna. Dengan demikian dapat disimpulkan,selain terjadi proses adsorpsi, nanokomposit juga mengalami fotodegradasi. Persen degradasi NC3 yang diperoleh, yaitu 85,19% (Lampiran 23). Hasil proses fotodegradasi ini menghasilkan CO2, H2O, dan asam-asam mineral (Madhu et al. 2007). Reaksi fotodegradasi BM dapat dituliskan sebagai berikut (Nogueira & Jardim 1993):
C16H18N3SCl + 51/2 •O2→ HCl + H2SO4 + 3HNO3 + 16CO2 +6H2O
Tabel 5 Proses yang terjadi pada pengujian fotodegradasi
Sampel Proses
Di tempat gelap Di bawah sinar UV
BM -
-BM+TiO2 - Fotodegradasi
BM+NC3 Adsorpsi Adsorpsi dan Fotodegradasi
BM+ZS3 Adsorpsi Adsorpsi
Biru metilena
SIMPULAN DAN SARAN
SIMPULAN
Zeolit X tidak dihasilkan dalam sintesis ini, melainkan tipe zeolit lain yaitu Zeolit A. Zeolit X terbentuk pada sintesis nanokomposit zeolit/TiO2. Uji adsorpsi zeolit menunjukkan bahwa semakin besar konsentrasi biru metilena, maka semakin besar pula kapasitas penjerapannya. Zeolit yang disintesis pada konsentrasi NaOH 2,5 N dengan waktu ageing 24 jam memiliki nilai kapasitas adsorpsi tertinggi yaitu 17,32 mg/g. Pembuatan nanokomposit zeolit/TiO2 menyebabkan nilai kapasitas adsorpi zeolit menjadi sebesar 21,03 mg/g. Tipe isoterm adsorpsi zeolit dan nanokomposit sintetis belum bisa ditentukan karena memiliki nilai koefisien determinasi Langmuir dan Freundlich yang tidak berbeda nyata. Nanokomposit memiliki sifat fotokalisis setelah penyinaran UV 365 nm yang ditunjukkan dari kemampuannya menguraikan biru metilena 12,5 g/mL selama 6 jam dengan persen degradasi sebesar 85,19%.
SARAN
Tahapan selanjutnya perlu dilakukan penambahan variasi konsentrasi biru metilena agar dapat diketahui konsentrasi maksimum biru metilena yang dapat diadsorpsi zeolit sintetis serta mendapatkan tipe isoterm yang diikuti pada proses adsorpsi zeolit dan nanokomposit sintetis.
DAFTAR PUSTAKA
[JCPDS] Joint Committee on Powder Difraction Standards. Zeolite A. 39-0222. [JCPDS] Joint Committee on Powder Difraction Standards.Zeolite X. 38-0237. Atkins PW. 1999. Kimia Fisik. Irma IK, penerjemah. Jakarta (ID): Erlangga.
Terjemahan dari: Physical Chemistry.
Banon C dan Suharto ET. 2008. Adsorpsi amoniak oleh adsorben zeolit alam yang diaktivasi dengan larutan amonium nitrat. Gradien. 4:354-360.
Barreer RM. 1978. Zeolite and Clay Mineral, Sorbents and Molecular Sieves. London (US): Academic Pr.
Chandrasekhar S dan Pramada PN. 1999. Investigation on the synthesis of zeolite Na-X from Kerala kaolin. J of Porous Mater. 6:283-297. doi:10.1023/A:1009632606671.
Fatimah Is, Wijaya K. 2005. Sintesis TiO2/zeolit sebagai fotokatalis pada pengolahan limbah cair industri tapioka secara adsorpsi-fotodegradasi. TEKNOIN. 10:257-267.
Flanigen EM. 1991. Zeolite and Molecular Sieves An Historical Perspective. New York (US): Elsevier Science Publishers BV.
Gruszkiewics MS, Simonson JM, Burchell TD, Cole DR. 2005. Water adsorption and desorption on microporous solids at elevated temperature. J of Therm Anal and Calor. 81:609-615. doi:10.1007/s10973-005-0832-1.
Hediana N. 2011. Sintesis, pencirian, dan uji fotodegradasi nanokomposit sodalit/TiO2 terhadap zat warna biru metilena [Skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Janjira W. 2002. Synthesis and kinetic study of zeolite NaA from thai kaolin
[Tesis]. Suranaree (TH): Degree of Mater of Science in Chemistry, Suranaree
University of Technology.
Jozefaciuk G, Bowanko G. 2002. Effect of acid and alkali treatments on surface areas and adsorption energies of selected minerals. J Clays and Clay Minerals. 50(6):771-783. doi:10.1180/claymin.2011.046.1.73.
Madhu GM, Lourdu AR, Vasantha, Kumar PK, Shreyas. 2007. Photodegradation of methylene blue dye using UV/BaTiO3, UV/H2O2, and UV/H2O2/BaTiO3 oxidation processes. Indian J of Chem Tech. 14:139–144. doi:10.1016/j.desal.2005.04.005.
Mouzdahir Y El, Elmchaori A, Mahboub R, Gil A, Korili SA. 2007. Adsorption of methylene blue from aqueous solutions on a Moroccan clay. J Chem Eng Data. 52:1621-1625. doi:10.1021/je700008g.
Murray HH. 1960. Industrial applications of kaolin. Clay and Clay Mineral: 292-298.
Nogueira R, Jardim WF. 1993. Photodegradation of methylene blue using solar light and semiconductor (TiO2). J Chem. 70(10):861-862. doi:10.1021/ed070p861.
Ozkan FC, Ulku S. 2008. Diffusion mechanism of water vapour in a zeolitic tuff rich in clinoptilolite. J of Therm Anal and Calorimetry. 94:699-702. doi:10.1007/s10973-008-9357-8.
Suardana N. 2005. Optimalisasi daya adsorpsi zeolit terhadap ion kromium (III). Jurnal Penelitian dan Pengembangan Sains & Humaniora. 2(1):17-33.
Treacy MMJ, Higgins JB. 2001. Collection of Simulated XRD Powder Patterns for Zeolites. New York (US): Elsevier Science Publishers BV.
Thammavong S. 2003. Studies of synthesis, kinetic and particle size of zeolite X from Narathiwat kaolin [Tesis]. Suranaree (TH): Degree of Master of Science in Chemistry, Suranaree University of Technology.
Wang S, Terdkiatburana T, Tade MO. 2008. Adsorption Cu (II), Pb (II), and humic acid on natural zeolite tuff in single and binary systems. Separation and Purification Technology. 62:64-70. doi:10.1016/j.cej.2007.08.005.
Lampiran1 Bagan alir penelitian
Kaolin
Metakaolin
Hasil sintesis zeolit X
Hasil sintesis nanokomposit zeolit X/TiO2
Penentuan kapasitas adsorpsi zeolit X dan nanokomposit zeolit X/TiO2
Uji fotodegradasi nanokomposit zeolit X/TiO2
XRD & SEM Waterglas
s
TiO2
NaOH 1,5 N dan 2.5 N
Biru metilena
Kalsinasi 700C T = 6 jam
17
Lampiran 2 Difraktogram XRD sampel ZS1
Tabel Identifikasi Zeolit ZS1
ZS1 JCPDS
Tipe zeolit
2θ I/Io 2θ I/Io
7.3299 7 7.184 100 Zeolit A
10.2491 21 10.166 51 Zeolit A
12.5329 24 12.460 32 Zeolit A
16.1604 27 16.106 20 Zeolit A
21.7191 55 21.664 11 Zeolit A
24.0339 84 23.986 44 Zeolit A
27.1621 81 27.111 41 Zeolit A
29.9902 100 29.944 20 Zeolit A
34.2223 59 34.183 27 Zeolit A
21
Tabel Identifikasi Zeolit ZS2
ZS2 JCPDS Tipe zeolit
2θ I/Io 2θ I/Io
7.3359 11 7.184 100 Zeolit A
10.2827 26 10.166 51 Zeolit A
12.5631 25 12.460 32 Zeolit A
16.1927 26 16.106 20 Zeolit A
21.7442 51 21.664 23 Zeolit A
24.0653 84 23.986 44 Zeolit A
27.1921 78 27.111 41 Zeolit A
30.0178 100 29.944 20 Zeolit A
34.2606 64 34.183 27 Zeolit A
Lampiran 4 Difraktogram XRD sampel ZS3
Tabel Identifikasi Zeolit ZS3
ZS3 JCPDS
Tipe zeolit
2θ I/Io 2θ I/Io
7.2882 3 7.184 100 Zeolit A
10.2334 21 10.166 51 Zeolit A
12.5172 27 12.460 32 Zeolit A
16.1421 27 16.106 20 Zeolit A
21.6972 59 21.664 23 Zeolit A
24.0165 93 23.986 44 Zeolit A
27.1384 81 27.111 41 Zeolit A
29.9634 100 29.944 20 Zeolit A
34.2053 65 34.183 27 Zeolit A
Lampiran 5 Difraktogram XRD sampel nanokomposit NC3
Keterangan: = Zeolit X, = Zeolit A
Tabel Identifikasi NC3
Nanokomposit JCPDS Tipe zeolit
2θ I/Io 2θ I/Io
10.0498 16 9.994 18 Zeolit X
11.7429 18 11.737 12 Zeolit X
15.4324 44 15.464 18 Zeolit X
16.1251 6 16.106 20 Zeolit A
20.0610 30 20.089 9 Zeolit X
21.6912 15 21.664 23 Zeolit A
23.5884 11 23.630 3 Zeolit X
26.6387 83 26.706 18 Zeolit X
27.4022 4 27.417 1 Zeolit X
29.9823 30 29.944 20 Zeolit A
30.9195 100 30.997 19 Zeolit X
31.9668 48 32.033 8 Zeolit X
34.1784 33 34.183 27 Zeolit A
37.3104 19 37.407 5 Zeolit X
23
Lampiran 6 JCPDS zeolit A (Na) dan LTA (Treacy dan Higgins 2001)
Lampiran 7 JCPDS Zeolit X
Lampiran 8 Referensi SEM Zeolit A dan Zeolit X (Wang et al, 2008)
25
Lampiran 9 Hasil SEM-EDX kaolin
Lampiran 10 Hasil SEM-EDX metakaolin
Lampiran 11 Hasil SEM-EDX ZS3
27
Lampiran 13 Penentuan pola isoterm adsorpsi BM oleh ZS1
Co *Ce Ct m Isoterm Langmuir
Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) (mg/g)x/m c/(x/m) (g/L) log c x/mlog
50 30.8421 19.1579 0.0502 0.0003 5.7245 5.3878 1.4891 0.7577
100 71.1579 28.8421 0.0502 0.0004 8.6182 8.2567 1.8522 0.9354
150 106.421 43.5789 0.0517 0.0007 12.6438 8.4169 2.0270 1.1019 200 152.7368 47.2632 0.0504 0.0007 14.0664 10.8583 2.1839 1.1482 300 243.7894 56.2105 0.0508 0.0008 16.5976 14.6882 2.3870 1.2200
*Ce digunakan sebagai variabel c pada rumus Isoterm Langmuir dan Freundlich
⁄
Persamaan garis isoterm Langmuir yang diperoleh y = 0,0419x + 4,4469 dengan R2= 98,91%
Lampiran 14 Penentuan pola isoterm adsorpsi BM oleh ZS2
Co *Ce Ct m Isoterm Langmuir
Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) (mg/g)x/m c/(x/m) (g/L) log c log x/m
50 28.2106 21.7894 0.0504 0.0003 6.4849 4.3502 1.4504 0.8119
100 64.8421 35.1579 0.0501 0.0005 10.5263 6.1600 1.8119 1.0223
150 105.3684 44.6316 0.0513 0.0007 13.0502 8.0741 2.0227 1.1156 200 146.4211 55.1579 0.0509 0.0008 16.2548 9.0079 2.1656 1.2110 300 241.6842 58.3158 0.0505 0.0009 17.3215 13.9528 2.3832 1.2386
*Ce digunakan sebagai variabel c pada rumus Isoterm Langmuir dan Freundlich
⁄
Persamaan garis isoterm Langmuir yang diperoleh y = 0,0439x + 3,1651 dengan R2= 99,54%
29
Lampiran 15 Penentuan pola isoterm adsorpsi BM oleh ZS3
Co *Ce Ct m Isoterm Langmuir
Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) (mg/g)x/m c/(x/m) (g/L) log c log x/m
50 28.7368 21.2632 0.0503 0.0003 6.3409 4.5320 1.4584 0.8022
100 66.3669 33.5790 0.0508 0.0005 9.9151 6.6935 1.8220 0.9963 150 108.5263 41.4737 0.0504 0.0006 12.3434 8.7923 2.0355 1.0914 200 149.0527 50.9474 0.0505 0.0008 15.1329 9.8496 2.1733 1.1799 300 242.7368 57.2632 0.0505 0.0009 17.0089 14.2712 2.3851 1.2307
*Ce digunakan sebagai variabel c pada rumus Isoterm Langmuir dan Freundlich
⁄
Persamaan garis isoterm Langmuir yang diperoleh y = 0,0442x + 3,5614 dengan R2= 99,62%
Lampiran 16 Penentuan pola isoterm adsorpsi BM oleh NC3
Co *Ce Ct m Isoterm Langmuir
Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) (mg/g)x/m c/(x/m) (g/L) log c log x/m
50 27.1579 22.8421 0.0501 0.0003 6.8390 3.9711 1.4339 0.8350
100 62.2105 37.7895 0.0501 0.0006 11.3142 5.4984 1.7939 1.0536 150 102.2106 47.7894 0.0504 0.0007 14.2230 7.1863 2.0095 1.1530 200 147.4737 52.5263 0.0501 0.0008 15.7264 9.3774 2.1687 1.1966 300 229.6842 70.3158 0.0501 0.0011 21.0526 10.9100 2.3611 1.3233
*Ce digunakan sebagai variabel c pada rumus Isoterm Langmuir dan Freundlich
⁄
Persamaan garis isoterm Langmuir yang diperoleh y = 0,0350x + 3,4043 dengan R2= 99,60%
31
Lampiran 17 Penentuan panjang gelombang maksimum larutan biru metilena
Panjang
Lampiran 18 Kurva standar larutan biru metilena
Larutan konsetrasi (mg/L) absorbansi
Lampiran 19 Data penentuan kapasitas adsorpsi BM pada ZS1
0.0502 50 0.043 29.5263 50 20.4737 6.1176 5.72
0.0502 50 0.048 32.1579 50 17.8421 5.3313
0.0505 100 0.058 74.8421 100 25.1579 7.4726 8.62
0.0500 100 0.051 67.4737 100 32.5263 9.7579
0.0519 150 0.089 107.4737 100 42.5263 12.2908 12.63
0.0516 150 0.087 105.3684 100 44.6316 12.9743
0.0500 200 0.129 149.5789 100 50.4211 15.1263 14.06
0.0509 200 0.135 155.8947 100 44.1053 12.9976
0.0510 300 0.220 245.3684 100 54.6316 16.0681 16.60
0.0506 300 0.217 242.2105 100 57.7895 17.1313
Lampiran 20 Data penentuan kapasitas adsorpsi BM pada ZS2
Bobot
zeolit (g) (ppm) Co Abs (ppm) Ce FP (ppm) Ct (mg/g) Q Rerata Q
0.0503 50 0.042 29.0000 50 21.0000 6.2624 6.48
0.0505 50 0.039 27.4211 50 22.5789 6.7066
0.0500 100 0.051 67.4737 100 32.5263 9.7579 10.51
0.0503 100 0.046 62.2105 100 37.7895 11.2692
0.0516 150 0.085 103.2632 100 46.7368 13.5863 13.05
0.0510 150 0.089 107.4737 100 42.5263 12.5077
0.0502 200 0.123 143.2632 100 56.7368 16.9532 15.79
0.0517 200 0.129 149.5789 100 50.4211 14.6289
0.0503 300 0.215 240.1053 100 59.8947 17.8613 17.32
0.0507 300 0.218 243.2632 100 56.7368 16.7860
Lampiran 21 Data penentuan kapasitas adsorpsi BM pada ZS3
Bobot
0.0505 50 0.038 26.8947 50 23.1053 6.8629 6.34
0.0501 50 0.045 30.5789 50 19.4211 5.8147
0.0511 100 0.049 65.3684 100 34.6316 10.1658 9.91
0.0505 100 0.051 67.4737 100 32.5263 9.6613
0.0507 150 0.083 101.1579 100 48.8421 14.4503 12.33
0.0501 150 0.097 115.8947 100 34.1053 10.2112
0.0510 200 0.123 143.2632 100 56.7368 16.6873 15.12
0.0500 200 0.134 154.8421 100 45.1579 13.5474
0.0504 300 0.216 241.1579 100 58.8421 17.5125 17.01
33
Lampiran 22 Data penentuan kapasitas adsorpsi BM oleh NC3
Bobot
nanokomposit (g) (ppm)Co Abs Ce (ppm) FP (ppm)Ct (mg/g)Q Rerata Q
0.0501 50 0.039 27.4211 50 22.5789 6.7602 6.84
0.0501 50 0.038 26.8947 50 23.1053 6.9177
0.0501 100 0.046 62.2105 100 37.7895 11.3142 11.30
0.0502 100 0.046 62.2105 100 37.7895 11.2917
0.0505 150 0.085 103.2632 100 46.7368 13.8822 14.22
0.0503 150 0.083 101.1579 100 48.8421 14.5652
0.0502 200 0.126 146.4211 100 53.5789 16.0096 15.71
0.0501 200 0.128 148.5263 100 51.4737 15.4113
0.0501 300 0.097 231.7895 200 68.2105 20.4223 21.03
0.0502 300 0.095 227.5789 200 72.4211 21.6398
Contoh perhitungan:
( )
Keterangan:
Co : Konsentrasi awal larutan biru metilena (mg/L) Ce : Konsentrasi akhir larutan biru metilena (mg/L) Ct : Konsentrasi terjerap larutan biru metilena (mg/L) Q : Kapasitas adsorpsi (mg/g)
Lampiran 23 Persen degradasi NC3
RIWAYAT HIDUP
Penulis merupakan putri keempat dari Bapak H. Usin dan Ibu Hj. Fatmawati yang dilahirkan di Tangerang pada tanggal 16 Mei 1990.
Tahun 2008 penulis lulus dari SMA Negeri 1 Ciputat, yang sekarang bernama SMA Negeri 1 Tangerang Selatan. Di tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Kimia Anorganik tahun ajaran 2011/2012.