EFEK PROBIOTIK INDIGENUS PADA PROFIL
IMUNOHISTOKIMIA ANTIOKSIDAN SUPEROKSIDA
DISMUTASE (SOD) DI HATI TIKUS YANG DIPAPAR
ENTEROPATHOGENIC Escherichia coli (EPEC)
FENNY FITRIAN UTAMI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Imunohistokimia Antioksidan Superoksida Dismutase (SOD) di Hati Tikus yang Dipapar Enteropathogenic Escherichia coli (EPEC). Di bawah bimbingan
TUTIK WRESDIYATI
Probiotik merupakan mikroorganisme hidup yang apabila diberikan pada jumlah yang tepat dapat bermanfaat bagi kesehatan saluran pencernaan.
Lactobacillus plantarum dan Lactobacillus fermentum merupakan probiotik yang telah berhasil diisolasi dari daging sapi peranakan Ongol di beberapa pasar tradisional di daerah Bogor dan telah terbukti secara in vitro bersifat sebagai probiotik.
EPEC merupakan salah satu penyebab utama diare pada anak-anak di Indonesia dengan prevalensi kejadiannya 55% dari jumlah anak penderita diare. Infeksi EPEC di saluran pencernaan membentuk lesio attaching/effacing (A/E lesion) pada epitel usus dan menyebabkan kerusakan struktur sitoskeletal sel serta membentuk formasi yang disebut pedestal actin formation. Formasi sel seperti ini merupakan tanda adanya penyakit dan kerusakan sel. EPEC yang berada di saluran pencernaan dan sel yang rusak akibat perlekatan EPEC, akan difagosit oleh makrofag. Proses fagositosis menghasilkan radikal bebas. Antioksidan merupakan suatu zat yang dapat menetralisir radikal bebas. Enzim copper, zinc-superoksida dismutase (Cu,Zn-SOD) merupakan salah satu enzim antioksidan endogen yang berperan mengkatalis dismutasi radikal bebas anion superoksida (O2-) menjadi radikal yang lebih lemah yaitu hidrogen peroksida (H2O2) dan selanjutnya akan diubah menjadi oksigen (O2) yang lebih stabil dan air (H2O) oleh glutation peroksidase dan katalase.
Sejauh ini belum banyak laporan secara in vivo tentang efek probiotik terhadap status antioksidan tubuh. Oleh karena itu, penelitian ini bertujuan menganalisa pengaruh pemberian probiotik L. plantarum dan L. fermentum
terhadap profil imunohistokimia antioksidan superoksida dismutase(Cu,Zn-SOD) di jaringan hati pada tikus yang dipapar bakteri EPEC.
Sebanyak 90 ekor tikus percobaan dibagi dalam 6 kelompok perlakuan,
yaitu: (A) kontrol negatif, (B) perlakuan L. plantarum, (C) perlakuan
L. fermentum, (D) perlakuan L. plantarum + EPEC, (E) perlakuan L. fermentum + EPEC, dan (F) perlakuan EPEC (kontrol positif). Dosis Lactobacillus yang diberi adalah 108 cfu/ml/hari pada hari ke-1 sampai hari ke-21, sedangkan dosis EPEC yang diberi adalah 106 cfu/ml/hari pada hari ke-8 sampai hari ke-14. Setiap kelompok perlakuan berjumlah 15 ekor tikus yang akan diterminasi pada 3 waktu yang berbeda (hari ke-8, 15, dan 22) masing-masing 5 ekor tikus. Setelah organ hati tikus diperoleh, selanjutnya diproses dan diwarnai dengan pewarnaan imunohistokimia terhadap Cu,Zn-SOD. Hasil pewarnaan imunohistokimia diamati secara kualitatif dan kuantitatif dengan mikroskop cahaya.
Hasil penelitian memperlihatkan bahwa pemberian probiotik L. fermentum
enzim antioksidan tersebut menurun pada minggu ketiga.
L. fermentum lebih baik dari pada L. plantarum dalam meningkatkan kandungan enzim Cu,Zn-SOD di jaringan hati tikus, baik pada kelompok yang diberi EPEC maupun tidak.
Immunohistochemical Profile of Antioxidant Superoxide Dismutase (SOD) in Liver of Enteropathogenic Escherichia coli (EPEC) Treated Rats.
Under direction of TUTIK WRESDIYATI
The study was conducted to analyze influence of indigeneous probiotic Lactobacillus plantarum and Lactobacillus fermentum on immunohistochemical profile of antioxidant superoxide dismutase (SOD) in liver of enteropathogenic Escherichia coli (EPEC) treated rats. A total of 90 male rats (Sprague Dawley) were divided into six groups; (A) negative control, (B) Lactobacillus plantarum treated group, (C) Lactobacillus fermentum treated group, (D) Lactobacillus plantarum and EPEC treated group, (E) Lactobacillus fermentum and EPEC treated group, and (F) EPEC treated group (positive control). The content of antioxidant copper, zinc-superoxide dismutase (Cu,Zn-SOD) was analyzed with immunohistochemical techniques using monoclonal antibody of Cu,Zn-SOD. The result showed that L. fermentum increased the content of Cu,Zn-SOD in rat liver on 2nd and 3rd weeks at both conditions; with and without EPEC treatment. L. plantarum treatment for 1 week until 3 weeks, could maintain the content of Cu,Zn-SOD in rat liver tissue as well as negative control. While, in L. plantarum and EPEC treated group, the content of Cu,Zn-SOD decreased after one week of EPEC treatment. L. fermentum showed better effect in terms increase the content of Cu,Zn-SOD in rat liver tissue.
Dengan ini saya menyatakan bahwa skripsi Efek Probiotik Indigenus pada Profil Imunohistokimia Antioksidan Superoksida Dismutase (SOD) di Hati Tikus yang Dipapar Enteropathogenic Escherichia coli (EPEC) adalah karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2011
Fenny Fitrian Utami
© Hak Cipta Milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
EFEK PROBIOTIK INDIGENUS PADA PROFIL
IMUNOHISTOKIMIA ANTIOKSIDAN SUPEROKSIDA
DISMUTASE (SOD) DI HATI TIKUS YANG DIPAPAR
ENTEROPATHOGENIC Escherichia coli (EPEC)
FENNY FITRIAN UTAMI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama : Fenny Fitrian Utami
NIM : B04070038
Program Studi : Kedokteran Hewan
Disetujui,
Dosen Pembimbing
Prof. Drh. Tutik Wresdiyati, Ph.D, PAVet
NIP. 19640909 199002 2 001
Diketahui,
Wakil Dekan Fakultas Kedokteran Hewan
Dr. Nastiti Kusumorini
NIP. 19621205 198703 2 001
Penulis mengucapkan syukur alhamdulillah kepada Allah SWT atas rahmat
dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian
dengan judul: Efek Probiotik Indigenus pada Profil Imunohistokimia Antioksidan
Superoksida Dismutase (SOD) di Hati Tikus yang Dipapar Enteropathogenic Escherichia coli (EPEC), merupakan bagian dari proyek penelitian yang didanai oleh Direktorat Jenderal Pendidikan Tinggi (DIKTI) Kementerian Pendidikan
Nasional RI melalui program Hibah Kompetensi dengan nomor kontrak:
409/SP2H/DP2M/VI/2010 atas nama Prof. Dr. Ir. Made Astawan, M.S. Penelitian
ini dilaksanakan sejak bulan Juli 2009 sampai Juli 2010 di SEAFAST CENTRE
IPB dan Laboratorium Histologi, Fakultas Kedokteran Hewan, Institut Pertanian
Bogor.
Penyusunan skripsi ini merupakan suatu proses perjalanan panjang yang
memberikan pembelajaran tiada henti bagi penulis. Penulis mengucapkan terima
kasih yang tak terhingga kepada Prof. Drh. Tutik Wresdiyati, Ph.D, PAVet selaku
dosen pembimbing skripsi atas ilmu, arahan, kritik, dan saran yang mendukung
terselesaikannya skripsi ini. Penulis juga mengucapkan terima kasih kepada Tim
Peneliti Hibah Kompetensi DIKTI: Prof. Dr. Ir. Made Astawan, M.S; Prof. Drh.
Tutik Wresdiyati, Ph.D, PAVet; dan Dr. Irma Isnafia Arief, S.Pt, M.Si yang telah
memberikan arahan dan ilmu selama pelaksanaan penelitian.
Penulis mengucapkan terima kasih kepada Drh. Huda S. Darusman, M.Si
dan Dr. Drh. Hera Maheshwari, M.Sc sebagai dosen pembimbing akademik yang
telah memberikan bimbingan serta semangat kepada penulis sepanjang perjalanan
pendidikan penulis di Fakultas Kedokteran Hewan IPB. Selanjutnya, penulis
mengucapkan terima kasih kepada Dr. Drh. Choirun ‘Nisa, M.Si, PAVet selaku
dosen penilai seminar, Drh. Wahono Esthi Prasetyaningtiyas, M.Si selaku dosen
moderator seminar, Dr. Drh. Elok Budi Retnani, M.S dan Dr. Drh. Wiwin
Winarsih, M.Si selaku dosen penguji Ujian Akhir Sarjana Kedokteran Hewan,
Dr. Drh. Adi Winarno dan Drh. I Ketut Mudite Adyane, M.Si atas ilmu dan saran
yang telah diberikan untuk penyelesaian skripsi ini. Seluruh dosen FKH IPB yang
dan bimbingan yang telah diberikan selama penelitian berlangsung.
Ungkapan rasa hormat, terima kasih, dan sayang penulis sampaikan kepada
ayahanda tercinta (Alm.), mama tercinta, dan adik-adik tersayang (Ona, Imam,
dan Ade), serta keluarga besar atas kasih sayang yang begitu besar, doa,
keceriaan, dan dukungan yang tidak ternilai harganya baik fisik maupun moril
yang telah diberikan kepada penulis sepanjang perjalanan hidup penulis. Kepada
Anggi Rianto, terima kasih atas semangat yang begitu berharga serta bantuan
yang telah diberikan kepada penulis selama penelitian sampai penyelesaian skripsi
ini.
Terima kasih penulis ucapkan kepada teman-teman sepenelitian (Kristina
Dwi Wulandari, Sri Rahmatul Laila, dan Yeni Setiorini) atas kerja sama,
kebersamaan, bantuan, dan waktu untuk bertukar pikiran selama ini. Penulis juga
mengucapkan terima kasih kepada Kak Sandra dan Kak Angga atas kerjasama dan
bantuan yang telah diberikan kepada penulis selama penelitian di Laboratorium
Histologi. Kepada sahabat-sahabatku (Sari, Levi, Wulan, Putri, Deni, Ira, Iwan),
terima kasih atas motivasi, semangat, keceriaan, persahabatan, dan semua hal
indah yang telah dilalui bersama selama ini. Sahabat-sahabat Gianuzzi FKH 44,
terima kasih atas kebersamaan, semoga persahabatan tetap terjalin sampai akhir
hayat.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
Penulis dilahirkan di Solok pada tanggal 10 November 1989 sebagai anak
pertama dari pasangan Yandraweli, SH (Alm.) dan Yulfitri, SP. Penulis
menamatkan pendidikan SMA pada tahun 2007 di SMAN 1 Gunung Talang
Kabupaten Solok dan pada tahun yang sama diterima di IPB melalui jalur
Undangan Seleksi Masuk IPB (USMI) pada Fakultas Kedokteran Hewan.
Selama menempuh pendidikan di IPB, penulis terlibat dalam organisasi
Himpunan Minat dan Profesi Satwaliar selama 2 periode yakni sebagai staf Divisi
Pendidikan pada periode kepengurusan 2008/2009 dan Sekretaris I pada periode
kepengurusan 2009/2010. Penulis juga aktif di Badan Eksekutif Mahasiswa
(BEM) Fakultas Kedokteran Hewan periode kepengurusan 2008/2009 sebagai staf
Departemen Pengembangan Sumber Daya Mahasiswa (PSDM). Selain itu, penulis
aktif di organisasi mahasiswa daerah Ikatan Pelajar dan Mahasiswa Minang
(IPMM) Bogor pada periode kepengurusan 2008-2009 sebagai staf Bidang
Olahraga. Penulis juga pernah menjadi Sekretaris Umum Kohati pada tahun 2010
dan Ketua Umum Kohati pada tahun 2011 di Himpunan Mahasiswa Islam (HMI)
Komisariat FKH IPB Bogor.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah
Histologi Veteriner I dan Histologi Veteriner II pada tahun ajaran 2009/2010.
Penulis juga mengikuti magang profesi medis veteriner di beberapa instansi,
seperti: Taman Marga Satwa Ragunan dan Pusat Penyelamatan Satwa (PPS)
Cikananga. Penulis memperoleh beasiswa Peningkatan Prestasi Akademik (PPA)
pada semester 4 sampai dengan semester 8. Bersama dengan tim, penulis lolos
seleksi Program Kreativitas Mahasiswa bidang Kewirausahaan (PKM-K) yang
memperoleh dana hibah dari Direktorat Jendral Pendidikan Tinggi (DIKTI) pada
tahun 2008. Sebagai tugas akhir, penulis melakukan penelitian “Efek Probiotik
Indigenus pada Profil Imunohistokimia Antioksidan Superoksida Dismutse (SOD)
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 4
II. TINJAUAN PUSTAKA 2.1 Hewan Percobaan... 5
2.2 Hati ... 7
2.3 EnteropathogenicE.coli (EPEC) ... 9
2.4 Bakteri Asam Laktat sebagai Probiotik ... 10
2.5 Radikal Bebas dan Antioksidan Cu-Zn SOD ... 13
2.6 Imunohistokimia ... 15
2.7 Penelitian Pendahuluan ... 16
III. METODE PENELITIAN 3.1 Alat dan Bahan Penelitian ... 18
3.2 Waktu dan Tempat Penelitian ... 18
3.3 Tahapan Penelitian 3.3.1 Hewan Percobaan. ... 19
3.3.2 Kandang dan Perlengkapan ... 20
3.3.3 Ransum ... 20
3.3.4 Perlakuan terhadap Hewan Percobaan ... 20
3.3.5 Pembuatan Preparat Histologi Jaringan Hati Ttikus ... 22
3.3.6 Analisis Kandungan SOD Hati Tikus ... 24
IV. HASIL DAN PEMBAHASAN ... 26
V. SIMPULAN DAN SARAN ... 41
DAFTAR TABEL
Halaman
1 Komposisi ransum standar tikus ... 20
2 Kelompok tikus percobaan sesuai perlakuan yang diberikan ... 21
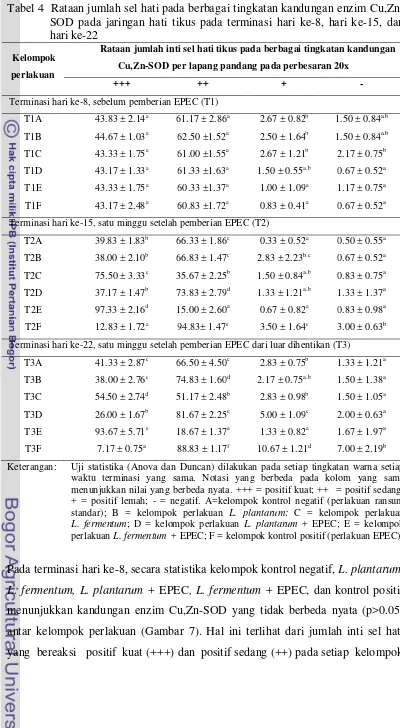
3 Kandungan enzim Cu,Zn-SOD pada jaringan hati tikus percobaan ... 27
4 Rata-rata jumlah sel hati pada berbagai tingkatan kandungan enzim
Cu,Zn-SOD pada jaringan hati tikus pada terminasi hari ke-8, hari ke-15, dan hari
DAFTAR GAMBAR
Halaman
1 Gambaran hati tikus ... 8
2 Bentuk infeksi EPEC pada epitel usus ... 10
3 Mekanisme pertahanan intestinal oleh probiotik ... 11
4 Prinsip teknik pewarnaan imunohistokimia ... 15
5 Diagram alur penelitian ... 19
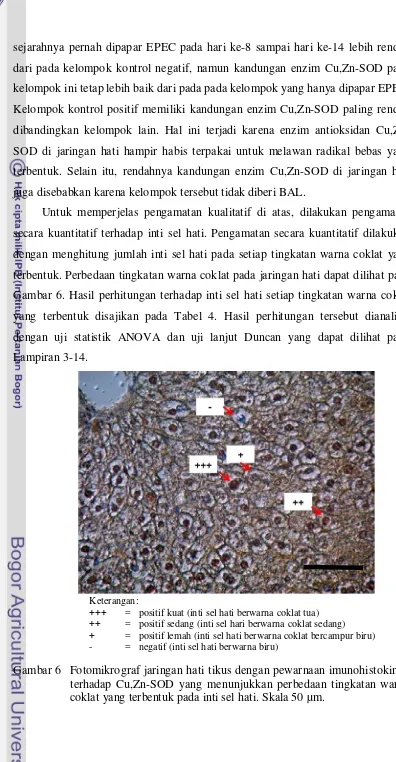
6 Fotomikrograf jaringan hati tikus dengan pewarnaan imunohistokimia terhadap Cu,Zn-SOD yang menunjukkan perbedaan intensitas warna coklat yang terbentuk pada jaringan hati ... 29
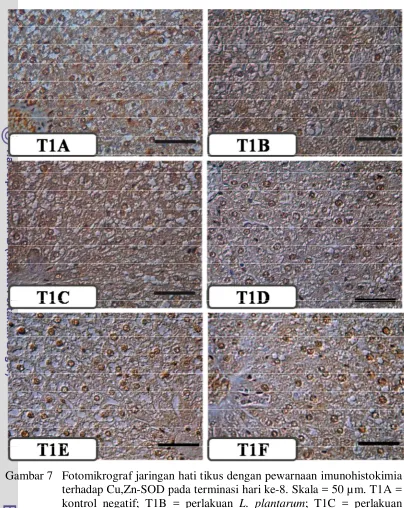
7 Fotomikrograf jaringan hati tikus dengan pewarnaan imunohistokimia terhadap Cu,Zn-SOD pada terminasi hari ke-8 ... 31
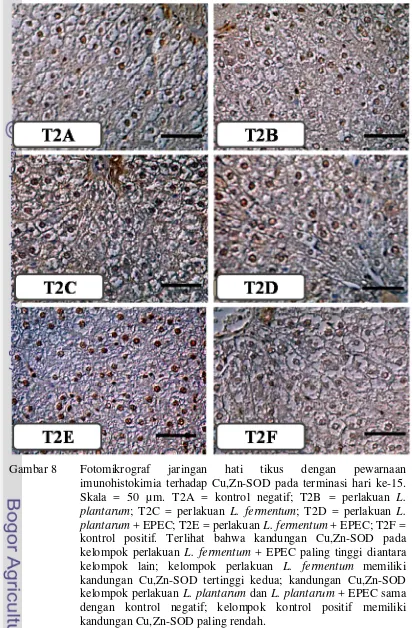
8 Fotomikrograf jaringan hati dengan pewarnaan imunohistokimia terhadap Cu,Zn-SOD tikus pada terminasi hari ke-15 ... 36
DAFTAR LAMPIRAN
Halaman
1 Tahapan Sampling dan Pemrosesan Jaringan Hati Tikus ... 48 2 Tahapan Pewarnaan Imunohistokimia untuk Analisis Kandungan Cu,
Zn-SOD di Jaringan Hati Tikus ... 50
3 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-8 dengan intensitas kandungan Cu,Zn-SOD positif kuat (+++) ... 52
4 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-8 dengan intensitas kandungan Cu,Zn-SOD positif sedang (++) ... 53
5 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-8 dengan intensitas kandungan Cu,Zn-SOD positif lemah(+)... 54
6 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada
terminasi hari ke-8 dengan intensitas kandungan Cu,Zn-SOD negatif (-) ... 55
7 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-15 dengan intensitas kandungan Cu,Zn-SOD positif kuat (+++) ... 56
8 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-15 dengan intensitas kandungan Cu,Zn-SOD positif sedang (++) ... 57
9 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-15 dengan intensitas kandungan Cu,Zn-SOD positif lemah (+) ... 58
10 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada
terminasi hari ke-15 dengan intensitas kandungan Cu,Zn-SOD negatif (-) ... 59
12 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-22 dengan intensitas kandungan Cu,Zn-SOD positif sedang (++) ... 61
13 Uji statistik (Anova) dengan SPSS untuk jumlah inti sel hati tikus pada terminasi hari ke-22 dengan intensitas kandungan Cu,Zn-SOD positif lemah (+) ... 62
1.1 Latar Belakang
Tingginya prevalensi penyakit diare terutama pada anak-anak terjadi hampir
di seluruh negara, termasuk Indonesia. Data dari Badan Penelitian dan
Pengembangan Kesehatan (LITBANGKES) Departemen Kesehatan Republik
Indonesia, menunjukkan bahwa secara umum kejadian diare di Indonesia rata-rata
setiap tahun adalah sebesar 2.5% dari semua kelompok umur.
Tingginya kejadian penyakit tersebut antara lain disebabkan oleh buruknya
higiene makanan dan buruknya sanitasi lingkungan.
Paparan agen patogen di saluran pencernaan dapat menyebabkan berbagai
jenis penyakit, salah satunya diare (Schiller dan Sellin 2006). Diare merupakan
salah satu penyakit gastroenteritis. Diare juga merupakan salah satu penyakit
menular berbasis lingkungan yang penting di Indonesia (LITBANGKES 2008).
Salah satu penyebab utama diare pada anak-anak di Indonesia adalah
enteropathogenic Escherichia coli (EPEC) dengan prevalensi kejadiannya 55% dari jumlah anak penderita diare (Budiarti 1997).
Mikroflora saluran pencernaan mempunyai peran dalam kesehatan dan
penyakit. Saluran pencernaan manusia ataupun hewan diperkirakan mengandung
flora normal sampai 1012 bakteri per gram isi saluran pencernaan dan setidaknya
terdiri atas 500 spesies yang sebagian besar merupakan bakteri asam laktat
(Gobarch 2001).
Dewasa ini, bakteri asam laktat (BAL) telah banyak dimanfaatkan oleh
industri pangan dalam menciptakan produk pangan fungsional untuk memelihara
kesehatan saluran pencernaan manusia, misalnya sebagai probiotik. Probiotik
adalah mikroorganisme hidup yang apabila diberikan pada jumlah yang tepat
dapat bermanfaat bagi kesehatan saluran pencernaan (Reid et al. 2003). Probiotik telah banyak dimanfaatkan dalam penanggulangan berbagai penyakit infeksi
saluran pencernaan di negara-negara maju, seperti menanggulangi diare pada
anak-anak.
pasar tradisional di daerah Bogor, Jawa Barat. Sebanyak 10 bakteri asam laktat ini
telah diuji secara in vitro mempunyai sifat sebagai probiotik. Selanjutnya, hasil penelitian Astawan et al. (2009) telah menemukan dua bakteri terbaik di antara 10 bakteri asam laktat tersebut, yaitu Lactobacillus plantarum dan Lactobacillus fermentum. Penemuan bakteri asam laktat isolat lokal sangat penting bagi Indonesia untuk menghasilkan pangan fungsional dan pakan hewan yang sesuai
dengan kondisi lingkungan Indonesia.
Penelitian lebih lanjut terhadap isolat lokal ini diperlukan untuk menguji
potensi BAL ini sebagai antidiare pada kondisi usus halus yang dipapar
enteropathogenic Escherichia coli (EPEC) serta melihat efektivitas probiotik ini dalam meningkatkan kandungan enzim antioksidan intraseluler pada jaringan
akibat terbentuknya radikal bebas sebagai konsekuensi terjadinya diare.
Kegagalan sistem pertahanan mukosa usus dalam memproduksi musin
(sebagai pelumas, barier, dan menghasilkan senyawa antibakteri) dan membentuk
mikrovili (yang mendorong musin dan bakteri keluar dari membran mukosa)
dalam mencegah adhesi EPEC akan mengawali infeksi EPEC. Kegagalan
mekanisme pertahanan tersebut menyebabkan perlekatan bakteri pada permukaan
sel usus inang. Bakteri EPEC melekatkan diri pada mukosa usus halus dan
membentuk koloni pada permukaan sel epitel usus yang terpapar, kemudian
melakukan invasi menembus sel mukosa usus halus. Perlekatan kuat antara sel
bakteri dan sel epitel usus inang akan menyebabkan kerusakan pada aktin dan
mikrovili sel-sel mukosa inang, sehingga kemampuan mukosa untuk
mengabsorbsi air hilang. Hal tersebut menyebabkan terjadinya diare (Khutton
et al. 1989).
Lesio yang terjadi pada sel epitel usus yang terinfeksi mengakibatkan
kerusakan struktur sitoskeletal sel dan membentuk formasi yang dikenal dengan
pedestal actin formation di bawah perlekatan EPEC pada epitel usus (Campellone 2003; Smith et al. 2010). Sel epitel yang rusak dan EPEC akan difagosit oleh makrofag (Tizard 2000). Makrofag merupakan salah satu sel radang yang
berperan dalam proses fagositosis di jaringan (Nishikawa et al. 2000; Forman dan Martine 2001). Makrofag menghasilkan dan melepaskan molekul mikrobisidal
terbentuk ini terakumulasi dan saat antioksidan tidak mampu menetralisir, maka
terjadilah kondisi stres oksidatif (Halliwell dan Gutteridge 1999).
Stres oksidatif adalah suatu kondisi terjadinya ketidakseimbangan antara
radikal bebas yang terdapat dalam tubuh, dimana keberadaan radikal-radikal
bebas dalam tubuh melampaui kapasitas antioksidan tubuh. Radikal bebas (free radical) didefinisikan sebagai molekul yang mempunyai satu atau lebih elektron tanpa pasangan pada orbit terluarnya. Antioksidan merupakan suatu zat yang
dapat menetralisir radikal bebas. Antioksidan dibedakan atas antioksidan eksogen
yang diperoleh dari bahan makanan seperti askorbat, tokoferol, karoten, dan
lain-lain serta antioksidan endogen yang terdiri dari enzim-enzim yang disintesis tubuh
seperti superoksida dismutase (SOD), katalase, dan glutation peroksidase
(Devasagayam et al. 2004). Superoksida dismutase (SOD) merupakan enzim antioksidan endogen yang menjadi lini pertahanan pertama antioksidan tubuh
dalam melindungi sel dari radikal bebas (Fridovich 1995).
Oleh karena itu, menjaga keseimbangan mikroflora usus sangat penting.
Mengonsumsi probiotik melalui produk-produk pangan merupakan salah satu cara
ideal menjaga keseimbangan mikroflora usus, dan lebih baik lagi jika mikroba
probiotik tersebut berasal dari wilayah lokal atau bersifat indigenus yang lebih
adaptif dengan lingkungan. Saat keseimbangan mikroflora usus terganggu, keseimbangan antara radikal bebas dan antioksidan juga akan terganggu dan
dampaknya adalah terjadi stress oksidatif.
Sejauh ini belum banyak laporan secara in vivo tentang efek probiotik terhadap status antioksidan tubuh. Penelitian ini difokuskan pada pengamatan
kandungan enzim antioksidan superoksida dismutase(Cu,Zn-SOD) pada jaringan
hati tikus percobaan yang diberi perlakuan probiotik Lactobacillus plantarum dan
Lactobacillus fermentum serta intervensi enteropathogenic Escherichia coli
(EPEC). Organ hati dipilih sebagai tempat diamatinya perubahan kandungan
Cu,Zn-SOD karena kandungan enzim ini di hati lebih tinggi 10 kali lipat per gram
berat basah dibandingkan keberadaannya pada organ lain di dalam tubuh (Slot
1.2 Tujuan Penelitian
Penelitian ini bertujuan menganalisa efek pemberian probiotik bakteri asam
laktat (Lactobacillus plantarum dan Lactobacillus fermentum) pada profil imunohistokimia antioksidan copper, zinc-superoksida dismutase (Cu,Zn-SOD)
pada jaringan hati tikus yang dipapar bakteri enteropathogenic E. coli (EPEC).
2.1 Hewan Percobaan
Hewan percobaan atau hewan laboratorium memainkan peranan penting
dalam perkembangan dan kemajuan ilmu biomedis. Hewan percobaan adalah
hewan yang sengaja dipelihara dan diternakkan untuk dipakai sebagai hewan
model guna mempelajari dan mengembangkan berbagai macam bidang ilmu
dalam skala penelitian atau pengamatan laboratorik. Penggunaan hewan
percobaan untuk penelitian banyak dilakukan di bidang fisiologi, farmakologi,
biokimia, patologi, komperatif zoologi, dan ekologi dalam arti luas. Di bidang
ilmu kedokteran selain untuk penelitian, hewan percobaan juga sering digunakan
untuk keperluan diagnostik (Malole dan Pramono 1989). Jenis-jenis hewan
percobaan meliputi hewan percobaan kecil, misalnya: mencit, tikus, marmut, dan
kelinci; serta hewan percobaan lain, seperti: ayam, itik, babi, satwa primata,
domba, dan kambing (Smith dan Mangkoewidjojo 1988).
Pemilihan hewan percobaan untuk penelitian mempertimbangkan beberapa
faktor, terutama tujuan dari penelitian itu sendiri. Misalnya, kelinci merupakan
hewan percobaan yang cocok dan paling sering digunakan untuk penelitian
tentang hiperkolesterolemia, karena kelinci memiliki cadangan lemak tubuh yang
banyak (Sirois 2005) dan peka terhadap kolesterol (Muliasari 2009). Berbeda
dengan anjing, kucing, dan tikus yang resisten terhadap pakan kolesterol.
Satwa primata merupakan hewan yang sangat cocok digunakan dalam
penelitian ilmiah yang ada kaitannya dengan manusia, karena satwa primata erat
hubungannya dengan manusia misalnya fisiologi dan patologinya. Tetapi banyak
faktor yang harus dipertimbangkan secara matang sebelum memutuskan hewan
percobaan ini digunakan dalam penelitian, seperti sulitnya pengadaan hewan
(satwa langka), biaya yang tinggi dan pemeliharaan yang rumit, pertimbangan
kemampuan dan keselamatan pekerja dalam hal meng-handling hewan percobaan, dan resiko tertularnya pekerja laboratorium dari penyakit menular karena satwa
primata dapat membawa organisme penyebab penyakit menular, terlebih
virus-virus yang tidak begitu patogenik terhadap hewan tersebut tetapi sangat berbahaya
Penggunaan hewan percobaan untuk pengujian secara in vivo biasanya menunjukkan hasil deviasi yang besar dibandingkan dengan pengujian in vitro,
karena adanya variasi individu. Supaya variasi tersebut minimal, hewan-hewan
yang mempunyai spesies yang sama atau strain yang sama, usia yang sama, dan
jenis kelamin yang sama, dipelihara pada kondisi yang sama pula (Malole dan
Pramono 1989).
Hewan percobaan yang umum digunakan dalam penelitian ilmiah adalah
tikus. Tikus merupakan spesies pertama mamalia yang didomestikasi untuk tujuan
ilmiah karena memiliki daya adaptasi yang baik. Tikus yang diproduksi sebagai
hewan percobaan dan hewan peliharaan adalah tikus putih (Rattus norvegicus).
Rattus norvegicus merupakan salah satu hewan percobaan yang paling sering digunakan dalam penelitian, karena memiliki karakter fungsional yang baik
sebagai model bagi hewan mamalia (Hedrich 2000).
Rattus norvegicus memiliki ciri-ciri panjang tubuh total 440 mm, panjang ekor 205 mm, bobot badan 140-500 g dengan rataan 400 g (Myers dan Armitage
2004). Tikus disapih hingga usia 21 hari dan memasuki masa dewasa pada usia
40-60 hari (Smith dan Mangkoewidjojo 1988). Rattus norvegicus memiliki beberapa keunggulan, antara lain: penanganan dan pemeliharaan yang mudah
karena tubuhnya kecil, kemampuan reproduksi yang tinggi dengan masa
kebuntingan yang singkat, sehat, bersih, dan cocok untuk berbagai macam
penelitian (Malole dan Pramono 1989). Penelitian yang telah pernah dilakukan
menggunakan Rattus norvegicus adalah penelitian tentang hipertensi, diabetes insipidus, katarak, obesitas, diabetes melitus, dan lain-lain (Sirois 2005).
Terdapat tiga galur atau varietas tikus Rattus norvegicus yang biasa digunakan sebagai hewan percobaan yaitu galur Sprague Dawley yang memiliki kepala kecil, berwarna albino putih, dan ekornya lebih panjang dari badannya.
Galur Wistar, memiliki kepala besar, berwarna putih, dan ekor yang lebih pendek. Galur Long Evans, lebih kecil dari tikus putih dan memiliki warna hitam pada kepala hingga tubuh bagian depan serta warna putih pada tubuh bagian belakang
(Malole dan Pramono 1989).
Penelitian ini juga menggunakan tikus sebagai hewan percobaan. Tikus
yang digunakan dalam penelitian ini adalah spesies Rattus norvegicus (Albino Norway Rats)galur Sprague Dawley. Rattus norvegicus dipakai karena tergolong omnivora seperti halnya manusia, dan kebutuhan asam amino esensialnya
menyamai kebutuhan manusia, khususnya anak-anak. Tikus putih dalam keadaan
sehat dapat hidup 2-3 tahun. Satu minggu umur tikus putih ekuivalen dengan 30
minggu umur manusia, sehingga pengaruh zat gizi terhadap pertumbuhan dapat
dipelajari dengan cepat pada tikus putih (Nio 1985).
Ada dua sifat utama yang membedakan tikus dengan hewan percobaan lain,
yaitu tikus tidak dapat muntah karena struktur anatomi yang tidak lazim pada
tempat bermuara esofagus ke dalam lambung sehingga mempermudah proses
pencekokan perlakuan menggunakan sonde lambung, dan tidak mempunyai
kantong empedu (Smith dan Mangkoewidjojo 1988). Selain itu, tikus hanya
mempunyai kelenjar keringat di telapak kaki. Ekor tikus menjadi bagian badan
yang paling penting untuk mengurangi panas tubuh. Mekanisme perlindungan lain
adalah tikus akan mengeluarkan banyak ludah dan menutupi bulunya dengan
ludah tersebut (Sirois 2005).
2.2 Hati
Hati merupakan kelenjar sekaligus organ parenkimatis terbesar di dalam
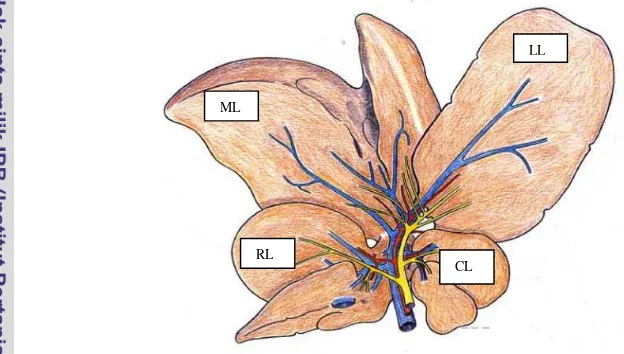
tubuh. Hati tikus terdiri atas 4 lobus (Gambar 1), yaitu lobus medial yang terbagi
menjadi sublobus kanan dan kiri oleh bifurcatio, lobus lateral kanan yang terbagi
menjadi bagian anterior dan posterior, lobus kiri (lobus yang paling besar), dan
lobus kaudatus yang terdiri atas dua sublobus seperti daun di dorsal dan ventral
fungsional dasar hati adalah lobulus hati, yang berbentuk silindris dengan panjang
beberapa milimeter dan berdiameter 0.8 sampai 2 milimeter. Lobulus hati
terbentuk mengelilingi vena centralis yang mengalir ke vena hepatica dan kemudian ke vena cava (Guyton dan Hall 1997). Hati mempunyai beberapa komponen sel, yaitu hepatosit (sel parenkim), sel sinusoidal (endotel, sel Kupffer,
dan sel lemak), sel haematopoesis, sel saraf, saluran limfatik, dan pembuluh darah
(Maronpot 1999).
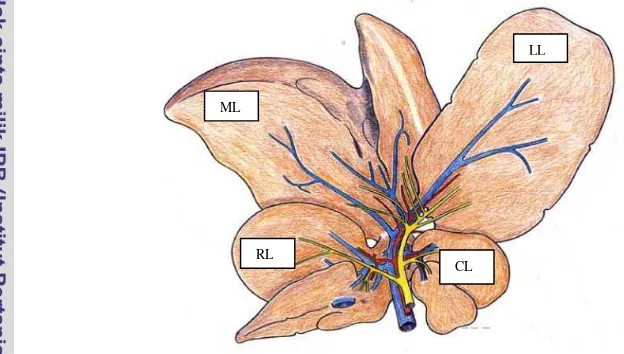
Gambar 1 Gambaran hati tikus yang terdiri dari empat lobus; LL = lobus kiri; ML = lobus medial; RL = lobus kanan; CL = lobus kaudatus.
Sumber : http://www.fibrogenesis.com/content/1/1/6/figure/F2
Komponen struktural utama dari hati adalah sel hati atau hepatosit. Secara
histologis, bentuk hepatosit serupa pada setiap spesies yaitu berbentuk polihedral
dan memiliki satu atau dua inti. Hepatosit bersifat metabolik aktif dan memiliki
banyak mitokondria, ribosom, rough endoplasmic reticulum, dan badan golgi. Peroksisom, smooth endoplasmic reticulum, dan lisosom juga terdapat pada sitoplasma. Hepatosit berderet secara radier dalam lobulus hati. Mereka
membentuk lapisan setebal 1 atau 2 sel. Lempeng ini mengarah dari tepian
lobulus ke pusat dan beranastomosis secara bebas. Antara lobulus ini dipisahkan
oleh sinusoid hati (Samuelson 2007).
Sinusoid hati merupakan kapiler yang menghubungkan pembuluh darah
interlobularis, arteri hepatica, dan vena porta ke vena centralis. Sinusoid terdiri dari 2 tipe sel, yaitu sel endotel (sinusoidal endothelial cells) dan sel Kupffer yang merupakan makrofag jaringan yang dapat memfagosit bakteri dan benda asing di
aliran darah hati. Di antara sel endotel dan sel hati terdapat ruang sempit yang
LL
ML
RL
disebut ruang Disse yang menghubungkan pembuluh limfe di dalam septum
interlobularis. Sel Kupffer mempunyai complement dan reseptor Fc yang dapat menghilangkan benda asing seperti sel debris dan sisa hasil perombakan sel darah
merah. Selain sel endotel dan sel Kupffer juga terdapat komponen yang disebut
Sel Ito (Ito Cells). Sel tersebut menyimpan banyak retinoid hati dalam droplet lemak yang banyak terlibat dalam dinamika retinol dalam tubuh (Samuelson
2007).
Fungsi dasar hati dapat dibagi menjadi: (1) fungsi detoksifikasi, (2) fungsi
metabolisme yang berhubungan dengan sebagian besar sistem metabolisme tubuh
yakni metabolisme karbohidrat, lemak, dan protein, (3) fungsi sekresi dan ekskresi
yang berperan membentuk empedu dan mengalirkan empedu ke saluran
pencernaan (Guyton dan Hall 1997).
Aktivitas SOD tertinggi terdapat dalam hati, kemudian dalam kelenjar
adrenal, ginjal, darah, limpa, pankreas, otak, paru-paru, lambung, usus, ovarium,
timus, dan lemak (Chow 1988). Jurczuk et al. (2004) menyebutkan bahwa sistem pertahanan antioksidan di hati lebih efektif dibandingkan dengan organ lain. Hati
berperan sebagai komponen utama pertahanan tubuh inang serta menginduksi
toleransi terhadap antigen (Kleinman al. 2008).
2.3 EnteropathogenicEscherichia coli (EPEC)
Escherichia coli merupakan bakteri Gram negatif yang berbentuk batang, tidak berspora, dan bersifat fakultatif anaerobik. E. coli merupakan bakteri yang normal terdapat di dalam usus besar manusia dan hewan berdarah panas dan
dikenal sebagai bakteri yang tidak berbahaya, sehingga sering ditemukan pada
feses.
Bakteri enteropahtogenic E. coli (EPEC) didefinisikan sebagai bakteri yang
memiliki karakteristik berikut: (1) kemampuan menimbulkan diare,
(2) kemampuan memproduksi sebuah bentukan histologi pada epitel usus yang
dikenal sebagai lesio attaching and effacing (A/E lesion), dan (3) ketidakmampuan memproduksi Shiga-like toxin (verocytotoxin). Karakteristik
E. coli (EAEC), dan enteroinvasive E. coli (EIEC). Karakteristik yang ketiga merupakan pembeda EPEC dengan E. coli penghasil Shiga-like toxin (STEC dan VTEC) dan enterohemorrhagic E. coli (EHEC) (Kaper et al. 2004).
Proses patogenitas EPEC diawali dengan perlekatan bakteri pada sel epitel
usus inang dan membentuk lesi attaching and effacing A/E (Gambar 2). Perlekatan awal EPEC pada sel epitel usus inang diperantarai oleh bundle-forming pilus (BFP) diikuti sekresi faktor virulen yang dikenal dengan “molecular syringe” berupa sistem sekresi tipe III. Salah satu faktor yang disuntikkan adalah Tir (translicated intimin receptor) yang berfungsi sebagai reseptor membran plasma untuk perlekatan EPEC. EPEC kemudian mengikat Tir melalui protein
membran luar, intimin. Sinyal transduksi terjadi dalam sel inang, termasuk
aktivasi protein kinase C (PKC), inositol triphosphate (IP3), dan pelepasan Ca2+. Beberapa protein sitoskeletal termasuk aktin, menjadi tempat melekatnya EPEC.
Pada akhirnya, terjadi penyusunan kembali sitoskeletal setelah Tir-intimin
berikatan, dan menghasilkan formasi pedestal-like structure (Lu dan Walker 2001).
Gambar 2 Bentuk infeksi EPEC pada epitel usus. Sumber : Lu dan Walker (2001)
2.4 Bakteri Asam Laktat sebagai Probiotik
Probiotik adalah mikroorganisme hidup yang biasanya ditambahkan ke
dalam pangan dalam jumlah yang tepat sehingga dapat bermanfaat bagi kesehatan
saluran pencernaan (Zubillaga et al. 2001). Naidu (1999) juga menyebutkan bahwa mikroba probiotik mempunyai hubungan dekat dengan kesehatan saluran
patogen di usus. Definisi FAO/WHO (2002) tentang probiotik adalah
mikroorganisme hidup yang saat dikonsumsi dengan jumlah yang cukup akan
tetap hidup sampai mencapai saluran gastrointenstinal (GI tract) serta memberikan manfaat kesehatan.
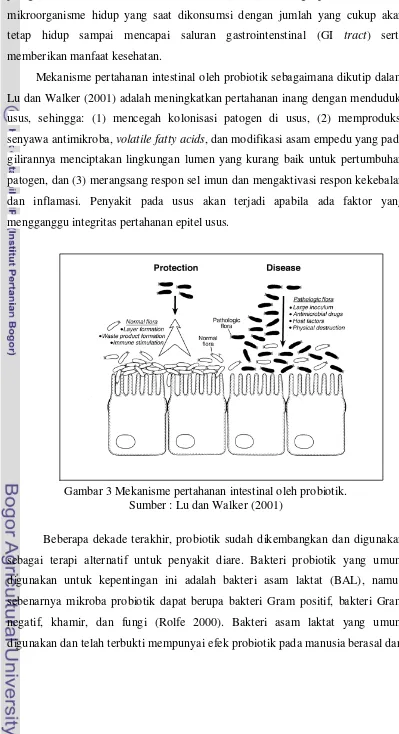
Mekanisme pertahanan intestinal oleh probiotik sebagaimana dikutip dalam
Lu dan Walker (2001) adalah meningkatkan pertahanan inang dengan menduduki
usus, sehingga: (1) mencegah kolonisasi patogen di usus, (2) memproduksi
senyawa antimikroba, volatile fatty acids, dan modifikasi asam empedu yang pada gilirannya menciptakan lingkungan lumen yang kurang baik untuk pertumbuhan
patogen, dan (3) merangsang respon sel imun dan mengaktivasi respon kekebalan
dan inflamasi. Penyakit pada usus akan terjadi apabila ada faktor yang
mengganggu integritas pertahanan epitel usus.
Gambar 3 Mekanisme pertahanan intestinal oleh probiotik. Sumber : Lu dan Walker (2001)
Beberapa dekade terakhir, probiotik sudah dikembangkan dan digunakan
sebagai terapi alternatif untuk penyakit diare. Bakteri probiotik yang umum
digunakan untuk kepentingan ini adalah bakteri asam laktat (BAL), namun
sebenarnya mikroba probiotik dapat berupa bakteri Gram positif, bakteri Gram
negatif, khamir, dan fungi (Rolfe 2000). Bakteri asam laktat yang umum
genus Lactobacillus dan Bifidobacterium, antara lain L. achidophilus, L. casei, L. fermentum, L. plantarum, L. reuteri, B. infantis, B. breve, B. animalis, B. adolescentis, dan B. longum. Bakteri–bakteri tersebut termasuk bakteri Gram
positif, fakultatif yang normal terdapat dalam usus besar manusia dan sebagian
besar merupakan mikroflora anaerobik (Liong 2007). Efek protektif probiotik
terhadap infeksi usus yang diperlihatkan pada hewan model adalah mekanisme
memproduksi asam, zat antimikroba, hidrogen peroksida, kompetisi nutrisi atau
reseptor adhesi/penempelan, tindakan antitoksin, dan stimulasi sistem kekebalan
tubuh (Marteau et al. 2001).
Kullisaar et al. (2003) telah membuktikan bahwa beberapa strains bakteri asam laktat tersebut memiliki aktivitas antioksidan dan mampu menurunkan
akumulasi reactive oxygen spesies (ROS)/radikal bebas pada inang, sehingga berpotensi menurunkan stess oksidatif. Selain itu, Kullisaar et al. (2002)
melaporkan pula bahwa mengkonsumsi susu fermentasi yang mengandung
L. fermentum ME-3 menunjukkan efek antioksidatif dan antiatherogenik.
Bakteri asam laktat (BAL) merupakan bakteri yang telah dikenal sebagai
probiotik. BAL adalah bakteri Gram positif yang bersifat mikroaerofilik, tidak
berspora, dan mampu memfermentasi karbohidrat menjadi asam laktat. Bakteri
asam laktat termasuk mikroorganisme yang aman jika ditambahkan dalam pangan
karena sifatnya tidak toksik dan tidak menghasilkan toksin, maka disebut food grade microorganism atau dikenal sebagai mikroorganisme yang Generally Recognized As Safe (GRAS) yaitu mikroorganisme yang tidak beresiko terhadap kesehatan, bahkan beberapa jenis bakteri tersebut berguna bagi kesehatan.
Bakteri probiotik umumnya dimasukkan ke dalam pangan fermentasi
berbasis susu. Untuk dapat dikatakan sebagai probiotik, maka BAL harus
memenuhi syarat antara lain: (1) tahan terhadap asam lambung (pH 1.5-5.0),
(2) stabil terhadap asam empedu dan mampu bertahan hidup selama berada dalam
usus kecil, (3) mampu bertahan (survive) dan berkolonisasi di saluran pencernaan, (4) mampu mempertahankan suatu keseimbangan mikroflora usus melalui
kompetisi dan inhibisi terhadap kuman-kuman patogen, seperti memproduksi
(5) tidak patogen dan tidak toksik, (6) stabil selama penyiapan sampai dengan
penggunaan agar dapat disediakan massal dalam industri pangan (Lisal 2005).
2.5 Radikal Bebas dan Antioksidan Cu,Zn-SOD
Radikal bebas (free radical), oksidan (oxidant) yang berupa reactive nitrogen species (RNS) atau reactive oxygen species (ROS) merupakan molekul yang mempunyai satu atau lebih elektron yang tidak berpasangan (unpaired electron) pada orbital luarnya. Elektron yang tidak berpasangan ini akan menjadi sangat reaktif dalam upaya memperoleh pasangan dengan cara menarik elektron
dari biomakromolekul disekitarnya, seperti protein, asam nukleat, dan asam
deoksiribonukleat (DNA). Oksidasi dan degradasi makromolekul yang merupakan
komponen sel akan mengakibatkan kerusakan pada sel tersebut (Halliwell dan
Gutteridge 1999).
Pada kondisi fisiologis normal, sel memproduksi radikal bebas sebagai
konsekuensi logis terhadap reaksi biokimia dalam kehidupan aerobik. Senyawa
radikal bebas yang terlibat dalam berbagai proses patologik berasal dari berbagai
sumber di antaranya sebagai reaksi reduksi oksidasi (redoks) biokimia yang
melibatkan senyawa oksigen. Reaksi ini terjadi pada sebagian besar proses
metabolisme tubuh normal, tetapi oleh suatu sebab senyawa tersebut terdapat
dalam jumlah yang berlebihan. Senyawa yang dihasilkan dari reaksi ini disebut
senyawa oksigen reaktif yang sebagian berbentuk radikal seperti hidroksil dan
superoksida serta sebagian lagi berbentuk non radikal seperti asam hipokrit,
singlet oksigen, dan hidrogen peroksida (Jhonson dan Giulivi 2005).
Awal terbentuknya radikal bebas adalah dari proses reduksi molekul
oksigen dalam rangkaian transpor elektron dalam mitokondria atau dalam
proses-proses lain yang terjadi secara acak dari berbagai proses-proses kimiawi dalam tubuh
yang melibatkan senyawa organik maupun inorganik. Radikal bebas yang
terbentuk mempunyai masa paruh yang sangat pendek, tetapi tetap mempunyai
potensi besar yang dapat merusak sel. Bila reaksi terus berlanjut maka terjadi
suatu reaksi berantai (chain reaction) sampai radikal bebas itu dihilangkan oleh sistem antioksidan tubuh. Naiknya level radikal bebas atau kurangnya antioksidan
(2002) dan Wresdiyati et al. (2003), bahwa keadaan stress oksidatif menimbulkan penurunan kandungan antioksidan copper, zinc-superoksida dismutase
(Cu,Zn-SOD) pada hati dan ginjal tikus.
Antioksidan adalah senyawa atau bahan bioaktif yang berfungsi mencegah,
menurunkan reaksi oksidasi, memutus, menghambat, menghentikan, dan
menstabilkan radikal bebas (Margaill 2005). Enzim antioksidan intraseluler terdiri
atas enzim katalase, glutation peroksidase, dan superoksida dismutase (SOD).
Superoksida dismutase terdiri atas 3 isoform, yakni Cu, Zn-SOD,
Mn-SOD, dan Fe-SOD (Valko et al. 2007).
Superoksida dismutase pertama kali ditemukan oleh Mann dan Keillis pada
tahun 1938 pada saat mengisolasi protein yang berwarna biru dari eritrosit sapi.
Protein tersebut selanjutnya diketahui mengandung Cu. Pada tahun 1968, McCord
dan Fridovich berhasil menemukan adanya aktivitas katalitik dismutase radikal
superoksida pada protein tersebut dan selanjutnya protein yang berhasil
diidentifikasi aktivitas katalitiknya ini dinamai superoksida dismutase (SOD).
Selanjutnya pada tahun 1972, Fridovich juga menemukan Cu,Zn-SOD pada
berbagai tingkatan organisme, seperti yeast atau ragi, Neurospora crassa, bayam, benih gandum, hati ikan, dan hati ayam. Oleh banyak peneliti selanjutnya protein
ini ditetapkan sebagai antioksidan enzimatis endogen (Fridovich 1995).
Antioksidan superoksida dismutase bekerja mengkatalisis dismutasi anion
superoksida (O2-) yang merupakan oksigen reaktif menjadi hidrogen peroksida
(H2O2) dan oksigen (O2). Dalam tubuh hewan mamalia, SOD mempunyai
berbagai macam jenis dan lokasi, antara lain Mn-SOD yang terdapat dalam
mitokondria, SOD ekstraseluler, dan Cu,Zn-SOD terdapat pada sitosol dan inti sel
(Yon et al. 2008).
Enzim antioksidan Cu,Zn-SOD merupakan protein enzimatis yang
memiliki berat molekul 32.000 Dalton dan tersusun atas dua subunit identik yang
mengandung sekelompok logam aktif, yaitu atom tembaga (Cu) dan seng (Zn).
Atom Cu pada Cu,Zn-SOD berperan dalam aktivitas enzimatis, sedangkan Zn
berfungsi sebagai stabilisator (Fridovich 1995). Antioksidan Cu,Zn-SOD
merupakan salah satu SOD paling stabil karena setiap subunit tergabung oleh
peranan penting dalam pertahanan tubuh melawan radikal-radikal bebas anion
superoksida atau yang merupakan produk metabolisme parsial oksigen
(Wresdiyati dan Astawan 2004).
2.6 Imunohistokimia
Imunohistokimia adalah metode pewarnaan jaringan yang merupakan
gabungan dari tiga cabang ilmu pengetahuan, yaitu: (1) imunologi, karena prinsip
pewarnaan ini adalah ikatan antigen dan antibodi, (2) histologi, menyangkut
penggunaan preparat dengan ketebalan mikro yang pengamatannya dengan
mikroskop cahaya, dan (3) kimia, karena pewarnaan yang dilakukan berdasarkan
reaksi kimia (Ramos-Vara 2005).
Teknik imunohistokimia yang ditemukan AH Coons pada tahun 1941
adalah teknik identifikasi unsur pokok jaringan secara in situ melalui reaksi antigen-antibodi spesifik dan diberi label agar terlihat dengan mikroskop. Ikatan
antigen-antibodi sangat spesifik ibarat ikatan kunci dan gembok (lock and key). Teknik ini menggunakan dua antibodi, yaitu antibodi primer dan antibodi
sekunder (Ramos-Vara 2005). Antibodi primer yang digunakan pada penelitian ini
adalah antibodi monoklonal terhadap Cu,Zn-SOD dan antibodi sekunder
(anti-antibodi primer) yang digunakan adalah (anti-antibodi yang sudah terkonjugasi dengan
peroksidase (Dako envision peroxidase system atau DEPS). Antibodi sekunder yang digunakan dapat bereaksi beberapa jenis antibodi monoklonal yang dibuat
dari beberapa jenis hewan.
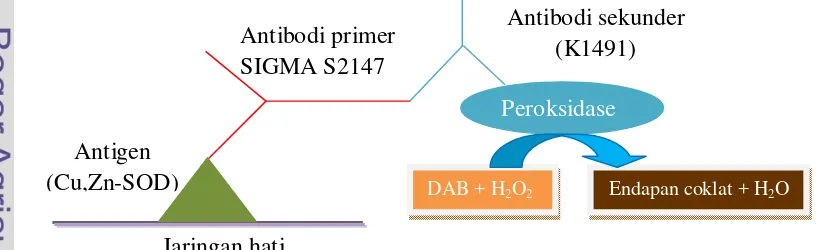
Prinsip pewarnaan imunohistokimia dapat dilihat pada Gambar 4.
Enzim antioksidan Cu,Zn-SOD di jaringan hati dikenali sebagai antigen
oleh antibodi primer (antibodi monoklonal terhadap Cu,Zn-SOD). Antigen akan
diikat oleh antibodi primer. Selanjutnya, antibodi primer akan berikatan dengan
antibodi sekunder yang telah dikonjugasikan dengan peroksidase (DEPS).
sehingga keberadaan peroksidase ini melambangkan adanya kompleks
antigen-antibodi. Peroksidase berfungsi mengkatalisis reaksi antara kromogen (diamino benzidine atau DAB ) dan hidrogen peroksida (H2O2), sehingga terbentuk endapan berwarna coklat yang menunjukkan keberadaan SOD. Semakin tua intensitas
warna coklatnya berarti semakin banyak kandungan SOD-nya.
2.7 Penelitian Pendahuluan
Arief et al. (2008) telah melakukan isolasi bakteri asam laktat (BAL) golongan Lactobacillus, Lactococcus, dan Streptococcus dari daging sapi bangsa peranakan Ongol yang dijual di berbagai pasar tradisional di daerah Bogor.
Bakteri asam laktat tersebut selanjutnya diuji kemampuannya bertahan pada
kondisi sesuai dengan kondisi saluran pencernaan manusia, antara lain pH, garam
empedu, serta aktivitas antimikrobanya terhadap bakteri patogen.
Hasil penelitian pendahuluan tersebut menunjukkan bahwa terdapat 10
bakteri asam laktat isolat indigenus yang mempunyai kemampuan bertahan pada
pH asam lambung yaitu pH 2 dan pH usus 7.2, serta pada kondisi garam empedu
0.5% sesuai dengan kondisi saluran pencernaan. Kesepuluh BAL tersebut adalah
dari spesies Lactobacillus spp., Lactococcus spp., dan Streptococcus spp. BAL tersebut memiliki kemampuan bakterisidal terhadap mikroba patogen karena
mampu menghasilkan senyawa bioaktif asam laktat, asam asetat, serta senyawa
bakteriosin. Selain itu, bakteri asam laktat tersebut juga mempunyai kemampuan
penghambat yang baik terhadap tiga jenis bakteri patogen, yaitu enterotoxigenic E. coli (ETEC), Salmonella Thypimurium, dan Staphylococcus aureus. Mengacu pada kriteria probiotik yang dikeluarkan oleh FAO/WHO (2002), kesepuluh isolat
bakteri asam laktat ini layak dikatakan sebagai probiotik.
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli-Agustus 2009 (sampling sampai dengan embedding), Februari 2010 (sectioning), dan bulan Juli 2010 (pewarnaan), bertempat di SEAFAST CENTRE IPB dan Laboratorium Histologi Departemen
Anatomi Fisiologi dan Farmakologi Fakultas Kedokteran Hewan Institut
Pertanian Bogor.
3.2 Alat dan Bahan Penelitian
Alat yang digunakan terdiri atas seperangkat alat bedah (gunting, pinset,
alas bedah), pisau silet, gelas piala, Erlenmeyer, botol sampel, kapas, kertas tissue,
benang, aluminium foil, tissue basket, exhause fan, pipet tetes, pipet mohr, mikropipet, gelas ukur, cup untuk embedding, gelas objek, cover glass, inkubator,
waterbath, mikrotom putar (rotatory microtom), tabung Eppendorf, kotak preparat, pensil, dan kamera.
Bahan-bahan yang digunakan pada penelitian ini adalah tikus putih Albino Norway Rats (Rattus norvegicus) galur Sprague Dawley umur 5-6 minggu sebanyak 90 ekor berjenis kelamin jantan dengan berat badan berkisar antara
140-240 g, bakteri asam laktat (BAL) indigenus isolat lokal yaitu Lactobacillus plantarum dan Lactobacillus fermentum, kultur bakteri enteropathogenic E. coli
(EPEC), ransum tikus percobaan, (kasein, minyak jagung, mineral mix,
carboximethylcellulose, dan maizena), eter, NaCl fisiologis 0.9%, larutan fiksatif Bouin (asam pikrat jenuh, formalin, dan asam asetat glasial dengan perbandingan
15:5:1), alkohol 70%, 80%, 90%, 95%, dan 100%, xylol, parafin, akuades, pewarna hematoksilin, entelan, neophren in toluene 2%, phosphate buffered saline (PBS), metanol, H2O2, serum normal, antibodi primer/monoklonal Cu,Zn-SOD (SIGMA S2147), antibodi sekunder Dako envision peroksidase system
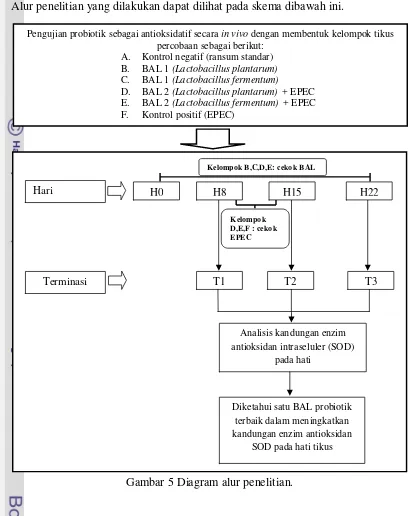
Alur penelitian yang dilakukan dapat dilihat pada skema dibawah ini.
Gambar 5 Diagram alur penelitian.
3.3 Tahapan Perlakuan 3.3.1 Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah 90 ekor tikus
putih Albino Norway Rats (Rattus norvegicus) galur Sprague Dawley yang berumur 5-6 minggu dengan berat badan berkisar 140-240 gdan berjenis kelamin
jantan hasil perkembangbiakkan dari Badan POM RI.
Hari
3.3.2 Kandang dan Perlengkapan
Kandang hewan percobaan yang digunakan dalam penelitian ini adalah
kandang yang berukuran 17.5 x 23.75 x 17.5 cm dan berjumlah sesuai dengan
jumlah tikus yang digunakan. Kandang tersebut terbuat dari stainless steel. Kandang tikus berlokasi pada tempat atau ruangan yang bebas dari suara ribut dan
terjaga dari asap industri dan polutan lainnya. Ruangan tempat kandang tikus
berada mudah dibersihkan dan disanitasi dengan suhu optimum ruangan untuk
tikus adalah 22-24 °C, kelembapan udara 50-60%, dan ventilasi yang cukup,
namun tidak ada jendela yang terbuka.
3.3.3 Ransum
Komposisi ransum basal disusun berdasarkan standar AOAC (Association of Official Agricultural Chemists) yaitu mengandung karbohidrat, protein, lemak, mineral, vitamin, dan air. Semua kelompok tikus percobaan diberi ransum standar.
Tabel 1 Komposisi ransum standar tikus
Sumber : Muchtadi et al. (1992)
3.3.4 Perlakuan terhadap Hewan Percobaan
Sebanyak 90 ekor tikus percobaan dibagi dalam 6 kelompok perlakuan.
Setiap kelompok perlakuan terdiri dari 15 ekor tikus yang akan diterminasi pada 3
waktu yang berbeda (hari ke-8, 15, dan 22) masing-masing 5 ekor tikus.
Masing-masing kelompok diberi perlakuan seperti pada Tabel 2 dan waktu terminasi dapat
dilihat pada Gambar 5.
Komponen Sumber Jumlah Perhitungan
Tabel 2 Kelompok tikus percobaan sesuai perlakuan yang diberikan
Kelompok
Tikus Perlakuan
A Tikus yang diberi ransum standar dan dicekok akuades mulai hari ke-1 sampai hari ke- 21 (kontrol negatif)
B Tikus yang diberi ransum standar dan dicekok BAL 1 (L. plantarum) mulai hari ke-1 sampai hari ke-21
C Tikus yang diberi ransum standar dan dicekok BAL 2 (L. fermentum) mulai hari ke-1 sampai hari ke-21
D Tikus yang diberi ransum standar dan dicekok BAL 1 (L. plantarum) mulai hari ke-1 sampai hari ke-21 serta dicekok EPEC pada hari-8 sampai hari ke-14
E Tikus yang diberi ransum standar dan dicekok BAL 2 (L. fermentum) mulai hari ke-1 sampai hari ke-21 serta dicekok EPEC pada hari-8 sampai hari ke-14
F Tikus yang diberi ransum standar dan dicekok akuades mulai hari ke-1 sampai hari ke- 21 serta cekok EPEC pada hari ke-8 sampai hari ke-14 (kontrol positif)
Jumlah BAL yang diberikan sesuai petunjuk Zoumpopolou et al. (2008). Dua buah kultur dari bakteri asam laktat terpilih (L. plantarum dan L. fermentum)
berumur satu hari pada media de Man Rogosa Sharpe Broth (MRS Broth) dengan populasi 108 cfu/ml/hari diberikan sesuai dengan perlakuan kepada tikus
percobaan. Sedangkan populasi EPEC penyebab diare yang diberikan adalah
sebesar 106 cfu/ml/hari, yang didasarkan bahwa dosis infeksi E. coli
enteropatogenik adalah minimal 105 cfu/ml menurut Oyetayo (2004). Setelah
perlakuan tertentu selesai diaplikasikan pada tikus percobaan, dilakukan terminasi
(pengakhiran perlakuan) dengan selang waktu 7 hari. Pembunuhan tikus
dilakukan dengan cara dislokatio cervicalis.
3.3.5 Pembuatan Preparat Histologi Jaringan Hati Tikus
Pembuatan preparat histologi meliputi proses pengambilan jaringan
(sampling), fiksasi, dehidrasi, penjernihan (clearing), infiltrasi parafin,
embedding, pemotongan (sectioning), dan pewarnaan (staining) (Kiernan 1990). Pada proses terminasi, organ hati tikus diambil kemudian dicuci dengan NaCl
yang telah disiapkan kurang lebih satu jam sebelum terminasi. Setelah terfiksasi,
organ direndam dalam alkohol 70% (stopping point). Selanjutnya sampel organ hati dipotong kecil-kecil seperti dadu dan dimasukkan ke dalam tissue basket serta diberi label dengan kertas film. Sampel jaringan yang telah berada dalam tissue basket didehidrasi dengan alkohol bertingkat mulai dari alkohol 70%, 80%, 90%, dan 95% masing-masing selama 24 jam. Selanjutnya dilakukan dehidrasi dalam
alkohol absolut (100%) I, II, III masing-masing selama 1 jam. Setelah itu,
dilakukan penjernihan (clearing) dalam xylol I, II, dan III masing-masing selama 1 jam dan dilanjutkan dengan infiltrasi parafin cair I, II, III pada suhu 60 °C
selama masing-masing 1 jam.
Tahap selanjutnya adalah embedding, yaitu penanaman jaringan dalam blok parafin (cetakan) sehingga memudahkan pada saat pemotongan/penyayatan
dengan mikrotom. Blok parafin tersebut kemudian dipotong dengan mikrotom
setebal 4 µ m. Proses ini disebut sectioning. Sebelum blok parafin dipasang pada
holder mikrotom, sebaiknya setiap sudut blok diiris sedikit sebagai pembatas antar potongan sehingga mudah dipisahkan setelah disayat. Hasil potongan
direndam dalam akuades suhu ruang. Setelah ditentukan hasil sayatan terbaik,
sayatan tersebut dimasukkan ke dalam akuades yang dipanaskan dengan suhu
37°C dalam waterbath. Selanjutnya sayatan jaringan dilekatkan pada gelas objek dan diberi label (untuk pewarnaan imunohistokimia, jaringan dilekatkan pada
gelas objek dengan agen perekat neophren in toluene). Setelah itu, sediaan diinkubasi dalam inkubator selama lebih kurang 24 jam.
Proses berikutnya adalah pewarnaan (staining). Pewarnaan diawali dengan deparafinisasi dengan cara merendam gelas preparat dalam xylol III, II, I secara
berurutan selama masing-masing 5 menit. Selanjutnya rehidrasi dilakukan dengan
merendam preparat dalam alkohol bertingkat mulai dari alkohol absolut III, II, I,
95%, 90%, 80%, 70% selama masing-masing 5 menit, kemudan dilanjutkan
dengan perendaman preparat dalam air kran selama 5 menit dan dalam akuades
selama 3 menit.
Pewarnaan Imunohistokimia Superoksida Dismutase (Cu,Zn-SOD)
Pewarnaan ini dilakukan untuk mengamati kandungan enzim Cu,Zn-SOD
tahapan awal yang harus dilakukan, yaitu preparasi gelas objek dan pelapisan
(coating) gelas objek dengan neofren in tholuene 2%. Setelah prosedur deparafinisasi dan rehidrasi dilakukan, tahap selanjutnya adalah penghilangan
peroksidase endogen menggunakan substrat metanol (30 ml) yang dicampur
dengan H2O2 (0.3 ml) atau 3% H2O2 dalam metanol (disiapkan sesaat sebelum
gelas objek dimasukkan) dengan cara mencelupkan gelas preparat dan dibiarkan
dalam keadaan gelap selama 15 menit. Kemudian dilakukan pencucian dengan
akuades dan phosphate buffer saline (PBS) masing-masing 2 kali selama 10 menit. Selanjutnya permukaan sediaan di sekitar jaringan dikeringkan
menggunakan kertas tissue dengan tetap menjaga jaringan untuk tidak kering, kemudian preparat disusun sejajar secara mendatar dalam kotak lembab untuk
selanjutnya ditetesi 50-60 µl normal serum untuk masing-masing preparat. Kotak
kemudian ditutup rapat dan diinkubasi dalam inkubator pada suhu 37°C selama
60 menit. Tujuan penetesan normal serum adalah untuk menutupi bagian antigen
yang tidak spesifik pada jaringan agar tidak mengacaukan reaksi. Selanjutnya
dilakukan pencucian preparat dengan PBS sebanyak 3 kali selama masing-masing
5 menit.
Tahap selanjutnya adalah penetesan antibodi primer (monoclonal antibody) Cu,Zn-SOD (SIGMA S2147) sebanyak 50-60 µ l pada masing-masing preparat,
lalu diinkubasi pada suhu 4 °C selama dua malam. Setelah diinkubasi, gelas
preparat dicuci kembali dengan PBS sebanyak tiga kali masing-masing 10 menit,
kemudian ditetesi antibodi sekunder DEPS sebanyak 50-60 µ l per preparat pada
suasana gelap dan diinkubasi pada suhu 37 °C selama 60 menit. Sediaan dicuci
dengan PBS masing-masing 3 kali selama 5 menit kemudian ditetesi larutan
kromogen DAB pada kondisi gelap dan di tutup selama 30 menit pada suhu ruang.
Selanjutnya preparat dicuci dengan air bebas ion (milliQ) dan kemudian dilakukan
pengecekan dengan mikroskop cahaya. Adanya warna coklat menunjukkan hasil
positif. Proses selanjutnya adalah counterstain menggunakan pewarna hematoksilin untuk mewarnai sel yang tidak menghasilkan Cu,Zn-SOD dan
dilanjutkan dengan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%,
absolut I, dan absolut II masing-masing beberapa detik serta absolut III selama 1
III selama 1 menit. Proses diakhiri dengan mounting (penutupan sediaan dengan
cover glass) menggunakan entelan.
Preparat yang telah selesai diwarnai diamati dengan mikroskop cahaya pada
lensa objektif 20x pada tiap preparat. Pemotretan juga dilakukan dengan
pembesaran lensa objektif 20x pada preparat jaringan hati tersebut sebanyak enam
lapang pandang secara acak pada setiap preparat.
3.3.6 Analisis Kandungan SOD Hati Tikus
Analisis kandungan enzim superoksida dismutase (SOD) dilakukan dengan
metode imunohistokimia. Pewarnaan imunohistokimia terhadap Cu,Zn-SOD
dilakukan untuk mendeteksi sel-sel penghasil Cu,Zn-SOD yang dapat
menunjukkan jumlah sel penghasil serta kandungan antioksidan Cu,Zn-SOD.
Pengamatan dilakukan secara kualitatif dan kuantitatif menggunakan mikroskop
cahaya dengan perbesaran lensa obyektif 20x.
Pengamatan Cu,Zn-SOD secara kualitatif dilakukan pada sitoplasma dan
inti sel hati dengan melihat intensitas warna coklat dan distribusinya pada seluruh
bagian setiap preparat yang diamati. Pengamatan dilakukan dengan mikroskop
cahaya pada perbesaran objektif 10x. Semakin tua dan semakin merata warna
coklatnya berarti mengandung semakin banyak Cu,Zn-SOD. Penilaian dilakukan
dengan memberikan tanda (+). Semakin banyak tanda (+) berarti kandungan
enzim Cu,Zn-SOD semakin banyak dan merata di seluruh bagian jaringan hati.
Pengamatan secara kuantitatif dilakukan pada inti sel hati berdasarkan
berbagai tingkatan kandungan warna coklat yang terbentuk tiap lapang pandang
pada perbesaran objektif 20x. Keberadaan enzim Cu,Zn-SOD ditunjukkan oleh
tanda (+), semakin banyak tanda (+) berarti semakin tinggi kandungan enzim
tersebut. Ada empat tingkatan hasil reaksi, yaitu positif kuat (+++, inti sel hati
berwarna coklat tua), positif sedang (++, inti sel hati berwarna coklat sedang),
positif lemah (+, inti sel hati berwarna coklat muda campur biru), dan reaksi
negatif (-, inti sel hati berwarna biru). Perhitungan dilakukan pada enam lapang
pandang yang berbeda yang dipilih secara acak pada setiap preparat jaringan.
kuantitatif ini dianalisis dengan ANOVA dan apabila terdapat perbedaan yang
Pewarnaan imunohistokimia terhadap Cu,Zn-SOD dilakukan untuk melihat
kandungan enzim antioksidan Cu,Zn-SOD di jaringan hati tikus pada setiap
kelompok perlakuan. Enzim Cu,Zn-SOD merupakan enzim antioksidan endogen
yang mempunyai peranan penting dalam melindungi sel dari serangan radikal
bebas dan secara tidak langsung dapat menjaga keseimbangan oksigen yang
bersifat toksik (Wresdiyati et al. 2002). Enzim Cu,Zn-SOD mengkatalis dismutasi radikal bebas anion superoksida (O2-) menjadi radikal yang lebih lemah yaitu
hidrogen peroksida (H2O2) dan selanjutnya akan diubah menjadi oksigen (O2)
yang lebih stabil dan air (H2O) oleh glutation peroksidase dan katalase (Finkel dan
Holbrook 2000).
Reaksi positif dari pewarnaan imunohistokimia terhadap enzim Cu,Zn-SOD
divisualisasikan berupa produk reaksi warna coklat di jaringan hati. Intensitas dan
distribusi warna coklat menujukkan kandungan enzim antioksidan Cu,Zn-SOD
pada jaringan hati. Semakin tua dan merata warna coklat yang terbentuk berarti
kandungan enzim Cu,Zn-SOD semakin banyak/tinggi. Sel yang bereaksi negatif
atau tidak mengandung enzim Cu,Zn-SOD ditunjukkan dengan warna biru.
Pengamatan dilakukan secara kualitatif dan kuantitatif. Pengamatan secara
kualitatif dilakukan dengan melihat intensitas warna coklat pada seluruh bagian
jaringan hati. Sedangkan pengamatan secara kuantitatif dilakukan dengan
menghitung inti sel hati yang dibedakan pada beberapa tingkatan warna coklat,
yakni positif kuat (+++, coklat tua), positif sedang (++, coklat sedang), positif
lemah (+, coklat muda campur biru), dan reaksi negatif (-, biru).
Pengamatan secara kualitatif terhadap jaringan hati pada terminasi hari ke-8
menunjukkan bahwa tidak terdapat perbedaan kandungan enzim Cu,Zn-SOD antar
kelompok perlakuan (Tabel 3). Kandungan enzim Cu,Zn-SOD pada jaringan hati
tikus kelompok perlakuan bakteri asam laktat (BAL) L. plantarum, L. fermentum,
L. plantarum + EPEC, dan L. fermentum + EPEC relatif sama dengan kelompok kontrol negatif dan kontrol positif (Gambar 7). Hal ini berarti L. plantarum dan
laktat tersebut. Selain itu, tidak adanya perbedaan kandungan enzim Cu,Zn-SOD
pada kelompok kontrol positif dengan kelompok perlakuan lain dapat terjadi
karena kelompok kontrol positif belum dicekok EPEC pada minggu pertama.
Tabel 3 Kandungan enzim Cu,Zn-SOD pada jaringan hati tikus percobaan
Kelompok perlakuan Kandungan Cu,Zn-SOD
Terminasi hari ke-8, sebelum pemberian EPEC (T1)
T1A ++
Terminasi hari ke-15, satu minggu setelah pemberian EPEC (T2)
T2A ++
Terminasi hari ke-22, satu minggu setelah pemberian EPEC dari luar dihentikan (T3)
T3A ++ EPEC; E = kelompok perlakuan L. fermentum + EPEC; F = kelompok kontrol positif (perlakuan EPEC).
Kemudian pada terminasi hari ke-15, terdapat perbedaan kandungan enzim
Cu,Zn-SOD pada setiap kelompok perlakuan (Gambar 8). Secara kualitatif
kelompok perlakuan L. fermentum + EPEC memiliki kandungan enzim Cu,Zn-SOD paling tinggi, terlihat dari intensitas warna coklat yang terbentuk pada
L. fermentum mampu meningkatkan kandungan enzim Cu,Zn-SOD pada kelompok yang diberi paparan EPEC pada hari ke-8 sampai hari ke-14. Kelompok
perlakuan L. fermentum memiliki kandungan enzim Cu,Zn-SOD tertinggi kedua setelah kelompok perlakuan L. fermentum + EPEC. Ini berarti bahwa perlakuan
L. fermentum selama 2 minggu dapat meningkatkan kandungan enzim Cu,Zn-SOD di jaringan hati tikus.
Selanjutnya, dari pengamatan secara kualitatif terlihat bahwa kelompok
perlakuan L. plantarum kandungan enzim Cu,Zn-SOD-nya sama dengan kelompok kontrol negatif. Hal ini berarti perlakuan L. plantarum selama 2 minggu hanya mampu mempertahankan dan tidak meningkatkan kandungan enzim
Cu,Zn-SOD di jaringan hati tikus. Kandungan enzim Cu,Zn-Cu,Zn-SOD pada jaringan hati tikus
kelompok perlakuan L. plantarum + EPEC juga sama dengan kelompok kontrol negatif, berarti pemberian L. plantarum pada tikus yang memperoleh paparan EPEC pada hari ke-8 sampai hari ke-14 dapat mempertahankan kandungan enzim
antioksidan Cu,Zn-SOD pada jaringan hati tikus. Kelompok yang memiliki
kandungan enzim Cu,Zn-SOD paling rendah adalah kelompok dengan perlakuan
EPEC atau kontrol positif. Hal ini dapat terjadi karena enzim antioksidan yang ada
di jaringan hati telah digunakan untuk menetralkan radikal bebas yang terbentuk,
selain itu juga karena kelompok kontrol positif tidak diberi BAL.
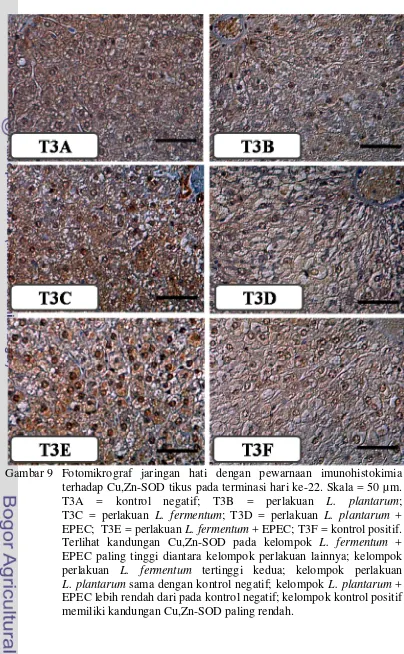
Pada terminasi hari ke-22, pengamatan secara kualitatif menunjukkan
bahwa kelompok perlakuan L. fermentum + EPEC memiliki kandungan enzim Cu,Zn-SOD paling tinggi dibandingkan kelompok lain (Gambar 9). Hal ini berarti
pemberian L. fermentum masih mampu meningkatkan kandungan enzim Cu,Zn-SOD setelah paparan EPEC sebelumnya pada hari ke-8 sampai hari ke-14.
Kelompok perlakuan L. fermentum memiliki kandungan enzim Cu,Zn-SOD tertinggi kedua. Hal ini menunjukkan bahwa L. fermentum memiliki kemampuan meningkatkan kandungan enzim Cu,Zn-SOD.
Kandungan enzim Cu,Zn-SOD pada kelompok perlakuan L. plantarum
sama dengan kelompok kontrol negatif, berarti pemberian L. plantarum mampu mempertahankan dan belum mampu meningkatkan kandungan enzim Cu,Zn-SOD