INDUKSI
MUTASI
MELALUI
PENGGANDAAN
KROMOSOM
NILAM
VARIETAS
SIDIKALANG
(
Pogostemon cablin
Benth.)
DENGAN
KOLKISIN
SECARA
IN VITRO
YUDIA
PUTRI
ANNE
A24070138
DEPARTEMEN
AGRONOMI
DAN
HORTIKULTURA
FAKULTAS
PERTANIAN
INSTITUT
PERTANIAN
BOGOR
INDUKSI MUTASI MELALUI PENGGANDAAN KROMOSOM NILAM VARIETAS SIDIKALANG
(Pogostemon cablin Benth.) DENGAN KOLKISIN SECARA IN VITRO
In Vitro Mutation Induction through Chromosome Doubling of Patchouli (Pogostemon cablin Benth.) using Colchicine
Yudia Putri Anne1, Ni Made Armini Wiendi2 1 Mahasiswa Departemen Agronomi dan Hortikultura, IPB 2 Staf Pengajar Departemen Agronomi dan Hortikultura, IPB
ABSTRACT
The research aimed to study the in vitro genetic mutation induction
through chromosome doubling of patchouli (Pogostemon cablin Benth) using
colchicine. This research was conducted from February 2011 toDecember 2011 at
Biotechnology and Micro Technique Laboratory, Department of Agronomy and
Horticulture, IPB, Bogor. The research was used factorial design which arranged
with Completely Randomized Design. The research was consist of 2 factors, concentrations of colchicine (0 %, 0,02 %, 0.04 % and 0.06 %) and the long
immersion with colchicine (24 hours, 48 hours, and 72 hours). The experiment
showed that consentrations of colchicine (0.02%, 0.04%, and 0.06%) were
significantly affected to increase number of shoots, leaves, chloroplast, stomatas
and size of stomata.Concentration of 0.04 % colchicine with 24 immer was produced the highest number of shoots and leave. Concentration of 0.02 % colchicine was produced the highest number of chloroplasts per cell and the lowest density of stomata Concentration of 0.06 % of colchicine and 48 hours immersion was produced the biggest size of stomata. Concentration 0.06 %
colchicine with 24 hours immersion and concentration 0.04% colchicine with 72
hour immersion gained chimera. Few shoots had different number of leaves per
bud than control. This experiment also can increased phenotypic variance of number shoots and leaves. Concentration of 0.02 % colchicine with 72 hours
immersion has the highest coefficent of phenotypic variance and concentration of
0 % colchicine with 24 hours immersion has the lowest coefficient of phenotypic
variance. Potential mutant plants which are produced 1189 plants.
RINGKASAN
YUDIA PUTRI ANNE. Induksi Mutasi Melalui Penggandaan Kromosom
Nilam (Pogostemon cablin Benth.) Varietas Sidikalang dengan Kolkisin
secara In Vitro. (Dibimbing oleh NI MADE ARMINI WIENDI)
Nilam merupakan salah satu penghasil minyak atsiri potensial yang ada di
Indonesia. Minyak nilam bersifat fiktatif (mengikat minyak atsiri lainnya) dan
hingga saat ini belum ada bahan substitusinya. Peningkatan kadar minyak nilam
melalui pemuliaan secara konvensional sulit untuk dilakukan, karena nilam aceh
tidak dapat berbunga di Indonesia. Usaha meningkatkan produksi diperlukan
suatu teknologi yang dapat merakit varietas baru yang memiliki kandungan
minyak atsiri tinggi sehingga dapat meningkatkan produktivitas minyak nilam,
salah satunya dengan induksi mutasi secara in vitro. Perendaman nilam dengan
kolkisin diharapkan mampu melipatgandakan kromosom nilam tersebut dan
menghasilkan ukuran tanaman, khususnya daun, yang lebih besar sehingga
produktivitas minyak nilam juga turut meningkat.
Penelitian ini bertujuan untuk menginduksi terjadinya mutasi kromosom
pada tanaman nilam varietas sidikalang (Pogostemon cablin Benth.). Melalui
penelitian ini diharapkan diperoleh galur Pogostemon cablin Benth. yang unggul.
Bahan tanam yang digunakan adalah planlet Pogostemon cablin Benth
berumur 8 minggu setelah tanam. Planlet diperbanyak pada media dasar MS
dengan tambahan zat pengatur tumbuh (ZPT) berupa 0.5 mg/l sitokinin dan 0.5
mg/l BAP. Penanaman eksplan setelah perendaman dengan kolkisin
menggunakan media dengan tambahan jenis dan konsentrasi ZPT yang sama.
Penelitian disusun menggunakan metode Rancangan Acak Lengkap
dengan dua faktor. Faktor pertama adalah konsentrasi kolkisin dengan taraf 0 %,
0.02 %, 0.04 % dan 0.06 %. Terdapat 3 taraf pada faktor lama perendaman, yaitu
24 jam, 48 jam dan 72 jam. Setiap perlakuan terdiri dari 20 eksplan yang menjadi
satuan terkecil yang diamati.
Hasil penelitian menunjukkan interaksi antara konsentrasi kolkisin dengan
lama perendaman berpengaruh sangat nyata pada peubah jumlah tunas, jumlah
menunjukkan hasil yang lebih tinggi dibanding kontrol pada semua peubah,
kecuali peubah ukuran daun. Pogostemon cablin Benth. dengan perlakuan
kolkisin menunjukkan jumlah tunas, jumlah daun dan jumlah kloroplas yang lebih
banyak, ukuran stomata yang lebih besar serta jumlah dan kerapatan stomata yang
lebih rendah.
Konsentrasi kolkisin 0.02 % dengan perendaman 48 jam memberikan hasil
yang paling optimal bagi peubah jumlah tunas. Perlakuan konsentrasi kolkisin
0.04 % dengan perendaman 24 jam menyebabkan jumlah daun per tunas tertinggi.
Peubah ukuran stomata memberikan hasil yang paling baik pada konsentrasi 0.06%
dengan perendaman 48 jam, tetapi pada peubah jumlah tunas dan daun perlakuan
ini memberikan hasil yang terendah.
Poliploidisasi tanaman dapat diketahui dari jumlah kloroplas, jumlah
stomata dan kerapatan stomata. Tunas yang dihasilkan dari perlakuan perendaman
kolkisin konsentrasi 0.02 % memiliki jumlah kloroplas yang paling banyak, dan
yang paling sedikit pada kontrol. Kerapatan stomata yang paling rendah juga
terdapat pada tunas dari perlakuan konsentrasi kolkisin 0.02 % dan kerapatan
stomata tertinggi diperoleh dari tanaman kontrol.
Perlakuan kolkisin dapat menghasilkan kimera pada tanaman nilam
sidikalang. Terdapat beberapa tunas yang memiliki letak daun berbeda dari
tanaman kontrol, yaitu tunas perlakuan konsentrasi kolkisin 0.06 % dengan
perendaman 24 jam dan perlakuan konsentrasi kolkisin 0.04 % dengan
perendaman 72 jam.
Perlakuan perendaman dengan larutan kolkisin dapat meningkatkan
keragaman fenotipe pada peubah jumlah tunas dan jumlah daun. Keragaman
jumlah tunas tanaman hasil perlakuan perendaman kolkisin termasuk dalam
kategori sempit dan keragaman jumlah daun termasuk dalam kategori luas.
Perlakuan yang memiliki nilai koefisien keragaman fenotipe pada peubah jumlah
tunas dan jumlah daun yang terluas adalah konsentrasi kolkisin 0.02 % dengan
perendaman selama 72 dan perlakuan dengan keragaman tersempit diperoleh dari
perlakuan tanpa kolkisin dengan perendaman 24 jam.
Tanaman mutan potensial yang diperoleh dari hasil penelitian ini adalah
INDUKSI MUTASI MELALUI PENGGANDAAN KROMOSOM NILAM
VARIETAS SIDIKALANG (Pogostemon cablin Benth.) DENGAN
KOLKISIN SECARA IN VITRO
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
YUDIA
PUTRI
ANNE
A24070138
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul
:
INDUKSI
MUTASI
MELALUI
PENGGANDAAN
KROMOSOM
NILAM
(
Pogostemon cablin
BENTH.)
VARIETAS
SIDIKALANG
DENGAN
KOLKISIN
SECARA
IN VITRO
Nama
:
YUDIA
PUTRI
ANNE
NIM
:
A24070138
Menyetujui,
Dosen Pembimbing
Dr. Ir. Ni Made Armini Wiendi, MS.
NIP 19610412 198703 2 003
Mengetahui.
Ketua Departemen
Dr. Ir. Agus Purwito, M. Sc. Agr.
NIP 19611101 198703 1 003
RIWAYAT
HIDUP
Penulis dilahirkan di Jakarta pada tanggal 19 Juli 1989, sebagai putri
kedua dari lima bersaudara pasangan Bapak Alidanar (alm.) dan Ibu Elfa Yalde.
Penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri 1 Depok
pada tahun 2007. Pada tahun yang sama penulis diterima sebagai mahasiswa
Departemen Agronomi dan Hortikultura,Fakultas Pertanian, Institut Pertanian
Bogor, melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama kuliah, penulis aktif dalam Unit Kegiatan Mahasiswa Uni
Konservasi Fauna (UKM UKF IPB). Penulis pernah berkesempatan mengikuti
PKM bidang Pengabdian Masyarakat pada tahun 2008. Tahun 2011 penulis
menjadi asisten praktikum mata kuliah Dasar-dasar Bioteknologi Tanaman dan
KATA
PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah
memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan
skripsi ini. Skripsi ini berjudul Induksi Mutasi Kromosom Nilam (Pogostemon
cablin Benth.) Varietas Sidikalang dengan Kolkisin secara In Vitro.
Ucapan terima kasih penulis sampaikan kepada pihak-pihak yang telah
membantu selama melakukan penelitian ini, antara lain:
1. Dr. Ir. Ni Made Armini Wiendi,MS selaku dosen pembimbing yang telah
memberikan bimbingan dan arahan selama pelaksanaan penelitian.
2. Dr. Endang Murniati selaku dosen pembimbing akademik.
3. Prof. Dr. G. A. Wattimena dan Dr. Diny Dinarti selaku dosen penguji.
4. Orang tua dan keluarga yang telah memberikan doa dan motivasi.
5. Teman-teman Laboratorium Bioteknoogi Tanaman: Tika, Alfia, Indah,
Meyga dan Neneng, serta rekan-rekan AGH 44 atas bantuan dan
kebersamaannya.
6. E. Mochamad Aaf Afnan atas semangat dan doanya.
7. Keluarga besar Uni Konservasi Fauna atas kekeluargaan dan
kebersamaannya.
Semoga penelitian ini dapat berguna bagi masyarakat dan civitas akademika.
Bogor, September 2012
DAFTAR
ISI
Halaman
DAFTAR TABEL ··· ii
DAFTAR GAMBAR ...iv
DAFTAR LAMPIRAN ...v
PENDAHULUAN ...1
Latar Belakang ...1
Tujuan ...2
Hipotesis ...2
TINJAUAN PUSTAKA... 4
Botani Nilam ...4
Kultur Jaringan Tanaman Nilam ...5
Mitosis Sel Somatik...6
Mutasi dengan Kolkisin ...6
Uji Sitologi Sel Tanaman...8
BAHAN DAN METODE ...10
Waktu dan Tempat Penelitian ...10
Alat dan Bahan Penelitian...10
Metode Penelitian...10
Pelaksanaan Penelitian... 11
Pengamatan ...14
HASIL DAN PEMBAHASAN ...15
Kondisi Umum Penelitian...15
Jumlah Tunas ...17
Jumlah Daun ...22
Sistem Percabangan...27
Ukuran Daun ...28
Persentase Tunas Berakar ...29
Kerapatan Stomata ...31
Ukuran Stomata...32
Jumlah Kloroplas...35
KESIMPULAN ...37
DAFTAR PUSTAKA ...39
DAFTAR
TABEL
Nomor Halaman
1. Kesalahan yang banyak terjadi dalam pengamatan mitosis
sel···8
2. Rekapitulasi hasil uji F pengaruh konsentrasi kolkisin dan
lama perendaman terhadap eksplan tunas Pogostemon cablin
Benth. secara in vitro 16
3. Interaksi antara tingkat konsentrasi dan lama perendaman
terhadap jumlah tunas Pogostemon cablin Benth. selama 8
MST secara in vitro . ···18
4. Pengaruh konsentrasi kolkisin terhadap jumlah tunas P.
cablin Benth. selama 8 MST secara in vitro 20
5. Pengaruh lama perendaman terhadap jumlah tunas
Pogostemon cablin Benth. selama 8 MST secara in vitro···21
6. Persentase KKF jumlah tunas Pogostemon cablin Benth. 22
7. Interaksi antara tingkat konsentrasi dan lama perendaman
terhadap jumlah daun Pogostemon cablin Benth. selama 8
MST secara in vitro···23
8. Pengaruh konsentrasi kolkisin terhadap jumlah daun
Pogostemon cablin Benth. selama 8 MST secara in vitro···25
9. Pengaruh lama perendaman terhadap jumlah daun
Pogostemon cablin Benth. selama 8 MST secara in vitro···25
10. Persen Koefisien Keragaman Fenotipe Peubah Jumlah Daun
Pogostemon cablin Benth. ···26
11. Pengaruh konsentrasi kolkisin terhadap ukuran daun
Pogostemon cablin Benth. selama 8 MST secara in vitro···29
12. Pengaruh konsentrasi kolkisin terhadap jumlah dan
kerapatan stomata Pogostemon cablin Benth. selama 8 MST
secara in vitro ···32
13. Interaksi antara tingkat konsentrasi dan lama perendaman
terhadap ukuran stomata Pogostemon cablin Benth. selama 8
14. Pengaruh konsentrasi kolkisin terhadap jumlah kloroplas 35
DAFTAR
GAMBAR
Nomor Halaman
1. Interaksi tingkat konsentrasi kolkisin dan lama perendaman
terhadap jumlah rata-rata tunas Pogostemon cablin Benth ... 20
2. Interaksi tingkat konsentrasi kolkisin dan lama perendaman
terhadap jumlah rata-rata daun Pogostemon cablin Benth... 24
3. Keragaan tunas nilam di media MS + 0.5 mg/l BAP dan 0.5
mg/l kinetin : (A) tunas tanaman kontrol dengan daun normal, (B) tunas dengan sistem percabangan alternate dan (C) tunas
dengan sistem percabangan alternate dan opposite... 28
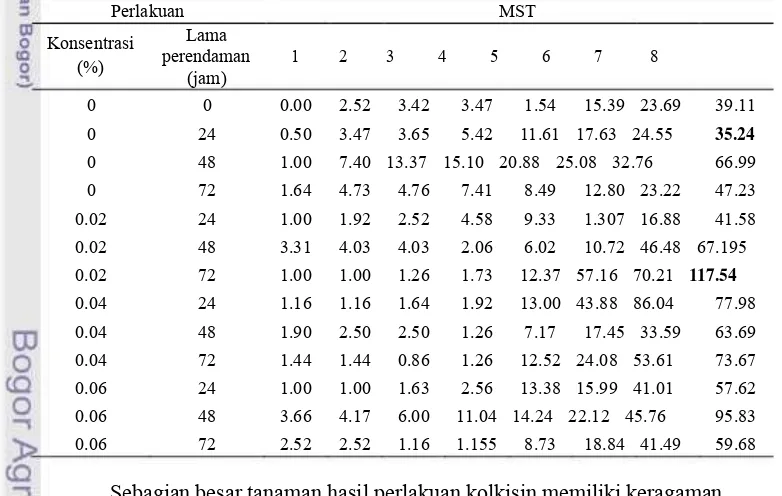
4. Persentase eksplan Pogostemon cablin Benth. yang berakar
selama 8 MST ... 30
5. Ukuran stomata Pogostemon cablin Benth. pada beberapa
perlakuan: A: konsentrasi kolkisin 0.02% dengan perendaman
72 jam; B: konsentrasi kolkisin 0.06% dengan perendaman 48
jam; C: tanpa kolkisin dengan perendaman 48 jam dan D: kontrol... 34
6. Kloroplas Pogostemon cablin Benth. A: kontrol; B: perlakuan
konsentrasi 0.02 %; C: perlakuan konsentrasi 0.04% dan D:
DAFTAR
LAMPIRAN
Nomor Halaman
1. Komposisi media Murashige-Skoog... 44
2. Analisis ragam jumlah tunas pada Pogostemon cablin Benth ...45
3. Analisis ragam jumlah daun pada Pogostemon cablin Benth. ...46
4. Analisis ragam panjang daun pada Pogostemon cablin Benth ...47
5. Analisis ragam lebar daun pada Pogostemon cablin Benth ...47
6. Analisis ragam kerapatan stomata pada Pogostemon cablin Benth .. 47
7. Analisis ragam jumlah kloroplas pada Pogostemon cablin Benth ....47
8. Analisis ragam panjang stomata pada Pogostemon cablin Benth···· 47
PENDAHULUAN
Latar Belakang
Minyak atsiri merupakan senyawa organik yang berasal dari tumbuhan
dan bersifat mudah menguap, mempunyai rasa getir dan aroma mirip tanaman
asalnya. Minyak atsiri banyak digunakan sebagai bahan baku untuk industri
parfum, bahan pewangi (fragrances), aroma (flavor), obat-obatan, kosmetika dan
aromaterapi. Tanaman penghasil minyak atsiri yang termasuk unggulan adalah
tanaman yang memiliki volume produksi cukup besar di dalam negeri dan hasil
minyaknya telah sangat dikenal di pasar dunia. Tanaman dalam kelompok ini
misalnya nilam, akar wangi, pala, cengkeh, dan sereh wangi (Atsiri Indonesia,
2010).
Nilam merupakan salah satu penghasil minyak atsiri potensial yang ada di
Indonesia. Negara tujuan ekspor seperti USA, Eropa, Australia, Afrika, Cina,
India dan ASEAN. Minyak nilam merupakan salah satu komoditi yang
memberikan pangsa pasar lebih dari 90 % kebutuhan dunia atau sekitar 35-40 %
dari total nilai ekspor minyak atsiri (Atsiri Indonesia, 2010). Minyak nilam, yang
disebut juga patchouli oil, banyak digunakan sebagai bahan baku dalam industri
parfum, kosmetik, antiseptik dan insektisida. Minyak nilam bersifat fiktatif
(mengikat minyak atsiri lainnya) dan hingga saat ini belum ada bahan
substitusinya (Nuryani, 2009). Seluruh bagian tanaman nilam aceh mengandung
minyak atsiri, terutama di bagian daun yang memiliki kandungan minyak atsiri
paling banyak (Krismawati, 2005).
Nilam yang saat ini banyak dibudidayakan di Indonesia adalah nilam aceh
varietas Tapak Tuan, Lhokseumawe dan Sidikalang, karena memiliki kadar
minyak dan patchouli alcohol yang paling tinggi dibanding nilam jawa dan nilam
sabun (Nuryani, 1998). Peningkatan kadar minyak nilam melalui pemuliaan
secara konvensional sulit untuk dilakukan, karena nilam aceh tidak dapat
berbunga di Indonesia. Peningkatan keragaman genetik secara in vitro dapat
digunakan untuk meningkatkan kadar minyak nilam. Suspensi sel nilam yang
menghasilkan kadar minyak tinggi dan stabil, diantaranya terdapat satu
somaklonal yang menghasilkan kadar minyak mencapai 4 % dan selalu stabil
pada setiap panen (Mariska, 2002).
Swamy et al. (2008) menyebutkan bahwa penggunaan media dasar MS
dengan penambahan 0.5 mg/l BA dapat menginduksi tunas paling banyak hingga
45 tunas per eksplan. Kombinasi 0.5 mg/l BA dan 0.5 mg/l kinetin merupakan
perlakuan yang paling baik untuk multiplikasi tunas.
Kebutuhan akan minyak nilam semakin meningkat, karena itu semakin
meningkat pula kebutuhan akan tanaman nilam. Hanya saja, produksi minyak
nilam di Indonesia cenderung menurun. Tahun 2009 Indonesia mampu
memproduksi 1000 ton minyak nilam atau sebesar 66.66 % kebutuhan minyak
nilam dunia, tetapi pada tahun 2010 Indonesia hanya mampu memproduksi 700-
800 ton minyak (Manurung, 2010). Usaha meningkatkan produksi diperlukan
suatu teknologi yang dapat merakit varietas baru yang memiliki kandungan
minyak atsiri tinggi sehingga dapat meningkatkan produktivitas minyak nilam,
salah satunya dengan induksi mutasi secara in vitro. Perendaman nilam dengan
kolkisin diharapkan mampu melipatgandakan kromosom nilam tersebut dan
menghasilkan ukuran tanaman, khususnya daun yang lebih besar sehingga
produktivitas minyak nilam juga turut meningkat.
Tujuan
1. Mempelajari pengaruh kolkisin serta lama perendaman terhadap
penggandaan kromosom tanaman nilam (Pogostemon cablin Benth.)
varietas sidikalang.
2. Menghasilkan keragaman genetik baru secara in vitro yang potensial untuk
tanaman nilam (Pogostemon cablin Benth.) dikembangkan lebih lanjut
menjadi varietas baru.
Hipotesis
1. Perlakuan konsentrasi kolkisin berpengaruh nyata terhadap pertumbuhan
dan perkembangan tunas serta ploidi tanaman nilam (Pogostemon cablin
2. Perlakuan lama perendaman kolkisin berpengaruh nyata terhadap
pertumbuhan dan perkembangan tunas, serta ploidi tanaman nilam
(Pogostemon cablin Benth.) varietas sidikalang secara in vitro.
3. Terdapat interaksi konsentrasi dan lama perendaman yang nyata terhadap
pertumbuhan dan perkembangan nilam (Pogostemon cablin Benth.)
TINJAUAN
PUSTAKA
Botani Nilam
Indonesia memiliki tiga jenis nilam yang sudah dikembangkan, yaitu:
nilam aceh (Pogostemon cablin), nilam jawa (Pogostemon heyneanus) dan nilam
sabun (Pogostemon hortensis). Varietas yang memiliki kadar minyak tertinggi
adalah nilam aceh, sehingga varietas ini paling banyak dibudidayakan (Nuryani,
2009).
Nilam sidikalang adalah salah satu dari tiga varietas unggul nilam aceh.
Varietas ini memiliki produktivitas terna (daun basah) dan kadar minyak paling
tinggi dibanding dua varietas lainnya, yaitu varietas Tapak Tuan dan
Lhokseumawe (Direktorat Budidaya Tanaman Semusim, 2010).
Berikut adalah taksonomi nilam sidikalang:
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Asteridae
Ordo : Lamiales
Famili : Lamiaceae
Genus : Pogostemon
Spesies : Pogostemon cablin (Blanco) Benth. (Plantamor, 2008)
Nilam sidikalang merupakan terna aromatis dengan tinggi sekitar 0.3
sampai 0.75 m (Dhalimi et al., 1998). Nilam jenis ini tidak berbunga dengan bulu
halus pada daun, dengan kadar minyak 2.5 sampai 5.0 % (Krismawati, 2005).
Berdasarkan sifat tumbuhnya, tanaman nilam adalah tanaman tahunan (perennial).
Tanaman ini merupakan tanaman semak yang tumbuh tegak memiliki banyak
percabangan, bertingkat-tingkat dan mempunyai aroma yang khas.
Daun nilam berbentuk bulat telur sampai lonjong, berbulu pada permukaan
bagian atas dan memiliki ukuran panjang antara 5 sampai 11 cm. Daun terletak
dan urat daun menonjol keluar. Nilam aceh berwarna hijau tidak mengilap,
berukuran lebih lebar dan lebih berdaging dibanding dua jenis nilam lainnya,
selain itu nilam aceh juga berbulu lebih lebat. Tangkai daun dan batang berwarna
merah kekuningan dan sangat sedikit memiliki bunga. Bunga tumbuh di ujung
tangkai, bergerombol dan berwarna ungu kemerah-merahan. Tangkai bunga
berukuran panjang antara 2-8 cm. Daun mahkota bunga berukuran panjang 8 mm.
Umumnya perbanyakan nilam dengan menggunakan stek batang (Rukmana,
2003).
Kultur Jaringan Tanaman Nilam
Nilam adalah salah satu tanaman penghasil minyak atsiri yang memiliki
nilai ekonomi cukup tinggi. Indonesia adalah salah satu pemasok utama minyak
nilam di dunia. Saat ini, produktivitas minyak nilam di Indonesia semakin
menurun dan peningkatan produktivitas minyak nilam secara konvensional sulit
untuk dilakukan (Mariska, 2002). Di Indonesia, nilam aceh sulit untuk berbunga,
sehingga keragaman genetik akibat persilangan alami tidak dapat terjadi (Mariska
dan Lestari, 2003). Sulitnya pembungaan nilam juga menyebabkan sulitnya
pengembangan nilam yang tahan serangan nematoda (Mariska dan Husni, 2006)
serta sulit mendapatkan bibit dalam jumlah banyak dalam waktu yang relatif cepat
(Amien et al., 2007).
Teknik fusi protoplas dapat digunakan untuk menghasilkan nilam yang
tahan terhadap serangan nematoda Pratylenchus brachyurus. Sifat ketahanan
nematoda tersebut terdapat pada nilam jawa yang produksi minyaknya rendah.
Fusi protoplas antara nilam jawa dan nilam aceh, yang kadar minyaknya tinggi,
dilakukan untuk memindahkan sifat ketahanan tersebut. Tanaman yang tahan
nematoda mempunyai kandungan fenol dan lignin yang lebih tinggi daripada
tanaman yang rentan. Hasil penelitian menunjukkan terdapat nomor-nomor baru
hasil fusi yang memiliki kandungan fenol lebih tinggi dari tetuanya nilam jawa
dan terdapat sepuluh nomor hasil fusi dengan kandungan lignin hampir sama
dengan nilam jawa (Mariska dan Husni, 2006).
Teknologi kultur jaringan dalam perbanyakan bibit dapat menghindari
konsentrasi 0.5 mg/l, 1.0 mg/l, 1.5 mg/l, 2.0 mg.l dan 2.5 mg/l dapat menginduksi
kalus nilam (Amien et al., 2007). Hutami et al. (2006) melaporkan bahwa
perlakuan radiasi sinar gamma dapat meningkatkan keragaman somaklonal nilam.
Terdapat lima somaklonal, dari 411 somaklonal yang diperoleh, yang memiliki
kadar minyak lebih tinggi dibanding tanaman induknya, nilam aceh.
Mitosis Sel Somatik
Mitosis merupakan pembelahan inti yang berhubungan dengan
pembelahan sel somatik, atau sel tubuh eukariot. Setiap sel yang membelah secara
mitosis menghasilkan dua sel baru yang jumlah kromosom dan kandungan
genetiknya identik dengan sel asal (Sastrosumarjo, 2006).
Pembelahan mitosis merupakan proses yang kontinyu, namun untuk
memudahkan, para ahli membagi mitosis menjadi lima tingkatan utama yaitu
interfase, profase, metafase, anafase dan telofase. Morfologi kromosom pada
metafase mitosis memperlihatkan panjang kromosom dan tipe sentromer. Kedua
hal ini menjadi dasar analisis kariotipe (Sastrosumarjo, 2006). Pada metafase
mitosis paling mudah menghitung banyaknya kromosom atau mempelajari
morfologinya, karena kromosom tersebar di bidang tengah dari sel (Suryo, 2007).
Mutasi dengan Kolkisin
Mutasi adalah proses suatu gen mengalami perubahan struktur. Gen yang
berubah karena mutasi disebut mutan (Crowder, 2006). Mutasi dapat terjadi
secara alamiah, tetapi peluangnya sangat kecil. Penyebab mutasi alami antara lain
sinar kosmos, batuan radioaktif dan sinar ultraviolet matahari. Mutasi buatan atau
mutasi induksi dapat digunakan untuk meningkatkan peluang terjadinya mutasi.
Mutasi induksi dapat dilakukan dengan menggunakan mutagen kimia atau
mutagen fisik (Aisyah, 2006). Menurut van Harten (1998), mutagen yang
umumnya digunakan adalah radiasi dan bahan kimia. Mutasi dengan cara radiasi
umumnya menggunakan sinar X, sinar gamma dan sinar UV. Mutagen kimia yang
umumnya banyak digunakan adalah kolkisin. Kolkisin banyak digunakan karena
mempengaruhi susunan DNA, tetapi hanya mengubah jumlah kromosom pada
genom sel.
Kolkisin (C22H25O6N) merupakan suatu alkaloid yang berasal dari umbi
dan biji tanaman crocus (Colchicum autumnale Linn.). Kolkisin bersifat racun
yang terutama pada tumbuhan memperlihatkan pengaruhnya pada nukleus yang
sedang membelah. Larutan kolkisin dengan konsentrasi yang kritis mencegah
terbentuknya benang-benang plasma dari gelendong inti (spindel) sehingga
pemisahan kromosom pada anafase mitosis tidak berlangsung dan menyebabkan
penggandaan kromosom tanpa pembentukan dinding sel (Suryo, 2007).
Menurut Suryo (2007) tidak ada ukuran tertentu mengenai besarnya
konsentrasi larutan kolkisin yang harus digunakan, juga mengenai lamanya waktu
perlakuan. Kedua hal tersebut tergantung dari bahan yang akan dipakai pada
percobaan. Umumnya kolkisin yang harus digunakan akan bekerja efektif pada
konsentrasi 0.01-1.0 %. Lamanya perlakuan berkisar antara 3-24 jam. Setiap jenis
tanaman mempunyai respon yang berbeda tergantung dari bahan yang diberi
perlakuan. Bagian-bagian tanaman yang dapat diberi perlakuan kolkisin antara
lain: benih, primordia, benih yang telah berkecambah direndam dalam larutan
kolkisin dan akar tanaman.
Mariska dan Lestari (2003) melaporkan bahwa terdapat pengaruh interaksi
antara perlakuan kolkisin dengan zat pengatur tumbuh terhadap jumlah tunas
nilam aceh. Perlakuan kolkisin 0.5 % dengan kontrol menghasilkan tunas yang
paling banyak. Lama perendaman juga berpengaruh terhadap tingkat regenerasi
sel. Semakin lama perendaman kolkisin, semakin rendah massa sel yang
beregenerasi. Setelah tanaman ditumbuhkan di rumah kaca, tanaman nilam yang
berasal dari perlakuan kolkisin memiliki daun yang lebih hijau, batang dan daun
yang lebih lebar, lebih kaku dan lebih tegar dibanding tanaman kontrol.
Haryanti et al. (2009) melaporkan bahwa perlakuan kolkisin pada kacang
hijau dapat mempengaruhi pertumbuhan dan ukuran sel metafase kacang hijau.
Kolkisin dengan konsentrasi 0.2 % mengakibatkan penurunan pertumbuhan
kacang hijau, namun dapat meningkatkan kandungan proteinnya.
Induksi kolkisin sering digunakan untuk mendorong terjadinya perubahan
pada bawang merah (Allim ascalonium L.) mengakibatkan variasi bentuk, ukuran
dan jumlah kromosom. Poliploidi yang terbentuk dapat dikelompokkan menjadi
tetraploid, pentaploid, heksaploid, oktaploid dan nanoploid (Suminah et al., 2002).
Uji Sitologi Sel Tanaman
Pengamatan sitologi kromosom dapat dilakukan dengan pewarnaan DNA
(metode squashing), misalnya dengan bahan pewarna aseto orcein, agar selain
kromosom bagian sel lainnya tidak terwarnai. Tahapan awal adalah pengambilan
sampel sel yang sedang aktif bermeiosis atau bermitosis. Melihat tingkat
kemudahannya studi kromosom lebih banyak dilakukan melalui pengamatan
terhadap sel yang sedang bermitosis dibanding meiosis (Jusuf, 2001).
Pada pengamatan mitosis sel, terdapat beberapa kasus kesalahan yang
sering terjadi. Berikut kesalahan dan penyebabnya dicantumkan dalam Tabel 1
(Jurčák, 1999).
Tabel 1. Kesalahan yang banyak terjadi dalam pengamatan mitosis sel
Kesalahan Penyebab
1. Inti terwarnai dengan jelas, tetapi tahap a. Pemotongan tidak dilakukan pada mitosis tidak terlihat waktu yang tepat
2. Kromosom tidak jelas a. Waktu fiksasi terlalu singkat b. Konsentrasi aseto carmine terlalu
rendah
c. Aseto carmine yang digunakan terlalu lama disimpan
d. Suhu saat pewrnaan terlalu rendah e. Waktu pewarnaan terlalu singkat 3. Beberapa lapisan sel menumpuk a. Waktu maserasi terlalu singkat
b. Pembuatan larutan untuk maserasi tidak tepat
c. Kurang tenaga ketika meneakn gelas objek
4. Sel meristem pecah, tahapan mitosis atau
kromosom tidak dapat diamati a. Gelas penutup bergeser ketika ditekan b. Gelas penutup ditekan berulang-ulang 5. Lensa mikroskop tergores atau pecah a. Permukaan penyangga tidak rata
Sumber: Jurčák (1999)
Bagian tanaman yang dapat digunakan untuk pengamatan kromosom
adalah bagian yang mengandung sel meristematik. Bagian yang mengandung sel
meristematik adalah bagian pucuk dan ujung akar, yang selnya terus aktif
tersebut tidak berklorofil sehingga lebih mudah menyerap pewarna. Waktu
pemotongan akar merupakan faktor kritis keberhasilan, karena pembelahan sel
tanaman tidak konstan setiap waktunya. Pada bawang bombay dan bawang putih,
BAHAN
DAN
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari 2011 hingga Desember 2011.
Percobaan in vitro dilakukan di Laboratorium Bioteknologi Tanaman,
Departemen Agronomi dan Hortikultura Fakultas Pertanian, IPB, Bogor.
Percobaan uji sitologi dilakukan di Laboratotium Ekofisiologi Tumbuhan
Departemen Agronomi dan Hortikultura, IPB, Bogor.
Alat dan Bahan Penelitian
Bahan tanaman yang digunakan adalah planlet tanaman nilam varietas
sidikalang (Pogostemon cablin Benth.). Eksplan yang digunakan adalah tunas
terminal dari planlet berumur 8 MST. Media kultur jaringan yang digunakan
adalah media dasar MS, gula 30 g/l serta pemadat agar 7 g/l. Media pertunasan
akan ditambah dengan 0.5 mg/l BAP + 0.5 mg/l kinetin. Tanaman nilam
disterilisasi dengan streptomisin sulfat dan benomil (50 %) masing-masing 4g/l,
serta sodium hipoklorit (5 %) dengan konsentrasi 10 % dan povidone iodine
(10 %) dengan konsentrasi 1 %.
Alat yang digunakan di laboratorium adalah timbangan, labu takar, gelas
kimia, laminar air flow cabinet, pengaduk, autoklaf, pH meter, botol kultur,
magnetic stirer, panci perebus, pipet, cawan petri, gunting, pinset, scalple, toples,
hand sprayer, rak kultur, penggaris, kertas label, alat pengering dan kamera.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) faktorial
dengan dua faktor. Faktor pertama yaitu konsentrasi larutan kolkisin dengan 4
taraf (0.00 %, 0.02 %, 0.04 %, 0.06 %) dan faktor kedua lama perendaman di
dalam larutan kolkisin dengan 3 taraf (24 jam, 48 jam, dan 72 jam). Terdapat 12
kombinasi perlakuan dengan masing-masing perlakuan terdiri dari empat ulangan,
Jumlah total eksplan sebanyak 240 eksplan sebagai satuan amatan. Metode
statistika yang digunakan sebagai berikut:
Yijk = µ + αi + βj + (αβ)ij + εijk
Keterangan:
Yijk : nilai pengamatan pada perlakuan konsentrasi ke-i, lama perendaman ke-j
dan pada pengamatan ke-k
µ : nilai tengah umum
αi : pengaruh konsentrasi kolkisin ke-i, i=1,2,3,4
βj : pengaruh lama perendaman dengan kolkisin ke-j, j=1,2,3
(αβ)ij : interaksi antara konsentrasi dan lama perendaman kolkisin εijk : pengaruh galat dari satuan pecobaan ke-i, pada ulangan ke-j
Perlakuan:
K0L1 : Perendaman dengan konsentrasi larutan kolkisin 0 % selama 24 jam
K0L2 : Perendaman dengan konsentrasi larutan kolkisin 0 % selama 48 jam
K0L3 : Perendaman dengan konsentrasi larutan kolkisin 0 % selama 72 jam
K1L1 : Perendaman dengan konsentrasi larutan kolkisin 0.02 % selama 24 jam
K1L2 : Perendaman dengan konsentrasi larutan kolkisin 0.02 % selama 48 jam
K1L3 : Perendaman dengan konsentrasi larutan kolkisin 0.02 % selama 72 jam
K2L1 : Perendaman dengan konsentrasi larutan kolkisin 0.04 % selama 24 jam
K2L2 : Perendaman dengan konsentrasi larutan kolkisin 0.04 % selama 48 jam
K2L3 : Perendaman dengan konsentrasi larutan kolkisin 0.04 % selama 72 jam
K3L1 : Perendaman dengan konsentrasi larutan kolkisin 0.06 % selama 24 jam
K3L2 : Perendaman dengan konsentrasi larutan kolkisin 0.06 % selama 48 jam
K3L3 : Perendaman dengan konsentrasi larutan kolkisin 0.06 % selama 72 jam
Data yang diperoleh dianalisis dengan uji F pada taraf 5 %. Apabila
terdapat beda nyata dilakukan uji lanjut dengan menggunakan DMRT (Duncan
Multiple Range Test) pada taraf 5 %.
Pelaksanaan Penelitian
Pembuatan Media dan Sterilisasi
Pembuatan media tanaman dari komposisi MS sebanyak satu liter adalah
kemudian dimasukkan ke dalam labu takar. Gula pasir dilarutkan dengan air
kemudian dimasukkan ke dalam labu takar yang telah berisi larutan stok, lalu
ditambahkan BAP dan kinetin masing-masing dengan konsentrasi 0.5 mg/l.
Selanjutnya larutan ditambahkan aquades sampai tanda tera (satu liter).
Kemasaman media (pH) diukur dan diatur agar sesuai dengan kondisi tumbuh
eksplan. Dalam penelitian ini pH yang digunakan adalah 5.9, didapatkan dengan
penambahan KOH 1 N bila pH larutan di bawah 5.9 dan HCl 1 N jika pH larutan
di atas 5.9. Setelah diatur pHnya larutan dituang ke dalam panci dan ditambahkan
agar-agar 7g/l. Larutan media dipanaskan untuk melarutkan agar-agar sambil
diaduk sampai mendidih, kemudian dituang ke dalam botol kultur sebanyak 25
ml/botol (volume botol 200 ml). Selanjutnya botol ditutup plastik dan diikat
dengan karet gelang. Media disterilisasi menggunakan autoklaf dengan tekanan
17.5 psi, 121 ◦C selama 20 menit.
Sterilisasi alat seperti pisau, pinset, scalpel, cawan petri, botol kultur
kosong dan botol berisi air steril disterilisasi menggunakan autoklaf dilakukan
selama satu jam dengan tekanan 17.5 psi, 121 ◦C.
Sub Kultur Planlet
Planlet yang sudah steril disubkultur ke dalam media MS + 0.5 mg/l BAP
dan kinetin 0.5 mg/l. Tunas dipotong-potong pada masing-masing buku dengan
ukuran ± 5 mm kemudian ditanam di dalam media. Pada saat penanaman, semua
peralatan yang digunakan disemprot alkohol 70 % sebelum dimasukkan ke dalam
laminar air flow cabinet.
Alat-alat yang digunakan untuk memindahkan eksplan, sebelum
digunakan dibakar dahulu sampai panas kemudian didiamkan sampai dingin. Pada
setiap botol ditanam 5 eksplan. Inkubasi kultur dilakukan pada ruangan dengan
penyinaran ± 1000 lux, 16 jam/hari dan suhu ± 23 ◦C. Setelah 4 MST planlet yang
dihasilkan dijadikan sumber propagula.
Pembuatan Larutan Kolkisin
Sebelum dibuat larutan kolkisin dengan konsentrasi 0 %, 0.02 %, 0.04 %
aquabides steril). Pembuatan larutan kolkisin dilakukan di dalam laminar air flow
cabinet. Pada saat kolkisin dibuka blower dimatikan sejenak, lalu kolkisin
dimasukkan ke dalam aquabides steril. Setelah botol berisi kolkisin ditutup,
blower dinyalakan kembali, kemudian larutan dikocok hingga larut. Larutan
disterilkan dengan menggunakan microfilter. Pada waktu membuat larutan stok
kolkisin digunakan juga alat pengaman seperti sarung tangan karet dan masker
khusus dengan filter udara. Larutan kolkisin yang sudah jadi ditempatkan dalam
labu erlenmeyer tertutup dan disimpan pada suhu 4 ◦C.
Perendaman dengan Larutan Kolkisin dan Penanaman Eksplan
Planlet yang telah disubkultur selama 4 MST dipotong-potong dengan 1
buku tunas dengan ukuran ± 5 mm, bagian buku yang mengandung mata tunas
aksilar dipisahkan dan dimasukkan ke dalam larutan kolkisin dengan konsentrasi
masing-masing 0.0 %, 0.02 %, 0.04 % dan 0.06 % kemudian setelah 24 jam
sebagian eksplan diambil dan ditanam di dalam media pertunasan. Media
pertunasan yang digunakan adalah media dasar MS + 0.5 mg/l BAP + 0.5 mg/l
kinetin. Penanaman ke media pertunasan ini diulang 24 jam berikutnya sampai 72
jam setelah perendaman. Alat-alat yang digunakan dibakar dahulu sampai panas
kemudian didiamkan dulu hingga dingin. Pada setiap botol ditanam lima eksplan.
Inkubasi kultur dilakukan pada ruangan dengan penyinaran ± 1000 lux, 16
jam/hari dan suhu ± 23 ◦C.
Analisis Kloroplas dan Stomata
Pengamatan kloroplas dan stomata dilakukan secara bersamaan. Bahan
contoh yang digunakan sebanyak tiga daun per ulangan. Langkah-langkahnya
sebagai berikut:
1. Sehelai daun dipotong dari tiga tunas yang berbeda setiap ulangan.
2. Bagian permukaan bawah daun ditempelkan ke selotip.
3. Bagian permukaan bawah daun dipukul-pukul secara perlahan lalu dikikis
agar tipis dengan menggunakan scalpel,namun tidak merusak organel di
dalam daun.
% KKF Standar deviasi populasi perlakuan
5. Pengamatan di bawah mikroskop dan dilakukan pemotretan pada kloroplas
dan stomata.
6. Dilakukan penghitungan jumlah kloroplas dan jumlah stomata dari hasil
foto.
Pengamatan
Pengamatan di laboratorium dilakukan setiap minggu selama 8 MST.
Peubah yang diamati adalah jumlah eksplan terkontaminasi, jumlah tunas, jumlah
daun, persentase eksplan hidup, persentase tunas berakar, jumlah kloroplas pada
sel stomata, ukuran dan jumlah stomata dan kerapatan stomata. Fenotipe tanaman
in vitro yang diamati adalah sistem percabangan, ukuran daun dan koefisein
keragaman fenotipik (KKF).
Menurut Murdaningsih et al. (1999)
Rataan populasi perlakuan %
Kategori keragaman berdasarkan % KKF:
0.00 < % KKF ≤ 24.91 sempit
24.91 < % KKF ≤ 49.71 agak sempit
49.71 < % KKF ≤74.71 agak luas
74.71 < % KKF ≤ 99.65 luas
HASIL
DAN
PEMBAHASAN
Kondisi Umum Penelitian
Eksplan buku yang membawa satu mata tunas aksilar yang digunakan
pada penelitian ini berasal dari tunas adventif yang berumur 8 MST. Tunas
adventif disubkultur dan ditanam ke media perbanyakan yaitu MS + 0.5 mg/l
BAP dan 0.5 mg/l kinetin. Setelah berumur 8 MST, selanjutnya bagian tunas
terminal dipotong dan direndam di dalam larutan kolkisin sesuai perlakuan.
Persentase kultur yang terkontaminasi sebesar 10 % dari total eksplan.
Eksplan yang terkontaminasi adalah eksplan perlakuan konsentrasi kolkisin
0.02 % dengan perendaman 24 jam dan kontrol. Kontaminasi terjadi pada umur
4 minggu setelah tanam (MST), berupa kontaminasi cendawan. Penyebab
kontaminasi diduga karena media tanam yang tidak steril karena kontaminan
tidak muncul dari eksplan tersebut, tetapi dari media tanam.
Pertumbuhan tunas nilam sidikalang kontrol berbeda dengan tunas yang
terlebih dahulu direndam dengan media MS cair. Tanaman yang direndam
dengan media MS cair memiliki lebih banyak tunas. Tanaman dengan
perendaman media MS selama 72 jam memiliki paling banyak tunas. Waktu
proliferasi tunas kontrol juga lebih lambat dibandingkan tanaman dengan
perendaman media MS cair. Eksplan yang direndam media MS selama 24 dan
48 jam mulai berproliferasi pada 2 MST, eksplan yang direndam media MS
selama 72 jam mulai berproliferasi pada 3 MST, dan eksplan kontrol mulai
berproliferasi pada 4 MST. Hal ini dapat disebabkan adanya zat pengatur
tumbuh (ZPT) berupa sitokinin pada media tersebut. Sitokinin merupakan ZPT
yang dapat memacu pembelahan sel, sehingga juga dapat memicu pertumbuhan
tunas. Menurut Marlin (2005) taraf konsentrasi kolkisin dapat mempercepat
pertumbuhan tunas. Pertumbuhan yang dipacu oleh BAP mencakup
pembelahan dan pembesaran sel yang lebih cepat. Sitokinin sangat penting
dalam pengaturan pembelahan sel dan morfogenesis (Gunawan, 1992).
Eksplan dengan perlakuan perendaman dengan kolkisin tumbuh lebih
perlakuan kolkisin juga lebih kecil daripada tanaman kontrol, tetapi memiliki
jumlah tunas yang lebih banyak.
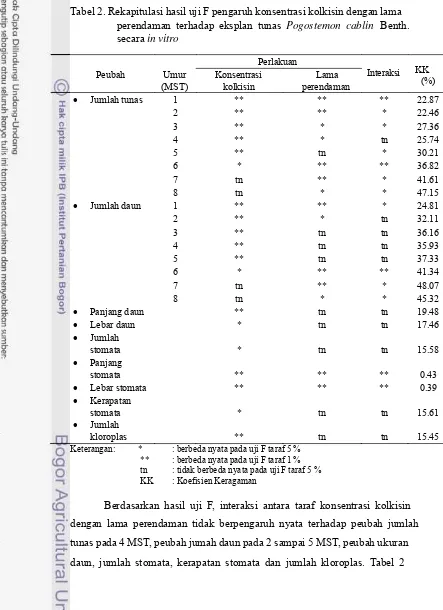
Tabel 2. Rekapitulasi hasil uji F pengaruh konsentrasi kolkisin dengan lama
perendaman terhadap eksplan tunas Pogostemon cablin Benth.
secara in vitro
Peubah Umur (MST)
Perlakuan
Konsentrasi Lama kolkisin perendaman
Interaksi KK (%)
Jumlah tunas 1 ** ** ** 22.87
2 ** ** * 22.46
3 ** * * 27.36
4 ** * tn 25.74
5 ** tn * 30.21
6 * ** ** 36.82
7 tn ** * 41.61
8 tn * * 47.15
Jumlah daun 1 ** ** * 24.81
2 ** * tn 32.11
3 ** tn tn 36.16
4 ** tn tn 35.93
5 ** tn tn 37.33
6 * ** ** 41.34
7 tn ** * 48.07
8 tn * * 45.32
Panjang daun ** tn tn 19.48
Lebar daun * tn tn 17.46
Jumlah
stomata * tn tn 15.58
Panjang
stomata ** ** ** 0.43
Lebar stomata ** ** ** 0.39
Kerapatan
stomata * tn tn 15.61
Jumlah
kloroplas ** tn tn 15.45
Keterangan: * : berbeda nyata pada uji F taraf 5 % ** : berbeda nyata pada uji F taraf 1 % tn : tidak berbeda nyata pada uji F taraf 5 % KK : Koefisien Keragaman
Berdasarkan hasil uji F, interaksi antara taraf konsentrasi kolkisin
dengan lama perendaman tidak berpengaruh nyata terhadap peubah jumlah
tunas pada 4 MST, peubah jumah daun pada 2 sampai 5 MST, peubah ukuran
menunjukkan hasil rekapitulasi uji F pengaruh konsentrasi kolkisin dengan
lama perendaman terhadap eksplan nilam sidikalang.
Beberapa perlakuan kolkisin dapat menyebabkan kematian eksplan.
Eksplan yang hanya direndam oleh media cair dan eksplan kontrol memiliki
persentase hidup sebesar 100 %. Eksplan yang memiliki persentase hidup
paling sedikit adalah eksplan yang diberi perlakuan perlakuan konsentrasi
kolkisin 0.06 % dengan perendaman 48 jam. Setelah minggu ke-5 MST,
persentase kematian tanaman perlakuan konsentrasi kolkisin 0.06 % dengan
perendaman 48 jam meningkat hingga 85 %. Kolkisin bersifat sebagai racun
dan dapat menyebabkan kematian tanaman. Kematian eksplan diduga karena
konsentrasi kolkisin yang terlalu tinggi atau perendaman yang terlalu lama.
Jumlah Tunas
Rata-rata tunas mulai muncul pada umur 1 MST dan mulai
berproliferasi pada umur 2 hingga 3 MST. Tunas yang paling cepat
berproliferasi adalah tunas pada perlakuan tanpa kolkisin dengan perendaman
24 dan 48 jam serta perlakuan konsentrasi kolkisin 0.06 % dengan perendaman
selama 48 jam. Tunas dengan perlakuan konsentrasi kolkisin 0.02 % dengan
perendaman 48 jam dan perlakuan konsentrasi kolkisin 0.04 % dengan
perendaman 24 jam memerlukan waktu proliferasi tunas yang paling lama,
yaitu 5 minggu. Waktu proliferasi tunas yang lama dapat disebabkan oleh
perlakuan kolkisin.
Interaksi antara konsentrasi kolkisin dengan lama perendaman
berpengaruh sangat nyata terhadap jumlah tunas (Tabel 3). Tunas yang diberi
perlakuan kolkisin mengalami pertumbuhan tunas yang lebih lambat
dibandingkan tunas kontrol. Tunas pada perlakuan perendaman 24 jam tanpa
larutan kolkisin dan perendaman 48 jam tanpa larutan kolkisin mulai
mengalami penambahan tunas baru pada 2 MST, tetapi tunas dengan perlakuan
kolkisin mulai mengalami penambahan jumlah tunas pada 3 dan 4 MST. Total
jumlah tunas yang diperoleh pada akhir pengamatan adalah 1233 tunas (Tabel
Jumlah tunas tanaman kontrol dan tanaman hasil perlakuan kolkisin
tidak berbeda nyata hingga 5 MST. Setelah 6 MST jumlah tunas yang
terbentuk dari perlakuan kolkisin lebih baik dibandingkan kontrol, seperti pada
perlakuan konsentrasi kolkisin 0.04 % dengan perendaman 24 jam. Hal ini
diduga karena larutan kolkisin yang bersifat racun dapat merusak sel-sel
tanaman, sehingga dibutuhkan waktu yang lebih lama untuk recovery dan
mengakibatkan pertumbuhan tunas lebih lama dibandingkan dengan tunas
kontrol. Damayanti dan Mariska (2003) menyebutkan pemberian kolkisin
dapat mengakibatkan penundaan pertumbuhan akibat jaringan yang rusak dan
memerlukan waktu lama untuk tumbuh.
Tabel 3. Interaksi antara tingkat konsentrasi dan lama perendaman terhadap jumlah tunas Pogostemon cablin Benth. selama 8 MST secara in
vitro
Perlakuan Rata-rata jumlah tunas pada minggu ke- (MST)
Konsentrasi Lama
kolkisin perendaman 1 3 6 8
Total jumlah tunas
(%) (jam)
0 0 0.9 0.9 1.5 2.9 44
0 24 1.0 a 1.0 b 2.6 bcd 4.0 abc 99 0 48 0.9 a 1.6 a 1.9 cde 3.2 bc 65 0 72 0.9 a 1.0 bc 3.7 ab 6.9 ab 139 0.02 24 0.8 ab 0.9 bcd 3.9 ab 6.9 ab 103 0.02 48 0.7 abc 0.7 bcd 3.5 abc 7.6 a 153 0.02 72 0.4 d 0.5 d 2.9 abc 4.7 abc 94 0.04 24 0.9 a 0.9 bcd 4.3 a 7.9 a 159 0.04 48 0.8 ab 0.8 bcd 1.2 de 2.0 c 40 0.04 72 0.6 bcd 0.7 bcd 2.3 bcde 4.9 abc 93 0.06 24 0.9 a 0.9 bcd 2.3 bcde 4.7 abc 90 0.06 48 0.3 d 0.6 cd 0.7 e 1.5 c 18 0.06 72 0.5 cd 0.6 bcd 3.1 abc 6.8 ab 136
Uji F ** * ** *
KK (%) 21.86 27.36 36.82 47.15 1233
Keterangan: tn : tidak berbeda nyata pada uji F taraf 5 % KK : Koefisien Keragaman
Pertumbuhan tunas terbanyak terdapat pada perlakuan konsentrasi
kolkisin 0.04 % dengan perendaman 24 jam, tetapi jumlah tunas tidak berbeda
nyata dengan tunas pada perlakuan perendaman 24 dan 72 jam, perlakuan
konsentrasi 0.02 % dengan perendaman 24, 48 dan 72 jam, konsentrasi kolkisin
perendaman 24 dan 72 jam. Pertumbuhan tunas paling sedikit terdapat pada
perlakuan konsentrasi 0.06 % dengan perendaman 48 jam. Hal ini diduga
disebabkan konsentrasi kolkisin yang terlalu tinggi atau perendaman yang
terlalu lama. Menurut Suryo (1995) konsentrasi kolkisin yang terlalu tinggi
atau waktu perlakuan yang terlalu lama akan memperlihatkan pengaruh negatif,
seperti sel-sel banyak yang rusak atau bahkan menyebabkan matinya tanaman.
Meningkatnya tingkat ploidi suatu tanaman juga dapat menyebabkan
pembelahan sel yang terlambat (Crowder, 2006). Penelitian pada tanaman
nilam oleh Mariska dan Lestari (2003) menunjukkan bahwa semakin lama
pemberian kolkisin, semakin rendah massa sel yang dapat beregenerasi.
Persentase regenerasi paling tinggi adalah dengan perendaman kolkisin selama
1 hari dan yang paling rendah dengan perendaman selama 7 hari.
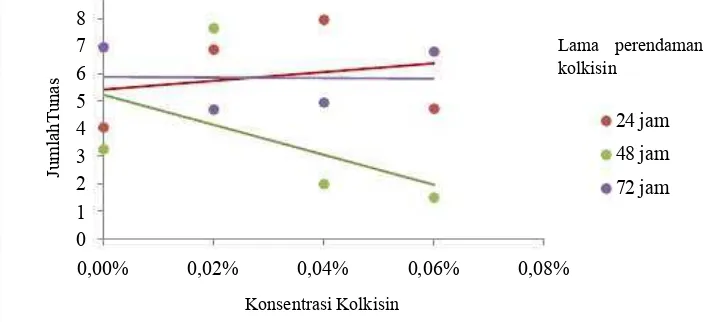
Gambar 1 menunjukkan pada perlakuan lama perendaman 24 jam
peningkatan konsentrasi kolkisin hingga 0.04 % menyebabkan jumlah tunas
terus meningkat, tetapi tunas hasil perlakuan kolkisin dengan konsentrasi 0.06 %
memiliki jumlah tunas lebih sedikit. Perlakuan perendaman 48 jam dan
konsentrasi kolkisin 0.02 % dapat meningkatkan jumlah tunas nilam sidikalang,
tetapi peningkatan konsentrasi kolkisin menyebabkan jumlah tunas lebih
sedikit. Konsentrasi kolkisin 0.02 % dan 0.04 % dengan perlakuan perendaman
72 jam memiliki jumlah tunas yang lebih sedikit dibanding tanaman dengan
perendaman 72 jam tanpa larutan kolkisin. Konsentrasi kolkisin 0.06 % dengan
perendaman 72 jam memiliki jumlah tunas lebih banyak dibanding konsentrasi
0.02 % dan 0.04 % tetapi jumlah tunas tersebut masih lebih sedikit
dibandingkan dengan tanaman perlakuan perendaman 72 jam tanpa larutan
kolkisin.
Hasil uji F memperlihatkan bahwa perlakuan konsentrasi kolkisin
dengan beberapa taraf lama perendaman berpengaruh sangat nyata terhadap
jumlah tunas nilam sidikalang,tetapi pada 7 dan 8 MST perlakuan konsentrasi
kolkisin tidak berbeda nyata (Tabel 4). Tunas yang dihasilkan dari perlakuan
konsentrasi 0.02 % menghasilkan tunas yang paling banyak. Pada 6 dan 7 MST
tunas yang dihasilkan perlakuan konsentrasi kolkisin 0.02 % memiliki jumlah
Jum la h T u nas
Hingga akhir pengamatan, pada 8 MST, eksplan dari perlakuan konsentrasi
kolkisin 0.06 % memiliki jumlah tunas yang paling sedikit dan waktu
kemunculan tunas baru yang paling lama.
9 8 7 6 5 4 3 2
Lama perendaman kolkisin
24 jam
48 jam
72 jam 1
0
0,00% 0,02% 0,04% 0,06% 0,08%
Konsentrasi Kolkisin
Gambar 1. Interaksi tingkat konsentrasi kolkisin dengan lama perendaman
terhadap jumlah rata-rata tunas Pogostemon cablin Benth. pada 8
MST
Pengaruh perlakuan kolkisin dengan perendaman selama 24 jam
ditunjukkan dengan persamaan Y=5.43+5.6X dan nilai R2 sebesar 0.049.
Pengaruh perlakuan kolkisin dengan perendaman selama 48 jam memiliki
persamaan Y=5.24-54.5X dengan nilai R2=0.253. Pengaruh perlakuan kolkisin
dengan perendaman selama 72 jam memiliki persamaan Y=5.88-X dengan
nilai R2=0. Nilai R2 yang sangat kecil menunjukkan data yang diperoleh
keragamannya sangat besar.
Tabel 4. Pengaruh konsentrasi kolkisin terhadap jumlah tunas Pogostemon
cablin Benth. selama 8 MST secara in vitro
Konsentrasi kolkisin (%)
Rata-rata jumlah tunas pada minggu ke- (MST) 1 2 3 4 5 6
0 0.9 a 1.0 a 1.2 a 1.4 a 1.9 a 2.8 ab 0.02 0.7 bc 0.7 c 0.7 b 1.0 b 1.4 b 3.4 a 0.04 0.8 b 0.8 b 0.8 b 1.0 b 1.4 b 2.6 ab 0.06 0.6 c 0.6 c 0.7 b 0.8 b 1.3 b 2.1 b KK (%) 22.87 20.79 27.36 25.74 30.21 36.82
Keterangan: Angka pada kolom yang sama dan diikuti huruf yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 %
[image:33.612.149.504.163.324.2]Hasil uji F menunjukkan lama perendaman kolkisin berpengaruh sangat
nyata terhadap pertambahan jumlah tunas, kecuali pada 8 MST yang
berpengaruh nyata (Tabel 5). Tunas dengan perlakuan perendaman 24 jam
memiliki jumlah tunas yang paling banyak, tetapi hasilnya tidak berbeda nyata
dengan perlakuan perendaman 48 jam dan 72 jam. Eksplan kontrol memiliki
jumlah tunas yang paling sedikit. Perlakuan tanpa kolkisin juga menyebabkan
proliferasi tunas adventif lebih cepat. Tunas pada tanaman kontrol baru
bertambah setelah minggu ketiga, tetapi pada perlakuan perendaman 24 dan 48
jam, tunas mulai bertambah pada 2 MST. Hasil ini berbeda pada tanaman
Anthurium plowmanii Croat. yang diberi perlakuan kolkisin. Tunas hasil
perlakuan perendaman dengan kolkisin pertumbuhannya lebih terhambat
dibanding kontrol. Semakin lama waktu perendaman menyebabkan
pertumbuhan tunas yang lebih lambat pula (Nurwanti, 2010).
Tabel 5. Pengaruh lama perendaman terhadap jumlah tunas Pogostemon cablin
Benth. selama 8 MST secara in vitro
Lama perendaman (jam) Rata-rata jumlah tunas pada minggu ke- (MST)
1 3 6 7 8
24 0.9 a 0.9 ab 3.2 a 3.9 a 6.1 a 48 0.7 b 1.0 a 1.9 b 2.4 b 3.6 b 72 0.6 b 0.7 b 3.0 a 3.9 a 5.9 a
KK (%) 22.87 27.36 36.82 41.61 47.15
Keterangan: Angka pada kolom yang sama dan diikuti huruf yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5 % KK: Koefisien Keragaman
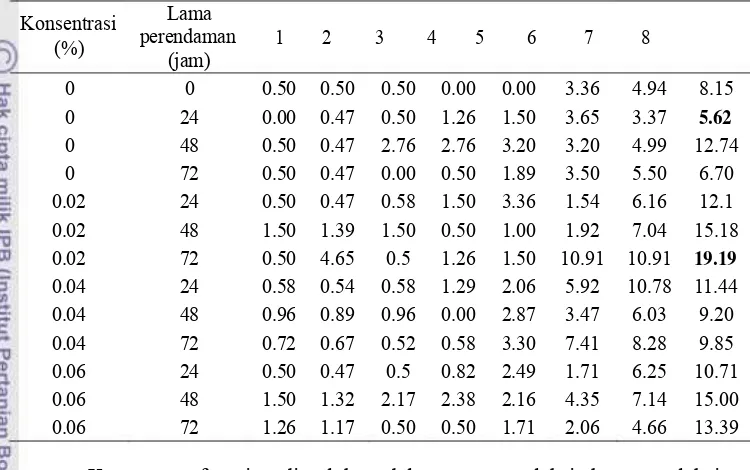
Berdasarkan tabel 6 dapat disimpulkan bahwa perlakuan aplikasi
kolkisin dapat meningkatkan keragaman fenotipe tanaman nilam sidikalang.
Nilai koefisien keragaman fenotipe (KKF) tunas nilam semakin meningkat
setiap minggunya. Semakin tinggi nilai koefisien keragaman fenotipe,
keragaman yang terjadi juga semakin tinggi.. Tanaman yang dihasilkan dari
perlakuan perendaman kolkisin memiliki nilai KKF yang lebih tinggi
dibanding tanaman tanpa perendaman kolkisin.
Umumnya tingkat keragaman mulai meningkat pada umur 3 MST,
tetapi pada tanaman kontrol tingkat keragaman fenotipe mulai meningkat
perlakuan konsentrasi kolkisin 0.02 % dengan perendaman selama 72 jam,
yaitu sebesar 19.19 %. Walaupun memiliki persentase KKF tertinggi, tingkat
keragaman tersebut masih termasuk dalam kategori keragaman sempit.
Tabel 6. Persentase KKF jumlah tunas Pogostemon cablin Benth.
Konsentrasi (%)
Lama
perendaman (jam)
1 2 3 4 5 6 7 8
0 0 0.50 0.50 0.50 0.00 0.00 3.36 4.94 8.15 0 24 0.00 0.47 0.50 1.26 1.50 3.65 3.37 5.62 0 48 0.50 0.47 2.76 2.76 3.20 3.20 4.99 12.74 0 72 0.50 0.47 0.00 0.50 1.89 3.50 5.50 6.70 0.02 24 0.50 0.47 0.58 1.50 3.36 1.54 6.16 12.1 0.02 48 1.50 1.39 1.50 0.50 1.00 1.92 7.04 15.18 0.02 72 0.50 4.65 0.5 1.26 1.50 10.91 10.91 19.19 0.04 24 0.58 0.54 0.58 1.29 2.06 5.92 10.78 11.44 0.04 48 0.96 0.89 0.96 0.00 2.87 3.47 6.03 9.20 0.04 72 0.72 0.67 0.52 0.58 3.30 7.41 8.28 9.85 0.06 24 0.50 0.47 0.5 0.82 2.49 1.71 6.25 10.71 0.06 48 1.50 1.32 2.17 2.38 2.16 4.35 7.14 15.00 0.06 72 1.26 1.17 0.50 0.50 1.71 2.06 4.66 13.39
Keragaman fenotipe diperlukan dalam proses seleksi, karena seleksi
dilakukan berdasarkan karakter fenotipe yang merupakan ekspresi genetik dari
suatu karakter. Apabila keragaman fenotipenya sempit, maka kurang leluasa
untuk melakukan proses seleksi (Budianto et al., 2009).
Jumlah Daun
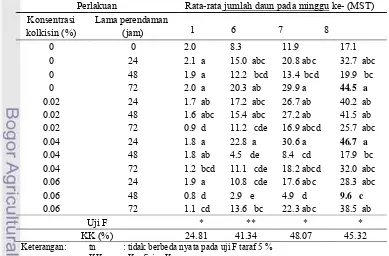
Interaksi konsentrasi kolkisin dengan lama perendaman terhadap
jumlah daun hanya terdapat pada minggu ke-1, 6, 7 dan 8 MST (Tabel 7).
Secara umum, perlakuan yang menunjukkan jumlah daun paling banyak adalah
perlakuan konsentrasi kolkisin 0.04 % dengan perendaman 24 jam dan
perlakuan konsentrasi 0 % dengan perendaman 72 jam, tetapi kedua perlakuan
ini tidak berbeda nyata hasilnya dengan tanpa dengan perendaman 24 jam,
konsentrasi kolkisin 0.02 % dengan perendaman 24, 48 dan 72 jam, konsentrasi
kolkisin 0.04 % dengan perendaman 72 jam, konsentrasi kolkisin 0.06 %
[image:35.612.136.511.172.407.2]Tanaman perlakuan konsentrasi kolkisin 0.04 % dengan perendaman 24
jam memiliki 46.7 daun dan tanaman perlakuan tanpa kolkisin dengan
perendaman 72 jam memiliki 44.5 daun. Tanaman perlakuan tanpa kolkisin
dengan perendaman 72 jam memiliki jumlah tunas yang lebih sedikit dibanding
perlakuan konsentrasi kolkisin 0.02 % dengan perendaman 48 jam, tetapi
memiliki jumlah daun yang lebih banyak. Hal ini dapat disebabkan tunas yang
terbentuk dari perlakuan tanpa kolkisin dengan perendaman 72 jam memiliki
jumlah buku tunas yang lebih banyak. Jumlah daun yang lebih banyak juga
dapat disebabkan perbedaan letak daun pada tanaman hasil perlakuan kolkisin.
Tunas kontrol memiliki dua daun per buku tunas, tetapi sebagian tunas yang
mendapat perlakuan kolkisin memiliki tiga daun per buku tunas. Tanaman
yang memiliki jumlah daun paling sedikit dihasilkan dari perlakuan konsentrasi
0.06 % dengan perendaman 48 jam, yaitu sebanyak 9.6 daun. Jumlah daun
meningkat seiring dengan meningkatnya jumlah tunas. Tanaman perlakuan
konsentrasi kolkisin 0.06 % dengan perendaman 48 jam memiliki jumlah tunas
yang paling sedikit sehingga jumlah daunnya pun sedikit.
Tabel 7. Interaksi antara tingkat konsentrasi dan lama perendaman terhadap jumlah daun Pogostemon cablin Benth. selama 8 MST secara in vitro
Perlakuan Rata-rata jumlah daun pada minggu ke- (MST) Konsentrasi
kolkisin (%)
Lama perendaman
(jam) 1 6 7 8
0 0 2.0 8.3 11.9 17.1
0 24 2.1 a 15.0 abc 20.8 abc 32.7 abc 0 48 1.9 a 12.2 bcd 13.4 bcd 19.9 bc 0 72 2.0 a 20.3 ab 29.9 a 44.5 a 0.02 24 1.7 ab 17.2 abc 26.7 ab 40.2 ab 0.02 48 1.6 abc 15.4 abc 27.2 ab 41.5 ab 0.02 72 0.9 d 11.2 cde 16.9 abcd 25.7 abc 0.04 24 1.8 a 22.8 a 30.6 a 46.7 a 0.04 48 1.8 ab 4.5 de 8.4 cd 17.9 bc 0.04 72 1.2 bcd 11.1 cde 18.2 abcd 32.0 abc 0.06 24 1.9 a 10.8 cde 17.6 abc 28.3 abc 0.06 48 0.8 d 2.9 e 4.9 d 9.6 c 0.06 72 1.1 cd 13.6 bc 22.3 abc 38.5 ab
Uji F * ** * *
KK (%) 24.81 41.34 48.07 45.32
[image:36.612.125.514.440.696.2]Jum
lahDaun
Chulalaksananukul dan Chimnoi (1999) melaporkan pegagan (Centella
asiatica) poliploid hasil aplikasi kolkisin memiliki jumlah daun yang lebih
banyak,hingga tiga kali lipat, dibanding tanaman diploidnya.
Gambar 2 menunjukkan pada perlakuan perendaman 24 jam, jumlah
daun terus meningkat dengan peningkatan konsentrasi kolkisin hingga 0.04