DEPARTEMEN KIMIA
FMIPA IPB
BAB 11
Created by
Created by: : BAR – TWSBAR – TWS
SENYAWA KOMPLEKS
BAB 11. SENYAWA KOMPLEKS
DAN POLIMER
11.1 KIMIA LOGAM TRANSISI
11.2 PEMBENTUKAN KOMPLEKS KOORDINASI
11.3 ISOMERISASI DALAM KOMPLEKS KOORDINASI 11.4 PENERAPAN KIMIA KOORDINASI
11.5 A. DEFINISI & KLASIFIKASI POLIMER 11.6 B. PROSES POLIMERISASI
11.7 C. SERAT, PLASTIK, DAN ELASTOMER 11.8 D. PROTEIN
Titik Leleh
W = 3410
oC
Hg = -39
oC
BILANGAN OKSIDASI
Sc max +3
Mn max +7
sangat beragam
Dalam satu gol biloks
11. 2 PEMBENTUKAN KOMPLEKS
KOORDINASI
Logam transisi mampu membentuk kompleks
koordinasi
Ion Logam : Asam Lewis Ligan : Basa Lewis
Misal [Cu(H2O)4]2+ - ion kompleks
Jenis Ligan Unidentat
Rumus Nama Rumus Nama Rumus Nama
Netral Anion Anion
OH2 Akuo NO2- Nitro F- Floro
NH3 Amina OCO22- Karbonato Cl- Kloro
CO Karbonil ONO- Nitrito Br- Bromo
NO Nitrosil CN- Siano I- Iodo
NH2CH3 Metilamina SCN- Tiosianato O2- Okso
NC6H5 Piridina NCS- Isotiosianato
JENIS LIGAN MULTIDENTAT
etilenadiamina en
oksalato oks
o-fenantrolina o-fen
dietilenatriamina dien
trietilenatetramina trien
Penyelesaian
a. Biloks K = +1 maka muatan ion kompleks = -1.
muatan ligan NH3 = 0 dan CN = -1, maka biloks atom logam pusat =
(2 x 0) + (4 x -1) + (X) = -1; X = +3
b. Muatan ligan CO = 0 maka muatan senyawa kompleks = 0 berarti biloks Os = 0
c. Biloks Na = +1 maka muatan ion kompleks = -1
muatan ligan H2O = 0 dan OH = -1, maka biloks atom logam pusat =
(3 x 0) + (3 x -1) + (X) = -1; X = +2
Tentukan bilangan oksidasi atom logam pusat yang ter-koordinasi dalam senyawa berikut:
a. K[Co(CN)4(NH3)2] b. [Os(CO)5]
Penyelesaian
a. Muatan ion kompleks = -3 diperlukan 3 kation Na rumus senyawanya = Na3[Co(CO3)3]
b. Muatan ion kompleks = +2 diperlukan 2 anion Br rumus senyawanya = [PtCl2(NH3)2(H2O)2]Br2
c. Muatan ion kompleks = -1 diperlukan 1 kation Na rumus senyawanya = Na[B(NO3)4]
Tafsirkan rumus senyawa kompleks dari nama-nama
senyawa di bawah ini:
a. natrium trikarbonatokobaltat(3-)
b. diaminadiakuodikloroplatinum(2+)bromida
c. natrium tetranitratoborat(1-)
PENULISAN RUMUS SENYAWA KOORDINASI
1.
Penulisan: bermuatan positif terlebih dahulu baru
yang bermuatan negatif.
2.
Dalam tiap ion kompleks atau kompleks netral: atom
pusat (logam) dituliskan dahulu, disusul ligan
bermuatan negatif lalu ligan netral dan terakhir ligan
bermuatan positif.
Penulisan ligan yang bermuatan sejenis diurutkan
berdasarkan abjad dalam bahasa inggris dari tiap
simbol pertama ligan
3.
Baik ion kompleks maupun kompleks netral
TATA NAMA SENYAWA KOORDINASI
1.
Penamaan: ion bermuatan positif lalu bermuatan
negatif.
2.
Nama ion kompleks: ligan dahulu lalu ion logam
pusatnya.
3.
Urutan penamaan ligan: abaikan muatan ligan &
urutkan berdasarkan urutan abjad nama ligan dalam
bahasa inggrisnya tetapi nama ligan tetap dituliskan
dalam bahasa Indonesia
4.
Aturan umum nama ligan:
ligan bermuatan negatif: diberi akhiran -o dari
nama dasarnya (Cl
-: klorida menjadi kloro)
ligan bermuatan positif: diberi akhiran ium dari
5.
Jumlah tiap jenis ligan dalam awalan Yunani.
6.
Muatan ion kompleks dituliskan setelah nama atom
logam pusat tanpa jarak. Jumlah muatan ion
kompleks ditulis dalam nomor Arab dan diikuti
dengan tanda jenis muatannya di
dalam tanda kurung
7.
nama logam pada ion kompleks bermuatan negatif di
beri akhiran at
ligan bermuatan netral, diberi nama sesuai
11.3 ISOMERISASI DALAM KOMPLEKS
KOORDINASI
ISOMER STRUKTUR
1. Isomer ionisasi, [PtCl
2(NH
3)
4]Br
2[PtBr
2(NH
3)
4]Cl
22. Isomer akua, [Cr(H
2O)
6]Cl
3ungu
[CrCl(H
2O)
5]Cl
2.H
2O biru hijau
[CrCl
2(H
2O)
4]Cl.2H
2O hijau
3. Isomer koordinasi,
[Co(NH
3)
6][Cr(CN)
6] dan [Cr(NH
3)
6][Co(CN)
6]
4. Isomer ikatan, ligan nitro –NO
2nitrito –ONO,
siano (CN
-) isosiano (NC
-),
•
ISOMER RUANG
11.4 PENERAPAN KIMIA KOORDINASI
1.
Proses fotografi
AgBr (p) + S
2O
32- [Ag(S
2O
3)
2]
3-+ Br
-2. Proses penyepuhan
Anoda : Cu + 3CN
-
[Cu(CN)
3]
2-+ e
-katoda : [Cu(CN)
3]
2-+ e
- Cu + 3CN
-3. Metalurgi emas
ekstraksi Au di alam dengan proses pengkompleksan
oleh CN
-4Au(p) + 8CN
-+ O
2+ 2H
2O
4[Au(CN)
2]
-+ 4OH
4.
Pengolahan air
menghilangkan logam tertentu dalam air
dengan cara pengkelatan
pengkelatan besi dengan EDTA
Fe
2++ EDTA
[Fe(EDTA)]
[Fe
2+] dalam air <<< tak menimbulkan
endapan walaupun ditambahkan basa
5. Membersihkan darah
pengikatan ion Ca
2+dalam darah dengan EDTA
6. Menghilangkan logam berat dalam tubuh
DEPARTEMEN KIMIA
FMIPA IPB
Diktat Kuliah Kimia TPB Bab13
Created by
Created by: : BAR – TWSBAR – TWS
Edited by
A. Definisi & Klasifikasi
Polimer: molekul raksasa yang terdiri atas unit berulang yang bergabung melalui ikatan kovalen.
Bahasa Latin: poli = banyak & meros = bagian
Klasifikasi:
1. Berdasarkan sumber/asalnya: alami dan sintetik
2. Gugus fungsi monomernya: poliamida, poliester, polisulfida, dll. 3. Struktur molekulnya: linear, bercabang, bertaut-silang
amorf, kristalin homopolimer,
heteropolimer/kopolimer
A. Definisi & Klasifikasi
Struktur polimer:
A. Definisi & Klasifikasi
Homopolimer: polimer yang dibuat dari 1 jenis monomer.
AAAAA AAAAA
AA AA
AAAAA AAAAA
Kopolimer/heteropolimer: campuran > 1 jenis monomer.
linear bercabang taut-silang
ABABAB AABABBA AAAAABBBB AAAAAAA BBB BBB
A. Definisi & Klasifikasi
(1)
Termoplastik: meleleh atau melunak jika dipanaskan dan
mengeras kembali jika didinginkan.Sifat polimer terhadap kalor:
Contoh: Polistirena, Polietilena, Polipropilena
(2)
Termoset: jika dipanaskan, dihasilkan material tak terleburkan
yang keras dan tidak dapat dilelehkan lagi.B. Proses Polimerisasi
(1)
Polimerisasi adisi:
Tidak ada atom yang hilang: polimer mengandung semua atom yang ada pada monomer.
Monomer memiliki ikatan rangkap
Produknya merupakan polimer yang biasanya tergolong
sebagai plastik.
Contoh: Polimerisasi polietilena dari etilena
H2C CH2 H2C CH2
n n
B. Proses Polimerisasi
Polimer vinil:
H2C CH inisiator
radikal H2C CH
n n
L L
L = –CH3 polipropilena (PP): karpet, koper, tali
L = –Cl poli(vinil klorida) (PVC):
pipa air, atap, kartu kredit, piringan hitam
L = –C6H5 polistirena (PS):
mebel, mainan, pelapis refrigerator, isolasi L = –CN poliakrilonitril (PAN, Orlon, Acrilan):
B. Proses Polimerisasi
(2)
Polimerisasi kondensasi:
Biasanya terjadi antara 2 monomer yang masing-masing memiliki sekurang-kurangnya 2 gugus fungsi.
Lepasnya molekul kecil (umumnya H2O)
B. Proses Polimerisasi
Biasanya dilakukan pada polimer yang sudah terbentuk, untuk mendapatkan sifat polimer yang sesuai dengan kebutuhan:
(a) menambah atau mengubah gugus fungsi. Contoh: PVC polivinil diklorida (PVDC)
(tahan suhu tinggi)
(3)
Modifikasi polimer:
(b) pertautan-silang (crosslinking) untuk membentuk jejaring. Syarat: monomer memiliki > 3 tapak reaktif.
C. Serat, Plastik, dan Elastomer
Ketahanan terhadap uluran
SERAT
(memanjang <10% tanpa putus)
PLASTIK (20–100%)
ELASTOMER (100–1000%)
(1)
Serat:
(a) Bersimetri molekular tinggi dan berenergi kohesif kuat antar-rantai akibat adanya gugus polar.
(b) Derajat kristalinitas tinggi yang dicirikan oleh adanya ikatan hidrogen antarmolekul dan tidak adanya percabangan.
(2)
Plastik:
C. Serat, Plastik, dan Elastomer
Tidak dapat dipintal seperti serat, tetapi dapat dicetak atau diekstrusi menjadi bentuk yang diinginkan atau dibentang menjadi film pengemas.
Sintetik:
Bakelit (resin fenol-formaldehida), PE, PP, PVC, PS, PMMA, poli(asam laktat) (PLA), poli(-kaprolakton) (PCL);
Alami:
(3)
Elastomer:
C. Serat, Plastik, dan Elastomer
Bersifat amorf pada kondisi normal (strukturnya tidak teratur dengan gaya tarik antarmolekul yang lemah), tetapi secara reversibel menjadi teratur bila ditarik/diregangkan.
Elastomer alami yang paling penting ialah karet alam, yaitu polimer semua cis dari isoprena (metilbutadiena).
n CH2 C CH3
CH CH2 C C
CH3
CH2
H
CH2
n
dan/atau C C
CH2 CH3 H CH2 n isoprena (metilbutadiena)
poli-cis-isoprena
(karet alam)
poli-trans-isoprena
C. Serat, Plastik, dan Elastomer
Karet alam lembek dan tidak sepenuhnya kembali ke bentuk semula jika diulur diperkeras dengan vulkanisasi (Charles
Goodyear, 1839).
Karet direaksikan dengan zink oksida sehingga terbentuk taut-silang sulfur (jembatan disulfida) antarrantai hidrokarbon.
sebelum vulkanisasi
setelah vulkanisasi
C. Serat, Plastik, dan Elastomer
Poli-cis-isoprena (diproduksi dengan katalis Ziegler-Natta; sifat-sifatnya nyaris sama dengan karet alam).
Contoh Karet Sintetik:
Karet SBR (tahun 1950 volume produksinya telah melampaui karet alam).
Kopolimer butadiena-akrilonitril (karet NBR).
D. Protein
Biopolimer polipeptida, tersusun dari sejumlah asam amino
yang dihubungkan dengan ikatan peptida.
Protein struktural pada sel, jaringan, atau organ Enzim (biokatalis)
Pembawa zat melalui membran sel: protein transpor Zat pengatur: hormon, antibodi
R CH NH2
C O
OH
asam amino
(R = rantai samping) Rumus Umum Asam Amino
–COOH = asam –NH2 = basa
D. Protein
Penggolongan protein:
Struktur : 1o, 2o, 3o, 4o
Sumber : hewani, nabati, mikrob Lokasi dalam sel : inti, sitoplasma, membran Bentuk : serat, globular
BM/ukuran : kecil, menengah, besar Polaritas (kelarutan) : netral, bermuatan +/–
Asosiasi dgn senyawa lain : nukleo-, lipo-, glikoprotein
Lambang Struktur Gugus Samping
“Gugus Samping” Hidrogen
Glisina Gly –H
Gugus Samping Alkil
Alanina Ala –CH3 Valina Val –CH(CH3)2 Leusina* Leu –CH2CH(CH3)2 Isoleusina* Ile –CH(CH3)CH2CH3 Prolina Pro
(struktur seluruh
asam amino) NH
Lambang Struktur Gugus Samping
Gugus Samping Aromatik
Fenilalanina* Phe Tirosina Tyr
Triptofan* Trp
Gugus Samping Mengandung Alkohol
Serina Ser –CH2OH Treonina* Thr –CH(OH)CH3
Gugus Samping Basa
Lisina* Lys –(CH2)4NH2
Arginina* Arg –(CH2)3NHC(NH2)=NH Histidina* Hys
CH2
CH2 OH
N H CH2
HN N
Lambang Struktur Gugus Samping
Gugus Samping Asam
Asam aspartat Asp –CH2COOH Asam glutamat Glu –(CH2)2COOH
Gugus Samping Mengandung Amida
Asparagina Asn
Glutamina Gln
Gugus Samping Mengandung Sulfur
Sisteina Cys –CH2SH Metionina* Met –CH2CH2SCH3
CH2 C O
NH2
CH2 CH2 C O
NH2
* asam amino esensial (tidak dapat disintesis oleh manusia dewasa)
D. Protein
Struktur primer protein:
Struktur 2 dimensi yang menggambarkan urutan residu asam amino penyusun protein dan ikatan tulang-punggung peptida.
H2N C H C R1 O OH N H C H C R2 O OH aa1 aa2
H2O
H2N C H C R1 O NH C H C R2 O OH dipeptida
H2N C H C R3 O OH aa3
H2O
D. Protein
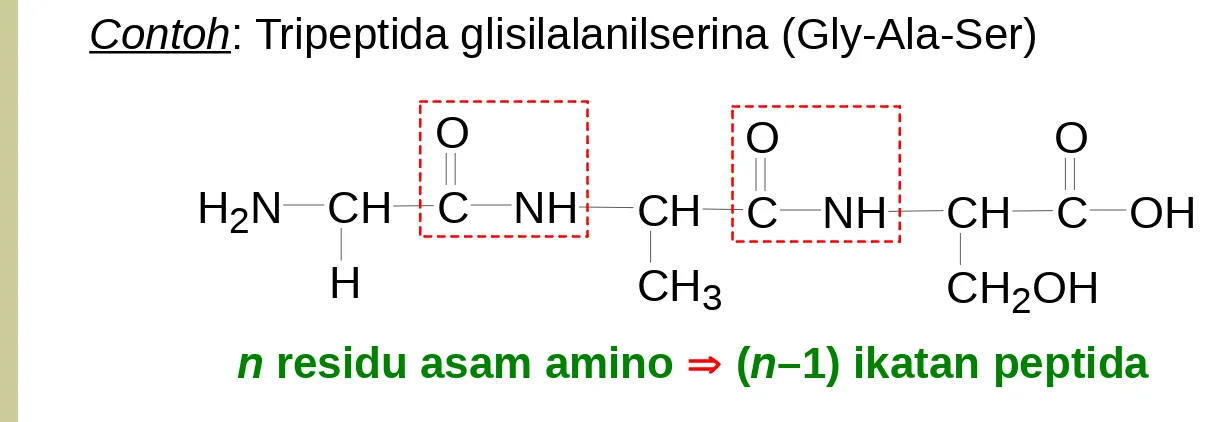
Contoh: Tripeptida glisilalanilserina (Gly-Ala-Ser)
H2N CH H C O NH CH CH3 C O NH CH
CH2OH C O
OH
[image:37.720.39.652.135.346.2]LATIHAN:
Gambarkan struktur tetrapeptida sisteiltreonilleusilmetionina jika rantai samping Cys = CH2SH, Thr = CH(OH)CH3, Leu = CH2CH(CH3)2, dan Met = CH2CH2SCH3. Lingkari semua ikatan peptida dalam struktur tersebut.
D. Protein
Struktur sekunder protein:
Struktur 3 dimensi hasil pelipatan polipeptida akibat ikatan hidrogen antara O-karboksil dan N-amino dari ikatan peptida:
C O H N
Intrarantai heliks- (wol, rambut)
(a) terjadi jika R berukuran besar (b) gugus R menonjol keluar heliks
D. Protein
Antarrantai lembaran terlipat- (sutera)
(a) terjadi jika monomer utamanya Gly dan Ala (R kecil) (b) gugus nonhidrogen terletak pada 1 sisi lembaran
D. Protein
Struktur tersier protein:
Struktur 3 dimensi hasil pelipatan polipeptida akibat interaksi antargugus R dari residu asam amino penyusun protein:
(1) Jembatan garam:
Terjadi antara residu asam amino-asam (Asp & Glu) dan
-basa (Lys, Arg, Hys), yaitu antara gugus CO2 dan NH
3+.
(2) Ikatan hidrogen:
D. Protein
(3)
Jembatan disulfida:
Terjadi di antara 2 residu Cys yang teroksidasi.
NH CH
CH2SH C O
NH CH C CH2SH
O
NH CH CH2
C O
NH CH C CH2 O S S oksidasi reduksi ikatan disulfida
2 residu sisteina residu sistina
D. Protein
(4)
Interaksi hidrofobik:
Terjadi karena residu-residu
nonpolar (Ala, Val, Leu, Ile, Phe, Cys) secara termodinamika lebih suka mengelompok untuk
D. Protein
Struktur kuaterner protein:
Struktur yang dihasilkan dari interaksi struktur tersier dengan senyawa lain, baik protein maupun nonprotein.
MIOGLOBIN
(contoh struktur tersier)
E. Karbohidrat
Polihidroksialdehida atau polihidroksiketon, atau zat yang
memberikan senyawa tersebut ketika dihidrolisis.
Sumber energi kimia utama bagi makhluk hidup Contoh: pati pada tumbuhan,
glikogen pada hewan & manusia.
Definisi sebagai hidrat dari karbon Cx(H2O)y, tidak dipakai lagi.
Komponen pembentuk struktur
E. Karbohidrat
Penggolongan karbohidrat berdasarkan jumlah monomer:
Polisakarida H2O
H+ Oligosakarida Monosakarida H2O
H+
Polisakarida : > 10 unit monosakarida
Oligosakarida : gabungan 2–10 monosakarida
disakarida, trisakarida, dst.
E. Karbohidrat
Penggolongan monosakarida:
3 atom C triosa 5 atom C pentosa
4 atom C tetrosa 6 atom C heksosa dst.
☼ Berdasarkan jenis gugus karbonil:
aldosa ketosa
n = jumlah C kiral
1
2 1
E. Karbohidrat
Lima monosakarida yang penting:
CHO OH H OH H OH H
CH2OH
CHO OH H H HO OH H OH H
CH2OH
CH2OH C O H HO OH H OH H
CH2OH CHO OH H H HO H HO OH H
CH2OH
D-ribosa D-glukosa D-galaktosa D-fruktosa
CHO H HO H HO OH H OH H
CH2OH
D-manosa
E. Karbohidrat
Glukosa (dektrosa) paling banyak di alam
Disebut juga gula darah; kandungan normalnya dalam darah ialah 100–120 mg/100 ml.
Fruktosa (levulosa) banyak ditemukan di madu, sirup jagung, dan buah-buahan manis.
Ribosa penyusun nukleotida dalam RNA
Galaktosa penyusun laktosa (gula susu)
E. Karbohidrat
Empat disakarida yang penting:
(1)
Maltosa:
Glukosa + glukosa(2)
Selobiosa:
Glukosa + glukosa(3)
Laktosa:
Galaktosa + glukosa(4)
Sukrosa:
Fruktosa + glukosaLaktosa gula utama dalam susu (kadarnya bervariasi: 4,5–4,8% pada susu sapi & kambing, 7% pada ASI).
E. Karbohidrat
Beberapa orang dewasa sangat rendah kandungan enzim laktasenya laktosa menumpuk di usus dan difermentasi menjadi asam laktat mengiritasi usus, menyebabkan diare.
(a) Yoghurt (laktosa diubah menjadi asam laktat). (b) Susu rendah-laktosa
(c) Susu yang telah ditambahkan enzim laktase.
Galaktosemia: tingginya kadar galaktosa pada urin dan darah bayi karena rendahnya kadar enzim yang
E. Karbohidrat
Empat polisakarida yang penting:
(1)
Amilosa:
Polimer dari maltosa(a) Rantai linear dari 50–300 unit D-glukosa dengan tautan glikosidik -(14), memiliki BM ~ 106.
(b) Berbentuk heliks (spiral) dalam larutan karena adanya tautan pada setiap unit glukosa.
E. Karbohidrat
(2)
Amilopektin:
Rantai amilosa dengan percabangan(a) Rantai sangat bercabang dengan 300–5000 unit D-glukosa, memiliki BM 107–5108.
(b) Pada setiap 25-30 unit D-glukosa yang bertautan -(14) seperti pada amilosa, terdapat percabangan dengan
tautan -(16) pada titik cabang.
E. Karbohidrat
(3)
Glikogen:
(a) BM dan percabangan > amilopektin Kira-kira 100 000
unit D-glukosa, dengan 1 cabang per 8–12 unit.
(b) Merupakan cadangan karbohidrat pada hati dan otot hewan.
(4)
Selulosa:
Polimer dari selobiosa(a) Rantai linear dari rerata 5000 unit D-glukosa dengan tautan glikosidik -(14), memiliki BM ~ 106.
(b) Ikatan hidrogen antarrantai agregasi menjadi fibril
E. Karbohidrat
(d) Dapat dicerna oleh bakteri pada rayap dan ruminansia (sapi, kambing, dsb.), yang menghasilkan enzim
-glukosidase.
(c) Tidak dapat dicerna oleh manusia dan sebagian besar hewan, yang hanya memiliki enzim -glukosidase.
Pati, glikogen, dan selulosa tergolong homoglikan, karena hanya terdiri dari 1 jenis monosakarida, yaitu D-glukosa.
Jika polisakarida terdiri dari >1 jenis monosakarida, disebut
F. Asam Nukleat
Biopolimer polinukleotida, tersusun dari sejumlah monomer
nukleotida yang dihubungkan oleh ikatan fosfodiester.
Nukleotida = nukleosida + gugus fosfat
Nukleosida = basa nitrogen + gula
purina
pirimidina basa
nitrogen
D-ribosa RNA
D-2-deoksiribosa DNA gula
(1) Basa nitrogen tergabung dengan C1 gula pada N1 untuk pirimidina dan N9 untuk purina.
F. Asam Nukleat
Struktur DNA Watson-Crick:
(1) Heliks rangkap (2) Antiparalel
(3) Komplementer
ujung 3’ ujung 5’
timina adenina
(dua ikatan hidrogen)
sitosina guanina
LATIHAN
CF2 CF2 n 1. Gambarkan monomer dari Teflon:
2. Tuliskan persamaan reaksi polimerisasi yang menghasilkan
poli(metil metakrilat) (PMMA). Metil metakrilat merupakan ester dengan nama IUPAC metil 2-metilpropenoat.
3. Kodel ialah poliester dengan struktur sebagai berikut:
C O
C O
O CH2 CH2 O
n
LATIHAN
4. Nilon-6,6 dihasilkan dari reaksi 1,6-heksanadiamina dengan asam adipat. Polimer nilon lainnya diperoleh jika sebasil
klorida Cl(O)C(CH2)8C(O)Cl digunakan sebagai pengganti asam adipat. Bagaimana struktur nilon tersebut?
NH NH C
O
C O
n 5. Kevlar (bahan rompi antipeluru) ialah poliamida aromatik
(aramid) dengan struktur sebagai berikut:
LATIHAN
7. 1,1-Dikloroetena dan vinil klorida membentuk kopolimer berseling yang disebut Saran, yang digunakan dalam
pengemasan makanan. Tuliskan reaksi kopolimerisasinya.