56 Lampiran 1. Hasil identifikasi tumbuhan
57
Lampiran 2. Gambar tumbuhan dan daun segarkembang bulan (Tithonia diversifolia (Hemsley) A. Gray)
Tumbuhan kembang bulan
Daun segar tumbuhan kembang bulan
58
Lampiran 3.GambarSimplisia dan serbuk simplisia daun kembang bulan
Simplisia daun kembang bulan
Serbuk simplisia daun kembang bulan
59
Lampiran 4. Bagan pembuatan ekstrak
Serbuk simplisia
Dimasukkan ke dalam bejana
Ditambah pelarut 5,5 liter etanol 80% (75 bagian)
Dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali di aduk
Diserkai, diperas
Dicuci dengan pelarut etanol 80% hingga diperoleh (100 bagian)
Dipindahkan ke dalam bejana tertutup
Dibiarkan di tempat sejuk, terlindung dari cahaya selama 2 hari Dienap tuangkan dan di saring
Digabung
Dipekatkan dengan alat rotary evaporator 40oC Dikeringkan dengan alat freeze dryer -40oC Ekstrak Kental
(71 g)
Maserat I Ampas
Maserat II Ampas
60
Lampiran 5. Bagan alur penelitian uji toksisitas subkronik
`
61
Lampiran 6. Contoh perhitungan dosis
Berat badan mencit 25 g dengan dosis EEDKB 1000 mg/kg bb Dosis = 1000 mg/kg bb
= (25 : 1000 kg ) x 1000 mg/kg = 25 mg
Konsentrasi ekstrak yang dibuat 6% = 6 g/100 mL = 6000 mg/100 mL = 60 mg/mL
Jumlah obat yang disuntikkan = 25 mg : 60 mg/mL = 0,42 mL
62
Lampiran 7. Hasil uji
pendahuluan1. Hasil pengamatan berat badan
Perlakuan Berat badan hari ke- (g)
0 1 2 3 4 5 6 7 2. Hasil perhitungan dan analisa rata-rata berat badan
Hari Rata-rata berat badan (g) ± SD
kontrol 250 mg 500 mg 1000 mg 1500 mg 3000 mg
0 26,55 ±0,78 26,75±0,35 24,55±0,78 24,65±1,63 24,7±0,71 24,65±2,33
7 26,95±0,49 27,05±0,35 24,5±0,99 23,6±2,26 24,00± -
3. Hasil pengamatan gejala toksik
Perlakuan Kejang Salivasi Diare Lemas
Perubahan bulu Gerak gerik
63
Lampiran 8. Hasil pengukuran berat badan
1. Berat badan pada minggu pertama
Perlakuan Berat badan hari ke- (g)
64 2. Berat badan pada minggu kedua
Perlakuan Berat badan hari ke- (g)
65 3. Berat badan pada minggu ketiga
Perlakuan Berat badan hari ke- (g)
66 4. Berat badan pada minggu keempat
Perlakuan Berat badan hari ke- (g)
67
Lampiran 9. Hasil pengukuran kadar ALT dan kreatinin
68
Lampiran 9. (lanjutan)
69
Lampiran 9.(lanjutan)
70
Lampiran 9.(lanjutan)
71
Lampiran 9.(lanjutan)
72
Lampiran 9.(lanjutan)
73
Lampiran 9. (lanjutan)
74
Lampiran 9.(lanjutan)
75
Lampiran 9.(lanjutan)
76
Lampiran 9.(lanjutan)
77
Lampiran 9.(lanjutan)
78
Lampiran 9.(lanjutan)
79
Lampiran 9.(lanjutan)
80
Lampiran 9.(lanjutan)
81
Lampiran 9.(lanjutan)
82
Lampiran 9.(lanjutan)
83
Lampiran 9.(lanjutan)
84
Lampiran 10. Hasil rata-rata kadar ALT dan kreatinin 1. Hasil rata-rata kadar ALT
Perlakuan Rata-Rata ±SD Nilai signifikansi
Kontrol 24,26 ±7,67 -
Dosis 250 mg/kg bb 48,5 ± 7,00 0,09*
Dosis 500 mg/kg bb 73,5 ± 19,46 0,014*
Dosis 750 mg/kg bb 99,5 ± 12,99 0,002*
Dosis 1000 mg/kg bb 151,2 ± 0,80 0,024*
2. Hasil rata-rata kadar kreatinin
Perlakuan Rata-Rata ±SD Nilai signifikansi
Kontrol 0,12 ± 0,05 -
Dosis 250 mg/kg bb 0,18 ± 0,04 0,092*
Dosis 500 mg/kg bb 0,33 ± 0,05 0,014*
Dosis 750 mg/kg bb 0,47 ± 0,05 0,004*
Dosis 1000 mg/kg bb 0,71 ± 0,08 0,024*
*) terdapat perbedaan yang signifikan
85
Lampiran 11.Pengamatan makropatologi organ hati dan ginjal
Hati dan ginjal mencit kelompok kontrol
Hati dan ginjal mencit dosis 250 mg/kg bb
86
Lampiran 11.(lanjutan)
Hati dan ginjal mencit dosis 500 mg/kg bb
Hati dan ginjal mencit dosis 750 mg/kg bb
87
Lampiran 11.(lanjutan)
Hati dan ginjal mencit dosis 1000 mg/kg bb
88
Lampiran 12. Gambar alat, bahan, dan objek yang digunakan
Oral sonde
Peralatan bedah
89
Lampiran 12. (lanjutan)
Mikroskop
Preparat hati dan ginjal
90
Lampiran 13. Gambar hewan percobaan yang digunakan
Mencit
Pembedahan mencit
7,5 cm
91
Lampiran 14. Hasil analisis SPSS berat badan mencit jantan
Descriptives Interval for Mean
Mini
19.5434 25.4966 20.0 0
19.3514 28.2886 20.0 0
21.5381 27.3019 22.7 0
20.8983 31.1817 21.0 0
19.9204 28.0796 20.0 0
20.2527 30.0273 20.7 0
22.5149 28.8851 23.6 0
20.8986 31.1014 20.0 0
18.1822 32.3378 17.0 0
18.8607 29.7393 20.4 0
20.2659 29.8941 20.4 0
20.4343 28.9257 19.0 0
13.7015 28.8985 13.0 0
15.8480 31.3120 15.0 0
20.1171 29.5629 21.0 0
20.0842 30.7558 20.4 0
20.5531 29.6069 18.6 0
14.0108 30.5092 13.0 0
31.00
92
17.2183 27.5017 15.0 0
21.0213 31.2987 21.8 0
21.0460 30.7140 22.0 0
19.5268 31.3932 17.0 0
14.2039 31.5961 13.0 0
17.2889 28.3111 15.0 0
26.00
Total 25 24.64 4.78774 .95755 22.6637 26.6163 13.0
0
32.00
Test of Homogeneity of Variances
93
Post Hoc Tests
95
minggu Iv kontrol
97
Lampiran 15. Hasil analisis SPSS pakan mencit
Oneway
Descriptives
Jumlah pakan(Gram)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Minim
Jumlah pakan(Gram)
Sum of Squares df Mean Square F Sig.
Between Groups 2660,077 4 665,019 18,501 ,000
Within Groups 2336,458 65 35,946
Total 4996,534 69
Post Hoc Tests
Multiple Comparisons
Dependent Variable: Jumlah pakan(Gram) (I)
95% Confidence Interval Lower
Bound Upper Bound
98
*. The mean difference is significant at the 0.05 level.
99
Lampiran 16. Hasil analisis SPSS kadar ALT dan kreatinin Descriptives
95% Confidence Interval for
Mean
Min Max
Lower Bound Upper Bound
kadar
Kolmogorov-Smirnova Shapiro-Wilk
Statistic df Sig. Statistic df Sig.
*. This is a lower bound of the true significance. a. Lilliefors Significance Correction
100
Lampiran 16.(lanjutan) NPAR TESTS
/K-W=kadar kdr BY perlakuan(1 5) /MISSING ANALYSIS.
NPar Tests
kadar ALT kadar kreatinin
Chi-Square 16,989 15,930
Df 4 4
Asymp. Sig. ,002 ,003
a. Kruskal Wallis Test
b. Grouping Variable: Perlakuan
101 NPAR TESTS
/M-W= kadar kdr BY perlakuan(1 2) /MISSING ANALYSIS.
NPar Tests
Mann-Whitney Test
Test Statisticsa
kadar ALT kadar kreatinin
Mann-Whitney U ,000 4,500
Wilcoxon W 15,000 19,500
Z -2,611 -1,687
Asymp. Sig. (2-tailed) ,009 ,092
Exact Sig. [2*(1-tailed Sig.)] ,008b ,095b
a. Grouping Variable: Perlakuan b. Not corrected for ties.
NPAR TESTS
/M-W= kadar kdr BY perlakuan(1 3) /MISSING ANALYSIS.
102
Test Statisticsa
kadar ALT kadar kreatinin
Mann-Whitney U ,000 ,000
Wilcoxon W 15,000 15,000
Z -2,449 -2,470
Asymp. Sig. (2-tailed) ,014 ,014
Exact Sig. [2*(1-tailed Sig.)] ,016b ,016b
a. Grouping Variable: Perlakuan b. Not corrected for ties.
NPAR TESTS
/K-W=kadar kdr BY perlakuan(1 4) /STATISTICS DESCRIPTIVES
/MISSING ANALYSIS.
NPar Tests
kadar ALT kadar kreatinin
Chi-Square 14,762 13,445
Df 3 3
Asymp. Sig. ,002 ,004
a. Kruskal Wallis Test
b. Grouping Variable: Perlakuan
103 NPAR TESTS
/M-W= kadar kdr BY perlakuan(1 5) /MISSING ANALYSIS.
NPar Tests
Mann-Whitney Test
Ranks
Perlakuan N Mean Rank Sum of Ranks
kadar ALT Kontrol 5 3,00 15,00
1000 mg 3 7,00 21,00
Total 8
kadar kreatinin Kontrol 5 3,00 15,00
1000 mg 3 7,00 21,00
Total 8
Test Statisticsa
kadar ALT kadar kreatinin
Mann-Whitney U ,000 ,000
Wilcoxon W 15,000 15,000
Z -2,249 -2,263
Asymp. Sig. (2-tailed) ,024 ,024
Exact Sig. [2*(1-tailed Sig.)] ,036b ,036b
a. Grouping Variable: Perlakuan b. Not corrected for ties.
50
DAFTAR PUSTAKA
Anggraini, D.R. (2008). Gambaran Makroskopik dan Mikroskopik Hati dan Ginjal Mencit Akibat Pemberian Plumbum Asetat. Tesis. Medan: Sekolah Pascasarjana Universitas Sumatera Utara. Halaman 52.
Anonim. (2012). Tithonia diversifolia (Hemsley) A. Grey, Asteraceae. Diakses
tanggal 26 Desember 2
diversifolia.htm.
Anonymous. (2009). Reference Values for Laboratory Animals, Normal Hematology Values. ReseachAnimal Resources. University of Minnesota. Halaman275.
Arifin, H., Leny, S., dan Netty, M. (2006). Kajian Toksisitas Akut Ekstrak Etanol Daun Capo (Blumea Balsamifera L.) dan Pengaruhnya Terhadap Gambaran Histologi Ginjal Mencit Putih Jantan. Media farmasi. 14(2): 120-124.
Chang, J .(1986). Synopsis of Pahatology. Printed Abrahan Publication. Halaman 26-27.
Cheville, N.F. (1999). Introduction to Veterinary Pathology. Edisi II. Iowa: Iowa State University Press. Halaman 214.
Covelli, V. (1972). Guide to The Necropsy of The Mouse. Diakses tanggal 26
Desember 2015.
file=Chapter-4htmL.
Contran, RS., Rennke, H., Kumar, V.(2007). Ginjal dan Sistem Penyalurannya. dalam: Kumar, Cotran,Robbin (ed). Buku Ajar Patologi Robbins Volume 2. Edisi VII. Jakarta:ECG. Halaman 594-7.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 7, 33, 744, 748.
Dewoto, H.R. (2007). Pengembangan Obat Tradisional Indonesia Menjadi Fitofarmaka. Jurnal Majalah Kedokteran Indonesia. 57(7). Halaman 208. Ditjen POM. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat.
Cetakan Pertama. Jakarta: Departemen Kesehatan RI. Halaman 3-5, 10-11. Ditjen POM. (2014). Peraturan Kepala Badan Pengawas Obat Dan
MakananRepublik IndonesiaNomor 7 Tahun 2014TentangPedoman Uji Toksisitas Nonklinik Secara In Vivo.Jakarta: Badan Pengawasan Obat dan Makanan RI. Halaman 3-4, 9,11-12,28-32.
Donatus, A.I. (2001). Toksikologi Dasar. Yogyakarta: Fakultas Farmasi Universitas Gajahmada. Halaman 67-79.
51
Elya, B., Amin, J., dan Emiyanah. (2010). Toksisitas Akut Daun Justicia gendarussa Burm.Jurnal Makara Sains. 14(2). Halaman 129-134.
Elufioye,T., Alatise, O.I., Fakoya, F.A., Agbedahunsi,J.M., dan Houghton,P.J.(2009). Toxicity Studies of Tithonia diversifolia A.Gray (Asteraceae) in Rats.Journal of Ethnopharmacology 122. Halaman 410-415.
Elufioye,T., danAgbedahunsi,J.M.(2004). Antimalaria Activities of Tithonia diversifolia (Asteraceae) and Crossopteryx febrifuga (Rubiaceae) on mice
in vivo. Journal of Ethnopharmacology 94. Halaman 167-171.
Eroschenko, V.P. (1996). AtlasHistologi Manusia. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 325.
Ganiswara, S.G. (1995). Farmakologi Dan Terapi. Edisi IV. Jakarta: Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia. Halaman 763-764.
Gupta, D., dan Bhardwaj, S. (2012). Study of Acute, Subacute and Chronic Toxicity Test. International Journal of Advanced Research in Pharmaceutical and Bio Sciences (IJARPB) 1(2):104. Halaman 14.
Guyton, A.C., dan Hall,J.E. (2008). Buku Ajar Fisiologi Kedokteran. Edisi XXII. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 34.
Hage, L.S. (1982). The Anatomy Workbook. Philadelphia: Printed Lipincott Company. Halaman 83.
Hagerman.(2002). The Tannin Hand Book. Diakses tanggal 9 September 2015.
http://www.users.miamioh.edu/hagermae/What%20Is%20a%20Tannin.pdf
Hasnisa, Juswono,Unggul, P., Wardoyo, Arinto, Y.P.(2014). Pengaruh Paparan Asap Kendaraan Bermotor terhadap Gambaran Histologi Organ Ginjal Mencit (Mus musculus): Universitas Brawijaya. Halaman 2.
Hendriani, R. (2007). Uji Toksisitas Subkronis Kombinasi Ekstrak Etanol Buah Mengkudu (Morinda citrifolia Linn.) Dan Rimpang Jahe Gajah (Zingiber officinale rosc.) Pada Tikus Wistar. Karya Ilmiah. Halaman 11.
Husada, Y. (1996). Fisiologi dan Pemeriksaan Biokimiawi Hati dalam:
Soeparman. Ilmu Penyakit Dalam. Jilid 1. Edisi III. Jakarta: Balai Penerbit FKUI. Halaman 244- 37.
Hutapea, J.R. (1994). Inventaris Tanaman Obat Indonesia. Jakarta: Badan Penelitian dan Pengembangan Kesehatan. Halaman. 297.
Ichwan. (2003). Membuat Pakan Ayam Ras Pedaging. Cetakan I. Agromedia Pustaka Utama. Jakarta. Halaman 56.
52
Ikatan Dokter Anak Indonesia. (1994).Nefrologi Anak Jilid I. Jakarta: Fakultas Kedokteran Universitas Indonesia. Halaman 32.
Jones, L.M., Nicholson, H.B.,Leslie, E.M., Donald. (1997). Veterinary Pharmacology and Therapeutics.Edisi IV. New Delhi: Oxford and IBH Publishing. Halaman 1223-1232.
Jubb, K.V.F., Kennedy, P.C., dan Peter, C. (1993). Pathology of Domestic Animal. London: Academic Press. Halaman 325-327.
Juhriyyah, S. (2008). Gambaran Histopatologi Organ Hati Dan Ginjal Tikus Pada Intoksikasi Akut Insektisida (Metofluthrin, D-Phenothrin, D-Allethrin) Dengan Dosis Bertingkat. Skripsi. Bogor: Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Junqueira,L.C., dan Corneiro,J.(2005). Basic Histology Text and Atlas Edisi XI.
Jakarta: EGC. Halaman 71-75.
Klasseen, H. (2001). Casarett and Doull’s Toxicology. The Basic Science of Poison. Edisi VI.United States of America: McGraw-Hill. Halaman 38,87,91.
Lee, S.S.T., Butter, J.T.M., Pinaeu, T., Fernandez, S.P., danGonzalez, F.J. (1997). Role of CYP2E1 in the hepatotoxicity of acetaminophen.Journal BiologyChemical. 271:12063–12067.
Lefever, K.J. (2007). Pedoman Pemeriksaan Laboratorium dan Diagnosis, Edisi VI. Jakarta: EGC. Halaman 23.
Lu, F.C. (1995). Toksikologi Dasar : Asas, Organ, Sasaran, dan Penilaian Risiko,
diterjemahkan oleh Nugroho, E., Bustami,Z.S., dan Darmansjah, I. Edisi II. Jakarta: UI Press. Halaman 46, 92, 206-220.
Mardihusodo, H.(2011). Sitotoksisitas Campuran Ekstrak Etanol Daun KembangBulan (Tithonia diversifolia(Hemsley) A. Gray.) dan Rimpang Kencur (Kaempferia galanga L.) pada Sel Widr.Majalah Obat Tradisional 16 (3). Halaman 174.
Macfarlane, P.S., Reid, R., dan Callander. (2000). Pathology Illustrated. Toronto: Huerchill Livingstone. Halaman 342.
Menkes RI. (2007). Kepmenkes Nomor 381/MENKES/SK/III/2007 tentang kebijakan obat tradisional. Jakarta:Kementrian Kesehatan.Halaman 4. Michael.(2013). Pengaruh Ekstrak Metanol Daun Kesum (Polygonum
minusHuds.) Terhadap Peningkatan Kadar Kreatinin dan Ureum Serum Tikus Putih Galur WistarTerinduksi Sisplatin. Naskah Publikasi Skripsi.Pontianak: Program Studi Farmasi Fakulas Kedokteran Universitas Tanjung Pura. Halaman 6.
53
Murtini,J.T.,Priyanto, N.,dan Siregar,T.H.(2010).Toksisitas Subkronik Alginat pada Histopatologi Hati, Ginjal dan Lambung Mencit. Prosiding Universitas Brawijaya. Halaman 98.
Oktriana,N.H., dan Nurlela. (2011). Toksisitas Pemberian Berulang Infusa Pegagan (Centella asiatica (L.) Urb) Terhadap Tikus Jantan Galur Aprague-Dawley Tinjauan Terhadap Parameter Hematologis.Prosiding Seminar Nasional Sains dan Teknologi ke-2. Halaman 57.
OECD. (2008). Organization for Economic Cooperation and Development Guidelines for the Testing of Chemicals TG 407. Halaman 1-14.
Permatasari, P.(2013). Gambaran Histopatologi Hepar Dan Ginjal Pasca Pemberian Ekstrak Etanol Daun Kembang Bulan (Thitonia Diversifolia) (Studi Pada Tikus Putih Galur Wistar). Skripsi. Halaman 2.
Praptiwi, Wulansari, dan Chairul.(2010). Efek Toksisitas Ekstrak Pegagan (Centella asiatica Linn.) pada Organ dan jaringan mencit (Mus musculus).
Majalah Farmasi Indonesia 21 (1). Halaman 45-46.
Price, SA., dan Wilson L.M. (2006). Patofisiologi: Konsep Klinis Proses-Proses Penyakit. Edisi VI. Jakarta: ECG. Halaman 867- 75.
Priyanto. (2009). Toksikologi Mekanisme, Terapi Antidotum, dan Penilaian Resiko. Jakarta: Lembaga Studi dan Konsultasi Farmakologi Indonesia (LESKONFI). Halaman 1, 7, 8.
Purnomo, B. (2009). Dasar-dasar Urologi. Jakarta: Sagung Seto. Halaman 45-47. Rippey, J.J (1994). General Phatology. Perth Western Australia: Witwaesrand
University Press. Pages 19-31.
Sagita, A.A., Wahyuningsih, S.P.A., dan Husen, S.A. (2012). Uji Toksisitas Subkronik Polisakarida Krestin Dari Ekstrak Coriolus versicolor Terhadap Kadar ALT Mus musculus L. Artikel Karya Tulis Ilmiah. 87(3): 412-419.
Santoso,H., dan Nurliani, A. (2006). Efek Doksisiklin Selama Masa Organogenesis Pada Struktur Histologi Organ Hati dan Ginjal Fetus Mencit. Bioscientiae 3(1). Halaman 15-27.
Sibagariang, P.(2014). Skrining Fitokimia dari Beberapa Ekstrak Daun Kembang Bulan (Tithonia diversifolia (Hemsley) A.Gray).Skripsi.Medan:Fakultas Farmasi Universitas Sumatera Utara.Halaman 34.
54
Spector, W.G. (1993). Pengantar Patologi Umum. Yogyakarta: Gadjah Mada University Press. Halaman 30.
Sumarny,R., dan Soetjipto,A.(2011). The Effect of Administrastion of N-Hexne Extraxt of Kembang Bulan (Tithonia diversifolia (Hemsley) A.Gray)Leaf to Alloxan Diabetes Mice.International Conference. Halaman 212. Surasa, Ngudy J., Utami, Nur R., dan Isaneni, W.(2014). Struktur Mikroanatomi
Hati dan Kadar Kolesterol Total Plasma Darah Tikus Putih Starin Wistar Pasca Suplementasi Minyak Lemuru dan Minyak Kelapa Sawit.
Biosaintifika 6 (2). Halaman 6.
Syamsuni, H.A. (2006). Ilmu Resep. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 23, 32.
Syarif,R.A., Mae, Wahyuningsih, dan Mustofa.(2006). Aktivitas Antiplasmodium
In VitroEstrak Kembang Bulan (Tithonia diversifolia (Hemsley) A. Gray)terhadap Plasmodium falciparum.Yogyakarta:Fakultas Kedokteran Universitas Gadjah Mada. Halaman 7.
Suyanti, L. (2008). Gambaran Histopatologi Ginjal Tikus Pada Pemberian Fraksi Asam Amino Non Protein Lantara Nera (Acacia villosa) pada Uji Toksisitas Akut. Skripsi. Bogor: IPB.
Taofik., M.I., Yulianti E., Barizi A.,dan Hayati, E.K. (2010).Isolasi dan Identifikasi Senyawa Aktif Ekstrak Air Daun Paitan (Tithonia diversifolia
(Hemsley) A.Gray) Sebagai Bahan Insektisida Botani untuk Pengendalian Hama Tungau Eriophyidae.Alchemy VoLume II No I.Halaman 138.
Takutude,Rico.,Loho, Lilliy., dan Lintong,M.P.(2014). Gambaran Histopatologi Hati Tikus Wistar yang Diberikan Boraks. Jurnal e-Bimedil (eBM) volume II ,Nomor IV. Halaman 4.
Underwood, J.C.E. (1994). Cedera Hepar Akibat Obat. Editor: Sarjadi. Edisi Patologi Umum dan Sistemik Volume 2. Edisi II. Jakarta: EGC. Halaman 483.
Verawati.,Mimi A., Novicaresa, M.(2011). Aktifitas Anti Inflamasi Ekstrak Etanol Daun Kembang Bulan (Tithonia diversifolia. A. Gray) Terhadap Mencit Putih Betina. Scientia Vol. INo .I. Halaman 47.
Wicaksono, S. (2002). Efek Toksik dan Cara Menentukan Toksisitas Bahan Kimia. Jakarta: Departemen Kesehatan RI. Cermin Dunia Kesehatan No 135. Halaman 33.
Widjaja,S. (2010). Gangguan Faal (Fungsi) Hati yang Sering Dipertanyakan oleh Penderita. Diakses tanggal 10 September 2015.
55
106.
Widyaningrum, H., dan Tim Solusi Alternatif (2011). Kitab Tanaman Obat Nusantara. Yogyakarta: Media Pressindo. Halaman820-821.
Wirasuta, Gelgel M.A., Niruri,Rasmaya. (2007). Toksikologi Umum (Buku Ajar). Bali: Jurusan Farmasi Fakultas MIPA Universitas Udayana. Halaman 28.
26
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan penelitian yaitu pengumpulan tumbuhan, identifikasi tumbuhan, pembuatan simplisia, pembuatan ekstrak, pengamatan meliputi gejala toksik, berat badan,jumlah pakan kematian,makropatologi dan histopatologi organ hati dan ginjal, pengujian biokimia darah meliputi ALT dan kreatinin serta kemudian dilakukan analisis statistik.
3.1Alat dan Bahan
3.1.1Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas laboratorium, alat bedah (Wells spencer), alat destilasi, blender (Miyako), lemari pengering, neraca digital (Vibra), neraca hewan (Presica Geniweigher GW-1500), neraca kasar (ohaus), oral sonde,rotary evaporator (heidolph VV-300), sentrifuge dan spuit 1mL (Terumo).
3.1.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan tumbuhan dan bahan kimia. Bahan tumbuhan yang digunakan yaitu daun kembang bulan (Tithonia diversifolia (Hemsley) A. Gray). Bahan kimia yang digunakan yaitu akuades, CMC-Na, etanol 80%, formalin 10% dan natrium klorida 0,9%.
3.2 Hewan Percobaan
Hewan percobaan yang digunakan adalah mencit jantan dengan berat badan 20-30 g, berumur 2-3 bulan. Sebelum percobaan dimulai,
27
hewandiaklimatisasi di ruang percobaan selama lebih kurang 7 hari (Ditjen, POM., 2014). Hewandikelompokkan secara acak sedemikian rupa sehingga penyebaran berat badan merata untuk semua kelompok. Sebanyak 25 ekor mencit dibagi dalam 5 kelompok.
3.3 Penyiapan Sampel
3.3.1 Pengumpulan tumbuhan
Pengumpulan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Tumbuhan yang digunakan adalah daunkembang bulan (Tithonia diversifolia (Hemsley) A. Gray) yang diperoleh dari bumi perkemahanSibolangit Provinsi Sumatera Utara.
3.3.2 Identifikasi tumbuhan
Identifikasidaunkembang bulan (Tithonia diversifolia (Hemsley) A. Gray) dilakukan di Herbarium Medanense (MEDA), Universitas Sumatera Utara.
3.3.3 Pembuatan simplisia
Daun kembang bulan (Tithonia diversifolia (Hemsley) A. Gray) yang masih segar dipisahkan dari tangkainya, dicuci kemudian ditiriskan dan ditimbang beratnya sebagai berat basah (6500 g). Daun kemudian dikeringkan dalam lemari pengering hingga kering yang ditandai dengan sampel mudah dipatahkan, kemudian ditimbang kembali sebagai berat kering selanjutnya diblender dan ditimbang sebagai berat serbuk simplisia (750 g). Serbuk simplisia dimasukkan kedalam kantong plastik, diberi etiket dan disimpan di tempat yang sesuai.
3.4 Pembuatan Ekstrak Etanol Daun Kembang Bulan
Pembuatan EEDKBdilakukan secara maserasi menggunakan etanol 80%. Cara kerja:
28
Sebanyak 750 g serbuk simplisia daun kembang bulandimasukkan ke dalam bejana, kemudian dituangi dengan 5,5 liter etanol 80%. Ditutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, diserkai dan diperas. Ampas dicuci kembali dengan2 liter etanol 80%, dipindahkan ke dalam bejana tertutup, dibiarkan di tempat sejuk, terlindung dari cahaya selama 2 hari, selanjutnya disaring (Depkes, RI., 1979). Maserat etanol yang diperoleh diuapkan dengan menggunakan rotary evaporator ± 40oC sampai diperoleh ekstrak kental.
3.5 Pengujian Efek Toksisitas
Pengujian efek toksisitas meliputi pembuatan sediaan uji EEDKB, uji pendahuluan, pengujian toksisitas subkronik meliputi gejala toksik, perubahan berat badan,jumlah pakan, kematian hewan,makropatologi dan histopatologi organ ginjal dan hati dan pengukuran kadarALT dan kreatinin.
3.5.1 Pembuatan sediaan uji ekstrak etanol daun kembang bulan
Sediaan ujidibuat dengan konsentrasi 6 %, ditimbang ekstrak kemudian dimasukkan ke dalam lumpang, dan ditambahkan CMC-Na 0,5 % digerus hingga merata. Sediaan uji EEDKB dimasukkan ke dalam labu ukur, cukupkan dengan CMC-Na 0,5 % hingga dicapai batas volume.
3.5.2 Uji pendahuluan
Dosis pada uji toksisitas subkronik biasanya dipilih berdasarkan informasi yang diperoleh dari uji toksisitas akut, juga diusulkan suatu penelitian untuk menentukan rentang dosis. Ini dilakukan dengan memberikan tiga atau empat tingkat dosis selama 7 hari kepada hewan uji (Lu, 1995).
Sebanyak12 ekor mencit dibagi dalam 6 kelompok, setiap kelompok terdiri dari 2 ekor. Kelompok kontrol diberi CMC-Na 1% bb, kelompok perlakuan
29
diberi EEDKB dosis250, 500, 1000, 1500,3000mg/kgbb secara oral selama 7 hari dan dilakukan pengamatan.
3.5.3Pengujian toksisitas subkronik
Berdasarkan hasil uji pendahuluan maka didapatkan dosis untuk dilakukan pengujian toksisitas subkronik. Mencit dikelompokkan menjadi 5 kelompok, masing-masing terdiri dari 5 ekor mencit yaitu: kelompok kontrol (1) dan kelompok perlakuan (2-5).
-Kelompok 1: kontrol, diberi CMC-Na 1% bb - Kelompok 2: diberi EEDKB dosis 250 mg/kg bb - Kelompok 3: diberi EEDKB dosis 500 mg/kg bb - Kelompok 4: diberi EEDKB dosis 750 mg/kg bb - Kelompok 5: diberi EEDKB dosis 1000 mg/kg bb
3.5.4Pengamatan
Penimbangan mencit dilakukan pada hari ke-0 kemudian pada hari ke-1 diberi sediaan uji secara oral setiap hari selama 28 hari dan dilakukan pengamatan (Ditjen, POM., 2014).
3.5.4.1Gejala toksik
Pengamatan terjadinya gejala-gejala toksik dan gejala klinis yang berupaperubahan kulit, bulu, sekresi, ekskresi,perubahan cara jalan, tingkah laku yang aneh (misalnya berjalan mundur),kejang dsb, dilakukan setiap hari selama 28 hari (Ditjen, POM., 2014).
3.5.4.2Berat badan
Mencit ditimbang setiap hari selama 28 hari untuk menentukan volume sediaan uji yang diberikan. Perubahan berat badan dianalisis setiap minggu. Pada akhir penelitian, hewan yang masih hidup ditimbang dan diotopsi (OECD, 2008).
30
3.5.4.3Jumlah pakan
Jumlah makanan yang dikonsumsi ditimbang dan diamati dua hari sekali (Ditjen, POM., 2014)
3.5.4.4Kematian hewan
Kematian mencit diamati dari hari pertama sampai hari terakhir dan mencit yang mati selama waktu pemberian sediaan uji segera diotopsi (Hendriani, 2007; Klasseen, 2001).
3.5.4.5Pengukuran kadar ALT dan kreatinin
Pada akhir periode pemberian sediaan uji semua mencit yang masih hidup diotopsi.Hewan dibunuh dengan melakukan dislokasi leher,kemudian selagi jantung masih berdenyut darah diambil melalui jantung (intra cardiac) secara perlahan-lahan menggunakan alat suntik steril sebanyak 1-3 mL. Sebanyak 1mL darah dimasukkan kedalam tabung mikrosentrifuge dan didiamkan pada suhu kamar selama 10 menit, kemudian dipindahkan kedalam tangas es dan segera disentrifuge selama 10 menit dengan kecepatan 3000 rpm.Serum dipisahkan dan disimpan dalam lemari beku(OECD, 2008; Sagita, dkk., 2012; Ditjen, POM., 2014). Kadar ALT dan kreatininselanjutnya diperiksa di Balai Laboratorium Kesehatan, Dinas Kesehatan Propinsi Sumatera Utara.
3.5.4.6Makropatologi
Mencit yang mati segera diotopsi dan dilakukan pengamatan (OECD, 2008). Pengamatan meliputi warna, permukaan dan konsistensi organ hati secara visual (Anggraini, 2008; Praptiwi,2010)
3.5.4.7Histopatologi organ ginjal dan hati
Selanjutnya diambil organ hati dan ginjal kemudian dicuci dengan larutan fisiologis 0,9% kemudian dimasukkan dalam larutan dapar formaldehida
31
10% dan hasilnya dilihat di bawah mikroskop (OECD, 2008; Hendriani, 2007).Pembuatan preparat histopatologi dilakukan di rumah sakit Murni Teguh.
3.5.5 Analisis statistik
Pengamatan berat badan,jumlah pakan danpengukuran ALT dan kreatinin dianalisisnormalitasnya terlebih dahulu menggunakan Shapiro- Wilk . Apabila data terdisribusi normal diuji dengan one-way analysis of variance (ANOVA) dan dilanjutkan dengan uji Tukey. Apabila data tidak terdistribusi normal diuji dengan
Kruskall-Wallis Hdan dilanjutkan dengan Mann-Whitney U. Pengujian dilakukan menggunakan program Statistic Product and Service Solutions (SPSS) versi 22.
32
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense (MEDA), Universitas Sumatera Utara Medan, disebutkan sampel yang digunakan adalah tumbuhan daunkembang bulan (Tithonia diversifolia (Hemsley) A. Gray) suku Asteraceae. Hasil identifikasi dapat dilihat pada Lampiran 1 dan gambar tumbuhan pada Lampiran 2.
4.2 Hasil Ekstraksi Serbuk Daun Kembang Bulan
Pembuatan ekstrak dilakukan dengan metode maserasi menggunakan pelarut etanol 80%. Hasil maserasi dari 750 g serbuk simplisia diperoleh ekstrak kental 71 g (randemen 9,466 %).
4.3 Hasil Uji Pendahuluan
Hasil uji pendahuluan selama 7 hari ditemukan adanya gejala toksik dan kematian pada dosis 1500 dan 3000 mg/kgbb. Tidakada perbedaan yang signifikan antara kenaikan berat badan dengan pemberian EEDKB (p > 0,05) pada kelompok kontrol maupun kelompok perlakuan dosis 250, 500, 1000, 1500 dan 3000 mg/kg bb. Hasil uji pendahuluan dapat dilihat pada Lampiran 7.
4.4 Hasil Pengujian Toksisitas Subkronik
Dari hasil uji pendahuluan EEDKB didapatkan dosis untuk pengujian toksisitas subkronik yaitu 250, 500, 750 dan 1000 mg/kg bb. Pengamatan dilakukan selama 28 hari meliputi gejala toksik, berat badan, jumlah pakan, kematian hewan, kadar ALT dan kreatinin, makropatologi dan histopatologi organ
33 hati dan ginjal.
4.4.1 Hasil pengamatan gejala toksik
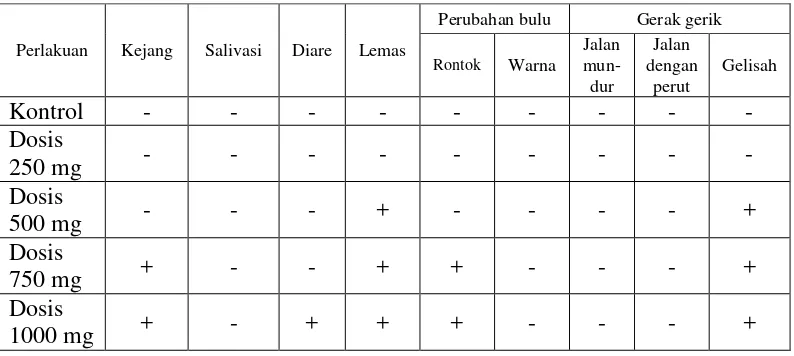
Hasil pengamatan yang dilakukan setiap hari selama 28 hari terhadap adanya kejang, salivasi, diare, lemas, perubahan bulu, gerak-gerik hewan seperti berjalan mundur dan berjalan dengan perut dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil pengamatan gejala toksik
Perlakuan Kejang Salivasi Diare Lemas
Perubahan bulu Gerak gerik
Rontok Warna
Pada Tabel 4.1 terlihat bahwa pemberian EEDKB tidak ditemukan adanya gejala toksik pada kelompok kontrol dan dosis 250 mg/kg bb. Pada dosis 500 mg/kg bb terdapat gejala toksik yaitu lemas dan gelisah sedangkan pada dosis 750 dan 1000 mg/kg bb ditemukan gejala toksik yaitu terjadi kejang, lemas,gelisah dan perubahan bulu pada mencit.
Sifat toksik dari suatu senyawa sangat ditentukan oleh dosis. Kenaikan dosis biasanya akan menyebabkan lebih banyak sistem organ yang dikenai dan akan memberikan efek kerja yang jauh berbeda. Jumlah individu yang menunjukkan efek toksik atau efek terapetik tergantung dari dosisnya.Setelah dosis berada pada dosis toksik maka zat tersebut dapat menimbulkan keracunan (Wirasuta dan Niruni, 2007).
Setiap zat biladiberikan pada dosis yangcukupbesar akan menimbulkan
34
gejala-gejala toksik (Ganiswara, 1995).Makin besar dosis yang diberikan makin besar efek toksik yang timbul (Lu, 1995). Tanda toksik yang muncul pada organ dan sistem antara lain : pada sistem gastrointestinal meliputi melemas, diare, salivasi, keluar air seni, pada perilaku meliputi sedasi, gelisah, depresi berat, sikap agresif atau defensif, ketakutan, bingung , aktivitas yang aneh,dll (Lu, 1995).
4.4.2 Hasil pengamatan berat badan
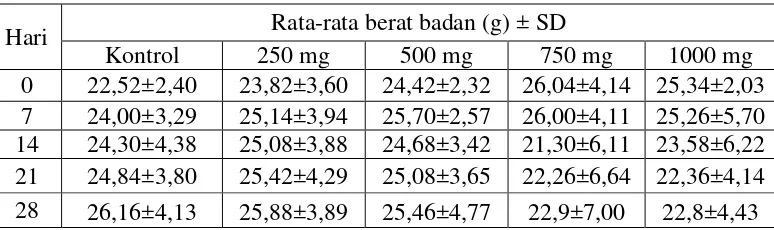
Penimbangan berat badan dilakukan setiap hari dari hari 0 sampai hari ke 28 untuk menentukan volume sediaan yang diberikan, sedangkan yang dianalisis secara statistik dilakukan seminggu sekali. Hasil pengamatan rata-rata berat badan dapat dilihat pada Tabel 4.2 di bawah ini:
Tabel 4.2 Hasil rata-rata berat badan
Hari Rata-rata berat badan (g) ± SD
Kontrol 250 mg 500 mg 750 mg 1000 mg
0 22,52±2,40 23,82±3,60 24,42±2,32 26,04±4,14 25,34±2,03 7 24,00±3,29 25,14±3,94 25,70±2,57 26,00±4,11 25,26±5,70 14 24,30±4,38 25,08±3,88 24,68±3,42 21,30±6,11 23,58±6,22 21 24,84±3,80 25,42±4,29 25,08±3,65 22,26±6,64 22,36±4,14 28 26,16±4,13 25,88±3,89 25,46±4,77 22,9±7,00 22,8±4,43
Berdasarkan hasil uji statistik pengamatan berat badan pada minggu pertama diketahui tidak terdapat perbedaan yang signifikan dari setiap kelompok perlakuan setelah pemberian EEDKB (sig. 0,947; p > 0,05). Hasil uji statistik pada minggu kedua pengamatan berat badan, tidak terdapat perbedaan yang signifikan dari setiap kelompok perlakuan setelah pemberian EEDKB (sig. 0,765; p > 0,05), pada perlakuan dosis 750 dan 1000 mg/kg bb terdapat kematian hari ke 12 dan dosis 1000 mg/kg bb pada hari ke-11 dan ke-14.
Hasil uji statistik berat badan mencit pada minggu ketiga menunjukkan masih tidak terdapat perbedaan signifikan dari setiapkelompok perlakuan setelah
35
pemberian EEDKB (sig. 0,695; p > 0,05). Terdapat kematian pada hari ke-16 pemberian dosis 750 mg/kg bb dan hari ke-17 dosis 1000 mg/kg bb.
Analisis data berat badan mencit minggu keempat menunjukkan tidak terdapat perbedaan yang signifikan antar kelompok perlakuan (sig. 0,700; p > 0,05). Pada pemberian dosis 500 mg/kg bb terjadi kematian pada hari ke-26.
Parameter yang merupakan indikator sensitif untuk mengetahui toksisitas yaitu gejala klinis dan berat badan. Hewan uji diamati setiap hari untuk gejala klinis dan berat badan diukur secara berkala (Gupta dan Bhardwaj, 2012).
Berdasarkan pengamatan selama 28 hari dan analisis data yang dilakukan setiap minggunya, dapat diketahui bahwa EEDKB tidak memberikan pengaruh terhadap perubahan kenaikan berat badan secara signifikan (p > 0,05), akan tetapi pada beberapa mencit yang mengalami kematian yaitu pada dosis 500,750 dan 1000 mg/kg bb diamati adanya penurunan berat badan sebelum terjadinya kematian.
Hal tersebut menunjukkan adanya pengaruh berat badan terhadap efek toksik, dimana berkurangnya pertambahan berat badan merupakan indeks efek toksik yang sederhana namun sensitif (Lu, 1995).
4.4.3 Hasil pengamatan jumlah pakan
Jumlah asupan makanan dan minuman merupakan salah satu faktor utama yang dapatmempengaruhi perkembangan berat badan (Oktriana dan Nurlaela, 2011). Hasil pengukuran asupan makanan menunjukkan bahwa kelompok kontrol dan dosis 250 mg/kg bb memiliki nilai asupan makanan rata-rata terbesar dibandingkan kelompok perlakuan lainnya, sedangkan kelompok perlakuan dosis 1000 mg/kg bb memiliki nilai asupan makanan rata-rata terendah dibandingkan kelompok perlakuan yang lain.
36
Jumlah pakan yang diberikan pada mencit, diamati setiap 2 hari sekali. Hasil pengamatan jumlah pakan dapat dilihat pada Tabel 4.3.
Tabel 4.3 Hasil pengamatan jumlah pakan
Hari Jumlah pakan (g)
Hasil statistik rata-rata asupan makanan menunjukkan nilai signifikansip<0,05 yang menyatakan terdapat perbedaan yang signifikan terhadap jumlah pakan yang dikonsumsi oleh mencit selama 28 hari pengamatan. Hasil dari Post Hoc Test dengan menggunakan uji Tukey menunjukkan bahwa perbedaan yang signifikan terdapat antara perlakuan dosis 750 dan 1000 mg/kg bb terhadap kelompok kontrol (p<0,05), sedangkan pada perlakuan dosis 250 dan 500 mg/kg bb tidak terdapat perbedaan yang signifikan jumlah pakan mencit terhadap kontrol (p>0,05). Dengan demikian pemberian EEDKB memberikan pengaruh terhadap jumlah pakan mencit jantan. Salah satu metabolit sekunder yang dimiliki kembang bulan adalah tanin. Tanin adalah senyawa polifenol yang bersifat terhidrolisa dan kental. Senyawa ini telah dikembangkan oleh tanaman sebagai bentuk pertahanan terhadap serangan eksternal dari predator yang memiliki rasa
37 sangat pahit atau kelat (Hagerman, 2002)
Kekurangan protein dalam ransum dapat mengakibatkan terhambatnya pertumbuhan. Secara umum penambahan berat badan akan dipengaruhi oleh jumlah konsumsi pakan yang dimakan dan kandungan nutrisi yang terdapat dalam pakan tersebut (Ichwan, 2003). Konsumsi makanan juga merupakan indikator yang berguna, konsumsi makanan yang nyata berkurang dapat menimbulkan efek yang mirip atau memperberat manifestasi toksik zat kimia tersebut (Lu, 1995).
4.4.4 Hasil pengamatan kematian
Mencit yang mati selama waktu pemberian sediaan uji dapat dilihat pada Tabel 4.4.
Tabel 4.4 Hasil pengamatan kematian
.
Tabel 4.4 menunjukkan bahwa pada kelompok kontrol dan 250 mg/kg bb tidak ada mencit yang mati selama waktu pemberian sediaan uji, sedang pada dosis 500 mg/kg bb jumlah mencit yang mati 1 ekor (pada hari ke-26), dosis 750 mg/kg bb 2 ekor(pada hari ke- 12 dan 16) dan dosis 1000 mg/kg bb 3 ekor (pada hari ke- 11, 14 dan 17).Hal tersebut dikarenakan pemberian EEDKB setiap hari selama 28 hari pada berbagai tingkat dosis.Suatu zat pada dasarnya bersifat racun dan terjadinya keracunan ditentukan oleh dosis dan cara pemberian namun dosis merupakan faktor utama yang terpenting (Ganiswara, 1995).
Pemberian EEDKB selama 28 hari juga menyebabkan terjadi kerusakan organ yang dapat menyebabkankematian pada mencit. Penelitian sebelumnya
Kelompok Jumlah mencit Jumlah kematian
38
menunjukkan bahwa ekstrak etanol kembang bulan memiliki efek sitotoksik pada sel yang membelah dengan cepat (Elufioye, et al., 2008).Pemberian ekstrak etanol kembang bulan untuk pengujian antimalaria juga menunjukkan bahwa jumlah rata-rata mencit yang bertahan pada pemberian dosis berulang kelompok perlakuan lebih rendah dibandingkan kontrol (Elufioye and Agbedahunsi,2004). Uji toksisitas ekstrak kembang bulan dengan pemberian dosis tunggal juga menunjukkan adanya efek toksik akut dan reversibel pada hati dan ginjal , (Elufioye, et al., 2008).
Kandungan senyawa metabolit sekunder dalam EEDKB juga merupakan penyebab kematian mencit. Alkaloid cukup toksik sehingga pemberian dalam jumlah yang besar dapat menyebabkan kematian (Elya, dkk., 2010).
Efek toksik merupakan efek yang sangat berbahaya dan dapat menyebabkan kematian. Efek toksik suatu zat dipengaruhi oleh zatnya, target organ, besar dosis dan kondisi fisiologi membran biologi yang terpapar (Priyanto, 2009).
4.4.5 Hasil pengukuran kadar ALT dan kreatinin
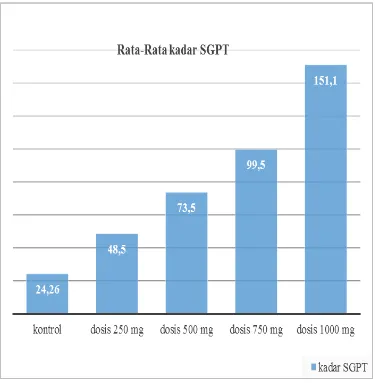
Pengukuran kadar ALTdan kreatinin dilakukan pada hari ke 29, hasil rata-rata kadar ALT dan kreatinin dapat dilihat pada Lampiran 9. Grafik rata-rata-rata-rata kadar ALTdapat dilihat pada Gambar 4.1, sedangkan kadar kreatinin dpat dilihat pada Gambar 4.2.
Pada Gambar 4.1 terlihat bahwa kadar ALT meningkat seiring peningkatan dosis. Berdasarkan hasil analisis statistika terdapat perbedaan yangsignifikan antara kelompok perlakuan dan kontrol (p < 0,05). Pada kelompok kontrol rata-rata kadar ALT (24,26IU/L), dosis 250 mg/kg bb (48,5IU/L),
39
dosis500 mg/kg bb (73,5IU/L), terlihat hasil rata-rata kadar ALT dari ketiga perlakuan
Gambar 4.1 Grafik rata-rata hasil pengukuran kadar ALT
tersebut masih dalam batas normal.Pada dosis 750 mg/kg bb (99,5IU/L) dan dosis 1000 mg/kg bb (151,1IU/L), rata-rata kadar ALTkelompok tersebut di atas batas normal. Kadar ALT darah mencit normal adalah 17–77 IU/L(Anonymous, 2009).
GPT dan GOT merupakan indikator yang kuat dan peka terhadap kelainan sel –sel hati. Enzim glutamate piruvat transaminase (GPT)/ALT merupakan enzim sitosol yang sebagian besar terdapat di dalam hati, jantung dan otot. Enzim ini sebagai indikator yang lebih spesifik untuk kerusakan sel-sel hati dibandingkan
40
GOT, karena GOT merupakan enzim mitokondria ada dalam jumlah besar di jantung, hati otot rangka dan ginjal, jika kadardalam jantung hati, ALT tinggi ada indikasi terjadi kerusakan sel di dalam hati (Murtini, dkk.,2010; Widjaja,2010).
Gambar 4.2 Grafik rata-rata hasil pengukuran kadar kreatinin
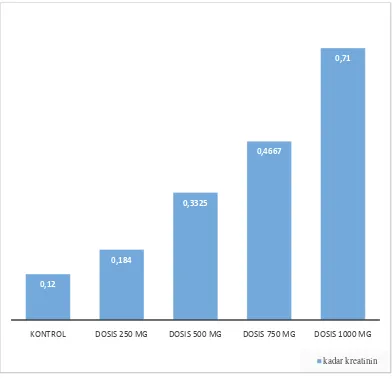
Pada Gambar 4.2 terlihat bahwa kadar kreatinin juga meningkat seiring peningkatan dosis. Berdasarkan hasil analisis statistika terdapat perbedaan yang signifikan antara kelompok perlakuan terhadap kontrol (p < 0,05).Pada kelompok kontrol rata-rata kadar kreatinin (0,12 mg/dL), dosis 250 mg/kg bb (0,184 mg/dL) ,dosis 500 mg/kg bb (0,33 mg/dL), dosis 750 mg/kg bb (0,47 mg/dL) dan dosis
0,12
0,184
0,3325
0,4667
0,71
KONTROL DOSIS 250 MG DOSIS 500 MG DOSIS 750 MG DOSIS 1000 MG
kadar kreatinin
41
1000 mg/kg bb (0,71 mg/dL). Terlihat kadar rata-rata kreatinin dari seluruh kelompok masih ada dalam batas normal, nilai kreatinin pada mencit yang sehat berada dalam rentang 0,2-0,9 mg/dL (Anonymous, 2009).
Analisis biokimia yang dapat dilakukan untuk mendeteksi fungsi ginjal yaitu kadar kreatinin dan ureum. Kreatinin serum secara khusus berguna dalam mengevaluasi fungsi glomerulus. Kreatinin serum dinilai lebih sensitif dan merupakan indikator penyakit ginjal yang lebih spesifik. Kreatinin ini kemudian meningkat dan tidak dipengaruhi diet atau masukan cairan(Lefever, K.J., 2007).
Kelemahan kadar kreatinin sebagai parameter fungsi ginjal yaitu peningkatannya dalam darah terjadi jika laju filtrasi glomerulus (LFG) telah menurun dibawah 70 % dari normal, sehingga tidak dapat digunakan untuk mendeteksi kerusakan ginjal dini (IDAI, 1993). Kadar kreatinin dan ureum bukanlah satu-satunya indikator kerusakan ginjal, tetapi perlu dikonfirmasi lagi dengan histologi jaringan ginjal (Michael,2013).
4.4.6 Hasil pengamatan makropatologi
Perubahan warna menjadi salah satu parameter terjadinya efek toksik yang bertujuan mendapatkan informasi mengenai toksisitas zat uji yang berkaitan dengan organ sasaran dan efek terhadap organ tersebut (Lu, 1995).
Kriteria normal pada organ bila tidak ditemukan perubahan warna, perubahan struktur permukaan dan perubahan konsistensi (Anggraini, 2008). Tidak terlihat adanya perubahan warna hati dan ginjal pada kelompok kontrol dan dosis 250 mg/kg bb warna organ merah kecoklatan, permukaan licin dan konsistensi kenyal.
Hasil pengamatan makropatologi meliputi pengamatan warna, permukaan
42
dan konsistensi organ hati dan ginjal.Hasil pengamatan makropatologi hati dan ginjal dapat dilihat pada Tabel4.5 dan Tabel 4.6 berikut:
Tabel 4.5 Hasil pengamatan makropatologi hati
Tabel 4.6 Hasil pengamatan makropatologi ginjal
Kelompok Pengamatan
Warna Permukaan Konsistensi
Kontrol Merah kecoklatan Licin Kenyal
Dosis 250 mg Merah kecoklatan Licin Kenyal
Dosis 500 mg Merah bata Licin Kenyal
Dosis 750 mg Merah bata Tidak licin Kenyal Dosis 1000 mg Merah bata,pucat Tidak licin Kenyal
Perubahan warna menjadi merah bata terjadi pada hati dan ginjal dosis 500 dan 750 mg/kg bb. Pada dosis 1000 mg/kg bb warna hati dan ginjal menjadi lebih pucat. Menurut Tang dalam Praptiwi (2010) Perubahan yang terjadi pada organ akibat pemberian ekstrak pegagan disebabkan adanya kandungan kimia pada ekstrak tersebut, misalnya saponin, turunan triterpenoid (asam asiastika, dan asam brahmida) dan ion potasium (K), sedangkan ekstrak kembang bulan juga memiliki kandungan saponin dan triterpenoid. Saponin yang merupakan salah satu kandungan ekstrak kembang bulan dapat menyebabkan hemolisis dan menurunkan tekanan permukaan sehingga dapat mengakibatkan kerusakan pada sel dan jaringan otot, pendarahan pada sinusoid, nekrosis pada tubuli dan juga adanya perubahan warna pada organ (Praptiwi,2010).
4.4.7 Hasil histopatologi organ hati dan ginjal
Kelompok Pengamatan
Warna Permukaan Konsistensi
Kontrol Merah kecoklatan Licin Kenyal
Dosis 250 mg Merah kecoklatan Licin Kenyal
Dosis 500 mg Merah bata Licin Kenyal
Dosis 750 mg Pucat Licin Kenyal
Dosis 1000 mg Pucat Tidak licin Tidak kenyal
43
Organ hati dan ginjal pada mencit yang mati segera diambil dan pada akhir periode pemberian sediaan uji, semua mencit yang masih hidup diotopsi. Organ hati dan ginjal diambil kemudian dibuat menjadi preparat histopatologi dan selanjutnya dilihat kerusakan jaringan di bawah mikroskop.
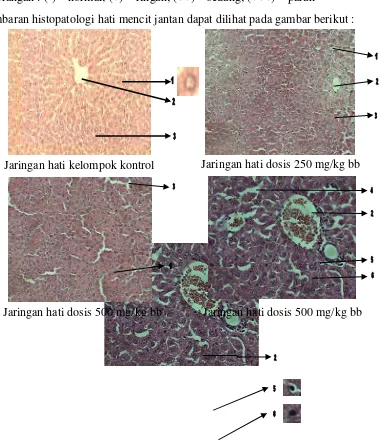
Tabel 4.7 Hasil histopatologi organ hati
Keterangan : (-) = normal; (+) = ringan; (++) = sedang; (+++) = parah
Gambaran histopatologi hati mencit jantan dapat dilihat pada gambar berikut : Kelompok Jenis kerusakan hepatosit Pelebaran
sinusoid Degenerasi hidropik Nekrosis
Kontrol - - -
Dosis 250 mg - - -
Dosis 500 mg - - Melebar
Dosis 750 mg ++ + Melebar
Dosis 1000 mg + +++ Melebar
Jaringan hati kelompok kontrol Jaringan hati dosis 250 mg/kg bb
Jaringan hati dosis 500 mg/kg bb Jaringan hati dosis 500 mg/kg bb
44
Gambar 4.3Jaringan hati mencit (perbesaran 40 x10)
Keterangan : 1 = hepatosit, 2 =vena sentral, 3=sinusoid, 4 = pelebaran sinusoid, 5 = degenerasi hidropik, 6 = nekrosis
Tabel 4.7 menunjukkan bahwa pada kelompok kontrol dan dosis 250 mg/kg bb tidak terdapat kerusakan pada jaringan hati mencit jantan. Pada dosis 500 mg/kg bb mulai terjadi kerusakan ditandai dengan adanya pelebaran sinusoid, sedangkan pada dosis 750 dan 1000 mg/kg bb kerusakan yang terjadi pada jaringan ginjal mencit jantan semakin parah ditandai dengan adanya pelebaran sinusoid, degenerasi hidropik dan terdapatnya nekrosis.
Berdasarkan gambar di atas dapat dilihat bahwa kelompok kontrol dan 250 mg/kg bb menunjukkan gambaran histopatologi masih dalam keadaan normal yaitu dengan menunjukkan hepatosit tersusun secara radial dalam lobulus hati. Celah antara lempeng-lempeng ini mengandung sinusoid-sinusoid kapiler yang dinamakan sinusoid hati. Sinusoid merupakan pembuluh yang melebar tidak teratur dan hanya terdiri atas satu lapisan endotel yang tidak kontinyu (Junqueira dan Corneiro, 2005). Pada dosis 500 mg/kg bb tampak sinusoid yang tidak utuh lagi, sedangkan pada dosis 750 dan 1000 mg/kg bb telah terjadi pelebaran sinusoid, degenerasi hidropik dan nekrosis pada sebagian hepatosit. Hal ini sesuai dengan teori yang mengatakan bahwa akumulasi bahan toksik dan metabolit lain menyebabkan degenerasi sel (Tatukude, dkk., 2014).
Menurut Rippey (1994) zat yang memiliki sifat toksik akan menyebabkan gangguan pada organel mitokondria yang menghasilkan energi Adenosin Triposphat (ATP) dan ATP tersebut dibutuhkan untuk berjalannya pompa natrium (Na+). Apabila tidak ada ATP maka Na+ yang ada dalam sel tidak akan keluar dari sel. Dimana Na+ memiliki sifat menarik air. Hal ini menyebabkan
Jaringan hati dosis 1000 mg/kg bb
45
terganggunya permeabilitas sel sehingga cairan yang ada di ekstrasel akan masuk ke dalam intrasel dalam jumlah yang banyak yang mengakibatkan terbentuknya vakuola yang jernih, kecil dan banyak. Vakuola-vakuola yang tersebar bersatu membentuk vakuola yang lebih besar atau vakuola tunggal yang menempati di dalam sitoplasma dan menggantikan inti sel serta terjadinya pembengkakan sel sehingga terjadilah degenerasi hidropik (Chang, 1986).
Degenerasi hidropik merupakan respon awal sel terhadap bahan-bahan yang bersifat toksik, serta merupakan proses awal dari kematian sel (Jones, et al.,
1997; Cheville, 1999). Kerusakan sel secara terus-menerus akan mencapai suatu titik sehingga terjadi kematian sel. Kematian sel ada dua macam yaitu nekrosis dan apoptosis, nekrosis ditandai dengan pembengkakan sel,kebocoran, kehancuran inti sel dan aliran dari sel-sel inflamasi (Klassen,2001). Lu (1995) mengatakan bahwa jika sebuah sel hati mendapat paparan zat yang dicurigai toksik secara terus menerus, maka akan mengganggu metabolisme hati yang akhirnya menyebabkan kerusakan mikroanatomi hati berupa nekrosis hati. Nekrosis hati adalah kematian hepatosit yang umumnya merupakan kerusakan akut.
Gambaran histopatologi pada dosis 500, 750 dan 1000 mg/kg bb meunnjukkan adanya pelebaran sinusoid. Menurut Junqueira dan Carneiro (1998) melebarnya sinusoid terjadi karena toksikan pada sel hati mudah berkontak dengan sinusoid. Melebarnya sinusoid disebabkan karena penyaluran aliran darah yang kuat dan rusaknya sel hati yang diakibatkan toksikan, dimana dinding sinusoid yang terdiri dari sel-sel endotel yang membentuk lapisan tidak utuh. Yang membatasi sel hati dan sinusoid adalah celah subendotel yang mengandung mikrovilli dari sel hati. Hal ini memudahkan kontak langsung antara permukaan
46
sel hati dan sinusoid sehingga memudahkan terjadinya pertukaran makromolekul termasuk toksikan. Toksikan pada sel hati yang rusak akan mudah berkontak dengan sinusoid, dan apabila konsentrasi toksikan tinggi maka akan menyebabkan pelebaran sinusoid (Surasa, dkk., 2014).
Tabel 4.8 menunjukkan bahwa pada kelompok kontrol dan dosis 250 mg/kg bb tidak terdapat kerusakan pada jaringan ginjal mencit jantan. Pada dosis 500 mg/kg bb mulai terjadi kerusakan yaitu adanya pelebaran ruang bowman, sedangkan pada dosis 750 dan 1000 mg/kg bb kerusakan yang terjadi pada jaringan ginjal mencit jantan semakin parah ditandai dengan adanya pelebaran ruang bowman, pelebaran sinusoid dan nekrosis.
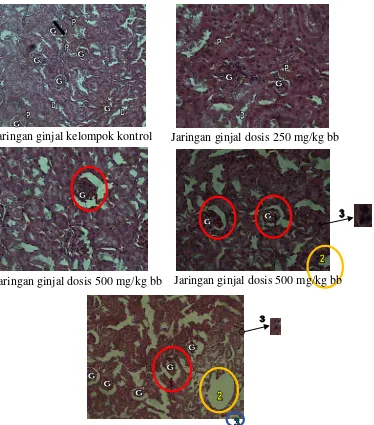
Tabel 4.8 Hasil histopatologi organ ginjal
Keterangan : (-) = normal; (+) = ringan; (++) = sedang; (+++) = parah
Gambaran mikroskopis ginjal selama penelitian dapat dilihat pada Gambar 4.4, pada kelompok kontrol dan dosis 250 mg/kg bb jaringan ginjal tampak normal (Gambar 4.8 dan 4.9). Pada perlakuan dosis 500 mg/kg bb telah terjadi pelebaran ruang bowman sedangkan pada dosis 750 dan 1000 mg/kg bb terjadi kerusakan ginjal yang ditandai adanya pelebaran lumen tubulus, pelebaran ruang bowman dan kematian sel (nekrosis).
Pelebaran ruang bowman diakibatkan atrofi glomerolus, yaitu menurunnya ukuran jaringan yang disebabkan oleh berkurangnya jumlah sel atau berkurangnya ukuran sel (Spector, 1993). Kerusakan ini menyebabkan
Kelompok Pelebaran ruang bowman
Pelebaran
lumen tubulus Nekrosis
47
terganggunya proses filtrasi darah. Jika kemampuan menyaring darah berkurang, maka sel darah dan protein dapat keluar bersama urin atau malah tertimbun pada tubulus karena dapat lolos pada proses filtrasi (Hasnisa, dkk., 2014).
Ginjal menghasilkan urin yang merupakan jalur utama peneluaran zat-zat toksik. Ginjal merupakan organ sasaran utama dari efek toksik karena ginjal mempunyai volume aliran darah yang tinggi, mengkonsentrasikan zat-zat toksik pada filtrat glomerolus dan membawanya melalui sel tubulus, serta mengaktifkan toksikan tertentu (Santoso dan Nurliani,2006).
Gambaran histopatologi ginjal dapat dilihat pada gambar berikut:
Jaringan ginjal kelompok kontrol Jaringan ginjal dosis 250 mg/kg bb
Jaringan ginjal dosis 500 mg/kg bb Jaringan ginjal dosis 500 mg/kg bb
Jaringan ginjal dosis 1000 mg/kg
48
Gambar 4.4Jaringan ginjal mencit (perbesaran 40 x10)
Keterangan : G = glomerolus, P = tubulus proksimal, D = tubulus distal, 1 = pelebaran ruang bowman, 2 = pelebaran lumen tubulus, 3 = nekrosis
Bila ginjal bekerja terlalu berat, maka sel mengalami kerusakan yang irreversibel dan menyebabkan kematian sel. Perubahan ini sesuai dengan pendapat Himawan (1992) yang menyatakan bahwa zat kimia yang terlalu banyak dalam ginjal diduga akan mengakibatkan kerusakan sel (Soepaptini, dkk., 2012). Kerusakan sel-sel epitel tubulus yang mengalami kontak langsung dengan bahan yang direabsorbsi dapat mengakibatakan terjadinya degenerasi maupun nekrosis pada sel ginjal (Cotran, 2007).
Hati dan ginjal memiliki kapasitas yang besar dalam mengikat senyawa kimia. Kedua organ ini mungkin memiliki konsentrasi toksikan yang lebih banyak dibandingkan seluruh organ lainnya (Klassen, 2001). Sel-sel endotelium pada sinusoid hati dan kapiler peritubular ginjal memiliki saluran yang lebih luas (diameter 50-150 nm) yang memungkinkan lewatnya bahkan ikatan-protein xenobiotik. Hal ini yang menyebabkan akumulasi zat-zat kimia pada hati dan ginjal (Klassen, 2001).
49
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka kesimpulan dari penelitian ini adalah:
a. EEDKBpada kelompok kontrol dan dosis 250 mg/kg bb tidak berpengaruh terhadap gejala klinis sedang dosis 500, 750 dan 1000 mg/kg bb berpengaruh pada mencit jantan.
b. EEDKB sampai dengan dosis 1000 mg/kg bb tidak berpengaruh secara signifikan terhadap berat badan mencit jantan, namun terjadi penurunan berat badan kepada mencit yang mengalami kematian.
c. EEDKB memberikan pengaruh terhadap jumlah pakan mencit jantan pada dosis 750 dan 1000 mg/kg bb.
d. EEDKBpada kelompok kontrol dan dosis 250 mg/kg bb tidak memberikan efek pada organ hati dan ginjal mencit jantan, sedangkan pada dosis 500,750 dan 1000 mg/kg bb memberikan efek pada hati dan ginjal mencit jantan.
e. EEDKB pada dosis 250 mg/kg bb tidak toksik sedang dosis 500,750 dan 1000 mg/kg bb toksik terhadap mencit jantan.
5.2Saran
Disarankan untuk peneliti selanjutnya untuk:
a. Melakukan ujitoksisitas kronikEEDKBpada organ hati, ginjal dan jantung b. Melakukan uji toksisitas khusus EEDKBseperti teratogenik dan karsinogenik. c. Meneliti lebih lanjut kandungan dari kembang bulan yang dapat menimbulkan
efek toksik.
6
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
2.1.1 Habitat dan daerah tumbuh
Tumbuhan kembang bulan (Tithonia diversifolia (Hemsley) A. Gray)umumnya tumbuh liar di tempat-tempat curam, misalnya di tebing-tebing, tepisungai dan selokan. Tumbuhan ini sekarang banyak ditanam sebagai tanamanhias karena warna bunganya yang kuning indah dan sebagai pagar untukmencegah kelongsoran tanah. Termasuk tumbuhan tahunan yang kerap tumbuhdi tempat terang dan banyak sinar matahari langsung. Tumbuh dengan mudahdi tempat atau di daerah berketinggian 5-1500 m di atas permukaan laut(Anonim, 2012).
2.1.2 Morfologi
Tumbuhan kembang bulan merupakan tumbuhan perdu yang tegakdengan ketinggian lebih kurang 5 m. Batang tegak, bulat, berkayu, danberwarna hijau. Daunnya tunggal, bertoreh sampai setengah panjang tulangdaun, bergerigi, berseling, panjang 26-32 cm dan lebar 15-25 cm, ujung danpangkal daun runcing, pertulangan menyirip, berwarna hijau. Bungamerupakan bunga majemuk yang terdapat di ujung ranting, berbentuk cawan,tangkai bulat, kelopak berbentuk tabung, berbulu halus, hijau. Mahkotaberlekatan, berbentuk pita, halus, dan berwarna kuning. Benang sari bulat,kuning, putik melengkung, kuning. Buahnya bulat, jika masih muda berwarnahijau setelah tua berwarna coklat. Bijinya bulat, keras, dan berwarna coklat.Akarnya berupa akar tunggang berwarna putih kotor (Widyaningrum, 2011).
7
2.1.3 Sistematika tumbuhan
Sistematika tumbuhan kembang bulan (Hutapea, 1994)adalah sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Asterales Suku : Asteraceae Marga : Tithonia
Jenis : Tithonia diversifolia (Hemsley) A. Gray
2.1.4 Nama lain
Tumbuhan kembang bulan memiliki nama lain yaitu Mirasolia diversifolia
Hemsley (Widyaningrum, 2011), dengan nama daerah rondosemoyo,sibunga-bunga atau sipahit-pahit (Tapanuli Utara), harsaga (Jawa),kirinyu (Sunda), kayu paik (Minang). Nama asing adalah Mary Gold, Shrub Sunflower, Mexican Sunflower (Inggris), Mirasol (Guatemala), Yellow Flower (Portugis)(Anonim, 2012).
2.1.5 Khasiat dan penggunaan
Tumbuhan kembang bulan digunakan sebagai obat luka atau lukalebam, dan sebagai obat sakit perut kembung. Untuk obat sakit perut kembungdipakai ± 7 gram daun segar, dicuci, direbus dengan 2 gelas air selama25 menit, setelah dingin disaring. Hasil saringan diminum sekaligus(Widyaningrum, 2011).
Hasil penelitian yang telah dilakukan terhadap khasiat daun kembang bulan antara lain, ekstrak n-heksan sebagai antidiabetes (Sumarny dan Soetjipto, 2011),ekstrak estil asetat, ekstrak n-heksan dan ekstrak etanol sebagai antibakteri
8
(Sibagariang, 2014), ekstrak etanol sebagai antiinflamasi (Verawati, dkk.,2011), ekstrak metanol dan klorofom sebagai anti plasmodium (Syarif, dkk., 2006), sebagai insektsida (Taofik, dkk., 2010) dan efek sitotoksik ekstrak etanol (Mardihusodo, dkk., 2011).
2.1.6 Kandungan kimia
Berdasarkan hasil penelitian yang telah dilakukan terhadap daun kembang bulan, terdapat kandungan senyawa kimia golongan alkaloid, steroid/triterpenoid, glikosida, flavonoid, saponin dan tanin (Sibagariang, 2014;Taofik, dkk., 2010).
2.2Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan suatu pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan kedalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dengan cara ekstraksi yang tepat(Ditjen, POM., 2000).
Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang cocok, di luar pengaruh cahaya matahari langsung (Ditjen POM,1979).Tujuan utama ekstraksi ini adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan (Syamsuni, 2006).
Beberapa metode ekstraksi yang sering digunakan dalam berbagai penelitian antara lain yaitu:
a. Cara dingin
9 1. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperature ruangan, sedangkan remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya (Ditjen, POM., 2000).
Maserasi dilakukan dengan cara memasukkan 10 bagian simplisia atau campuran simplisia dengan derajat halus yang cocok ke dalam sebuah bejana, dituangi dengan 75 bagian cairan penyari, ditutup, kemudian dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, diserkai, diperas, dicuci ampas dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Dipindahkan ke dalam bejana tertutup, dibiarkan di tempat sejuk, terlindung dari cahaya selama 2 hari. Dienaptuangkan dan disaring (Ditjen POM, 1979).
2. Perkolasi
Perkolasi adalah suatu proses penyarian simplisia menggunakan alat yang disebut perkolator dimana simplisia terendam dalam cairan penyari, zat-zat akan terlarut dan larutan tersebut akan menetes secara beraturan. Prosesnya terdiri dari tahapan pengembangan bahan, tahap perendaman antara, tahap perkolasi sebenarnya (penetesan/ penampungan perkolat) sampai diperoleh ekstrak (Ditjen, POM., 2000).
Prosedur perkolasi yaitu 10 bagian simplisia atau campuran simplisia dengan derajat halus yang cocok dibasahi dengan 2,5 bagian sampai 5 bagian cairan penyari, dimasukkan ke dalam bejana tertutup sekurang-kurangnya selama 3 jam. Massa dipindahkan sedikit demi sedikit ke dalam perkolator sambil tiap kali di tekan hati-hati, dituangi dengan cairan penyari secukupnya sampai cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan penyari, tutup
10
perkolator, biarkan selama 24 jam. Biarkan cairan menetes dengan kecepatan 1 mL per menit, cairan penyariberulang-ulangditambahkan secukupnya sehingga selalu terdapat selapis cairan penyari di atas simplisia, hingga diperoleh 80 bagian perkolat. Massa diperas,cairan perasan dicampurkan ke dalam perkolat, ditambahkan cairan penyari secukupnya hingga diperoleh 100 bagian. Cairan dipindahkan ke dalam bejana, ditutup, dibiarkan selama 2 hari di tempat yang sejuk, terlindung dari cahaya dan dienaptuangkan atau disaring (Ditjen POM, 1979).
b. Cara panas 1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu(Ditjen, POM., 2000).
2. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat soklet dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel (Ditjen, POM., 2000).
3. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu secara umum dilakukan pada temperatur 40-50°C(Ditjen, POM., 2000).
4. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit (Ditjen, POM., 2000).
11 5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit (Ditjen, POM., 2000).
2.3 Toksisitas
Uji toksisitas adalah suatu uji untuk mendeteksi efek toksik suatu zat pada sistem biologi dan untuk memperoleh data dosis-respon yang khas dari sediaan uji. Data yang diperoleh dapat digunakan untuk memberi informasimengenai derajat bahaya sediaan uji tersebut bila terjadi pemaparan padamanusia, sehingga dapat ditentukan dosis penggunaannya demi keamananmanusia.
Uji toksisitas menggunakan hewan uji sebagai model berguna untukmelihat adanya reaksi biokimia, fisiologik dan patologik pada manusiaterhadap suatu sediaan uji. Hasil uji toksisitas tidak dapat digunakan secaramutlak untuk membuktikan keamanan suatu bahan/ sediaan pada manusia,namun dapat memberikan petunjuk adanya toksisitas relatif dan membantuidentifikasi efek toksik bila terjadi pemaparan pada manusia (Ditjen, POM., 2014).
1. Uji toksisitas akut oral
Uji toksisitas akut oral adalah suatu pengujian untuk mendeteksi efektoksik yang muncul dalam waktu singkat setelah pemberian sediaan uji yangdiberikan secara oral dalam dosis tunggal atau dosis berulang yang diberikandalam waktu 24 jam.Prinsip uji toksisitas akut oral yaitu, sediaan uji dalam beberapa tingkatdosis diberikan pada beberapa kelompok hewan uji dengan satu dosis perkelompok, kemudian dilakukan pengamatan terhadap adanya efek
12
toksik dankematian. Hewan yang mati selama percobaan dan yang hidup sampai akhirpercobaan diotopsi untuk dievaluasi adanya gejala-gejala toksisitas.
Tujuan uji toksisitas akut oral adalah untuk mendeteksi toksisitas intrinsik suatu zat, menentukan organ sasaran, kepekaan spesies, memperolehinformasi bahaya setelah pemaparan suatu zat secara akut, memperolehinformasi awal yang dapat digunakan untuk menetapkan tingkat dosis,merancang uji toksisitas selanjutnya, memperoleh nilai LD50 suatu bahan/sediaan, serta penentuan penggolongan bahan/ sediaan dan pelabelan (Ditjen, POM., 2014).
2. Uji toksisitas subkronis oral
Uji toksisitas subkronis oral adalah suatu pengujian untuk mendeteksi efek toksik yang muncul setelah pemberian sediaan uji dengan dosis berulang yangdiberikan secara oral pada hewan uji selama sebagian umur hewan, tetapitidak lebih dari 10% seluruh umur hewan.
Prinsip dari uji toksisitas subkronis oral adalah sediaan uji dalam beberapa tingkat dosis diberikan setiap hari pada beberapa kelompok hewan uji dengansatu dosis per kelompok selama 28 atau 90 hari, bila diperlukanditambahkan kelompok satelit untuk melihat adanya efek tertunda atau efekyang bersifat reversibel. Selama waktu pemberian sediaan uji, hewan harusdiamati setiap hari untuk menentukan adanya toksisitas. Hewan yang matiselama periode pemberian sediaan uji, bila belum melewati periode rigor mortis(kaku) segera diotopsi,dan organ serta jaringan diamati secara makropatologidan histopatologi.
13
Pada akhir periode pemberian sediaan uji, semua hewanyang masih hidup diotopsi selanjutnya dilakukan pengamatan secaramakropatologi pada setiap organ dan jaringan,pemeriksaan hematologi, biokimia klinis dan histopatologi.
Tujuan uji toksisitas subkronis oral adalah untuk memperoleh informasiadanya efek toksik zat yang tidak terdeteksi pada uji toksisitas akut, informasikemungkinan adanya efek toksik setelah pemaparan sediaan uji secaraberulangdalam jangka waktu tertentu; informasi dosis yang tidakmenimbulkan efek toksik (No Observed Adverse Effect Level / NOAEL); danmempelajari adanya efek kumulatif dan efek reversibilitas zat tersebut (Ditjen, POM., 2014).
3. Uji toksisitas kronis oral
Uji toksisitas kronis oral adalah suatu pengujian untuk mendeteksi efektoksik yang muncul setelah pemberian sediaan uji secara berulang sampaiseluruh umur hewan. Uji toksisitas kronis pada prinsipnya sama dengan ujitoksisitas subkronis, tetapi sediaan uji diberikan selama tidak kurang dari12 bulan. Tujuan dari uji toksisitas kronis oral adalah untuk mengetahui profilefek toksik setelah pemberian sediaan uji secara berulang selama waktu yangpanjang, untuk menetapkan tingkat dosis yang tidak menimbulkan efek toksik(NOAEL). Uji toksisitas kronis harus dirancang sedemikianrupa sehingga dapatdiperoleh informasi toksisitas secara umum meliputi efek neurologi, fisiologi,hematologi, biokimia klinis dan histopatologi (Ditjen, POM., 2014).
4. Uji teratogenisitas
Uji teratogenisitas adalah suatu pengujian untuk memperoleh informasiadanya abnormalitas fetus yang terjadi karena pemberian sediaan uji selamamasa pembentukan organ fetus (masa organogenesis). Informasi
14
tersebutmeliputi abnormalitas bagian luar fetus (morfologi), jaringan lunak sertakerangka fetus.
Prinsip uji teratogenisitas adalah pemberian sediaan uji dalambeberapa tingkat dosis pada beberapa kelompok hewan bunting selama palingsedikit masa organogenesis dari kebuntingan, satu dosis per kelompok. Satuhari sebelum waktu melahirkan induk dibedah, uterus diambil dan dilakukan evaluasi terhadap fetus (Ditjen, POM., 2014).
5. Uji sensitisasi kulit
Uji sensitisasi kulit adalah suatu pengujian untuk mengidentifikasi suatu zat yang berpotensi menyebabkan sensitisasi kulit. Prinsip uji sensitisasi kulitadalah hewan uji diinduksi dengan dan tanpa Freund’s Complete Adjuvant(FCA) secara injeksi intradermal dan topikal untuk membentuk respon imun,kemudian dilakukan uji tantang (challenge test). Tingkat dan derajat reaksikulit dinilai berdasarkan skala Magnusson dan Kligman (Ditjen, POM., 2014).
6. Uji iritasi mata
Uji iritasi mata adalah suatu uji pada hewan uji (kelinci albino) untukmendeteksi efek toksik yang muncul setelah pemaparan sediaan uji pada mata.Prinsip uji iritasi mata adalah sediaan uji dalam dosis tunggal dipaparkankedalam salah satu mata pada beberapa hewan uji dan mata yang tidak diberiperlakuan digunakan sebagai kontrol. Derajat iritasi/korosi dievaluasi denganpemberian skor terhadap cedera pada konjungtiva, kornea, dan iris padainterval waktu tertentu. Tujuan uji iritasi mata adalah untuk memperolehinformasi adanya kemungkinan bahaya yang timbul pada saat sediaan ujiterpapar pada mata dan membran mukosa mata (Ditjen, POM., 2014).