Lampiran 1. Foto morfologi tanaman kunyit
A
B
Keterangan:
A : Tanaman Kunyit
Lampiran 2. Foto simplisia kunyit
A
B
C Keterangan:
A : Irisan Rimpang Kunyit B : Simplisia Rimpang Kunyit
Lampiran 3. Hasil pemeriksaan mikroskopik rimpang tanaman kunyit
Keterangan: 1. Butir pati
2. Parenkim berisi butir pati 3. Rambut penutup
4. Pembuluh kayu
1
4
Lampiran 5. Perhitungan penetapan kadar air
No. Berat sampel Volume awal (ml) Volume akhir (ml)
1 2,51 g 1,3 ml 1,6 ml
kadar air = 0,3 ml
2,51 g × 100% = 11,95%
Lampiran 6. Perhitungan penetapan kadar sari larut air
No. Berat sampel (g) Berat sari (g) kadar sari larut air rata –rata = 15,39+19,23+17,32
3 = 17,31%
Lampiran 7. Perhitungan penetapan kadar sari larut etanol
kadar sari larut air rata – rata = 20,24+21,37+20,82
3 = 20,81% Lampiran 8. Perhitungan penetapan kadar abu total
No. Berat sampel (g) Berat abu (g) kadar abu total rata –rata = 7,53+6,84+7,18
3 = 7,18%
Lampiran 9. Perhitungan penetapan kadar abu tidak larut asam
No. Berat sampel (g) Berat abu (g)
kadar abu tidak larut asam rata – rata = 0,50+0,39+0,45
Lampiran 12. Data percobaan pelepasan kurkumin dari beads alginat 23G 500 – 600 cp dalam medium lambung buatan pH 1,2
disolusi I; berat beads = 213 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
5 0,009 0,6116 550,4 3,0578 0,0000 550,4000 0,20%
Lampiran 12. (lanjutan)
disolusi II; berat beads = 221 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 12. (lanjutan)
disolusi III; berat beads = 209 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 13. Data percobaan pelepasan kurkumin dari beads alginat 21G 80 – 120 cp dalam medium lambung buatan pH 1,2
disolusi I; berat beads: 205 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
5 0,009 0,6116 550,4 3,0578 0,0000 550,4000 0,16%
Lampiran 13. (lanjutan) disolusi II; berat beads: 202 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 13. (lanjutan)
disolusi III; berat beads: 202 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 14. Data percobaan pelepasan kurkumin dari beads alginat 23G 80 – 120 cp dalam medium lambung buatan pH 1,2
disolusi I; berat beads: 211 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
5 0,013 1,0560 950,4 5,2800 0,0000 950,4000 0,28%
Lampiran 14. (lanjutan) disolusi II; berat beads: 206 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 14. (lanjutan)
disolusi III; berat beads: 212 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 15. Data percobaan pelepasan kurkumin dari beads alginat 25G 80 – 120 cp dalam medium lambung buatan pH 1,2
disolusi I; berat beads: 216 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
5 0,012 0,8782 790,4 4,3911 0,0000 790,4000 0,26%
Lampiran 15. (lanjutan) disolusi II; berat beads: 209 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 15. (lanjutan)
disolusi III; berat beads: 207 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 16. Data percobaan pelepasan kurkumin dari beads alginat 21G 80 – 120 cp ekstrak 10% dalam medium lambung buatan pH 1,2 disolusi I; berat beads: 205 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
5 0,005 0,2560 230,4 1,2800 0,0000 230,4000 0,06%
Lampiran 16. (lanjutan)
disolusi II; berat beads: 205 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 16. (lanjutan)
disolusi III; berat beads: 206 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 17. Data percobaan pelepasan kurkumin dari beads alginat 21G 80 – 120 cp ekstrak 15% dalam medium lambung buatan pH 1,2 disolusi I; berat beads: 201 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
5 0,003 -0,0107 -9,6 -0,0533 0,0000 -9,6000 0,00%
Lampiran 17. (lanjutan)
disolusi II; berat beads: 200 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 17. (lanjutan)
disolusi III; berat beads: 202 mg
min Abs kons kons dlm
900 ml
kons dlm 5 ml
faktor
pe(+)an kons total %kumulatif
Lampiran 24. Data AUC pelepasan kurkumin dari beads alginat 500 – 600 Cp 23G
waktu
Lampiran 25. Data AUC pelepasan kurkumin dari beads alginat 80 – 120 Cp 21G
waktu
(menit) disolusi 1 disolusi 2 disolusi 3
0 - 5 0,41 0,65 0,43
10 1,06 1,02 1,01
15 1,42 1,56 1,40
15 - 30 7,12 8,13 8,18
30 - 45 10,17 10,69 11,23 45 - 60 12,71 13,09 13,87 60 - 90 32,29 34,60 36,28 90 - 120 35,31 39,82 41,52 120 - 150 42,59 45,08 48,10 150 - 180 47,08 52,16 54,72 180 - 210 50,52 54,60 57,30 210 - 240 51,51 56,70 60,00 240 - 270 56,39 61,68 64,17 270 - 300 60,95 64,17 67,87 300 - 330 63,76 65,60 69,54 330 - 390 68,00 69,18 73,59 360 - 390 76,52 71,35 78,74 390 - 420 75,15 73,89 80,98 420 - 450 76,97 75,00 82,13 450 - 480 81,63 77,19 85,29 480 - 510 85,60 79,03 86,86 510 - 540 88,89 80,88 90,69 total 1026,04 1036,08 1113,88
Lampiran 26. Data AUC pelepasan kurkumin dari beads alginat 80 – 120 Cp 23G
waktu
Lampiran 27. Data AUC pelepasan kurkumin dari beads alginat 80 – 120 Cp 25G
waktu
(menit) disolusi 1 disolusi 2 disolusi 3 0 - 5 0,640627 0,058971 0
Lampiran 28. Data AUC pelepasan kurkumin dari beads alginat 80 – 120 Cp 21G Dengan Ekstrak 10%
waktu
(menit) disolusi 1 disolusi 2 disolusi 3
0 - 5 0,16 0,00 0,05
10 0,22 0,27 0,05
15 0,33 0,16 0,22
15 - 30 1,66 1,16 1,48
30 - 45 2,50 3,00 3,15
45 - 60 3,52 2,51 2,50
60 - 90 9,08 7,73 9,02
90 - 120 11,80 9,77 10,73
120 - 150 13,54 11,16 12,45 150 - 180 15,61 12,89 13,85 180 - 210 16,37 13,96 14,59 210 - 240 18,79 16,37 16,99 240 - 270 19,56 17,13 18,74 270 - 300 21,33 18,22 21,17 300 - 330 22,78 21,33 21,95 330 - 390 25,24 21,44 24,06 360 - 390 25,38 21,89 24,51 390 - 420 25,85 23,34 25,29 420 - 450 30,32 29,14 26,39 450 - 480 29,15 24,96 28,16 480 - 510 30,64 26,76 28,26 510 - 540 32,14 28,57 32,34 total 355,98 311,77 335,92
Lampiran 29. Data AUC pelepasan kurkumin dari beads alginat 80 – 120 Cp 21G Dengan Ekstrak 15%
waktu
(menit) disolusi 1 disolusi 2 disolusi 3
0 - 5 0 0,054866 0
Lampiran 31. Grafik kinetika pelepasan kurkumin dari beads alginat 80 – 120
0,00 5,00 10,00 15,00 20,00 25,00
Lampiran 34. Uji Normalitas dan Uji Independent Sample T Test beads alginat ukuran 23G berdasarkan perbedaan viskositas
Hipotesis uji Normalitas: Ho = Data berdistribusi normal H1 = Data tidak berdistribusi normal
Tests of Normality
viskositas_alginat Kolmogorov-Smirnova Shapiro-Wilk
Statistic df Sig. Statistic df Sig.
AUC
dim ension1
500 - 600 cP ,177 3 . 1,000 3 ,962
80 - 120 cP ,352 3 . ,824 3 ,174
a. Lilliefors Significance Correction
Kesimpulan: Karena sig.> 0,05, Ho diterima. Data berdistribusi normal. Hipotesis uji Independent Sample Test:
Ho = tidak terdapat perbedaan yang signifikan antara AUC Beads Alginat viskositas 500 – 600 cP dan viskositas 80 – 120 cP
H1 = terdapat perbedaan yang signifikan antara AUC Beads Alginat viskositas 500 – 600 cP dan viskositas 80 – 120 cP
Group Statistics
viskositas_alginat N Mean Std. Deviation Std. Error Mean
AUC
dim ension1
500 - 600 cP 3 549,58307 76,711797 44,289576
80 - 120 cP 3 998,74443 252,261559 145,643279
Kesimpulan: H1 diterima, yakni terdapat perbedaan yang signifikan antara AUC beads alginat viskositas 500-600 cP dan viskositas 80-120 cP dimana nilai sig(2 tailed) yang dihasilkan < 0,05 (probabilitas
Independent Samples Test Levene's Test
for Equality of Variances
t-test for Equality of Means
F Sig. t df Interval of the
Difference
Lampiran 35. Uji Normalitas dan Uji ANOVA AUC beads alginat berdasarkan perbedaan ukuran syringe
Hipotesis uji Normalitas: Ho = Data berdistribusi normal H1 = Data tidak berdistribusi normal
Tests of Normality
Ukuran_syringe Kolmogorov-Smirnova Shapiro-Wilk
Statistic df Sig. Statistic df Sig.
a. Lilliefors Significance Correction
Kesimpulan: Karena sig.> 0,05, Ho diterima. Data berdistribusi normal. Hipotesis uji ANOVA:
Ho = tidak terdapat perbedaan yang signifikan antara AUC dengan ukuran syringe 21G, 23G, dan 25G
H1 = terdapat perbedaan yang signifikan antara AUC dengan ukuran syringe 21G, 23G, dan 25G
Descriptives
AUC
N Mean Std.
Deviation Std. Error
95% Confidence Interval
for Mean
21G 3 1058,666 48,075600 27,75646 939,24026 1178,09308 1026,041 1113,876
23G 3 998,7443 252,261632 145,6433 372,09170 1625,39697 830,728 1288,820
25G 3 1007,777 176,443250 101,8695 569,46767 1446,08633 804,336 1119,039
Tota
l 9 1021,729 158,280156 52,76005 900,06444 1143,39423 804,336 1288,820
ANOVA
AUC
Sum of Squares df Mean Square F Sig.
Between Groups 6262,033 2 3131,017 ,097 ,909
Within Groups 194158,829 6 32359,805
Total 200420,863 8
Lampiran 36. Uji Normalitas dan Uji ANOVA AUC beads alginat berdasarkan perbedaan kadar ekstrak
Hipotesis uji Normalitas: Ho = Data berdistribusi normal H1 = Data tidak berdistribusi normal
Tests of Normality
kadar_ekstrak Kolmogorov-Smirnova
Shapiro-Wilk
a. Lilliefors Significance Correction
Kesimpulan: Karena sig.> 0,05, Ho diterima. Data berdistribusi normal.
Hipotesis uji ANOVA:
Ho = tidak terdapat perbedaan yang signifikan antara AUC kadar ekstrak 5, 10, dan 15% Between Groups 922091,831 2 461045,915 473,626 ,000
Within Groups 5840,638 6 973,440
Deviation Std. Error
95% Confidence Interval for Mean
5% 3 1058,6666 48,075600 27,75646 939,24026 1178,0930 1026,041 1113,87 10% 3 334,55667 22,136509 12,78051 279,56653 389,54680 311,770 355,980 15% 3 436,23800 10,910125 6,298964 409,13575 463,34025 423,956 444,807 Tota
Lampiran 38. Perhitungan Indeks Ulkus (IU)
kelompok I (Ulkus mula – mula) (bedah setelah 1 jam induksi) tikus 1
indeks ulkus 0,1260
tikus 2
Lampiran 38. (lanjutan)
indeks ulkus 0,1054
kelompok II (tanpa pengobatan) Hari ke – 2 tikus 1
Lampiran 38. (lanjutan)
indeks ulkus 0,1039
tikus 3
jumlah luas ulkus (mm2) 0,7595
luas mukosa (mm2) 8,6989
Lampiran 38. (lanjutan)
kelompok II (tanpa pengobatan) Hari ke – 4 tikus 1
jumlah ulkus = 12 no. ulkus
panjang ulkus (mm)
lebar ulkus (mm)
luas ulkus (mm2)
1 0,19 0,11 0,0209
2 0,18 0,09 0,0162
3 0,20 0,13 0,0260
4 0,11 0,09 0,0099
5 0,09 0,08 0,0072
6 0,05 0,05 0,0025
7 0,15 0,11 0,0165
8 0,12 0,05 0,0060
9 0,08 0,04 0,0032
10 0,10 0,09 0,0090
11 0,11 0,06 0,0066
12 0,09 0,03 0,0027
jumlah luas ulkus (mm2) 0,1267 luas mukosa (mm2) 9,2160
Lampiran 38. (lanjutan)
Lampiran 38. (lanjutan)
jumlah luas ulkus (mm2) 0,1292
luas mukosa (mm2) 8,8550
indeks ulkus 0,0146
kelompok II (tanpa pengobatan) Hari ke – 6 tikus 1
Lampiran 38. (lanjutan)
indeks ulkus 0,0095
tikus 3
Lampiran 38. (lanjutan)
indeks ulkus 0,0106
kelompok III (beads alginat) Hari ke – 2 pengobatan tikus 1
Lampiran 38. (lanjutan)
indeks ulkus 0,0413
tikus 3
indeks ulkus 0,0105
kelompok III (beads alginat) Hari ke – 4 pengobatan tikus 1
Lampiran 38. (lanjutan)
indeks ulkus 0,0040
tikus 3
indeks ulkus 0,0073
Lampiran 38. (lanjutan)
indeks ulkus 0,0002
Lampiran 39. Perhitungan dosis
Misalkan, dosis dewasa = 2 kapsul (@ 500 mg beads alginat yang mengandung ekstrak kunyit). Faktor konversi dosis manusia dewasa (70 kg) terhadap hewan tikus (200 g) adalah 0,018.
Konversi dosis terhadap hewan tikus 200 gram = 1000 mg x 0,018 = 18 mg ~ 20 mg Dosis tiap kg berat badan = 20 mg x 1000 g
200 g
= 100 mg/kgBB
DAFTAR PUSTAKA
Aggarwal, B.B., Kumar, A., dan Bharti, A.C. (2003). Anticancer Potential of Curcumin: Preclinical and Clinical Studies. Anticancer. 23: 363-398. Aihara, T., Nakamura, E., Amagase, K., Tomita, K., Fujishita, T. Furutani, K.
(2003). Pharmacological Control of Gastric Acid Secretion for the Treatment of Acid-related Peptic Disease: Past, Present, and Future. Pharmacol Ther. 98: 109-127.
Ali, J., Arora, S., dan Khar, R.K. (2005). Floating Drug Delivery System: A Review. AAPS Pharm Sci Tech. 6(3). Halaman 372-390.
Allen, A. dan Snary, D. (1972). The Structure and Function of Gastric Mucus. Gut. 13: 666-672.
Anand, P., Kunnumakkara, A. B., Newman, R. A., dan Aggarwal, B. B. (2002). Bioavailability of Curcumin: Problems and Promises. Mol. Pharmaceutics. 4 (6): 807- 818.
Apisariyakul, A., Vanittanakomm, N., dan Buddasukh, D. (1995). Antifungal Activity of Turmeric Oil Extracted from Curcuma longa (Zingiberaceae). Journal of Ethnopharmacology. 49: 163-169.
Avinash, K. (2011). Peptic Ulcer: A Review with Emphasis on Plants from Cucurbitaceae Family with Anti Ulcer Potential. International Journal of Research in Ayurveda & Pharmacy. 2 (6): 1714- 6.
Badoni, A., Ojha, A., Granarajan, G., dan Kothiyal, P. (2012). Review on Gastro Retentive Drug Delivery System. The Pharma Innovation. 1(8): 32- 6. Bansar, N. dan Basant, D. (1982). Curcumin as an Effective Chemopreventive
Agent. Indian Journal of Experimental Biology. 11: 115-211.
Bansil, R. dan Turner, B. (2006). Mucin Structure, Aggregation, Physiological Functions and Biomedical Applications. Curr. Opin. Colloid Interface Sci. 11: 164-170.
Bruschi, M.L. (2015). Strategies to Modify the Drug Release from Pharmaceutical Systems. UK: Elsevier Ltd. Halaman 158.
Cheng, A.L., Hsu, C. H., dan Lin, J. K. (2001). Phase I Clinical Trial of Curcumin, a Chemopreventive Agent, in Patients with High-risk or Pre-malignant Lesions. Anticancer Res. 21: 2895-2900.
Cora, L.A., Miranda, J.R. A., Americo, M.F., Oliveira, R.B., dan Baffa, O. (2007). Biomagnetic Approaches Applied to Drug Delivery Studies. Drug Delivery Research Advances. New York: Nova Science Publishers, Inc.. Halaman 190, 191.
Davenport, H. W. (1982). Physiology of the Digestive Tract. Yearbook. Chicago: Medical Publ. Halaman 140-141.
Depkes RI. (1979). Materia Medika Indonesia. Jilid III. Jakarta: Departemen Kesehatan RI. Halaman 52.
Depkes RI. (1989). Materia Medika Indonesia. Jilid V. Jakarta: Departemen Kesehatan RI. Halaman 31.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Halaman 9, 33.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 31.
Farnsworth, N.R., dan Bunyapraphatsara. (1992). Thai Medicinal Plants. First Edition. Bangkok: MPIC. Halaman 402.
Gathak, N dan Basu, N. (1972). Sodium Curcuminate as an Effective Anti-inflammatory Agent. Indian Journal of Experimental Biology. 10:235-236. Grant, G.T., Morris, E.R., Rees, D.A., Smith, P.J.C., dan Thom, D. (1973). Biological Interactions between Polysaccharides and Divalent Cations-Egg-box Model. Febs. Lett. 32: 195-198.
Hakim, B. dan Arianto, A. (2016). Healing Effect of Alginate Liquid against HCl-induced Gastric Mucosal Lesions in Rats. International Journal of PharmTech Research. 9(3): 287-296.
Halim, E.M., dan Ali, H. (2002). Hypoglycemic, Hypolipidemic, and Antioxidant Properties of Combination of Curcumin from Curcuma longa Linn. and Partially Purified Product from Abroma augusta Linn. in Streptozocin Induced Diabetes. Indian Journal of Clinical Biochemistry. 17(12): 33-43. Holt, P.R., Katz, S., dan Kirshoff, R. (2005). Curcumin Therapy in Inflammatory
Bowel Disease: A Pilot Study. Dig Dis Sci. 11: 2191- 2193.
Isselbacher. (2000). Harrison’s Principles of Internal Medicine. Penerjemah: Asdie, A.H. (2000). Prinsip-Prinsip Ilmu Penyakit Dalam. Volume Empat. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 1532-1549.
Johnson, L.R. dan McCormack, S.A. (1994). Regulation of Gastrointestinal Mucosal Growth. Physiology of the Gastrointestinal Tract. Third Edition. Newyork: Johnson LR, Raven Press. Halaman 611- 641.
Jurenka, J.S. (2009). Anti-inflammatory Properties of Curcumin, a Major Constituent of Curcuma longa: A Review of Preclinical and Clinical Research. Alternative Medicine Review. 14(2): 141-153.
Koosirirat, C., Linpisam, S., Changsom, D., Chawansuntati, K., dan Wipasa, J. (2010). Investigation of the Anti-inflammatory Effect of Curcuma longa in Helicobacter pylori-infected patients. Int. Immunopharmacol. 10: 815- 818.
Krishnaswamy, K. (2009). Turmeric: The Salt of the Orient is the Spice of Life. New Delhi: Allied Publishers Pvt. Ltd. Halaman 14 – 24.
Kumavat, S.D., Chaudari, Y.S., Borole, P., Mishra, P., Shenghani, K., dan Duvvuri, P. (2013). Degradation Studies of Curcumin. Interational Journal of Pharmacy Review & Research. 3 (2): 50-55.
Li, N., Xie, C., Lu, N.H. (2015). Transforming Growth Factor-β: an Important Mediator in Helicobacterpylori-associated Pathogenesis. Front. Cell. Infect. Microbiol. 5:77.
Lipkin, M. (1987). Proliferation and Differentiation of Normal and Diseased Gastrointestinal Cells. Physiology of Gastrointestinal Cells. Second Edition. Newyork: Johnson LR, Raven Press. Halaman 255-284.
Mahattanadul, S., Nakamura, T., Panichayupakaranant, P., Phdoongsombut, N., Tungsinmunkong, K., dan Bouking, P. (2009). Comparative Antiulcer Effect of Bisdemethoxycurcumin and Curcumin in a Gastric Ulcer Model System. Phytomedicine. 16: 342-351.
Mani, H., Sidho, G. S., Kumari, R., Gaddipati, J. P., Seth, P., dan Maheshwari, R.K. (2002). Curcumin Differentially Regulates TGF-beta1, Its Receptors and Nitric Oxide Synthase During Impaired Wound Healing. Biofactors. 16 (1 -2): 29- 43.
Mazumdar, A., Raghavan, K., Weinstein, J., Kohn, K.W., dan Pommer, Y. (1995). Inhibition of Human Immunodeficiency virus type-I Integrase by Curcumin. Biochemical pharmacology. 49: 165-170.
Milani, S., dan Calabro, S. (2001). Role of Growth Factors and their Receptors in Gastric Ulcer Healing. Microscopy Research and Technique. 53(5): 360- 371.
Mishra, M. (2016). Handbook of Encapsulation and Controlled Release. Boca Raton: CRC Press. Halaman 606.
Morris, E.R., Rees, D.A., Thom, D. (1980). Characterisation of Alginates Composition and Block Structure by Circular Dichroism. Carbohydrate Research. 81(2): 305-310.
Munzenmaier, A., Lange. C., Glocker, E., Covacci, A., dan Moran, A.. (1997). A Secreted Shed Product of Helicobacter pylori Activates Transcription Factor Nuclear Factor-kappa B. Immunology. 159: 6140- 6147.
Nayak, A. K., Maji, R., dan Das, B. (2010). Gastroretentive Drug Delivery System: A Review. Asian Journal of Pharmaceutical and Clinical Research. 3 (1): 2- 4, 7- 9.
Negi, P.S., Jayaprakash, G.K., Jagan, M.R.I., dan Sakariah, K.K. (1999). Antibacterial Activity of Turmeric Oil; a byproduct from curcumin manufacture. Journal of Agricultural and Food Chemistry. 47: 297-300. Porth, C. (2009). Porth Pathophysiology: Concepts of Altered Health States.
Philadelphia: Lippincott Williams & Wilkins. Halaman 884-5.
Ravindran, P.N., Babu, K.N., dan Sivaraman, K. (2007). Turmeric: the Genus curcuma. Boca Raton: CRC Press. Halaman 298.
Ruby, A.J., Kuttan, G., Dinesh, B.K., Rajasekharan, K.N., dan Kuttan, R. (1995). Antitumor and antioxidant Activity of Natural Curcuminoids. Cancer Letters. 94: 79-83.
Sandri, G., Rossi, S., Ferrari, F., Bonferoni, M.C., dan Caramella, C.M. (2015). Mucoadhesive Polymers as Enabling Excipients for Oral Mucosal Drug Delivery. Controlled Release Society. Halaman 53-56.
Satoskar, R.R., Shah, S.J., Shenoy, S.G. (1986). Evaluation of Anti-inflammatory Property of Curcumin (diferuloyl methane) in Patients with Post-operative in Flammation. Int J Clin Pharmacol Ther Toxicol. 24: 651 -654.
Schreiber, D.S. (2010). Hidup Bebas Kanker: Terobosan Terbaru Mencegah, Melawan, & Mengobati Kanker. Bandung: PT. Mizan Pustaka. Halaman 158.
Sherwood, L. (2011). Human Physiology: From Cells to System. Penerjemah: Pendit, B.U. (2001). Fisiologi Manusia dari Sel ke Sistem. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 538-560.
Singh, B.N. dan Kim, K.H. (2000). Floating Drug Delivery Systems: an Approach to Oral Controlled Drug Delivery via Gastri Retention. J Control Release. 63. Halaman: 235-259.
Sinko, P.J. (2012). Farmasi Fisika dan Ilmu Farmasetika Martin. Jakarta: EGC. Halaman: 431-432.
Smidsrod, O. dan Skjak-Braek, G. (1990). Alginate as Immobilization Matrix for Cells. Trend Biotechnol. 8: 71-78.
Sunil. K., Amandeep K., Robin, S., Ramica, S. (2012). Peptic Ulcer: A Review on Etiology and Pathogenesis. International Research Journal Pharmacy. Volume 3 (6): 34-35.
Szabo, S., Vincze, A., Sandor, Z., Jadus, M., Gombos, Z., dan Pedram, A.. (1998). Vascular Approach to Gastroduodenal Ulceration: New Studies with endothelins and VEGF. Dig Dis Sci. 43: 40-45.
Talukder, R. dan Fassihi, R. (2004). Gastroretentive Delivery Systems: A mini review. Drug Dev. Ind. Pharm. 30(10): 1019-1028.
Tarnawski, A., Hollander, D., Stachura J.Krause W. J., Eltorei, M., Dabros, W., dan Gergely, H. (1999). Vascular and Microvascular Changes-Key Factors in the Development of Acetic Acid-induced gastric ulcers in rats. J. Clin. Gastroenterol. 148-157.
Tipton, P.A. (2010). Synthesis of Alginat in Bacteria. Comprehensive Natural Products II: Chemistry and Biology. UK: Elsevier. Halaman 423-424.
Vetter, A. dan Schnurch, A.B. (2010). Bioadhesive Delivery Systems. Biodrug Delivery Systems: Fundamentals, Applications and Clinical Development. Boca Raton: CRC Press. Halaman 220-221.
Wen, H. dan Park, K. (2010). Oral Controlled Release Formulation Design and Drug Delivery: Theory to Practice. Singapore: John Wiley & Sons, Inc. Halaman 21, 23.
Yu, T., Andrews, G.P., dan Jones, D.S. (2014). Mucoadhesion and Characterization of Mucoadhesive Properties. Mucosal Delivery of Biopharmaceuticals: Biology, Challenges dan Strategies. New York: Springers. Halaman 35-43.
BAB III
METODE PENELITIAN
3.1 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Farmasi Fisik Fakultas Farmasi Universitas Sumatera Utara, Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara, dan Laboratorium Fitokimia Fakultas Farmasi Universitas Sumatera Utara.
3.2 Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian eksperimental yang meliputi pembuatan beadsalginat yang mengandung ekstrak kunyit,evaluasi dan karakterisasi sediaan, uji in vitro dan uji in vivo.
3.3 Alat
3.4 Bahan
Bahan-bahan yang digunakan adalah rimpang kunyit (Curcuma domesticaVal.), etanol 96%, Akua DM (Brataco), Kurkumin baku (Sigma Aldrich), Tween 80 (Merck), Natrium alginat 80-120 cP dan 500-600 cP (Wako pure chemical industries, Ltd. Japan), dan bahan-bahan yang berkualitas pro analysis (Merck): kalsium klorida dan asam klorida. Akuades diperoleh dari laboratorium Farmasi Fisik, Fakultas Farmasi, USU.
3.5 Prosedur Penelitian
3.5.1 Penyiapan bahan tumbuhan
Penyiapan bahan tumbuhan meliputi pengambilan, identifikasi, dan pengolahan bahan.
3.5.1.1 Pengambilan bahan tumbuhan
Metode pengambilan bahan tumbuhan dilakukan secara purposif yaitu diambil dari satu daerah saja tanpa membandingkan dengan tumbuhan yang sama di daerah lain. Bahan tumbuhan diperoleh dari Pasar Sentral, Kota Medan, Provinsi Sumatera Utara.
3.5.1.2 Identifikasi bahan tumbuhan
Identifikasi bahan tumbuhan (rimpang) dilakukan di Herbarium Medanense (MEDA), Universitas Sumatera Utara, Medan.
3.5.1.3 Pengolahan bahan tumbuhan
ditimbang. Dikeringkan dalam lemari pengering sampai bahan tumbuhan rapuh (dapat dipatahkan) kemudian simplisia ditimbang.
3.5.2 Pemeriksaan karakteristik simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut asam (Depkes RI, 1989; WHO, 1992).
3.5.2.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, ukuran, warna, dan bau rimpang kunyit.
3.5.2.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia rimpang kunyit. Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati dengan mikroskop. Untuk melihat bentuk butir pati ditetesi dengan akuades.
3.5.2.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi, yang meliputi: a. Penjenuhan toluen
b. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu yang berisi toluen yang telah dijenuhkan, dipanaskan secara hati-hati selama 15 menit. Kecepatan tetesan diatur 2 tetes per detik setelah toluen mendidih sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik. Bagian dalam pendingin dibilas dengan toluen setelah semua air terdestilasi. Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar. Volume air dibaca setelah air dan toluen memisah sempurna dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.5.2.4 Penetapan kadar sari larut air
Sebanyak 5 g serbuk dimaserasi selama 24 jam dalam 100 ml air - kloroform (2,5 ml kloroform dalam akuades sampai 1 liter) dengan menggunakan botol bersumbat warna coklat sambil sekali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18-24 jam dan disaring, sejumlah 20 ml filtrat pertama diuapkan hingga kering dalam cawan yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 1050C sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan diudara (Depkes RI, 1989).
3.5.2.5 Penetapan kadar sari larut etanol
disaring.Sejumlah 20 ml filtrat pertama diuapkan hingga kering dalam cawan yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 1050C sampai diperoleh bobot tetap. Kadar sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan diudara (Depkes RI, 1989).
3.5.2.6 Penetapan kadar abu total
Lebih kurang 2 g zat yang telah digerus dan ditimbang seksama, dimasukkan kedalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus porselen bersama isinya dipijarkan perlahan–lahan hingga arang habis, didinginkan, ditimbang sampai diperoleh bobot yang tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan diudara (Depkes RI, 1989).
3.5.2.7 Penetapan kadar abu yang tidak larut asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit, dikumpulkan bagian yang tidak larut dalam asam, disaring dengan kertas saring, lalu dicuci dengan air panas. Kemudian residu dan kertas saring dipijarkan sampai diperoleh bobot tetap, didinginkan dan ditimbang beratnya. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan diudara (Depkes, 1989).
3.5.3Pembuatan pereaksi
3.5.3.1 Pembuatan larutan kalsium klorida 0,15 M
Kalsium klorida ditimbang 22,053 gram kemudian dilarutkan dengan akua bebas CO2 secukupnya sampai 1000 ml (Ditjen POM, 1995).
3.5.3.2 Pembuatan medium lambung buatan (medium pH 1,2)
3.5.4 Pembuatan kurva serapan dan kurva kalibrasi kurkumin 3.5.4.1 Pembuatan larutan induk baku kurkumin
Dilarutkan 10 mg kurkumin baku dengan etanol hingga larut sempurna di dalam labu 10 ml, kemudian dicukupkan HCl 0,1 N(LIB I= 1000 ppm). Kemudian dipipet 5 ml ke dalam labu 50 ml (LIB II= 100 ppm).
3.5.4.2 Pembuatankurva serapankurkumin dalam medium lambung pH 1,2
Dipipet 1 ml dari LIB II ke dalam labu 10 ml, dicukupkan dengan HCl 0,1 N. Diukur pada λ 400-800 nm.
3.5.4.3 Pembuatan kurva kalibrasi kurkumin dalammediumlambung pH 1,2
Dipipet 2,5, 5, 7, 10, 12,5 ml dari LIB II, dimasukkan ke dalam labu 50 ml, dicukupkan dengan HCl 0,1 N (konsentrasi 5, 10, 15, 20, 25 ppm). Diukur pada λmaksimum (λ= 428 nm).
3.5.5 Pembuatan ekstrak kunyit
Dihaluskan simplisia rimpang kunyit, kemudian ditimbang. Dimaserasi serbuk kunyit (750 gram) dengan etanol 96% (5 liter) selama 5 hari, kemudian di remaserasi selama 3 hari dengan etanol 96% (3 liter). Kemudian diuapkan dengan rotary evaporator hingga didapatkan ekstrak kental dan diuapkan dengan waterbathhingga ekstrak bebas dari pelarut.
3.5.6 Pembuatan beadsalginat
R/ Ekstrak kunyit 5, 10, 15%
Tween 80 5%
Timbang seksamaNatrium Alginat, didispersikan ke sejumlah akua DM dan didiamkan selama 24 jam. Ekstrak kunyit digerus dengan etanol secukupnya hingga larut, kemudian ditambahkan Tween 80. Natrium alginat dimasukkan dan dihomogenkan. Kemudian diteteskan ke dalam larutan kalsium klorida (CaCl2) 0,15 M dengan curing time 4-5 menit. Beads dibilasdengan akua DM, dikumpulkan dan dikeringkan di suhu ruangan selama 2 hari.Beads disimpan dalam desikator hingga waktu pemakaian.
3.5.7 Karakterisasi beads 3.5.7.1 Penentuan berat beads
Dilakukan penimbangan 20 beads sebanyak 6 kali. 3.5.7.2 Penentuan ukuran beads
Dilakukan pengukuran sebanyak 6 beads dari 3 sisi diameter, dirata-ratakan diameter untuk memperolah diameter beads.
3.5.8 Penentuan PenjerapanBeads
Ditimbang ±50 mg beads, diekstrak dengan etanol 96% secukupnya sampai larutan tidak menghasilkan absorbansi pada spektrofotometer. Dimasukkan hasil ekstrak ke labu tentukur 50 ml, dicukupkan dengan medium lambung buatan pH 1,2. Dipipet 1 ml ke dalam labu 20 ml, kemudian dipipet kembali 1 ml ke dalam labu 10 ml. Diukur pada λ 428 nm.
3.5.9 Studi pelepasan in-vitro
Medium disolusi : medium lambung buatan (pH 1,2) Kecepatan Pengadukan : 50 rpm
Volume medium : 900 ml
Metode : dayung
Ditimbang beadsalginat dan dimasukkan ke apparatus disolusi tipe dayung berisi 900 ml medium lambung buatan, suhu 37±0,5oC dengan kecepatan 50 rpm. Sampel diambil pada interval waktu 5 menit, 10 menit, 15 menit, 30 menit, 45 menit, 60 menit, lalu sampel selanjutnya diambil pada interval 30 menit. Diambil aliquot sebanyak 5 ml dan dijaga volume nya tetap 900 ml. Pengambilan dilakukan pada tempat yang sama yaitu pertengahan antara permukaan medium disolusi dan bagian atas dari dayung tidak kurang dari 1 cm dari dinding wadah (Ditjen POM, 1995). Sampel dianalisis dengan Spektrofotometer pada λmaks untuk menentukan konsentrasi obat.
3.5.10 Uji bioadhesi
Dipilih formula dengan pelepasan paling bagus dan dilakukan uji bioadhesif in vitro. Mukosa lambung tikus dibersihkan, dan direndam dalam NaCl fisiologis. Mukosa lambung ditempelkan ke kaca objek dengan bagian muka menghadap ke atas. Dimiringkan kaca objek dengan sudut 450. Sebanyak 20 beads ditempelkan di atas mukosa lambung, kemudian ditetesi cairan lambung
buatan dan dibiarkan 1 menit. Mukosa dialiri dengan cairan lambung buatan suhu 37 ± 0,50C dengan kecepatan 22 ml/ menit. Dihitung jumlah beads yang tertinggal pada 5 menit dan 10 menit. Dihitung nomor adhesi dengan rumus:
Na =�
N No
� �
100
3.5.11 Induksi luka lambung dengan larutan HCl 1 M dan penyembuhan lesi lambung menggunakan beads alginat dari ekstrak kunyit
Tikus yang dipakai berjenis kelamin jantan dengan berat 150-200 g. Semua tikus diaklimatisasi selama 1 minggu sebelum perlakuan. Tikus dipuasakan selama 36 jam, kemudian diinduksi dengan 1 ml larutan HCl 1 M untuk membuat luka lambung (Bangun, et al., 2016). Setelah 1 jam induksi, 3 tikus dikorbankan dengan dislokasi, kemudian lambung dibuka dan dicuci dengan larutan NaCl 0,9%, dan luka diamati secara makroskopik dan mikroskopik (histopatologi).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Hasil identifikasi yang dilakukan oleh Herbarium Medanense (MEDA) terhadap tumbuhan yang diteliti adalah tumbuhan Curcuma domestica Val. suku Zingiberaceae. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 4.
4.2 Karakteristik Simplisia
Hasil karakterisasi simplisia rimpang kunyit dapat dilihat pada Tabel 4.1. Tabel 4.1 Hasil karakterisasi simplisia rimpang kunyit
No. Pemeriksaan karakteristik
simplisia A (%) B (%)
1 Kadar air 11,95 8-13,7
2 Kadar sari larut etanol 20,81 > 10
3 Kadar sari larut air 17,31 > 15
4 Kadar abu total 7,185 < 9
5 Kadar abu tidak larut asam 0,44 < 1,6 Keterangan:
A: kadar hasil penelitian B: kadar menurut MMI
reaksienzimatik tidak berlangsung lagi bila kadar air dalam simplisia memenuhi persyaratan MMI.
Penetapan kadar sari dilakukan terhadap 2 pelarut, yakni kadar sari larut etanol dan air. Penetapan kadar sari simplisia menyatakan jumlah zat yang dapat tersari dalam etanol dan dalam air. Kadar sari larut etanol yang didapat sebesar 20,81% dan kadar sari larut air yang didapat sebesar 17,31%.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral yang terkandung dalam simplisa serta senyawa organik yang tersisa selama pembakaran. Kadar abu total yang didapatkan adalah sebesar 7,185%. Sedangkan kadar abu tidak larut asam yang diperoleh sebesar 0,44%.
4.3 Pemeriksaan Makroskopik dan Mikroskopik Rimpang Kunyit 4.3.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia rimpang kunyit berupa irisan-irisan berbentuk bundar berwarna kuning kecoklatan, warna daging jingga, diameter kira-kira 2-3 cm dan memiliki bau khas.
4.3.2 Hasil pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik pada simplisia rimpang kunyit terdapat butir pati, rambut penutup dan jaringan parenkim, dapat dilihat pada Lampiran 3.
4.4 Pembuatan dan spesifikasi beads alginat
memilikimanfaat sebagai surfaktan yang membantu pelarutan kurkumin yang praktis tidak larut dalam air dan suasana asam. Campuran alginat kemudian diteteskan ke dalam larutan CaCl2 0,15 M menggunakan spuit dengan ukuran syringe yang berbeda selama curing time 4-5 menit agar beads yang dihasilkan tidak begitu kompak sehingga dikhawatirkan mempersulit pelepasan bahan aktif dari beads.
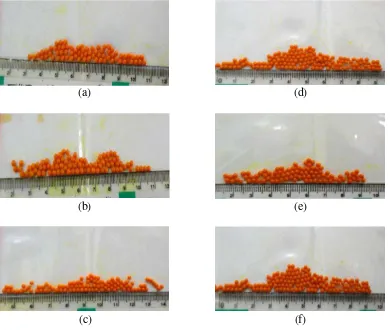
(a)
(b)
(d)
(e)
(c) (f)
Gambar 4.1Beads alginat sebelum pengeringan. Beads dibuat menggunakan syringe dan alginat berdasarkan keterangan:
Hasil gelasi alginat ditunjukkan pada Gambar 4.1. Beads yang terbentuk memiliki ukuran ± 2 mm dan tidak terdapat perbedaan ukuran yang signifikan diantara masing-masing beads berdasarkan perbedaan viskositas dan ukuran syringe. Setelah itu, dilakukan pengeringan terhadap beads yang dihasilkan. Demikian pula beads setelah pengeringan yang ditunjukkan pada Gambar 4.2, tidak terdapat perbedaan signifikan terlihat dari segi penampakan beads.
(a)
(b)
(c)
(d)
(e)
(f)
Gambar 4.2Beadsalginat setelah pengeringan. Beads dibuat menggunakan syringe dan alginat berdasarkan keterangan:
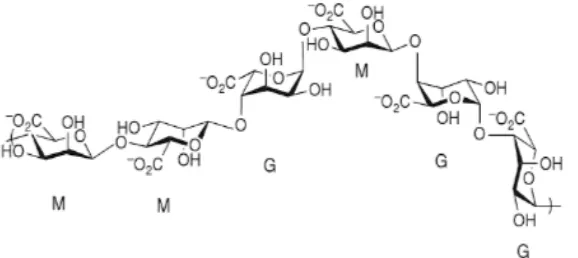
Alginat adalah polisakarida alami linear yang terdiri dari asam β -D-mannuronat dan asam α-L-guluronat. Kation divalen, seperti ion kalsium dapatmengikat residu guluronat membentuk struktur “kotak telur” dan menyebabkan gelasi (Grant, et al., 1973; Smidsrod, et al., 1990).
Gambar 4.3 Gelasi larutan alginat dengan penambahan ion kalsium dan pembentukan struktur “kotak telur” (Grant, et al., 1973; Smidsrod, et al., 1990).
4.4.1 Hasil pengukuran diameter beads alginat
Pengukuran diameter beads alginat mengambil rata – rata dari 3 sisi oleh karena bentuk beads yang sferis. Tabel 4.2 menunjukkan bahwa terdapat perbedaan ukuranbeads berdasarkan viskositas dan ukuran syringe. Beads dengan alginat viskositas 500-600 cP memiliki ukuran beads lebih besardibandingkan alginat viskositas80-120 cP.
Tabel 4.2 Perbandingan diameter beads berdasarkan ukuran diameter dalam syringe dan viskositas (n = 6)
Ukuran syringe Viskositas
Ukuran beads (mm) 21G
(ɸ = 0,514 mm)
23G (ɸ = 0,337 mm)
Semakin kental viskositas alginat yang dipakai, semakin banyak jumlah blok G dalam strukturnya sehingga lebih mudah membentuk gel dengan adanya ion Ca2+ (Tipton, 2010). Alginat viskositas 500-600 cP lebih mudah membentukgel sehingga ukurannya lebih besar daripada viskositas 80-120 cP. Berdasarkan ukuran syringe, semakin kecil ukuran syringe, semakin kecil pula ukuran beads yang diperoleh.
4.4.2 Hasil penimbangan berat beads alginat
Penentuan berat dilakukan dengan menimbang sebanyak 20 beads alginat. Tabel 4.3 menunjukkan bahwa beads 500-600 cP lebih berat dibandingkan beads 80-120 cP. Hal ini sesuai dikarenakan alginat viskositas 500-600 cP yang lebih membentuk gel dengan Ca2+ sehingga menyebabkan beads alginat 500-600 cP lebih berat dibandingkan beads alginat 80-120 cP. Berdasarkan ukuran syringe, semakin besar ukuran syringe maka semakin besar ukuran beads sehingga semakin berat pula beads yang diperoleh.
Tabel 4.3 Perbandingan berat beads berdasarkan ukuran diameter dalam syringe dan viskositas (n = 6)
Ukuran syringe
Viskositas
Berat beads (mg)
21G
4.5 Uji pelepasan kurkumin dari beads alginat
4.5.1Hasil uji pelepasan berdasarkan perbedaan viskositas alginat dan ukuran syringe
Berdasarkan uji statistikIndependent Sample T Test, pelepasan kurkumin dari beads alginat viskositas 80-120 cP berbeda signifikan dibandingkan viskositas 500-600 cP yang dapat dilihat pada Lampiran 34. Hal ini dikarenakan alginatviskositas 500-600 cP lebih kental sehingga menghasilkan beads yang lebih padat dibandingkan alginat viskositas 80-120 cP. Kepadatan yang tinggi menyulitkan pelepasan obat dari dalam beads.
Gambar 4.4Grafik perbandinganpelepasan obatvs waktuberdasarkan
perbedaan viskositas alginatbeads alginat ukuran syringe 23G (ɸ = 0,337 mm)
Berdasarkan ukuran syringe, ditunjukkan melalui grafik pada Gambar 4.5 bahwa tidak terdapat perbedaan pelepasan kurkumin antara beads dari tiap ukuran syringe. Berdasarkan uji statistik ANOVA, tidak terdapat pelepasan kurkumin yang signifikan dari beads alginat berdasarkan perbedaan ukuran syringe. Hasil pengujian statistik dapat dilihat pada Lampiran 35. Hal ini dikarenakan ukuran diameter dalam syringe yang tidak berbeda jauh menghasilkan beads dengan ukuran yang tidak berbeda jauh pula sehingga pelepasan kurkumin relatif sama. 4.5.2Hasil Uji Pelepasan Berdasarkan Perbedaan Kadar Ekstrak
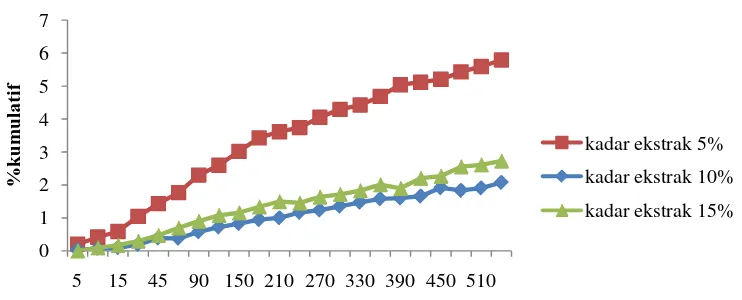
0
0 5 10 15 30 45 60 90 120150180210240270300330360390420450480510540
BerdasarkanGambar 4.6, dapat dilihat bahwa ada pengaruh kadar ekstrak terhadap rata-rata % kumulatif obat yang terlepas.Berdasarkan uji statistik ANOVA, tidak terdapat perbedaan AUC yang signifikan dari beads alginat berdasarkan perbedaan kadar ekstrak. Hasil pengujian statistik dapat dilihat pada Lampiran 36. Beads alginat dengan kadar ekstrak terendah yakni 5% menunjukkan pelepasan bahan aktif yang lebih tinggi dibandingkan kadar ekstrak 10% dan 15%. Ini dikarenakan semakin tinggi kadar ekstrak, semakin padat beads sehingga memperkecil pelepasan kurkumin dari beads. Selain itu, formula dengan ekstrak 5% memiliki perbandingan 1:1 terhadap surfaktan Tween 80, sehingga dibandingkan formula dengan ekstrak 10% dan ekstrak 15% (perbandingan ekstrak banding Tween 80 2:1 dan 3:1 berurutan) tidak efisien melepaskan bahan aktif.
Gambar 4.5Grafikperbandingan pelepasan obatvs waktuberdasarkan
Gambar 4.6Grafik pengaruh kadar ekstrak terhadap pelepasan kurkumin 4.6Hasil Kinetika Orde Pelepasan
Kinetika orde pelepasan dilakukan terhadap setiap beads dengan tiga model kinetika yaitu: orde nol, orde satu, dan model Higuchi. Penentuan kinetika pelepasan dilakukan untuk mengetahui berapa persen bahan aktif yang dilepaskan dari waktu ke waktu selama pengujian dengan memplotkan hasil uji pelepasan kurkumin dalam grafik waktu versus persen kumulatif, logaritma persen kumulatif versus waktu, dan persen kumulatif versus akar waktu maka dapat diperoleh nilai korelasi (R2). Kinetika pelepasan dari beads alginat dapat dilihat pada Tabel 4.4, 4.5, 4.6, dan 4.7. Kinetika orde pelepasan kurkumin dari semua beads alginat mengikuti kinetika pelepasan mengikuti kinetika pelepasan Orde Higuchi.
Tabel 4.4 Kinetika pelepasan obat dari beads alginat viskositas 500-600 dengan syringe 23G
Orde Kinetika Pelepasan Persamaan Regresi R2
Orde Nol y = 0,0052x + 0,4959 0,9371
Orde Satu y = 0,0019x - 0,3172 0,7459
Higuchi y = 0,1418x - 0,2334 0,9925
Model persamaan Higuchi adalah model teoritis untuk pelepasan obat yang larut dan sukar larut dalam air dari berbagai matriks, termasuk semipadat
dan padat. Obat yang terdispersi homogen di seluruh matriks dianggap melarut dalam matriks polimer dan berdifusi keluar dari permukaan matriks (Sinko, P. J., 2012).
Tabel 4.5 Kinetika pelepasan obat dari beads alginat viskositas 80-120 dengan syringe 21G
Orde Kinetika Pelepasan Persamaan Regresi R2
Orde Nol y = 0,0147x + 1,529 0,9412
Orde Satu y = 0,0019x + 0,1397 0,6798
Higuchi y = 0,398x - 0,52 0,9979
Tabel 4.6 Kinetika pelepasan obat dari beads alginat viskositas 80-120 dengan syringe 23G
Orde kinetika pelepasan Persamaan regresi R2
Orde Nol y = 0,0083x + 1,203 0,8678
Orde Satu y = 0,0017x - 0,0055 0,6491
Higuchi y = 0,2313x - 0,0426 0,9721
Tabel 4.7 Kinetika pelepasan obat dari beads alginat viskositas 80-120 dengan syringe 25G
Orde kinetika pelepasan Persamaan regresi R2
Orde Nol y = 0,0101x + 0,7747 0,9393
Orde Satu y = 0,0023x - 0,1964 0,6503
Higuchi y = 0,2721x - 0,6248 0,9948
4.7 Uji Bioadhesi
Tabel 4.8 Tabel hasil uji bioadhesi dari beads alginat
Mukoadhesi dan kekuatan interaksi beads alginat dapat dipengaruhi oleh struktur polimer dan gugus fungsional. Saat ini, polimer mukoadhesi yang umum digunakan tersusun atas gugus fungsi polar seperti gugus hidroksil (-OH), karboksil (-COOH), amida (-NH2), dan sulfat (-SO4) yang bisa berinteraksi dengan glikoprotein musin (Yu, et al., 2014). Alginat, terlihat pada Gambar 4.7mengandung gugus –OH dan (-COOH) menyebabkan sifat alaminya yang mukoadhesif sehingga cocok sebagai pembawa sediaan farmasi yang gastroretentif melekat di mukosa lambung.
Gambar 4.7 Struktur Alginat. Residu mannuronat diberi label M dan residu guluronat diberi label G (Tipton, 2010)
Percobaan Jumlah beads
Menit 0 Menit 5 Menit 10
1 20 15 15
2 20 18 15
3 20 19 19
rata-rata 17,333 16,3333
4.8 Hasil Uji In Vivo
4.8.1 Penginduksian Lesi Lambung dengan HCl 1 M
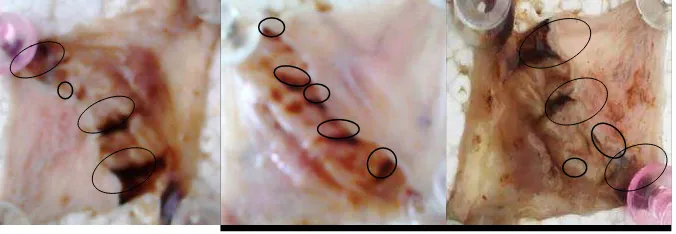
Pada semua tikus menunjukkan terjadinya lesi lambung setelah pemberian larutan HCl 1 M. Gambar 4.8 menunjukkan kerusakan pada mukosa lambung setelah pemberian HCl 1 M.
Gambar 4.8 Mukosa lambung setelah pemberian HCL 1 M
Pada Gambar 4.8 menunjukkan terdapat luka di mukosa lambung tikus yang diinduksi HCl 1 M satu jam sebelum pembedahan. Sekresi asam lambung ditetapkan sebagai salah satu faktor pembentuk tukak dalam menginduksipenyakit tukak lambung. Telah dilaporkan bahwa sekitar 50% pasien tukak lambung mensekresi pepsin dan asam lambung berlebihan (Szabo, et al., 1998; Aihara, et al., 2003; Sunil, et al., 2012).
4.8.2 Penyembuhan Lesi lambung
4.8.2.1 Pengamatan makroskopis lambung tikus
tikus 1 tikus 2 tikus 3
tanpa pengobatan
tikus 1 tikus 2 tikus 3
dengan pengobatan
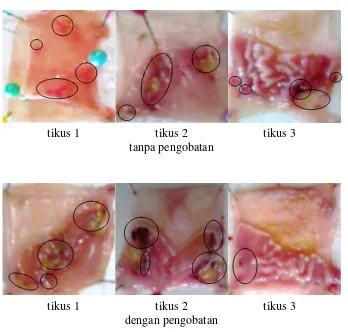
Gambar 4.9 Gambar makroskopik lambung tikus hari ke-2
Pengamatan secara makroskopis lambung tikus dilakukan dengan menghitung jumlah ulkus dan luas ulkus, kemudian dihitung indeks ulkus dari kelompok tanpa pengobatan dan kelompok dengan pengobatan dan dibandingkan.
tikus 1 tikus 2 tikus 3 tanpa pengobatan
tikus 1 tikus 2 tikus 3
dengan pengobatan
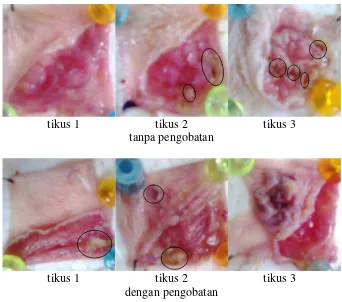
Gambar 4.10 Gambar makroskopik lambung tikus hari ke-4
Kelompok tanpa pengobatan masih menunjukkan adanya ulkus hingga pada hari ke-8 pada 1 subjek sedangkan kelompok dengan pengobatan sudah bersih yang ditunjukkan pada Gambar 4.12.
tikus 1 tikus 2 tikus 3
tikus 1 tikus 2 tikus 3 dengan pengobatan
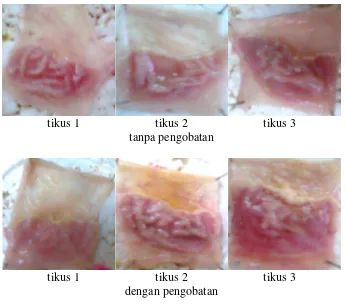
Gambar 4.11 Gambar makroskopik lambung tikus hari ke-6
tikus 1 tikus 2 tikus 3
tanpa pengobatan
tikus 1 tikus 2 tikus 3
dengan pengobatan
Gambar 4.12 Gambar makroskopik lambung tikus hari ke-8
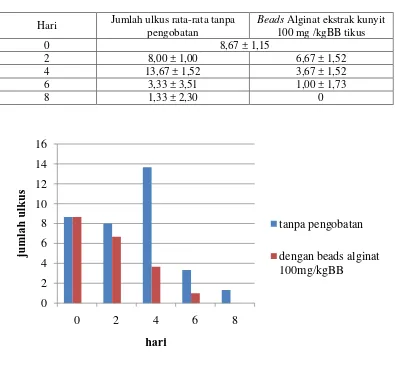
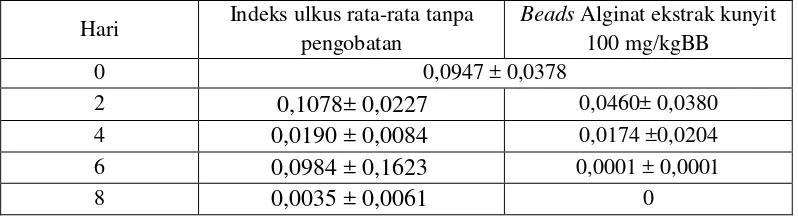
Selain pengamatan makroskopis dengan menghitung jumlah ulkus, dilakukan juga perhitungan indeks ulkus pada masing-masing kelompok. Efek penyembuhan dari beads alginat dapat dilihat juga dari penurunan indeks ulkus pada pembedahan hari kedua sampai hari kedelapan. Hasil indeks ulkus rata-rata pada kedua kelompok dapat dilihat pada Tabel 4.10.
Tabel 4.9 Jumlah ulkus rata-rata pada masing-masing kelompok (n = 3) Hari Jumlah ulkus rata-rata tanpa
pengobatan
Beads Alginat ekstrak kunyit 100 mg /kgBB tikus pengobatan dan dengan pengobatan (n = 3).
Pada Tabel 4.9 dan Gambar 4.13 dapat disimpulkan bahwa beads alginat dengan ekstrak kunyit mampu menyembuhkan lesi lambung lebih cepat jika dibandingkan dengan tanpa pengobatan.
Hari Indeks ulkus rata-rata tanpa pengobatan
Beads Alginat ekstrak kunyit 100 mg/kgBB
Pada Tabel 4.10 dan Gambar 4.14, dilihat dari penurunan indeks ulkus dapat disimpulkan bahwa pemberian beads alginat dapat menyembuhkan ulkus lambung pada tikus, namun dibandingkan dengan kelompok tanpa pengobatan kurang signfikan, dilihat dengan adanya beberapa titik pada grafik dengan pengobatan yang masih bersinggungan dengan grafik tanpa pengobatan.
Grafik perbandingan indeks ulkus pada mukosa lambung masing – masing kelompok tampak pada Gambar 4.14.
Gambar 4.14 Perbandingan indeks ulkus antara kelompok tikus tanpa pengobatan dan yang diberi beads alginat (n = 3)
Sel-sel saluran pencernaan memiliki kecepatan pergantian tinggi yang membuat mukosa saluran pencernaan menjadi jaringan paling cepat berproliferasi dalam tubuh setelah jaringan kulit (Davenport, 1982). Pada kondisi normal, populasi sel dalam saluran pencernaan dipertahankan pada kondisi stabil dinamis
akibat kehilangan sel karena pengelupasan permukaan sel (sebab mukosa lambung sering terpapar senyawa-senyawa yang memiliki pH, osmolaritas, dan suhu dengan rentang luas) diseimbangkan dengan pembaharuan sel yang terus menerus (Lipkin, 1987). Keseimbangan antara sel yang hilang dan pembaharuan sel harus diatur dengan ketat, karena kehilangan sel yang berlebihan dapat menyebabkan atrofi atau pembentukan tukak, sedangkan kelebihan proliferasi atau perpanjangan waktu hidup sel dapat memicu hiperplasia (Johnson dan McCormack, 1994).
Kurkumin, komponen bioaktif dari kunyit, telah menunjukkan peran penting dalam pencegahan dan pengobatan berbagai penyakit kronik proinflamasi termasuk penyakit neurodegeneratif, kardiovaskular, paru-paru, metabolisme, autoimun, dan penyakit mematikan. Aktivitas kurkumin melawan penyakit kronik dihubungkan dengan penghambatan biomarker inflamasi. Banyak studi in vitro telah melaporkan bahwa kurkumin memiliki kemampuan menghambat faktor transkripsi proinflamasi (Krishnaswamy, 2009).
menunjukkan efek penghambatan pada aktivasi NF-kappa B dan juga IL oleh H. pylori (Munzeinmaier, et al., 1997). Ini menjelaskan efek anti H. pylori dari kunyit dan kemudian penyembuhan tukak lambungnya.
4.8.2.2 Pengamatan mikroskopis lambung tikus
Pengamatan mikroskopis dilakukan dengan uji histologi jaringan lambung tikus. Gambar 4.15 menunjukkan hasil mikroskopik dari lambung tikus normal.
Gambar 4.15 Hasil mikroskopik lambung normal perbesaran 40 (kiri) dan 100 (kanan)
Keterangan: 1. Lapisan mukosa
2. Lapisan muskularis mukosa 3. Lapisan submukosa
4. Lapisan tunika muskularis
Pada Gambar 4.16 menunjukkan tikus kelompok kontrol ulkus setelah 1 jam pemberian HCl. Erosi yang terbentuk ditunjukkan oleh gambar panah. Terjadi kerusakan dan erosi sel-sel epitel yang cukup dalam (ditunjukkan oleh anak panah) pada permukaan mukosa lambung karena bersentuhan langsung dengan HCl. Iritasi yang bersifat lokal menimbulkan kerusakan jaringan dan menyebabkan difusi kembali asam lambung ke mukosa (Sherwood, 2011).
1
2
Gambar 4.16 Hasil mikroskopik lambung setelah pemberian HCl perbesaran 40 (atas) dan 100 (bawah)
Keterangan: 1. Lapisan mukosa
2. Lapisan muskularis mukosa 3. Lapisan submukosa
4. Lapisan tunika muskularis
Pengamatan mikroskopik hari ke-2 ditunjukkan pada Gambar 4.17 dan Gambar 4.18. Gambar mikroskopik menunjukkan masih adanya kerusakan sel-sel epitel dan terjadi erosi pada sel-sel epitel pada pembedahan hari ke-2. Pengamatan mikroskopik hari ke-4 mulai menunjukkan perbedaan signifikan, dimana sel-sel epitel kelompok tanpa pengobatan masih terdapat erosi yang cukup dalam di semua preparat, sedangkan pada kelompok pengobatan, sel-sel epitel mulai mendekati keadaan normal. Pengamatan mikroskopik hari ke-4 kelompok tanpa pengobatan ditunjukkan pada Gambar 3.19 dan kelompok dengan pengobatan pada Gambar 4.20.
Gambar 4.17 Hasil mikroskopik lambung kelompok tanpa pengobatan hari ke-2 perbesaran 40 (atas) dan 100 (bawah)
Gambar 4.18 Hasil mikroskopik lambung kelompok dengan pengobatan hari ke-2 perbesaran 40 (kiri) dan 100 (kanan)
Gambar 4.19 Hasil mikroskopik lambung kelompok tanpa pengobatan hari ke-4 perbesaran 40 (atas) dan 100 (bawah)
Gambar 4.20 Hasil mikroskopik lambung kelompok dengan pengobatan hari ke-4 perbesaran 40 (atas) dan 100 (bawah)
Pengamatan mikroskopik hari ke-6 menujukkan bahwa kelompok tanpa pengobatan masih terdapat erosi dan kelompok dengan pemberian
1
1
1 2
2
2
3 3
3
4 4
1
1 1
2
2 2
3
3
3 4
4
obatmenunjukkan sel-sel epitel yang mendekati kondisi normal. Pengamatan mikroskopik hari ke -6 ditunjukkan pada Gambar 4.21 dan 4.22.
Pengamatan mikroskopik hari ke-8, menunjukkan kelompok tanpa pengobatan masih terdapat erosi sedangkan kelompok dengan pengobatan menunjukkan sel-sel epitel yang normal. Pengamatan mikroskopik hari ke-8 ditunjukkan pada Gambar 4.23 dan 4.24.
Hasil mikroskopik menunjukkan bahwa kelompok pengobatan mencapai tingkat kesembuhan pada hari ke-8 dibandingkan kelompok tanpa pengobatan.
Gambar 4.21 Hasil mikroskopik lambung kelompok tanpa pengobatan hari ke-6 perbesaran 40 (atas) dan 100 (bawah)
Penyembuhan tukak lambung membutuhkan penyusunan kembali struktur epitel dan jaringan penghubung yang menopang, termasuk lapisan pembuluh dan otot. Beberapa faktor pertumbuhan telah dilibatkan dalam proses ini, karena kemampuannnya dalam mengatur fungsi penting sel, seperti proliferasi sel, migrasi, diferensiasi, sekresi, dan degradasi matriks ekstraseluler, dimana semuanya penting selama penyembuhan jaringan (Milani dan Calabro, 2001).
1 1
1
2
2 2
3 3
3 4 4
Gambar 4.22 Hasil mikroskopik lambung kelompok dengan pengobatan hari ke-6 perbesaran 40 (atas) dan 100 (bawah)
Gambar 4.23 Hasil mikroskopik lambung kelompok tanpa pengobatan hari ke-8 perbesaran 40 (atas) dan 100 (bawah)
4
4 4
3
3 3
2 2
2 1
1
1
1
1 1
2 2
2
3
3 3
4
4
Gambar 4.24 Hasil mikroskopik lambung kelompok dengan pengobatan hari ke-8 perbesaran 40 (atas) dan 100 (bawah)
Penyembuhan luka merupakan proses yang melibatkan peptida faktor pertumbuhan dimana TGF-beta adalah salah satu yang paling penting. Nitric oxide juga merupakan faktor penting penyembuhan dan produksinya diatur oleh inducible nitric oxide synthase (iNOS).Kurkumin secara signifikan mempercepat penyembuhan luka oleh karena peningkatan ekspresi TGF-beta1 dan TGF-beta tIIrc dan peningkatan level iNOS (Mani, et al., 2002).
Gambar 4.25 Jalur infeksi pembentukan tukak lambung oleh H. pylori (Li, et al., 2015).
4
4 4
1
2
2 2
1 1
3
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Ada pengaruh viskositas alginatdan kadar ekstrak terhadap pelepasan kurkumin daribeads alginat, tetapi tidak ada pengaruh ukuran syringe terhadap pelepasan kurkumin.
2. Sediaan beads alginat yang mengandung ekstrak kunyit bersifat gastroretentif dengan nilai persen bioadhesi 87% pada menit ke-5 dan 82% pada menit ke-10.
3. Sediaan beads alginat dari ekstrak kunyit efektif menyembuhkan lesi lambung pada dosis 100mg/kgBB tikus pada hari ke-8.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Lambung
Lambung adalah rongga berbentuk J yang terletak antara esofagus dan usus halus. Organ ini dibagi menjadi tiga bagian berdasarkan pembedaan anatomik, histologis, dan fungsional. Fundus adalah bagian lambung yang terletak di atas lubang esofagus. Bagian tengah atau utama lambung adalah korpus. Lapisan otot polos di fundus dan korpus relatif tipis, tetapi bagian bawah lambung, antrum, memiliki otot yang jauh labih tebal. Perbedaan ketebalan otot ini memiliki peran penting dalam motilitas lambung di kedua regio tersebut. Juga terdapat perbedaan kelenjar di mukosa regio-regio ini. Bagian terminal lambung adalah sfingter pilorus, yang bekerja sebagai sawar antara lambung dan bagian atas usus halus duodenum (Sherwood, 2011).
2.1.1 Fungsi lambung
Lambung melakukan tiga fungsi utama:
1. Lambung menyimpan makanan yang masuk sampai makanan dapat disalurkan ke usus halus dengan kecepatan yang sesuai untuk pencernaan dan penyerapan yang optimal. Diperlukan waktu beberapa jam untuk mencerna dan menyerap satu porsi makanan yang dikonsumsi hanya dalam bilangan menit. Lambung menyimpan makanan dan menyalurkannya secara mencicil ke duodenum dengan kecepatan yang tidak melebihi kapasitas usus halus.
3. Melalui gerakan mencampur lambung, makanan yang tertelan dihaluskan dan dicampur dengan sekresi lambung untuk menghasilkan campuran cairan kental yang dikenal sebagai kimus (Sherwood, 2011).
2.1.2 Anatomi Lambung
Secara anatomi, lambung dibagi atas tiga bagian:fundus, badan (body), dan pilorus antrum. Bagian proksimal terdiri atas fundus dan badan lambung bertindak sebagai penampung materi yang belum dicerna, dimana antrum adalah bagian utama tempat gerakan pencampuran dan bertindak sebagai pompa untuk pengosongan lambung dengan gerakan mendorong. Pengosongan lambung terjadi selama puasa (fasted state) dan juga keadaan kenyang (fed state). Selama keadaan puasa, terjadi seri elektrik interdigestifmelewati lambung dan usus tiap 2-3 jam. Ini disebut siklus miloelektrik interdigestif atau migrating myloelectric cycle (MCC), yang kemudian dibagi menjadi 4 fase (Singh dan Kim, 2000).
Tabel 2.1 Empat fase dalammigrating myloelectric cycle (MCC) (Talukder dan Fassihi, 2004)
Fase I Fase I adalah periode tanpa gerak, berlangsung 30-60 menit tanpa ada kontraksi
Fase II Fase II terdiri atas kontraksi singkat yang perlahan meningkat intensitasnya seiring berjalannya fase dan berlangsung sekitar 20-40 menit. Lambung kemudian mengeluarkan cairan dan partikel yang sangat kecil pada fase ini
Fase III Fase III adalah periode singkat dari kontraksi lambung proksimal dan distal yang kuat (4-5 kontraksi per menit) berlangsung sekitar 10-20 menit. Kontraksi ini juga dikenal sebagai gelombang house-keeper, menyapu isi lambung ke arah bawah menuju usus halus Fase IV Fase IV adalah periode transit singkat kira–kira 0-5 menit dan
kontraksi mengosongkan antara bagian akhir fase III dan fase I yang tanpa gerakan
pencernaan (digestive motility pattern) dan terdiri atas kontraksi lanjutan fase II pada keadaan puasa. Kontraksi ini menghasilkan pengurangan ukuran dari partikel makanan (hingga kurang dari 1 mm), yang didorong menuju pilorus dalam bentuk suspensi. Selama keadaan kenyang, onset MCC ditunda sehingga memperlambat waktu pengosongan lambung (Allen dan Snary, 1972).
2.1.3 Mukosa dan mukus lambung
Lambung dilindungi oleh mukosa yang mencegah sekresi lambung dan agen perusak lainnya melukai lapisan epitel dan lapisan terdalam dari dinding lambung. Dinding mukosa biasanya impermeabel terhadap asam yang disekresinya, sehingga lambung bisa menyimpan asam dan pepsin tanpa membuat dindingnya ikut tercerna. Beberapa faktor membantu menjaga mukosa lambung, termasuk penutupan permukaan sel epitel yang impermeabel, mekanisme transpor selektif ion hidrogen dan bikarbonat, dan sifat mukus lambung. Mekanisme ini disebut sebagai mukosa lambung penghalang (Porth, 2009).
Mukus adalah lapisan gel yang melekat pada mukosa berupa sekresi lengket dan kental yang disintesa oleh sel goblet khusus. Sel ini adalah sel epitel kelenjar berbentuk kolom dan berada di sepanjang semua organ yang terpapar ke bagian luar. Mukus ditemukan memiliki banyak fungsi seperti pelumas bagi objek yang melewatinya, mempertahankan lapisan epitel tetap terhidrasi, sebagai penghalang bagi patogen dan senyawa berbahaya, dan sebagai lapisan gel permeabel bagi pertukaran gas dan nutrien dari dan ke dalam epitel (Bansil dan Turner, 2006). Mukus ini berfungsi sebagai sawar protektif terhadap beberapa bentuk cedera yang dapat mengenai mukosa lambung:
b. mukus membantu mencegah dinding lambung mencerna dirinya sendiri karena pepsin terhambat jika berkontak dengan lapisan mukus yang menutupi bagian dalam lambung
c. karena bersifat basa, mukus membantu melindungi lambung dari cedera asam karena menetralkan HCl di dekat lapisan dalam lambung, tetapi tidak mengganggu fungsi HCl di lumen. Sementara pH di lumen dapat serendah 2, pH di lapisan mukus di permukaan sel mukosa adalah sekitar 7 (Sherwood, 2011).
Mukus terdiri atas air (>95%), musinglikoprotein dan lipid (0,5-5 %) yang merupakan glikoprotein dengan berat molekul sangat tinggi (2-4 x 106 g/mol), garam inorganik (elektrolit; 0,5-1%) dan protein bebas (1%). Musin ada dalam keluarga glikoprotein yang dikarakterisasi berdasarkan berat molekul (BM) beragam dari 1000 hingga 4000 kDa. Glikoprotein musin membentuk jaringan makromolekul sangat kusut yang berhubungan satu sama lain melalui ikatan nonkovalen. Hubungan makromolekular tersebut adalah pusat dari struktur mukus dan bertanggung jawab atas sifat alirannya. Komponen non musin laintermasuk IgA, lisozin, laktoferrin, lipid, polisakarida, dan bermacam spesies ionik lain yang dipercaya memiliki aktivitas bakteriostatik. Komposisi dapat beragam bergantung asal dan peran mukus, dan kondisi kesehatan individu (Allen dan Snary, 1972; Sandri, et al., 2015).
mukosa. Mukus yang larut air tercuci dari permukaan dan bercampur dengan isi lambung; sifatnya sebagai lubrikan yang mencegah kerusakan mekanik pada permukaan mukosa. Kemampuannya mempengaruhi permeabilitas mukosa dan produksi bikarbonat, dapat dihambat dan diubah sifatnya oleh agen perusak seperti aspirin dan OAINS (Porth, 2009).
2.2 Sistem Penyampaian Gastroretentif
Sistem penyampaian gastroretentif adalah bentuk sediaan yang dapat tertahan di lambung selama beberapa jam dan secara signifikan memperpanjang waktu tinggal obat dalam lambung. Sistem ini disampaikan per oral, tertahan dalam lambung, dan akan melepaskan obat dengan cara terkontrol, sehingga obat dapat disuplai secara kontinu pada daerah absorpsi saluran pencernaan (Nayak, et al., 2010).
Memperpanjang waktu tinggal obat di lambung diinginkan untuk mencapai keuntungan terapi dari obat yang diabsorpsi di bagian proksimal saluran pencernaan, atau yang kurang larut, atau terdegradasi pH basa pada bagian bawah saluran pencernaan. Sistem penyampaian gastroretentif menguntungkan bagi obat untuk:
a. meningkatkan bioavailabilitas b. efisiensi terapi
c. kemungkinan pengurangan dosis
d. keuntungan farmakokinetik, seperti mempertahankan level terapetik yang konstan dan mengurangi fluktuasi konsentrasi terapetik (Ali, et al., 2005).
systems (FDDS)), juga dikenal sebagai sistem hidrodinamik seimbang (hydrodynamically balanced systems (HBS)), sistem mengembang (swelling) dan melebar (expanding), dan sistem polimer bioadhesif (Mishra, 2016).
Tabel 2.2 Perbandinganantarasistem penyampaianobat gastroretentif dan sistempenyampaian obat konvensional (Badoni, et al., 2012)
No. Perbandingan Konvensional Gastroretentif
1 Toksisitas Toksisitas berisiko tinggi
Toksisitas berisiko rendah
2 Kepatuhan pasien berkurang Meningkatkan
kepatuhan pasien 3 Obat dengan absorpsi
sempit pada usus halus Tidak cocok Cocok 4
Obat dengan absorpsi cepat melalui saluran pencernaan
Tidak
menguntungkan
Sangat
menguntungkan 5 Obat yang didegradasi
dalam kolon 7 Obat dengan kelarutan
rendah pada pH basa
Tidak
menguntungkan
Sangat
menguntungkan
Bentuk sediaan pelepasan terkontrol mampu mencapai berbagai keuntungan terapi, termasuk (a) mempertahankan konsentrasi plasma dalam rentang yang diinginkan dengan fluktuasi minimal sehingga efek terapi yang lebih konstan; (b) peningkatan durasi aktivitas dari obat dengan waktu paruh singkat; (c) mengurangi efek samping; (d) mengurangi frekuensi dosis dan peningkatan kepatuhan pasien; dan (e) potensi untuk penyampaian obat tapak spesifik dalam saluran pencernaan (Wen dan Park, 2010).
2.3 Sistem mukoadhesif