STUDI PEMANFAATAN DAUN NANAS (Ananas cosmosus)
SEBAGAI ADSORBEN UNTUK MENURUNKAN
KANDUNGAN ION TEMBAGA (Cu
2+),
BESI (Fe
3+), DAN SENG (Zn
2+)
DIDALAM AIR
SKRIPSI
MEGAWATI SIMANJUNTAK 100822011
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PEMANFAATAN DAUN NANAS (Ananas cosmosus)
SEBAGAI ADSORBEN UNTUK MENURUNKAN
KANDUNGAN ION TEMBAGA (Cu
2+),
BESI (Fe
3+), DAN SENG (Zn
2+)
DIDALAM AIR
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains.
MEGAWATI SIMANJUNTAK
100822011
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : STUDI PEMANFAATAN DAUN NANAS (Ananas
cosmosus) SEBAGAI ADSORBEN UNTUK
MENURUNKAN KANDUNGAN ION TEMBAGA (Cu2+), BESI (Fe3+), DAN SENG (Zn2+) DIDALAM AIR
Kategori : SKRIPSI
Nama : MEGAWATI SIMANJUNTAK
Nomor Induk Mahasiswa : 100822011
Program Studi : SARJANA (S1) KIMIA EKSTENSI
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di, Medan, Oktober 2012 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Chairuddin, M.Sc Jamahir Gultom Ph.D
NIP. 195912311987011001 NIP. 195209251977031001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PEMANFAATAN DAUN NANAS (Ananas cosmosus)
SEBAGAI ADSORBEN UNTUK MENURUNKAN
KANDUNGAN ION TEMBAGA (Cu
2+),
BESI (Fe
3+), DAN SENG (Zn
2+)
DIDALAM AIR
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Oktober 2012
PENGHARGAAN
Segala puji dan syukur ke hadirat TuhanYesus Kristus, karena kasih karunia dan berkat-NYA yang melimpah penulis dapat meyelesaikan penelitian dan menyusun skripsi ini.
Dalam kesempatan ini dengan segala kerendahan hati penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada Orang Tua tercinta, abang, kakak, dan adik-adikku tercinta atas cinta kasih, dukungan, semangat dan pengorbanan, serta doa tulus yang tiada hentinya bagi penulis sehingga penulis dapat menyelesaikan skripsi ini.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Jamahir Gultom, Ph.D selaku dosen pembimbing I dan Bapak Drs.Chairuddin, M.Sc selaku dosen pembimbing II yang telah memberikan perhatian, bimbingan, dan saran kepada penulis selama penelitian dan penyusunan skripsi. Ibu Dr. Rumondang Bulan, MS selaku ketua departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Bapak Drs. Albert Pasaribu, M.Sc selaku sekretaris departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Buat seluruh staf dosen yang mengajar di departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. Bapak Prof.Dr. Harlem Marpaung selaku kepala Laboratorium Kimia Analitik beserta seluruh staf, laboran dan asisten Laboratorium Kimia Analitik yang telah membantu penulis selama melakukan penelitian. Buat sahabat-sahabatku Elda Arnaeva Sitepu, Andreas, Nur Zahara, Ira Veronika Sihombing, Cut Mustika, Mares Sipahutar, Edyatur Pane, Winny, Dian Gulo, Lina Chuango dan seluruh teman-teman Ekstensi Stambuk 2010 yang telah memberikan saran dan dukungan buat saya.
ABSTRAK
STUDY THE USE OF PINEAPPLE LEAF (Pineapple cosmosus) AS AN
ADSORBENT TO REDUCED OF ION COPPER (Cu2+),
IRON (Fe3+), AND ZINC (Zn2+) CONTENTS IN WATER
ABSTRACT
DAFTAR ISI
Halaman
PERSETUJUAN ii
PERNYATAAN iii
PENGHARGAAN iv
ABSTRAK v
ABSTRACT vi
DAFTAR ISI vii
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
BAB 1 PENDAHULUAN 1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 3
1.6. Lokasi Penelitian 3
1.7. Metodologi Penelitian 4
BAB 2 TINJAUAN PUSTAKA 2.1. Nanas 5
2.2. Kandungan Logam Dalam Air 8
2.3. Tembaga (Cu) 9
2.3.1. Sifat dan Kegunaan 9
2.3.2. Tingkat Pencemaran 10
2.3.3. Efek Toksik 10
2.4. Besi (Fe) 12
2.4.1. Sifat dan Kegunaan 12
2.4.2. Tingkat Pencemaran 12
2.4.3. Efek Toksik 13
2.5. Seng (Zn) 14
2.5.1. Sifat dan Kegunaan 14
2.5.2. Tingkat Pencemaran 15
2.5.3. Efek Toksik 15
2.6. Adsorpsi 16
2.7. Aktivasi dengan HCl 19
2.8. Spektrofotometri Serapan Atom (SSA) 21
2.8.1. Prinsip Dasar Analisa Spektrofotometri Serapan Atom (SSA) 21
2.8.2. Instrumentasi Spektrofotometri Serapan Atom (SSA) 22
BAB 3 BAHAB DAN METODE PENELITIAN 3.1. Alat-alat 25
3.2. Bahan-bahan 26
3.3. Prosedur Penelitian 26
3.3.1. Pembuatan HCl 5% 26
3.3.3. Pembuatan HCl 15% 26
3.3.4. Penyedian Sampel Daun Nanas 26
3.3.5. Aktivasi Serbuk Daun Nanas Dengan HCl 5% 27
3.3.6. Aktivasi Serbuk Daun Nanas Dengan HCl 10% 27
3.3.7. Aktivasi Serbuk Daun Nanas Dengan HCl 15% 27
3.3.8. Pembuatan Larutan Standar Cu2+ 28
3.3.8.1. Pembuatan Larutan Blanko 28
3.3.8.2. Pembuatan Larutan Standar Cu2+ 1000 mg/L 28
3.3.8.3. Pembuatan Larutan Standar Cu2+ 100 mg/L 28
3.3.8.4. Pembuatan Larutan Standar Cu2+ 20 mg/L 28
3.3.8.5. Pembuatan Larutan Standar Cu2+ 10 mg/L 28
3.3.8.6 Pembuatan Larutan Seri Standar Cu2+ 0,5; 1,0; 2,0; 3,0; 4,0 mg/L 28
3.3.8.7.Pembuatan Kurva Kalibrasi Ion Cu2+ 28
3.3.9 Pembuatan Larutan Standar Fe3+ 29
3.3.9.1. Pembuatan Larutan Blanko 29
3.3.9.2. Pembuatan Larutan Standar Fe3+ 1000 mg/L 29
3.3.9.3. Pembuatan Larutan Standar Fe3+ 100 mg/L 29
3.3.9.4. Pembuatan Larutan Standar Fe3+ 20 mg/L 29
3.3.9.5. Pembuatan Larutan Standar Fe3+ 10 mg/L 29
3.3.9.6. Pembuatan Larutan Seri Standar Fe3+ 0,5; 1,0; 2,0; 3,0; 4,0 mg/L 29
3.3.9.7. Pembuatan Kurva Kalibrasi Ion Fe3+ 30
3.3.10. Pembuatan Larutan Standar Zn2+ 30
3.3.10.1. Pembuatan Larutan Blanko 30
3.3.10.2. Pembuatan Larutan Standar Zn2+ 1000 mg/L 30
3.3.10.3. Pembuatan Larutan Standar Zn2+ 100 mg/L 30
3.3.10.4. Pembuatan Larutan Standar Zn2+ 20 mg/L 30
3.3.10.5. Pembuatan Larutan Standar Zn2+ 10 mg/L 30
3.3.10.6. Pembuatan Larutan Seri Standar Zn2+ 0,2; 0,4; 0,6; 0,8; 1,0 mg/L 31
3.3.10.7. Pembuatan Kurva Kalibrasi Ion Zn2+ 31
3.3.11.Penyerapan Ion Cu2+, Fe3+, dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan Menggunakan HCl 5% dan Penentuan Ion Cu2+, Fe3+ dan Zn2+ dengan Spektrofotometri Serapan Atom (SSA) 31
3.3.11.1 Penyerapan Ion Cu2+ Setelah Penambahan Serbuk Daun Nanas Aktif 31
3.3.11.2 Penentuan Ion Cu2+ dengan Spektrofotometri Serapan Atom (SSA) 31
3.3.11.3 Penyerapan Ion Fe3+ Setelah Penambahan Serbuk Daun Nanas Aktif 31
3.3.11.4 Penentuan Ion Fe3+ dengan Spektrofotometri Serapan Atom (SSA) 32
3.3.11.5 Penyerapan Ion Zn2+ Setelah Penambahan Serbuk Daun Nanas Aktif 32
Serbuk Daun Nanas yang Telah Diaktivasi dengan
Menggunakan HCl 10% dan Penentuan Ion Cu2+, Fe3+ dan Zn2+
dengan Spektrofotometri Serapan Atom (SSA) 32
3.3.12.1 Penyerapan Ion Cu2+ Setelah Penambahan Serbuk Daun Nanas Aktif 32
3.3.12.2. Penentuan Ion Cu2+ dengan Spektrofotometri Serapan Atom (SSA) 33
3.3.12.3. Penyerapan Ion Fe3+ Setelah Penambahan Serbuk Daun Nanas Aktif 33
3.3.12.4. Penentuan Ion Fe3+ dengan Spektrofotometri Serapan Atom (SSA) 33
3.3.12.5. Penyerapan Ion Zn2+ Setelah Penambahan Serbuk Daun Nanas Aktif 33
3.3.12.6. Penentuan Ion Zn2+ dengan Spektrofotometri Serapan Atom (SSA) 33
3.3.13. Penyerapan Ion Cu2+, Fe3+, dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan Menggunakan HCl 15% dan Penentuan Ion Cu2+, Fe3+ dan Zn2+ 34
3.3.13.1. Penyerapan Ion Cu2+ Setelah Penambahan Serbuk Daun Nanas Aktif 34
3.3.13.2. Penentuan Ion Cu2+ dengan Spektrofotometri Serapan Atom (SSA) 34
3.3.13.3. Penyerapan Ion Fe3+ Setelah Penambahan Serbuk Daun Nanas Aktif 34
3.3.13.4. Penentuan Ion Fe3+ dengan Spektrofotometri Serapan Atom (SSA) 34
3.3.13.5. Penyerapan Ion Zn2+ Setelah Penambahan Serbuk Daun Nanas Aktif 34
3.3.13.6. Penentuan Ion Zn2+ dengan Spektrofotometri Serapan Atom (SSA) 35
3.4 Bagan Penelitian 36
3.4.1 Penyediaan Daun Nanas 36
3.4.2 Aktivasi Serbuk Daun Nanas 36
3.4.3 Pengukuran Absorbansi Larutan Blanko dan Larutan Seri Standar Cu2+, Fe3+, dan Zn2+ (Pembuatan Kurva Kalibrasi) 37
3.4.3.1 Pengukuran Absorbansi Larutan Blanko 37
3.4.3.2 Pengukuran Absorbansi Larutan Seri Standar Ion Cu2+, dan Fe3+ (Pembuatan Kurva Kalibrasi) 38
3.4.3.3 Pengukuran Absorbansi Larutan Seri Standar Ion Zn2+ (Pembuatan Kurva Kalibrasi) 39
3.4.4 Penyerapan Ion Cu2+, Fe3+, dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan HCl 5%; HCl 10%; dan HCl 15% Pada Larutan Sintetis 40
BAB 4 HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian 41
Ion Tembaga (Cu2+) 41 4.1.1.2. Pengolahan Data Ion Tembaga (Cu2+) 42 4.1.1.2.1. Penurunan Persamaan Garis Regresi dengan Metode
Least Square 42 4.1.1.2.2. Perhitungan Koefisien Korelasi 44 4.1.1.3. Penentuan Persentase (%) Penurunan Konsentrasi
Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5%; HCl 10%;
dan HCl 15% 45 4.1.1.3.1. Penentuan Persentase (%)Penurunan Konsentrasi
Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5% 45
4.1.1.3.2. Penentuan Persentase (%)Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 10% 45
4.1.1.3.3. Penentuan Persentase (%)Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 15% 46 4.1.1.4. Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah
Penambahan Serbuk Daun Nanas yang Telah Diaktivasi
Menggunakan HCl 5%; HCl 10%; dan HCl 15% 46 4.1.2. Ion Besi (Fe3+) 48 4.1.2.1. Konsentrasi dan Absorbansi Larutan Seri Standar
Ion Besi (Fe3+) 48 4.1.2.2. Pengolahan Data Ion Besi (Fe3+) 49 4.1.2.2.1. Penurunan Persamaan Garis Regresi dengan Metode
Least Square 49 4.1.2.2.2. Perhitungan Koefisien Korelasi 51 4.1.2.3. Penentuan Persentase (%)Penurunan Konsentrasi
Ion Besi (Fe3+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 5%; HCl 10%; dan HCl 15% 52
4.1.2.3.1. Penentuan Persentase (%) Penurunan Konsentrasi Ion Besi (Fe3+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 5% 52 4.1.2.3.2. Penentuan Persentase (%) Penurunan Konsentrasi
Ion Besi (Fe3+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 10% 52 4.1.2.3.3. Penentuan Persentase (%) Penurunan Konsentrasi
Ion Besi (Fe3+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 15% 53 4.1.2.4. Penurunan Konsentrasi Ion Besi (Fe3+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan
HCl 5%; HCl 10%; dan HCl 15% 53 4.1.3. Ion Seng (Zn2+) 55 4.1.3.1. Konsentrasi dan Absorbansi Larutan Seri Standar
Least Square 56 4.1.3.2.2. Perhitungan Koefisien Korelasi 58 4.1.3.3. Penentuan Persentase (%) Penurunan Konsentrasi
Ion Seng (Zn2+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 5%; HCl 10%; dan HCl 15% 58
4.1.3.3.1. Penentuan Persentase (%)Penurunan Konsentrasi Ion Seng (Zn2+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 5% 58 4.1.3.3.2. Penentuan Persentase (%)Penurunan Konsentrasi
Ion Seng (Zn2+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 10% 59 4.1.3.3.3. Penentuan Persentase (%)Penurunan Konsentrasi
Ion Seng (Zn2+) Setelah Penambahan Serbuk Daun
Nanas yang Telah Diaktivasi Menggunakan HCl 15% 59 4.1.3.4. Penurunan Konsentrasi Ion Seng (Zn2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan
HCl 5%; HCl 10%; dan HCl 15% 60
4.2. Pembahasan 62
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 66
5.2 Saran 66
DAFTAR PUSTAKA
DAFTAR TABEL
Halaman Tabel 2.1. Komposisi Kimia Serat Nanas 7 Tabel 2.2. Karakteristik dari Adsorpsi Fisika dan Kimia 18
Tabel 2.3. Sifat – sifat asam klorida (HCl) 20
Tabel 4.1. Kondisi Alat SSA Merek Shimadzu tipe AA-7000F Pada Pengukuran Konsentrasi Ion Tembaga (Cu2+) 41 Tabel 4.2. Data Konsentrasi dan Absorbansi Larutan Seri Standar
Ion Tembaga (Cu2+) 42
Tabel 4.3. Data Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5% 47 Tabel 4.4. Data Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 10% 47 Tabel 4.5. Data Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 15% 48 Tabel 4.6 Kondisi Alat SSA Merek Shimadzu tipe AA-7000F Pada Pengukuran Konsentrasi Ion Besi (Fe3+) 48 Tabel 4.7. Data Konsentrasi dan Absorbansi Larutan Seri Standar
Ion Besi (Fe3+) 49
Tabel 4.8. Data Penurunan Konsentrasi Ion Besi (Fe3+) Setelah Penambahan
Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5% 54 Tabel 4.9. Data Penurunan Konsentrasi Ion Besi (Fe3+) Setelah Penambahan
Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 10% 54 Tabel 4.10. Data Penurunan Konsentrasi Ion Besi (Fe3+) Setelah Penambahan
Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 15% 54 Tabel 4.11. Kondisi Alat SSA Merek Shimadzu tipe AA-7000F Pada Pengukuran Konsentrasi Ion Seng (Zn2+) 55 Tabel 4.12. Data Konsentrasi dan Absorbansi Larutan Seri Standar
Ion Seng (Zn2+) 56
Tabel 4.13. Data Penurunan Konsentrasi Ion Seng (Zn2+) Setelah Penambahan
Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5% 60 Tabel 4.14. Data Penurunan Konsentrasi Ion Seng (Zn2+) Setelah Penambahan
Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 10% 61 Tabel 4.15. Data Penurunan Konsentrasi Ion Seng (Zn2+) Setelah Penambahan
Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 15% 61 Tabel 1.Data Hasil Uji Coba Serbuk Daun Nanas (Ananas cosmosus) yang
Telah Diaktivasi Menggunakan HCl 10% Terhadap Sampel Air Sungai
DAFTAR GAMBAR
Halaman Gambar 2.1. Skema Instrumentasi Spektrofotometri Serapan Atom (SSA) 22 Gambar 4.1. Kurva Kalibrasi Larutan Seri Standar Ion Tembaga (Cu2+) 42 Gambar 4.2. Kurva Kalibrasi Larutan Seri Standar Ion Besi (Fe3+) 49 Gambar 4.3. Kurva Kalibrasi Larutan Seri Standar Ion Seng (Zn2+) 56 Gambar 4.4 Kurva Penyerapan Serbuk Daun Nanas dengan Aktivasi HCl
Terhadap Ion Tembaga (Cu2+) 63 Gambar 4.5. Kurva Penyerapan Serbuk Daun Nanas dengan Aktivasi HCl
Terhadap Ion Besi (Fe3+) 64 Gambar 4.6. Kurva Penyerapan Serbuk Daun Nanas dengan Aktivasi HCl
ABSTRAK
STUDY THE USE OF PINEAPPLE LEAF (Pineapple cosmosus) AS AN
ADSORBENT TO REDUCED OF ION COPPER (Cu2+),
IRON (Fe3+), AND ZINC (Zn2+) CONTENTS IN WATER
ABSTRACT
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Air merupakan zat yang penting dalam kehidupan makhluk hidup di dunia ini, dari hewan yang berspesies terendah sampai yang tertinggi, juga manusia dan tanaman. Apabila air sudah tercemar logam-logam yang berbahaya akan mengakibatkan hal-hal yang buruk bagi kehidupan. Bermacam-macam kasus pencemaran logam berat pernah dilaporkan baik di negara maju maupun negara yang sedang berkembang. Begitu pula akibat buruk terhadap penduduk yang tinggal disekitarnya (Darmono, 1995).
Di Indonesia, pencemaran logam berat cenderung meningkat sejalan dengan meningkatnya proses industrialisasi. Pencemaran logam berat dalam lingkungan bisa menimbulkan bahaya bagi kesehatan, baik pada manusia, hewan, tanaman maupun lingkungan (Widowati, 2008). Toksikan yang sangat berbahaya umumnya berasal dari buangan industri, terutama sekali kimia (produk dari industri pestisida) dan industri yang melibatkan logam berat (contohnya Cu, Fe, dan Zn) dalam proses produksinya (Palar, 2008).
dapat menyebabkan keracunan, dan terjadinya keracunan logam paling sering disebabkan oleh pengaruh pencemaran lingkungan oleh logam berat seperti Zn dalam penggunaannya sebagai pembasmi hama (pestisida), pemupukan maupun karena pembuangan limbah pabrik yang menggunakan logam Zn (Darmono, 1995).
Indonesia kaya akan sumber daya alam hayati termasuk serat alam dan salah satu serat alam yang masih berpotensi untuk dikembangkan pemanfaatannya adalah serat daun nanas. Tanaman nanas (Ananas cosmosus) merupakan salah satu tanaman yang memiliki kandungan serat yang tinggi (Onggo, 2005). Hidayat (2008), menyatakan bahwa dalam serat daun nanas mengandung 69,5-71,5% selulosa. Kandungan serat yang tinggi dalam daun nanas ini diharapkan dapat dijadikan sumber selulosa sebagai alternatif baru untuk adsorben logam berat.
Penelitian tentang pemanfaatan serat daun nanas ini masih berkiprah dalam pemanfaatannya sebagai alternatif bahan baku tekstil dan hasil yang diperoleh bahwa serat daun nanas sangat memungkinkan untuk dipintal menjadi benang. Pada penelitian kali ini serat daun nanas dicoba dimanfaatkan sebagai bahan penyerap atau adsorben logam dalam air. Adsorben dari serat daun nanas ini memiliki keunggulan yaitu keberadaannya yang melimpah sebagai limbah dari produksi buah nanas, proses preparasi yang mudah, dan biaya yang relatif murah. Penelitian ini dilakukan dengan mengadsorpsi logam menggunakan serat daun nanas setelah diaktivasi dengan HCl 10%. Serat daun nanas yang telah diaktivasi dengan HCl 10% diharapkan dapat menyerap logam.
1.2 Permasalahan
1. Apakah daun nanas dapat digunakan untuk menyerap ion Cu2+, Fe3+, danZn2+ yang terkandung didalam air ?
1.3 Pembatasan Masalah
Penelitian ini dibatasi pada penentuan kemampuan daun nanas untuk menyerap ion Cu2+, Fe3+, dan Zn2+. Contoh air yang digunakan dalam penelitian ini terdiri dari larutan ion Cu2+, Fe3+, dan Zn2+ yang dibuat sendiri (sintetis).
1.4 Tujuan Penelitian
1. Untuk mengetahui kemampuan daun nanas untuk menyerap ion Cu2+, Fe3+, dan Zn2+ yang terkandung didalam air.
2. Untuk mengetahui HCl 10% merupakan aktivator optimum dalam pengaktivasian daun nanas.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberi informasi tentang kemampuan daun nanas untuk mengurangi kandungan ion Cu2+, Fe3+, dan Zn2+ didalam air, sehingga limbah daun nanas pada waktu panen dapat dimanfaatkan oleh masyarakat, terutama dalam penyediaan air bersih.
1.6 Lokasi Penelitian
1.7 Metodologi Penelitian
1. Penelitian ini merupakan eksperimen laboratorium.
2. Sampel daun nanas diambil secara acak di daerah Pancur Batu.
3. Daun nanas terlebih dahulu dirajang, dikeringkan, diaktivasi dengan HCl 5%; HCl 10%; dan HCl 15% dicuci hingga pH netral dan dikeringkan pada suhu 1100C selama 5 jam.
4. Penelitian ini dibatasi pada penentuan kemampuan daun nanas untuk menyerap ion Cu2+, Fe3+, dan Zn2+. Contoh air yang digunakan dalam penelitian ini terdiri dari larutan ion Cu2+, Fe3+, dan Zn2+ yang dibuat sendiri (sintetis).
5. Daun nanas yang telah diaktivasi digunakan sebagai adsorben untuk ion Cu2+, Fe3+, dan Zn2+ didalam air.
BAB 2
TINJAUAN PUSTAKA
2.1 Nanas (Ananas cosmosus L. Merr)
Kingdom : Plantae
Divisio : Spermatophyta Kelas : Angiospermae
Ordo : Farinosae (Bromeliales) Famili : Bromeliaceae
Genus : Ananas
Spesies : Ananas cosmosus (L) Merr (http://www.ristek.go.id)
Nanas merupakan tanaman buah berupa semak yang memiliki nama ilmiah
Ananas cosmosus. Nanas atau ”Pineapple” bukan tanaman asli Indonesia. Berdasarkan nara sumber (literatur) tanaman ini berasal dari benua Amerika. Beberapa bukti yang menguatkan bahwa tanaman nanas berasal dari Amerika adalah penemuan Colombus pada tahun 1493 di pulau Guadelopus, di pulau ini tumbuh subur tumbuhan nanas, dan tahun 1502 hamparan tanaman ini meluas di pantai Puerto Bello.
Masuknya nanas ke wilayah Indonesia diduga pada abad ke-15, tepatnya tahun 1599. Penyebaran nanas di Indonesia pada mulanya hanya sebagai tanaman pengisi di lahan pekarangan, tetapi lambat laun meluas dikebunkan di lahan kering (tegalan) di seluruh wilayah nusantara (Rahmat, 1996). Penyebaran nanas meluas hampir di setiap propinsi di Indonesia. Namun, sentra produksi nanas hanya terdapat di lima propinsi, yakni: Sumatera Utara, Riau, Sumatera Selatan, Jawa Barat, dan Jawa Timur (Santoso, 1998). Daerah penghasil nanas yang terkenal di antaranya Subang, Bogor, Riau, Palembang, dan Blitar (Hendro Sunarjono, 2008).
Berdasarkan bentuk daun dan buah dikenal 4 jenis nanas, diantaranya cayenne
(daun halus, tidak berduri, buah besar), queen (daun pendek berduri tajam, buah lonjong mirip kerucut), spanyol atau spainsh (daun panjang kecil, berduri halus sampai kasar, buah bulat dengan mata datar), dan abacaxi (daun panjang berduri kasar, buah silindris, atau seperti piramida). Jenis nanas yang banyak ditanam di Indonesia adalah golongan cayenne dan queen. Sementara itu, golongan spainsh
dikembangkan di kepulauan India Barat, Puerte Rico, Mexico, dan Malaysia.
Ada dua varietas yang sudah lama dikembangkan di Indonesia yaitu nanas
queen dan nanas smooth cayenne. Nanas queen banyak ditanam di daerah Bogor dan Palembang. Nanas queen memiliki rasa yang lebih manis dari pada nanas cayenne dan memiliki daun yang berduri. Nanas queen umumnya ditanam di dataran rendah, sedangkan nanas cayenne ditanam luas di dataran tinggi. Namun, khusus untuk nanas
cayenne yang ditanam di daerah Subang, buahnya lebih manis dari pada nanas queen
dan nanas jenis cayenne yang ditanam di daerah lain (Redaksi AgroMedia Pustaka, 2009). Dalam penelitian ini digunakan daun tanaman nanas jenis Queen.
serat yang berasal dari tumbuhan yang diperoleh dari daun-daun tanaman nanas (Hidayat, 2008). Komposisi kimia serat nanas dapat dilihat pada tabel 2.1. Pada penelitian ini daun nanas yang mempunyai serat panjang tersebut dimanfaatkan sebagai adsorben atau bahan penyerap dalam air.
Tabel 2.1Komposisi Kimia Serat Nanas
No. Komposisi Kimia Serat Nanas (%)
1. Alpha Selulosa 69,5 – 71,5
2. Pentosan 17,0 – 17,8
3. Lignin 4,4 – 4,7
4. Pektin 1,0 – 1,2
5. Lemak dan Wax 3,0 – 3,3
6. Abu 0,71 – 0,87
7. Zat – zat lain (protein, asam organik, dan lain – lain.)
4,5 – 5,3
(Hidayat, 2008) Sama halnya dengan serat-serat alam lainnya yang berasal dari daun (leaf fibres), secara morfologi jumlah serat dalam daun nanas terdiri dari beberapa ikatan serat (bundle of fibres) dan masing-masing ikatan terdiri dari beberapa serat ( multi-celluler fibre). Berdasarkan pengamatan dengan mikroskop, sel-sel dalam serat daun nanas mempunyai ukuran diameter rata-rata berkisar 10 µm dan panjang rata-rata 4,5 mm dengan rasio perbandingan antara panjang dan diameter adalah 450. Rata-rata ketebalan dinding sel dari serat daun nanas adalah 8,3 µm. Ketebalan dinding sel ini ini terletak antara serat sisal (12,8 µm) dan serat batang pisang (1,2 µm) (Hidayat, 2008).
dihasilkan selobiosa (Winarno, 1992). Selulosa mempunyai sifat antara lain berwarna putih, berserat, tidak larut dalam air dan pelarut organik serta mempunyai kuat tarik yang tinggi (Artati, 2009).
2.2 Kandungan Logam Dalam Air
Kandungan logam di dalam air sangat tergantung pada asal sumber air (air tanah dan air sungai). Disamping itu, jenis air juga mempengaruhi kandungan logam di dalamnya (air tawar, air payau, dan air laut). Air sungai di daerah hulu mungkin kandungan logamnya akan berbeda dengan air sungai dekat muara. Hal ini disebabkan dalam perjalanannya air tersebut mengalami beberapa kontaminasi, baik karena erosi maupun pencemaran dari sepanjang tepi sungai. Kandungan logam air laut juga berbeda-beda, seperti di daerah pantai, daerah dekat muara sungai, dan daerah laut lepas. Biasanya, daerah pantai memiliki kandungan logam lebih tinggi daripada daerah laut lepas (Darmono, 1995).
Banyak logam berat baik yang bersifat toksik maupun esensial terlarut dalam air dan mencemari air tawar maupun air laut. Sumber pencemaran ini banyak berasal dari pertambangan, peleburan logam, dan jenis industri lainnya, dan dapat juga berasal dari lahan pertanian yang menggunakan pupuk atau antihama yang mengandung logam (Darmono, 2001).
2.3 Tembaga (Cu)
2.3.1 Sifat dan Kegunaan
Kuprum atau tembaga (Cu) memiliki sistem kristal kubik, yang secara fisik berwarna kuning dan apabila menggunakan mikroskop akan berwarna pink kecoklatan sampai keabuan. Cu termasuk golongan logam, berwarna merah, serta mudah berubah bentuk. Di alam, Cu banyak ditemukan dalam bentuk pyrite, Fe-sulfat, dan sering bercampur dengan Antimon (Sb), merkuri (Hg), timbal (Pb), dan arsen-sulfat. Pada umumnya, bijih tembaga di Indonesia terbentuk secara magmatik. Pembentukan endapan magmatik bisa berupa proses hidrotermal atau metasomatisme. Unsur tembaga di alam bisa ditemukan dalam bentuk logam bebas, tetapi lebih banyak ditemukan dalam bentuk senyawa padat bentuk mineral. Unsur Cu bersumber dari peristiwa pengikisan (erosi) batuan mineral, debu-debu, dan partikulat Cu dalam lapisan udara yang dibawa turun oleh air hujan (Widowati, 2008).
Secara kimia, senyawa-senyawa dibentuk oleh logam Cu (tembaga) mempunyai bilangan valensi +1 dan +2. Berdasarkan pada bilangan valensi yang dibawanya, logam Cu dinamakan juga cuppro untuk yang bervalensi +1, dan cuppry untuk yang bervalensi +2 (Palar, 2008). Secara fisika, logam berat Cu digolongkan ke dalam logam-logam penghantar listrik yang baik. Cu merupakan penghantar listrik terbaik setelah perak (Ag) sehingga Cu banyak digunakan dalam bidang elektronika. Tembaga (Cu) banyak digunakan sebagai peralatan elektronika sebesar 60%; untuk konstruksi, misalnya atap dan plumbing adalah sebesar 20%; industri mesin, yaitu sebagai pengganti penghantar panas sebesar 15%, dan untuk berbagai alloy sebesar 5% (Widowati, 2008).
Senyawaa CuSO4 juga sering digunakan untuk membasmi siput sebagai inang
2.3.2 Tingkat Pencemaran
Dari berbagai limbah, limbah yang paling banyak mengandung logam berat adalah limbah industri. Beberapa polutan yang terdapat pada sumber air, antara lain kuprum (Cu). Bahan itu berasal dari pelapukan pipa air minum dan kontaminan alamiah dari hasil pelapukan batuan yang dilewati oleh air dalam perjalannya. Limbah batuan adalah sisa batuan yang ditambang yang tidak diproduksi. Limbah batuan dari Grasberg mengandung pyrite (senyawa besi sulfida) dan Cu sulfida. Limbah batuan itu juga merupakan limbah B3 karena mengandung logam berat (Widowati, 2008).
Tembaga biasa mencemari sayuran dan buah-buahan apabila disemprotkan pestisida yang mengandung Cu secara berlebihan. Kadar Cu dalam sayuran dan buah-buahan cenderung meningkat dikarenakan penggunaan fungisida berbahan baku Cu serta tingginya kadar Cu dalam tanah. Tingginya kadar Cu dalam tanah dikarenakan tingkat keasaman tanah yang tinggi sehingga absorpsi Cu dari tanah meningkat. Penggunaan pupuk amonium nitrat ataupun penggunaan bahan organik seperti humus akan meningkatkan absorpsi Cu dari tanah (Widowati, 2008).
2.3.3 Efek Toksik
Tembaga (Cu) memiliki sifat baik dan buruk bagi kesehatan makkhluk hidup. Dalam jumlah kecil, Cu dibutuhkan untuk mempertahankan kesehatan. Namun, dalam konsentrasi yang tinggi Cu bersifat toksik dan bisa mengganggu kesehatan. Kebutuhan tubuh akan Cu adalah 0,005 mg/hari/kg berat badan. Pada kadar tersebut, tidak terjadi akumulasi Cu pada tubuh normal. Konsumsi Cu dalam jumlah yang besar bisa menyebabkan gejala-gejala yang akut (Widowati, 2008).
atau uap Cu tersebut adalah terjadinya kerusakan atropik pada selaput lendir yang berhubungan dengan hidung. Kerusakan itu, merupakan akibat dari gabungan sifat iritatif yang dimiliki oleh debu atau uap Cu tersebut (Palar, 2008). Tembaga (Cu) juga dapat memengaruhi sistem enzim, yaitu dengan menghambat enzim dihydrolipoly dehydrogenase yang akan menghambat sistem pyruvate dehydrogenase sehingga mengganggu metabolisme energi dalam sel. Hemolisis eritrosit disebabkan oleh tidak aktifnya enzim glucose-6-phosphate dehydrogenase dalam eritrosit (Widowati, 2008).
Keracunan logam berat bersifat kronis dan dan dampaknya baru terlihat setelah beberapa tahun. Pada manusia, keracunan Cu secara kronis dapat dilihat dengan timbulnya penyakit Wilson dan Kinsky. Gejala dari penyakit Wilson ini adalah terjadi
hepatic cirrhosis, kerusakan pada otak dan demyelinasi, serta terjadinya penurunan kerja ginjal dan pengendapan Cu dalam kornea mata. Penyakit Kinsky dapat diketahui dengan terbentuknya rambut yang kaku dan berwarna kemerahan pada penderita. Sementara pada hewan seperti kerang, bila dalam tubuhnya telah terakumulasi dalam jumlah tinggi, maka bagian otot tubuhnya akan memperlihatkan warna kehijauan. Hal itu dapat menjadi petunjuk apakah kerang tersebut masih bisa dikonsumsi oleh manusia (Palar, 2008).
2.4 Besi (Fe)
2.4.1 Sifat dan Kegunaan
Besi (Fe) merupakan logam transisi dan memiliki nomor atom 26. Bilangan oksidasi Fe adalah +3 dan +2. Fe memiliki berat atom 55, 845 g/mol, titik leleh 1.5380 C, dan titik didih 2.8610 C. Fe menempati urutan sepuluh besar sebagai unsur di bumi. Fe menyusun 5-5,6% dari kerak bumi dan menyusun 35% dari masa bumi. Fe menempati berbagai lapisan bumi. Konsentrasi tertinggi terdapat pada lapisan dalam dari inti bumi dan sejumlah kecil terdapat di lapisan terluar kerak bumi. Beberapa tempat di bumi bisa mengandung Fe mencapai 70%. Logam Fe ditemukan dalam inti bumi berupa hematit (Widowati, 2008).
Logam besi (Fe) sebagian besar digunakan dalam pembuatan baja dan menghasilkan hampir 95% baja di dunia dengan berbagai kombinasi kekuatan baja. Baja dikenal sebagai alloy besi. Penggunaan besi dan baja sangat luas, mulai dari peralatan yang sederhana, seperti jarum, peniti, paper clip, skyscraper, sampai dengan alat-alat dan mesin berat, seperti berbagai bidang automobil, tank, kapal besar, dan berbagai komponen bangunan (Widowati, 2008).
Fe (II) oksida atau fero-oksida (FeO), berupa bubuk berwarna hitam, dalam keadaan tertentu bisa mengakibatkan ledakan ketika terkena panas; Fe (III) atau feri-oksida (Fe2O3) atau hematit dapat digunakan dalam pelapisan magnet audio dan
komputer, dan dalam lingkungan basa mampu menghambat korosi. Fe (II, III) oksida atau fero feri-oksida (Fe3O4) dikenal sebagai mineral magnetit atau lodestone
berwarna hitam, yang terdapat di planet Mars, merupakan sumber bijih Fe. Fero feri-oksida cenderung lebih mudah mengalami korosi bila terkena air. Fero sering ditemukan di samping atau bawah kapal (Widowati, 2008).
2.4.2 Tingkat Pencemaran
gangguan lingkungan. Pencemaran bisa berasal dari sampah rumah tangga ataupun limbah industri di kawasan lingkungan tersebut. Pencemaran sumber air oleh sampah sistem open dumping dan tertimbun di TPA mengalami dekomposisi bersama air hujan dan menghasilkan cairan lindi (leachate), yang antara lain mengandung senyawa terlarut dan tersuspensi hasil penguraian mikroba berupa kalsium (Ca), magnesium (Mg), besi (Fe), khlorida (Cl), seng (Zn), dan nikel (Ni) (Widowati, 2008).
Beberapa wilayah perairan di Indonesia tercemar Fe karena aktivitas industri. Makanan dapat tercemar oleh besi melalui tanah. Air yang tercemar Fe saat pengolahan menggunakan peralatan (panci) yang mengandung Fe atau peralatan pengemasan (kaleng) mengandung Fe (Widowati, 2008). Pencemaran Fe di udara juga dapat terjadi, sumber utama pencemaran udara oleh Fe ialah pabrik besi dan baja. Inhalasi Fe oksida dari asap dan debu yang sering terjadi di lokasi pertambangan, dapat menyebabkan radang paru-paru (Darmono,2001).
2.4.3 Efek Toksik
Kelebihan Fe jarang terjadi akibat konsumsi yang berasal dari makanan, tetapi oleh konsumsi suplemen Fe. Konsumsi Fe berlebih berakibat pada meningkatnya feritrin dan hemosiderin dalam sel parenkim hati. Kadar Fe dalam feritrin dan hemosiderin juga meningkat. Konsumsi Fe dosis besar akan merusak sel alat pencernaan secara langsung, lalu Fe akan mengikuti peredaran darah. Kerusakan sel juga meluas pada hati, jantung, dan organ lain, bahkan bisa berakhir pada kematian (Widowati, 2008).
erythematosus (SLE), reumatik artritis dan penyakit Huntington, juga meningkatkan risiko terhadap penyakit jantung (Widowati, 2008).
Toksisitas akut Fe pada anak, terjadi karena anak memakan sekitar 1 g Fe, walaupun yang termakan mungkin lebih banyak. Mekanisme toksisitas Fe secara pasti belum begitu jelas, diperkirakan kematian terjadi karena sekunder shock yang disebabkan oleh iritasi gastro-intestinal. Bila dilakukan autopsi terhadap korban keracunan ditemukan perdarahan dan nekrosis pada mukosa lambung dan usus (Darmono, 2001).
2.5 Seng (Zn)
2.5.1 Sifat dan Kegunaan
Seng (Zn) adalah komponen alam yang terdapat di kerak bumi. Zn adalah logam yang memiliki karakteristik cukup reaktif, berwarna putih-kebiruan, pudar bila terkena uap udara, dan terbakar bila terkena udara dengan api hijau terang. Zn dapat bereaksi dengan asam, basa, dan senyawa nonlogam. Zn memiliki nomor atom 30 dan memiliki titik lebur 419,730C. Seng (Zn) di alam tidak berada dalam keadaan bebas, tetapi dalam bentuk terikat dengan unsur lain berupa mineral. Mineral yang mengandung Zn di alam bebas antara lain kalamin, franklinit, smithsonit, willenit, dan
zinkit (Widowati, 2008).
Zn digunakan dalam berbagai jenis industri, seperti cat, produk karet, kosmetik, obat-obatan, pelapis lantai, plastik, printing, tinta, baterai, tekstil, peralatan elektrik, bahan kimia, solder dan industri pertanian. Kegunaan Zn pada berbagai jenis industri, seperti: bahan tabung baterai, bahan alloy seperti kuningan, nikel-perak, logam mesin ketik, dan penyepuhan listrik (Widowati, 2008).
2.5.2 Tingkat Pencemaran
Zn merupakan komponen alami yang terdapat di dalam kerak bumi dan merupakan bagian tak terpisahkan dari lingkungan. Zn terdapat di batuan, tanah, udara, air, dan biosfer. Tanaman, hewan, dan manusia juga mengandung Zn. Kadar Zn di kerak bumi adalah sebesar 70 mg/kg berat kering yang bervariasi antara 10-300 mg/kg. Di beberapa lokasi tertentu, terdapat kandungan konsentrasi yang tinggi oleh proses geologi serta geokimia yang mampu mencapai 50.000-150.000 mg/kg (Widowati, 2008).
Kadar Zn meningkat saat kontak dengan pipa plastik atau prabot yang digalvanisasi. Zn di atmosfer meningkat sesuai dengan meningkatnya kegiatan industri dan konsentrasi tinggi Zn ditemukan di daerah industri. Pewarnaan dan pembilasan tekstil menghasilkan air limbah yang berwarna dengan COD (Chemical Oxygen Demand) tinggi dan bahan-bahan lain dari zat warna yang dipakai, seperti fenol dan logam. Jenis limbah yang dihasilkan oleh industri tekstil adalah logam berat, terutama arsen (As), Cd, Cr, Pb, Cu, Zn, hidrokarbon terhalogenasi (dari proses
dressing dan finishing), zat warna, dan pelarut organik (Widowati, 2008).
2.5.3 Efek Toksik
bersifat akut dan kronis. Konsumsi Zn lebih dari 50 mg/hari selama beberapa minggu bisa mengganggu ketersediaan biologi Cu, sedangkan konsumsi Zn yang tinggi bisa memengaruhi sintesis ikatan Cu protein atau metalotionein dalam usus (Widowati, 2008).
Ion Zn bebas dalam larutan bersifat sangat toksik bagi tanaman, hewan invertebrata, dan ikan. Hasil penelitian menunjukkan bahwa 6 µmol Zn mampu membunuh 93% dari semua jenis Daphnia di perairan. Toksisitas Zn jarang terjadi karena konsumsi Zn dari makanan. Itu biasanya terjadi karena gangguan pada alat pencernaan dan diare yang diakibatkan oleh minuman atau makanan yang terkontaminasi oleh peralatan yang dilapisi Zn. Toksisitas akut Zn terjadi sebagai akibat dari tindakan mengonsumsi makanan atau minuman yang terkontaminasi Zn dari wadah/panci yang dilapisi Zn. Gejala toksisitas akut bisa berupa sakit lambung, diare, mual, dan muntah (Widowati, 2008).
2.6 Adsorpsi
Adsorben adalah bahan padat dengan luas permukaan dalam yang sangat besar. Permukaan yang luas ini terbentuk karena banyaknya pori yang halus pada padatan tersebut. Biasanya luasnya berada dalam ukuran 200-1000 m2/g adsorben. Diameter pori sebesar 0,0003-0,02 µm. Di samping luas spesifik dan diameter pori, kerapatan unggun, distribusi ukuran partikel maupun kekerasannya merupakan data karakteristik yang penting dari suatu adsorben. Tergantung pada tujuan penggunaannya, adsorben dapat berupa granular (dengan ukuran butir sebesar beberapa mm) atau serbuk (khusus untuk adsorpsi campuran cair) (Bernasconi, 1995).
Mekanisme sorpsi dapat berupa pertukaran ion (untuk yang terionisasi), dan ikatan hidrofobik (untuk zat organik yang tidak larut). Sorpsi oleh biota dan sedimen dapat terjadi sebagai berikut :
1. Bagi zat organik yang tidak larut sorpsi terjadi secara lengkap dalam beberapa jam, reversibel secara cepat.
2. Semakin halus partikel, semakin cepat adsorpsi, karena luas permukaan menjadi semakin luas.
3. Bila tidak terjadi pertukaran ion, maka zat yang tidak larut paling cepat diadsorpsi, begitu pula bagi kation.
4. Kation organik akan lebih cepat diadsorpsi (Soemitra, 2005).
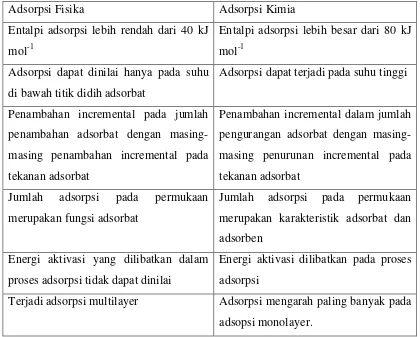
Tabel 2.2 Karakteristik dari adsorpsi fisika dan kimia
Adsorpsi Fisika Adsorpsi Kimia
Entalpi adsorpsi lebih rendah dari 40 kJ mol-1
Entalpi adsorpsi lebih besar dari 80 kJ mol-1
Adsorpsi dapat dinilai hanya pada suhu di bawah titik didih adsorbat
Adsorpsi dapat terjadi pada suhu tinggi
Penambahan incremental pada jumlah penambahan adsorbat dengan masing-masing penambahan incremental pada tekanan adsorbat
Penambahan incremental dalam jumlah pengurangan adsorbat dengan masing-masing penurunan incremental pada tekanan adsorbat
Jumlah adsorpsi pada permukaan merupakan fungsi adsorbat
Jumlah adsorpsi pada permukaan merupakan karakteristik adsorbat dan adsorben
Energi aktivasi yang dilibatkan dalam proses adsorpsi tidak dapat dinilai
Energi aktivasi dilibatkan pada proses adsorpsi
Terjadi adsorpsi multilayer Adsorpsi mengarah paling banyak pada adsopsi monolayer.
Pemanfaatan tanaman nanas masih sebatas pada buahnya saja sedangkan daun nanas (Ananas cosmosus) relatif belum banyak diolah. Untuk 2-3 kali panen, tanaman ini harus diganti dengan tanaman nanas baru, sehingga terdapat relatif banyak limbah daun nanas (Ananas cosmosus) dari pertanian nanas. Daun nanas (Ananas cosmosus) mengandung banyak bahan kimia, salah satunya adalah selulosa. Dengan kandungan kandungan selulosa 69,6-71% dalam daun nanas, serat daun dapat dijadikan adsorben limbah logam berat. Sebab, struktur rongga dalam selulosa dapat mengadsorpsi logam
berat seperti Cu dan Ag
2.7 Aktivasi Dengan HCl
Aktivasi dalam pengolahan daun nanas merupakan proses yang bertujuan untuk meningkatkan daya sorpsi. Aktivasi dibagi menjadi dua yaitu aktivasi fisika dan kimia. Aktivasi fisika dapat dilakukan dengan bantuan panas, uap dan CO2, sedangkan
aktivasi kimia merupakan aktivasi dengan pemakaian bahan kimia yang dinamakan aktivator. Untuk aktivasi kimia, aktivator yang digunakan adalah bahan-bahan kimia seperti hidroksida logam alkali, garam-garam karbonat, klorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, asam-asam anorganik seperti H2SO4 dan
H3PO4 (Meilita, 2003).
Asam klorida adalah larutan akuatik dari gas hidrogen klorida (HCl). Asam klorida harus ditangani dengan berhati-hati karena merupakan cairan yang sangat korosif. Senyawa ini juga digunakan secara luas dalam industri
[image:36.595.112.522.228.380.2]
asam klorida (HCl) (Vogel,1985) :
Tabel 2.3 Sifat – sifat asam klorida (HCl)
No Sifat – Sifat HCl Harga
1. Massa molekul relatif 36,46 g/mol
2. Titik leleh -260 C
3. Titik didih 480 C
4. Rumus molekul HCl
5. Rapatan 1,19 g/cm3
2.8 Spektrofotometri Serapan Atom (SSA)
2.8.1 Prinsip Dasar Analisa Spektrofotometri Serapan Atom (SSA)
Jika suatu larutan yang mengandung suatu garam logam (atau sesuatu senyawa logam) dihembuskan ke dalam suatu nyala (misalnya asetilena yang terbakar di udara), dapatlah terbentuk uap yang mengandung atom-atom logam itu. Beberapa atom logam dalam gas ini dapat dieksitasi ke tingkatan energi yang cukup tinggi untuk memungkinkan pemancaran radiasi yang karakteristik dari logam tersebut. Tetapi, jumlah jauh lebih besar dari atom logam bentuk gas itu normalnya tetap berada dalam keadaan tak tereksitasi, atau dengan perkataan lain, dalam keadaan dasar. Atom-atom keadaan dasar ini mampu menyerap energi cahaya yang panjang gelombang resonansinya khas untuknya, yang pada umumnya adalah panjang gelombang radiasi yang akan dipancarkan atom-atom itu bila tereksitasi dari keadaan dasar. Jadi jika cahaya dengan panjang gelombang resonansi itu dilewatkan nyala yang mengandung atom-atom, maka sebagian cahaya itu akan diserap, dan jauhnya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala. Ini adalah asas yang mendasari spektroskopi serapan atom (AAS) (Vogel, 1994).
2.8.2 Instrumentasi Spektrofotometri Serapan Atom (SSA)
Skematis ringkas peralatan Spektrofotometer Serapan Atom dengan nyala adalah :
Lampu Katoda Berongga Nyala Monokromator
A
Bahan Bakar
Oksigen
[image:38.595.109.527.138.376.2]Sampel
Gambar 2.1 Diagram Balok Peralatan Spektrofotometer Serapan Atom (Clark.D.V) Keterangan :
A = Lampu katoda berongga (sumber cahaya) B = Nyala
C = Monokromator D = Detektor E = Recorder
1. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hallow chatode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda. Katoda sendiri berbentuk silinder berongga yang terbuat dari logam atau dilapisi dengan logam tertentu. Salah satu kelemahan penggunaan lampu katoda berongga adalah satu lampu digunakan untuk satu unsur, akan tetapi saat ini telah banyak dijumpai suatu lampu katoda berongga kombinasi; yakni satu lampu dilapisi dengan beberapa unsur sehingga dapat digunakan untuk analisis beberapa unsur sekaligus.
B C
D Detektor
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan asas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu :
a. Nyala (Flame)
Digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas yang digunakan. Sumber nyala yang paling banyak digunakan adalah campuran asetilen sebagai bahan pembakar dan udara sebagai pengoksidasi. Ada bebetapa cara pengatoman dengan nyala ini, yaitu :
i. Cara langsung (pembakaran konsumsi total atau total consumption burner) ii. Cara tidak langsung (memakai pencampur berupa bahan pengoksidasi). b. Tanpa nyala (Flameless)
Pengatoman dapat dilakukan dalam tungku dari grafit seperti tungku yang dikembangkan oleh Masmann. Sistem pemanasan dengan tanpa nyala ini dapat melalui 3 tahap yaitu : pengeringan (drying) yang membutuhkan suhu yang relatif rendah; pengabuan (ashing) yang membutuhkan suhu yang lebih tinggi untuk menghilangkan matriks kimia dengan makenisme volatilasi atau pirolisis; dan pengatoman (atomising).
3. Monokromator
Pada SSA, monokromator yang dimaksudkan untuk memisahkan dan memilih panjang gelombang yang digunakan dalam analisis. Di samping sistem optik, dalam monokromator juga terdapat suatu alat yang digunakan untuk memisahkan radiasi resonansi dan kontinyu yang disebut dengan chopper.
4. Detektor
5. Readout
3.2 Bahan-bahan
- Daun Nanas
- HCl(p) p.a E. Merck
- Kristal CuSO4.5H2O p.a E. Merck
- Kristal FeCl3.6H2O p.a E. Merck
- Kristal ZnSO4.7H2O p.a E. Merck
- HNO3(p) p.a E. Merck
- Akuades
3.3 Prosedur Penelitian
3.3.1 Pembuatan HCl 5%
Sebanyak 135 mL HCl(p) dimasukkan ke dalam labu takar 1000 mL, diencerkan
dengan akuades hingga garis tanda dan dihomogenkan.
3.3.2 Pembuatan HCl 10%
Sebanyak 270 mL HCl(p) dimasukkan ke dalam labu takar 1000 mL, diencerkan
dengan akuades hingga garis tanda dan dihomogenkan.
3.3.3 Pembuatan HCl 15%
Sebanyak 405 mL HCl(p) dimasukkan ke dalam labu takar 1000 mL, diencerkan
dengan akuades hingga garis tanda dan dihomogenkan.
3.3.4 Penyedian Sampel Daun Nanas
3.3.5 Aktivasi Serbuk Daun Nanas Dengan HCl 5%
Sebanyak 140 g daun nanas dimasukkan ke dalam beaker glass 1000 mL, ditambahkan HCl 5% sebanyak 1000 mL, diaduk selama 3 jam, ditutup dengan aluminium foil, direndam selama 24 jam, dicuci dengan akuades hingga pH netral, dikeringkan dalam oven pada suhu 1100 C selama 5 jam, didinginkan dalam desikator lalu ditimbang.
3.3.6 Aktivasi Serbuk Daun Nanas Dengan HCl 10%
Sebanyak 140 g daun nanas dimasukkan ke dalam beaker glass 1000 mL, ditambahkan HCl 10% sebanyak 1000 mL, diaduk selama 3 jam, ditutup dengan aluminium foil, direndam selama 24 jam, dicuci dengan akuades hingga pH netral, dikeringkan dalam oven pada suhu 1100 C selama 5 jam, didinginkan dalam desikator lalu ditimbang.
3.3.7 Aktivasi Serbuk Daun Nanas Dengan HCl 15%
3.3.8 Pembuatan Larutan Standar Cu2+
3.3.8.1 Pembuatan Larutan Blanko
Sebanyak 50 mL akuades dimasukkan ke dalam beaker glass 250 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p).
3.3.8.2 Pembuatan Larutan Standar Cu2+ 1000 mg/L
Sebanyak 0,3819 g kristal CuSO4.5H2O ditimbang secara kuantitatif, dimasukkan ke
dalam beaker glass 100 mL, dilarutkan dengan akuades secukupnya, dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.8.3 Pembuatan Larutan Standar Cu2+ 100 mg/L
Sebanyak 10 mL larutan induk tembaga 1000 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.8.4 Pembuatan Larutan Standar Cu2+ 20 mg/L
Sebanyak 20 mL larutan standar tembaga 100 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.8.5 Pembuatan Larutan Standar Cu2+ 10 mg/L
Sebanyak 10 mL larutan standar tembaga 100 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.8.6 Pembuatan Larutan Seri Standar Cu2+ 0,5; 1,0; 2,0; 3,0; 4,0 mg/L
Sebanyak 2,5; 5,0; 10,0; 15,0; 20,0 mL larutan standar tembaga 10 mg/L dimasukkan ke dalam masing-masing labu takar 50 mL kemudian diencerkan dengan akuades hingga garis tanda dan dihomogenkan. Masing-masing larutan adalah 0,5; 1,0; 2,0; 3,0; 4,0 mg/L tembaga.
3.3.8.7 Pembuatan Kurva Kalibrasi Ion Cu2+
Dilakukan hal yang sama untuk larutan seri standar ion Cu2+ 0,5; 1,0; 2,0; 3,0; dan 4,0 mg/L.
3.3.9 Pembuatan Larutan Standar Fe3+
3.3.9.1 Pembuatan Larutan Blanko
Sebanyak 50 mL akuades dimasukkan ke dalam beaker glass 250 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p).
3.3.9.2 Pembuatan Larutan Standar Fe3+ 1000 mg/L
Sebanyak 0,4840 g kristal FeCl3.6H2O ditimbang secara kuantitatif, dimasukkan ke
dalam beaker glass 100 mL, dilarutkan dengan akuades secukupnya, dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.9.3 Pembuatan Larutan Standar Fe3+ 100 mg/L
Sebanyak 10 mL larutan standar induk besi 1000 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.9.4 Pembuatan Larutan Standar Fe3+ 20 mg/L
Sebanyak 20 mL larutan standar besi 100 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.9.5 Pembuatan Larutan Standar Fe3+ 10 mg/L
Sebanyak 10 mL larutan standar besi 100 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.9.6 Pembuatan Larutan Seri Standar Fe3+ 0,5; 1,0; 2,0; 3,0; 4,0 mg/L
3.3.9.7 Pembuatan Kurva Kalibrasi Ion Fe3+
Diukur absorbansi larutan blanko dengan menggunakan Spektrofotometri Serapan Atom (SSA) pada panjang gelombang 248,3 nm. Perlakuan dilakukan sebanyak 3 kali. Dilakukan hal yang sama untuk larutan seri standar ion Fe3+ 0,5; 1,0; 2,0; 3,0; dan 4,0 mg/L.
3.3.10 Pembuatan Larutan Standar Zn2+
3.3.10.1 Pembuatan Larutan Blanko
Sebanyak 50 mL akuades dimasukkan ke dalam beaker glass 250 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p).
3.3.10.2 Pembuatan Larutan Standar Zn2+ 1000 mg/L
Sebanyak 0,4398 g kristal ZnSO4.7H2O ditimbang secara kuantitatif, dimasukkan ke
dalam beaker glass 100 mL, dilarutkan dengan akuades secukupnya, dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.10.3 Pembuatan Larutan Standar Zn2+ 100 mg/L
Sebanyak 10 mL larutan standar induk seng 1000 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.10.4 Pembuatan Larutan Standar Zn2+ 20 mg/L
Sebanyak 20 mL larutan standar seng 100 mg/L dimasukkan ke dalam labu takar 100 mL, diencerkan dengan akuades hingga garis tanda, dan dihomogenkan.
3.3.10.5 Pembuatan Larutan Standar Zn2+ 10 mg/L
3.3.10.6 Pembuatan Larutan Seri Standar Zn2+ 0,2; 0,4; 0,6; 0,8; 1,0 mg/L
Sebanyak 1; 2; 3; 4; 5 mL larutan standar seng 10 mg/L dimasukkan ke dalam masing-masing labu takar 50 mL kemudian diencerkan dengan akuades hingga garis tanda dan dihomogenkan. Masing-masing larutan adalah 0,2; 0,4; 0,6; 0,8; 1,0 mg/L seng.
3.3.10.7 Pembuatan Kurva Kalibrasi Ion Zn2+
Diukur absorbansi larutan blanko dengan menggunakan Spektrofotometri Serapan Atom (SSA) pada panjang gelombang 213,9 nm. Perlakuan dilakukan sebanyak 3 kali. Dilakukan hal yang sama untuk larutan seri standar ion Zn2+ 0,2; 0,4; 0,6; 0,8; dan 1,0 mg/L.
3.3.11 Penyerapan Ion Cu2+, Fe3+, dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan Menggunakan HCl 5% dan Penentuan Ion Cu2+, Fe3+ dan Zn2+ Dengan Spektrofotometri Serapan Atom (SSA)
3.3.11.1 Penyerapan Ion Cu2+ Setelah Penambahan Serbuk Daun Nanas Aktif
Sebanyak 2 g serbuk daun nanas aktif dimasukkan ke dalam 100 mL larutan standar Cu2+ 20 mg/L, ditutup dengan aluminium foil, diaduk dengan menggunakan magnetik stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.11.2 Penentuan Ion Cu2+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Cu2+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu ion Cu2+ pada panjang gelombang 324,8 nm.
3.3.11.3 Penyerapan Ion Fe3+ Setelah Penambahan Serbuk Daun Nanas Aktif
stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.11.4 Penentuan Ion Fe3+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Fe3+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu ion Fe3+ pada panjang gelombang 248,3 nm.
3.3.11.5 Penyerapan Ion Zn2+ Setelah Penambahan Serbuk Daun Nanas Aktif
Sebanyak 2 g serbuk daun nanas aktif dimasukkan ke dalam 100 mL larutan standar Zn2+ 20 mg/L, ditutup dengan aluminium foil, diaduk dengan menggunakan magnetik stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.11.6 Penentuan Ion Zn2+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Zn2+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu ion Zn2+ pada panjang gelombang 213,9 nm.
3.3.12 Penyerapan Ion Cu2+, Fe3+, dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan Menggunakan HCl 10% dan Penentuan Ion Cu2+, Fe3+ dan Zn2+ Dengan Spektrofotometri Serapan Atom (SSA)
3.3.12.1 Penyerapan Ion Cu2+ Setelah Penambahan Serbuk Daun Nanas Aktif
3.3.12.2 Penentuan Ion Cu2+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Cu2+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu ion Cu2+ pada panjang gelombang 324,8 nm.
3.3.12.3 Penyerapan Ion Fe3+ Setelah Penambahan Serbuk Daun Nanas Aktif
Sebanyak 2 g serbuk daun nanas aktif dimasukkan ke dalam 100 mL larutan standar Fe3+ 20 mg/L, ditutup dengan aluminium foil, diaduk dengan menggunakan magnetik stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.12.4 Penentuan Ion Fe3+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Fe3+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu ion Fe3+ pada panjang gelombang 248,3 nm.
3.3.12.5 Penyerapan Ion Zn2+ Setelah Penambahan Serbuk Daun Nanas Aktif
Sebanyak 2 g serbuk daun nanas aktif dimasukkan ke dalam 100 mL larutan standar Zn2+ 20 mg/L, ditutup dengan aluminium foil, diaduk dengan menggunakan magnetik stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.12.6 Penentuan Zn2+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Zn2+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
3.3.13 Penyerapan Ion Cu2+, Fe3+, dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan Menggunakan HCl 15% dan Penentuan Ion Cu2+, Fe3+ dan Zn2+ Dengan Spektrofotometri Serapan Atom (SSA)
3.3.13.1 Penyerapan Ion Cu2+ Setelah Penambahan Serbuk Daun Nanas Aktif
Sebanyak 2 g serbuk daun nanas aktif dimasukkan ke dalam 100 mL larutan standar Cu2+ 20 mg/L, ditutup dengan aluminium foil, diaduk dengan menggunakan magnetik stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.13.2 Penentuan Ion Cu2+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Cu2+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu Ion Cu2+ pada panjang gelombang 324,8 nm.
3.3.13.3 Penyerapan Ion Fe3+ Setelah Penambahan Serbuk Daun Nanas Aktif
Sebanyak 2 g serbuk daun nanas aktif dimasukkan ke dalam 100 mL larutan standar Fe3+ 20 mg/L, ditutup dengan aluminium foil, diaduk dengan menggunakan magnetik stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.13.4 Penentuan Ion Fe3+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Fe3+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
Atom (SSA) yaitu ion Fe3+ pada panjang gelombang 248,3 nm.
3.3.13.5 Penyerapan Ion Zn2+ Setelah Penambahan Serbuk Daun Nanas Aktif
stirer selama 24 jam, disaring dengan kertas saring Whatman No. 42, filtrat yang dihasilkan diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA).
3.3.13.6 Penentuan Ion Zn2+ Dengan Spektrofotometri Serapan Atom (SSA)
Sebanyak 15 mL filtrat larutan standar Zn2+ 20 mg/L yang telah direndam dengan serbuk daun nanas aktif dimasukkan ke dalam beaker glass 50 mL, diatur pH-nya 3,50 dengan penambahan HNO3(p), diukur absorbansinya dengan Spektrofotometri Serapan
3.4 Bagan Penelitian
3.4.1 Penyediaan Daun Nanas
Dicuci dengan air
Dibuang duri daun nanas Dipotong-potong kecil
Dikeringkan di bawah sinar matahari selama 14 hari Dihaluskan dengan blender hingga berbentuk serbuk
3.4.2 Aktivasi Serbuk Daun Nanas
Dimasukkan ke dalam beaker glass 1000 mL Ditambahkan HCl 5% sebanyak 1000 mL Diaduk selama 3 jam
Ditutup dengan aluminium foil Direndam selama 24 jam
Dicuci dengan akuades sampai pH netral Dikeringkan pada suhu 1100 C selama 5 jam Didinginkan dalam desikator
Ditimbang
Catatan : Dilakukan hal yang sama untuk aktivasi serbuk daun nanas dengan menggunakan HCl 10% dan HCl 15%
Serbuk daun nanas Daun Nanas
3.4.3 Pengukuran Absorbansi Larutan Blanko dan Larutan Seri Standar Ion Cu2+, Fe3+, dan Zn2+ (Pembuatan Kurva Kalibrasi)
3.4.3.1 Pengukuran Absorbansi Larutan Blanko
Diambil 50 mL lalu dimasukkan ke dalam beaker glass 250 mL Diatur pH-nya 3,50 dengan penambahan HNO3(p)
Diukur absorbansi blanko dengan Spektrofotometri Serapan Atom (SSA) yaitu ion Cu2+pada λ = 324,8 nm
Catatan : Dilakukan hal yang sama untuk ion Fe3+ dan ion Zn2+
3.4.3.2 Pengukuran Absorbansi Larutan Seri Standar Ion Cu2+ dan Fe3+ (Pembuatan Kurva Kalibrasi)
Diambil sebanyak 15 mL
Dimasukkan ke dalam beaker glass 50 mL Diatur pH-nya 3,50 dengan penambahan HNO3(p)
Diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA) yaitu ion Cu2+pada λ = 324,8 nm
Catatan :- Dilakukan hal yang sama untuk larutan seri standar Cu2+ 1,0; 2,0; 3,0; dan 4,0 mg/L
- Perlakuan yang sama dilakukan sebanyak 3 kali
- Pengukuran dengan cara yang sama dilakukan untuk larutan seri standar Fe3+.
Larutan seri standar Cu2+ 0,5 mg/L
3.4.3.3 Pengukuran Absorbansi Larutan Seri Standar Ion Zn2+ (Pembuatan Kurva Kalibrasi)
Diambil sebanyak 15 mL
Dimasukkan ke dalam beaker glass 50 mL Diatur pH-nya 3,50 dengan penambahan HNO3(p)
Diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA) yaitu ion Zn2+pada λ = 213,9 nm
Catatan :- Dilakukan hal yang sama untuk larutan seri standar Zn2+ 0,4; 0,6; 0,8; dan 1,0 mg/L
- Perlakuan yang sama dilakukan sebanyak 3 kali.
Larutan seri standar Zn2+ 0,2 mg/L
3.4.4 Penyerapan Ion Cu2+, Fe3+, Dan Zn2+ Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi dengan HCl 5%; HCl 10%; dan HCl 15% Pada Larutan Sintetis
Ditimbang sebanyak 2 g
Dimasukkan ke dalam 100 mL larutan standar Cu2+ 20 mg/L
Ditutup dengan aluminium foil
Diaduk dengan menggunakan magnetik stirer selama 24 jam
Disaring dengan kertas saring Whatman No.42
Diambil sebanyak 15 mL
Dimasukkan ke dalam beaker glass 50 mL Diatur pH-nya 3,50 dengan penambahan HNO3(p)
Diukur absorbansinya dengan Spektrofotometri Serapan Atom (SSA) yaitu ion Cu2+pada λ = 324,8 nm
Catatan : - Dilakukan hal yang sama untuk serbuk daun nanas yang telah diaktivasi dengan menggunakan HCl 10% dan HCl 15%
- Perlakuan dengan cara yang sama dilakukan untuk larutan standar
Fe3+ 20 mg/L dan larutan standar Zn2+ 20 mg/L.
Serbuk daun nanas teraktivasi HCl 5%
Filtrat Residu
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 4.1.1 Ion Tembaga (Cu2+)
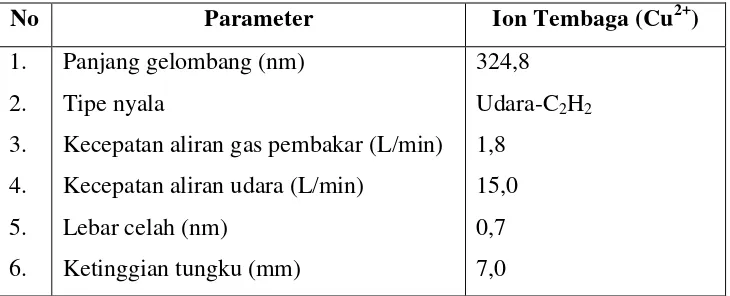
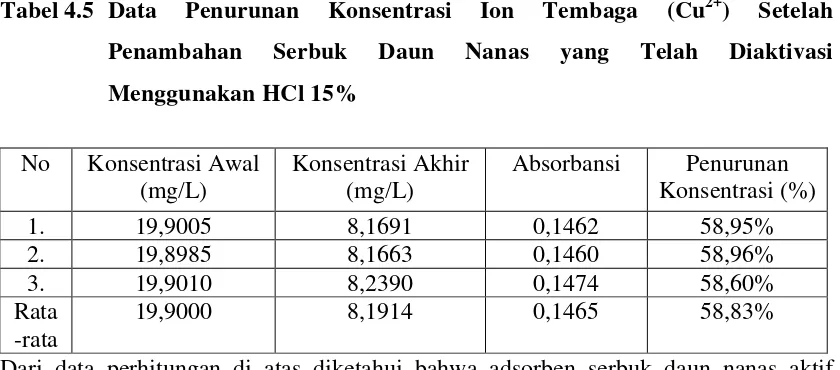
[image:56.595.109.474.387.535.2]Kondisi alat Spektrofotometer Serapan Atom (SSA) pada pengukuran konsentrasi ion Tembaga (Cu2+) dapat dilihat pada tabel 4.1.
Tabel 4.1 Kondisi Alat SSA Merek Shimadzu tipe AA-7000F Pada Pengukuran
Konsentrasi Ion Tembaga (Cu2+)
No Parameter Ion Tembaga (Cu2+)
1. 2. 3. 4. 5. 6.
Panjang gelombang (nm) Tipe nyala
Kecepatan aliran gas pembakar (L/min) Kecepatan aliran udara (L/min)
Lebar celah (nm)
Ketinggian tungku (mm)
324,8 Udara-C2H2
1,8 15,0 0,7 7,0
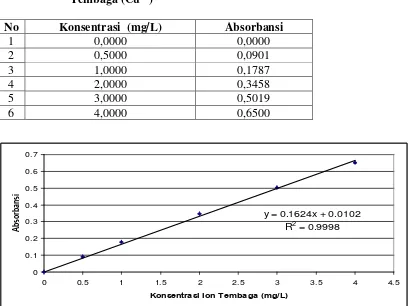
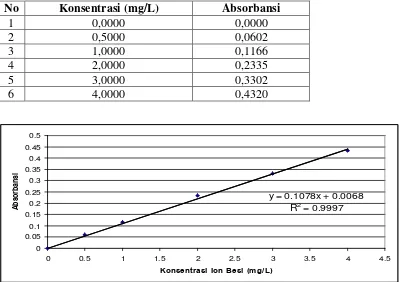
4.1.1.1 Konsentrasi dan Absorbansi Larutan Seri Standar Ion Tembaga (Cu2+)
Tabel 4.2 Data Konsentrasi dan Absorbansi Larutan Seri Standar Ion Tembaga (Cu2+)
No Konsentrasi (mg/L) Absorbansi
1 0,0000 0,0000
2 0,5000 0,0901
3 1,0000 0,1787
4 2,0000 0,3458
5 3,0000 0,5019
6 4,0000 0,6500
y = 0.1624x + 0.0102 R2 = 0.9998
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5
Konsentrasi Ion Tembaga (mg/L)
A
b
so
rb
an
si
Gambar 4.1 Kurva Kalibrasi Larutan Seri Standar Ion Tembaga (Cu2+) 4.1.1.2 Pengolahan Data Ion Tembaga (Cu2+)
4.1.1.2.1 Penurunan Persamaan Garis Regresi dengan Metode Least Square
No. Xi (mg/L)
Yi
(A) Xi −X Yi−Y
(
)
2 X
Xi−
(
Yi−Y)
2(
Xi−X)(
Yi−Y)
1 0,0000 0,0000 -1,75 -0,2944 3,0625 0,0866 0,5152 2 0,5000 0,0901 -1,25 -0,2043 1,5625 0,0417 0,2553 3 1,0000 0,1787 -0,75 -0,1157 0,5625 0,0133 0,0867 4 2,0000 0,3458 0,25 0,0514 0,0625 0,0026 0,0128 5 3,0000 0,5019 1,25 0,2075 1,5625 0,0430 0,2593 6 4,0000 0,6500 2,25 0,3556 5,0625 0,1264 0,8001
∑ 10,5000 1,7665 0,00 0,0001 11,8750 0,3136 1,9294 Keterangan : Xi : Konsentrasi (mg/L)
Yi : Absorbansi (A)
Dimana X rata-rata : X =
n Xi
∑
= 6 5 , 10 = 1,75Harga Y rata-rata : Y =
n Yi
∑
= 6 7665 , 1 = 0,2944Persamaaan garis regresi untuk kurva kalibrasi dapat ditentukan dari persamaan garis:
Y = aX + b
Dengan, a = slope b = intersep
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square sebagai berikut:
a =
(
)(
)
(
)
∑
∑
− − − 2 X Xi Y Yi X Xia =
11,875 1,9294
a = 0,1624
Sehingga diperoleh harga slope (a) = 0,1624
Harga intersep (b) diperoleh melalui substitusi harga (a) ke persamaan berikut :
Y = aX + b
b = 0,2944 – (0,1624)(1,75)
b = 0,0102
Sehingga diperoleh harga intersep (b) = 0,0102 Maka persamaan garis regresi yang diperoleh adalah :
Y = 0,1624X + 0,0102
4.1.1.2.2 Perhitungan Koefisien Korelasi
Koefisien korelasi (r) dapat ditentukan sebagai berikut :
r =
(
)(
)
(
) (
)
[
]
21 2 2
∑
∑
∑
− −
− −
Y Yi X
Xi
Y Yi X Xi
r =
(
)(
)
[
]
21
3136 , 0 875 , 11
1,9290
r =
1,9297 1,9294
r = 0,9998
4.1.1.3 Penentuan Persentase (%) Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5%; HCl 10%; dan HCl 15%
4.1.1.3.1 Penentuan Persentase (%) Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 5%
Persentase (%) penurunan konsentrasi ion Tembaga (Cu2+) dapat ditentukan dengan menggunakan rumus :
[ ]
[ ]
[ ]
Cu awal akhir Cu awalCu −
x 100%
Maka persentase (%) penurunan konsentrasi ion Tembaga (Cu2+) dalam larutan standar 20 mg/L setelah penambahan serbuk daun nanas aktif adalah :
L mg L mg L mg / 9000 , 19 / 6121 , 15 / 9000 , 19 −
x 100% = 21,54%.
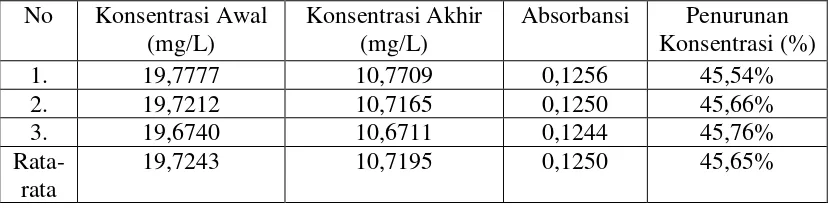
4.1.1.3.2 Penentuan Persentase (%) Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi
Menggunakan HCl 10%
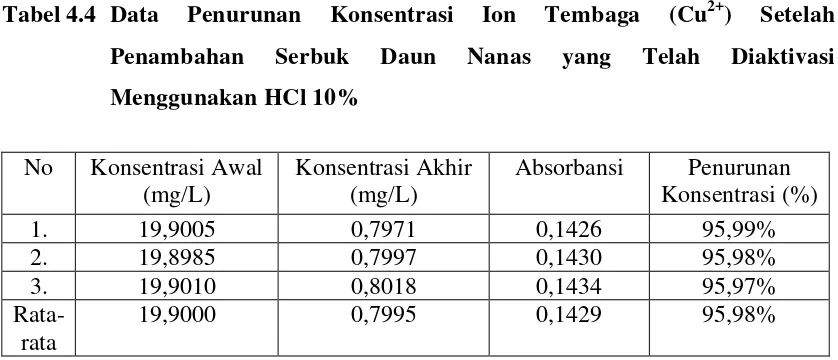
Persentase (%) penurunan konsentrasi ion Tembaga (Cu2+) dapat ditentukan dengan menggunakan rumus :
[ ]
[ ]
[ ]
Cu awal akhir Cu awalCu −
x 100%
L mg L mg L mg / 9000 , 19 / 7995 , 0 / 9000 , 19 −
x 100% = 95,98%.
4.1.1.3.3 Penentuan Persentase (%) Penurunan Konsentrasi Ion Tembaga (Cu2+) Setelah Penambahan Serbuk Daun Nanas yang Telah Diaktivasi Menggunakan HCl 15%
Persentase (%) penurunan konsentrasi ion Tembaga (Cu2+) dapat ditentukan dengan menggunakan rumus :
[ ]
[ ]
[ ]
Cu awal akhir Cu awalCu −
x 100%
Maka persentase (%) penurunan konsentrasi ion Tembaga (Cu2+) dalam larutan standar 20 mg/L setelah penambahan serbuk daun nanas aktif adalah :
L mg L mg L mg / 9000 , 19 / 1914 , 8 / 9000 , 19 −
x 100% = 58,83%.