ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI DAUN SIRIH
MERAH (Piper ornatum N) ASAL
PEMATANG SIANTAR
SKRIPSI
NOVITA SANI SIANTURI
130822014
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI DAUN SIRIH
MERAH (Piper ornatum N) ASAL
PEMATANG SIANTAR
SKRIPSI
Diajukkan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
NOVITA SANI SIANTURI
130822014
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Analisis Komponen Kimia Dan Uji Aktifitas Antibakteri Minyak Atsiri Daun Sirih Merah (Piper ornatum N) Asal Pematang Siantar
Kategori : SKRIPSI
Nama Mahasiswa : Novita Sani Sianturi
Nomor Induk Mahasiswa : 130822014
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Mei 2015
Komisi Pembimbing :
Pembimbing II Pembimbing I
Dr. Mimpin Ginting, MS Drs. Darwis Surbakti, MS
NIP. 1955 1013 1986 011001 NIP. 1953 0707 1983 031001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU
Ketua,
Dr. Rumondang Bulan Nst, MS
PERNYATAAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIFITAS ANTIBAKTERI MINYAK ATSIRI DAUN SIRIH MERAH (Piper ornatum N)
ASAL PEMATANG SIANTAR
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2015
NOVITA SANI SIANTURI
PENGHARGAAN
Segala Puji dan ucapan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas Kasih dan KaruniaNya yang selalu melimpah sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk menyelesaikan pendidikan Sarjana Sains di fakultas MIPA USU. Adapun judul skripsi adalah “Analisis Komponen Kimia dan Uji Aktivitas Antibakteri Minyak Atsiri Daun Sirih Merah (Piper ornatum N) Asal Pematang Siantar”
Penyelesaian skripsi ini tidak terlepas dari bantuan, masukan dan dukungan dari berbagai pihak. Oleh karena itu, dalam kesempatan ini penulis ingin menyampaikan terima kasih kepada:
1. Ibu Dr.Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu, MSc selaku ketua dan sekretaris Departemen Kimia, Serta seluruh staff pengajar Departemen Kimia FMIPA USU yang telah membimbing penulis selama perkuliahan.
2. Bapak Drs. Darwis Surbakti, MS selaku pembimbing I dan Bapak Dr. Mimpin Ginting, MS selaku dosen pembimbing yang telah banyak
meluangkan waktu selama penulis melakukan penelitian dan memberikan masukan dan bimbingan dalam Penyusunan skripsi hingga selesai.
3. Bapak Dr. Mimpin Ginting, MS selaku Kepala Laboratorium Kimia Organik FMIPA USU.
4. Kedua Orang Tua penulis Bapak Tercinta W.Sianturi dan Mama tercinta S.Hutajulu yang telah memberikan dukungan moril dan bantuan materi sampai selesainya Skripsi ini.
5. Adikku Okta Sariito dan kakakku Rina Sianturi Tersayang yang memberikan dukungan dan kasih sayang, serta keponakaan Penulis Boas Gabriel Pasaribu yang memberikan penulis semangat dengan tingkah nya yang lucu.
6. Rekan-rekan Mahasiswa Kimia Ekstensi 2013: Kk delima, Elprida, Kk novel, Dorli, yang telah semakin kompak dan telah memberikan masukan dan dukungan selama penulisan karya ilmiah ini.
7. Dan semua pihak yang terlibat yang tidak dapat disebutkan satu persatu.
Semoga Tuhan Yang Maha Esa dengan segala kebaikan dan kemurahanNya memberkati Bapak/Ibu serta saudara/saudari sekalian yang telah meluangkan waktu dan pemikiran serta memberikan motivasi kepada penulis. Penulis juga menyadari bahwa didalam penulisan skripsi masih jauh dari kesempurnaan dan masih banyak memilki kekurangan.
Akhir kata penulis berharap agar skripsi ini dapat berguna dan bermanfaat bagi kita semua.
ANALISIS KOMPONEN KIMIA DAN UJI AKTIFITAS ANTIBAKTERI MINYAK ATSIRI DAUN SIRIH MERAH (Piper ornatum N) ASAL
PEMATANG SIANTAR.
ABSTRAK
Minyak atsiri daun Sirih Merah (Piper ornatum N) diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Daun Sirih Merah didestilasi selama ± 4-5 jam menghasilkan minyak atsiri sebesar 1,46% . Komponen kimia minyak atsiri daun Sirih Merah yang dianalisis menggunakan GC-MS menunjukkan ada 12 senyawa dan
8 senyawa utamanya yaitu Sabinen (43,57%), β-Mirsen (23,77%), L-Linalool (9,39%), 4-Terpineol (4,65%), Trans-Kariofilen (4,02%), γ-terpinen
(2,88%), α-Tuyan (2,86%), dan α-Pinen (2,49%). Uji aktivitas antibakteri minyak
atsiri daun Sirih Merah dilakukan dengan metode difusi agar dengan konsentrasi 5%, 10%, 20%, 30% v/v dalam pelarut DMSO terhadap bakteri Pseudomonas aeruginosa
dan Listeria monocytogenes yang menunjukkan terbentuknya zona hambat, dimana semakin tinggi konsentrasi yang diujikan semakin luas zona hambat yang terbentuk.
ANALYSIS OF CHEMICAL COMPONENTS AND ANTIBACTERIAL ACTIVITY IN ESSENTIAL OIL OF RED BETEL LEAF (Piper ornatum N)
FROM PEMATANG SIANTAR
ABSTRACT
Essential oil of red betel leaf (Piper ornatum N) leaves have been isolated with hydrodestillation method use Stahl apparatus. Red betel leaf have hydrodestillation for ± 4-5 hours resulting essential oil amount 1,46%. Chemical components in essential oil of red betel leaf leaves have been analyzed use GC-MS shown 12
compounds and 8 some major compounds such as Sabinene (43,57%), β-Myrcene
(23,77%), L-Linalool (9,39%), 4-Terpineol (4,65%), Trans-Caryophyllene (4,02%),
γ-terpinen (2,88%), α-Thujene (2,86%), and α-Pinene (2,49%). Antibacterial activity
test of red betel leaf leaves have been done using agar diffusion method in 5%, 10%, 20%, 30% v/v the essential oil in DMSO solvent concentration to the Pseudomonas aeruginosa, Listeria monocytogenes bacteria showed antibacterial activity were characterized a retardation area. If concentration seems higher area of retardation area will be wider.
ANALISIS KOMPONEN KIMIA DAN UJI AKTIFITAS ANTIBAKTERI MINYAK ATSIRI DAUN SIRIH MERAH (Piper ornatum N) ASAL
PEMATANG SIANTAR.
ABSTRAK
Minyak atsiri daun Sirih Merah (Piper ornatum N) diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Daun Sirih Merah didestilasi selama ± 4-5 jam menghasilkan minyak atsiri sebesar 1,46% . Komponen kimia minyak atsiri daun Sirih Merah yang dianalisis menggunakan GC-MS menunjukkan ada 12 senyawa dan
8 senyawa utamanya yaitu Sabinen (43,57%), β-Mirsen (23,77%), L-Linalool (9,39%), 4-Terpineol (4,65%), Trans-Kariofilen (4,02%), γ-terpinen
(2,88%), α-Tuyan (2,86%), dan α-Pinen (2,49%). Uji aktivitas antibakteri minyak
atsiri daun Sirih Merah dilakukan dengan metode difusi agar dengan konsentrasi 5%, 10%, 20%, 30% v/v dalam pelarut DMSO terhadap bakteri Pseudomonas aeruginosa
dan Listeria monocytogenes yang menunjukkan terbentuknya zona hambat, dimana semakin tinggi konsentrasi yang diujikan semakin luas zona hambat yang terbentuk.
ANALYSIS OF CHEMICAL COMPONENTS AND ANTIBACTERIAL ACTIVITY IN ESSENTIAL OIL OF RED BETEL LEAF (Piper ornatum N)
FROM PEMATANG SIANTAR
ABSTRACT
Essential oil of red betel leaf (Piper ornatum N) leaves have been isolated with hydrodestillation method use Stahl apparatus. Red betel leaf have hydrodestillation for ± 4-5 hours resulting essential oil amount 1,46%. Chemical components in essential oil of red betel leaf leaves have been analyzed use GC-MS shown 12
compounds and 8 some major compounds such as Sabinene (43,57%), β-Myrcene
(23,77%), L-Linalool (9,39%), 4-Terpineol (4,65%), Trans-Caryophyllene (4,02%),
γ-terpinen (2,88%), α-Thujene (2,86%), and α-Pinene (2,49%). Antibacterial activity
test of red betel leaf leaves have been done using agar diffusion method in 5%, 10%, 20%, 30% v/v the essential oil in DMSO solvent concentration to the Pseudomonas aeruginosa, Listeria monocytogenes bacteria showed antibacterial activity were characterized a retardation area. If concentration seems higher area of retardation area will be wider.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Minyak atsiri yang saat ini tumbuh di wilayah Indonesia sudah dikenal oleh sebagian
masyarakat. Bahkan beberapa jenis tanaman minyak atsiri menjadi bahan yang sangat
penting dalam kehidupan sehari-hari. Minyak atsiri dihasilkan dari bagian jaringan
tanaman tertentu seperti akar, batang, kulit, bunga, atau biji. Sifat minyak atsiri yang
menonjol antara lain mudah menguap pada suhu kamar, mempunyai rasa getir,
berbau wangi sesuai dengan aroma tanaman yang menghasilkannya, dan umumnya
larut dalam pelarut organik. Banyak istilah digunakan untuk menyebut minyak atsiri,
misalnya dalam Bahasa Inggris disebut essential Oils, ethereal oils dan volatile oils.
Dalam Bahasa Indonesia ada yang menyebutnya minyak terbang, bahkan ada pula
yang menyebut minyak kabur (Lutony, 1994).
Penggunaan minyak atsiri dari bahan alam sebagai obat semakin diminati
masyarakat, seiring dengan gerakan kembali ke alam (back to nature) yang dilakukan
masyarakat. Tanaman obat makin penting peranannya dalam pembuatan makanan,
minuman dan obat-obatan. Minyak atsiri dikenal dengan nama minyak eteris atau
minyak terbang (essential oil, volatile) yang merupakan salah satu hasil metabolisme
sekunder pada tanaman. Minyak atsiri bersifat mudah menguap pada suhu kamar,
mempunyai rasa getir, berbau wangi sesuai dengan bau tanaman penghasilnya dan
larut dalam pelarut organik dan tidak larut dalam air (Sudaryani dan Sugiharti, 1990).
Tumbuhan sirih merah ada terdiri dari beberapa spesies, pada penelitian ini
digunakan tumbuhan sirih berbatang merah berdaun hijau (Piperbetle ornatum N),
termasuk familia Piperaceae. Tumbuhan ini memiliki kemampuan sebagai antiseptik,
pada kulit, obat saluran pencernaan dan dapat menguatkan gigi. Sirih merah tumbuh
subur di daerah Sumatera Utara, dahulu digunakan untuk upacara adat suku Karo.
Salah satu di antaranya adalah sirih, dikenal dengan sirih hijau, sirih merah, sirih
hitam, sirih kuning dan sirih perak (Depkes, 1988).
Beberapa penelitian sebelumnya telah meneliti ekstrak daun sirih merah yaitu
analisis Kromatografi Lapis Tipis (KLT) menggunakan ekstrak etanol, fraksi etil
asetat, fraksi n-heksan dan fraksi air, serta pengujian aktivitas antibakteri dari
ekstrak daun sirih merah terhadap pertumbuhan bakteri Staphylococcus aureus,
Escherichia coli dan Candida albicans (Julia, 2011). Sedangkan Siti ( 2010), telah
melakukan isolasi dan identifikasi komponen kimia minyak atsiri daun sirih merah
kering asal Magelang, dimana terdapat 6 komponen kimia minyak atsiri dengan kadar
paling banyak adalah Sabinen yakni sebesar 74,73%, dan uji aktivitas antibakteri
menggunakan metode difusi agar untuk bakteri Staphylococcus aureus, Bacillus
cereus (gram positif) dan Eschericia coli, dan Pseudomonas aeruginosa (gram
negatif), dan potensi antibakteri minyak atsiri daun sirih merah kering asal Magelang
dibanding amoksisilin pada B. cereus, S. aureus, E. coli, dan P. aeruginosa
(Siti, 2010).
Kandungan minyak atsiri dari tumbuhan sangat dipengaruhi oleh: tempat
tumbuh, musim, perbedaan tempat/daerah, pengambilan sampel, perlakuan pasca
panen misalnya pengeringan dan penyimpanan, serta kondisi operasional alat yang
digunakan dalam mendeteksi komponen tersebut khususnya kolom yang digunakan
(Olonisakin et al., 2006). Disamping itu, pada keadaan yang sangat kering
(kemarau panjang) minyak pada daun akan cepat menguap, sehingga kadar
minyaknya akan menurun (Nuryani et al., 2006).
Berdasarkan uraian yang telah dikemukan diatas maka, peneliti tertarik untuk
mengidentifikasi komponen kimia minyak atsiri daun sirih merah asal Pematang
Siantar yang diperoleh menggunakan alat Stahl metode hidrodestilasi dan identifikasi
dengan uji antibakteri dilakukan terhadap bakteri Pseudomonas aeruginosa dan
Listeria monocytogenes menggunakan metode difusi agar.
1.2 Permasalahan
1. Komponen senyawa kimia utama apakah yang terdapat pada minyak atsiri daun
sirih merah yang berasal dari daerah Perumnas Batu 6, Kecamatan Pematang
Siantar.
2. Apakah minyak atsiri daun Sirih Merah dapat bersifat sebagai antibakteri terhadap
bakteri Pseudomonas aeruginosa dan Listeria monocytogenes dengan metode
difusi agar.
1.3 Pembatasan Masalah
1. Daun sirih merah diperoleh dari daerah Perumnas Batu 6, Kecamatan Pematang
Siantar.
2. Daun Sirih Merah diperoleh dengan metode hidrodestilasi menggunakan alat
Sthal.
3. Uji antibakteri minyak atsiri daun sirih merah segar dilakukan terhadap bakteri
Listeria monocytogenes dan Pseudomonas aeruginosa dengan metode difusi
agar.
1.4 Tujuan Penelitian
1. Untuk mengetahui komponen senyawa kimia utama yang terdapat dalam minyak
atsiri daun sirih merah yang berasal dari daerah Perumnas Batu 6, kecamatan
Pematang siantar melalui analisa GC-MS.
2. Untuk mengetahui aktifitas antibakteri minyak atsiri daun sirih merah terhadap
bakteri Pseudomonas aeruginosa dan Listeria monocytogenes dengan metode
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai komponen kimia
yang terdapat dalam minyak atsiri daun sirih merah yang berasal dari daerah
Perumnas Batu 6, Kecamatan Pematang Siantar, dan aktivitas antibakterinya terhadap
bakteri Listeria monocytogenes, dan Pseudomonas aeruginosa.
1.6 Lokasi Penelitian
Untuk uji penyulingan minyak atsiri daun daun sirih merah dilakukan di
Laboratorium Kimia Organik Bahan Alam FMIPA USU Medan, untuk uji analisa
Spektroskopi GC-MS dilakukan di Laboratorium FMIPA-UGM, dan untuk uji
aktivitas antibakteri dilakukan dilaboratorium Mikrobiologi Balai Riset dan
Standardisasi Industri Medan (PT. Baristand).
1.7 Metodologi Penelitian
Penelitian ini dilakukan secara eksperimen laboratorium dan sebagai objek penelitian
adalah daun sirih merah yang berada di daerah Perumnas Batu 6, Kecamatan
Pematang Siantar. daun sirih merah diiris kecil - kecil, dimana minyak atsiri daun
sirih merah diperoleh dengan metode hidrodestilasi mengguanakan alat stahl. minyak
atsiri yang diperoleh dipisahkan dari lapisan airnya kemudian ditambahkan Na2S04
anhidrous untuk menghilangkan kandungan airnya, kemudian didekantasi. minyak
atsiri yang diperoleh dianalisa dengan metode GC-MS untuk mengetahui komponen
kimianya, serta diuji antibakteri terhadap bakteri Listeria monocytogenes dan
BAB 2
TINJAUAN PUSTAKA
2.1 Daun Sirih Merah (Piper ornatum N).
Berdasarkan taksonomi tanaman, Klasifikasi daun sirih merah hasil identifikasi
tumbuhan dilaboratorium Herbarium Medanense (MEDA) Universitas Sumatera
Utara adalah sebagai berikut :
Kerajaan : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledonae
Bangsa : Piperales
Familia : Piperaceae
Genus : Piper
Spesies : Piper ornatum N
Gambar 2.1. Daun Sirih Merah
Tanaman daun sirih merah merambat, daun berbentuk jantung atau bulat-telur.
bunga berbentuk bulir. Beberapa jenis sirih dibedakan menurut rasa pedas dan warna
(sirih Jawa, sirih Banda, sirih kuning, sirih cengkeh, sirih hitam, dan lain – lain).
(bahan baku obat batuk dan asma), tetapi jumlah produksi dan yang diperdagangkan
tidak tercatat (Harris, 1987). Semua jenis tanaman sirih memiliki ciri yang hampir
sama, yaitu tanaman merambat dengan bentuk daun menyerupai hati dan bertangkai
yang tumbuh berselang-seling dari batangnya. Sirih merah dapat dibedakan dengan
sirih hijau dari daunnya. Selain daunnya berwarna merah keperakan, bila daunnya
disobek maka akan berlendir serta aromanya lebih wangi (Manoi, 2007).
2.1.1 Kandungan Kimia Daun sirih Merah
Kandungan kimia dari sirih merah antara lain flavonoid, alkaloid, polevenolad, tanin,
dan minyak atsiri. Senyawa flavonoid dan polevenolad bersifat antioksidan,
antikanker, antiseptik, dan antiinflamasi. Sedangkan senyawa alkoloid mempunyai
sifat antineoplastik yang juga ampuh menghambat pertumbuhan sel-sel kanker
(Sudewo, 2005).
2.1.2 Manfaat Daun Sirih Merah
Beberapa pengalaman di masyarakat menunjukkan bahwa sirih merah dapat
menurunkan penyakit darah tinggi, juga dapat menyembuhkan penyakit hepatitis.
Sirih merah juga bisa dipakai mengobati penyakit diabetes, dengan meminum air
rebusan sirih merah setiap hari akan menurunkan kadar gula darah sampai pada
tingkat yang normal. Kanker merupakan penyakit yang cukup banyak diderita
manusia dan sangat mematikan, dapat disembuhkan dengan menggunakan serbuk
atau rebusan dari daun sirih merah (Sudewo, 2005). Ekstrak daun sirih digunakan
sebagai obat kumur dan batuk, juga berkhasiat sebagai anti jamur pada kulit. Khasiat
obat ini dikarenakan senyawa aktif yang dikandungnya terutama adalah minyak atsiri
2.2 Minyak Atsiri
Minyak atsiri adalah salah satu kandungan tanaman yang sering disebut minyak
terbang, dinamakan demikian karena minyak tersebut mudah menguap. Selain itu,
minyak atsiri juga disebut essential oil (dari kata essence) karena minyak tersebut
memberikan bau pada tanaman (Koensoemardiyah, 2010). Minyak atsiri bukan
merupakan senyawa tunggal, tetapi tersusun dari berbagai komponen kimia, seperti
senyawa – senyawa monoterpen (Gunawan, 1991).
Minyak atsiri dibagi 2 kelompok, yaitu:
1. Minyak atsiri yang dengan mudah dapat dipisahkan menjadi
komponen-komponen atau penyusun murninya, komponen-komponen ini dapat menjadi bahan dasar
untuk diproses menjadi produk - produk lain. contohnya: minyak sereh, minyak
terpentin.
2. Minyak atsiri yang sukar dipisahkan menjadi komponen murni. contohnya
minyak nilam, minyak kenanga.
Minyak atsiri dari tanaman menghasilkan aroma yang berbeda, bahkan 1 jenis
tumbuhaan yang sama bila ditanam ditempat yang berlainan mampu menghasilkan
aroma yang berbeda, iklim, keberadaan tanah, dan sinar matahari. Cara pengolahaan
tidak hanya mempengharui rendeman minyak atsiri tetapi berpengaruh pula pada
aromanya (Harris, 1987). Aktivitas kerja minyak atsiri dalam menghambat
pertumbuhan atau mematikan bakteri yaitu dengan cara mengganggu proses
terbentuknya membran dan atau dinding sel, membran atau dinding sel tidak
terbentuk atau terbentuk secara tidak sempurna (Ajizah, 2004). Hasil identifikasi
komponen utama minyak atsiri sirih merah tersusun atas senyawa terpenoid yaitu
2.2.1. Komponen Kimia Minyak Atsiri
Pada umumnya perbedaan komposisi minyak atsiri disebabkan perbedaan jenis
tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode
ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia
yang terbentuk dari unsur Karbon (C), Hidrogen (H), dan Oksigen (O). pada
umumnya komponen kimia minyak atsiri dibagi menjadi dua golongan, yaitu:
1. Golongan hidrokarbon yang terdiri dari persenyawaan Terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur Karbon (C), dan
Hidrogen (H). Jenis Hidrokarbon yang terdapat dalam minyak atsiri sebagian
besar terdiri dari monoterpen (2 unit isopren), dan politerpen.
2. Golongan hidrokarbon teroksigenasi
Komponen kimia dari golongan ini terbentuk dari unsur Karbon (C), Hidrogen
(H), dan Oksigen (O). Persenyawaan yang termasuk dari golongan ini adalah
persenyawaan alkohol, aldehid, ester, fenol. Ikatan karbon yang terdapat dalam
molekulnya dapat terdiri dari ikatan tunggal, dan ikatan rangkap dua dan ikatan
rangkap tiga. Terpen mengandung ikatan tunggal dan ikatan rangkap dua.
Senyawa terpen memiliki aroma kurang wangi, sukar larut dalam alkohol encer
dan jika disimpan dalam waktu lama akan terbentuk resin. Golongan hidrokarbon
teroksigenasi merupakan senyawa yang penting dalam minyak atsiri karena
umumnya aroma yang lebih wangi. Fraksi terpen perlu dipisahkan untuk tujuan
tertentu, misalnya untuk pembuatan parfum, sehingga didapatkan minyak atsiri
yang bebas terpen (Ketaren, 1985). Pada minyak atsiri yang bagian utamanya
terpenoid, biasanya terpenoid itu terdapat pada fraksi minyak atsiri yang tersuling
uap. Zat inilah penyebab wangi, harum atau bau yang khas pada banyak
2.2.2. Biosintesa pembentukan Minyak Atsiri
Berdasarkan proses biosintesisnya atau pembentukan komponen minyak atsiri di
dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan. Golongan
pertama adalah turunan terpen yang terbentuk dari asam asetat melalui jalur
biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang
terbentuk dari biosintesis asam sikimat melalui jalur fenil propanoid (Agusta, 2000).
Mekanisme dari tahap tahap reaksi biosintesis terpenoid yaitu asam asetat
yang telah diaktifkan oleh koenzim A melalui kondensasi jenis Cleisen menghasilkan
asam asetoasetat. Senyawa yang dihasilkan ini dengan koenzim a melakukan
kondensasi sejenis aldol menghasilkan rantai karbon bercabang sebagaimana
ditemukan pada asam mevalonat. Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi
asam fosfat dan dekarboksilasi menghasilkan IPP (Isopentenil Pirofosfat) oleh enzim
isomerase, IPP sebagi unit isoprene aktif bergabung secara kepala ke ekor dengan
DMAPP dan penggabungan ini merupakan langkah pertama dari polimerasi isoprene
untuk menghasilkan terpenoid. Penggabungan ini terjadi karena serangan elektron
dari ikatan rangkap IPP terhadap atom karbon dari DMAPP yang kekurangan
elektron diikuti oleh penyingkiran ion Pirofosfat. Serangan ini menghasilkan geranil
pirofosfat (GPP) yakni senyawa antara bagi semua senyawa monoterpen.
Penggabungan selanjutnya antara satu unit IPP dan GPP, dengan mekanisme yang
sama seperti anatara IPP dan DMAPP menghasilkan Farnesil Pirofosfat (FPP) yang
merupakan senyawa antara bagi semua senyawa seskuiterpen. Senyawa-senyawa
diterpen diturunkan dari geranil-geranil pirofosfat (GGPP) yang berasal dari
kondensasi antara satu unit IPP dan FPP dengan mekanisme yang sama. Sintesa
terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi organik sintesa ini
hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi selanjutnaya dari
senyawa antara GPP, FPP, GGPP untuk menghasilkan senyawa-senyawa terpenoid
satu per satu hanya melibatkan beberapa jenis reaksi sekunder. Reaksi-reaksi
sekunder ini lazimnya adalah hidrolisa, siklisasi, oksidasi, reduksi, dan reaksi-reaksi
kamar, seperti isomerasi, dehidrasi, dekarboksilasi, dan sebagainya. Berikut ini
adalah gambar biosintesa terpenoid sapat dilihat pada gambar dibawah ini:
ATP
Gambar 2.2 Biosintesis Terpenoid (Achmad, 1985).
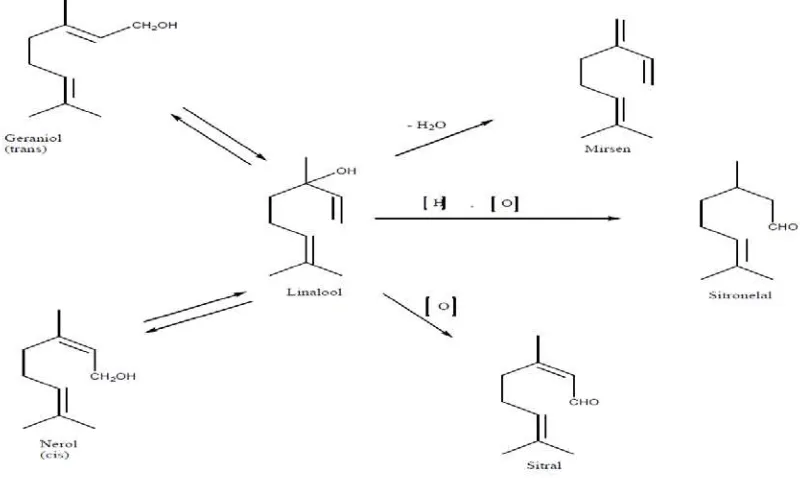
Untuk menjelaskan dapat diambil beberapa contoh monoterpen. Dari segi
biogenetik, perubahan geraniol, nerol dan linalool dari yang satu menjadi yang lain
berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari
hidrolisa geranil pirofosfat (GPP) dapat menjalani reaksi-reaksi sekunder berikut,
misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi
reduksi menghasilkan sitronelal. Berikut ini adalah contoh perubahan senyawa
monoterpen, dapat dilihat pada gambar 2.3
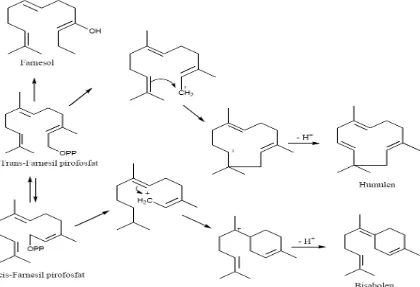
Senyawa- senyawa seskuiterpen diturunkan dari cis-farnesil pirofosfat dan
trans- farnesil pirofosfat melalui reaksi siklisasi dan reaksi sekunder lainnya. Kedua
isomer farnesil pirofosfat ini dihasilkan in vivo melalui mekanisme yang sama seperti
isomerisasi antara geraniol dan nerol. Perubahan farnesil pirofosfat menjadi
seskuiterpen terlihat pada gambar 2.4
Gambar 2.4. Reaksi Biogenetik Beberapa Seskuiterpena (Achmad, 1985)
2.2.3. Sumber Minyak Atsiri
Minyak atsiri merupakan salah satu akhir proses metabolisme sekunder dalam
tanaman tumbuhan. Tumbuhan penghasil minyak atsiri antara lain termasuk family
Pinaceae, Labiatae, Compositae, Lauraceae, Myrtaceae, Rutaceae, Piperaceae,
Zingiberaceae, Umbelliferae, dan Gramineae. Minyak atsiri terdapat pada setiap
bagian tumbuhan yaitu di daun, bunga, batang, kulit, akar, dan rimpang
2.2.4. Isolasi Minyak Atsiri dengan Destilasi
Dalam tanaman minyak atsiri, biasanya proses difusi berlangsung sangat lambat,
maka untuk mempercepat proses difusi sebelum melakukan penyulingan terlebih
dahulu bahan tanaman harus diperkecil dengan cara dipotong - potong atau digerus.
Peristiwa terpenting yang terjadi dalam proses penyulingan dengan metode
hidrodestilasi ini adalah terjadinya difusi minyak atsiri dan air panas melalui
membran bahan yang disuling, terjadinya hidrolisa terhadap beberapa komponen
minyak atsiri dan terjadinya dekomposisi yang disebabkan oleh panas
(Guenther, 1987). Penyulingan suatu campuran yang berwujud cairan yang tidak
saling bercampur, hingga membentuk dua fase atau dua lapisan. Keadaan ini terjadi
pada pemisahaan minyak atsiri dengan uap air. Penyulingan dengan uap air sering
disebut steam destilasi. Pengertian umum ini memberikan gambaran bahwa
penyulingan dapat dilakukan dengan cara mendidihkan bahan tanaman atau minyak
atsiri dengan air (Sastrohamidjojo, 2004).
Beberapa jenis tanaman sumber minyak atsiri perlu dirajang terlebih dahulu
sebelum disuling. Hal ini untuk memudahkan proses penguapan minyak yang
terdapat didalamnya karena perajangan ini menyebabkan kelenjar minyak dapat
selebar mungkin (Lutony, 1994).
Dalam industri minyak atsiri dikenal 3 macam metode penyulingan, yaitu:
1. Penyulingan air (Hidrodestilasi)
Pada metode ini bahan yang akan disuling berhubungan langsung dengan air
mendidih. Bahan yang akan disuling kemungkinan mengapung diatas air atau
terendam seluruhnya (Sastrohamidjojo, 2004).
2. Penyulingan uap (Steam destilasi)
Penyulingan uap disebut juga penyulingan tak langsung. didalam proses
penyulingan dengan uap ini, uap dialirkan melalui pipa uap berlingkar yang
berpori dan berada dibawah bahan tanaman yang akan disuling. Kemudian uap
akan bergerak menuju ke bagian atas melalui bahan yang disimpan di atas
3. Penyulingan dengan air dan uap (Water and Steam distillation)
Bahan tanaman yang akan diproses secara penyulingan uap dan air ditempatkan
dalam suatu tempat yang bagian bawah dan tengah berlobang-lobang yang
ditopang diatas dasar alat penyulingan. Ciri khas model ini yaitu uap selalu
dalam keadaan basah, jenuh, dan tidak terlalu panas. Bahan tanaman yang akan
disuling hanya berhubungan dengan uap dan tidak dengan air panas (Lutony,
1994).
2.3. Analisis Komponen Kimia Minyak Atsiri dengan GC-MS
Minyak atsiri yang memiliki komponen tunggal dengan porsi yang sangat besar,
kebanyakan mengandung campuran senyawa dengan berbagai tipe. Karena itu
analisis dan karakterisasi komponen minyak atsiri merupakan masalah yang cukup
rumit, ditambah dengan sifatnya yang mudah menguap pada suhu kamar. Jadi, untuk
menganalisa minyak atsiri perlu diseleksi metode yang akan diterapkan. Sejak
ditemukan kromatografi gas (GC), kendala dalam analisis komponen minyak atsiri ini
mulai dapat diatasi. Pada penggunaan GC efek penguapan dapat dihindari bahkan
dihilangkan sama sekali. Perkembangan teknologi instrumentasi yang sangat pesat
akhirnya dapat melahirkan suatu alat yang merupakan gabungan dua sistem dengan
prinsip dasar yang berbeda satu sama lain tetapi dapat saling menguntungkan atau
saling melengkapi, yaitu gabungan antara kromatografi gas dan spektrometri massa
(GC-MS). Kromatografi gas berfungsi sebagai alat pemisah berbagai komponen
campuran dalam sampel, sedangkan spektrometri massa berfungsi untuk mendeteksi
masing-masing molekul komponen yang telah dipisahkan pada sistem kromatografi
gas (Agusta, 2000).
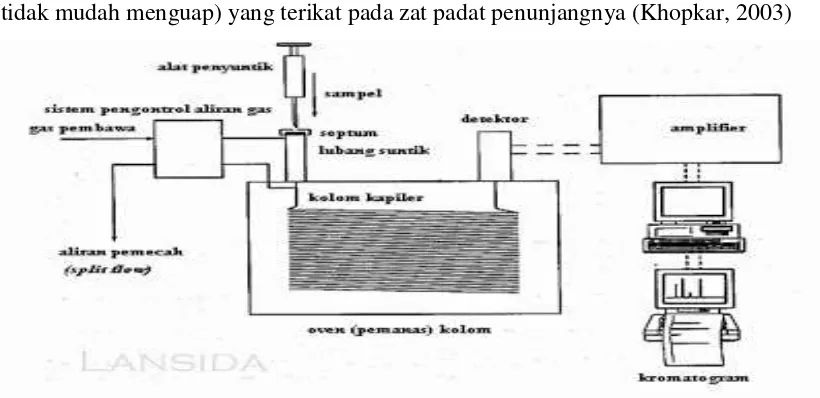
2.3.1. Analisis Kromatograf Gas
Kromatografi gas digunakan untuk memisahkan komponen campuran kimia dalam
suatu bahan berdasarkan perbedaan polaritas campuran. Fase gerak akan membawa
dengan kecepatan yang berbeda dimana interaksi komponen dengan fase diam
dengan waktu yang paling akhir (Eaton, 1989). Pemisahan tercapai dengan partisi
sampel antara fase gas bergerak dan fase diam berupa cairan dengan titik didih tinggi
(tidak mudah menguap) yang terikat pada zat padat penunjangnya (Khopkar, 2003)
Gambar 2.5 Skema Alat Gas Kromatografi
Komponen utama dalam Kromatografi Gas :
2.3.1.1. Gas pembawa
Pemilihan gas pembawa sampai taraf tertentu bergantung pada detektor yang
dipakai : hantar hambang, ionisasi nyala, tangkap elektron, atau khas terhadap unsur.
Nitrogen, Helium, Argon, Hidrogen, dan Karbon dioksida adalah gas yang paling
sering dipakai sebagai gas pembawa karena mereka tidak reaktif serta dapat dibeli
dalam keadaan murni dan kering dalam kemasan tangki bervolume besar dan
bertekanan tinggi. Hal yang menentukan ialah bahwa kita harus memakai gas paling
murni (Gritter, 1991)
2.3.1.2. Sistem injeksi
Lubang injeksi didesain untuk memasukkan sampel secara cepat dan efesien. Pada
1. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan
diuapkan dalam injektor yang panas dan 100% masuk menuju kolom.
2. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan
dalam injektor yang panas dan selanjutnya dilakukan pemecahan.
3. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel
diuapkan dalam injektor yang panas dan dibawa ke dalam kolom karena katup
pemecah ditutup.
4. Injeksi langsung ke kolom (on coloum injection), yang mana ujung semprit
dimasukkan langsung ke dalam kolom.
Teknik injeksi langsung ke dalam kolom digunakan untuk senyawa-senyawa yang
mudah menguap, karena kalau penyuntikkannya melalui lubang suntik,
dikwatirkan akan terjadi peruraian senyawa tersebut karena suhu yang tinggi
(Rohman, 2009).
2.3.1.3. Kolom
Kolom merupakan tempat terjadinya proses pemisahaan karena didalamnya terdapat
fase diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi
gas (Rohman, 2009).
2.3.1.4. Fase diam
Fase diam dibedakan berdasarkan kepolarannya, yaitu nonpolar, semi polar dan polar.
Berdasarkan minyak atsiri yang nonpolar sampai sedikit polar, maka untuk keperluan
analisis sebaiknya digunakan kolom fase diam yang bersifat nonpolar (Agusta, 2000).
2.3.1.5. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis
Kromatografi Gas dan Spektrometri Massa. Umumnya yang sangat menentukan
2.3.1.6. Detektor
Detektor pada kromatografi gas adalah suatu sensor elektronik yang berfungsi
mengubah sinyal gas pembawa komponen-komponen di dalamnya menjadi sinyal
elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif
maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam
dan fase gerak (Rohman, 2009).
2.3.2. Analisis Spektrometri Massa
Spektrometer massa adalah suatu alat berfungsi untuk mendeteksi masing-masing
molekul komponen yang telah dipisahkan pada sistem kromatografi gas yang terdiri
dari sistem analisis dan sistem ionisasi dan sistem molekul. Prinsip spektrometri
massa (MS) ialah senyawa organik (sampel) ditembak dengan berkas elektron dan
menghasilkan ion bermuatan positif yang mempunyai energi yang tinggi karena
lepasnya elektron dari molekul yang dapat pecah menjadi ion positif yang lebih kecil
(ion fragmen). Spektrum massa merupakan grafik antara limpahan relatif lawan
perbandingan massa/muatan (m/z). Terpisah fragmen ion positif didasarkan pada
massanya. Kejadian tersederhana adalah tercampaknya satu elektron dari molekul
dalam fasa gas oleh sebuah elektron dalam berkas elektron dan membentuk suatu
kation radikal (M•+ )
M •• + e → M•+ + 2e
Satu proses yang disebabkan oleh tabrakan elektron pada kamar pengion
spektrometer massa adalah ionisasi dari molekul yang berupa uap dengan kehilangan
satu elektron dan terbentuk ion molekul bermuatan positif, karena molekul senyawa
organik mempunyai elektron berjumlah genap maka proses pelepasan satu elektron
menghasilkan ion radikal yang mengandung satu elektron tidak berpasangan.
M M•+
Proses lain molekul yang berupa uap tersebut menangkap sebuah elektron
membentuk ion radikal bermuatan negatif dengan kemudian terjadi jauh lebih kecil
(10-2) dari pada ion radikal bermuatan positif (Sudjadi, 1983).
Gambar 2.6. Skema alat Spektroskopi Massa
(http://perpustakaancyber.blogspot.com/2013/04/fisika-inti-partikel-penyusun-inti-atom)
Pada sistem GC-MS ini, yang berfungsi sebagai detektor adalah spektrometer
massa itu sendiri yang terdiri dari sistem analisis dan sistem ionisasi, dimana Electron
Impact ionization (EI) adalah metode ionisasi yang umum digunakan (Agusta, 2000).
Spektrometer massa pada umumnya digunakan untuk :
1. Menentukan massa suatu molekul
2. Menentukan rumus molekul dengan menggunakan Spektrum Massa Beresolusi
Tinggi (High Resolution Mass Spectra)
3. Mengetahui informasi dari struktur dengan melihat pola fragmentasinya.
2. 4. Bakteri
Bakteri termasuk dalam golongan prokariot, secara fisik memiliki morfologis seperti
yang telah dikemukan oleh Antony Van Leeuwenhoek, dengan ukuran hanya
beberapa mikron sehingga tidak dapat dilihat dengan mata telanjang (Pelczar dan
Chan, 1988). Dinding selnya terdiri atas peptidoglikan, berkembang biak secara
antibiotika. Beberapa bakteri ada yang dapat bergerak aktif karena memiliki flagela
(Dzen et al., 2003).
Bakteri secara tradisional dibagi dalam dua golongan besar: patogen,
menunjukkan pada bakteri penyebab penyakit, dan nonpatogen menunjukkan pada
mereka yang tidak menyebabkan penyakit. Patogen secara klasik diduga memiliki
sifat-sifat tertentu yang memperkuat kemampuan mereka menimbulkan penyakit
(Shulman et al., 1994). Kelompok mikroorganisme yang paling penting dan beraneka
ragam, yang berhubungan dengan makanan dan manusia adalah bakteri. Adanya
bakteri dalam bahan pangan dapat mengakibatkan pembusukan yang tidak diinginkan
atau menimbulkan penyakit yang ditularkan melalui makanan. Bakteri adalah
mikroorganisme bersel tunggal yang tidak terlihat oleh mata (Buckle, 2009).
2.4.1. Bakteri Gram Negatif
Dinding sel bakteri gram negatif tersusun atas satu lapisan peptidoglikan dan
membran luar. Dinding selnya tidak mengandung teichoic acid. Membran luar
terususun atas lipopolisakarida, lipoprotein dan pospolipid. Bakteri gram negatif lebih
sensitif terhadap antibiotik lainnya seperti streptomisin dan bersifat lebih konstan
terhadap reaksi pewarnaan (Tortora, 2001). Bakteri gram negatif lebih sensitif
terhadap antibiotik lainnya seperti streptomisin dan bersifat lebih konstan terhadap
reaksi pewarnaan (Fardiaz, 1992). Pada umumnya berbentuk batang (basil) kecuali
basillus antharias, dibawah mikroskop tampak berwarna merah (Nasution, 2014).
2.4.1.1. Genus Pseudomonas aeruginosa
Genus Pseudomonas aeruginosa mempunyai habitat normal ditanah dan air dan
berperan dalam proses dekomposisi bahan-bahan organik. Pseudomonas aeruginosa
bergerak aktif dengan flagella polar dan mempunyai ukuran lebar 0,5 - 1µm dan
panjang 3 - 4 µm, dan bersifat aerob ( Brooks et al., 2005). Organisme ini juga dapat
sewaktu penusukan lumbar (bagian pinggang) (Volk & Wheeler, 1989).
Pseudomonas aeruginosa kadang-kadang kedapatan didalam luka pada hewan atau
manusia. Bakteri ini menyebabkan timbulnya nanah yang kebiruan (Irianto, 2006).
Gambar 2.7 Pseudomonas aeruginosa
2.4.2. Bakteri Gram Positif
Bakteri gram positif sering berubah sifat pewarnaannya sehingga menunjukkan reaksi
gram variabel. Sebagai contoh, kultur gram positif yang sudah tua dapat kehilangan
kemampuannya untuk menyerap pewarna violet kristal sehingga dapat berwarna
merah seperti bakteri gram negatif. Perubahan tersebut dapat juga disebabkan oleh
perubahan kondisi lingkungan atau modifikasi teknik pewarnaan. Bakteri gram positif
lebih sensitif terhadap penisilin, tetapi lebih tahan terhadap perlakuan fisik
dibandingkan bakteri gram negatif (Fardiaz, 1992). Dinding sel bakteri gram positif
tersusun atas beberapa lapisan peptidoglikan dan strukturnya tebal dan keras. Dinding
selnya juga tersusun atas teichonic acid yang mengandung alkohol (seperti gliserol)
2.4.2.1. Genus Listeria. monocytogenes
Listeria monocytogenes masuk ketubuh melalui saluran gastrointestinal, ketika
makanan terkontaminasi oleh Listeria monocytogenes seperti keju atau sayur-mayur.
Monocytogenes dapat bergerak dari sel ke sel tanpa terpapar dengan antibodi
(Jawetz et al., 1996). Listeria monocytogenes menyebabkan penyakit zoonosis yang
disebut Listeriosis, yang ditandai dengan kenaikan jumlah monosit didalam darah
penderita. Listeria monocytogenes ditemukan pada tahun 1926 oleh Webb, Murray
dan Swan dari suatu penyakit yang menyerang kelinci dan marmut dengan gejala
adanya kenaikan jumlah sel leukosit jenis monosit. Pada saat itu, bakteri ini disebut
dengan Bacterium monocytogenes. Selanjutnya pada tahun 1952, Seeliger
menemukan Listeria monocytogenes (Brooks et al., 2005).
Gambar 2.8 Listeria Monocytogenes
2.5. Antibakteri
Antibakteri adalah obat yang digunakan sebagai pembasmi bakteri, khususnya bakteri
yang bersifat merugikan manusia atau pathogen. Berdasarkan aktivitasnya terhadap
bakteri suatu zat antibakteri dapat digolongkan menjadi dua, yaitu zat yang hanya
dapat menghambat pertumbuhan bakteri saja disebut bakteriostatik dan zat yang
dapat membunuh bakteri disebut bakterisid (Setiabudy dan Vincent, 1995). Suatu
obat antibakteri memperlihatkan toksisitas selektif jika obat ini lebih toksik terhadap
organisme yang menyerang daripada sel hospes (Katzung & Trevor, 1994). Zat
[image:30.612.231.410.331.442.2]sehingga sel hanya dibatasi oleh membran sel yang tipis (Jawetz et al., 1996).
Adapun Ukuran Besar Zona hambat antibakteri :
1. Diameter zona hambat < 8 mm kurang sensitive
2. Diameter zona hambat 9 -14 mm Sensitif
3. Diameter zona hambat 15 – 19 mm Sangat sensitive
4. Diameter zona hambat > 20 mm Luar biasa sensitive
(Kusuma, 2010).
2.5.1. Pengujian aktivitas antibakteri
Penentuan kerentanan pathogen bakteri terhadap obat-obatan antimikroba dapat
dilakukan dengan salah satu metode utama yaitu metode difusi dan metode dilusi.
Metode utama yang dapat digunakan antara lain adalah:
2.5.1.1. Metode difusi
Metode difusi dilakukan dengan cara menginokulasikan kuman kedalam media
perbenihan yang berupa agar dan antibakteri uji diberikan pada permukaan agar
dalam tempat tertentu sehingga antibakteri uji akan berdifusi dalam permukaan agar
yang telah diinokulasikan dengan kuman (Jawetz et al., 1996). Apabila zat antimikroba efektif maka zona hambat akan terbentuk disekitar cakram setelah
inkubasi (Tortora, 2001).
2.5.1.2. Metode Dilusi
Metode dilusi dilakukan dengan cara mencampurkan zat antibakteri yang akan diuji
dengan media dan kemudian diinokulasikan dengan kuman. Pengamatan dilakukan
BAB 3
METODOLOGI PENELITIAN
3.1. Alat-alat
Peralatan yang digunakan dalam penelitian ini meliputi:
- Alat Stahl
- Autoklaf Yamato SN20
- Batang Pengaduk
- Beaker Glass 500 ml Pyrex
- Cawan Petri
- GC-MS Shimadzu
- Gelas Erlenmeyer 250 ml Pyrex
- Gelas Ukur 100 ml Pyrex
- Hot Plate stirrer Cimarec2
- Inkubator Fisher Scientific
- Jarum Ose
- Jangka Sorong
- Jarum Suntik
- Labu destilasi 1000 ml Pyrex
- Neraca Analitis Mettler AE 2000
- Oven
- Pipet tetes
- Spatula
- Spinch
- Tabung Reaksi Pyrex
- Thermo scientific maxQ shaker Fisher Scientific
3.2. Bahan-bahan
- Alkohol 70%
- Aluminium foil
- Aquadest
- Bakteri Pseudomonas aeruginosa
- Bakteri Listeria monocytogenes
- Cawan Petri
- Daun sirih Merah Segar
- Dimetil Sulfoksida (DMSO)
- Kapas
- Kassa
- Kertas Cakram Oxoid
- Mueller Hinton Agar (MHA) p.a Oxoid
- Na2SO4 anhidrous p.a Merck
3.3.Prosedur Penelitian
3.3.1. Penyediaan Sampel
Bahan yang digunakan dalam penelitian adalah daun sirih merah segar yang diperoleh
dari Perumnas Batu 6, Pematang Siantar. Daun sirih merah dibersihkan, dicuci
kemudian dipotong kecil-kecil.
3.3.2. Isolasi Minyak Atsiri Daun Sirih Merah dengan Alat Stahl
Sebanyak 150 gram daun sirih merah segar dipotong kecil-kecil dan dimasukkan
kedalam labu alas 1000 mL ditambahkan aquadest sebanyak 500 mL, dihubungkan
dengan alat penyuling Stahl, dan dididihkan selama ± 4-5 jam hingga menghasilkan
minyak atsiri yang mana destilat yang dihasilkan jernih. Kemudian dipisahkan
dengan corong pisah. Destilat yang diperoleh merupakan campuran minyak dengan
air. Kemudian lapisan minyak ditambahkan Na2SO4 anhidrous untuk mengikat air
yang mungkin masih tercampur dengan minyak atsiri, lapisan minyak didekantasi dan
dimasukkan kedalam botol vial, disimpan dilemari pendingin dalam botol dan ditutup
rapat. Minyak yang diperoleh dianalisis kandungan kimianya menggunakan alat
GC-MS dan diuji aktivitas antibakteri terhadap Pseudomonas aeruginosa dan listeria
monocytogenes.
3.3.3. Analisis Minyak Atsiri Daun sirih Merah dengan GC-MS
Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS. Selanjutnya
kondisi disesuaikan dengan kondisi masing-masing bagian peralatan seperti dibawah
ini kemudian diamati kromatogram yang dihasilkan oleh recorder dan mass recorder
Kondisi GC-MS yang di gunakan analisa komponen kimia minyak atsiri daun daun
sirih merah segar tersebut adalah sebagai berikut :
GCMS – QP2010S SHIMADZU
Kolom : AGILENT HP 5MS
Panjang : 30 meter
Gas Pembawa : Helium
Pengion : EI
[GC-2010]
Column Oven Temperature : 50.oC
Injection Temperature : 300oC
Injection Mode : Split
Flow Control Mode : Pressure
Pressure : 13.0 kPa
Total Flow : 83.9 mL/min
Column Flow : 0.55 mL/min
Linear Velocity : 26.8 cm/sec
Purge Flow : 3.0 mL/min
Split Ratio : 147.4
Equilibrium Time : 1.0min
[GCMS-QP2010]
Interface Temperature : 300oC
Solvent Cut Time : 1.60min
Detector Gain Mode : Relative
Detector Gain : +0,00kV
[MS]
Start Time : 1.80min
End time : 80min
ACQ Mode : Scan
Event Time : 0.50sec
Scan Speed : 1250
Start m/z : 28
End m/z : 600
3.3.4. Pengujian Sifat antibakteri Minyak Atsiri Daun Sirih Merah
3.3.4.1. Pembuatan Media Nutrien Agar (NA)
Sebanyak 7 gram media nutrient agar dimasukkan kedalam gelas lalu dilarutkan
dengan 250 ml aquadest dan dipanaskan hingga larut. Kemudian disterilkan dalam
autoklaf pada suhu 121oC selama 15 menit.
3.3.4.2. Pembuatan Stok Kultur Bakteri
Sebanyak 3 ml nutrient agar steril dimasukkan kedalam tabung reaksi yang steril,
didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk
sudut 30 – 40oC. Biakan bakteri Pseudomonas aeruginosa diambil dari strain utama
miring dengan cara menggores, kemudian diinkubasi pada suhu 35±2oC selama 18-24
jam. Hal yang sama juga dilakukan pada biakan bakteri Listeria monocytogenes.
3.3.4.3. Penyiapan Inkulum Bakteri
Sebanyak 3,25 gram Brain Heart Broth (BHB) dilarutkan dengan 250 ml aquades
dalam gelas dan dipanaskan hingga semua larut, kemudian disterilkan di autoklaf
121oC selama 15 menit dan didinginkan. Lalu koloni bakteri Pseudomonas
aeruginosa diambil dari stok kultur menggunakan jarum ose steril kemudian
disuspensikan kedalam 10 ml media Brain Heart Broth (BHB) steril dalam tabung
reaksi dan diinkubasikan pada suhu 35±2oC selama 24 jam. Hal yang sama juga
dilakukan untuk koloni bakteri Listeria monocytogenes.
3.3.4.4. Pembuatan Variasi Konsentrasi Minyak Atsiri Daun sirih Merah
(Piper ornatum N).
Minyak atsiri daun sirih merah diencerkan dengan pelarut DMSO dengan
masing –masing dalam konsentrasi 5%, 10%, 20% dan 30 % (v/v).
3.3.4.5. Uji Aktifitas Antibakteri Minyak Atsiri Daun Sirih Merah
Sebanyak 1 ml inkolum Pseudomonas aeruginosa dimasukkan kedalam cawan petri,
kemudian dituang media nutrient agar sebanyak 15 ml pada suhu 45-500C
dihomogenkan sampai media dan bakteri tercampur rata, kemudian dibiarkan sampai
media memadat. Diletakkan kertas cakram yang telah direndam dengan minyak atsiri
daun sirih merah dengan berbagai konsentrasi kedalam cawan petri yang telah berisi
bakteri, kemudian diinkubasi dalam inkubator pada suhu 35±20C selama 24 jam.
Selanjutnya diukur zona bening yang ada disekitar kertas cakram menggunakan
jangka sorong. Dilakukan dengan cara yang sama terhadap bakteri Listeria
3.4. Bagan Penelitian
3.4.1 Isolasi Minyak Atsiri Daun Sirih Merah Dengan Stahl
Dimasukkan kedalam labu Stahl 1 liter
Ditambahkan air suling 500 ml
Dirangkai alat Stahl
Dipanaskan selama ±4-5 jam hingga air
bersama minyak atsiri
Dimasukkan kedalam botol vial
Ditambahkan Na2SO4 Anhidrous
Didekantasi
Minyak Atsiri
Diukur volumenya
3.4.2. Analisis Minyak Atsiri Daun Sirih Merah dengan GC-MS
Cuplikan
Diinjeksikan kedalam GC-MS
Diamati Kromatogram yang dihasilkan
Hasil
350 g Daun Sirih Merah Segar yang telah diiris
Lapisan Minyak Lapisan Air
3.4.3. Pengujian Sifat Antibakteri Minyak Atsiri Daun Sirih Merah
3.4.3.1. Pembuatan Media Nutrient Agar (NA), Media Agar Miring dan Stok
Kultur Bakteri
Dilarutkan dengan 250 ml aquadest
dalam Gelas Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada
suhu 121oC selama 15 menit
Dituangkan sebanyak 3 ml kedalam
tabung reaksi
Dibiarkan pada temperatur kamar
sampai memadat pada posisi
miring membentuk sudut 30-45oC
Diambil biakan bakteri Pseudomonas aeruginosa dari
strain utama dengan jarum ose lalu digoreskan pada
media nutrient agar (NA) yang telah memadat
Diinkubasi pada suhu 35oC selama 24 jam
Dilakukan hal yang sama untuk bakteri Listeria monocytogenes.
7 g media Nutrient Agar (NA)
Media Nutrient Agar (NA)
steril
3.4.3.2. Inokulum Penyiapan Bakteri
Dilarutkan dengan 250 ml
aquadest kedalam Gelas Erlenmeyer
Dipanaskan sambil diaduk
hingga larut dan mendidih
Disterilkan dalam autoklaf
pada suhu 121oC selama 15 menit
Dimasukkan sebanyak 10 ml
kedalam tabung reaksi
Diambil koloni bakteri Pseudomonas
aeruginosa dari stok kultur bakteri
dengan jarum ose
Disuspensikan kedalam Brain Heart
Broth (BHB)
Diinkubasi pada suhu 35±2oC
selama 24 jam
Dilakukan hal yang sama untuk bakteri Listeria monocytogenes.
3,25 g media Brain Heart Broth (BHB)
Media Brain Heart Broth
(BHB)
Inokulum Bakteri
3.4.3.3. Uji Aktivitas Antibakteri
Dimasukkan kedalam cawan petri
steril
Ditambah dengan 15 ml media Nutrient agar
(NA) dengan suhu 45-50oC
Dihomogenkan sampai media dan
bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang
telah direndam dengan ekstrak daun sirih
merah dengan berbagai konsentrasi kedalam
cawan petri yang telah berisi bakteri
Diinkubasi selama 24 jam pada suhu 35o±2oC
Diukur diameter zona bening disekitar
cakram dengan jangka Sorong bening
Dilakukan hal yang sama untuk bakteri Listeria monocytogenes.
1 ml inokulum bakteri Pseudomonas
aeruginosa
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Penentuan Kadar Minyak Atsiri
Minyak atsiri daun sirih merah diperoleh dengan metode hidrodestilasi menggunakan
alat Stahl. Proses ini dilakukan secara triplo. Dari hasil destilasi daun Sirih Merah
segar sebanyak 150 g diperoleh rata-rata 2,2 g minyak atsiri kadar minyak atsiri daun
sirih merah sebesar 1,46%. Dari perlakuan proses destilasi secara triplo seperti table
[image:42.612.124.511.384.520.2]4.1 berikut.
Tabel 4.1 Hasil Hidrodestilasi Minyak Atsiri daun sirih merah
No Sampel (g) Minyak Atsiri (g) Persentase (%)
1 150 2,0 1,35
2 150 2,5 1,66
3 150 2,3 1,53
Rata-rata 150 2,2 1,46
sampel (gram)
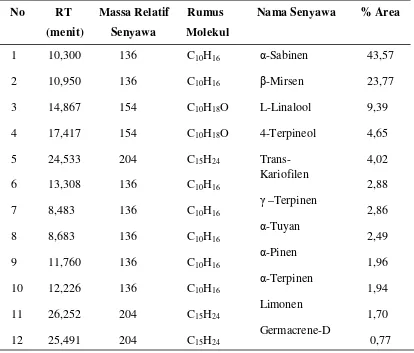
Kromatogram hasil analisis GC menunjukkan terdapatnya 12 puncak senyawa
(Gambar 4.1) yang menunjukkan adanya 12 senyawa yang terkandung dalam minyak
4.1.2. Hasil Analisis dengan GC-MS
Minyak atsiri yang dihasilkan secara hidrodestilasi dianalisis dengan gas
Chromatography-Mass Spectroscopy (GC-MS). Kromatogram GC dari minyak atsiri
daun sirih merah segar. Hasil hidrodestilasi diperoleh 12 puncak senyawa
(gambar 4.1), Senyawa hasil Analisis GC-MS Minyak Atsiri Daun Sirih Merah
sebanyak 12 senyawa seperti pada (table 4.2), dan senyawa dari hasil interpretasi
yang dapat diindentifikasi sebanyak 8 buah senyawa berdasarkan standart library
[image:44.612.118.532.329.682.2]Willey dan NIST (>2%) seperti pada table 4.3.
Tabel 4.2. Senyawa Hasil Analisis GC-MS Minyak Atsiri Daun Sirih Merah
No RT Massa Relatif Rumus Nama Senyawa % Area
(menit) Senyawa Molekul
1 2 3 4 5 6 7 8 9 10 11 12 10,300 10,950 14,867 17,417 24,533 13,308 8,483 8,683 11,760 12,226 26,252 25,491 136 136 154 154 204 136 136 136 136 136 204 204
C10H16
C10H16
C10H18O
C10H18O
C15H24
C10H16
C10H16
C10H16
C10H16
C10H16
C15H24
C15H24
α-Sabinen β-Mirsen L-Linalool 4-Terpineol Trans-Kariofilen
γ –Terpinen
Pada Tabel 4.3. Hasil interpretasi yang dapat diindentifikasi sebanyak 8 buah
senyawa komponen utama berdasarkan standart library Willey dan
NIST (>2%).
No RT Massa Relatif Rumus Nama Senyawa % Area
(Menit) Senyawa Molekul
1 2 3 4 5 6 7 8 10,300 10,950 14,867 17,417 24,533 13,308 8,483 8,683
C10H16
C10H16
C10H18O
C10H18O
C15H24
C10H16
C10H16
C10H16
α-Sabinen
β-Mirsen
L-Linalool
4-Terpineol
Trans-Kariofilen
γ –Terpinen
4.1.3. Hasil Uji Aktivitas Antibakteri
Aktivitas antibakteri daun sirih merah menunjukkan zona hambat pada pertumbuhan
beberapa bakteri yaitu Listeria monocytogenes. dan Pseudomonas Aeruginosa
berdasarkan metode difusi agar seperti yang ditunjukkan pada gambar 4.2 :
[image:46.612.352.527.186.551.2]
(a) Pseudomonas aeruginosa (b) Listeria monocytogenes.
Gambar 4.2. Zona hambat dari minyak atsiri daun sirih merah terhadap
bakteri Pseudomonas aeruginosa dan Listeria monocytogenes.
Hasil pengujian minyak atsiri daun sirih merah terhadap pertumbuhan bakteri gram
positif Listeria monocytogenes serta pertumbuhan bakteri gram negatif Pseudomonas
aeruginosa setelah inkubasi 1x24 jam dapat dilihat pada table 4.3.
Tabel 4.3. Hasil pengukuran diameter zona bening pada kultur bakteri gram positif
Listeria monocytogenes serta pertumbuhan bakteri gram negatif
Pseudomonas aeruginosa.
Diameter Daerah Hambatan (mm)
Konsentrasi Bakteri Gram Negatif Bakteri Gram Positif
Pseudomanas aureginosa Listeria monocytogenes
5% - -
10 % 9,2 -
20 % 10,4 8,7
30 % 11,3 9,4
Semakin tinggi konsentrasi maka zona bening akan semakin lebar
4.2.Pembahasan
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Stahl
Dari sebanyak 450 g daun sirih merah segar diperoleh minyak atsiri daun sirih merah
sebanyak 2,2 g (b/b) dengan persentase sebesar 1,46% yang diperoleh dari
perhitungan berikut:
% kadar minyak atsiri = ����� ������ ������
����� ���� ���� ℎ���� ℎ
= 2,2 gram
150 gram x 100 %
= 1,46%
[image:47.612.111.527.190.432.2]4.2.2. Analisis Minyak Atsiri Daun Sirih Merah
Hasil analisis GC-Ms terhadap minyak atsiri daun sirih merah menunjukkan bahwa
didalam minyak atsiri tersebut terdapat 8 senyawa yang dapat diinterprestasi yaitu:
1. α – Tuyan
Puncak dengan RT 8,483 menit merupakan senyawa dengan rumus molekul C10H16.
Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121, 105, 93, 77,65, 41. Dengan membandingkan data
spektrum yang diperoleh dengan data spektrum library Wiley, yang lebih mendekati
adalah senyawa monoterpen yaitu α – Tuyan sebanyak 2,86% dengan spektrum
[image:48.612.113.525.362.625.2]seperti gambar 4.3 dan pola fragmentasi α – Tuyan secara hipotesis ditunjukkan pada
gambar 4.4
(a)
(b)
Gambar 4.3. Spektrum Massa α – Tuyan
Keterangan : a= Spektrum massa hasil analisis GC-MS
2. α-Pinen
Puncak dengan RT 8.683 menit merupakan senyawa dengan rumus molekul C10H16.
Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121, 105, 93, 77, 67, 53, 39. Dengan membandingkan
data spektrum yang diperoleh dengan data spektrum library wiley 229, yang lebih
mendekati adalah senyawa golongan monoterpen yaitu α-Pinen sebanyak 2,49 %
dengan spektrum seperti gambar 4.5 dan pola fragmentasi α-Pinen secara hipotesis
ditunjukkan pada gambar 4.6.
(a)
[image:50.612.111.525.267.580.2](b)
Gambar 4.5. Spektrum Massa α-Pinen
Keterangan: a= Spektrum massa hasil analisis GC-MS
3. Sabinen
Puncak Kromatogram dengan waktu retensi 10,300 menit merupakan
senyawa golongan monoterpen dengan rumus molekul C10H16. Spektrum massa
menunjukkan puncak ion molekul pada m/e 136 diikuti fragmen- fragmen pada m/e
121, 105, 93, 77, 69, 43 dan 41. Dengan membandingkan spektrum yang diperoleh
dengan data spektrum library wiley, yang lebih mendekati adalah golongan
monoterpen yaitu sabinen sebanyak 43,57 % dengan spektrum seperti gambar 4.7.
Selanjutnya pola fragmentasi dari senyawa sabinen tersebut secara hipotesis seperti
pada gambar 4.
(a)
(b)
Gambar 4.7. Spektrum massa sabinen
Keterangan: a. Spektrum massa hasil analisis GC-MS
4. β-Mirsen
Puncak dengan RT 10.950 menit merupakan senyawa dengan rumus molekul C10H16.
Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121,107, 93, 79, 69, 53, 41. Dengan membandingkan
data spektrum yang diperoleh dengan data spektrum library Wiley, yang lebih
mendekati adalah golongan monoterpen yaitu senyawa β-Mirsen sebanyak 23,77%
dengan spektrum seperti gambar 4.9 dan pola fragmentasi β-Mirsen secara hipotesis
ditunjukkan pada gambar 4.10
(a)
[image:54.612.112.529.246.539.2](b)
Gambar 4.9. Pola Fragmentasi yangmungkin dari senyawa β-Mirsen
Keterangan : a = Spektrum massa hasil analisis GC-MS
5. γ-Terpinen
Puncak dengan RT 13.308 menit merupakan senyawa dengan rumus molekul
C10H16 . Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121, 105, 93, 77, 65, 41. Dengan
membandingkan data spektrum yang diperoleh dengan data spektrum library, yang
lebih mendekati adalah golongan monoterpen yaitu senyawa γ-Terpinen sebanyak
2,88 % dengan spektrum seperti gambar 4.11 dan pola fragmentasi γ-Terpinen secara
hipotesis ditunjukkan pada gambar 4.12
(a)
[image:56.612.113.534.276.574.2](b)
Gambar 4.11. Spektrum massa γ-Terpinen
Keterangan a = Spektrum massa hasil analisis GC-MS
b = Spektrum standard library NIST
6. L-Linalool
Puncak dengan RT 14,867 menit merupakan senyawa dengan rumus molekul
C10H18O. Data spektrum menunjukkan puncak ion molekul pada m/e 154 diikuti
puncak-puncak fragmentasi pada m/e 136, 121, 107, 93, 71, 69, 41. Dengan
membandingkan spektrum yang diperoleh dengan data spektrum library wiley, yang
lebih mendekati adalah golongan monoterpen yaitu Linalool sebanyak 9,39 % dengan
spektrum gambar 4.13. Selanjutnya pola fragmentasi dari senyawa L-Linalool
tersebut secara hipotesis seperti pada gambar 4.14
(a)
[image:58.612.112.532.229.570.2](b)
Gambar 4.13. Spektrum massa L-Linalool
Keterangan : a= Spektrum massa hasil analisis GC-MS
7. 4-Terpeniol
Puncak dengan RT 17.417 menit merupakan senyawa dengan rumus molekul
C10H180. Data spektrum menunjukkan puncak ion molekul pada m/e 154 diikuti
puncak-puncak fragmentasi pada m/e 136, 121, 111, 93, 71, 69, 43, 41. Dengan
membandingkan data spektrum yang diperoleh dengan data spektrum library Wiley
229, yang lebih mendekati adalah senyawa monoterpen yaitu 4-Terpeniol sebanyak
4,65 % dengan spektrum seperti gambar 4.15 dan pola fragmentasi 4-Terpeniol secara
hipotesis ditunjukkan pada gambar 4.16
(a)
[image:60.612.113.535.270.574.2](b)
Gambar 4.15 Spektrum Massa 4-Terpeniol
Keterangan : a= Spektrum massa hasil analisis GC-MS
8. Trans-Kariofilen
Puncak dengan RT 24,533 menit merupakan senyawa dengan rumus molekul C15H24.
Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 175, 161, 148, 133, 120, 107, 93, 79, 69, 55, 41.
Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library,
yang lebih mendekati adalah senyawa golongan seskuiterpen yaitu Trans-Kariofilen
sebanyak 4,02 % dengan spektrum seperti gambar 4.17 dan pola fragmentasi
Trans-Kariofilen secara hipotesis ditunjukkan pada gambar 4.18
(a)
(b)
Gambar 4.17 Spektrum massa senyawa Trans-Kariofilen
Keterangan : a = Spektrum massa hasil analisis GC-MS
Selanjutnya pola fragmentasi dari senyawa Trans-Kariofilen tersebut secara hipotesis
pada gambar 4.4
H
3C
CH3
CH
2CH
3+ e
-2 e
CH
2H
3C
H
3C
CH
3CH
3H
3C
H
3C
CH
2m/e = 93 (C
7H
9)
C
2H
4m/e = 161
CH
2H
2C
C
5H
8CH
2m/e =79
C
3H
2m/e = 41
m/e = 204
[image:63.612.115.514.134.642.2]m/e = 189
M = 204
Ngaisah Siti, 2010 memperoleh komponen kimia Daun Sirih merah kering
asal Magelang melalui proses destilasi Stahl sebanyak 6 senyawa yaitu α-Tuyan
(2,42%), α-Pinen (3,16%), Kamfen (0,49%), Sabinen (74,73%), β-Mirsen (17,12%),
Trans-kariofilen (1,88%). Dalam Hal ini disebabkan karena kandungan minyak atsiri
dari tumbuhan sangat dipengaruhi oleh: tempat tumbuh, musim, perbedaan
tempat/daerah, pengambilan sampel, perlakuan pasca panen misalnya pengeringan
dan penyimpanan, serta kondisi operasional alat yang digunakan dalam mendeteksi
komponen tersebut khususnya kolom yang digunakan (Olonisakin et al., 2006).
4.2.4. Uji Aktifitas Antibakteri Minyak Atsiri Daun Sirih Merah
Hasil Uji antibakteri dari minyak atsiri daun sirih merah mampu menghambat
pertumbuhan bakteri Pseudomonas aeruginosa dan listeria monocytogenes. Hal ini
ditunjukkan dengan adanya zona bening terhadap bakteri Pseudomonas aureginosa
dan listeria monocytogenes sekitar kertas cakram setelah diencerkan dalam DMSO
dengan variasi konsentrasi minyak atsiri yaitu konsentrasi 5% tidak menunjukkan
zona halo atau zona bening sedangkan konsentrasi 10% pada bakteri Pseudomonas
aeruginosa menunjukkan aktivitas dengan zona hambat 9,2 mm (Sensitif), dan pada
bakteri listeria monocytogenes konsentrasi 10% tidak menunjukkan zona halo (zona
bening), Konsentrasi 20% pada bakteri Pseudomonas aeruginosa menunjukkan
aktivitas dengan zona hambat 10,4 mm (Sensitif), dan pada bakteri listeria
monocytogenes pada konsentrasi 20% memiliki zona hambat yaitu 8,7 mm (Kurang
sensitif), Konsentrasi 30% pada bakteri Pseudomonas aeruginosa memiliki zona
hambat sebesar 11,3 mm(Sensitif), dan pada bakteri listeria monocytogenes memiliki
zona hambat sebesar 9,4 mm (Sensitif).
Dari data hasil uji menunjukkan bahwa Dinding sel bakteri gram negatif
mengandung peptidoglikan jauh lebih sedikit daripada gram positif Sehingga
permeabilitas bakteri gram positif lebih rendah dibandingkan permeabilitas bakteri
akan mengalami kesulitan untuk menembus membran sel bakteri gram positif
sehingga efek bakterinya kurang optimal peptidoglikan pada sel bakteri yang sedang
tumbuh dan menyebabkan kematian sel. Ajizah (2004) dimana semakin kecil
konsentrasi maka semakin sedikit jumlah zat aktif yang terkandung didalamnya,
sehingga semakin rendah kemampuan dalam menghambat pertumbuhan suatu bakteri
Sehingga, aktivitas antibakteri minyak atsiri daun sirih merah tergantung dari
konsentrasi yang digunakan.
Menurut Kusuma (2010) mengemukan bahwa ketentuan kekuatan daya
antibakteri adalah:
1. Diameter zona hambat < 8 mm kurang sensitif
2. Diameter zona hambat 9 -14 mm Sensitif
3. Diameter zona hambat 15 – 19 mm Sangat sensitif
4. Diameter zona hambat > 20 mm Luar biasa sensitif
Senyawa metabolik sekunder golongan fenol dan minyak atsiri terjadi
penghambatan terhadap pertumbuhan koloni bakteri diduga disebabkan karena
kerusakaan yang terjadi pada komponen struktural membran sel bakteri
(Wulandari, 2006). Komponen minyak atsiri yang mengandung percabangan gugus
fenol maupun 63lcohol dapat melarutkan fosfolipid. Kondisi asam oleh adanya fenol
dapat berpengaruh terhadap pertumbuhan bakteri Pseudomonas aeruginosa, dan
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Komponen kimia daun sirih merah yang terkandung didalamnya adalah
Sabinen (43,57%), β-Mirsen (23,77%), L-Linalool (9,39%),
4-Terpineol (4,65%), Trans-Kariofilen (4,02%), γ-Terpinen (2,88%),
α-Tuyan (2,86%), dan α-Pinen (2,49%), kadar minyak atsiri daun sirih merah yang diperoleh dengan metode hidrodestilasi adalah 1,46%
2. Minyak atsiri daun Sirih Merah (Piper ornatum N) memiliki aktivitas sebagai
antibakteri terhadap bakteri Pseudeumonas aureginosa. Zona hambat
antibakteri yang terkandung dalam minyak atsiri daun sirih merah termasuk
dalam kategori “Sangat sensitif” yaitu kisaran (10-20 mm) tetapi pada bakteri
zona hambat minyak atsiri daun sirih merah terhadap bakteri
listeria monocytogenes termasuk dalam kategori “sensitif” yaitu kisaran
(5-10 mm).
5.2. Saran
Perlu diteliti lebih lanjut uji antijamur dan antibakteri daun sirih merah (Piper
DAFTAR PUSTAKA
Achmad, S. 1985. Kimia Organik Bahan Alam. Jakarta. Universitas Terbuka.
Agusta, A. 2000. Minyak Atsiri Tumbuhan Tropika Indonesia. Jakarta: Penerbit ITB.
Ajizah , A. 2004. Sensitivitas Salmonella tyhimurium terhadap ekstrak daun Psidium guajava L. Journal Bioscientiae. Volume 1 Nomor 1.
Brooks, G.F., Janet, S.B., Stephen, A.M. 2005. Mikrobiologi kedokteran1. Penerjemah:Bagian Mikrobiologi FK.Unair. Jakarta: Penerbit Salemba Medika.
<