TESIS
Oleh
IRWANSYAH 097 006 032/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
TESIS
Diajukan Sebagai Salah Satu Syarat untuk Memproleh Gelar
Magister Sains dalam Program Studi Ilmu Kimia Pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh
IRWANSYAH 097 006 032 / KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Nomor Pokok : 097006032 Program Studi : Ilmu Kimia.
Menyetujui : Komisi Pembimbing
(Prof. Dr. Jamaran Kaban, MSc) (Drs. Adil Ginting, MSc)
Ketua Anggota
Ketua Program Studi, Dekan
(Prof. Basuki Wirjosentono, M.S, Ph.D) (Dr. Sutarman, MSc)
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Jamaran Kaban, M.Sc. Anggota : 1. Drs. Adil Ginting, M.Sc.
2. Prof. Basuki Wirjosentono, M.S, Ph.D 3. Dr. Hamonangan Nainggolan, M.Sc. 4. Prof. Dr. Tonel Barus.
TESIS
Dengan ini saya menyatakan bahwa tesis ini tidak terdapat karya yang pernah diajukan untuk memproleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang sepengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis dan diterbitkan oleh orang lain, kecuali secara tertulis untuk diacu dalam naskah dan disebutkan dalam daftar pustaka.
Medan, Juni 2011.
Penulis,
ABSTRAK
Banyak peneliti tertarik untuk mengembangkan kegunaan kitosan dengan melakukan reaksi transformasi kimia menjadi turunan kitosan. Telah dilakukan pembuatan N-palmitil kitosan dari reaksi antara palmitil klorida dengan kitosan. Palmitil klorida diperoleh melalui reaksi antara asam palmitat dengan phosforpentaklorida dalam pelarut kloroform pada suhu 60 – 70 oC selama 3 jam. Palmitil klorida direaksikan dengan kitosan dalam kloroform pada suhu O oC selama 30 menit, lalu dihidrolisis menggunakan NaOH 1 M pada suhu 60 – 65 oC selama 20 jam. Terbentuknya N-palmitil kitosan dapat dilihat dari hasil analisa FT-IR, dimana muncul serapan 2916 cm-1 (gugus alkil, CH- stratching; CH3- asymetris), 2848 cm-1 (gugus alkil, CH- stretching; -CH2- symetris), 720 cm-1 (-CH2- rocking in C-(CH2)n -C), 3448 cm-1 (amida, N-H stretching; NH sekunder, dan –OH stretching; dimer), 1543 cm-1(amida II, N-H deformasi; sekunder), 1573 cm-1 (amida I, N-H stretching; C=O stretching; sekunder) dan 1111 cm-1 (amida III, CN stretching-NH deformation, sekunder).
Many researchers interest to develope using of chitosan by performing chemical transformation reaction to produce chitosan derivatives. It has been conducted formation of N-palmityl chitosan from the reaction between palmityl chloride and chitosan. Palmityl chloride was produced by reaction between palmatic acid with phosphorpentachloride in chloroform at (60-70) oC for 3 hours. Palmityl chloride was reacted with chitosan in chloroform at 0 oC for 30 minutes, then it was hydrolyzed by using NaOH 1M at (60-65) oC for 20 hours. Formation of N-palmityl chitosan can be seen from FT-IR analysis, where absorptions at 2916 cm-1 (alkyl group, CH- stratching, CH3- assymetris), 2848 cm-1 (alkyl group, CH stretching,
-CH2- symetris), 720 cm-1 (-CH2- rocking in C-(CH2)n-C), 3448 cm-1 (amide, N-H
stretching, R2NH secondary, and –OH stretching, dimer), 1543 cm-1 (amide-II, N-H
deformation, secondary), 1573 cm-1 (amide-I, NH stretching, C=O stretching, secunder) and 1111 cm-1 (amide-III, CN stretching-NH deformation, secondary).
Key Words : N-Palmityl chitosan, Chitosan, Palmitic acid, Palmityl chloride and
Puji dan syukur kepada Allah SWT atas segala rahmat dan anugrah-Nya, yang telah memberikan kesempatan dan kemudahan, sehingga penulis mampu menyelesaikan tesis dari penelitian dengan judul “ Transformasi Kitosan dan Asam Palmitat Menjadi N-Palmitil Kitosan ”. Tesis merupakan suatu syarat yang harus dipenuhi dalam rangka untuk mencapai kesarjanaan magister (S-2) pada Program Studi Magister Kimia di Sekolah Pascasarjana Universitas Sumatera Utara.
Dalam penulisan tesis ini, penulis sangat menyadari bahwa dengan bantuan dari berbagai pihak dapatlah tesis ini terselesaikan, sebagai mana diharapkan. Pada kesempatan ini, penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Bapak Prof. Dr. Jamaran Kaban, M.Sc dan Drs. Adil Ginting, MSc selaku dosen pembimbing I dan II, atas segala dukungan, saran dan masukan serta pengarahannya dalam memberikan pengetahuan dan bimbingan yang sangat bermanfaat bagi penyusunan tesis dari penelitian ini.
2. Bapak Prof. Basuki Wirjosentono, MS, Ph.D dan Dr. Hamonangan
Nainggolan, M.Sc selaku Ketua Prodi dan Sekretaris Prodi Kimia Sekolah Pascasarjana USU, yang telah mengarahkan kami selama perkuliahan dan dalam melaksanakan persiapan penelitian sampai penyelasian penulisan tesis ini.
3. Rektor Universitas Sumatera Utara, Prof . Dr. dr. Syahril Pasaribu,
Ginting, M.Sc, staf ahli Ibu Juliati Tarigan, S.Si, M.Si dan lainya yang tidak dapat saya sebutkan satu persatu, Asisten Laboratorium Aspriadi Tarigan dan lainnya yang telah banyak membantu dalam melakukan penelitian.
6. Kepala dan Staf ahli Laboratorium Kimia Organik FMIPA-UGM Yokyakarta atas bantuannya menganalisa sampel.
7. Keluarga, teristimewa kepada istri saya Dra. Lili Sri Astuti, M.Pd, anak- anak saya Putri Aswanti Hasanah, Dewi Astri Khairina, Fira Aulia Mardha dan Muhammad Fadlan Irliansyah yang dengan penuh pengertian serta Doanya sehingga saya dapat menyelesaikan pendidikan ini.
8. Rekan – rekan se-Jurusan Kimia, khususnya mahasiswa angkatan 2009 Sekolah Pascasarjana USU.
Dengan menyadari keterbatasan pengalaman dan kemampuan yang dimiliki, sudah tentu terdapat banyak kekurangan dalam tulisan ini. Untuk itu penulis mengharapkan adanya saran dan kritik dari berbagai pihak yang sifatnya membangun dan menyempurnakan tesis ini. Akhir kata semoga tesis ini dapat memberikan manfaat bagi semua pihak, khususnya bagi penulis dan umumnya bagi para pembaca.
Medan, Juni 2011.
Penulis,
IRWANSYAH
Penulis lahir di Tanjungpura, Kabupaten Langkat, Sumatera Utara pada tanggal 08 Nopember 1964 anak kedua dari sembilan bersaudara dari pasangan Bapak Harun Nurdin (Alm) dan Ibu Asnah D.
Pendidikan Sekolah Dasar di SD Negeri 1 Tanjungpura (1973 s/d 1978), Sekolah Menengah Pertama di SMP Negeri 1 Tanjungpura (1978 s/d 1981) dan Sekolah Menengah Atas di SMA Negeri 1 Tanjungpura (1981 s/d 1984).
2.1.3.1. Reaksi Transformasi Kitosan Tanpa Menggunakan Gugus pelindung 11
2.2.2. Sifat dan Kegunaan Asam Palmitat 19
3.2.2. Klorinasi Asam Palmitat dengan Phosforpentaklorida 34
3.2.2.1. Pembuatan Phosforpentaklorida dari diphosforpentaoksida direaksikan dengan asam klorida 34
3.2.2.2. Pembuatan Palmitil Klorida Mereaksikan Asam Palmitat dengan Phosforpentaklorida 35
3.2.2.3. Karakterisasi Palmitil Klorida Menggunakan Sepektrofotmeter Inframerah 35
3.2.3..Pembuatan N,N-Palmitil Kitosan mereaksikan Palmitil Klorida dengan Kitosan 35
3.2.3.4. Karakterisasi Hasil Reaksi Hidrolisis N,N-Palmi til Kitosan Menggunakan Spektrofotometer Infra
merah 36
3.3. Bagan Penelitian 37
3.3.1. Bagan Pembuatan Phosforpentaklorida 37 3.3.2. Bagan Pembuatan Palmitil Klorida dari Klorinasi Asam
Asam Palmitat Menggunakan Phosforpentaklorida 38 3.3.3. Bagan Pembuatan N,N-Palmitil Kitosan Mereaksikan
Palmitil Klorida dengan Kitosan 39
3.3.4. Bagan Reaksi Hidrolisis N,N-Palmitil Kitosan untuk
Menghasikan N-Palmitil Kitosan 40
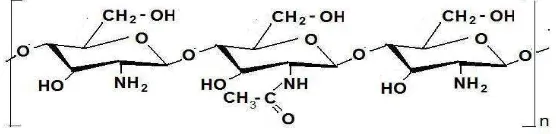
2.1. Struktur Polimer Kitosan 5
2.2.Deasetilasi kitin menjadi kitosan 7
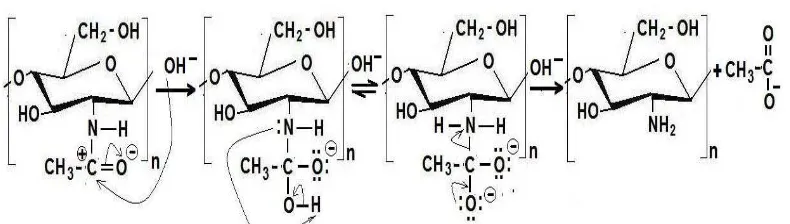
2.3. Mekanisme Reaksi Hidrolisis Kitin Menjadi Kitosan 7
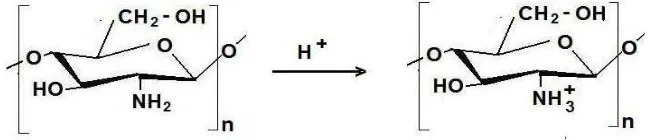
2.4. Kitosan sebagai polielektrolit kationik 8
2.5. Jembatan hidrogen secara (a) intermolekuler atau (b) intramolekuler 10
2.6. Gugus-gugus aktif dari kitosan 10
2.7. Reaksi asilasi pada N-Kitosan dengan asam formiat dan asam asetat 11
4.5. Spektra FT-IR, (atas) Palmitil Klorida : pembanding,
(bawah) Palmitil Klorida : pereaksi (sampel di analisa) 44 4.6. Spektra FT-IR dari Asam Palmitat pereaksi dan Palmitil
Klorida Hasil Reaksi Klorinasi 45
4.7. Reaksi Asilasi Kitosan menggunakan Palmitil Klorida 46 4.8. Mekanisma reaksi pembentukan N,N-Palmitil Kitosan dari
Reaksi asilasi menggunakan Palmitil Klorida 47 4.9. Spektrum FT-IR, N,N-Palmitil Kitosan 48 4.10. Spektra FT-IR, A. Kitosan dan B. N,N-Palmitil Kitosan 49 4.11. Reaksi Pembentukan N-Palmitil Kitosan dengan menghidrolisis N,
N-Palmitil Kitosan 50 4.12. Mekanisma reaksi pembentukan N-Palmitil Kitosan dari
Palmitil Kitosan di hidrolisis menggunakan larutan NaOH 1 M 50 4.13. Spektrum FT-IR N-Palmitil Kitosan dari hasil hidrolisis N,
N-Palmitil Kitosan 51 4.14. Spektra FT-IR, A.Asam Palmitat, B.Palmitil Klorida, C.Kitosan,
D. N,N-Palmitil Kitosan, dan E. N-Palmitil Kitosan 52 4.15. Tahapan reaksi mulai klorinasi, asilasi dan hidrolisis 53
Banyak peneliti tertarik untuk mengembangkan kegunaan kitosan dengan melakukan reaksi transformasi kimia menjadi turunan kitosan. Telah dilakukan pembuatan N-palmitil kitosan dari reaksi antara palmitil klorida dengan kitosan. Palmitil klorida diperoleh melalui reaksi antara asam palmitat dengan phosforpentaklorida dalam pelarut kloroform pada suhu 60 – 70 oC selama 3 jam. Palmitil klorida direaksikan dengan kitosan dalam kloroform pada suhu O oC selama 30 menit, lalu dihidrolisis menggunakan NaOH 1 M pada suhu 60 – 65 oC selama 20 jam. Terbentuknya N-palmitil kitosan dapat dilihat dari hasil analisa FT-IR, dimana muncul serapan 2916 cm-1 (gugus alkil, CH- stratching; CH3- asymetris), 2848 cm-1 (gugus alkil, CH- stretching; -CH2- symetris), 720 cm-1 (-CH2- rocking in C-(CH2)n -C), 3448 cm-1 (amida, N-H stretching; NH sekunder, dan –OH stretching; dimer), 1543 cm-1(amida II, N-H deformasi; sekunder), 1573 cm-1 (amida I, N-H stretching; C=O stretching; sekunder) dan 1111 cm-1 (amida III, CN stretching-NH deformation, sekunder).
Many researchers interest to develope using of chitosan by performing chemical transformation reaction to produce chitosan derivatives. It has been conducted formation of N-palmityl chitosan from the reaction between palmityl chloride and chitosan. Palmityl chloride was produced by reaction between palmatic acid with phosphorpentachloride in chloroform at (60-70) oC for 3 hours. Palmityl chloride was reacted with chitosan in chloroform at 0 oC for 30 minutes, then it was hydrolyzed by using NaOH 1M at (60-65) oC for 20 hours. Formation of N-palmityl chitosan can be seen from FT-IR analysis, where absorptions at 2916 cm-1 (alkyl group, CH- stratching, CH3- assymetris), 2848 cm-1 (alkyl group, CH stretching,
-CH2- symetris), 720 cm-1 (-CH2- rocking in C-(CH2)n-C), 3448 cm-1 (amide, N-H
stretching, R2NH secondary, and –OH stretching, dimer), 1543 cm-1 (amide-II, N-H
deformation, secondary), 1573 cm-1 (amide-I, NH stretching, C=O stretching, secunder) and 1111 cm-1 (amide-III, CN stretching-NH deformation, secondary).
Key Words : N-Palmityl chitosan, Chitosan, Palmitic acid, Palmityl chloride and
BAB 1
P E N D A H U L U A N
1.1. Latar Belakang.
Sebagai negara maritim, Indonesia mempunyai potensi hasil perikanan laut yang sangat melimpah, seperti udang dan kepiting. Kulit udang mengandung 15 – 20 % kitin dan kulit kepiting mengandung 18,70 – 32,20 % kitin (Marganov, 2003). Salah satu turunan kitin adalah kitosan suatu senyawa mempunyai rumus kimia poli-β-(1,4)-2-amino-2-dioksi-D-glukosa yang dapat dihasilkan dari proses hidrolisis kitin menggunakan basa kuat diikuti dengan terjadinya deasetilasi (Srijanto dan Imam, 2005). Senyawa kitosan saat ini telah banyak menarik perhatian peneliti untuk mengembangkan kegunaannya dengan membuat berbagai jenis reaksi transformasi kimia menjadi senyawa turunan kitosan. (Kaban, 2009).
Sejak tahun 2007, Indonesia merupakan produsen crude palm oil (CPO) terbesar dunia. Produksi CPO Indonesia pada tahun 2008 mencapai 20 juta ton. Saat ini kapasitas terpakai industri pengolahan CPO baru mencapai 54 %. Dalam rangka mengantisipasi melimpahnya produksi CPO ini, perlu diupayakan usaha pengolahan CPO menjadi produk hilir. ( http;//repository.usu.ac.id ). Minyak kepala sawit mengandung senyawa-senyawa kimia diantaranya yaitu asam palmitat 40 – 46 %, asam stearat (3,6 – 4,7 %) asam oleat (39 – 45 %), asam miristat (1,1 – 2,5 %) dan asam linoleat (7 – 11 %) (Ketaren, 1986).
pendorong untuk melengkapi metode mengadopsi biopolimer yang bernilai, sebagai bahan dasar yang selanjutnya ditransformasi secara kimia menjadi bermacam
turunannya guna keperluan tertentu. (Tharanathan and Kittur, 2003).
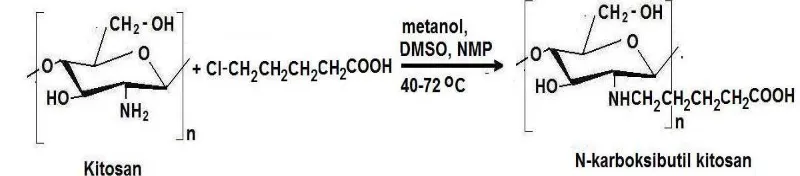
Beberapa peneliti telah melakukan transformasi kimia terhadap senyawa kitosan, untuk menghasilkan turunan kitosan, antara lain menjadi senyawa karboksimetil kitosan, asetil kitosan dan hidroksipropil kitosan. (Hirano, 2003., Park, 2001). N-karboksibutil kitosan.(Chun H.K, and C.S. Kyu,.1998). N,N-lauril kitosan.(Chun L.M et al., 2003). N-lauril kitosan dan heksanoil kitosan.(Shelma R, dan C.P. Sharma., 2010). Kitosan suksinat diperoleh dengan melarutkan kitosan dalam asam asetat dan metanol, direaksikan dengan anhidrida suksinat (Noerati, 2007).
Pada penelitian ini dilakukan pembuatan N-palmitil kitosan, dengan mengubah asam palmitat melalui reaksi klorinasi menggunakan phosphorpentaklorida membentuk senyawa palmitil klorida yang lebih reaktif. Palmitil klorida direaksikan dengan kitosan, untuk membentuk senyawa turunan kitosan dan selanjutnya dilakukan hidrolisis untuk menghasilkan senyawa N-palmitil kitosan. Hasil reaksi yang terbentuk dari mulai reaksi klorinasi, asilasi dan hidrolisis dikarakterisasi menggunakan FT-IR, untuk mengidentifikasi adanya perubahan gugus fungsi karboksilat pada asam palmitat menjadi asil klorida, dan
gugus amina pada kitosan menjadi gugus amida yang mengikat palmitil. 1.2. Perumusan Masalah.
Bagaimanakah mentransformasi kitosan dan asam palmitat menjadi
palmitil kitosan, tanpa menggunakan gugus pelindung pada gugus hidroksi kitosan? 1.3. Pembatasan Masalah.
1. Kitosan yang dipergunakan adalah sudah tersedia dan tidak diisolasi dari sumbernya.
3. Terbentuknya palmitil kitosan, diidentifikasi dari data hasil analisa secara Spektrofotometer Inframerah (FT-IR).
1.4. Tujuan Penelitian.
1. Membuat senyawa N-palmitil kitosan dari kitosan dan asam palmitat yang sudah diklorinasi dengan phosforpentaklorida diikuti reaksi
hidrolisis.
2. Membuat N-palmitil kitosan dari asam palmitat diklorinasi dan kitosan, tanpa menggunakan gugus pelindung pada gugus hidroksi kitosan.
1.5. Manfaat Penelitian.
1. Penelitian ini diharapkan memberikan sumbangan dalam reaksi sintesa organik, guna pengembangan polimer alam berupa kitosan dan asam palmitat untuk menghasilkan senyawa N-palmitil kitosan.
2. Senyawa N-palmitil kitosan dapat digunakan sebagai bahan baku, untuk pembuatan kosmetik.(Aranaz et al., 2010).
1.6. Lokasi Penelitian.
Reaksi pembuatan senyawa N-palmitil kitosan di Laboratorium Kimia Organik – Fakultas Matematika dan Ilmu Pengetahuan Alam – Universitas Sumatera Utara (USU) – Medan, analisa menggunakan Spektrofotometer infamerah (FT-IR) di Laboratorium Kimia Organik – Fakultas Matematika dan Ilmu Pengetahuan Alam – Universitas Gadjah Mada (UGM) – Yokyakarta.
1.7. Metodologi Penelitian.
klorida standar pro analysis E’Merck dan serbuk phosfor pentaoksida standar pro analysis E’Merck.
Asam palmitat dilarutkan dalam pelarut semipolar berupa senyawa
kloroform. Selanjutnya kedalam larutan ditambahkan phosforpentaklorida, sambil dilakukan pengadukan dan direfluks pada suhu 60 – 70 oC selama 3 jam. Hasil samping berupa senyawa polar HCl dan POCl3 yang terbentuk setelah didiamkan akan memisah dari lapisan kloroform, pada bagian atas berupa HCl dan bagian bawah POCl3 dan PCl5 berlebih. Pisahkan HCl, POCl3 dan PCl5. Lalu kedalam campuran ditambahkan sedikit demi sedikit kitosan, dan lakukan pengadukan selama 30 menit pada suhu 0 oC. Kemudian diamkan, sehingga terbentuk endapan dan lapisan larutan. Endapan berupa hasil reaksi palmitil kitosan dan pelarut kloroform, serta lapisan atas adalah hasil samping reaksi asilasi berupa HCl.
Hasil samping dipisahkan dan endapan berupa palmitil kitosan selanjutnya dihidrolisis menggunakan larutan NaOH 1 M dengan merefluks pada suhu 60 oC selama 20 jam untuk menghasilkan N-palmitil kitosan. Pengendapan hasil reaksi dilakukan dengan penambahan metanol. Pemisahan hasil reaksi berupa N-palmitil kitosan dilakukan melalui penyaringan,
dan pencucian dengan metanol, keringkan dalam oven pada suhu 110 oC sampai bebas air.
BAB 2
TINJAUAN PUSTAKA
2.1. Kitosan.
Kitosan pertama kali ditemukan oleh ilmuwan Perancis, Ojier, pada tahun 1823. Ojier meneliti kitosan hasil ekstrak kerak binatang berkulit keras, seperti udang, kepiting, dan serangga.
Gambar 2.1. Struktur Polimer Kitosan.
kitosan mampu menyerap lemak 4-6 kali beratnya sendiri untuk kemudian dibuang melalui faces. (www.wikipedia,
kimia, kitosan ).
2.1.1. Pembuatan Kitosan.
Proses pembuatan kitosan dapat dilakukan dengan terlebih dahulu penghilangan mineral (demineralisasi), selanjutnya penghilangan protein (deproteinasi), deasetilasi kitin dan pemurnian kitosan. Bahan dasar dapat berupa kulit udang atau kepiting.
Proses demineralisasi, pertama kulit udang atau kulit kepiting sudah dihaluskan menjadi serbuk ditambah HCl, lalu campuran dipanaskan pada suhu 70 – 80 oC selama 4 jam sambil diaduk dengan pengaduk 50 rpm, dan disaring. Padatan yang diproleh dicuci dengan akuades untuk menghilangkan HCl yang masih tersisa. Filtrat terakhir yang didapat diuji dengan larutan perak nitrat (AgNO3), bila sudah tidak terbentuk endapan putih maka ion Cl- dalam larutan sudah tidak ada lagi. Kemudian padatan berupa serbuk ini dikeringkan dalam oven pada suhu 70 oC selama 24 jam. Serbuk kulit udang atau kepiting ini sudah tanpa mineral. (Weska dan Moura, 2006).
memberikan warna violet (Marganov, 2003).
Proses deasetilasi kitin menjadi kitosan, yaitu kitin ditambah NaOH 60 % , lalu campuran diaduk dan dipanaskan pada suhu 120 oC selama 4 jam.
Gambar 2.2. Deasetilasi kitin menjadi kitosan. (Goosen,1997).
Campuran disaring melalui kertas saring wollfram, selanjutnya larutan dititrasi menggunakan HCl untuk mengendapkan kembali kitosan yang masih ada dalam larutan. Campuran yang ada endapan disentrifuge untuk memisahkan kitosan. Padatan yang diproleh dicuci dengan akuades, padatan yang didapat berupa serbuk kitosan berwarna putih krem, lalu dikeringkan pada 80 oC selama 24 jam sebanyak 55 % (Puspawati dan Simpen, 2010). Untuk menguji kemurniaan kandungan kitosan, dimana sebanyak 1 gram serbuk dilarutkan dalam 100 mL asam asetat 2 % dengan perbandingan 1 : 100 (b/v) antara kitosan dengan pelarut. Kitosan dikatakan mempunyai kemurnian yang tinggi bila larut dalam larutan asam asetat 2% tersebut (Mukherjee, 2001).
Secara fisik kitosan, tidak berbau, berupa padatan amorf berwarna putih kekuningan dengan rotasi sfesifik [α]D11 -3 hingga -10o (pada konsentrasi asam astat 2 %). Kitosan tidak larut dalam air, alkohol dan aseton. Polimer kitosan dengan berat molekul tinggi, didapati memiliki viskositas yang baik dalam asam. Bersifat hidrofilik, menahan air dalam strukturnya dan membentuk gel secara spontan. Pembentukan gel berlangsung pada pH < 6 dan sedikit asam, disebabkan bersifat polielektrolit kationik dari kitosan. Viskositas gel kitosan dengan
Gambar 2.4. Kitosan sebagai polielektrolit kationik. (Sugita, dkk., 2009).
meningkatnya berat molekul atau jumlah polimer. Penurunan pH akan meningkatkan viskositas, yang disebabkan konformasi kitosan yang telah mengembang, karena daya repulsive di antara gugus-gugus amino bermuatan positif. Viskositas juga meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan teregradasi secara berangsur-angsur, sebagai mana halnya kitosan melarut (Muzarelli etal., 1988).
Tabel 2.1. Karakteristik Kitosan.
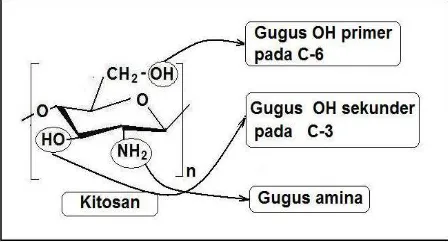
Kitosan mempunyai reaktifitas kimia yang baik karena mempunyai sejumlah gugus hidroksil (-OH) dan gugus amina (-NH2) pada rantainya, merupakan polisakarida bersifat basa. Kebanyakan polisakarida yang terdapat di alam bersifat netral dan asam seperti selulosa, dekstran, peptin, asam alginat, agar, dan agarose. (Kumar, 2000).
Gambar 2.5. Jembatan hidrogen secara (a) intermolekuler atau (b) intramolekuler.
Gugus fungsi dari kitosan (gugus hidroksil primer pada C-6, gugus hidroksil sekunder pada C-3 dan gugus amino pada posisi C-2) membuatnya mudah dimodifikasi secara kimia, dan ditransformasi menjadi turunannya. Karena adanya gugus amino, kitosan merupakan polielektrolit kationik (pKa 6,5) dan bersifat sebagai basa, hal yang sangat jarang terjadi secara alami. (Kaban, 2007).
Urutan kereaktifitasan dari gugus aktif yang ada pada molekul kitosan adalah NH2 > NH > (OH pada C-3) > (OH pada C-6). (Fessenden and Fessenden, 1999).
2.1.3.1. Reaksi Transformasi Kitosan Tanpa Menggunakan Gugus Pelindung.
Reaksi-reaksi transformasi kitosan pada N atau N dan O umumnya dilangsungkan tanpa melakukan proteksi (perlindungan) terhadap gugus OH primer maupun pada OH skunder.
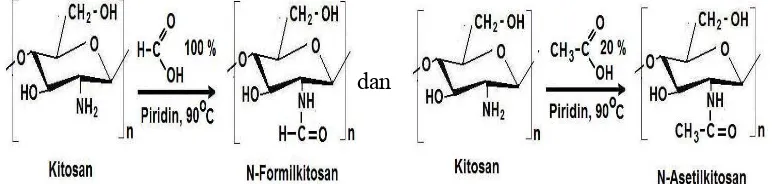
Reaksi N-asilasi kitosan dilakukan dengan mereaksikan asam karboksilat dengan kitosan. Pemanasan larutan kitosan dalam asam formiat 100 % pada suhu 90 o
C dengan penambahan sedikit demi sedikit piridin, akan menghasilkan N-formilkitosan, serta N-Asetil dalam asam asetat 20%. Pereaksi yang sangat banyak digunakan untuk N-asilasi kitosan adalah asil anhidrida, baik dalam kondisi homogen dan heterogen. (Kaban, 2007).
dan
Gambar 2.7. Reaksi asilasi pada N-kitosan dengan asam formiat dan asam asetat.
Gambar 2.8. Reaksi N-asilasi kitosan dengan asam 4-klorobutirat.
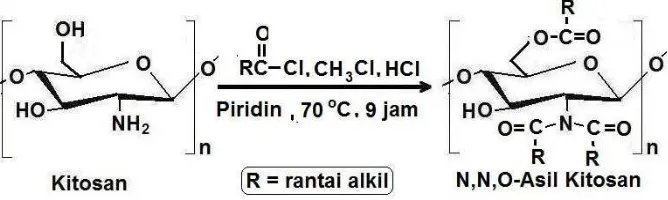
Reaksi N,O-asilasi kitosan, pemanasan selama delapan jam pasa suhu 60 oC campuran kitosan dengan asil klorida dengan katalis piridin kering dalam pelarut kloroform, menyebabkan semua gugus fungsi dari kitosan mengalami alkilasi. Hasil reaksi berupa O,O-alkilasi dan N,N-alkilasi, dihidrolisis selama 20 jam menggunakan larutan NaOH 1 molar suhu 60 oC mampu memutuskan ikatan ester dan menghasikan senyawa amida dari kitosan dalam bentuk N,N-asil kitosan. Perbandingan volume piridin dan kloroform yang digunakan mempengaruhi derajat substitusi asilasi dari kitosan.(Chun, et al., 2005).
Gambar 2.9. Sintesa asil kitosan dan N,N-diasil kitosan.
Gambar 2.10. Reaksi N- dan O-Asilasi kitosan secara bersamaan.
N- dan O-asilasi menggunakan anhidrit asam suksinat dapat berlangsung mencampurkan suksinat anhidrit ke dalam campuran kitosan dalam asam asatat 2 % dan metanol 1 : 1 (v/v). Dilakukan pengadukan selama 3 jam dan kemudian dibiarkan selama 20 jam. (Noerati, dkk., 2007).
Gambar 2.11. Reaksi N,O-asilasi kitosan dengan asam suksinat anhidrit.
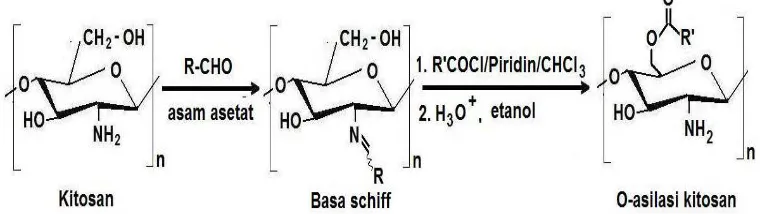
2.1.3.2. Reaksi Transformasi Kitosan Menggunakan Gugus Pelindung.
Gambar 2.12. Reaksi O-asilasi kitosan dalam basa schiff dengan asilklorida.
Reaksi O-asilasi dapat juga dilakukan melalui reaksi esterifikasi menggunakan katalis asam sulfat (2 M) ditambahkan kepada suspensi campuran kitosan dan asam alkanoat pada suhu kamar. Campuran dipanaskan pada suhu 80 oC selama 4 jam disertai pengadukan. Asam sulfat yang ditambahkan akan membentuk ion hidrogen sulfit sebagai konter ion dari NH3+, selanjutnya berfungsi untuk memproteksi (sebagai gugus pelindung) N-kitosan. Kemudian pada suhu kamar, tambahkan natrium hidrokarbonat sampai pH 7 (netral). (Badawy, et al., 2005).
Gambar 2.13. O-asilasi kitosan mereaksikan kitosan dan asam alkanoat, katalis H2SO4.
2.1.4. Kegunaan Kitosan dan turunannya.
kimia dari kitin dan kitosan, sudah banyak menghasilkan senyawa turunan kitin dan kitosan sehingga aplikasi dan
kegunaan senyawa tersebut sangat luas, seperti bagi industri farmasi, kesehatan, kosmetik, makanan, pengolah limbah dan air, fotografi, kayu dan kertas.
Kitin dan kitosan dapat digunakan di berbagai macam aplikasi industri diantaranya, seperti pada tabel 2.2.
Tabel 2.2. Kegunaan dari kitosan dan turunannya.
Bidang Aplikasi Industri Kegunaan
Industri makanan Dietari fiber, pengawet makanan (anti oksidan, anti mikroba), dan pengemulsi.
Pertanian
Elisitor gen, antibakteri, pelapis biji, dan menjaga bunga yang telah dipotong tetap segar.
Sumber : Aranaz et al.,2010.
bersifat polielektrolit kationik (pKa = 6,5) dan bersifat sebagai basa, hal yang sangat jarang terjadi secara alami. Sifat basa ini menjadikan kitosan :
a. Dapat larut dalam media asam encer membentuk larutan yang kental sehingga dapat digunakan dalam pembuatan gel. Dalam beberapa variasi konfigurasi seperti butiran, membran, pelapis kapsul, serat dan spons. b. Membentuk kompleks yang tidak larut dalam air dengan polianion
yang dapat juga digunakan untuk pembuatan butiran gel, kapsul dan membran.
c. Dapat digunakan sebagai pengkhelat ion logam berat dimana gelnya menyediakan sistem produksi terhadap efek destruksi dari ion (Meryati, 2005).
Sifat kitosan sebagai polimer alami mempunyai sifat menghambat absorbsi lemak, penurun kolesterol, pelangsing tubuh, atau pencegahan penyakit lainnya. Kitosan mampu menurunkan tingkat kolesterol dalam serum dengan efektif dan tanpa menimbulkan efek samping.(Rismana, 2001). Kitosan dan beberapa tipe modifikasinya dilaporkan penggunaannya untuk aplikasi biomedi, seperti pelembab kulit, penyembuh luka, anti koagulan, jahitan pada luka (suuture), obat-obatan, bahan vaksin, dan dietary fiber. Baru-baru ini, penggunaan kitosan dan derivatnya telah banyak dikembangkan sebagai proses mineralisasi, atau pembentukan tulang stimulin endoktrin. (Irawan, 2007). Penelitian yang dilakukan Handayani (2004) menunjukan bahwa kitin dan kitosan dapat dipergunakan sebagai bahan koagulasi pada sari buah tomat. Pelapisan menggunakan kitosan (chitosan coating) telah terbukti meminimalisasi oksidasi, ditunjukan oleh angka peroksida, perubahan warna, dan jumlah mikroba pada sampel. (Yingyuad et al., 2006).
produk kosmetik, bahan pembawa obat, dan pelapisan membran. Palmitil kitosan kira-kira 10 % telah digunakan untuk kapsul sebagai pelepas obat secara terkontrol (Aranaz et al.,2010).
2.2. Asam Palmitat.
Asam palmitat adalah salah satu asam lemak jenuh yang paling umum ditemukan pada hewan dan tanaman. Sebagai komponen utama minyak dari pohon kelapa (kelapa sawit dan minyak inti sawit). Merupakan asam lemak pertama yang dihasilkan selama lipogenesis (sintesis asam lemak), berupa asam karboksilat dengan ekor panjang tidak bercabang alifatik (rantai) jenuh. Asam lemak jenuh tidak mengandung ikatan ganda atau kelompok fungsional lainnya sepanjang rantai. Istilah "jenuh" mengacu pada hidrogen, dalam bahwa semua karbon (terlepas dari kelompok [-COOH] asam karboksilat) berisi sebagai hidrogen sebanyak mungkin. Asam lemak jenuh membentuk rantai lurus dan, sebagai hasilnya, dapat dikemas bersama sangat erat, yang memungkinkan organisme hidup untuk menyimpan energi kimia yang sangat padat. Jaringan lemak hewan mengandung banyak rantai panjang asam lemak jenuh. Palmitat feed negatif kembali ke asetil-KoA karboksilase (ACC) yang bertanggung jawab untuk mengkonversi asetil-KoA menjadi malonyl-CoA yang digunakan untuk menambah rantai asil berkembang, sehingga mencegah lebih lanjut palmitat generasi. Dalam proses biologi beberapa protein yang diubah dengan penambahan kelompok palmitoil dikenal sebagai palmitoylation proses. Proses palmitoylasi penting bagi lokalisasi membran untuk banyak protein. (http://id.wikipedia.org/wiki/Asam_palmitat).
Asam lemak yang paling mudah diperoleh adalah asam palmitat atau asam heksadekanoat, tersusun dari 16 atom karbon [CH3(CH2)14COOH].
Tumbuh-tumbuhan dari famili Palmaceae, seperti kelapa (Cocos nucifera) dan kelapa sawit (Elaeis guineensis) merupakan sumber utama asam lemak ini. Minyak kelapa bahkan mengandung hampir semuanya palmitat (92%). Minyak sawit mengandung sekitar 50% palmitat. Produk hewani juga banyak mengandung asam lemak ini (dari mentega, keju, susu, dan juga daging).(http://www.Wapedia.mobi/id/Asam-Lemak). Minyak kelapa sawit banyak mengandung senyawa-senyawa kimia diantaranya yaitu asam palmitat (40 - 46%), asam stearat (3,6 - 4,7%), asam oleat (39 – 45%), asam miristat (1,1 - 2,5%) dan asam linoleat ( 7- 11% ) (Ketaren, 1986). Asam lemak (bahasa Inggris: fatty acid, fatty acyls) adalah adalah senyawa alifatik dengan gugus karboksil. Bersama-sama dengan gliserol, merupakan penyusun utama minyak nabati atau lemak dan merupakan bahan baku untuk semua lipida pada makhluk hidup. Asam ini mudah dijumpai dalam minyak masak (goreng), margarin, atau lemak hewan dan menentukan nilai gizinya. Secara alami, asam lemak bisa berbentuk bebas (karena lemak yang terhidrolisis) maupun terikat sebagai gliserida. Asam palmitat ditemukan oleh Edmond Frémy pada tahun 1840, dari minyak sawit disaponifikasi. (http://id.wikipedia.org/wiki/Asam_palmitat).
2.2.1. Pembuatam Asam Palmitat.
Daging buah kelapa (Cocos nucifera) atau kulit buah kelapa sawit (Elaeis guineensis) dipressing atau diektraksi untuk mendapatkan minyak dari kelapa tersebut. Minyak kelapa yang diproleh ditambah larutan NaOH dan metanol, kemudian direfluks sambil diaduk pada suhu 60 oC selama 5 jam. Pisahkan metanol dengan penguapan, dan setelah dingin tambahkan asam sulfat 25 % sampai pH ± 6,8. Asam lemak yang terbentuk dipisahkan dari fraksi air melalui corong pisah dan uapkan sisa pelarut. Kemudian asam lemak yang diproleh dilarutkan dalam aseton, selanjutnya dinginkan pada suhu 5 oC terbentuk residu, lalu dipisahkan
2.2.2. Sifat dan Kegunaan Asam Palmitat.
Asam palmitat (16 karbon, massa molar asam palmitat adalah 256,40 gram/mol, dan memiliki gugus fungsi karboksilat) adalah asam lemak jenuh yang terdapat dalam sebahagian besar asam lemak hewani dan minyak nabati, berwujud padat pada suhu ruang (27 °C) dan berwarna putih, memiliki kepadatan 0.850 gram/mL pada suhu 62 oC, sukar larut dalam air .
Dapat larut dalam pelarut organik sepeti klorofrom, aseton, benzena, dietil eter, etahol dan metanol. Titik lebur 63,1 oC dan titik didihnya 352 oC. Anion palmitat yang terbentuk dari asam palmitat dapat terbentuk pada pH netral. (http://www.Wapedia.mobi/id/Asam-Lemak).
Dalam industri, asam palmitat banyak dimanfaatkan dalam bidang kosmetika dan pewarnaan. Penggunaan paling terkenal dari asam palmitat adalah komponen penting dalam pembuatan sabun. Dari segi gizi, asam palmitat merupakan sumber kalori penting, namun memiliki daya antioksidasi yang rendah. Tentang mengkonsumsi asam palmitat, peneliti masih memperdebatkan atas dampaknya. Menurut Organisasi Kesehatan Dunia, konsumsi asam palmitat dapat meningkatkan kemungkinan terjadinya penyakit jantung. Ada sebuah penelitian kontradiktif yang mengatakan, konsumsi asam palmitat tidak memiliki efek terjadinya penyakit jantung. Turunan asam palmitat juga digunakan dalam obat anti-psikotik, terutama dalam pengobatan skizofrenia. Selama Perang Dunia Kedua, asam palmitat yang digunakan setelah dikombinasikan dengan nafta, merupakan bagian yang paling volatile untuk hidrokarbon cair, dalam membentuk napalm, merupakan pembentuk gel yang dipergunakan dalam operasi pertahanan.
(http://www.Wapedia.mobi/id/Asam-Lemak). 2.3. Reaksi Klorinasi.
triklorida (PCl3), atau fosfor pentaklorida (PCl5) ataupun dengan tionil klorida (SOCl2). Reaksinya adalah :
3 CH3COOH + PCl3 3 CH3CO-Cl + H3PO3 CH3COOH + PCl5 CH3CO-Cl + HCl + POCl3 CH3COOH + SOCl2 CH3CO-Cl + HCl + SO2
Pemilihan pereaksi klorinasi harus sedemikian rupa dalam terbentuknya hasil reaksi dan hasil yang tidak diinginkan agar nantinya dapat dipisahkan dengan cara yang tidak terlalu rumit. Hal ini berkenaan dengan sifat kimia maupun sifat fisik dari asam klorida, asam phosfat dan phosforoksitriklorida. (Fessenden and Fessenden,
1999).
2.4. Reaktifitas Gugus Fungsi Senyawa Karbon.
2.4.1. Gugus Karboksilat.
sintesis senyawa organik lain, seperti untuk pembuatan senyawa keton, ester atau amida.
Diantara semua derivat asam karboksilat, halida asamnya merupakan yang paling reaktif, lebih mudah ditukargantikan. Reaksi berlangsung dalam dua tahap: 1) adisi nukleofil kepada gugus karbonil, disusul 2) eleminasi ion klor. Hasil reaksi ini ialah suatu substitusi asil nukleofilik, yang berarti “substitusi nukleofilik pada suatu karbon asil ( RCO- ). Laju reaksi suatu klorida asam dari yang memiliki gugus alkil pendek sampai kepada gugus alkil panjang akan semakin berkurang (lambat). Efek ukuran gugus alkil pada laju reaksi adalah efek pada kelarutan dalam air, bukan dikarenakan efek halangan sterik. Suatu klorida asam dengan gugus alkil kecil adalah lebih mudah larut dan bereaksi dengan lebih cepat. . (Fessenden and
Fessenden, 1999). 2.4.2. Gugus Amina.
asam kerboksilat induknya, dengan mengubah imbuhan asam ....,-oat (atau –at) menjadi amida. Amida dengan substituen alkil pada nitrogen diberi tambahan N-alkil di depan namanya, dengan N merajuk pada atom nitrogen. (Fessenden and
Fessenden, 1999).
2.4.3. Gugus Hidroksi.
Gugus hidroksi (-OH) yang terikat pada alkil (golongan alkohol) bersifat serupa dengan yang terikat pada rantai cincin glukosa. Gugus ini dapat diesterifikasikan oleh asam karboksilat atau oleh asam anorganik. Dalam senyawa kitosan terdapat dua gugus hidroksi dan satu gugus amina. Kekuatan basa gugus amina (-NH2) dibanding gugus hidroksi (-OH) dalam molekul kitosan, gugus amina memiliki sifat basa yang jauh lebih kuat. Reaktifitas gugus amina kitosan lebih kuat dibandingkan dengan gugus OH-nya. Gugus hidroksi pada alkohol bersifat sebagai asam lemah, dalam air mampu melepaskan proton dan dapat bereaksi dengan logam natrium membebaskan gas hidrogen. (Fessenden and Fessenden, 1999)
2.5. Spektrofotometri Inframerah (FT-IR).
Spektrofotometri inframerah merupakan salah satu analisa kualitatif yang digunakan untuk menentukan gugus fungsi suatu senyawa organik serta untuk mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya. Frekuensi di dalam spektroskopi inframerah seringkali dinyatakan dalam bentuk bilangan gelombang, dimana rentang bilangan gelombang yang dipergunakan adalah antara 4600 cm -1 sampai dengan 400 cm -1. Energi yang dihasilkan oleh radiasi inframerah menyebabkan vibrasi atau getaran pada molekul (Silverstein, et al., 1999).
memberikan manfaat. Spektrum yang dihasilkan senyawa tersebut dibandingkan terhadap spektrum cuplikan asli, kesesuaian puncak demi puncak merupakan bukti kuat tentang identitas cuplikan yang di analisa. Disamping itu enantiomer, dari dua senyawa tidak mungkin memberikan spektrum inframerah yang sama. Walaupun spektrum infra-merah merupakan kekhasan sebuah molekul secara menyeluruh, gugus-gugus atom tertentu memberikan penambahan pita-pita pada serapan tertentu, ataupun di dekatnya, apapun bangun molekul selengkapnya. Hal ini yang memungkinkan kimiawan memproleh informasi tentang struktur yang berguna serta mendapatkan acuan bagi peta umum frekwensi dari gugus yang khas. Karena penyidikan tidak semata menggunakan spektrum infra-merah, suatu analisis yang terperinci tidaklah dilakukan. Oleh karena itu hanya akan disajikan teori secukupmya untuk mewujudkan tujuan penggunaan spektrum infra-merah, dalam kaitan dengan data spektrometri lainnya untuk menentukan struktur molekul. (Silverstein, et al., 1999 ).
Spektrofotometri inframerah merupakan alat rutin dalam penemuan gugus fungsi, pengenalan senyawa, dan analisa campuran. Kebanyakan gugus, seperti C-H, O-H, C=O, dan C=N menyebabkan pita absorsi inframerah, yang berbeda hanya sedikit dari satu molekul ke molekul yang lain, tergantung pada substituen lain dari molekul tersebut. (Day and Underwood, 1981).
2.5.1. Perinsip Dasar.
Sumber : E-MAIL: nicinfo@thermonicolet.com • www.thermonicolet.com Gambar 2.14. Skema Spektrofotometer Inframerah Fourier.
2.5.2. Komponen Peralatan.
Spektrofotometer berkas ganda terdiri dari lima bagian utama yaitu : sumber cahaya, daerah cuplikan, fotometer, monokromator dan detektor.
1. Sumber Cahaya
Pancaran inframerah dihasilkan oleh sebuah sumber yang dipanaskan dengan listrik pada suhu 1000-1800
0
C. Sumber cahaya yang umum digunakan adalah lamputungsen, nernst glowers atau globar. Lampu nernst dibuat dari sebuah pengikat dan oksida-oksidazirkonium, torium dan serium. Sedangkan lampu globar
terbuat dari batang kecil silikon karbida. 2. Daerah Cuplikan
Berkas acuan dan berkas cuplikan masuk kedalam daerah cuplikan dan masing-masing menembus sel cuplikan dan sel acuan.
3. Monokromator
4. Detektor
Detektor akan mendeteksifrekuensi yang dilewatkan pada sampel yang tidak diserap oleh senyawa. Banyaknya frekuensi yang melewati senyawa (yang tidak
diserap) akan diukur sebagai persen transmitan. (Silverstein, et al., 1999). 2.5.3. Serapan Khas Gugus Fungsi.
Untuk menafsirkan sebuah spektrum inframerah tidak terdapat aturan pasti. Tetapi terdapat beberapa syarat yang harus dipenuhi sebelum mencoba menafsirkan spektrum.
1. Spektrum haruslah cukup terpisah dan mempunyai kuat puncak yang memadai. 2. Spektrum dibuat dari senyawa yang cukup murni.
3. Spektrofotometer harus dikalibrasi sehingga pita akan teramati pada serapan (panjang gelombang) yang semestinya.
4. Metoda penanganan sampel harus ditentukan. Bila menggunakan pelarut, maka macam dan konsentrasi pelarut serta tebal sel harus disebutkan.
Penanganan yang tepat atas getaran molekul yang rumit adalah tidak harus mutlak, dimana suatu spektrum infra-merah haruslah ditafsirkan dengan cara perbandingan empirik terhadap spektrum lain, dan dengan mengekstrapolasi kajian molekul yang lebih sederhana. (Silverstein, et al., 1999).
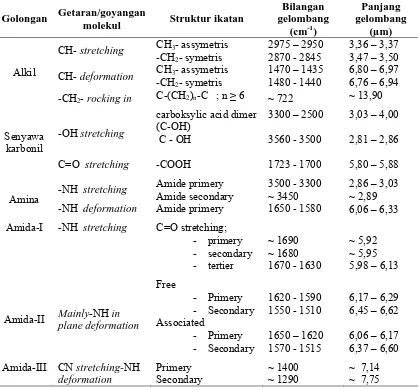
Tabel 2.3. Serapan inframerah beberapa gugus fungsi senyawa organik.
CH- stretching CH3- assymetris
-CH2- symetris
2975 – 2950 2870 - 2845
3,36 – 3,37 3,47 – 3,50 CH- deformation CH3- assymetris
-CH2- symetris Amida-I -NH stretching C=O stretching;
- primery
Sumber : Silverstein, et al., 1999 dan Dyke, et al., 1978.
struktur. Dua kawasan penting dalam pemeriksaan awal sebuah spektrum ialah daerah 4000 –1300 cm-1 (2,5 – 7,7 µm) dan
daerah 909 – 650 cm-1 (11,0 – 15,4 µm). Bagian serapan tinggi dari sebuah spektrum disebut sebagai daerah gugus fungsi. Gugus-gugus fungsi yang penting, seperti OH, NH dan C=O terletak pada bagian ini.
Bagian tengah spektrum, merupakan daerah sidik jari adalah daerah antara panjang gelombang 1300 cm
-1
– 909 cm -1
(7,7 – 11,0 µm). Corak serapan didaerah ini seringkali rumit dengan pita-pita yang ditimbulkan oleh cara-cara getaran yang berantaraksi. Bagian spektrum ini sangat berharga dalam hubungannya dengan bagian spektrum lainnya. ( Silverstein, et al., 1999 ).
Pada daerah sidik jari suatu senyawa akan memberikan pola serapan yang khas yang tidak dimiliki oleh senyawa lainnya, sehingga dengan melihat pola serapan di daerah tersebut dapat disimpulkan struktur kimianya, pada daerah itu pula suatu isomer dapat dibedakan dengan yang lainnya. (Underwood, et al., 2002).
Dalam keadaan cair atau padat, dan juga dalam larutan yang kepekatannya lebih daripada 0,01 M, dengan pelarut CCl4, asam-asam karboksilat berada sebagai dimer akibat kuatnya ikatan hidrogen.
Ikatan hidrogen yang luar biasa kuatnya itu diterangkan berdasarkan besarnya sumbangan ion dalam talunan. Akibat kuatnya ikatan hidrogen itu, maka getaran ulur hidroksil bebas dapat diamati (di dekat 3520 cm-1). Walaupun begitu, dalam bentuk apapun selalu terdapat
campuran monomer dan dimer. Dimer asam karboksilat memperagakan serapan ulur O-H yang sangat lebar dan kuat di daerah 3300 – 2500 cm-1. Pita tersebut biasanya berpuncak di 3000 cm-1, Pita ulur C-H yang lebih lemah biasanya tampak
menumpang diatas pita dekat milik O-H. Pita lebar milik O-H itu, di sisi yang berpanjang gelombang tinggi, memiliki struktur-halus/renik yang menyatakan adanya nadalipat dan sambung pita-pita dasar yang terletak pada panjang gelombang yeng lebih besar. Spektrum khas asam karboksilat seperti pada gambar 2.16. point. c.
Semua amida memperlihatkan sebuah pita serapan karbonil yang disebut pita Amida-I. Kedudukan pita tersebut tergantung pada derajat ikatan hidrogen dan dengan demikian tergantung pula pada keadaan fisik senyawanya. Amida-amida primer memiliki dua buah pita uluran N-H simetrik dan taksimetrik. Amida skunder hanya menunjukan sebuah pita uluran N-H. Seperti halnya uluran O-H, serapan ulur N-H juga mengalami penurunan oleh adanya ikatan hidrogen walaupun dengan derajat yang lebih kecil. Kedudukan serapan ulur N-H dan O-H bertumpangan dalam pengamatan untuk membedakan kedua struktur tersebut perlu kecermatan. Amida primer dan skunder memperlihatkan sebuah atau banyak pita di daerah sekitar 1650 – 1515 cm-1 yang terutama dihasilkan oleh tekukan NH2 atau NH disebut pita Amida-II. Penyerapan itu melibatkan pengkopelan antara tekukan N-H dan getaran-getaran dasar yang lain serta menuntut suatu geometri trans. Kibasan NH keluar bidang adalah penyebab adanya suatu pita lebar dengan kekuatan menengah di daerah 800 – 666 cm-1. Spektrum dalam gambar 2.17., adalah khas amida primer suatu alifatik.
Dalam larutan yang lebih pekat dan sampel padat, pita NH bebas digantikan oleh pita-pita jamak/terdarab di daerah 3330 – 3060 cm-1. Pita-pita jamak/terdarab itu
teramati karena gugus amida dapat mengikat membentuk dimer berkonformasi cis, atau membentuk polimer berkonformasi tran,
Spektrum dalam gambar 2.18., adalah khas amida skunder suatu alifatik. (Silverstein, et al. 1999, Fessenden and Fessenden, 1999).
Gambar 2.17. Spektrum inframerah amida skunder.
Absorpsi inframerah karbonil dari klorida asam dijumpai pada frekwensi yang sedikit lebih tinggi dari pada resapan untuk derivat asam lain. Tidak ada sifat khusus lain dalam spektrum inframerah yang menandakan bahwa inilah klorida asam (asil klorida).
Halida-halida asam memperlihatkan serapan di daerah uluran C=O. Klorida-klorida asam terkonjugasi menampilkan serapan di daerah 1815 – 1785 cm-1. Gambar 2.19. memperlihatkan spektrum inframerah dari klorida asam yang khas. (Silverstein, et al., 1999 , Fessenden and Fessenden, 1999 ).
BAB 3
BAHAN DAN METODE
3.1. Bahan dan Alat.
Bahan-bahan yang digunakan dalam penelitian ini adalah :
Kitosan p.a (Fluka).
Alat yang digunakan dalam penelitian ini adalah :
Corong Penetes Pyrex
3.2.1. Karakterisasi Asam Palmitat dan Kitosan Menggunakan Spektrophotometer Inframerah.
Karakterisasi gugus fungsi kitosan dan asam palmitat yang akan dipergunakan pada penelitian ini menggunakan Spektroforometer Inframerah.
Masing-masing 0,1 gram serbuk kitosan dan 0,1 gram kristal halus asam palmitat diambil dan dalam keadaan bebas air untuk pengujian analisa Spektrofotometer Inframerah.
3.2.2. Klorinasi Asam Palmitat Menggunakan Phosfor Pentaklorida.
3.2.2.1. Pembuatan Phosforpentaklorida dari Diphosforpentaoksida direaksikan dengan asam klorida.
kekuningan sedikit kental berupa produk hasil reaksi (phosforpentaklorida). 3.2.2.2. Pembuatan Palmitil Klorida Mereaksikan Asam Palmitat dengan Phosforpentaklorida.
Asam palmitat seberat 3,74 gram ( 0,015 mol) ditempatkan dalam labu leher dua, kemudian melalui corong penetes tambahkan 30 mL kloroform lalu aduk dengan pengaduk stirrer sampai larut. Selanjutya melalui corong penetes tambahkan 2,00 mL phosforpentaklorida (4,2 gram = 0,020 mol), kemudian refluks campuran pada suhu 60 – 70 0C selama 180 menit, dinginkan campuran. Pisahkan dengan corong pisah, fraksi yang memisah dari kloroform berupa POCl3 dilapisan bawah dan HCl dilapisan atas. Hasil reaksi berada dalam lapisan
kloroform.
3.2.2.3. Karakterisasi Palmitil Klorida Menggunakan Spektrophotometer
Infra merah.
Pipet cairan lapisan bagian tengah (kloroform) dari pengerjaan point 3.2.2.2. sebanyak 1,00 mL, uapkan pelarut dan dinginkan residu dalam desikator. Kemudian, tempatkan residu dengan segera dalam bejana kedap udara dan bebas
air. Untuk dianalisa menggunakan Spektrophotometer Inframerah.
3.2.3. Pembuatan N,N-Palmitil Kitosan Mereaksikan Palmitil Klorida dengan Kitosan.
3.2.3.1. Pembuatan N,N-Palmitil Kitosan Melalui Reaksi Asilasi Kitosan Menggunakan Palmitil Klorida.
Tambahkan Kitosan seberat 0,250 gram (0,0016 mol/monomer) kedalam labu berisi fraksi kloroform dari pengerjaan point 3.2.2.2., kemudian aduk dengan
3.2.3.2. Karakterisasi Hasil Reaksi Asilasi Kitosan Menggunakan Palmitil Klorida dengan Spektrofotometer Inframerah.
Ambil 5 mL lapisan kloroform hasil pengerjaan point 3.2.3.1., kemudian tambahkan 5 mL metanol hingga terbentuk endapan. Saring endapan dan cuci endapan dengan menggunakan metanol. Keringkan endapan dalam oven pada suhu 110 oC sampai bebas air, kemudian analisa menggunakan Spektrofotometer
Inframerah.
3.2.3.3. Hidrolisis N,N-Palmitil Kitosan untuk Menghasilkan N-Palmitil Kitosan.
Fraksi kloroform dari pengerjaan point 3.2.3.1., tambahkan 10 mL metanol dan kemudian tambahkan 10 mL larutan NaOH 1 molar, aduk sampai gumpalan endapan merata dan diamkan. Endapan yang terbentuk disaring dengan kertas saring, cuci endapan dengan metanol dan akuades. Tempatkan endapan dalam labu distilasi dan kemudian tambahkan 40 mL larutan NaOH 1 molar, refluks campuran pada suhu 60 – 65 oC selama 20 jam. Setelah dingin, saring endapan dan cuci dengan akuades. Kemudian cuci dengan metanol, dan keringkan dalam oven pada
suhu 110 oC sampai bebas air.
3.2.3.4. Karakterisasi Hasil Reaksi Hidrolisis N,N-Palmitil Kitosan Menggunakan Spektrofotometer Inframerah.
3.3. Bagan Penelitian.
3.3.1. Bagan Pembuatan Phosforpentaklorida dari Reaksi Diphosfor pentaoksida dengan Asam Klorida.
Asam Klorida Pekat 417 mL
Encerkan sampai volume 500 mL
Tambahkan 75 gram serbuk P2O5
Aduk dan panaskan suhu 110 oC dalam Lemari asam
Uapkan air sampai habis dan timbang
Panaskan dan timbang.
Berat konstan.
3.3.2. Bagan Pembuatan Palmitil Klorida dari Klorinasi Asam Palmitat Menggunakan Phosforpentaklorida.
Tambahkan 30 mL kloroform, aduk.
Tambahkan 2,00 mL PCl5 (berlebih).
Refluks suhu 60 – 70 oC selama 3 jam.
Didiamkan sampai suhu ruang
Pisahkan dengan corong pisah.
Asam Palmitat 3,74 gram
Lapisan Bawah PCI5dan POCI3 Lapisan Tengah
Kloroform dan Palmitil Klorida Lapisan Atas
HCL
O
C
15H
31-C
Cl
Ambil 0,5 mL, uapkan pelarut.
3.3.3. Bagan Pembuatan Palmitil Kitosan Melalui Reaksi Asilasi Kitosan dengan Palmitil Klorida.
Lapisan Tengah Kloroform dan Palmitil Klorida
O
C
15H
31-C
Cl
Tambahkan Kitosan 0,250 gram
Aduk selama 30 menit
pada suhu 0 oC.
Diamkan, sampai suhu ruang
dan terbentuk endapan.
Pisahkan dengan corong pisah.
Ambil 5 mL, tambahkan metanol.
Saring endapan, dan cuci dengan metanol. Keringkan di oven suhu 110 oC
Fraksi Kloroform dan endapan (N,N-Palmitil Kitosan)
Lapisan Atas HCL
3.3.4. Bagan Reaksi Hidrolisis N,N-Palmitil Kitosan untuk Menghasilkan N-Palmitil Kitosan.
Tambahkan 10 mL metanol dan 10 mL larutan NaOH 1 M, aduk.
Saring endapan, cuci dengan
akuades dan metanol.
Tempatkan endapan dalam labu
distilasi.
Tambahkan 40 mL larutan
NaOH 1 M.
Refluks pada suhu 60 – 65 oC
selama 20 jam.
Saring endapan.
Cuci denga akuades dan metanol. Keringkan di oven suhu 110 oC sampai bebas air.
N-Palmitil Kitosan
Residu Filtrat
Gugus Fungsi
Analisa FT-IR Fraksi Kloroform
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian dan Pembahasan.
4.1.1. Spektrum Inframerah Asam Palmitat
Asam palmitat yang digunakan untuk reaksi pembentukan Palmitil Klorida terlebih dahulu di analisa menggunakan spektrofotometer Inframerah. Gambar 4.1. Spektra hasil analisa FT-IR dari asam palmitat.
Gambar 4.1. Spektra FT-IR, (atas) Asam Palmitat : pembanding, (bawah) Asam Palmitat : pereaksi (sampel di analisa).
Data hasil analisa Spektrofotometer Inframerah menunjukan enam puncak kuat pada daerah bilangan gelombang 2848, 2915 cm-1, 1472 cm-1 dan 720 cm-1, 1703 cm-1 dan puncak dari 2848, 2915 cm-1 melebar ke 3300 cm-1.
Serapan-serapan kuat pada daerah bilangan gelombang tersebut, menunjukan C-H dari –CH2- dan –CH3 gugus alkil (2848 cm-1 dan 2915 cm-1), -CH2- (1472 cm-1) dan rantai panjang alkil C-(CH2)n-C (720 cm-1), C=O karbonil (1703 cm-1), dan O-H dari karbonil (3300 cm-1) melebar ke 2848 dan 2915 cm-1 (Stark and Wallace, 1982., Silverstein, et al., 1999). Grafik FT-IR hasil analisa menunjukan, asam palmitat yang dipergunakan sebagai pereaksi memiliki grafik
sangat hampir sama dengan grafik FT-IR asam palmitat pembanding (referensi). 4.1.2. Spektrum Inframerah Kitosan.
Kitosan yang akan digunakan sebagai pereaksi untuk pembuatan Palmitil Kitosan terlebih dahulu di analisa menggunakan Spektrofotometer Inframerah. Gambar 4.2. Spektra hasil analisa FT-IR dari kitosan.
Kitosan :
Data hasil analisa spektrofotometer Inframerah menunjukan empat puncak kuat pada 2917 cm-1, 1080 cm-1, 3368 cm-1, dan 1382 cm-1.
Serapan-serapan kuat pada daerah bilangan gelombang tersebut, menunjukan C-H dari –CH3 alkil (2917 cm-1), C-O (1080 cm-1), NH2 berimpitan dengan O-H (3368 cm-1 melebar), dan C-N (1383 cm-1). (Stark and Wallace, 1982., Silverstein, et al., 1999).
4.1.3. Pembuatan Palmitil Klorida dari Klorinasi Asam Palmitat Menggunakan Phosforpentaklorida.
Reaksi Asam Palmitat dengan phosforpentaklorida :
Mekanisma Reaksi :
Gambar 4.4. Mekanisma Reaksi Pembentukan Palmitil Klorida.
Hasil reaksi klorinasi dari asam palmitat menggunakan phosforpentaklorida terbentuk senyawa Palmitil Klorida, di analisa menggunakan Spektrofotometer Inframerah. Gambar 4.5. Spektra FT-IR dari Palmitil Klorida.
daerah bilangan gelombang 2848, 2915 cm-1, 1472 cm-1 dan 720 cm-1, munculnya puncak 1699 cm-1.
Serapan-serapan kuat pada daerah bilangan gelombang tersebut, menunjukan C-H dari –CH2- dan –CH3 alkil (2848 cm-1 dan 2915 cm-1), -CH2- (1472 cm-1) dan rantai panjang C-(CH2)n-C alkil terikat di kitosan (720 cm-1), C=O karbonil bergeser (1699 cm-1). (Stark and Wallace, 1982., Silverstein, et al., 1999).
Grafik FT-IR hasil analisa dari palmitil klorida hasil reaksi klorinasi memiliki bentuk sangat hampir sama dengan grafik FT-IR palmitil klorida pembanding (referensi).
Dari kedua spektrum FT-IR gambar 4.6., terdapat perbedaan yang nyata, antara serapan pada asam palmitat, di bilangan gelombang 2849, 2917 cm-1 kemudian melebar ke 3300 cm-1, tidak dijumpai pada palmitil klorida adanya bilangan gelombang melebar ke 3300 cm-1. Ini menjelaskan bahwa gugus O-H telah berubah dan digantikan oleh gugus Cl. Adanya Cl terikat pada C=O, ditunjukan dengan munculnya bilangan gelombang 1699 cm-1 dengan sedikit tekukan yang merupakan pergeseran dari bilangan gelombang 1703 cm-1 .
4.1.4. Pembuatan Palmitil Kitosan Mereaksikan Palmitil Klorida dengan Kitosan
Reaksi asilasi kitosan menggunakan palmitil klorida.
Gambar 4.7. Reaksi Asilasi Kitosan menggunakan Palmitil Klorida.
Gambar 4.8. Mekanisma reaksi pembentukan N,N-Palmitil Kitosan dari Reaksi asilasi menggunakan Palmitil Klorida.
Gambar 4.9. Spektrum FT-IR dari N,N-Palmitil Kitosan.
Data hasil analisa Spektrofotometer Inframerah menunjukan enam puncak kuat pada daerah bilangan gelombang 2845, 2918 cm-1, 1705 cm-1 , 1536 cm-1 dan 720 cm-1, serta 3425 cm-1.
A
B
Gambar 4.10. Spektra FT-IR, A. Kitosan dan B. N,N-Palmitil Kitosan.
Perbedaan dan perubahan puncak (bilangan gelombang) ditunjukan pada gambar 4.10.,
1. Spektrum (A) bilangan gelombang 3368 cm-1 (OH berimpit dengan NH2), di spektrum (B) bilangan gelombang 3425 cm-1 (OH).
2. Spektrum (A) 1382 dan 1421 cm-1 berhampiran (NH2), 1595 cm-1 (C-N), di spektrum (B) muncul 1536 cm-1 {amida, N(COR)2} dan 1701 cm-1 (C=O amida).
4.1.5. Reaksi Hidrolisis N,N-Palmitil Kitosan untuk Menghasilkan N-Palmitil Kitosan.
Reaksi pembentukan N-Palmitil Kitosan dengan menghidrolisis N,N-palmitil kitosan menggunakan larutan natrium hidroksida.
Gambar 4.11. Reaksi Pembentukan N-Palmitil Kitosan dengan menghidrolisis N,N-palmitil kitosan.
Mekanisme reaksi pembentukan N-Palmitil Kitosan dengan menghidrolisis N,N-Palmitil Kitosan menggunakan larutan Natrium Hidroksida 1 M.
Hasil reaksi hidrolisis dari N,N-palmitil kitosan menggunakan larutan natrium hidroksida 1 M, di analisa menggunakan Spektrofotometer Inframerah. Gambar 4.13., Spektrum FT-IR dari hasil reaksi hidrolisis senyawa N,N-palmitil kitosan.
Gambar 4.13. Spektrum FT-IR N-Palmitil Kitosan dari hasil hidrolisis N,N-Palmitil Kitosan.
A
B
C
D
E
Dari data FT-IR gambar 4.14., tahapan reaksi, mulai dari asam palmitat diklorinasi membentuk palmitil klorida, selanjutnya palmitil klorida bereaksi dengan kitosan membentuk N,N-palmitil kitosan, dan hidrolisis N,N-palmitil klorida menghasilkan senyawa N-palmitil kitosan, tahapan reaksi pada gambar 4.15.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian dan pembahasan dapat disimpulkan sebagai berikut :
Reaksi asilasi, kitosan menggunakan pereaksi palmitil klorida dalam pelarut kloroform dan tanpa melindungi gugus OH pada suhu 0 oC selama 30 menit dapat berlangsung membentuk senyawa N,N-palmitil kitosan.
N-palmitil kitosan dapat dibuat melalui reaksi hidrolisis N,N-palmitil kitosan menggunakan larutan NaOH 1 M pada suhu 60 – 65 oC selama 20 jam.
5.2. Saran
Dari penelitian yang telah dilakukan terdapat beberapa hal menarik untuk diteliti lebih lanjut, antara lain :
1. Pengujian persentase hasil N,N-palmitil kitosan dan N-palmitil kitosan terbentuk.
2. Pengujian NMR dan Mass Spektroskopi untuk mendapatkan hasil secara kualitatif.
DAFTAR PUSTAKA
Anonim, 1976, “ The Merch Index ”, Ninth Edition, Merck and Co. Inc, New Jersey, USA.
Aritonang, H.F., and M. Surbakti, 2004, “Separation of Lauric Acid From Coconut Oil Using Crystallization Method With Acetone Solvent”, Eugenia 10(2) : 195-204
Aranaz, R. Harris , and A. Heras, 2010,”Chitosan Amphiphilic Derivats,”
Chemistry and Applications, Current Organic Chemistry, Vol. 14, No.3, Madrid, Spain.
Badawy,M.E.I., E.I. Rabea, W. Steurbaut, T.T. Rogge, C.V. Stevens, and G.
Smagghe, 2005,”Insectidal and Growth Inhibitory Effects of Nem O-Acil Chitosan Derivats on The Cotton Leafworm Spodoptera Littoralis”, Comm. Appl, Biol. Sci, Chent University,
Belgium.
Breslow, R., 1969, “ Organic Reaction Mechanisms “, An Introduction, Second Editoin, Columbia Uviversity.
Chun LI.M., L. Chao, X.M. Hua, Z. Huang, W. Min, F. Zhen and S. X. Li, 2005, “ Preparation and Characterization of Acylated Chitosan”, Journal CHEM RES CHENESE U 2005, 21(10, 114-116), Collage of Material Science and Enginnerring, Huaqiao
University, Quanzhou 362011, China.
Day, R.A., and A. L. Undewood, 1981, “Analisa Kimia Kuantitatif”, edisi ke- enam, Penerbit Erlangga, Jakarta.
Dyke, S.F., A.J. Floyd, M. Sainsbury and R.S. Theobald, 1978, “Organic Spectroscopy”, An Introduction, Longman, London.
Fessenden, R.J. and J.S. Fessenden, 1999. “ Kimia Organik “, Edisi Ketiga, Jilid 2, Penerbit Erlangga Jakarta.
Ginting, M.V., 2005, “ Sintesis N-Palmitoyl Glukosida Melalui Amidasi Palmitoyl Klorida dengan Glukosamin “. Skripsi, Jurusan Kimia, FMIPA, USU.
Goosen, M.F.A., 1997,”Applications of Chitin and Chitosan”,Technomic Publishing Company, Inc, USA.
Chitosan Macromol” ,Biosci, 2003.
http;//repository.usu.ac.id/bitstream/123456789/19863/4/Chapter%2OII.pdf, “ Perkem bangan Komiditi Kepala Sawit Indonesia ”, download 08 Nop. 2010.
http;//.www.wapedia, mobi/id/Asam_Palmitat, download 05 Des. 2010 Handayani, T., 2004,”Pengaruh Habitat Hidup Udang dan Urutan Proses
Ekstraksi terhadap Kualitas Kitin dan Kitosan Kulit Udang serta Pemanfaatannya sebagai Bahan Koagulasi pada Sari Buah Tomat”, Undergraduate Thesis dari JP TUMM/2004-06-
28.http://library.gunadarma.ac.id. Diakses 23 Maret 2010.
Irawan, B. ,2007,”Berbagai Ragam Pemanfaatan Polimer”, http://digital-library.usu. ac.id. Diakses 23 Maret 2010.
Kaban, J., 2007, “Studi Karakteristik dan Aplikasi Film Pelapis Kelat Logam Alkali Tanah Alginat-Kitosan”, Disertasi Program Doktor Ilmu Kimia, Sekolah Pascasarjana, USU.
Kaban, J., 2009, “ Modifikasi Kimia Dari Kitosan dan Aplikasi Produk yang Dihasilkan “ ,Pidato Pengukuhan Guru Besar, Kimia Organik Sintesis, FMIPA, USU.
Ketaren, S., 1986, “Minyak dan Lemak Pangan” ,Cetakan Pertama, UI-Press, Jakarta.
Kim, C.H., and K.S. Choi,1998,”Synthesis and Properties of Carboxyalkyl Chitosan Derivatives”, Journal of ind. & Eng. Chemistry, Vol 4, No.1, Marc 1998, 19-25.
Marganof, 2003, “Potensi Limbah Udang Sebagai Penyerap Logam Berat (Timbal, Cadmium dan Tembaga) di Perairan” ,Available from :
tomouto.net/70207134/marganof.pdf.
Muzzarelli, R., V. Baldassare, F. Conti, P. Ferrara, and G. Biagini, 1988, “ Biological activity of Chitosan: Ultrastructural Study
“,Biomaterial, 9:247-252.
Mukherjee, D.P., 2001, “Method forProducing Chitin or Chitosan”,Sept 3., http://www.freepatentsonline.com/6310188.htm., 7 Januari 2009. Noerati, L. Chintia, Radiman, S. Ahmad, dan B. Ariwahjoedi, 2007, “Sintesis
Puspawati, N.M., dan I.N. Simpen, 2010, “ Optimasi Deasetilasi Khitin Dari Kulit Udang dan Cangkang Kepiting Limbah Restoran Seafood Menjadi Khitosan Melalui Variasi Konsentrasi NaOH “, Jurusan Kimia, FMIPA, Univ. Udayana, Jurnal Kimia 2010 PP. 79090, ISSN 1907-9850.
Pavia, D.L., 1976, “ Introduction to Organic Laboratory Techniques “, W.B. Saunders Company, Philadelphia.
Rismana, E., 2001, “Langsing dan Sehat Lewat Limbah Perikanan”,
www.sinarharapan.co.id.iptek/index.html. diakses 23 Maret 2010. Roberts, G. A. F., 1997 ,” Determination of the degree of N-acetylation of chitin
and chitosan”, In R. A. A. Muzzarelli, &M. G. Peter (Eds.), Chitin Handbook (pp. 127–132). Grottammare, Italy: European
Chitin Society.
Stark, J.G., and H.G. Wallace, 1982,”Chemistry Data Book”, 2 Edition in SI, John Murray, 50 Albemarle Street, London.
Sariisik N.O.M., 2002.,”Using and Properties Biofibers Based on Chitin and Chitosan on Medical Applications University”, Textile,
Engineering Departement, Turkey.
Simunek, J.G., B. Tishchenko, and Hodrova, 2006, “Effect of Chitosan of Human Colonic Bacteria”. Jounal Folia Microbiology. Vol. 51 (4), 306- 308 (2006).
Silverstein, Bassler, and Morrirr, 1999, “Penyidikan Spektrometrik Senyawa Organik“, Alih Bahasa Hartono, AJ., dan Purba Anny Victor, edisi ke empat, Pen. Erlangga.
Srijanto, B., dan I. Paryanto, Feb. 11, 2005, “Pengaruh Suhu pada Pembuatan Khitosan Secara Kimiawi”,http://www.faperta.ugm.ac.id/semnaskan/ abstrak/prosiding2005/abstrak/bidang.thp.php.,27 November 2007
Sugita, P., W. Tuti, S. Ahmad, dan W. Dwi, 2009,”Kitosan: Sumber Biomaterial Masa Depan”, IPB Press, Bogor.
Tharanathan and Kittur, 2003, “Chitin The Undisputed Biomolecule of Great Potential” ,Critical Reviews in Food Scienceand Nutrition, 43, 1; ProQuestMedical Library.
Widiyati, E., 2006, “ Sintesis Asetil Klorida dari Asam Asetat dan Tionil Klorida pada Suhu yang Divariasi dan Mempelajari Mekanisma Reaksinya “.Jurnal Gardien vol.4, 2008, PP. 314-317, Jurusan Kimia, FMIPA, Univ. Bengkulu.
Weska, R. F., and J.M. Moura, 206, “Optimazation of Deasetylation in The Production of Chitosan from Shrimp Waste”, Juornal Food
Enginnering, 80 : 749 – 753.
Yingyuad, S., S. Ruamsin, P. Reekprkhon, S. Douglass, S. Pongamphai, and U. Siripatiawan., 2006, “Effect of Chitosan Coating and Vacum Packaging on The Quality of Refrigrated Grilled Pork”, Journal of Research Article Vol.19, issue 3, Pages 149-157 (2006). John Willey and Sons, Lth. http://www.interscience.wiley.com. Diakses
23 Maret 2010.