ii
ABSTRAK
YANDITYA DWASTU GITASARI. Aktivitas Antibakteri Fraksi Aktif Daun
Lidah Mertua (Sanseviera trifasciata Prain). Dibimbing oleh IRMA HERAWATI
SUPARTO dan DONDIN SAJUTHI.
Lidah
mertua
(Sanseviera trifasciata
Prain) merupakan tanaman yang
berasal dari Afrika dan diindikasikan memiliki aktivitas antibakteri. Tujuan
penelitian ini adalah mengevaluasi potensi tanaman lidah mertua dalam
menghambat aktivitas bakteri
Staphylococcus aureus dan
Escherichia coli
menggunakan metode difusi agar cakram. Sampel daun diekstraksi dengan
menggunakan metode maserasi. Hasil pengujian aktivitas antibakteri ekstrak kasar
pada konsentrasi 1250, 2500, 5000, dan 10000 ppm tidak menunjukkan aktivitas
antibakteri terhadap bakteri uji. Ekstrak kasar yang didapat mengandung
flavonoid, steroid dan alkaloid. Ekstrak kasar selanjutnya difraksinasi dengan
menggunakan metode kromatografi kolom dengan nisbah pelarut kloroform:etil
asetat (1:6). Fraksinasi menghasilkan 10 fraksi. Kesepuluh fraksi diuji aktivitas
antibakterinya dengan konsentrasi 10000, 20000, dan 40000 ppm. Berdasarkan uji
aktivitas antibakteri yang dilakukan hanya terdapat 1 fraksi yang dapat
menghambat bakteri Gram positif (S. aureus), dan diduga metabolit lainnya tidak
menunjukkan aktivitas penghambatan pada bakteri uji.
ABSTRACT
YANDITYA DWASTU GITASARI. Antibacterial Activity of Active
Fractionated Extract of
Sansevieria trifasciata
Prain. Supervised by IRMA
HERAWATI SUPARTO and DONDIN SAJUTHI.
PENDAHULUAN
Latar Belakang
Indonesia umumnya memiliki iklim tropis dan lembab. Hal ini memudahkan perkembangbiakan mikroorganisme, baik yang patogen maupun yang non patogen. Keadaan iklim yang demikian menyebabkan timbulnya banyak penyakit yang disebabkan oleh bakteri dan mikroorganisme lainnya.
Telah banyak penelitian-penelitian mengenai antibakteri yang dilakukan, akan tetapi saat ini muncul banyak masalah sulit yang dihadapi, yaitu terjadinya resistensi bakteri terhadap antibiotik yang digunakan (Volk & Wheeler 1993). Berkembangnya resistensi terhadap obat-obatan merupakan salah satu contoh proses alamiah yang tak pernah ada akhirnya yang dilakukan oleh organisme untuk beradaptasi terhadap keadaan lingkungan yang baru. Resistensi obat oleh suatu mikroorganisme dapat disebabkan oleh faktor yang memang sudah ada pada mikroorganisme itu sebelumnya atau mungkin juga faktor itu diperoleh kemudian (Pelczar & Chan 2005). Karena hal itulah, perlu terus dilakukan usaha untuk mencari antibakteri baru, terutama suatu bahan atau tanaman yang mudah tumbuh di Indonesia.
Salah satu tumbuhan yang diindikasikan dapat dijadikan alternatif sebagai antibakteri adalah tumbuhan Sansevieria atau biasa disebut dengan tumbuhan lidah mertua. Hal ini dikarenakan dalam beberapa penelitian, tumbuhan Sansevieria diketahui memiliki potensi sebagai zat antibakteri. Dold dan Cocks (2001), melaporkan bahwaSansevieria mengandung antibiotik yang dapat digunakan untuk menyembuhkan berbagai penyakit, antara lain influenza, luka akibat terkena pukulan, dan luka gigitan ular berbisa. Menurut Van Wyk et al. (1997), ekstrak S. hyacinthoides dapat dimanfaatkan sebagai obat sakit kepala, obat tetes sakit telinga, borok, bisul, dan obat diare. Penelitian berbagai ahli herbal seperti Lucas et al. (1999), menyatakan bahwa biji Sansevieria bersifat antibakteri yang efektif menekan Mycobacterium tuberculosis penyebab penyakit TBC. Afolayan et al (2008), telah melakukan uji antibakteri pada S. hyacinthoides dengan menggunakan bakteri uji Bacillus cereus, Staphylococcus epidermidis, S. aureus, Micrococcus kristinae, Escherichia coli, dan Pseudomonas aeruginosa. dengan konsentrasi 5.0, 2.0, 1.0,
0.5, dan 0.1 mg/ml. Karena hal itulah penelitian ini bertujuan melakukan uji aktivitas antibakteri fraksi ekstrakSansevieria terhadapS. aureusdanE. coli dengan spesies yang berbeda, yaitu jenis Sansevieria trifasciataPrain.
TINJAUAN PUSTAKA
Tumbuhan Sansevieria
Sansevieria atau lidah mertua adalah marga tanaman hias yang cukup populer sebagai penghias di dalam rumah karena tanaman ini dapat tumbuh dalam kondisi yang sedikit air dan cahaya matahari. Sansevieria memiliki daun keras, tegak, dengan ujung meruncing dengan panjang antara 30-120 cm, sedangkan lebarnya sekitar 2.5-8 cm. Daun Sansevieria sering digunakan sebagai variasi pada karangan bunga. Sansevieria termasuk ke dalam kelas Liliopsida (berkeping satu/monokotil) dan famili Agaveceae. Tumbuhan ini bahkan dapat bertahan hidup di negara yang memiliki empat musim sehingga banyak mengalami penyimpangan bentuk, corak, dan warna. Tumbuhan ini banyak tumbuh di daerah bagian utara dan timur di Afrika selatan (Van Wyket al. 1997).Dalam uji fitokimia yang dilakukan oleh Yoshihiro et al. (1997), S. trifasciata mengandung karbohidrat, saponin, glikosida, dan steroid. Menurut Sastradipradja (1997) dan Departmen Kesehatan RI (1997), kandungan kimia yang terdapat dalam tumbuhan Sansevieria, antara lain saponin polifenol, kardenolin, kardamin, dan abamagenin. Warna daun Sansevieria beragam, mulai hijau tua, hijau muda, hijau abu-abu, perak, dan warna kombinasi putih kuning atau hijau kuning (Gambar 1). Motif alur atau garis-garis yang terdapat pada helai daun juga bervariasi, ada yang mengikuti arah serat daun, tidak beraturan, dan ada juga yang zig-zag.
1
PENDAHULUAN
Latar Belakang
Indonesia umumnya memiliki iklim tropis dan lembab. Hal ini memudahkan perkembangbiakan mikroorganisme, baik yang patogen maupun yang non patogen. Keadaan iklim yang demikian menyebabkan timbulnya banyak penyakit yang disebabkan oleh bakteri dan mikroorganisme lainnya.
Telah banyak penelitian-penelitian mengenai antibakteri yang dilakukan, akan tetapi saat ini muncul banyak masalah sulit yang dihadapi, yaitu terjadinya resistensi bakteri terhadap antibiotik yang digunakan (Volk & Wheeler 1993). Berkembangnya resistensi terhadap obat-obatan merupakan salah satu contoh proses alamiah yang tak pernah ada akhirnya yang dilakukan oleh organisme untuk beradaptasi terhadap keadaan lingkungan yang baru. Resistensi obat oleh suatu mikroorganisme dapat disebabkan oleh faktor yang memang sudah ada pada mikroorganisme itu sebelumnya atau mungkin juga faktor itu diperoleh kemudian (Pelczar & Chan 2005). Karena hal itulah, perlu terus dilakukan usaha untuk mencari antibakteri baru, terutama suatu bahan atau tanaman yang mudah tumbuh di Indonesia.
Salah satu tumbuhan yang diindikasikan dapat dijadikan alternatif sebagai antibakteri adalah tumbuhan Sansevieria atau biasa disebut dengan tumbuhan lidah mertua. Hal ini dikarenakan dalam beberapa penelitian, tumbuhan Sansevieria diketahui memiliki potensi sebagai zat antibakteri. Dold dan Cocks (2001), melaporkan bahwaSansevieria mengandung antibiotik yang dapat digunakan untuk menyembuhkan berbagai penyakit, antara lain influenza, luka akibat terkena pukulan, dan luka gigitan ular berbisa. Menurut Van Wyk et al. (1997), ekstrak S. hyacinthoides dapat dimanfaatkan sebagai obat sakit kepala, obat tetes sakit telinga, borok, bisul, dan obat diare. Penelitian berbagai ahli herbal seperti Lucas et al. (1999), menyatakan bahwa biji Sansevieria bersifat antibakteri yang efektif menekan Mycobacterium tuberculosis penyebab penyakit TBC. Afolayan et al (2008), telah melakukan uji antibakteri pada S. hyacinthoides dengan menggunakan bakteri uji Bacillus cereus, Staphylococcus epidermidis, S. aureus, Micrococcus kristinae, Escherichia coli, dan Pseudomonas aeruginosa. dengan konsentrasi 5.0, 2.0, 1.0,
0.5, dan 0.1 mg/ml. Karena hal itulah penelitian ini bertujuan melakukan uji aktivitas antibakteri fraksi ekstrakSansevieria terhadapS. aureusdanE. coli dengan spesies yang berbeda, yaitu jenis Sansevieria trifasciataPrain.
TINJAUAN PUSTAKA
Tumbuhan Sansevieria
Sansevieria atau lidah mertua adalah marga tanaman hias yang cukup populer sebagai penghias di dalam rumah karena tanaman ini dapat tumbuh dalam kondisi yang sedikit air dan cahaya matahari. Sansevieria memiliki daun keras, tegak, dengan ujung meruncing dengan panjang antara 30-120 cm, sedangkan lebarnya sekitar 2.5-8 cm. Daun Sansevieria sering digunakan sebagai variasi pada karangan bunga. Sansevieria termasuk ke dalam kelas Liliopsida (berkeping satu/monokotil) dan famili Agaveceae. Tumbuhan ini bahkan dapat bertahan hidup di negara yang memiliki empat musim sehingga banyak mengalami penyimpangan bentuk, corak, dan warna. Tumbuhan ini banyak tumbuh di daerah bagian utara dan timur di Afrika selatan (Van Wyket al. 1997).Dalam uji fitokimia yang dilakukan oleh Yoshihiro et al. (1997), S. trifasciata mengandung karbohidrat, saponin, glikosida, dan steroid. Menurut Sastradipradja (1997) dan Departmen Kesehatan RI (1997), kandungan kimia yang terdapat dalam tumbuhan Sansevieria, antara lain saponin polifenol, kardenolin, kardamin, dan abamagenin. Warna daun Sansevieria beragam, mulai hijau tua, hijau muda, hijau abu-abu, perak, dan warna kombinasi putih kuning atau hijau kuning (Gambar 1). Motif alur atau garis-garis yang terdapat pada helai daun juga bervariasi, ada yang mengikuti arah serat daun, tidak beraturan, dan ada juga yang zig-zag.
Ditinjau berdasarkan jenisnyaSansevieria ada dua jenis, yaituSansevieria keturunan asli dan hasil persilangan/hibridasi yang bisa disebut dengan jenis Sansevieria hibrid. Dari bentuk hibrid ini, terciptaSansevieria dengan karakter dan fisik yang berbeda dari induknya. Mutasi Sansevieria juga dapat terjadi dari perbanyakan melalui stek daun (Van Wyket al.1997).
Sansevieria mampu menyerap polutan berbahaya yang terdapat di udara sebab Sansevieria mengandung bahan aktif pregnan glikosid yang berfungsi untuk mereduksi polutan menjadi asam organik, gula, dan asam amino, dengan demikian unsur polutan tersebut jadi tidak berbahaya lagi bagi manusia (Yoshihiroet al. 1997). Sansevieria juga menjadi objek penelitian tanaman penyaring udara NASA (National Aeronautics and Space Administration) untuk membersihkan udara di stasiun ruang angkasa. Berdasarkan riset yang dilakukan oleh Wolfereton Environmental Service (1999), menyatakan bahwa setiap helai daun Sansevieria bisa menyerap formaldehid sebanyak 0.938 g per jam. Riset lainnya dapat disimpulkan bahwa untuk ruangan seluas 100 m3 cukup ditempatkan S. trifasciataLaurentii dewasa sebanyak 5 helai dalam ruangan tersebut agar bebas polutan (Arnold 2004).
Bakteri
Bakteri merupakan organisme yang paling banyak terdapat di alam dibandingkan dengan organisme lainnya. Bakteri biasanya hanya berukuran 0.5-5 m, tetapi ada pula jenis yang memiliki diameter mencapai 0.3 mm. Bakteri dapat digolongkan menjadi dua kelompok, yaitu Gram positif dan Gram negatif yang didasarkan pada perbedaan struktur dinding sel. Bakteri Gram positif memiliki dinding sel yang terdiri atas lapisan peptidoglikan yang tebal dan asam teikoat. Sementara, bakteri Gram negatif memiliki lapisan luar, lipopolisakarida yang terdiri atas membran dan lapisan peptidoglikan yang tipis dan terletak pada periplasma (di antara lapisan luar dan membran sitoplasmik) (Atlas 1995).
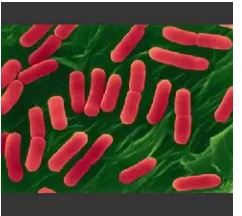
Staphylococcus aureus merupakan bakteri Gram positif, tidak bergerak, tidak berspora, berbentuk bola, dapat ditemukan satu-satu atau berpasangan (Gambar 2). Ukuran Staphylococcus berbeda-beda tergantung kepada media pertumbuhannya. Staphylococcus memiliki diameter 0.5-1,0
mm dengan koloni berwarna kuning. S. aureus tumbuh dengan optimum pada suhu 37oC dengan waktu pembelahan 0.47 jam. Bakteri ini biasanya terdapat pada saluran pernafasan atas dan kulit (Jawetzet al. 2001).
Gambar 2 BakteriStaphylococcus aureus (Sumber : www.hartoke.files.wordpress.com) Escherichia coli, atauE. coli, adalah salah satu jenis spesies utama bakteri Gram negatif (Gambar 3). Pada umumnya, bakteri yang ditemukan oleh Theodor Escherich ini dapat ditemukan dalam usus besar manusia. Kebanyakan E. coli tidak berbahaya, tetapi beberapa, sepertiE. coli tipe O157:H7, dapat mengakibatkan keracunan makanan yang serius pada manusia. E. coli banyak digunakan dalam teknologi rekayasa genetika. Biasa digunakan sebagai vektor untuk menyisipkan gen-gen tertentu yang diinginkan untuk dikembangkan. E. coli dipilih karena pertumbuhannya sangat cepat dan mudah dalam penanganannya (Jawetzet al. 2001).
Gambar 3 BakteriEscherichia coli (Sumber :www.astrographics.com)
Antibakteri
3
kedua adalah antibakteri bakterisida yang bekerja dengan membunuh bakteri. Umumnya terdapat transisi antara kerja bakteriostatik dengan bakterisida. Ada beberapa antibakteri yang bersifat bakteriostatik dapat berubah menjadi bakterisida jika digunakan dalam dosis tinggi (Schunacket al. 1990).
Berdasarkan efektivitas kerjanya terhadap berbagai mikroorganisme maka senyawa antibakteri digolongkan menjadi dua kelompok, yaitu antibakteri berspektrum luas yang efektif terhadap berbagai jenis mikroorganisme dan antibakteri berspektrum sempit yang hanya efektif terhadap mikroorganisme tertentu (Volk & Wheeler 1988). Senyawa antibakteri dapat bekerja dengan berbagai macam cara, tergantung pada strukturnya, diantaranya menghambat sintesis molekul kecil esensial (contoh trimetoprim), menghambat sintesis dinding sel (contoh penisilin dan amoksilin), dan menghambat sintesis asam nukleat (misal bromodeoksiuridin) (Schunacket al. 1990).
Ekstraksi dan Fraksinasi
Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut (Sudjadi 1986).Metode ekstraksi yang digunakan pada percobaan kali ini adalah metode maserasi. Metode maserasi digunakan untuk melarutkan simplisia yang mengandung komponen kimia yang mudah larut dalam pelarut, tidak mengandung benzoin, tiraks, dan lilin. Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selama proses maserasi dilakukan pengadukan dan penggantian pelarut setiap hari. Endapan yang diperoleh dipisahkan kemudian filtratnya dipekatkan (Sudjadi 1986).
Kromatografi kolom merupakan salah satu metode kromatografi yang dapat digunakan untuk fraksinasi ini merupakan cara yang terbaik untuk pemisahan campuran dalam jumlah besar (lebih dari 1 g). Campuran yang akan dipisahkan pada kromatografi kolom adalah berupa pita pada bagian atas kolom penjerap yang berada dalam tabung kaca, tabung logam, atau bahkan tabung plastik. Pelarut eluen dibiarkan mengalir melalui
kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan (Rouessac & Rouessac 2004).
BAHAN DAN METODE
Alat dan Bahan
Bahan yang digunakan dalam percobaan ini adalah daun Sansevieria trifasciata Prain dari kebun percobaan Kampus Lodaya IPB, kultur bakteri yang terdiri dariE. coli(ATCC 25922) danS. aureus(ATCC 25923). Media yang digunakan untuk pertumbuhan bakteri adalah Nutrient Agar (NA), larutan metanol 96%, larutan NaCl, kloroform, etil-asetat, n-heksana, diklorometan, metanol, eter, FeCl 1%, H2SO4 pekat, serbuk Mg, amil alkohol,HCl 2 N, pereaksi Mayer, pereaksi Dragendorf, pereaksi Wagner, pereaksi Lieberman-Buchard, dan akuades, Silika G 60 (E. Merck 230 400 mesh), pelat aluminium jenis silika gel G60F254, media Muller-Hinton, cakram kosong, standar amoksilin dan trimetoprim
Alat-alat yang digunakan antara lain, evaporator, kertas saring, jarum ose, mikropipet, pengaduk magnetik, pelat penangas botol timbang, oven, cawan porselein, plat penangas alat timbang, kolom pengemas, kapas bebas lemak atau wol kaca, pelat kromatografi lapis tipis (KLT), labu erlenmeyer, tabung reaksi, pipet volumetrik, dan autoklaf.
METODE
Preparasi Sampel
Daun Sansevieria sebagai sampel dibersihkan dengan air mengalir, kemudian dikeringkan dengan menggunakan tisu. Sampel dipotong-potong kecil kemudian dikeringkan dalam oven pada suhu 60o C selama 3 x 24 jam.
kedua adalah antibakteri bakterisida yang bekerja dengan membunuh bakteri. Umumnya terdapat transisi antara kerja bakteriostatik dengan bakterisida. Ada beberapa antibakteri yang bersifat bakteriostatik dapat berubah menjadi bakterisida jika digunakan dalam dosis tinggi (Schunacket al. 1990).
Berdasarkan efektivitas kerjanya terhadap berbagai mikroorganisme maka senyawa antibakteri digolongkan menjadi dua kelompok, yaitu antibakteri berspektrum luas yang efektif terhadap berbagai jenis mikroorganisme dan antibakteri berspektrum sempit yang hanya efektif terhadap mikroorganisme tertentu (Volk & Wheeler 1988). Senyawa antibakteri dapat bekerja dengan berbagai macam cara, tergantung pada strukturnya, diantaranya menghambat sintesis molekul kecil esensial (contoh trimetoprim), menghambat sintesis dinding sel (contoh penisilin dan amoksilin), dan menghambat sintesis asam nukleat (misal bromodeoksiuridin) (Schunacket al. 1990).
Ekstraksi dan Fraksinasi
Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut (Sudjadi 1986).Metode ekstraksi yang digunakan pada percobaan kali ini adalah metode maserasi. Metode maserasi digunakan untuk melarutkan simplisia yang mengandung komponen kimia yang mudah larut dalam pelarut, tidak mengandung benzoin, tiraks, dan lilin. Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selama proses maserasi dilakukan pengadukan dan penggantian pelarut setiap hari. Endapan yang diperoleh dipisahkan kemudian filtratnya dipekatkan (Sudjadi 1986).
Kromatografi kolom merupakan salah satu metode kromatografi yang dapat digunakan untuk fraksinasi ini merupakan cara yang terbaik untuk pemisahan campuran dalam jumlah besar (lebih dari 1 g). Campuran yang akan dipisahkan pada kromatografi kolom adalah berupa pita pada bagian atas kolom penjerap yang berada dalam tabung kaca, tabung logam, atau bahkan tabung plastik. Pelarut eluen dibiarkan mengalir melalui
kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan (Rouessac & Rouessac 2004).
BAHAN DAN METODE
Alat dan Bahan
Bahan yang digunakan dalam percobaan ini adalah daun Sansevieria trifasciata Prain dari kebun percobaan Kampus Lodaya IPB, kultur bakteri yang terdiri dariE. coli(ATCC 25922) danS. aureus(ATCC 25923). Media yang digunakan untuk pertumbuhan bakteri adalah Nutrient Agar (NA), larutan metanol 96%, larutan NaCl, kloroform, etil-asetat, n-heksana, diklorometan, metanol, eter, FeCl 1%, H2SO4 pekat, serbuk Mg, amil alkohol,HCl 2 N, pereaksi Mayer, pereaksi Dragendorf, pereaksi Wagner, pereaksi Lieberman-Buchard, dan akuades, Silika G 60 (E. Merck 230 400 mesh), pelat aluminium jenis silika gel G60F254, media Muller-Hinton, cakram kosong, standar amoksilin dan trimetoprim
Alat-alat yang digunakan antara lain, evaporator, kertas saring, jarum ose, mikropipet, pengaduk magnetik, pelat penangas botol timbang, oven, cawan porselein, plat penangas alat timbang, kolom pengemas, kapas bebas lemak atau wol kaca, pelat kromatografi lapis tipis (KLT), labu erlenmeyer, tabung reaksi, pipet volumetrik, dan autoklaf.
METODE
Preparasi Sampel
Daun Sansevieria sebagai sampel dibersihkan dengan air mengalir, kemudian dikeringkan dengan menggunakan tisu. Sampel dipotong-potong kecil kemudian dikeringkan dalam oven pada suhu 60o C selama 3 x 24 jam.
4
menit. Bobot cawan beserta ekstrak kering ditimbang dan dicatat nilainya. Pemanasan dan penimbangan diulang setiap 24 jam sampai didapat bobot konstan. Kadar air dihitung dengan cara berikut:
Kadar air (%) =
a b
a
−
X 100% dengan
a = bobot awal sample (g)
b = bobot akhir sampel setelah dioven (g)
Ekstraksi
Sampel yang telah dikeringkan dalam oven dihaluskan menggunakan blender sampai menjadi serbuk. Sampel kemudian ditimbang sebanyak 20 g. kemudian dimaserasi dengan menggunakan pelarut metanol 30% sebanyak 200 ml lalu didiamkan selama 3 x 24 jam. Sampel kemudian disaring sebanyak 3 kali dengan perbandingan yang sama. Filtrat yang didapatkan ditampung dalam labu erlenmeyer. Ekstrak yang terkumpul kemudian dievaporasi pada suhu 37°C hingga pelarut menguap. Sebagian ekstrak pekat digunakan pada uji fitokimia dan sebagian lagi digunakan untuk uji aktivitas antibakteri.
Rendemen ekstrak (%) = ×100% Keterangan :
a = bobot ekstrak (g) b = bobot sampel kering (g) ka = kadar air
Uji Fitokimia (Harborne 1987)
Uji saponin dan tanin
Sebanyak 1 g sampel diekstraksi dengan akuadestilata secukupnya kemudian dipanaskan dengan penangas air selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam dua tabung reaksi. Bagian pertama, uji saponin filtrat didiamkan sampai agak dingin kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung saponin. Uji tanin, filtrat yang didapatkan ditambahkan dengan FeCl3 1 %, bila dihasilkan warna hijau, biru, atau hitam maka filtrat positif mengandung tanin.
Uji steroid dan triterpenoid
Sampel ditimbang sebanyak 1 g dan dilarutkan dengan 25 ml etanol panas (50oC), kemudian disaring ke dalam pinggan porselein
dan diuapkan sampai kering. Residu yang didapatkan dilarutkan dalam eter dan dipindahkan ke dalam tabung reaksi lalu ditambahkan pereaksi Lieberman-Buchard (3 tetes anhidrida asam asetat dan 1 tetes H2SO4 pekat). Terbentuknya warna merah atau ungu menunjukkan adanya kandungan triterpenoid, sedangkan jika terbentuk warna hijau atau biru menunjukkan adanya steroid.
Uji alkaloid
Sebanyak 1 g sampel dilarutkan dalam 10 ml kloroform lalu ditambahkan beberapa tetes kloroform-amonia lalu disaring. Filtrat yang diperoleh ditambahkan 10 tetes H2SO4 2M, kemudian dikocok hingga terbentuk 2 lapisan. Lapisan asam yang tidak berwarna dipindahkan ke dalam tabung reaksi lain, lalu diteteskan pada lempeng tetes dan ditambahkan pereaksi Dragendorf, Mayer, dan Wagner. Adanya alkaloid ditunjukkan dengan terbentuknya endapan berwarna jingga, putih, dan coklat.
Uji flavonoid
Sebanyak 1 g sampel ditambahkan air panas secukupnya, lalu dipanaskan selama 5 menit dan disaring. Sebanyak 5 ml filtrat ditambahkan sedikit serbuk Mg dan 1 ml HCl pekat dan 1 ml amil alkohol kemudian dikocok. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah/jingga/ kuning pada lapisan amil alkohol.
Uji polifenol
Ekstrak kasar Sansevieria. ditambahkan dengan larutan FeCl3 1 %. Warna hijau kehitaman yang terbentuk setelah proses penambahan menunjukkan adanya senyawa golongan polifenol.
Fraksinasi
Fraksinasi dilakukan untuk memisahkan senyawa sesuai dengan polaritasnya. Metode fraksinasi yang digunakan adalah metode kolom. Bubur adsorben dibuat dengan mencampurkan silika gel dalam eluen terbaik dengan perbandingan (1:10). Bubur adsorban tersebut kemudian dimasukkan ke dalam kolom hingga mencapai 3/4 tinggi kolom. Pelarut dibiarkan turun melalui cerat kolom. Pelarut terus ditambahkan sampai laju alirnya konstan, yang menunjukkan bahwa kolom telah terkemas dengan baik. Ekstrak contoh dimasukkan ke dalam kolom. Eluat yang keluar ditampung dengan menggunakan tabung reaksi. Pemisahan yang terjadi dicirikan dengan terbentuknya pita-pita berwarna. Eluat yang keluar ditampung dalam tabung reaksi sebanyak masing-masing 5 ml.
Fraksi hasil penampungan kolom ditotolkan pada plat silika gel G60F254, lalu dibiarkan hingga kering. Kemudian dimasukkan ke dalam bejana KLT yang sudah jenuh dengan eluen dan dibiarkan sampai eluen merambat naik hingga garis akhir. Pelat KLT dianalisis dengan menggunakan sinar UV pada panjang gelombang 254 nm dan 366 nm. Kemudian dihitung nilai Rf-nya dengan rumus:
Rf = Jarak titik pusat spot noda titik awal Jarak garis depan dari titik awal Eluen yang digunakan adalah eluen terbaik berdasarkan uji yang dilakukan pada berbagai jenis eluen yang semakin meningkat kepolarannya dari kloroform sampai ke etil asetat dengan perbandingan (100%), (9:1), (6:1), (3:1), (2:1) dan (1:1). Setiap fraksi yang memiliki nilai Rf yang sama digabung kemudian diujikan kembali aktivitas antibakterinya untuk menentukan fraksi yang paling aktif. Selanjutnya fraksi yang paling aktif diuji fitokimianya untuk menentukan golongan senyawanya.
Uji Aktivitas Antibakteri
Pelaksanaan uji aktivitas antibakteri dilakukan secara aseptik dengan metode difusi agar cakram. Pembuatan masing-masing suspensi bakteri dilakukan dengan menyiapkan tabung reaksi yang telah berisi media larutan NaCl steril kemudian diinokulasi dengan 1loop biakan bakteri uji. Untuk uji aktivitas antibakteri, digunakan biakan bakteri dengan kepadatan sel 108sel/ml. Kepadatan suspensi bakteri diukur kepadatan selnya dengan metode standar McFarland (Mc Farland 1987). Biakan bakteri kemudian dioles pada permukaan media Muller-Hinton (Collin and Lyne 1995).
Ekstrak kasar dibuat pada konsentrasi 10000, 5000, 2500, dan 1250 ppm dalam pelarut DMSO. Setelah itu cakram kosong diletakkan di atas permukaan agar dan ditetesi dengan 7,5 l ekstrak. Sebagai kontrol negatif atau pelarut digunakan cakram yang telah diteteskan DMSO dan sebagai kontrol positif, yaitu obat standar trimetoprim (25 g/cakram) dan amoksilin (25 g/cakram). Cawan petri ini diinkubasi dengan cara terbalik selama 24 jam pada suhu 37oC. Daerah bening disekitar kertas cakram menunjukkan uji positif atau terjadinya proses penghambatan oleh zat uji (Sahoo et al. 2006; Rath et al. 1999). Diameter daerah bening sekeliling cakram diukur dan dibandingkan daerah hambatannya dengan kedua obat standar.
Masing-masing fraksi hasil kromatografi kolom dan KLT juga dilakukan uji aktivitas antimikroba dengan cara yang sama seperti ekstrak metanol sampel. Konsentrasi yang digunakan untuk setiap fraksi, yaitu 40000, 20000, dan 10000 ppm dalam larutan DMSO.
HASIL DAN PEMBAHASAN
Kadar Air
Kadar air merupakan banyaknya air yang terkandung dalam bahan yang dinyatakan dalam persen (Winarno 1997). Daun
sansevieria segar yang telah dikeringkan
dalam oven pada suhu 105oC memiliki kadar air sebesar 90.60 % dan serbuknya menghasilkan kadar air sebesar 7.40 % dengan nilai selang kepercayaan 95 % berada pada kisaran 7.296-7.570 yang dapat diartikan bahwa terdapat 95 % kemungkinan bahwa suatu nilai sampel yang dipilih secara acak dari suatu sampel yang menyebar normal dalam kisaran tersebut.
5
Fraksinasi
Fraksinasi dilakukan untuk memisahkan senyawa sesuai dengan polaritasnya. Metode fraksinasi yang digunakan adalah metode kolom. Bubur adsorben dibuat dengan mencampurkan silika gel dalam eluen terbaik dengan perbandingan (1:10). Bubur adsorban tersebut kemudian dimasukkan ke dalam kolom hingga mencapai 3/4 tinggi kolom. Pelarut dibiarkan turun melalui cerat kolom. Pelarut terus ditambahkan sampai laju alirnya konstan, yang menunjukkan bahwa kolom telah terkemas dengan baik. Ekstrak contoh dimasukkan ke dalam kolom. Eluat yang keluar ditampung dengan menggunakan tabung reaksi. Pemisahan yang terjadi dicirikan dengan terbentuknya pita-pita berwarna. Eluat yang keluar ditampung dalam tabung reaksi sebanyak masing-masing 5 ml.
Fraksi hasil penampungan kolom ditotolkan pada plat silika gel G60F254, lalu dibiarkan hingga kering. Kemudian dimasukkan ke dalam bejana KLT yang sudah jenuh dengan eluen dan dibiarkan sampai eluen merambat naik hingga garis akhir. Pelat KLT dianalisis dengan menggunakan sinar UV pada panjang gelombang 254 nm dan 366 nm. Kemudian dihitung nilai Rf-nya dengan rumus:
Rf = Jarak titik pusat spot noda titik awal Jarak garis depan dari titik awal Eluen yang digunakan adalah eluen terbaik berdasarkan uji yang dilakukan pada berbagai jenis eluen yang semakin meningkat kepolarannya dari kloroform sampai ke etil asetat dengan perbandingan (100%), (9:1), (6:1), (3:1), (2:1) dan (1:1). Setiap fraksi yang memiliki nilai Rf yang sama digabung kemudian diujikan kembali aktivitas antibakterinya untuk menentukan fraksi yang paling aktif. Selanjutnya fraksi yang paling aktif diuji fitokimianya untuk menentukan golongan senyawanya.
Uji Aktivitas Antibakteri
Pelaksanaan uji aktivitas antibakteri dilakukan secara aseptik dengan metode difusi agar cakram. Pembuatan masing-masing suspensi bakteri dilakukan dengan menyiapkan tabung reaksi yang telah berisi media larutan NaCl steril kemudian diinokulasi dengan 1loop biakan bakteri uji. Untuk uji aktivitas antibakteri, digunakan biakan bakteri dengan kepadatan sel 108sel/ml. Kepadatan suspensi bakteri diukur kepadatan selnya dengan metode standar McFarland (Mc Farland 1987). Biakan bakteri kemudian dioles pada permukaan media Muller-Hinton (Collin and Lyne 1995).
Ekstrak kasar dibuat pada konsentrasi 10000, 5000, 2500, dan 1250 ppm dalam pelarut DMSO. Setelah itu cakram kosong diletakkan di atas permukaan agar dan ditetesi dengan 7,5 l ekstrak. Sebagai kontrol negatif atau pelarut digunakan cakram yang telah diteteskan DMSO dan sebagai kontrol positif, yaitu obat standar trimetoprim (25 g/cakram) dan amoksilin (25 g/cakram). Cawan petri ini diinkubasi dengan cara terbalik selama 24 jam pada suhu 37oC. Daerah bening disekitar kertas cakram menunjukkan uji positif atau terjadinya proses penghambatan oleh zat uji (Sahoo et al. 2006; Rath et al. 1999). Diameter daerah bening sekeliling cakram diukur dan dibandingkan daerah hambatannya dengan kedua obat standar.
Masing-masing fraksi hasil kromatografi kolom dan KLT juga dilakukan uji aktivitas antimikroba dengan cara yang sama seperti ekstrak metanol sampel. Konsentrasi yang digunakan untuk setiap fraksi, yaitu 40000, 20000, dan 10000 ppm dalam larutan DMSO.
HASIL DAN PEMBAHASAN
Kadar Air
Kadar air merupakan banyaknya air yang terkandung dalam bahan yang dinyatakan dalam persen (Winarno 1997). Daun
sansevieria segar yang telah dikeringkan
dalam oven pada suhu 105oC memiliki kadar air sebesar 90.60 % dan serbuknya menghasilkan kadar air sebesar 7.40 % dengan nilai selang kepercayaan 95 % berada pada kisaran 7.296-7.570 yang dapat diartikan bahwa terdapat 95 % kemungkinan bahwa suatu nilai sampel yang dipilih secara acak dari suatu sampel yang menyebar normal dalam kisaran tersebut.
25 30
6 6 6 6
41
34
6 6 6 6
0 5 10 15 20 25 30 35 40 45 Amoksis ilin Trime
toprim DMSO 25 00
5000 10000
Konsentrasi (ppm) D aya ham bat (m m )
yang disebabkan oleh mikroba.Kadar air yang tinggi mengakibatkan mudahnya bakteri, kapang, dan khamir untuk berkembang biak, sehingga akan terjadi perubahan pada bahan pangan. (Winarno 1997).
Ekstraksi
Ekstraksi adalah pemisahan suatu zat dari campurannya dengan pembagian sebuah zat terlarut antara dua pelarut yang tidak dapat tercampur untuk mengambil zat terlarut tersebut dari satu pelarut ke pelarut yang lain (Sudjadi 1986). Serbuk S. trifasciara Prain sebanyak 20 g dilarutkan dalam metanol dengan perbandingan (1:10) selama 3 x 24 jam sebanyak 5 kali pengulangan. Cairan hasil maserasi kemudian dievaporasi, untuk menguapkan sisa pelarut yang dipakai. Selain itu untuk memekatkan ekstrak sehingga diperoleh ekstrak kental berwana hijau kehitaman. Nilai rerata rendemen ekstrak yang didapatkan dari 5 kali pengulangan (lampiran 2) adalah sebesar 15.50 % dengan nilai standar deviasi sebesar 1.4823 dengan selang kepercayaan 95 % pada kisaran 13.660-17.346 Proses ekstraksi dilakukan dengan menggunakan metode maserasi. Penggunaan metode maserasi dikarenakan tidak diketahuinya sifat sampel yang akan diekstraksi tahan panas atau tidak.
Metanol 96% digunakan karena dengan menggunakan pelarut ini tidak hanya senyawa polar yang dapat terekstrak tetapi senyawa non polar juga dapat terekstrak. Semakin besar nisbah pelarut dibandingkan sampel maka kemampuan melarutkan sampel juga akan semakin lebih besar dan efektif.
Uji Fitokimia
Uji fitokimia dilakukan untuk mengetahui kandungan metabolit sekunder dalam suatu bahan alam. Ekstrak sampel yang telah didapat dilakukan uji kandungan saponin, tanin, flavonoid, steroid, triterpenoid, dan alkaloid. Data hasil uji fitokimia dapat dilihat pada Tabel 1.
Pengujian kandungan senyawa saponin, tanin, flavonoid, serta triterpenoid pada ekstrak daunS. trifasciataPrain menunjukkan hasil yang negatif. Hasil pengujian kandungan steroid terbentuk warna hijau kehitaman yang menunjukkan terdapat kandungan steroid pada ekstrak. Ekstrak daun juga positif mengandung senyawa alkaloid, hal ini ditunjukkan dari terbentuknya endapan
berwarna jingga, putih, dan coklat setelah
ditambahkan pereaksi Dragendorf, Mayer, dan Wagner.
Tabel 1. Hasil uji fitokimia ekstrak daun S. trifasciataPrain.
Golongan senyawa Hasil uji
Saponin -Tanin -Flavonoid + Steroid + Triterpenoid -Alkaloid +
Ket : (+) mengandung golongan senyawa (-) tidak mengandung golongan senyawa
Hasil ini sedikit berbeda dengan Yoshihiro et al. (1997), diperoleh Sansevieria mengandung saponin dan steroid, serta menurut Sastradipradja (1997), kandungannya antara lain polifenol dan saponin. Perbedaan ini dapat dikarenakan perbedaan tempat dan kondisi tanaman tersebut ditanam, contohnya antara lain suhu dan hara tanah. Selain itu perbedaan pelarut dan metode ekstraksi yang digunakan juga dapat mempengaruhi perbedaan kandungan metabolit sekunder.
Aktivitas Antibakteri Ekstrak
Kasar
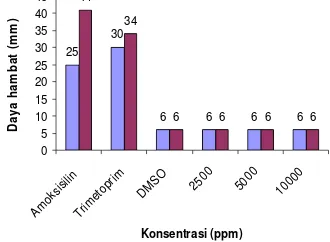
Berdasarkan hasil uji antibakteri metode difusi agar terhadap ekstrak kasar daun S. trifasciata Prain pada konsentrasi 1250 sampai 10000 menunjukkan bahwa tidak adanya penambahan diameter pada zona bening di sekitar cakram (Gambar 4). Hal tersebut menunjukkan bahwa ekstrak kasar daun S. trifasciata Prain tidak memiliki aktivitas antibakteri.
*Diameter daya hambat termasuk diameter cakram 6 mm
7
Hasil ini berbeda dengan hasil uji antibakteri dari S. hyacinthoides yang menghasilkan diameter zona bening berkisar antara 20-30 mm pada berbagai galur bakteri (Afolayanet al. 2008).
Fraksinasi Ekstrak Metanol
Proses fraksinasi dilakukan dengan metode kromatografi kolom. Sebelum dilakukan kromatografi kolom ekstrak diidentifikasi dengan menggunakan KLT untuk memperoleh campuran dan perbandingan eluen yang tepat. Metode KLT digunakan karena metodenya sederhana, murah, proses kerja singkat dan sampel yang digunakan sedikit. (Rouessac & Rouessac 2007).Fase diam yang digunakan adalah silika gel dan eluen tunggal yang digunakan pada metode KLT ini adalah metanol, heksana, kloroform, diklorometan dan etil asetat.
Berdasarkan hasil uji KLT, perbandingan eluen yang terbaik adalah etil asetat:kloroform dengan perbandingan (6:1). Hal ini karena pada perbandingan kedua pelarut tersebut didapatkan hasil kromatogram dengan spot yang terbanyak, yaitu tujuh spot.
Gambar 5 Kromatogram KLT ekstrak daunS. trifasciata Prain dengan eluen terbaik kloroform : etil asetat (6:1). Eluen terbaik yang telah didapatkan selanjutnya digunakan pada proses kromatografi kolom. Metode kromatografi kolom yang digunakan adalah secara gradien yaitu berdasarkan peningkatan kepolaran. Penggunaan cara gradien bertujuan agar dengan peningkatan polaritas sistem eluen,
semua komponen akan terbawa lebih cepat (Harvey 2000).
Kromatografi kolom diawali dengan melakukan elusi dengan pelarut kloroform 100%, kemudian diikuti kloroform : etil asetat dengan perbandingan 9:1, 6:1, 3:1, 2:1, 1:1, 1:9, 1:6, 1:3, 1:2, dan diakhiri dengan pelarut etil asetat 100%. Hasil pemisahan ekstrak ditampung sebanyak 5 ml dalam tiap tabung reaksi.
Eluat pada masing-masing tabung reaksi tersebut kemudian diuji dengan menggunakan KLT. Hasil pengujian KLT dapat dilihat pada Lampiran 4. Tabung-tabung yang memiliki pola KLT yang sama kemudian disatukan dan didapatkan fraksi-fraksi yang berjumlah 10 fraksi. Kesepuluh fraksi tersebut kemudian dihitung jumlah rendemennya untuk digunakan pada uji aktivitas antibakteri (Lampiran 3). Fraksi yang telah didapatkan dari proses kromatografi tersebut kemudian digunakan dalam pengujian aktivivitas antibakteri.
Uji Antibakteri Fraksi Aktif
Sepuluh fraksi hasil fraksinasi selanjutnya dilakukan uji antibakteri terhadapE. coli dan S. aureus dengan kontrol positif yang sama untuk ekstrak kasar. Konsentrasi yang digunakan adalah 10000 ppm, 20000 ppm, dan 40000 ppm. Pemilihan konsentrasi ini dikarenakan pada pengujian ekstrak kasar dengan konsentrasi 10000 ppm didapatkan hasil yang negatif, sehingga konsentrasinya ditingkatkan melebihi 10000 ppm.Berdasarkan hasil pengukuran diameter zona bening di sekitar cakram kertas terlihat adanya penambahan diameter fraksi 1 pada bakteri S. aureus. Kesembilan fraksi lainnya tidak ada daerah bening yang terbentuk disekitar cakram kertas (Gambar 6).
22 28
6 6 6 6
40
30
6 7 7 9
0 5 10 15 20 25 30 35 40 45 Am oksisilin trimetopr im
DMSO 10000 20000 4000 0 Konsentrasi (ppm) Da ya h a m b a t (m m )
*Diameter daya hambat termasuk diameter cakram 6 mm. Gambar 6 Diameter daya hambat fraksi teraktif denganE. coli ( ) danS. aureus( ).
Bakteri Gram negatif mempunyai ketahanan yang lebih baik terhadap senyawa antimikroba dibandingkan dengan bakteri Gram positif. Bakteri Gram negatif memiliki sistem seleksi terhadap zat-zat asing, yaitu pada lapisan lipopolisakarida (Branen & Davidson 1993). Pelczar dan Chan (2005) menyatakan struktur dinding sel bakteri Gram positif relatif lebih sederhana, sehingga memudahkan senyawa antimikroba untuk masuk ke dalam sel dan menemukan sasaran untuk merusak struktur dinding sel. Struktur dinding sel bakteri Gram negatif relatif lebih kompleks, berlapis tiga, yaitu lapisan luar yang berupa lipoprotein, lapisan tengah yang berupa lipopolisakarida, dan lapisan dalam peptidoglikan.
Zona bening untuk kedua antibakteri terhadap bakteriE. coli dengan nomer ATCC 25922 dan S. aureus dengan nmer ATCC 25923 ini menghasilkan zona bening disekitar cakram dengan diameter masing-masing 22 mm dan 40 mm terhadap amoksilin, sedangkan trimetoprim 28 mm dan 30 mm. DMSO sebagai kontrol negatif tidak menghasilkan penambahan diameter disekitar cakram, atau tidak terbentuknya zona bening di sekitar cakram (Gambar 7 dan 8).
Penggunaan obat standar berupa amoksilin dan trimetoprim dikarenakan kedua obat tersebut merupakan zat antibiotik yang berspektrum luas yang aktif pada sebagian besar mikroorganisme, sehingga dapat menghambat pertumbuhan bakteri baik bakteri Gram negatif maupun bakteri Gram positif (Jawetz 2001).
Berdasarkan hasil pengamatan pada fraksi 1 ditemukan adanya aktivitas penghambatan antibakteri pada bakteri Gram positif. Uji fitokimia dilakukan pada kesepuluh fraksi dan
didapatkan hasil pada fraksi 1 mengandung senyawa steroid dan alkaloid. Fraksi 2 sampai 10 tidak ditemukan adanya senyawa steroid, hanya terdapat senyawa alkaloid dan flavonoid. Hal ini menunjukkan bahwa senyawa steroid diduga memiliki aktivitas dalam penghambatan bakteri.
Gambar 7 Hasil pengamatan uji antibakteri obat standar amoksilin, trimetoprim dan DMSO pada bakteriE. coli.
Gambar 8 Hasil pengamatan uji antibakteri obat standar amoksilin, trimetoprim dan DMSO pada bakteriS. aureus.
Amoksilin dan trimetoprim memiliki metode penghambatan bakteri yang berbeda. Penghambatan pertumbuhan bakteri amoksilin dilakukan dengan menghambat sintesis dinding sel bakteri, sedangkan pada trimetoprim dengan cara menghambat sintesis asam nukleat. Senyawa penghambat akan berikatan dengan enzim atau komponen lain yang berperan dalam tahap sintesis, sehingga tidak ada substrat yang direaksikan. Karena kekurangan nutrisi maka pembentukan dinding sel akan terhalangi, yang selanjutnya akan menyebabkan kematian sel (Jawetz 2001).
9
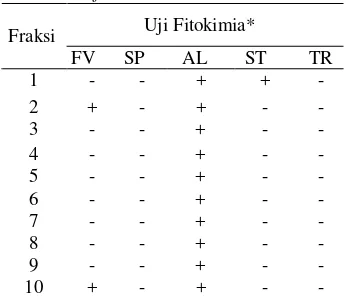
Tabel 3 Hasil uji fitokimia fraksi daun S. trifasciataPrain
Uji Fitokimia* Fraksi
FV SP AL ST TR 1 + + 2 + + 3 + 4 + 5 + 6 + 7 + 8 + 9 + 10 + + -*Keterangan:FV=flavonoid, SP=Saponin, AL=Alkaloid, ST= steroid, TR= triterpenoid
Menurut Afolayan (2008), gabungan saponin dan steroid dalam satu fraksi mampu menghasilkan antibakteri yang lebih baik bila dibandingkan dengan keberadaan steroid dan saponin yang terpisah. Hal ini diduga menyebabkan fraksi 1 hanya mampu menghambat pertumbuhan bakteri Gram positif (S. aureus) saja, sedangkan pada bakteri Gram negatif tidak menunjukkan adanya aktivitas penghambatan.
SIMPULAN DAN SARAN
Simpulan
Hasil uji antibakteri yang dilakukan terhadap ekstrak kasar metanol daun Sanseviera trifasciata Prain menunjukkan bahwa tidak ada aktivitas penghambatan pertumbuhan bakteri. Hasil fraksinasi yag mengandung senyawa steroid menunjukkan adanya aktivitas penghambatan pertumbuhan antibakteri hanya pada S. aureus dengan konsentrasi 10000, 20000, dan 40000 ppm
.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menelaah aktivitas antibakteri pada daun Sanseviera trifasciata Prain dengan menggunakan beberapa metode ekstraksi yang berbeda, pelarut yang berbeda, serta dengan menggunakan variasi konsentrasi yang berbeda.
DAFTAR PUSTAKA
Afolayan AJ, Jimoh FO, Aliero AA. 2008. Antioxidant and antibacterial properties of Sansevieria hyacinthoides.Internat J Pure Appl Sci 2(3) : 103-110.
Arnold MA. 2004. Landscape Plants for Environment 3rd Edition. Texas: Odenwald Inc.
Atlas RM. 1995. Principles of Microbiology. St. Louis:Mosby
Brannen LA, Davidson PM. 1993. Antimicrobials in Food. New York:Marcel Dekker Inc.
Collins CH, Lyne PM. 1995.Microbiological Methods 7th ed. London:Butterworths.
Departemen Kesehatan RI. 1997. Inventarisasi Tanaman Obat Indonesia, Vol. IV. DepKes. RI:Jakarta.
Dold AP, Cocks ML. 2001.Traditional Veterinary Medicine in The Alice District of the Eastern Cape Province, South Africa.S. Afr J Sci 97:375-379.
Harborne JB. 1987. Metode Fitokimia, penuntun Cara Modern Menganalisisa Tumbuhan. Padmawinata K, penerjemah. Terjemahan dari:Phytochemical Method a Guide to Modern Techniques of Plant Analysis.Bandung: ITB.
Harvey D. 2000. Modern Analytical Chemistry. New York:McGraw-Hill.
Jawetz E, Melnick JL, Adelberg EA. 2001. Medical Herb Index in Indonesia. Ed ke-2. Jakarta:EGC.
Levaro J, Rojas G. 2001. Antimicrobial evaluation of certain plants used in Mexican traditional medicine for the treatment of respiratory disease. J Ethnopharmacol 74:97-101.
Lucas H, David JK, Duke J. 2001. Bioshyntesis of Natural Plant. Maryland:Chicster Ellis Horwood Ltd. McFarland J. 1987 Standardization of
bacterial culture for disc diffusion assay.J Americ Med Assoc49:1176-1178.
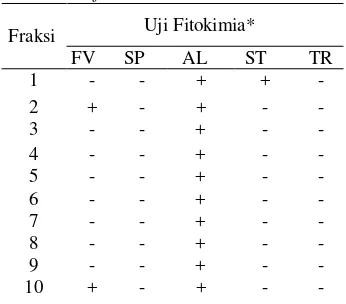
Tabel 3 Hasil uji fitokimia fraksi daun S. trifasciataPrain
Uji Fitokimia* Fraksi
FV SP AL ST TR 1 + + 2 + + 3 + 4 + 5 + 6 + 7 + 8 + 9 + 10 + + -*Keterangan:FV=flavonoid, SP=Saponin, AL=Alkaloid, ST= steroid, TR= triterpenoid
Menurut Afolayan (2008), gabungan saponin dan steroid dalam satu fraksi mampu menghasilkan antibakteri yang lebih baik bila dibandingkan dengan keberadaan steroid dan saponin yang terpisah. Hal ini diduga menyebabkan fraksi 1 hanya mampu menghambat pertumbuhan bakteri Gram positif (S. aureus) saja, sedangkan pada bakteri Gram negatif tidak menunjukkan adanya aktivitas penghambatan.
SIMPULAN DAN SARAN
Simpulan
Hasil uji antibakteri yang dilakukan terhadap ekstrak kasar metanol daun Sanseviera trifasciata Prain menunjukkan bahwa tidak ada aktivitas penghambatan pertumbuhan bakteri. Hasil fraksinasi yag mengandung senyawa steroid menunjukkan adanya aktivitas penghambatan pertumbuhan antibakteri hanya pada S. aureus dengan konsentrasi 10000, 20000, dan 40000 ppm
.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menelaah aktivitas antibakteri pada daun Sanseviera trifasciata Prain dengan menggunakan beberapa metode ekstraksi yang berbeda, pelarut yang berbeda, serta dengan menggunakan variasi konsentrasi yang berbeda.
DAFTAR PUSTAKA
Afolayan AJ, Jimoh FO, Aliero AA. 2008. Antioxidant and antibacterial properties of Sansevieria hyacinthoides.Internat J Pure Appl Sci 2(3) : 103-110.
Arnold MA. 2004. Landscape Plants for Environment 3rd Edition. Texas: Odenwald Inc.
Atlas RM. 1995. Principles of Microbiology. St. Louis:Mosby
Brannen LA, Davidson PM. 1993. Antimicrobials in Food. New York:Marcel Dekker Inc.
Collins CH, Lyne PM. 1995.Microbiological Methods 7th ed. London:Butterworths.
Departemen Kesehatan RI. 1997. Inventarisasi Tanaman Obat Indonesia, Vol. IV. DepKes. RI:Jakarta.
Dold AP, Cocks ML. 2001.Traditional Veterinary Medicine in The Alice District of the Eastern Cape Province, South Africa.S. Afr J Sci 97:375-379.
Harborne JB. 1987. Metode Fitokimia, penuntun Cara Modern Menganalisisa Tumbuhan. Padmawinata K, penerjemah. Terjemahan dari:Phytochemical Method a Guide to Modern Techniques of Plant Analysis.Bandung: ITB.
Harvey D. 2000. Modern Analytical Chemistry. New York:McGraw-Hill.
Jawetz E, Melnick JL, Adelberg EA. 2001. Medical Herb Index in Indonesia. Ed ke-2. Jakarta:EGC.
Levaro J, Rojas G. 2001. Antimicrobial evaluation of certain plants used in Mexican traditional medicine for the treatment of respiratory disease. J Ethnopharmacol 74:97-101.
Lucas H, David JK, Duke J. 2001. Bioshyntesis of Natural Plant. Maryland:Chicster Ellis Horwood Ltd. McFarland J. 1987 Standardization of
bacterial culture for disc diffusion assay.J Americ Med Assoc49:1176-1178.
AKTIVITAS ANTIBAKTERI FRAKSI AKTIF DAUN
LIDAH MERTUA (
Sansevieria trifasciata
Prain)
YANDITYA DWASTU GITASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Tabel 3 Hasil uji fitokimia fraksi daun S. trifasciataPrain
Uji Fitokimia* Fraksi
FV SP AL ST TR 1 + + 2 + + 3 + 4 + 5 + 6 + 7 + 8 + 9 + 10 + + -*Keterangan:FV=flavonoid, SP=Saponin, AL=Alkaloid, ST= steroid, TR= triterpenoid
Menurut Afolayan (2008), gabungan saponin dan steroid dalam satu fraksi mampu menghasilkan antibakteri yang lebih baik bila dibandingkan dengan keberadaan steroid dan saponin yang terpisah. Hal ini diduga menyebabkan fraksi 1 hanya mampu menghambat pertumbuhan bakteri Gram positif (S. aureus) saja, sedangkan pada bakteri Gram negatif tidak menunjukkan adanya aktivitas penghambatan.
SIMPULAN DAN SARAN
Simpulan
Hasil uji antibakteri yang dilakukan terhadap ekstrak kasar metanol daun Sanseviera trifasciata Prain menunjukkan bahwa tidak ada aktivitas penghambatan pertumbuhan bakteri. Hasil fraksinasi yag mengandung senyawa steroid menunjukkan adanya aktivitas penghambatan pertumbuhan antibakteri hanya pada S. aureus dengan konsentrasi 10000, 20000, dan 40000 ppm
.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menelaah aktivitas antibakteri pada daun Sanseviera trifasciata Prain dengan menggunakan beberapa metode ekstraksi yang berbeda, pelarut yang berbeda, serta dengan menggunakan variasi konsentrasi yang berbeda.
DAFTAR PUSTAKA
Afolayan AJ, Jimoh FO, Aliero AA. 2008. Antioxidant and antibacterial properties of Sansevieria hyacinthoides.Internat J Pure Appl Sci 2(3) : 103-110.
Arnold MA. 2004. Landscape Plants for Environment 3rd Edition. Texas: Odenwald Inc.
Atlas RM. 1995. Principles of Microbiology. St. Louis:Mosby
Brannen LA, Davidson PM. 1993. Antimicrobials in Food. New York:Marcel Dekker Inc.
Collins CH, Lyne PM. 1995.Microbiological Methods 7th ed. London:Butterworths.
Departemen Kesehatan RI. 1997. Inventarisasi Tanaman Obat Indonesia, Vol. IV. DepKes. RI:Jakarta.
Dold AP, Cocks ML. 2001.Traditional Veterinary Medicine in The Alice District of the Eastern Cape Province, South Africa.S. Afr J Sci 97:375-379.
Harborne JB. 1987. Metode Fitokimia, penuntun Cara Modern Menganalisisa Tumbuhan. Padmawinata K, penerjemah. Terjemahan dari:Phytochemical Method a Guide to Modern Techniques of Plant Analysis.Bandung: ITB.
Harvey D. 2000. Modern Analytical Chemistry. New York:McGraw-Hill.
Jawetz E, Melnick JL, Adelberg EA. 2001. Medical Herb Index in Indonesia. Ed ke-2. Jakarta:EGC.
Levaro J, Rojas G. 2001. Antimicrobial evaluation of certain plants used in Mexican traditional medicine for the treatment of respiratory disease. J Ethnopharmacol 74:97-101.
Lucas H, David JK, Duke J. 2001. Bioshyntesis of Natural Plant. Maryland:Chicster Ellis Horwood Ltd. McFarland J. 1987 Standardization of
bacterial culture for disc diffusion assay.J Americ Med Assoc49:1176-1178.
1 0
Rath CC, Dash SK, Mishra RK, Carluty JK. 1999. In vitro evaluation of antimycotic activity of turmeric (Curcuma longa L) essensial oils againts Candida albicans and Cryptococcus neoformans. J Essensl Oil Bearing Plants 43:172-178.
Rouessac F, Rouessac A. 2004. Chemical Analysis Modern Instrumentation Methods and Techniques 2nd. USA:John Wiley & Aons, Ltd.
Sahoo S, Kar DM, Mohapatra S, Rout SP, Dash SK. 2006. Antibacterial activity of Hybanthus enneaspermus against selected UTI pathogens. Ind J Pharm Sci 68:653-655.
Sastradipradja, S. 1997. Tanaman Hias, Bogor : Lembaga Biologi Nasional LIPI.
Schunack W, Mayer K, Hawke M. 1990. Senyawa Obat Ed ke-2. Yogyakarta: Gajah Mada University Press.
Sudjadi. 1986. Metode Pemisahan. Yogyakarta : UGM Press
Van Wyk BE, Van Oudtshoorn B, Gericke N. 1997. Medicinal Plants of South Africa. Briza: Pretoria.
Volk WA, Wheeler MF. 1993. Mikrobiologi Dasar I Ed ke-5. Jakarta: Erlangga.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta:Gramedia Pustaka Utama.
1 2
Lampiran 1 Bagan Alir Kerja
Sampel
Ekstraksi
(maserasi)
3 x 24 jam
Kadar air
Uji anti bakteri
1250, 2500, 5000, 10000
Uji fitokimia
Uji
fitokimia
Uji aktivitas antibakteri
10000, 20000, 40000 ppm
Fraksinasi
(Kromatografi
kolom dan KLT)
Fraksi paling
aktif
Fraksi II
Lampiran 2 Perolehan rendemen ekstrak serbuk daun
S. trifasciata
Prain
Ulangan
Kadar
air
(%) Bobot
sampel
(g)
Bobot ekstrak
kasar (g)
Rendemen
(%)
1
7.4328 20.0113 2.8176 15.2052
2
7.4328 20.0296 3.0532 16.4616
3
7.4328 20.0383 3.2405 17.4639
4
7.4328 20.0237 2.7246 14.6943
5
7.4328 20.0772 2.5454 13.6912
Rerata
15.5032
Contoh perhitungan ulangan 1 hasil rendemen ekstrak serbuk
S. trifasciata
Prain.
Rendemen = Bobot ekstrak kasar
x 100 %
(1-Ka) x Bobot sampel
=
2.8176 g
100%
(1 - 0.0074328 ) x 20.0113 g
×
14
Lampiran 3 Perolehan rendemen hasil fraksinasi ekstrak
S. trifasciata
Prain.
Fraksi
Bobot
ekstrak
(mg)
Rendemen
(%)
1
50.1
2.16
2
42.1
1.82
3
30.2
1.30
4
32.6
1.47
5
53.8
2.32
6
39.6
1.71
7
18.6
0.80
8
13.8
0.59
9
33.8
1.46
10
54.8
2.37
Contoh perhitungan perolehan rendemen fraksi 1 ekstrak serbuk
S. trifasciata
Prain
Bobot sampel = 2.5 g
Kadar air serbuk rat-rata = 7.4328 %
Rendemen =
Bobot ekstrak
100%
(1-Ka) x Bobot sampel
×
=
50.1 mg
100%
(1 - 0.0743) x 2500 mg
×
AKTIVITAS ANTIBAKTERI FRAKSI AKTIF DAUN
LIDAH MERTUA (
Sansevieria trifasciata
Prain)
YANDITYA DWASTU GITASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
YANDITYA DWASTU GITASARI. Aktivitas Antibakteri Fraksi Aktif Daun
Lidah Mertua (Sanseviera trifasciata Prain). Dibimbing oleh IRMA HERAWATI
SUPARTO dan DONDIN SAJUTHI.
Lidah
mertua
(Sanseviera trifasciata
Prain) merupakan tanaman yang
berasal dari Afrika dan diindikasikan memiliki aktivitas antibakteri. Tujuan
penelitian ini adalah mengevaluasi potensi tanaman lidah mertua dalam
menghambat aktivitas bakteri
Staphylococcus aureus dan
Escherichia coli
menggunakan metode difusi agar cakram. Sampel daun diekstraksi dengan
menggunakan metode maserasi. Hasil pengujian aktivitas antibakteri ekstrak kasar
pada konsentrasi 1250, 2500, 5000, dan 10000 ppm tidak menunjukkan aktivitas
antibakteri terhadap bakteri uji. Ekstrak kasar yang didapat mengandung
flavonoid, steroid dan alkaloid. Ekstrak kasar selanjutnya difraksinasi dengan
menggunakan metode kromatografi kolom dengan nisbah pelarut kloroform:etil
asetat (1:6). Fraksinasi menghasilkan 10 fraksi. Kesepuluh fraksi diuji aktivitas
antibakterinya dengan konsentrasi 10000, 20000, dan 40000 ppm. Berdasarkan uji
aktivitas antibakteri yang dilakukan hanya terdapat 1 fraksi yang dapat
menghambat bakteri Gram positif (S. aureus), dan diduga metabolit lainnya tidak
menunjukkan aktivitas penghambatan pada bakteri uji.
ABSTRACT
YANDITYA DWASTU GITASARI. Antibacterial Activity of Active
Fractionated Extract of
Sansevieria trifasciata
Prain. Supervised by IRMA
HERAWATI SUPARTO and DONDIN SAJUTHI.
iii
AKTIVITAS ANTIBAKTERI FRAKSI AKTIF DAUN
LIDAH MERTUA (
Sansevieria trifasciata
Prain)
YANDITYA DWASTU GITASARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
:
Aktivitas antibakteri fraksi aktif daun lidah mertua (Sansevieria
trifasciata
Prain)
Nama
:
Yanditya
Dwastu Gitasari
NIM :
G44060871
Menyetujui,
Pembimbing
1
Pembimbing II
Dr, dr. Irma H Suparto, MS Prof. drh. Dondin Sajuthi, MST, PhD
NIP.19581123 198603 2002 NIP.19541027 197603 1001
Mengetahui
Ketua Departemen,
Prof.
Dr.
Ir.
Tun
Tedja
Irawadi,
MS
NIP.19501227 197603 2002
v
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah Yang Maha Esa atas berkat
dan rahmat yang dilimpahkan sehingga penulis dapat menyelesaikan skripsi ini.
Skripsi ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Februari
sampai Oktober 2010 di Laboratorium Kimia Anorganik dan Pusat Studi Satwa
Primata (PSSP) IPB.
Penulis mengucapkan terima kasih kepada Dr. dr. Irma H. Suparto, MS dan
Prof. drh. Dondin Sajuthi, MST, PhD selaku pembimbing yang telah banyak
memberikan arahan, motivasi, saran, dan solusi dari setiap permasalahan hingga
terselesaikannya skripsi ini. Selain itu, penulis juga mengucapkan terima kasih
kepada kedua orang tua mama dan bapak, kakak (Novan), dan sahabat-sahabat
(Noe, Saki. Nisa, Indri, Irma, Nova, Anna, dan Erika) yang telah membantu
penulis secara moril dan materil, serta dorongan semangat dan doa kepada penulis
selama menempuh masa studi, penelitian, dan penulisan skripsi ini.
Ucapan terimakasih juga penulis berikan kepada kak Willy P, SSi dan staf
Laboratorium Kimia Anorganik, Analitik, dan Organik atas segala fasilitas dan
bantuan yang telah diberikan kepada penulis selama berjalannya penelitian ini.
Selain itu, penghargaan juga penulis sampaikan kepada Ani kimia 43, bu Nunung,
atas segala diskusi dan saran yang telah diberikan kepada penulis berkaitan
dengan skripsi ini. Penulis berharap karya ilmiah ini kiranya dapat bermanfaat dan
sumbangan pemikiran baru bagi ilmu pengetahuan secara umum.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Kendal pada tanggal 17 Januari 1988. Penulis merupakan
anak kedua dari dua bersaudara dari Bapak Prihasto Whisnu dan Ibu Kundiyati.
Tahun 2006 penulis lulus dari SMAN 5 Karawang dan diterima di Institut
Pertanian Bogor (IPB) pada program studi Kimia FMIPA melalui jalur Undangan
Seleksi Masuk IPB (USMI).
v ii
DAFTAR ISI
Halaman
DAFTAR TABEL... ...
DAFTAR GAMBAR...
DAFTAR LAMPIRAN...
viii
viii
viii
PENDAHULUAN...
1
TINJAUAN PUSTAKA
Sansevieria trifasciata
Prain...
Bakteri ...
Antibakteri...
Ekstraksi dan Fraksinasi...
1
2
2
3
BAHAN DAN METODE
Bahan dan Alat...
Persiapan Sampel...
Penentuan Kadar Air...
Ekstraksi...
Uji Fitokimia...
Fraksinasi...
Uji Aktivitas Antibakteri...
3
3
3
4
4
5
5
HASIL DAN PEMBAHASAN
Kadar Air...
Ekstraksi...
Uji Fitokimia...
Aktivitas Antibakteri Ekstrak Kasar...
Fraksinasi Ekstrak Metanol...
Aktivitas Antibakteri Hasil Kromatografi Kolom...
5
6
6
6
7
7
SIMPULAN DAN SARAN
Simpulan...
Saran...
DAFTAR PUSTAKA...
9
9
9
DAFTAR TABEL
Halaman
1
Hasil uji fitokimia ekstrak daun
S. trifasciata
Prain...
2 Hasil uji fitokimia fraksi daun
S. trifasciata
Prain...
6
9
DAFTAR GAMBAR
Halaman
1 Tumbuhan
Sansevieria trifasciata
Prain...
2 Bakteri
Staphylococcus aureus...
3 Bakteri
Escherichia coli...
4 Perbandingan diameter hambat ekstrak kasar dengan
E. coli dan
S.
aureus...
5 Kromatogram KLT ekstrak daun
S. trifasciata
Prain dengan eluen
terbaik...
6 Perbandingan diameter daya hambat fraksi teraktif (fraksi A)...
7 Hasil pengamatan uji antibakteri obat standar amoksilin, trimetoprim
dan DMSO pada bakteri
E. coli...
8 Hasil pengamatan uji antibakteri obat standar amoksilin, trimetoprim
dan DMSO pada bakteri
S. aureus...
1
2
2
6
7
8
8
8
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian...
2 Perolehan rendemen ekstrak serbuk daun
S. trifasciata
Prain...
3 Perolehan rendemen hasil fraksinasi ekstrak
S. trifasciata
Prain...
4 Pola KLT hasil fraksinasi ekstrak
S. trifasciata
Prain...
12
13
14
1
PENDAHULUAN
Latar Belakang
Indonesia umumnya memiliki iklim tropis dan lembab. Hal ini memudahkan perkembangbiakan mikroorganisme, baik yang patogen maupun yang non patogen. Keadaan iklim yang demikian menyebabkan timbulnya banyak penyakit yang disebabkan oleh bakteri dan mikroorganisme lainnya.
Telah banyak penelitian-penelitian mengenai antibakteri yang dilakukan, akan tetapi saat ini muncul banyak masalah sulit yang dihadapi, yaitu terjadinya resistensi bakteri terhadap antibiotik yang digunakan (Volk & Wheeler 1993). Berkembangnya resistensi terhadap obat-obatan merupakan salah satu contoh proses alamiah yang tak pernah ada akhirnya yang dilakukan oleh organisme untuk beradaptasi terhadap keadaan lingkungan yang baru. Resistensi obat oleh suatu mikroorganisme dapat disebabkan oleh faktor yang memang sudah ada pada mikroorganisme itu sebelumnya atau mungkin juga faktor itu diperoleh kemudian (Pelczar & Chan 2005). Karena hal itulah, perlu terus dilakukan usaha untuk mencari antibakteri baru, terutama suatu bahan atau tanaman yang mudah tumbuh di Indonesia.
Salah satu tumbuhan yang diindikasikan dapat dijadikan alternatif sebagai antibakteri adalah tumbuhan Sansevieria atau biasa disebut dengan tumbuhan lidah mertua. Hal ini dikarenakan dalam beberapa penelitian, tumbuhan Sansevieria diketahui memiliki potensi sebagai zat antibakteri. Dold dan Cocks (2001), melaporkan bahwaSansevieria mengandung antibiotik yang dapat digunakan untuk menyembuhkan berbagai penyakit, antara lain influenza, luka akibat terkena pukulan, dan luka gigitan ular berbisa. Menurut Van Wyk et al. (1997), ekstrak S. hyacinthoides dapat dimanfaatkan sebagai obat sakit kepala, obat tetes sakit telinga, borok, bisul, dan obat diare. Penelitian berbagai ahli herbal seperti Lucas et al. (1999), menyatakan bahwa biji Sansevieria bersifat antibakteri yang efektif menekan Mycobacterium tuberculosis penyebab penyakit TBC. Afolayan et al (2008), telah melakukan uji antibakteri pada S. hyacinthoides dengan menggunakan bakteri uji Bacillus cereus, Staphylococcus epidermidis, S. aureus, Micrococcus kristinae, Escherichia coli, dan Pseudomonas aeruginosa. dengan konsentrasi 5.0, 2.0, 1.0,
0.5, dan 0.1 mg/ml. Karena hal itulah penelitian ini bertujuan melakukan uji aktivitas antibakteri fraksi ekstrakSansevieria terhadapS. aureusdanE. coli dengan spesies yang berbeda, yaitu jenis Sansevieria trifasciataPrain.
TINJAUAN PUSTAKA
Tumbuhan Sansevieria
Sansevieria atau lidah mertua adalah marga tanaman hias yang cukup populer sebagai penghias di dalam rumah karena tanaman ini dapat tumbuh dalam kondisi yang sedikit air dan cahaya matahari. Sansevieria memiliki daun keras, tegak, dengan ujung meruncing dengan panjang antara 30-120 cm, sedangkan lebarnya sekitar 2.5-8 cm. Daun Sansevieria sering digunakan sebagai variasi pada karangan bunga. Sansevieria termasuk ke dalam kelas Liliopsida (berkeping satu/monokotil) dan famili Agaveceae. Tumbuhan ini bahkan dapat bertahan hidup di negara yang memiliki empat musim sehingga banyak mengalami penyimpangan bentuk, corak, dan warna. Tumbuhan ini banyak tumbuh di daerah bagian utara dan timur di Afrika selatan (Van Wyket al. 1997). [image:31.612.366.463.587.680.2]Dalam uji fitokimia yang dilakukan oleh Yoshihiro et al. (1997), S. trifasciata mengandung karbohidrat, saponin, glikosida, dan steroid. Menurut Sastradipradja (1997) dan Departmen Kesehatan RI (1997), kandungan kimia yang terdapat dalam tumbuhan Sansevieria, antara lain saponin polifenol, kardenolin, kardamin, dan abamagenin. Warna daun Sansevieria beragam, mulai hijau tua, hijau muda, hijau abu-abu, perak, dan warna kombinasi putih kuning atau hijau kuning (Gambar 1). Motif alur atau garis-garis yang terdapat pada helai daun juga bervariasi, ada yang mengikuti arah serat daun, tidak beraturan, dan ada juga yang zig-zag.
Ditinjau berdasarkan jenisnyaSansevieria ada dua jenis, yaituSansevieria keturunan asli dan hasil persilangan/hibridasi yang bisa disebut dengan jenis Sansevieria hibrid. Dari bentuk hibrid ini, terciptaSansevieria dengan karakter dan fisik yang berbeda dari induknya. Mutasi Sansevieria juga dapat terjadi dari perbanyakan melalui stek daun (Van Wyket al.1997).
Sansevieria mampu menyerap polutan berbahaya yang terdapat di udara sebab Sansevieria mengandung bahan aktif pregnan glikosid yang berfungsi untuk mereduksi polutan menjadi asam organik, gula, dan asam amino, dengan demikian unsur polutan tersebut jadi tidak berbahaya lagi bagi manusia (Yoshihiroet al. 1997). Sansevieria juga menjadi objek penelitian tanaman penyaring udara NASA (National Aeronautics and Space Administration) untuk membersihkan udara di stasiun ruang angkasa. Berdasarkan riset yang dilakukan oleh Wolfereton Environmental Service (1999), menyatakan bahwa setiap helai daun Sansevieria bisa menyerap formaldehid sebanyak 0.938 g per jam. Riset lainnya dapat disimpulkan bahwa untuk ruangan seluas 100 m3 cukup ditempatkan S. trifasciataLaurentii dewasa sebanyak 5 helai dalam ruangan tersebut agar bebas polutan (Arnold 2004).
Bakteri
Bakteri merupakan organisme yang paling banyak terdapat di alam dibandingkan dengan organisme lainnya. Bakteri biasanya hanya berukuran 0.5-5 m, tetapi ada pula jenis yang memiliki diameter mencapai 0.3 mm. Bakteri dapat digolongkan menjadi dua kelompok, yaitu Gram positif dan Gram negatif yang didasarkan pada perbedaan struktur dinding sel. Bakteri Gram positif memiliki dinding sel yang terdiri atas lapisan peptidoglikan yang tebal dan asam teikoat. Sementara, bakteri Gram negatif memiliki lapisan luar, lipopolisakarida yang terdiri atas membran dan lapisan peptidoglikan yang tipis dan terletak pada periplasma (di antara lapisan luar dan membran sitoplasmik) (Atlas 1995).
Staphylococcus aureus merupakan bakteri Gram positif, tidak bergerak, tidak berspora, berbentuk bola, dapat ditemukan satu-satu atau berpasangan (Gambar 2). Ukuran Staphylococcus berbeda-beda tergantung kepada media pertumbuhannya. Staphylococcus memiliki diameter 0.5-1,0
[image:32.612.354.479.142.252.2]mm dengan koloni berwarna kuning. S. aureus tumbuh dengan optimum pada suhu 37oC dengan waktu pembelahan 0.47 jam. Bakteri ini biasanya terdapat pada saluran pernafasan atas dan kulit (Jawetzet al. 2001).
Gambar 2 BakteriStaphylococcus aureus (Sumber : www.hartoke.files.wordpress.com) Escherichia coli, atauE. coli, adalah salah satu jenis spesies utama bakteri Gram negatif (Gambar 3). Pada umumnya, bakteri yang ditemukan oleh Theodor Escherich ini dapat ditemukan dalam usus besar manusia. Kebanyakan E. coli tidak berbahaya, tetapi beberapa, sepertiE. coli tipe O157:H7, dapat mengakibatkan keracunan makanan yang serius pada manusia. E. coli banyak digunakan dalam teknologi rekayasa genetika. Biasa digunakan sebagai vektor untuk menyisipkan gen-gen tertentu yang diinginkan untuk dikembangkan. E. coli dipilih karena pertumbuhannya sangat cepat dan mudah dalam penanganannya (Jawetzet al. 2001).
Gambar 3 BakteriEscherichia coli (Sumber :www.astrographics.com)
Antibakteri
[image:32.612.359.480.454.562.2]3
kedua adalah antibakteri bakterisida yang bekerja dengan membunuh bakteri. Umumnya terdapat transisi antara kerja bakteriostatik dengan bakterisida. Ada beberapa antibakteri yang bersifat bakteriostatik dapat berubah menjadi bakterisida jika digunakan dalam dosis tinggi (Schunacket al. 1990).
Berdasarkan efektivitas kerjanya terhadap berbagai mikroorganisme maka senyawa antibakteri digolongkan menjadi dua kelompok, yaitu antibakteri berspektrum luas yang efektif terhadap berbagai jenis mikroorganisme dan antibakteri berspektrum sempit yang hanya efektif terhadap mikroorganisme tertentu (Volk & Wheeler 1988). Senyawa antibakteri dapat bekerja dengan berbagai macam cara, tergantung pada strukturnya, diantaranya menghambat sintesis molekul kecil esensial (contoh trimetoprim), menghambat sintesis dinding sel (contoh penisilin dan amoksilin), dan menghambat sintesis asam nukleat (misal bromodeoksiuridin) (Schunacket al. 1990).
Ekstraksi dan Fraksinasi
Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut (Sudjadi 1986).Metode ekstraksi yang digunakan pada percobaan kali ini adalah metode maserasi. Metode maserasi digunakan untuk melarutkan simplisia yang mengandung komponen kimia yang mudah larut dalam pelarut, tidak mengandung benzoin, tiraks, dan lilin. Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Selama proses maserasi dilakukan pengadukan dan penggantian pelarut setiap hari. Endapan yang diperoleh dipisahkan kemudian filtratnya dipekatkan (Sudjadi 1986).
Kromatografi kolom merupakan salah satu metode kromatografi yang dapat digunakan untuk fraksinasi ini merupakan cara yang terbaik untuk pemisahan campuran dalam jumlah besar (lebih dari 1 g). Campuran yang akan dipisahkan pada kromatografi kolom adalah berupa pita pada bagian atas kolom penjerap yang berada dalam tabung kaca, tabung logam, atau bahkan tabung plastik. Pelarut eluen dibiarkan mengalir melalui
kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan (Rouessac & Rouessac 2004).
BAHAN DAN METODE
Alat dan Bahan
Bahan yang digunakan dalam percobaan ini adalah daun Sansevieria trifasciata Prain dari kebun percobaan Kampus Lodaya IPB, kultur bakteri yang terdiri dariE. coli(ATCC 25922) danS. aureus(ATCC 25923). Media yang digunakan untuk pertumbuhan bakteri adalah Nutrient Agar (NA), larutan metanol 96%, larutan NaCl, kloroform, etil-asetat, n-heksana, diklorometan, metanol, eter, FeCl 1%, H2SO4 pekat, serbuk Mg, amil alkohol,HCl 2 N, pereaksi Mayer, pereaksi Dragendorf, pereaksi Wagner, pereaksi Lieberman-Buchard, dan akuades, Silika G 60 (E. Merck 230 400 mesh), pelat aluminium jenis silika gel G60F254, media Muller-Hinton, cakram kosong, standar amoksilin dan trimetoprim
Alat-alat yang digunakan antara lain, evaporator, kertas saring, jarum ose, mikropipet, pengaduk magnetik, pelat penangas botol timbang, oven, cawan porselein, plat penangas alat timbang, kolom pengemas, kapas bebas lemak atau wol kaca, pelat kromatografi lapis tipis (KLT), labu erlenmeyer, tabung reaksi, pipet volumetrik, dan autoklaf.
METODE
Preparasi Sampel
Daun Sansevieria sebagai sampel dibersihkan dengan air mengalir, kemudian dikeringkan dengan menggunakan tisu. Sampel dipotong-potong kecil kemudian dikeringkan dalam oven pada suhu 60o C selama 3 x 24 jam.
menit. Bobot cawan beserta ekstrak kering ditimbang dan dicatat nilainya. Pemanasan dan penimbangan diulang setiap 24 jam sampai didapat bobot konstan. Kadar air dihitung dengan cara berikut:
Kadar air (%) =
a b
a
−
X 100% dengan
a = bobot awal sample (g)
b = bobot akhir sampel setelah dioven (g)
Ekstraksi
Sampel yang telah dikeringkan dalam oven dihaluskan menggunakan blender sampai menjadi serbuk. Sampel kemudian ditimbang sebanyak 20 g. kemudian dimaserasi dengan menggunakan pelarut metanol 30% sebanyak 200 ml lalu didiamkan selama 3 x 24 jam. Sampel kemudian disaring sebanyak 3 kali dengan perbandingan yang sama. Filtrat yang didapatkan ditampung dalam labu erlenmeyer. Ekstrak yang terkumpul kemudian dievaporasi pada suhu 37°C hingga pelarut menguap. Sebagian ekstrak pekat digunakan pada uji fitokimia dan sebagian lagi digunakan untuk uji aktivitas antibakteri.
Rendemen ekstrak (%) = ×100% Keterangan :
a = bobot ekstrak (g) b = bobot sampel kering (g) ka = kadar air
Uji Fitokimia (Harborne 1987)
Uji saponin dan tanin
Sebanyak 1 g sampel diekstraksi dengan akuadestilata secukupnya kemudian dipanaskan dengan penangas air selama 5 menit. Campuran disaring dan filtrat dibagi ke dalam dua tabung reaksi. Bagian pertama, uji saponin filtrat didiamkan sampai agak dingin kemudian dikocok kuat sampai timbul busa. Bila busa stabil dalam 10 menit, maka filtrat positif mengandung sap