i
KERAGAMAN GENETIK
Pinus merkusii
Jungh. et de Vriese
STRAIN TAPANULI BERDASARKAN
PENANDA MIKROSATELIT
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
BOGOR 2013
ii
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi berjudul Keragaman Genetik Pinus merkusii Jungh. et de Vriese Strain Tapanuli berdasarkan Penanda Mikrosatelit adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2013
ii
i
ABSTRAK
I MADE MAYUN MAHA DIPUTRA. Keragaman Genetik Pinus merkusii Jungh. et de Vriese Strain Tapanuli berdasarkan Penanda Mikrosatelit. Dibimbing oleh ULFAH JUNIARTI SIREGAR
Pinus merkusii strain Tapanuli tumbuh alami di Tapanuli, ke arah Selatan Danau Toba, tetapi akibat intensitas penebangan yang tinggi populasinya semakin berkurang. Penelitian ini bertujuan mengetahui keragaman genetik strain Tapanuli dengan penanda mikrosatelit pada tiga populasi, yaitu Dolok Tusam Timur, Lobugala, dan Parinsoran. Sampel diekstraksi dengan metoda CTAB (cetyl trimethyl ammonium bromide) yang dimodifikasi dengan DNeasy plant mini kit, kemudian diamplifikasi menggunakan tujuh primer mikrosatelit spesifik P. merkusii, yaitu pm01, pm04, pm05, pm07, pm08, pm09a, dan pm12 yang dikembangkan dari strain Aceh. Hasil analisis menunjukkan bahwa tujuh primer tersebut dapat mengamplifikasi fragmen polimorfik dengan ukuran yang berbeda. Populasi Lobugala memiliki tingkat heterozigositas tertinggi (He=0.4693), disusul Dolok Tusam Timur (He=0.4614), dan Parinsoran (He=0.4316). Populasi Dolok Tusam Timur dan Lobugala memiliki hubungan kekerabatan paling jauh dengan jarak genetik 0.3798, sedangkan Lobugala dan Parinsoran memiliki hubungan kekerabatan paling dekat dengan jarak genetik 0.0617. Variasi genetik ketiga populasi tersebar sebanyak 81% di dalam populasi dan 18% di antara populasi.
Kata kunci: keragaman genetik, mikrosatelit, Pinus merkusii
ABSTRACT
I MADE MAYUN MAHA DIPUTRA. Genetic diversity of Pinus merkusii Jungh. et de Vriese of Tapanuli Strain based on Microsatellite Markers. Supervised by ULFAH JUNIARTI SIREGAR
Pinus merkusii of Tapanuli strain, which grows naturally in Tapanuli area to the south of Toba Lake, has decreased considerably due to intensive logging. This research aimed at investigating genetic diversity of strain Tapanuli Pine using microsatellite markers on its three populations, i.e. Dolok Tusam Timur, Lobugala, and Parinsoran. Leaf samples were extracted using combined CTAB (cetyl trimethyl ammonium bromide) and DNeasy plant mini kit, then amplified using seven specific microsatellite primers from P. merkusii Aceh strain, i.e. pm01, pm04, pm05, pm07, pm08, pm09a, and pm12. Those primers could amplify polymorphic fragments with different sizes than reported before. Estimation of genetic diversity parameters showed that Lobugala population has the highest heterozygosity (He = 0.4693) followed by Dolok Tusam Timur (He = 0.4614) and Parinsoran (He = 0.4316). Lobugala population was closely related to Parinsoran with 0.0617 genetic distance, and separated from Dolok Tusam Timur by 0.3798 genetic distance. Partition of genetic variation showed that 81% was found within population, and only 18% was among population.
iv
v Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
I MADE MAYUN MAHA DIPUTRA
KERAGAMAN GENETIK
Pinus merkusii
Jungh. et de Vriese
STRAIN TAPANULI BERDASARKAN
PENANDA MIKROSATELIT
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
vi
vii Judul Skripsi : Keragaman Genetik Pinus merkusii Jungh. et de Vriese
Strain Tapanuli berdasarkan Penanda Mikrosatelit Nama : I Made Mayun Maha Diputra
NIM : E44080010
Disetujui oleh
Dr Ir Ulfah Juniarti Siregar, MAgr Pembimbing
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
viii
ix
PRAKATA
Puji dan syukur penulis panjatkan kepada Ida Sang Hyang Widhi Wasa atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2011 sampai Agustus 2012 ini ialah Keragaman Genetik Pinus merkusii Jungh. et de Vriese Strain Tapanuli berdasarkan Penanda Mikrosatelit.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Ulfah Juniarti Siregar, MAgr selaku pembimbing dan Ibu Dr Ir Arum Sekar Wulandari, MS yang telah banyak memberi saran dalam penulisan skripsi ini. Di samping itu, penghargaan penulis sampaikan kepada SEAMEO BIOTROP khususnya bagian Common Laboratory Mbak Anidah yang telah membantu dan memfasilitasi terlaksananya kegiatan penelitian ini dan PT. Angkasa Pura yang memberikan beasiswa bakat dan prestasi. Kepada Kak Ranny, Jumadin Sidabutar, Bapak Alfan Gunawan, Satryo Wibisono, Kak Dika, dan Kak Laswi yang telah banyak membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada Bapak tercinta Wayan Wage, Ibu tercinta Nyoman Swarsini, Kakak tercinta I Putu Mayun Eka Atmaja dan Ni Made Setianingsih, Adik tercinta I Nyoman Mayun Tri Sanjaya dan Ketut Mayun Sinta Septiari, keponakan tercinta Gede Giovalenra Maystha Angelo, sahabat seperjuangan Indra Prastha (IP), yaitu Yudha, Dedot, Wira, Joni, Yoga, Didi, Bli Manu, Gde, dan Ajik, sahabat-sahabat terbaik KMHD IPB angkatan 45 dan Brahmacarya Bogor angkatan 2008, teman-teman Departemen Silvikultur angkatan 2008, serta seluruh pihak yang telah menyemangati dan selalu mendoakan yang terbaik bagi penulis.
Semoga skripsi ini bermanfaat.
Bogor, Maret 2013
x
v
Pinus merkusii Jungh. et de Vriese 2
Klasifikasi dan Penyebaran 2
Polymerase Chain Reaction (PCR) Mikrosatelit 13
Elektroforesis Gel Polyacrylamide 14
Visualisasi DNA 15
Analisis Data 15
HASIL DAN PEMBAHASAN
Ekstraksi DNA 16
Hasil PCR dengan Primer Mikrosatelit Spesifik P. merkusii 18 Analisis Keragaman Genetik P. merkusii Strain Tapanuli 20
Keragaman Genetik dalam Populasi 20
Keragaman Genetik antar Populasi 23
vi
vi
vi
DAFTAR TABEL
1 Tiga lokasi pengambilan sampel daun pinus di Tapanuli 9
2 Susunan bahan buffer ekstrak CTAB 11
3 Susunan bahan larutan buffer TE (tris-EDTA) 11 4 Susunan bahan larutan buffer TAE (tris-acetic-EDTA)
50 kali 12
5 Pasangan primer mikrosatelit yang digunakan
(Nurtjahjaningsih et al. 2005) 13
6 Susunan bahan mix PCR mikrosatelit dalam 1 kali reaksi 14
7 Tahapan dan kondisi reaksi PCR 14
8 Komposisi bahan-bahan gel polyacrylamide 6% 14 9 Ukuran fragmen mikrosatelit pada P. merkusii strain
Tapanuli 19
10 Keragaman genetik P. merkusii pada 3 populasi yang diteliti 20 11 Keragaman genetik beberapa jenis pinus 23 13 Jarak genetik Nei (1972) antar populasi P. merkusii 23 14 Analysis of molecular variance (AMOVA) dari 3 populasi
P. merkusii menggunakan 7 lokus mikrosatelit 25 15 Diferensiasi genetik (FST) beberapa jenis pinus 27
DAFTAR GAMBAR
1 Tahapan proses PCR 8
2 Peta lokasi pengambilan sampel daun pinus di Tapanuli 9
3 Bagan tahapan penelitian 10
4 Cara scoring DNA mikrosatelit. 15
5 Contoh kemurnian pita DNA hasil ekstraksi dengan metode CTAB (garis melingkar kuning = DNA; garis melingkar biru = RNA; garis melingkar hijau = kotoran bahan-bahan
kimia) 16
6 Contoh kemurnian pita DNA hasil ekstraksi dengan metode DNeasy plant mini kit dari QIAGEN (garis melingkar
8 Foto hasil amplifikasi DNA dengan tujuh primer spesifik P.
merkusii pada gel polyacrylamide 6% 19 9 Kondisi tempat pengambilan sampel di lapangan: (a) Dolok
Tusam Timur, (b) Parinsoran, (c) Lobugala 22 10 Dendogram hubungan antara 3 populasi P. merkusii
vii
DAFTAR LAMPIRAN
1 Alat-alat yang digunakan dalam penelitian 32 2 Hasil analisis data dengan software Arlequin versi 3.5
(Excoffier et al. 2011) 33
3 Hasil analisis FST dengan software Fstat versi 2.9.3.2
1 yang kurang subur seperti padang alang-alang. Sifatnya yang cepat tumbuh membuat pinus ini tidak memerlukan tempat tumbuh dengan persyaratan khusus. Berdasarkan sebaran geografis alaminya berada di tiga lokasi di wilayah Utara Sumatera, yaitu Aceh, Kerinci, dan Tapanuli, yang menurut Lamb dan Colling (1967) membentuk strain, Cooling (1968) menyebutnya provenansi, sedangkan Armizon et al. (1995) menamakannya galur P. merkusii. Strain Tapanuli menyebar di daerah Tapanuli, ke arah Selatan Danau Toba. Tegakan pinus alam terdapat di pegunungan Dolok Tusam, Batu Manumpak, Sialogo, Habinsaran, Dolok Sibualbuali, Dolok Sipirok, Sipagimbar, Padang Mandailing, dan Dolok Pardumahan. Pada perbukitan Dolok Saut tegakan tusam bercampur dengan pohon daun lebar dengan ketinggian tempat 1 000–1 500 m dpl (Siregar 2005).
Saat ini ekosistem daratan Tapanuli mengalami beberapa tekanan kuat yang berpotensi menghilangkan keberadaan sumberdaya hutan yang ada, seperti gangguan tanah longsor, gempa bumi, serta ilegal logging dan pembakaran hutan (Anonim 2009). Usaha pelestarian dan pembangunan hutan yang kurang serta intensitas kegiatan penebangan yang tinggi pada daerah-daerah penyebaran alami di Tapanuli Utara dan Selatan mengakibatkan populasi pinus strain Tapanuli semakin berkurang. Sementara itu banyak kegiatan penghijauan dan reboisasi, salah satunya Gerhan, yang menggunakan strain Aceh, sehingga dapat menjadi ancaman bagi potensi genetik strain Tapanuli (Aswandi 2011), misalnya berdampak pada perubahan frekuensi gen strain Tapanuli akibat adanya strain lain yang tumbuh pada tempat tumbuh alaminya. Perubahan frekuensi gen melalui migrasi akan mempengaruhi tingkat keragaman genetik suatu populasi. Dengan demikian perlu dilakukan penelitian tentang keragaman genetik menggunakan marka DNA sehingga upaya pelestarian dan pembangunan hutan, serta konservasi basis genetik strain Tapanuli dapat berjalan dengan maksimal.
Informasi tentang keragaman genetik sangat penting diketahui untuk pengembangan tanaman di masa depan, seperti bahan seleksi genotip yang dikehendaki, pendugaan hubungan kekerabatan (hubungan filogenetis), dan penentuan asal-usul ataupun penggolongan suatu spesies dalam taksonomi. Informasi genetik yang mendalam sangat membantu dalam pengambilan keputusan konservasi untuk mempertahankan suatu spesies di alam terutama pada spesies-spesies yang terancam punah agar tetap lestari. Variasi genetik yang tinggi akan berpengaruh pada kelestarian keanekaragaman hayati. Suatu populasi mampu beradaptasi terhadap berbagai perubahan yang terjadi di lingkungan sekitarnya karena didukung oleh variasi genetik yang dimiliki oleh populasi tersebut.
2
2 menggunakan penanda molekuler karena bersifat stabil dan tidak terpengaruh lingkungan. Dewasa ini telah berkembang berbagai jenis penanda molekuler diantaranya ialah RAPD (random amplified polymorfik DNA), RFLP (restriction fragment length polymorphism), isoenzim, dan SSR (simple sequence repeat) atau mikrosatelit.
Mikrosatelit adalah salah satu metode penanda genetik yang bersifat kodominan sehingga dapat mendeteksi keragaman alel pada level yang tinggi, mudah dan ekonomis dalam penerapannya karena menggunakan proses PCR (polymerase chain reaction). Mikrosatelit paling banyak digunakan secara luas untuk pemetaan genetik, analisis keragaman genetik, dan studi evolusi. Marka atau penanda ini muncul sebagai marka yang sangat variatif dan mudah diulang, menjadikan sangat ideal untuk pemetaan genom (Prasetiyono et al. 2004).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keragaman genetik P. merkusii strain Tapanuli di dalam dan antar populasi Dolok Tusam Timur, Lobugala, dan Parinsoran.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menambah informasi tentang keragaman genetik di dalam dan di antara populasi Dolok Tusam Timur, Lobugala, dan Parinsoran, serta dapat mengetahui persentase sebaran variasi genetik dan nilai indeks fiksasi (FST) untuk kegiatan pembangunan dan pelestarian
hutan, serta konservasi sumberdaya genetik P. merkusii strain Tapanuli.
TINJAUAN PUSTAKA
Pinus merkusii Jungh. et de Vriese
Klasifikasi dan Penyebaran
P. merkusii pertama sekali ditemukan dengan nama tusam di daerah Sipirok, Tapanuli Selatan oleh seorang ahli botani dari Jerman, yaitu Dr F. R. Junghuhn pada tahun 1841. Jenis ini tergolong jenis cepat tumbuh dan tidak membutuhkan persyaratan khusus. Keistimewaan jenis ini ialah satu-satunya jenis pinus yang menyebar secara alami ke Selatan khatulistiwa sampai 2 °LS (Harahap 2000).
3
Kingdom : Plantae
Sub kingdom : Tracheobionta Sub divisi : Spermatophyta
Spesies : P. merkusii Jungh. et de Vriese
Deskripsi Botani
Pohon pinus memiliki tajuk yang umumnya berbentuk piramida dan bentuk ini terlihat nyata sekali pada waktu muda. Pada keadaan yang kurang baik tajuk terlihat agak mendatar atau berbentuk payung terbuka. Daun pinus berbentuk seperti jarum sehingga disebut pohon daun jarum. Daun-daun ini berpasangan dalam satu ikatan yang terdiri dari dua jarum dalam satu fasikel yang dibungkus oleh suatu selaput tipis 3 mm sampai 10 mm. Panjang daun antara 12–25 cm sedangkan lebar daun 1–2 mm dengan bentuk penampang segitiga dan lancip dibagian ujung. Panjang daun berbeda dan menurut Cooling (1968) panjang daun dapat dijadikan sebagai pembeda provenans.
P. merkusii termasuk pohon berukuran sedang, berumah satu, dan tingginya hingga 15–45 m. Batang utama lurus dalam tegakan rapat, bebas cabang sampai 10–25 m, berdiameter hingga 100–140 cm, dan tidak berbanir tetapi di bagian pangkal melebar. Kulit batang berwarna coklat tua agak kelabu, kasar, beralur dalam dan menyerpih dalam keping-keping panjang lurus dan juga bengkok, tetapi di Tapanuli ditemukan kulit batang yang licin, jarang beralur dalam, tipis, dan berwarna muda (Soerianegara dan Djamhuri 1979).
Kegunaan dan Manfaat
Kayu pinus masih sangat berperan dalam kehidupan manusia karena memiliki banyak manfaat, yaitu sebagai bahan bangunan untuk rumah, korek api, pulp, dan kertas. Teras kayu dapat dijadikan untuk penyulut kayu bakar yang banyak digunakan di daerah pegunungan yang berhawa sejuk/dingin. Hasil turunan dari getah pinus juga banyak dimanfaatkan, yaitu gondorukem untuk bahan pembuat sabun, resin, dan cat sedangkan terpentin digunakan untuk bahan industri parfum, obat-obatan, dan desinfektan. Bagian kulit kayu dapat dimanfaatkan sebagai bahan bakar dan abunya digunakan untuk bahan campuran pupuk, karena mengandung kalium (Dahlian dan Hartoyo 1997).
Keragaman Genetik
4
4 genetik dapat diwariskan kepada keturunannya dan terjadi karena adanya rekombinasi genetik sebagai akibat adanya persilangan-persilangan dan mutasi.
Beberapa keragaman yang dapat dijumpai dalam suatu jenis pohon, yaitu keragaman geografis (antar provenans), keragaman lokal (antar tempat tumbuh, antar tapak), keragaman antar pohon, dan keragaman di dalam pohon. Finkeldey (2005) berpendapat bahwa keragaman genetik suatu jenis tanaman dapat dievaluasi pada dua tingkatan, yaitu keragaman dalam populasi (intra-population) dan keragaman antar populasi (inter-population). Keragaman genetik dalam populasi dapat diukur dari nilai heterozigitas individual. Adapun ukuran-ukuran yang sering digunakan untuk mencirikan variasi genetik dalam populasi ialah persentase lokus polimorfik (PLP), jumlah alel yang diamati (na), jumlah alel yang efektif (ne), dan heterozigositas harapan (He), sedangkan keragaman genetik antar populasi dapat diukur dari jarak genetik, diferensiasi genetik (Gst), dan analisis gerombol.
Dua sebab utama yang menyebabkan keragaman, yaitu perbedaan lingkungan (environmental variation) dan perbedaan susunan genetik yang diturunkan dari tetua kepada keturunannya (genetic variation). Adanya keragaman dalam suatu jenis perlu diketahui terlebih dahulu sebelum memulai pemuliaan pohon, karena adanya keragaman genetik merupakan prasyarat mutlak dalam pemuliaan, yaitu untuk memungkinkan seleksi dan untuk mencegah dihasilkannya tanaman yang tidak bermutu (Soerianegara dan Djamhuri 1979). Finkeldey (2005) menjelaskan bahwa keragaman genetik pada suatu populasi dipengaruhi oleh beberapa faktor, yaitu mutasi dan aliran gen yang meningkatkan keragaman genetik, sedangkan faktor yang menurunkan keragaman genetik ialah seleksi dan hanyutan genetik.
Tingkat keragaman genetik merupakan suatu indikasi atas kemampuan beradaptasi tanaman terhadap lingkungan tumbuhnya. Siregar (2000) mengungkapkan bahwa pada pohon-pohon hutan, keberadaan keragaman genetik yang berbeda dalam populasi bertanggung jawab terhadap perbedaan tingkat adaptasi dan kapasitasnya untuk beradaptasi terhadap perubahan lingkungan karena pohon-pohon tidak mampu untuk berpindah dan berumur panjang. Jenis tanaman yang mempunyai sebaran alam yang luas akan mempunyai keragaman genetik yang tinggi, karena eksistensi tanaman pada suatu lingkungan tumbuh merupakan manifestasi kemampuan jenis tersebut tumbuh dan berkembang dalam lingkungan tumbuh yang ada (Hartl dan Clark 1989).
5
Penanda Genetik
Sifat tanaman dapat diidentifikasi berdasarkan sifat fenotip dan genotip. Identifikasi tanaman berdasarkan sifat fenotip dapat melalui morfologi tanaman antara lain tinggi tanaman, bentuk batang, panjang daun, warna, rambut daun, serta ukuran dan bentuk organ lainnya. Cara ini memiliki kelemahan, yaitu adanya pengaruh lingkungan di sekitarnya. Sifat fenotip dipengaruhi oleh dua faktor, yaitu genotip dan lingkungan, dengan demikian alternatif lain ialah penelusuran sifat tanaman dari segi genotip tanaman melalui analisis DNA.
Keragaman genetik tanaman dapat diketahui melalui analisis DNA. Keragaman genetik dapat dianalisis menggunakan teknik penanda genetik sebagai alat bantu mengidentifikasi genotip suatu individu. Beberapa manfaat penting dari penanda genetik ialah sebagai alat pembantu dalam identifikasi hibrid, identifikasi klon, penelitian sistem reproduksi yang mencangkup sistem perkawinan dan aliran gen, pembuktian pengaruh seleksi dan identifikasi QTL (quantitative trait loci), serta pengukuran variasi genetik di dalam dan antar populasi. Saat ini sudah terdapat banyak jenis penanda genetik yang telah teridentifikasi. Penanda genetik yang dipilih ialah penanda yang terpaut dengan sifat/karakter yang menjadi sasaran penelitian. Penanda genetik yang sering digunakan dalam genetika hutan, yaitu polimorfisme morfologi, sifat-sifat warna, produksi metabolisme sekunder, isoenzim, dan penanda DNA (Finkeldey 2005).
Penanda atau marka dapat digolongkan menjadi tiga, yaitu marka morfologis, marka sitologi, dan marka molekuler. Penanda morfologis digunakan sejak awal genetika untuk mendeskripsikan taksonomi karena lebih mudah, lebih cepat, sederhana, dan lebih murah. Walaupun mudah dan masih dipakai (biasanya digunakan untuk mengontrol berhasilnya suatu persilangan) akan tetapi penanda ini dapat dipengaruhi oleh lingkungan sehingga dianggap tidak stabil (Wulandari 2008).
Asiedu (1989) dalam Aritonang et al. (2007) menyebutkan bahwa penanda sitologi digunakan untuk membantu pemuliaan tanaman melalui ukuran kromosom, rasio tangan kromosom, dan pola pita teknik-teknik pewarnaan kromosom. Penggunaan penanda sitologi khususnya pola pita kromosom dimungkinkan pada spesies-spesies tanaman yang mempunyai kromosom dengan ukuran yang lebih besar misalnya pada tanaman gandum. Penanda molekuler bersifat stabil karena DNA bersifat kekal dan tidak terpengaruh lingkungan.
Penelitian pada tingkat molekuler dapat menggunakan salah satu metode penanda genetik, yaitu penanda genetik mikrosatelit. Mikrosatelit yang dikenal dengan simple sequence repeats (SSRs) merupakan kelas terkecil dari sekuen berulang (Anonim 2011 dalam Fahmi 2011). Mikrosatelit merupakan rangkaian pola nukleotida antara dua sampai enam pasang basa yang berulang secara berurutan dan mempunyai karakteristik tingkat polimorfisme yang tinggi, kodominan dan diwariskan mengikuti hukum Mendel (Weising et al. 2005). Bila satu primer yang spesifik telah didesain, lokus SSR dapat diamplifikasi dari sedikit sample DNA dengan PCR (Ujino et al. 1998 diacu dalam Zulfahmi 2006). Mikrosatelit diamplifikasi menggunakan teknik PCR dengan beberapa pasang mikrosatelit (Anonim 2011 dalam Fahmi 2011).
6
6 simple tandem repeat polymorphism (STRP), karena perbedaan genetik di antara molekul-molekul DNA yang mengandung sejumlah kopi sekuen DNA pendek yang diulang beberapa kali. STRP yang memiliki pengulangan 2–9 pasang basa sering disebut mikrosatelit, sedangkan STRP dengan pengulangan 10–60 pasang basa sering disebut minisatelit atau variable number of tandem repeats (VNTR).
Marka ini telah terbukti lebih efektif baik untuk pengorganisasian materi genetik berdasarkan jarak genetik, pemetaan gen, dan dalam pengimplementasian program pemuliaan yang lebih efisien. Mikrosatelit biasa digunakan untuk menguji kemurnian galur, studi filogenetik, lokus pengendali sifat kuantitatif, dan forensik. Selain itu mikrosatelit telah diaplikasikan untuk diagnosis dan identifikasi penyakit, studi populasi genetik dan efek leher botol (bottlenecks effect), konservasi biologi untuk mengamati perubahan dalam populasi, pengaruh fragmentasi dan interaksi populasi yang berbeda, serta untuk identifikasi populasi yang baru terbentuk.
Korzun (2003) menjelaskan keuntungan menggunakan mikrosatelit, yaitu metode relatif sederhana dan dapat dilakukan secara otomatis, kebanyakan marker monolokus dan mengikuti warisan hukum Mendel, memiliki kandungan informasi lebih mendalam, pasangan primer mikrosatelit tersedia di pasaran dalam jumlah yang besar, lebih efektif dalam biaya untuk setiap genotip dan primer (sama dengan RAPD). Kekurangan penggunaan mikrosatelit adalah kesulitan kloning dan sequencing daerah flanking SSRs. Daerah flanking ini relatif spesifik untuk tiap spesies (Anonim 2011 dalam Fahmi 2011). Selain itu Powell et al. 1996 dalam Azrai 2005 memaparkan bahwa marka SSR tidak tersedia pada semua spesies tanaman sehingga untuk merancang primer baru membutuhkan waktu yang lebih lama dan biaya cukup mahal.
Elektroforesis
Elektroforesis adalah suatu teknik pemisahan makromolekul (enzim atau protein) dalam suatu larutan yang memiliki pH tertentu dan dialiri aliran listrik. Kecepatan relatif perpindahan makromolekul pada medium dapat mengungkapkan bentuk-bentuk yang berbeda dari enzim yang memiliki aktivitas katalik reaksi yang sama. Perbedaan kecepatan migrasi tersebut tergantung pada besarnya muatan listrik dari gugus-gugus yang terionisasi di permukaan partikel dan besarnya tergantung kepada kekuatan ionik dan pH medium serta ukuran dan bentuk partikel enzim atau protein yang berkaitan langsung dengan susunan asam amino dari peptida yang membentuknya. Sargent dan George (1975) dalam Siregar et al. (2004) menyatakan bahwa migrasi partikel bermuatan pada medan listrik bergantung pada sifat partikel yang bermuatan, medan listrik, dan larutan penyangga (buffer).
7
PCR (polymerase chain reaction)
Polymerase chain reaction (PCR) adalah suatu teknik sintesis dan amplifikasi DNA secara in vitro. Teknik ini pertama kali dikembangkan oleh Karry Mullis pada tahun 1985. Teknik PCR dapat digunakan untuk mengamplifikasi segmen DNA dalam jumlah jutaan kali hanya dalam beberapa jam. Proses PCR melibatkan beberapa tahap, yaitu pra-denaturasi DNA templat, denaturasi DNA templat, penempelan primer pada templat (annealing), pemanjangan primer (extension), dan pemantapan (postextension). Tahapan denaturation, annealing, dan extension merupakan tahapan berulang (siklus) dimana pada setiap siklus terjadi duplikasi jumlah.
Proses PCR yang terjadi secara berulang dapat menduplikasi DNA target untai ganda dalam jumlah yang banyak. Untai ganda DNA templat (unamplified DNA) dipisahkan dengan denaturasi termal dan kemudian didinginkan hingga mencapai suatu suhu tertentu untuk memberi waktu pada primer menempel (anneal primers) pada daerah tertentu dari target DNA. Suryanto (2011) juga mengungkapkan bahwa proses penempelan primer pada utas DNA yang sudah terbuka memerlukan suhu optimum, sebab suhu yang terlalu rendah menyebabkan primer menempel pada sisi lain genom yang bukan sisi homolognya. Peristiwa ini dapat menyebabkan teramplifikasi banyak daerah yang tidak spesifik dalam genom tersebut. Polimerase DNA digunakan untuk memperpanjang primer (extend primers) dengan adanya dNTPs (dATP, dCTP, dGTP dan dTTP) dan buffer yang sesuai. Umumnya keadaan ini dilakukan antara 20–40 siklus DNA (Handoyo et al. 2001). Tahapan proses PCR dapat dilihat pada Gambar 1.
Proses penggandaan sejumlah molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan nukleotida yang posisinya diapit sepasang primer. Proses PCR melibatkan serangkaian siklus temperatur yang berulang dan masing-masing siklus terdiri atas tiga tahapan, yaitu tahap peleburan (denaturation), tahap penempelan (annealing), dan tahap pemanjangan (extension).
8
8
Gambar 1 Tahapan proses PCR
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian analisis DNA dilaksanakan dari bulan Oktober 2011 sampai Agustus 2012. Penelitian ini dilakukan di Common Laboratory SEAMEO BIOTROP.
Bahan dan Alat Penelitian
9
Lobugala berada di luar kawasan hutan lindung Dolok Tusam Barat, juga terdapat banyak aktivitas perladangan. Informasi ketiga lokasi disajikan pada Tabel 1 dan letak lokasi pada Gambar 2.
Tabel 1 Tiga lokasi pengambilan sampel daun pinus di Tapanuli
No Populasi Kecamatan Kabupaten Provinsi
Koordinat Geografis
Gambar 2 Peta lokasi pengambilan sampel daun pinus di Tapanuli
10
10 Bahan-bahan yang digunakan dalam visualisasi DNA di gel polyacrylamide ialah: gel polyacrylamide 6%, buffer TBE (tris-base-EDTA), larutan fiksasi (asam asetat 10%), larutan staining/pewarna, larutan developer, dan aquadest. Alat-alat yang digunakan dalam penelitian ini dapat dilihat secara lengkap pada Lampiran 1.
Prosedur Penelitian
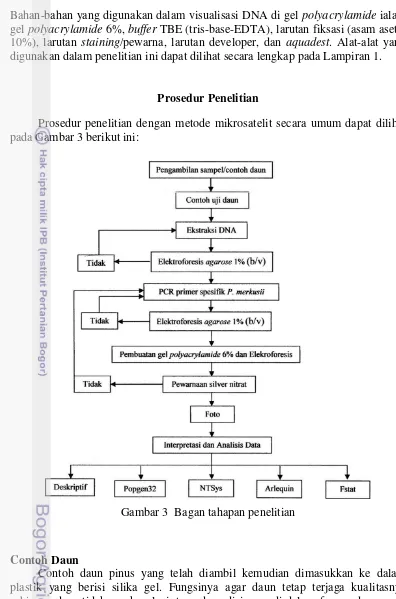
Prosedur penelitian dengan metode mikrosatelit secara umum dapat dilihat pada Gambar 3 berikut ini:
Gambar 3 Bagan tahapan penelitian
Contoh Daun
Contoh daun pinus yang telah diambil kemudian dimasukkan ke dalam plastik yang berisi silika gel. Fungsinya agar daun tetap terjaga kualitasnya sehingga daun tidak rusak, selanjutnya daun disimpan di dalam freezer dan segera dilakukan ekstraksi apabila dikeluarkan dari freezer.
Ekstraksi DNA
11
menggunakan metode CTAB (cetyl trimethyl ammonium bromide) untuk mendapatkan DNA murni. Sebanyak 0.5 gram sampel daun pinus yang masih segar dimasukkan ke dalam mortar yang bersih, kemudian ditambahkan nitrogen cair dan secepatnya digerus sampai halus. Hasil gerusan berupa serbuk halus dimasukkan ke dalam tube berukuran 2 mL dan ditambahkan 1 mL buffer ekstrak dan 10 µL β-mercaptoethanol. Selanjutnya tube dihomogenkan menggunakan vortex agar jaringan daun dengan larutan buffer tercampur dengan baik. Pada Tabel 2 diperlihatkan susunan buffer ekstrak CTAB yang digunakan.
Tabel 2 Susunan bahan buffer ekstrak CTAB
Bahan buffer ekstrak CTAB Volume untuk 50 mL
1. CTAB 10%
Proses setelah dihomogenkan dengan menggunakan vortex, dilanjutkan dengan inkubasi selama 30 menit di dalam water bath dan setiap 5 menit sekali dibolak-balik atau dihomogenkan. Suhu optimal yang digunakan dalam proses inkubasi ialah 65 °C. Apabila proses inkubasi telah selesai maka tube diangkat dan didinginkan selama 15 menit, kemudian disentrifuge selama 10 menit dengan suhu 20 °C dan kecepatan 12 000 rpm. Sentrifuge dilakukan untuk memisahkan bahan-bahan kimia atau fase organik dari fase cair berupa supernatan. Bagian supernatan diambil untuk selanjutnya dipurifikasi dengan menambahkan 750 µL fenol:kloroform:isoamilalkohol (25:24:1) kemudian dihomogenkan menggunakan vortex dan disentrifuge kembali dengan waktu, suhu, dan kecepatan yang sama. Tahap ini dilakukan sebanyak 2 kali hingga supernatan yang diperoleh bersih dan murni. Supernatan yang sudah murni kemudian ditambahkan kloroform:isoamilalkohol (24:1) sebanyak 1 mL, dihomogenkan dan disentrifuge kembali, supernatan dipindahkan ke tube baru. Tahap ini juga dilakukan sebanyak 2 kali hingga supernatan yang diperoleh benar-benar bersih dan murni.
Supernatan yang bersih dan murni ditambahkan isopropanol dingin sebanyak 1 kali volume supernatan, kemudian didinginkan dalam freezer dengan suhu –20 °C minimal 30 menit. Hasil pengendapan berupa pelet DNA melalui sentrifuge dengan kecepatan 12 000 rpm, suhu 20 °C selama 10 menit selanjutnya dicuci dengan etanol 70% sebanyak 500 µL. Pelet yang telah tercuci divacum selama 30 menit untuk menghilangkan bau alkohol. Pelet yang sudah kering diberikan buffer TE sebanyak 100 µL. Pelet DNA yang sudah dilarutkan dengan buffer TE siap diuji kualitasnya. Pada Tabel 3 diperlihatkan secara jelas susunan larutan buffer TE (Tris-EDTA) yang digunakan dalam penelitian ini.
Tabel 3 Susunan bahan larutan buffer TE (tris-EDTA)
Bahan larutan buffer TE (tris-EDTA) Volume untuk 100 mL
12
12 Penelitian ini juga dilakukan metode ekstraksi DNA dengan menggunakan DNeasy plant mini kit dari QIAGEN. Sebanyak 100 mg serbuk halus sampel yang telah digerus menggunakan nitrogen cair dimasukkan ke dalam tube 2 mL kemudian ditambahkan 400 µL buffer AP1 dan 4 µL RNAse A. Campuran ini dihomogenkan dengan menggunakan vortex selama 2 menit, diinkubasi selama 10 menit dengan suhu 65 °C di dalam water bath. Pada tahap ini sampel dihomogenkan dengan cara dibolak-balik setiap 2 menit sekali. Sampel yang telah diinkubasi lalu didinginkan selama 2 menit, kemudian ditambahkan buffer AP2 sebanyak 130 µL dan tube disimpan selama 5 menit di dalam batu es yang telah dihancurkan. Proses berikutnya dilakukan pemisahan supernatan dengan sentrifuge selama 10 menit, kecepatan 12 000 rpm, dan suhu 5 °C. Supernatanyang diperoleh kemudian dimasukkan ke dalam QIA Shredder mini spin column dan kembali disentrifuge dengan kecepatan 12 000 rpm, suhu 5 °C selama 2 menit. Supernatan yang sudah bersih dimasukkan ke dalam tube 2 mL, ditambahkan buffer AP3 sebanyak 1.5 kali volume supernatan lalu dihomogenkan. Setelah homogen kemudian ditransfer ke dalam DNeasy mini spin column, disentrifuge selama 1 menit dengan kecepatan 8 000 rpm, dan suhu 5 °C. Cairan yang berada di bawah column hasil sentrifuge dibuang dan pada column ditambahkan buffer AW sebanyak 500 µL lalu disentrifuge dengan kecepatan 8 000 rpm, suhu 5 °C selama 2 menit. Cairan hasil sentrifuge pada tahap ini selanjutnya dibuang. Tahap akhir ialah tahap elusi, yaitu buffer AE ditambahkan sebanyak 100 µL ke dalam column sebelumnya, diamkan selama 5 menit pada suhu ruang, lalu disentrifuge 8 000 rpm, suhu 5 °C selama 1 menit. DNA yang diperoleh dari tahap elusi siap diuji kualitas.
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan elektroforesis pada gel agarose 1% (b/v), yaitu agarose sebanyak 0.4 gram dilarutkan ke dalam 40 mL buffer TAE 1 kali. Buffer TAE 1 kali dibuat dari 20 mL buffer TAE 50 kali (Tabel 4) yang dilarutkan dalam aquadest sebanyak 980 mL. Campuran agarose dalam buffer TAE 1 kali dihomogenkan dengan stirer dan dipanaskan. Setelah warna menjadi bening, agarose didinginkan dan kemudian ditambahkan SYBR Safe DNA gel stain sebanyak 4 µL. Campuran dihomogenkan dengan stirer kembali namun tidak dipanaskan agar SYBR Safe DNA gel stain tercampur merata. Agarose selanjutnya dituang pada cetakan dan ditunggu hingga mengeras. Larutan DNA dari tahap ekstraksi diambil sebanyak 5 µL yang kemudian ditambahkan dengan 1 µL loading dye dan dimasukkan ke dalam sumur gel. Loading dye yang digunakan terdiri dari bahan sukrosa 20%, bromofenol blue, dan cylene cyanol. Larutan DNA yang sudah tertuang semua kemudian dielektroforesis dengan tegangan 75 Volt. Hasil running kemudian divisualisasikan di bawah cahaya UV dan difoto di dalam KODAK gel logic 200 hingga pita DNA terlihat jelas.
Tabel 4 Susunan bahan larutan buffer TAE (tris-acetic-EDTA) 50 kali
13
Polymerase Chain Reaction (PCR) Mikrosatelit
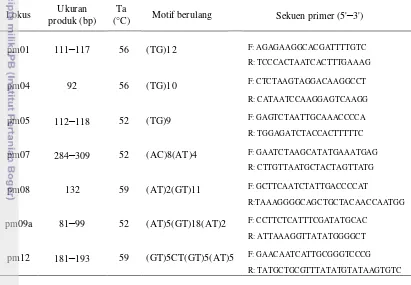
Primer yang menghasilkan pita atau jumlah amplifikasi terbanyak selanjutnya digunakan untuk amplifikasi DNA dari 49 sampel yang diuji. Primer yang sesuai akan mempengaruhi visualisasi pita DNA yang muncul setelah proses pewarnaan gel polyacrylamide. Ada tujuh jenis primer spesifik mikrosatelit P. merkusii yang digunakan, yaitu pm01, pm04, pm05, pm07, pm08, pm09a dan pm12. Pada Tabel 5 ditampilkan secara jelas informasi ketujuh jenis primer yang digunakan dalam penelitian.
pm08 132 59 (AT)2(GT)11 F: GCTTCAATCTATTGACCCCAT
R:TAAAGGGGCAGCTGCTACAACCAATGG
pm09a 81–99 52 (AT)5(GT)18(AT)2 F: CCTTCTCATTTCGATATGCAC
R: ATTAAAGGTTATATGGGGCT
pm12 181–193 59 (GT)5CT(GT)5(AT)5 F: GAACAATCATTGCGGGTCCCG
R: TATGCTGCGTTTATATGTATAAGTGTC
DNA hasil proses ekstraksi sebelum dilakukan amplifikasi PCR harus dilakukan pengenceran DNA. Pengenceran DNA dilakukan dengan menggunakan aquabidest steril. Perbandingan antara DNA dengan aquabidest tergantung dari tebal tipisnya DNA genomik hasil dari ekstraksi pada masing-masing sampel. Pita dengan ekor yang tebal memerlukan pengenceran yang lebih besar untuk mengurangi konsentrasi pengotor yang berasal dari bahan-bahan kimia pada tahap ekstraksi sebelumnya.
14
14 Tabel 6 Susunan bahan mix PCR mikrosatelit dalam 1 kali reaksi
Pereaksi 1 kali reaksi sampai 5 detik, kemudian dispin agar tercampur merata dan selanjutnya dilakukan proses PCR. Pada Tabel 7 ditampilkan tahapan dan kondisi reaksi PCR yang digunakan selama proses amplifikasi.
Tabel 7 Tahapan dan kondisi reaksi PCR
Tahapan Suhu (°C) Waktu (menit) Jumlah siklus
Produk PCR sebelum dielektroforesis pada gel polyacrylamide dianalisis terlebih dahulu menggunakan gel agarose 1% (b/v) sebanyak 5 µL selama 10 menit dengan tegangan 75 Volt untuk mengetahui kualitasnya. Produk PCR yang kualitasnya baik kemudian ditambahkan 20 µL loading dye formamide yang selanjutnya didenaturasi dengan suhu 94 °C selama 3 menit di dalam mesin PCR. Hasil denaturasi dielektroforesis sebanyak 6 µL pada gel polyacrylamide 6%. Komposisi bahan-bahan yang digunakan untuk membuat gel polyacrylamide 6% disajikan dalam Tabel 8.
Tabel 8 Komposisi bahan-bahan gel polyacrylamide 6%
Bahan Volume/gram untuk 60 mL gel
1. Urea
bahan 1 s/d 4 dihomogenkan dahulu kemudian dicampur dengan bahan 5 dan 6
5. APS 10%
6. TEMED
400.0 µL 40.0 µL
15
selanjutnya larutan sampel dimasukkan ke dalam sumur gel dan gel siap dielektroforesis pada daya 65 Watt, selama 1 jam 15 menit (sampai warna hijau dari xylene cyanol berada pada posisi 2/3 dari ujung gel), diatur sehingga suhu gel berkisar 50 °C.
Visualisasi DNA
Gel polyacrylamide yang selesai dielektroforesis, dikeluarkan dari chamber selanjutnya dimasukkan ke dalam tray pewarnaan yang telah ditambahkan 1 L larutan fiksasi (asam asetat 10%) dan dibiarkan selama 20 menit di atas shaker. Larutan fiksasi yang telah digunakan ditampung sejenak dan gel dicuci dengan 1 L aquadest sebanyak 2 kali masing-masing selama 2 menit. Tahap selanjutnya ditambahkan 1 L larutan pewarna atau stainning (1 gram serbuk AgNO3 dan 1.5
mL formaldehide dilarutkan dengan aquadest hingga volume 1 L) dan ditempatkan kembali dalam shaker selama 30 menit. Larutan pewarna kemudian dibuang, gel dicuci dengan 1 L aquadest selama 10 detik dan gel yang telah dicuci direndam dalam larutan developer (30 gram serbuk Na2CO3, 1.5 mL
formaldehyde 37%, dan 200 µL larutan natrium-tiosulfat 10 mg/mL dilarutkan dengan aquadest hingga volume 1 L) sambil di-shaker hingga pita-pita DNA muncul. Proses pewarnaan dihentikan setelah semua pita DNA muncul dengan menambahkan larutan fiksasi dari tahap sebelumnya. Gel kemudian dicuci kembali dengan 1 L aquadest dan dikeringkan. Selanjutnya pita DNA difoto dengan menggunakan kamera digital.
Analisis Data
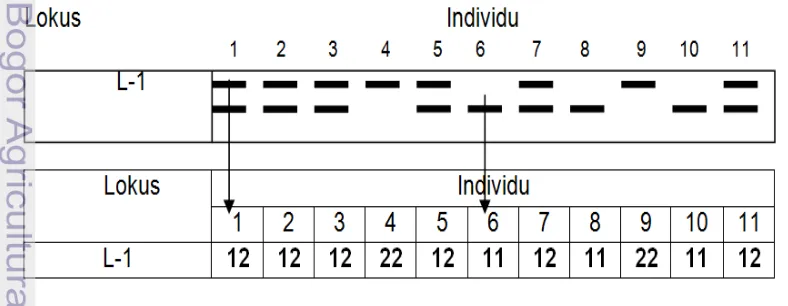
Hasil PCR yang telah dielektroforesis difoto kemudian dilakukan scoring pola pita yang muncul. Cara scoring DNA mikrosatelit ditampilkan pada Gambar 4. Data scoring kemudian dianalisis dengan menggunakan software POPGENE 32 versi 1.31 (Yeh 1999), NTSys Ver 2.0 (Rohlf 1998), dan untuk mengetahui besarnya persentase variasi genetik pada AMOVA (analysis of molecular variance) digunakan software Arlequin versi 3.5 (Excoffier et al. 2011). Selain itu digunakan juga software Fstat versi 2.9.3.2 (Goudet 2002) untuk mengecek keakuratan persentase variasi genetik AMOVA. Panjang fragmen pita dihitung dengan menggunakan penggaris yang kemudian dikonversi ke dalam besaran basepairs.
16
16
HASIL DAN PEMBAHASAN
Ekstraksi DNA
Proses ekstraksi DNA dalam penelitian ini menggunakan dua metode, yaitu CTAB (cetyl trimethyl ammonium bromide) dan DNeasy plant mini kit dari QIAGEN. Kemurnian hasil pita DNA yang diperoleh dari kedua metode ini sangat berbeda. Pita DNA yang diperoleh dari metode CTAB menghasilkan pita DNA yang masih kotor, yaitu pita dengan ekor yang tebal (smear) masih mengandung kontaminasi protein, polisakarida, RNA (Qiagen 2001), dan masih terdapat sisa-sisa bahan kimia selama proses ekstraksi berupa fenol, kloroform, dan alkohol (Gambar 5).
Gambar 5 Contoh kemurnian pita DNA hasil ekstraksi dengan metode CTAB (garis melingkar kuning = DNA; garis melingkar biru = RNA; garis melingkar hijau = kotoran bahan-bahan kimia)
Metode DNeasy plant mini kit dari QIAGEN menghasilkan pita DNA yang tergolong bersih, yaitu tidak terdapat kotoran dan juga RNA (Gambar 6). Hasil tidak adanya RNA disebabkan oleh pengaruh penggunaan RNAse A dalam proses ekstraksi. Enzim RNAse berfungsi untuk menghancurkan RNA sehingga DNA dapat diisolasi secara utuh. Kotoran berupa bahan-bahan kimia juga tidak ditemukan dalam larutan DNA hasil ekstraksi karena terdapat penyaring pada column/tube yang khusus digunakan pada metode ini.
Sumur gel
1 kb DNA ladder (Promega)
17
Gambar 6 Contoh kemurnian pita DNA hasil ekstraksi dengan metode DNeasy plant mini kit dari QIAGEN (garis melingkar cokelat = tidak ada RNA dan juga kotoran sisa ekstraksi; garis melingkar merah = DNA dari contoh sampel daun segar; garis melingkar kuning = DNA dari contoh sampel daun kurang segar)
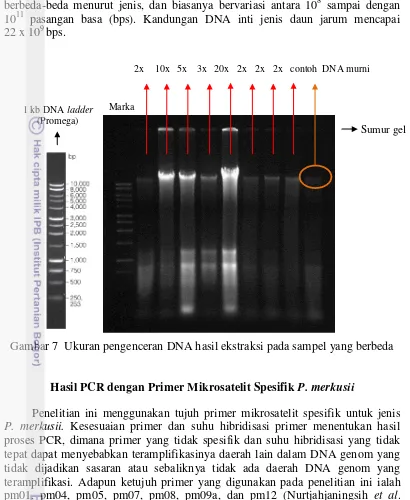
Kualitas DNA hasil ekstraksi sangat menentukan tahapan PCR, karena itu sebelum digunakan DNA terlebih dahulu diuji kualitasnya dengan elektroforesis untuk mengetahui kemurniannya. Pola pita hasil ekstraksi sangat bervariasi mulai dari yang tebal sampai yang tipis. Pengenceran DNA dilakukan menggunakan aquabidest steril dengan perbandingan tertentu yang mengacu pada tingkat ketebalan pita DNA yang diperoleh, yaitu pita yang tebal dan mengekor/smear (masih kotor) pada beberapa sampel memerlukan perbandingan pengenceran yang lebih besar, yaitu dapat mencapai 20 kali (1 µL DNA:19 µL aquabidest steril). Pengenceran bertujuan untuk mengurangi konsentrasi kontaminasi atau kotoran. Dengan demikian setiap sampel DNA yang berbeda mempunyai perlakuan pengenceran yang berbeda-beda tergantung dari kualitasnya masing-masing (Gambar 7). Pengenceran ini dimaksudkan agar pada tahap PCR primer dapat menempel pada template DNA sehingga dapat teramplifikasi.
Ketebalan pita juga dipengaruhi oleh tingkat kesegaran sampel daun yang digunakan. Sampel yang masih segar akan menghasilkan pita yang lebih tebal dibandingkan dengan sampel yang kurang segar. Ketebalan pita juga bisa berarti konsentrasi DNA lebih tinggi. Pada Gambar 6 menunjukkan bahwa sampel yang segar ditandai dengan garis melingkar merah sedangkan sampel yang kurang segar ditandai dengan garis melingkar kuning. Penyimpanan sampel dalam waktu yang lama akan menyebabkan kerusakan sel-sel daun sehingga DNA yang terkandung didalamnya akan mengalami kerusakan.
Ukuran DNA genom P. merkusii strain Tapanuli dapat diperkirakan berada di atas 10 000 bp seperti terlihat pada Gambar 5, 6, dan 7. Finkeldey (2005) menjelaskan bahwa jumlah total DNA inti dari suatu organisme tingkat tinggi Sumur gel 1 kb DNA ladder
(Promega)
18
18 berbeda-beda menurut jenis, dan biasanya bervariasi antara 108 sampai dengan 1011 pasangan basa (bps). Kandungan DNA inti jenis daun jarum mencapai 22 x 109 bps.
2x 10x 5x 3x 20x 2x 2x 2x contoh DNA murni
Gambar 7 Ukuran pengenceran DNA hasil ekstraksi pada sampel yang berbeda
Hasil PCR dengan Primer Mikrosatelit Spesifik P. merkusii
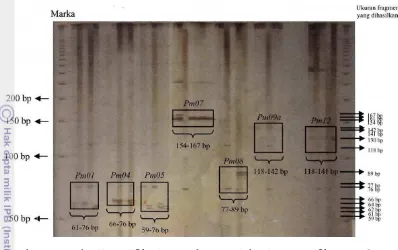
Penelitian ini menggunakan tujuh primer mikrosatelit spesifik untuk jenis P. merkusii. Kesesuaian primer dan suhu hibridisasi primer menentukan hasil proses PCR, dimana primer yang tidak spesifik dan suhu hibridisasi yang tidak tepat dapat menyebabkan teramplifikasinya daerah lain dalam DNA genom yang tidak dijadikan sasaran atau sebaliknya tidak ada daerah DNA genom yang teramplifikasi. Adapun ketujuh primer yang digunakan pada penelitian ini ialah pm01, pm04, pm05, pm07, pm08, pm09a, dan pm12 (Nurtjahjaningsih et al. 2005) mampu mengamplifikasi dan menghasilkan fragmen DNA yang polimorfik pada strain Tapanuli. Polimorfisme dapat dilihat dari posisi fragmen yang menunjukkan posisi lokus dengan alel yang berbeda. Dengan demikian ketujuh primer ini digunakan dalam penelitian ini.
Hasil elektroforesis pada gel polyacrylamide 6% mampu memisahkan DNA lebih sempurna karena memiliki ukuran pori-pori yang lebih kecil dibandingkan dengan gel agarose 1%. Leung et al. dalam Munarti (2005) menyatakan bahwa penentuan ukuran dan jumlah alel yang muncul pada gel didasarkan pada asumsi bahwa pita DNA yang memiliki laju migrasi yang sama disebut homolog. Pada Gambar 8 diperlihatkan hasil elektroforesis amplifikasi DNA strain Tapanuli dengan tujuh primer mikrosatelit spesifik P. merkusii beserta marka yang digunakan.
Sumurgel 1 kb DNA ladder
(Promega)
19
Gambar 8 Foto hasil amplifikasi DNA dengan tujuh primer spesifik P. merkusii pada gel polyacrylamide 6%
Ketujuh primer yang digunakan menghasilkan lokus yang polimorfik, dimana fragmen DNA atau pita P. merkusii strain Tapanuli yang dihasilkan memiliki ukuran base pairs (bp) yang berbeda-beda pada masing-masing primer. Pada Tabel 9 dapat dilihat ukuran fragmen yang diperoleh pada masing-masing primer berbeda dengan ukuran fragmen pada penelitian Nurtjahjaningsih et al. (2005).
Tabel 9 Ukuran fragmen mikrosatelit pada P. merkusii strain Tapanuli Primer Hasil PCR menurut Nurtjahjaningsih
et al. (2005), (bp)
Hasil PCR pada P. merkusii strain Tapanuli (bp)
20
20 Danarto et al. (2000) menyebutkan bahwa eksplorasi benih untuk meningkatkan basis genetik P. merkusii di Jawa telah dilakukan pada tahun 1995 terhadap populasi Janto, Takengon, dan Blangkejeren. Ketiga daerah ini terletak di Aceh dan material hasil eksplorasi ini telah ditanam di Jember dan Sumedang pada tahun 1996. Selain alasan tersebut ada kemungkinan terjadi mutasi yang dapat mengubah informasi genetik secara acak dari suatu organisme. Finkeldey (2005) memaparkan bahwa mutasi bisa terjadi pada satu sistron tunggal (misalnya mutasi titik, yakni suatu perubahan spontan dari suatu nukleotida tunggal), struktur kromosom (misalnya peleburan, perpindahan, dan pertukaran) atau jumlah gen-gen (misalnya penggandaan, poliploidi).
Handiwirawan (2006) menyatakan bahwa mutasi merupakan sumber yang utama bagi adanya variasi genetik. Mutasi akan memunculkan alel-alel baru atau merubah struktur genom dan akhirnya menghasilkan keragaman genetik. Mutasi pada tingkat molekuler terjadi dalam beberapa cara, yaitu hasil penggantian satu pasang nukleotida dengan nukleotida yang lain (substitusi basa), hasil delesi atau duplikasi dari sekuen nukleotida, dan hasil dari transposisi sekuen DNA dari satu lokasi ke lokasi lain di dalam genom organisme.
Analisis Keragaman Genetik P. merkusii Strain Tapanuli
Keragaman Genetik dalam Populasi
Nilai ukuran keragaman diperoleh dari hasil analisis scoring pita DNA mikrosatelit dengan software Popgen32. Pita yang di-scoring ialah semua pita yang terletak pada suatu lokus yang diamati. Pemberian score 1 bagi pita yang terletak paling atas (dekat sumur gel), score 2 bagi pita yang berada tepat dibawahnya. Score tertinggi yang diberikan tergantung jumlah alel maksimal yang ditemukan dalam suatu individu (misalnya ditemukan jumlah alel maksimal 3 maka score tertinggi ialah 3). Cara scoring pita DNA mikrosatelit disajikan pada Gambar 4. Finkeldey (2005) mengungkapkan bahwa keragaman genetik dalam populasi dapat diukur dari nilai heterozigitas individual. Adapun ukuran-ukuran yang digunakan untuk mencirikan variasi genetik dalam populasi ialah persentase lokus polimorfik (PLP), jumlah alel yang diamati (na), jumlah alel yang efektif (ne), dan heterozigositas harapan (He). Nilai parameter keragaman pada penelitian ini disajikan pada Tabel 10.
Tabel 10 Keragaman genetik P. merkusii pada 3 populasi yang diteliti
No Populasi N PLP (%) na ne He
N = jumlah total individu; PLP = persentase lokus polimorfik; na = jumlah alel yang diamati; ne = jumlah alel efektif (Kimura and Crow (1964)); He = diferensiasi genetik Nei (1973)/heterozigositas harapan.
21
signifikan, yaitu hanya berkisar antara 0.4316 sampai 0.4693. Hal ini menunjukkan bahwa ketiga populasi tersebut memiliki variasi genetik yang hampir sama, namun dari ketiga populasi tersebut populasi Lobugala memiliki nilai keragaman genetik paling tinggi, yaitu sebesar 0.4693. Nilai He yang paling tinggi di Lobugala diduga disebabkan oleh adanya migrasi atau gene flow yang berasal dari upaya rehabilitasi hutan. Lokasi kegiatan rehabilitasi hutan ini relatif dekat dengan populasi Lobugala dan telah dilakukan sejak tahun 1984. Adapun pinus yang digunakan untuk merehabilitasi hutan adalah pinus strain Aceh. Migrasi dapat meningkatkan variasi genetik, dimana migrasi alel dari suatu populasi atau spesies lain secara umum diakibatkan oleh disribusi polen atau benih (Irwanto 2006). Adams (1992) juga menyatakan bahwa pola pergerakan gen (gene flow) melalui serbuk sari menunjukkan jarak dan jumlah serbuk sari yang berkontribusi pada sistem perkawinan, sehingga pola pergerakan gen ini menentukan keragaman dan struktur genetik benih yang dihasilkan. Pola pergerakan gen P. merkusii sangat luas karena selama proses penyerbukan dan penyebaran benih sangat dibantu oleh peranan angin. Pola penyebaran serbuk sari merupakan faktor penting dalam populasi genetik, memegang peranan penting dalam pemuliaan pohon dan konservasi genetik (Nurtjahjaningsih 2008).
Lokasi pengambilan sampel pada Gambar 9 menunjukkan bahwa sampel Dolok Tusam Timur memiliki kerapatan tegakan/populasi yang lebih tinggi dibandingkan dengan populasi Parinsoran dan Lobugala. Kerapatan yang lebih rendah pada populasi Parinsoran dan Lobugala disebabkan akibat kerusakan hutan berupa penebangan hutan yang tidak terkendali. Pembukaan lahan hutan ini dilakukan oleh masyarakat lokal untuk kegiatan perladangan. Banyak aktivitas perladangan dijumpai di kedua lokasi ini sehingga tampak tutupan hutan pinus menjadi lebih terbuka (tidak menyebar rata). Kondisi demikian diduga akan menurunkan variasi genetik pada populasi Parinsoran dan Lobugala di masa datang jika tidak ada upaya konservasi dan rehabilitasi yang didukung program pemuliaan. Langkah awal program konservasi dapat ditempuh melalui rehabilitasi hutan berupa penanaman pohon dengan strain yang sama agar kondisi hutan pinus dapat pulih kembali dan kelestarian P. merkusii strain Tapanuli tetap terjaga. Penanaman kembali pada lahan-lahan yang telah terdegradasi akan dapat mengurangi keterbukaan tegakan hutan pinus, sehingga hutan menjadi lebih rapat. Kerapatan tegakan hutan sangat mempengaruhi tingkat keragaman genetik. Finkeldey (2005) menyatakan bahwa tegakan dengan kerapatan yang rendah akan memiliki nilai variasi genetik yang lebih rendah dibandingkan dengan tegakan yang memiliki kerapatan yang tinggi. Kerapatan yang rendah akan menghambat terjadinya aliran gen dalam populasi.
22
22 mengungkapkan bahwa pada pohon-pohon hutan, keberadaan keragaman genetik yang berbeda dalam populasi bertanggung jawab terhadap perbedaan tingkat adaptasi dan kapasitasnya untuk beradaptasi terhadap perubahan lingkungan karena pohon-pohon tidak mampu untuk berpindah dan berumur panjang. Jenis tanaman yang mempunyai sebaran alam yang luas akan mempunyai keragaman genetik yang tinggi, karena eksistensi tanaman pada suatu lingkungan tumbuh merupakan manifestasi kemampuan jenis tersebut tumbuh dan berkembang dalam lingkungan tumbuh yang ada (Hartl dan Clark 1989).
Kegiatan penanaman kembali yang intensif di lokasi Parinsoran dan Lobugala akan berdampak pada kondisi hutan menjadi lebih baik. Semakin bertambah populasi pinus pada kedua lokasi ini akan dapat meningkatkan basis genetik P. merkusii strain Tapanuli, sehingga peluang untuk mengembangkan populasi dasar menjadi lebih baik akan semakin terbuka. Populasi dasar yang baik akan mempermudah kegiatan pemuliaan seperti, penentuan spesies/provenansi, studi variabilitas, penentuan sifat-sifat yang diinginkan, serta mengembangkan dan mempertahankan basis genetik untuk kepentingan lebih lanjut.
Gambar 9 Kondisi tempat pengambilan sampel di lapangan: (a) Dolok Tusam
Timur, (b) Parinsoran, (c) Lobugala
Hasil tingkat heterozigositas pada penelitian ini lebih kecil apabila dibandingkan dengan penelitian sebelumnya (Nurtjahjaningsih et al. 2007; 2009), begitu pula jika dibandingkan dengan hasil penelitian Zhan et al. (2012) pada jenis pinus yang berbeda, yaitu P. tabuliformis dan P. henryi. Sedangkan nilai He dalam penelitian ini lebih besar jika dibandingkan dengan P. pinaster yang diteliti Nadya et al. (2010) dimana memiliki nilai He sebesar 0.432. Perbedaan nilai tingkat heterozigositas pinus yang masing-masing dianalisis berdasarkan penanda mikrosatelit yang sama diduga dipengaruhi oleh asal-usul sampel, yaitu strain dan populasi yang berbeda, jumlah sampel, termasuk jumlah populasi, dan jumlah penanda atau lokus yang digunakan dalam penelitian. Handiwirawan (2007) menjelaskan bahwa semakin besar jumlah lokus yang diuji per individu maka hasil yang diperoleh semakin dapat diandalkan, akan tetapi jika lokus yang diuji relatif kecil maka jumlah individu yang diuji harus cukup besar. Selain itu Nei (1987) mengemukakan bahwa jika lokus yang di uji sebanyak 25 maka dianjurkan paling sedikit 20 atau 30 individu diuji untuk setiap lokusnya. Pada Tabel 11 disajikan nilai tingkat heterozigositas pada beberapa jenis pinus yang dianalisis dengan metode mikrosatelit.
23
Tabel 11 Keragaman genetik beberapa jenis pinus
Jenis Populasi Metode He Referensi
P. merkusii
Nurtjahjaningsih et al. 2007 Nurtjahjaningsih 2009 Nadya et al. 2010 Zhan et al. 2012 Zhan et al. 2012
Keragaman Genetik antar Populasi
Perbedaan genetik antar populasi dikuantifikasi oleh ukuran diferensiasi genetik, (Finkeldey 2005) yaitu jarak genetik, dan ditunjukkan lebih lanjut dengan metode pengelompokan. Jarak genetik mengukur perbedaan struktur genetik antar dua populasi pada suatu lokus gen tertentu. Pada Tabel 12 ditampilkan jarak genetik antar populasi P. merkusii strain Tapanuli yang diteliti.
Tabel 12 Jarak genetik Nei (1972) antar populasi P. merkusii
Populasi Dolok Tusam Timur Lobugala Parinsoran
Dolok Tusam Timur
Tabel 12 di atas menunjukkan bahwa populasi yang memiliki jarak genetik paling besar ialah antara populasi Dolok Tusam Timur dengan Lobugala dengan nilai jarak genetik sebesar 0.3798. Hal ini menunjukkan bahwa hubungan kekerabatan kedua populasi ini cukup jauh, sedangkan populasi yang memiliki nilai jarak genetik terendah ialah populasi Lobugala dan Parinsoran, yaitu dengan jarak genetik sebesar 0.0617. Jarak genetik yang rendah mengindikasikan bahwa semakin dekat hubungan kekerabatan kedua populasi.
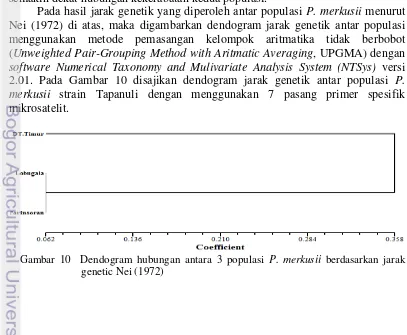
Pada hasil jarak genetik yang diperoleh antar populasi P. merkusii menurut Nei (1972) di atas, maka digambarkan dendogram jarak genetik antar populasi menggunakan metode pemasangan kelompok aritmatika tidak berbobot (Unweighted Pair-Grouping Method with Aritmatic Averaging, UPGMA) dengan software Numerical Taxonomy and Mulivariate Analysis System (NTSys) versi 2.01. Pada Gambar 10 disajikan dendogram jarak genetik antar populasi P. merkusii strain Tapanuli dengan menggunakan 7 pasang primer spesifik mikrosatelit.
24
24 Pada Gambar 10 di atas dapat dilihat bahwa ketiga populasi P. merkusii strain Tapanuli yang diteliti membentuk dua kelompok/klaster besar. Kelompok pertama terdiri dari populasi Parinsoran dan Lobugala, sedangkan populasi Dolok Tusam Timur terpisah dari kelompok pertama. Berdasarkan dendogram tersebut, terlihat ketiga populasi tidak mengelompok berdasarkan kedekatan lokasi satu sama lain melainkan mengelompok secara acak. Pada Gambar 2 terlihat jelas bahwa populasi Dolok Tusam Timur memisah dengan Parinsoran walaupun berdasarkan kedekatan lokasi kedua populasi ini terletak berdekatan yaitu pada Kecamatan yang sama. Populasi Parinsoran dan populasi Dolok Tusam Timur terletak pada kecamatan Garoga sedangkan populasi Lobugala terletak pada Kecamatan Pangaribuan.
Informasi tentang keragaman genetik di dalam dan antar populasi merupakan informasi dasar bagi aktivitas pemuliaan pohon di masa datang dan upaya melakukan konservasi genetik serta penelusuran asal usul bahan tanaman. Keragaman genetik menempati posisi kunci dalam program pemuliaan karena optimalisasi perolehan genetik akan sifat-sifat tertentu akan dapat dicapai manakala ada cukup peluang untuk melakukan seleksi gen untuk sifat yang diinginkan. Salah satu aktivitas pemuliaan yang dapat dilakukan untuk mengembangkan potensi genetik pinus Tapanuli ialah membangun kebun benih. Kebun benih merupakan pertanaman dari klon-klon/keturunan dari famili terpilih, diisolasi untuk menghindari atau mengurangi penyerbukan dari luar dan dikelola secara intensif untuk menghasilkan benih bermutu tinggi, terus menerus dan mudah dipanen. Dengan demikian berdasarkan kondisi tempat tumbuh ketiga populasi, sumber benih yang baik dapat diambil dari populasi Dolok Tusam Timur sebab berada di dalam hutan lindung alami, tidak terdegradasi, serta memiliki kerapatan tegakan yang lebih tinggi sehingga nilai variasi genetik yang tinggi tetap terjaga.
Pengembangan pinus strain Tapanuli melalui pembangunan kebun benih dari berbagai sumber benih unggul merupakan langkah yang tepat untuk melestarikannya. Selain jumlahnya yang semakin berkurang di sebaran alaminya juga kegiatan pengembangan strain ini masih sangat kurang. Suhaendi (2005) memaparkan bahwa hutan tanaman pinus strain Tapanuli pernah dibuat dalam skala kecil oleh masyarakat di Kecamatan Pangaribuan dan Kecamatan Sipahutar (keduanya termasuk dalam Kabupaten Tapanuli Utara) dengan menggunakan bibit/anakan alam yang diambil secara cabutan, dan sekarang hampir habis karena pengusahaan oleh rakyat dialihkan menjadi tanaman kopi. Selain itu, Harahap (2000) juga menjelaskan bahwa pengembangan pinus strain Tapanuli tidak dilanjutkan kembali di Aek Nauli, Kabupaten Tapanuli Selatan akibat terkena serangan Milionia basalis.
25
banyak dikembangkan dan dibudidayakan di pulau Jawa, yaitu bentuk batang ramping dan lurus, kulit batang tipis dan beralur dangkal, cabang-cabang lebih kecil, serta produksi getah lebih banyak. Selain itu, pada penelitian ini juga menunjukkan bahwa populasi alami strain Tapanuli yang diteliti memiliki nilai keragaman genetik (He) yang cukup tinggi dan tidak terlalu berbeda jauh dibandingkan dengan strain Aceh pada penelitian Nurtjahjaningsih et al. (2007; 2009). Berdasarkan beberapa keunggulan di atas maka mengembangkan strain Tapanuli di pulau Jawa dapat dijadikan alternatif dan kemungkinan dapat mengurangi kerugian akibat hama ―kutu lilin‖ karena adanya strain lain berasal dari Tapanuli. Namun alternatif ini perlu dikaji lebih mendalam melalui beberapa penelitian sehingga dapat dibuktikan pengaruhnya terhadap tingkat keberhasilan pengembangan yang dilakukan.
Pinus strain Tapanuli yang lestari berarti melestarikan sumberdaya genetiknya. Upaya pelestarian sumberdaya genetik sangat terkait dengan kegiatan konservasi untuk mempertahankan keragaman atau variasi genetik suatu populasi. Keberagaman variasi genetik akan menjamin ketersediaan sumberdaya genetik apabila diperlukan. Tingkat keragaman genetik yang tinggi merupakan modal dasar dalam konservasi plasma nutfah sebab konservasi menjadi hal yang penting diperhatikan dalam rangka menjaga agar tidak terjadi penurunan basis genetik populasi dasar P. merkusii strain Tapanuli di masa depan.
Variasi Genetik dan Indeks Fiksasi (FST)
AMOVA (analysis of molecular variance) untuk mengetahui sebaran variasi genetik dari ketiga populasi dianalisis menggunakan software Arlequin versi 3.5 (Excoffier et al. 2011) sehingga diperoleh persentase variasi seperti terlihat pada Tabel 13.
Tabel 13 Analysis of molecular variance (AMOVA) dari 3 populasi P. merkusii menggunakan 7 lokus mikrosatelit
Sumber variasi Derajat
bebas Jumlah square Komponen varian
Persentase 81.33% variasi genetik tersebar di dalam populasi (within populations) dan 18.67% tersebar di antara populasi (among populations) dengan nilai FST =
0.1867, namun berdasarkan hasil analisis data dengan software Fstat versi 2.9.3.2 (Goudet 2002) pada Lampiran 3 diperoleh nilai FST yang berbeda, yaitu sebesar
0.1750. Penghitungan FST dengan program Fstat dilakukan untuk mengetahui nilai
FST yang lebih akurat. Hasil analisis ini menunjukkan perbedaan nilai FST yang
tidak terlalu signifikan atau tidak berbeda nyata.
Indeks fiksasi (FST) merupakan ukuran diferensiasi genetik suatu populasi
26
26 0.1750 menunjukkan bahwa ketiga populasi P. merkusii strain Tapanuli yang diteliti memiliki perbedaan genetik yang sedikit. Perbedaan genetik yang sedikit menandakan ketiga populasi ini memiliki hubungan kekerabatan yang tergolong dekat satu dengan lainnya, karena sebanyak 81.33% variasi genetik terdapat di dalam masing-masing populasi (within populations). Dengan demikian ketiga populasi yang diteliti secara genetik masih tergolong sama atau memiliki kemiripan genetik yang cukup tinggi satu dengan lainnya.
Pada populasi Lobugala dan Parinsoran yang telah terjadi degradasi, namun berdasarkan analisis AMOVA masih menunjukkan adanya variasi genetik di dalam populasi yang tinggi. Hal ini diduga degradasi hutan pada kedua lokasi ini belum menunjukkan dampak negatif yang besar bagi potensi genetik yang ada. Potensi genetik berupa variasi genetik yang tinggi ini dikhawatirkan akan menurun jika tidak ada upaya pelestarian pinus Tapanuli pada habitat alaminya. Upaya pelestarian pasca degradasi hutan sangat penting dan dapat dilakukan dengan teknologi silvikultur yang tepat, meliputi penanaman kembali P. merkusii strain Tapanuli, pemeliharaan yang intensif, dan kegiatan evaluasi keberhasilan penanaman pada lahan-lahan terdegradasi di tempat tumbuh alaminya. Keberhasilan penanaman dapat meningkatkan jumlah populasi dan potensi genetik yang ada, sehingga upaya pemuliaan dapat dilakukan dengan mudah, seperti kegiatan seleksi dan persilangan untuk mendapatkan sifat-sifat yang diinginkan, serta perbanyakan massal untuk mewujudkan individu-individu yang diharapkan. Pemuliaan dengan konservasi tidak dapat dipisahkan karena dari areal konservasi inilah materi yang dimuliakan diperoleh, dengan demikian untuk melestarikan pinus Tapanuli sangat diperlukan kegiatan konservasi untuk mengkonservasi potensi genetik, sehingga tidak akan terjadi kepunahan pada jenis ini di masa datang.
Pada Tabel 14 menunjukkan bahwa nilai FST dalam penelitian ini lebih
tinggi dibandingkan penelitian sebelumnya dengan strain Aceh (Nurtjahjaningsih et al. 2007; 2009). Perbedaan yang mendasar penelitian Nurtjahjaningsih et al. (2007), ialah sampel berasal dari 13 populasi tetua (parental) berupa pohon plus yang terdapat di kebun benih semai Jember. Ketigabelas populasi ini masing-masing berasal dari daerah yang berbeda di pulau Jawa. Adapun jumlah total sampel yang dianalisis dari ketigabelas populasi ini berjumlah 644 sampel dan hanya menggunakan 5 primer mikrosatelit spesifik P. merkusii (pm01, pm05, pm07, pm09a, dan pm12). Perbedaan juga ditemukan pada penelitian Nurtjahjaningsih (2009), yaitu membandingkan 2 populasi P. merkusii strain Aceh di kebun benih semai Jember, yaitu populasi infusi genetik dengan populasi pohon plus kebun benih. Populasi infusi genetik terdiri dari 3 populasi, yaitu Takengon, Janto, dan Blangkejeren (strain Aceh) yang masing-masing berjumlah 24 sampel, sedangkan jumlah sampel populasi pohon plus kebun benih berjumlah 644 sampel. Penelitian Nurtjahjaningsih (2009) ini juga menggunakan 5 primer mikrosatelit spesifik P. merkusii yang sama seperti pada penelitian sebelumnya.
Nilai FST yang kecil pada penelitian Nurtjahjaningsih et al. (2007; 2009)
27
lebih tinggi, dimana mengindikasikan bahwa ketiga populasi ini memiliki perbedaan genetik yang cukup tinggi antar populasinya. Dengan demikian terkait konservasi maka strain Tapanuli memerlukan upaya konservasi yang lebih luas agar potensi genetik antar populasinya tidak hilang dan tetap lestari. Semakin besar perbedaan genetik antar populasi maka diperlukan upaya konservasi yang lebih luas agar variasi genetik yang tinggi pada masing-masing populasi tersebut tetap lestari.
Tabel 14 Diferensiasi genetik (FST) beberapa jenis pinus
No. Spesies FST Referensi
Nurtjahjaningsih et al. 2007 Nurtjahjaningsih 2009 yang dianalisis menggunakan marka mikrosatelit dengan 7 macam primer (PtTX-3025, PtTX-2090, PtTX-3030, PtTX-3020, PtTX-2123, PtTX-3118 dan P-7) . P. pinaster yang diteliti berasal dari 10 populasi alami di Morocco yang tersebar di tiga daerah yang berbeda, yaitu Rif mountain, middle Atlas dan High Atlas. Jumlah sampel yang diteliti setiap populasinya berkisar antara 16 sampai 35 pohon, dengan total keseluruhan sebanyak 240 sampel.
Penelitian Zhan et al. (2012) pada P. tabuliformis, dan P. henryi memiliki nilai FST yang lebih tinggi dari penelitian ini, yaitu masing-masing sebesar 0.316 dan 0.357 (Tabel 14). Kedua jenis pinus yang digunakan ini berasal dari 3 sistem pegunungan di Cina bagian Utara, yaitu Qinling, Daba, dan Wuling. Total populasi dari kedua pinus ini berjumlah 29 populasi alami dengan jumlah sampel pada masing- masing populasi berkisar antara 7 sampai 32 sampel. Jumlah primer yang digunakan untuk menganalisis kedua pinus ini berjumlah 10 primer, yaitu RPTest11, PtTX2123, RPS160, PtTX4001, PtTX3116, Cjgssr124, PR4.6, RPTest1, pdms065, and pdms221. Perbedaan nilai FST (indeks fiksasi antar
populasi) dari beberapa hasil penelitian di atas diduga sangat ditentukan oleh jenis pinus (termasuk strain/sumber populasi), jumlah populasi dan sampel yang diteliti, serta jumlah penanda atau lokus (primer) yang digunakan dalam analisis.
SIMPULAN DAN SARAN
Simpulan
28
28 Dolok Tusam Timur memiliki nilai He = 0.4614, sedangkan populasi yang memiliki tingkat heterozigositas terendah ialah populasi Parinsoran dengan He = 0.4316. Populasi P. merkusii dari Dolok Tusam Timur dan populasi Lobugala memiliki hubungan kekerabatan yang paling jauh dengan jarak genetik sebesar 0.3798, sedangkan populasi Lobugala dan populasi Parinsoran memiliki hubungan kekerabatan yang paling dekat dengan jarak genetik sebesar 0.0617. Variasi genetik ketiga populasi tersebar sebanyak 81.33% di dalam populasi (within populations) dan sebanyak 17.50% tersebar di antara populasi (among populations).
Saran
Perlu dilakukan penelitian keragaman genetik lebih lanjut dengan jumlah sampel (termasuk jumlah populasi) yang lebih banyak agar dapat mewakili keragaman genetik secara menyeluruh P. merkusii strain Tapanuli serta perlu dilakukan upaya konservasi dan rehabilitasi yang lebih intensif serta didukung dengan program pemuliaan agar P. merkusii strain Tapanuli tetap lestari.
DAFTAR PUSTAKA
Adams WT. 1992. Gene dispersal within forest tree populations. New Forest 6:217-240.
[Anonim]. 2009. Hutan lindung terbakar akibat penebangan liar [Internet]. [diunduh 2012 Mei 28]. Tersedia pada: http://news.liputan6.com/read/ 230604/hutan-lindung-terbakar-akibat-penebangan-liar
Armizon, Sukmana C, Manan S. 1995. Okurasi Pinus merkusii Jungh et de Vriese galur Kerinci berdasarkan ketinggian tempat di hutan pegunungan Cagar Alam Bukit Tapan, Kawasan Taman Nasional Kerinci-Seblat. Rimba Indonesia 30(4):2-9.
Aritonang KV, Siregar IZ, Yunanto T. 2007. Manual Analisis Genetik Tanaman Hutan di Laboratorium Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Bogor (ID): Fakultas Kehutanan IPB.
Aswandi. 2011. Selamatkan tusam Tapanuli [Internet]. [diunduh 2012 Mei 28]. Tersedia pada: http://bpk-aeknauli.litbang.dephut.go.id.
Azrai M. 2005. Pemanfaatan markah molekuler dalam proses seleksi pemuliaan tanaman. Jurnal Agro Biogen 1(1):26-37.
Colling ENG. 1968. Pinus merkusii Fast Growing Timber Trees of The Low Land Tropics. Oxford: Commonwealth Forestry Institute Departement of Fprestry University of Oxford.
Dahlian E, Hartoyo. 1997. Komponen kimia terpentin dari getah tusam (Pinus merkusii) asal Kalimantan Barat. Info Hasil Hutan Badan Penelitian dan Pengembangan Kehutanan Bogor 4(1):38-39.