BERTEKANAN-PENDINGINAN SERTA EVALUASI SIFAT
PREBIOTIKNYA
R. HARYO BIMO SETIARTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Peningkatan Pati Resisten Tepung Talas melalui Fermentasi dan Pemanasan Bertekanan-Pendinginan serta Evaluasi Sifat Prebiotiknya adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
R. Haryo Bimo Setiarto
RINGKASAN
R. HARYO BIMO SETIARTO. Peningkatan Pati Resisten Tepung Talas melalui Fermentasi dan Pemanasan Bertekanan-Pendinginan serta Evaluasi Sifat Prebiotiknya. Dibimbing oleh SRI LAKSMI SURYAATMADJA, DIDAH NUR FARIDAH, dan IWAN SASKIAWAN.
Prebiotik adalah komponen pangan fungsional yang dapat menstimulasi pertumbuhan bakteri probiotik dalam kolon sehingga mampu memperbaiki kesehatan saluran pencernaan manusia. Salah satu bahan pangan yaitu talas Bogor (Colocasia esculenta) berpotensi sebagai sumber prebiotik dengan kandungan pati resisten (3,5-4,0%) dan oligosakarida seperti inulin (1,72 mg/g) maupun rafinosa (8,6 mg/g). Talas memiliki kandungan amilosa yang tinggi (25,78%) sehingga dapat dikonversi menjadi pati resisten melalui proses retrogradasi. Kadar pati resisten (RS) talas diindikasikan dapat ditingkatkan melalui fermentasi bakteri asam laktat (BAL) penghasil amilase dan pululanase yang dilanjutkan dengan pemanasan bertekanan-pendinginan/ autoclaving-cooling (OC). Tujuan penelitian ini adalah a) Seleksi isolat BAL unggul penghasil amilase dan pululanase; b) Penentuan lama waktu fermentasi talas optimum dan jumlah siklus pemanasan bertekanan-pendinginan; c) Evaluasi sifat prebiotik Tepung Talas Modifikasi (TTM) kaya RS secara in-vitro.
Empat puluh satu isolat BAL diuji aktivitas enzim amilase dan pululanase tertinggi. Dua isolat BAL dengan aktivitas amilase dan pululanase tertinggi dipilih untuk diaplikasikan pada fermentasi irisan talas selama 0, 6, 12, 18 dan 24 jam. Setelah fermentasi, irisan talas diberi perlakuan pemanasan bertekanan dan pendinginan sebanyak satu siklus maupun dua siklus. Tepung talas modifikasi (TTM) terpilih selanjutnya dievaluasi sifat prebiotiknya dengan parameter efek, indeks dan aktivitas prebiotik. Karakteristik lain dari TTM yang juga dianalisis antara lain resistensinya terhadap asam lambung, dan viabilitas BAL probiotik yang ditumbuhkan dalam TTM.
Tiga isolat BAL yang menunjukkan aktivitas enzim amilase dan pululanase tertinggi yaitu Lactobacillus plantarum D-240 (2,57 U/mL dan 2,72 U/mL), Leuconostoc mesenteroides SU-LS 59 (2,70 U/mL dan 2,88 U/mL) dan
Leuconostoc mesenteroides SU-LS 67 (2,50 U/mL dan 2,91 U/mL). Berdasarkan nilai rerata derajat polimerisasi (DP), kondisi optimum fermentasi talas dicapai dengan 2% kultur campuran L. plantarum D-240 dan Leu. mesenteroides SU-LS 67 rasio (1:1) selama 18 jam dengan nilai DP sebesar 27,13.
Evaluasi sifat prebiotik menunjukkan bahwa tepung talas FOC-1S memiliki ketahanan terhadap hidrolisis asam lambung artifisial sebesar 87%. RS tepung talas FOC-1S memberikan efek prebiotik yang baik dengan meningkatkan pertumbuhan bakteri probiotik (L. acidophilus dan L. plantarum) masing-masing sebesar 2,6 (log cfu/ml) dan 1,5 (log cfu/ml) dengan indeks prebiotik masing-masing adalah 2,1 (log cfu/ml) dan 1,2 (log cfu/ml). Aktivitas prebiotik tepung talas FOC-1S sebagai media pertumbuhan L. plantarum-EPEC maupun L. acidophilus-EPEC bernilai positif yaitu 0,10 dan 0,11. Bahan pangan dinyatakan sebagai sumber prebiotik yang baik apabila memiliki nilai efek dan indeks prebiotik di atas 2,0 serta aktivitas prebiotik terhadap bakteri patogen di atas 0,25. Dengan demikian tepung talas FOC-1S merupakan sumber prebiotik karena memiliki sifat prebiotik yang lebih baik daripada kontrol serta tahan hidrolisis asam lambung.
SUMMARY
R. HARYO BIMO SETIARTO. Improvement Resistant Starch Content from Taro Flour by Fermentation and Autoclaving-Cooling and It Prebiotic Properties Evaluation. Supervised by SRI LAKSMI SURYAATMADJA, DIDAH NUR FARIDAH, dan IWAN SASKIAWAN.
Prebiotic is functional food component that can stimulate the growth of probiotic bacteria in the colon. Taro (Colocasia esculenta) was considered potential as a source of prebiotic because it contains resistant starch (3,5-4,0%) and oligosaccharides such as inulin (1,72 mg/g) and raffinose (8,60 mg/g). Taro has relatively high amylose content (25,78%) that can be converted into resistant starch by retrogradation process. The formation of resistant starch (RS) may be increased by performing fermentation using amylase-pullulanase producer Lactic Acid Bacteria (LAB) followed by autoclaving-cooling. The objectives of this research were: a) to obtain the LAB isolates with high activity of amylase and pullulanase, b) to select the best fermentation time and the number of cycle of autoclaving-cooling, c) to evaluate prebiotic properties of the modified taro flour.
Fourty one LAB isolates were selected based on activity of amylase and pullulanase. Two selected LAB isolates either single culture or mixed culture were used to ferment the taro slices for 0, 6, 12, 18 and 24 hours. After fermentation, taro slices were autoclaved and cooled by one and two cycles. Taro flour obtained from the optimum process was evaluated for prebiotic properties including prebiotic effect, index and activity. Other characteristics of the modified taro flour were also analyzed such as resistance to gastric acid, and viability of probiotic grown on taro flour.
Three isolates of LAB showed the highest amylase and pullulanase activity such as: Lactobacillus plantarum D-240 (2,57 U/mL and 2,72 U/mL),
Leuconostoc mesenteroides SU-LS 59 (2,70 U/mL and 2,88 U/mL), Leuconostoc mesenteroides SU-LS 67 (2,50 U/mL and 2,91 U/mL). Based on the average DP (degree of polymerization), the optimum fermentation conditions were achieved by using 2% of mixed culture of L. plantarum D-240 and Leu. mesentroides SU-LS 67 ratio (1:1) for 18 hour at value of 27,13.
Evaluation of prebiotic properties showed that modified taro flour FOC-1S improved it is resistancy to artificial gastric acid more than 87%. RS from taro flour FOC-1S had prebiotic effect by increasing the growth of probiotic bacteria (L. acidophilus and L. plantarum) of 2,6 (log cfu/ml) and 1,5 (log cfu/ml) respectively and prebiotic index were 2,1 (log cfu/ml) and 1,2 (log cfu/ml) respectively. Prebiotic activity of taro flour FOC-1S as growth media of L. plantarum-EPEC and L. acidophilus-EPEC were 0,10 and 0,11 respectively. Food materials can be classified as prebiotic sources if it had prebiotic effects, index (above 2,0) and prebiotic activity (above 0,25). Thus, taro flour FOC-1S is a good source of prebiotic because it has prebiotic properties better than control treatment and it also has resistance from gastric acid.
© Hak Cipta milik IPB, Tahun 2015
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian dan penulisan Karya Ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
PENINGKATAN PATI RESISTEN TEPUNG TALAS
MELALUI FERMENTASI DAN PEMANASAN
BERTEKANAN-PENDINGINAN SERTA SIFAT
PREBIOTIKNYA
R. HARYO BIMO SETIARTO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Peningkatan Pati Resisten Tepung Talas melalui
Fermentasi dan Pemanasan Bertekanan-Pendinginan serta Evaluasi Sifat Prebiotiknya
Nama : R. Haryo Bimo Setiarto NIM : F251130391
Disetujui: Komisi Pembimbing
Prof. Dr. Ir. Sri Laksmi Suryaatmadja, MS Ketua
Dr. Didah Nur Faridah, STP, M.Si Dr. Iwan Saskiawan Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Prof. Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Dr. Ir. Dahrul Syah, M.Sc Agr
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan nikmat dan kasih-Nya sehingga penulis dapat menyelesaikan pembuatan tesis berjudul Peningkatan Pati Resisten Tepung Talas melalui Fermentasi dan Pemanasan Bertekanan-Pendinginan serta Evaluasi Sifat Prebiotiknya. Penulisan tesis ini tidak terlepas dari bantuan dan dukungan baik secara moral maupun material dari berbagai pihak. Oleh karena itu pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada :
1. Ibu Prof. Dr. Ir. Betty Sri Laksmi Suryaatmadja, MS. sebagai ketua komisi pembimbing, Ibu Dr. Didah Nur Faridah, STP, M.Si dan Bapak Dr. Iwan Saskiawan selaku anggota komisi pembimbing atas arahan dan bimbingannya serta curahan ilmu yang diberikan dalam membantu kelancaran penulisan tesis ini.
2. Bapak Prof. Dr. Ir. Sugiyono, M.App.Sc yang telah bersedia menjadi penguji luar komisi dalam ujian sidang tesis serta ikut memberikan saran dan masukan untuk penyempurnaan tesis ini.
3. Ibu Dr. Sulistiani, S.Si, M.Kes dari Pusat Penelitian Biologi LIPI yang telah banyak membantu dalam penyediaan isolat bakteri asam laktat (BAL) dan proses identifikasi isolat BAL unggulan selama penelitian berlangsung.
4. Ibu Dra. Nunuk Widhyastuti, M.Si dan ibu Kasirah yang banyak membantu selama persiapan peralatan dan teknis penelitian di laboratorium biokimia mikroba Pusat Penelitian Biologi LIPI.
5. Seluruh staf peneliti dan teknisi di laboratorium Biokimia Mikroba Pusat Penelitian LIPI (ibu Tatik Khusniati, bapak Abdul Choliq, ibu Yati Soedaryati Soeka, ibu Rini Riffiani, ibu Nunik Sulistinah) atas bantuannya baik secara teknis maupun non-teknis di laboratorium.
6. Kementerian Negara Riset dan Teknologi yang telah memberikan beasiswa
pascasarjana karya siswa Ristek kepada penulis.
7. Dukungan penuh kedua orang tua (ibu Sri Gading Setiawati, BA dan alm bapak Drh. Soedarto), adikku tersayang (R. Haryo Tauhid Sulaiman) dan seluruh keluarga yang selalu memberikan doa, kasih sayang, motivasi, dan bantuan baik moril maupun material kepada penulis.
8. Seluruh teman-teman program studi Magister Ilmu Pangan khususnya angkatan tahun 2013 yang telah saling membantu dan menyemangati, serta semua pihak yang turut membantu penulis selama kuliah sampai dengan penulisan tesis ini.
Penulis menyadari penulisan tesis ini masih jauh dari kata sempurna, tiada gading yang tak retak. Semoga tesis ini dapat bermanfaat untuk pengembangan ilmu pengetahuan dan teknologi khususnya di bidang pangan.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xiv
1. PENDAHULUAN... ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Tujuan Penelitian ... 4
1.4. Manfaat Penelitian . ...4
1.5. Hipotesis Penelitian... ...4
2. TINJAUAN PUSTAKA... ... 5
2.1. Talas (Colocasia esculenta) . ...5
2.2. Kandungan Pati Resisten dan Indeks Prebiotik dari Berbagai Produk Tepung dan Pati……… . ………...6
2.3. BAL Penghasil Enzim Amilase dan pululanase ... 7
2.4. Pati Resisten………… . …………....………..9
2.5. Manfaat Pati Resisten sebagai Prebiotik .. ...9
2.6. Teknik Modifikasi untuk Peningkatan Pati Resisten ...11
2.7. Sifat Prebiotik Pati Resisten . ...16
2.8. Metode Evaluasi Sifat Prebiotik ………...17
3. METODE ... 20
3.1. Tempat dan Waktu Penelitian ... 20
3.2. Alat dan Bahan Percobaan... . 20
3.3. Diagram Alir Penelitian... . 21
3.4. Tahap 1: Seleksi BAL Penghasil Amilase dan Pululanase serta Aplikasinya dalam Fermentasi Talas………... .. 25
3.5. Tahap 2: Fermentasi BAL dan Siklus Pemanasan Bertekanan- Pendinginan untuk Pembuatan Tepung Talas Modifikasi... ... 26
3.6. Tahap 3: Evaluasi Sifat Prebiotik Tepung Talas Modifikasi... . 27
3.7. Metode Analisis... . 29
3.8. Rancangan Percobaan... . 38
3.9. Analisis Statistika...38
4. HASIL DAN PEMBAHASAN... ... 39
4.1. Seleksi BAL Penghasil Amilase dan Pululanase serta Aplikasinya dalam Fermentasi Talas... 39
4.1.1. Seleksi BAL Penghasil Amilase dan Pululanase……... 39
4.1.2. Penentuan Waktu Fermentasi dan Jenis Kultur Starter BAL Optimum... 42
4.2. Pengaruh Fermentasi dan Pemanasan Bertekanan-Pendinginan terhadap Sifat Kimia TTM... 45
4.2.1. Analisis Proksimat TTM………..… 45
4.2.3. Kadar Gula Pereduksi…...……... . 47
4.2.4. Kadar Amilosa dan Amilopektin…... . 48
4.2.5. Kadar Pati Resisten....…………... .. 49
4.2.6. Kadar Serat Pangan…………... .. 51
4.2.7. Daya Cerna……….………... .. 52
4.2.8. Analisis Korelasi Kadar Pati, Gula Pereduksi, Serat Pangan dan Daya Cerna TTM…... . 53
4.3. Sifat Prebiotik TTM... .. 56
4.3.1. Ketahanan RS Tepung Talas Modifikasi terhadap Cairan Lambung secara in-vitro………... .. 56
4.3.2. Viabilitas Bakteri Asam Laktat...……….. .. 58
4.3.3. Efek dan Indeks Prebiotik………. .. 61
4.3.4. Aktivitas Prebiotik terhadap Bakteri Penyebab Diare………... . 62
KESIMPULAN DAN SARAN... ... 64
DAFTAR PUSTAKA ... 65
LAMPIRAN. ... .72
RIWAYAT HIDUP ... 96
DAFTAR TABEL
1. Kandungan gizi dalam 100 g umbi dan tepung talas ... 52. Kandungan RS, pati non-RS, total pati, indeks prebiotik pada Berbagai produk tepung dan pati ... 6
3. Hasil penelitian fermentasi BAL penghasil amilase dan pululanase pada bahan pangan yang mengandung pati ... 8
4. Penelitian teknik modifikasi peningkatan RS pada bahan pangan ... 12
5. Penelitian untuk peningkatan RS dengan debranching pululanase ... 16
6. Beberapa metode evaluasi sifat prebiotik ... 18
7. Hasil seleksi isolat BAL berdasarkan aktivitas amilase, pululanase dan total koloni BAL ... 40
8. Perubahan pH selama fermentasi talas... 42
9. Perubahan jumlah total koloni BAL selama fermentasi talas ... 43
10.Perubahan derajat polimerisasi (DP) selama fermentasi talas ... 44
11.Hasil analisis proksimat terhadap sampel TTM ... 46
DAFTAR GAMBAR
1. Mekanisme pembentukan RS dengan autoclaving-cooling melalui
proses retrogradasi ... 13
2. Debranching ikatan percabangan amilopektin oleh pululanase ... 15
3. Diagram alir metode penelitian secara umum... 21
4. Diagram alir seleksi BAL dan penentuan waktu fermentasi optimum irisan talas oleh kultur BAL ... 22
5. Diagram alir pembuatan TTM dengan fermentasi BAL dan siklus autoclaving-cooling ... 23
6. Diagram alirevaluasi sifat prebiotik RS TTM ... 24
7. Pengaruh fermentasi dan OC terhadap kadar total pati TTM ... 47
8. Pengaruh fermentasi dan OC terhadap kadar gula pereduksi TTM ... 48
9. Pengaruh fermentasi dan OC terhadap amilosa, amilopektin TTM... 49
10.Pengaruh fermentasi dan OC terhadap kadar pati resisten TTM ... 50
11.Pengaruh fermentasi dan OC terhadap kadar serat pangan TTM ... 51
12.Pengaruh fermentasi dan OC terhadap daya cerna in-vitro TTM ... 52
13.Kurva korelasi hubungan antara berbagai parameter kimia TTM ... 54
14.Grafik ketahanan RS3 tepung talas modifikasi oleh asam lambung artifisial secara in-vitro pada pH1, 2, 3, 4, 5 ... 57
15.Viabilitas L. acidophilus pada media yang mengandung TTM dibanding dengan inulin setelah 24 jam ... 59
16.Viabilitas L. plantarum pada media yang mengandung TTM dibanding dengan inulin setelah 24 jam ... 59
17.Efek dan indeks prebiotik TTM terhadap bakteri probiotik L. plantarum dan L. acidophilus ... 61
18.Aktivitas prebiotik TTM terhadap L. plantarum-EPECdan terhadap L. acidophilus-EPEC ... 63
DAFTAR LAMPIRAN
1. Dokumentasi proses pembuatan TTM ... 732. Karakteristik fisik TTM dengan berbagai variasi perlakuan ... 76
3. Perhitungan analisis kadar total pati pada TTM ... 77
4. Perhitungan analisis kadar gula pereduksi pada TTM ... 78
5. Perhitungan analisis kadar amilosa pada TTM ... 80
6. Perhitungan analisis kadar pati resisten (RS) pada TTM ... 81
7. Perhitungan analisis daya cerna in-vitro pada TTM ... 83
8. Perhitungan analisis kadar serat pangan TTM ... 85
9. Rekapitulasi analisis sifat kimia TTM ... 86
10.Perhitungan analisis proksimat TTM ... 87
11.Perhitungan hasil evaluasi sifat prebiotik ... 89
12.Perhitungan jumlah RS tepung talas yang terhidrolisis oleh asam lambung secara in-vitro ... 91
1. PENDAHULUAN
1.1. Latar BelakangPerkembangan ilmu pengetahuan dan teknologi telah menyebabkan perubahan trend konsumsi pangan. Saat ini konsumen tidak hanya menilai pangan dari segi nutrisi, sensorik dan keamanan tetapi juga mempertimbangkan efek pangan bagi kesehatan. Pangan fungsional adalah pangan yang bersifat aman, memiliki nilai gizi dan efek positif bagi kesehatan. Salah satu komponen bahan pangan fungsional yang dikembangkan sampai saat ini adalah prebiotik. Prebiotik adalah komponen bahan pangan yang bermanfaat bagi manusia karena dapat menstimulasi pertumbuhan dan aktivitas sejumlah bakteri probiotik dalam kolon sehingga dapat memperbaiki kesehatan saluran pencernaan manusia (Toma dan Pokrotnieks 2006, Wells et al. 2008).
Kajian untuk mengungkap pemanfaatan bahan pangan sebagai sumber prebiotik telah dilakukan melalui evaluasi sifat prebiotik baik secara in-vitro
maupun in-vivo. Beberapa penelitian yang bersifat in-vitro diantaranya adalah analisis efek prebiotik dan indeks prebiotik (Robertfroid 2007), aktivitas prebiotik terhadap bakteri patogen (Huebner et al. 2007), uji viabilitas bakteri asam laktat (BAL) (Kim JH 2009), ketahanan terhadap asam lambung (Wicheinchot et al.
2010), serta analisis asam lemak rantai pendek sebagai hasil fermentasi bakteri probiotik (Lesmes et al. 2009). Penelitian in-vivo dilakukan dengan memberikan pakan prebiotik pada tikus percobaan yang dilanjutkan dengan analisis jumlah koloni bakteri probiotik pada feses tikus (Nuraida et al. 2008, Arief et al. 2010). Vrese dan Marteau (2007) melaporkan bahwa bahan pangan dinyatakan sebagai sumber prebiotik yang baik apabila memiliki nilai efek prebiotik dan indeks prebiotik di atas 2,0 serta aktivitas prebiotik terhadap bakteri patogen di atas 0,25.
Granato et al. (2013) melaporkan bahwa produk prebiotik yang digunakan sebagai ingridien, suplemen, dan makanan di pasar global mencapai angka penjualan sebesar 14,9 milyar USD pada tahun 2011 dan 16 milyar USD tahun 2012, serta diestimasikan mencapai 19,6 milyar USD pada tahun 2013. Trend penjualan produk prebiotik terus meningkat di tahun 2014 sebesar 22,4 milyar USD dan sudah mencapai 23,5 milyar USD di awal tahun 2015 (FAO 2015). Tingkat harapan konsumen terhadap variasi jenis produk prebiotik meningkat secara signifikan sejak 5 lima tahun terakhir (Granato et al. 2013). Hal ini mendorong industri pangan untuk melakukan inovasi dan mengembangkan jenis produk prebiotik baru.
Produk prebiotik yang paling banyak dikomersialisasikan adalah golongan oligosakarida seperti FOS (Frukto Oligo Sakarida), GOS (Galakto Oligo Sakarida), rafinosa dan inulin yaitu mewakili 71,9 % penjualan prebiotik di tahun 2013 (Granato et al. 2013). Prebiotik pada produk pangan sebagian besar diaplikasikan pada produk susu formula untuk menstimulasi pertumbuhan bakteri probiotik. Toole dan Cooney (2008) melaporkan bahwa pemberian susu formula yang difortifikasi dengan campuran GOS/FOS dengan konsentrasi 0,4 g/100 ml atau 0,8 g/100 ml selama 28 hari menunjukkan peningkatan Bifidobacterium bifidum dan Lactobacillus sp. dalam feses sebesar 1 log.
merupakan pati yang tidak dapat dicerna oleh enzim pencernaan dan tahan terhadap asam lambung sehingga dapat mencapai usus besar untuk difermentasi oleh bakteri probiotik (Sajilata et al. 2006 dan Zaragoza et al. 2010). RS memiliki kelebihan sebagai prebiotik jika dibandingkan dengan FOS dan inulin yaitu mampu mengikat dan mempertahankan kadar air dalam feses, sehingga tidak menyebabkan sembelit dan flatulensi jika dikonsumsi dalam jumlah besar (Ozturk
et al. 2011 dan Vatanasuchart et al. 2012). Selain itu, RS digolongkan sebagai sumber serat tidak larut dan mampu menurunkan kolesterol dan indeks glikemik (Okoniewska dan Witwer 2007), mencegah terjadinya kanker kolon melalui pembentukan asam lemak rantai pendek (Hovhannisyan et al. 2009), mereduksi pembentukan batu empedu, dan membantu penyerapan mineral (Lesmes et al.
2009). FAO (2015) telah merekomendasikan konsumsi RS sebanyak 15-20 gram setiap hari untuk memperoleh manfaat bagi kesehatan.
Berbagai upaya untuk meningkatkan kadar pati resisten pada bahan pangan telah dilakukan. Pemberian pemanasan bertekanan-pendinginan 5 siklus pada pati garut meningkatkan kadar RS hingga 5 kali lipat dari 2,12 % menjadi 10,91% (Sugiyono et al. 2009). Kombinasi hidrolisis asam dan 3 siklus pemanasan bertekanan-pendinginan juga dapat meningkatkan kadar RS pada pati garut sebesar 5,6 kali lipat (Faridah et al. 2013). Dalam upaya untuk mengurangi jumlah siklus pemanasan bertekanan-pendinginan (autoclaving-cooling/ OC), Jenie et al. (2012) telah menerapkan fermentasi bakteri asam laktat (BAL) terhadap irisan pisang tanduk sebagai pra perlakuan dengan 1 siklus OC sehingga terjadi peningkatan kadar RS tepung pisang tanduk sebesar 2 kali lipat (dari 5,87-6,45% menjadi 12,99-13,71%) yang setara dengan 2 siklus OC tanpa fermentasi.
Talas bogor sebagai komoditas lokal tersedia secara melimpah dengan produktivitas sebesar 68.000 ton/ hektar (Badan Pusat Statistik 2012), sehingga dapat diolah menjadi tepung talas kaya RS. Talas bogor varietas pandan memiliki kandungan amilosa tertinggi yaitu 25,78% jika dibandingkan dengan varietas lampung (23,12%) dan varietas sutera (24,56%) (Rahmawati et al. 2012), sehingga kadar RS pada talas dapat ditingkatkan melalui proses retrogradasi. Selain mengandung RS, talas juga mengandung oligosakarida seperti inulin (1,72 mg/g) dan rafinosa (8,6 mg/g) serta komponen serat pangan lain yang berperan sebagai prebiotik (Njintang et al. 2007).
1.2. Rumusan Masalah
Talas berpotensi untuk dimanfaatkan sebagai sumber RS, akan tetapi kadar RS alami dari talas tergolong rendah (3,5-4,0 % bk), sehingga perlu ditingkatkan melalui modifikasi proses pengolahannya (Moongngarm 2013). Peningkatan kadar RS pada suatu bahan pangan akan berdampak terhadap peningkatan sifat prebiotiknya (Ozturk et al. 2011). Jenie et al. (2012) melaporkan bahwa kombinasi fermentasi kultur campuran BAL (L. plantarum dan L. fermentum) dengan pemanasan bertekanan-pendinginan telah terbukti dapat meningkatkan kadar RS pada tepung pisang tanduk dengan mengurangi jumlah siklus pemanasan bertekanan-pendinginan. Akan tetapi waktu fermentasi yang digunakan masih terlalu lama (72 jam) sehingga perlu dioptimalkan. Waktu fermentasi kultur campuran BAL yang terlalu lama justru menyebabkan hidrolisis berlebihan terhadap amilosa dan amilopektin sehingga membentuk gula sederhana dengan DP (di bawah 10) yang menghambat proses retrogradasi, akibatnya kadar RS yang dihasilkan akan lebih rendah. Nurhayati et al. (2014) melaporkan bahwa lama fermentasi irisan pisang tanduk untuk meningkatkan kadar RS dapat diefisienkan menjadi 24 jam dengan memanfaatkan kultur Lactobacillus salivarius FSnh1. Sementara itu Widaningrum et al. (2013) melaporkan bahwa kultur Lactobacillus plantarum BSL dapat dimanfaatkan untuk mengefisienkan lama fermentasi pada irisan pisang uli menjadi 24 jam pada produksi tepung pisang uli modifikasi kaya RS.
Pada penelitian ini dilakukan seleksi terhadap 41 isolat BAL berdasarkan aktivitas enzim amilase dan pululanase yang dihasilkan. Isolat BAL dengan aktivitas amilase dan pululanase tertinggi selanjutnya dioptimasi untuk mempersingkat waktu fermentasi talas (kurang dari 24 jam). Pemanfaatan isolat BAL terseleksi diharapkan dapat mempersingkat waktu fermentasi dengan menurunkan derajat polimerisasi (DP) pati talas. Optimasi waktu fermentasi dilakukan berdasarkan parameter DP yang diperlukan untuk pembentukan amilosa rantai pendek (19-29) sebagai bahan baku pembentukan RS. Fermentasi irisan talas oleh BAL penghasil amilase dan pululanase dilanjutkan dengan pemanasan bertekanan-pendinginan sehingga terjadi retrogradasi pati yang akan meningkatkan RS pada Tepung Talas Modifikasi (TTM).
Sajilata et al. (2006) dan Zaragoza et al. (2010) melaporkan bahwa semakin banyak jumlah siklus pemanasan bertekanan-pendinginan yang diterapkan maka akan semakin tinggi kadar RS yang diperoleh. Hal ini tentu sangat berpengaruh terhadap besarnya biaya produksi, energi serta waktu produksi yang lebih lama. Pada penelitian ini ditentukan jumlah siklus pemanasan bertekanan-pendinginan yang paling optimal. Selanjutnya, fermentasi BAL penghasil amilase dan pululanase yang dilakukan sebelum pemanasan diharapkan dapat mengurangi jumlah siklus pemanasan bertekanan-pendinginan.
Untuk mengevaluasi sifat prebiotik pada TTM kaya RS dilakukan analisis sifat prebiotik secara in-vitro dengan menguji ketahanannya terhadap asam lambung (HCl), viabilitias probiotik, analisis efek, indeks dan aktivitas prebiotik dengan mengukur pertumbuhan bakteri probiotik (Lactobacillus acidophilus
1.3. Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk memperoleh teknologi proses pembuatan TTM kaya RS melalui proses fermentasi BAL penghasil amilase dan pululanase yang dilanjutkan dengan pemanasan bertekanan-pendinginan serta mengetahui sifat prebiotik TTM. Secara rinci tujuan dari penelitian adalah:
1. Menyeleksi isolat BAL berdasarkan aktivitas enzim amilase dan pululanase tertinggi untuk selanjutnya digunakan sebagai starter fermentasi talas.
2. Menentukan waktu fermentasi talas optimum dengan mengaplikasikan isolat BAL unggulan dalam pembuatan TTM kaya RS.
3. Menentukan perlakuan optimum kombinasi fermentasi dengan siklus pemanasan bertekanan-pendinginan pada pembuatan TTM kaya RS.
4. Mengevaluasi sifat prebiotik TTM kaya RS.
1.4. Manfaat Penelitian
Manfaat dari penelitian ini adalah diperolehnya teknologi proses pembuatan TTM kaya RS yang dapat dimanfaatkan untuk pengembangan produk RS dari sumber karbohidrat yang lain. Di samping itu TTM yang dihasilkan dapat dimanfaatkan untuk pengembangan berbagai ragam pangan fungsional berbasis tepung talas.
1.5. Hipotesis Penelitian
Hipotesis penelitian adalah:
1. Isolat BAL unggulan dengan aktivitas amilase dan pululanase tertinggi akan mempersingkat waktu fermentasi talas dengan menurunkan derajat polimerisasi (DP) pati talas.
2. Fermentasi BAL penghasil amilase dan pululanase mampu mengefisienkan jumlah siklus pemanasan bertekanan-pendinginan yang diterapkan selama produksi TTM kaya RS.
2. TINJAUAN PUSTAKA
2.1. Talas Bogor (Colocasia esculenta)Komponen nutrisi tertinggi di dalam talas adalah karbohidrat dengan kandungan pati mencapai 77,9 % yang terdiri dari amilosa sebesar 25,78 % dan amilopektin sebesar 52,12 % (Agama-Avecado et. al 2011). Kandungan amilosa tinggi pada talas bogor dapat dimanfaatkan untuk meningkatkan kadar RS melalui produksi Tepung Talas Modifikasi (TTM). Kandungan nutrisi lain di dalam talas adalah protein (1,9 %) yang lebih tinggi jika dibandingkan dengan singkong (1,2 %) dan ubi jalar (1,8 %) (Njintang et al. 2007). Kandungan protein di dalam talas mengandung beragam asam amino esensial namun rendah histidin, lisin, isoleusin, triptofan dan metionin(Njintang dan Mbofung 2006).
Selain protein, talas juga kaya akan vitamin dan mineral esensial seperti vitamin C, kalsium, fosfor dan zat besi. Di samping itu talas juga mengandung serat pangan yaitu selulosa, hemiselulosa dan verbaskosa yang cukup tinggi (Mbofung et al. 2006). Kehadiran serat pangan tersebut sangat baik untuk menjaga kesehatan saluran pencernaan (Njintang et al. 2007). Mbofung et al.
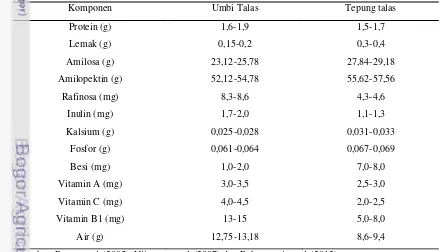
(2006) melaporkan bahwa tepung talas memiliki sifat fungsional karena mengandung serat (12,57 %), pati resisten (3,5 - 4,0 %) serta komponen oligosakarida yaitu inulin (1,7 mg/g) dan rafinosa (8,6 mg/g) sehingga berpotensi sebagai sumber prebiotik. Kadar beberapa komponen makronutrien dan mikronutrien dari umbi talas dan tepung talas dapat dilihat pada Tabel 1.
Tabel 1. Kandungan gizi dalam 100 g umbi talas dan tepung talas
Komponen Umbi Talas Tepung talas
Protein (g) 1,6-1,9 1,5-1,7
menyebabkan pembentukan batu oksalat atau batu ginjal (Griffins dan Abrams 2008). Selain itu, adanya oksalat dapat menurunkan penyerapan kalsium oleh tubuh dan menyebabkan timbulnya rasa gatal, sensasi terbakar serta iritasi pada kulit, mulut, tenggorokan (Dahal dan Swamylingappa, 2006). Secara biologis kandungan kalsium oksalat dapat dihilangkan dengan fermentasi anaerobik memanfaatkan mikroba Lactobacillus plantarum, Rhyzopus oryzae, Saccharomyces cerevisiae, maupun Candida utilis (Dahal dan Swamylingappa, 2006). Selain itu perendaman dengan larutan garam 1 % selama 20 menit dilaporkan dapat menurunkan kadar oksalat secara maksimal hingga 37,2 % (menjadi 22,98 ppm) serta mengurangi efek gatal pada talas (Aboubakar et al.
2008).
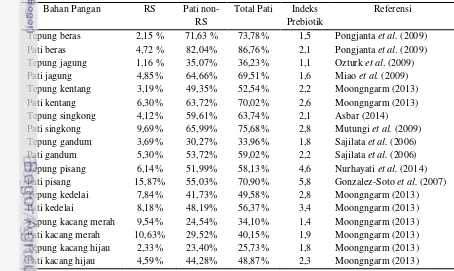
2.2. Kandungan Pati Resisten dan Indeks Prebiotik dari Berbagai Produk Tepung dan Pati
Perbedaan kandungan pati resisten pada berbagai bahan pangan sangat dipengaruhi oleh kandungan total pati, rasio amilosa dan amilopektin, teknologi pengolahan pangan, teknik penyimpanan bahan pangan sebelum dikonsumsi, dan daya cerna suatu bahan pangan (Zaragoza et al. 2010 dan Moongngarm 2013). Pada Tabel 2 ditunjukkan informasi tentang kandungan RS, pati non-RS, total pati dan indeks prebiotik pada berbagai produk tepung dan pati.
pemanfaatannya. Pati merupakan penyusun utama tepung yang hanya mengandung amilosa dan amilopektin (Moongngarm 2013). Pada pembuatan tepung, seluruh komponen yang terkandung di dalam bahan pangan tetap dipertahankan keberadaannya sehingga tepung tidak hanya mengandung pati karena masih tercampur dengan protein, lemak, serat, vitamin dan mineral. Sementara itu pada pembuatan pati pada prinsipnya hanya mengekstrak kandungan patinya saja, sehingga komponen bahan pangan lain seperti lemak, protein dan serat pangan akan ikut terbuang pada proses pembuatan pati (Moongngarm 2013).
Moongngarm (2013) melaporkan bahwa kadar RS suatu bahan pangan yang dimodifikasi dalam bentuk tepung lebih rendah jika dibandingkan dalam bentuk pati. Hal ini dikarenakan adanya interaksi antara amilosa dengan senyawa lain seperti protein, lipid, maupun mineral yang dapat mengganggu terjadinya pembentukan RS pada tepung. Sementara itu dalam bentuk pati, senyawa amilosa dan amilopektin diekstrak dari komponen senyawa lainnya sehingga proses pembentukan RS dapat terjadi dengan lebih mudah.
Toma dan Pokrotnieks (2006) serta Huebner et al. (2007) melaporkan bahwa indeks prebiotik bahan pangan dalam bentuk pati lebih tinggi jika dibandingkan dengan dalam bentuk tepung. Hal ini dipengaruhi oleh lebih tingginya kadar RS bahan pangan dalam bentuk pati jika dibandingkan dengan dalam bentuk tepung. Kadar RS yang lebih tinggi tersebut dapat menstimulasi pertumbuhan bakteri probiotik seperti Lactobacillus sp. dan Bifidobacterium sp yang diindikasikan dengan peningkatan nilai indeks prebiotiknya (Robertfroid 2007 dan Lesmes et al. 2009).
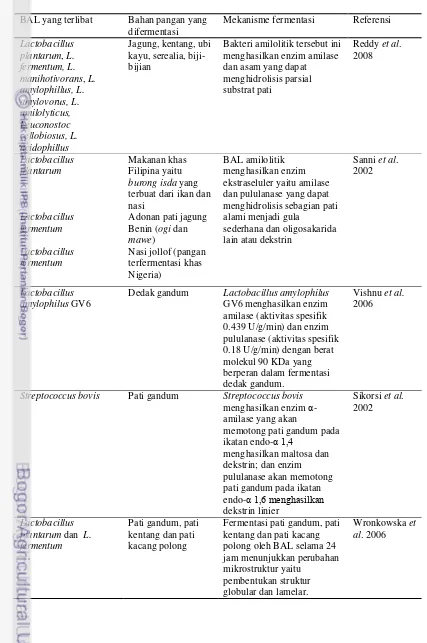
2.3. BAL Penghasil Enzim Amilase dan Pululanase
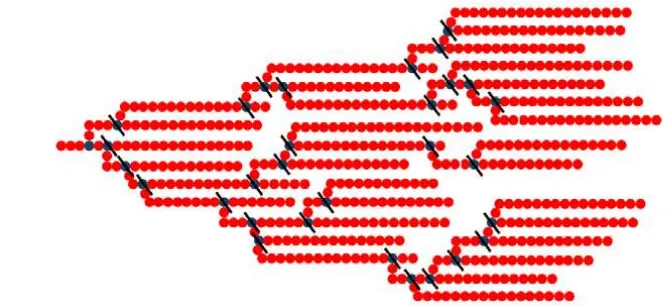
Bakteri asam laktat (BAL) merupakan kelompok bakteri gram positif, katalase negatif yang dapat memproduksi asam laktat dengan cara memfermentasi karbohidrat. Bakteri asam laktat yang memiliki kemampuan memanfaatkan pati sebagai substratnya dikenal sebagai bakteri asam laktat penghasil enzim amilase dan pululanase (Moradi et al. 2014). Enzim alfa amilase (EC 3.2.1.1) adalah enzim yang mengkatalisis reaksi hidrolisis ikatan α-1,4 glikosida pada amilosa secara acak menghasilkan campuran dekstrin, maltosa dan glukosa (Bhanwar dan Ganguli 2014). Sementara itu enzim pululanase (amilopektin 6 – glucanohydrolase, EC 3.2.1.41) adalah eksoenzim yang mengkatalisis hidrolisis α-1,6 penghubung amilopektin dan polisakarida lain untuk menghasilkan oligosakarida rantai pendek (Asha et al. 2013).
Tabel 3. Hasil penelitian fermentasi BAL penghasil amilase dan pululanase pada bahan pangan yang mengandung pati
BAL yang terlibat Bahan pangan yang
difermentasi
Streptococcus bovis Pati gandum Streptococcus bovis
-2.4. Pati Resisten
Pati dapat dibedakan berdasarkan daya cernanya oleh enzim amilase. Klasifikasi pati berdasarkan daya cernanya terdiri atas tiga yaitu pati yang dicerna dengan cepat (Rapidly Digestible Starch), pati yang dicerna dengan lambat (Slowly Digestible Starch), dan pati resisten (Resistant Starch). (Sajilata et al.
2006). Sejumlah besar pati yang tidak dapat dicerna (RS) masuk ke dalam usus besar dan merupakan substrat yang penting bagi mikroflora kolon. RS dapat terukur bersama-sama dengan serat dalam bahan pangan sebagai komponen serat pangan tidak larut.
Pati resisten (RS) diklasifikasikan dalam lima kelompok berdasarkan pada asal dan cara proses pembuatannya, yaitu tipe RS1, RS2, RS3, RS4, RS 5 (Sajilata
et al. 2006, Zaragoza et al. 2010, Birt et al. 2013). Pati resisten tipe I (RS1) merupakan pati yang terdapat secara alamiah dan secara fisik terperangkap dalam sel-sel tanaman dan matriks dalam bahan pangan kaya pati, terutama dari biji-bijian dan sereal. Jumlah RS1 dipengaruhi oleh proses pengolahan dan dapat dikurangi atau dihilangkan dengan penggilingan. Pati resisten tipe II (RS2) merupakan pati yang secara alami sangat resisten terhadap pencernaan oleh enzim α-amilase dan umumnya granulanya berbentuk kristalin. Sumber RS2 antara lain pisang dan kentang yang masih mentah, serta jenis pati jagung dengan kadar amilosa yang tinggi. Pati resisten tipe III (RS3) adalah pati teretrogradasi yang diproses dengan pemanasan otoklaf (1210C), annealing, HMT (heat moisture treatment) dan dilanjutkan dengan pendinginan pada suhu rendah (40C) maupun
pada suhu ruang sehingga mengalami retrogradasi. Retrogradasi pati terjadi melalui reasosiasi (penyusunan kembali) ikatan hidrogen antara amilosa rantai pendek yang terbentuk setelah proses pemanasan otoklaf dan dipercepat melalui proses pendinginan. Pati resisten tipe IV (RS4) adalah pati termodifikasi secara kimia seperti pati ester maupun pati ikatan silang (Sajilata et al. 2006 dan Zaragoza et al. 2010).
Pati resisten tipe V (RS5) terbentuk ketika pati berinteraksi dengan lipid, sehingga amilosa membentuk kompleks heliks tunggal dengan asam lemak dan lemak alkohol. Rantai linear pati dalam struktur heliks akan membentuk kompleks dengan asam lemak dalam rongga heliks, sehingga pati akan saling mengikat dan sulit dihidrolisis oleh enzim amilase. Karena pembentukan kompleks amilosa-lipid adalah reaksi instan dan kompleks dapat terbentuk setelah proses pemasakan, maka RS5 dianggap stabil terhadap pemanasan (Birt et al. 2013).
Dari semua jenis RS, RS3 adalah yang paling menarik perhatian karena RS tipe ini dapat mempertahankan karakteristik organoleptik ketika ditambahkan pada makanan (Lehmann et al 2002). RS tipe ini relatif tahan panas dibandingkan RS tipe lainnya sehingga RS3 stabil selama proses pengolahan pangan (Zaragoza
et al 2010). RS3 merupakan jenis RS yang paling banyak digunakan sebagai bahan baku fungsional berbasis RS. Kandungan RS3 dalam bahan pangan alami umumnya rendah, oleh karena itu perlu ditingkatkan kadarnya melalui teknik modifikasi.
2.5. Manfaat Pati Resisten Sebagai Prebiotik
imun, menghambat patogen di intestinal, dan mereduksi konstipasi (Vanhoutte et al. 2006). RS3 juga meningkatkan jumlah Lactobacillus pada fekal dan sekum tikus serta meningkatkan jumlah Bifidobacteria (bersifat bifidogenik) setelah dilakukan pengujian pada manusia (Bouhnik et al 2004). RS3 juga dilaporkan mampu menekan pertumbuhan bakteri patogen Escherichia coli. Total koliform dan E. coli menurun dalam kolon proksimal dari 7-8 log cfu/g menjadi 6 log cfu/g (Crittenden et al 2005).
RS dapat difermentasi oleh bakteri probiotik sehingga dihasilkan asam lemak rantai pendek (short chain fatty acid atau SCFA). Lesmes et al. (2009) melaporkan bahwa feses tikus percobaan mengandung asam lemak rantai pendek dua kali lebih banyak pada tikus yang diberi konsumsi 20% RS3 daripada tikus yang diberi konsumsi glukosa 20% pada pakannya. Schmiedl et al. (2000) melaporkan bahwa fermentasi RS oleh bakteri probiotik banyak mengandung SCFA seperti asam asetat, propionat dan butirat. Hovhannisyan et al. (2009) melaporkan bahwa konsentrasi asam asetat lebih tinggi dihasilkan dari fermentasi RS3, sedangkan asam propionat lebih tinggi dihasilkan dari fermentasi RS2. Asam butirat dihasilkan dari RS3 yang diisolasi dari tepung pisang hasil modifikasi fermentasi spontan dengan dua siklus pemanasan bertekanan-pendinginan (Gonzalez-Soto et al. 2007). SCFA tersebut menyebabkan usus menjadi asam dan akhirnya menekan pertumbuhan bakteri patogen penyebab radang usus seperti Entero Pathogenic Escherichia coli (EPEC) dan Clostridium perfringens (Toma dan Pokrotnieks 2006). SCFA juga mampu menurunkan pH usus, meningkatkan absorpsi kalsium, mengurangi penyerapan amonia dan amina sehingga dapat mencegah tekanan darah tinggi (Toole dan Cooney 2008).
Manfaat lain dari SCFA di antaranya asam asetat untuk metabolisme jaringan otot, ginjal, hati dan otak manusia, sedangkan asam propionat merupakan prekursor glukoneogenik yang mampu menekan pembentukan kolesterol dalam tubuh (Manning et al. 2004). Asam butirat menyediakan sekitar 50% energi yang rutin diperlukan oleh mukosa gastrointestinal (Toole dan Cooney 2008). Dalam perkembangan riset terakhir diketahui bahwa asam butirat tidak hanya sebagai sumber energi bagi sel-sel mukosa, akan tetapi juga diperlukan untuk pro-diferensiasi, anti-proliferasi dan anti-angiogenik yang berperan dalam mencegah kanker kolon (Vanhoute 2006). Pada konsentrasi 2-4 mM, asam butirat mampu mereduksi mikronukleus sehingga dapat melindungi sel dari kanker kolon akibat terpapar senyawa genotoksik seperti H2O2 dan Fe-NTA (Hovhannisyan et al.
2009).
Keberadaan RS dalam usus halus dapat menurunkan respon glikemik dan insulemik pada penderita diabetes dan penderita hiperinsulemik (Okoniewska dan Witwer 2007). Pati resisten juga berpotensi memperbaiki sensitivitas hormon insulin (Robertson et al. 2005). RS dapat mencapai kolon tanpa mengalami perubahan dan berkontribusi sebagai serat pangan. Fermentasi RS dalam usus besar oleh mikroorganisme mampu meningkatkan massa feses. Peningkatan massa feses mempengaruhi berbagai agen genotoksik dalam usus besar, sehingga mereduksi kerusakan DNA dalam sel kolon (Toma dan Pokrotnieks 2006).
Menurut Okoniewska dan Witwer (2007) pati resisten meningkatkan rasa kenyang karena mampu meningkatkan ekspresi genetik penstimulasi rasa kenyang yang dihubungkan pada hormon GLP-1 dan PYY dalam usus besar. Higgins et al.
(2006) juga melaporkan bahwa RS secara signifikan mencegah peningkatan berat badan dalam jangka waktu yang lama.
Konsumsi RS3 juga dapat mencegah pertumbuhan sel tumor, menurunkan proliferasi sel, meningkatkan apoptosis, menginduksi protein kinase C-δ (PKC-δ), menginduksi ekspresi protein heat shock (HSP 25), tetapi menghambat glutation peroksidase gastrointestinal (GI-GPx), dan mencegah karsinogenesis kolon (Marinovic et al. 2006). Ramakrishna et al. (2008) melaporkan bahwa pati resisten mampu mereduksi kehilangan cairan fekal dan memperpendek durasi diare pada remaja dan orang dewasa penderita kolera dan mereduksi pertumbuhan
Vibrio cholera penyebab kolera.
2.6. Teknik Modifikasi untuk Peningkatan Pati Resisten
Kandungan RS dapat ditingkatkan dengan beberapa cara, diantaranya yaitu pemanasan bertekanan-pendinginan beberapa siklus, proses hidrolisis asam di bawah suhu gelatinisasi (proses lintnerisasi), perlakuan hidrotermal dan pemutusan rantai cabang amilopektin (debranching) dengan enzim pululanase yang dikombinasikan dengan pemanasan bertekanan-pendinginan (Zaragoza et al.
2010 dan Faridah 2011). Kandungan RS dipengaruhi oleh nisbah amilosa dan amilopektin, konsentrasi enzim pululanase, konsentrasi pati, suhu pemanasan, siklus pemanasan dan pendinginan, kondisi penyimpanan dan adanya lipid atau substansi bermolekul rendah seperti gula (Lehmann et al. 2002, Sajilata et al.
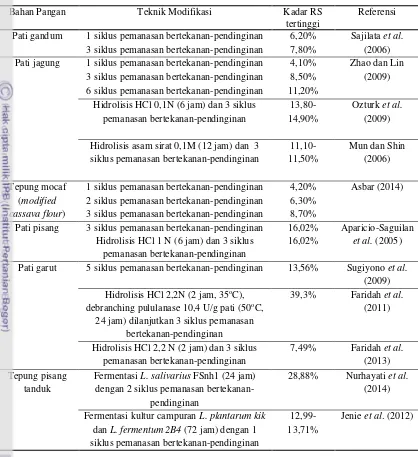
2006). Analisis daya cerna pati merupakan salah satu parameter yang digunakan untuk mengetahui pengaruh perlakuan modifikasi pati terhadap kadar RS yang dihasilkan (Anderson et al. 2002). Daya cerna pati yang lebih rendah mengindikasikan kadar RS yang meningkat. Berbagai teknik modifikasi untuk peningkatan kadar RS ditunjukkan pada Tabel 4.
2.6.1 Modifikasi RS dengan Siklus Pemanasan Bertekanan dan Pendinginan
Teknik modifikasi peningkatan pati resisten dengan siklus autoclaving-cooling telah dilaporkan oleh banyak peneliti, seperti Aparicio-Saguilan et al.
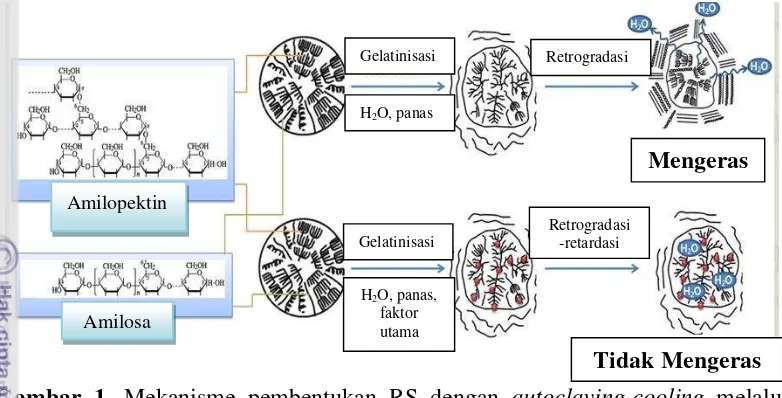
(2005); Gonzalez-Soto et al. (2007), Zabar et al. (2008), Sugiyono et al. (2009), Faridah (2011), Vatanasuchart et al. (2012), Asbar (2014). Prinsip dari teknik tersebut adalah pati disuspensikan dahulu dalam air dengan nisbah penambahan air tertentu (1:2 hingga 1:5). Suspensi pati tersebut kemudian dipanaskan dengan menggunakan otoklaf yang mengakibatkan pati tergelatinisasi secara sempurna dan keluarnya fraksi amilosa dari granula pati. Selanjutnya pasta pati didinginkan yang dapat menyebabkan fraksi amilosa mengalami retrogradasi seperti ditunjukkan pada Gambar 1. Kadar RS3 dapat ditingkatkan dengan perlakuan
autoclaving-cooling secara berulang. Produksi RS3 pada dasarnya melalui tiga
tahapan proses: pemutusan cabang, gelatinisasi, dan retrogradasi pati native (alami)
pada kondisi-kondisi yang dioptimalkan yaitu suhu penyimpanan dan konsentrasi pati
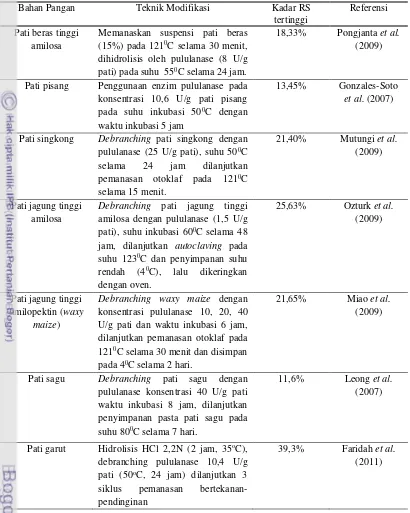
Tabel 4. Berbagai penelitian tentang teknik modifikasi peningkatan RS pada berbagai bahan pangan
Bahan Pangan Teknik Modifikasi Kadar RS
tertinggi
Referensi
Pati gandum 1 sikluspemanasan bertekanan-pendinginan 6,20% Sajilata et al.
(2006)
3 sikluspemanasan bertekanan-pendinginan 7,80%
Pati jagung 1 sikluspemanasan bertekanan-pendinginan 4,10% Zhao dan Lin
(2009)
3 sikluspemanasan bertekanan-pendinginan 8,50%
6 sikluspemanasan bertekanan-pendinginan 11,20%
Hidrolisis HCl 0,1N (6 jam) dan 3 siklus pemanasan bertekanan-pendinginan
13,80-14,90%
Ozturk et al.
(2009)
Hidrolisis asam sirat 0,1M (12 jam) dan 3 siklus pemanasan bertekanan-pendinginan
1 sikluspemanasan bertekanan-pendinginan 4,20% Asbar (2014)
2 sikluspemanasan bertekanan-pendinginan 6,30%
3 sikluspemanasan bertekanan-pendinginan 8,70%
Pati pisang 3 sikluspemanasan bertekanan-pendinginan 16,02% Aparicio-Saguilan
et al. (2005) Hidrolisis HCl 1 N (6 jam) dan 3 siklus
pemanasan bertekanan-pendinginan
16,02%
Pati garut 5 sikluspemanasan bertekanan-pendinginan 13,56% Sugiyono et al.
(2009) Hidrolisis HCl 2,2N (2 jam, 35oC),
debranching pululanase 10,4 U/g pati (50oC,
24 jam) dilanjutkan 3 siklus pemanasan bertekanan-pendinginan
39,3% Faridah et al.
(2011)
Hidrolisis HCl 2,2 N (2 jam) dan 3 siklus pemanasan bertekanan-pendinginan
7,49% Faridah et al.
(2013) Tepung pisang
tanduk
Fermentasi L. salivarius FSnh1 (24 jam)
dengan 2 siklus pemanasan bertekanan-pendinginan
28,88% Nurhayati et al.
(2014)
Fermentasi kultur campuran L. plantarum kik
dan L. fermentum 2B4 (72 jam) dengan 1 siklus pemanasan bertekanan-pendinginan
12,99-13,71%
Jenie et al. (2012)
Proses pemanasan pada suhu tinggi di dalam otoklaf (autoclaving)
menyebabkan suspensi pati mengalami gelatinisasi. Pada saat gelatinisasi pati, sifat birefringence granula pati hilang akibat penambahan air secara berlebih dan pemanasan pada waktu dan suhu tertentu, sehingga granula pati membengkak dan tidak dapat kembali pada kondisi semula (irreversibel) (Zabar et al. 2008). Pemanasan suspensi pati di atas suhu gelatinisasi dapat menyebabkan terjadinya pemutusan (disosiasi) ikatan hidrogen dari struktur double helix amilopektin, pelelehan (melting) bagian kristalit dan pelepasan amilosa dari granulanya
Gambar 1. Mekanisme pembentukan RS dengan autoclaving-cooling melalui proses retrogradasi (Zaragoza et al. 2010)
Proses autoclaving-cooling (OC) secara berulang dapat menyebabkan semakin banyaknya pembentukan fraksi amilosa teretrogradasi atau terkristalisasi (Saguilan et al. 2005). Fraksi amilosa yang berikatan dengan fraksi amilosa lainnya melalui ikatan hidrogen membentuk struktur double helix. Struktur double helix berikatan dengan struktur double helix lainnya membentuk kristalit sehingga terjadi rekristalisasi fraksi amilosa yang dikenal dengan proses pembentukan RS3 (Mutungi et al. 2009). Rekristalisasi amilosa ini terjadi selama proses pendinginan
(cooling). Amilosa teretrogradasi (RS3) bersifat lebih stabil terhadap panas, sangat kompleks dan tahan terhadap enzim amilase.
Faktor lain yang berpengaruh terhadap pembentukan RS3 melalui proses
autoclaving-cooling (OC) adalah konsentrasi pati dan suhu otoklaf. Pembentukan RS3 berlangsung paling optimum apabila konsentrasi suspensi pati dalam air sebesar 20% (b/b) dengan suhu otoklaf sebesar 1210C sebagaimana dilaporkan oleh Lehmann et al. (2002), Leemann et al. (2006) dan Zaragoza et al. (2010). Konsentrasi suspensi pati yang lebih kecil atau lebih besar dari 20% (b/b) menghasilkan kadar RS3 yang cenderung menurun.
Proses gelatinisasi granula pati juga sangat dipengaruhi oleh nisbah pati dan air. Jumlah air yang ditambahkan dalam suspensi pati akan mempengaruhi konsentrasi pati sehingga berpengaruh dalam proses autoclaving-cooling (Leeman
et al. 2006). Hal ini disebabkan nisbah pati dan air sangat mempengaruhi proses ekspansi matriks pati dan gelatinisasi granula. Penambahan air yang terlalu sedikit ke dalam suspensi pati menyebabkan jumlah amilosa yang keluar dari granula tidak optimum (Sajilata et al. 2006). Hal ini dapat mengurangi kadar pati resisten yang terbentuk yang disebabkan oleh menurunnya peluang terjadinya reasosiasi amilosa-amilosa dan amilosa-amilopektin (Zaragoza et al. 2010).
2.6.2 Modifikasi RS dengan Perlakuan Hidrotermal
Perlakuan hidrotermal terdiri dari annealing dan heat moisture treatment
(HMT). Prinsip perlakuan hidrotermal adalah penggunaan air dan panas untuk memodifikasi pati. Pada annealing, modifikasi dilakukan dengan menggunakan jumlah air yang banyak (lebih dari 40%) dan dipanaskan pada suhu di bawah suhu
gelatinisasi pati. Proses HMT dilakukan dengan menggunakan jumlah kandungan air terbatas (18, 21, 24, 27%) dan dipanaskan pada suhu melebihi suhu gelatinisasi. Perlakuan hidrotermal dapat mengubah karakteristik gelatinisasi pati yaitu meningkatkan suhu gelatinisasi, meningkatkan viskositas pasta pati, dan meningkatkan kecenderungan pati untuk mengalami retrogradasi (Adobowale et al 2005).
2.6.3 Modifikasi RS dengan Hidrolisis Asam (Lintnerisasi)
Selain dengan perlakuan autoclaving-cooling maupun hidrotermal, teknik modifikasi peningkatan pati resisten dapat dilakukan dengan hidrolisis asam secara lambat (lintnerisasi) (Faridah et al. 2013). Perlakuan lintnerisasi bertujuan mendegradasi rantai amilopektin pada titik percabangan α-1,6 sehingga meningkatkan jumlah fraksi amilosa rantai pendek dengan derajat polimerisasi (DP) sebesar 19-29 (Ozturk et al. 2011). Apabila jumlah fraksi amilosa rantai pendek meningkat, maka semakin banyak fraksi amilosa yang teretrogradasi, sehingga proses pembentukan RS3 semakin tinggi dan berdampak pada penurunan daya cerna pati (Ozturk et al. 2009, Faridah et al. 2013). Fraksi amilosa sebagai struktur linear akan memfasilitasi pembentukan ikatan silang dengan adanya ikatan hidrogen sehingga terbentuk struktur amilosa yang sangat kompak (Lehmann et al. 2002, Aparicio-Saguilán et al. 2005, Zhao dan Lin 2009).
Hidrolisis pati secara lambat dengan asam dilakukan dengan menggunakan asam kuat seperti HCl maupun H2SO4. Asam kuat akan menghidrolisis ikatan
glikosidik, sehingga memperpendek panjang rantai dan berat molekul amilosa menjadi lebih rendah (Aparicio-Saguilán et al. 2005). Proses modifikasi dengan hidrolisis asam dibuat dengan mensuspensikan pati dalam larutan asam kuat dengan konsentrasi (1 N - 2,2 N) dan memanaskannya pada suhu di bawah suhu gelatinisasi pati (40-600C), kemudian dilakukan pengadukan selama inkubasi. Apabila telah tercapai tingkat kekentalan atau derajat konversi yang dikehendaki, suspensi dinetralkan dan residu pati disaring atau disentrifugasi, kemudian dicuci, dan dikeringkan (Ozturk et al. 2011). Modifikasi pati dengan metode hidrolisis asam tidak mengubah bentuk granula pati yang dihasilkan, tetapi menyebabkan penurunan kemampuan mengembang (swelling), viskositas dan kestabilan pasta pati selama proses gelatinisasi (Ferrini et al. 2008). Proses hidrolisis asam terjadi dalam dua tahap penyerangan pada granula pati, yaitu tahap penyerangan secara cepat pada daerah amorf, dan tahap penyerangan yang lebih lambat terhadap fraksi amilopektin di daerah kristalin (Ferrini et al. 2008, Jayakody dan Hoover 2008).
2.6.4 Modifikasi RS melalui Debranching Pululanase dan Fermentasi BAL
Modifikasi peningkatan RS dapat dilakukan dengan kombinasi
(Reddy et al. 2008). Pemutusan ikatan percabangan (debranching) oleh pululanase terjadi pada ikatan glikosidik α-1,6 secara acak pada bagian dalam sehingga akan dihasilkan amilosa rantai pendek (DP 19-29) sebagai bahan baku RS (Vatanasuchart et al. 2010) seperti yang ditunjukan pada Gambar 2.
Gambar 2. Debranching ikatan α-1,6 pada percabangan amilopektin oleh pululanase (Sajilata et al. 2006)
Pengaruh perlakuan debranching rantai amilopektin dengan enzim pululanase dalam meningkatkan kadar RS telah dilaporkan oleh beberapa peneliti (Gonzales-Soto et al. 2007, Leong et al. 2007, Pongjanta et al. 2009, Miao et al.
2009, Mutungi et al. 2009, Ozturk et al. 2009, Zhao dan Lin 2009, Vatanasuchart
et al. 2010, Faridah 2011). Hasil penelitian tersebut memberikan kadar RS yang berbeda-beda untuk jenis pati dan kondisi proses debranching yang berbeda seperti dilihat pada Tabel 5. Secara umum, kadar RS3 dipengaruhi oleh konsentrasi enzim pululanase dan waktu inkubasi selama proses debranching, serta suhu dan waktu pemanasan (autoclaving) dan pendinginan (cooling) setelah proses debranching (Ozturk et al. 2009, Zhao dan Lin 2009, Vatanasuchart et al. 2010).
Tabel 5. Beberapa Penelitian untuk Peningkatan RS dengan Debranching Pati oleh Pululanase
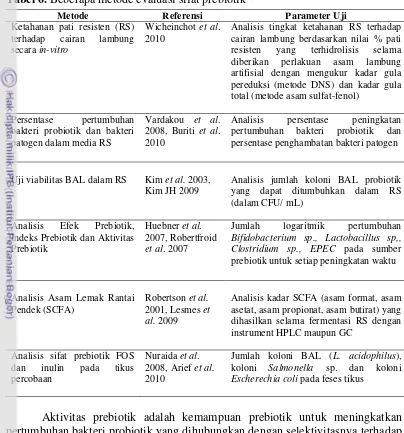
Bahan Pangan Teknik Modifikasi Kadar RS
tertinggi
Referensi
Pati beras tinggi amilosa
Memanaskan suspensi pati beras (15%) pada 1210C selama 30 menit, dihidrolisis oleh pululanase (8 U/g pati) pada suhu 550C selama 24 jam.
18,33% Pongjanta et al.
(2009)
Pati pisang Penggunaan enzim pululanase pada
konsentrasi 10,6 U/g pati pisang
pada suhu inkubasi 500C dengan
waktu inkubasi 5 jam
13,45% Gonzales-Soto
et al. (2007)
Pati singkong Debranching pati singkong dengan
pululanase (25 U/g pati), suhu 500C
Debranching pati jagung tinggi amilosa dengan pululanase (1,5 U/g pati), suhu inkubasi 600C selama 48
jam, dilanjutkan autoclaving pada
suhu 1230C dan penyimpanan suhu dilanjutkan pemanasan otoklaf pada
1210C selama 30 menit dan disimpan
pada 40C selama 2 hari.
21,65% Miao et al.
(2009)
Pati sagu Debranching pati sagu dengan
pululanase konsentrasi 40 U/g pati
debranching pululanase 10,4 U/g pati (50oC, 24 jam) dilanjutkan 3 (2007), suatu bahan pangan dapat diklaim memiliki sifat prebiotik apabila memenuhi beberapa persyaratan sebagai berikut:
3) Dapat menjadi substrat yang selektif untuk pertumbuhan bakteri probiotik di usus besar contohnya: Bifidobacterium bifidum maupun L. plantarum.
4) Tidak dapat dimanfaatkan untuk pertumbuhan bakteri enteropatogenik.
Di samping itu prebiotik juga tidak diijinkan mengandung kontaminan dan impuritis sehingga perlu mendapatkan status GRAS (Generally Recognized As Safe) atau setaranya (Toma dan Pokrotnieks 2006). Pati resisten termasuk molekul yang mempunyai panjang rantai (derajat polimerisasi) lebih pendek. Panjang rantai ini sangat berhubungan dengan kecepatan fermentasi. Roberfroid (2007) menjelaskan bahwa derajat polimerisasi suatu oligosakarida seperti kelompok β -fruktan memberikan pengaruh yang nyata terhadap kecepatan fermentasi secara
in-vitro. Molekul dengan derajat polimerisasi (DP) kurang dari 10 seperti inulin akan difermentasi dua kali lebih cepat daripada molekul yang mempunyai DP lebih dari 10 yaitu pati resisten (RS) (Huebner et al. 2007).
Nurhayati et al. (2014) melaporkan bahwa RS3 dari tepung pisang modifikasi terbukti dapat memenuhi beberapa persyaratan sebagai komponen prebiotik meliputi ketahanannya terhadap hidrolisis asam lambung, mampu meningkatkan pertumbuhan Lactobacillus dan Bifidobacteria, menurunkan pertumbuhan bakteri patogen, menghasilkan asam lemak rantai pendek terutama asam butirat dan memiliki indeks prebiotik lebih tinggi daripada RS2 tepung pisang kontrol. RS3 juga bersifat spesifik untuk meningkatkan pertumbuhan
Lactobacillus acidophilus dan mampu menghambat pertumbuhan beberapa bakteri enteropatogenik seperti (Entero Pathogenic Escherechia coli) EPEC dan
Salmonella typhimurium.
Selain RS pada tepung pisang modifikasi, RS pati jagung yang dihasilkan dari proses modifikasi secara kimia dapat menstimulasi pertumbuhan
Bifidobacteria sehingga merupakan prebiotik yang sangat potensial (Mun dan Shin 2006). RS3 dari gandum, kentang dan kacang polong juga dapat menstimulasi pertumbuhan bifidobakteria yaitu Bifidobacteria pseudolongum
KSI9, B. breve KN14 dan B. animalis KS20a1 (Wronkowska et al. 2006).
2.8. Metode Evaluasi Sifat Prebiotik
Menurut FAO (2015) evaluasi sifat prebiotik harus didasarkan pada penelitian dan metode ilmiah yang representatif dan akurat, serta aman jika prebiotik tersebut dikonsumsi. Pengaruh prebiotik terhadap pertumbuhan probiotik dinyatakan sebagai efek prebiotik maupun indeks prebiotik yang dihitung berdasarkan jumlah total koloni bakteri probiotik (log cfu/mL) (Huebner
et al. 2007). Peningkatan nilai indeks prebiotik maupun efek prebiotik mengindikasikan terjadinya peningkatkan populasi bakteri probiotik seperti
Lactobacillus sp dan Bifidobacterium sp. ketika ditumbuhkan dalam sumber prebiotik (Manderson et al. 2005, Roberfroid 2007). Beberapa metode pengujian sifat prebiotik dapat dilihat pada Tabel 6.
melaporkan bahwa bahan pangan dinyatakan sebagai sumber prebiotik yang baik apabila memiliki nilai efek prebiotik dan indeks prebiotik di atas 2,0.
Tabel 6. Beberapa metode evaluasi sifat prebiotik
Aktivitas prebiotik adalah kemampuan prebiotik untuk meningkatkan pertumbuhan bakteri probiotik yang dihubungkan dengan selektivitasnya terhadap bakteri patogen (Lesmes et al. 2009). Bahan pangan memiliki aktivitas prebiotik positif (di atas 0,25) jika dimetabolisme secara selektif oleh bakteri probiotik seperti L. acidophilus dan L. plantarum akan tetapi tidak dimetabolisme oleh bakteri patogen seperti EPEC (Vrese dan Marteau 2007).
Pengujian ketahanan RS penting dilakukan untuk mengkonfirmasi bahwa RS tidak terhidrolisis selama berinteraksi dengan asam lambung sehingga dapat mencapai kolon dan dapat dimanfaatkan sebagai sumber nutrisi bagi bakteri probiotik seperti yang dipersyaratkan oleh FAO (2007). Robertson et al. (2001) melaporkan bahwa kemampuan RS untuk menstimulasi pertumbuhan bakteri probiotik dapat dievaluasi dengan analisis kadar asam lemak rantai pendek (short chain fatty acid/SCFA) yang dihasilkan selama fermentasi kultur fekal pada media yang mengandung RS3. SCFA sebagai hasil fermentasi RS dapat dianalisis dengan instrument HPLC (High Performance liquid Chromatography) maupun
Metode Referensi Parameter Uji
Ketahanan pati resisten (RS)
terhadap cairan lambung
secara in-vitro
Wicheinchot et al. 2010
Analisis tingkat ketahanan RS terhadap cairan lambung berdasarkan nilai % pati
resisten yang terhidrolisis selama
diberikan perlakuan asam lambung
artifisial dengan mengukur kadar gula pereduksi (metode DNS) dan kadar gula total (metode asam sulfat-fenol)
Persentase pertumbuhan
bakteri probiotik dan bakteri patogen dalam media RS
Vardakou et al.
2008, Buriti et al. 2010
Analisis persentase peningkatan
pertumbuhan bakteri probiotik dan
persentase penghambatan bakteri patogen
Uji viabilitas BAL dalam RS Kim et al. 2003,
Kim JH 2009
Analisis jumlah koloni BAL probiotik yang dapat ditumbuhkan dalam RS
Bifidobacterium sp., Lactobacillus sp,, Clostridium sp., EPEC pada sumber
Analisis kadar SCFA (asam format, asam asetat, asam propionat, asam butirat) yang dihasilkan selama fermentasi RS dengan instrument HPLC maupun GC
Analisis sifat prebiotik FOS
dan inulin pada tikus
koloni Salmonella sp. dan koloni
GC (Gas Chromomatography). Analisis HPLC dilakukan melalui injeksi sampel sebanyak 10 l ke HPLC dengan kondisi fase gerak H2SO4 0,01 N, flow 0,5
ml/menit, kolom C18, suhu oven 500C, detektor UV 210 nm. Standar yang digunakan adalah asam format (0,236 %), asam asetat (0,257 %), asam propionat (0,3254 %) dan asam butirat (0,2139 %) (Lesmes et al. 2009).
Analisis SCFA dengan instrumen GC (Gas Chromomatography) dilakukan sebagai berikut: 1 ml sampel hasil kultur fermentasi BAL probiotik, disentrifugasi pada 7000 rpm selama 5 menit, supernatan disaring dengan milipore 0,45 l, kemudian diambil 0,5 l dan diinjeksikan ke dalam sistem kromatografi gas. Instrumen GC yang digunakan adalah merek Shimadzu GC 8, jenis kolom gelas (GP 10% SP 1200 on 1% H3PO4), panjang kolom 2 meter,
diameter kolom 3 mm, suhu injector 2200C, suhu kolom 130°C. Jenis detektor
Flame IonisationDetector (FID), suhu detektor 220° C, dan tekanan nitrogen (N2)
sebagai gas pembawa 1,3 ml/cm2. Data dari UV detector diintegrasikan
3. METODE
3.1. Waktu dan tempat penelitian
Penelitian ini dilaksanakan di laboratorium Biokimia Mikroba, Bidang Mikrobiologi, Pusat Penelitian Biologi LIPI, Cibinong Bogor mulai bulan September 2014 sampai dengan bulan Februari 2015.
3.2. Bahan dan alat
Bahan baku yang digunakan adalah umbi talas bogor varietas pandan (Colocasia esculenta) yang diperoleh dari petani di Kecamatan Cijeruk Kabupaten Bogor Propinsi Jawa Barat. Umbi talas dipanen pada bulan ke- 8 ketika kandungan amilosa dan amilopektinnya tinggi (Rahmawati et al. 2012).
Media dan bahan kimia yang digunakan antara lain: media MRS (de Mann Rogosa Sharpe) Agar dan Broth, m-MRSB, m-TSB, TSB, TSA, yeast extract
(Difco), beef extract (Difco), bacto agar (Difco), enzim α-amilase Sigma A6380, enzim pepsin Sigma P6887, pankreatin Sigma P-1750, enzim amiloglukosidase Sigma A-9913, inulin Sigma I2255, glukosa, maltosa, 3,5-dinitrosalisilat (Merck), Na-K-tartarat (Merck), fenol (Merck), asam sulfat pekat, natrium dodesilsulfat, etanol, aseton, eter, NaCl, CaCO3, amonium sitrat, natrium asetat, magnesium
sulfat, manganase sulfat, dikalium fosfat, tween 80, NaOH (25% dan 1 N), HCl, akuades, buffer Na fosfat 0,05 M dan 0,01 M pH 6,9 dan pH 7, buffer sodium asetat 0,1 M pH 5,2 dan pH 6,0, dan 0,4 M pH 4,75, buffer HCl-KCl 0,05 M dan 0,1 M (pH 1,5), filter selulosa 0,45 m, kertas saring Whatman No. 41.
Alat-alat yang digunakan meliputi: otoklaf (Hirayama), spektrofotometer UV-Vis Type 1601 (Shimadzu), High Speed Refrigerated Centrifuge Type 6500 (Kubota), inkubator (Shimadzu), pH meter (TOA), pin disc mil (Agrowindo), neraca analitik (Shimadzu), hot plate, water bath (Memmert wnb 14), drying oven
(Isuzu), lemari pendingin (National), tanur (Shimadzu), mikropipet (Gilson), tip, sudip, magnetic stirer, slicer, blender (Phillips), vortex, soxhlet, labu Kjeldahl, labu distilasi dan seperangkat alat gelas.
Kultur bakteri
Kultur bakteri yang digunakan terdiri dari kultur bakteri untuk starter fermentasi talas dan kultur bakteri untuk evaluasi sifat prebiotik yang diperoleh dari Laboratorium Culture Collection INA-CC Pusat Penelitian Biologi LIPI. Kultur bakteri untuk starter fermentasi diseleksi dari 40 strain isolat BAL asal nira siwalan (Borassus flabellifer L.) dari kota Kupang, Nusa Tenggara Timur, dan 1 strain Lactobacillus plantarum D-240 yang diisolasi dari sawi asin asal Bogor Indonesia. Sementara itu kultur bakteri untuk evaluasi sifat prebiotik adalah
3.3. Diagram alir penelitian
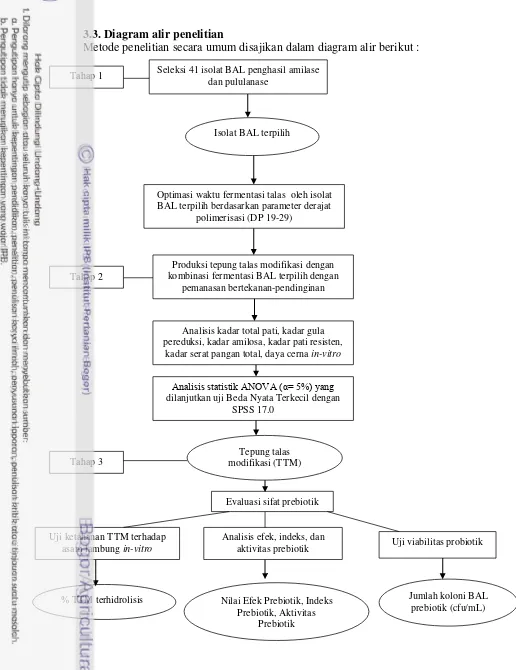
Metode penelitian secara umum disajikan dalam diagram alir berikut :
Gambar 3. Diagram alir metode penelitian secara umum Seleksi 41 isolat BAL penghasil amilase
dan pululanase
Isolat BAL terpilih
Optimasi waktu fermentasi talas oleh isolat BAL terpilih berdasarkan parameter derajat
polimerisasi (DP 19-29) Tahap 1
Tahap 2
Produksi tepung talas modifikasi dengan kombinasi fermentasi BAL terpilih dengan
pemanasan bertekanan-pendinginan
Analisis kadar total pati, kadar gula pereduksi, kadar amilosa, kadar pati resisten,
kadar serat pangan total, daya cerna in-vitro
Analisis statistik ANOVA (α= 5%) yang
dilanjutkan uji Beda Nyata Terkecil dengan SPSS 17.0
Tepung talas modifikasi (TTM)
terpilih Tahap 3
Evaluasi sifat prebiotik
Analisis efek, indeks, dan aktivitas prebiotik Uji ketahanan TTM terhadap
asam lambung in-vitro Uji viabilitas probiotik
% TTM terhidrolisis Nilai Efek Prebiotik, Indeks
Prebiotik, Aktivitas Prebiotik
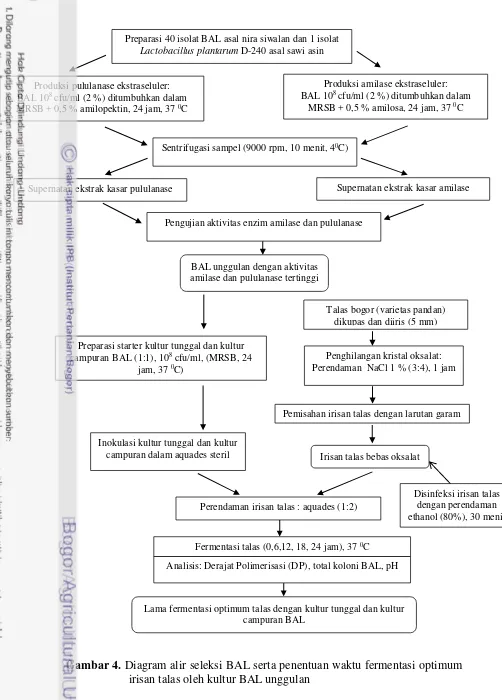
Gambar 4. Diagram alir seleksi BAL serta penentuan waktu fermentasi optimum irisan talas oleh kultur BAL unggulan
Talas bogor (varietas pandan) dikupas dan diiris (5 mm)
Fermentasi talas (0,6,12, 18, 24 jam), 37 0C
Penghilangan kristal oksalat: Perendaman NaCl 1 % (3:4), 1 jam
Lama fermentasi optimum talas dengan kultur tunggal dan kultur campuran BAL
Preparasi starter kultur tunggal dan kultur
campuran BAL (1:1), 108 cfu/ml, (MRSB, 24
jam, 37 0C)
Pemisahan irisan talas dengan larutan garam
Analisis: Derajat Polimerisasi (DP), total koloni BAL, pH Inokulasi kultur tunggal dan kultur
campuran dalam aquades steril Irisan talas bebas oksalat
Perendaman irisan talas : aquades (1:2) Preparasi 40 isolat BAL asal nira siwalan dan 1 isolat
Lactobacillus plantarum D-240 asal sawi asin
Produksi amilase ekstraseluler:
BAL 108 cfu/ml (2 %) ditumbuhkan dalam
MRSB + 0,5 % amilosa, 24 jam, 37 0C
Produksi pululanase ekstraseluler:
BAL 108 cfu/ml (2 %) ditumbuhkan dalam
MRSB + 0,5 % amilopektin, 24 jam, 37 0C
Sentrifugasi sampel (9000 rpm, 10 menit, 40C)
Supernatan ekstrak kasar amilase Supernatan ekstrak kasar pululanase
Pengujian aktivitas enzim amilase dan pululanase
BAL unggulan dengan aktivitas amilase dan pululanase tertinggi
Gambar 5. Diagram alir pembuatan Tepung Talas Modifikasi dengan fermentasi BAL dan siklus autoclaving-cooling
Pengeringan oven (70 oC, 16 jam)
Perlakuan otoklaf (1210C, 15 menit), rasio air: chips talas (2:1)
Autoclaving-cooling 1 siklus (OC-1S)
Analisis: kadar total pati, amilosa, kadar gula pereduksi, kadar pati resisten (RS), daya cerna pati talas in-vitro, serat pangan total
TTM terpilih (tinggi kadar RS)
Fermentasi dan 1 siklus
Autoclaving-cooling(FOC-1S ) Irisan talas bebas oksalat (5 mm) 67:L. plantarum D-240 ) (1:1), 108 cfu/ml, (MRSB, 18 jam, 37 0C)
Inokulasi starter BAL (2 %) dalam aquades steril
Perendaman irisan talas : aquades (1:2)
Fermentasi talas (waktu optimum), 370C
Irisan talas (5 mm) ditiriskan, cairan fermentasi dipisahkan
pendinginan (4 oC, 24 jam)
autoclaving-cooling (1 siklus atau 2 siklus)
Penepungan dengan pin disk mill 80 mesh
Kelompok B (Fermentasi) Kelompok A (Tanpa
Fermentasi)
Kontrol (K),
tanpa OC Fermentasi (F)
Autoclaving-cooling 2 siklus (OC-2S)
Fermentasi dan 2 siklus
Autoclaving-cooling(FOC-2S) irisan talas : NaCl 1 % (3:4), 1 jam
Gambar 6. Diagram alir evaluasi sifat prebiotik Tepung Talas Modifikasi Uji ketahanan RS terhadap asam
lambung in-vitro
Analisis efek, indeks dan aktivitas prebiotik Isolasi RS (Goni et al.,1996)
TTM terpilih
Buffer asam klorida (pH 1,2,3,4,5)
Analisis gula pereduksi dan total gula
% RS terhidrolisis
L. acidophilus, L. plantarum, EPEC
inokulasi ke media MRSB (tanpa glukosa, TTM 2,5%, inulin 2,5%) dan media MRSB (kontrol negatif)
Inkubasi 37 oC, 24 jam
Hitungan cawan (metode tuang):
L. acidophilus (MRSA), L.plantarum
(MRSA), EPEC (TSA)
Nilai Efek, Indeks dan Aktivitas Prebiotik
Uji viabilitas probiotik
2.5 mL BAL (24 jam) inokulasi ke (50 mL MRSB
+ 2,5% TTM)dan (50 mL
aquades steril + 2,5% TTM)
Inkubasi 37 oC, 24 jam
Pengenceran 10-1-10-8 dengan NaCl 0,85 %
BAL ditumbuhkan dalam
MRSA, 370C, 48 jam