% & ' & "# ( $ ! ) ) )*
! " "# % + %
, - & ' .,./01 .23 "
4 % # 4 % % % %
% 1 % + ,
-. 5-.1 , 5 -.1 6 5 . & '1 %
" % 7, % % 4 "
% % % % " %" " 1 81
" %# & # " & ' % '
, - % . 5 .1 , 5 .1 6 5 .
" 1 " ' " #
& ' ' " ' #
4 .6 ,,9 ! + %
, - , 5 . 4 "# & '
% " 4 ' 4 ''
% " % ' " % ' " "
" & " ' 4 1 # " .2 :.9 4
4 ' # % + ;. -<
' + - ? ' ( 0 =1 #
' ( 0 =1 # # $2 $ %
' ( ' ( ' @ 03 + 2 ' ( ' 0
? ' ( ' ( 9 ?
( # $ ' ( 0 =1 # 2 # $ ' ( 0 =1 # 2
# $ ' ( 0 =1 & 2 # $2 0>
' ( ( 3 ? # $ :
+ ' ' 2 + # #
' ( ' ' : + <
' ( !2 + < '
' * ' (@ ' + ' !
' ( ' ( ' '
' # + (
( 2 '
2 '
! !
;- 3A! ' # ! : '
' (@ # ' ( ' 2 +
+ ' ' (
" # $ %
& '
& ()*+,+*-*
! '
.
/ ! / / " $ 0 / /
.
! / / . 0 / /
#
!
.
! / / ! 1 0 / /
! '
/ ! / / . #/ & 0 / /
$ ! % $! & '
( ! ) $ * + , !
!
!
& (
1
>
7
7
. (
&
"
/ 0 " ! "
3 0 *
(
0 ) 1 ( +
) . )
7 8 1 %7 '
) 3 * % )*' !
! ! 1 " ! ! " $
/
" 6
! ( ! ! ! % '
9 3 ! ! ! 1 7
* "
" ! 0 !
$ ! % $! & '
( ! ) $ * + , !
!
!
& (
1
>
7
7
. (
&
"
/ 0 " ! "
3 0 *
(
0 ) 1 ( +
) . )
7 8 1 %7 '
) 3 * % )*' !
! ! 1 " ! ! " $
/
" 6
! ( ! ! ! % '
9 3 ! ! ! 1 7
* "
" ! 0 !
# $ % & '
' () ! ! '
* + ,
!
-! -!
-# . ! ! /
' & ! ! 0
- + & . )
1 + 2
2 % ! /
# 3
# 4 % ( 0
# " % 0
# # )%) )
# ' )% ! ! 1
# - 5 5).
#-# 1 ! !
#-' + +
' ,) & ! ! %
6 7 #1
' , . " % ' #/
' # ! ! ! '0
' # * " ! '
' # ' ! ! ! ! 8 " ! !
!
'-' '-' ! ! ! % . ( ! ) , 9 (
6 % '7 % !
3 ) & ':
' ' , % ! ! ':
' ' , %
-' -' # , % )! -#
' ' ' 8 9 ! 5 -1
' ' - ) ! ! -/
' ' 1 ( -:
' - + & ! ) ( ! )% & ! 6 7 1
' - ; . ! ! 1
' - & % % ! . ) 1#
' - # ! . ) " % ( 8 . .
1-' - 1-' , % + 12
' - - , % 9 ( 9 6 7 % . 9
6 7 1/
' - 1 % ! ! 5 1:
- , + +
- , ! ( 2
- + 2
+ , 2#
* 1 ,,
) $ )
,&
) $ )
5 6 5 6 ,+
# &%
) $ )
dengan pembesaran 1000 x ... 81
2 Tampilan output software API Test CHL 50 kik dan
2B4 ... 82
3 Tabel pengukuran berat, panjang, dan diameter pisang tanduk ... 83
4 Kondisi fermentasi irisan pisang tanduk oleh kultur campuran
kik dan 2B4 ... 83
5 Penampakan irisan pisang tanduk setelah fermentasi dan perlakuan
pemanasan otoklaf ... 84
6 Penampakan tepung pisang dan tepung pisang modifikasi ... 84
7 Tabel kurva pertumbuhan kik dan
2B4... 85
8 Tabel kurva pertumbuhan kik dan
2B4 berdasarkan densitas optik (λ = 600 nm) ... 85
9 Tabel pengukuran berat, panjang, dan diameter pisang tanduk ... 86
10a Tabel pengaruh lama fermentasi terhadap jumlah bakteri asam laktat
pada cairan fermentasi (Log cfu/ml) ... 87
10b Tabel analisis deskriptif pengaruh lama fermentasi terhadap jumlah
bakteri asam laktat pada cairan fermentasi (Log cfu/ml) ... 87
10c Tabel analisis ragam pengaruh lama fermentasi terhadap jumlah
bakteri asam laktat pada cairan fermentasi (Log cfu/ml) ... 87
10d Tabel uji lanjut Duncan pengaruh lama fermentasi terhadap jumlah
bakteri asam laktat pada cairan fermentasi (Log cfu/ml) ... 88
11a Tabel pengaruh lama fermentasi terhadap total asam terlarut (TAT)
pada cairan fermentasi (%) ... 88
11b Tabel analisis deskriptif pengaruh lama fermentasi terhadap total
asam terlarut (TAT) pada cairan fermentasi (%) ... 88
11c Tabel analisis ragam pengaruh lama fermentasi terhadap total asam
terlarut (TAT) pada cairan fermentasi (%) ... 89
11d Tabel uji lanjut Duncan pengaruh lama fermentasi terhadap total asam terlarut (TAT) pada cairan fermentasi (%) ... 89
12a Tabel pengaruh lama fermentasi terhadap pH pada cairan fermentasi 89
12b Tabel analisis deskriptif pengaruh lama fermentasi terhadap pada
cairan fermentasi ... 90
12d Tabel uji lanjut Duncan pengaruh lama fermentasi terhadap pH pada
cairan fermentasi ... 90
13a Tabel pengaruh lama fermentasi terhadap amilase ekstraseluler yang
dihasilkan oleh kultur campuran pada cairan fermentasi (unit/ml) ... 91
13b Tabel Analisis deskriptif pengaruh lama fermentasi terhadap amilase ekstraseluler yang dihasilkan oleh kultur campuran pada cairan
fermentasi (unit/ml) ... 91
13c Tabel Analisis ragam pengaruh lama fermentasi terhadap amilase ekstraseluler yang dihasilkan oleh kultur campuran pada cairan
fermentasi (unit/ml) ... 91
13d Tabel uji lanjut Duncan pengaruh lama fermentasi terhadap amilase ekstraseluler yang dihasilkan oleh kultur campuran pada cairan
fermentasi (unit/ml) ... 92
14 Tabel kadar air tepung pisang (% bk) ... 92
15a Tabel pengaruh rasio kik dan 2B4 dan
pemanasan otoklaf terhadap kadar pati resisten tepung pisang
(% bk) ... 93
15b Tabel analisis deskriptif pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap kadar pati
resisten tepung pisang (% bk) ... 94
15c Tabel analisis ragam pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap kadar pati
resisten tepung pisang (% bk) ... 94
16a Tabel pengaruh rasio kik dan 2B4 dan
pemanasan otoklaf terhadap kadar pati tepung pisang (% bk) ... 95
16b Tabel analisis deskriptif pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap kadar pati
tepung pisang (% bk) ... 96
16c Tabel analisis ragam pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap kadar pati
tepung pisang (% bk) ... 96
17a Tabel pengaruh rasio kik dan 2B4 dan
pemanasan otoklaf terhadap kadar amilosa tepung pisang (% bk) ... 97
17b Tabel analisis deskriptif pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap kadar amilosa
2B4 dan pemanasan otoklaf terhadap kadar amilosa
tepung pisang (% bk) ... 98
17d Tabel uji lanjut Duncan pengaruh rasio kik dan
2B4 terhadap kadar amilosa tepung pisang (% bk) ... 99
18a Tabel pengaruh rasio kik dan 2B4 dan
pemanasan otoklaf terhadap daya cerna pati tepung pisang secara
(% bk) ... 99
18b Tabel analisis deskriptif pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap daya cerna pati
tepung pisang secara (% bk) ... 100
18c Tabel analisis ragam pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap daya cerna pati
tepung pisang secara (% bk) ... 100
18d Tabel uji lanjut Duncan pengaruh rasio kik dan
2B4 terhadap daya cerna pati tepung pisang secara
(% bk) ... 101
19a Tabel pengaruh rasio kik dan 2B4 dan
pemanasan otoklaf terhadap total asam tertitrasi (TAT) tepung
pisang (% bk) ... 101
19b Tabel analisis deskriptif pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap total asam
tertitrasi (TAT) tepung pisang (% bk) ... 102
19c Tabel analisis ragam pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap total asam
tertitrasi (TAT) tepung pisang (% bk) ... 102
20a Tabel pengaruh rasio kik dan 2B4 dan
pemanasan otoklaf terhadap pH tepung pisang ... 103
20b Tabel analisis deskriptif pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap pH tepung
pisang ... 104
20c Tabel analisis ragam pengaruh rasio kik dan
2B4 dan pemanasan otoklaf terhadap pH tepung
pisang ... 104
20d Tabel uji lanjut Duncan pengaruh rasio kik dan
2B4 terhadap pH tepung pisang ... 105
21a Tabel pengaruh fermentasi terhadap serat pangan larut, serat pangan
tidak larut, dan total serat pangan tepung pisang modifikasi (% bk) ... 105
21b Tabel uji pengaruh fermentasi terhadap serat pangan larut
larut tepung pisang modifikasi (% bk) ... 106
21d Tabel uji pengaruh fermentasi terhadap total serat pangan
tepung pisang modifikasi (% bk) ... 106
22a Tabel pengaruh fermentasi terhadap pati cepat cerna ( ) dan pati
lambat cerna ( ) tepung pisang modifikasi (% bk) ... 106
22b Tabel uji pengaruh fermentasi terhadap pati cepat cerna
( ) tepung pisang modifikasi (% bk) ... 107
22c Tabel uji pengaruh fermentasi terhadap pati lambat cerna
( ) tepung pisang modifikasi (% bk) ... 107
23 Tabel pengaruh fermentasi terhadap hidrolisis pati tepung pisang
modifikasi ... 108
24a Tabel pengaruh fermentasi terhadap nilai C ekuilibrium (C∞),
konstanta kinetik (k), indeks hidrolisis (IH₉₀), dan estimasi indeks
glikemik secara tepung pisang modifikasi (% bk)... 109
24b Tabel uji pengaruh fermentasi terhadap estimasi indeks
glikemik secara tepung pisang modifikasi (% bk) ... 109
25 Tabel jumlah kultur awal bakteri asam laktat dan
( ) pada pengujian prebiotik ... 109
26 Tabel jumlah kultur bakteri asam laktat setelah 24 jam pada media yang
mengandung TPM dan FOS ... 110
27 Tabel jumlah kultur ( ) setelah 24 jam
pada media yang mengandung TPM dan FOS ... 110
!
"
!
# $ % !
$ %% !
& ! $ %%%
%' !
( )* ( + + ,
-( .
$ /
0
2 - /
3 !
+
)
%%%
4 5 ! 677/
8*
#* , %%%
1
1 # %%%
9 /
,: ! ; )
! ; $ 8 < )
%%% %' = (9₃
, : =
> / ?
! 7 6:6, = ? !
)
!
? ?
(
6 6B9 6
6 /6=
6) = ?
? %%%
C9 6
67 8#= 0 ! : @ / 5 (
) %%%
6 ;3 6 6B9
6 8 B9 )
, ;6
8 B9 D & &: ,
0E #
& ! &
(? *
? 7 0
A
!
(
$
? !
?
6 /6= 0 ! : @ /
!
5
1# 6 6B9 0
6 6B9
! 5
%D
$ F
6
! 1#
!
1# 6 6B9
8
! 103
! "#
6 A 1#
? ! 103
8 $
# $
cerna (sekitar 30% dari bagian yang dapat dimakan). Pisang banyak mengandung
komponen karbohidrat terutama pati, sehingga pisang sering ditepungkan atau
terkadang diambil patinya. Pisang memiliki rasa yang sangat enak dan dapat
mengenyangkan, sebagai sumber pro vitamin A, mengandung vitamin C sekitar
20 mg/100g bobot segar, dan vitamin B. Nilai energi pisang sekitar 136 kalori
yang secara keseluruhan berasal dari karbohidrat (Wikipedia 2007).
Pisang tua mengandung 70 80% pati berdasarkan berat kering. Pati pisang
alami bersifat resisten terhadap seranganαamilase dan glukoamilase. Pisang juga
mengandung serat pangan, terutama hemiselulosa dan pektik polisakarida (Zhang
. 2005).
Menurut Nunez Santiago (2004) pati pisang mempunyai ukuran
diameter rata rata 24.31 2m untuk pati yang tidak dimasak dan 59 – 66 2m untuk
pati yang dimasak. Tingkat kematangan pisang juga mempengaruhi komposisi
kimia daging buah seperti kadar pati, gula reduksi, sukrosa dan suhu gelatinisasi
(Zhang . 2005). Pisang mengandung kalium tinggi, walaupun kandungan besi
dan natriumnya rendah. Kandungan protein pisang sekitar 1% dan lemak 0.3%
dari bagian yang dapat dimakan (Rubatzky dan Yamaguchi 1998).
Pati adalah homopolimer glukosa dengan ikatan α glikosidik. Sifat pati
tergantung dari panjang rantai C nya, serta rantai molekul (bercabang atau lurus).
Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Amilosa
merupakan fraksi terlarut dan mempunyai struktur lurus dengan ikatan α (1.4) D
glukosa. Amilopektin adalah fraksi tidak larut dan mempunyai struktur bercabang
dengan ikatan α (1.6) D glukosa (Winarno 2002). Amilosa dan amilopektin
Amilosa memiliki derajat polimerisasi 6000 dengan berat molekul 105
sampai 106 g/mol. Rantainya dapat dengan mudah membentuk rantai heliks
tunggal atau ganda. Amilopektin memiliki derajat polimerisasi rata rata 2 juta
dengan berat molekul 107sampai 109g/mol. Panjang rantai terdiri dari 20 25 unit
glukosa antara setiap percabangan (Sajilata . 2006).
Pati merupakan suatu bentuk utama karbohidrat yang dikonsumsi. Pati
adalah polisakarida yang terbentuk dari sejumlah molekul glukosa yang berikatan
bersama dan membentuk karbohidrat kompleks. Umumnya, pati dapat diurai oleh
enzim pencernaan dalam usus halus menjadi molekul glukosa. Glukosa kemudian
diserap ke dalam darah dan digunakan untuk menghasilkan energi untuk tubuh
(British Nutrition Foundation 2005).
Pati dihidrolisa di dalam saluran pencernaan oleh amilase yang disekresikan
ke dalam saluran pencernaan. Cairan air liur dan pankreas mengandung α amilase
yang mampu menghidrolisa ikatan α (1.4) amilopektin menghasilkan D glukosa,
sejumlah kecil maltosa dan suatu inti yang tahan hidrolisa (limit dekstrin). Limit
dekstrin tidak dihidrolisa lebih jauh oleh α amilase (tidak dapat memecahkan
ikatan α (1.6). Enzim yang berperan dalam pemecahan ikatan ini adalah α (1.6)
glukosidase. Aktivitas gabungan α amilase dan α (1.6) glukosidase dapat
menguraikan amilopektin secara sempurna menjadi glukosa dan sejumlah kecil
maltosa (Lehninger 1993).
Pati dapat dibedakan berdasarkan difraksi sinar X, berdasarkan aktivitas
enzim, dan berdasarkan karakteristik nutrisi. Klasifikasi pati berdasarkan aktivitas
enzim terbagi atas tiga yaitu pati yang dicerna dengan cepat (
pati yang dicerna dengan lambat ( dan pati
resisten. Klasifikasi berdasarkan karakteristik nutrisi, pati terbagi atas dua jenis
yaitu pati yang dapat dicerna dan pati resisten (tidak dapat dicerna) (Sajilata .
2006).
Pati resisten dianggap sebagai jumlah keseluruhan pati dan produk
degradasi pati yang tidak dapat diserap dalam saluran pencernaan (usus
digolongkan sebagai sumber serat pangan (British Nutrition Foundation 2005).
Pati resisten memiliki tiga peranan yaitu sebagai serat pangan, serat pangan yang
tidak larut, dan sebagian berperan sebagai serat pangan yang dapat larut
(Wikipedia 2008).
Pati resisten tidak dapat diserap dalam tubuh disebabkan oleh beberapa
faktor. Pati secara fisik memiliki ketahanan terhadap enzim saluran pencernaan,
granula pati memiliki struktur yang bersusun sehingga mencegah enzim
pencernaan untuk mendegradasinya. Ketika pati dipanaskan, pati akan
tergelatinisasi dan menjadi mudah untuk dicerna. Namun, jika gel pati
didinginkan, kristal pati terbentuk dalam makanan dan bersifat resisten terhadap
enzim pencernaan. Pati juga tidak dapat diserap diakibatkan diberi perlakuan
kimia sehingga tidak dapat dipecah oleh enzim pencernaan (eterisasi, esterisasi,
dan ikatan silang) (British Nutrition Foundation 2005).
of Australia, merekomendasikan
konsumsi sebanyak 20 gram setiap hari untuk memperoleh manfaat kesehatan.
Negara berkembang mengonsumsi pati resisten berkisar 3 7 gram per hari.
Masyarakat Australia mengonsumsi pati resisten berkisar 5 7 gram per hari,
sedangkan di U.S rata rata berkisar 4,9 gram per hari (Oldways 2007).
Klasifikasi pati resisten berdasarkan mekanisme dan struktur yang
berkontribusi terhadap ketahanannya dalam enzim pencernaan. Pati resisten tipe I,
resisten dalam saluran pencernaan disebabkan pati ini dilindungi dari enzim
pencernaan oleh komponen lain yang secara normal ada dalam matriks pati. Pati
resisten tipe II, resisten terhadap saluran pencernaan diakibatkan struktur granula
dan arsitektur molekulnya. Pati resisten tipe III, sifat resistennya diakibatkan
bentuknya tidak bergranula (struktur kristal), pati ini terutama dihasilkan selama
proses pemasakan dan pendinginan pati selama proses pengolahan makanan (pati
terlepas dari struktur granulanya dan mungkin rantai glukosanya membentuk
kristal atau retrogradasi sehingga sulit untuk dicerna). Pati resisten tipe IV, sifat
resistennya diakibatkan ikatan kimia yang tidak dapat dicerna oleh enzim
pencernaan (Englyst . 1992; Onyango . 2006; Okoniewska dan Witwer
Faktor faktor yang mempengaruhi pembentukan pati resisten adalah sifat
alami pati (kristalinitas pati, struktur granula, rasio amilosa dan amilopektin,
retrogradasi amilosa, pengaruh panjang rantai amilosa, linearisasi amilopektin),
panas dan kelembaban, interaksi pati dengan komponen lain (protein, serat
pangan, inhibitor enzim, ion, gula, lipid atau emulsifier), kondisi pengolahan dan
proses panas (Sajilata . 2006).
Kadar pati resisten dipengaruhi oleh rasio amilosa : amilopektin. Kadar
amilosa yang tinggi berkorelasi positif dengan kadar pati resisten yang dihasilkan.
Makanan yang mengandung amilosa tinggi (tepung jagung dengan kadar amilosa
70%) memiliki kadar pati resisten lebih tinggi, yaitu 20 g/100 g berat kering
dibandingkan tepung jagung yang mengandung amilosa 25%, yaitu 3 g/100 g
berat kering (Sajilata . 2006). Pembentukan pati resisten tipe III
dipertimbangkan sebagai proses kristalisasi amilosa (Eerlingan dan Delcour 1995;
Thompson 2000). Sievert dan Pomeranz (1990) melaporkan peningkatan kadar
amilosa pada pati dihubungkan dengan peningkatan entalpi gelatinisasi pati.
Menurut Sajilata . (2006) panjang rantai amilosa tidak berpengaruh
terhadap derajat polimerisasi (DPn) pati resisten yang dihasilkan. DPn berkisar
19 29 yang berasal dari panjang rantai amilosa yang berbeda (DPn amilosa
berkisar 40 610). Hal ini menunjukkan pati resisten mungkin dibentuk oleh
aggregasi rantai amilosa dengan residu 24 unit glukosa. Thompson (2000)
melaporkan panjang rantai amilosa dengan DPn 260 meningkatkan kadar pati
resisten, yaitu 28%. Panjang rantai amilosa dengan DPndi atas 260 menghasilkan
kadar pati resisten kurang dari 28%. Eerlingan dan Delcour (1995) melaporkan
fraksi amilosa dengan DPn kurang dari 100 memiliki konsentrasi rantai relatif
tinggi dan tidak memiliki dimensi untuk membentuk struktur kristal. Hal ini
mengakibatkan kadar pati resisten rendah. Menurut Thompson (2000) amilosa
dengan DPn lebih tinggi dari 300 tidak mudah untuk mengkristal sehingga
membutuhkan rantai polimer lurus untuk membentuk kritalitas resisten.
Kandungan protein dan lemak pada pati berpengaruh terhadap suhu
gelatinisasi pati dan kadar pati resisten yang dihasilkan. Kadar pati resisten pati
kering. Setelah dilakukan hidrolisis protein dan lemak, kadar pati resisten
meningkat secara signifikan. Kadar pati resisten pati beras dan pati ragi setelah
hidrolisis protein meningkat menjadi 0.14 g/100 g berat kering dan 0.04 g/100 g
berat kering. Kadar pati resisten pati beras dan pati ragi setelah hidrolisis lemak
menggunakan berbagai solven berkisar 0.14 0.22 g/100 g berat kering dan 0.05
0.07 g/100 g berat kering (Mangala . 1999).
Kandungan air dari pati berpengaruh terhadap pati resisten yang dihasilkan.
Kadar pati resisten maksimal diperoleh ketika rasio pati : air (1 : 3.5) (Eerlingan
dan Delcour 1995; Sajilata . 2006). Kadar air pati 18 % meningkatkan level
derajat kristalinitas pati, sedangkan kadar air pati 27 % menyebabkan pati lebih
mudah didegradasi oleh enzim (Sajilata . 2006).
Menurut Mangala . (1999) suhu juga berpengaruh terhadap kadar pati
resisten yang dihasilkan. Suhu autoklaf meningkatkan kadar pati resisten pati
beras dan pati ragi setelah diberi perlakuan hidrolisis protein dan lemak. Kadar
pati resisten pati beras dan pati ragi setelah hidrolisis protein dan diotoklaf adalah
0.15 g/100 g berat kering dan 0.10 g/100 g berat kering. Kadar pati resisten pati
beras dan pati ragi setelah hidrolisis lemak menggunakan berbagai solven dan
diotoklaf berkisar 0.39 0.89 g/100 g berat kering dan 0.12 0.15 g/100 g berat
kering. Menurut Onyango . (2006) waktu pemanasan pada suhu autoklaf
berpengaruh terhadap pati resisten tipe III yang dihasilkan dari pati singkong
setelah disuspensi dengan 10 mmol/L asam laktat. Kadar pati resisten tipe III
tertinggi diperoleh pada suhu autoklaf selama 45 menit. Hal ini mengindikasikan
efek hidrolisis panas dan asam berlanjut pada menit ke 45.
Menurut Onyango . (2006) suhu dan waktu retrogradasi secara
signifikan berpengaruh terhadap kadar pati resisten tipe III yang dihasilkan, tetapi
interaksi antara suhu dan waktu retrogradasi tidak berpengaruh terhadap kadar
pati resisten tipe III. Kadar pati resisten tipe III tertinggi dihasilkan dari pati
singkong yang telah disuspensi 10 mmol/L asam laktat dengan suhu dan waktu
retrogradasi 60⁰C selama 48 jam, yaitu 9.97 g/100 g berat kering. Menurut
Schmiedl . (2000) waktu retrogradasi berpengaruh terhadap entalpi (∆H)
retrogradasi dan kadar pati resisten tipe III yang dihasilkan. Pati yang
lebih tinggi dibandingkan pati yang diretrogradasi selama 24 jam. ∆H pati yang
diretrogradasi selama 2 jam adalah 28.7 mJ/mg dengan pati resisten tipe III 93%,
sedangkan ∆H pati yang diretrogradasi selama 24 jam adalah 10.3 mJ/mg dengan
pati resisten tipe III 56%.
Linierisasi amilopektin menggunakan asam organik (asam laktat) dan enzim
pullulanase secara signifikan meningkatkan pembentukan pati resisten selama
pemanasan pada suhu otoklaf (Sajilata . 2006). Menurut Onyango .
(2006) pati resisten tipe III tertinggi dihasilkan dari konsentrasi 10 mmol/L asam
laktat dibandingkan konsentrasi 1 mmol/L asam laktat dan 100 mmol/L asam
laktat.
Bakteri penghasil asam laktat (BAL) dapat tumbuh pada pati sagu yang
difermentasi secara spontan. BAL mampu menghasilkan beberapa jenis asam
organik. Asam organik yang dihasilkan terutama asam asetat, asam laktat, dan
asam n butirat. Asam laktat meningkat secara signifikan pada hari ke 23
fermentasi, yaitu 37 mM (Greenhill . 2008).! mampu
menghasilkan asam laktat dari metabolisme glukosa (Axelsson 2004).
! A6 yang diisolasi dari singkong mampu menghasilkan enzim
amilolitik, dan secara efisien memiliki kemampuan untuk menghidrolisis pati
secara parsial (Nguyen . 2007; Ouattara . 2009).! L137 yang
diisolasi dari makanan fermentasi tradisional (ikan dan nasi) menghasilkan enzim
amilolitik dan pullulanase (amilopullulanase) yang mampu menghidrolisis ikatan
amilosa dan amilopektin (Kim . 2008; Kim l. 2009). Sobowale .
(2007) melaporkan tepung " " yang diperoleh melalui proses fermentasi tepung
singkong, baik fermentasi tradisional maupun menggunakan kultur !
SL 14 dan ! SL 19 meningkatkan kadar amilosa tepung " "
dibandingkan kontrol (tanpa fermentasi). Kadar amilosa tepung yang difermentasi
berkisar 21,10 21,30 % sedangkan kontrol 19,80%.
Pati resisten dalam usus halus menurunkan respon glikemik dan insulemik
pada manusia penderita diabetes, penderita hiperinsulemik, dan penderita
penambahan tepung pisang mentah yang mengandung pati resisten tipe II dalam
makanan tidak mempengaruhi penyerapan usus halus terhadap komponen nutrisi
atau jumlah sterol.
Pati resisten dapat mencapai usus besar (kolon) tanpa mengalami perubahan
dan berkontribusi sebagai serat pangan. Pati resisten dapat difermentasi oleh
mikroflora yang secara alami terdapat dalam kolon untuk menghasilkan
sejumlah kecil karbon dioksida, metana, dan hidrogen. Fermentasi pati resisten
dalam usus besar oleh mikroorganisme mampu meningkatkan massa kotoran.
Peningkatan massa kotoran mempengaruhi berbagai agen genotoksik dalam usus
besar, sehingga mereduksi kerusakan DNA dalam sel kolon (British Nutrition
Foundation 2005). Pati resisten secara selektif menstimulasi pertumbuhan atau
aktivitas bakteri menguntungkan seperti # " dan !
(Okoniewska dan Witwer 2007).
Pati resisten secara cepat difermentasi dalam sekum (bagian usus besar) dan
kolon proksimal. Pati resisten dapat secara efektif menghasilkan asam lemak
rantai pendek (butirat) dan menurunkan amoniak yang bersifat toksik melalui
fermentasi dalam kolon proksimal (Govers . 1999), menurunkan jumlah asam
empedu sekunder, memperbaiki saluran pencernaan, dan meningkatkan
penyerapan mikronutrien (magnesium dan kalsium) dalam kolon (British
Nutrition Foundation 2005). Asam lemak ini menurunkan pH kolon, menghambat
pertumbuhan bakteri patogen, mencegah kerusakan DNA akibat mengkonsumsi
protein dalam jumlah tinggi, dan memulihkan keseimbangan usus dari
ketidakseimbangan yang disebabkan oleh bakteri patogen (Okoniewska dan
Witwer 2007).
Suplemen serat pangan pati resisten berpotensi memperbaiki sensitivitas
hormon insulin (Robertson . 2005). So . (2007) melaporkan pemberian
pati resisten pada tikus secara signifikan memberi dampak pada jaringan
adiposa, morfologi dan metabolisme adiposa, metabolisme glukosa dan
insulin, mempengaruhi regulasi nafsu makan yang disebabkan oleh perubahan
aktivitas neuronal dalam pusat pengatur nafsu makan hipotalamik yang
resisten meningkatkan rasa kenyang karena mampu meningkatkan ekspresi
genetik penstimulasi rasa kenyang yang dihubungkan pada hormon GLP 1 dan
PYY dalam usus besar.
Pati resisten tidak memberikan pengaruh terhadap konsentrasi insulin
postprandial, glukosa, triasilgliserol, dan asam lemak bebas dalam darah (Higgins
. 2004), dan tidak mengubah serum lipid, urea, H2, dan CH4 dalam serum
(Jenkins . 1998). Menurut Higgins . (2006) pati resisten secara signifikan
mencegah berat badan dalam jangka waktu yang lama. Konsumsi pati resisten tipe
III mencegah pertumbuhan sel tumor, menurunkan sejumlah proliferasi sel,
meningkatkan apoptosis, menginduksi protein kinase C δ (PKC δ), menginduksi
ekspresi protein $ (HSP 25), tetapi menghambat glutation peroksidase
gastrointestinal (GI GPx), dan mencegah karsinogenesis kolon (Marinovic .
2006).
Reduksi respon glikemik ditingkatkan oleh kombinasi pati resisten dan serat
pangan yang larut. Konsumsi makanan yang mengandung serat pangan ini
memperbaiki metabolisme glukosa (Behall . 2006). Korelasi respon akut
apoptosis terhadap karsinogen genotoksik tidak bergantung pada kelompok serat
pangan tetapi dipengaruhi oleh pati resisten. Perubahan jumlah asupan pati
resisten mampu mengubah aktivitas fermentasi dalam kolon (Le leu . 2003).
Pati resisten memberikan efek yang signifikan terhadap kesehatan kolon pada
manusia dan memudahkan defekasi (Phillips . 1995).
Pati resisten mampu mereduksi kehilangan cairan fekal dan memperpendek
durasi diare pada anak remaja dan orang dewasa yang menderita kolera
(Ramakrishna . 2000). Menurut Ramakrishna . (2008) pati resisten
mampu mempercepat pemulihan diare, mereduksi pertumbuhan %
penyebab kolera.
Menurut Wells . (2008) prebiotik didefenisikan sebagai ingridien
makanan yang tidak dapat diserap dalam usus halus dan bermanfaat bagi
inang melalui stimulasi secara selektif pertumbuhan dan aktivitas sejumlah
dan Abrams (2008) prebiotik adalah komponen ingridien makanan yang tidak
dapat diserap dalam usus halus, tetapi dapat difermentasi oleh mikroflora dalam
usus besar menjadi asam lemak berantai pendek ( &') yang bersifat volatil.
Kandidat prebiotik diharapkan tidak dihidrolisis atau diserap pada bagian
atas saluran gastrointestinal dan secara selektif difermentasi oleh satu atau
sejumlah bakteri komensial yang menguntungkan pada kolon misalnya
# " dan ! (Wells . 2008). Menurut Roberfroid (2008)
klasifikasi ingridien makanan sebagai prebiotik antara lain : tahan terhadap asam
lambung, tidak dihidrolisis oleh enzim mamalia, tidak diserap pada bagian atas
saluran gastrointestinal, difermentasi oleh mikroflora usus, secara selektif
menstimulasi pertumbuhan atau aktivitas bakteri intestinal yang berpotensial dan
dihubungkan dengan kesehatan.
Menurut ISAPP (2008) suatu “prebiotik” dinyatakan bukan prebiotik jika
dapat didegradasi oleh asam lambung hewan atau manusia, tidak bersifat selektif
(hanya menumbuhkan sejumlah bakteri yang menguntungkan bagi kesehatan
bukan sejumlah besar bakteri yang merugikan bagi kesehatan), hanya diuji dalam
laboratorium dan hewan belum pada manusia, mungkin mengandung senyawa
yang mempengaruhi sifat prebiotiknya, dan belum diatur penggunaannya dalam
jumlah yang rendah untuk memberikan manfaat bagi kesehatan.
Manning . (2004) melaporkan banyak komponen serat yang memiliki
potensi sebagai prebiotik, tetapi sumber prebiotik yang paling banyak
dikembangkan berasal dari oligosakarida yang tidak dapat dihidrolisis dalam
saluran pencernaan seperti fruktooligosakarida (FOS), transgalaktooligosakarida
(TOS), isomaltooligosakarida (IMO), xylooligosakarida (XOS), soyoligosakarida
(SOS), glukooligosakarida (GOS), dan laktosukrosa. Menurut Grajek . (2005)
lactulosa, galaktoligosakarida, fruktooligosakarida, inulin dan hidrolisatnya,
maltooligosakarida, dan pati resisten merupakan prebiotik yang umumnya
digunakan dalam nutrisi manusia.
Oligosakarida merupakan gula yang terdiri antara 2 dan 20 unit sakarida.
Oligosakarida adalah rantai pendek polisakarida. Beberapa terdapat secara
alami pada buah buahan dan sayuran kemudian diekstrak dan sebagian
enzimatik. Sifat prebiotik dari karbohidrat dipengaruhi oleh beberapa faktor
yaitu : (1) Komposisi monosakarida, prebiotik terutama dibentuk dari glukosa,
galaktosa, xylosa, fruktosa, arabinosa, rhamnosa, dan glukosamin; (2) Ikatan
glikosidik, ikatan antara residu monosakarida merupakan faktor penting untuk
menentukan selektifitas fermentasi dan daya cerna dalam usus halus; (3) berat
molekul, polisakarida bukan prebiotik, prebiotik memiliki berat molekul yang
rendah (Manning . 2004).
Menurut ISAPP (2008) serat pangan dan prebiotik merupakan karbohidrat
yang tidak dapat dicerna, dan keduanya dapat difermentasi oleh mikroflora usus.
Walaupun demikian, prebiotik berbeda dengan serat pangan. Prebiotik bersifat
selektif, hanya membantu pertumbuhan bakteri yang bersifat menguntungkan bagi
kesehatan. Prebiotik lebih dihubungkan dengan konsep probiotik dibandingkan
serat pangan.
Saluran gastrointestinal manusia terdiri dari komunitas mikroorganisme.
Konsentrasi bakteri dan aktivitas metabolik tertinggi ditemukan dalam usus besar.
Kelompok bakteri predominan dalam usus besar manusia dewasa adalah bakteri
fakultatif dan obligat anaerob terutama genera # (
# " , dan & (Vanhoutte
. 2006). Menurut Wells . (2008) bakteri dominan pada usus manusia adalah
& # (termasuk genus # ) dan
& (termasuk genera ( ). Keduanya kira kira
meliputi 30% dari total bakteri dalam mucus dan feses. Dalam usus, organisme
anaerob lebih mendominasi dibandingkan organisme aerob. Genera anaerob yang
mendominasi antara lain ) ) # "
. Genera subdominant aerob (fakultatif anaerob) termasuk
( ( ( * ! , dan ) .
Anatomi saluran pencernaan dapat dilihat pada Gambar 1.
Vanhoutte . (2006) melaporkan bakteri kolon berperan untuk
memfermentasi berbagai substrat yang lolos atau komponen serat pangan yang
tidak terserap pada bagian atas saluran gastrointestinal. Produk fermentasi antara
lain asam lemak berantai pendek ( &') yang menyediakan tambahan energi bagi
dan amoniak. Wells . (2008) melaporkan sumber energi dari fermentasi di
kolon adalah karbohidrat termasuk polisakarida (pektin, hemiselulosa, selulosa,
gum, dan pati resisten), oligosakarida, alkohol yang tidak dapat diserap, dan gula.
Gambar 1 Perbedaan komunitas bakteri pada saluran pencernaan. Wells .
(2008)
Menurut Lichtenstein dan Goldin (2004) usus halus yang lebih rendah
merupakan zona transisi antara populasi bakteri pada bagian atas saluran
gastrointestinal dan populasi bakteri di kolon. Pada ileum yang lebih rendah
sejumlah bakteri meningkat antara 106 dan 107 cfu/ml. Pada kolon, konsentrasi
meningkat antara 1011sampai 1012cfu/ml dari material fekal.
Bakteri kolon diklasifikasikan berdasarkan potensi efeknya bagi kesehatan.
Peningkatan bakteri proteolitik seperti dan # dapat
menyebabkan gangguan bagi kesehatan. # " dan !
memberikan efek positif antara lain menstimulasi sistem imun, menghasilkan
vitamin, menghambat patogen di intestinal, mereduksi amoniak dalam darah dan
sejumlah kolesterol, dan mereduksi konstipasi (Vanhoutte . 2006).
Cummings dan Macfarlane (2002) melaporkan efek prebiotik antara lain :
(1) Melalui fermentasi dalam usus besar, menghasilkan asam lemak berantai
pendek dan laktat, gas terutama CO2 dan H2, meningkatkan biomassa,
meningkatkan energi fekal dan nitrogen, meningkatkan sifat laksatif; (2) Bagi
mikroflora, secara selektif meningkatkan # " dan ! dalam
Usus halus : Jumlah bakteri
Jumlah bakteri 103/ml
Contoh :
Kolon :
Jumlah bakteri 1012/g
Contoh :#
# "
) &
! (
( (
planktonik dan komunitas biomassa, reduksi , meningkatkan ketahanan
kolonisasi terhadap patogen, memiliki manfaat yang berpotensial mencegah invasi
patogen; (3) Usus halus, efek osmotik prebiotik yang memiliki berat molekul
rendah, memperbaiki penyerapan kalsium, magnesium, dan besi, berinteraksi
dengan mucus mengubah daerah ikatan bakteri, lektin, dan lain lain; (4) Mulut,
melindungi kerusakan gigi; (5) Efek lain, metabolisme asam empedu (perubahan
yang dihasilkan tidak konsisten), efek bervariasi pada enzim mikroba yang
berpotensi berpengaruh terhadap karsinogenesis, menstimulasi apoptosis.
Penelitian pada tikus uji, memperlihatkan prebiotik meningkatkan
penyerapan kalsium, mereduksi terjadinya osteoporosis post gastrektonin, dan
memperbaiki mineral pada tulang. Efek ini dihubungkan dengan peningkatan
berat kandungan fekal, meningkatkan jumlah asam lemak rantai pendek fekal, dan
menurunkan pH fekal (Griffin dan Abrams 2008). Menurut Manning . (2004),
prebiotik mampu mencegah terjadinya kanker kolon, memiliki efek bagi bakteri
patogen, memperbaiki penyerapan kalsium, memiliki efek terhadap lemak darah,
dan memiliki efek imunologi. Prebiotik mungkin secara langsung memodifikasi
aktivitas enzim yang dihasilkan oleh bakteri asam laktat yang terlibat dalam
karsinogenesis seperti azoreduktase, nitroreduktase, dan β glucuronidase.
Pati resisten dianggap memiliki efek prebiotik. Hasil penelitian pada hewan
model (tikus dan babi) secara signifikan meningkatkan jumlah# " dan
! setelah mengkonsumsi pati resisten tipe III. Intervensi diet pati
resisten tinggi pada manusia secara signifikan meningkatkan produksi asam lemak
berantai pendek ( &') yang menandakan pengaruh pati resisten pada mikroflora
(Klinder . 2008). Menurut Manning . (2004) pati resisten ditemukan
mereduksi sterol, asam empedu sekunder, dan enzim genotoksik.
Pati resisten memiliki kelebihan dibandingkan prebiotik jenis lain (FOS dan
inulin). Pati resisten mudah mengikat dan memerangkap air, sehingga dapat
mempertahankan kadar air dalam feses. Hal ini mengakibatkan pati resisten tidak
menyebabkan sembelit jika dikonsumsi dalam jumlah relatif tinggi (Taggart
Le Leu . (2007) melaporkan hasil penelitian pada tikus uji
memperlihatkan pati resisten mengganggu kolonik luminal melalui peningkatan
konsentrasi asam lemak berantai pendek (butirat) dan menurunkan produksi toksik
hasil fermentasi protein akibat mengkonsumsi protein dalam jumlah yang tinggi.
Pati resisten tidak hanya bersifat sebagai pelindung melawan penyebab tumor
usus tetapi juga memperbaiki efek tumor yang disebabkan oleh protein yang tidak
dapat dicerna. Hylla . (1998) melaporkan pati resisten memiliki potensi
penting bagi metabolisme mikroorganisme yang terdapat dalam kolon manusia
dan berperan penting sebagai pencegah kanker. Menurut Jenkins . (1998) pati
resisten memiliki manfaat fisiologi yang dihubungkan dengan kesehatan kolonik
dalam fekal dan metabolisme &'.
Asam lemak berantai pendek ( &') dibentuk ketika polisakarida
difermentasi oleh bakteri anaerobik yang terdapat dalam usus besar. Terdapat
banyak bentuk polisakarida dalam usus besar, salah satunya pati resisten. &'
utama yang dihasilkan dalam usus manusia adalah butirat, propionat, dan asetat.
Konsentrasi &' dalam usus besar bergantung pada jenis polisakarida.
Umumnya, asetat adalah asam lemak berantai pendek yang paling banyak
dihasilkan sedangkan butirat yang paling rendah. Selain itu, konsentrasi juga
dipengaruhi oleh daerah di usus besar. Konsentrasi tertinggi dideteksi pada daerah
yang paling dekat dengan usus halus (70 140 mM) (British Nutrition Foundation
2005).
!
Serat pangan menurut ' ' " (2001)
Champ (2003) adalah bagian edibel atau analog karbohidrat yang
memiliki sifat resisten terhadap enzim pencernaan dan penyerapan dalam usus
halus dan dapat difermentasi secara parsial atau keseluruhan di dalam usus besar.
Serat pangan terdiri dari polisakarida, oligosakarida, lignin, dan substansi pada
tanaman. Serat pangan memberikan efek kesehatan termasuk menurunkan
kolesterol dan glukosa darah.
Hernot dan Fahey (2007) menyatakan serat pangan terdiri dari karbohidrat
tanaman dan lignin yang terdapat dalam jumlah yang besar pada matriks tanaman
pati resisten juga digolongkan dalam serat pangan. Serat pangan dibedakan
menjadi dua kelompok yaitu serat pangan larut dan serat pangan tidak larut.
Sajilata . (2006) melaporkan pati resisten walaupun bukan komponen dinding
sel, akan tetapi secara nutrisi memiliki fungsi yang sama dengan polisakarida
bukan pati, pati resisten digolongkan sebagai serat pangan yang tidak larut tetapi
fungsinya sama dengan serat pangan larut.
Menurut McIntyre . (1993) serat pangan menghasilkan konsentrasi
butirat yang lebih tinggi dibandingkan asetat. Hal ini menunjukkan serat pangan
dihubungkan dengan konsentrasi butirat yang tinggi dalam usus besar distal yang
berfungsi sebagai pelindung atau melawan kanker usus besar sedangkan serat
pangan yang bersifat larut tidak menghasilkan peningkatan konsentrasi butirat
dalam distal kolon. Pengujian pada tikus produksi butirat secara signifikan
dihubungkan dengan penghambatan pembentukan sel tumor.
Pati resisten menghasilkan butirat sedangkan pektin berperan untuk
membentuk asetat dalam jumlah besar. Butirat dihubungkan dengan banyak
sifat biologi dalam kolon. Butirat memiliki efek pada tingkat metilase DNA
yang dihubungkan dengan ekspresi gen. Butirat juga meningkatkan proliferasi sel
normal dan menekan proliferasi sel yang telah mengalami perubahan. Apoptosis
mungkin meningkat pada sel yang telah mengalami perubahan tetapi menghambat
sel normal ketika terdapat butirat (Wollowski . 2001).
" # $%
Indeks glikemik adalah pengukuran kecepatan penyerapan karbohidrat serta
kemampuan karbohidrat untuk menaikkan konsentrasi glukosa darah dalam waktu
tertentu. Definisi lain indeks glikemik adalah sebagai respon glukosa darah
terhadap makanan yang mengandung karbohidrat dalam takaran dan waktu
tertentu (Prijatmoko 2007).
Menurut Patterson (2006) faktor yang mempengaruhi IG adalah struktur
matriks makanan, dinding sel dan struktur pati, struktur granula pati, kandungan
amilosa dan amilopektin, kadar serat pangan, asam organik, penghambat amilase,
komposisi monosakarida, komposisi karbohidrat, kadar pati resisten, dan gula
alkohol. Kadar IG dari suatu makanan dibagi menjadi 3 kelompok, yaitu rendah
Kadar amilosa yang tinggi menunjukkan derajat hidrolisis yang lebih
rendah, amilosa adalah faktor utama yang mempengaruhi indeks hidrolisis pati
(HI), estimasi nilai indeks glikemik (IG) secara signifikan lebih rendah pada kadar
amilosa yang tinggi dibandingkan kadar amilosa rendah (Frei . 2003; Hu
. 2004; Margareta Leeman . 2006). Xue . (1996) menyatakan pati
jagung yang kaya amilosa berkorelasi positif terhadap penurunan glukosa darah
dan level insulin. Selanjutnya, Akerberg . (1998) menyatakan IG yang rendah
tidak hanya ditentukan oleh pati resisten, tetapi rendahnya IG mungkin juga
dipengaruhi oleh fraksi selain pati resisten, produk dengan kadar amilosa tinggi
Laboratorium Mikrobiologi Pangan, Kimia Pangan, dan Pilot Plan SEAFAST
Center IPB dan Laboratorium (Kimia Pangan, Mikrobiologi Pangan, Pengolahan
Pangan, dan Biokimia Pangan) Departemen Ilmu dan Teknologi Pangan.
Bahan utama digunakan dalam penelitian ini adalah pisang tanduk (
) yang diperoleh dari Lumajang, Jawa Timur. Bahan bahan lain yang
digunakan adalah enzim α amilase Fluka 52.9 U/mg α amilase
tahan panas Sigma E.C.3.2.1. type XII A 786 U/mg protein,
pepsin Sigma E.C.34231 porcin pankreas 624 U/mg, AMG (Amiloglukosidase)
Sigma A 7095 300 U/ml, API Test CHL 50, air deionisasi,
akuades, larutan kristal violet, larutan safranin, glukosa, maltosa, amilosa, pati
murni, etanol (95%, 80% dan 10%), petroleum eter, aseton, NaOH (25% dan 1 N),
asam asetat 1 N, larutan iod, HCl (25%, 4 M dan 0,1 N), KOH, pereaksi DNS,
buffer Na fosfat 0,05 M dan 0,01 M pH 6,9 dan pH 7, buffer sodium asetat 0,1 M
pH 5,2 dan pH 6,0, dan 0,4 M pH 4,75, buffer HCl KCl 0,05 M dan 0,1 M (pH
1,5), filter selulosa 0,45µm, dan kertas saring Whatman No. 41.
Media pertumbuhan bakteri yang digunakan adalah MRSA, MRSB, TSA,
TSB, mMRSB terdiri dari (protease pepton, ekstrak daging, ekstrak khamir,
ammonium sitrat, sodium asetat, MgSO4, MnSO4, dan dipotasium fosfat), dan
mTSB terdiri dari (pepton, sodium klorida, dipotasium hidrogen fosfat),
fruktooligosakarida (FOS). Bakteri yang digunakan terdiri dari
kik, 2B4, sa28k, diperoleh
dari Laboratorium Mikrobiologi Pangan, IPB (ditumbuhkan dalam media MRSB)
( ) diperoleh dari Laboratorium FKH, IPB
ditumbuhkan dalam media TSB. Alat alat yang digunakan dalam penelitian ini
adalah neraca analitik, otoklaf model MC 40, , , lemari pendingin,
oven, sentrifus, spektrofotometer, pH meter, inkubator,
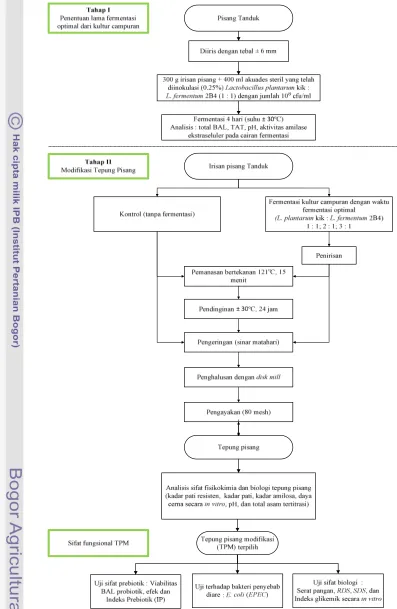
Penelitian yang dilakukan terdiri dari dua tahap, yaitu : tahap pertama,
menentukan lama fermentasi optimal irisan pisang oleh kultur campuran
kik dan 2B4; tahap kedua, penentuan rasio kultur
campuran ( kik dan 2B4) dan pengaruh pemanasan
otoklaf (121ºC) terhadap kadar pati resisten dan sifat fungsionalnya. Diagram alir
penelitian ini dapat dilihat pada Gambar 2.
!
Bakteri digunakan dalam proses fermentasi irisan pisang ( kik
dan 2B4) dikonfirmasi terlebih dahulu menggunakan API Test CHL
50. Kultur yang berumur 24 jam pada media MRSA agar miring, diambil
sebanyak 1 ose dan dimasukkan dalam media API CHL. Media yang telah
diinokulasikan kultur bakteri asam laktat dimasukkan dalam sumur sumur API
Test CHL 50 yang berisi 50 jenis gula berbeda, kultur dimasukkan secara hati hati
dan diusahakan tidak terbentuk gelembung. Selanjutnya ditambahkan parafin cair
steril. API Test CHL 50 diinkubasi selama 24 jam, diamati perubahan warna pada
masing masing sumur dan dimasukkan dalam software API Test.
Pertumbuhan kik dan 2B4 diamati dengan
menumbuhkan masing masing koloni (satu ose) pada media MRSB 100 ml, dan
diinkubasi pada suhu 37⁰C. Sebanyak 5 ml larutan MRSB diambil setiap tiga
jam untuk diukur selama 24 jam. Sebanyak 4 ml cairan MRSB digunakan untuk
mengukur densitas optik (OD) MRSB pada panjang gelombang (λ) 600 nm,
MRSB steril digunakan sebagai blanko.
Jumlah BAL selama pertumbuhan juga diukur dengan metode pemupukan
pada MRSA. Sebanyak 1 ml dimasukkan dalam larutan fisiologis NaCl 0.85%
9 ml dan divorteks untuk pengenceran 101. Pengenceran dilakukan sampai 106
dan 108 dengan cara yang sama. Pemupukan dilakukan secara duplo
pada pengenceran 104106dan 106108menggunakan MRSA dalam cawan petri.
Cawan petri diinkubasi pada suhu 37oC dalam posisi terbalik. Perhitungan koloni
" # $ % $ $ ! & ' (
Pisang diiris tipis dengan tebal ± 6 mm. Selanjutnya sebanyak 300 g irisan
pisang direndam dalam 400 ml akuades steril yang telah diinokulasi dengan
kik : 2B4 (1 : 1) 108 cfu/ml sebanyak 0,25% )
(Sobowale . 2007). Inkubasi dilakukan pada suhu ruang (±30°C) selama 0,
24, 48, 72, 96 jam. Untuk menentukan lama fermentasi optimum, pada setiap
interval waktu dilakukan pengukuran jumlah total bakteri asam laktat (unit log),
pH, total asam tertitrasi (%), dan aktivitas enzim amilase ekstraseluler (unit/mL)
pada cairan fermentasi.
# $ % $ $ ) $ *
& !( $ +
& ,*(
Irisan pisang difermentasi mengikuti prosedur yang sama seperti di atas
(Sobowale . 2007) menggunakan tiga rasio kultur campuran
kik : 2B4 yaitu (1 : 1); (2 : 1), dan (3 : 1). Setelah fermentasi selesai,
irisan pisang dibagi menjadi dua kelompok, yaitu tanpa perlakuan pemanasan
otoklaf dan diberi perlakuan pemanasan otoklaf.
Pada kelompok tanpa perlakuan pemanasan otoklaf, irisan setelah
fermentasi langsung dikeringkan dengan sinar matahari. Pada kelompok perlakuan
pemanasan otoklaf, irisan setelah fermentasi ditiriskan dan dipanaskan dalam
otoklaf (tekanan 0.15 Mpa atau 1.5 atm) pada suhu 121°C selama 15 menit,
kemudian didinginkan pada suhu ruang (±30°C) selama 24 jam, dan selanjutnya
irisan dikeringkan menggunakan sinar matahari. Irisan pisang dihaluskan
menggunakan dan diayak menggunakan saringan ukuran 80 mesh.
Perlakuan ini juga dilakukan pada irisan pisang tanpa fermentasi sebagai
perlakuan kontrol. Penentuan rasio kultur campuran yang menghasilkan tepung
pisang modifikasi (TPM) terbaik berdasarkan pada kadar pati resisten (%), daya
! - . + $ + $ & (
Tepung pisang modifikasi (TPM) terlebih dahulu dicuci dengan etanol 85%
dengan perbandingan TPM : etanol 85% adalah 1 : 2. Selanjutnya sampel disaring
menggunakan kertas saring dan dikeringkan dengan sinar matahari. Tujuan dari
pencucian ini adalah untuk menghilangkan gula gula sederhana (gula gula
reduksi) yang tersedia dalam TPM. Dengan demikian, pertumbuhan bakteri uji
pada media yang mengandung TPM diasumsikan hanya menggunakan sumber
karbon dari pati termasuk pati resisten bukan dari gula gula sederhana.
! /- 0 $ $ " &1
223(
Media pertumbuhan TPM disiapkan. Sebanyak 50 ml mMRSB + 2.5% TPM
dan 50 ml akuades + 2.5% TPM disterilkan. 2.5 ml kultur sp. yang
berumur 24 jam berisi 10⁵ cfu/ml dipipet dan dimasukkan ke dalam media
pertumbuhan yang berisi TPM. Selanjutnya diinkubasi selama 24 jam pada suhu
37oC.
Setelah inkubasi 24 jam, 1 ml larutan dipipet dan dimasukkan ke dalam
larutan pengencer NaCl 0.85% 9 ml dan divorteks untuk pengenceran 101.
Pengenceran dilakukan sampai 108 dengan cara yang sama. Pemupukan
dilakukan secara duplo pada pengenceran 106 108 menggunakan MRSA
dalam cawan petri. Cawan petri diinkubasi pada suhu 37oC dalam posisi terbalik.
Perhitungan koloni dilakukan setelah 48 jam berdasarkan metode ISO dalam
satuan cfu/ml. Prosedur yang sama dilakukan menggunakan prebiotik komersial
fruktooligosakarida (FOS) sebagai kontrol.
! + % $ &) + 224(
Efek prebiotik adalah meningkatnya populasi tetapi
peningkatan ini tidak dihubungkan dengan konsentrasi prebiotik. Indeks prebiotik
adalah peningkatan populasi atau yang dikorelasikan
dengan konsentrasi prebiotik (Roberfroid 2007). Analisis Indeks Prebiotik
mMRSB dan media mMRSB yang mengandung TPM. Setelah waktu inkubasi 24
jam, sampel dienumerasi dalam media MRSA. Prosedur yang sama dilakukan
menggunakan prebiotik komersial fruktooligosakarida (FOS) sebagai kontrol.
Efek Prebiotik = Log T2 T1
Indeks Prebiotik =
Log T2 T1
Berat
Keterangan :
T1 = media mMRSB
T2 = media mMRSB yang mengandung 2.5% TPM
! - $ 5
&6 224(
Aktivitas prebiotik adalah kemampuan prebiotik untuk membantu
pertumbuhan organisme yang dihubungkan dengan organisme lain dan
dibandingkan dengan glukosa. Oleh karena itu, karbohidrat memiliki aktivitas
prebiotik positif jika dimetabolisme oleh dan secara selektif
dimetabolisme oleh probiotik tetapi tidak oleh bakteri yang lain (Huebner .
2007).
Pengujian dilakukan dengan menambahkan 5% (v/v) kultur
sp. dalam tabung berbeda yang mengandung mMRSB dengan 2.5% (w/v) glukosa
atau 2.5% (w/v) TPM. Setelah 0 dan 24 jam waktu inkubasi, sampel dienumerasi
dalam media MRSA.
Pengujian juga dilakukan pada kultur bakteri penyebab diare. Kultur yang
digunakan adalah ( ) (5% (v/v)). Kultur kemudian
ditambahkan dalam tabung yang berbeda yang mengandung mTSB dengan 2.5%
(w/v) glukosa atau 2.5% (w/v) TPM. Kultur diinkubasi pada suhu 37⁰C, dan
Nilai Aktivitas
N = Jumlah bakteri probiotik
E = Jumlah ( )
t₀ = Waktu inkubasi awal t₁ = Waktu inkubasi akhir
7 - . +
Pengujian sifat biologi TPM terpilih meliputi pengujian serat pangan, pati
yang cepat dicerna (!"#), pati yang lambat dicerna (#"#), dan indeks glikemik
secara .
! $ $
! ) $ $ & 5$ 88 (
Tepung pisang modifikasi yang telah bebas lemak dan gula sederhana
(1 gram) dalam 20 ml buffer sodium asetat (0.1 M, pH 5.2) dimasak dalam
selama 30 menit. Dispersi pati didinginkan pada suhu 37⁰C, dicampur
dengan larutan enzim (5 ml) yang terdiri dari ekstrak pankreatin dan
amiloglukosidase (AMG), dan diinkubasi dalam pada suhu 37⁰C.
Ekstrak pankreatin diperoleh dari : 3 g pankreatin disuspensi dalam 20 ml air
deionisasi, distirrer selama 10 menit pada suhu ruang, dan disentrifus pada 1500 g
selama 10 menit. Larutan enzim dipersiapkan dengan mencampurkan 13.5 ml
supernatan ekstrak pankreatin, 210 U AMG, dan 1 ml air deionisasi. Pati yang
cepat dicerna (!"#) dinyatakan sebagai total pati yang dicerna selama 20 menit
pertama, dan pati yang lambat dicerna (#"#) dinyatakan sebagai total pati yang
dicerna antara 20 dan 120 menit. Dispersi pati kemudian ditambahkan KOH (10
M) dan disimpan pada suhu 0⁰C selama 15 menit, kemudian ditambahkan AMG
Sebanyak 1 ml sampel ditambahkan 2 ml pereaksi DNS. Setelah itu dipanaskan
dalam penangas air dengan suhu air (100⁰C) selama 10 menit lalu didinginkan pada
suhu ruang. Sampel kemudian diencerkan dengan penambahan 10 ml akuades dan
diukur menggunakan spektrofotometer pada panjang gelombang 550 nm. Akuades
digunakan sebagai blanko. Kurva standar dibuat menggunakan larutan glukosa
standar, yaitu 5000 ppm sebagai larutan induk. Larutan kerja yang digunakan sebagai
standar adalah 500 ppm, 1000 ppm, 1500 ppm, 2000 ppm, 2500 ppm, 3000 ppm,
3500 ppm, 4000 ppm, 4500 ppm, dan 5000 ppm. Persen pati diperoleh dengan
mengalikan persen glukosa dengan faktor koreksi 0.9.
% Pati Resisten = A
S ×
FP
W ×100 ×0.9
Keterangan :
A = Absorbansi sampel
S = Slope atau kemiringan kurva Fp = Faktor pengenceran
W = Berat sampel (g)
! & * 887(
Sebanyak 3 g tepung pisang dicuci dengan menggunakan etanol 80%
sebanyak ± 30 ml secara maserasi untuk menghilangkan gula gula sederhana pada
suhu kamar selama 15 menit. Suspensi disaring dengan kertas saring dan dicuci
dengan akuades sampai volume filtrat mencapai 250 ml. Residu kertas saring
dicuci 5 kali dengan 10 ml eter untuk menghilangkan lemak. Selanjutnya sampel
dibiarkan untuk menguapkan eter dari residu dan dicuci lagi dengan 150 ml
alkohol 10% untuk membebaskan lebih lanjut karbohidrat yang terlarut. Residu
pada kertas saring kemudian dikeringkan dengan menggunakan sinar matahari
selama 3 jam.
Analisis kadar pati dengan metode hidrolisis langsung oleh asam ("
$% % ). Selanjutnya sebanyak 0.5 g sampel tepung pisang yang telah
bebas lemak dan gula gula sederhana ditimbang dan dimasukkan ke dalam
erlenmeyer. Lalu ditambahkan 25 ml akuades dan 5 ml HCl 25%. Erlenmeyer
ditutup dengan pendingin balik dan dipanaskan di atas penangas air
dengan NaOH 25%, disaring, dan ditepatkan volumenya hingga 100 ml.
Penentuan kadar pati dinyatakan sebagai glukosa pada filtrat. Total glukosa
dianalisis dengan menggunakan metode DNS.
Sebanyak 1 ml sampel yang dihidrolisis dengan asam, dinetralkan, disaring dan
ditepatkan hingga volume 100 ml dimasukkan ke dalam tabung reaksi, kemudian
ditambahkan 2 ml pereaksi DNS. Setelah itu dipanaskan dalam penangas air dengan
suhu air (100⁰C) selama 10 menit lalu didinginkan pada suhu ruang. Sampel
kemudian diencerkan dengan penambahan 10 ml akuades dan diukur dengan
spektrofotometer pada panjang gelombang 550 nm. Akuades digunakan sebagai
blanko. Kurva standar dibuat menggunakan larutan glukosa standar, yaitu 5000 ppm
sebagai larutan induk. Larutan kerja yang digunakan sebagai standar adalah 500 ppm,
1000 ppm, 1500 ppm, 2000 ppm, 2500 ppm, 3000 ppm, 3500 ppm, 4000 ppm, 4500
ppm, dan 5000 ppm. Persen pati diperoleh dengan mengalikan persen glukosa
dengan faktor koreksi 0.9.
% Pati = A
S ×
FP
W ×100 ×0.9
Keterangan :
A = Absorbansi sampel
S = Slope atau kemiringan kurva Fp = Faktor pengenceran
W = Berat sampel (g)
! $ &%))% 84 5 898(
! .
Amilosa murni ditimbang sebanyak 40 mg kemudian dimasukkan ke dalam
labu takar 100 ml dan ditambahkan dengan 1 ml etanol 95% dan 9 ml NaOH 1 N
lalu didiamkan selama 24 jam dan ditepatkan sampai tanda tera dengan akuades.
Selanjutnya larutan tersebut dipipet masing masing sebanyak 1, 2, 3, 4, dan 5 ml
lalu dimasukkan ke dalam labu takar 100 ml. Ke dalam masing masing labu
takar tersebut ditambahkan asam asetat 1 N sebanyak masing masing 0.2; 0.4; 0.6;
ditepatkan sampai tanda tera dengan akuades, dikocok, lalu didiamkan selama 20
menit, dan diukur intensitas warna yang terbentu dengan spektrofotometer pada
panjang gelombang 625 nm.
! $ .
Sebanyak 100 mg sampel (tanpa lemak) dimasukkan ke dalam labu takar
100 ml, dan ditambahkan dengan 1 ml etanol 95% dan 9 ml NaOH 1 N lalu
didiamkan selama 24 jam dan ditepatkan sampai tanda tera dengan akuades.
Pipet 5 ml larutan tersebut, lalu dimasukkan ke dalam labu takar 100 ml,
dan ditambahkan 1 ml asam asetat 1 N dan 2 ml larutan iod. Setelah itu, larutan
ditepatkan sampai tanda tera dengan akuades, dikocok, lalu didiamkan selama 20
menit, dan diukur intensitas warna yang terbentuk dengan spektrofotometer pada
panjang gelombang 625 nm. Kadar amilosa dihitung dengan persamaan :
% Kadar amilosa = A S
FP W
Keterangan :
A = Absorbansi sampel
S = Slope atau kemiringan kurva Fp = Faktor pengenceran, yaitu 0.002 W = Berat sampel (g)
! ! /- 5 * $ : & $ 22 (
Enzim α amilase dilarutkan di dalam buffer Na Fosfat 0.05 M pH 7.
Pereaksi dinitrosalisilat dibuat dengan melarutkan 1 gram 3.5 dinitrosalisilat, 30
gram Na K tartarat dan 1.6 gram NaOH dalam 100 ml akuades. Kurva standar
dibuat menggunakan larutan maltosa standar, yaitu 1000 ppm sebagai larutan induk.
Larutan kerja yang digunakan sebagai standar adalah 100 ppm, 200 ppm, 300 ppm,
400 ppm, 500 ppm, 600 ppm, 700 ppm, 800 ppm, 900 ppm, dan 1000 ppm.
Sebanyak 0.5 gram pati disuspensikan dalam 50 ml akuades sehingga
diperoleh konsentrasi 1% w/v, kemudian dipanaskan dalam penangas air selama
30 menit pada suhu 90oC kemudian didinginkan. Sebanyak 2 ml sampel
Na Fosfat 0.1 M, pH 7. Lalu diinkubasi pada suhu 37oC selama 15 menit.
Selanjutnya ditambahkan larutan α amilase dan diinkubasi lagi pada suhu 37oC
selama 30 menit.
Sebanyak 1 ml sampel dari tabung reaksi dipipet dan dimasukkan ke dalam
tabung reaksi lain, ditambah 2 ml pereaksi dinitrosalisilat. Lalu dipanaskan pada
suhu 100oC selama 10 menit. Warna merah orange yang terbentuk diukur
absorbansinya pada panjang gelombang 520 nm. Kadar maltosa campuran reaksi
dihitung dengan menggunakan kurva standar maltosa murni yang diperoleh
dengan mereaksikan larutan maltosa standar dengan pereaksi dinitrosalisilat
menggunakan prosedur seperti di atas. Blanko dibuat untuk menghitung kadar
maltosa awal (bukan hasil hidrolisis enzim). Prosedur pembuatan blanko sama
seperti prosedur untuk sampel hanya saja tanpa sampel dan tidak ditambahkan
larutan enzim α amilase. Sebagai gantinya untuk blanko diganti buffer Na Fosfat
0.1 M pH 7.
% DC Pati = Kadar maltosa sampel – Kadar maltosa blanko sampel
Kadar maltosa pati murni – Kadar maltosa blanko pati murni
! 7 /- . & * 887(
Pengukuran serat pangan dibagi menjadi tiga tahap yaitu persiapan sampel,
pengukuran serat pangan tidak larut, dan pengukuran serat pangan larut.
Persiapan sampel
Sampel yang telah diekstraksi lemaknya ditimbang sebanyak 1 gram (W)
dan dimasukkan ke dalam erlenmeyer, kemudian ditambahkan larutan buffer.
Sampel ditambahkan 100 KL termamyl lalu dipanaskan sambil ditutup dan
diinkubasi (T = 100⁰C selama t = 15 menit) sambil sesekali diaduk. Sampel
didinginkan kemudian ditambahkan 20 mL akuades dan ditambahkan HCl 4 M
hingga pH 1.5. Sampel ditambahkan 100 mg pepsin, lalu erlenmeyer ditutup dan
ditempatkan pada suhu 40⁰C sambil diaduk selama 60 menit, kemudian sampel
ditambahkan 20 mL akuades dan diatur pH nya hingga 4.5 dengan cara
ditambahkan NaOH. Sampel ditambahkan enzim AMG, lalu erlenmeyer ditutup
dan diinkubasi pada suhu 40⁰C selama 60 menit sambil diaduk, kemudian sampel
ditambahkan NaOH kembali hingga pH 6.8. Sampel disaring melalui
Pengukuran serat makanan tidak larut
Residu dari hasil persiapan sampel dicuci dengan 10 mL etanol 95%
sebanyak dua kali, dan 10 mL aseton sebanyak dua kali. Residu dikeringkan pada
suhu 105⁰C hingga diperoleh berat yang tetap, kemudian dimasukkan ke dalam
desikator dan ditimbang (D1). Suspensi yang telah kering diabukan dengan suhu
500⁰C selama lima jam, didinginkan, dimasukkan dalam desikator dan ditimbang
(L1).
Pengukuran serat makanan larut
Volume dari filtrat yang didapat dari persiapan sampel ditambahkan
akuades hingga 100 ml. Filtrat ditambahkan etanol 95% dengan suhu 60⁰C
sebanyak 400 mL, kemudian diendapkan selama satu jam. Filtrat disaring,
kemudian dicuci dengan 10 mL etanol 95% dan 10 mL aseton sebanyak dua kali.
Sampel dikeringkan pada suhu 105⁰C selama 24 jam, kemudian dimasukkan ke
dalam desikator dan ditimbang (D2). Sampel yang telah kering diabukan dengan
suhu 500⁰C selama lima jam, didinginkan, dimasukkan dalam desikator dan
ditimbang (L2).
Penetapan blanko
Analisis ini menggunakan blanko yang diperoleh dengan cara yang sama
tetapi tanpa adanya sampel (akuades). Nilai blanko harus diperiksa ulang terutama
jika menggunakan enzim dari kemasan yang baru. Berat blanko bebas serat (B1
dan B2)
Total serat makanan
Total serat makanan diperoleh dengan menjumlahkan serat makanan larut
dan tidak larut
% (bk) serat pangan tidak larut = D1 – L1 – B1 W
% (bk) serat pangan larut = D2 – L2 – B2
W
! 3 /- % $ ; $ : &; 884(
Sampel sebanyak 50 mg ditambahkan 10 mL buffer HCl KCl pH 1.5.
Kemudian 0.2 ml larutan yang mengandung satu gram pepsin dalam 10 ml buffer
HCl KCl ditambahkan pada sampel dan diinkubasi pada suhu 40⁰C selama satu
jam dalam shaker . Volume ditambahkan 25 mL buffer Tris Maleat pH
6.9 (dalam penelitian ini buffer Tris Maleat digantikan dengan buffer Na fosfat
pH 6.9). 5 mL larutan αamilase dalam buffer Na fosfat ditambahkan pada
sampel. Sampel diinkubasi dalam shaker pada suhu 37⁰C. 1 ml cairan
sampel diambil setiap 30 menit dari 0 sampai 30 jam. Cairan ini ditempatkan
dalam tabung reaksi dan dipanaskan pada suhu 100⁰C selama 5 menit untuk
menginaktifkan enzim dan disimpan dalam lemari pendingin sampai waktu
inkubasi berakhir. Kemudian 3 mL buffer sodium asetat pH 4.75 ditambahkan
pada masing masing cairan, dan 60µL AMG digunakan untuk menghidrolisis pati
yang dicerna menjadi glukosa setelah 45 menit pada suhu 60⁰C dalam .
Sebanyak 1 ml sampel ditambahkan 2 ml pereaksi DNS. Setelah itu dipanaskan
dalam penangas air dengan suhu air (100⁰C) selama 10 menit lalu didinginkan pada
suhu ruang. Sampel kemudian diencerkan dengan penambahan 10 ml akuades dan
diukur pada panjang gelombang 550 nm. Gunakan sampel akuades sebagai blanko.
Kurva standar dibuat menggunakan larutan glukosa standar dengan kisaran 5 mg/ml.
Berat pati diperoleh dengan mengalikan berat glukosa dengan faktor koreksi 0.9.
Pati yang dicerna dinyatakan sebagai persentasi hidrolisis total pati pada
waktu 30, 60, 90, 120, 150, dan 180 menit. Kurva yang diperoleh mengikuti
persamaan non linear yang menggambarkan kinetik hidrolisis pati
C = C∞ 1 ekt
Keterangan :
C = Persentase pati terhidrolisis pada waktu t (menit)
C∞ = Persentase ekuilibrium pati terhidrolisis setelah waktu 180 menit k = Konstanta kinetik
Variabel C∞ dan k masing masing sampel diestimasi menggunakan SPSS for
Indeks hidrolisis dan estimasi indeks glikemik
Kurva hidrolisis pati yang diperoleh akan dihasilkan area pada kurva
hidrolisis (AUC) yang dihitung menggunakan persamaan integral kinetik
hidrolisis pati :
AUC = C∞ (tf – to) – (C∞/k)[1 – exp [–k(tf – to]]
Keterangan :
tf = Waktu pada menit ke 90 t₀ = Waktu awal
Indeks hidrolisis (IH) diperoleh dari rasio antara AUC setiap sampel dengan nilai
AUC sampel referensi ( IH = 100). IH90 digunakan dalam
penentuan estimasi IG. Indeks glikemik diprediksi menggunakan persamaan :
EGI = 39.21 + 0.803 × IH
! 4 1 ; $ $ "
Perhitungan jumlah koloni bakteri asam laktat berdasarkan metode ISO
dalam satuan cfu/ml
N = C
n n d
Keterangan :
N = Jumlah mikroba (cfu/ml)
∑c = Jumlah koloni dari total cawan (25 250 koloni)
n1 = Jumlah cawan pada pengenceran pertama (25 250 koloni) n2 = Jumlah cawan pada pengenceran kedua (25 250 koloni) d = Tingkat pengenceran terendah
Perhitungan waktu generasi bakteri dihitung menggunakan persamaan
kecepatan pertumbuhan (Fardiaz 1992).
xt = 2ktx0
Keterangan :
x₀ = Jumlah sel awal
xt = Jumlah sel setelah waktu t
t = Waktu dari x₀ ke xt, dinyatakan dalam jam atau menit
k = Konstan kecepatan pertumbuhan, dinyatakan dalam jumlah generasi per
waktu
! 9 $ $
Bahan ditimbang sebanyak 5 gram, ditambahkan aquadest sebanyak 100 ml
sampai batas tanda tera kemudian di homogenkan. Sampel diambil 25 ml dan
dimasukkan ke dalam Erlenmeyer. Campuran ini ditambahkan indikator PP untuk
uji total asam sebanyak 2 hingga 3 tetes. Sampel kemudian dititrasi dengan
larutan NaOH 0,1 N hingga terjadi perubahan warna menjadi merah muda.
% Total Asam= ml NaOH ×N NaOH ×BM ×Fp
Berat Bahan ×1000 ×100%
Keterangan :
BM asam laktat = 90,08
! 8 6
pH meter dikalibrasi dengan menggunakan buffer fosfat pH 4 dan pH 7.
Sampel dalam bentuk tepung sebanyak 1 g dilarutkan dalam 20 ml akuades,
kemudian dikocok (distirer) sampai basah sempurna. Setelah itu, ukur pH pada
supernatan sampel dengan menggunakan pH meter yang telah dikalibrasi terlebih
dahulu. Untuk sampel dalam bentuk cairan, setelah dikalibrasi terlebih dahulu
sampel dapat langsung diukur menggunakan pH meter.
! 2 $ $ $ $ &. 22 (
Supernatan disaring dengan filter selulosa (diameter lubang 0.45 Km) dan
filtrat diambil untuk dianalisis aktivitas amilase ekstraseluler berdasarkan
terbentuknya komplek pati iodin. Cairan fermentasi disentrifuse, filtrat yang
mengandung enzim sebanyak 0.1 mL ditambah 0.5 ml pati 1% b/v dalam buffer
asetat 0.1 M pH 6.0. Selanjutnya diinkubasi selama 10 menit pada suhu 400C.
Inkubasi dihentikan dengan menambah 1.0 ml HCl 0.1 N. Sebanyak 0.5 mL
larutan pereaksi ditambah 5 ml iodin (12 mg I2dan 25 mg KI/100 mL). Jumlah
pati yang tersisa diukur pada panjang gelombang 700 nm. Satu unit aktivitas
amilase adalah banyaknya enzim yang dapat menghidrolisis 1 Sg pati per menit
! $ $ & * 887(
Cawan kosong dikeringkan dalam oven selama 15 menit dan didinginkan
dalam desikator, dan ditimbang. Ditimbang dengan cepat ± 5 gram sampel yang
sudah dihomogenkan dalam cawan. Cawan dimasukkan ke dalam oven selama 6
jam. Untuk produk yang tidak mengalami dekomposisi dengan pengeringan yang
lama, dapat dikeringkan selama 1 malam (16 jam). Cawan dipindahkan ke
desikator, didinginkan, dan ditimbang kembali. Cawan dikeringkan kembali
dalam di dalam oven sampai diperoleh bobot yang tetap (konstan).
% Kadar air (berat kering) = W3 W2
% Kadar air (berat basah) = W3 W1
Keterangan :
W1 = Berat sampel sebelum dikeringkan (g) W2 = Berat sampel setelah dikeringkan (g) W3 = W2– W1
7 ) : :
Rancangan percobaan pada penelitian penentuan lama fermentasi optimal
irisan pisang oleh kultur campuran kik dan 2B4 adalah
rancangan acak lengkap dengan lama fermentasi (0, 24, 48, 72, dan 96 jam)
sebagai variabel.
Rancangan percobaan pada penelitian penentuan rasio kultur campuran (
kik dan 2B4) dan pengaruh pemanasan otoklaf (121ºC)
terhadap kadar pati resisten dan sifat fungsionalnya adalah rancangan acak
lengkap pola faktorial dengan rasio kultur campuran BAL (1 : 1, 2 : 1, dan 3 : 1)
sebagai variabel A dan pemanasan otoklaf sebagai variabel B.
3 $ $
Pengolahan data dilakukan dengan menggunakan Analisis ragam
(ANOVA). Jika berbeda signifikan maka dilanjutkan dengan Uji Duncan pada
level 95% (α = 0.05). Pada pengujian sifat fungsional, dilakukan analisis
4.1. Konfirmasi Bakteri Asam Laktat dan Bakteri ( )
!
!
" # $
%& '' !
!
" # $ ( ''
!
!
)
!
##* + ) , - #..
$ / 0 '' ! )
1
! ! ) *
0 0 !
) * 1
)
$ 4 5 #..2
-- 6 7*
-7 /
! ! !
!
-!
- !
0 0
-%/8 9 7:" ;' %/8
:
%/8 9 7:" ;' ! 2
! 2 8
%/8 9 7:" ;'
! 2 %/8 9 7:" ;'
5 6
*
4.2. Kurva Pertumbuhan kik dan 2B4
/ )
Waktu pertumbuhan (Jam)
# >
! ; )
Waktu pertumbuhan (Jam)
# ; 2
@ # 0
.2 0 ? ) # > . 0 ? ) # ; 2
λ A >'' " 9
(<
<
(< λ A >''
) *#
$ , - #..
5
# #
0 # ?
# ' .> ;3 3
# ' ? 5
0 5
0
%"
4.3. Penentuan Lama Fermentasi Irisan Pisang
1 0
# B # * 0
: )
9 0
/
* 2. 3'
23 0 . # 0 2 .2
0 >3 0 ';
0 % ''
#*2
,
1 @ ''.
%
-4.3.1. Jumlah Bakteri Asam Laktat
/
! > @ 0
%" ' .> > 2.
2# 0 ?
: /C' ';
%" 0 " #'0 :
< 0 " #' %"
3 0 ? .> 2# 0 ?
%" > 2. 0 ? %"
! > : 0
4.3.2. Produksi Asam
9
: /C' ';
' ?" / 0
#' ?" 7 ''2
4.3.3. Perubahan pH
/ : !