PENGGUNAAN FITASE DALAM PAKAN
BERBASIS TEPUNG BUNGKIL KEDELAI UNTUK
IKAN BAUNG (Hemibagrus nemurus)
YULISMAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Penggunaan fitase dalam pakan berbasis tepung bungkil kedelai untuk ikan baung (Hemibagrus nemurus) adalah benar hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 16 Oktober 2006
ABSTRAK
Yulisman. Penggunaan Fitase dalam Pakan Berbasis Tepung Bungkil Kedelai untuk Ikan Baung (Hemibagrus nemurus). Dibimbing oleh Dedi Jusadi dan Ing Mokoginta.
Percobaan ini bertujuan untuk mengevaluasi pengaruh penambahan fitase dalam pakan terhadap kecernaan fosfor (P) dan kinerja pertumbuhan ikan baung (Hemibagrus nemurus). Percobaan ini menggunakan Rancangan Acak Lengkap (RAL) satu faktor, terdiri dari 5 (lima) perlakuan dan 3 (tiga) ulangan, yaitu: pakan A (tanpa fitase dan dengan penambahan fosfor anorganik/kontrol), pakan B, C, D dan E masing- masing penambahan 0, 20, 40 dan 60 mg fitase/100g tepung bungkil kedelai dan tanpa penambahan P anorganik. Data yang diperoleh dianalisa dengan menggunakan sidik ragam (ANOVA), yang dilanjutkan dengan uji Duncan. Ikan baung sebanyak 15 ekor dengan bobot 6,9 + 0,2 gdimasukkan ke dalam akuarium ukuran 50 x 40 x 35 cm. Pakan diberikan 3 kali sehari secara
at satiation dan dipelihara selama 60 hari. Hasil menunjukkan bahwa kecernaan P meningkat dari 64,5% menjadi 87,0% dengan meningkatnya kadar fitase dari 0 mg/100 g tepung bungkil kedelai dalam pakan (pakan B) sampai 60 mg fitase/100 g tepung bungkil kedelai dalam pakan (pakan E). Kecernaan P pada pakan E lebih tinggi daripada pakan A (77,6%). Rata-rata pertambahan bobot ikan yang diberi pakan E lebih tinggi (p<0,05) daripada pakan lainnya. Laju pertumbuhan harian mempunyai pola yang sama dengan pertambahan bobot ikan. Nilai konversi pakan (FCR) yang terbaik (p<0,05) dihasilkan pada pakan E, sementara yang terjelek diperoleh pada pakan B. Konsentrasi P, kalsium (Ca) dan seng (Zn) dalam tubuh dan tulang ikan yang diberi pakan E lebih tinggi daripada pakan B, C dan D, tetapi sama dengan (p<0,05) pakan A. Limbah Nitrogen (N) dan P yang dikeluarkan oleh ikan melalui feses yang diberi pakan E 76% dan 20% lebih rendah daripada pakan kontrol.
ABSTRACT
Yulisman. Utilization of phytase in soybean meal based diet for green catfish
Hemibagrus nemurus. Under the direction of Dedi Jusadi and Ing Mokoginta. A triplicate experiment s was conducted to evaluate the effect of phytase supplemented into the diet on phosphorus (P) digestibility and growth performance of green catfish Hemibagrus nemurus. Five experimental diets were used in this experiment, namely diets A, B, C, D and E. Diet A, as a control, was supplemented with inorganic P, without any phytase supplementation. Diet B, C, D and E were supplemented with 0, 20, 40 or 60 mg phytase/100 g soybean meal (SBM), respectively, without inorganic P supplementation. Fifteen fish with initial body weight of 6.9 + 0.2 g were distributed into a 60- l aquaria. Fish were fed on the diets for 60 days. Results indicated that P digestibility was increase from 64.5% to 87.0% as phytase supplementation elevated from 0 mg in diet B to 60 mg phytase/100 g SBM in diet E. P digestibility in diet E was better than diet A (77.6%). Mean weight gain of fish fed diet E was higher (P<0.05) than the fish fed other diets. The daily growth rate followed similar trend. Feed conversion ratio (FCR) was the best (P<0.05) in fish fed diet E, while the fish fed diet B had the worst FCR. P, Calsium (Ca) and Zinc (Zn) concentration in whole body and bone of fish fed diet E was higher than the fish fed diet B, C and D, but was no significance different (P>0.05) with fish fed diet A. Nitrogen (N) and P loading by fish fed diet E was 76% and 20% lower than the fish fed control diet.
PENGGUNAAN FITASE DALAM PAKAN
BERBASIS TEPUNG BUNGKIL KEDELAI UNTUK IKAN
BAUNG (
Hemibagrus nemurus
)
YULISMAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
RIWAYAT HIDUP
Penulis dilahirkan di Tanjungpinang pada tanggal 3 Juli 1976 dari ayah
Nazaruddin Toesry dan Ibu Nurtila. Penulis merupakan anak ketiga dari tiga
bersaudara.
Tahun 1995 penulis menamatkan SMAN Airtiris dan pada tahun yang
sama penulis diterima di Program Studi Budidaya Perairan, Fakultas Perikanan
dan Ilmu Kelautan, Universitas Riau, Pekanbaru melalui jalur PBUD.
Tahun 1999 penulis berhasil menyelesaikan studi S-1 dan berhak
mendapatkan gelar Sarjana Perikanan (S.Pi). Pada tahun 2002, penulis diterima
sebagai tenaga pengajar di program D-III Perikanan dan Ilmu Kelautan, Fakultas
PRAKATA
Puji dan Syukur penulis panjatkan kehadhirat Allah SWT, karena berkat
Rahmat dan Karunia-Nya penulis dapat menyelesaikan tesis ini.
Pada kesempatan ini tidak lupa penulis menyampaikan ucapan terima
kasih kepada Bapak Dr. Dedi Jusadi, M.Sc selaku Ketua Komisi Pembimbing
dan Ibu Prof. Dr. Ing Mokoginta, MS selaku Anggota Komisi Pembimbing yang
telah banyak memberikan bimbingan dan saran sehingga tersusunnya tesis ini.
Terima kasih penulis ucapkan kepada DIKTI yang telah memberikan bantuan
beasiswa BPPS selama masa studi saya. Terima kasih juga penulis ucapkan
kepada ayahanda Nazaruddin Toesry, A.Md dan ibunda Nurtila tercinta atas
limpahan kasih sayang dan do’anya, juga kepada bang Indra Suharman, M.Sc dan
kak Irma Suryanti, kak Ratna Enita dan bang Sukhairi, keponaanku yang
tersayang Nabilla Zahra Indra, Zakia Rahma Indra, Rizki Aulia dan Muhammad
Rafi, serta istriku yang tercinta Dade Jubaedah, M.Si yang selalu mencurahkan
rasa kasih sayang dan motivasinya.
Tesis yang berjudul ”Penggunaan fitase dalam pakan berbasis tepung
bungkil kedelai untuk ikan baung (Hemibagrus nemurus)” merupakan suatu tulisan singkat dari hasil penelitian yang telah dilakukan, disusun semaksimal
mungkin sesuai keterbatasan ilmu yang penulis miliki. Oleh karena it u penulis
sangat menyadari bahwa masih banyak terdapat kekurangan dan kelemahannya.
Saran dan masukan yang sifatnya membangun dari semua pihak, sangat penulis
harapkan demi tercapainya kesempurnaan. Atas masukan dan sarannya, penulis
mengucapkan terima kasih.
Semoga tesis ini bermanfaat terutama bagi penulis dan bagi pihak yang
memerlukannya.
Bogor, Oktober 2006
DAFTAR ISI
Halaman
Daftar Tabel ... vi
Daftar Lampiran ... vii
PENDAHULUAN Latar Belakang ... 1
Perumusan Hipotesis ... 2
Tujuan dan Manfaat ... 2
TINJAUAN PUSTAKA Asam Fitat dan Fitase... 3
Peranan Fosfor ... 5
Peranan Fitase ... 5
BAHAN DAN METODE Metode dan Desain Penelitian ………... 7
Pakan Uji... 7
Pemeliharaan Ikan dan Pengumpulan Data... 9
Analisis Kimia ... 11
Analisis Statistik ... 11
HASIL DAN PEMBAHASAN Hasil ... 13
Pembahasan ... 15
SIMPULAN DAN SARAN Simpulan ... 19
Saran ... 19
DAFTAR PUSTAKA ... 20
DAFTAR TABEL
Tabel Halaman
1. Kandungan fitat dan fosfor fitat pada beberapa bahan pangan…………. 4
2. Aktivitas fitase pada kondisi pH yang berbeda ... 5
3. Komposisi bahan penyusun pakan yang digunakan (g/kg pakan) ... 8
4. Komposisi proksimat pakan (% bobot basah) dan energi pakan
percobaan ... 9
5. Nilai kecernaan P dan protein pakan serta P dan N yang terbuang
melalui feses antar perlakuan selama penelitian ... 13
6. Komposisi mineral ikan baung (% bobot kering) ... 14
7. Rata-rata bobot awal (Bo), bobot akhir (Bt), retensi protein (RP), laju pertumbuhan harian (LPH), konsumsi pakan (KP),
konversi pakan (FCR), dan tingkat kelangsungan hidup (SR)
ikan baung (Hemibagrus nemurus) selama penelitian ... 14 8. Limbah P dan N yang terbuang (g/kg pertambahan bobot ikan)
DAFTAR LAMPIRAN
Lampiran Halaman
1. Prosedur analisa kadar protein
(metode Semi Mikro Kjedahl, Takeuchi 1988) ... 24
2. Prosedur kadar lemak (metode ether ekstraksi: Takeuchi 1988) ... 25
3. Prosedur analisis kadar abu (Takeuchi 1988) ……….... 26
4. Prosedur analisis serat kasar (Takeuchi 1988) ……….. 27
5. Prosedur analisis kadar air (Takeuchi 1988) ………. 28
6. Prosedur analisis mineral (Reitz et al. 1960) ... 29
7. Pertambahan bobot (%) biomass ikan baung setiap perlakuan ... 30
8. Analisa ragam pertambahan bobot (%) ikan baung ... 30
9. Konversi pakan ikan baung setiap perlakuan ... 30
10. Analisa ragam konversi pakan ikan baung setiap perlakuan ... 30
11. Retensi protein (%) setiap perlakuan ... 30
12. Analisa ragam retensi protein (%) ikan baung setiap perlakuan ... 30
13. Tingkat kelangsungan hidup (%) ikan baung setiap perlakuan ... 31
14. Konsumsi pakan (g) ikan baung setiap perlakuan selama penelitian .. 31
15. Hasil analisa kandungan mineral tubuh dan tulang ikan baung pada akhir penelitian ... 31
PENDAHULUAN
Latar Belakang
Saat ini tepung bungkil kedelai merupakan sumber protein nabati yang
umum digunakan dalam pakan ikan untuk mengurangi penggunaan tepung ikan.
Pongmaneerat dan Watanabe (1992) menyatakan bahwa tepung bungkil kedelai
memiliki komposisi asam amino yang lebih lengkap dan lebih sesuai untuk
memenuhi kebutuhan asam amino ikan dibandingkan dengan sumber protein
nabati lainnya. Beberapa penelitian menyebutkan bahwa tepung bungkil kedelai
dapat digunakan sebagai sumber protein untuk menggantikan tepung ikan dalam
pakan ikan mas Cyprinus carpio, rainbow trout Oncorhynchus mykiss (Pongmaneerat dan Watanabe 1992), gurami Osphronemus gouramy (Suprayudi
et al. 1999). Namun demikian, salah satu masalah dalam penggunaan sumber protein bahan nabati adalah terdapatnya faktor anti nutrisi yaitu mengandung
asam fitat yang merupakan bentuk utama penyimpanan fosfor (P) yang tidak
dapat dimanfaatkan oleh hewan monogastrik, termasuk ikan (Masumoto et al. 2001; Debnath et al. 2005).
Penggunaan fitase dapat meningkatkan kecernaan P dalam pakan hewan.
Hasil penelitian Han et al. (1998) menunjukkan bahwa penambahan 10% wheat middlings per kg pakan, 300 unit mikrobial fitase dan 1,5% asam sitrat dapat menggantikan 2% fosfor anorganik yang biasa ditambahkan dalam pakan yang
mengandung tepung jagung dan kedelai untuk babi. Li et al. (2004) mengatakan bahwa penggunaan fitase dengan konsentrasi 250 unit per kg efektif dapat
menggantikan dikalsium fosfat dalam pakan tanpa mempengaruhi pertumbuhan,
efisiens i pakan, atau deposisi tulang pada ikan channel catfish ukuran fingerling.
Masumoto et al.(2001) menyatakan bahwa penambahan 0,2 g fitase dalam pakan yang mengandung 67% bungkil kedelai dapat meningkatkan pertumbuhan dan
efisiensi pakan pada ikan Japanese flounder (Paralichthys olivaceus) berukuran 35 g. Dengan demikian, penggunaan fitase dapat meningkatkan pemanfaatan P
dari bungkil kedelai, menggantikan P anorganik, yang pada gilirannya juga
2
Dalam pakan benih ikan baung (bobot 7,5 g), tepung bungkil kedelai dapat
menggantikan 75% protein tepung ikan dengan penambahan 0,5% methionin dan
0,3% triptofan (Pebriyadi 2004). Pakan tersebut belum menggunakan fitase dalam
formulasinya. Penelitian ini dilakukan untuk menguji penga ruh penambahan fitase
dalam pakan terhadap kecernaan fosfor tepung bungkil kedelai dan kinerja
pertumbuhan ikan baung (Hemibagrus nemurus).
Perumusan Hipotesis
Apabila fitase dapat melepaskan P dari tepung bungkil kedelai maka
kecernaan dan penyerapan P akan meningkat sehingga kinerja pertumbuhan ikan
baung juga akan meningkat.
Tujuan dan Manfaat
Tujuan dari penelitian ini adalah untuk menguji pengaruh penambahan
fitase dalam pakan terhadap kecernaan fosfor dan kinerja pertumbuhan ikan baung
(Hemibagrus nemurus).
Sedangkan manfaatnya adalah memberikan informasi tentang pakan ikan
ramah lingkungan sehingga dapat mengurangi pencemaran perairan yang
TINJAUAN PUSTAKA
Asam Fitat dan Fitase
Asam fitat (mio inositol 1,2,3,4,5,6-heksafosfat) merupakan bentuk fosfor
yang banyak tersimpan dalam bahan tanaman dan jumlahnya dapat mencapai 80%
dari total fosfor. Densitas kelompok fosfat bermuatan negatif ya ng tinggi, fitat
bergabung dengan mineral kation seperti potasium (K), magnesium (Mg), kalsium
(Ca), seng (Zn), besi (Fe), copper (Cu), dan membentuk komplek yang sulit larut
dalam air. Fitat juga membentuk komplek dengan protein dan asam amino
(Baruah et al. 2004). Fosfor yang terdapat dalam tanaman umumnya tergabung dalam bentuk molekul yang disebut asam fitat (fitat). Asam fitat terdiri dari suatu
gula (mirip dengan glukosa) yang disebut dengan mio inositol, kelompok fosfat
(PO4) terikat secara kovalen. Menurut Hertrampf dan Pascual (2000) bahwa P
yang terikat pada fitat selain mempunyai daya cerna yang rendah juga mengikat
kalsium (Ca), magnesium (Mg), dan zinc (Zn). Fitase melepaskan fosfat dari
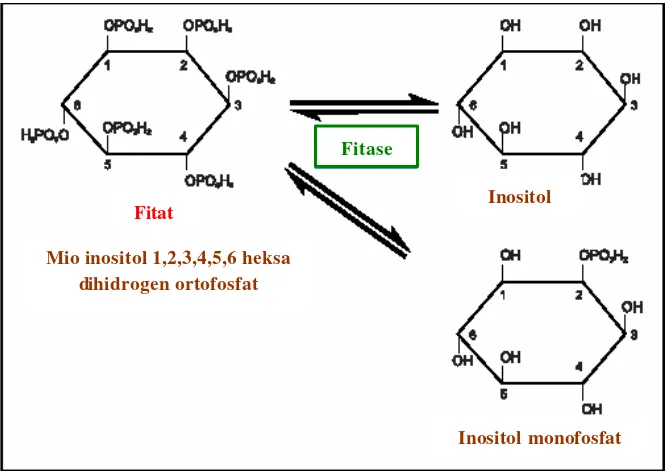
cincin inositol (Gambar 1) (Baruah et al. 2004). Berdasarkan gambar tersebut terlihat bahwa fitase akan menghidrolisis fitat menjadi inositol dan inositol
monofosfat.
Gambar 1. Aksi fitase dalam melepaskan fosfat dari fitat.
Inositol monofosfat Inositol
Fitat
Fitase
4
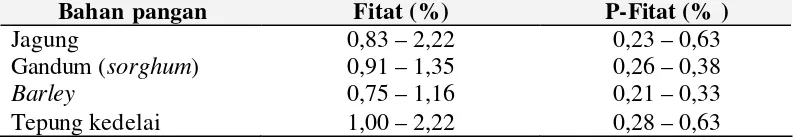
Kandungan asam fitat dan fosfor pada beberapa bahan pangan dapat
dilihat pada Tabel 1 (Reddy et al. 2000).
Tabel 1. Kandungan fitat dan fosfor fitat pada beberapa bahan pangan
Bahan pangan Fitat (%) P-Fitat (% )
Jagung 0,83 – 2,22 0,23 – 0,63
Gandum (sorghum) 0,91 – 1,35 0,26 – 0,38
Barley 0,75 – 1,16 0,21 – 0,33
Tepung kedelai 1,00 – 2,22 0,28 – 0,63
Fitase merupakan suatu enzim yang secara kimia dikenal sebagai mio
inositol heksafosfat fosfohidrolase yang dihasilkan oleh mikroorganisme atau
terdapat pada beberapa bahan tanaman. Hewan- hewan monogastrik tidak dapat
menghasilkan enzim ini. Adanya fitase pada beberapa saluran pencernaan hewan
berasal dari mikroba (Baruah et al. 2004). Reddy et al. (2000) mengemukakan terdapat 2 jenis enzim fitase, yaitu: 1) 3-fitase (E.C. 3.1.3.8) yang mengkatalisis
reaksi mio inositol 1,2,3,4,5,6 heksafosfat + H2 menjadi mio inositol 1,2,3,4,5
pentafosfat + ortofosfat, dan 2) 6- fitase (E.C. 3.1.3.26) yang mengkatalisis reaksi
mio inositol 1,2,3,4,5,6 heksafosfat + H2O menjadi mio inositol-1,2,3,4,5
pentafosfat + ortofosfat. Mikroba mempunyai ciri khas penghasil 3- fitase (E.C.
3.1.3.8), sedangkan 6-fitase terutama dihasilkan dalam biji tumbuhan tingkat
tinggi. Mikrobial fitase (fitase yang dihasilkan oleh mikroba) ada yang berupa
tepung kering atau berupa cair yang tersedia dalam bentuk komersial. Natuphos
merupakan perusahaan yang memproduksi fitase komersial yang pertama, berasal
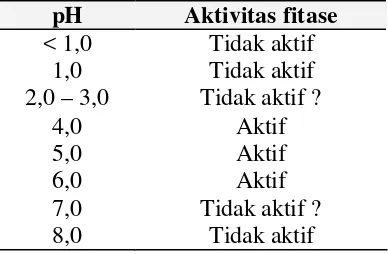
dari Aspergillus niger. Aktivitas optimum mikrobial fitase terjadi pada dua nilai pH, yaitu aktivitas tertinggi terjadi pada pH 5,0 – 5,5 dan aktivitas kedua
tertinggi pada pH 2,5 (Simons et al. 1990). Hasil penelitian pada ikan Japanese flounder (Paralichthys olivaceus) menunjukkan aktifitas fitase tertinggi terjadi pada pH 5,5 (Masumoto et al. 2001). Aktivitas fitase berdasarkan kondisi pH yang berbeda dapat dilihat pada Tabel 2 berikut (Baruah et al. 2004). Satu unit fitase didefinisikan sebagai jumlah enzim yang membebaskan satu mikromol
fosfor anorganik per menit dari 0,0015 mol/L sodium fitat pada pH 5,5 dan suhu
5
intestinum (Baruah et al. 2004). Saluran pencernaan ikan mempunyai pH yang rendah. Lambung ikan channel catfish mempunyai pH 2 – 4 (Steffens 1989).
Tabel 2. Aktivitas fitase pada kondisi pH yang berbeda
pH Aktivitas fitase
Fosfor organik merupakan bagian dari struktur semua sel tubuh. Fosfor (P)
merupakan komponen energi tinggi dalam bentuk Adenosin Trifosfat (ATP) yang
diperlukan untuk energi transduksi, esensial untuk semua aktivitas sel. Oksidasi
karbohidrat memacu pembentukan ATP juga memerlukan fosfor karena proses
fosforilasi yang merupakan tahap penting dalam metabolisme monosakarida (Pike
dan Brown 1984). Li dan Robinson (2005) menyatakan bahwa fosfor merupakan
elemen esensial untuk pertumbuhan normal, perkembangan tulang, dan fungsi
fisiologis lainnya pada hewan. Ion fosfat penting untuk metabolisme karbohidrat,
lipid, dan protein, dan berfungsi sebagai kofaktor pada kebanyakan sistem enzim
dan mendukung pada potensi metabolik untuk membentuk komponen fosfat
berenergi tinggi (Pike dan Brown 1984). Secara keseluruhan, fungsi fosfor bagi
organisme adalah 1) regulasi pelepasan energi (ADP, ATP), 2) memfasilitasi
penyerapan dan pengangkutan nutrien, 3) bagian dari komponen tubuh yang
penting (DNA, RNA), 4) pembentukan tulang dan gigi, 5) regulasi keseimbangan
asam-basa (Budianto 2002).
Peranan Fitase
Asam fitat (ester organik) dari sereal dan biji-bijian tidak dapat diabsorpsi
oleh manusia dan hewan ternak, karena keterbatasan enzim fitase yang penting
6
pakan ikan stripped bass yang mengandung fitat tinggi dapat meningkatkan penyerapan dan penggunaan fosfor (Hughes dan Soares 1998). Fitase pakan juga
meningkatkan nilai nutrien dari protein dan mengurangi pengeluaran fosfor pada
ikan rainbow trout (Forster et al, 1999), ikan channel catfish (Li dan Robinson 2005), African catfish (Van Weerd et al. 1999), ikan mas (Schafer et al. 1995), dan Pangasius pangasius (Debnath et al. 2005). Robinson et al. (2002) melaporkan bahwa 250 unit fitase per kilogram pakan efektif dapat menggantikan
dikalsium fosfat dalam pakan ikan channel catfish tanpa mempengaruhi
pertumbuhan, efisiensi pakan, atau gangguan fosfor tulang. Soares dan Hughes
(2004) menyatakan bahwa penggunaan fitase dalam pakan hewan monogastrik
mempunyai beberapa keuntungan, yaitu fitase akan menghidrolisis rantai P
sehingga meningkatkan bioavailabilitasnya dan mengurangi atau menghilangkan
penambahan P dalam pakan, karena P dapat dimanfaatkan dengan baik, maka
akan sedikit yang akan diekskresikan ke lingkungan. Penambahan mikrobial fitase
dalam pakan Pangasius pangasius dapat meningkatkan penggunaan dan daya cerna protein (Debnath et al. 2005). Richardson et al. (1985) menyatakan bahwa ikan Chinook salmon (Oncorhynchus tshawytscha) yang diberi pakan semi- murni yang mengandung kadar kalsium, fosfor, seng, dan sodium fosfat yang berbeda
dengan asam fitat pakan yang tinggi (2,58%) menunjukkan penurunan
pertumbuhan. Sebaliknya, pertumbuhan meningkat bila ditambahkan mikrobial
fitase dalam pakan. Pengaruh ya ng sama juga terjadi pada pertumbuhan dan
komposisi tubuh larva ikan mrigal Cirrhinus mrigala (Usmani dan Jafri 2002). Pada ikan channel catfish terjadi pertambahan bobot jika diberi penambahan fitase
dalam pakan yang hanya mengandung sumber protein nabati atau kombinasi
protein nabati dan hewani (Jackson et al. 1996). Pertambahan bobot dan konsumsi pakan meningkat 23,52% (pada sumber protein nabati) dan 11,59% (pada
BAHAN DAN METODE
Penelitian ini dilaksanakan pada bulan Maret sampai dengan Juli 2006,
bertempat di Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas
Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Metode dan Desain Penelitian
Metode yang digunakan dalam penelitian ini adalah me tode eksperimental
laboratorium, dengan menggunakan desain acak lengkap (RAL), yang terdiri dari
5 perlakuan dan 3 ulangan, yaitu pemeliharaan ikan yang diberi pakan dengan
kadar fitase yang berbeda.
Perlakuan A : Tanpa fitase + P anorganik (kontrol)
Perlakuan B : Tanpa fitase dan tanpa P anorganik
Perlakuan C : 20 mgfitase/100 g bungkil kedelai tanpa penambahan P
Perlakuan D : 40 mgfitase/100 g bungkil kedelai tanpa penambahan P
Perlakuan E : 60 mgfitase/100 g bungkil kedelai tanpa penambahan P
Keterangan:
20 mg fitase setara dengan 100 unit/100 g bungkil kedelai 40 mg fitase setara dengan 200 unit/100 g bungkil kedelai 60 mg fitase setara dengan 300 unit/100 g bungkil kedelai
Pakan Uji
Pakan uji yang digunakan dalam penelitian ini adalah tepung ikan sebagai
sumber protein hewani, tepung bungkil kedelai sebagai sumber protein nabati.
Kadar protein pakan uji setiap perlakuan adalah sama (isoprotein). Sebagai
sumber lemak digunakan minyak ikan dan minyak jagung. Untuk melengkapi
vitamin dan mineral, ditambahkan vitamin dan mineral mix dalam campuran
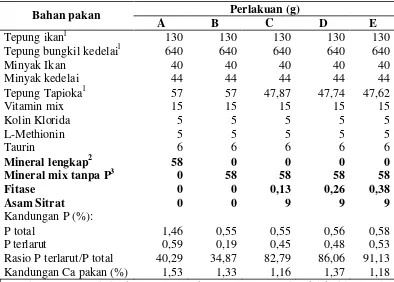
pakan tersebut. Setiap perlakuan ditambahkan fitase (Natuphos® 5000) dengan jumlah yang berbeda sesuai dengan perlakuan. Komposisi bahan penyusun pakan
8
Tabel 3. Komposisi bahan penyusun pakan yang digunakan (g/kg pakan)
Perlakuan (g)
Kandungan protein (bobot kering) tepung ikan 70,39%, tepung bungkil kedelai 42,75%, tepung tapioka 0,91%.
Mineral mix tanpa P mengandung (g/kg pakan kering): NaCl 0,5, MgSO4.7H2O 7,5; KCl
17,53; Fe-citrat 1,25; CaCl2.2H2O 13,34; filler 30,5 dan trace element mix (0,5 g) terdiri
dari: ZnSO4.7H2O 17,365; MnSO4 8,1; CuSO4.5H2O 1,55; CoCl.6H2O 0,05; KIO3 0,15;
dan filler 30,5.
Prosedur pembuatan pakan dari 1 kg bahan baku adalah sesuai prosedur
Cheng dan Hardy (2002): fitase dicamp ur dengan bungkil kedelai, diaduk sampai
homogen (campuran bahan A). Kemudian campuran bahan-bahan yang lainnya
dicampur dimulai dengan bahan yang jumlahnya sedikit pada wadah yang berbeda,
lalu diaduk sampai homogen (campuran bahan B). Campuran bahan A dicampur
dengan hasil campuran bahan B, kemudian diaduk (mixer) hingga homogen. Air
sebanyak 400 ml dimasukkan ke dalam campuran bahan tersebut dan diaduk
hingga merata (jadi adonan). Adonan dicetak menjadi pellet dan diinkubasi dalam
9
malam. Pellet (pakan) siap diberikan ke ikan dan disimpan pada suhu rendah
(0-5oC). Hasil proksimat pakan uji setiap perlakuan disajikan pada Tabel 4.
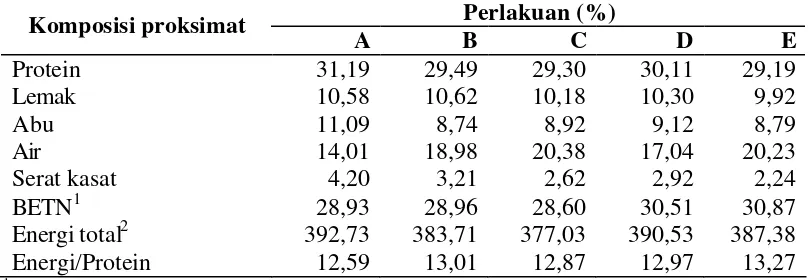
Tabel 4. Komposisi proksimat pakan (% bobot basah) dan energi pakan percobaan
Perlakuan (%)
Bahan ekstrak tanpa nitrogen.
2
Energi total (GE) dihitung berdasarkan nilai ekuivalen: protein 5,6 kkal/g, lemak 9,4 kkal/g, dan BETN 4,1 kkal/g (Watanabe 1988).
Pemeliharaan Ikan dan Pengumpulan Data
1. Uji pertumbuhan
Ikan baung yang digunakan berukuran 6,9 + 0,2 g yang berasal dari Balai
Budidaya Air Tawar Sukabumi. Wadah yang digunakan untuk pemeliharaan ikan
uji adalah akuarium berukuran 50 x 40 x 35 cm, dilengkapi dengan aerasi dan
sirkulasi air. Ikan uji terlebih dahulu diaklimatisasi terhadap pakan uji dan
lingkungan selama kurang lebih 10 hari. Setelah beradaptasi, diseleksi sebagai
ikan uji, dimasukkan ke dalam akuarium sebanyak 15 ekor per akuarium yang
sebelumnya telah ditimbang bobotnya, kemudian dilakukan pemuasaan selama 24
jam sebelum pemberian pakan perlakuan. Pemberian pakan dilakukan 3 kali
sehari (08.00, 13.00, dan 18.00 WIB) secara at satiation. Pemeliharaan ikan dilakukan selama 60 hari. Penyiponan dan penggantian air sebanyak 50% dari
volume total air setiap hari (pagi) sebelum diberikan pakan. Selama penelitian,
kandungan oksigen terlarut berkisar 4,18 – 5,13 ppm, suhu berkisar 28 – 30oC, derajat keasaman (pH) berkisar 6,30 – 6,35, dan amonia (NH3) tidak terdeteksi.
10
2. Uji daya cerna pakan
Uji daya cerna pakan dilakukan secara terpisah dengan uji pertumbuhan.
Ikan baung yang digunakan berukuran 15,9 + 2,4 g dimasukkan ke dalam
akuarium sebanyak 12 ekor/akuarium. Akuarium yang digunakan berukuran
50 x 40 x 35 cm sebanyak 5 unit sesuai dengan jumlah perlakuan. Adanya
penambahan kromium 0,5%, maka penggunaan tepung tapioka dikurangi
sebanyak 0,5% dalam pakan. Adaptasi ikan terhadap pakan dilakukan selama 6
hari, dan pada hari ke 7 dimulai pengumpulan fe ses ikan. Feses yang terkumpul
selama kurang lebih 21 hari, selanjutnya dianalisa kandungan kromium, fosfor
dan protein untuk dihitung daya cernanya berdasarkan prosedur Takeuchi (1988).
3. Pengumpulan data
a. Data proksimat dan kadar mineral tubuh dan tulang ikan
Ikan sampel sebanyak 5 ekor/akuarium diambil secara acak, dicincang
sampai halus (hancur) dan homogen. Hasil cincanga n yang sudah homogen ini
kemudian dilakukan analisa proksimat dan mineral (P, Ca, dan Zn). Analisa
proksimat dilakukan pada awal dan akhir penelitian sedangkan analisa mineral
tubuh ikan dilakukan pada akhir penelitian.
b. Data mineral tulang ikan
Ikan sampel sebanyak 3 ekor/akuarium diambil secara acak dan direbus
sampai dagingnya bisa dipisahkan dari tulang. Kemudian ikan diangkat dan
dibersihkan semua daging yang menempel pada tulang menggunakan sikat sampai
tulang benar-benar bebas dari daging. Tulang tersebut kemudian dianalisa
kandungan mineralnya (P, Ca, dan Zn).
c. Data bobot ikan dan pakan
Penentuan bobot ikan uji dilakukan dengan cara mengambil semua ikan
dalam setiap akuarium dan dimasukkan ke dalam suatu wadah tanpa air,
kemudian ditimbang. Penimbangan ini dilakukan pada awal dan akhir penelitian.
Pakan yang diberikan pada ikan uji selama penelitian dicatat jumlahnya.
Hal ini berguna untuk mengetahui jumlah P dan protein yang dikonsumsi selama
11
Analisis Kimia
Analisis proksimat (protein, lemak, serat kasar, abu, dan air) pakan dan
tubuh ikan dilakukan dengan metode Takeuchi (1988). Prosedur kerja analisis
proksimat terlampir pada Lampiran 1, 2, 3, 4, dan 5.
Analisis mineral dilakukan dengan menggunakan Prosedur Reitz et al. (1960). Pengukuran fosfor dilakukan dengan menggunakan spektrofotometer,
analisis Ca dan Zn dilakukan dengan menggunakan AAS (Atomic Absorption
Spectrophotometer) (Lampiran 6).
Analisis Statistik
Data retens i protein, laju pertumbuhan harian, konversi pakan, dan P dan
Nitrogen (N) yang terbuang melalui feses dianalisis keragamannya dengan
menggunakan ANOVA, jika terdapat perbedaan antar perlakuan dilanjutkan
dengan Uji Duncan (Steel and Torrie 1993).
Parameter yang diuji sebagai berikut:
1. Daya cerna nutrien (%) (Takeuchi 1988):
2. Laju pertumbuhan harian (Huisman 1976)
12
3. Konversi pakan (Steffens 1989)
4. Retensi protein (Takeuchi 1988)
RP (%) = bobot protein tubuh akhir (g) – bobot protein tubuh awal (g) x100 Bobot total konsumsi protein (g)
5. Tingkat kelangsungan hidup (%)
x100
Nt = Jumlah ikan yang hidup pada akhir penelitian (ekor)
No = Jumlah ikan yang mati selama penelitian (ekor) 6. Fosfor (P) terbuang melalui feses (g)
7. Nitrogen (N) terbuang melalui feses (g)
P terbuang (g) = P (%) yang tidak dicerna x P dikonsumsi selama penelitian
HASIL DAN PEMBAHASAN
Hasil
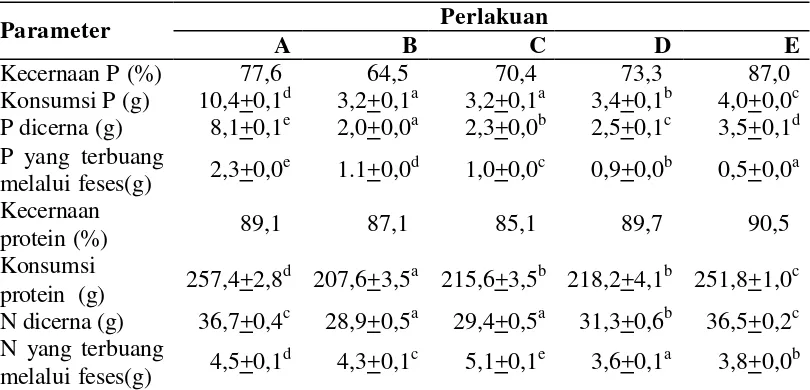
Kecernaan fosfor (P) dari bungkil kedelai dalam pakan secara nyata
meningkat dengan meningkatnya kadar fitase dalam pakan (Tabel 5).
Meningkatnya kecernaan P maka P yang dapat dimanfaatkan oleh tubuh ikan akan
semakin besar sehingga P yang dideposisi baik pada total tubuh maupun tulang
ikan semakin meningkat (Tabel 6). Kecernaan P yang tinggi akan menyebabkan P
yang terbuang akan semakin rendah. Ini dapat dilihat dari P yang dikonsumsi,
pakan E yang mempunyai daya cerna P tertinggi (87,0%) menghasilkan P yang
terbuang paling rendah. Sementara pakan A, walaupun mempunyai daya cerna P
yang cukup tinggi (77,6%) namun menghasilkan P yang terbuang juga paling
tinggi. Hal ini disebabkan kandungan P total pada pakan A yang tinggi sehingga
jumlah P yang dikonsumsi juga tinggi selama penelitian. Disisi lain, kecernaan
protein relatif sama antar perlakuan (Tabel 5). Walaupun kecernaan protein relatif
sama antar perlakuan, namun Nitrogen (N) yang terbuang menunjukkan adanya
perbedaan antar perlakuan. Hal ini disebabkan adanya perbedaan dalam jumlah P
yang dikonsumsi. Pengaruh kecernaan P, selain terlihat pada komposisi mineral
baik pada total tubuh maupun tulang ikan baung, juga dapat dilihat pada nilai
retensi protein, laju pertumbuhan harian dan konversi pakan (Tabel 7).
Tabel 5. Nilai kecernaan P dan protein pakan serta P dan N yang terbuang melalui feses antar perlakuan selama penelitian
Perlakuan
14
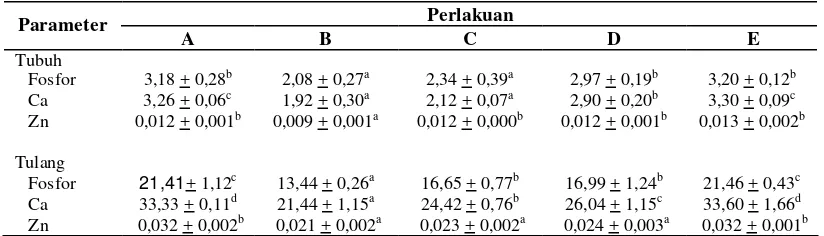
Hasil analisa mineral tubuh dan tulang ikan baung (Hemibagrus nemurus) disajikan pada Tabel 6, yang menunjukkan adanya perbedaan komposisi mineral
pada tubuh dan tulang ikan baung antar perlakuan. Peningkatan kadar fitase dari
0 – 60 mg/100 g bungkil kedelai dalam pakan (perlakuan B-E), meningkatkan
kandungan P dan Ca secara signifikan (P<0,05), baik di tulang maupun total tubuh.
Namun pakan E sama dengan pakan A (kontrol). Demikian juga dengan
kandungan Zn, baik di tulang maupun total tubuh.
Tabel 6. Komposisi mineral ikan baung (% bobot kering)
Perlakuan Keterangan: Angka yang diikuti huruf yang sama pada lajur yang sama menunjukkan tidak berbeda nyata (p>0,05).
Data bobot awal dan akhir biomass ikan baung (Hemibagrus nemurus) pada setiap perlakuan dan ulangan selama penelitian disajikan pada Tabel 7. Ikan
yang diberi pakan E menghasilkan laju pertumbuhan harian yang signifikan
(P<0,05) lebih tinggi daripada ikan yang diberi pakan lainnya, kemudian diikuti
oleh pakan A (tanpa fitase dan penambahan fosfor anorganik). Sedangkan laju
pertumbuhan harian yang terendah dihasilkan oleh pakan B (Tabel 7).
Tabel 7. Rata-rata bobot awal (Bo), bobot akhir (Bt), retensi protein (RP), laju pertumbuhan harian (LPH), konsumsi pakan (KP), konversi pakan (FCR) dan tingkat kelangsungan hidup (SR) ikan baung (Hemibagrus nemurus) selama penelitian
15
Nilai konversi pakan memperlihatkan adanya perbedaan antar perlakuan.
Ikan yang diberi pakan E menghasilkan nilai konversi pakan yang signifikan
(P<0,05) lebih baik daripada pakan lainnya sementara konversi pakan yang
terjelek dihasilkan pada ikan yang diberi pakan B. Demikian juga dengan retensi
protein menunjukkan adanya perbedaan antar perlakuan. Ikan yang diberi pakan E
secara signifikan (P<0,05) lebih tinggi daripada perlakuan lainnya, sedangkan
yang terendah diperoleh pada ikan yang diberi pakan B (Tabel 7).
Pembahasan
Penambahan fitase dalam pakan dari 0 – 60 mg/100 g bungkil kedelai
menyebabkan terjadinya peningkatan P terlarut sehingga rasio P terlarut/P total
pakan berubah dari 34,87% menjadi 91,13%. Ikan yang diberi pakan E
menghasilkan kecernaan P tertinggi, kemudian diikuti oleh pakan A (kontrol). Hal
ini menunjukkan bahwa fitase dapat menghidrolisis fitat yang terdapat pada
bungkil kedelai sehingga meningkatkan kecernaan P. Pendapat yang sama
disampaikan oleh Sajjadi and Carter (2004) bahwa penambahan fitase dalam
pakan yang mengandung bahan nabati dapat meningkatkan kecernaan P pada ikan
Atlantic salmon (Salmo salar L), ikan striped bass (Morone saxatilis) (Papatryphon dan Soares 2001), ikan rainbow trout (Oncorhynchus mykiss) (Cheng dan Hardy 2004), ikan Korean rockfish (Sebastes schlegeli) (Yoo et al. 2005), dan ikan nila (Oreochromis niloticus) (Liebert dan Portz 2005). Disisi lain, ikan yang diberi pakan B, menghasilkan daya cerna P yang terendah. Hal ini
menunjukkan bahwa P yang berasal dari tepung bungkil kedelai dan tepung ikan
tidak dapat dimanfaatkan dengan baik oleh ikan karena terbatasnya fitase,
sehingga P yang terbuang di feses pada pakan B tersebut lebih tinggi.
Meningkatnya kecernaan P akan menyebabkan P yang dapat dimanfaatkan
oleh tubuh ikan akan semakin tinggi, yang pada akhirnya proses metabolisme sel
tubuh semakin meningkat. Hal ini sesuai dengan peranan P yang merupakan
elemen esensial untuk mendukung pertumbuhan, dan perkembanga n tulang
(Li dan Robinson 2005), sebagai bagian struktur semua sel tubuh, merupakan
komponen energi tinggi dalam bentuk Adenosine Trifosfat (ATP) yang sangat
16
karbohidrat yang memacu pembentukan ATP juga memerlukan fosfor karena
proses fosforilasi yang merupakan tahap penting dalam metabolisme
monosakarida (Pike dan Brown 1984), dan metabolisme protein (McDowell 1992),
sehingga pengaruhnya dapat dilihat pada komposisi mineral, baik pada total tubuh
maupun tulang ikan, retensi protein, laju pertumbuhan dan konversi pakan.
Hasil analisa mineral pada tubuh dan tulang ikan baung menunjukkan
bahwa penambahan fitase dalam pakan cenderung meningkatkan kadar P, Ca dan
Zn (Tabel 6). Pendapat yang sama disampaikan oleh Nwanna et al. (2005) bahwa penambahan fitase dalam pakan menyebabkan terjadinya peningkatan kadar Ca, P,
dan Mn pada ikan African catfish (Clarias gariepinus), ikan striped bass (Morone saxatilis) (Hughes dan Soares 1988), ikan catfish (Reigh danYan 2001), dan ikan Atlantic salmon (Salmo salar L) (Sajjadi dan Carter 2004).
Fosfor dan kalsium merupakan komponen anorganik yang dominan
terutama pada tulang. Pada tubuh ikan rainbow trout mengandung sekitar 0,43%
Ca dan 0,41% P, sedangkan 90% Ca dan 80% P ditemukan pada tulang
(Hertrampf dan Pascual 2000). Menurut Currey (2002), deposit P dan Ca dalam
jaringan tulang ikan berbentuk hydroxyapatite [(Ca10(PO4)6(OH)2], dimana P dan
Ca dideposit dalam waktu yang sama pada matriks tulang. Kalsium dan fosfor
berhubungan erat dalam perkembangan dan pemeliharaan sistem kerangka, dalam
arti bahwa kekuatan tulang belakang ikan (vertebrae) dijaga oleh konsentrasi
kalsium fosfat (Halver dan Hardy 2002).
Penambahan fitase dalam pakan, selain meningkatkan kadar mineral, baik
pada total tubuh maupun tulang ikan, juga peningkatan nilai retensi protein. Ikan
yang diberi pakan E menghasilkan retensi protein tertinggi, sedangkan yang
terendah dihasilkan pada ikan yang diberi pakan B. Adanya peningkatan retensi
protein akan meningkatkan potensi pertumbuhan ikan, sehingga pakan yang
menghasilkan retensi protein yang tinggi pada gilirannya akan menyebabkan laju
pertumbuhan ikan yang semakin tinggi pula. Dalam percobaan ini ikan yang
diberi pakan E yang menghasilkan retensi protein tertinggi juga menunjukkan laju
pertumbuhan harian tertinggi. Hal ini menunjukkan bahwa fitase mampu
meningkatkan pemanfaatan nutrien (protein) yang dicirikan dengan nilai retensi
17
pada akhirnya pertumbuhan juga naik (Baruah et al. 2004). Pendapat yang sama dinyatakan oleh Yoo et al. (2005) bahwa penambahan fitase dalam bungkil kedelai dapat meningkatkan pertambahan bobot dan laju pertumbuhan juvenil
ikan Korean rockfish (Sebastes schlegeli), ikan nila (Oreochromis niloticus) (Liebert dan Portz 2005, Furuya et al. 2001), ikan rainbow trout (Oncorhynchus mykiss) (Vandenberg et al. 2003), dan ikan Pangasius pangasius (Debnath et al. 2005).
Laju pertumbuhan ikan dan konsumsi pakan akan berpengaruh terhadap
nilai konversi pakan. Laju pertumbuhan harian yang semakin tinggi dengan pakan
yang baik akan menyebabkan nilai konversi pakan semakin rendah. Semakin
rendahnya nilai konversi pakan dengan meningkatnya kadar fitase dalam pakan
menunjukkan bahwa pakan yang dimanfaatkan oleh ikan semakin efisien. Dalam
percobaan ini, ikan yang diberi pakan E (60 mg fitase/100g tepung bungkil
kedelai tanpa penambahan P anorganik) menghasilkan nilai konversi pakan ya ng
paling rendah. Hasil ini menunjukkan bahwa pakan E lebih efisien dimanfaatkan
untuk pertumbuhan oleh ikan baung. Hal ini diperkuat oleh pendapat Nwanna
et al. (2005) yang menyatakan bahwa penambahan fitase dalam pakan yang mengandung bungkil kedelai menghasilkan nilai konversi pakan yang lebih baik
daripada pakan tanpa penambahan fitase pada ikan African catfish (Clarias gariepinus), dan ikan striped bass (Monorone saxatalis) (Hughes dan Soares 1998).
Kebutuhan ikan akan fosfor berbeda-beda setiap spesies. Watanabe (1988)
menyatakan bahwa kebutuhan fosfor untuk ikan Red sea bream adalah 0,68%,
ikan Japanese eel 0,58%, ikan Tilapia nilotica 0,8 – 1,0%, ikan mas 0,6 - 0,7%, ikan Rainbow trout 0,7 - 0,8%, dan ikan Channel catfish 0,33 – 0,45%. Walaupun
P di pakan A tinggi, namun kebutuhan P mungkin sudah terpenuhi di pakan E,
yang menunjukkan pertumbuhan ikan baung yang diberi pakan E lebih tinggi
daripada pakan A. Kelebihan P dalam pakan tidak dimanfaatkan oleh ikan dan
akan dibuang dalam bentuk P terlarut yang diduga dikeluarkan melalui urin. Total
P yang diekskresikan oleh ikan dapat dibagi menjadi 2 bagian yaitu P organik dan
P anorganik (ortofosfat). Fosfor yang dikeluarkan melalui feses umumnya dalam
18
Pakan yang dikonsumsi oleh ikan tidak semuanya dicerna. Pakan yang
tidak dicerna akan dibuang melalui feses (Tabel 5). Peningkatan kadar fitase
dalam pakan dari 0 – 60 mg/100 g bungkil kedelai menyebabkan semakin
berkurangnya ekskresi P yang terbuang melalui feses (Tabel 8). Sebagai
gambaran dalam aplikasi praktis di lapangan adalah untuk memproduksi 1 kg ikan
baung dengan menggunakan pakan yang mengandung fitase sebanyak 60 mg/100
g tepung bungkil kedelai (pakan E) hanya akan menghasilkan limbah P sebesar
0,84 g atau sekitar 1/5 dari pakan A (kontrol).
Tabel 8. Limbah P dan N yang terbuang (g/kg pertambahan bobot ikan) melalui feses setiap perlakuan
Keterangan: Angka yang diikuti huruf yang sama pada lajur yang sama menunjukkan tidak berbeda nyata (p>0,05).
Meningkatnya kadar fitase dalam pakan menyebabkan terjadinya
penurunan limbah Nitrogen (N) melalui feses ke perairan (Tabel 8). Dengan
ilustrasi yang sama pada kasus limbah P diatas, pakan E menghasilkan limbah
Nitrogen (N) yang lebih rendah, sekitar 76% dari pakan A (kontrol). Hal ini
menunjukkan bahwa fitase mampu melepaskan nutrien (protein) dan mineral dari
fitat, sehingga dapat dimanfaatkan dengan baik untuk pertumbuhan oleh ikan
yang pada gilirannya akan mengurangi limbah P dan N yang diakibatkan oleh
pakan yang mengandung bungkil kedelai yang cukup tinggi. Pendapat yang sama
disampaikan oleh Hughes dan Soares (1998) bahwa fitase dalam pakan yang
mengandung protein nabati yang tinggi dapat mengurangi ekskresi P pada ikan
SIMPULAN DAN SARAN
Simpulan
Kadar fitase 60 mg/100 g tepung bungkil kedelai dalam pakan dapat
meningkatkan kecernaan fosfor bungkil kedelai dan kinerja pertumbuhan ikan
baung (Hemibagrus nemurus). Penggunaan fitase pada kadar tersebut juga mengurangi ekskresi P dan N ke perairan melalui feses, masing- masing sebesar
80% dan 24% dari penggunaan pakan kontrol.
Saran
Penggunaan fitase sebanyak 60 mg/100g tepung bungkil kedelai dapat
DAFTAR PUSTAKA
Budianto MAK. 2002. Dasar-dasar ilmu gizi. Edisi revisi. Universitas Muhammadiyah Malang. 336 hal.
Baruah K, Sahu NP, Pal AK; Debnath D. 2004. Dietary phytase: an ideal approach for a cost effective and low-polluting aquafeed. NAGA, Worldfish Center Quarterly 27 (3) 3 & 4 Jul- Dec 2004.
Cheng ZJ., Hardy RW. 2002. Effect of microbial phytase on apparent nutrient digestibility of barley, canola meal, wheat and wheat middlings, measured in vivo using rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition (8): 271 – 277.
Cheng ZJ., Hardy RW. 2004. Effect of microbial phytase supplementation in corn distiller’s dried grain with solubles on nutrient digestibility and growth performance of rainbow trout, Oncorhynchus mykiss. Journal of Applied Aquaculture. 15 (3/4).
Currey JD. 2002. Bone: Structure and mechaniscs. Princeton University Press.
http://www.pupress.princeton.edu/chapters/s7313.html
Debnath D., Pal AK., Sahu NP., Jain KK., Yengkokpam S., Mukherjee SC. 2005. Effect of dietary microbial phytase supplementation on growth and nutrient digestibility of Pangasius pangasius fingerlings. Aquaculture Research (36) 2: 180 – 187.
Forster I, Higgs DA, Dosanjh BS, Rowshandeli M, Parr J. 1999. Potensial for dietary phytase to improve the nut ritive value of canola protein concentrate and decrease phosphorus output in rainbow trout (Oncorhynchus mykiss) held in 11oC freshwater. Aquaculture, 179: 109-125.
Furuya WM., Gonclaves GS., Furuya VRB., Hayashi C. 2001. Phytase as feeding for Nile Tilapia (Oreochromis niloticus). Performance and digestibility. Rev. Bras. Zootec. 30: 924 – 929.
Halver J., Hardy RW. 2002. Fish nutrition. Third edition. Academic Press. Amsterdam. 822pp.
Han YM, Roneker KR, Pond WG, Lei, XG. 1998. Adding wheat middlings, microbial phytase, and citric acid to corn-soybean meal diets for growing pigs may replace inorganic phosphorus supplementation. Journal Animal Science, 76:2649 – 2656.
21
Hughes KP, Soares JR. JH. 1998. Efficacy of phytase on phosphorus utilization in practical die ts fed to striped bass Morone saxatilis. Aquaculture Nutrition, 4: 133 – 140.
Huisman EA. 1976. Food conversion efficiencies at maintenance and production levels for carp (Cyprinus carpio Linn) and rainbow trout (Salmo gairdneri Ric.). Aquaculture, 9 (2): 259-273.
Jackson LS, Li MH,. Robinson EH. 1996. Use of microbial phytase in channel catfish Ictalurus punctatus diets to improve utilization of phytate phosphorus. Journal World Aquaculture Society, 27:309-313.
Li MH, Robinson EH. 2005. Feeding fungal phytase to channel catfish. Aqua feeds: Formulation & Beyond (2) Issue I no. 13.
Liebert F, Portz L. 2005. Nutrient utilization of Nile tilapia (Oreochromis niloticus) fed plant based low phosphorus diets supplemented with graded levels of different sources of microbial phytase. Aquaculture, 248: 111 – 119.
Li MH., Manning BB, Robinson EH. 2004. Summary of phytase studies for channel catfish. Mississippi Agricultural and Forestry Experiment Station (23) 23 No. 13.
Masumoto T, Tamura B, Shimeno S. 2001. Effects of phytase on bioavailabilty of phosphorus in soybean meal-based diets for japanese flounder (Paralichthys olivaceus). Fisheries Science, 67:1075-1080.
McDowell LR. 1992. Minerals in animal and human nutrition. Academic Press. Toronto. 524pp.
National Research Council [NRC] 1993. Nutrient requirements of fish. Nasional Academy Press. Constitution Avenue, NW. Washington, D.C. 71pp.
Nwanna LC, Fagbenro OA, Adeyo AO. 2005. Effect of different treatments of dietary soybean meal and phytase on the growth and mineral deposition in African catfish Clarias gariepinus. Journal of Animal and Veterinary Advances. 4: 980 – 987.
Papatryphon E, Soares JH. Jr. 2001. The effect of phytase on apparent digestibility of four practical plant feedstuffs fed to striped bass, Morone saxatilis. Journal Aquaculture Nutrition. 161-167.
22
Pike RL, Brown ML. 1984. Nutrition: an integrated approach. John Wiley & Sons. New York, Chichester, Bristone, Toronto, Singapore. 1068 pp.
Pongmaneerat J, Watanabe T. 1992. Utilization of soybean meal as protein source in diets for rainbow trout. Nippon suisan Gakkaishi 58(10):1983-1990. Reddy NR, Pierson MD, Sathe SK, Salunkhe DK. 2000. Phytates in cereals and
legumes. CRC Press. Boca Raton, Florida. 152pp.
Reigh RC, Yan W. 2001. Enzyme treatment of catfish feed can reduce environmental phosphorus. Louisiana Agriculture Magazine.
http://www.lsuagcenter.com/publications/agmag/archive/2001/summer/e nzyme+treatment+of+catfish+feeds+can+reduce+environmental+phosph orus.htm
Reitz LL, Smith WH, Plumlee MP. 1960. Analytical Chemistry. Animal Science Department, West Lafayette, Ind. 1730pp.
Richardson NL, Higgs DA, Beames RM, McBride JR. 1985. Influence of dietary calcium, phosphorus, zinc and sodium phytate level on catarac incidence, growth, and histopathology in juvenil chinook salmon (Onchorhynchus tshawytscha). Journal Nutrition, 115:553-567.
Robinson EH, MH Li, Manning BB. 2002. Comparison of microbial phytase and dicalsium phosphate for growth and bone mineralization of pond-raised channel catfish, Ictalurus punctatus. Journal Appl. Aquaculture, 12:81-88.
Sajjadi M, Carter CG. 2004. Dietary phyatse supplementation and the utilization of phosphorus by Atlantic salmon (Salmo salar L.) fed a canola-meal-based diet. Aquaculture 240: 417 – 431.
Schafer A, Koppe WM, MeyerBurgdorff KH, Gunther KD. 1995. Effects of microbial phytase on the utilization of native phosphorus by carp in a diet based on soybean meal. Water science technology, 31:149-155.
Simons PCM, Versteegh HAJ, Jongbloed AW, Kemme PA, Slump P, Bos KD, Wolters WGE, Beudeker RF, Verschoor GJ. 1990. Improvement of phosphorus availability by microbial phytase in broilers and pigs. Journal Nutrition. 64: 525 – 540.
Soares Jr JH, Hughes KP. 2004. Efficacy of phytase on phosporus utilization. Journal of applied aquaculture (15 ) Issue 3 / 4.
23
Steffens W. 1989. Principles of fish nutrition. Halsted Press: a division of John Wiley & Sons. New York. 384 pp.
Suprayudi MA, Bintang M, Takeuchi T, Mokoginta I, Sutardi T. 1999. Defatted soybean meal as alternatif source to substitute fish meal in the feed of giant gouramy Osphronemus gouramy Lac. Sanzoshoku 47(4):551 – 557. Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients. p.
179-233, In Watanabe (Ed) Fish nutrition and mariculture. Kanagawa International Fisheries Training. Japan International Cooperation Agency (JICA), Japan.
Teles AO, Pereira JP, Gouveia A, Gomes E. 1998. Utilization of diets supplemented with microbial phytase by seabass (Dicentrarchus labrax) juvenils. Aquaculture Living Resources, 11 (4): 255-259.
Usmani N, Jafri AK. 2002. Influence of dietary phytic acid on the growth, conversion efficiency, and carcass composition of mrigal Cirrhinus
mrigala (Hamilton) fry. Journal World Aquaculture Society, 33:199-304.
Vandenberg GW., Dallaire V., Scott SL., De la Noue J. 2003. Encapsulation of microbial phytase : effects on phosphorus bioavailability in rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition-Contributed papers.
http://www.aquacultureassociation.ca/ac03/abstracts/nutrition.htm
Van Weerd JH, Khalaf KHA, Aartsen FJ, Tjissen PAT. 1999. Balance trials with African catfish Clarias gariepinus fed phytase-treated soybean meal based diets. Aquaculture Nutrition, 5:135-142.
Vielma J, Ruohonen K, Peisker M. 2002. Dephytinization of two soy proteins increases phosphorus and protein utilization by rainbow trout,
Oncorhynchus mykiss. Aquaculture. 204: 145 – 156.
Watanabe T. 1988. Fish nutrition and mariculture. JICA Textbook. The general aquaculture course. Department of Aquatic Biosciences. Tokyo University of Fisheries. 233 pp.
24
Lampiran 1. Prosedur analisa kadar protein (metode Semi Mikro Kjedahl, Takeuchi 1988)
A. Prosedur Oksidasi:
1. Sampel ditimbang 0,5 g (S), dimasukkan ke dalam labu kjedahl.
2. Katalis (K2SO4 + CuSO4 + H2O) rasio 9:1 ditimbang sebanyak 3 g dan
dimasukkan ke dalam labu kjedahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu kjedahl kemudian
dipanaskan pada suhu 400oC selama 3-4 jam sampai cairan dalam labu berwarna hijau bening.
4. Larutan didinginkan, ditambahkan air destilasi 100 ml, kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades hingga volume larutan tersebut mencapai 100 ml (larutan A).
B. Prosedur Destilasi:
1. Labu erlenmeyer diisi dengan 10 ml H2SO4 0,05 N, ditambahkan 2 tetes
indikator methyl red (larutan B).
2. Larutan A diambil sebanyak 5 ml dan ditambahkan 10 ml NaOH 30% lalu dimasukkan ke dalam lebu kjedahl. Lakukan destruksi selama 10 menit mulai saat tetesan pertama pada larutan B.
C. Titrasi:
1. Hasil destruksi dititrasi dengan NaOH 0,05 N, dan volume titran dicatat. 2. Dilakukan juga terhadap blanko dengan prosedur yang sama.
D. Protein (%) =
25
Lampiran 2. Prosedur kadar lemak (metode ether ekstraksi: Takeuchi 1988).
1. Labu ekstraksi dipanaskan pada suhu 110oC selama 1 jam. Kemudian didinginkan dalam eksikator selama 30 menit. Panaskan kembali selama 30
menit, lalu didinginkan, kemudian ditimbang. Proses tersebut diulang sampai
tidak ada perbedaan bobot labu lebih dari 0,3 mg. Bobot labu ekstraksi (A)
2. Sampel sebanyak 1 – 2 gram dimasukkan ke dalam tabung filter, lalu
dipanaskan pada suhu 90o – 100oC selama 2 – 3 jam.
3. Tabung filter ditempatkan pada no.2 ke dalam ekstraksi dari soxchlet.
Kemudian disambungkan ke kondensor labu ekstraksi pada no.1 yang telah
diisi 100 ml petroleum ether.
4. Dilakukan pemanasan ether pada labu ekstraksi dengan mengguanakan water
bath, suhu 70oC selama 16 jam.
5. Labu ekstraksi dipanaskan pada suhu 100oC, kemudian ditimbang (B).
6.
B - A
% lemak = x 100%
26
Lampiran 3. Prosedur analisis kadar abu (Takeuchi 1988).
1. Cawan porselen dipanaskan pada suhu 600oC selama 1 jam dengan menggunakan muffle furnace, kemudian dibiarkan sampai suhu muffle
furnace turun sampai suhu 110oC, lalu cawan porselen dikeluarkan dan didinginkan dalam eksikator selama 30 menit, lalu ditimbang (A).
2. Sampel dimasukkan ke dalam cawan porselen lalu ditimbang (B) pada suhu
600oC, sampai bahan berwarna putih.
3. Cawan porselen dikeluarkan lalu didinginkan dalam eksikator selama 30
menit, lalu ditimbang (C).
4.
C - A
% abu = x 100%
27
Lampiran 4. Prosedur analisis serat kasar (Takeuchi 1988).
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC, lalu didinginkan dalam eksikator lalu ditimbang (X1).
2. Sampel ditimbang 0,5 g (A), dimasukkan ke dalam erlenmeyer 250 ml.
3. H2SO4 0,3 N sebanyak 50 ml dimasukkan ke dalam erlenmeyer lagi kemudian
dipanaskan selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 ml
dimasukkan ke dalam erlenmeyer lagi kemudian dipanaskan selama 30 menit.
4. Larutran dan bahan yang telah dipanaskan kemudian disaring dalam corong
buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi.
5. Larutan dan bahan yang ada pada corong buchner dibilas secara berturut-turut
dengan 50 ml air panas, H2SO4 0,3 N, air panas 50 ml, dan 25 ml aseton.
6. Kertas saring dan isinya dimasukkan ke dalam cawan porselen, dikeringkan
selama 1 jam kemudian didinginkan dalam eksikator dan ditimbang (X2).
7. Kemudian dipanaskan dalam tannur 600oC hingga berwarna putih, dinginkan dalam eksikator dan ditimbang (X3).
8. Serat kasar (%) = 2 1 3100 A
X X
X − −
28
Lampiran 5. Prosedur analisis kadar air (Takeuchi 1988).
1. Cawan dipanaskan pada suhu 105oC selama 3 jam.
2. Bahan seberat A gram dimasukkan ke dalam cawan dan ditimbang (X gram).
3. Cawan yang sudah berisi bahan dipanaskan dalam oven pada suhu 105oC selama 3 jam, selanjutnya didinginkan dalam eksikator dan ditimbang (Y
gram).
4. Prosedur no.3 diulang kembali sampai berat sampel konstan (tidak berubah).
5.
(X – Y)
29
Lampiran 6. Prosedur analisis mineral (Reitz et al.1960). A. Preparasi sampel (Wet ashing)
1. Sampel ditimbang + 1 g dimasukkan ke dalam erlenmeyer 125 ml
2. Ditambahkan larutan HNO3 65% (pa) sebanyak 5 ml tiap sampel
(pengerjaan di rua ng asam)
3. Dibiarkan selama 1 jam tanpa pemanasan di ruang asam, kemudian dipanaskan di atas hot plate suhu 80oC selama 4 – 6 jam
4. Didiamkan selama satu malam setelah pemanasan
5. Ditambahkan 0,4 ml H2SO4 (pa), kemudian dipanaskan kembali sampai
larutan mengental (+ 1 jam)
6. Ditambahkan + 2 tetes campuran HNO3 : HclO4 sampai larutan berubah
warna, dari cokelat menjadi kuning, kemudian pemanasan dilanjutkan selama 15 menit, ditambahkan 0,6 ml HCl (p) dan 2 ml aquades, dipanaskan kembali selama 15 menit
7. Tiap sampel dimasukkan ke dalam labu takar 100 ml (dapat dianalisa berbagai macam mineral yang diinginkan)
B. Analisa Fosfor (P)
1. Dibuat standard P sebanyak 5 deret standard, yaitu 0, 2, 3, 4 dan 5 ppm 2. Dipipet sampel ke dalam tabung reaksi sebanyak + 1 ml
3. Ditambahkan larutan C (campuran 10 ml amonium molibdat 10% + aquades + 5 g FeSO4.7H2O + aquades sampai 100 ml) sebanyak 2 ml
setelah semua standard dan sampel dipipet dan dijadikan 3 ml, lalu ditambahkan 2 ml larutan C sehingga totalnya menjadi 5 ml, diaduk (vortex) lalu dibaca di spektrofotometer dengan ? = 660 nm
C. Analisa Ca dan Zn
1. Dibuat larutan standard untuk Ca: 2, 4 dan 6 ppm sedangkan untuk Zn: 0,1, 0,5 dan 0,75 ppm
2. Kedalam tabung reaksi, sampel yang sudah dipreparasi (wet ashing) dipipet sebanyak 0,1 ml lalu ditambahkan 0,05 ml larutan Cl3La.7H2O dan
aquades sebanyak 4,9 ml, kemudian diaduk (vortex) dan ditutup
30
Lampiran 7. Pertambahan bobot (%) biomass ikan baung setiap perlakuan
Perlakuan
Lampiran 8. Analisa ragam pertambahan bobot (%) ikan baung
SK DB JK KT F hitung P value
Perlakua n 4 113302 28325 141,43* 0,000
Galat 10 2003 200
Total 14 115305
*
Berbeda nyata pada tingkat kepercayaan 95% (P<0,05)
Lampiran 9. Konversi pakan ikan baung setiap perlakuan
Perlakuan
Lampiran 10. Analisa ragam konversi pakan ikan baung setiap perlakuan
SK DB JK KT F hitung P value
Perlakuan 4 0,302781 0,075695 99,10* 0,000
Galat 10 0,007638 0,000764
Total 14 0,310419
*
Berbeda nyata pada tingkat kepercayaan 95% (P<0,05)
Lampiran 11. Retensi protein (%) setiap perlakuan
Perlakuan
Lampiran 12. Analisa ragam retensi protein (%) ikan baung setiap perlakuan
SK DB JK KT F hitung P value
Perlakuan 4 92,96 23,24 14,69* 0,000
Galat 10 15,82 1,58
Total 14 108,78
*
31
Lampiran 13. Tingkat kelangsungan hidup (%) ikan baung setiap perlakuan
Perlakuan
Lampiran 14. Konsumsi pakan (g) ikan baung setiap perlakuan selama penelitian
Perlakuan
Lampiran 15. Hasil analisa kandungan mineral tubuh dan tulang ikan baung pada akhir penelitian
Perlakuan Sampel Mineral Ulangan
32
Lampiran 16. Perhitungan bobot awal, bobot akhir, laju pertumbuhan harian, konsumsi pakan, retensi protein dan konversi pakan ikan baung
Parameter Ulangan A B C D E
Jlh protein pakan (g) selama penelitian 1 223,48 171,04 172,90 183,61 201,56
33
Laju pertumbuhan harian (%) 1 3,12 2,60 2,80 3,00 3,32
2 3,08 2,48 2,78 3,02 3,32
3 3,07 2,58 2,66 2,97 3,27
Konversi pakan 1 1,27 1,51 1,36 1,20 1,12
2 1,30 1,58 1,37 1,18 1,12
3 1,29 1,50 1,42 1,22 1,13