OPTIMALISASI PEMATANGAN OOSIT DAN OVULASI
PADA IKAN MAS KOKI (
Carassius auratus
)
MELALUI PENGGUNAAN INHIBITOR AROMATASE
FAJAR BASUKI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa segala pernyataan dalam disertasi
OPTIMALISASI PEMATANGAN OOSIT DAN OVULASI PADA IKAN
MAS KOKI (Carassius auratus) MELALUI PENGGUNAAN INHIBITOR
AROMATASE adalah benar merupakan gagasan dan hasil penelitian saya sendiri dibawah arahan komisi pembimbing. Semua data dan sumber informasi yang digunakan dalam disertasi ini telah dinyatakan secara jelas dan dicantumkan dalam daftar pustaka dibagian akhir disertasi serta dapat diperiksa kebenarannya. Disertasi ini belum pernah diajukan untuk memperoleh gelar pada program studi sejenis di Perguruan Tinggi lain.
Bogor, Juni 2007.
ABSTRAK
FAJAR BASUKI. Optimalisasi Pematangan Oosit dan Ovulasi pada Ikan Mas Koki (Carassius auratus) Melalui Penggunaan Inhibitor Aromatase. Dibimbing oleh Muh. Zairin Junior, Agus Oman Sudrajat, Tuty L. Yusuf, Bambang Purwantara, Mozes R. Toelihere (Alm).
Penelitian dilakukan dengan empat tahap untuk mengkaji lebih dalam reproduksi ikan mas koki mulai dari perkembangan, pematangan dan ovulasi oositnya. Penelitian dilakukan di holding ground ikan hias Dinas Agribisnis Kota Bogor mulai tahun 2003 sampai 2005
Penelitian tahap pertama bertujuan untuk memacu pertumbuhan oosit dengan menggunakan estradiol-17β. Dosis yang digunakan adalah k= kontrol (disuntik minyak ikan), Pl = 100 μg/kg berat tubuh (b.t), P2 = 200 μg/kg b.t., P3 = 400 μg/kg b.t., dan P4 = 800 μg/kg b.t. Hasil penelitian menunjukkan bahwa dosis perlakuan estradiol-17β yang diberikan dapat mempercepat pertumbuhanan oosit, waktu ovulasi tercepat dicapai pada dosis 200µg yaitu 313,60±13,14 jam dengan hasil daya fertilitas dan daya tetasnya masing-masing sebesar 91,88±2,77% dan 85,84±0,83%.
Penelitian tahap kedua bertujuan untuk mengetahui peranan inhibitor aromatase (IA) terhadap mekanisme penurunan estradiol-17β dan efeknya terhadap perkembangan oosit ikan mas koki. Dosis Inhibitor Aromatase (IA) yang digunakan adalah k= kontrol (disuntik NaCl fisiologis), Pl = 2,5 mg IA/kg berat tubuh (b.t); P2 = 7,5 mg IA/kg b.t dan P3 = 12,5 mg IA/kg b.t. Hasil penelitian menunjukkan bahwa hari ke tujuh pada semua dosis perlakuan menyebabkan penurunan hormon estradiol-17β. Hasil ini menunjukkan bahwa dosis inhibitor aromatase 2,5 mg/kg efektif menurunkan estradiol-17β.
Penelitian tahap ketiga ini bertujuan untuk mengetahui peranan kehadiran pejantan dan penyuntikan inhibitor aromatase (IA) terhadap proses ovulasi ikan mas koki. Rasio jantan dan betina yang digunakan 1:3, dosis IA yang digunakan adalah k= kontrol (disuntik NaCl fisiologis), Pl = 2,5 mg IA/kg berat tubuh (b.t), P2 = 7,5 mg IA/kg b.t., dan P3 = 12,5 mg IA/kg b.t. Perkembangan proses ovulasi ditandai dengan perubahan kandungan protein dalam gonad, dan perubahan hormon dalam plasma darah. Hasil penelitian menunjukkan pada jam ke-36 setelah penyuntikan terjadi proses ovulasi ditandai penurunan kandungan protein gonad, kandungan protein pada dosis 2,5 mg dan 7,5 mg turun sangat nyata, lebih rendah dibandingkan dengan kandungan protein kontrol dan dosis 12,5 mg. Pada jam ke-36 kandungan hormon estradiol-17β dan 17α-hidroksiprogesteron mencapai puncaknya. Waktu ovulasi tercepat dicapai pada kehadiran pejantan (rasio jantan : betina yaitu 1:3) dan dosis IA 2,5 mg yaitu 49,63±0,58 jam dengan hasil daya fertilitas dan daya tetas telurnya masing-masing sebesar 91,43 ±1,14% dan 86,68±3,05%.
aromatase (IA) terhadap proses ovulasi ikan mas koki. Dosis hCG dan IA yang digunakan adalah k= kontrol (disuntik NaCl fisiologis); Pl = Kombinasi 750 IU hCG dengan 2,5 mg IA/kg berat tubuh (b.t) ; P2 = Kombinasi 750 IU hCG dengan 7,5 mg IA/kg b.t.; dan P3 = Kombinasi 750IU hCG dengan 12,5 mg IA/kg b.t. Hasil penelitian menunjukkan bahwa semua dosis perlakuan menyebabkan terjadinya proses ovulasi. Proses ovulasi ditandai dengan terjadinya penurunan kandungan protein pada jam kesembilan perlakuan, kandungan protein pada semua dosis perlakuan turun sangat nyata dan lebih rendah dibandingkan kandungan protein kontrol. Kandungan hormon estradiol-17β dan 17α -progesteron mencapai puncak pada jam kesembilan perlakuan. Waktu ovulasi tercepat dicapai pada kombinasi 750 iu hCG dan 2,5 mg IA dengan hasil daya fertilitas dan daya tetas telur masing-masing sebesar 89,54% dan 85,59 %.
Sebagai kesimpulan umum dari rangkaian penelitian didapatkan bahwa pemijahan induk ikan mas koki dapat dipercepat dengan penyuntikan estradiol-17β. Penyuntikan Inhibitor Aromatase dapat menghambat kerja aromatase ditandai dengan menurunnya kandungan hormon estradiol-17β dalam darah dan terjadi pematangan oosit. IA menyebabkan terhentinya vitelogenesis, menuju pematangan oosit namun tidak menyebabkan ovulasi. Sedangkan kombinasi kehadiran pejantan dan penyuntikan IA telah merangsang terjadinya ovulasi, demikian juga penyuntikan kombinasi antara hCG dan IA telah mampu merangsang ovulasi.
Kata kunci : Optimalisasi, estradiol-17β, inhibitor aromatase (IA), hCG, kehadir- an pejantan, perkembangan, pematangan, oosit, ovulasi,
ABSTRACT
FAJAR BASUKI. The Optimalisation of Oocyte Maturation and Ovulation in Gold Fish (Carassius auratus) by the use of Aromatase Inhibitor. Under the supervision of Muh. Zairin Junior, Agus Oman Sudradjat, Tuty L. Yusuf, Bambang Purwantara, Mozes R. Toelihere.
A series of experiments were conducted to study the effect of estradiol-17β, hCG, Aromatase Inhibitor on the maturation oocyte and subsequent ovulation in goldfish. The experiments had been caried out at holding ground of ornamental fish of Agribisnis Section of Bogor, from 2003 to 2005
The objective of the first experiment is to know the optimalisation of oocyte development in goldfish by the use of estradiol-17β. The dosage of estradiol-17β used were for control ( injected by fish oil); 100 µg/body weight (b.w.), estradiol-17β 200 µg/b.w., estradiol-17β 400 µg/b.w., and estradiol-17β 800 µg/b.w. Results of the experiment indicated that all dose treatment affect the oocyte development. The shortest ovulation time was after injection reached by estradiol-17β 200 µg (313,60±13,14 hours), with fertilization and hatching rate were 91,88±2,77% and 85,84±0,83%. respectively.
The second experiment was done to study the mechanism of the decrease of estradiol-17 β and the effect on oocyte development by use of aromatase inhibitor (AI). The dosage used were control ( injected by physiological saline solution), IA 2,50 mg /kg body weight/bw; AI 7,50 mg/kg bw, and AI 12,50 ug/kg bw. Results experiment indicated that on seventh days after all of dosis treatment the hormone estradiol-17β and protein content in gonad decreased. Histological analysis indicated of the occurrecence of atretion of gonad was observed. In the D-14 estradiol-17βincreased and so protein gonad content. In the twenty-first day the estradiol-17β content is same as control content, and followed by gonad level protein.
The third experiment was done to study the presence of the male and AI to the ovulation process. Male and female was set on the variation of 1:3. The dose of AI were 0 (control = injected with physiological saline solution); IA 2,5 mg /kg body weight (b.w); IA 7,5 mg/kg b.w.; and IA 12,5 mg/kg b.w. Results of this research indicated that in the process of ovulation, the protein decreased at 36 hours after treatment, the level of protein at dosage 2,5 mg and 7,5 mg being significantly the lowest compare with the control and 12,5 mg. The level of estradiol-17β and 17α-progesterone hormones reached its peak at 36 hours after treatment. The shortest ovulation time was reached by dosis 2,5 mg (49.63±0,58 hours), with fertilization and hatching rates were 91,43±1,14% and 86,68±3,05%, respectively.
The objective of the fourth experiment is to study the optimum dosage of IA and hCG. The dosage that is used is k = control (injected with physiological
hCG with 12,5 mg IA/kg of body weight. Result of the experiment indicated that during ovulation process, protein content decreased in the h-9 of process. The protein content at all dose are obviously decreased and lower than the protein content in control. Estradiol and progesterone hormone content reach the peak in the h-9 process. The earliest ovulation occured at combination of 750 iu hCG and 2,5 mg IA (12,03±0,50 h) with fertility of 89,54% and the hatchibility of 85,59%.
In general, it is concluded that goldfish breedstock will ready to spawn by use of estradiol-17β injection. Aromatese inhibitor will inhibit aromatese activity indicated by the decrease of estradiol-17β concentrations in the blood and the process of maturation was happened. IA caused switch off vitellogenesis and switch on maturation process but not ovulation. Injection of IA and the presence of the male have been proved to stimulate ovulation. Like wise, combination hCG and IA injection on goldfish may also can stimulate ovulation processes on goldfish breedstock.
OPTIMALISASI PEMATANGAN OOSIT DAN OVULASI PADA IKAN MAS KOKI (Carassius auratus)
MELALUI PENGGUNAAN INHIBITOR AROMATASE
Oleh
FAJAR BASUKI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor Pada Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi Ujian Tertutup :
Dr. Drh. Ligaya I. Tumbelaka, MSc.
Penguji Luar Komisi Ujian Terbuka :
1. Dr. Ir. Atmadja Hardja Mulia, MS, APU.
Judul Penelitian : Optimalisasi Pematangan Oosit dan Ovulasi pada Ikan Mas Koki (Carassius auratus) Melalui Penggunaan Inhibitor Aromatase.
Nama : Fajar Basuki NIM : Pl1600002/S3/BRP
Disetujui
Komisi Pembimbing,
Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc. Ketua
Dr.Ir. Agus Oman Sudrajat, M.Sc. Dr. drh. Tuty L. Yusuf, M.S. Anggota Anggota
Dr. drh. Bambang Purwantara, M.Sc. Prof. Dr. drh. Mozes R. Toelihere, M.Sc.(Alm) Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Biologi Reproduksi
Dr. drh. Tuty L. Yusuf, M.S. Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
KATA PENGANTAR
Syukur Alhamdulillah atas segala rahmat dan hidayah Allah SWT sehingga memungkinkan diselesaikannya penulisan disertasi dengan judul
''Optimalisasi Pematangan Oosit Dan Ovulasi Pada Ikan Mas Koki (Carassius auratus) Melalui Penggunaan Inhibitor Aromatase” Diajukan untuk memperoleh gelar Doktor pada Sekolah Pascasarjana Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Ir. Muhammad Zairin Jr., MSc., selaku ketua komisi pembimbing, serta Bapak Dr. Ir. Agus Oman Sudradjat, MSc., Ibu Dr. drh. Tuty L. Yusuf , MS., dan Bapak Dr. drh. Bambang Purwantara, MSc., Bapak Prof. Dr. Drh. Mozes R. Toelihere., MSc (Alm) selaku anggota komisi pembimbing, atas keikhlasan, kesabaran dan kelembutan hati memberikan bimbingan nasehat, arahan dan dorongan mulai dari penulisan proposal, selama pelaksanaan penelitian berlangsung sampai selesainya penulisan disertasi ini.
Secara khusus penghargaan dan ucapan terima kasih saya sampaikan kepada Almarhum Bapak Prof. Dr. Drh. Mozes R. Toelihere., MSc atas segala nasehatnya, teriring doa semoga amal sholeh almarhum diterima disisi Tuhan Yang Maha Esa.
Ucapan Terima kasih juga saya sampaikan kepada Rektor Universitas Diponegoro Semarang, Departemen Pendidikan dan Kebudayaan Repuplik Indonesia melalui Dana Pendidikan BPPS, Direktur Pembinaan Penelitianm Dan Pengabdian pada Masyarakat DIKTI serta Dirut Perusahaan Gas Negara Jakarta yang telah membantu memberikan biaya penelitian, sehingga penelitian berjalan dengan lancar.
Terima kasih saya sampaikan kepada Dinas Agribisnis Kota Bogor atas izin lokasi penelitian, Bapak Ir. Sony Gumelar MSi, Diding, Bapak Herman (petani ikan koki), Bapak Yosef (analisis Hormon), Ibu Hetty (analisis protein gonad) dan Mas Bodan (teknisi URR IPB). Sahabat dan teman saya Pak Surya, Pak Rizal, Pak Herdis, Ibu Marlene, Ibu Ristika, Ibu Yoshinta, Pak Slamet, Pak Faik dan Bu Yusufi atas kebersamaan selama ini.
Terima kasih kepada isteri Trimunindrawati dan anak-anak tercinta Fani Suryo Wibowo dan Fafan Suryo Nugroho atas segala dukungan dan doa yang tak putus-putusnya, mudah-mudahan jerih payah ini dapat membahagiakan kita dan orang tua kita.
Mudah-mudahan disertasi ini dapat memberikan sumbangsih yang berharga bagi pembangunan perikanan ikan hias, khususnya peningkatan potensi produksi ikan mas koki.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Sukoharjo Jawa Tengah pada tanggal 18 November 1957 dari Ayahanda Sartono Wihardjo (Almarhum) dan Ibu Kusmaryatun (almarhumah) sebagai anak ke ke tujuh dari tiga belas bersaudara. Gelar Magister Sains diperoleh pada tahun 1990 dari Program Studi Biologi Reproduksi dari Sekolah Pasca Sarjana Institut Pertanian Bogor. Pada tahun 2000 penulis melanjutkan pendidikan S3 pada Program Studi yang sama.
Gelar Insinyur diperoleh pada tahun 1983 dari Jurusan Perikanan Fakultas Perternakan dan Perikanan Universitas Diponegoro Semarang. Pada tahun 1985 penulis diterima menjadi staf pengajar pada Jurusan yang sama.
i
Hipotesis Penelitian ... 7
Manfaat Penelitian ... 7
Gonad dan Perkembangan Oosit... 11
Peranan estradiol-17β dalam perkembangan oosit (vitelogenesis)... 13
Peranan testosteron dalam proses pematngan oosit ... 15
Peranan Aromatase dan Inhibitor Aromatase dalam Pematangan Oosit ... 16
Peranan Gonadotropic Hormon (GTH) dalam Pematangan Oosit... 19
a. Peranan Gonadotropic Hormone (GTH) sebagai media primer dalam pematangan oosit... 19
b. Maturation-Inducing Hormone (MIH) sebagai mediator kedua pada kematangan oosit... 19
c. Maturation-Promoting Factor (MPF) sebagai mediator ketiga pada kematangan oosit... 20
d. Mekanisme Hormonal Pertumbuhan, Pematangan dan Ovulasi Oosit… ...21
Daftar Pustaka ... 23
PENGARUH ESTRADIOL-17β TERHADAP PERKEMBANGAN OOSIT PADA IKAN MAS KOKI(Carassius auratus)... 27
ii
PENGARUH INHIBITOR AROMATASE (IA) TERHADAP PERKEM-
BANGAN OOSIT PADA IKAN MAS KOKI(Carassius auratus)... 40
Abstrak ... 40
Pendahuluan ... 41
Bahan dan Metode ... 43
Hasil dan Pembahasan ... 46
Simpulan ... 52
Daftar Pustaka ... 52
PENGARUH KEHADIRAN PEJANTAN DAN INHIBITOR AROMATASE (IA) TERHADAP KEMATANGAN OOSITDAN OVULASI PADA IKAN MAS KOKI (Carassius auratus)... 54
Abstrak ... 54
Pendahuluan ... 55
Bahan dan Metode ... 58
Hasil dan Pembahasan ... 62
Simpulan ... 68
Daftar Pustaka ... 68
PENGARUH KOMBINASI HCG (HUMAN CHORIONIC GONADO- TROPIN) DAN INHIBITOR AROMATASE (IA) TERHADAP KEMA- TANGAN OOSIT DAN OVULASI PADA IKAN MAS KOKI(Carassius auratus)... 70
Abstrak ... 70
Pendahuluan ... 72
Bahan dan Metode ... 75
Hasil dan Pembahasan ... 79
Simpulan ... 84
Daftar Pustaka ... 85
PEMBAHASAN UMUM... 87
iii
DAFTAR TABEL
Halaman
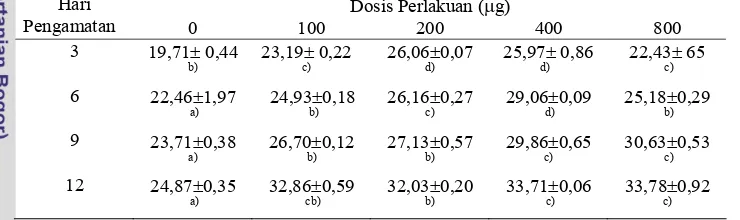
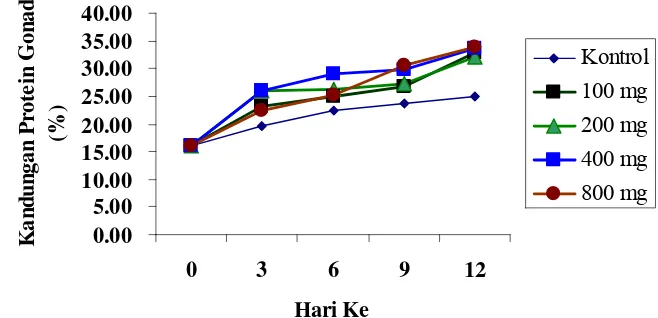
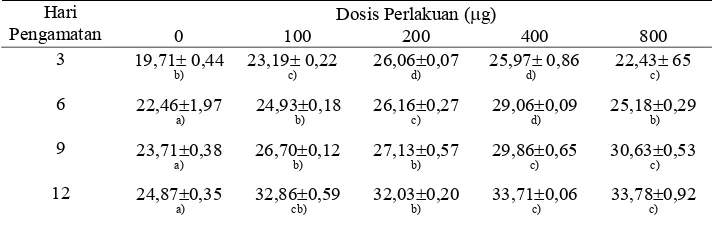
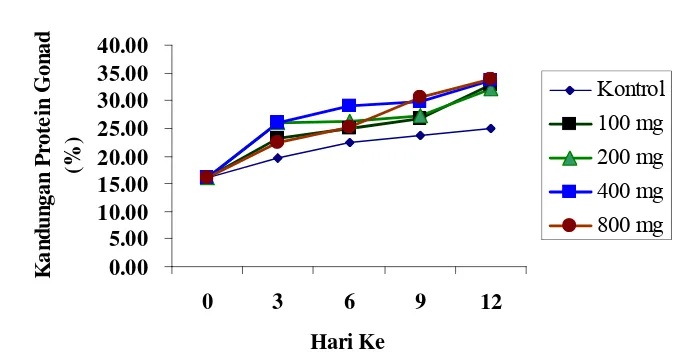
1. Pengaruh pemberian estradiol-17β terhadap kandungan protein gonad
hasil perlakuan dari hari ketiga sampai hari ke-12... 33
2. Pengaruh pemberian estradiol-17β terhadap lama waktu ovulasi (jam)
pada ikan betina yang dirangsang dengan pejantan ………. 35
3. Pengaruh pemberian estradiol-17β terhadap persentase pembuahan
dan penetasan pada ikan betina yang dirangsang dengan pejantan... 37
4. Pengaruh pemberian Pengaruh pemberian Inhibitor Aromatase (IA)
terhadap kandungan hormon estradiol-l7β (pg/mg) ... 46
5. Pengaruh pemberian Inhibitor Aromatase (IA) terhadap kandungan
protein gonad (%) dari awal sampai hari ke-21 ... 48
6. Pengaruh keberadaan jantan dan pemberian IA terhadap kandungan
protein gonad (%) dari awal sampai 36 jam perlakuan ………. 62
7. Pengaruh keberadaan jantan dan pemberian IA terhadap kandungan
protein gonad (%) kontrol dan telur ovulasi ………. 62
8. Pengaruh keberadaan jantan dan pemberian IA terhadap waktu (jam)
ovulasi ……….. 66
9. Pengaruh keberadaan jantan dan pemberian IA terhadap persentase
pembuahan dan penetasan telur ovulasi ……… 66
10.Pengaruh kombinasi hCG dan IA terhadap kandungan protein gonad
(%) dari awal sampai 9 jam perlakuan ………. 79
11.Pengaruh kombinasi hCG dan IA terhadap kandungan protein gonad
(%) pada kontrol dan telur ovulasi……… 79
12.Pengaruh kombinasi hCG dan IA terhadap waktu (jam) Ovulasi …… 83
13.Pengaruh kombinasi hCG dan IA terhadap persentase pembuahan
iv
DAFTAR GAMBAR
Halaman
1 Alur kerangka pemikiran penggunaan estradiol-l7β dan kehadir- an pejantan, IA, kehadiran pejantan dan IA, kombinasi hCG dan
IA ... 6
2 Proses perkembangan oosit ikan ... 15
3 Alur kerangka pemikiran penelitian penggunaan estradiol-l7β dan kehadiran pejantan……….. 29
4 Pengaruh pemberian estradiol-l7β terhadap kandungan protein gonad (%) dari awal sampai hari ke12………... 34
5 Alur kerangka pemikiran penelitian pemberian Inhibitor Aroma- tase (IA)……….. 42
6 Pengaruh Inhibitor Aromatase (IA) terhadap kandungan estra- diol-17β ……….. 47
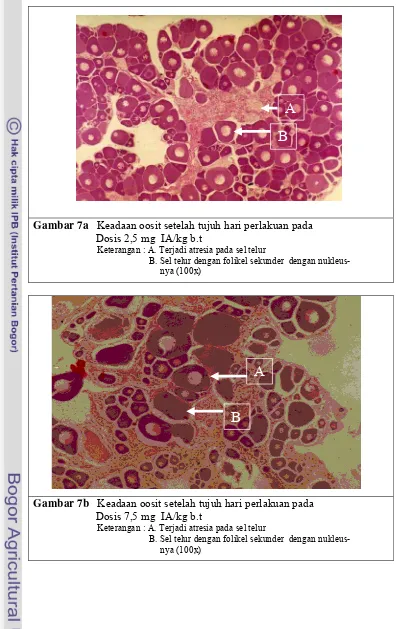
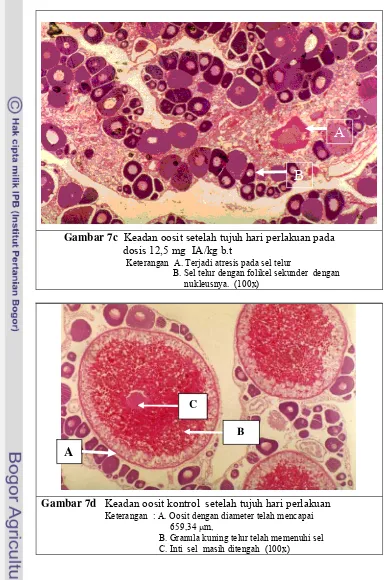
7 a. Keadaan oosit dosis 2,5 mg setelah tujuh hari perlakuan... 49
b. Keadaan oosit dosis 7,5 mg setelah tujuh hari perlakuan... 49
c. Keadaan oosit dosis 12,5 mg setelah tujuh hari perlakuan... 50
d. Keadaan oosit kontrol setelah tujuh hari perlakuan ... 50
8 Alur kerangka pemikiran penelitian kehadiran pejantan dan pemberian Inhibitor Aromatase (IA) ... 57
9 Pengaruh kehadiran pejantan dan pemberian IA terhadap kandung- an hormon estradiol-17β ………... 64
10 Pengaruh kehadiran pejantan dan pemberian IA terhadap kandung- hormon 17α-hidroksiprogesteron ………. 64
11 Alur kerangka pemikiran penelitian kombinasi hCG dan IA……… 74
12 Pengaruh kombinasi hCG dan IA terhadap kandungan hormon estradiol-17β ……… 81
1
PENDAHULUAN Latar Belakang
Ikan hias banyak digemari oleh konsumen karena keindahan yang dimilikinya, meliputi warna, bentuk maupun sifat-sifat khusus lainnya, sehingga dapat memuaskan kebutuhan psikis penggemarnya. Kelebihan yang dimiliki ikan hias tadi telah membuat ikan hias mempunyai potensi ekonomi yang cukup tinggi. Oleh karena itu ikan hias sebagai salah satu potensi sumberdaya perairan Indonesia dapat terus dikembangkan menjadi salah satu komoditas alternatif yang cukup penting dalam bidang perikanan budidaya.
Ditinjau dari segi ekonomi, nilai ekspor ikan hias terus meningkat. Pada tahun 1991 nilai ekspor ikan hias mencapai US $ 7.981.000, Sedangkan pada tahun 2000 mencapai nilai US $ 9.510.000 atau meningkat 19,03 % (Director General of Aquaculture 2001). Ekspor ikan hias melonjak pesat pada tahun 2002 mencapai US $ 15 juta, dan sampai saat ini Indonesia hanya menguasai sekitar 6% pangsa ekspor ikan hias dunia, dibawah Singapura yang telah mencapai 38,5% (Putro et al. 2004).
Salah satu jenis ikan hias yang sangat populer adalah ikan mas koki (Carassius auratus). Ikan ini sangat digemari baik di dalam maupun di luar negeri, sehingga mempunyai potensi pasar dalam negeri (pasar lokal daerah maupun regional), serta pasar luar negeri untuk ekspor.
Sampai saat ini upaya untuk memproduksi ikan mas koki masih
dilakukan dengan cara tradisional yang sangat sederhana, sehingga keberhasilan pemijahannya masih rendah. Kegagalan pemijahan diduga karena dua faktor, yaitu faktor yang pertama adalah kegagalan dalam mempersiapkan induk yang benar-benar matang gonad dan siap dipijahkan, dan faktor yang kedua adalah kegagalan dalam merangsang induk sehingga terjadinya ovulasi.
2 Ikan dapat bereproduksi dengan rekayasa lingkungan yakni (1) rangsangan bau-bauan, baik bau tanah kering yang terkena air hujan atau feromon, (2) Pengaturan suhu, baik suhu hangat/panas maupun suhu dingin, (3) pembuatan sarang untuk meletakkan telurya, serta (4) keberadaan pejantan.
Selain faktor lingkungan, rekayasa berupa pemberian hormon steroid maupun hormon gonadotropin telah banyak diperkenalkan. Untuk merangsang perkembangan oosit agar dapat tumbuh sehingga induk siap untuk bereproduksi dapat diberikan estradiol-17β melalui pakan, implantasi sub kutan dan penyuntikan. Peningkatan kadar estradiol-17β di dalam darah akan menyebabkan umpan balik positif terhadap hipathalamus/hipofisa akibatnya akan terjadi pertumbuhan oosit. Dipihak lain estradiol-17β merangsang hati untuk meproduksi vitelogenin (VTG), VTG akan didesposisikan ke dalam oosit sehingga oosit tumbuh, pada akahirnya induk ikan siap untuk bereproduksi.
Untuk merangsang ovulasi ikan lele dumbo telah digunakan hormon GnRH (Gonadotropin Releasing Hormone). Untuk merangsang ovulasi pada Clarias batracus telah digunakan hCG (human Chorionic Gonadotropin), dan untuk merangsang ovulasi ikan mas koki (Carassius auratus) digunakan hCG, serta untuk merangsang ovulasi ikan jambal siam (Pangasius hypothalmus) telah digunakan implantasi LH-RH dan 17α-metiltestosteron. Penggunaan hormon gonadotropin untuk merangsang ovulasi pada ikan harganya cukup mahal.
Teknologi rekayasa reproduksi untuk merangsang agar ikan bereproduksi yaitu dengan hipofisasi. Namun demikian penggunaan hormon protein yang berasal dari hipofisis untuk merangsang ovulasi mempunyai kendala. Diantara kendala tersebut adalah pelaksanaan hipofisasi yang rumit, berpeluang untuk menularkan penyakit, dan karena molekul protein yang besar dapat menyebabkan respon kekebalan.
3 dalam oosit sehingga oosit tumbuh (Kjesbu et al. 1996). Dipihak lain, pematangan oosit dikontrol oleh LH (Luteinizing hormone) yang merangsang sel teka memproduksi 17α-hidroksiprogesteron, kemudian ditranfer ke basal lamina. LH juga mempengaruhi sel granulosa mengaktifkan enzim 20β -hidroksisteroid-dehidrogenase (20β-HSD), sehingga aktivitas enzim meningkat dan mampu mengkonversi l7α-hidroksiprogesteron menjadi l7α,20β-dihidroksiprogesteron (l7α,20β-DP). Hormon steroid inilah yang berperan dalam pematangan oosit (Katsu et al. 1999; Nagahama, 1987; 1994 dan Nagahama et al. 1995). Fungsi LH dalam proses pematangan oosit juga menekan aktivitas aromatase. Akibatnya aktivitas aromatase berkurang sehingga terjadi pengurangan atau penghentian produksi estradiol-17β, dan terjadi peningkatan produksi testosteron (Fritzpatrick et al. 1997). Testosteron akan memberikan umpan balik positif terhadap gonadotropin, sehingga gonadotropin semakin melimpah dan akhirnya terjadi pematangan dan ovulasi oosit.
Berdasarkan proses fisiologi reproduksi telah diketahui bahwa masa transisi dari tahap vitelogenik ke tahap pematangan oosit adalah terjadinya perpindahan jalur, dari jalur penghambatan atau penghentian pembentukan estradiol-l7β, ke jalur sintesis atau peningkatan 17α,20β-dihidroksiprogesteron. Penggunaan inhibitor aromatase (IA) pada ikan salmon (Oncorhynchus kisutch) adalah untuk menghambat aktivitas enzim aromatase ternyata mampu merangsang oosit tahap vitelogenis menuju ke pematangan dan ovulasi (Afonso et al. 1999 a,b).
IA suatu zat non steroid yang dapat digunakan untuk menghambat/ menghentikan aktivitas enzim aromatase, inhibitor aromatase yang diberi nama anastrozole dan letrozole pada dosis 1-5 mg mampu menurunkan konsentrasi estradiol sebanyak 97-99% dan mempunyai waktu paruh berkisar antara 30-60 jam, serta mampu dimetabolisme di dalam hati (Holzer et al, 2006).
4 didapatkan pemijahan dan tingkat ovulasi yang tinggi disertai dengan fertilitas dan daya tetas telur yang tinggi.
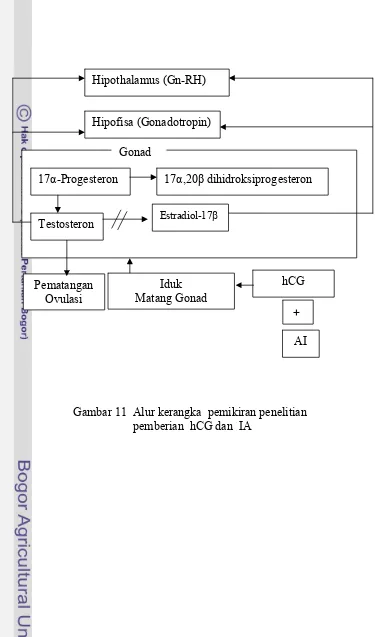
Kerangka Pemikiran
Mekanisme hormonal untuk vitelogenesis, pematangan serta ovulasi oosit melibatkan Gn-RH, gonadotropin, estradiol-l7β, testosteron, 17α-20β dihidroksiprogesteron, dan aromatase. Pemberian estradiol-l7β dari luar dapat meningkatkan estradiol-l7β dalam tubuh, estradiol-l7β akan dibawa ke hati dan hati akan dirangsang untuk mensintesis VTG yang sangat penting dalam vitelogenesis, sehingga dapat memacu pertumbuhan oosit. Pertumbuhan oosit yang semakin besar menyebabkan estradiol-l7β semakin tinggi hal ini menyebabkan umpan balik negatif terhadap FSH (Follicle Stimulating hormone) dan umpan balik positif terhadap LH. Berkurangnya FSH dan meningkatnya LH menyebabkan penurunan aktivitas aromatase, akibatnya produksi estradiol-l7β turun dan meningkatkan produksi testosteron, kadar testostoteron yang tinggi dapat merangsang pematangan oosit. Dipihak lain peningkatan LH akan meningkatkan aktivitas 20β-HSD sehingga memacu peningkatan produksi 17α -20β dihidroksiprogesteron akibatnya terjadi pematangan yang diikuti ovulasi oosit. Pemberian AI dari luar akan menurunkan aktivitas aromatase akibatnya produksi estradiol-l7β turun dan meningkatkan produksi testosteron, keadaan ini diharapkan menyebabkan terjadinya pematangan dan ovulasi. Kehadiran pejantan dimaksudkan untuk merangsang sekresi LH, fungsi LH meningkatkan kinerja enzim 20β-HSD sehingga diharapkan terjadi peningkatan produksi 17α,20β -dehidroksiprogesteron dan akan menurunkan aktivitas enzim aromatase. Penambahan IA memungkinkan kerja LH dalam menurunkan enzim aromatase tadi akan diperkuat atau digantikan oleh IA, sehingga peranan LH dalam proses pematangan dan ovulasi oosit akan lebih efisien. Pemberian hCG dapat digunakan sebagai pengganti pejantan.
Berdasarkan kerangka pemikiran di atas maka telah dilakukan tahapan penelitian, sebagai berikut :
5 2. Pengaruh inhibitor aromatase (IA) terhadap perkembangan oosit pada ikan
mas koki (Carassius auratus)
3. Pengaruh inhibitor aromatase (IA) dan kehadiran pejantan terhadap proses ovulasi pada ikan mas koki (Carassius auratus)
6
7
Tujuan Penelitian
Tujuan penelitian yang ingin dicapai dalam penelitian ini adalah : 1. Optimalisasi perkembangan oosit dengan penggunaan Estradiol-17β.
2. Mengetahui mekanisme penurunan estradiol 17β dan efeknya terhadap perkembangan oosit
3. Mendapatkan pematangan dan ovulasi oosit yang optimum melalui kehadiran pejantan dan penyuntikan IA, kombinasi hCG dan IA
Hipotesis
Hipotesis yang akan diuji dalam penelitian ini adalah
1. Penyuntikan estradiol-17β meningkatkan proses perkembangan oosit.
2. Penyuntikan inhibitor aromatase (IA) menghambat kerja aromatase, sehingga terjadi penurunan hormon estradiol-17β dalam plasma darah.
3. Kombinasi kehadiran pejantan dan penyuntikan inhibitor aromatase (IA) akan meningkatkan proses pematangan dan ovulasi oosit.
4. Penyuntikan kombinasi hCG (human Chorionic Gonadotropin) dan IA akan meningkatkan proses pematangan dan ovulasi oosit.
Manfaat Penelitian
8
TINJAUAN PUSTAKA
Biologi lkan Mas Koki (Carassius auratus)
Varietas Mas Koki
Berdasarkan riwayatnya ikan mas koki merupakan salah satu ikan hasil
domestikasi tertua di dunia ikan ini sangat populer karena dapat di jumpai di
toko-toko ikan hias di seluruh dunia (Axelrod dan Burges,1973). Menurut Kafuku dan
Ikenoue (1983) ikan mas koki telah didomestikasi pada Zaman Dinasti Sung di China
pada sekitar tahun 960 Masehi. Jenis ikan ini masuk ke Jepang pada sekitar tahun
1500 M dan masuk ke benua Eropa pada sekitar tahun 1700 Masehi.
Varietas mas koki telah berkembang sangat pesat mencapai ratusan varietas,
namun beberapa varietas yang terkenal di China, Jepang, Eropa maupun Amerika.
Menurut Andrews (1987); Kafuku and Ikenoue (1983); Paradise (1988), varietas
yang terkenal itu antara lain
l. Ikan mas koki biasa atau Common goldfish atau di Jepang disebut wakin karena
bentuk fisiknya masih seperti ikan karper krusian dan belum banyak mengalami
perubahan. Warna dasarnya adalah biru, warna terbaik pada ikan ini adalah
merah-oranye metalik tetapi tidak ada warna peraknya sedikitpun. Ikan ini
mempunyai ekor terbelah menjadi dua (forked). Panjang total ikan dapat
mencapai 8 inchi, aslinya berasal dari China.
2. Ikan mas koki berekor kipas atau juga disebut mas koki fantail atau lochoo, yang
berasal dari China, dan masuk ke Jepang melalui pulau Ryukyu, sehingga oleh
masyarakat Jepang menyebutnya ryukin. Ekornya bersirip kembar, bentuknya
mekar dan panjang, panjang sirip ekor melebihi panjang tubuhnya. Panjang
totalnya dapat mencapai 3,5 inchi.
3. Ikan mas koki berekor rumbai atau juga disebut mas koki veiltail. Orang sering
keliru membedakan antara ikan mas koki kipas dan mas koki rumbai. Untuk
membedakannya sangat mudah yaitu sirip ekor pada ikan mas koki rumbai sangat
panjang dan terbelah menjadi dua (kembar), sirip ekornya sangat panjang dan
bahkan kelihatan mengantung ke bawah, juga mempunyai sirip punggung yang
9 4. Ikan mas koki teleskop atau di Jepang disebut juga demekin. Ciri khas dari ikan
ini adalah matanya yang mencuat keluar, sehingga seolah-olah matanya memakai
teleskop. Perkawinan antara mas koki lionhead ranchu dan mas koki teleskop
menghasilkan ikan mas koki demerancu.
5. Ikan mas koki oranda adalah ikan yang mempunyai kepala mirip kepala singa,
namun mempunyai sirip punggung. Warna oranda yang terkenal adalah tancho
oranda yang badannnya berwarna putih, dan di atas kepalanya terdapat warna
merah.
6. Ikan mas koki kepala singa atau lion head. Ikan ini mempunyai kepala mirip
kepala singa, namun tidak mempunyai sirip punggung, sirip anal dan sirip ekor
pendek dan kaku.
7. lkan mas koki nirwana atau celestial. Ciri khas ikan ini terletak pada bentuk pupil
matanya yang menghadap keatas. Karena lokasi matanya yang demikian
menyebabkan ikan ini sulit memenangkan kompetisi pakan dengan ikan lain.
Oleh karena itu ikan ini hanya cocok dipelihara dengan varietas yang sama. Ciri
lain adalah warnanya oranye metalik, dan tidak mempunyai sirip punggung.
8. Ikan mas koki burik. Ciri khas dari ikan ini adalah warnanya. Hampir semua
warna yang dimiliki ikan mas koki dapat muncul. Varietas mas koki burik yang
terkenal adalah shubunkin bristol, yang muncul di Jepang sekitar tahun 1900, dan
shubunkin London. Kedua ikan tadi sekilas nampak hampir sama, yang
membedakannya adalah sirip dan ekor shubunkin bristol lebih panjang
dibandingkan dengan shubunkin London.
9. Ikan mas Komet. Keunikan ikan ini terletak pada ekornya yang berbentuk seperti
garpu, memanjang dan lebih panjang dari pada badannya. Karena ekornya yang
memanjang ini maka disebut komet.
10. Ikan mas koki mata balon atau bubble eyes. Ciri khas dari ikan ini adalah bentuk
matanya normal, namun pelupuknya menggelembung seperti balon. Gelembung
ini mulai tumbuh setelah ikan berumur tiga bulan. Ciri lainnya adalah ikan ini
10 ll. Ikan mas koki sisik mutiara atau mas koki mutiara. Ciri khas dari ikan ini
sisiknya seperti mutiara, muncul di permukaan kulit, kalau diraba terasa berbintil,
sisik ini tumbuh sejak burayak.
12. Ikan mas koki moor atau black moor. Ciri khas ikan aclalah warnanya yang
hitam kelam, pada usia muda ikan ini berwarna coklat kemerahan. Adapun
ekornya seperti kipas atau fantail dan matanya berkembang seperti mas koki
teleskop.
Jenis-jenis ikan mas koki fantail maupunveiltail di Indonesia disebut ikan mas
koki tosa, dan saat ini telah berkembang mas koki tosa yang berekor pendek disebut
tosakin.
Reproduksi Ikan Mas Koki
Dalam usaha pembenihan ikan kesuksesan pemilihan induk sangat menentukan
keberhasilan pemijahan ikan. Berdasarkan teori pematangan oosit maka induk ikan
yang terpilih adalah induk yang sudah matang gonad; secara fisiologis oosit telah
tumbuh penuh, diameter mencapai ukuran maksimal (Harvey dan Hoar, 1979; Lam,
1985; Yamashita 2000; Woynarovich dan Horvath, 1980).
lkan mas koki jantan yang matang gonad ditandai dengan munculnya tubercles
atau bintil-bintil di daerah tutup insangnya atau pada pangkal sirip dadanya. Kalau
diraba di daerah tersebut terasa kasar seperti ada butiran kecil menempel; sedangkan
mas koki betina yang matang gonad ditandai dengan perutnya yang gendut penuh
dengan telur, dan terasa lunak (Andrews, 1987; Axelrod dan Burgess, 1973; dan
Paradise, 1988). Untuk lebih meyakinkan maka induk dan pejantan terpilih ditangkap
kemudian perutnya diurut dengan jari. Pejantan yang matang gonad akan keluar
cairan putih berisi sperma dari saluran urogenetalisnya, dan yang betina akan
mengeluarkan sedikit butiran telur berwarna kekuningan (Paradise, 1988).
Teknik pemijahan ikan mas koki menurut Paradise (1988) dapat dilakukan
dengan dua metode, yaitu metode alamiah dan perkembangbiakan buatan. Metode
alamiah dapat dilakukan dengan menggunakan akuarium maupun di kolam.
11 dan betina sehingga dapat dikoleksi sperma dan sel telur kemudian dicampur
sehingga terjadi pembuahan.
Pemijahan ikan mas koki di dalam akuarium dapat dilakukan dengan aquarium
yang berukuran minimal sebesar 60x30x30 cm (panjang x lebar x tinggi).
Perbandingan jumlah jantan : betina sebanyak 2:1 artinya dua pejantan dengan satu
betina untuk sistem berpasangan, atau 1:1 artinya satu jantan dan satu betina untuk
pemijahan masal (Andrews, 1987).
Ikan mas koki merupakan spesies multi spawner yaitu memijah beberapa kali
dalam satu musim pemijahan. Oleh karena itu ikan ini mempunyai tipe ovarium yang
berisi oosit pada tahap perkembangan yang berbeda (Yoshiura et al. 1997).
Pakan Ikan Mas Koki
lkan mas koki termasuk pemakan segalanya (omnivorua), baik sumber pakan
yang berasal dari nabati maupun hewani. Sumber pakan nabati berupa dedaunan
dari tumbuhan air, sedangkan sumber pakan hewani berupa cacing sutera (tubifex),
dafnia, moina maupun jentik nyamuk. Berbagai bentuk pakan buatan seperti flakes
(serpihan kecil); bubuk maupun pelet (butiran) juga cocok untuk pemeliharaan mas
koki (Kafuku dan Ikenoue, 1983; dan Paradise, 1988).
Gonad dan Perkembangan Oosit
Organ kelamin atau gonad betina disebut ovarium dan terletak di bagian
dorsokaudal dari tubuh ikan. Ovarium berbentuk bulat panjang, dengan sumbu
memanjang ke arah horizontal. Apabila ovarium ini dipotong melintang maka
nampak susunan sel yang mencakup selubung folikel yang terdiri atas sel-sel
granulosa, sel-sel theka, zona radiata dan sel telur itu sendiri (Harvey dan Hoar, 1979;
Reding dan Patino, 1993). Sementara itu Smith (1982) menyatakan bahwa susunan
ovarium ikan trout dari luar ke dalam dengan menggunakan mikroskop elektron
terdiri atas: sel-sel theka, membran ropria folliculi; sel-sel folikel; zona pellusida;
12 Untuk mempelajari perkembangan telur ikan mas koki belum tersedia data
yang cukup, sebagai pembanding dipelajari perkembangan sel telur ikan mas.
Menurut Woynarovich dan Horvath (1980) perkembangan telur ikan mas dibagi
dalam tahap-tahap di bawah ini
'l'ahap I: Sel benih atau primitive egg cells (ovogonium atau archovogonium)
berukuran sangat kecil (antara 8-12 µm), perbanyakan sel ini melalui
pembelahan mitosis.
Tahap II : Sel epitel benih mulai tumbuh dengan ukuran antara 12-20 µm, yang
dibungkus oleh folikel. Fungsi folikel nanti sebagai tempat asuhan dan
perlindungan dalam perkembangan sel telur. Pada awalnya selubung
folikel ini hanya satu lapis (folikel primer) kemudian akan menjadi dua
lapis (folikel sekunder).
Tahap III. Selama tahap ini, sel telur telah tumbuh semakin besar ukuran mencapai
antara 40-200 µm, dan ditutup oleh folikel.
Tahap pertama perkembangan sel telur pada tiga tahap di atas merupakan tahap
pendahuluan, yang merupakan tahap awal akumulasi nutrien dalam perkembangan sel
telur ikan. Oleh karena itu, calon induk ikan selain ditempatkan pada lingkungan
yang cocok, juga harus mendapat pakan yang bergizi tinggi, agar kuantitas maupun
kualitas telur sesuai yang diharapkan.
Tahap IV : Selama tahap ini produksi dan akumulasi kuning telur dimulai, proses ini
disebut vitellogenesis. Telur terus berkembang sampai mencapai ukuran
200-350µm sebagai akibat dari akumulasi materi lipoid dalam
sitoplasmanya.
Tahap V: Tahap ini dinamai fase vitelogenesis kedua; sitoplasma sekarang penuh
butiran lipoid dan kuning telur. Telur telah mencapai ukuran 350-500 µm.
Tahap VI:Tahap ini adalah fase vitelogenesis ketiga; pada fase ini kuning telur
mendesak butiran lipoid ke arah tepi dari sel, dan sekarang lingkaran
kedua mulai dibentuk. Inti sel membentuk membran yang disintesis dari
13 Tahap VII:Proses vitelogenesis telah selesai dan ukuran telur mencapai 900-1.000
µm. Pada saat akumulasi kuning telur selesai, nukleolus masuk ke tengah
inti. Pada tahap ini mikrofil (lobang masuknya spermatozoa) mulai
berkembang. Tahap ini disebut fase dorman atau fase istirahat karena
sampai beberapa bulan sel telur tidak mengalami perubahan, menunggu
kondisi lingkungan baik. Apabila kondisi lingkungan telah memungkinkan
maka induk-induk tersebut akan berovulasi, sebaliknya kalau kondisi tidak
memungkinkan ovulasi maka sel-sel telur tadi akan diserap kembali.
Tahap IV,V,VI,VII merupakan tahap vitellogenesis maka calon induk ikan selain
ditempatkan pada lingkungan yang cocok, juga harus diberikan pakan yang bergizi
tinggi, agar kuantitas maupun kualitas telur sesuai yang diharapkan. Menurut Linhart
et al. (1995) komposisi telur ikan mas terdiri atas 64,9-75% air, 17,6-27,7% protein
2,2-7,3 lemak dan 1,4-2.2% abu.
Peranan estradiol-l7β dalam perkembangan oosit (vitellogenesis)
Perkembangan oosit terjadi karena peran dari Gonadotropic Hormone (GTH)
atau gonadotropin. GTH yang berperanan dalam aktivitas gonad adalah follicle
stimulating hormone (FSH) dan Luteinizing hormone (LH). Setiap jenis hormon tadi
terdiri atas dua sub unit glikoprotein. FSH bertanggung jawab terhadap
perkembangan oosit (vitelogenesis) dan LH sebagai pemicu kematangan oosit
(Nagahama 1987 dan Nagahama et al. 1995).
Ikan mas koki merupakan jenis ikan multi spawner yaitu dalam satu musim
pemijahan terjadi memijah beberapa kali, sehingga dalam ovariumnya terdapat
berbagai tingkatan oositnya, hal ini terjadi karena FSH dan LH pada ikan mas koki
disintesis pada setiap tahapan pertumbuhan gonad (Yoshiura et al. 1997). Menurut
Fostier et al. (1983) empat hari setelah ovulasi maka akan mulai terlihat terjadi
peningkatan GTH. Hal tersebut terjadi karena estradiol 17β juga mulai meningkat. Besarnya kandungan estradiol-17β dalam plasma darah pada ikan salmon pada tahap
awal vitelogenesis sebesar 10 ng/ml terus meningkat sampai pada tahap akhir
14 pada ikan cod tahap vitelogenesis berkisar antara 6,2-30 ng/ml (Kjesbu et al. 1996).
Adapun konsentrasi estradiol-l7β di dalam darah pada ikan coho salmon (Oncorhynchus kisutch) tahap vitelogenesis berkisar antara 7,69-13,80 ng/ml (Afonso
et al. 1999a ). Menurut Afonso et al. (1999b), konsentrasi estradiol-17β pada ikan coho salmon yang siap memijah berkisar antara 28,60-45,30 ng/ml. Kadar
estradiol-l7β yang semakin tinggi akan memacu meningkatkan GTH dan VTG akibatnya oosit tumbuh maksimal.
Peningkatan estradiol-17β akan merangsang hati untuk memproduksi vitelogenin (VTG) kemudian dirembeskan kedalam darah dan akan didesposisikan
kedalam oosit (Gambar 2). Adapun proses masuknya vitelogenin (VTG) kedalam
oosit dijelaskan Rodriguez et al. (1996) sebagai berikut. Vitelogenin masuk kedalam
oosit melalui cara endositosis spesifik protein. VTG disintesis didalam hati secara
kontinyu, dan merupakan bahan utama prekursor kuning telur. Vitelogenin yang di
sintesis di dalam hati, untuk mencapai ovari melalui aliran darah dan secara selektip
diambil pada saat pertumbuhan oosit, dan masuk kedalam folikel oosit melalui
pembuluh kapiler yang terletak di dalam sel teka. VTG mencapai germinal sel
melewati basal lamina, ruang antar sel granulosa, dan kemudian masuk ke dalam
ekstra seluler dari epitel granulosa, dan terus melewati oosit microvillosites dalam
saluran zona radiata sampai oolemma.
Matsubara dan Sawano (1995) yang menyatakan bahwa pada ikan Barfin
flounder, VTG masuk kedalam oosit dalam tiga bentuk yaitu lipovitelin dengan berat
molekul 410 kDa, fosvitin 38kDa dan β-komponen 19kDa, pada saat maturasi MIH mengaktifkan enzim proteolitik sehingga akan menyebabkan terjadinya pembelahan
VTG menjadi lipovitelin 170 kDa, akibatnya oosit mempunyai substrat sebagai
energi aerobik untuk osmotik pada saat hidrasi dan awal perkembangan embrio.
Penumpukan kuning telur dilakukan terus menerus sampai sel telur atau ovum
mencapai ukuran tertentu, setelah sel telur mencapai ukuran tertentu maka inti sel
akan ditarik ke tengah, dan telur mengalami masa istirahat (fase dorman), pada fase
15 alamiah ditentukan oleh musim. Ukuran diameter telur ikan mas koki sekitar 0,7 mm
(Kafuku dan Ikenoe, 1983).
Gambar 2. Proses perkembangan oosit ikan (Sumber Matsubara dan Sawano, 1995)
Peranan testosteron dalam proses pematangan oosit
Gonadotropin merangsang sel-sel teka melalui sistem cAMP untuk
memproduksi testosteron. Testosteron yang terbentuk akan dikonversi menjadi
estradiol-17β di dalam sel granulosa melalui aktivasi aromatase. Keberadaan estradiol-l7β menyebabkan terjadinya perkembangan oosit, semakin tinggi produksi estradiol-l7β menyebabkan oosit berkembang semakin besar, dan akan terjadi umpan balik negatif terhadap gonadotropin terutama FSH dan umpan balik positif terhadap
LH. Penurunan FSH menyebabkan terjadi penurunan aktivitas aromatase akibatnya
16 Menurut Joy et al. (2000) penyuntikan testosteron 0,25 dan 0,5 μg/g b.t pada Clarias batrachus betina setiap hari menyebabkan peningkatan LH pada minggu ke empat hal
ini berarti terjadi umpan balik positip, sedangkan pada dosis 1 μg/g b.t. justru terjadi umpan balik negatif.
Menurut Zairin (1993) penyuntikan hCG pada ikan lele akan menyebabkan
terjadinya peningkatan produksi testosteron, dan mencapai puncaknya 38,3 ng/ml
setelah 4 jam penyuntikan, kemudian terjadi penurunan yang diikuti peningkatan
produksi 17α-21β-dihidroksiprogesteron yang mencapai puncak produksi setelah l2 jam penyuntikan. Setelah itu terjadi GVBD (germinal vesicle break down), yang
diikuti ovulasi.
Peranan Aromatase dan Inhibitor Aromatase dalam Pematangan Oosit
Aromatase merupakan anggota dari sitokrom P450 yang berisi enzim
kompleks. Enzim ini mengkatalisis tahap akhir proses pembentukan estrogen yaitu
hidrosilaksi androstenedion menjadi estron dan testosteron menjadi estradiol-17β.
Aktivitas enzim ini dapat dilihat didalam ovari, jaringan adiposa, plasenta, otak, otot,
fibroblas, osteoblas, hati dan payudara. (Holzer et al. 2006).
Seiring dengan perkembangan oosit di dalam folikel ovarium maka
gonadotropin .juga berpengaruh terhadap biosintesis hormon-hormon steroid. Proses
biosintesis hormon steroid dimediasi oleh hidroksisteroid dehidogenase dan sitokrom
P-450.
Nagahama et al. (1995) menyatakan bahwa dalam biosintesis hormon steroid di
dalam sel teka dan sel granulosa ikan salmon, telah diidentifikasi adanya tiga buah
hidroksisteroid dehidrogenase dan empat buah sitokrom. Fungsi dari masing-masing
hidroksisteroid dehidrogenase adalah sebagai berikut :
1. 3β-hidroksisteroid dehidrogenase-isomerase (3β-HSD), berperan dalam pem-bentukan progesteron dari pregnenolon.
17 3. 17β-hidroksisteroid dehidrogenase (l7β-HSD), berperan mengubah androstenedion
menjadi testosteron.
Sedangkan fungsi masing-masing sitokrom dalam biosintesis steroid adalah
sebagai berikut :
l. P-450scc atau cholesterol side-chain clevage sitokrom P-450, berperan dalam pembentukan pregnenolon dari kholesterol.
2. P-45017α atau P-450 17α hidrolase, berperan dalam pembentukan l7α hidroksi
progesteron dari progesteron.
3. P-45017,20 lyase atau P-450 17,20 lyase berperan dalam pembentukan
androste-nedion dari 17α hidroksi progesteron.
4. P-450 arom atau aromatase sitokrom P-450, berperan dalam pembentukan estradiol
l7β dari testosteron.
Pada hewan mamalia, Fitzpatrick et al. (l997) menyatakan bahwa aktivitas
P-450arom di dalam sel granulosa dirangsang oleh folikel stimulating hormone (FSH),
dan aktivitas p-450arom pada mamalia menurun drastis apabila ditambah dengan
luteinizing hormone (LH). Sumber hormon yang memiliki potensi LH yang amat kuat
adalah hCG/human chorionic gonadotropin (Partodihardjo, l987). Hormon ini telah
digunakan untuk induksi ovulasi pada beberapa jenis lele Afrika (Eding et al. 1982;
Mollah dan Tan, 1983). hCG juga digunakan untuk merangsang ovulasi pada Clarias
butrachus (Zairin, 1993), serta untuk merangsang ovulasi ikan mas koki Carassius
auratus (Carman, 1992).
Aktivitas aromatase pada ikan, meningkat dan mencapai puncaknya pada
pascavitelogenesis, setelah mencapai pascavitelogenesis produksi estradiol-17β akan menurun drastis, demikian juga aktivitas aromatase. (Nagahama et al, 1995).
18 Inhibitor aromatase (IA) suatu zat non steroid yang dapat digunakan untuk
menghambat/menghentikan aktivitas enzim aromatase. Menurut Kitano et al. (2000)
penggunaan inhibitor aromatase menyebabkan tertekannya ekpresi gen P-450 arom,
sehingga produksi estrogen berkurang dan produksi testoteron meningkat.
Beberapa tahun terakhir ini aromatase inhibitor telah digunakan sebagai
perlakuan tambahan dalam mengobati kanker payudara. Anastrozole dan letrozole
merupakan jenis inhibitor aromatase pada dosis 1-5 mg mampu menurunkan level
estradiol-17β sebanyak 97-99%, dan mempunyai waktu paruh berkisar antara 30-60 jam, serta mampu dimetabolisme didalam hati (Holzer et al. 2006).
Inhibitor aromatase mampu membloking produksi estrogen dengan
menghambat proses aromatisasi pada hipothalamus-hipophisis-gonad axis dari umpan
balik negatif estrogen, hasilnya sekresi FSH meningkat merangsang perkembangan
ovari sampai terjadinya ovulasi, sehingga IA dapat digunakan sebagai induksi ovulasi
(Holzer et al. 2006 dan Casper dan Mitwally, 2006). Karena kemampuan IA
membloking produksi estrogen dengan menghambat proses aromatisasi pada
hipothalamus-hipophisis-gonad axis dari umpan balik negatif estrogen dengan
hasilnya sekresi FSH meningkat, maka IA dapat digunakan sebagai perlakuan
tambahan dengan gonadotropin (Holzer et al. 2006 dan Casper dan Mitwally, 2006).
Penggunaan IA dengan gonadotropin untuk induksi ovulasi mampu menurunkan
dosis pada penggunaan gonadotropin (Casper dan Mitwally, 2006). Menurut Casper
dan Mitwally (2002) menyatakan bahwa IA meningkatkan kemampuan respon
ovarium terhadap folikel stimulating hormon.
Menurut Afonso et al. (1999b.) penyuntikan inhibitor aromatase dengan dosis
l0,00 mg/kg pada induk ikan coho salmon siap memijah, menurunkan produksi
estradiol-l7β setelah penyuntikan, produksi testosteron meningkat mencapai puncaknya atau sebesar 294 ng/ml setelah 96 jam setelah penyuntikan, produksi
17α,20βdihidroksi-4-pregnen-3-one (l7α,20β-DP) mulai meningkat pada 6 jam setelah penyuntikan, dan rnencapai puncaknya atau sebesar 733,4 ng/ml 192 jam
setelah penyuntikan. Pada hari ke-l0 setelah penyuntikan mulai terjadi ovulasi
19 Penyuntikan induk ikan coho salmon (Oncorhynchus kisutch) pada tahap
vitelogenesis menurut Afonso (1999a) menurunkan estradiol-17β, meningkatkan 17α,20β-dihidroksi-4-pregnen-3-one (17α,20β-DP) dan testoteron. Juga terjadi penghambatan perkembangan oosit, serta banyak ditemui oosiot yang mengalami
atresi. Atresi juga terjadi apabila gonad kekurangan hormon gonadotropin
(Woynarovich dan Horvath, 1981). Hong dan Donaldson (1998) menyatakan bahwa
implantasi IA dengan dosis 100mg/kg berat tubuh pada 44 hari perlakuan telah terjadi
atresi pada gonad ikan coho salmon. Menurut Carnevali et al. (1999) menyatakan
bahwa oosit kuning telur dapat dipecah kemudian diserap kembali karena aktivitas
enzim proteolitik, enzim proteolitik cathepsin B dan D mulai ditemukan pada oosit
ikan kakap yang berukuran 0,2-0,3 mm atau pada tahap awal vitelogenesis, dan
cathepsin L mulai ditemukan pertengahan vitelogenesis sampai akhir vitelogenesis.
Peranan Gonadotropic Hormone (GTH ) dalam Pematangan Oosit
a. Peranan Gonadotropic hormone (GTH) sebagai media primer dalam
pematangan oosit
Pada berbagai spesies ikan termasuk ikan mas koki, ikan mas dan sejumlah
ikan teleos lainnya, gonad dapat dirangsang untuk matang dan berovulasi dengan
penyuntikan gonadotropin dari berbagai sumber. Menurut Nagahama (1994) dan
Nagahama et al. (1995) proses pematangan oosit terjadi akibat rangsangan
gonadotropin pada folikel, kemudian terjadi proses pembentukan hormon-hormon
steroid. Pada sel theka membentuk 17α-hidroksiprogesteron dan pada sel granulosa terbentuk I7α,20β-dihidroksi-4-pregnen-3-one, dan hormon steroid yang terakhir inilah yang mempunyai peranan sebagai mediator kematangan oosit
lebih lanjut.
b. Maturation-Inducing Hormone (MIH) sebagai mediator kedua pada
pematangan oosit
Pada sejumlah spesies ikan teleos, telah dapat ditunjukkan secara in vitro
bahwa hormon steroid C21 mempunyai potensi sebagai insiator untuk merangsang
20 ternyata mampu merangsang terjadinya kematangan oosit. Yamashita (2000);
(Nagahama, 1997) menyatakan bahwa hormon steroid yang berperan dalam
merangsang GVBD pada oosit disebut Maturation-lnducing Hormone (MIH),
MIH merupakan suatu hormon steroid misalnya 17α, 20B-dihidroksi-4-pregnen-3-one, yang akan berinteraksi dengan suatu ikatan reseptor membran pada
permukaan oosit. MIH diterima pada permukaan masuk kedalam sitoplasma
dengan bantuan GT'P-binding protein (G-proteins), rangsangan MIH pada
akhirnya akan menghasilkan, membentuk dan mengaktifkan apa yang disebut
Maturation-Promoting Factor(MPF).
Banyak sekali hormon steroid C21 namun menurut Nagahama et al. (1995)
yang telah diidentifikasi oleh para peneliti secara natural yang dapat berfungsi
sebagai maturation-inducing hormone (MIH) pada ikan antara lain l7α,20β -dihidroksi-4-pregnen-3-one (l7α,20β-DP) dalam amago salmon (Nagahama dan Adachi 1985); 17α,20β,21-trihidroksi-4-prenen-3-one (20β dihidro-11-deoxy-cortisol, 20β-S) pada ikan Atlantic croaker (Micropogonias undulatus) dan spotted seatrout (Cynoscion nebulosus) (Trant et al. 1986; Trant dan Thomas,
1988, 1989; Thomas dan Trant, 1989). Testosteron merupakan steroid C19 juga
dapat merangsang terjadinya GVBD pada konsentrasi yang tinggi, sedangkan
estradiol-l7β dan steroid C18 lainnya secara umum tidak efektif dalam
merangsang kematangan oosit pada ikan.
c. Maturation-Promoting Factor (MPF) sebagai mediator ketiga pada kematangan oosit
Yamashita et al. (1995); Yamashita (1998); Yamashita et al. (2000);
Yamashita (2000) menyatakan bahwa Maturation-Promoting Factor (MPF)
merupakan kompleks dari Cdc2 (suatu sub unit katalitik) dan cyclin B (suatu sub
unit regulator/pengatur). Lebih lanjut dijelaskan bahwa aktivitas MPF dikontrol
oleh modifikasi biokimiawi secara molekuler melalui penghambatan fosforilasi
dari Cdc2 pada threonin 14/tyrosin 15 (T14/Yl5) oleh Weel dan Myt 1, dan
21
kinase aktivating kinase atau CAK setelah itu kemudian akan terbentuk suatu
ikatan kompleks dari Cdc2 dan cyclin B.
MPF rnemberikan aksi yang dominan dalam merangsang proses mitosis
M-phase pada semua sel eukariotik. MPF disimpan di dalam oosit yang belum
matang dalam bentuk inaktif yang disebut pra-MPF, namun kelimpahannya di
dalam oosit berbeda dari satu species ke species lainnya. Sebagai contoh,
menurut Yamashita et al. (1995), oosit ikan mas koki yang belum matang
(immature) hanya berisi monomerik 35-kDa cdc2 dalam keadaan tidak aktif,
sedangkan cyclin B tidak ada, adapun jumlah monomerik 35-kDa cdc2 mendekati
1,5 μM. Tetapi pada oosit sejenis katak Afrika Xenopus laevis menurut
Yamashita (2000) terdapat pra-MPF (cdc2 dan cyclin B) yang melimpah sehingga
cukup dapat menyebabkan kematangan oosit. Oosit tikus berisi pra-MPF yang
sangat terbatas, namun masih cukup untuk melangsungkan GVBD tetapi tidak
untuk proses kematangan oosit lebih lanjut, dan oosit dari ikan dan amfibi selain
katak Afrika Xenopus laevis tidak terdapat pra-MPF. Hasil penelitian pada
kematangan oosit terdapat kejadian yang menunjukkan bahwa oosit yang berisi
pra-MPF cukup untuk kematangan oosit; ternyata MPF baru harus dibuat untuk
memberikan rangsangan awal kematangan oosit walaupun pada saat yang sama
pra-MPF melimpah, pra-MPF dibentuk melalui proses de novo dari cyclin B yang
dirangsang oleh MIH selama proses kematangan oosit pada kondisi normal.
Mekanisme molekuler pembentukan MPF selama proses pematangan oosit
bervariasi dari satu spesies ke spesies lainnya, walaupun strukturnya ada di dalam
setiap sel eukariotik.
d. Mekanisme Pertumbuhan, Pematangan dan Ovulasi Oosit
Mekanisme hormonal untuk vitelogenesis, pematangan serta ovulasi oosit
melibatkan Gn-RH, gonadotropin, estradiol-l7β, testosteron, 17α-20β dihidroksiprogesteron, dan aromatase. Gonadotropin merangsang sel-sel teka
melalui sistem cAMP untuk memproduksi testosteron. Testosteron yang
22 aktivasi aromatase. Keberadaan estradiol-l7β menyebabkan terjadinya umpan balik positif terhadap GTH, pada awal perkembangan oosit setelah ovulasi terjadi
peningkatan GTH diikuti peningkatan estradiol-l7β (Fostier et al. 1983), semakin tinggi produksi estrogen menyebabkan oosit berkembang semakin besar (Afonso
et al. 1999a; Kjesbu et al. 1996; Nagahama et al. 1995). Estradiol-17β akan merangsang hati untuk memproduksi vitelogenin (VTG), dirembeskan kedalam
darah dan akan didesposisikan kedalam oosit (Gambar 2). Dipihatk lain estradiol
-17β yang semakin tinggi akan menyebabkan umpan balik negatif terhadap FSH dan umpan balik positif terhadap LH. Umpan balik negatif terhadap FSH ber
akibat pada penurunan aktivitas aromatase yang diikuti penurunan produksi
estradiol-17β. Puncak aktivitas aromatase pada ikan tercapai pada pascavitelogenesis, setelah mencapai pascavitelogenesis aktivitas aromatase akan
menurun drastis yang diikuti penurunan produksi estradiol-17β (Nagahama et al.
1995). Akibat aktivitas aromatase yang menurun terjadi penumpukan testosteron,
sehingga terjadi umpan balik positip terhadap gonadotropin terutama LH (Joy et
al. 2000).
Menurut Nagahama (1994) dan Nagahama et al. (1995) proses pematangan
oosit terjadi karena rangsangan LH pada folikel, kemudian terjadi proses
pembentukan hormon steroid, pada sel theka membentuk 17α -Hidroksiprogesteron dan pada sel granulosa terbentuk I7α,20β -Dihidroksi-4-pregnen-3-one, dan hormon steroid yang terakhir inilah yang mempunyai peranan
sebagai mediator kematangan oosit lebih lanjut. Menurunnya produksi
estradiol-17β dan aktivitas aromatase, ternyata diikuti peningkatan testosteron, l7α,20β -dihidroksi-4-pregnen-3-one (17α,20β-DP) sehingga oosit mengalami GVBD dan berakhir pada ovulasi.
Ovulasi terjadi karena peran dari hormon adrenalin dan prostaglandin,
mekanisme ovulasi menurut Epler (1981) menyatakan bahwa setelah sel telur
masak, maka tanda kematangannya disampaikan ke pusat syaraf, kemudian dari
23 hormon adrenalin ini akan ikut merangasang selaput folikel (follicle envelope)
mensintesa prostaglandin F2α (PGF2α). Dengan adanya prostaglandin F2α ini maka terjadilah kontraksi folikel, sehingga terjadilah ovulasi.
DAFTAR PUSTAKA
Afonso LOB, Iwama GK, Smith J, Donaldson EM.1999a. Effect of aromatase inhibitor fadrozol on plasma sex steroid secretion and oocyte maturation in female coho salmon (Onchorynchus kisutch) during vitellogenesis. Fish Physiol. Biochem 20 : 231-241.
Afonso LOB, Iwama GK, Smith J, Donaldson EM.1999b. Effect of aromatasc inhibitor fadrozol on plasma sex steroid secretion and ovulation rate in female coho salmon, Onchorynchus kisutch close to final maturation. Gen Comp Endocrinol 113: 221-229.
Andrews C. 1987. A Fishkeeper's Guide To Fancy Goldfishes. Salamander. Books Ltd. Published by Tetra Press, 201 Tabor Road, Morris Plains. New Jork..
Axelrod H, Burgess L. 1973. Breeding Aquarium Fishes. TFH Publications Inc. Ltd.
Carnevali O, Carletta R, Cambi A, Vita A, Bromage N.1999. Yolk Formation and Degradation during Oocyte Maturation in Seabream Sparus aurata: Involvement of Two Lysosomal Proteins. Biol of Reprod 60: 140-146
Casper R, Mitwally, MFM. 2006. Aromatase inhibitor for ovulation induction. J Clinic Endocrinol Metabol. 91, 3: 760-771.
Director General of Aquaculture. 2001. Present status and the development of aquaculture in Indonesia. Seminar Akuakultur Indonesia 2001 Tgl.30-31 Oktober 2001 Di Semarang.
Eding EH, Jonssen JAL, Staarman GHJK, Richter CJJ, 1982. Effects of human chorionic gonadotropin (hCG) on maturation and ovulation of oocyte in the catfish Clarias hazepa (C & V). Proceedings of the Intemational Symposium on Reproductive Physiology of Fish. Wageningen, Netherlands. hlm: 195.
24 Fostier A, Jalabert B, Billard R, Breton B, and Zohar Y. 1983. The gonadal steroids.
in : Fish Physiology edited by W.S. Hoar, D.J. Randall, E.M. Donalson. Volume IX. Academic Press. Inc. pp .277-372.
Fritzpatrick L, Susan LC, Diana LR, Richards JS. 1997. Expression of aromatase in the ovary: Down-regulation of mRNA by the ovulatory luteinizing hormone surge. Steroids 62 : 197-206.
Harvey BJ, Hoar WS. 1979. The theory and practice of induced breeding in fish. National Research Council of Canada, Ottawa.
Holzer H, Casper RF, Tulandi T. 2006 A new era in ovulation induction. Fertil Steril
85. 2: 277-284.
Hong W, Donaldson EM. 1998. Effect of the aromatase inhibitor fadrozole on gonadal development in coho salmon, Oncorhynchus kisutch. Asian Fisheries Science 10 : 339-345.
Joy KP, Singh MS, Senthilkumaran B, Goos HJTh. 2000. Gonadal relationship in the Catfish Clarias batrachus (L) : A study correlating gonadotropin-II and sex steroid dynamics. Zoo. Sci 17: 395-404.
Kafuku T, Ikenoue H. 1983. Modern Methods of Aquaculture in Japan. Goldfish (Carussius auratus) Culture. Elsevier Scientific Pub. Co.
Katsu Y, Yamashita M, Nagahama Y. 1999. Translational regulation of cyclin B mRNA by l7α,20B-dihydroxy-4-pregnen-3-one (maturation-inducing hormone) during oocyte maturation in a teleost fish, the goldfish (Carassius auratus). Mol and Cell Endocrinol 158 :79-85.
Kitano T, Takamune K, Nagahama Y, Abe SI. 2000. Aromatse inhibitor and 17α -methyltestosterone cause sex reversal from genetical females to phenotypic males and suppresion of P450 aromatase gene expression in Japanese Flounder (Paralichthys olivaceus). Mol Reprod Dev 56:1-5.
Kjesbu OS, Kryvi H, Norberg B. 1996. Oocyte size and structure in relation to blood plasma steroid hormones in individually monitoried, spawning Atlantic cod. J Fish Biol 49 :1197-1215.
Lam TJ. 1985. lnduce Spawning in Fish. Work Shop on the reproduction culture of milk fish. Oceanic Institut Hawaii.
25 Matsubara T, Sawano K. 1995. Proteolytic Cleavage of vitellogenin and yolk protein
during vitellogenin up take and oocyte maturation in Barfin Flounder (Verasper moseri). J Exp Zool 272: 34-45.
Mitwally MFM, Casper RF. 2002. Aromatase inhibition improves ovarian response to follicle-stimulating hormone in poor responders. Fertil Steril 77 : 776-780.
Mollah MFA, Tan ESP. 1983. HCG induced spawning of the catfish, Clarias macrocephalus (Gunther). Aquaculture 35: 739-247.
Nagahama Y. 1994. Endocrine regulation of gametogenesis in fish. Int. J. Dev. Biol.
38 : 217-229.
Nagahama Y. 1987. Gonadotropin action on gametogenesis and steroidogenesis in teleost gonads. Zool Sci 4 :209-222.
Nagahama Y. 1997. I7α,20β-dihydroxy-4-pregnen-3-one, a maturation-inducing hormone in fish oocytes. Mechanisms of synthesis and action. Steroid 62 : 190-196
Nagahama Y, et al. 1995. Regulation of oocyte growth and maturation in fish. Dev Biol 30 : 103-145
Paradise P. 1988. Goldfish. T.F.H. Publications. Inc.
Partodihardjo S. 1987. Ilmu Reproduksi Hewan. Mutiara Sumber Widya. Jakarta.
Putro Sumpeno et al. 2004. Direktori Ikan Hias. Cet 1. Jakarta: Penebar Swadaya.
Redding JM, Patino R. 1993. Reproductive Physiology in DH Evans (Ed.) The Physiology of Fishes. CRC Press, Boca Raton Ann Arbor London Tokyo.
Rodriguez JN, Bon E, Le Menn. F, 1996. Vitellogenin Receptors during vitellogenesis in the rainbow trout Oncorhynchus mykiss. J Exp Zool 174 : l63 - 170
Smith LS. I982. Introduction to Fish physiology. T.F.H. publications, Inc. England.
Woynarovich E, Horvath L. 1980. The Artificial Propagation of Warm Water Finfishes. A Manual Extension. Food And Agriculture. Organization of The United Nation.
26 Yamashita M. 1998. Molecular mechanisms of meiotic maturation and arrest in fish
and amphibian oocytes. Cell Dev Biol 9 : 569-579
Yamashita M, Mita K, Yoshida N, Kondo T. 2000. Molecular mechanisms of the initiation of oocyte maturation : general and species-species aspects. Cell Cycle Research 4 : 115-129
Yamashita M. 2000. Toward modeling of a general mechanism of MPF formation during oocyte maturation in vertebrates. Zoo Sci l7 : 841-851
Yoshiura Y, Kobayashi M, Kato Y, Aida. K., 1997. Molecular cloning of the cDNAs encoding two gonadotropin β sub unit (FSH-Iβ and LH-IIβ) from the goldfish,
Carassius auratus.Gen Comp Endocrinol 105 : 379-389.
27
PENGARUH ESTRADIOL - 17β DAN KEHADIRAN PEJANTAN
TERHADAP PERKEMBANGAN OOSIT DAN OVULASI PADA IKAN MAS KOKI (Carassius auratus).
ABSTRAK
Penelitian ini bertujuan untuk memacu pertumbuhan oosit dengan menggunakan estradiol-17β. Dosis yang digunakan adalah k= kontrol (disuntik minyak ikan), Pl = 100 μg/kg berat tubuh (b.t), P2 = 200 μg/kg b.t., P3 = 400 μg/kg b.t., dan P4 = 800 μg/kg b.t. Perkembangan oosit dianalisis berdasarkan kandungan protein di dalam gonadnya. Ikan dikorbankan secara acak untuk diambil gonadnya, mulai dari awal perlakuan kemudian setiap tiga hari sekali, yaitu hari ketiga; keenam; kesembilan; dan ke-12. Untuk pengamatan daya fertilitas dan daya tetas telur ikan dirangsang dengan memasukkan pejantan pada hari ke-12 dengan rasio jantan dan betina 2:1. Setelah ikan terlihat berovulasi lalu diangkat, kemudian dilakukan striping. Telur yang dihasilkan ditampung dan ditambahkan spermatozoa, sebanyak 100 butir telur diamati, kemudian dihitung persentase daya fertilitas telur dan daya tetas telurnya. Hasil penelitian menunjukkan bahwa dosis perlakuan estradiol-17β yang diberikan dapat mempercepat pertumbuhanan oosit, waktu ovulasi tercepat dicapai pada dosis 200µg yaitu 313,60±13,14 jam dengan hasil daya fertilitas dan daya tetasnya masing-masing sebesar 91,88±2,77% dan 85,84±0,83%.
Kata kunci: estradiol-17β, perkembangan oosit. kandungan protein gonad, daya fertilitas, daya tetas telur
EFFECT OF ESTRADIOL - 17β AND THE PRESENCE OF THE MALE
ON OOCYTE DEVELOPMENT AND OVULATION IN GOLDFISH (Carassius auratus)
ABSTRACT
The aim of this research to know the optimal dose of estradiol 17ß for oocyte development in goldfish. The dose used were k= control ( injected by fish oil), Pl = 100 µg/body weight (b.w.), P2 = 200 µg/b.w., P3 = 400 µg/b.w., and P4 = 800 µg/b.w. The oocyte development was evaluated by measuring the protein level in gonad. Fish were randomly selected and killed for gonad examination, starting at initial day then repeated every three days until the end of the experiment. To analysis the fertilization and hatching rate, females were stimulated by introducing the male at twelveth day, male and female ratio of 2:1. When the ovulation was detected female is taken then stripped to release the eggs. There after the eggs were collected and the spermatozoa was added to fertilize them. Approximately 100 pieces of eggs were analysed, then e fertilization of egg and hatching rate were determined. Results indicated that all dosis treatment was given for oocyte development, the shortest ovulation time was reached by dosis 200µg at 313,60±13,14 hours, with fertilization and hatching rate were 91,88±2,77% and 85,84±0,83%. respectively.
28
PENDAHULUAN
Sampai saat ini upaya untuk memproduksi ikan mas koki masih dilakukan dengan cara tradisional yang sederhana. Hasil penelitian di lapangan menunjukkan bahwa keberhasilan pemijahan dengan cara tradisional masih rendah. Kegagalan pemijahan diduga karena penyediaan induk yang benar-benar matang gonad siap pijah masih kurang. Oleh karena itu perlu dilakukan usaha mempersiapkan induk sebaik-baiknya agar kegagalan pembenihan dapat diatasi.
Induk ikan yang siap pijah adalah induk yang sudah matang gonad yaitu induk yang sudah menyelesaiakan fase vitelogenesis (Woynarovich dan Horvath, 1980). Secara alamiah perkembangan gonad dari fase pravitelogenesis menuju fase vitelogenesis dirangsang oleh peningkatan hormon estrogen di dalam darah. Sebagai gambaran pada ikan amago salmon besarnya kandungan estradiol-17β di dalam intak folikel pada tahap awal vitelogenesis berkisar sekitar 10 ng/ml, sedangkan pada tahap akhir vitelogenesis berkisar 5 ng/ml (Nagahama et al, 1995). Sementara itu, kandungan estradiol-17β pada ikan cod tahap vitelogenesis berkisar antara 6,2 - 30 ng/ml (Kjesbu et al. 1996). Pemberian estrogen eksogen dapat merangsang hati untuk mensintesis vitellogenin (Nagahama 1994). Pemberian estradiol-17β akumulatif sebanyak 5 mg/kg selama 15 hari pada ikan rainbow trout telah mampu meningkatkan reseptor vitellogenin, sehingga oosit dapat tumbuh pesat (Rodriguez et al. 1996). Menurut Sularto (2002) implantasi 400 μg/kg estradiol-17β cukup efektif untuk meningkatkan pertumbuhan gonad ikan Pangasius djambal.
29 pijah akan merangsang hipothalamus/hipofisisa untuk melepas hormon gonadotropin, melimpahnya LH akan merangsang pematangan oosit yang diikuti ovulasi. Dengan demikian pemberian Estradiol-17β sangat efektif dalam memacu pertumbuhan oosit.
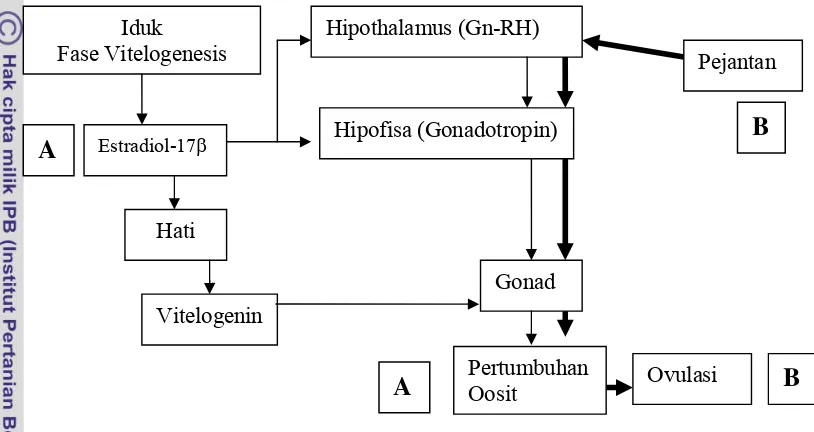
Iduk
Fase Vitelogenesis
A Estradiol-17β
Hati
Vitelogenin
Hipothalamus (Gn-RH)
Hipofisa (Gonadotropin)
Gonad
Pertumbuhan Oosit
Pejantan
Ovulasi
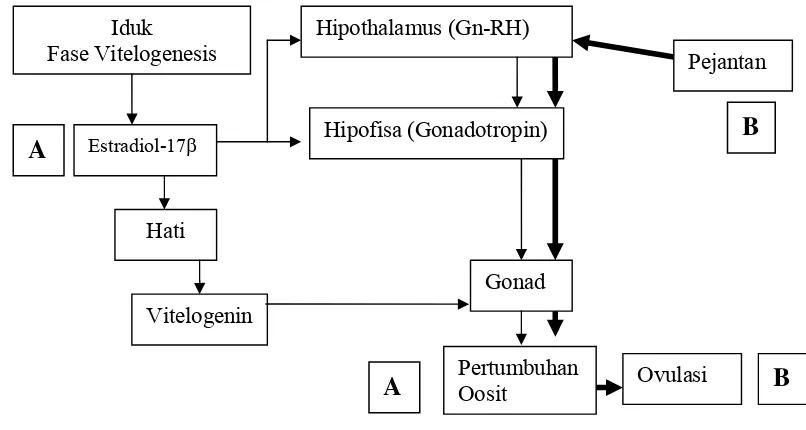
Gambar 3 Alur kerangka pemikiran penelitian pemberian estradiol-17β dan kehadiran pejantan
A
B
30
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian untuk pemeliharaan ikan dan pengamatan pemijahan dilakukan di holding ground ikan hias, Dinas Agribisnis Kota Bogor, di Desa Cipaku Rancamaya Bogor. Analisa protein gonad dilakukan di Laboratorium Penguji Balai Besar Penelitian dan Pengembangan Pasca Panen, Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian Bogor. Penelitian berlangsung mulai bulan Oktober 2003 sampai dengan Januari 2004.
Ikan Uji
Penelitian ini menggunakan ikan mas koki fase vitelogenesis. ikan yang digunakan diperoleh dari petani ikan di desa Ciseeng, Kecamatan Parung. Kabupaten Bogor. Ikan terpilih selanjutnya dipelihara dan dipersiapkan di akuarium holding ground ikan hias Dinas Agribisnis Kota, di Desa Cipaku Bogor.
Pakan
Selama tahap persiapan ikan diberi pakan pelet dengan kandungan protein 35%, dan jumlah pakan diberikan 5 % dari berat tubuh ikan, diberikan tiga kali per hari.
Wadah Pemeliharaan
Sebagai wadah pemeliharaan ikan adalah akuarium dengan ukuran l00x 40x35 cm, sebanyak 10 buah dilengkapi dengan aerasi dan disifon setiap hari.
Bahan (hormon yang digunakan)
Hormon estradiol yang digunakan adalah estradiol-17β diproduksi oleh Argent Laboratorium Inc; Makati Philippines. Untuk pelarut hormon digunakan minyak ikan lokal.