DISERTASI
KONSTRUKSI FUSI TRANSKRIPSI GEN KITINASE DARI
Aeromonas caviae
DAN EKSPRESINYA PADA
Pseudomonas fluoresceiti
Oleh
AMARLLA MALIK
PROGRAM
PASCASARJANA
DISERTASI
KONSTRUKSI FUSI TRANSKRIPSI GEN KITINASE DARI
Aerornonas caviae
DAN
EKSPRESINYA
PADA
Pseudomonas fluorescens
'Oleh
AMARILA
MALIK
PROGRAM
PASCASAWANA
". .
.plXzli
meninggit&an orang yang
6eriman
diantara
&mudan orang-oraw
yang di6eri
$mupengetahuan, 6e6erapa
derajat
. . .
"@ l % ~ ~ ~ M d a h l i
: 1 I )ABSTRACT
Chitinase gene (chi) fiom A e r o m o w m i a e WS%, which was cloned previously in pUC19 based plasmid vector, has been sequenced. Its completed
nuceleotide sequence was determined. The structural gene consists of 2.937 bp with an ORF encoding 865 amino acids. DNA sequence analysis indicated that the gene was cloned without its indigenous promoter. Comparison to other chitinase genes in database shows that the deduced amino acid sequence was nearly identical (97%) to
chiA from A. caviae isolated fiom Israel. In this study, chi was cloned either under a strong constitutive promoter, i.e. P K ~ ~ , as a transcriptional fusion, or under an inducible strong promoter, Pfac. To introduce the gene fision/s into Pseudomonas
fluorescemfPf), the constructs were cloned into broad host range plasmid vectors
such as pRK415, pBBRlMCS2, and pVSP61. Chitinolytic expression of ~ ~ m ~ - c h i fUsion on chitin agar plate as clear zones could only be demonstrated in a
recombinant plasmid based on pBBRlMCS2 replicon, designated as pAM340.
pBBRlMCS2, which has higher copy number than the either pRK415 or pVSP61,
was used as a vector for the construction of Ptac-chi, which was designated as pAM630. A P ~ r n ~ - c h i fision in a suicide vector, pWTmini-TnS SplSm, has been constructed as well, and was designated as pAM520. Construction of pAM520 was
performed to obtain the chi fision clone that integrated into Pf chromosome, and
that will be stably maintained as a single copy number. From the three
transcriptional fusion recombinants, only Escherichia wIi harboring pAM520 recombinant could not demonstrated chitinolytic activity. To mobilize the chi fusion recombinant into PC gene tranfer was performed employing bacterial conjugation.
Based on the time of incubation required to display transparent zone on chitin agar
plate, the chi gene expression in Pf demonstrated much higher activity than when the same construct was present in E. colz. Chitinase activities were determined speckrophotometricaIly using colloidal chitin azure as a specific substrate. The
influenced by plasmid w p y number as shown in E. coli (pWS506), which expressed intracellular chitinase activity (4.17 U/mg protein) several folds higher than that of medium copy plasmid in
E.
coZi (pAM630) (1.05 U/mg protein). Pf5 100 (pAM630) overnight culture accumulated chitinase in the intracellular fraction which is threefolds higher (2.53 Ulmg protein) than the control strain. There was no significant chitinase activity in the extracellular fraction of PfS100 (pAh.4630). From these results, it could be concluded that the expression of chi was influenced by gene copy number of constructed gene, as well as the nature of bacterial host used in this
AMi4RE.A h4AL.X. Konstmksi h s i translcripsi gen kitinase dari Aeromonas caviae
dan ekspresinya pada Psetcdomonas fIuorescens. Di bawah bimbingan ANTONIUS SUWANTO sebagai ketua, dan berturut-tumt BUD1 TJAHJONO, MAGGY T.
SUHARTONO, INDRAWAT1 GANDJAR d m ED1 GUHARDJA sebagai anggota
komisi
.
Penelitian tentang gen kitinase dan pemanfaatannya telah banyak dilakukan. Gen kitinase berpotensi antara lain untuk mengkonstruksi agens biokontrol terhadap ~ e n d a w a n patogen tanaman, selain untuk dimanfaatkan ddam stud1 regulasi dan
ekspresi gen, serta proses degradasi kitin. Gen kitinase yang diisolasi dari Aeromollas caviae rnasih belurn banyak dilaporkan jika dibandingkan dengan laporan tentang gen kitinase dari Serratia marcescens. Studi tentang kloning gen kitinase secara fisi transkripsi telah dilaporkan, namun sumber gen kitinase yang digunakan adalah gen kitinase dari S. marcescens. Di dalam penelitian ini gen kitinase (chi) dari A. cavzae isolat WS7b yang & i o n pada vektor berbasis pUC (pWS506) oleh peneliti sebelumnya, telah disekuens, dan sekuens nukleotida yang
diperoleh d i i a l i s i s dengan mernbandingkan dengan kitinase yang telah a& di ahtabase.
Konstruksi fisi transkripsi gen chi di daIam penelitian ini menggunakan vektor berspektmm inang has, yaitu pRK415, pBBRIMCS2, dm pVSP61. Ketiga vektor mempunyai karakter berbeda, yaitu dari jumlah kopi, penanda antibiotik,
ulcuran plasmid, situs endonuklease restriksi, dan kelompok inkompatibiiitas. Promotor untuk ekspresi gen chi yang digunakan di dalam penelitian ini adatah
promotor gen resistensi Kanamisin, P K ~ ~ , yang bersifat konstitutic yang diisolasi dari pUC4K, d m promotor hibrid trp-lac (Pfac) yang merupakan promotor kuat bersifat terinduksi, namun dalam keadaan tidak terinduksi bersifat konstitutif Konstruksi fbsi chi diintroduksi ke PseuCtOmo~s Jluorescem (Pf) gatur dan isolat biokontrol. Galur yang digunakan adalah B29, yaitu biokontrol balcteri patogen
Penelitian ini bertujuan untuk : (i) karakterisasi DNA gen chi dengan sekuensing, dan data sekuens yang diperoleh akan dibandingkan dengan kiti- kitinase yang sudah ada di &&base unntuk mempelajari kekerabatannya; (ii) mengkonstruksi gen chi sebagai fisi transkripsi di bawah prornotor ekspresi yang
konstitutie (iii) mengintroduksi k s i transkripsi chi ke P. fluorescens (Pf) isolat- isolat biokontrol ; (iv) menganalisis ekspresi gen chi pada isolat-isolat P f secara esei kualitatif dan esei kuantitatif.
Untuk mencapai tujuan tersebut telah dilalcukan serangkaian percobaan sebagai berikut, yaitu (i) sekuensing DNA gen chi dengan stmtegi subkloning d m
primer waiking. Data sekuens yang diperoleh dianalisis dengan program BLAST dari European Bioinformatics Institute, dan sekuens asam amino turunan diperoleh dengan program Swiss-Prot. Pembandingan dengan kitinase-kitinase yang sudah ada
dilakukan rnenggunakan program CIustaI-W, ((ii) konstruksi fbsi transkripsi P K ~ ~ - chi pa& vektor-vektor plasmid berspektrum inang luas, analisis ekspresi kitinolitik rekombinan-rekombinan di klon E. wi'i, dan intnwluksi rekombinan kitinolitik
(pAh.4340) ke isolat-isolat
Pf;
(iii) konstruksifusi
translcripsi pICmR-chi pada vektortransposon mini, pUTmini-Tn5 Sp/Sm, menghasilkan pAMS20, analisis ekspresi kitinolitik rekombinan di klon E. d i , dao introduksi pAM520 ke isolat-isotat
serta analisis keberadaan gen chi dengan metode amplifikasi; (iv) konstruksi fusi transkripsi Pfac-chi pada vektor berspektnun inang luas pBBRlMCS2, menghasilkan pAM630, analisis ekspresi kitinolitik rekombinan di klon E colt,
dan
introduksi pAM630 ke Pf5100; (v) esei aktivitas kitinase secara spektrofotometxi
rnenggunakan substrat spesifik Chitin Arure, serta mengukur konsentrasi protein total dari finksi ekstraselular dan intraselular.
Dari hasil sekuensing diperoleh selcuens nukleotida gen chi sepanjang 2.937 pasang bssa yang m e n y a n d i i 865 asam amino lmumm yang menunjukkan kemiripan sekuens DNA sangat tinggi (98%) dan kemiripan sekeuns asam amino
AGGA terletak 9 nukleotida mendahului kodon inisiasi transkripsi ATG. Pada ujung
karboksil terdapat tiga buah sekuens ulangan terbalik yang potensial membentuk struktur hairpin-loop sebagai terminasi transkripsi yang didahului oleh kodon terminasi translasi TGA.
E. coli yang membawa konstruksi fisi transkripsi pECmR-chi di pRK415 (p-30) dan pVSP61 (pAM430) tidak menunjukkan ekspresi kitinolitik medium agar-agar kitin yang diamati sampai 7 hari inkubasi, sedangkan fisi di pBBRlMCS2 fpAM330 dan pAM340f dapat mendegradasi kitin, namun tidak sekuat di inang
asalnya. Dari faktor jumlah kopi gen, pBBRlMCS2 mempunyai jumlah kopi lebih tinggi daripada pRK415 dan pVSP61. Introduksi pAM340 ke Pf B29 tidak berhasil memperoleh ekskonjugan yang kitinolitik. Introduksi pAM340 ke Pf 5200 berhasil
memperoleh ekskonjugan yang menunjukkan ekspresi kitinolitik yang &p lcuat
berupa wna bening setelah diinkubasi selama 9 hari. Hasil analisis ampiifikasi menunjukkan Pf B29 tidak membawa gen chi, sedangkan Pf 5100 membawa gen chi.
E. coli yang membawa h s i transkripsi ~ ~ m ~ - c h i di pUTmini-TnS Sp/Sm (pAM520) tidak menunjukkan ekspresi kitinolitik sampai 10 hari inkubasi.
Introduksi pAM520 ke Pf B29, Pf 5024 dan Pf 5100 dianalisis dengan asnplifikasi
gen chi menunjukkan bahwa gen chi tidak ada di dalam Pf B29, namun terbukti ada
di dalam Pf 5024 dan 5100. Ekspresi gen chi di Pf 5024 dan 5100 tidak terlihat sampai 10 hari inkubasi pa& medium agar-agar kitin.
E. coli yang membawa konstruksi fisi transhipsi Ptac-chi di pBBRlMCS2,
yaitu pAM630, menunjukkan ekspresi kitinolitiik setelah d i i b a s i selama 11 hari, namun zona bening yang dihasilkan lemah. Introduksi pAM630 ke Pf 5100 berhasil
memperoleh ekskonjugan kitinolitik yang culcup kuat dari munadnya zona bening setelah diinkubasi selama 7 hari.
Hasil esei aktivitas kitinase menunjukkan bahwa ekspresi fbsi chi di E c d i dipengaruhi oleh jumlah kopi plasmid sebagaimana yang ditunjukkan oleh E. cdi
KONSTRUKSI FUSI TRANSKRIPSI GEN KITINASE DAM
Aeromonas caviae DAN
EKSPRESINYA PADA
Pseudomonas fluorescens
Oleh
Disertasi
Sebagai saiah satu syarat untuk memperoleh gelar DOKTOR
pada Program Studi Biologi Program Pascasarjana Institut Pertanian Bogor
PROGRAM PASCASARTANA
INSTITUT PERTANLAN
BOGOR
JUDUL DISERTASI : KONSTRUKSI FUSI TRAlYSKRlPSI GEN KITINASE DARI Aeromunm &c DAN EBPRESINYA PADA
13eudomonmfZlcmescens
NAMA MAI-IASISWA : AlMARILA MALIK
NOMOR MAHASISWA: 95575
PROGRAM STUD1 : BIOLOGI
1. Komisi Pembimbing
Dr. Ir. Antonius Suwanto M Sc.
Ketua
no
Prof. Dr. Prof. Dr. Edi Guhardja
-~nggota Anggota
2. Ketua Program Studi Biologi ram Pas- Sa j a n a
A
Dr. Ir. Dedi Setiadi. MS
Penulis adalah anak kedua dari empat bersaudara putra-putri dari ayah Amir
Malik dan ibu Martha Amir, dilahirkan di Jakarta pada tanggal 3 Oktober 1964. Telah dikaruniai seorang putri Rizka h4aulida dan seorang putra Radhian Amandito dari suami
Rusli Yunus.
Penulis lulus pendidikan Sekolah Dasar (SD) di SD Adik Irma Suryani, Jakarta, bulan Desember tahun 1976, Iulus pendidikan Sekolah Menengah tingkat Pertama (SMP) di S M P Negeri I, Jakarta bulan Juni tahun 1980, dan lulus pendidikan Sekolah
Menengah tingkat Atas (SMA) di SMA Negeri 4, Jakarta bulan Juni tahun 1983. Pada tahun yang sama melanjutkan pendidikan ke Jurusan Farmasi, Fakultas Matematika dan
Ilmu Pengetahuan Alam (FhlIPA), Universitas Indonesia
0
melalui Proyek Perintis I.Lulus sarjana Farmasi pada bulan September tahun 1988, melanjutkan ke pendidikan
profesi Program Apoteker di Jurusan yang sama hingga iulus bulan Desember 1989.
Penulis melanjutkan pendidikan ke jenjang S2 pada tahun akademik 1991/1992 hingga lulus bulan Oktober tahun 1993 di Program Studi Farrnasi Pascasarjana fnstitut Teknologi Bandung dengan sponsor dari Tim Manajemen Program Doktor (TMF'D), Direktorat Pendidikan Tinggi (Dikti). Pada tahun akademik 1995/1996 penulis melanjutkan p e n d i d i i ke jenjang 53 di Program Studi Biologi Prognun Pascasajana Institut Pertanian Bogor dengan sponsor dari Beasiswa Unggulan (URGE) dari Bank
Dunia melalui Dikti. Sejak bulan Maret 1990 hingga sekarang menjadi s t a f pengajar
di
UCAPAN TERIMA KASIH
Syukur AlhamduliUah penulis ucapkan atas segala rahmat dan hidayah dari
Allah SWT atas s e l d y a pelaksanaan penelitii dan penulisan d i i
ini,
dan semoga m w a e t bagi pengembangan ilmu pengetahuan dan teknologi, khususnya di bidang Biologi.Dalam mehksanakan penelitian dan penulisan disertasi penulis telah mendapat bantuan dari berbagai pihak, baik bempa saran, kritik, dana, maupun bantuan moril dan d o a Pada kesemptan ini perkenankan penulis mengucapkan terima kasih yang tulus dan sebesar-besarnya kepada semua pihak yang telah memberikan bantuan
Kepada Dr. Ir. Antonius Suwanto, M.Sc., sebagai ketua komisi pembimbing yang telah ~nemberikan biibimgan, saran
dan
arahan mulai dari pemilihan mataajaran, penyusunan usulan penelitian, pelaksanaan penelitian sampai penulisan disertasi. Penghargaan yang tinggi penulis haturkan atas dorongan beliau yang
memotivasi penulis untuk rnenge- kemampuan bersikap mandiri, tekun, dan percaya diri dalam meneliti. Tidak lupa rasa terima kasih p u g besar atas kesempatan yang diperoleh
unNc
melakukan sebagian pekejaan penelitian ini di Scottish Agricultural College, The University of Edinburgh, dari Higher EducationLINK
Project, berjudd"Sustainable
crop protection to improve food production:tra~ " ' g technology h m m f ito practice'' dari DFID, The British Council,
dimanabeliau adalah salah seorang koordinator.
Kepada Dr. Ir. Budi Tjahjono, M-Agr., sebagai anggota komisi pembiiing yang telah membmhn b i i h g a n dan saran, serta kesempatan bergabung dalarn kelornpok peneliii H h h Tim (URGE) Project Grant
029/HTPP/WURGE/l996
"Construction of Biowntrol for B a c t d Disease in
Plants:
Genome AnalysiiPathogenesis, and Molecular Ecology of Xanthomonas campestris pv. gZycines",
sehingga mendapat bantuan dam yang b e r h g a untuk dapat mehksamkm dan
anggota komisi pemb'img yang telah rnemberhn birnbingan dan saran, serta
kesempatan melakukan sebagii pekerjaan peffilitian di Laboratorium Mikrobiologi dan Biokimia, Pusat Antar Universitas-Bioteknologi, IPB yang beliau kepalai. Kepada Prof. Dr. Indrawati Gadjar, sebagai anggota kornisi p e m b i i b ' i atas
bib'mgan dan saran, serta dukungan m o d yang kuat sebagai intelektual dan Guru
3esar FMIPA, Universitas Indonesia, tempat penulis bekeja sebagai staf pengajar. Kepada Prof. Dr. Edi Guhardja, sebagai anggota komisis pembimbing atas bimbmgan dan saran, serta kearifan dalam memberikan pandangan dan masukan
yang berguna bagi kesempurnaan suaiu disertasi.
Kepada Dr. Endang Purwantini, staf pengajar FMIPA Institut Teknologi Bandung, dan Dr. Anja Meryandini, staf pengajar FMIPA Institut Pertanian Bogor, sebagai penguji luar komisis, atas saran clan kritik yang menjadi masukan yang
IJ~rInanfaat agar disertasi ini menjadi kbih sempuma lagi
Kepada Direktur Program Pascasajana dan Ketua Program Studi Biologi, Institut Pertanian Bogor. beserta staf yang telah memberikan kesempatan untuk pendidikan S3 dengan Beasiswa Unggulan URGE (Universify Research for Graduate Education) Batch
III
tahun 1996/1997. Kepada Rektor UniversitasIndonesia, Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia, dan Ketua Jurusan Farmasi FMIPA
UI
yang telah memberikan kesempatan untuk pendidiken S3 di Institut Peaanian Bogor.Kepada Direktur SEAMEO BIO'JXOP (South Easf Asia Regional Centre for Tropical Biology) Pro£ Dr. Sitanala Arsyad rcmg telah memberikan kesempatan clan
. .
melakukan penelitii di Laboratorium Molecular Biology. Kepada parapeneliti dan -wan S M O BIOTROP atas kesempatan mengguaakan
hilitas, terutama kepada Pro€ Dr- Irene M U m b o h sebagai kepala Divisi
Biofechnology
and
Tree Breeding (ETB), beserta stafdan telcnisi yang dengan penuh kesabaran dan pengertian dalamsuasana
kekeluargaandsn
pmddxkm yang tulusKepada Dr. Rob Harling, koordinator Higher Education LINK Project be judul "Sustainable crop protection to improve f w d production: transferring technology porn research to practice" dari DFID, The British Council, atas b i i a n , saran, dan arahan yang &bedcan selama rnehkukan sebagii penelitian ini di Scottish Agricultural College, Univemity of Edinburgh, Scotland, UK
Kepada rekan-rekan mahasiswa, para staf dan karyawan Pascasarjana IPB,
para teknisi PAU-Bioteknologi IPB dan Laboratorium Molecular Biology SEAMEO BIOTROP, yang selama ini telah membantu dau bekejasama dengan baik.
Kepada yang tercinta keluarga pen&, ibu, ayah, suami, anak-anakku, nenek, kakak, ad&-ad&, dan ibu mertua, yang selalu memberikan dukungan moril dan
kekuatan do'a, serta toleransi yang talc terhingga berupa rasa pengertian dan sangat memaklurni sejak awd hingga selesainya pendidilcan S3 ini.
Kepada semua pihak yang belum disebutkan, penulis ucapkan banyak terima kasih.
KATA PENGANTAR
Berkat rahmat Allah SWT, penelitian dan penulisan disertasi yang berjudul "Konstruksi f i s i transkripsi gen kitinase dari Aeromonas caviae clan ekspresinya pa& Pseuabmo~sfluorescen.3' dapat diselesaikan. Dalam penelitian ini ditalcukan
konstruksi penyisipan gen chi di bawah promotor konstitutif dan terinduksi , d m
diklon pada vektor berspekttum inang luas dan vektor transposon, sehingga ekspresi
gen chr akan dikendalikan secara konstitutif di inang Pseudomonas fluorescens isolat-isolat biokontrol. Melalui penelitian dan penulisan ini penulis ingin
menyumbangkan informasi tentang karakteristik gen chi dari A. cuviae asal
Indonesia, serta kemungkinan pemanfkatannya sebagai sumber gen chi yang berpotensi dalam mengkoastruksi biokontrol d w a a patogen tanaman.
Berdasarkan konstruksi fUsi transkripsi yang dihasilkan di dalam penelitian
ini maka ekspresi kitinase di biok-1 akan bersifat konstitutif tanpa induksi, yang
sangat sesuai untuk diimplikasikan sebagai biokontrol pencegah serangan ceadawan patogen alternatif. Dengan demikian, penggunaan firagisida kimia yang selama ini telah terbukti dapat memberikaa dam& bumk pada liagkungan, dan membahayakan mahluk hidup serta m i k m o ~ s m e non target hinaya, dapat
dihindari.
Penulis mengharaplcaa adanya sumbang saran dan kritikan dari pembaca sekalian untuk meajadikan hasil penelitian &sertasi temtaag konstruksi &si transkripsi gen chi di biokontrol
P.
fr~orescens ini berpotensi untuk dikembangkan dalam pencegahaa cendawan patogea altematifhagisida kimia.Bogor, Agustus 2000
DAFTAR IS1 ...
DAFTAR GAMBAR ... DAFTAR TABEL ...
f . PENDAHULUAN ...
A . Latar Belakang ...
. .
B . Tujuan Penelitran ...
C . Tahap Pengerj aan ...
D . Manfaat Penelitian ...
I1 . TIN JAUAN PUSTAKA ... xiv xvii xix 1 1 6 6 7 8
.
.A . Enzim IOt~nase ... 8
B
.
Gen Kitinase bakteri yang telah dilaporkan...
11 C . Pseudornonc~sfluorescens ...D
.
Teknologi DNA rekombinan...
E
.
Regulasi ekspresi gen dan fbsi transkripsi...
F
.
Transfer gen pada Bakteri...
G.
Sekuensing DNA...
III
.
BAHAN
DAN METODE...
A.
Tempat Penelitian...
B
.
Bahan...
C . Prosedur Umum dan Peralatan...
.
...D Metode
E
.
Sekuensing DNA gen kitinase...
F
.
Konstruksi gen chi di bawah promotor gen dan introduksi keP
.
ji'uorescens...
F
.
1.
Penyisipan gen penanda resistensi antibiotik...
5 9...
F.2. Penyisipan gen KmR pada plasmid vektor berspektrum inang luas 5 9...
F.3. Pembuatan fragmen gen chi bemjung tumpul dengan teknikfiCI-in 61
... F.4. Penyisipan -men tumpul gen chi pa& vektor perantara 6 2
R
F.5. Penyisipan gen chi di bawah PKm ... 62
...
F.6. Penyisipan gen penyandi CimR sebagai penanda seleksi 63
F.7. Introduksi konstruksi fusi transkripsi ~ ~ r n ~ - c h i pada vektor
berspektrum inang luas ke Pf ... 63
G
.
Rekonstruksi fusi transkripsi pKmR-chi menggunakan vektorintegrasi dan introduksi ke P.fIuorescens ... 64
G
.
1 . Konstruksi sisipan fragmen gen chi dengan penanda C+mR ... 6 4G.2. Penyisipan fkagmen chi-GmR di bawah PKmR pada pUC4K ... 66
G.3. Penyisipan m e n fhsi PKmR-chi-GmR pada vektor perantara
pUC 18NotI ... 66
G.4 Konstruksi h i PKrnR-chi-GmR pada vektor integrasi pUTmini
...
67G.5. Introduksi konstnrksi fusi pI€mR-chi pada pUTmini ke Pf ... 67
H
.
Konstruksi Fusi Transkripsi gen chi di bawah Ptac dan introduksi ke Pf..
67 H.
1.
Pengambilan Ptac dari pKK223-3 dm penyisipan pada vektor plasmid 68 H.2. Fusi transkripsi m e ngen chi-GmR di bawah kontrol Ptac...
68 H.3. Introduksi konstruksi fusi Pfac-chi ke Pf...
69.
IV
HASIL DAN PEMBAHASAN
...
71 A. SekuensDNA
gen kitinase...
71B
.
Konstruksi gen chi di bawah pKrnR dan introduksi ke ~f...
80C
.
Rekonstruski fisi tramkripsi pKrnR-chi menggunakan velctor transposondan inhoduksi ke Pf
...
92E. Esei enzimatik kitinase dengan substrat spesifik
.
. .. . .
. . .. . . .
. .. . . .
. .. . . .
..
104DAFTAR GAMBAR
Halaman
. .
2.1 Struktur h t l n ... 9
2.2 Lintasan degradasi kitin ... 10
2.3 Alur informasi dan fakto-faktor regulasi ekspresi gen ... 26
2.4 Fusi gen terhadap suatu gen penyandi ... 28
3.1 Strategi sekuensing gen chi dengan subkloning danprimer walking
...
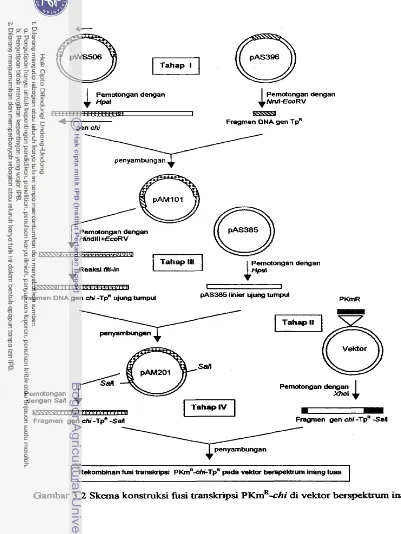
553.2 Skerna konstruksi fisi transkripsi ~ ~ m ~ - c h i pada vektor berspektrum inang luas ... 60
3.3 Plasmid p34S-Grn ... 63
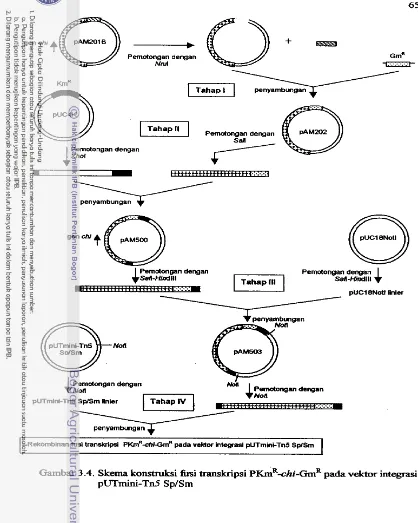
3.4 Skema konstruksi k s i transkripsi pICmR-chi-~mR pada vektor integrasi PUT mini-Tn5 Sp/Sm ... 65
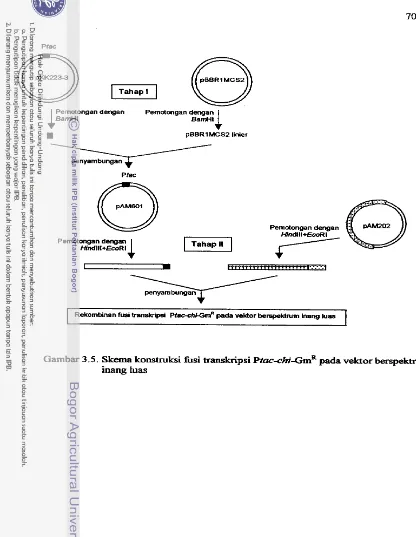
3.5 Skema konstruksi h s i transkripsi ~fac-chiGrnR pada vektor berspektrum ... inang luas 70 4.1 Sekuens nukleotida fragmen 2.9 kb gen chi beserta sekuens asam amino 4.2 Pembandingan sekuens asam amino turunan dari kitinasekitinase yang berkerabat dekat
...
774.3 Analisa perbandingan ujung karboksil gen chi WS7b
...
804.4 ~ e n y i s i ~ a n gen T~~ di bagian hilir gen chi p ~ ~ 5 0 6
...
814.5 Vektor-vektor berspektmm inang luas yang digunakan
...
834.6 ~ e n y i s i ~ a n &agmen
chi-^^^
plasmid p ~ ~ 3 8 5...
844.7 Verifikas'l orientasi pAM201 dengan enzim restriksi pada gel agaros
...
864.8 Fragmen
chi-^^^
disisipkan di vektor-vektor pembawa gen ICmR...
874.9 Verifikasi orientasi rekombinan fbsi transkripsi pAM330
...
884.10 Peta restriksi plasmid pAM330
...
894.1 1 Ekspresi kitinolitik gen chi pada klon E
.
coli dan P.
fluorescem 5 100...
pembawa pAM340 91 4.12 Peta restriksi plasmid pernbawa sisipan fragmen chi-GnR, pAM202...
93...
4.14 Verifikasi rekombinan pAMSOO. p a 5 0 3 dan pAh4520 ... 95
4.15 Esei aktivitas kitinolitik E
.
coZi (pAM500)...
964.16 Anaiisis keberadaan gen chi dengan teknik amplifikasi ... 97
4.17 Konstruksi Ptac pada pBBRlMCS2 dalam dua orientasi ... 99
4.18 Hasil elektroforesis pengambilan h g m e n Pfac dari pKK223-3 dan verifikasi pAM601 clan pAM630 ... 101
4.19 Peta plasmid rekombinan pAM630 ... 102
4.20 Esei aktivitas kitinolitik bakteri pembawa fUsi transkripsi Ptac-chi ... 103
4.2 1 Kurva pengukuran waktu inkubasi optimum dan lcurva standar ... 106
4.22 Aktivitas kitinase A
.
cavim WS7b pada dua suhu inkubasi ... 1074.23 Esei kuantitatif aktivitas kitinase gen chi di E
.
colz dan P.
fluorescens terhadap substrat Chitin Azure ... 109DAFTAR TABEL
Halaman
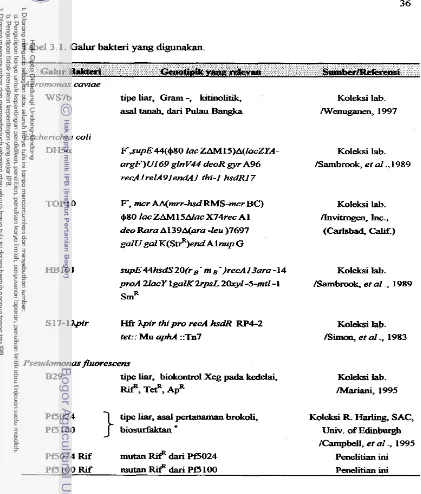
3.1 Galur bakteri yang digunakan ...
3.2 Plasmid yang digunakan ...
4.1 Ukuran £'ragmen DNA hasit verifikasi pAh4201 ... 4 . 2 Ukuran fragmen D N A hasil verifikasi pAM330 ... 4.3 Ukuran ftagmen DNA hasil verifikasi pAMSOO, pAMS03 dan pAM520 4.4 Ukuran fragmen DNA hasil verifikasi pAM601 dan pAM630 ...
4.5 Ekspresi kitinolitik gen chi pada reombinan plasmid ...
A. Latar Bdakang
Kitinase (EC3.2.1.14 = poly-PZ.4-(Zacetami&2-Cieoxy)-D-gZucosi&
g & m hydrolase) adalah enzim yang mempunyai kemampuan menghidrolisis kitin.
Senyawa kitin adalab polimer N-asetilglukosamin dengan ikatan P(14) yang banyak
terdapat di alam sebagai komponen utama kerangka luar arhopoda, mohska,
dinding sel cendawan dan askarida, serta dinding sel streptomises (Smucker & Kim, 1991).
Aeromonas caviae WS7b, yaitu suatu isolat bakteri tanah asal Pulau Bangka.
Propinsi Sumatera Selatan, yang diisolasi dari areal pertanian mengandung relatif
sedikit populasi nematoda patogen tumbuhan, menunjukkan aktivitas kitinolitik
yang h a t pada medium agar kitin. Gen kitinase dari galur ini telah diklon oleh Wenuganen (1997) pada vektor plasmid turunan pUC19 dinamai pWS506. Gen
kitinase tersebut dapat diekspresikan dengan baik pada Ekckriichia coli DHSa di
b a w d promotor gen penyandi enzim P-gdaktosidase ( C u d ) . Hasii penelitian
Wenuganen (1997) menunjukkan bahwa gen kitinase-tersebut diduga terklon tanpa
promotor aslinya.
Penelitian-penelitian pemanfaatan gen kitinase telah dilakukan baik dengan
mengkonstrue~ galur bakteri biokontrol maupun mengkonstruksi tanaman yang
membawa gen kitinase terhadap cendawan patogen (Boller et al., 1983; Hedrick ei
2
cendawan patogen, penelitian-penelitian tentang gen kitinase banyak dilakukan
untuk tujuan rnempelajari regulasi tahap degradasi dan pemanfiistan kitin,
rnengkadkerisasi gen-gen kitinase dan produk-produknya, serta model untuk
mempelajari regulasi ekspresi dan sekresi protein Wobbins et al., 1992; Fujii 62
Miyashita, 1993; Miyashita & Fujii, 1993; Brurberg et al., 1995, Watanabe et al., 1997)
Gen kitinase berpotensi untuk dimanfaatkan dalam mengkonstruksi galur-
gdur biokontrol potensial yang dapat mencegah timbulnya penyakit tumbuhan yang
disebabkan oleh cendawan. Biokontrol, berasal dari kata bioIogicaI controt, menjadi
komponen yang sangat penting &lam pertanian. Pestisida kimia telah menjadi suatu
substansi yang mencemaskan beberapa tahun terakhir hi, karena efek samping yang
dapat diiimbulkannya terhadap linglcungan yang rnembahayakan baik bagi
kesehatan manusia, maupun organisme nontarget lainnya, termasuk musuh alami
yang sebenarnya menguntungkan. Oleh karena itu dipandang penting
untuk
mengembangkan pengendali alternatif yang arnan dan layak lingkungan, terutama
dengan rnenggunakan organisme yang sudah ada
di
dalamsuatu
habitat alamiya.Organisme-organisme ini mampu bertindak melindungi tanaman terhadap berbagai
macam cendawan patogen tanamaq tanpa m e n i m b u l b efek perusalcan terhadap sistem ekologis. Namun, sebelum biokontrol ini menjadi suatu komponen
dalam
penanganan penyakit tumbuhan, haruslah efektif, mampu bertahan, konsisten, dan
genetik untuk menarnbah ketangguhan atau memperluas spektrum aktivitas bioIogis
(Chet et al,, 1993).
Untuk rnemanipulasi dan mengintroduksi gen kitinase ke berbagai bakteri
selain E. coli dan kerabatnya, gen ini hams dikonstruksi pada plasmid vektor
berspektrum inang luas dan di bawah promotor yang sesuai agar dapat terekspresi,
sebagaimana yang dilalcukan dalam penelitian ini. Vektor plasmid yang berspektrum
inang luas yang sudah banyak digunakan anatara lain adalah pRK415, (JCeen et al.
1988). Selaim mengkonstruksi suatu gen di plasmid vektor berspektrum inang luas,
sebagian peneliti rnengkonstruksi gen yang diminati di dalam suatu transposon.
Beberapa penelitian m e r n b u k t i bahwa konstruksi suatu gen di dahm transposon, yang kemudian akan terintegrasi ke dalarn kromosom inang yang dituju sebagai
resipien, akan Iebih s a i l dibandingkan d m konstruksi pada vektor plasmid
yang dapat hilang karena adaptasi dan seieksi di alam (Koby et al, 1994; de
Lorenu, et d.,1990; Herrero ef al., 1990). Selain i t y lokasi penyisipan elemen
sisipan beserta gen yang dirninati di kromosom juga menjadi masalah yang harus
d iapakah penyisipan tersebut ~ ~
akan
mempengamhi kernampuan sel inangdalam proses pertumbuhaq dan kernampuan m e u g k o l o n i s ~ serta kadcter-kamkkr
penting tainnya. Berdasarkan ha1 tersebut ~~i plasmid r e k o m b ' i fUsi
transkripsi pada penelitian ini diIakdcan pada beberapa vektor bexspektrum inang luas dan juga transposon Tn5 dengan menambahkan gen penanda antibiotik yang
sesuai untuk introduksi m e n fbsi transkripsi ke galur-gdur biokontrol
Ekspresi yang diharapkan dari suatu agens biokontrol antara lain adalah
ekspresi tanpa induksi, yaitu menghasilkan produk gen secara konstitutif dalam
tingkat konsentmsi tertentu, sehingga dapat berfimgsi sebagai pencegah serangan
patogen. Untuk tujuan tersebut dalam penelitian ini gen kitinase difusikan di bawah
promotor gen yang M i f a t konstitutif, yaitu promotor gen resistensi antibiotik Kanamisin (PICmR) clan promotor hibrid trp
dan
lac, Ptac. Promotor pICmR diambildari kaset gen resistensi Kanarnisin dari plasmid pUC4K yang berasal dari
transposon Tn903 (Oka et a1..1981). Promotor fac yang diambil dari plasmid
pKK223-3 (Pharmacia) adalah suatu promotor kuat dalam kondisi konstitutif
maupun terinduksi (Glick & Pastern& 1994). Koby et d (1994)
dan
Downing &Thomson (2000), telah berhasil mengklon gen kitinase asal Sema murcecens dan
&ekspresikan di bawah promotor tat di dalam baik yang terkonstruksi di dalam
vektor plasmid maupun pada tmnsposon.
Galur biokontrol yang tengah d i m b a n g k a n terhadap patogen tanaman
kedelai Xbnakmtmm c a m p e m pathovarg2ycines adalah Psemhnonarfluorescem
B29 @ b a r h i , 1995; Suwanto et al, 1996, Manuella et al., 1997). Galur
Pf
B29diisolasi dari daun tanaman kedelai yang terserang bakteri patogen tersebut. Peneliti-
penetiti terdahulu membulctikan bahwa @ur Pf B29 mampu m e n g e n d a t i bakteri
penyebab pushd pada kedelai seuua kompetitif (Nawangsih, 1997; Khaeruni, 1998).
Galur Pf B29 akan dikembangkan kemampuannya sebagai biokontrol terhadap
cendawan dengan mengkonstruksi galur B29 yang kitinolitik Dari studi
antibiotik Tetrasiklin (10 pg/ml), Kanamisin (25 pdrnl), Streptomisin dan
Spektinomisin (masing-masing 50
dd).
Untuk keperluan pemeliharaan danseleksi, h4ariani (1995), telah melakukan mutasi spontan pada Pf B29 sehingga
menjadi resisten terhadap antibiotik Rifampisin (100 pg/ml).
Gatur Pf lainnya yang juga sedang dikembangkan sebagai agens biokontrol
adalah isolat Pf5024 dan isolat PfS100, yang termasuk
Pf
kelompok Vb berdasarkanpengelompolcan secara taksonomi yang diuraikan oleh Leltiott el a!. (1966). Isolat-
isolat tersebut merupakan galur-galur nonpatogen yang diisohsi dari pucuk brokoli
(Brassica oleracea var italics), dan telah dimanfaatkan sebagai biokontrol pada
pertanaman brokoli karena kemampuannya menghasilkan biosurfaktan (Campbell et
at., 1995). Isolat-isolat Pf tipe liar tersebut telah diiutasikan secara spontan
sehingga menjadi resisten terhadap antibiotik Rifampisin di dalam penelitian in<
untuk membantu proses seleksi balik (carnter-seZection) pada teknik introduksi gen
kitinase secara konjugasi bakterial.
Di d a b penelitian inii juga dilakukan sekuensing m e n
DNA
genpenyandi kitinase (ch2 urrtuk memastikan struldur daerah promotor, selain
memperoleh infonnasi-informasi lain seperti hubungan karakternya dengan data
sekuens
DNA
yang sudah ada di database, sekuens asam-amino gen kitinasedugaan, dan informasi tentang protein kitinase, berdasarkan data sekuens
DNA
yangdiperoleh Gen penyandi kitinase dari isolat bakteri tanah berasal dari Israel, Aeromonas caviae, telah diisolasi dan disekuens sepanjang 2.710 basa nukleotida
data pembanding bagi gen kitinase isolat asal Indonesa berdasarkan data sekuens
DNA yang diperoleh, dan akan merupakan suatu hat yang rnenarik, karena kedua
bakteri ini berasa1 dari daerah yang seuurr geografrs sangat berjauhan.
B. Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk mendapatkan organisme
rekombinan, dalam ha1 ini
P.
fluorescens, yang memproduksi kitinase ekstraselular. Berdasarkan ha1 tersebut, maka penelitian ini dilakukan dengan suatu strategi yang meliputi beberapa tahapan, yaitu (i) mengkarakterisasi DNA gen kitinase (chi)dengan sekuensing. Data sekuens DNA gen chi yang diperoleh dimanfaatkan dalarn
mempelajari d m meneliti kekerabatan gen chi ini dengan gen-gen kitinase lain yang
telah ada dengan m e m b a n d i a n n y a dengan data sekuens DNA di dblzbase. dan
membandingkan sekuens asarn amino turunannya; (ii) melakukan fusi gen chi di
bawah promotor konstitutif yang sesuai untuk ekspresi gen kitinase di inang selain
E.coli, sehingga produk kitinase &pat diekspresikan secara konstitutif; (ii)
mengintroduksi fbsi transkripsi gen chi ke galur-galur biokontrol P. jluorescew,
dan
(iv) menganalisis ekspresi gen chi pa& galur-galur bakteri biokontrol dengan esei
halitatif dan semikuantitatif aktivitas enzim kitinase.
C. Tahap Pengerjaan
Di &lam disertasi ini pekerjaan penelitian dibagi sebagai berikut, (i)
7
bersifrtt terhduks'i dan konstitutic pada vektor-vektor plasmid yang berspektrum
inang luas, d m pada vektor transposon, (iii) introduksi gen chi ke galur-galur bakteri
biokontrol P s e d m o n a s jluorescens, beserta esei ekspresinya pada media agar kitin
dan esei kuantitatif.
D. Manfaal: peneiitian
Di dalam rnengkonshuksi agens biokontrol, diharapkan suatu gen potensial
yang diklon dapat diekspresikan secara konstitutif. Dengan demikian produk gen
yang dihasilkan tidak b e r l e b i i sehingga tidak menyebabkan t o k s ' i d m inang klon gen tersebut, dalam ha1 ini agens biokontml. dapat mengadaptasi kondisi baru ini dengan baik, tanpa tejadi mutasi untuk mengatrtsi efek produk gen tersebut.
Ekspresi fusi transkripsi gen chi pada galur-galur biokontrol Pf akan sangat
A.Enzim kitinase
Kitinase adalah enzim yang mempunyai kemampuan mendegradasi kitin,
yaitu polisakarida yang &bangun oleh satuan N-asetilglukosamin dengan ikatan P(1-
4). Kitin (Garnbar 2.1) merupakan biopolimer yang paling metimpah di alam karena
merupakan komponen struktural dinding sel cendawan kecuali oomycetes, kerangka
luar artropod, kerangka luar molusca, cangkang luar cmstaceae dm nematod
(Adonreal 8t Reese, 1969; Cabib, 1987). Produk kitinase umum diproduksi di
berbagai organisme. Beberapa bakteri memproduksi kitinase untuk autilisis,
morfogenetis, maupun nutrisi yaitu memadaatkrtn kitin sebagai sumber karbon
(Gooday, 1990; Monreal 62 Reese, 1969; Roberts & Cabib, 1992; Watanabe et al., 1990). Prokariot yang banyak ditaporkan r n e m p r o d a i kit'mase adalah bakteri
luncur, Pseudomonad, Vibrio, Photobacterium, Enterobacteriaceae, Actinomycetes,
Bacillus dan Clostridium (Gooday, 1979; Jones et al., 1986, Watanabe et al., 1990; Bmrberg et al., 1995; Sitrit et al., 1995; Svitil el al., 1997). 1Mikroba-rnikroba
eukariot yang memiliki kemampuan m e n u d a d c m kitin sebagai sumber karbon dan
energi adatah Myxomycetes, Chytri4 Zygomycetes, Deutemmycetes, Ascomycetes dan Basidiomycetes, dengan memodifikasi konstituen struldur kitin (Ohtakara,
1961). Salah satu cendawan air tawar yang mempunyai kemampuan t d u t addah
Kmlingia asteraysfa yang bersifat kitofil obligat. Ditemukan pula arnuba tanah
tinggi juga dilaporkan produe1 enzim pengbidrolisis kitin tersebut (Powning &
Irzykiewcz, 1965; Abeles et al., 1970; Pegg & Vassey, 1973; Boller eta/-, 1983). Di alam terdapat beberapa bentuk kitin, yang tenrtama ditemukan adalah
bentuk a-kitin, berupa rantai yang terancang sebagai antiparalel, misalnya pada
kaliks hydrozoa, kulit telur nematoda, dm raduhe moluska. Bentuk kitin yang lain
adalah 0-kitin, terancang sebagai rantai yang paralel, umumnya terdapat pada
caugkang moluska. dan y-kitin yang me~pakat'b jenis kitin yang t e d i dari
campran antara kedua jenis kitin ( a clan P)yang disebut di atas (Svitil el d., 1997;
Gooday, 1990).
A0
\CHI
Proses degradasi kitin dapat melalui dua lintasan (Gambar 2.2). Lintasan
pertama adalah hidrolisis ikatan P(1-4) yang disebut proses kitinolitik. Enzim yang
berperan dalarn proses tersebut adalah enzim kitinme. Proses kitinolitik melibatkan
dua jenis enzim kitinase, yaitu eksokitinase dan endoki*. Eksokitinase
memotong unit diasetilkitobiosa nonreduksi pada ujung rantai polimer, sedangkan
diasetilkitobiosa sebagai hasii utama
dan
triasetiikitotriosa, yang lambat laun a hdidegradasi menjadi disakarida dan monosakarida. Bentuk di- dan mono- akan
diangkut ke dalam sel mikroorganisme dan b e d b g s i sebagai sumber karbon dan
nitrogen. Di dalam sel, metabolisme N-asetilglukosamin dapat melalui fosforilasi
N-
asetilglukosamin-6-fosfat, ataupun melalui deasetilasi menjdi glukosamin, melalui
deaminasi, dan selanjutnya meialui hidrolisis menjadi glukosa oleh glukosaminidase
(Gooday, 1990).
Lintasan alternatif degradasi kitin adalah lintasan yang melibatkan deasetilasi
kitin menjadi kitosan. Proses ini penting untuk lingkungan yang memiliki
kandungan kitosan pada sedimen perairan. Enzim kitosanase dapat menghidrolisis
ikatan glikosida P(1-4) pada kitosan menghasilkan kitobiosa, kemudian kitobiosa
dihidrolisis oleh eN-asetilglukosaminidase menjadi N-asetilglukosamin (Gooday,
1990).
KAsetIl
1
Kitosanaseglukosarninidase
1
Kitobima
N-asetilglukosamin (Glukosaminil glukosaminida) GI kNAs
D d I A d k J I l n ! d a s e Glukoasamin
[image:32.563.40.463.21.511.2]( G l W
B.
Gen kitinase bakteri yang telah dilaporkanKitinase baEderi, yaitu kitinase yang dihasilkan oleh bakteri, mempunyai
mekanisme aktivitas antikngi yang berbeda dari kitinase tanaman. Kitinase bakteri
berperanan penting dalam menjaga keseimbangan ekologis dengan mendegradasi
dan mengubah kitin menjadi bentuk biologis yang bermanfaat, disamping
memanfaatkan kitin sebagai sumber nutrisi (Roberts & Selitrennikoe 1988). Berdasarkan sekuens DNA, Ohno ef al. (1996) menyebutkan bahwa gen-gen kitinase dapat dikelompokkan menjadi dua firmili yaitu M l i 18 dan 19. Kitinase bakteri
sesungguhnya berada dalam satu kelompok famili 18 bersama kitinase dari cendawan, virus, hewan dan kelas
III
dan V kitinase tumbuhan. Kitinase yangtermasuk famili 19 adalah k e h I,
II
clanIV
kitinase tumbuhan. Namun, Saito et d(1999) melaporkan kini telah ada kitinase bakteri yang dapat dikelompokkan ke
&lam Eamili 19.
Berbagai gen kitinase bakteri telah dikion dan dikarakterisasi bersarna
dengan produk transLas'mya dari bakteri aerob mauputt anaerob. W i e dari
Serratia rnarcescens telah banyak diteliii serta gen-gen kitinasenya telah & i o n
dan disekuens.
Gen yang menyandikan kitinase utarna dari Serratia marcescecens, yaitu chitinase A
(chL4) telah diklon oleh Downing & Thomson (2000) di bawah kendali promotor
tac, baik disisipkan di suatu plasmid berspektrum inang luas, maupun di wtuvektor integrasi, dan diintroduksi ke P. frtlorescem. Galw Pf yang membawa tac-chiA baik
yang efektif terhadap cendawan patogen tanaman Rhizoctonia soIani. Struldur tiga dimensi enzim kitinase chiA dari S. marcescens galur QMB1466 telah
dikarakterisasi dan dilaporkan oleh Srurberg et al. (1996), serta pembandingan
sekuens-sekuens chitinuse A d m B telah dilakukan beserta lokalisasi seluIarnya di
klon E. coli. Suatu sistem transposon Tn7 yang membawa gen chiA telah dikonstruksi oleh Koby et al. (1994) dalam bentuk &si operon di bawah promotor
h c . K o n s t ~ u ~ ini telah diintroduksi ke dalam Pseudomona~ ji'uorescens dan
terintegrasi dengan stabil, serta mengekspresikan enzirn kitinase yang aktiE Galur
biokontrol tersebut telah diuji pula kernampuan melindungi kecambah biji kapas
terhadap Rhizoctonza s o h i . Sebelumnya Sundheim et al. (1988) telah behasil
mengklon dua macam kitinase dari Serratia mmcescens, kemudian mengintmduksi salah satu gen kitinase tersebut ke Pseuabmonm fluorescens. M ~ v i t a s kitinase
dapat terekspresi di
P.
Ji'uorescens, dan galur tersebut dapat menghambat pertumbuhan tabung kecambah dari F d u m o ~ ~ c u r n fsp. re&Zens, sesertamenurunkan smmga~~ penyakit
pada
lobak yang dibabkan oleh cendawantersebut.
EnteroZMcler aggiorneram juga merupakan bakteri sumber gen kitinase
bakteri yang betpotexmi. Chernin et al. (1997) telah mengklon dan mengkadcterisasi
sekuens gen penyandi endokitinase chiA dari E agglomerans. Selruens lengkap gen
chi4 telah dilaporkan, dan dari sekuens asam amino turunsnnya diperoleh i n f o m i
d a n y a suatu kerangka baca terbuka (open reading frame =
ORF)
yangmenyandikan 562 asam amino dari suatu protein prekuisor dengan berat molekd 61
13
karboksil. Chernin et al. (1995) telah berhasil mendeteksi empat macam enzim
kitinase, yaitu dua macarn N-asetil-j3-D-glukosaminidase dengan berat molekul 89
kDa dan 67 ma, satu endokitinase dengan berat molekul 59 kDa, serta suaiu
kitobiosidase dengan berat molekul 50 kDa. Kuantifikasi enzim-enzirn kitinase
tersebut dilakukan menggunakan substrat kromogenik analog p-nitrofenil disakarida,
trisakarida dan tetrasakarida turunan N-asetifglukosarnin
Isolat kitinolitik dari Aerornonas m l a e yang diisolasi dari akar tanaman
buncis yang sehat yang tumbuh di tanah yang mengandung Sclerotium rolfsii
dilaporkan bahwa secara artifisid dapat mengendalikan Rhizoctonia s o h i dan
F w i w n oxyqmrwn fsp. vainfeeturn dikapas dan S. rolfsii di buncis di dalam kondisi rumah kaca. Inbar & Chet (1991) telah mengkadcterisasi produk kitinase yang dihasilkan. Ekspresi gen k i t i i s e dari A. d u e
di
Ecoli telah dianalisis olehSitrit et al(1995) dan menunjukkan produk kitinase yang aktif. Selruens nukleotida
gen tersebut telah dikar%kterisasi, dan dilaporkiui mempunyai kerninpan ti@
dengan gen chi4 dari S. marcescens. Produk kitinase dari suatu isolat Aeromonas sp telah dikarakterisasi oleh Ueda et al. (1992) dan Utda et al. (1998), dan dilaporkan
ada delapan macam kitinase. Salah satu gen kitinase tersebut telah diklon dan di
karakterisasi &ens nukleotidanya
BacilZus sp adalah kelompok bakteri yang termasuk berpotensi memproduksi
14
(Watanabe ei al., 1990; Watanabe et a/., 1992; Watanabe et al., 1994; Alam et al.,
1995; Alam et al., 1996)
Suatu penelitian enzim kitinase bakteri pada Vibrio harveyz (Svitil et al.,
1997) menunjukkan bahwa keragaman jenis enzim kitinolitik yang dihasilkan oleh
setiap rnikroorganisme disebabkan perbedaan jenis substrat kitin yang didegradasi, dan jenis turunan kitin. Enzim-enzim kitinase yang dihasilkan menunjukkan
perbedaan berdasarkan pola restriksi DNA data imunologi, dan aktivitas enzim Streptomyces adalah bakteri tanah bersifat saprofit yang merupakan salah
satu penghasii kitinase utama di dalam lingkungan tanah. Telah banyak gen-gen
kitinase yang diklon dari kelompok ini, yang sumbernya berasal dari S. plicatus (Robbins et al., 1992), S. Iiviabw (Fujii & Miyashita, 1992; Miyashita & Fujii, 1992), S. gri~ars (Ohno et al., 1996), d m S. coelicolor (Saito el al., 1999).
Enzim kitinase yang terdapat pada tumbuhan tidak satupun yang
menunjukkan homologi dengan enzim kitinase yang dihasilkan mikroba,
sebagaimana diutarakan oleh Oppenheim 62 Chet (1992). Roberts & Selitrennikoff
(1988) membandingkan aktivitas anti- kitinase tumbuhan dari biji gandum
terhadap kitinase bakteri dari Serratia m~llcescens, Stmptornyces dan
Pseudomoms stutzeri. Uji dil- berdasarkan penghambatan pemanjaagan hifa
cendawan uji Trichoderma reesei d m Phyumycxs bIakzsleearzus. Disebutkan
bahwa perbedaan aktivitas antifungi kedua jenis kitinase berkaitan dengan perbedaan
mekanisme dari dua kelas enzim kitinase. Kitinase tumbuhan merupakan
Pseudomoms fluorescens tennasuk datam genus Pseudornonas pada
kelompok Pseudomonad. Kelompok ini merupakan kelompok kemoorganotrofik
aerob yang tidak menunjukkan metabolisme fermentatit respirasi bersifat obligat,
mempunyai kemarnpuan denitrifikasi, berupa Gram negatic bersel tunggal,
berbentuk batang lurus atau bengkok, berukuran 0.5 - 1.0 pn x 1.5 - 4.0 pm,
dengan flagella polar, tunggal afaupun majemuk. Bakteri-bakteri Pseudomonad hanya membutuhkan nutrien yang sederhana untuk pertumbuhannya, serta hidup
pada kicisaran pH netral dan suhu mesofilik (Madigan e f al., 1997). Namun, beberapa
bakteri kelompok ini dapat pula dijumpai bertahan hidup pada kondisi suhu, pH, dan
faktor-faktoc fisik dan kimia yang ekstrim (Lindow. 1992).
Secara
filogenetisanggota kelompok ini tersebar di dalam kelornpok bakteri ungu di dalam kingdom
Balderi. Spesies-spesies genus P&monas dapat dibedakan berdasarkrrn berbagai
karakter fisiologis dan genetiknya. Berdasarkan analisis 16s r R N q P. fluorescens
dikelornpokkan ke dalam bakteri ungu hlompok gamma, bersama
P.
a e ~ ~ m s a .
P.
putiab, dan P. syrhgue yang disebut subkelompok Fluoresens. Persen (%) mol GC
DNA bakteri subkelompok ini berkisar antara 58 sampai 67 %, dimana P.
fluorescens mempunyai % mol
GC
59-61. Berdasarkm fisiologinya, P. fluorescensdibedakan berdasarkan adanya flagella polar yang majemuk, dan berdasarkan
Spesies-spesies Pseudomonas yang betfluoresens adalah kelompok bakteri
yang berperan penting dalam melindungi tumbuhan dari serangan mikroorganisme
patogen Bakteri-bakteri tersebut rnenghasilkan sejumlah besar -or antagonis
terhadap patogen, berupa siderofor yang berwarna kuning kehijauan dan
berfluoresens yang merupakan ciri khasnya. Produk selcunder lainnya yang juga
berperan penting daIam kemampuan bakteri-bakteri ini sebagai biokontrol terhadap
patogen adalah kemampuannya menghasilkan hidrogen sianida dan mensintesis
antibiotik-antibiotik, seperti phenazines dan phlorogluczonol (Lindow, 1992).
B e r d m k a n ha1 tersebut, selain kemampuannya tumbuh pada kondisi nutrien yang
minim, maka bakteri kelompok ini mampu mengkolonisasi tempat hidup yang
seperti di tumbuhan, baik dilinglolngan
akar
maupun 61 permukaandaun, dan berkompetisi dengan mikroorganisme lainya.
D. Teknologi
DNA
rekombinanTelcnologi DNA r e k o m b i i sering pula disebut kloning gen ataupun kloning rnolekuIer, adalafi sejumlah eksperimen tertentu yang bertujuan mentransfer
inforrnasi genetik (DNA) dari satu organisme ke organisme lain.
Eksperimen DNA rekombinan secara umum meliputj (i) pengekstraksi
DNA dari organisme donor, baik itu DNA klon, DNA sisipan, DNA target, maupun DNA asing; (ii) pernotongan secara enzimatis, dan penyambungan ke DNA vektor
untuk membentuk rnolekul DNA rekombinasi baru; (iii) transfer hasil konstruksi
dan (v) identifikasi sel-sel inang yang menangkap dan membawa konstruksi
D N A
(sel tertransform, transforman). dan seleksi dari yang bukan transforman (Glick &
Pastemak, 1994).
Pada dasarnya
D N A
diekstraksi dari sel berdasarkan prinsip sebagai berikut,(i) penghancuran dinding sel, baik secara mekanis maupun enzirnatk sebagai
contoh penggunaan lisozim; (ii) pelisisan set, dapat dilalcukan dengan penambahan
deterjen seperti
SDS
(sodium dodecyl sulphate); (ui) pembersihan debris sel,dilalarkan dengan sentrifugasi, serta memisahkan protein dari lisat dengan ekstraksi
menggunakan pelarut organik &no1 bersama dengan kloroform dan isoarnil alkohol; (iv) pengendapan
D N A
dari lisat jernih dengan menarnbahkan etanol dan garamnatrium, atau dapat pula dengan sentdkgasi gradien menggunakan Cesium klorida
(CsCIz), yang dapat memisahkan
D N A
plasmid dariD N A
kromosom (Old &Primrose, 1985).
Pada kloning molekular,
DNA
sisipam atauD N A
target, sertaD N A
vektorhams dipotong menjadi -en linier, ulrtuk saling disambuagkan. Penmtongan
D N A
merupakan kerja dari suatu enzim yang diproduksi oleh beberapa bakteri, yangdisebut endonuklease restriksi tipe 11 atau disebut puIa enzim restiksi. Enzim ini
bersifat spesifik mengenali s e h e n s pasangan basa dalam bekerja memotong
D N A
utas ganda, sehingga menghasilkan
D N A
dengan patongan yang unik. Enzim inibekerja memotong
D N A
dengan mengenali sehens spesifk yang pendek secaraoleh enzim pereparasi sel inang. Hasil pemotongan DNA dapat bempa molekul
berujung mencuat atau lengket yaitu berujung 5'-fosfat dan berujung 3'-OH, serta
berujung tumpul, yaitu kedua utas terpotong pada situs yang sama. Fragmen DNA
yang diperoleh saling disambungkan dengan bantuan enzim ligase D N A Enzim ini bekerja menyambungkan setiap bagian terputus di dalam molekul DNA yang
mempunyai ujung 5'-fosfat dengan 3'-OH. Di dafam sel, enzim ini mempunyai
tugas sebagai perangkat reparasi bersama dengan polimerase DNA I dalam proses replikasi DNA (Madigan et al., 1997; Gtick & Pastemak, 1994).
Untuk membawa sisipan DNA yang disambungkan diperlukan suatu vektor kloning. Vektor kloning adalah rnolekul DNA yang telah terkmakterisasi dengan baik, yang memungkinkan introduksi molekul DNA rekomb'inan ke sel inang yang
&
serta memungkinkan bertahan secara stabil di sel inang. Hal-ha1 yangmerupakan kngsi dasar suatu vektor adalah, (i) replikon, terdiri dari suatu origin of
replicutz-on dan gen-gen lain yang memungkinkan m o l e h l
ini
untuk b e r e p b isebagai elemen ekstrakromosornal, tidak tergantung
dari
pengendalian kromosomal;(ii)
memiliki penanda seleksi biasanya merupakan gen-gen penyandi resistensiterhadap senyawa toksik, seperti antibiotik, atau gen-gen yang merupakan
komplemen dari s f i t aubotmfi bakteri inang; dan (ui) t d k n y a situssitus endonuklease restriksi unik sebagai situs kloning sisipan DNA Wagdasarian &
Bagdasarian, 1994; Madigan et al., 1997).
Banyak vektor yang dilengkapi dengan kernanfaatan lain untuk
ekspresi klon gen, introduksi ke b d a g a i inang bakteri, atau seleksi fungsi spesifik,
misalnya promotor atau terminator. Vektor yang umum digunakan adalah plasmid,
bakteriofaga h, phagemid,
dan
wsmid (Bagdasarian & Bagdasarian, 1994).Plasmid perlu mempunyai sifat-sifat yang menjadikannya suatu vektor
kloning berkualitas tinggi, selain sifat-sifat vektor yang telah disebutkan di atas,
antara lain, (i) berukuran kecil, sehingga molekul DNA mudah diisolasi dan dimanipulasi Efisiensi transfer DNA s i n g ke datam E. coli menurun secara nyata dengan bertambahnya ukuran plasmid di atas 15 kilopasangbasa. Selain itu, (ii)
berbentuk sirkular, sehingga molelcul DNA stabil selama proses isolasi secara
kimiawi;
dan
(iii) jumlah kopiberganda,
sehingga dapat berada dalam sel dalamjumlah banyak, clan memungkinkan arnplif& molekul DNA (Madigan et al., 1997; Glick & Pastemak, 1994).
Berdasarkan ha1 tersebut, biasanya plasmid untuk velctor kloning merupakan molekul DNA hasil rekayasa gen-. Plasmid sebagai vektor kloning dengan
sistem inang E. coli
dan
kerabatnya telah banyak dikembangkandan
digunakan.Namun, ada beberapa ket- dahm penggunaan sistem inang E. cdi, yaitu (i)
k e b a n y k plasmid vektor yang digunakan, yang berulruran kecil dan berjumlah
kopi tinggi seperti disebutkm di atas, berspektmm inang sempit, sehingga tidak matnpu ditransfer ke dan b e r e p l i i i di inang spesies lain; (ii) sinyal trauskripsi dan
translasi spesies lain
tidak
dikenali dengan baik oleh inang E. coli, sehingga ekspresigen-gen heterologus di E: cdi l e d ,
(ii)
sulit mempelajari fbngsi gen-gen denganhidrokarbon, deklorinasi, fiksasi nitrogen; dan (iv) kemungkinan toksisitas dari
produk-produk gen-gen heterologus terhadap sel E. coli (Bagdasarian & Bagdasarian, 1994).
Plasmid dengan replikon berspektrum inang luas seperti replikon dari
turunan IncPl dm IncQ sangat berguna untuk mengkonstruksi suatu plasmid rekombinan serta mengadisis ekspresi gen yang terkonstruksi di dalam vektor
plasmid ke dalam inang s e k n E. coli dan kerabatnya, namun umumnya berukuran relatif besar dan berjumlah kopi rendah. Sebagai contoh, pRK4 15 (Keen et al., 1988)
merupakan turunan plasmid RK2 dari kelompok inkompatibilitas
P-1
yang sangatmirip dengan RPl. RP4 dan R68 @itta et al., 1985). Plasmid pRK415 memiliki
oriT, oriV, sebagian hngsi transfer
(m
clan DNA penyandi resistensi tehadaptetrasiklin.
DNA murni yang sudah d i n g tersambungkan sntara vektor dan sisipan,
kemudian di transfer ke sel inang melalui proses yang d i i b u t transformasi.
Karakteristik yang ideal untuk surrtu inang kloning gen adalah (i) pertumbuhan cepat
dan baik, mampu tumbuh pada medium murah;
(-5)
tidak berbahaya dannonpatogenik; (iii) mampu menangkap/mengambil molekul DNA,
dan
stabil dalamkultur, (iv) m e m i l i enzim yang sesuai untuk r e p l i i i vektor rekombinan; (v)
mempunyai informasi genetis yang selengkap mungkiw, dan (vi) mempunyai
Mutasi-mutasi tertentu terhadap galur-galur sel inang telah dilakukan untuk
memenuhi kriteria tersebut di atas, dan untuk meningkatkan efisiensi stabilitas
plasmid rekombinan setelah tertransfornasi serta membantu analisis galur yang
tertransformsi. Untuk memastikan plasmid rekombinan tetap berada dalam bentuk
originalnya, sel inang dimutasi menjadi negatif rekombinasi (RecA-), uniuk
menghindari terjadinya rekombinasi dengan genom inang. Selain itu sel inang
dimutasi tidak memiliki gen-gen untuk enzirn-enzim endonuklease restriksi (Glick &
Pasternak, 1994).
Inang yang sering digunakan ddam kloning gen adalah E. coli, disamping
bakteri Gram-positif Baci1Iu.s subtilis, dan juga Saccharomyces cereviseae untuk
ekspresi gen-gen eukariot. Beberapa galur E. c d i sebagai inang proses transformi telah dieliminase e k s o ~ l k ~ ~ n u k l ~ y a , serta
ada
pula yang diiutasi kemampuan restriksiiya (hsdR) sehingga DNA rekombinan yang akanditransformasi dapat terhindar dari restriksi oleh enzim restciks'~ yang d W ioleh inang. Ada galur E. coli yang dimutasi pada bagian
CacZ
tertentu, misalnyalacZAtvl15 pada galur DHSa, untuk d h m h & a n sebagai penselel& transforman.
J i i a galur ini d i f o r m a s i oleh plasmid yang membawa daerah regulator operon
lac, yaitu gen penyandi P-gahktosidase, dan suatu segmen pendek DNA penyandi
ujung amino terminal ZacZ, maka peptida hasil ekspresi bagian amino terminal ZacZ
yang disandikan plasmid tersebut b e r k o m b i i i dengan produk P-galalctosidase tidak
lengkap yang dihasilkan galur lacZAM15, menghasilkan P-galaktosidase yang
f b n g s i o d ini disebut kornplernentasia. P-Galaktosidase fingsional ini dapat
diinduksi oleh isopmpil-P-D-tiogalaktopiranosida (IPTG). Fenotipe ini dapat diamati
sebagai warna biru yang dihasilkan dari reaksi dengan substrat krornogenik 5-
brom&-~hZor~3-zndo~-~D-galacto~mrosid (x-GalR) yang ditambahkan ke
&lam medium. Suatu multiple cloning region atau disebut pula multiple cloning
sites (MCS), yaitu suatu daerah sempit seb& situs penyisipan suatu -men DNA, telah diiancang tepat di bagian hilir IacZ di beberapa plasmid vektor Honing. Jika
DNA terklon pada daerah tersebut, maka aktivitas hngsional
lacZ
di plasmidterganggu, sehingga tidak menghasilkan P-galaktosidase yang fUngsional, dengan
demikian substrat tidak bereaksi menghasilkan warm b i i . Hal ini dimanfaatkan
untuk membedakan set transforman antara yang membawa plasmid rekombinan dengan yang membawa plasmid vektor tanpa DNA sisipan pada proses seleksi
dengan prinsip seleksi koloni biru putih (Provence & Curtiss
IE.,
1994).Seleksi transfonnan yang membawa klon gen yang benar adalah tahap yang pent*. Seleksi antara inang yang merupakan transforman dengan yang bukan
transforrnan dapat memanfaatkan penginaldifan gen peoanda pada vektor plasmid,
dapat pula dengan seleksi koloni bii-putih. Untuk vektor asal virus, dapat dilakukan
dengan mengamati plaque yang terbentuk Namun, untuk membedakan antara
transforman yang tidak membawa klon gen dengan yang membawa klon gen yang
benar &pat dilakukan dengan m e f i i ekspresi klon gen dalam sel inang. OIeh
karena itu d d v i t a s protein procluk klon gen harus dapat diesei (Madigan et al.,
d i i n a k a n metode antigen antibodi. J i i tidak ada antibodi yang sesuai untuk
produk gen, maka digunakan probe asam nukleat. Dengan cara hibridisasi DNA menggunakan probe yang sesuai, akan dapat ditemukan transforman mana yang membawa klon gen (Midigan et at., 1997)
Pada kloning gen, dapat pula d h m f " t k a n suatu transposon sebagai vektor
integrasi, karena kemampuannya menyisip dan berintegrasi ke kromosom, sehingga
dapat digumkan sebagai pembawa gen yang akan diidroduksi ke suatu kromosom
bakteri, selain itu juga berguna pada keperluan ekspresi klon gen dalam jurnlah kopi tunggai (Madigan ef al., 1997, de Bruijn & Rossbach, 1994). Transposon adalafi suatu elemen loncat yang mampu berpindah dan menyisip dari suatu molekul DNA ke molekul DNA lain. Transposon membawa elemen IS dengan orientasi searah
maupun berlawanan pada kedua ujung elemen, membawa gen penyandi enzim transposase yaug terlibat pada proses transposisi, dan membawa suatu gen resistensi antibiotik, atau resistensi logam berat, 8tau gen penentu patogenisitas. d e Lorenzo et
d , 1990, clan Hemem et al, 1990, telah mengkonstmksi trausposon krdamm mini yang dirancang dengsn behagai penan