PENGARUH PEMBATASAN PAKAN TERHADAP KUALITAS
SEMEN SEGAR ITIK MOJOSARI
(Anas platyrhynchos javanicus)
SKRIPSI
OMAR NAJI
PROGRAM STUDI TEKNOLOGI PRODUKSI TERNAK FAKULTAS PETERNAKAN
RINGKASAN
OMAR NAJI. D01498049. 2006. Pengaruh Pembatasan Pakan terhadap Kualitas Semen Segar Itik Mojosari (Anas platyrhynchos javanicus). Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Ir. Niken Ulupi, MS
Pembimbing Anggota : Dr. Ir. Pius P. Ketaren, M.Agr.Sc.
Pamanfaatan pejantan unggul dapat lebih maksimal apabila ditunjang dengan kemampuan reproduksinya, dalam hal ini kualitas semen yang dihasilkannya. Semen berkualitas penting untuk mendukung fertilisasi dan koleksi semen untuk inseminasi. Salah satu faktor yang berpengaruh terhadap kualitas semen adalah faktor pakan. Pakan yang kurang atau berlebih berpengaruh buruk terhadap kemampuan reproduksi dan produksi spermatozoa. Pakan yang berlebih juga menjadikan biaya produksi semakin bengkak. Mengingat biaya pakan merupakan biaya produksi terbesar yang mencapai 60-80% dari total biaya produksi, maka pembatasan jumlah pakan bisa dijadikan solusi untuk menekan biaya produksi.
Penelitian ini telah dilakukan pada bulan Mei sampai Juni 2005 di Balitnak-Ciawi, Bogor, untuk melihat pengaruh pembatasan pakan terhadap kualitas semen segar itik Mojosari. Pengamatan dilakukan pada karakteristik semen segar itik yang ditampung dari 63 ekor itik mojosari jantan pada umur 39 minggu. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) pola searah dengan empat perlakuan dan tiga ulangan. Perlakuannya adalah: pemberian pakan itik masa starter sampai layer ad libitum sebagai kontrol (P1), masa starter-grower 100% dan layer 85% ad libitum (P2), masa starter-grower 85% dan layer 100% ad libitum (P3), masa starter sampai layer 85% ad libitum (P4). Pengaruh nyata perlakuan dilanjutkan dengan uji jarak Tukey.
Hasil penelitian menunjukkan tidak ada pengaruh nyata perlakuan terhadap volume semen per ejakulat, jumlah spermatozoa per ejakulat, konsentrasi, motilitas, viabilitas, dan abnormalitas spermatozoa. Pengaruh nyata (P<0,05) perlakuan hanya terdapat pada keadaan abnormalitas ekor buntung. Pada keadaan abnormalitas ekor buntung, perlakuan kontrol (P1) justru mempunyai jumlah ekor buntung terbesar dan menimbulkan perbedaan nyata (P<0,05) dengan perlakuan P3. Kelompok itik dengan tingkat perlakuan pembatasan pakan yang terbatas, dari starter sampai layer diperlakukan pembatasan pakan tetap sebesar 85% ad libitum yaitu perlakuan P4, dalam kesemua peubah yang diukur menunjukkan tidak berbeda nyata dengan dengan kontrol (P1) yang pemberian pakannya ad libitum. Hal ini mengindikasikan bahwa perlakuan P4 adalah perlakuan yang paling efisien dan efektif dalam produksi kualitas semen yang baik, juga ekonomis dari segi pengeluaran.
ABSTRACT
The Effect of Feed Restriction on Fresh Semen Characteristics of Mojosari Duck (Anas platyrhynchos javanicus)
Naji O., N. Ulupi and P.P. Ketaren
The high quality semen is important to support fertilization and semen collection for the insemination. One of the factors influencing the semen quality is feed. Both insufficient and over fed affect spermatozoa production. This research was done from May to June 2005 in Balitnak-Ciawi, Bogor. Objective of this study is to evaluate effect of feed restriction on characteristics of Mojosari drake semen. The observation was focus on the characteristics of fresh semen out of 63 drakes of 39 weeks old. The design of the experiment was based on the completely randomized design with four dietary treatments and 3 repetitions. The dietary treatments were: (1) ad libitum feeding for starter, grower and layer=P1 (control), (2) ad libitum feeding for starter, grower and restricted feeding for layer=P2, (3) restricted feeding for starter and grower, and ad libitum feeding for layer=P3, (4) restricted feeding for starter, grower and layer=P4. The results of the study showed that the dietarey treatments did not significantly effect volume semen per ejaculat, spermatozoa concentration, total spermatozoa per ejaculat, motility, viability and spermatozoa abnormality. The number of spermatozoa without tail was significantly (P<0.05) higher on drakes fed P1. All parameters measured on the ducks fed P4 (restricted feeding a during starter, grower and layer) was not significantly different from the control (P1). This study indicates that feeding P4 to drakes is sufficient to produce a high quality of drake semen.
PENGARUH PEMBATASAN PAKAN TERHADAP KUALITAS
SEMEN SEGAR ITIK MOJOSARI
(Anas platyrhynchos javanicus)
OMAR NAJI D01498049
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI PRODUKSI TERNAK FAKULTAS PETERNAKAN
PENGARUH PEMBATASAN PAKAN TERHADAP KUALITAS
SEMEN SEGAR ITIK MOJOSARI
(Anas platyrhynchos javanicus)
Oleh: OMAR NAJI
D01498049
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 29 Januari 2007
Pembimbing Utama Pembimbing Anggota
Ir. Niken Ulupi, MS Dr. Ir. Pius P. Ketaren, M.Agr.Sc. NIP. 131 284 604 NIP. 080 036 794
Dekan Fakultas Peternakan Institut Pertanian Bogor
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat, pada tanggal 18 November 1979. Penulis adalah anak pertama dari empat bersaudara dari pasangan Bapak Lukman Naji dan Balkis Rasyid.
Pendidikan formal penulis dari TK sampai SMU diselesaikan di Bogor. Tahun 1986 penulis lulus dari TK Al Irsyad, kemudian tahun 1992 lulus dari SD Negeri Empang 2, dan pada tahun 1995 lulus dari SMP Negeri 1 Bogor. Pada tahun yang sama penulis melanjutkan di SMU Negeri 4 Bogor dan lulus pada tahun 1998.
KATA PENGANTAR
Assalaamualaikum Wr. Wb.
Kami Panjatkan rasa syukur Alhamdulillah ke hadirat Allah Yang Maha Tinggi, puja dan puji hanya milik-Nya semata yang telah melimpahkan rahmat dan karunia-Nya yang begitu besar sehingga penulis dapat menyelesaikan skripsi ini. Kami haturkan sholawat salam semoga terus tercurah kepada junjungan kita Rasulullah SAW, para keluarga, sahabat dan orang-orang yang istiqomah mengikuti jalannya hingga akhir zaman.
Pada awalnya jauh sebelum gagasan muncul untuk mengambil topik penelitian ini, penulis sering datang ke perpustakaan dan membaca banyak buku, jurnal dan laporan hasil penelitian yang interaksinya menjadi permulaan dari timbulnya inspirasi. Penulis pun suka berdiskusi dengan kawan-kawan, para peneliti, peternak dan orang-orang lain yang menekuni bidang peternakan. Kemudian penulis sampai pada satu titik kesadaran yang menimbulkan kepedulian tentang tingginya biaya pakan yang banyak membuat para peternak mengeluh, dan pada benak timbul satu minat: bagaimana membantu para peternak ini untuk menyediakan pakan ternak yang lebih terjangkau tetapi berkualitas. Penulis pun pernah membaca beberapa hasil penelitian tentang pembatasan pakan, di antaranya hasil penelitian Matram dan Tamzil yang banyak menggugah, yang ternyata pembatasan pakan yang terkendali dan dengan perhitungan tidak selalu memberikan performa buruk terhadap pertumbuhan dan reproduksi ternak. Jika demikian maka pembatasan pakan bisa diterapkan untuk mengurangi biaya produksi tanpa menimbulkan efek buruk terhadap ternaknya.
Penulis sadar penuh bahwa skripsi ini banyak kekurangan dan jauh dari sempurna, karena penulis sendiri bukan manusia sempurna yang tidak luput dari berbuat salah. Setiap kesalahan dan kekurangan datang dari saya sendiri, dan setiap kebenaran dan kesempurnaan hanya milik Allah semata. Penulis mohon maaf atas kekurangan dan kelalaian yang terdapat dalam skripsi ini dan selama pengerjaannya, dan penulis sangat berharap atas kritik dan masukkannya yang membangun. Harapan penulis tentang skripsi ini semoga dapat memberikan informasi berharga, menambah kekayaan baru pengetahuan, dan dapat bermanfaat bagi orang-orang yang memerlukannya khusunya para peternak. Amin ya robbal alamin.
Bogor, Oktober 2006
DAFTAR TABEL
Nomor Halaman 1. Kebutuhan Gizi Itik Pekin pada Berbagai Umur ... 6 2. Formula Pakan Grower dan Layer ... 14 3. Kebutuhan Gizi Itik Petelur pada Berbagai Umur ... 18 4. Kandungan Nutrisi Ransum Itik pada Berbagai
Periode Pemeliharaan ... 18 5. Konsumsi Pakan Itik pada Setiap Periode Pemeliharaan
Perlakuan Pembatasan Pakan ... 19 6. Perkiraan konsumsi pakan itik ... 19 7. Karakteristik Warna dan Konsistensi Semen pada Setiap
Perlakuan Pembatasan Pakan ... 20 8. Frekuensi nilai Gerakan Massa Spermatozoa pada Setiap
Perlakuan Pembatasan Pakan ... 21 9. Volume Semen per Ejakulat pada Setiap Perlakuan
Pembatasan Pakan ... 22 10. Konsentrasi Spermatozoa pada Setiap Perlakuan
Pembatasan Pakan ... 23 11. Jumlah Spermatozoa per Ejakulat pada Setiap Perlakuan
Pembatasan Pakan ... 24 12. Motilitas Spermatozoa pada Setiap Perlakuan
Pembatasan Pakan ... 25 13. Viabilitas Spermatozoa pada Setiap Perlakuan
Pembatasan Pakan ... 26 14. Abnormalitas Spermatozoa pada Setiap Perlakuan
Pembatasan Pakan ... 27 15. Macam Keadaan Abnormalitas pada Setiap Perlakuan
DAFTAR LAMPIRAN
Nomor Halaman
1. Sidik Ragam Volume Semen per Ejakulasi ... 36
2. Sidik Ragam Konsentrasi Spermatozoa ... 36
3. Sidik Ragam Jumlah Spermatozoa per Ejakulat ... 36
4. Sidik Ragam Motilitas Spermatozoa ... 36
5. Sidik Ragam Viabilitas Spermatozoa ... 36
6. Sidik ragam Abnormalitas Spermatozoa ... 37
7. Sidik Ragam Kepala Bengkak ... 37
8. Sidik Ragam Kepala Rusak ... 37
9. Sidik Ragam Ekor Patah ... 37
10. Sidik Ragam Ekor Buntung ... 37
11. Konsumsi Pakan Itik pada Setiap Perlakuan Pembatasan pakan ... 39
PENDAHULUAN
Latar Belakang
Itik lokal menyimpan potensi besar untuk dikembangkan dan bermanfaat
sebagai pensuplai kebutuhan protein masyarakat. Itik lokal mempunyai banyak
kelebihan diantaranya mudah beradaptasi dengan lingkungan, memiliki resistensi
terhadap penyakit yang tinggi dan memiliki keragaman yang besar. Keragaman yang
besar dari itik lokal membuka kemungkinan untuk diperoleh bibit-bibit itik lokal
dengan sifat-sifat produksi yang baik, yang bisa dilakukan dengan usaha seleksi dan
persilangan.
Faktor pakan sangat berpengaruh terhadap pertumbuhan dan reproduksi
ternak. Dalam peternakan itik, pakan komersial merupakan biaya terbesar yang
menyita 60-80% biaya produksi (Montong,1987). Menimbang hal itu, perhatian yang
lebih pada faktor pakan dapat menunjang keberhasilan usaha ternak itik. Pemberian
pakan yang baik meliputi kuantitas dan kualitas pakan, jumlah penyajiannya cukup
dengan memperhatikan kandungan nutrisi yang sesuai dengan kebutuhan ternak.
Menurut Tomaszewska et al. (1991) bahwa pemberian pakan yang kurang maupun
berlebih tidak diragukan lagi memberikan pengaruh buruk pada reproduksi ternak,
yang pada ternak jantan akan berpengaruh terhadap volume testis, fertilitas dan
produksi spermatozoa. Pendapat Tomaszewska et al. ini didukung pula oleh Tillman
et al. (1998) yang menyatakan hal yang sama bahwa pakan yang kurang atau
berlebih berpengaruh buruk terhadap reproduksi dan produksi spermatozoa.
Pakan yang berlebih selain berpengaruh buruk terhadap kemampuan
reproduksi, juga meningkatkan biaya produksi. Pembatasan jumlah pakan bisa
dijadikan solusi untuk menekan biaya produksi, yang mempunyai implikasi
terhadap peningkatan keuntungan. Jumlah pakan yang baik adalah pakan yang tidak
kurang dan tidak berlebih, tetapi memberikan performa bagus terhadap pertumbuhan
dan reproduksi ternak, dalam hal ini kualitas semen yang dihasilkannya. Beberapa
faktor yang mempengaruhi kualitas semen adalah bangsa dan strain, pakan, umur
ternak, ukuran badan ternak, dan frekuensi penampungan semen (Toelihere, 1985).
Pejantan dengan kualitas produksi unggul dapat ditingkatkan kegunaannya
untuk mengawini sejumlah betina dalam jumlah banyak. Dengan demikian dapat
berumur sama dalam waktu yang relatif singkat. Seleksi dan persilangan sangat
berperan demi dihasilkannya pejantan unggul. Pemanfaatan pejantan unggul secara
maksimal terkait dengan kualitas semen yang dihasilkannya. Semen yang berkualitas
sangat diperlukan untuk fertilitas dan daya tetas telur, terutama yang lebih penting
yang berkaitan dengan persediaan semen untuk inseminasi, dimana semen disimpan
dalam jangka waktu lama dengan tetap menjaga kualitas semen yang tinggi. Masih
belum ada penelitian tentang pengaruh pakan pada itik jantan terhadap kualitas
semen. Penelitian tentang ini sangat diperlukan untuk memperoleh informasi tentang
jumlah pakan yang cukup untuk menghasilkan kualitas semen yang baik.
Perumusan Masalah
1) Seberapa besar perbedaan pengaruh perlakuan pakan ad libitum dibandingkan
pakan terbatas terhadap karakteristik semen segar itik mojosari.
2) Peubah-peubah apa saja dari karakteristik semen yang mendapat pengaruh nyata
sebagai akibat respon perlakuan dan juga sejauh apa perbedaannya.
3) Perlakuan mana yang menghasilkan karakteristik semen segar yang paling baik
Tujuan
Tujuan penelitian ini untuk membandingkan dan mengetahui pengaruh
pemberian pakan antara pakan yang diberikan ad libitum dengan pakan terbatas
TINJAUAN PUSTAKA
Deskripsi Ternak Itik
Itik termasuk unggas air (waterfowl) bersama-sama dengan angsa. Ternak ini
bersifat lebih aquatic daripada angsa. Sifat khas lainnya dari itik omnivorous
(pemakan segala), yaitu memakan bahan makanan yang bersumber dari tumbuhan
hewan, seperti biji-bijian, rumput-rumputan, umbi-umbian, ikan bekicot dan keong
(Suharno dan Setiawan, 1999). Jenis unggas ini mempunyai sifat-sifat khusus yang
secara anatomis menyesuaikan dirinya dengan lingkungan air, yaitu mempunyai
selaput renang (foot web), tulang dada berbentuk sampan, bulu yang berminyak
hingga tahan air, serta paruh berbentuk khusus yang dilapisi selaput peka (Samosir,
1984). Melalui proses domestikasi yang telah terjadi sejak zaman Mesopotamia, itik
liar (Anas boscha) kemudian berubah menjadi ternak piaraan. Nenek-moyangnya
yang sampai saat ini masih banyak tersebar di seluruh dunia ialah burung Belibis
(Mliwis) atau disebut juga Wild mallard (Srigandono, 1980).
Itik termasuk dalam kelas Aves, ordo Anseriformes, famili Anatidae,
sub-famili Anatinae, rumpun Anatini, genus Anas dan spesies Anas platyrhynchos. Itik
yang tersebar di Indonesia mempunyai banyak variasi dalam besar atau bobot badan,
warna bulu, posisi tubuh waktu berjalan serta tanda khusus misalnya adanya jambul
yaitu bulu di bagian atas kepala dan warna cangkang telur yang bervariasi dari warna
putih sampai hijau-kebiruan (Achmanu, 1997). Itik lokal Indonesia berasal dari
bangsa Indian runner yang banyak diternakkan di pulau Jawa (Samosir, 1984). Itik
lokal indonesia patut dibanggakan karena bangun, bentuk dan ukuran tubuhnya
dipakai sebagai standar itik tipe petelur (Achmanu, 1997).
Itik lokal Indonesia diberi nama identitas berdasarkan asal dari itik tersebut
didapat atau dikembangkan sehingga ada itik Mojosari, Ambarawa, Magelang, Tegal
dan Kerawang. Itik Mojosari berasal dari desa Modopuro, kecamatan Mojokerto,
kabupaten Mojokerto, Jawa Timur (Suharno dan Anwar, 1996). Ciri-ciri itik
Mojosari antara lain kebanyakan berwarna coklat agak gelap dengan garis hitam
samar-samar, disamping warna lain yang dikenal dengan warna branjangan dan ada
yang dinamakan warna jarakan (Achmanu, 1997). Besar ukuran bagian tubuh itik
Mojosari, bobot badan jantan dan betina 1.201,08 ± 183,95 dan 1.227,01 ± 154,32 gr,
dan betina 25,03 ± 2,92 dan 25,07 ± 2,26 cm, panjang badan jantan dan betina 22,13
± 3,23 dan 21,11 ± 1,98 cm, dan panjang kaki jantan dan betina 24,92 ± 1,15 dan
23,67 ± 1,22 cm (Dinas Peternakan Daerah Tingkat I Propinsi Jawa Timur ,1995).
Sistem Pemeliharaan
Berdasarkan keterlibatan manusia dalam pengelolaannya, sistem
pemeliharaan ternak unggas dapat digolongkan menjadi tiga sistem yaitu sistem
ekstensif (free range), semi intensif dan intensif (Suprijatna et al., 2005). Lebih jauh
lagi diterangkan tentang masing-masing dari sistem pemeliharaan:
1) Sistem ekstensif, pada sistem ini ternak dipelihara pada suatu padang umbaran
luas dan ternak melakukan hampir semua aktifitasnya sendiri. Kebutuhan pakan
hampir seluruhnya diperoleh dari aktifitas ternak mencari pakannya sendiri dan
pada sistem ini sangat kecil sekali keterlibatan pengelola. Padang umbaran
hanya dilengkapai tempat naungan untuk berteduh serta untuk menghindari
hujan dan panas dan tidak terdapat kandang secara umum.
2) Sistem semi intensif, ternak dipelihara di padang umbaran terbatas. Kandang
disediakan untuk memenuhi sebagian besar kebutuhannya, seperti makan,
minum, bertelur, berteduh dan tidur. Padang umbaran hanya untuk melakukan
exercise, berjemur dan mencari pakan tambahan.
3) Sistem intensif, ternak sepenuhnya dipelihara dalam kandang dan aktifitasnya
sangat terbatas. Seluruh kebutuhan hidupnya dipenuhi oleh pengelola.
Menurut Suharno dan Setiawan (1999), berdasarkan fase pemeliharaan dapat
dibagi kandang itik menjadi tiga jenis yaitu:
1) Kandang induk buatan, untuk pemeliharaan itik yang baru menetas sampai
berumur empat minggu. Induk buatan ini dapat dibuat dari papan, bambu atau
kawat, dengan ukuran kandang 90x60x30 cm3. Untuk lantai kandang dapat
digunakan kawat kasa atau bilah-bilah bambu dengan jarak 1-1,5 cm.
2) Kandang itik remaja (kandang ren), untuk pemeliharaan itik pada fase
pertumbuhan antara umur 4-18 minggu. Kandang ini adalah kandang ren yang
beralaskan litter. Tujuan pemeliharaan itik dikandang ren adalah untuk
menyiapkan kondisi fisik itik pra bertelur, mengurangi penumpukan lemak
dalam rongga telur karena itik banyak bergerak dan juga untuk menyeleksi itik
Pada kandang ini dibuat dua bagian, bagian yang beratap dan bagian yang
terbuka (untuk umbaran). Untuk atap dapat digunakan genteng yang ukuran
bagian beratap 150x125 cm, sedangkan untuk umbaran berukuran 100x125 cm.
Kapasitas ideal untuk ukuran kandang ren 10-15 ekor untuk umur 0-2 minggu
dan 10-15 ekor untuk umur 2- 4 minggu.
3) Kandang baterai, digunakan untuk memelihara itik dewasa selepas umur 18
minggu. Kandang baterai ini merupakan kandang berbentuk sangkar (cage) yang
disusun secara berderet. Bahan pembuat cage dapat dipilih dari bilah-bilah
bambu atau kawat. Setiap cage digunakan untuk memelihara seekor itik. Ukuran
cage untuk seekor itik, panjang 40 cm, lebar 30 cm, tinggi depan 55 cm dan
tinggi belakang 50 cm. Untuk tempat telur dapat ditambah ukuran 12 cm
sehingga panjang kandang menjadi 52 cm. Pemilihan jumlah tingkat dan model
susunan cage yang akan dibuat harus mempertimbangkan kemudahan pekerja
dalam melakukan kegiatan, kemudahan dalam pembersihan kotoran dan luas
lahan yang tersedia. Untuk itu konstruksi kandang baterai dapat dibuat 2-3
tingkat, tetapi disarankan yang baik hanya dua tingkat saja.
Suprijatna et al. (2005) menjelaskan pada pemeliharaan unggas bahwa
kandang harus dilengkapi peralatan seperti tempat pakan, tempat minum, alat
pemanas, alat penerangan dan alat sanitasi atau alat kebersihan. Alat pemanas
diperlukan terutama untuk kandang indukan, saat pemeliharaan dari umur satu hari
sampai 2-3 minggu, tergantung kondisi pertumbuhan anak ayam, temperatur
lingkungan dan musim. Lampu penerangan disediakan untuk penerangan pada
malam hari, pemberiannya dapat disesuaikan dengan program pemeliharaan.
Kebutuhan Nutrisi untuk Itik Jantan
Untuk dapat tumbuh, berkembang dan berproduksi ternak memerlukan nutrisi
sebagai bahan untuk pembentukan jaringan tubuh dan produksi. Sumber nutrisi
tersebut terkandung di dalam pakan yang dikonsumsinya. Oleh karena itu, untuk
tercapai pertumbuhan dan produksi yang maksimal maka nutrisi yang terkandung di
dalam pakan yang di konsumsi harus memadai. Pertumbuhan dan produksi
merupakan sifat genetis. Setiap jenis ternak mempunyai potensi genetis yang berbeda
potensi genetisnya, karena itu terdapat standar kebutuhan nurisi untuk setiap jenis
ternak dengan fungsi produksi yang khusus (Suprijatna et al., 2005).
Itik jantan yang biasa diternakkan sebagai itik pedaging atau bibit belum
tersedia informasi kebutuhan gizinya, karena itik jantan masih belum umum
diternakkan (Ketaren, 2001). Kebutuhan gizi itik jantan pada penelitian ini
menggunakan standar kebutuhan gizi itik petelur yang dikutip dari rekomendasi
Sinurat (2000).
Tabel 1. Kebutuhan Gizi Itik Petelur pada Berbagai Umur
Gizi Starter
Istilah pembatasan pakan mempunyai maksud pengurangan asupan nutrisi
dengan membatasi konsumsi pakan ternak dibawah standar kebutuhannya untuk
mencapai hasil-hasil yang diinginkan. Beberapa cara pembatasan pakan yang telah
dilakukan para peneliti yaitu antara lain dengan membatasi waktu pemberian pakan,
jumlah pakan, dan kualitas pakan atau kandungan nutrisinya. Menurut Montong
(1987) faktor-faktor yang perlu diperhatikan selama melakukan program pembatasan
pakan antara lain adalah:
1) Penimbangan pakan harus dilakukan dengan hati-hati dan jumlah pakan yang
dikonsumsi harus diketahui dengan tepat sesuai dengan temperatur lingkungan.
2) Tempat pakan dan minum harus cukup.
3) Bobot badan harus senantiasa dikontrol.
Kebutuhan energi tidak selalu menjadi faktor utama yang mempengaruhi
konsumsi pakan, hal ini karena unggas tidak mampu beradaptasi terhadap
Matram (1984) yang menyatakan bahwa pemberian pakan ad libitum pada itik
cenderung berperilaku pakan melebihi kebutuhannya, sehingga konsumsi pakan
menimbulkan kelebihan energi yang ditimbun sebagai lemak tubuh. Katanabaf et al.
(1989) juga memperoleh hasil yang sama bahwa kadar lemak ayam yang diberi
pakan ad libitum nyata lebih tinggi dibanding dengan ayam yang mendapat
perlakuan terbatas. Penelitian lebih lanjut yang dilaporkan Tamzil (1995) mendapati
bahwa konversi pakan itik yang mendapat pakan ad libitum nyata lebih tinggi
dibanding yang mendapat pakan terbatas. Pendapat lebih jauh dijelaskan oleh
Ketaren et al. (1999), tingginya konversi pakan diduga karena banyaknya pakan
terbuang akibat kebiasaan itik untuk segera mencari minum setelah makan, yang
dapat terjadi baik pada saat pindah dari tempat pakan ke tempat minum maupun pada
saat minum. Menurut Gowe et al. (1960) pembatasan pakan dapat meningkatkan
efisiensi penggunaan pakan dan menunda umur dewasa kelamin. Hal yang serupa
dilaporkan pula oleh Oliver et al. (1978) dari itik-itik pekin yang dibatasi konsumsi
pakannya dari umur 8 sampai 22 minggu mengalami penundaan umur dewasa
kelamin. Penundaan umur dewasa kelamin dapat terjadi karena umur dewasa
kelamin mempunyai korelasi erat dengan kadar lemak tubuh dan bobot badan yang
dapat berkurang sebagai akibat respon pembatasan pakan (Hocking, 1993). Pendapat
yang sama dikatakan pula oleh Bunan (1990) bahwa umur dewasa kelamin pada
unggas lebih ditentukan oleh kandungan lemak tubuh daripada bobot badan.
Tomaszewska et al. (1991) berpendapat bahwa pemberian pakan yang kurang
maupun berlebih berpengaruh buruk terhadap reproduksi. Pada ternak jantan
pemberian pakan kurang yang berat akan menurunkan volume testis, produksi
spermatozoa dan kapasitas reproduksi dari pejantan, sedangkan pakan berlebih akan
mengurangi tingkat fertilitasnya karena berkurangnya ketangkasan secara umum.
Tillman et al. (1998) mendukung hal ini pula bahwa kelebihan pakan dapat
menyebabkan deposisi lemak pada organ reproduksi yang dapat mengganggu proses
reproduksi pada semua ternak, pada ternak betina ovaria akan mengalami infiltrasi
jaringan lemak yang dapat mencegah pertumbuhan normal folikel dan pelepasan
telur yang pada akhirnya estrus akan menjadi tidak teratur dan menghambat
pembuahan. Demikian juga pada ternak jantan deposisi lemak yang terjadi pada
menjadi sulit kawin. Lebih lanjut Tillman et al. (1998) menyatakan pula bahwa
pakan yang kurang dalam waktu lama pada ternak jantan dapat mengurangi produksi
spermatozoa dan menurunkan fertilitasnya, sedangkan pada ternak betina akan
terjadi pengurangan ovarium dan tidak teratur estrus. Informasi yang dikemukakan
Tillman et al. (1998) makin menegaskan kembali bahwa kelebihan pakan tidak
selamanya berdampak baik terhadap performa ternak.
Fisiologi Semen
Semen adalah cairan yang disekresikan oleh alat kelamin jantan yang secara
normal diejakulasikan ke dalam saluran reproduksi hewan betina sewaktu kopulasi
(Toelihere, 1985). Bagian semen terdiri dari dua bagian utama yaitu sel-sel gamet
jantan atau spermatozoa yang bersuspensi di dalam plasma semen yang dihasilkan
oleh kelenjar-kelenjar kelamin pelengkap hewan jantan (Garner dan Hafez, 1987).
Fungsi plasma semen antara lain sebagai sarana transportasi spermatozoa dari
kelenjar reproduksi jantan selama ejakulasi, dan sebagai penyangga (buffer) yang
berperan untuk membantu spermatozoa agar tetap hidup sesudah dideposisikan ke
dalam saluran reproduksi betina (Evans dan Maxwell, 1987). Karena unggas tidak
memiliki kelenjar kelamin pelengkap maka plasma semen unggas hanya berasal dari
ductus deferens ditambah dengan campuran cairan transparan yang berasal dari
sekresi lipatan-lipatan limphe dan badan-badan vasculer di dalam kloaka bila semen
ditampung dengan cara pemijatan (King dan McLelland, 1975). Plasma semen terdiri
dari zat-zat organik dan zat-zat inorganik. Zat-zat organik penyusun plasma yaitu
phosporicholine, glyceryl phosporicholine, asam sitrat, fruktosa, inositol, sorbitol,
ergothionine dan sperumine. Zat-zat inorganiknya yaitu kalium, kalsium dan
bikarbonat (Partodihardjo, 1982).
Spermatozoa dibentuk melalui proses spermatogenesis di dalam testis.
Permukaan spermatozoa ditutupi oleh suatu membran lipoprotein yang akan
meninggi permeabilitasnya pada saat sel mati terutama di bagian kepala (Toelihere,
1981). Spermatozoa unggas terdiri dari kepala, bagian tengah dan ekor. Bagian
kepala spermatozoa unggas berukuran 12,5 μm, sementara akrosom berukuran 1,75
μm. Bagian tengah spermatozoa berukuran 4 μm dan ekor berukuran 80 μm. Diameter bagian tengah dan kepala spermatozoa berukuran 0,5 μm (Etches, 1996).
Proses metabolisme spermatozoa yang paling utama melalui jalur glikolisis
dan respirasi (Salisbury dan Vandemark, 1985). Metabolisme spermatozoa unggas
mendapat energi melalui jalur glikolisis pada kondisi aerob dan anaerob, namun
proses metabolisme ini lebih cepat pada kondisi anaerob. Energi untuk motilitas
berasal dari perombakan adenosin triphospat (ATP) di dalam selubung mitokondria
melalui reaksi pengurainya menjadi adenosin diphospat (ADP) dan adenosin
monophospat (AMP) (Lake, 1966).
Penampungan Semen
Metode penampungan semen yang telah dikenal sampai saat ini di antaranya
adalah teknik pengurutan (massage technique), teknik penyedotan (aspiration
technique), vagina buatan (artificial vagina) dan elektroejakulasi (electroejaculation)
(Herrick dan Self, 1962). Widodo (2004) mengungkapkan hal yang sama tentang
beberapa metode penampungan semen yang dapat dilakukan yaitu dengan
rangsangan listrik, rangsangan urut dengan pemijatan dan dengan teknik vagina
buatan. Metode yang banyak dilakukan pada ternak unggas adalah rangsangan urut
diikuti dengan rangsangan listrik. Lebih jauh diterangkan tentang masing-masing
dari metode penampungan semen:
1) Teknik rangsangan urut
Teknik ini pertama kali diberitakan oleh Quinn dan Burrows (1936) dan
digunakan sebagai dasar teknik pengumpulan semen unggas hingga sekarang.
Cara melakukan rangsangan dengan pengurutan, pejantan yang dipegang oleh
operator lain dilakukan pengurutan dengan jari-jari tangan kiri pada kedua sisi
punggung pejantan dan jari tangan kanan mengurut bagian perut sampai kloaka.
Gerakan dilakukan secara beraturan dan diulang beberapa kali sampai pejantan
terangsang (ereksi). Pada saat terjadi ejakulasi, semen dihisap oleh alat
penghisap (aspirator) dan akan tertampung dalam termos kecil. Untuk
mendapatkan hasil yang baik, pejantan memerlukan latihan-latihan selama 10-15
hari sampai semen dapat tertampung.
2) Teknik rangsangan listrik
Itik jantan yang tidak dapat dilatih dengan metode rangsangan urut,
dipakai terdiri dari transformer, volt meter (0-30 volt), milliamper meter (1-100
milliamper) dan tombol kontak. Cara melakukannya, itik jantan dipegang oleh
seorang operator, sebuah kutub listrik berbentuk jarum disuntikkan dibawah
kulit dibagian sisi punggung. Kemudian kutub listrik yang lain berupa batang
besi kecil dimasukkan ke dalam kloaka sedalam ± 4 cm. Pada rangsangan
pertama arus listrik 30 volt dan 60-80 miliamper dialirkan dengan menekan
tombol kontak selama tiga detik dan diulangi sampai tiga atau lima kali dengan
inteval lima detik. Dengan teknik ini umumnya phallus pada posisi normal tanpa
adanya penonjolan, sehingga perlu dilakukan peremasan (milking) ke dalam
gelas penampung.
3) Teknik vagina buatan
Penampungan semen itik dengan teknik vagina buatan pertama kali dilaporkan
oleh Kuzmina (1933) dengan menggunakan tabung dari gelas yang dimasukkan
ke dalam lingkaran karet dan difiksasi di kloaka itik betina. Secara otomatis
semen akan tertampung di tabung tersebut apabila itik jantan melakukan kawin
alam. Alat ini mirip vagina buatan pada ternak besar, tetapi ukurannya lebih
kecil dan tidak perlu mengisikan air hangat maupun pemberian pelumas. Itik
jantan dimasukkan ke dalam kandang betina, pada saat pejantan naik ke atas
punggung betina, phallus diarahkan ke dalam vagina buatan. Dengan metode ini
semen yang bersih dan berkualitas baik dapat dikumpulkan dengan cepat. Tan
(1980) melakukannya dengan menggunakan tabung gelas berukuran 3,5 cm
dengan panjang 10 cm, entok betina digunakan sebagai dummy. Selanjutnya
dilaporkan bahwa dengan teknik vagina buatan ini, semen itik dapat lebih sering
dikumpulkan tanpa mempengaruhi kualitas dan kuantitasnya, dan menghasilkan
semen yang lebih bersih karena pencemaran urine dan feces dapat berkurang.
Pemeriksaan Semen
Pemeriksaan semen dilakukan secara makroskopis dan mikroskopis.
Pemeriksaan makroskopis meliputi penilaian terhadap volume, warna, bau,
kekentalan atau konsistensi dan derajat keasaman atau pH. Pemeriksaan mikroskopis
meliputi penghitungan konsentrasi, motilitas, jumlah spermatozoa hidup dan
penghitungan jumlah spermatozoa normal dan yang abnormal (Partodihardjo, 1982).
semen umumnya digunakan sebagai ukuran kesanggupan spermatozoa membuahi sel
telur (Toelihere, 1985). Menurut Perry (1969) penentuan motilitas mempunyai
kriteria sebagai berikut: spermatozoa motil atau tidak bergerak (nilai 0), gerakan
melingkar dan kurang dari 50% bergerak progresif serta tidak ada gelombang (nilai
2), spermatozoa bergerak progresif 50-80% dan terdapat gerakan massa (nilai 3),
pergerakan spermatozoa motil progresif yang gesit yang membentuk gelombang
(nilai 4), pergerakan spermatozoa motil progresif yang gesit yang membentuk
gelombang yang sangat cepat menunjukkan 100% motil aktif.
Penilaian konsentrasi atau jumlah spermatozoa per mililiter semen sangat
perlu dilakukan, karena faktor inilah yang menggambarkan sifat-sifat semen dan
dipakai sebagai salah satu kritea penentuan kualitas semen. Konsentrasi digabung
dengan volume dan persentase spermatozoa motil memberikan jumlah spermatozoa
motil per ejakulat, yaitu kuantitas yang menentukan berapa jumlah betina yang dapat
diinseminasi dengan ejakulat tersebut (Toelihere, 1985). Lebih jauh lagi diterangkan
beberapa metode penghitungan konsentrasi yaitu:
1) Penghitungan jarak antar kepala spermatozoa
Penghitungan ini dilakukan dengan memperkirakan jarak antara dua kepala
spermatozoa dibawah mikroskop dengan pembesaran 45x10, dengan hasil
penghitungan dikelompokkan sebagai berikut:
a) Densum (D) atau padat, jika jarak dua kepala spermatozoa kurang dari satu
panjang kepala; konsentrasi diperkirakan kurang lebih 1.000 sampai 2.000
juta spermatozoa per ml semen.
b) Semidensum (SD) atau sedang, jika jarak dua kepala spermatozoa sama
dengan panjang satu sampai 1,5 kepala; konsentrasinya diperkirakan kurang
lebih 500 sampai 1.000 juta spermatozoa per ml semen.
c) Rarum (R) atau jarang, jika jarak antar dua kepala melebihi panjang satu
kepala atau sama dengan panjang seluruh spermatozoa dan konsentrasinya
berada antara 200 sampai 500 juta spermatozoa per ml semen.
d) Oligospermia (OS) atau sedikit spermatozoa, apabila jarak dua kepala
berjarak panjang seluruh spermatozoa dengan perkiraan konsentrasi kurang
e) Aspermia (A) atau tidak ada spermatozoa, apabila sama sekali tidak terdapat
spermatozoa di dalam semen.
2) Penghitungan dengan hemocytometer
Pipet erythrocyt diisi dengan semen yang belum diencerkan sampai tanda 0,5.
Suatu larutan 3% NaCl dihisap sampai tanda 101 pada pipet. Larutan tersebut
mengencerkan dan membunuh spermatozoa. Campuran ini dikocok dengan
hati-hati dan cukup cepat menurut angka delapan selama 2-3 menit. Beberapa tetes
lagi dibuang, kemudian suatu tetes ditempatkan dibawah gelas penutup pada
kamar hitung sel darah merah menurut Neubauer. Spermatozoa di dalam lima
kamar dihitung menurut arah diagonal. Karena setiap kamar terdapat 16 ruangan
kecil (Gambar 2), maka di dalam lima kamar terdapat 80 ruangan kecil. Dengan
volume setiap ruangan kecil 0,1 mm3 dengan pengenceran 200x, dan apabila
didalam lima kamar terdapat X spermatozoa, maka nilai konsentrasi
spermatozoanya adalah: X x 400/80 x 10 x 200 = 10.000 = X x 0,01 juta
spermatozoa per mm3
3) Penghitungan dengan kolorimeter fotoelektrik
Penghitungan metode ini dengan memperkirakan turbiditas atau kepekaan optik
suatu contoh semen dengan kolorimeter fotoelektrik yang telah dikalibrasikan
terhadap konsentrasi spermatozoa yang telah diketahui.
4) Penghitungan secara elektronik
Penghitungan dengan cara ini digunakan di laboratorium-laboratorium modern
atau pada pusat-pusat inseminasi buatan yang besar yang harus memeriksa
beberapa ratus contoh semen dalam sehari.
Pewarnaan diferensial digunakan untuk mengetahui persentase spermatozoa
yang mati dan yang hidup (Hafez, 1993). Perbedaan afinitas zat warna antara
spermatozoa yang mati dengan yang hidup digunakan untuk menghitung jumlah
spermatozoa secara objektif. Zat warna yang digunakan adalah eosin atau
METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan pada Mei sampai dengan Juni 2005 di Kompleks
Kandang Itik dan Laboratorium Reproduksi Balai Penelitian Ternak.
Materi
Ternak
Ternak yang digunakan dalam penelitian ini 63 ekor itik Mojosari jantan
umur 39 minggu.
Kandang
Kandang yang digunakan sebelum dan selama penelitian ini terdiri dari:
1) Kandang indukan digunakan sebelum penelitian untuk memelihara itik yang
baru menetas sampai umur delapan minggu. Kandang ini berukuran 90x60x30
cm dengan ketinggian 87 cm dari lantai, dilengkapi dengan alat pemanas, tempat
makan dan tempat minum.
2) Kandang pertumbuhan digunakan sebelum penelitian untuk memelihara itik
setelah umur delapan minggu sampai 16 minggu. Kandang ini adalah kandang
lantai beralaskan litter, berukuran 500x100 cm. Kandang ini dilengkapi dengan
lampu penerang, tempat pakan dan tempat minum.
3) Kandang individu digunakan sebelum dan selama penelitian untuk memelihara
itik setelah umur 16 minggu. Kandang ini berukuran 120x50x55 cm yang
disekat menjadi dua bagian yang sama. Ketinggian kandang sekitar 95 cm dari
lantai. Kandang ini dilengkapi dengan lampu penerang, tempat makan dan
tempat minum.
Pakan
Pakan yang digunakan sebelum dan selama penelitian ini terdiri dari tiga
macam sesuai periode pemeliharaannya yaitu:
1) Pakan fase starter yang diberikan sebelum penelitian untuk itik umur sehari
sampai delapan minggu, berupa pakan komersial “Gold Coin 202 C” yang
diproduksi oleh pabrik pakan ternak sehingga diharapkan mutu lebih terjamin
2) Pakan fase grower diberikan sebelum penelitian untuk itik setelah umur delapan
minggu sampai 16 minggu, berupa hasil pencampuran pakan komersial untuk
broiler “Gold Coin 202 C” dengan dedak, premix, DCP dan kapur.
3) Pakan fase layer diberikan sebelum dan selama penelitian untuk itik setelah
umur 16 minggu, berupa hasil pencampuran pakan komersial untuk broiler
“Gold Coin 202 C” dengan dedak, metionin, lisin, premix, kapur dan garam.
Pakan campuran yang digunakan pada fase grower dan layer mempunyai
formula yang tersaji pada Tabel 2.
Tabel 2. Formula Pakan Grower dan Layer
Bahan Pakan Persentase Bahan Pakan (%)
Starter Grower Layer
Pakan komersial “Gold Coin 202 C” 100 62,00 80,00
Dedak - 36,80 19,17
Premix - 0,20 0,20
DCP - 0,40 -
Kapur - 0,60 0,20
Metionin - - 0,03
Lisin - - 0,20
Garam - - 0,20
Total 100 100 100
Bahan dan Peralatan
Peralatan lain yang digunakan alat penghisap (aspirator), haemocytometer,
mikroskop, counter, pipet, erlenmeyer, gelas ukur, tabung penampung, pembakar
bunsen, objek gelas, cover glass, syringe insuline 1 cc dan kertas tissue.
Bahan-bahan yang digunakan antara lain alkohol, cairan NaCl fisiologis,
larutan formalin, cairan pewarna eosin/nigrosin, minyak emersi, air es, dan
aquadestilata steril.
Rancangan
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak
dengan masing-masing perlakuan terdiri atas 3 ulangan. Perlakuan yang diamati
terdiri dari empat macam yaitu: pemberian pakan masa starter sampai layer ad
libitum sebagai kontrol (P1), pakan masa starter-grower 100% dan layer 85% ad
libitum (P2), pakan masa starter-grower 85% dan layer 100% ad libitum (P3), pakan
masa starter sampai layer 85% ad libitum (P4).
Model linier yang digunakan untuk rancangan ini menurut Steel dan Torrie
(1993) adalah:
Yij = µ + άi + εij
Yij = respon tingkat pembatasan pakan ke-i (i = 1,2,3,4), ulangan ke-j (j =1,2,3)
µ = rataan umum hasil percobaan
άi = pengaruh tingkat pembatasan pakan ke-i
εij = galat pada tingkat pembatasan pakan ke-i dan ulangan ke-j.
Peubah yang diamati dalam penelitian ini adalah warna dan konsistensi
semen, volume semen per ejakulat, konsentrasi spermatozoa, jumlah spermatozoa
per ejakulat, gerakan massa spermatozoa, motilitas, viabilitas, dan abnormalitas
spermatozoa beserta morfologi keadaan abnormalnya yang meliputi kepala bengkak,
kepala rusak, ekor patah dan ekor buntung. Data dari seluruh peubah (kecuali peubah
warna semen, konsistensi semen, dan gerakan massa spermatozoa) dilakukan analisis
ragam. Data yang di analisis ragam sebelumnya dilakukan pengujian asumsi yang
meliputi kenormalan, kehomogenan, dan kebebasan galat. Data yang tidak
memenuhi asumsi dilakukan transformasi arcsin. Hasil analisis ragam yang
menunjukkan perbedaan nyata dilanjutkan dengan uji jarak Tukey (Steel dan Torrie,
1993). Peubah warna semen, konsistensi semen, dan gerakan massa spermatozoa di
analisis secara deskriptif.
Prosedur
Pemberian Pakan
Pemberian pakan terbagi dalam dua bagian yaitu pemberian pakan ad libitum
dan pakan yang dibatasi. Kelompok pemberian pakan ad libitum sebagai kontrol dan
digunakan sebagai acuan untuk membatasi konsumsi pakan itik pada kelompok
perlakuan lainnya, karena itu itik dalam kelompok ini diberi pakan satu minggu lebih
Penampungan Semen
Koleksi semen dilakukan pada itik umur 39 minggu. Jumlah itik yang
dikoleksi semen sebanyak 63 ekor. Pengambilan semen dilakukan dengan
menggunakan metode urut. Penampungan semen dilakukan dengan cara mengurut
bagian punggung hingga ke pangkal ekor. Pengurutan diulang beberapa kali hingga
itik menunjukkan ereksi maksimal. Hal ini ditandai dengan meregangnya bulu ekor
keatas dan mencuatnya penis keluar dari permukaan kloaka. Spermatozoa yang
keluar dihisap oleh alat penghisap aspirator dan akan tertampung dibotol. Lalu semen
dimasukkan dalam tabung-tabung yang selanjutnya tabung disimpan dalam termos
yang diisi air es. Kisaran suhu penyimpanan 5 –10 oC.
Pemeriksaan Semen
1. Warna dan konsistensi semen, pengukurannya dilakukan secara kualitatif.
2. Volume semen per ejakulat, pengukurannya dengan membaca langsung skala
pada tabung penampung.
3. Konsentrasi spermatozoa, penghitungannya dengan menggunakan kamar hitung
haemocytometer. Semen diencerkan sampai 400x menggunakan NaCl fisiologis
dengan kadar formalin 1%, kemudian diteteskan diatas haemocytometer dan
dihitung dibawah mikroskop dengan pembesaran 10x40. Jumlah spermatozoa
pada lima kotak haemocytometer dihitung secara diagonal dan hasilnya dikalikan
dengan 20 x 106.
4. Jumlah spermatozoa per ejakulat, dihitung dengan mengalikan volume semen
dengan konsentrasi.
5. Gerakan massa spermatozoa, pengukurannya dengan mengamati langsung semen
yang diteteskan di atas objek glass dan diamati pergerakannya dibawah
mikroskop dengan pembesaran 10x10 dengan cahaya dikurangi. Nilai gerakan
massa disimbolkan dengan notasi “+“ sesuai besar tingkat gelombangnya., kritea
penghitungan meliputi dari tidak ada pergerakan (-) sampai gelombang yang
sangat besar, gelap dan tebal (++++).
6. Motilitas spermatozoa, pengukurannya dengan meneteskan semen diatas objek
glass kemudian ditambahkan satu tetes NaCl fisiologis. Kemudian diaduk dengan
dilakukan penghitungan dibawah mikroskop jumlah sperma yang motil progresif
dengan pembesaran 10x10 dari jumlah pengamatan 100 ekor spermatozoa.
7. Viabilitas spermatozoa, pengukurannya menggunakan preparat ulas yang
kemudian diamati di bawah mikroskop dengan pembesaran 10x100. Preparat ulas
dibuat dengan cara mencampurkan cairan semen dengan larutan eosin-nigrosin
dengan perbandingan 1:3 tetes diatas objek glass. Dengan objek glass lainnya
yang membentuk posisi sudut lancip, diaduk campuran tersebut untuk
mendapatkan selapis semen yang telah diwarnai setipis mungkin. Lalu difiksasi
atau dikeringkan dengan api bunsen yang hasilnya preparat yang siap diamati.
Preparat diamati dibawah mikroskop dengan pembesaran 10x100, lalu dilakukan
penghitungan jumlah spermatozoa yang hidup dari luas pengamatan 100 ekor
spermatozoa. Spermatozoa mati adalah yang berwarna merah dan spermatozoa
hidup yang tidak menyerap warna.
8. Abnormalitas spermatozoa, pengukurannya menggunakan preparat ulas yang sama dengan perhitungan viabilitas. Penghitungan dilakukan di bawah mikroskop
dengan pembesaran 10x100 dari luas pandang 100 ekor spermatozoa yang
diamati. Penghitungannya meliputi keadaan-keadaan spermatozoa yang
mempunyai morfologi yang abnormal yang meliputi kepala bengkak, kepala
HASIL DAN PEMBAHASAN
Nutrisi Pakan
Setiap makhluk hidup memerlukan nutrisi dalam pakan untuk tumbuh,
berkembang dan reproduksi. Agar pertumbuhan dan produksi maksimal maka jumlah
kandungan nutrisi yang diperlukan ternak harus memadai sesuai kebutuhan ternak
dan fungsi produksi khusus. Kebutuhan gizi itik jantan pada penelitian ini
menggunakan standar kebutuhan gizi itik petelur yang dikutip dari rekomendasi
Sinurat (2000) seperti yang tertera pada Tabel 3.
Tabel 3. Kebutuhan Gizi Itik Petelur pada Berbagai Umur
Gizi Starter
Hasil perhitungan kandungan nutrisi pakan yang digunakan dalam penelitian
ini disajikan pada Tabel 4.
Tabel 4. Kandungan Nutrisi Ransum Itik pada Berbagai Periode Pemeliharaan
Rataan konsumsi pakan ternak itik dari setiap perlakuan pada masing-masing
periode pemeliharaan disajikan pada Tabel 5. Perkiraan rekomendasi konsumsi
pakan itik disajikan pada Tabel 6.
Tabel 5. Konsumsi Pakan Itik pada Setiap Periode Pemeliharaan Perlakuan Pembatasan Pakan
Umur (minggu)
Konsumsi Pakan Itik pada Setiap Perlakuan (g/ekor/hari)
P1 P2 P3 P4
0-8 113,29 112,30 96,30 96,30
8-16 142,96 140,61 121,54 121,54
16-39 139,67 118,70 138,57 118,70
Tabel 6. Perkiraan konsumsi pakan itik
Umur
Konsumsi pakan penelitian dibandingkan dengan perkiraan konsumsi pakan
sampai umur 18 minggu. Rataan konsumsi pakan itik pada semua perlakuan baik
pada periode starter (0-8 minggu), grower (9-16 minggu) dan layer (>16 minggu)
ternyata lebih tinggi dibandingkan dengan yang direkomendasikan Hardjosworo
(1989). Perlakuan konsumsi pakan yang terbatas pun masih sangat berlebih sehingga
Kualitas Semen Segar Itik Mojosari
Pemeriksaan dan evaluasi semen harus meliputi keadaan umum contoh
semen, volume, konsentrasi, dan motilitas atau daya geraknya (Toelihere, 1985).
Pemeriksaan karakteristik semen segar itik pada penelitian ini meliputi warna dan
konsistensi semen, volume semen per ejakulat, konsentrasi spermatozoa, jumlah
spermatozoa per ejakulat, motilitas, viabilitas, dan abnormalitas spermatozoa beserta
empat macam keadaan morfologi abnormalnya yang meliputi kepala bengkak, kepala
rusak, ekor patah dan ekor buntung.
Warna dan Konsistensi Semen
Pemeriksaan warna semen dilakukan secara kualitatif dan hasilnya tersaji
pada Tabel 7. Seluruh perlakuan mempunyai rata-rata warna yang sama yaitu putih
serta tidak tembus cahaya. Hasil ini menunjukkan faktor perlakuan pembatasan
pakan tidak berpengaruh terhadap warna semen. Rerata warna semen yang sama
pada semua perlakuan yaitu putih menunjukkan ciri semen yang baik, sesuai seperti
yang dikatakan Supriatna (2000) bahwa semen berkualitas, berwarna putih dan tidak
tembus cahaya menunjukkan konsentrasi semen yang tinggi.
Tabel 7. Karakteristik Warna dan Konsistensi Semen pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Warna Konsistensi
P1 (kontrol) Putih Kental
P2 (starter-grower 100% dan layer
85% ad libitum) Putih Kental
P3 (starter-grower 85% dan layer
100% ad libitum) Putih Kental
P4 (starter-layer 85% ad libitum) Putih Kental
Rataan Putih Kental
Konsistensi semen setiap perlakuan pembatasan pakan tersaji pada Tabel 4.
Seluruh perlakuan mempunyai konsistensi yang relatif tidak berbeda yaitu kental.
Hal ini menunjukkan tidak ada pengaruh perlakuan pembatasan pakan terhadap
konsistensi semen. Warna bersama konsistensi semen menentukan konsentrasi
spermatozoa, bila semen kental dan berwarna putih maka konsentrasi spermatozoa
konsentrasi semen yang rendah (Toelihere, 1981). Warna dan konsistensi tidak
berbeda nyata antar kelompok perlakuan diduga hal ini karena pembatasan pakan
yang paling lama pun telah cukup memberikan gizi dan zat-zat makanan yang
diperlukan untuk memberikan karakteristik warna semen dan konsistensi yang baik.
Gerakan Massa Spermatozoa
Gerakan massa spermatozoa merupakan gambaran kasar kualitas semen dan
secara cepat dapat dilihat dengan mata secara langsung, tetapi akan lebih akurat jika
menggunakan mikroskop (Evans dan Maxwell, 1987). Gerakan massa spermatozoa
dapat terjadi karena pergerakan spermatozoa secara massal yang bergerak ke arah
yang sama secara bersamaan.
Tabel 8. Frekuensi nilai Gerakan Massa Spermatozoa pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Gerakan Massa Spermatozoa (%)
(-) (+) (++) (+++) (++++)
P1 (kontrol) - - 29,41 35,29 35,29
P2 (starter-grower 100% dan layer
85% ad libitum) - - - 44,44 55,56
P3 (starter-grower 85% dan layer
100% ad libitum) - 13,33 20,00 53,33 13,33
P4 (starter-layer 85% ad libitum) - - 53,85 46,15
Tabel 8 menyajikan frekuensi nilai gerakan massa spermatozoa dari setiap
perlakuan pembatasan pakan. Seluruh perlakuan terlihat mempunyai gerakan massa
spermatozoa yang sebagian besar bernilai (+++) dan (++++) yaitu gerakan massa
spermatozoa dengan gelombang-gelombang yang besar dan sangat cepat. Hasil ini
menunjukkan sebagian besar perlakuan mempunyai kualitas semen yang baik seperti
yang dikatakan Toelihere (1981) bahwa kualitas semen yang baik mempunyai
gelombang yang besar, gelap, tebal dan aktif seperti gumpalan awan hitam yang
bergerak capat dan berpindah-pindah. Gelombang-gelombang pergerakan
spermatozoa yang besar dan tebal seperti yang dimaksud Toelihere (1981) terdapat
pada gerakan massa spermatozoa yang bernilai (+++) dan (++++), sedangkan pada
gerakan massa yang bernilai (++) yang terlihat adalah gelombang-gelombang yang
Semen dengan nilai gerakan massa spermatozoa (-) dan (+) tidak memenuhi
syarat untuk digunakan inseminasi, gerakan massa yang layak adalah paling sedikit
yang bernilai (++) (Taurin, 1977). Hal ini berarti seluruh perlakuan hampir
mempunyai nilai gerakan massa yang layak untuk digunakan inseminasi, hanya pada
perlakuan P3 terdapat gerakan massa spermatozoa (+) yang tidak layak sebesar
13,33%. Kemungkinan hal ini karena faktor keragaman yang besar pada itik lokal
yang sebagian besar belum mengalami seleksi.
Volume Semen per Ejakulat
Volume semen yang dipancarkan oleh seekor pejantan dapat berbeda-beda
tergantung dari umur, ras, besar dan berat badan, mutu pakan, frekuensi
penampungan, faktor genetik dan kondisi dari ternak itu sendiri (Salisbury dan
Vandemark, 1985). Hasil sidik ragam menunjukkan tidak terdapat pengaruh
perlakuan pembatasan pakan terhadap volume semen per ejakulat. Seluruh
perlakuan mempunyai rata-rata volume semen per ejakulat yang relatif tidak berbeda.
Kemungkinan hal ini disebabkan selain karena itik yang diambil semennya berasal
dari bangsa dan umur yang sama, asupan nutrisi esensial itik pada perlakuan pakan
terbatas sudah mencukupi untuk menunjang volume semen yang baik. Rataan
volume semen per ejakulat dari setiap perlakuan pembatasan pakan dapat dilihat
pada tabel 9.
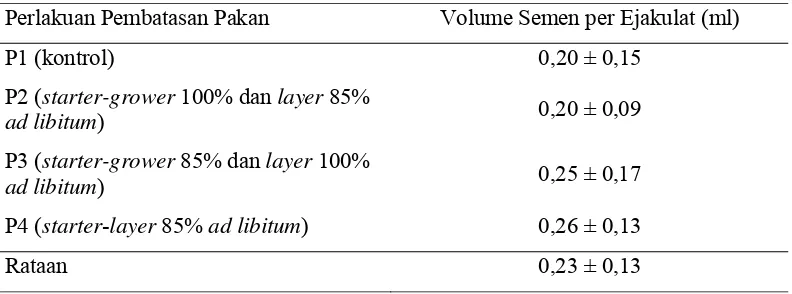
Tabel 9. Volume Semen per Ejakulat pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Volume Semen per Ejakulat (ml)
P1 (kontrol) 0,20 ± 0,15
P2 (starter-grower 100% dan layer 85%
ad libitum) 0,20 ± 0,09
P3 (starter-grower 85% dan layer 100%
ad libitum) 0,25 ± 0,17
P4 (starter-layer 85% ad libitum) 0,26 ± 0,13
Rataan 0,23 ± 0,13
Rataan volume semen per ejakulat yang didapatkan dari setiap perlakuan
pembatasan pakan, dibawah yang dilaporkan Setioko (1981) pada itik Pekin yaitu
yaitu 0,6-0,8 ml. Kemungkinan perbedaan ini timbul karena faktor galur dan strain
yang berbeda, umur ternak, seta faktor ukuran atau bobot badan.
Konsentrasi Spermatozoa
Penilaian konsentrasi sangat penting dalam penentuan kualitas semen.
Penghitungan konsentrasi yang digambarkan dengan volume dan persentase
spermatozoa motil memberikan jumlah spermatozoa motil per ejakulat, yaitu kualitas
yang menentukan berapa betina yang dapat diinseminasikan dengan ejakulat tersebut
(Hafez,1993). Konsentrasi spermatozoa semakin tinggi, kualitas semen semakin baik
dan semakin banyak pula jumlah betina yang dapat diinseminasikan.
Hasil sidik ragam menunjukkan bahwa perlakuan pembatasan pakan tidak
berpengaruh terhadap konsentrasi spermatozoa. Konsentrasi setiap perlakuan relatif
sama. Dugaan hal ini karena pembatasan pakan sudah mencukupi kebutuhan nutrisi
dan energi pada itik untuk mendukung konsentrasi spermatozoa yang optimal.
Konsentrasi spermatozoa pada setiap taraf perlakuan dapat dilihat pada Tabel 10.
Tabel 10. Konsentrasi Spermatozoa pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Konsentrasi Spermatozoa
(x 108 spermatozoa/ml)
P1 (kontrol) 7,600 ± 3,193
P2 (starter-grower 100% dan layer 85%
ad libitum) 6,225 ± 2,104
P3 (starter-grower 85% dan layer 100%
ad libitum) 8,053 ± 3,217
P4 (starter-layer 85% ad libitum) 6,240 ± 3,473
Rataan 7,057 ± 3,001
Rataan konsentrasi semen dari seluruh perlakuan dibawah yang dilaporkan
oleh Tan (1980) pada entog yaitu 10,800 x 108 spermatozoa/ml, dibawah juga yang
didapat oleh Zubir (1984) pada itik hasil persilangan antara itik lokal dengan itik
Manila yaitu 17,640 x 108 spermatozoa/ml dan sangat jauh dibawah yang didapat
oleh Setioko (1981) pada itik Pekin yaitu sebesar 91,600 x 108 spermatozoa/ml.
Perbedaan ini diduga disebabkan karena perbedaan bangsa ternak, umur ternak,
Jumlah Spermatozoa Per Ejakulat
Beberapa faktor lingkungan dan fisiologi yang mempengaruhi produksi
semen itik yaitu periode lamanya siang dan malam, musim, aktivitas sexual, umur
ternak, nutrisi, manajemen, keturunan, frekuensi penampungan semen dan teknik
penampungan semen (Setioko,1981). Hasil sidik ragam menunjukkan bahwa jumlah
spermatozoa per ejakulasi tidak dipengaruhi oleh perlakuan pembatasan pakan.
Jumlah spermatozoa per ejakulasi antar perlakuan mempunyai rata-rata jumlah yang
relatif sama. Pembatasan pakan tidak menimbulkan perbedaan antar perlakuan pada
jumlah spermatozoa per ejakulasi diperkirakan karena pembatasan pakan sudah
mencukupi kebutuhan nutrisi penting pada itik untuk produksi jumlah spermatozoa
per ejakulat yang memadai. Jumlah spermatozoa per ejakulat dari setiap perlakuan
pembatasan pakan disajikan pada Tabel 11.
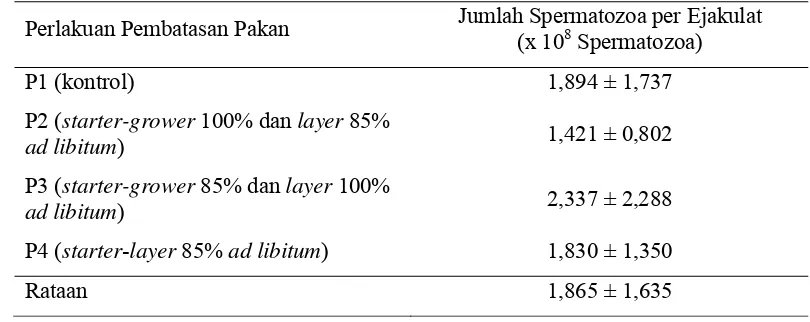
Tabel 11. Jumlah Spermatozoa per Ejakulat pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Jumlah Spermatozoa per Ejakulat
(x 108 Spermatozoa)
P1 (kontrol) 1,894 ± 1,737
P2 (starter-grower 100% dan layer 85%
ad libitum) 1,421 ± 0,802
P3 (starter-grower 85% dan layer 100%
ad libitum) 2,337 ± 2,288
P4 (starter-layer 85% ad libitum) 1,830 ± 1,350
Rataan 1,865 ± 1,635
Hasil rataan jumlah spermatozoa dari seluruh perlakuan lebih rendah dari
yang dilaporkan Chelmonska et al. (1962) pada itik Pekin yaitu 12,090 x 108
spermatozoa dan yang dilaporkan Setioko (1981) pada itik Pekin dengan rataan
42,300 x 109 spermatozoa. Tetapi jumlah spermatozoa yang diperoleh sudah
termasuk baik dan layak untuk digunakan inseminasi. Hal ini sesuai dengan yang
dikatakan Setioko (1981) bahwa jumlah spermatozoa yang memadai yaitu 50-100
juta spermatozoa untuk inseminasi setiap hari atau 150-200 juta spermatozoa untuk
Motilitas Spermatozoa
Motilitas spermatozoa adalah pergerakan spermatozoa yang berfungsi untuk
mencapai dan menembus ovum (Salisburry dan Van Demark, 1985). Faktor yang
mempengaruhi motilitas spermatozoa antara lain umur spermatozoa, energi ATP,
bagian-bagian agen yang aktif, faktor biofisikal dan psiologikal, kandungan cairan
dan stimulasi inhibisi (Hafez, 1993). Hasil sidik ragam menunjukkan perlakuan
pembatasan pakan tidak mempengaruhi motilitas spermatozoa. Pada perlakuan
pemberian pakan ad libitum (kontrol) dan pakan yang terbatas mempunyai rata-rata
motilitas spermatozoa yang relatif sama dimungkinkan hal ini karena pakan terbatas
sudah mencukupi kebutuhan nutrisi itik untuk mendukung pergerakan spermatozoa
yang progresif.Pada Tabel 12 disajikan motilitas spermatozoa dari setiap perlakuan
pembatasan pakan,
Tabel 12. Motilitas Spermatozoa pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Motilitas Spermatozoa (%)
P1 (kontrol) 71,18 ± 11,11
P2 (starter-grower 100% dan layer 85%
ad libitum) 75,00 ± 7,07
P3 (starter-grower 85% dan layer 100%
ad libitum) 67, 33 ± 18,70
P4 (starter-layer 85% ad libitum) 75,39 ± 7,76
Rataan 72,22 ± 12,11
Rataan konsentrasi semen yang didapatkan penelitian ini sesuai dengan yang
dikatakan Garner dan Hafez (1987) yang mengatakan bahwa motilitas pada unggas
berkisar antara 60-80% dan hasil ini hampir sesuai dengan yang didapat Setioko et
al. (2002) yaitu rata-rata berkisar antara 66-72% dan Bahr dan Bakst (1987) pada
unggas ayam yaitu 60-80%. Semen yang diperoleh termasuk kategori baik, karena
semen yang mengandung 50% sperma motil layak digunakan untuk inseminasi
buatan (Toelihere, 1985).
Viabilitas Spermatozoa
Viabilitas spermatozoa adalah jumlah spermatozoa yang hidup dari 100 ekor
perlakuan pembatasan pakan terhadap viabilitas spermatozoa. Seluruh perlakuan
mempunyai rata-rata viabilitas spermatozoa yang sama diduga hal ini karena
pembatasan pakan sudah memberikan asupan nutrisi yang memadai bagi itik untuk
produksi semen yang baik yang berkaitan dengan viabilitas spermatozoanya. Pada
Tabel 13 tersaji viabilitas spermatozoa pada setiap perlakuan pembatasan pakan.
Tabel 13. Viabilitas Spermatozoa pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Viabilitas Spermatozoa (%)
P1 (kontrol) 81,65 ± 6,64
P2 (starter-grower 100% dan layer 85%
ad libitum) 82,56 ± 4,34
P3 (starter-grower 85% dan layer 100%
ad libitum) 84, 13 ± 6,56
P4 (starter-layer 85% ad libitum) 83, 75 ± 3,93
Rataan 82, 92 ± 5,52
Rata-rata viabilitas dari seluruh kelompok perlakuan adalah 82,92% dan
hasil ini dibawah yang dilaporkan Setioko et al. (2002) yang berkisar 92-94%
Perbedaan ini diduga terjadi karena perbedaan bangsa, umur ternak, berat badan
ternak dan lingkungan. Hasil ini sudah mensyarati untuk semen normal yang baik
dari yang pernah dilaporkan oleh Chemineau et al. (1991) tentang kisaran jumlah
spermatozoa mati untuk semen normal, menurutnya jumlah semen yang
mengandung 20-30% spermatozoa mati adalah normal. Berarti, untuk 20-30%
spermatozoa mati, jumlah spermatozoa hidup atau viabilitas 70-80% dan hasil yang
yang didapat pada penelitian ini lebih baik dari yang dikatakan Chemineau et al.
Abnormalitas Spermatozoa
Penghitungan abnormalitas spermatozoa meliputi penghitungan dari
spermatozoa yang keluar dari morfologi normal. Seperti yang dikatakan Nalbandof
(1990) bahwa penyimpangan dari morfologi normal dianggap sebagai abnormalitas.
Bentuk-bentuk abnormalitas spermatozoa menurut Hafez (1993) yaitu mikrocepalik,
makrocepalik, kepala pendek melebar, kepala sempit memanjang, kepala kepala
pyriformis, kepala ganda, ekor ganda, bagian tengah membengkak, ekor melingkar,
yang distal dan bagian tengah membengkak, dan akrosom yang terlepas. Hasil sidik
ragam menunjukkan tidak ada pengaruh perlakuan pembatasan pakan terhadap
abnormalitas spermatozoa, tetapi menimbulkan pengaruh nyata (P<0,05) pada satu
macam keadaan abnormalitasnya yaitu pada ekor buntung, dan tidak menimbulkan
pengaruh pada beberapa macam abnormalitas spermatozoa lainnya.
Tabel 14. Abnormalitas Spermatozoa pada Setiap Perlakuan Pembatasan Pakan
Perlakuan Pembatasan Pakan Abnormalitas Spermatozoa (%)
P1 (kontrol) 21,76 ± 9,00
P2 (starter-grower 100% dan layer 85%
ad libitum) 19,28 ± 3, 97
P3 (starter-grower 85% dan layer 100%
ad libitum) 19.47 ± 6,76
P4 (starter-layer 85% ad libitum) 22,08 ± 7,97
Rataan 20,55 ± 7,01
Pada Tabel 14 dapat dilihat nilai rataan abnormalitas spermatozoa untuk
semua perlakuan yaitu 20,55%, hampir sesuai dengan yang dikatakan Parker et al.
(1974) bahwa spermatozoa abnormal yang ditemukan dalam beberapa ejakulasi
berkisar 5-20%. Hasil ini hampir sesuai dengan yang dikatakan Toelihere (1981)
tentang abnormalitas semen yang layak digunakan untuk inseminasi tidak lebih dari
20%. Beberapa perlakuan lebih tipis diatas angka 20% yaitu perlakuan kontrol (P1)
dan P4 yang jumlah abnormalitasnya 21,76% dan 22,08% tetapi tidak sampai
menimbulkan perbedaan nyata dengan perlakuan P2 dan P3 yang abnormalitasnya
dibawah 20%.
Pada Tabel 15 dapat dilihat besar macam keadaan abnormalitas pada setiap
taraf perlakuan pemberian pakan. Beberapa keadaan abnormalitas yaitu kepala
bengkak, kepala rusak dan ekor patah tidak menimbulkan perbedaan nyata sebagai
akibat respon perlakuan. Hanya pada ekor buntung terdapat pengaruh perlakuan,
perlakuan kontrol (P1) yang pemberian pakannya ad libitum justru mempunyai
jumlah terbesar ekor buntung yaitu 5,71% dan menimbulkan perbedaan nyata
(P<0,05) dengan perlakuan P3 yang mempunyai jumlah ekor buntung paling sedikit
kelebihan energi yang disimpan dalam bentuk kelebihan lemak tubuh pada organ
reproduksinya yang berpengaruh pada produksi spermatozoa yang dihasilkan. Sesuai
dengan yang dikatakan Tillman et al. (1998) bahwa pakan berlebih pun bisa
berdampak tidak baik terhadap produksi spermatozoa karena pada organ reproduksi
hewan akan terjadi penumpukan lemak yang berpengaruh buruk terhadap produksi
spermatozoa.
Tabel 15. Macam Keadaan Abnormalitas Spermatozoa pada Setiap Perlakuan Pembatasan Pakan
Perlakuan
Macam Abnormalitas (%)
Kepala Bengkak
Kepala Rusak
Ekor Patah
Ekor Buntung
P1 (kontrol) 7,88 ± 3,26 4,77 ± 1,97 3,41 ± 1,41 5,71 ± 2,36 a
P2 11,00 ± 2,23 4,72 ± 0,96 0,94 ± 0,19 2,56 ± 0,52 ab
P2 10,27 ± 3,07 5,47 ± 1,64 1,47 ± 0,44 2,07 ± 0,62 b
P4 12,75 ± 4,60 5,92 ± 2,14 1,00 ± 0,36 2,42 ± 0,87 ab
Rataan 10,31 ± 3,51 5,15 ± 1,76 1,76 ± 0,60 3,27 ± 1,11
Ket: P1=pakan starter-grower dan layer ad libitum (kontrol), P2=pakan starter-grower 100% dan layer 85% ad libitum, P3=pakan starter-grower 85% dan layer 100% ad libitum, P4=pakan starter-grower dan layer 85% ad libitum
KESIMPULAN DAN SARAN
Kesimpulan
Warna dan konsistensi semen seluruh perlakuan sebagian besar putih dan
kental. Gerakan massa spermatozoa seluruh perlakuan sebagian besar bernilai (+++)
dan (++++), hanya pada perlakuan P3 terdapat gerakan massa spermatozoa yang
bernilai (+) sebesar 13,33%, hasil ini menunjukkan kualitas semen yang tidak layak
digunakan untuk inseminasi.
Perlakuan pembatasan pakan tidak berpengaruh terhadap volume semen per
ejakulat, konsentrasi spermatozoa, jumlah spermatozoa per ejakulat, motilitas,
viabilitas, dan abnormalitas spermatozoa serta pada beberapa keadaan
abnormalitasnya yaitu pada kepala bengkak, kepala rusak dan ekor patah Terdapat
pengaruh pembatasan pakan (P<0,05) hanya pada macam abnormalitas ekor buntung.
Perlakuan P1 (kontrol) yang pemberian pakannya ad libitum justru mempunyai
jumlah ekor buntung terbanyak sampai pada tingkat menimbulkan perbedaan nyata
dengan perlakuan P3 (pakan starter-grower 85% dan layer 100% ad libitum).
Saran
Perlu dilakukan penelitian lanjutan dengan jumlah unit percobaan ekor itik
dan ulangan yang lebih banyak dengan kisaran waktu penelitian yang panjang untuk
mendapatkan informasi karakteristik semen segar dari berbagai tingkat umur,
sehingga akan diperoleh informasi tentang umur ternak yang menghasilkan kualitas
UCAPAN TERIMA KASIH
Puji dan syukur penulis panjatkan hanya kepada Allah semata yang telah
melimpahkan rahmat dan karunia-Nya yang tak terhingga, sehingga dengan
pertolongan-Nya penulis bisa menyelesaikan skripsi ini.
Penulis mengucapkan banyak terima kasih kepada kedua orang tua yang telah
banyak pengorbanannya dan tidak pernah berhenti baik materi, motivasi serta kasih
sayang yang diberikannya. Penulis juga mengucapkan banyak terima kasih kepada
Ir. Niken Ulupi, MS dan Dr. Ir. Pius P. Ketaren, MAgrSc selaku pembimbing utama
dan pembimbing anggota yang dengan sabar dan telaten telah banyak mencurahkan
waktu, bimbingan dan intelektualnya hingga tahap akhir penulisan skripsi. Terima
kasih kepada Dr. Ir. Cece Sumantri, MAgrSc dan Dr. Ir. Sumiati, MSc yang telah
bersedia menjadi penguji sehingga penulis mendapatkan banyak masukan dan
perbaikan yang berharga. Berikutnya penulis haturkan ucapan terima kasih yang
tulus kepada Ir. Hotnida C.H. Siregar, MS selaku pembimbing akademik yang telah
banyak memberi arahan, semangat dan membesarkan hati penulis sepanjang masa
studi perkuliahan.
Ucapan terima kasih penulis sampaikan kepada Balai Penelitian Ternak yang
telah memberi kesempatan dan fasilitas untuk melakukan penelitian di sana. Terima
kasih juga penulis haturkan kepada Bapak Ajum dan Bapak Pipih yang banyak
membantu dan mengajar penulis dalam koleksi semen. Penulis juga mengucapkan
rasa terima kasih yang dalam kepada Ibu Resmi yang dengan sabar telah banyak
menolong penulis dan mengajar dalam evaluasi semen. Kepada seluruh staff
manajeman Balitnak yang banyak memberi bantuan dalam penelitian ini yang tidak
dapat disebutkan satu per satu namanya.
Terakhir penulis ucapkan terima kasih kepada civitas akademik Fakultas
Peternakan IPB dan kepada rekan-rekan sekalian yang telah membantu yang tidak
bisa disebutkan namanya satu per satu. Semoga skripsi ini dapat bermanfaat bagi
yang membacanya.
Bogor, Oktober 2006
DAFTAR PUSTAKA
Achmanu. 1997. Ilmu Ternak Itik. Karangan Ilmiah. Fakultas Peternakan Universitas Brawijaya, Malang.
Bahr, J.M. and M.R. Bakst. 1987. Poultry. Dalam: E.S.E. Hafes (Ed). Reproduction in Farm Animals 5th Ed. Lea and Febriger, Philadhelphia.
Bunan, A.T. 1990. Reproductive performance as influenced by nutritional management in chickens selected for aspects of growth and body composition. Proceeding of The Australian Poultry Science Symposium. p: 119 (Abstr.).
Chelmonska, B., H. Galuszkowa and J. Lisieky. 1962. Electroejaculation in drakes. Med. Water. 18: 712-714.
Chemineau, P., Y. Cagnie, Y. Gverin, P. Orgeur and J.C. Vallet. 1991. Training Manual of Artificial Insemination in Sheep and Goat. FAO, Rome.
Dinas Peternakan Daerah Tingkat I Propinsi Jawa Timur .1995. Laporan pemantapan standar bibit unggas di Jawa Timur. Dinas Peternakan Daerah Tingkat I Jawa Timur, Surabaya.
Etches, R.J. Reproduction in Poultry. Cab International, Canada.
Evans, G. dan W.M.C. Maxwell. 1987. Salamon’s Artificial Insemination of Sheep and Goat. Butterworths, London.
Garner, D.L. dan E.S.E. Hafez. 1987. Spermatozoa and seminal plasma. Dalam: E.S.E. Hafez (Ed). Reproduction in Farm Animals. 5th Ed. Lea and Febiger, Philadelphia.
Gowe, R.S., A.S. Johnson, R.D. Crawford, J.H. Strain. 1960. Restricted vs full-feeding during the growing period for egg production stock. British Poult. Sci. 1: 37-56.
Hafez, E.S.E. 1993. Reproduction In Farm Animals. Lea and Febiger, Philadelphia.
Hardjosworo, P.S. 1989. Budidaya Itik Petelur. Fakultas Politeknik Pertanian. Institut Pertanian Bogor, Bogor.
Herrick, J.B. dan H.L. Self.1962. Evaluation of Fertility in The Bull and Boar. State University Press, Ames, Iowa, USA.
Hocking, P.M. 1993. Effect of body weight at sexual maturity and the degree and age of restriction during rearing on the ovarian follicular hierarchy of broiler breeder females. Brit. Poult. Sci. 34: 793-801.
Katanabaf, M.N., E.A. Dunnington and P.B. Siegel. 1989. Restricted feeding in early and late-feathering chickens. 3. Organ size and carcass composition. Poult. Sci. 68: 359-368.