ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI DAUN
LEGUNDI (Vitex trifolia L)
SKRIPSI
IREKHA RAMOT OLIVIA PARAPAT
120822008
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS
ANTIBAKTERI MINYAK ATSIRI DAUN
LEGUNDI (Vitex trifolia L)
SKRIPSI
Diajukkan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
IREKHA RAMOT OLIVIA PARAPAT
120822008
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : ANALISIS KOMPONEN KIMIA DAN UJI
AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAUN LEGUNDI (Vitex trifolia L)
Kategori : SKRIPSI
Nama : Irekha Ramot Olivia Parapat
Nomor Induk Mahasiswa : 120822008
Program Studi : SARJANA (S-1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU
PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2014 Komisi Pembimbing
Pembimbing 2, Pembimbing 1,
Dr. Mimpin Ginting,MS Drs. Darwis Surbakti, M.S NIP:195510131986011001 NIP:195307071983031001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ANALISIS KOMPONEN KIMIA DAN UJI AKTIVITAS ANTIBAKTERI MINYAK ATSIRI DAUN LEGUNDI (Vitex trifolia L)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2014
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus, yang telah
melimpahkan kasih dan karuniaNya sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk menyelesaikan pendidikan Sarjana Sains di fakultas MIPA USU. Adapun judul skripsi adalah “Analisis Komponen Kimia dan Uji Aktivitas Antibakteri Minyak Atsiri Daun Legundi (Vitextrifolia L)”.
Penyelesaian skripsi ini tidak terlepas dari bantuan, masukan dan dukungan dari berbagai pihak. Oleh karena itu, dalam kesempatan ini penulis ingin menyampaikan terima kasih kepada :
1. Ibu Dr. Rumondang Bulan, MS dan Bapak Albert Pasaribu, M.Sc selaku Ketua dan Sekertaris Departemen Kimia, serta seluruh staff pengajar Departemen Kimia FMIPA USU yang telah membimbing penulis selama perkuliahan.
2. Bapak Drs. Darwis Surbakti, MS selaku pembimbing I dan Bapak Dr. Mimpin Ginting, MS selaku pembimbing II yang telah meluangkan waktu selama penulis melakukan penelitian dan penyusunan skripsi ini hingga selesai.
3. Kedua orang tua penulis, bapak H. Parapat dan Ibu R. Sidabutar, Opung penulis T. Simanjuntak, serta saudara-saudari penulis (Sofyan, Riccad dan Maylyta) yang telah banyak mendukung baik dalam doa dan juga dukungan semangat kepada penulis.
4. Teman-teman terkasih seperjuangan stambuk 2012 kimia ekstensi yang tidak dapat disebutkan namanya satu per satu namun tulus membantu penulis dalam menyelesaikan skripsi ini.
Semoga Tuhan Yang Maha Esa dengan segala kebaikan dan
kemurahannya memberkati Bapak/Ibu serta saudara-saudari sekalian yang telah meluangkan waktu dan pemikiran serta memberikan motivasi kepada penulis.
ABSTRAK
Minyak atsiri daun legundi ( Vitex trifolia L) diisolasi dengan metode
ANALYSIS OF CHEMICAL COMPONENTS AND ANTIBACTERIAL ACTIVITY IN ESSENTIAL OIL FROM Vitex trifolia L LEAVES
ABSTRACT
Essential oil of Vitex trifolia L leaves have been isolated with hydrodistillation method using Sthal. Vitex trifolia L leaves have hydrodestillated for ±4-5 hours produced essential oil 0,18% (b/b). Chemical components in essential oil of Vitex trifolia L leaves have been analyzed use GC-MS shows 24 compounds and some major compounds such as 1,8 cineole (24,35 %), Sabinene (19,10 %), β-
Caryophyllen (17,49%), α-pinene (10,06%), β-pinene (4,07%), α-terpineol (4,07 %) and 7-oktene-4-ol (2,99%). Antibacterial activity test of Vitex trifolia L leaves have been done using diffuse agar method which essential oil of Vitex trifolia L
2.5. Antibakteri 22
2.5.1. Metode Difusi
23
2.5.2. Metode Dilusi 23
Bab 3. Metodologi Penelitian
3.1. Alat-alat 24
3.2. Bahan-bahan 24
3.3. Prosedur Penelitian 25
3.3.1. Penyediaan Sampel 25
3.3.2. Isolasi Minyak Atsiri Daun legundi
dengan Alat Stahl 25
3.3.3. Analisa Minyak Atsiri Daun legundi
dengan GC-MS 26
3.3.4. Pengujian Sifat Antibakteri Minyak Atsiri
Daun legundi 27
3.3.4.1. Pembuatan Media Nutrient Agar (NA) 27 3.3.4.2. Pembuatan Media Agar Miring dan Stok Kultur
bakteri 27
3.3.4.3. Pembuatan Media Mueller Hinton Agar
(MHA) 27
3.3.4.4. Penyiapan Inokulum Bakteri 27 3.3.4.5. Pembuatan Variasi Konsentrasi Minyak Atsiri Daun legundi (Vitex trifolia L) 28 3.3.4.6. Uji Aktivitas Antibakteri Minyak Atsiri
Daun legundi 28
3.4. Bagan Penelitian 29
3.4.1. Isolasi Minyak Atsiri Daun legundi
dengan Alat Sthal 29
3.4.2. Pengujian Sifat Antibakteri Minyak Atsiri
Daun legundi 30
3.4.2.1. Pembuatan Media Nutrient Agar (NA)
Miring dan Stok kultur Bakteri 30 3.4.2.2. Pembuatan Media Mueller Hinton Agar
(MHA) 31
3.4.2.3. Penyiapan Inokulum Bakteri 31 3.4.2.4. Uji Aktivitas Antibakteri 32 Bab 4. Hasil Dan Pembahasan
4.1. Hasil Penelitian 33
4.1.1. Penentuan volume Minyak Atsiri 33 4.1.2. Hasil Analisa dengan GC-MS 33 4.1.3. Hasil Uji Aktivitas Antibakteri 36
4.2. Pembahasan 37
4.2.1. Minyak Atsiri dari Hasil Destilasi
dengan Alat Stahl 37
Bab 5. Kesimpulan Dan Saran
5.1. Kesimpulan 54
5.2. Saran 54
Daftar Pustaka 55
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1 Perbedaan relatif sifat bakteri gram positif dan 22 bakteri gram negatif
4.1 Hasil Hidrodestilasi Minyak Atsiri Daun legundi 33 4.2 Senyawa Hasil Analsia GC-MS Minyak Atsiri Daun legundi 35 4.3 Hasil Pengukuran diameter zona bening beberapa 37
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2. 1 Daun legundi (Vitex trifolia L) 5
2. 2 Reaksi Biosintesis Terpenoid 10
2. 3 Perubahan senyawa monoterpen 11
2. 4 Reaksi Biogenetik beberapa seskuiterpen 12
2. 5 Diagram Spektrometer Massa 19
2. 6 Streptococcus mutans 20
2. 7 Esherichia coli 21
4. 1 Kromatogram hasil analisa GC minyak atsiri daun Legundi 34
4. 2 Zona hambat dari minyak atsiri daun legundi 36
4. 3 Spektrum massa senyawa1,8 sineol 38
4. 4 Pola fragmentasi dari senyawa 1,8 sineol 39
4. 5 Spektrum massa senyawa Sabinen 40
4. 6 Pola fragmentasi dari Sabinen 41
4. 7 Spektrum masssa senyawa β-kariofilen 42
4. 8 Pola fragmentasi dari senyawa β-kariofilen 43
4. 9 Spektrum massa senyawa α-pinen 44
4.10 Pola fragmentasi dari senyawa α-pinen 45
4.11 Spektrum massa senyawa β-pinen 46
4.12 Pola fragmentasi dari senyawa β-pinen 47
4.13 Spektrum massa senyawa 7-okten-4-ol 48
4.14 Pola fragmentasi dari senyawa 7-okten-4-ol 49
4.15 Spektrum massa senyawa α-terpineol 50
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lamp
1. Hasil Identifikasi Tumbuhan 58
2. Alat Stahl 59
ABSTRAK
Minyak atsiri daun legundi ( Vitex trifolia L) diisolasi dengan metode
ANALYSIS OF CHEMICAL COMPONENTS AND ANTIBACTERIAL ACTIVITY IN ESSENTIAL OIL FROM Vitex trifolia L LEAVES
ABSTRACT
Essential oil of Vitex trifolia L leaves have been isolated with hydrodistillation method using Sthal. Vitex trifolia L leaves have hydrodestillated for ±4-5 hours produced essential oil 0,18% (b/b). Chemical components in essential oil of Vitex trifolia L leaves have been analyzed use GC-MS shows 24 compounds and some major compounds such as 1,8 cineole (24,35 %), Sabinene (19,10 %), β-
Caryophyllen (17,49%), α-pinene (10,06%), β-pinene (4,07%), α-terpineol (4,07 %) and 7-oktene-4-ol (2,99%). Antibacterial activity test of Vitex trifolia L leaves have been done using diffuse agar method which essential oil of Vitex trifolia L
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Minyak atsiri yang juga disebut minyak eteris merupakan minyak yang mudah menguap dengan komposisi yang berbeda-beda sesuai sumber penghasilnya. Hampir seluruh tanaman penghasil minyak atsiri yang saat ini tumbuh diwilayah Indonesia sudah dikenal oleh sebagian masyarakat. Bahkan beberapa jenis tanaman minyak atsiri menjadi bahan yang sangat penting dalam kehidupan sehari-hari. Minyak atsiri dihasilkan dari bagian jaringan tanaman tertentu seperti akar, batang, kulit, daun, bunga, buah, atau biji. Sifat minyak atsiri yang menonjol antara lain mudah menguap pada suhu kamar, mempunyai rasa getir, berbau wangi sesuai dengan aroma tanaman yang menghasilkannya, dan umumnya larut dalam pelarut organik (Lutony, 2000).
Pemilihan bakteri Eschericia coli merupakan bagian dari mikrobiota normal saluran pencernaan yang apabila jumlahnya mengalami peningkatan didalam usus akan menyebabkan diare sedang sampai gawat yang kadang-kadang timbul pada manusia (Volk, A. 1989). Streptococcus mutans merupakan penyebab karies pada gigi ( Pelczar, 1988).
Yulianti, 2011 melakukan penelitian analisa komponen minyak atsiri dari daun legundi keringsecara kromatografi Gas – Spektrometri massa (GC-MS) diperoleh lima komponen utama minyak atsiri dalam daun legundi yang berasal dari magelang yaitu 1,8 sineol, kariofilen, α-pinen, sabinen, α-terpineol asetat dan 3-sikloheksan-1-ol dan Pengujian aktivitas antibakteri dari minyak atsiri daun legundi memberikan hasil yang baik terhadap bakteri Staphylococcus epidermidis, Shigella flexneri, Streptococcus pyogenens dan Proteus mirabilis. Beberapa penelitian uji aktivitas antibakteri ekstrak dari tumbuhan legundi telah banyak dilakukan. Daun legundi yang diekstrak dengan Kloroform dan metanol menunjukkan hasil yang cukup baik untuk menghambat bakteri Mycobacterim tuberculosis H37Rv (Karuniawati, H et al, 2009). Natheer et al, 2012 melakukan penelitian uji aktivitas antibakteri terhadap ekstrak metanol, etanol, etil asetat daun legundi yang menunjukkan hasil cukup baik terhadap bakteri Eschericia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Klebsiella pneumonia,
Streptococcus sp, Shigella flexineri, Proteus mirabilis, Pseudomonas diminuta,
Pseudomonas fluorescens, Enterobacter cloacae, S. aureus ATCC 6538, E. coli
ATCC 25922.
1.2. Permasalahan
1. Komponen senyawa kimia utama apakah yang terdapat dalam minyak atsiri daun legundi yang berasal dari daerah Padang Bulan, Medan
2. Bagaimanakah aktivitas antibakteri minyak atsiri daun legundi (Vitex trifolia L) terhadap bakteri Eschericia coli dan Streptococcus mutans
dengan metode difusi agar
1.3. Pembatasan Masalah
1. Daun legundi diperoleh dari daerah pasar 1 padang bulan Medan, kecamatan Medan Baru
2. Minyak atsiri daun legundi diperoleh dengan metode hidrodestilasi menggunakan alat stahl
3. Minyak atsiri daun legundi diuji terhadap bakteri Eschericia coli dan
Streptococcus mutans dengan metode difusi agar
1.4. Tujuan
1. Untuk mengetahui komponen senyawa kimia utama yang terdapat dalam minyak atsiri daun legundi yang berasal dari daerah padang bulan, Medan melalui analisa GC-MS
2. Untuk mengetahui aktivitas antibakteri minyak atsiri daun legundi terhadap bakteri Eschericia coli dan Streptococcus mutans dengan metode difusi Agar
1.5. Manfaat
1.6. Lokasi Penelitian
Penelitian untuk isolasi minyak atsiri dilakukan di Laboratorium Kimia Organik FMIPA-USU Medan. Uji aktivitas antibakteri dilakukan di laboratorium Mikrobiologi Fakultas Farmasi USU, analisa spektroskopi GC-MS dilakukan di Laboratorium FMIPA-UGM.
1.7. Metodologi Penelitian
Penelitian ini dilakukan melalui eksperimen laboratorium. Dimana minyak atsiri daun legundi diperoleh dengan metode hidrodestilasi menggunakan alat Stahl. Minyak atsiri yang diperoleh dipisahkan dari lapisan airnya kemudian ditambahkan Na2SO4 anhidrous untuk menghilangkan kandungan airnya,
kemudian didekantasi. Minyak atsiri yang diperoleh dianalisa dengan metode GC-MS untuk mengetahui komponen kimianya, serta dilakukan pengujian aktivitas antibakteri terhadap Escherchia coli dan Streptococcus mutans dengan metode difusi agar.
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Legundi (Vitex trifolia L)
Berdasarkan taksonomi tanaman, daun legundi termasuk dalam : Kerajaan : Plantae
Divisi : Spermatophyta Kelas : Dicotyledonae Bangsa : Lamiales Suku : Verbenaceae Marga : Vitex
Jenis : Vitex trifolia L.
Nama Daerah : Gendarasi (palembang), Lagundi, Lilegundi (Minangkabau), Lagondi (sunda), Legundi (jawa), Galumi (sumbawa), Sangari (bima), Lenra (makasar), Lawarani (bugis), Ai tuban (ambon)
Nama Asing : Man Jing ( Cina), simpleleaf shrub chastetree (inggris) (Heyne, 1981).
Legundi tumbuh pada tempat-tempat yang tandus, panas dan berpasir. Ditemukan tumbuh liar dihutan jati, hutan sekunder, semak belukar, atau dipelihara sebagai tanaman pagar.
Gambar 2.1. Tanaman Legundi
pangkal runcing, tepi rata, pertulangan menyirip, permukaan atas berwarna hijau, permukaan bawah berambut rapat warna putih, panjang 4-9,5 cm, lebar 1,75-3,75 cm. Bunga majemuk berkumpul dalam tandan, berwarna ungu muda, keluar dari ujung tangkai. Buahnya berbentuk bulat. Daun berbau aromatik khas dan dapat digunakan untuk menghalau serangga atau kutu lemari (Dalimartha, 2000).
Beberapa senyawa kimia yang terkandung dalam legundi diantaranya
camphene, L-α-pinene, silexicarpin, casticin, terpenyl acetate,
luteolin-7-glucoside flavopurposid, vitrisin, dihidroksi asam benzoate dan vitamin A. Efek farmakologis legundi diantaranya sebagai obat influenza, demam, migren, sakit kepala, sakit gigi, sakit perut, mata merah, diare, rematik, beri-beri, batuk, luka terpukul, luka berdarah, muntah darah, eksim, haid tidak teratur, dan pembunuh serangga (Hariana, A. 2009).
Daun legundi berkhasiat sebagai analgesik, antipiretik, obat luka, peluruh kencing, peluruh kentut, pereda kejang, germicide (pembunuh kuman), batuk kering, batuk rejan, beri-beri, sakit tenggorokan, muntah darah, obat cacing, demam nifas, sakit kepala, TBC, turun peranakan, tipus dan peluruh keringat. Pada pemakaian luar digunakan untuk mengatasi eksim dan kurap (Sudarsono dkk, 2002).
Daun legundi dikonsumsi untuk meningkatkan daya ingat, mengurangi rasa sakit, menghilangkan rasa tidak enak dimulut dan menyembuhkan demam (Kirtikar and Basu, 1991).
Ekstrak daun legundi bermanfaat sebagai antikanker (Ghani, 1998). Bunga dari legundi dengan campuran madu dapat mengatasi demam yang disertai muntah (Batthacharjee and De 2005).
2.2. Minyak Atsiri
Ditinjau dari sumber alami minyak atsiri, substansi mudah menguap ini dapat dijadikan sebagai sidik jari atau ciri khas dari suatu jenis tumbuhan karena setiap tumbuhan menghasilkan minyak atsiri dengan aroma yang berbeda. Dengan kata lain, setiap jenis tumbuhan menghasilkan minyak atsiri dengan aroma yang spesifik. Memang ada beberapa jenis minyak atsiri yang memiliki aroma yang mirip, tetapi tidak persis sama, dan sangat bergantung pada komponen kimia penyusun minyak tersebut.
Minyak atsiri, minyak mudah menguap, atau minyak terbang, merupakan campuran dari senyawa yang berwujud cairan atau padatan yang memiliki komposisi maupun titik didih yang beragam. Minyak atsiri dibagi menjadi dua kelompok, yaitu :
1. Minyak atsiri yang dengan mudah dapat dipisahkan menjadi komponen-komponen atau penyusun murninya. Komponen-komponen-komponen ini dapat menjadi bahan dasar untuk diproses menjadi produk-produk lain, contoh : minyak sereh, minyak daun cengkeh, minyak permai, dan minyak terpentin.
2. Minyak atsiri yang sukar dipisahkan menjadi komponen murninya. Contohnya : minyak akar wangi, minyak nilam, dan minyak kenanga. Biasanya minyak atsiri tersebut langsung dapat digunakan tanpa diisolasi komponen-komponennya sebagai pewangi berbagai produk (Sastrohamidjojo, 2004).
2.2.1. Komposisi Kimia Minyak Atsiri
Pada umumnya perbedaan komposisi minyak atsiri disebabkan perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia yang terbentuk dari unsur karbon (C), Hidrogen (H), dan Oksigen (O). Pada umumnya komponen kimia minyak atsiri dibagai menjadi dua golongan, yaitu: 1. Hidrokarbon yang terutama terdiri dari persenyawaan terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur Karbon (C), dan Hidrogen (H). Jenis Hidrokarbon yang terdapat dalam minyak atsiri sebagian besar terdiri dari monoterpen (2 unit isopren), sesquiterpen (3 unit isopren), diterpen (4 unit isopren), dan politerpen.
2. Hidrokarbon teroksigenasi
Komponen kimia dari golongan ini terbentuk dari unsur Karbon (C), Hidrogen (H), dan Oksigen (O). Persenyawaan yang termasuk dalam golongan ini adalah persenyawaan alkohol, aldehid, ester, fenol. Ikatan Karbon yang terdapat dalam molekulnya dapat terdiri dari ikatan tunggal, ikatan rangkap dua dan ikatan rangkap tiga. Terpen mengandung ikatan tunggal dan ikatan rangkap dua. Senyawa terpen memiliki aroma kurang wangi, sukar larut dalam alkohol encer dan jika disimpan dalam waktu lama akan membentuk resin. Golongan hidrokarbon teroksigenasi merupakan senyawa yang penting dalam minyak atsiri karena umumnya aroma yang lebih wangi. Fraksi terpen perlu dipisahkan untuk tujuan tertentu, misalnya untuk pembuatan parfum, sehingga didapatkan minyak atsiri yang bebas terpen (Ketaren, 1985).
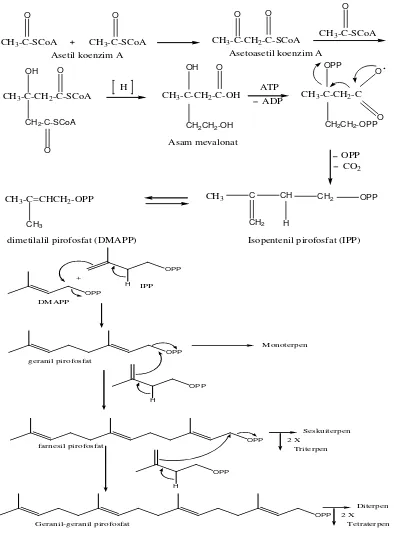
2.2.2. Biosintesa Pembentukan Minyak Atsiri
Minyak atsiri pada umumnya mengandung persenyawaan terpena dalam jumlah yang besar, dimana terpena merupakan persenyawaan hidrokarbon tidak jenuh dan unit terkecil dalam molekulnya disebut dengan isoprene (C5H8) (Agusta,2000).
Mekanisme dari tahap-tahap reaksi biosintesis terpenoid yaitu asam asetat yang telah diaktifkan oleh koenzim A melalui kondensasi jenis Claisen menghasilkan asam asetoasetat. Senyawa yang dihasilkan ini dengan koenzim A melakukan kondensasi sejenis aldol menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat. Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi asam fosfat dan dekarboksilasi menghasilkan IPP (Isopentenil Pirofosfat) yang selanjutnya berisomerisasi menjadi DMAPP (Dimetilalil Pirofosfat) oleh enzim isomerase, IPP sebagai unit isoprene aktif bergabung secara kepala ke ekor dengan DMAPP dan penggabungan ini merupakan langkah pertama dari polimerisasi isoprene untuk menghasilkan terpenoid. Penggabungan ini terjadi karena serangan electron dari ikatan rangkap IPP terhadap atom karbon dari DMAPP yang kekurangan electron diikuti oleh penyingkiran ion pirofosfat. Serangan ini menghasilkan geranil pirofosfat (GPP) yakni senyawa antara bagi semua senyawa monoterpen.
Penggabungan selanjutnya antara satu unit IPP dan GPP, dengan mekanisme yang sama seperti antara IPP dan DMAPP menghasilkan Farnesil Pirofosfat (FPP) yang merupakan senyawa antara bagi semua senyawa seskuiterpen. Senyawa-senyawa diterpen diturunkan dari geranil-geranil pirofosfat (GGPP) yang berasal dari kondensasi antara satu unit IPP dan FPP dengan mekanisme yang sama.
reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam suasana netral dan pada suhu kamar, seperti isomerasi, dehidrasi, dekarboksilasi dan sebagainya. Berikut ini adalah gambar biosintesa terpenoid dapat dilihat pada gambar dibawah ini :
CH3-C-SCoA
Asetil koenzim A Asetoasetil koenzim A
CH3-C-CH2-C-SCoA
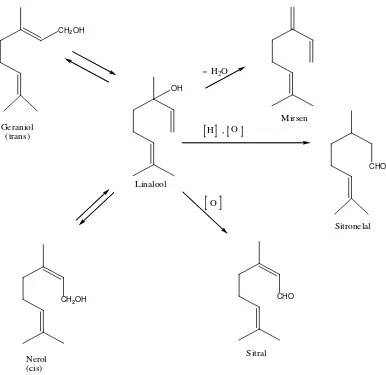
Untuk menjelaskan hal diatas dapat diambil beberapa contoh monoterpen. Dari segi biogenetik, perubahan geraniol, nerol, dan linalool dari satu menjadi yang lain berlangsung sebagai akibat reaksi isomerasi. Ketiga alkohol ini, yang berasal dari hidrolisa geranil pirofosfat (GPP) dapat menjalai reaksi-reaksi sekunder berikut, misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi menghasilkan sitronelal. Berikut ini contoh perubahan senyawa monoterpen dapat dilihat pada gambar 2.3.
CH2OH
Gambar 2.3. Perubahan senyawa monoterpen (Achmad, 1986)
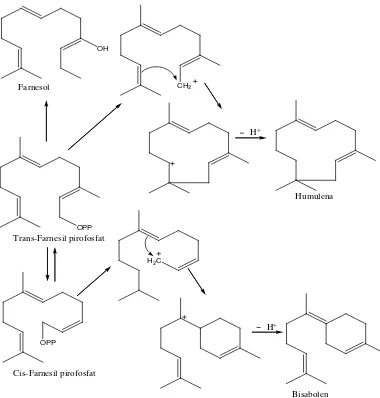
OH
Farnesol
OPP
Trans-Farnesil pirofosfat
OPP
Cis-Farnesil pirofosfat
CH2
H+
Humulena
H2C
H+
Bisabolen
Gambar 2.4. Reaksi biogenetik beberapa seskuiterpen (Achmad, 1986)
2.2.3. Isolasi Minyak Atsiri dengan Destilasi
Destilasi dapat didefenisikan sebagai cara penguapan dari suatu zat dengan perantara uap air dan proses pengembunan berdasarkan perbedaan titik didihnya. Destilasi merupakan metode yang paling berfungsi untuk memisahkan dua zat yang berbeda, tetapi tergantung beberapa faktor, termasuk juga perbedaan tekanan uap air (berkaitan dengan perbedaan titik didihnya) dari komponen-komponen tersebut (Pasto, 1992).
dapat terbuka selebar mungkin. Tujuan lainnya yaitu agar rendemen minyak menjadi lebih tinggi dan waktu penyulingan lebih singkat (Lutony, 2000).
Minyak atsiri, minyak mudah menguap, atau minyak terbang merupakan campuran dari senyawa yang berwujud cairan atau padatan yang memiliki komposisi maupun titik didih yang beragam. Penyulingan dapat didefenisikan sebagai proses pemisahan komponen-komponen suatu campuran yang terdiri atas dua cairan atau lebih berdasarkan perbedaan titik didih komponen-komponen senyawa tersebut. Proses penyulingan sangat penting diketahui oleh para penghasil minyak atsiri. Penyulingan suatu campuran yang berwujud cairan yang tidak saling bercampur, hingga membentuk dua fase atau dua lapisan. Keadaan ini terjadi pada pemisahan minyak atsiri dengan uap air. Penyulingan dengan uap air sering disebut hidrodestilasi. Pengertian umum ini memberikan gambaran bahwa penyulingan dapat dilakukan dengan cara mendidihkan bahan tanaman atau minyak atsiri dengan air (Sastrohamidjojo, 2004).
2.3. Analisis Komponen Kimia Minyak Atsiri dengan GC-MS
Sedikit sekali jenis minyak atsiri yang memiliki komponen tunggal dengan porsi yang sangat besar, kebanyakan mengandung campuran senyawa dengan berbagai tipe. Karena itu analisis dan karakterisasi komponen minyak atsiri merupakan masalah yang cukup rumit , ditambah dengan sifatnya yang mudah menguap pada suhu kamar. Jadi, untuk menganalisis minyak atsiri perlu diseleksi metode yang akan diterapkan.
melengkapi, yaitu gabungan antara kromatografi gas dan spektrometri massa (GC-MS). Kromatografi gas berfungsi sebagai alat pemisah berbagai komponen campuran dalam sampel, sedangkan spektrometer massa berfungsi untuk mendeteksi masing-masing molekul komponen yang telah dipisahkan pada sistem kromatografi gas (Agusta,2000).
2.3.1. Kromatografi Gas
Kromatografi gas adalah proses pemisahan campuran menjadi komponen-komponennya dengan menggunakan gas sebagai fase bergerak yang melewati suatu lapisan serapan yang diam. Kromatografi gas digunakan untuk analisa kualitatif dan kuantitatif terhadap cuplikan yang komponennya dapat menguap. Keuntungan utama kromatografi gas adalah waktu analisis yang singkat dan ketajaman pemisahan yang tinggi. Waktu yang dibutuhkan oleh molekul komponen untuk melintasi suatu kolom yang panjangnya L disebut dengan waktu retensi (Yazid, 2005).
Dalam kromatografi gas, fase bergeraknya adalah gas dan zat terlarut terpisah sebagai uap. Pemisahan tercapai dengan partisi sampel antara fase gas bergerak dan fase diam berupa cairan dengan titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya (Khopkar, 2003).
2.3.1.1. Gas Pembawa
Gas Pembawa : gas pembawa yang paling sering digunakan adalah helium (He), argon (Ar), nitrogen (N2), hidrogen (H2), dan karbon dioksida (CO2).
Keuntungannya adalah karena semua gas ini tidak reaktif dan dapat dibeli dalam keadaan murni dan kering yang dikemas dalam tangki bertekanan tinggi. Gas pembawa harus memuhi syarat antara lain harus inert, murni dan mudah diperoleh (Agusta, 2000).
2.3.1.2. Sistem Injeksi
a. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan diuapkan dalam injector yang panas dan 100% masuk menju kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan dalam injector yang panas dan selanjutnya dilakukan pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel diuapkan dalam injector yang panas dan dibawa ke dalam kolom karena katup pemecah ditutup; dan
d. Injeksi langsung ke kolom (on colum injection), yang mana ujung semprit dimasukkan langsung ke dalam kolom.
Teknik injeksi langsung ke dalam kolom digunakan untuk senyawa-senyawa yang mudah menguap, karena kalau penyuntikkannya melalui lubang suntik, dikawatirkan akan terjadi peruraian senyawa tersebut karena suhu yang tinggi (Rohman, 2009)
2.3.1.3. Kolom
Kolom merupakan tempat terjadinya proses pemisahan karena di dalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi gas (Rohman, 2009). Keberhasilan suatu proses pemisahan terutama ditentukan oleh pemilihan kolom. Kolom dapat terbuat dari tembaga, baja tahan karet, aluminium, atau gelas. Kolom dapat berbentuk lurus, melengkung, atau gulungan spiral sehingga lebih menghemat ruang (Agusta, 2000).
2.3.1.4. Fase Diam
tersebut juga membentuk ekor. Begitu juga dengan garis dasarnya tidak rata dan terlihat bergelombang. Bahkan kemungkinan besar komponen yang bersifat nonpolar tidak akan terdeteksi sama sekali (Agusta, 2000).
2.3.1.5. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis kromatografi gas dan spektrometri massa. Umumnya yang sangat menentukan adalah pengaturan suhu injektor dan kolom. Kondisi analisis yang cocok sangat bergantung pada komponen minyak atsiri yang akan dianalisis (Agusta, 2000).
2.3.1.6. Detektor
Detektor merupakan perangkat yang diletakkan pada ujung kolom tempat keluar fase gerak (gas pembawa) yang membawa komponen hasil pemisahan. Detektor pada kromatografi adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas pembawa dan komponen-komponen di dalamnya menjadi sinyal elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam dan fase gerak (Rohman, 2009).
2.3.2. Spektrometri masaa
Spektrometri massa adalah suatu metode analisis instrumental yang dipakai untuk identifikasi dan penentuan struktur dari komponen sampel dengan cara menunjukkan massa relatif dari molekul komponen dan massa relatif hasil pecahannya. Penggabungan spektrometri massa dengan kromatografi gas telah memperluas wawasan metode tersebut sehingga mampu untuk menganalisis matriks sampel yang sulit sekalipun. Asas spektrometri massa adalah penembakan molekul dengan electron yang berkekuatan tertentu dan molekul tersebut akan terpecah (Mulja, 1999).
Spektrometer massa pada umumnya digunakan untuk : 1.Menentukan massa suatu molekul
3.Mengetahui informasi dari struktur dengan melihat pola fragmentasinya (Dachriyanus,2004).
Sebuah spektroskopi massa akan siap memberikan berat molekuler dari suatu senyawa organik dalam hitungan menit. Analisis unsurnya cukup akurat sehingga akan memungkinkan perhitungan rumus molekulnya. Penghilangan satu elektron dari hasil seluruh molekul dalam suatu spesies M++, umumnya disebut ion molekuler . Sehingga nilai m/z dari ion molekul memberikan berat molekul sampel
M.. + e M + . + 2 e ( Brown, 1988).
Pemboman molekul oleh sebuah arus elektron pada energi mendekati 70 elektron volt dapat menghasilkan banyak perubahan pada struktur molekul. Salah satu proses yang terjadi yang disebabkan oleh pemboman dengan elektron adalah keluarnya sebuah elektron dari molekul sehingga terbentuklah kation molekul [M.]+.
Ion berenergi tinggi ini serta hasil fragmentasinya merupakan dasar bagi cara analisis
spektrometri massa (Pine, 1988).
Pada sistem GC-MS ini, yang berfungsi sebagai detektor adalah spektrometer massa itu sendiri yang terdiri dari sistem analisis dan sistem ionisasi, dimana Electron Impact ionization (EI) adalah metode ionisasi yang umum digunakan (Agusta, 2000).
Ketika uap suatu senyawa dilewatkan dalam ruang ionisasi spektrometer
massa, maka zat ini dibombardir atau ditembak dengan elektron. Elektron ini
mempunyai energi yang cukup untuk melemparkan elektron dalam senyawa sehingga
akan memberikan ion positif, ion ini disebut dengan ion molekul (M+). Ion molekul
cendrung tidak stabil dan terpecah menjadi fragmen-fragmen yang lebih kecil.
Fragmen-fragmen ini yang akan menghasilkan diagram batang (Dachriyanus,2004).
Peningkatan penggunaan GC-MS banyak digunakan yang dihubungkan
akan berkembang pada pemisah yang lebih efesien. Karena komputer dapat
diprogram untuk mencari spektra library yang langka, membuat indentifikasi dan
menunjukkan analisis dari campuran gas tersebut (Willett, 1987).
2.3.2.1. Instrumentasi Spektrometer Massa
Bagian-bagian utama suatu spektrometer massa terdiri dari tempat menginjeksikan sampel, ruangan pengion, pengumpul ion, penguat sinyal dan pencatat. Sampel diuapkan dan didorong ke dalam ruang pengion. Fungsi dari penganalisis massa adalah menguraian partikel-partikel. Kemudian molekul-molekul sampel terionisasi baik secara langsung ataupun tidak langsung oleh arus elektron sehingga menghasilkan ion-ion positif, dan molekul-molekul dipisahkan dalam bentuk ion-ionnya. Ion-ion positif masuk kedalam daerah penganalisis massa. Kemudian partikel yang bergerak cepat diberi medan magnit yang kuat, sehingga lintasannya menjadi lengkung. Jari-jari lengkung lintasan tergantung dari kecepatan dan kekuatan medan magnit. Partikel-partikel dengan massa yang berbeda difokuskan ke suatu celah ke luar dengan cara memvariasikan potensial akselerasi atau kekuatan medan magnit. Ion-ion yang melewati celah akan diterima oleh elektroda pengumpul. Arus ion yang dihasilkan diperkuat dan dicatat sebagai fungsi kuat medan atau potensial akselerasi (Khopkar, 2003).
1. Sistem penanganan sampel
Bagian ini berfungsi mengubah sampel agar mempunyai bentuk gas pada tekanan rendah dan reprodusibel. Untuk sampel yang tidak mudah menguap, diperlukan pemanas asalkan senyawa tersebut stabil secara termal. Senyawa-senyawa tidak mudah menguap dan tidak stabil secara termal dimasukkan ke dalam kamar pengion dengan bantuan probe sampel yang dilengkapi pemanas yang dapat menguapkan sampel tekanan rendah.
2. Sumber ion
Di sini molekul-molekul diubah menjadi ion dalam bentuk gas. Cara yang umum untuk menghasilkan ion-ion meliputi penembakan sampel dengan berkas elektron berenergi tinggi yang berasal dari suatu ion gun. Pada cara elektron
chemical ionization memberikan fragmentasi lebih sederhana. Pada cara nyala, pembentukan ion dari sampel anorganik yang tidak mudah menguap dilakukan dengan cara nyala. Pada cara ionisasi medan dipakai anoda dan katoda untuk mendapat fragmentasinya.
3. Penganalisis massa
Ini adalah susunan alat-alat yang berguna untuk memisahkan ion-ion dengan perbandingan massa terhadap muatan yang berbeda-beda. Penganalisis massa harus dapat membedakan selisih massa yang kecil serta dapat menghasilkan arus ion yang tinggi (Khopkar, 2003).
4. Pengumpul ion
Terdiri dari satu celah atau lebih dan silinder Faraday. Berkas ion membentuk tegak lurus pada plat pengumpul dan isyarat yang timbul diperkuat dengan pelipat ganda elektron (Sudjadi, 1983).
5. Pencatat
Spektrum massa biasanya dibuat dari massa rendah ke massa tinggi. Pencatat yang banyak digunakan mempunyai 3-6 galvanometer yang mencatat secara bersama-sama pada kertas fotografi. Galvanometer menyimpang jika ada ion menabrak lempeng pengumpul, berkas sinar ultraviolet dapat menimbulkan berbagai puncak pada kertas pencatat yang peka terhadap sinar ultraviolet (Sudjadi, 1983).
2.4. Bakteri
Bakteri adalah sel prokariotik yang khas; uniseluler dan tidak mengandung struktur yang terbatasi membran didalam sitoplasmanya sel-selnya khas berbentuk bola, batang atau spiral (Waluyo, 2007). Bakteri terdiri atas sitoplasma yang dikelilingi oleh sebuah dinding sel yang kaku yang terbuat dari suatu zat khusus yang disebut peptidoglikan (Corwin, 2007). Bakteri menimbulkan berbagai perubahan kimiawi pada substansi yang ditumbuhinya. Mereka mampu menghancurkan banyak zat. Bakteri tidak memiliki inti sel. Organisme amat penting untuk memelihara lingkungan kita, yakni dengan menghancurkan bahan yang tertumpuk di atau dalam daratan dan lautan. Beberapa menimbulkan penyakit pada binatang, termasuk manusia, tumbuhan, dan protista lainnya. Mikroorganisme ini sangat luas penyebarannya dalam permukaan bumi dan dilingkungan kita sehari-hari (Waluyo, 2007).
Bakteri memiliki sifat transparan sehingga untuk mengamati morfologi bakteri diperlukan suatu pewarnaan. Ada dua cara yang dapat dilakukan untuk memeriksa bakteri secara mikroskopis yaitu diperiksa secara langsung dan diwarnai dahulu kemudian diperiksa. Salah satu jenis pewarnaan tersebut ialah pewarnaan Gram yang pertama kali dipublikasikan oleh seorang ahli bakteriologi Denmark Hans Christian Gram pada tahun 1884. Pewarnaan gram bertujuan untuk mengetahui bakteri –bakteri gram positif atau bakteri gram negatif yang memiliki struktur yang berbeda terutama pada dinding selnya Adanya perbedaan bakteri gram negatif dan bakteri gram positif adalah pada dinding selnya (Novel, 2010).
2.4.1. Bakteri Gram Positif
2.4.1.1. Streptococcus mutans
Organisme yang berperan pada penyebab karies gigi adalah jenis streptokokus dimana ada dua jenis streptokokus yang menyebabkan karies tersebut yaitu
Streptococcus mutans dan Streptococcus sobrinus. Streptococcus mutans
merupakan bakteri utama penyebab karies gigi. Streptococcus mutans biasanya terdapat pada permukaan karies (Saraf, 2006).
Spesies Streptococcus mutans berbentuk bulat yang dapat dijumpai secara berpasangan dan dalam rantai. Organisme ini berperan penting dalam mengawali terbentuknya luka-luka karies pada permukaan email (Pelczar, 1986).
Gambar 2.6. Bakteri Streptococcus mutans
2.4.2. Bakteri Gram Negatif
Bakteri gram negatif, yaitu bakteri yang kehilangan warna Kristal violet ketika dicuci dengan alkohol dan setelah diberi zat warna kedua (Safranin), bakteri akan memberikan warna merah muda (Lay, 1994). Dinding sel bakteri gram negatif lebih kompleks dibandingkan bakteri gram positif. Perbedaan utamanya adalah adanya lapisan membran luar yang meliputi peptidoglikan (Waluyo, 2007).
2.4.2.1. Eschericia coli
Walaupun Eschericia coli merupakan bagian dari mikrobiota normal saluran pencernaan, namun terbukti bahwa galur-galur tertentu mampu menyebabkan gastroenteritis taraf sedang sampai parah pada manusia dan hewan.
E.coli merupakan organisme indikator yang dipakai didalam analisis air untuk menguji adanya pencemaran oleh tinja, tetapi pemindahsebarannya tidak melalui air melainkan Eschericia coli dipindahsebarkan dengan kegiatan tangan ke mulut atau dengan pemindahan pasif lewat makanan atau minuman.
Tabel 2.1Beberapa ciri bakteri gram positif dan gram negatif
NO Ciri Perbedaan Relatif
Gram positif Gram negatif 1 Struktur
Memiliki asam teikoat
Kandungan lipid
Lebih rentan Kurang rentan
4 Resistensi terhadap gangguan fisik
Lebih resisten Kurang resisten
2.5. Antibakteri
Antimikroba merupakan suatu senyawa yang mampu membunuh bakteri secara langsung (Bactericidal) atau pun mampu menghambat pertumbuhan dari mikroba (Bacteriostatic). Bakteriostatic memiliki pertahan sendiri termasuk dalam menghasilkan antibodi dan phagositosis yang biasanya berguna untuk membunuh mikroorganisme (Tortora, dkk, 2001). Beberapa uji dapat digunakan untuk menguji aktivitas antimikroba, antara lain:
2.5.1. Metode Difusi
Merupakan metode yang paling sering digunakan, lazim dikenal dengan cara Kirby-Bauer seperti berikut, sebuah cawan petri yang berisi media agar yang telah dimasukkan bakteri yang sudah sesuai standar di atas permukaannya. Kemudian kertas cakram dibasahi atau dibubuhi dengan zat antimikroba yang telah diketahui konsentrasinya diletakkan di atas permukaan agar yang sudah memadat. Selama inkubasi, zat antimikroba akan berdifusi dari cakram ke media agar. Apabila zat antimikroba efektif maka zona hambat akan terbentuk di sekitar cakram setelah inkubasi (Tortora dkk, 2001).
2.5.2. Metode Dilusi
BAB 3
Inkubator Fiber Scientific
Neraca analitis Mettler AE 2000
Na2SO4 Anhidrous p.a Merck
Aquadest Alkohol 70 %
Kertas cakram Oxoid
Dimetil sulfoksida (DMSO)
Nutrien Agar (NA) p.a Oxoid
Mueller Hinton Agar (MHA) p.a Oxoid
Nutrient Broth p.a Oxoid
Larutan Standart Mcfarland
Streptococcus mutans
Escherichia coli
3.3. Prosedur Penelitian 3.3.1. Penyediaan Sampel
Bahan yang digunakan dalam penelitian adalah daun legundi yang diperoleh di pasar 1 Padang bulan Kecamatan Medan Baru. Daun legundi dibersihkan, dicuci kemudian dikeringkan pada suhu kamar atau diangin-anginkan kurang lebih 1 minggu. Daun legundi kering kemudian dipotong kecil-kecil.
3.3.2. Isolasi Minyak Atsiri Daun Legundi dengan Alat Destilasi Stahl
Sebanyak 200 g daun legundi kering dimasukkan kedalam labu destilasi 1000 mL ditambahkan air suling 500 mL, dipasang pada alat Stahl. Kemudian dipanaskan selama ± 4-5 jam hingga minyak atsiri menguap sempurna. Minyak atsiri yang diperoleh ditampung dalam botol vial. Kemudian ditambahkan Na2SO4 anhidrous
3.3.3 Analisis Minyak Atsiri Daun Legundi dengan GC-MS
Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS. Selanjutnya kondisi disesuaikan dengan kondisi dibawah ini kemudian diamati kromatogram yang dihasilkan oleh recorder dan mass recorder serta mass spektra masing-masing senyawa.
Kondisi alat GC-MS yaitu:
ACQ Mode : Scan
Event Time : 0,50 sec
Scan Speed : 1250
Start m/z : 28
End m/z : 600
3.3.4 Pengujian Sifat Antibakteri Minyak Atsiri Daun Legundi
3.3.4.1 Pembuatan Media Nutrien Agar (NA)
Sebanyak 7 gram media nutrient agar dimasukkan kedalam gelas lalu dilarutkan dengan 250 mL dan dipanaskan hingga semua larut. Kemudian disterilkan dalam autoklaf pada suhu 121°C selama 15 menit.
3.3.4.2 Pembuatan Stok Kultur Bakteri
Sebanyak 3 mL media nutrient agar steril dimasukkan kedalam tabung reaksi yang steril, didiamkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30-45°. Biakan bakteri Escherichia coli diambil dari strain utama dengan jarum ose steril lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasi pada suhu 35 ± 2°C selama 18-24 jam. Hal yang sama juga dilakukan pada biakan bakteri
Streptococcus mutans.
3.3.4.3 Pembuatan Media Mueller Hinton Agar (MHA)
Sebanyak 9.5 g serbuk Mueller Hinton Agar dimasukkan kedalam gelas lalu dilarutkan dalam 250 mL aquades dan dipanaskan hingga semua larut dan
mendidih. Kemudian disterilkan pada autoklaf pada suhu 121°C selama 15 menit.
3.3.4.4. Penyiapan Inokulum Bakteri
media nutrient broth steril dalam tabung reaksi dan diinkubasikan pada suhu 35±2°C selama ± 3 jam, lalu dibandingkan kekeruhannya dengan kekeruhan standar Mcfarland. Hal yang sama juga dilakukan untuk koloni bakteri
Streptococcus mutans.
3.3.4.5. Pembuatan Variasi Konsentrasi Minyak Atsiri Daun Legundi (Vitex trifolia L)
Minyak atsiri daun legundi dibuat dalam konsentrasi 20 % dan 30% (v/v), dengan memipet masing-masing 1 mL dan 1.5 mL minyak atsiri dengan menggunakan mat pipet dan dimasukkan kedam labu ukur 5 mL, kemudian ditambahkan Dimetil Sulfoksida (DMSO) pada masing-masing minyak atsiri hingga garis batas dan dihomogenkan..
3.3.4.6. Uji Aktivitas Antibakteri Minyak Atsiri Daun Legundi
3.4. Bagan Penelitian
3.4.1 Isolasi Minyak Atsiri Daun Legundi Dengan Destilasi Stahl
Dimasukkan kedalam labu Stahl 1Liter Ditambahkan air suling 500 mL
Dirangkai alat Stahl
Dipanaskan selama ± 4-5 jam hingga keluar uap air bersama minyak
Dimasukkan kedalam botol vial Ditambahkan Na2SO4 Anhidrous
Didekantasi
diukur volumenya 200 g Daun Legundi Kering
Lapisan Minyak Lapisan Air
Minyak Atsiri
3.4.2 Pengujian Sifat Antibakteri Minyak Atsiri Daun Legundi 3.4.2.1 Pembuatan Media Nutrient Agar (NA) Miring dan Stok Kultur Bakteri
Dilarutkan dengan 250 mL aquadest dalam Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15 menit
Dituangkan kedalam tabung reaksi sebanyak 3 mL Dibiarkan pada temperatur kamar sampai memadat pada posisi miring membentuk sudut 30°-45°C Diambil biakan bakteri Escherchia coli dari strain utama dengan jarum ose lalu digoreskan pada Media NA yang telah memadat
Diinkubasi pada suhu 35°C selama 18-24 jam
Dilakukan hal yang sama untuk bakteri Streptococcus mutans. 7 g Media NA
Media NA Steril
3.4.2.2 Pembuatan Media Mueller Hinton Agar (MHA)
Dilarutkan dengan 250 mL aquadest dalam Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15 menit
3.4.2.3 Penyiapan Inokulum Bakteri
Dilarutkan dengan 250 mL aquadest dalam erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121°C selama 15 menit
Dimasukkan sebanyak 10 mL kedalam tabung reaksi
Diambil koloni bakteri Escherchia coli dari stok kultur bakteri dengan jarum ose
Disuspensikan kedalam media Nutrient Broth (NB) Diinokulasi pada suhu 35°C selama 3 jam
Dibandingkan kekeruhannya dengan standar Mcfarland (BaCl2 : H2SO4)
Dilakukan hal yang sama untuk bakteri Streptococcus mutans.
9.5 g Media Mueller Hionton Agar (MHA)
Media MHA Steril
3.25 g Media Nutrien Broth (NB)
Media NB Steril
3.4.2.4 Uji Aktivitas Antibakteri
Dimasukkan kedalam cawan petri
Ditambahkan 15 mL MHA dengan suhu 45°C-50°C Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan minyak atsiri daun legundi kedalam cawan petri yang telah berisi bakteri
Diinkubasi pada suhu 35°C selama 18-24 jam dalm inkubator
Diukur diameter zona bening disekitar cakram dengan jangka sorong
Dilakukan hal yang sama untuk Streptococcus mutans.
0.1 mL inokulum bakteri
Escherchia coli
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Volume Minyak Atsiri
Minyak Atsiri daun legundi diperoleh dengan metode hidrodestilasi menggunakan alat Stahl. Proses ini dilakukan secara triplo. Hasilnya seperti yang ditunjukkan tabel 4.1
Tabel 4.1 Minyak Atsiri daun legundi yang diperoleh dengan Metode hidrodestilasi
Berat Sampel (g)
Hasil (mL)
Rata-rata (mL)
I II III
200 g 0,4 0,39 0,41 0,4
4.1.2 Hasil Analisa dengan GC-MS
Tabel 4.2. Senyawa Hasil Analisa GC-MS Minyak Atsiri Daun legundi
4.1.3. Hasil Uji Aktivitas Antibakteri
Sifat antibakteri minyak atsiri daun legundi menunjukkan zona hambat pada pertumbuhan beberapa bakteri patogen yaitu Escherchia coli dan
Streptococcus mutans.
(a) Eschericia coli (b)Streptococcus mutans
Gambar 4.2. Zona hambat dari minyak atsiri daun legundi terhadap bakteri (a)
Eschericia coli (b) Streptococcus mutans
E.coli
blanko
E.coli
20 %
E.coli
30%
S.mutans
30%
S.mutans S.mutans
blanko
Hasil pengujian minyak atsiri daun legundi terhadap pertumbuhan bakteri gram positif Streptococcus mutans serta pertumbuhan bakteri gram negatif
Escherchia coli setelah inkubasi 1 x 24 jam dapat dilihat pada tabel 4.3.
Tabel 4.3. Hasil Pengukuran diameter zona bening beberapa kultur bakteri oleh minyak atsiri daun legundi
Bakteri Diameter Zona Bening Minyak Atsiri (mm)
20 % 30 %
Streptococcus mutans 10.8 12.6
Escherchia coli 8.3 9.1
4.2. Pembahasan
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Stahl
Dari hasil penelitian yang telah dilakukan diperoleh minyak atsiri daun legundi (Vitex trifolia L) rata-rata sebanyak 0,4 mL (0,36 g) dari 200 gram daun legundi. Jadi kadar minyak atsiri adalah 0,18% yang diperoleh dari perhitungan berikut :
% kadar minyak atsiri =
x
100%% kadar Minyak Atsiri = x 100% = 0,18 % (b/b)
Minyak atsiri daun legundi diperoleh berwarna kuning jernih dan berbau khas. Kadar minyak atsiri yang diperoleh sebesar 0,18% (b/b). Hal ini tidak jauh berbeda dengan kadar minyak atsiri daun legundi yang berasal dari magelang yaitu 0,20 % (v/b).Senyawa kimia daun legundi yang diperoleh dominan senyawa monoterpen (65,81%) dan sesquiterpen ( 23,29%). Hasil analisa GC-MS
yaitu : 7-okten-4-ol, trans sabinen hidrat, beta kariofilen, androsta-4,16-dien-3-one, trans kariofilen, isokariofilen, 1-alfa-terpineol, terpinen-4-ol. Perbedaan hasil GC-MS kedua minyak atsiri daun legundi ini dapat disebabkan oleh beberapa faktor antara lain : factor geografis tempat tumbuhnya, proses pengeringan, dan suhu (Hussain et al, 2008).
4.2.2. Analisa Minyak Atsiri Daun legundi dengan GC-MS
1. Puncak dengan RT 4,975 menit merupakan senyawa dengan rumus molekul C10H18O. Data spektrum menunjukkan puncak ion molekul pada m/e 154 diikuti
puncak-puncak fragmentasi pada m/e 140, 139, 125, 108, 84, 81, 69 dan 43. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum
library wiley 229, yang lebih mendekati adalah senyawa golongan monoterpen yaitu 1,8 sineol sebanyak 24,35 % dengan spektrum 4.3
a.
b.
Gambar 4.3. Spektrum massa senyawa 1,8 sineol dengan RT 4,975 Keterangan : a : Senyawa 1,8 sineol dari sampel
Selanjutnya pola fragmentasi dari senyawa 1,8 sineol tersebut secara
2. Puncak dengan RT 4,033 menit merupakan senyawa dengan rumus molekul C10H16. Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121, 107, 93. Dengan membandingkan data spectrum yang diperoleh dengan data spektrum library wiley 229, yang lebih mendekati adalah senyawa golongan monoterpen yaitu sabinen sebanyak 19,10 % dengan spektrum 4.5
a.
b.
Gambar 4.5 Spektrum massa senyawa sabinen dengan RT 4,033 Keterangan a: Senyawa sabinen dari sampel
Selanjutnya pola fragmentasi pada senyawa sabinen tersebut secara hipotesis seperti gambar 4.6
H3C CH3
CH2
+ e
2e
CH3 H3C
CH2
CH3
CH2
(C10H16) (C9H13)
m/e = 121
C2H4
CH2 (C7H9)
m/e = 93
CH4
(C6H5)
m/e = 77 CH3
(C10H16) m/e = 136
(15)
(28)
(16)
3. Puncak dengan RT 15,450 menit merupakan senyawa dengan rumus molekul C15H24. Data spektrum menunjukkan puncak ion molekul pada m/e 204 diikuti
puncak-puncak fragmentasi pada m/e 189, 175, 161, 147, 133, 120, 105, 93, 79, 69, 55, 43. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library wiley 229, yang lebih mendekati adalah senyawa golongan seskuiterpen yaitu beta-kariofilen sebanyak 17,49 % dengan spektrum 4.7 a.
b.
Gambar 4.7 Spektrum massa senyawa beta-kariofilen dengan RT 15,450 Keterangan a: Senyawa beta-kariofilen dari sampel
Selanjutnya pola fragmentasi dari senyawa beta-kariofilen tersebut secara hipotesis seperti gambar 4.8
CH3
4. Puncak dengan RT 3,583 menit merupakan senyawa dengan rumus molekul C10H16. Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121, 105, 93. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library wiley 229, yang lebih mendekati adalah senyawa golongan monoterpen yaitu alfa-pinen sebanyak 10,06 % dengan spektrum 4.9
a.
b.
Gambar 4.9 Spektrum massa senyawa alfa-pinen dengan RT 3,583 Keterangan a: Senyawa alfa-pinen dari sampel
Selanjutnya pola fragmentasi dari senyawa alfa-pinen tersebut secara hipotesis seperti pada gambar 4.10
H3C
5. Puncak dengan RT 4,125 menit merupakan senyawa dengan rumus molekul C10H16. Data spektrum menunjukkan puncak ion molekul pada m/e 136 diikuti
puncak-puncak fragmentasi pada m/e 121, 107, 93. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library wiley 229, yang lebih mendekati adalah senyawa golongan monoterpen yaitu Beta-pinen sebanyak 4,07 % dengan spektrum 4.11
a.
a: Senyawa Beta-pinen dari sampel b. B: Standart Library
Gambar 4.11 Spektrum massa senyawa beta-pinen dengan RT 4,125 Keterangan a: Senyawa beta-pinen dari sampel
Selanjutnya pola fragmentasi dari senyawa Beta-pinen tersebut secara hipotesis seperti pada gambar 4.12
H3C
6. Puncak dengan RT 3,942 menit merupakan senyawa dengan rumus molekul C8H16O. Data spektrum menunjukkan puncak ion molekul pada m/e 128 diikuti
puncak-puncak fragmentasi pada m/e 99, 85, 72, 57. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library NIST 62, yang lebih mendekati adalah senyawa golongan hemiterpen yaitu 7-okten-4-ol sebanyak 2,99% dengan spektrum 4.13
a: Senyawa 7-okten-4-ol dari senyawa a. b: Standart Library
b.
Gambar 4.13 Spektrum massa senyawa 7-okten-4-ol dengan RT 3,942 Keterangan a: Senyawa 7-okten-4-ol dari sampel
Selanjutnya pola fragmentasi dari 7-okten-4-ol tersebut secara hipotesis pada gambar 4.14
OH
e
2e
OH
m/e = 128 (C8H16O)
CH2=C=O C2H5
m/e = 99 (C6H11O)
OH
m/e = 57 (C4H9) (C8H16O)
(29)
(42)
7. Puncak dengan RT 8,725 menit merupakan senyawa dengan rumus molekul C10H18O. Data spektrum menunjukkan puncak ion molekul pada m/e 154 diikuti
puncak-puncak fragmentasi pada m/e 136, 121, 107, 93, 81, 59. Dengan membandingkan data spektrum yang diperoleh dengan data spektrum library Wiley 229, yang lebih mendekati adalah senyawa golongan monoterpen yaitu alfa-terpineol sebanyak 4,07 % dengan spektrum 4.15
a.
b.
Gambar 4.15 Spektrum massa senyawa alfa-terpineol dengan RT 8,725 Keterangan a: Senyawa alfa-terpineol dari sampel
Selanjutnya pola fragmentasi dari senyawa alfa-terpineol tersebut secara
4.2.3. Uji Antibakteri Minyak Atsiri Daun legundi
Dari tabel 4.3 diketahui bahwa minyak atsiri daun legundi dapat menghambat pertumbuhan bakteri Escherchia coli dan Streptococcus mutans. Hal ini
disebabkan senyawa aktif minyak atsiri mengandung gugus fungsi hidroksil dan kabonil. Komponen senyawa pada daun legundi mengandung gugus –OH yang bersifat sebagai antibakteri yaitu 7-okten-4-ol, 1,8 sineol, alfa-terpineol dan trans-sabinen hidrat.
Menurut conner 1993 senyawa terpenoid yang mempunyai aktivitas antimikroba antara lain borneoil, sineol, pinene dan kamper. Minyak atsiri dari daun legundi mengandung senyawa 1,8 Sineol yang merupakan senyawa terpenoid yang mempunyai sifat menghambat pertumbuhan bakteri. Senyawa sabinen merupakan komponen penyusun batang teh yang memiliki efek antibakteri (Dewick, 2002).
Menurut Jawetz et al 2005 senyawa golongan terpenoid yang terdapat dalam minyak atsiri daun legundi menghambat pertumbuhan bakteri yaitu dengan cara merusak membran sel bakteri, membran sel bertindak pelindung, mengontrol pertukaran zat dengan lingkungannya. Minyak atsiri yang terkonsentrasi pada permukaan sel akan merubah fisik membran yang sebenarnya, mencegah fungsi normalnya dan akan menyebabkan sel menjadi pecah. Minyak atsiri dapat mengubah molekul protein dan asam nukleat dengan cara mendenaturasi protein dan asam-asam nukleat sehingga merusak sel tanpa dapat diperbaiki lagi
(Suryaningrum, S. 2009).
Dinding sel bakteri gram positif memiliki kandungan peptidoglikan yang tinggi serta memiliki kandungan lipid yang rendah (1-4 %) dibandingkan bakteri gram negatif, hal ini menyebabkan senyawa aktif yang terdapat didalam minyak atsiri lebih mudah masuk dan merusak dinding sel bakteri gram positif sedangkan dinding sel bakteri gram negatif lebih kompleks dibandingkan gram positif perbedaan utamanya dengan adanya lapisan membran luar yang meliputi
Sifat antibakteri minyak atsiri daun legundi menunjukkan zona hambat pada pertumbuhan beberapa bakteri patogen yaitu Escherchia coli dan
Streptococcus mutans dimana dalam konsentrasi pengenceran 30% zona bening lebih besar dibandingkan konsentrasi pengenceran 20%. Pengaruh antimikroba bergantung pada konsentrasi dimana konsentrasi semakin tinggi maka sifat bakterisidalnya juga semakin tinggi.
Terbentuknya daerah bening di sekitar kertas cakram menunjukkan terjadinya penghambatan pertumbuhan bakteri akibat pengaruh senyawa bioaktif yang terdapat dalam minyak atsiri daun legundi. Minyak atsiri daun legundi pada konsentrasi 20% dapat dikatakan kurang sensitif terhadap bakteri Escherchia coli
namun pada konsentrasi 30 % dikatakan sensitif . Minyak atsiri daun legundi dikatakan sensitif terhadap bakteri Streptococcus mutans hal ini sesuai dengan literatur yang menyatakan bahwa :
Diameter zona hambat < 8 mm : kurang sensitif Diameter zona hambat 9-14 mm : sensitif
Diameter zona hambat 15-19 mm : sangat sensitif
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Berdasarkan hasil analisa GC-MS menunjukkan komponen utama minyak atsiri daun legundi adalah 1,8 sineol (24,35 %), Sabinen (19,10 %), β-kariofilen (17,49%), α-pinen (10,06%), β-pinen (4,07%), 7-okten-4-ol (2,99%) dan α- terpineol (4,07 %).
2. Minyak atsiri daun legundi memiliki aktivitas antibakteri yang kurang sensitif pada konsentrasi 20% tetapi sensitif pada konsentrasi 30% terhadap bakteri patogen Escherchia coli dan sensitif pada konsentrasi 20 % dan 30 % terhadap bakteri Streptococcus mutans.
5.2. Saran
- Perlu diteliti lebih lanjut untuk uji antioksidan minyak atsiri daun legundi
DAFTAR PUSTAKA
Acmad, S. 1986. Kimia Organik Bahan Alam. Jakarta. Universitas Terbuka
Agoes, S. 2007. Teknologi Bahan Alam. Cetakan Pertama. Bandung. Penerbit ITB
Agusta, A. 2000. Minyak Atsiri Tumbuhan Tropis Indonesia. Bandung. Penerbit ITB
Bhattacharjee, S.K and De, L.C., 2005. Medicinal Herbs and Flowers. India . Avishkar, Jaipur,p. 306.
Brown, D.W., Floyd, A.J and Sainsbury. 1988. Organic Spectroscopy. New York . John willey and sons
Conner, D.E.1993. Naturally Occuring Compounds, In Davidson.P.M and A.L Branen Antimicrobial in Foods 2nd. Mercel Dekker,Inc. New York. Tesis. Isolasi dan Analisa Kimia Minyak Atsiri dari Buah Kecombrang (Etlingera elatior) dengan Gas Kromatografi-Spektrometer Massa(GC-MS) dan Uji Aktivitas Antibakteri. Medan. USU
Corwin, J.E. 2009. Buku Saku Patofisiologi. Edisi ketiga. Jakarta . EGC
Dachriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. Cetakan Pertama. Padang . Andalas Universiti Press.
Dalimartha, S., 2008. Atlas Tumbuhan Obat Indonesia. Jilid 5. Jakarta . Pustaka Bunda
Dewick., 2002. Medicinal Natural Product. New york . John Willey and sons Gritter, R.J. 1991. Pengantar Kromatografi. Bandung. Penerbit ITB
Hariana, A. 2008. Tumbuhan Obat dan Khasiat II. Jakarta . Penebar Swadaya. Heyne, K. 1981. Tumbuhan Berguna Indonesia. Jilid ketiga. Jakarta . Badan
Litbang Kehutanan
Hussain, Al., Anwar F., Sherazi S. T. H., and Przybylski R. 2008. Chemical Composition, Antioxidant and Antimicrobial Activities of Basil (Ocimum basilicum) Essential Oils Depends on Seasonal Variations, Food Chem., 108: 986 – 995.
Karuniawati, Iravati, S dan Indrayudha, P. 2009. Aktivitas Antibakteri Ekstrak Kloroform dan Metanol Daun Legundi (Vitex trifolia Linn) terhadap Mycobacterium tuberculosis H37Rv dan Profil Kromatografi Lapis Tipisnya. Dalam Jurnal Farmasi Indonesia Pharmacon.Volume 10 No 1. Juni 2009
Ketaren, S. 1985. Pengantar Teknologi Minyak Atsiri. Jakarta . Balai Pustaka Khopkar, S. M. 2003. Konsep Dasar Kimia Analitik. Jakarta. UI-Press
Kirtikar, K.R and Basu, B.D. 1991. Indian Medicinal Plants. Basu, L.M, Allahabad, India, 1935-1944
Kusmayati, Agustini, N.W.R. 2007. Uji Aktivitas Senyawa Antibakteri dari Mikroalga (Prophyridium cruentum), J Biod
Lay, W.B. 1994. Analisa Mikroba di Laboratorium. Edisi I. Jakarta. PT. Raja Grafindo Persada
Lutony, T. 2000. Produksi dan Perdagangan Minyak Atsiri. Jakarta . Penebar Swadaya
Mulja. 1999. Analisis Instrumen. Jakarta . Erlangga
Natheer, Sekar, Amutharaj, Rahman and Kahn, F. 2012. Evaluation of antibacterial activity of Morinda citrifolia, Vitex trifolia and Chromolaena odorata. India . Tamil nadu
Novel,S, Wulandari, A, dan Safitri, R. 2010. Praktikum Mikrobiologi Dasar.
Jakarta . TIM
Pelczar, M. J. 1986. Dasar-dasar Mikrobiologi. Jilid I. Jakarta . Penerbit Universitas Indonesia
Pine, S.H. 1988. Kimia Organik. Terbitan keempat. Bandung . Penerbit ITB Pratiwi, S.T. 2008. Mikrobiologi Farmasi. Jakarta. Penerbit Erlangga
Rohman, A.2009. Kromatografi Untuk Analisis Obat. Edisi Pertama. Yogyakarta. Graha Ilmu
Saraf, S. 2006.Textbook of Oral Pathology.New delhi . Jaypee brothers medical publishers
Sastrohamidjojo, H.,2004. Kimia Minyak Atsiri. UGM Press . Yogyakarta
Sudarsono, Gunawan, D., dan Wahyuno, S., 2002.Tumbuhan Obat II. Hasil Penelitian, Sifat-sifat dan Penggunaanya. Yogyakarta . Pusat Studi Obat Tradisional UGM
Sudjadi. 1983. Penentuan Struktur Senyawa Organik. Jakarta. Ghalia Indonesia Suryaningrum, S.2009. UJi Aktivitas Antibakteri Minyak Atsiri Buah Jeruk Purut(
Citrus hystrix D.C) terhadap Staphyloccocus aereus dan Esherichia coli. Surakarta. Fakultas Farmasi.Universitas Muhamadiyah
Tortora GJ, Funke BR. 2004. Microbiology an Introduction. Edisi kedelapan. San Fransisco.
Benjamins cumings
Volk,W.A dan M.F Wheeler. 1989. Mikrobiologi Dasar. Edisi Kelima. Jilid 2. Jakarta. Erlangga
Waluyo, L. 2007. Mikrobiologi Umum. Malang . UMM Press Willet, J.E. 1987.Gas chromatography. London. John Wiley & Sons Yazid, E. 2005.Kimia Fisika Untuk Paramedis. Yogyakarta . Andi Offset.
Lampiran 2. Alat Stahl