RAGAM JENIS EKTOPARASIT PADA HEWAN COBA TIKUS
PUTIH (Rattus norvegicus) GALUR SPRAGUE DAWLEY
PRADIPTA NURI ADIYATI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Pradipta Nuri Adiyati. EctoparasitesDiversity ofan Experimental Animal
Rattus norvegicus Strain Sprague Dawley. Under direction ofdrh. Upik Kesumawati Hadi, MS, Ph.Danddrh. Supriyono.
The aim of this study was to know the diversity and morphology of ectoparasitesofRattus norvegicusstrain Spargue Dawley as experimental animal. The research was conducted in March to April 2010 and implemented in 3 sampling,blood smear preparation, and identification. The ectoparasites wer collected and mounted by Hoyer solution. Species identification was don Baker and Canin€s systematic key(1958). The results showed that there were 3 species of ectoparasites found in experimental animalR. norvegicus, i.e.Laelaps
echidninus(92%),Polyplax spinulosa (6%), and Ixodid ticks larvae (2%). Based on the discovery of ectoparasites region, 44% ectoparasites found i region of the body, 32% in the tail, and 24% on the head.The generalsymptomof
theexperimental rats infestedby ectoparasitesshowednervous andbitingits own
bodies. Thegross featuresofwhite blood cells were higher than normally rats, especiallyon lymphocytes and monocytes.However,thefeatures of neutrophyls, eosinophyls, and basophylsof the rats were normal.
ABSTRAK
Pradipta Nuri Adiyati.Ragam Jenis Ektoparasit pada Hewan Coba Tikus Putih (Rattus norvegicus) Galur Sprague Dawley. Dibawah bimbingandrh. Upik
Kesumawati Hadi, MS, Ph.Danddrh. Supriyono.
Penelitian ini bertujuan untuk mengetahui keragaman jenis dan m ektoparasit yang terdapat pada tikus putih (Rattus norvegicus) galur Sprague
Dawley sebagai hewan coba. Penelitian ini dilakukan pada bulan Mare A pril 2010 dan terdiri atas tiga tahap: pengambilan sampel ektoparasi preparat darah, dan identifikasi. Ektoparasit yang telah dikoleks diberikan larutan Hoyer. Identifikasi dilakukan dengan menggunaka identifikasi Baker dan Canin (1958). Hasil menunjukkan bahwa terdapat tiga je spesies yang ditemukan pada tikus putih (Rattus norvegicus), yaituLaelaps
echidninus (92%),Polyplax spinulosa (6%),dan larva caplak Ixodidae(2%). Berdasarkan regio, sebanyak 44% ektoparasit ditemukan di bagian punggung tubuh, 32% di pangkal ekor, dan 24% di kepala.Gambaran umum mengenai perilaku tikus yang terinfestasiektoparasit adalahgelisah,seringmenggigit dan menggesek-gesektubuhnya sendiri.Hasil penelitianini juga menunjukkan bahwa gambaran diferensiasi sel darah putihpada tikus tersebut menunjukkan adanya peningkatan jumlah limfosit dan monosit. Namun demikian, gambaran neutrofil, eosinofil, dan basofil tidak mengalami perubahan yang sign
Dengan ini saya menyatakan bahwa skripsi Ragam Jenis Ektoparasit pada
Hewan Coba Tikus Putih (Rattus norvegicus) Galur Sprague Dawley adalah karya
saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk
apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir
skripsi ini.
Bogor, Agustus 2011
Pradipta Nuri Adiyati
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PRADIPTA NURI ADIYATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul : Ragam Jenis Ektoparasit pada Hewan Coba Tikus Putih
(Rattus norvegicus) Galur Sprague Dawley
Nama mahasiswa : Pradipta Nuri Adiyati
NRP : B04070184
Disetujui Komisi Pembimbing
Dr.drh. Upik Kesumawati Hadi, MS Ketua
drh. Supriyono anggota
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
Nya sehingga skripsi yang berjudul Ragam Jenis Ektoparasit pada Hewan Coba
Tikus Putih (Rattus norvegicus) Galur Sprague Dawley telah diselesaikan. Skripsi
ini disusun sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran
Hewan Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya, penulis
ucapkan kepada :
1 Keluarga tercinta, Bapak, Ibu, Ajun dan Fahmi atas segala nasehat,
kesabaran, dukungan, dan doanya kepada penulis.
2 drh. Upik Kesumawati Hadi, MS, Ph.D dan drh. Supriyono selaku dosen
pembimbing tugas akhir yang telah memberikan ilmu-ilmunya dan
bersabar dalam membimbing penulis.
3 Bima yang selalu menemani dan memberikan semangat untuk tidak pernah
menyerah setiap saat.
4 Teman-teman seperjuangan penelitian di Laboratoriun Entomologi yang
bersama-sama berjuang dalam menyelesaikan tugas akhir.
5 Arni, Rio, dan Ridwan yang telah membantu penulis dalam proses
penyusunan skripsi dan dukungannya dalam penyelesaian tugas akhir.
6 Seluruh teman-teman Gianuzzi yang telah bersama-sama selama 3 tahun
menuntut ilmu di FKH IPB.
7 Dosen-dosen dan Staf Laboratorium Entomologi yang tak pernah bosan
selalu membantu dan memberikan senyuman serta semangat setiap
harinya.
8 Teman-teman di Tri Regina yang tak pernah lelah mendukung penulis
untuk menyelesaikan tugas akhirnya.
Semoga skripsi ini dapat bermanfaat bagi pembaca.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Bengkulu pada tanggal 1 Maret 1990 dari ayah Drs.
Boko Susilo, M.Kom dan ibu Rusmiyati. Penulis merupakan putri pertama dari
tiga bersaudara.
Penulis dibesarkan di kota Yogyakarta dan menempuh pendidikan sekolah
taman kanak-kanak di TK Aisyiah 3, Depok, kemudian melanjutkan di SD Negeri
Nglarang, Yogyakarta. Namun, pada tahun 1999 penulis kembali ke Bengkulu dan
melanjutkan sekolah di SD Negeri 2 Bengkulu hingga lulus di tahun 2000. Di
tahun yang sama, penulis melanjutkan pendidikan ke bangku SMP Negeri 2 Kota
Bengkulu dan lulus pada tahun 2004. Tahun 2007 penulis lulus dari SMA
Muhammadiyah 1 Yogyakarta dan pada tahun yang sama lulus seleksi masuk IPB
melalui jalur SPMB. Penulis memilih Fakultas Kedokteran Hewan sebagai
program studi mayor di perguruan tinggi IPB.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum mata
kuliah Embriologi dan Genetika Perkembangan pada tahun 2009-2010. Penulis
juga aktif di berbagai organisasi seperti Himpunan Minat dan Profesi Hewan
Kesayangan dan Satwa Akuatik Eksotik (HIMPRO HKSA) Komunitas Seni
STERIL, dan Ikatan Mahasiswa Daerah Istimewa Yogyakarta (IKAMADITA).
Penulis juga merupakan aktivis di Ikatan Mahasiswa Kedokteran Hewan
Indonesia (IMAKAHI) dan pernah menjabat sebagai Sekretaris Jendral Pengurus
Besar Ikatan Mahasiswa Kedokteran Hewan Indonesia (Sekjen PB IMAKAHI)
DAFTAR ISI Tikus putih (Rattus norvegicus)... 3
Jenis ektoparasit pengganggu pada tikus putih (R. norvegicus) ... 6
Gambaran diferensiasi sel darah putih pada tikus putih (R. norvegicus)... 9
METODOLOGI Waktu dan tempat penelitian ... 14
Alat dan bahan penelitian ... 14
Pengambilan sampel ektoparasit ... 14
Pembuatan preparat ektoparasit ... 14
Identifikasi ektoparasit ... 15
Pengamatan tikus yang terinfeksi ektoparasit ... 15
Analisis data ... 16
HASIL DAN PEMBAHASAN Jenis ektoparasit ... 17
Sebaran jenis-jenis ektoparasit pada tikus putih (R. norvegicus)... 23
Sebaran ektoparasit berdasarkan regio ... 24
Gambaran umum tikus putih yang terinfestasi ektoparasit ... 25
Gambaran sel darah putih (leucocyte) tikus putih (R. norvegicus) .. 26
Pengendalian ektoparasit pada tikus putih (R. norvegicus) ... 27
SIMPULAN DAN SARAN ... 29
DAFTAR PUTAKA ... 30
iv
DAFTAR TABEL
No Teks Halaman
1 Jenis-enis ektoparasit pada tikus putih (R. norvegicus) ... 24 2 Sebaran ektoparasit pada tikus putih (R. norvegicus)
DAFTAR GAMBAR
No Teks Halaman
1 MorfologiLaelaps echidninus ... 7 2 MorfologiNotoedres cati ... 8 3 Xenopsylla cheopis... 9 4 Sel darah putih 13
(a) Neutrofil; (b) Eosinofil; (c) Basofil; (d) Limosit; (e) Monosit ...
1 PENDAHULUAN
1.1 Latar Belakang
Seiring dengan perkembangan ilmu kedokteran pemanfaatan hewan
sebagai objek percobaan juga terus berkembang. Hewan coba merupakan hewan
yang dikembangbiakkan untuk digunakan sebagai hewan uji coba di laboratorium.
Beberapa contoh hewan yang biasa digunakan sebagai hewan coba adalah tikus
putih (R. norvegicus) dan mencit putih (Mus musculusstrain albino).
Tikus putih (R. norvegicus) merupakan hewan coba yang sering digunakan
pada penelitian biomedis, pengujian, dan pendidikan. Sebagai hewan rondentia
(pengerat), tikus juga tidak bebas dari infestasi ektoparasit. Ektoparasit adalah
parasit yang berada di luar tubuh inang.
Jenis ektoparasit pada tikus yang pernah dilaporkan pada studi di
Sarpole-Zahab, Provinsi Kermanshah, Iran, terdapat sebanyak sembilan spesies ektoparasit
yang ditemukan pada 139 ekor tikus di enam spesies yang diidentifikasi.
Ektoparasit tersebut yaitu tiga jenis pinjal (Pulex irritans, Xenopsylla buxtoni,
Nosopsyllus medus), satu jenis kutu penghisap (Polyplax spinulosa), dua jenis
caplak (Rhipicephalussp.,Hyalomma sp.), dan tiga jenis tungau (Laelaps nutalli,
Dermanysus sanguineus, Ornithonyssus bacoti) (Telmadarraiy et al. 2007).
Motevalli et al. (2002) menemukan ektoparasit Echinolaelaps echidninus,
Hoplopleura sp., Rhipicephalus sp., dan Nosopsyllus fasciatus pada R.
norvegicus, R. rattus, Mus musculus, Glis glis, Apodemous sylvaticus, Nesokia
indica,danArvicola terretrisdi wilayah Selatan Laut Kaspia.
Ektoparasit dapat menimbulkan kerugian pada inangnya, yaitu terjadinya
iritasi, kegatalan serta gejala lain yang mengindikasikan kondisi
ketidaknyamanan. Selain itu, ektoparasit juga dapat sebagai vektor berbagai
macam agen penyakit. Tubuh inang digunakan sebagai tempat untuk berkembang
biak serta bertahan hidup.
Keberadaan ektoparasit ini mempengaruhi kesehatan tikus sebagai hewan
berbagai macam agen penyakit. Tikus juga berperan dalam penyebaran penyakit
zoonosis, seperti leptospirosis, salmonellosis, rat-bite fever, leishmaniasis, dan
plague (Kia et al. 2009). Tikus rentan terhadap penyakit infeksius yang
disebabkan oleh bakteria, virus, parasit, dan jamur. Beberapa penelitian yang telah
dilakukan menunjukkan penyakit yang terdapat pada tikus seperti plague,
tripanosomiasis, dan merupakan reservoir alami penyebabepidemic haemorrhagic
fever (EHF)virus (Su et al. 1989; Coutinho dan Linardi 2007; Wei et al. 2010).
Selain itu, tikus di alam juga dapat dijadikan sebagai indikator kehadiran dan
dispersal dari enam agen mikroba zoonotik, seperti Rickettsia typhi, R. Conorii,
Toxoplasmasp., Coxiella burnetti, Bartonella henselae,danLeishmania infantum
(Annaet al. 2010).
Selain mempengaruhi kesehatan tikus putih, keberadaan ektoparasit juga
dapat mempengaruhi hasil dari penelitian yang menggunakan tikus sebagai hewan
coba. Oleh karena itu, sangat penting diketahui jenis-jenis ektoparasit yang
terdapat pada tikus sebagai hewan coba. Info mengenai jenis-jenis ektoparasit
pada tikus ini belum pernah ditemukan sehingga penelitian ini diperlukan.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keragaman jenis dan morfologi
ektoparasit pada tikus putih (R. norvegicus) galur Sprague Dawley sebagai hewan
coba.
1.3 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang keberadaan
dan jenis ektoparasit yang terdapat pada tikus putih (R. norvegicus) galur Sprague
Dawley sehingga dapat menjadi bahan pertimbangan dalam menentukan
penggunaan tikus terinfestasi ektoparasit sebagai hewan coba dan pengendalian
2 TINJAUAN PUSTAKA
2. 1 Tikus putih (R. norvegicus)
Hewan coba merupakan hewan yang dikembangbiakkan untuk digunakan
sebagai hewan uji coba. Tikus sering digunakan pada berbagai macam penelitian
medis selama bertahun-tahun. Hal ini dikarenakan tikus memiliki karakteristik
genetik yang unik, mudah berkembang biak, murah serta mudah untuk
mendapatkannya. Tikus merupakan hewan yang melakukan aktivitasnya pada
malam hari (nocturnal).
Tikus putih (R. norvegicus) atau biasa dikenal dengan nama lainNorway
Ratberasal dari wilayah Cina dan menyebar ke Eropa bagian barat (Sirois 2005).
Pada wilayah Asia Tenggara, tikus ini berkembang biak di Filipina, Indonesia,
Laos, Malaysia, dan Singapura (Medway 1983). Faktor yang mempengaruhi
penyebaran ekologi dan dinamika populasi tikus putih (R. norvegicus) yaitu faktor
abiotik dan biotik. Faktor abiotik yang penting dalam mempengaruhi dinamika
populasi tikus adalah air minum dan sarang. Air merupakan kebutuhan penting
bagi tikus. Sarang memiliki beberapa fungsi untuk kehidupan tikus, seperti untuk
melahirkan, membesarkan anak-anaknya, menyimpan pakan, berlindung dari
lingkungan yang kurang menguntungkan, dan tempat untuk beristirahat. Cuaca
tidak mempengaruhi secara langsung pada dinamika populasi tikus. Faktor biotik
yang penting dalam mempengaruhi populasi tikus antara lain adalah (1) tumbuhan
atau hewan kecil sebagai sumber pakan, (2) patogen (penyebab penyakit) dari
golongan virus, bakteri, cendawan, nematoda, protozoa, dan sebagainya, (3)
predator dari golongan reptilia, aves, dan mamalia, (4) tikus sebagai kompetitor,
khususnya pada populasi tinggi, dan (5) manusia yang merupakan musuh utama
bagi tikus (Priyambodo 1995).
2.1.1 Klasifikasi Tikus Putih (R. norvegicus)
Tikus digolongkan ke dalam Ordo Rodentia (hewan pengerat), Famili
Ordo Rodentia merupakan ordo terbesar dari kelas mamalia karena memiliki
jumlah spesies (40%) dari 5.000 spesies di seluruh mamalia.
Klasifikasi tikus putih (R. norvegicus) menurut Myres & Armitage (2004).
Kingdom : Animalia
Tikus putih merupakan strain albino dari R. norvegicus. Tikus memiliki
beberapa galur yang merupakan hasil pembiakkan sesama jenis atau persilangan.
Galur yang sering digunakan untuk penelitian adalah galur Sprague Dawley
(Inglis 1980). Galur ini berasal dari peternakan Sprague Dawley, Madison,
Wiscoustin.
2.1.2 Ciri Morfologi Tikus Putih (R. norvegicus)
Tikus putih (R. norvegicus) yang memiliki nama lain Norway rat,
termasuk ke dalam hewan mamalia yang memiliki ekor panjang. Ciri-ciri galur ini
yaitu bertubuh panjang dengan kepala lebih sempit. Telinga tikus ini tebal dan
pendek dengan rambut halus. Mata tikus putih berwarna merah. Ciri yang paling
terlihat adalah ekornya yang panjang. Bobot badan tikus jantan pada umur dua
belas minggu mencapai 240 gram sedangkan betinanya mencapai 200 gram. Tikus
memiliki lama hidup berkisar antara 4-5 tahun dengan berat badan umum tikus
jantan berkisar antara 267-500 gram dan betina 225-325 gram (Sirois 2005).
Tikus dapat mendengar hingga suara ultrasonik dengan rentang
5
antara 8-32 kHz. Suara ultrasonik ini sangat penting sebagai alat berkomunikasi
antara induk dengan anaknya. Galur ini memiliki pertumbuhan yang cepat,
tempramen yang baik dan kemampuan laktasi yang tinggi (Robinson 1979). Tikus
putih (R. norvegicus) tersebar luas di beberapa tipe habitat, namun tikus putih
lebih sering terlihat pada beberapa tempat yang merupakan habitat alami dari tikus
putih, yaitu area pertanian, hutan alami maupun buatan, pesisir pantai, dan
tempat-tempat yang lembab (Pagad 2011).
2.1.3 Biologi dan Perilaku Tikus Putih (R. norvegicus)
Tikus termasuk binatang pemakan segala makanan (omnivora). Walaupun
demikian, tikus cenderung untuk memilih biji-bijian (serealia) seperti jagung,
padi, dan gandum. Air sebagai sumber minuman dapat diambil dari air bebas atau
dapat diperoleh dari pakan yang banyak mengandung air. Kebutuhan air bagi tikus
tergantung dari suhu, lingkungan, aktivitas, umur, dan jenis makanan. Kebutuhan
air berkurang, jika pakan yang dikonsumsi sudah banyak mengandung air. Pada
umumnya tikus makan secara teratur pada tempat tertentu. Tikus putih (R.
norvegicus) biasanya membuat sarang pada tempat-tempat yang berdekatan
dengan sumber makanan dan air. Tikus bermigrasi jika terjadi kekurangan
makanan pada habitat awal yang ditempati (Priyambodo 1995).
Menurut Smith & Mangkoewidjojo (1988) tikus memiliki masa kawin
pada saat berumur delapan sampai sembilan minggu. Tikus merupakan hewan
poliestrus dan berkembang biak sepanjang tahun. Periode estrus terjadi selama
dua belas jam dan lebih sering terjadi pada malam hari dibandingkan dengan siang
hari. Kelahiran anak pada tikus putih dipengaruhi oleh beberapa faktor, yaitu
kondisi iklim dan cuaca yang optimal (khususnya suhu), pakan yang melimpah,
2.2 Jenis Ektoparasit Pengganggu pada Tikus Putih (R. norvegicus)
Penyakit yang dapat diderita oleh tikus salah satunya diakibatkan oleh
parasit luar. Ektoparasit yang dapat menginfestasi pada tikus ini meliputiPolyplax
spinulosa, Laelaps echidninus, Bdellonyssus bacoti, Notoedres cati, Otodectes
cyanotis, Echidnophaga gallinacea,danXenopsylla cheopis(Sirois 2005).
Polyplax spinulosa merupakan kutu yang termasuk dalam ordo
Phthiraptera dan famili polyplacidae. Kutu ini memiliki ukuran kecil, yaitu
berukuran mulai 1-10 mm, bermetamorfosis tak sempurna (hemimetabola), tipe
mulut untuk menusuk dan menghisap, serta tidak memiliki sayap. Kutu dapat
menyebabkan hewan tidak bisa tidur (gatal-gatal), kehilangan berat badan,
produksi berkurang, dan anemia (Levine 1990). Selain itu, kutu juga dapat sebagai
vektor penyebaran penyakit pada tikus. Penyebaran penyakit ini dapat ditularkan
melalui gigitan dari kutu yang membawa virus, bakteri, rikketsia, dan penyakit
parasitik lainnya (Omudu & Ati 2010).
Laelaps echidninusmerupakan jenis tungau yang biasa terdapat pada tikus
(Gambar 1). Tungau ini memiliki ukuran yang sangat kecil dan aktif menghisap
darah. L. echidninussendiri merupakan vektor alami dari Hepatozoon murisdan
dapat juga mentransmisikan agen tularemia (Francisella tularensis) di antara
rodentia lain. Infestasi tungau pada tubuh tikus dapat menyebabkan iritasi dan
kegatalan. L. echidninus menyebabkan lesio pada telapak kaki tikus (Flynn
7
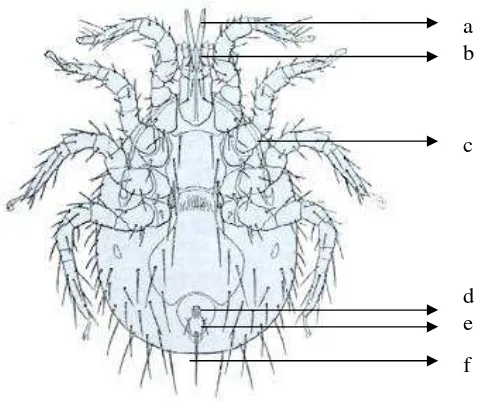
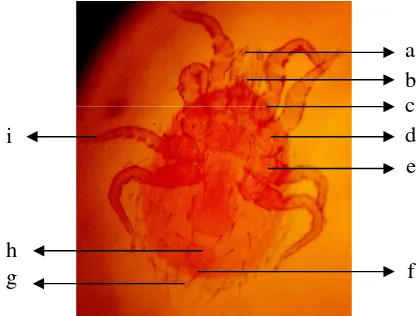
Gambar 1 MorfologiLaelaps echidninus(ventral). (a) Kelisera, (b) Pedipalpus, (c) Peritreme, (d) Anus, (e) Keping anal, (f) Seta.
Bdellonyssus bacoti atau biasa dikenal dengan Ornithonyssus bacoti,
termasuk ke dalam famili Macronyssidae dan merupakan tungau yang biasa hidup
pada tikus. Bdellonyssus bacoti dapat menyebabkan dermatitis dan menularkan
penyakit tifus pada manusia. Tungau ini memiliki kelisera yang lebih kuat dari
pada Dermanyssus sp. dan lebih mudah terlihat di bawah mikroskop. Morfologi
lain dari tungau yaitu memiliki satu keping dorsal dan anus terletak di tengah
anterior keping anal. B. bacoti merupakan inang antara dari Litmosoides carinii
(Bowmanet al. 2003). Selain itu,B. bacotisebagai vektor mekanikTrypanosoma
cruzi(Jimenezet al.1994).
Notoedres catimerupakan parasit pada kucing, tikus, kelinci, dan manusia
(bersifat sementara). Tungau ini memiliki ukuran dewasa mencapai 230-275m
dan memiliki empat kaki yang pendek (Gambar 2). Bagian dorsal tubuh tungau
terdapat sisik, namun tidak terdapat duri. AnusN. cati terletak pada bagian dorsal
antara kaki ketiga dan keempat (Flynn 1973). Tungau ini menginfestasi kucing,
dan dapat berpindah ke hewan lain atau manusia, tetapi hanya dapat bertahan
hidup tidak lebih dari tiga hari. Hal ini disebabkan karena tungau memiliki induk
semang (inang) yang spesifik (Nahm & Corwin 1997). Peradangan dan a
b
c
d e
keratinisasi pada kulit menyebabkan kulit menjadi tebal dan berkerut (Soulsby
1982).
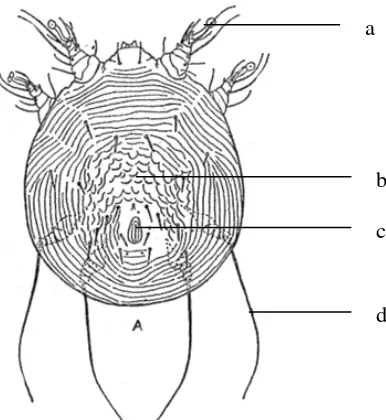
Gambar 2 MorfologiNotoedres cati. (a) Alat penghisap, (b) sisik, (c) anus, (d) Flagela (Urquhartet al.1987).
Otodectes cynotis merupakan tungau yang termasuk ke dalam famili
Psoroptidae. TubuhO. cynotismemiliki tarsi yang pendek, pedikulus pertama dan
kedua tidak memiliki segmen pada betina, serta di seluruh pedikulus pada jantan.
Tungau ini menginfestasi telinga bagian luar dan kulit anjing, kucing, musang,
dan rubah yang dapat menyebabkan iritasi. Karakteristik dari penyakit yang
ditimbulkan oleh O. cynotis adalah produk serumen yang berwarna gelap
(Bowmanet al.2003).
Echidnophaga gallinacea (sticktight flea), umumnya terdapat pada ayam
namun dapat menyerang hewan domestik. Pinjal ini biasanya menyerang pada
bagian kepala, terutama pial pada ayam. Beberapa hewan yang dapat dijadikan
inang olehE. gallinaceaantara lain burung-burung lokal (kalkun, burung puyuh),
tikus, anjing, kucing, dan terkadang manusia. Bentuk dewasa dari pinjal ini dapat
dikenali dari bentuk kepala dan tidak adanya pronatal serta genal ktenidia (Mullen
et al.2009).
a
b
c
9
Xenopsylla cheopismerupakan genus pinjal yang terdapat pada tikus serta
dapat menyerang ke manusia. Ukuran tubuh pinjal kurang lebih 2,5 mm. Tubuh
pinjal terdiri dari kepala, thoraks, dan abdomen. Bagian kepala dan toraks
memiliki dua segmen dan abdomen memiliki delapan segmen. X. Cheopis
memiliki tiga pasang kaki (Gambar 3). Kaki belakang pinjal memiliki tungkai
yang panjang sehingga pinjal dapat melompat jauh. Ciri morfologi yang
membedakan X. cheopisdengan genus lainnya adalah tidak memiliki rambut dan
bentuk kepala yang lebih bulat. Pinjal ini berperan penting dalam penyebaran
penyakit pes di Indonesia maupun di dunia (Gage & Kosoy 2005).
(a) (b)
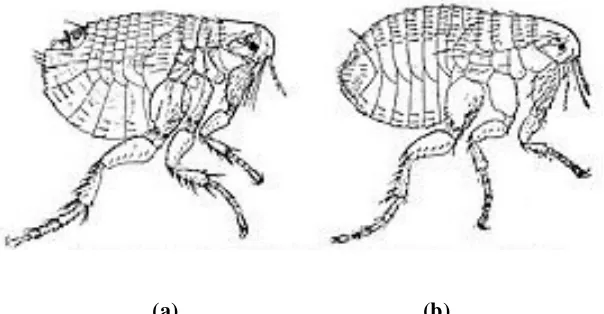
Gambar 3 Xenopsylla cheopis; (a) jantan; (b) betina
2.3.1 Gambaran Diferensiasi Sel Darah Putih pada Tikus Putih (R. norvegicus)
Darah merupakan jaringan sirkulasi yang menyalurkan oksigen dan nutrisi
serta membuang karbondioksida dan beberapa materi yang tidak diperlukan oleh
tubuh melalui pertukaran gas, aktivitas seluler, dan pertahanan tubuh. Darah
tersusun dari komponen-komponen darah, yaitu sel darah dan plasma darah. Sel
darah terdiri atas sel darah merah (red blood cell), sel darah putih (white blood
2.3.1 Sel Darah Putih (Leucocyte)
Sel darah putih dikenal sebagai leukosit merupakan unit pertahanan tubuh
yang dibentuk di sumsum tulang belakang dan sebagian dibentuk di jaringan
limfoid. Granulosit dan monosit merupakan sel darah putih yang dibentuk di
sumsum tulang belakang, sedangkan limfosit dan sel-sel plasma dibentuk di
jaringan limfoid. Granulosit merupakan sel-sel polimorfonuklear yang memiliki
granular, seperti neutrofil, eosinofil, dan basofil. Granulosit memiliki masa hidup
empat sampai delapan jam dalam sirkulasi darah dan empat sampai lima hari
berikutnya pada jaringan yang membutuhkan. Namun, pada infeksi yang berat,
masa hidup keseluruhan dapat berkurang lebih cepat karena granulosit bekerja
lebih cepat pada daerah yang terinfeksi, melakukan fungsinya, dan masuk ke
dalam proses ketika sel-sel tersebut dimusnahkan. Monosit memiliki masa edar
yang singkat, yaitu 10-20 jam dalam darah, sedangkan limfosit memiliki masa
hidup berminggu-minggu atau berbulan-bulan tergantung dari kebutuhan tubuh
terhadap limfosit (Guyton & Hall 2008)
Leukosit mempunyai peranan dalam pertahanan seluler dan humoral.
Neutrofil, eosinofil, basofil, dan monosit berfungsi sebagai pelindung tubuh
terhadap zat asing dengan cara fagositosis (seluler). Fungsi limfosit dan sel
plasma berkaitan dengan sistem imun (humoral). Diferensiasi sel darah putih
dapat menjadi acuan untuk mengetahui sistem kekebalan tubuh pada tikus jika
terserang suatu penyakit (Guyton & Hall 2008)
2.3.2 Neutrofil
Neutrofil merupakan sel darah putih yang tergolong ke dalam sel
polimorfonuklear (PMN). Neutrofil dibentuk dalam sumsum tulang dan
dikeluarkan dalam sistem sirkulasi. Jumlah neutrofil normal berkisar antara
12-37% dari leukosit yang beredar, garis tengah sekitar 12 m, dan terdapat dua
sampai lima segmen (Gambar 4a). Sitoplasma banyak diisi oleh granula-granula
11
Neutrofil jarang mengandung retikulum endoplasma granuler, sedikit
mitokondria, aparatus golgi rudimenter, dan sedikit granula glikogen. Neutrofil
merupakan garis depan pertahanan seluler terhadap invasi jasad renik, memfagosit
partikel kecil dengan aktif. Neutrofil mempunyai metabolisme yang sangat aktif
dan mampu melakukan glikolisis baik secara aerob maupun anaerob. Kemampuan
neutrofil untuk hidup dalam lingkungan anaerob sangat menguntungkan karena
mereka dapat membunuh bakteri dan membantu membersihkan debris pada
jaringan nekrotik (Effendi 2003).
2.3.3 Eosinofil
Eosinofil merupakan sel darah putih yang termasuk ke dalam granulosit.
Jumlah eosinofil hanya 0-6% dari leukosit dan mempunyai garis tengah 9m,
sedikit lebih kecil dari neutrofil (Mitruka & Rawnsley 1981). Inti memiliki dua
segmen, retikulum endoplasma, mitokondria, dan apparatus Golgi kurang
berkembang (Gambar 4b). Eosinofil mempunyai pergerakan amuboid dan mampu
melakukan fagositosis terhadap komplek antigen dan antibodi (Effendi 2003).
Pada infeksi parasit, eosinofil diproduksi dalam jumlah yang besar dan akan
dimigrasikan ke daerah yang terinfeksi. Selain itu, eosinofil juga mempunyai
kecenderungan khusus untuk berkumpul di jaringan tempat terjadinya reaksi
alergi dan diduga mampu mendetoksifikasi beberapa zat yang dapat menimbulkan
peradangan yang dilepaskan oleh sel mast dan basofil (Guyton & Hall 2008).
2.3.4 Basofil
Basofil merupakan sel darah putih yang memiliki jumlah kecil di dalam
darah tikus. Jumlah basofil di dalam darah berkisar antara 0-3% (Thrall et al.
2004). Basofil umumnya berbentuk seperti huruf S (Gambar 4c). Sitoplasma
basofil berisi granul yang lebih besar dan seringkali menutupi inti. Granul basofil
memiliki bentuk ireguler berwarna metakromatik. Basofil merupakan sel utama
yang paling banyak ditemukan pada tempat peradangan atau alergi (Carolineet al.
permukaan yang dapat mengikat IgE (Imunoglobulin yang berperan dalam
pertahanan terhadap alergi) (Guyton & Hall 2008).
2.3.5 Limfosit
Limfosit merupakan sel yang sferis, memiliki garis tengah 6-8 m,
dengan jumlah 63-84% dari leukosit darah (Mitruka & Rawnsley 1981). Secara
normal, sel limfosit mempunyai inti relatif besar, bulat sedikit cekungan pada satu
sisi, inti kromatin padat, anak inti baru terlihat dengan menggunakan mikroskop
elektron (Gambar 4d). Limfosit memiliki sitoplasma yang sangat sedikit, sedikit
basofilik, dan mengandung granula-granula azurofilik. Limfosit dalam sirkulasi
darah normal dapat berukuran 10-12m. Ukuran yang lebih besar disebabkan
sitoplasmanya yang lebih banyak. Sel limfosit berada dalam kelenjar getah bening
dan akan tampak dalam darah dalam keadaan patologis. Secara fungsional,
limfosit dikelompokkan menjadi dua, yaitu limfosit T dan limfosit B. Limfosit T
dan B dibentuk dalam sumsum tulang. Limfosit T memiliki jangka waktu hidup
lama dan berperan dalam reaksi kekebalan yang diperantarai oleh sel. Limfosit B
memiliki jangka waktu hidup yang bervariasi dan berperan dalam produksi
antibodi (Guyton & Hall 2008).
2.3.6 Monosit
Monosit merupakan sel leukosit yang berukuran besar dan terdapat
sebanyak 0 sampai 5% dari jumlah leukosit normal (Mitruka & Rawnsley 1981).
Monosit memiliki diameter 9-10 m, tetapi pada sediaan darah kering diameter
mencapai 20m atau lebih. Inti biasanya eksentris, adanya lekukan yang dalam
berbentuk tapal kuda dan kromatin kurang padat (Gambar 4e). Retikulum
endoplasma yang ditemui pada monosit sedikit. Monosit banyak ditemukan dalam
darah dan terdapat di dalam darah selama beberapa jam (Guyton & Hall 2008).
Monosit tergolong fagositik mononuklear (sistem retikuloendotel) dan
mempunyai tempat-tempat reseptor pada permukaan membrannya. Monosit
13
penghubung, dan berdiferensiasi menjadi makrofag. Di dalam jaringan bereaksi
dengan limfosit dan memegang peranan penting dalam pengenalan dan interaksi
sel-sel dengan antigen (Samuelson 2007).
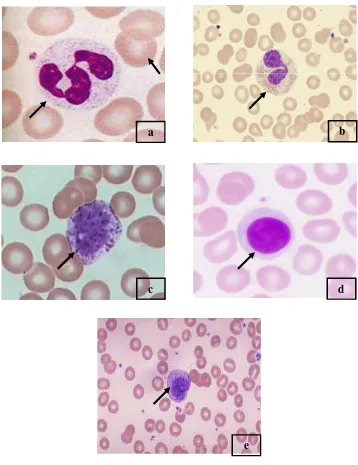
Gambar 4 Sel darah putih (leucocyte) dan sel darah merah (erytrocyte) ; (a) Neutrofil, (b) Eosinofil, (c) Basofil, (d) Limfosit, (e) Monosit
a b
c d
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Insektarium, Laboratorium Entomologi, Bagian
Parasitologi dan Entomologi Kesehatan, Departemen Ilmu Penyakit Hewan dan
Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian
Bogor. Penelitian ini dilakukan pada bulan Maret sampai April 2010 dan
dilaksanakan dalam tiga tahap, yaitu pengambilan sampel, pembuatan preparat,
dan identifikasi.
3.2 Pengambilan Sampel Ektoparasit
Sampel ektoparasit diambil dari empat belas ekor tikus putih (R.
norvegicus) galur Sprague Dawley. Pengambilan ektoparasit pada tikus ini
dilakukan secara manual yaitu dengan menggunakan kapas yang dibasahi dengan
alkohol 70% dan pinset. Kapas yang sudah dibasahi dengan alkohol ini kemudian
ditempelkan ke bagian tubuh tikus yang terdapat ektoparasit. Hal ini dimaksudkan
supaya ektoparasit pada tubuh tikus mudah untuk didapatkan dan dikoleksi
sedangkan pinset digunakan sebagai alat bantu untuk mengambil ektoparasit yang
menempel pada badan tikus.
Teknik pengambilan sampel dilakukan selama sepuluh menit dan dilakukan
pengulangan sebanyak dua kali. Sampel yang telah didapatkan kemudian
dimasukkan ke dalam cawan petri yang berisi alkohol 70%. Tiap-tiap sampel
ektoparasit yang telah terkumpul kemudian dipisahkan dengan kotoran yang
terikut di dalam cawan petri dan dipindahkan ke dalam tabung koleksi yang juga
berisi alkohol 70% dan diberi label.
3.3 Pembuatan Preparat Ektoparasit
Pembuatan preparat dilakukan setelah sampel semua terkumpul. Spesimen
yang berasal dari alkohol dikeluarkan dari botol, kemudian dicuci dengan
menggunakan air dan spesimen direndam dengan menggunakan laktofenol dalam
15
dengan larutan laktofenol, spesimen kemudian dicuci sebanyak tiga sampai empat
kali sampai air tidak berkabut. Larutan Hoyer diteteskan kurang lebih satu sampai
dua tetes di atas gelas objek yang akan dipakai. Lalu satu sampai dua spesimen
diletakkan ke dalam larutan Hoyer dengan cara menenggelamkan ke dalam
larutan. Preparat kemudian ditutup dengan gelas penutup dan jangan sampai ada
gelembung udara yang masuk. Namun, jika ada gelembung udara yang masuk
maka gelas objek dipanaskan di atas api secara perlahan-lahan sehingga
gelembung udara ini akan menghilang. Setelah itu, slide disimpan ke dalam slide
warmer selama empat sampai lima hari atau di dalam temperatur kamar selama
tujuh sampai sepuluh hari. Jika preparat tersebut sudah kering, pada sekeliling
gelas penutup diberikan lapisan kuteks secara merata.
3.4 Identifikasi Ektoparasit
Proses identifikasi sampel ektoparasit yang dikumpulkan dilakukan
dengan pengamatan di bawah mikroskop yang kemudian dicocokkan dengan
kunci identifikasi ektoparasit Baker & Canin (1958).
3.5 Pengamatan Tikus yang Terinfestasi Ektoparasit
3.5.1 Kondisi Umum
Pengamatan kondisi umum tikus dilakukan selama sebelum diberikan
perlakuan dengan melihat kondisi normal serta perilaku (behaviour) tikus tersebut.
3.5.2 Gambaran Darah
Gambaran darah tikus yang terinfeksi ektoparasit dilihat diferensiasinya
berdasarkan jumlah sel-sel darah putih, yaitu neutrofil, eosinofil, basofil, monosit
dan limfosit. Pengambilan darah dilakukan pada empat belas ekor tikus. Sebanyak
satu sampai dua tetes darah diambil dari ekor tikus, kemudian diletakkan di gelas
objek. Kemudian dilakukan pengulasan darah dengan mengunakan gelas objek
lainnya sehingga terbentuk ulasan darah yang tipis. Lalu ulasan tersebut
didiamkan selama beberapa menit agar kering dan siap untuk dilakukan
Pewarnaan dilakukan dengan cara mencelupkan preparat ulasan darah ke
dalam metil alkohol selama kurang lebih tiga sampai lima menit lalu dikeringkan.
Setelah kering, preparat dimasukkan ke dalam larutan Giemsa selama kurang
lebih tigah puluh menit kemudian dibilas dengan air yang mengalir dan
dikeringkan. Hal ini bertujuan agar seluruh preparat dapat terwarnai dengan baik.
Pengamatan terhadap preparat ulas darah dilakukan dibawah mikroskop
cahaya dengan perbesaran 100x. Metode yang digunakan adalah metode jalur
sejajar, yaitu dengan menelusuri daerah yang terpilih pada lapang pandang yang
digeser satu arah sehingga tidak terjadi perhitungan ulang. Setiap leukosit yang
ditemukan dideferensiasi ke dalam kelompok basofil, eosinofil, neutrofil, monosit,
dan limfosit sampai berjumlah 100 leukosit.
3.6 Analisis Data
Analisis data dilakukan secara deskriptif dan disajikan dalam bentuk
4 HASIL DAN PEMBAHASAN
4. 1 Jenis Ektoparasit
Jenis ektoparasit yang ditemukan dari empat belas ekor tikus putih (R.
norvegicus) galur Sprague Dawley terdiri atas tiga jenis, yaitu tungau Laelaps
echidninus,kutuPolyplax spinulosa,dan larva caplak.
4.1.1 Laelaps echidninus
L. echidninusmerupakan tungau yang paling banyak ditemukan pada tikus
putih (R. norvegicus) galur Sprague Dawley. Hasil pengamatan dan pengukuran,
menunjukkan bahwa jenis L. echidninus memiliki mata tunggal, berukuran satu
mm, berwarna cokelat, berbentuk oval, dan terbagi menjadi dua bagian yaitu
gnatosoma dan idiosoma (Gambar 5). Gnatosoma merupakan bagian anterior
sedangkan idiosoma merupakan bagian posterior dari tubuh L. echidninus. Di
bagian gnatosoma terdapat sepasang pedipalpus dan kelisera. Pedipalpus terletak
di lateral dan memiliki ukuran yang lebih panjang dibandingkan dengan kelisera.
Kelisera padaL. echidninusberukuran kecil namun sangat kuat. Bagian idiosoma
tidak mempunyai skutum atau perisai dorsal. Abdomennya hampir ditutupi
sepenuhnya seta yang terlihat menyebar rata, berukuran kecil, meruncing dan
terdapat keping genital yang berbentuk konkaf. L. echidninus dewasa memiliki
empat pasang kaki yang panjang, dan bentuk yang bulat sedangkan larvanya
hanya memiliki tiga pasang kaki. Stigmata terletak di bagian lateral di antara kaki
ketiga dan keempat.
Gambaran morfologi tersebut sesuai dengan Strandtmann & Mitchell
(1963) yang menyatakan bahwa L. echindinus betina memiliki panjang rata-rata
kurang lebih satu mm dengan bentuk yang oval hingga bulat dan berwarna merah
kecokelatan. Pilus dentilis lurus dan apendikulat berada di puncak. Tritosternum
lebih lebar dibandingkan dengan piringan pada bagian basis. Seta adanal memiliki
panjang yang hampir sama dengan seta post natal yaitu 1/2-2/3. seta inner basal
pada trokhanter I bervariasi, mulai dari yang paling panjang hingga yang paling
echidninusjantan memiliki rata–rata panjang sekitar 880. Seta koksa berbentuk
filiform dan semua seta tarsal lonjong runcing. Peritreme terletak lebih ke depan
mendekati koksa II. Seluruh seta anal terlihat tipis dengan bentuk meruncing.
L. echidninus tergolong parasit yang biasa terdapat pada hewan
laboratorium terutama tikus putih (R. norvegicus). L. echidninus termasuk ke
dalam ordo Acariformes dan famili Laelaptidae. Foreyt (2001) menyatakan bahwa
L. echidninusmerupakan satu di antara jenis ektoparasit yang tersebar di wilayah
tropis. Tungau tersebar diseluruh dunia (worldwide distribution) karena L.
echidninus memiliki ukuran tubuh kecil, yaitu satu mm dan dapat dengan mudah
beradaptasi dengan lingkungan.
Gambar 5 Laelaps echidninus. (a) pedipalpus, (b) kelisera, (c) (d) (e) coxae 1-4, (f) keping anal, (g) seta, (h) anus, (i) kuku
Berdasarkan klasifikasinya, L. echidninus tergolong ke dalam kingdom
Animalia, filum Arthropoda, kelas Arachnida, ordo Acariformes, famili
Laelaptidae, genus Laelaps, dan spesies Laelaps echidninus (Noble & Noble
1989).
L. echidninus termasuk tungau yang menghabiskan hampir seluruh
hidupnya di tubuh inangnya. Pada tikus putih (R. norvegicus) tungau ini biasanya
ditemukan dalam bentuk dewasa dan nimfa serta beberapa di antaranya dapat
ditemukan dalam bentuk larva. Siklus hidup tungau terdiri dari telur, prelarva,
19
daur hidupnya, seekor tungau betina dapat menghasilkan ratusan hingga ribuan
telur. Telur-telur berubah menjadi larva dan sebagian besar bertindak sebagai
ektoparasit pada inangnya.
L. echidninus betina merupakan tungau yang berkembang biak secara
ovivar. Tungau betina akan memproduksi hexapod larva, terkadang larva tersebut
parthenogenesis. Larva tungau tidak makan, namun berganti kulit (molting)
sampai fase pertama dari nimfa pada 10-13 jam. Perubahan menjadi nimfa fase
kedua berlangsung dalam kurun waktu hingga sebelas hari. Lalu dalam kurun
waktu tiga sampai sembilan hari akan berubah menjadi fase dewasa. Jadi, seluruh
siklus hidup memerlukan waktu kurang lebih dua puluh hari. Tungau betina dapat
hidup selama dua sampai tiga bulan jika makan, namun hanya mampu bertahan
kurang lebih satu minggu tanpa adanya makanan.
L. echidninus umum ditemukan pada tikus liar. Inang alaminya adalah
cotton rats dan tikus-tikus liar lainnya. Tikus laboratorium dan mencit juga peka
terhadap tungau ini dan infestasi pada tikus laboratorium sering terjadi. Hal ini
dikarenakan kondisi kandang tikus yang tidak bersih maupun infestasi melalui
alas kandang yang terinfestasi olehL. echidninus. Alas kandang tikus yang biasa
digunakan dalam pemeliharaan tikus laboratorium adalah jerami maupun serbuk
kayu yang dapat menjadi tempat berkembang biak L. echidninus. Tungau akan
makan pada malam hari dengan cara merobek kulit inang kemudian menghisap
darah dari inang tersebut melalui kulit yang telah dilukai. Selain menghisap darah,
L. echidninus juga memakan sekresi lakrimal dan eksudat serous dari inangnya.
Terkadang, tungau juga memakan larva mereka sendiri. Pada kondisi
laboratorium, mereka tidak pernah terlihat melukai kulit dari inang mereka.
Menurut Flynn & Baker (2007) L. echidninus merupakan inang alami dari
Hepatozoon muris dan vektor Francisella tularensis, penyebab penyakit
tularemia. L. echidninus dapat menyebabkan urtikaria pada tikus putih (Zhao
4.1.2 Polyplax spinulosa
Polyplax spinulosa merupakan kutu penghisap yang termasuk ke dalam
ordo Phthiraptera dan subordo Anoplura (sucking lice), famili Polyplacidae. Kutu
ini biasa ditemukan pada tikus laboratorium (R. norvegicus) dan tikus liar.
Menurut Burmeister (1839) P. spinulosa tergolong ke dalam kingdom Animalia,
filum Arthropoda, kelas Insecta, ordo Phthiraptera, famili Polyplacidae, genus
Polyplax, dan spesiesPolyplax spinulosa.
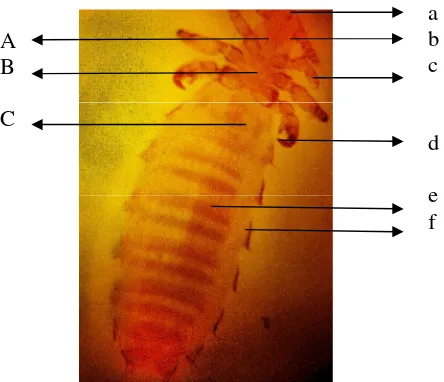
Gambar 6 Polyplax spinulosa. (A) Kepala, (B), Toraks, (C), Abdomen, (a) mulut, (b) antena, (c) kaki, (d) kuku, (e) segmen, (f) keping
pleura
Hasil penelitian menunjukkan bahwa P. spinulosamemiliki ukuran tubuh
mencapai 1,5 mm dengan pembagian struktur tubuh kepala, toraks, dan abdomen.
P. spinulosa tidak memiliki mata. Kepala kutu berukuran kecil dan terdapat
sepasang antena yang tersegmentasi menjadi tiga sampai lima bagian dan
meruncing pada bagian ujung dari antena tersebut. Di bagian toraks terdapat tiga
pasang kaki dengan kuku yang berbentuk seperti capit pada bagian ujung kaki.
Abdomen P. spinulosa berukuran panjang dan menyerupai kerucut. Bagian
abdomen memiliki tujuh keping lateral pada setiap sisi dan memiliki tujuh sampai
tiga belas keping dorsal. Tubuh kutu berwarna kuning kecokelatan (Gambar 6).
Suckow et al. (2006) menyatakan bahwa P. spinulosa merupakan jenis
21
memiliki tubuh yang ramping dan berwarna kuning kecoklatan dan memiliki
panjang tubuh 0,6-1,5 mm. Pada bagian kepala umumnya memiliki bentuk yang
ramping dan lebih sempit dibandingkan toraks. Di bagian toraks terdapat keping
ventral yang berbentuk pentagonal. Abdomen kutu dewasa berwarna kecokelatan
dan memiliki sebelas segmen yang ditutupi oleh seta. P. spinulosa betina
umumnya memiliki tubuh yang lebih panjang dari pada jantan yang memiliki
bentuk tubuh lebih pendek dan lebar. Pada kutu betina, organ genitalnya memiliki
dua pasang gonopod yang berfungsi untuk memandu, memanipulasi, dan
memberikan perekat pada telur untuk diletakkan pada rambut maupun kulit inang.
Organ genitalP. spinulosajantan umumnya besar dan terletak pada bagian tengah
dari abdomen. Kutu memiliki enam kaki dengan kuku yang digunakan untuk
mencengkeram rambut inang (Mullenet al.2009).
Kutu termasuk serangga yang bermetamorfosis tidak sempurna, yaitu
perkembangbiakkan yang memiliki fase hidup telur, nimfa, dan dewasa dimana
fase nimfa menyerupai fase dewasa. P. spinulosabetina termasuk hewan ovivar.
Sebagian besar telurnya diletakkan pada rambut inang. Telur-telur pada kutu
memiliki operculum yang merupakan tempat untuk keluarnya larva, berbentuk
kerucut dengan pori-pori di sepanjang operculum. Pada bagian atas dari
operculum terdapat lubang kecil yang diselimuti oleh kutikula tipis berfungsi
untuk tempat respirasi embrio yang sedang berkembang. Pada tahap nimfa,
terdapat tiga nimfa instar dan nimfa ketiga akan berubah menjadi dewasa.
Umumnya tahap ini berlangsung selama empat sampai lima belas hari,
masing-masing nimfa instar selama tiga sampai delapan hari dan menjadi dewasa
mencapai 35 hari. Pada kondisi yang optimal, kutu ini dapat menghasilkan
sepuluh sampai dua belas generasi pertahunnya, namun jarang terjadi pada
keadaan alaminya (Mullenet al.2009).
P. spinulosa termasuk ke dalam kutu dengan inang yang spesifik (host
specific) dan biasanya tidak dapat hidup jauh dari inangnya lebih dari empat jam
atau empat hari pada sebagian kasus. P. spinulosa menghabiskan seluruh
hidupnya pada tubuh inangnya. Kutu ini dapat berkembang dengan baik pada
maka dapat menyebabkan pendarahan yang serius pada tikus yang menjadi
inangnya sehingga terjadi anemia serta dermatitis akibat gigitan dariP. spinulosa.
Selain itu, P. spinulosa merupakan vektor dari Myoplasma haemomuris
(Haemobartonella muris),Rickettsia typhii,Trypanosoma lewisi,Borellia duttoni,
danBrucella brucei(Suckowet al. 2006).
4.1.3 Larva Caplak
Larva caplak merupakan jenis ektoparasit ketiga yang ditemukan pada
tikus putih (R. norvegicus). Hasil penelitian menunjukkan bahwa larva caplak
yang ditemukan tergolong ke dalam ordo Parasitiformes dan famili Ixodidae. Hal
ini ditunjukkan oleh adanya skutum pada larva tersebut yang merupakan ciri khas
dari famili Ixodidae. Ixodidae memiliki tubuh yang berbentuk bulat telur dan
mempunyai integumen. Panjang bagian dari mulut sama dengan bagian basis
kapituli. Segmen kedua dari palpi dan basis kapituli tidak tumbuh ke arah lateral.
Caplak jantan dan betina memiliki skutum, namun pada caplak jantan skutum
menutupi seluruh tubuh bagian dorsal sedangkan pada betina hanya menutupi
sepertiga bagian anterior dari tubuh. Larva caplak memiliki tiga pasang kaki yang
terdapat pada abdomen (Gambar 7).
Caplak tergolong ke dalam famili Ixodidae (caplak keras) dan Argasidae
(caplak lunak). Berdasarkan hasil penangkapan tikus di Korea, Kimet al.(2010)
menemukan banyak larva caplak yang berasal dari famili Ixodidae pada tikus
putih (R. norvegicus). Caplak dewasa memiliki daur hidup yang diawali dari
bentuk telur yang diletakkan di tanah oleh induknya. Larva yang telah menetas
akan segera mencari inang untuk ditempatinya agar dapat bertahan hidup. Larva
akan berubah menjadi nimfa. Larva dan nimfa caplak menghisap darah inangnya
untuk dapat melakukan perubahan siklus hingga pencapaian dewasanya. Larva
caplak memiliki tiga pasang kaki dan tidak berwarna. Larva caplak akan
berbentuk bulat dan akan menjadi lebih besar ketika kenyang menghisap darah.
Stadium larva pada caplak merupakan stadium parasitik. Infestasi larva
caplak dapat menyebabkan anemia dan dermatitis. Selain itu, larva caplak
23
bahwa Ixodidae merupakan vektor Anaplasma phagocytophilum dan Rickettsia
helveticpada tikus. Keberadaan larva caplak pada tikus laboratorium dapat terjadi
karena faktor alas kandang yang digunakan terinfestasi oleh telur caplak.
Pemeliharaan tikus laboratorium dikondisikan untuk dikandangkan sehingga larva
yang ditemukan hanya sedikit.
Gambar 7 Larva Caplak Ixodidae. (a) palpi (b) kapitulum, (c) basis kapituli, (d) kaki, (e) skutum.
4.2 Sebaran Jenis-Jenis Ektoparasit pada Tikus Putih (R. norvegicus)
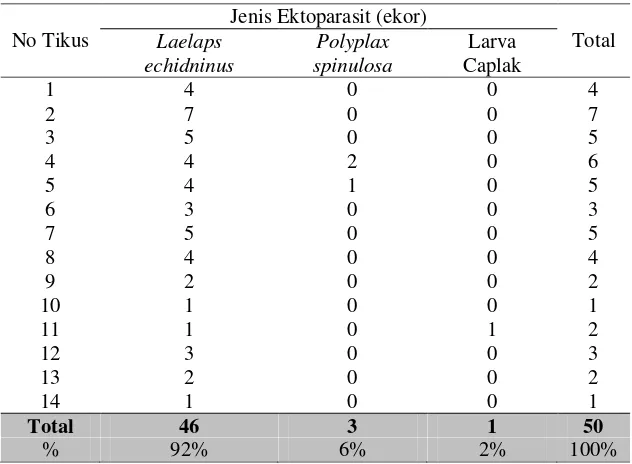
Berdasarkan hasil penelitian, jenis ektoparasit yang paling dominan
terdapat pada tubuh tikus spesies R. norvegicusadalah L. echidninus. Jenis-jenis
ektoparasit lain yang berhasil diidentifikasi adalah P. spinulosa, dan larva caplak
(Tabel 1). L. echidninusyang berhasil diidentifikasi pada empat belas ekor tikus
(R. norvegicus) sebesar sebesar 92% (46 ekor). P. spinulosa teridentifikasi
sebanyak 6% (3 ekor), dan larva caplak sebanyak 2% (1 ekor). a b c
L. echidninus merupakan tungau yang dominan ditemukan pada tikus
putih. Hal ini terkait dengan daur hidup L. echidninus yang memiliki daur hidup
metamorfosis sempurna. Larva dewasa yang bertelur akan meletakkan
telur-telurnya pada permukaan tanah maupun alas kandang. Telur-telur akan berubah
menjadi larva, nimfa, dan dewasa pada tubuh inang. Siklus hidup L. echidninus
dewasa tergolong lama karena dapat bertahan hidup selama kurang lebih dua
sampai tiga bulan.
4.3 Sebaran Ektoparasit Berdasarkan Regio
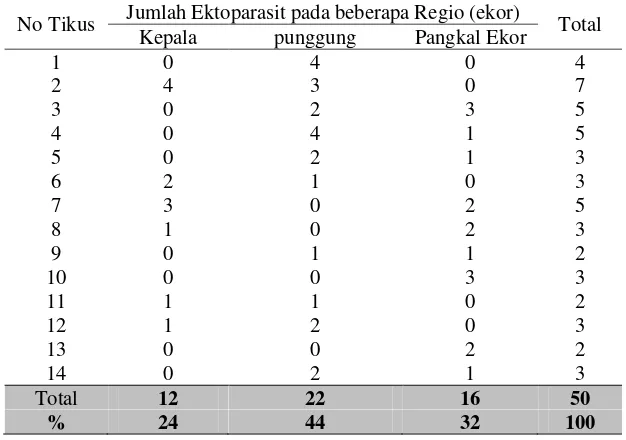
Hasil penelitian menunjukkan bahwa total ektoparasit yang berhasil
dikoleksi dari beberapa regio tubuh empat belas ekor tikus (R. norvegicus) galur
Sprague Dawley, seperti kepala, punggung, dan ekor adalah sebanyak 50 ekor
(Tabel 2). Sebesar 44% (22 ekor) ektoparasit ditemukan di regio tubuh punggung
tikus putih (R. norvegicus), bagian pangkal ekor sebanyak 32% (16 ekor), dan
bagian kepala sebanyak 24% (12 ekor). Hasil ini menunjukkan bahwa regio yang
paling dominan ditemukan ektoparasit tersebut adalah pada bagian punggung
tikus putih (R. norvegicus). Hal ini terjadi karena pada bagian punggung
merupakan bagian dari tubuh yang paling jarang terjadi pergerakan, pergesekan
dengan kandang dan tikus lainnya sehingga pada daerah tersebut banyak Tabel 1 Jenis ektoparasit pada tikus putih (R. norvegicus)
25
ditemukan ektoparasit. Selain itu, pada daerah punggung merupakan daerah yang
nyaman bagi kehidupan ektoparasit karena pada lokasi ini memiliki kelenturan
kulit yang cukup baik sehingga memudahkan ektoparasit tersebut mengambil
makanan.
Tabel 2 Sebaran ektoparasit pada tikus putih (R. norvegicus) berdasarkan regio
No Tikus Jumlah Ektoparasit pada beberapa Regio (ekor) Total Kepala punggung Pangkal Ekor
4.4 Gambaran Umum Tikus yang Terinfestasi Ektoparasit
Berdasarkan hasil pengamatan yang telah dilakukan, gigitan ektoparasit
dapat mempengaruhi kondisi fisiologis dari tikus putih (R. norvegicus) yaitu tikus
mengalami kegelisahan, seringnya menggigit bagian dari tubuhnya, kerontokan
rambut, dan lebih sering bergerak. Banyaknya jumlah ektoparasit yang
menginfestasi tikus mengakibatkan terganggunya kondisi fisiologis tikus dan
dermatitis. Zhao (2002) menyatakan bahwa infestasi ektoparasit dapat
menyebabkan urtikaria, kerusakan pada kulit, dan anaphylaxis. Perubahan
fisologis tersebut dapat mengakibatkan tikus mengalami penurunan nafsu makan,
stamina, dan tingkat kesehatan tikus sehingga penggunaan tikus yang terinfestasi
ektoparasit akan mempengaruhi hasil penelitian. Selain itu, ektoparasit dapat
sebagai reservoir beberapa parasit lain, seperti Coxiella burnetii, O.
4.5 Gambaran Sel Darah Putih (Leucocyte) Tikus Putih (R. norvegicus)
Gambaran sel darah putih memberikan informasi mengenai reaksi sel
darah putih terhadap infestasi ektoparasit pada tubuh tikus. Tabel 3 menunjukkan
perbandingan persentase diferensiasi sel darah putih pada jumlah normal dengan
jumlah yang didapatkan pada penelitian.
Tabel 3 Persentase gambaran sel darah putih tikus putih (R. norvegicus)
Sel leukosit Normal (%) Hasil penelitian (%)
Limfosit 68-84 74-95
Monosit 0-4 0-13
Neutrofil 12-37 0-8
Eosinofil 0-7 0-7
Basofil 0-3 0-5
Hasil penelitian menunjukkan bahwa jumlah limfosit yang didapatkan
adalah 74-95%. Jumlah limfosit yang terdapat pada tikus ini lebih besar
dibandingkan dengan nilai normal, yaitu berkisar antara 68-84%. Hal ini
kemungkinan akibat infestasi ektoparasit pada tikus putih (R. norvegicus) terjadi
dalam waktu yang cukup lama sehingga tubuh tikus membentuk suatu sistem
pertahanan yang spesifik. Zat asing yang berada pada tubuh tikus putih (R.
norvegicus) dikenal oleh tubuh sebagai suatu antigen. Antigen yang terdapat pada
tubuh tikus putih ini akan menginduksi sel T helper yang kemudian
mensekresikan limfokin untuk mengaktifkan limfosit B spesifik. Limfosit B akan
berdiferensiasi membentuk plasmablas yang merupakan prekusor dari sel plasma.
Sel plasma tersebut nantinya akan berproliferasi dan menghasilkan antibodi.
Pada penelitian ini, jumlah monosit yang terkandung di dalam darah tikus
putih (R. norvegicus) lebih tinggi dibandingkan dengan jumlah normal, yaitu
berada dalam kisaran 0-13%. Hal ini berkaitan dengan monosit yang memiliki
peranan dalam pertahanan lokal spesifik. Monosit merupakan sel darah yang
27
terjadi inflamasi kronik. Samuelson (2007) menyatakan bahwa di dalam jaringan,
monosit (makrofag) bereaksi dengan limfosit dan memegang peranan penting
dalam pengenalan dan interaksi sel-sel dengan antigen.
Kisaran eosinofil yang didapatkan dari hasil pengamatan preparat darah
tikus putih (R. norvegicus) menunjukkan kisaran yang sama dengan angka normal
eosinofil dalam darah tikus, yaitu sebesar 0-7%. Eosinofil merupakan sel yang
sering diproduksi dalam jumlah besar pada tubuh yang terinfeksi parasit, dan akan
melakukan migrasi besar-besaran ke lokasi yang terinfeksi parasit. Namun, dalam
hal ini eosinofil bekerja hanya beberapa saat setelah paparan atau gigitan
ektoparasit sehingga jumlah eosinofil dalam darah tidak begitu besar sedangkan
basofil merupakan sel darah putih granuler yang hanya berjumlah sedikit pada
tubuh mamalia, termasuk tikus putih (R. norvegicus).
Neutrofil yang didapatkan di dalam darah tikus berkisar di antara 0-8%.
Jumlah ini cukup rendah dibandingkan dengan kisaran normal neutrofil dalam
darah, yaitu 9-34%. Hal ini terjadi akibat infestasi ektoparasit pada tikus putih (R.
norvegicus) sudah berlangsung cukup lama sedangkan neutrofil merupakan sel
pertahanan pertama pada respon primer dan pembentukan antibodi pada beberapa
jam setelah terjadi paparan pertama oleh suatu antigen.
4.6 Pengendalian Ektoparasit pada Tikus Putih (R. norvegicus)
Pemeliharaan tikus dengan baik merupakan suatu tindakan pengendalian
dan pencegahan yang dapat dilakukan agar tikus putih (R. norvegicus) sebagai
hewan coba tidak terinfestasi ektoparasit. Pemeliharaan tikus putih sebaiknya
diletakkan pada kandang yang cukup. Sebanyak empat sampai lima ekor tikus
putih merupakan jumlah yang maksimal untuk diletakkan pada sebuah kandang.
Selain itu, tikus putih dapat juga dilakukan dengan menempatkan sebanyak satu
tikus pada satu kandang. Ukuran kandang yang dianjurkan 900 cm2. Kandang tersebut harus dibuat dari bahan yang baik, cukup kuat, mudah dibongkar, mudah
dibersihkan, mudah untuk dipasang lagi. Kandang juga harus rutin untuk
dengan cara pencucian dan pensterilan dengan bahan kimia pada suhu maksimal
120C. Alas kandang yang digunakan juga diganti sesering mungkin. Alas
kandang dapat menggunakan serbuk kayu maupun jerami yang terlebih dahulu
dijemur dibawah sinar matahari. Tikus putih sebaiknya dirawat dan dikandangkan
pada suhu yang optimal, yaitu pada suhu 20-25C (Smith & Mangkoewidjojo
1988).
Pengendalian tikus putih (R. norvegicus) yang telah terinfestasi oleh
ektoparasit dalam jumlah banyak dapat dilakukan dengan menggunakan
insektisida golongan piretroid yang saat ini banyak digunakan seperti metoflutrin,
dialetrin, dan lain-lain. Penggunaan insektisida pada hewan coba harus
memperhatikan aturan pakai sehingga mampu mengendalikan ektoparasit pada
tikus dengan baik dan mencegah terjadinya resistensi pada ektoparasit. Selain itu,
pemilihan insektisida harus tepat. Pemeliharaan tikus putih (R. norvegicus)
sebagai hewan coba perlu diawasi oleh dokter hewan sehingga kesehatan hewan
5 SIMPULAN DAN SARAN
5.1 Simpulan
Dari empat belas ekor tikus putih (R. norvegicus) galur Sprague Dawley
sebagai hewan percobaan, ektoparasit yang berhasil ditemukan adalah L.
echidninus, P. spinulosa,dan larva caplak. Sebagian besar ektoparasit ditemukan
di regio punggung tikus (44%), pangkal ekor (32%), dan bagian kepala (24%).
Gambaran umum mengenai perilaku tikus yang terinfestasi ektoparasit adalah
gelisah, sering menggigit dan menggesek-gesek tubuhnya sendiri. Hasil penelitian
ini juga menunjukkan bahwa gambaran diferensiasi sel darah putih pada tikus
tersebut menunjukkan adanya peningkatan jumlah limfosit dan monosit. Namun
demikian, gambaran pada neutrofil, eosinofil, dan basofil tidak mengalami
perubahan yang signifikan.
5.2 Saran
Informasi mengenai ektoparasit yang terdapat pada hewan coba perlu
disebarluaskan ke masyarakat dan instansi pengguna agar dapat diberikan
Pheidias L, Andreas P, Ioanna M, & Yannis T. 2010. Rats as indicators of the presence and dispersal of six zoonotic microbial agents in Cyprus, an island ecosystem: a seroepidemiological study. Transc. Roy. Soc. Trop. Med. Hyg.104: 733–739.
Baker EW & Canin JH. 1958. Guide to The Families of Mites. America : The Institute of Arcalogy, Departemen Zoology.
Bowman DD, Lynn RC, Eberhard ML, & Alcaraz A. 2003. Parasitology for Veterinarians 8thed.Philadelphia: Wb Saunders Company.
Caroline LS, Chu NQ, Yu S, Nish SA, Laufer TM & Medzhitoy R. 2009. Basophils function as antigen-presenting cells for an allergen-induced T helper type 2 response.Nat. Immunol.10 : 713–720.
Coutinho Z & Linardi M. 2007. Can Fleas from Dogs Infected with Canine Visceral Leishmaniasis Transfer The Infection to Other Mamals?. Vet. Parasitol.147:320-325.
Effendi Z. 2003. Peranan Leukosit Sebagai Anti Inflamasi Alergik dalam Tubuh. Sumatera Utara: Bagian Histologi Fakultas Kedokteran Universitas Sumatera Utara.
Foreyt WJ. 2001.Veterinary Parasitology 5thed.America: Iowa State University Press.
Flynn RJ. 1973. Parasites of Laboratory Animals. America: The Iowa State University Press.
Flynn RJ & Baker DG. 2007. Flynn's parasites of laboratory animals. America: American College of Laboratory Animal Medicine.
Gage K & Kosoy M. 2005. Natural History of Plague: Perspectives from more than a century of research.Annu. Rev. Entomol.50: 505-528.
Golub N & Nokkala S. 2004. Brief report Chromosome numbers of two sucking louse species (Insecta, Phthiraptera, Anoplura). Hereditas141: 94-96.
Guyton AC & Hall JE. 2008. Buku Ajar Fisiologi Kedokteran 11st ed. Jakarta : Penerbit Buku Kedokteran EGC.
31
Jimenez MC, Torres BM, & Aguilar RA. 1994. Experimental transmission of Trypanosoma cruzi by Ornithonyssus bacoti. Vet. Mexico,25 : 61-63.
Kia EB, Moghddas-Sani H, Hassanpoor H, Vatandoost H, Zahabiun H, Akhavan AA, Hanafi-Bojd AA, & Telmadarraiy Z. 2009. Ectoparasites of Rodents Captured in Bandar Abbas, Southern Iran.Iranian J. Arthropod. Brn. Dis.3(2) : 44-49.
Kim H.C, Chong ST, Sames WJ, Nunn PT, Wolf SP, Robbins RG & Klein TA. 2010. Tick surveillance of small mammals captured in Gyeonggi and Gangwon Provinces, Republic of Korea, 2004–2008. Syst. App. Acarol.
J.15 :100–108.
Levine ND. 1990. Parasitologi Veteriner. Prof.Dr. Gatot Ashadi. Penerjemah: UGM Press. Yogyakarta. Terjemahan dari:The Book of Parasitology for Veterinary.
Mitruka BM & Rawnsley HM. 1981. Clinical Biochemical and Hematological Reference Values in Normal Experimental Animals and Normal Humans 2nd Ed. New York : Masson Publishing USA Inc.
Motevalli HF, Gholami SH, Sharifi M, Mobedi I, Sobhani I, Sedaghat MM, & Najafpour AA. 2002. Study of Rodents ectoparasites in urban areas of Mazandaran Province in 1997-1999. Iranian J. Mazandaran. Uni. Med. Sci.27(13):72-77.
Mullen G, Mullen GR, & Durden L. 2009. Medical and Veterinary Entomology. London: Academic Press.
Myres P & Armitage D. 2004. Rattus novergicus Animal Diversiy.
http://animaldiversity.umuz.umich.edu/site/accounts/information/Rattusn overgicus.html. [19 Agustus 2010].
Nahm J & Corwin RM. 1997. Arthropoda. http://www.missouri.edu.html [19 April 2011].
Nijhof AM, Bodaan C, Postigo M, Nieuwenhuijs H, Opsteegh M, Franssen L, Jebbink F, & Jongejan F. 2007. Ticks and associated pathogens collected from domestic animals in the Netherlands.Vector-Borne Zoonotic Dis.7: 585-595
Noble ER & Noble GA. 1989. Parasitologi : Biologi Parasit Hewan. Widiarto, penerj UGM Press. Yogyakarta. Terjemahan dari: Parasitology: The Biology of Animal Parasites.
Pagad S. 2011. Rattus norvegicus (mammal). http://www.issg.org/database. [8 Juni 2011].
Priyambodo S. 1995.Pengendalian Hama Tikus Terpadu.Jakarata : PT Swadaya.
Robinson R. 1979. Taxonomy and Genetics. In Baker HJ, Lindsey JR, dan Weisbroth.The Laboratory Rat. London : Academic Press.
Samuelson DA. 2007. Textbook of Veterinary Histology. Missouri: Saunders Elsevier.
Sirois M. 2005.Laboratory Animal Medicine : Principles and Procedures. United States of America: Mosby, Inc.
Smith JB & Mangkoewidjojo S. 1988. Pemeliharaan, Pembiakan, dan Penggunaan Hewan Percobaan di Daerah Tropis. Jakarta : UI Press.
Soulsby EJL. 1982. Helminth, Arthropods, and Protozoa of Domestical Animal. London: Balliere Tindall.
Strandtmann RW & Mitchell CJ. 1963. The Laelaptine Mites of The Echinolaelaps Complex from The Southwest Pacific Area (Acarina : Mesostigmata).Pac. Insect.5 (3) : 541-576.
Su FC, Li FG, Qu SZ, Yang JL, Zhao SD, & Zhang XK. 1989.Medical Animals in Yunnan Province.China: Yunnan Science & Technology Press.
Suckow MA, Steven HW, & Craig LF. 2006. The laboratory rat. London: Academic Press.
Telmadarrairy Z, Vatandoost H, Mohammadi S, Akkhavan AA, Abai MR, Rafinejad J, Kia EB, Faghih NF, Jedari M, & Aboulhasani M. 2007. Determination of Rodent Ectoparasite Fauna in Sarpole Zahab District, Kermanshah Province, Iran 2004-2005. Iranian J. Arthropod. Brn. Dis.1(1): 58-62.
Thrall MA, Baker DC, Terry WC, DeNicola D, Fettman MJ, Lassen ED, Rebar A, & Weiser G. 2004.Veterinary Hematology and Clinical Chemisry. USA: Lippincott Wiliams & Wilkins.
Urquhart GM, Armour J, Duncan JL, Dunn AM, & Jennings FW. 1987.
Veterinary Parasitology. New York: Churchill Livingstone Inc.
33
34
Lampiran 1 Perbandingan jumlah sel darah putih
No Tikus
Jenis - jenis Leukosit (%) Jenis Ektoparasit (ekor)
Limfosit Monosit basofil Eosinofil Neutrofil L. echidninus
P. spinulosa
Larva Caplak
1 95 2 1 2 0 4 0 0
2 81 9 0 2 8 7 0 0
3 89 4 4 3 0 5 0 0
4 89 6 5 0 0 4 2 0
5 85 1 5 5 4 4 1 0
6 95 0 4 1 0 3 0 0
7 74 13 3 3 7 5 0 0
8 90 0 2 5 3 4 0 0
9 91 0 2 5 2 2 0 0
10 81 5 0 7 7 1 0 0
11 94 1 4 1 0 1 0 1
12 91 0 3 4 2 3 0 0
13 87 2 2 7 2 2 0 0