Lampiran 1. Tumbuhan Kesumba Keling (B. orellana L.) yangdigunakan dalam
Lampiran 3.Kromatogram lapisan tipisekstrak pekat lapisankloroform daun
tumbuhan Kesumba Keling (B. orellana L.) sebelum Kromatografi Kolom
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform daun Kesumba Keling I : Fasa gerak n-heksana:etil asetat (90:10) v/v
II : Fasa gerak n-heksana:etil asetat (80:20) v/v III : Fasa gerak n-heksana:etil asetat (70:30) v/v IV : Fasa gerak n-heksana:etil asetat (60:40) v/v V : Fasa gerak n-heksana:etil asetat (50:50) v/v VI : Fasa gerak n-heksana:etil asetat (40:10) v/v
No Fasa gerak Jumlah noda Rf
1. n-heksana:etil asetat 90:10 (v/v) 1 Rf = 0,066 2. n-heksana:etil asetat 80:20 (v/v) 1 Rf = 0,066 3. n-heksana:etil asetat 70:30 (v/v) 2 Rf 1 = 0,133
Rf 2 = 0,066 4. n-heksana:etil asetat 60:40 (v/v) 3 Rf 1 = 0,177 Rf 2 = 0,11 Rf 3 = 0,066 5. n-heksana:etil asetat 50:50 (v/v) 4 Rf 0,266
Rf 2 = 0,2 Rf 3 = 0,155 Rf 4 = 0,088 6. n-heksana:etil asetat 40:60 (v/v) 3 Rf 1 = 0,51
Lampiran 4. Kromatogram Lapisan Tipis sebelum preparatif
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Etil asetatdaun Kesumba keling I : Fasa gerak benzena:aseton (70:30) v/v
No Fasa gerak Jumlah noda Rf
1. Benzena:aseton 70:30 (v/v) 2
Lampiran 5. Kromatogram Lapisan Tipis senyawa hasil isolasi
Keterangan :
Fase diam : Silika gel 60 F254
E : Ekstrak Pekat etil asetat daun kesumbu keling I : Fasa gerak n-heksana:etil asetat 50:50(v/v) II : Fasa gerak benzena:aseton70:30(v/v)
No Fase Gerak Jumlah Noda Rf
I n-heksana:etil asetat 50:50 (v/v) 1 Rf = 0,51
Lampiran 6.Spektrum Ultraviolet-Visible Beberapa Standard Senyawa Flavonoid
Lampiran 7. Spektrum 1H-NMR Senyawa Hasil Isolasi
Lampiran 8. Spektrum1H-NMR Senyawa Hasil Isolasi pada δ = 6,65-7,4 ppm
Lampiran 9. Spektrum1H-NMR Senyawa Hasil Isolasi pada δ = 0,75-1,7 ppm
Lampiran 10. Spektrum1H-NMR Senyawa Hasil Isolasi pada δ = 3,1-5,2 ppm
O
O HO
OCH3
OCH3
OH
OCH3
C H C H3C
H3C
O
O HO
OCH3
OCH3
OH OCH3
C H C H3C
H3C
C-H3
Lampiran 11. Spektrum 1H-NMR Senyawa Pembanding Flavonoida
(Markham, 1998)
DAFTAR PUSTAKA
Andersen, M., Markham, K.R. 2006. Flavonoids. Taylor & Francis Group. New York
Aseervatham,S. B., Sasikumar, J. M., Kumar, D. 2012. Studies On in Vitro Free Radical Scavenging Activity of Bixa orellana L. Bark Extract. International Journal of Pharmacy and Pharmaceutical Sciences. India Bhat, S.V. 2005. Chemistry of Natural Products. Narosa Publishing House. New
Delhi
Castello, M.C. 2002. Antimicrobial Actovity of Crude Extracts from Plants Parts and Corresponding Calli of Bixa Orellana L. Indian Journal of Experimental Biology. India
Cseke, L., Kirakosyan, A., Kaufman, P., Warber, S., Duke, J., Brielmann, H. 2006. Natural Products From Plants. CRC Press. New York
Connolly, J. D. 1991. Dictionary of Natural Products. Chapman & Hall. London Dalimartha, S. 2009. Atlas Tumbuhan Obat Indonesia. Jilid 6. Pustaka Bunda.
Jakarta
Gandjar, I.G., Rohman, A. 2007. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta
Gritter, R.J., Bobbit, J.M., Schwarting, A.E. 1991. Pengantar Kromatografi. Edisi Kedua. Penerbit ITB. Bandung
Harbone, J. B. 1996. Metode Fitokimia. Terbitan Kedua. Penerbit ITB. Bandung Heinrich, M., Barnes, J., Gibbons, S., Williamson, E.M. 2009. Farmakognosi dan
Fitoterapi. Penerbit Buku Kedokteran EGC. Jakarta
Hostettmann, K., Hostettmann, M., Marston, A. 1995. Cara Kromatografi Preparatif, Penggunaan Pada Senyawa Bahan Alam. Penerbit ITB. Bandung
Narvaez, J.A. 2001. Development of Molecular Thechiques for Studying The Metabolism of Caratenoids in Bixa orellana L.. Hortscience. Mexico Mabry, T.J., Markham, K.R., Thomas, M.B. 1970. The Sistematic Identification of
Manito, P. 1981. Biosintesis Produk Alami. Terjemahan Koensoemardiyah. IKIP Semarang Press. Semarang
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan KosasiPadmawinata. ITB Press. Bandung
Muldja, M.H. 1995.Analisis Instrumental. Cetakan Pertama.UniversitasAirlanggaPress. Surabaya
Nakanishi, K., Goto, T., Ito, S., Natori, S., Nosoe, S. 1974. Natural Product Chemistry. Volume 1. Kodansha Ltd Academic Press. Tokyo
Nessa, F. 2003. Free Radical-Scavenging Activity of Organic Extracts and Pure Flavonoids of Blumea balsamifera DC Leaves. Food Chemistry
Pavia, D.L., Lampman, G.M., Kriz, G.S. 1979. Introduction to Spectroscopy: A Guide for Students of Organic Chemistry. Saunders College. Philadelphia Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi
Keenam.Bandung: Penerbit ITB
Sarker, J. D., Latif, Z., Gray, A. I. 2006. Natural Products Isolation. Second Edition. Humana Press Inc. New Jersey
Sastrohamidjojo,H. 1996. Sintesis Bahan Alam.Gadjah Mada University Press. Yogyakarta
Satiadarma, K., Mulja, M., Tjahjono, D.H., Kartasasmita, R.E. 1995. Asas Pengembangan Prosedur Analisis. Edisi Pertama. Airlangga University Press. Surabaya
Selvi, T., Dinesh, M.G., Satyan, R. S., Chandrasekaran, B., and Rose, C. 2011. Leaf and Seed Extracrs of Bixa Orellana L. Exert Anti-microbial Activity Againts Bacterial Pathogens. Journal of Applied Pharmaceutical Science. India
Shirataki, Y., Komatsu, M., Yokoe, I., Manaka, A. 1981. Constituents of the Root of Eucheresta Japonica Hook. Josai University. Sakado
Sirait, M. 2007. Penuntun Fitokimia Dalam Farmasi. Penerbit ITB. Bandung Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Penerbit Widya
Padjajaran. Bandung
Torssell, K.B.G. 1981. Natural Product Chemistry, a Mechanistic and Biosynthetic Approach to Secondary Metabolism. John Wiley & Sons Limited. New York
Elusidasi Struktur
Gambar 2.3 Diagram Teknik Pemisahan Metabolit Sekunder
2.6.1 Ekstraksi
Sampel yang berasal dari tanaman setelah diidentifikasi, kemudian digolongkan menjadi spesies dan famili, sampel kemudian dikumpulkan dari bagian arialnya (daun, batang, kulit kayu pada batang, kulit batang, dan akar). Sampel ini kemudian dikeringkan dengan cara diangin-anginkan untuk menghindari penguraian komponen oleh udara atau mikroba.
Jika telah dikeringkan, biomassa kemudian digiling menjadi partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini penting karena ektraksi efektif pada partikel kecil, dikarenakan memiliki luas permukaan yang lebih besar.Pemilihan pelarut ekstraksi sangat penting. Jika tanaman diteliti dari sudut pandang etnobotani, ektraksi harus mengikuti pemakaiannya secara tradisional. Kegagalan mengekstraksi biomassa dapat menyebabkan kehilangan akses untuk mendapatkan zat aktif.
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
Maserasi
Maserasi merupakan metode ekstraksi paling sederhana digunakan dalam tumbuhan dengan skala kecil. Cara maserasi dilakukan dengan merendam sampel dengan pelarut dan dilakukan perendaman hingga satu malam. Sampel dengan skala besar bisa digunakan metode maserasi tetapi sebaiknyapenggunaan sampel pada skala besar digunakan metode perkolasi.
Perkolasi
Perkolasi merupakan metode ekstraksi yang paling efisien pada sampel skala besar. Pada perkolasi menggunakan alat perkolator. Sampel dimasukkan kedalam tabung (kontainer). Dan dilakukan pengaliran pelarut pada tabung dan tabung ditutup dengan rapat. Jika sampel tidak terisi padat, bisa mengakibatkan proses perkolasinya tidak efisien. Perkolator akan mengekstrak sampel dan hasil ekstrak akan turun melalui keran sehingga pelarut dapat berganti-ganti setelah pelarut yang lain habis.
Sokletasi
Sokletasi merupakan metode ekstraksi dengan skala kecil. Sokletasi merupakan sistem tertutup karena pada sistem ini pelarut dialirkan secara kontiniu.pada proses ini membutuhkan pemanasan (Sarker, et al, 2006).
2.6.2 Partisi
pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat.
Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi fisik dengan medium lain (Heinrich,et al, 2009).
2.6.3 Hidrolisis
Prosedur yang digunakan untuk hidrolisis asam dari flavonoid glikosida adalah, sebanyak 2 mg sampel flavonoid glikosida dicampur dengan asam klorida 6% sebanyak 5 ml dengan jumlah metanol yang sangat sedikit pada sampel untuk membuat proses hidrolisis menjadi sempurna. Larutan dipanaskan selama 60 menit lalu didinginkan, kemudian ekstrak sepenuhnya dilarutkan dengan eter. Penguapan dari larutan akan mengendapkan ramnosa dan glukosa. Lapisan eter, setelah dikeringkan dengan menggunakan natrium sulfat akan didapatkan aglikon flavonoid setelah diuapkan (Mabry et al, 1970).
2.6.4 Kromatografi
dan mengkuantifikasi berbagai macam komponen yang kompleks, baik komponen organik maupun komponen anorganik.
Kromatografi dapat dibedakan atas berbagai macam tergantung pada pengelompokkannya.Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi: kromatografi adsorbsi, kromatografi partisi, kromatografi pasangan ion, kromatografi penukar ion, kromatografi eksklusi ukuran. Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: kromatografi kertas, kromatografi lapis tipis (disebut juga kromatografi planar), kromatografi cair kinerja tinggi, dan kromatogtrafi gas. Bentuk kromatografi yang paling awal adalah kromatografi kolom yang digunakan untuk pemisahan sampel dalam jumlah yang besar.
Pemisahan pada kromatografi planar pada umumnya dihentikan sebelum semua fase gerak melewati seluruh permukaan fase diam. Solut pada kedua kromatografi ini dikarakterisasi dengan jarak migrasi solut terhadap jarak ujung fase geraknya. Nilai faktor retardasi solut (Rf) dapat dihitung dengan menggunakan perbandingan dalam persamaan:
f= arak yang ditempuh fase gerak arak yang ditempuh solut
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai perbandingan distribusi (D) dan faktor retensi sama dengan 0 yang berarti solut bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal di permukaan fase diam.
Proses Sorpsi
terus menerus selama pemisahan kromatografi karenanya sistem kromatografi berada dalam keadaan kesetimbangan dinamis.
Solut akan terdistribusi diantara dua fase yang bersesuaian dengan perbandingan distribusinya (D) untuk menjaga keadaan kesetimbangan ini. Ada 4 jenis mekanisme sorpsi dasar dan umumnya 2atau lebih mekanisme ini terlibat dalam satu jenis kromatografi. Keempat jenis tersebut adalah adsorpsi, partisi, pertukaran ion, dan eksklusi ukuran.
Adsorben
Silika gel merupakan jenis adsorben (fase diam) yang penggunaannya paling luas. Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus silanol (Si-OH). Gugus silanol bersifat sedikit asam dan polar karenanya gugus ini mampu membentuk ikatan hidrogen dengan solut-solut yang agak polar sampai sangat polar.
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu mendeaktifkan permukaan silika gel karena air akan menutup sisi aktif silika gel. Hal seperti ini dapat diatasi dengan memanaskan pada suhu 1050C, meskipun demikian reprodusibilitasnya sulit dicapai kecuali jika suhu dan kelembapan benar-benar dijaga secara hati-hati. Semakin polar solut maka akan semakin tertahan kuat ke dalam adsorben silika gel ini. Berikut merupakan kepolaran dari beberapa adsorben menurut Gandjar dkk (2007) yang disajikan pada tabel berikut:
Tabel 2.1 Daftar Adsorben pada Kromatografi
No Nama Adsorben Sifat Adsorben
1 Alumina Paling polar
2 Karbon aktif Sangat polar
3 Silika gel Polar
4 Selulosa Polar
2.6.4.1 Kromatografi Lapis Tipis (KLT)
Dalam kromatografi lapis tipis, adsorben diletakkan tepat pada satu sisi plat atau kaca atau saluran plastik ataupun aluminium. Adsorben yang paling sering digunakan adalah silika gel dan alumina. Beberapa mikroliter larutan sampel yang akan dianalisa ditotolkan pada plat sebagai titik kecil yang tunggal dengan menggunakan pipa mikrokapilaritas. Plat dikembangkan dengan meletakkannya didalam botol ataupun chamber pengembang yang berisi sejumlah kecil pelarut. Pelarut akan menaiki plat dengan adanya gaya kapilar, dan membawa senyawa dari sampel dengan itu. Senyawa yang berbeda dipisahkan dari dasarnya pada saat interaksi mereka dengan lapisan adsorben.
Plat KLT yang biasa digunakan adalah plat dengan ukuran pori silika 60 Å dan ketebalan lapisan 25 µm dalam penyangga poliester atau aluminium, beberapa dengan menggunakan atau tanpa menggunakan indikator fluorosensi yang sesuai untuk analisa cepat dari ekstrak kasar tanaman dan digunakan sebagai dasar dari langkah preparatif. Plat biasa dapat digunting dengan menggunakan gunting atau kertas cutter untuk mengambil ukuran yang diinginkan. Deteksi noda yang dihasilkan dapat menggunakan lampu ultraviolet ataupun dengan menyemprot dengan menggunakan reagen yang sesuai (Cseke et al, 2006).
2.6.4.2 Kromatografi Kolom
Kromatografi kolom sangat berguna dalam pemisahan senyawa bahan alam terutama untuk pemisahan flavonoida. Fase diam yang umum digunakan adalah silika gel, sephadeks, dan dan selulosa (Bhat, 2005)
.
dilengkapi keran jenis tertentu pada bagian bawahnya untuk mengatur aliran pelarut.
Ukuran keseluruhan kolom sungguh beragam, tetapi biasanya panjangnya sekurang-kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100 kalinya. Ukuran kolom dan banyaknya penjerap yang dipakai ditentukan oleh bobot campuran sampel yang akan dipisahkan.
Untuk pemisahan normal, bobot sampel biasanya 30:1 ternyata memadai jika pemisahan tidak terlalu sukar. Ukuran partikel penjerap pada kolom biasanya lebih besar daripada untuk KLT. Walau pun banyak jenis penjerap telah dipakai untuk kolom, alumina dan silika gel adalah penjerap yang paling berguna dan mudah didapat.
Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan KLT) atau tampaknya berasal dari satu puncak (memakai pendeteksian sinambung) digabungkan, dan pelarutnya diuapkan, lebih baik dengan tekanan rendah. Jika pelarut dan penjerap murni. Maka fraksi-fraksi pun murni (Gritter dkk, 1991).
2.6.4.3 Kromatografi Lapis Tipis Preparatif (KLTP)
Sebagian besar pemakaian kromatografi lapis tipis preparatif hanya dalam jumlah miligram. KLTP bersama-sama dengan kromatografi kolom terbuka, dijumpai sebagian besar dalam isolasi bahan alam. Penjerap yang paling umum digunakan adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Ukuran partikel dan porinya kurang lebih sama dengan ukuran tingkat KLT.
Kebanyakan penjerap KLTP mengandung indikator fluorosensi yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Pita yang kedudukannya telah diketahui dikerok dari plat dengan spatula atau pengerok berbentuk tabung. Senyawa harus diekstraksi dari penjerap dengan pelarut yang paling kurang polar yang mungkin (sekitar 5 ml pelarut untuk 1 g penjerap). Harus diperhatikan bahwa semakin lama senyawa berkontak dengan penjerap makin besar kemungkinan penguraian (Hostettmann dkk, 1995).
2.7 Teknik Spektroskopi
Teknik analisis modern mencakup berbagai teknik analisis instrumen elektronika yang dikembangkan untuk mengukur parameter fisika dan kimia alami yang khas dan tetap dari atom atau molekul. Parameter khas yang bermakna untuk analisis adalah absorpsi dan emisi energi radiasi elektromagnet oleh atom atau molekul.
Teknik analisis spektroskopi berasaskan antaraksi radiasi elektromagnet dengan komponen atom atau molekul yang menghasilkan fenomena bermakna sebagai parameter analisis. Karena pada setiap teknik spektroskopi antaraksi radiasi elektromagnet dengan komponen atom/ molekul khas dan tidak semuanya sama, uraian teknik analisis didahului dengan mekanisme antaraksi tersebut, serta fenomena yang dipakai sebagai parameter analisisnya (Satiadarma dkk, 1995).
2.7.1 Spektroskopi Ultraviolet (UV-Vis)
Spektroskopi serapan ultraviolet dan serapan tampak barangkali merupakan cara tunggal yang paling berguna untuk menganalisa struktur flavonoida. Cara tersebut membantu mengidentifikasi jenis flavonoid dan menentukan pola oksigenasi. Disamping itu, kedudukan gugus hidroksi fenol bebas pada inti flavonoid dapat
ditentukan dengan menambahkan pereaksi („pereaksi geser‟) kedalam larutan
Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut metanol (MeOH, AR atau yang setara) atau etanol (EtOH), meski perlu diingat bahwa spektrum yang dihasilkan dalam etanol kurang memuaskan sehingga pada umumnya pelarut metanol yang digunakan untuk menentukan serapan pita yang dihasilkan.Perubahan penyulihan pada cincin A cenderung tercerminkan pada serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung lebih jelas tercermin pada serapan pita I (Markham, 1988).
Senyawa polifenol memiliki dua karakteristik pita penyerapan Ultraviolet dengan maksimal jarak 240 sampai 285 nm dan 300 sampai 550 nm. Berbagai macam golongan flavonoid dapat dikenali dari spektrum UV mereka masing-masing, karakteristik spektra UV dari masing-masing flavonoid yang mengandung jumlah dari golongan hidroksil aglikon, pola substituen glikosida, dan golongan asil aromatik bahan alam.
Saat ini penggunaan Spektroskopi UV-Visible paling sering digunakan dalam aplikasi untuk analisa kuantitatif, dan nilai dari metode ini dapat mengurangi perbandingan informasi yang banyak dari teknik spektroskopi yang lainnya seperti NMR dan MS (Andersen, 2006).
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara disajikan pada tabel dibawah :
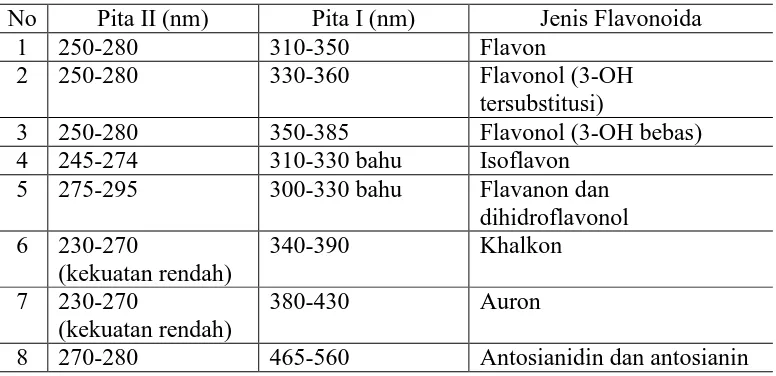
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida (Markham, 1998).
Tabel 2.3 Spektrum UV-Vis pada golongan isoflavon berbeda pada cincin A pada pita II.
Nomor spektrum
Isoflavon Pola oksidasi Pita II (nm) Cincin A Cincin B
108 Daidzein 7 4‟ 249
113 Genistein 5, 7 4‟ 261
129
6-Hidroksigenistein
5, 6, 7 4‟ 270
Gambar 2.3 Spektroskopi UV-Vis pada spektrum isoflavon
(Markham, 1970)
2.7.2 Spektroskopi Inframerah (FT-IR)
Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi tereksitasi , energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan (H, C-C, C=O, C=C-C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang gelombang yang berlainan.
Dengan demikian spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini disebabkan sebagian
oleh perubahan dalam momen dipol (µ≠0) pada saat energi diserap. Ikatan
nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur): vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk): vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan.
2.7.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Setelah spektroskopi inframerah, spektroskopi resonansi magnetik inti (NMR) adalah yang metode yang paling penting digunakan dalam kimia organik. Dalam spektroskopi inframerah mengandung infromasi mengenai adanya gugus fungsi pada molekul, sedangkan spektroskopi NMR memberikan informasi mengenai jumlah dari masing-masing hidrogen.
Kemampuan terhebat resonansi inti magnetik timbul karena tidak semua proton dalam molekul memiliki resonansi yang identik pada frekuensi yang sama. Hal ini sesuai dengan fakta bahwa berbagai macam proton dalam molekul dikelilingi oleh elektron dan memiliki sedikit perbedaan dalam lingkungan elektronik dari satu dan yang lainnya. Proton akan terlindungi oleh elektron yang mengelilingi mereka. Dalam daerah magnetik, peredaran elektron valensi dari daerah penghasil proton yang bertentangan dengan daerah magnetik yang berlaku.
Pergeseran kimia dalam unit δ ditunjukkan dalam jumlah resonansi proton yang
bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi
δ=frekuensi spektrometer dalam M zpergeseran dalam z
Unsur dasar dari spektrometer nmr adalah ilustrasi skematis. Sampel dilarutkan dalam pelarut yang tidak memiliki proton (biasanya CCl4) dan dalam jumlah yang kecil dari TMS yang ditambahkan sebagai pusat referensi internal.
Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzena, siklopentana, atau aseton memiliki nilai
BAB 3
METODE PENELITIAN
3.1 Alat-alat
1. Spektrofotometer UV-Vis
2. Spektrofotometer 1H-NMR Jeol/Delta2NMR
500MHz
3. Spektrofotometer FT-IR 2Shimadzu
4. Rotarievaporator Bűchi -114
5. Labu rotarievaporator 1000 mL Schoot/ Duran
6. Ekstraktor 5000 mL Schoot/ Duran
7. Kolom kromatografi Pyrex
8. Alat destilasi
9. Lampu UV 254 nm/356 nm UVGL 58
10. Neraca analitis Mettler AE 200
11. Corong Kaca
12. Corong Pisah 500 ml Pyrex
13. Gelas ukur Pyrex
14. Labu takar 250 mL Pyrex
15. Tabung reaksi Pyrex
16. Botol vial 15 mL
17. Gelas Erlenmeyer Pyrex
18. Beaker Glass Pyrex
19. Statif dan klem 20. Penangas air 21. Batang pengaduk 22. Chamber
3.2 Bahan-bahan
1. Daun Kesumba keling
2. Metanol Destilasi
3. Etil asetat Teknis
4. Aquadest
5. N-heksana Teknis
6. Silika gel 40 (70-230 mesh) ASTM E.Merck. KgA 7. FeCl3 5%
8. NaOH 10% 9. Serbuk Mg 10. HCl(p) 11. H2SO4(p)
12. Pereaksi Benedict 13. HCl 6%
14. Kapas
15. Kloroform Teknis
16. Plat KLT silika gel 60 F254 E.Merck.Art 554 17. Plat KLT Preparatif 60 F254
18. Benzena p.a. E. Merck
19. Aseton p.a. E. Merck
20. Kertas saring 21. Aluminium foil
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
3.3.2 Uji Pendahuluan Terhadap Ekstrak Daun Tumbuhan Kesumba keling
Serbuk kering halus daun Kesumba Keling diidentifikasi dengan menggunakan cara Skrining Fitokimia. Untuk membuktikan adanya senyawa flavonoida yang terdapat dalam daun kesumba keling maka dilakukan uji pendahuluan secara kualitatif dengan reaksi warna sebagai berikut:
1. Dimasukkan 10 gram serbuk kering halus daun Kesumba Keling yang telah dikeringkan ke dalam dua gelas Erlenmeyer
2. Ditambahkan 100 mL metanol ke dalam gelas Erlenmeyer 3. Didiamkan selama 1 malam
4. Disaring
5. Dibagi masing-masing ekstrak sampel ke dalam 3 tabung reaksi 6. Ditambahkan masing-masing pereaksi
a. Tabung I : dengan FeCl3 5% menghasilkan larutan berwarna hitam b. Tabung II : dengan serbuk Mg, dan HCl(p) menghasilkan larutan merah
jambu
c. Tabung III: dengan NaOH 10% menghasilkan larutan biru violet
3.3.3 Ekstraksi Daun Tumbuhan Kesumba Keling
rotarievaporator dan diuapkan kembali sampai diperoleh 100 ml ekstrak metanol. Ekstrak metanol di uji kandungan gula dengan pereaksi Benedict, lalu di hidrolisis dengan menggunakan HCl 6% sambil di panaskan diatas penangas air selama ± 60 menit. Kemudian disaring dan filtrat yang diperoleh di ektraksi partisi dengan kloroform sebanyak 3 kali hingga lapisan kloroform negatif flavonoida. Ekstrak kloroform dipekatkan dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ekstrak pekat kloroform sebanyak 1,7 g.
3.3.4 Analisis Kromatografi Lapis Tipis
Analisis Kromatografi Lapis Tipis dilakukan terhadap ekstrak kloroform dengan menggunakan fase diam silika gel 60F254 Merck. Analisis ini dimaksudkan untuk mencari sistem dan perbandingan pelarut yang sesuai untuk kromatografi kolom. Fasa gerak yang digunakan adalah campuran pelarut n-heksana:etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40, 50:50; 40:60(v/v).
Dimasukkan 10 ml campuran larutan fase gerak n-heksana: etil asetat 90:10 (v/v) ke dalam bejana kromatografi, kemudian dijenuhkan. Di totolkan ekstrak pekat kloroform pada plat KLT yang telah diaktifkan. Dimasukkan plat ke dalam bejana yang telah berisi campuran pelarut yang telah dijenuhkan, lalu di tutup dan di elusi. Plat yang telah di elusi, di keluarkan dari bejana, lalu di keringkan. Di amati noda yang terbentuk dibawah sinar UV, kemudian difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut n-heksana:etil asetat dengan perbandingan 80:20, 70:30, 60:40, 50:50; 40:60 (v/v).
3.3.5 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Dirangkai alat kromatografi kolom. Terlebih dahulu dibuburkan silika gel 40 (70-230 mesh) ASTM dengan menggunakan n-heksana, diaduk-aduk hingga homogen lalu dimasukkan ke dalam kolom kromatografi. Kemudian dielusi dengan menggunakan n-heksana 100% hingga silika gel padat dan homogen. Dibuburkan 1,7 g ekstrak pekat kloroform dengan silika gel dengan pelarut kloroform, kemudian dimasukkan ke dalam kolom kromatografi yang telah berisi bubur silika gel, lalu ditambahkan fasa gerak n-heksana:etil asetat 90:10 (v/v) secara perlahan-lahan dan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n-heksana:etil asetat dengan perbandingan 80:20 (v/v), 70:30 (v/v), 60:40 (v/v), dan 50:50 (v/v). Hasil yang diperoleh ditampung dalam botol vial setiap ± 10 mL, lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%. Kemudian diuapkan sampai terbentuk kristal.
3.3.6 Pemurnian
3.3.7 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian kristal dilakukan dengan kromatografi lapis tipis dengan menggunakan fasa diam silika gel 60 F254 dengan fasa gerak n-heksana:etil asetat 50:50 (v/v), dan benzena:aseton 70:30 (v/v).
Dimasukkan 10 mL larutan fasa gerak ke dalam bejana kromatografi lapis tipis, lalu dijenuhkan. Ditotolkan kristal yang sebelumnya dilarutkan dengan etil asetat pada plat KLT. Dimasukkan plat KLT tersebut ke dalam bejana kromatografi lapis tipis yang telah jenuh. Setelah pelarut fasa gerak merembes sampai batas tanda, plat KLT dikeluarkan dari bejana, dikeringkan, diamati di bawah sinar UV, dan difiksasi dengan menggunakan pereaksi FeCl3 5% dalam metanol menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa flavonoida.
3.3.8 Identifikasi Senyawa Hasil Isolasi
3.3.8.1 Identifikasi dengan Spektrofotometer UV-Visible
Analisis dengan alat Spektrofotometer UV-Visible diperoleh dari Laboratorium Kimia Organik Bahan Alam ITB, Jalan Ganesha 10- Bandung, Jawa Barat dengan menggunakan pelarut metanol.
3.3.8.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
3.3.8.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton
(1H-NMR)
3.4 Bagan Skrining Fitokimia
3.4.1 Maserasi dengan menggunakan pelarut metanol
10 gram serbuk kering halus daun tumbuhan Kesumba Keling (B. orellana .L)
Diekstraksi maserasi dengan metanol Disaring
Dibagi kedalam 3 tabung reaksi
Tabung I
3.4.2 Maserasi dengan menggunakan pelarut etil asetat
10 gram serbuk kering halus daun tumbuhan Kesumba Keling (B. orellana .L)
Diekstraksi maserasi dengan etil asetat Disaring
Dibagi kedalam 3 tabung reaksi
Tabung I
3.5 Bagan Penelitian
980 gram serbuk kering halus daun tumbuhan kesumba keling (B. orellana L.)
Ampas
Ekstrak pekat metanol
Ekstrak etil asetat
Ekstrak pekat etil asetat Ekstrak metanol
diuji dengan FeCl3 5% (positif flavonoida) dilarutkan dengan metanol
diekstraksi partisi dengan n-heksana secara berulang-ulang sampai negatif Residu
Lapisan metanol Lapisan n-heksana
Ekstrak metanol asam Residu
Lapisan kloroform Lapisan ekstrak
metanol asam dipekatkan
Ekstrak pekat kloroform
dimaserasi dengan metanol sebanyak 6 L didiamkan selama ± 24 jam
diulangi sebanyak 6 kali disaring
diuji dengan FeCl3 5% (positif flavonoida) dipekatkan dengan rotarievaporator
diuapkan sampai semua pelarut metanol habis
dilarutkan dengan etil asetat secara berulang ulang hingga negatif disaring
dipekatkan dengan rotarievaporator
diuapkan sampai semua pelarut etil asetat menguap
diuji dengan FeCl3 5% (positif flavonoida) dipekatkan dengan rotarievaporator diuapkan hingga pekat (100 ml) diuji dengan larutan Bennedict
dihidrolisa dengan HCl 6% sambil dipanaskan selama 1 jam didinginkan
disaring
diekstraksi partisi dengan kloroform hingga lapisan kloroform negatif flavonoida
Lanjutan
Ekstrak pekat kloroform
diuji dengan FeCl3 5% (+ flavonoida)
diuji Kromatografi Lapis Tipis untuk mengetahui eluen n-heksana:etil asetat (90:10; 80:20; 70:30; 60:40; 50:50; 40:60 v/v)
dikolom kromatografi dengan fasa diam silika gel dan fasa gerak (eluen) n-heksana:etil asetat (90:10; 80:20; 70:30; 60:40, 50:50 v/v)
ditampung tiap fraksi sebanyak ± 10 mL dalam botol vial
digabung fraksi dengan Rf yang sama diuji Kromatografi Lapis Tipis
fraksi 1-16 fraksi 17-23 fraksi 33-42 fraksi 43-58
hasil positif
dianalisis Kromatografi Lapis Tipis
dipreparatif dengan
eluen benzen : aseton (70:30 v/v)
dikeringkan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Peneltian
Dari hasil skrining pendahuluan terhadap ekstrak metanol dan etil asetat dari daun tumbuhan kesumba keling (B. orelanaL.) dengan adanya penambahan pereaksi-pereaksi warna untuk menentukan golongan senyawa kimia yang dikandung dengan menggunakan pereaksi flavonoida ternyata sampel positif mengandung flavonoida.
Hasil elusi pada fraksi 43-58, dilakukan KLT preparatif dengan eluen benzen : aseton70:30(v/v) untuk mendapatkan senyawa murni. Sehingga diperoleh senyawa murni berupa kristal berwarna kuning, seberat 29,7 mg,dan nilai Rf= 0,51.
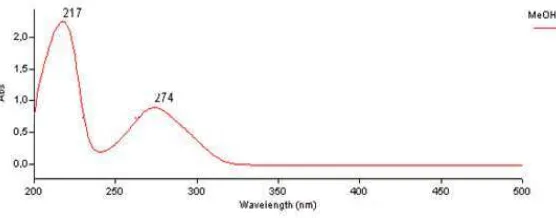
Spektrum UV-Visible senyawa hasil isolasi dengan menggunakan pelarut metanol ditunjukkan pada gambar 4.1 dibawah ini :
Gambar 4.1 Spektrum UV-Visible Senyawa Hasil Isolasi
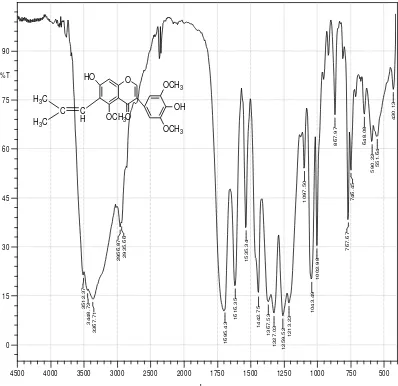
Hasil analisis spektrofotometer FT-IR dari krisal hasil isolasi menghasilkan pita-pita serapan pada daerah bilangan gelombang yang dapat dilihat pada Gambar 4.2.
Keterangan, x : Bilangan gelombang (cm-1) , y : Transmitansi (%T)
Gambar 4.2 Spektrum Inframerah (FT-IR) Senyawa Hasil Isolasi
Dari hasil analisis Spektrofotometer infra merah (FT-IR) memberikan pita-pita serapan pada bilangan gelombang (cm-1) sebagai berikut:
Tabel 2.4 Interpretasi Spektrum FT-IR Senyawa Hasil Isolasi Bilangan
Gelombang (cm-1)
Intensitas Gugus Fungsi
3448,72-3367,71 Sedang Vibrasi ulur –OH 2956,87-2935,66 Sedang Vibrasi ulur C-H alifatis 1695,43 Tajam Vibrasi tekuk C=O
1616,35 Sedang Vibrasi tekuk C=C dari sistem alkena 1442,75 Sedang Vibrasi tekuk C=C dari sistem aromatis 1327,03 Sedang Vibrasi ulur –CH3
1259,52 Sedang Vibrasi tekuk C-O dari gugus alkohol 1097,50 Tajam Vibrasi tekuk C-CO-C dari gugus keton 1043,49 Tajam Vibrasi tekuk C-O-C tak simetris 1002,98 Tajam Vibrasi tekuk C-O-C simetris 867,97 Sedang Vibrasi tekuk –CH aromatis
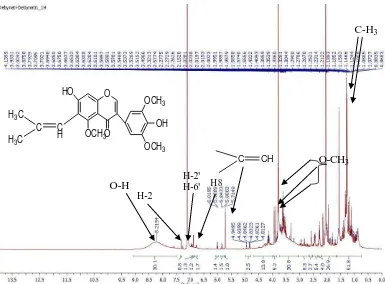
Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dapat dilihat pada Gambar 4.3 berikut:
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi
Dari hasil analisis Spektrometer Resonansi Inti Proton (1H-NMR) senyawahasil isoalasi dengan menggunakan pelarut Aseton-d6 memberikan pergeseran kimia pada daerah (ppm) sebagai berikut:
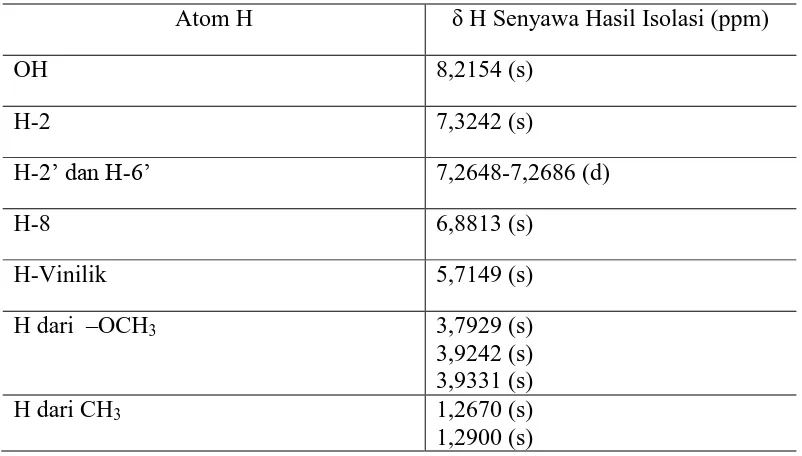
Tabel 2.5 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi
Atom H δ H Senyawa Hasil Isolasi (ppm)
Dari hasil interpretasi spektrum UV-Visible dengan pelarut metanol
(Gambar 4.1)memberikan panjang gelombang (λ maks) 274,00 nm untuk pita II. Hal ini menunjukkan bahwa senyawa hasil isolasi sesuai dengan spektrum UV-Visible dari senyawa pembanding flavonoida yaitu Isoflavon (Lampiran 5).
Dari hasil interpretasi Spektrum Inframerah (FT-IR) (Gambar 4.2) dan Spektrum 1H-NMR (Gambar 4.3) dengan menggunakan pelarut aseton dalam standar TMS diperoleh:
Pergeseran kimia pada daerah δ = 8,2154 ppmdengan puncak singlet menunjukkan adanya proton pada OH.Hal ini didukung oleh spektrum pembandingpada lampiran 11 dan juga didukung oleh spektrum infra merah pada bilangan gelombang 3448,72-3367,71 cm-1 dengan puncak sedang menunjukkan adanya vibrasi tekuk C-O dari gugus alkohol.
Pergeseran kimia pada daerah δ = 6,8813 ppmdengan puncak singlet menunjukkan adanya proton dariH-8 pada cincin A struktur flavonoida. Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 1442,75 cm -1
dengan puncak sedang menunjukkan adanya vibrasi tekuk C=C pada sistem aromatis dan panjang gelombang 867,97 cm-1 dengan puncak sedang menunjukkan adanya vibrasi tekuk –CH pada cincin aromatis.
Pergeseran kimia pada daerah δ = 5,7149 ppm dengan puncak singlet
menunjukkan adanya proton pada vinilik. Hal ini didukung dengan pergeseran kimia spektrum inframerah pada bilangan gelombang 2956,87- 2935,66 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur –CH alifatis dan bilangan gelombang 1616,35 cm-1 dengan puncak sedang menunjukkan adanya vibrasi tekuk C=C pada sistem alifatis.
Pergeseran kimia pada daerah δ= 7,3242 ppm denganpuncak singlet menunjukkanadanya proton dari H-2 pada cincin C struktur flavonoida. Hal ini didukung oleh spektrum inframerah pada bilangan gelombang1002,98cm-1dengan puncak tajam menunjukkan adanya vibrasi tekuk C-O-C simetris dan dan panjang gelombang 867,97 cm-1 dengan puncak sedang menunjukkan adanya vibrasi tekuk
–CH pada cincin aromatis.
flavonoida. Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 1442,75 cm-1dengan puncak sedang menunjukkan adanya vibrasi tekuk C=C aromatis dan panjang gelombang 867,97 cm-1 dengan puncak sedang menunjukkan adanya vibrasi tekuk –CH pada sistem aromatis.
Pergeseran kimia pada daerah δ = 1,2670 ppm dan δ = 1,2900 ppm dengan puncak singlet menunjukkan adanya proton dari –CH3 pada rantai lurus vinilik. Hal ini didukung dengan pergeseran kimia spektrum inframerah pada bilangan gelombang 2956,87- 2935,66 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur –CH alifatis dan pada bilangan gelombang 1327,03 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur -CH3.
Pergeseran kimia pada daerah δ = 3,9242 ppm, 3,9331 ppm dan 3,7929 ppm dengan puncak singlet menunjukkan adanya proton dari gugus metoksi – OCH3. Hal ini didukung dari spektrum inframerah pada bilangan gelombang 2956,87- 2935,66 cm-1dengan puncak sedang menunjukkan adanya vibrasi ulur – CH alifatis dan pada bilangan gelombang 1327,03 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur -CH3.Hal ini juga didukung pada bilangan gelombang 1043,49 cm-1dengan puncak tajam menunjukkan adanya vibrasi ulur C-O-C.
Dari data 1H-NMR senyawa hasil isolasi menunjukkan data yang mendukung bahwa senyawa yang diisolasi adalah senyawa flavonoida golongan isoflavon. Hal ini dibuktikan bahwa pada data 1H-NMR terdapat puncak singlet pada daerah 7,3242 ppm untuk proton pada C-2 dan daerah pergeseran kimia ini merupakan ciri khas dari senyawa isoflavon. Berdasarkan data UV-Vis senyawa untuk isoflavon pada pita II sekitar 274 nm yaitu pada H-5, H-6, dan H-7 pada cincin A terdapat subtituen. Pada senyawa isoflavon akan menghasilkan spektrum yang rendah. Intensitas absorpsi pada pita II akan menghasilkan bahu (pundak) atau menghasilkan intensitas yg lemah pada pita I.
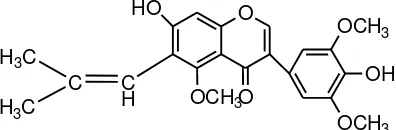
Berikut adalahstruktur yang diduga merupakan senyawa hasil isolasi :
O
O HO
OCH3
OCH3 OH
OCH3 C
H C H3C
H3C
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil isolasi yang diperoleh dari 980 g daun tumbuhan kesumba keling(B. orellana L.) merupakan kristal berwarna kuning, diperoleh sebanyak 29,7 mg, Rf = 0,51 dengan eluen n-heksana:etil asetat 50:50 (v/v).
2. Berdasarkan hasil skrining fitokimia flavonoida terhadap kristal hasil isolasi dari daun tumbuhan kesumba keling(B.OrellanaL.), menunjukkan hasil positif senyawa flavonoida.
3. Hasil analisis dengan Spektrofotometri UV-Visible, Spektrofotometri Inframerah (FT-IR) dan Spektrometri Resonansi Magnetik Inti Proton (1 H-NMR) menunjukkan bahwa senyawa hasil isolasi dari daun tumbuhan kesumba keling(B.orellanaL.) diduga adalah senyawa flavonoida golongan isoflavon.
5.2 Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Kesumba Keling(B. orellana L.)
B. orellanaL. sejak tahun 1828 telah menjadi tanaman wajib yang ditanam di pulau Jawa dan pada tahun 1889 kesumba keling telah diekspor ke negara-negara Eropa. Kesumba keling digunakan sebagai zat warna alami. Pemakaian zat warna alami dibeberapa negara lebih aman dari pada zat warna sintetis karena sifatnya non karsinogenik. B. orellana L. tergolong dalam famili bixaceae. Di Philipina, penduduk aslinya menggunakan kesumba kelingsebagai obat-obatan untuk menyembuhkan infeksi, pengobatan penyakit kulit dan untuk mengobati luka bakar (Sutara, 2009; Aseervatham, et al, 2012; Selvi, et al, 2011).
Kesumba keling merupakan jenis tumbuhan perdu tegak atau pohon kecil, tinggi 2-8 m. Ciri umum dari tumbuhan kesumba keling adalah daun tunggal bertangkai panjang, bentuknya bulat telur, ujung runcing, pangkal rata kadang berbentuk jantung, tepi rata, pertulangan menyirip, panjang 8-20 cm, lebar 5-12 cm, dan berwarna hijau berbintik merah. Berbunga majemuk berwarna merah muda atau putih dengan diameter 4-6 cm. Buah seperti rambutan, tertutup rambut sikat, berwarna hijau saat masih muda dan merah tua setelah masak, pipih, panjang 2-4 cm, berisi banyak biji kecil berwarna merah tua (Dalimartha, 2009).
Sistematika Tumbuhan Kesumba Keling
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledonae
Ordo : Cistales
Famili : Bixaceae
Genus : Bixa
Spesies : Bixa orellana L.
2.2 Senyawa Organik Bahan Alam
Pada hakekatnya kimia bahan alam merupakan pengetahuan yang telah dikenal sejak peradaban manusia tumbuh. Contohnya adalah pembuatan bahan makanan, pewarnaan benda, obat-obatan atau stimulan, dan sebagainya.
Para kimiawan pada akhir abad ke delapan belas mulai mengakhiri kepercayaan dunia mitos ke ilmu pengetahuan modern, dan diantara para ilmuan sangat antusias untuk menguak sifat-sifat yang sebenarnya dari bahan ekstrak yang diperoleh dari alam. Mereka mulai memisahkan, memurnikan, dan akhirnya menganalisis senyawa-senyawa yang dihasilkan dari sel-sel hidup. Seiring dengan kemajuan ilmu pengetahuan maka perkembangan kimia bahan alam tidak lagi diragukan hingga sekarang (Sastrohamidjojo, 1996).
Biogenesis dari produk alami, meskipun pada mulanya berkaitan dengan kimia organik dan biokimia, menjadi berlainan karena mempunyai tujuan yang berlainan. Kimia organik terutama mempelajari struktur, sifat-sifat kimia dan fisika, serta cara sintesisnya, baik secara alami ataupun in vitro dari zat-zat kimia tetapi cenderung untuk mengabaikan sifat-sifat khusus dari bahan alam, misalnya tentang cara pembentukan dan peran biologisnya. Biokimia, berusaha menjawab pertanyaan-pertanyaan yang paling banyak diajukan terutama tentang metabolisme primer, dan mengabaikan proses-proses sekunder misalnya tentang pembentukan alkaloid, terpena dan lain-lain (Manitto, 1981).
Dengan meningkatnya jenis dan tipe senyawa yang ditemukan di dalam berbagai bahan alam, berkembang juga sistem klasifikasi senyawa yang berasal dari bahan alam. Ada 4 jenis klasifikasi yang digunakan (Nakanishi,et al, 1974).
1. Klasifikasi Berdasarkan Struktur Kimia
a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula-gula, dan hampir semua asam amino
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid
c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
d. Senyawa heterosiklik, seperti alkaloid, flavonoid, dan basa-basa nukleat.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Pengembangan bahan alam didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
Sebagai contoh, berbagai steroid dengan struktur yang berbeda, aktivitas kardiotoniknya (kardenolida dan bufadienolida) ditunjukkan secara spesifik oleh (a) ikatan cis cincin A/B, (b) adanya gugus gula pada C3, dan (c) gugus lakton (dengan 5 atau 6 atom karbon) terkonjugasi pada C17.
R= gugus gula
3. Klasifikasi Berdasarkan Taksonomi
Klasifikasi ini didasarkan pada pengkajian morfologi komparatif atau taksonomi tumbuhan. Di dalam hewan dan sebagian mikroorganisme metabolit akhir biasanya diekskresikan ke luar tubuh, sedangkan di dalam tumbuhan, metabolit tersebut disimpan di dalam tubuh tumbuhan.
Walaupun beberapa metabolit selama ini diketahui spesifik pada tumbuhan tertentu, tetapi sekarang telah diketahui tersebar di dalam berbagai tumbuhan, misalnya alkaloid dan isoprenoid telah dapat diisolasi dari berbagai genus, spesies, suku, atau ordo. Bahkan di dalam satu spesies terdapat sejumlah komponen yang memiliki struktur dasar yang berkaitan. Sebagai contoh, opium dari Papaver somniferum mengandung lebih dari 20 alkaloid seperti morfin, kodein, tebain dan narkotin yang semuanya merupakan hasil biosintesis dari prekursor 11-benzilisokuinolin dengan kopling oksidatif.
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi dan karakterisasinya. Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan klasifikasi tumbuhan.
O
4. Klasifikasi Berdasarkan Biogenesis
Sebagian besar bahkan hampir semua, senyawa kandungan kimia bahan alam adalah senyawa organik, dan sumber utama senyawa karbon atau senyawa organik ini adalah glukosa yang dibentuk melalui fotosintesis di dalam tumbuhan autotropik atau diperoleh dari organisme heterotrof.
Berbagai teori tentang pembentukan senyawa metabolit primer dan metabolit sekunder telah dikemukakan di dalam berbagai publikasi. Diawali dengan teori aturan isoprena pada tahun 1930, yang menyatakan bahwa semua terpenoid dibentuk dari unit isoprena 5-C, dilanjutkan dengan teori poliketometilena untuk senyawa fenolik, yang merupakan saran pertama bagi biosintesis asetogenin (poliketida). Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor, yaitu:
Asetil ko-A
Malonil ko-A unit 2C(Me-C
O
) poliketida (asetogenin)
a.
b. asam sikimat unit 6C-3C (6C-1C atau 6C-2C) senyawa fenolik c. asam mevalonat unit prenil isoprenoid
CH2=C-CH2-CH2
Me
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan alkaloid
e.
5-5'-deoksiadenilmetionina unit 1C2.3 Metabolit Sekunder
Senyawa kimia bermolekul besar merupakan bagian utama dalam organ tanaman kering. Senyawa bermolekul besar ini berfungsi sebagai pembentuk struktur tanaman (selulosa, kitin, lignin), sebagai cadangan makanan (amilum, protein, lipoprotein) atau untuk memenuhi fungsi metabolisme penting lainnya (protein dan enzim). Senyawa kimia dari tanaman yang bebeda-beda dapat disaring dengan pelarut umum (air, etanol, eter, benzen), berupa senyawa kimia tanaman dengan molekul kecil, senyawa kimia bermolekul kecil ini memiliki penyebaran yang terbatas, senyawa inilah yang disebut dengan metabolit sekunder.
Penggolongan Metabolit Sekuder
Pengelompokkan senyawa kimia tananam berdasarkan sifat khas yang dimiliknya (antara lain warna, rasa, bau, pH, kelarutan), merupakan hal penting sehingga sampai sekarang masih banyak dipakai.
Berikut contoh pengelompokkan senyawa kimia seperti tersebut diatas.
1. Minyak Atsiri. Baunya khas dan dapat dipisahkan dari senyawa kimia tanaman lainnya, karena sukar larut dalam air dan dapat menguap bersama uap air. 2. Alkaloid. Senyawa yang bersifat basa dapat dipisahkan dari yang netral dan
asam. Penyebab sifat basa sangat erat kaitannya dengan kerja farmakologi pada tubuh binatang dan manusia.
3. Zat Pahit. Berpedoman pada rasa pahit adalah suatu metode yang mudah untuk memisahkan senyawa kimia tanaman, perlu waktu yang cukup sehingga seluruh zat pahit dalam sari menjadi zat yang dapat dikristalkan.
2.4 Senyawa Flavonoida
Flavonoidaterdapat dalam tumbuhan sebagai campuram, jarang dijumpai hanya flavonoida tunggal dalam jaringan tumbuhan. Banyak terdapat campuran yang terdiri dari flavonoida yang berbeda kelas. Flavonoid terdapat dalam semua tumbuhan berpembuluh, tetapi beberapa kelas lebih tersebar daripada yang lainnya. Flavon dan flavonol tersebar luas pada alam semesta, sedangkan isoflavon dan biflavonol hanya terdapat pada beberapa suku tumbuhan (Harborne, 1996).
Senyawa flavonoida diturunkan dari unit C6-C3 (fenil propana) yang bersumber dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6-C3 (sebagai KoA tioester) untuk membentuk unit awal triketida. Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida.
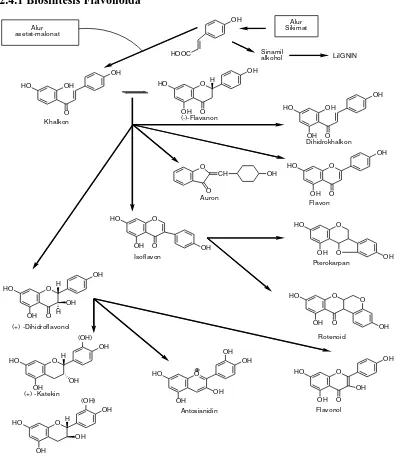
Unit awal triketida mengalami siklisasi oleh enzim kalkon sintase untuk membentuk gugus kalkon pada flavonoid. Kemudian terjadi siklus untuk menghasilkan cincin piranon yang mengandung inti flavanon, yang dapat memiliki ikatan C2-C3 teroksidasi (tidak jenuh) untuk menghasilkan gugus flavon, atau dihidroksilasi pada posisi C3 cincin piranon untuk menghasilkan gugus flavanol pada flavonoid.
Sistem penomoran untuk turunan senyawa flavonoid diberikan di bawah :
Flavanol ini selanjutnya dioksidasi untuk menghasilkan antosianin, yang memberikan warna biru terang pada bunga dan warna anggur merah gelap. Senyawa flavonoid juga berperan dalam memberikan banyak warna lain di alam, terutama daun mahkota kuning dan jingga, bahkan flavonoid yang tidak berwarna menyerap cahaya pada spektrum UV (karena banyak gugus kromofor) dan dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk membantu penyerbukan tanaman. Flavonoid tertentu juga mempengaruhi rasa makanan secara signifikan, misalnya beberapa tanaman memiliki rasa pahit dan kesat seperti glikosida flavanon naringin.
O
OH
OH O Glc
O Rha
Naringin
2.4.1 Biosintesis Flavonoida
Gambar 2.1Biosintesa hubungan antara jenis monomer flavonoida dari alur asetat-malonat dan alur sikimat (Markham, 1998).
2.4.2 Klasifikasi Senyawa Flavonoida
Dalam tumbuhan, flavonoid terdapat dalam berbagai bentuk struktur. Keragaman struktur flavonoid ini disebabkan karena perbedaan tahap modifikasi lanjutan dari struktur dasar flavonoid, antara lain:
1. Flavonoid O-glikosida.
Flavonoid biasanya terdapat sebagai flavonoid O-glikosida, pada senyawa tersebut satu gugus hidroksi flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi meyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan). Glukosa merupakan gula yang paling umum terlibat, walaupun galaktosa, ramnosa, xilosa, dan arabinosa sering juga terdapat. Gula lain yang ditemukan adalah alosa, manosa, fruktosa, apiosa dan asam glukuronat serta galakturonat.
O
(2) (R=H) Apigenin 7-O-β-D-glukopiranosida
(3) (R=OCOCH3) Apigenin 7-O-β-D-(6”-O-asetil)glukopiranosida
2. Flavonoid C-glikosida.
O
Apigenin 8-C-β-D-glukopiranosida (viteksin)
3. Flavonoid Sulfat
Gabungan flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion sulfat atau lebih, yang terikat pada hidroksil fenol atau gula.
4. Biflavonoid
Biflavonod adalah flavonoid dimer, walau pun prosianidin dimer (satuan dasarnya katekin) biasanya tidak dimasukkan ke dalam golongan ini. Flavonoid yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4‟ (atau kadang-kadang 5,7,3‟,4‟) dan ikatan antar-flavonoid berupa ikatan karbon-karbon atau kadang-kadang ikatan eter. Biflavonoid jarang ditemukan sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada gimnospermae. 5. Aglikon flavonoid yang aktif-optik
Flavonoid dapat dikelompokkan berdasarkan tahanan oksidasi dan keragaman lain pada rantai C3 :
1. Flavon
Flavon berbeda dengan flavonol karena pada flavon tidak terdapat gugus 3-hidroksi. Flavon juga terdapat sebagai glikosida, tetapi jenis glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Jenis yang paling umum ialah7-glukosida, contohnya luteolin7-hidroksida. Tidak seperti pada flavonol, flavon sungguh ajaib, terdapat juga yang terikat pada gula melalui ikatan karbon- karbon. Flavon merupakan senyawa yang berwarna kuning pucat.
O
O
A C
B
2. Flavonol
Flavonol sangat tersebar luas dalam tumbuhan, baik sebagai kopigmen antosianin dalam daun, bunga maupun dalam daun tumbuhan tinggi. Seperti antosianin, mereka paling sering terdapat sebagai glikosida. Walaupun telah dikenal dua atau tiga ratus aglikon flavonol, yang umum hanya tiga saja: kemferol (pola hidroksilasi serupa dengan antosianidin dan pelargonidin), kuersetin (bandingkan dengan sianidin), dan mirisetin (bandingkan dengan delfinidin).
O
O OH
A C
3. Flavanon
Flavanon terbentuk dari biosintesa dari kalkon melalui mediasi enzim isomerasi kalkon. Flavonon merupakan senyawa yang tersebar luas dialam. Senyawa ini banyak terdapat pada buah citrus dan pada bagian tumbuhan famili rutaceae. Senyawa ini banyak terjadi dialam. Flavonon terutama digunakan sebagai aktivitas antimikroba dan senyawa sakuranetin (narigenin 7-metil eter) yang digunakan sebagai antifungal pada daun ribes.
4. Auron
Auron dan khalkon merupakan „antoklor‟ , yaitu pigmen kuning yang dapat dideteksi berdasarkan kenyataan bahwa bila daun bunga yang berwarna kuning diasapi dengan asap basa dari sebatang cerutu, atau diuapi dengan uap amonia warnanya berubah menjadi jingga atau merah (Harborne, 1996).
5. Flavanonol
Flavanonol (atau dihidroflavonol) barangkali merupakan flavonoid yang paling kurang dikenal, dan tidak dapat diketahui apakah senyawa ini terdapat sebagai glikosida. Senyawa ini stabil dalam asam klorida panas tetapi terurai oleh udara.
6. Katekin
Katekin dan proantosianidin adalah dua golongan senyawa yang mempunyai banyak kesamaan. Semuanya senyawa tanpa warna, terdapat pada seluruh tumbuhan tetapi terutama dalam tumbuhan berkayu.
7. Kalkon
Pada kenyataan, pengubahan kalkon menjadi flavanon terjadi dengan mudah dalam larutan asam dan reaksi kebalikannya dalam basa. Reaksi ini mudah diamati karena kalkon warnanya jauh lebih kuat daripada warna flavanon, terutama dalam larutan basa warnya merah jingga. Oleh karena itu, hidrolisis glikosida kalkon dalam suasana asam menghasilkan aglikon flavanon sebagai senyawa jadi, bukan kalkon (Robinson, 1995).
8. Antosianin
Senyawa flavonoid alam yang paling menyolok adalah antosianin, yang merupakan pembentuk dasar pigmen warna merah, ungu dan biru pada tanaman, terutama sebagai bahan pewarna bunga dan buah- buahan. Antosianin adalah glikosida antosianidi, yaitu merupakan garam polihidroksiflavilium (2-arilbenzopirilium) (Sastrohamidjojo, 1996).
9. Leukoantosianidin
Adalah flavan 3,4-diol, tidak berwarna, dalam larutan asam berwarna merah.
10. Isoflavon
Isoflavon adalah 3-fenil kromon. Pada saat ini diketahui terdapat sekitar 35 isoflavon. Isoflavon dapat dipecah oleh alkali. Isoflavon menunjukkan aktivitas sebagai estrogenik, insektisida, dan antifungi. Beberapa diantaranya berguna untuk racun ikan (Sirait, 2007).
O
O
A C
B
2.5Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel dan beberapa tetes HCl pekat, warna orange, pink, merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan 2,3-dihidro dan xanton. Penggunaan zinc sebagai pengganti magnesium dapat dilakukan, dimana hanya flavanonol yang memberikan perubahan warna merah pekat sampai magenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta.
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah.
3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5% digunakan untuk mengidentifikasi senyawa fenolik. Pereaksi ini akan memberikan perubahan warna menjadi biru, kehitaman, biru-orange (Sarker,et al, 2006).
2.6 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya.
Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan (Muldja, 1995).
Biomassa (tanaman, mikroba, laut)
Ekstraksi
Skrining
Isolasi zat aktif berdasarkan uji hayati
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Flavonoida merupakan senyawa bahan alam dengan karakteristik struktur memiliki dua cincin hidroksil aromatik A dan B, yang dihubungkan oleh tiga atom karbon.Flavonoida terdapat pada semua bagian tumbuhan termasuk akar, kayu, kulit, tepung sari, nektar, bunga, buah , dan biji. Hanya sedikit yang melaporkan adanya flavonoida pada hewan (Torssell, 1981; Markham,1988).
Flavonoida umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan gula bersenyawa pada pada satu atau lebih grup hidroksil fenolik. Gugus hidroksil selalu terdapat pada atom karbon nomor 5 dan nomor 7 pada cincin A. Pada cincin B gugusan hidroksil atau alkoksil terdapat pada karbon nomor 3 dan nomor 4 (Sirait, 2007).
Flavonoid adalah senyawa turunan polifenolyang terbesar di alam terdapat didalam bagian tumbuhan yang berbeda-beda dalam bentuk bebas dan sebagai glikosida. Kata flavonoida berasal dari bahasa latin yaitu “flavus” yang berarti kuning. Kebanyakan dari flavonoida berwarna kuning. Flavonoida digunakan sebagai pigmen atau copigmen tumbuhan. Flavonoidadapat juga digunakan sebagai pelindung tubuh manusia dari radikal bebas dan dapat mengurangi resiko penyakit kanker dan peradangan (Bhat, 2005; Nessa, 2003).
Flavonida merupakan golongan terbesar senyawa bahan alam yang menyebar luas pada tumbuhan tingkat tinggi tetapi juga ditemukan pada tumbuhan tingkat rendah seperti alga.Antosianin banyak terdapat pada bunga yang berwarna pada kelompok angiospermae, tetapi pada bunga yang tidak berwarna juga banyak tersebar luas dan melimpah (Connolly, 1991).
Daun kesumba keling digunakan masyarakat sebagai obat disentri, diare, perut kembung, sakit kuning, pendarahan, dan meningkatkan nafsu makan (Dalimartha, 2009).
Biji pada tumbuhan ini dikenal sebagai annatto (“achiote” di Mexico) mempunyai kandungan zat warna orange kemerahan yang tinggi dan banyak digunakan sebagai pewarna alami pada bahan makanan dan minuman. Akhir-akhir ini B. orellana L. digunakan sebagai penghasil bahan warna alami yang penting nomor dua di dunia, setelah karamel yaitu yang terdapat pada selaput bijinya (Narvaez, 2001).
Beberapa penelitian terdahulu yang pernah dilakukan terhadap tumbuhan kesumba keling ini. Marie-Claire Castello (2002) melakukan penelitian mengenai uji aktivitas antimikroba pada ekstrak kasar dari bagian tumbuhan kesumba keling. Dari hasil penelitian diperoleh bahwa aktivitas yang maksimal terdapat pada bagian daun kesumba keling .
Ekstrak daun dan biji dari tumbuhan kesumba keling telah dilakukan skrining fitokimia yang menyatakan bahwa di dalam ekstrak tersebut terkandung tanin, saponin, flavonoid, alkaloid, protein, dan steroid (Selvi, et al, 2011).
Dari uji pendahuluan yang peneliti lakukan, yaitu dengan uji skrining fitokimia dengan pereaksi Mg-HCl, FeCl3 5%, dan NaOH 10% menunjukkan bahwa ekstrak metanol dan etil asetat daun tumbuhan kesumba keling (B. orellanaL.) mengandung senyawa flavonoida.
Dari uraian diatas, dan beberapa literatur penelitian yang telah dilakukan terhadap tumbuhan kesumba keling maka peneliti tertarik untuk meneliti daun B. orellana L. yang merupakan salah satu spesies dari Genus Bixa, khususnya mengenai senyawa flavonoida yang terkandung dalam tumbuhan ini.
1.2 Permasalahan
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk menentukan golongan senyawa flavonoida yang terdapat dalam daun tumbuhan kesumba keling (B. orellana L.) dan cara mengisolasi senyawa flavonoida
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya mengenai golongan senyawa flavonoida yang terkandung dalam daun tumbuhan kesumba keling (B. orellana L.)
1.5 Lokasi Penelitian
1. Tempat pengambilan sampel
Sampel yang digunakan diperoleh dari daerah desa Sentang, Kecamatan Kisaran Timur, Kabupaten Asahan, Sumatera Utara.
2. Tempat melakukan penelitian
Penelitian dilakukan di Laboratorium Kimia Bahan Alam Hayati Universitas Sumatera Utara
3. Lokasi Identifikasi Senyawa Hasil Isolasi
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap daun tumbuhan kesumba keling berupa serbuk halus yang kering sebanyak 1000 gram. Tahap awal yaitu dilakukan uji skrining fitokimia untuk senyawa flavonoida dari ekstrak metanol dan etil asetat dengan menggunakan pereaksi serbuk Mg-HCl, FeCl3 5%, dan NaOH 10%.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KESUMBA KELING (Bixa orellana L.)
ABSTRAK
Isolasi senyawa flavonoida yang terdapat pada daun tumbuhan Kesumba Keling (Bixa orellana L.). Ekstraksi dilakukan secara maserasi dengan pelarut metanol. Ekstrak pekat metanol ditambahkan dengan etil asetat kemudian disaring. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 6% dan selanjutnya dipartisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan eluen n-heksana : etil asetat (90:10; 80:20; 70:30; 60:40; 50:50 (v/v)). Senyawa yang diperoleh dimurnikan dengan kromatografi lapis tipis preparatif, menghasilkan kristal berwarna kuning sebanyak 29,7 mg dengan harga Rf=0,51. Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visible, Inframerah (FT-IR) dan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR). Dari data spektroskopi menunjukkan bahwa senyawa yang diperoleh adalah golongan isoflavon.
ISOLATION OF FLAVONOID COMPOUNDS FROM LEAVES OF KESUMBA KELING (Bixa orellana L.)
ABSTRACT
Isolation of flavonoid compounds from leaves of Kesumba Keling (Bixa orellana L.). Extraction has been done with maceration by methanol solvent. The concentrated extract of methanol added with ethyl acetate. The concentrated extract of ethyl acetate then dissolved with methanol and partition extracted with n-hexane. The concentrated extract of methanol acidified by HCl 6%, then partition extracted with chloroform. The concentrated extract of chloroform separated with column chromatography with eluent n-hexane: ethyl acetate 90:10; 80:20; 70:30; 60:40; 50:50 (v/v). The compounds was purified with TLC preparative yielding yellow cristal with weight 29,7 mg with Rf=0,51. The compound was further identified by spectroscopy Ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR) and Proton Nuclear Magnetic Resonancy Spectroscopy (1H-NMR). Spectroscopic data show that the compound was isoflavone.
ISOLASI SENYAWA FLAVONOIDA DARI
DAUN TUMBUHAN KESUMBA
KELING (Bixa orellana L.)
SKRIPSI
DEBYNATI SIHOMBING
110802024
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI
DAUN TUMBUHAN KESUMBA
KELING (Bixa orellana L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
DEBYNATI SIHOMBING
110802024
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Isolasi Senyawa Flavonoida Dari Daun Tumbuhan Kesumba Keling (Bixa orellana L.)
Kategori : Skripsi
Nama Mahasiswa : Debynati Sihombing Nomor Induk Mahasiswa : 110802024
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, Januari 2016 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Lamek Marpaung, M.Phil, Ph.D Dr. Sovia Lenny, M.Si NIP: 1952 0828 1982 031001 NIP: 1975 1018 2000 032001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN KESUMBA KELING (Bixa orellana L.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2016