Lampiran 1. Perhitungan Penetapan Kadar Allopurinol
Persyaratan (Q) : Tidak kurang 75% dari yang tertera pada etiket
Bobot baku (Bb) : 20,1 mg
Tabel 3. Data Uji Disolusi
No. Berat Tablet (mg) Absorbansi Larutan
Perhitungan:
Fu = Faktor pengenceran larutan uji Fb = Faktor pengenceran larutan baku Au = Absorbansi larutan uji
Ab = Absorbansi larutan baku
Bb = Bobot baku yang ditimbang (mg)
K = 900 100×
10
20×
0,62946
0,57391×
20,1
100 × 99,80% = 99,00%
Untuk Au6 = 0,62927
K = 900 100×
10
20×
0,62927
0,57391×
20,1
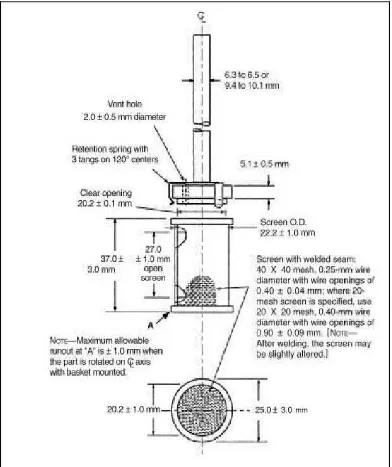
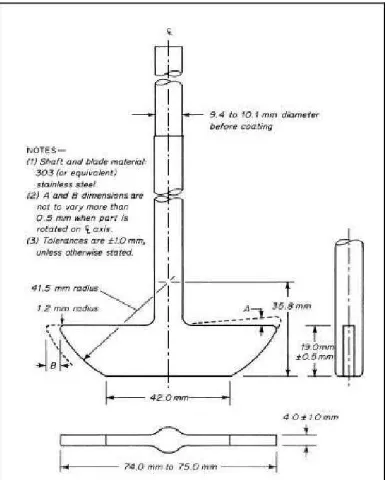
Lampiran 2. Gambar Alat Uji Disolusi
DAFTAR PUSTAKA
Admar, J. (2007). Perihal Obat dengan Berbagai Bentuk Sediaannya. Medan: Universitas Sumatera Utara Press. Hal. 35.
Agoes, Goeswin. (2008). Pengembangan Sediaan Farmasi. Bandung: ITB Press. Hal. 195, 297.
Anief, Moh. (1987). Ilmu Farmasi. Yogyakarta: Gadjah Mada University Press. Hal. 244.
Ansel, Howard C. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi Ke empat. Cetakan Pertama. Jakarta: Penerbit Universitas Indonesia Press. Hal. 244-249.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 1.
Devissaquest, J. (1993). Farmasetika 2 Biofarmasi. Surabaya: Airlangga University Press. Hal. 385.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 1084-1085.
Katzung, Bertram G. (2002). Farmakologi Dasar dan Klinik. Edisi VIII. Jakarta: Salemba Medika. Hal. 492-493.
Lachman, Leon. (1994). Teori dan Praktek Farmasi Industri. Jakarta: Universitas Indonesia Press. Hal. 645, 646, 795.
Mycek, Mary J. (2001). Farmakologi Ulasan Bergambar. Edisi kedua. Jakarta: Widya Medika. Hal. 418-420.
Mulja, Muhammad H. dan Suharman. (1995). Analisis Instrumental. Cetakan Pertama. Surabaya: Airlangga University Press. Hal. 28.
Setiabudy, Rianto. (2007). Farmakologi dan Terapi. Edisi V. Jakarta: Departemen Farmakologi dan Terapeutik FK UI. Hal. 233, 243-244.
Sardjoko. (1993). Rancangan Obat. Cetakan Pertama. Yogyakarta: Gadjah Mada University Press. Hal. 162.
Syukri, Yandi. (2002). Biofarmasetika. Edisi Pertama. Yogyakarta: Universitas Indonesia Press. Hal. 31, 32.
Sukandar, Yulinah E. (2009). ISO Farmakoterapi. Jakarta: PT. ISFI. Hal. 19, 655.
Tjay, T. H. dan Rahardja K. (2007). Obat-Obat Penting. Edisi ke enam. Cetakan Pertama. Jakarta: Penerbit PT. Elex Media Komputindo. Hal. 343.
BAB III METODOLOGI
3.1 Tempat
Uji disolusi tablet allopurinol 100 mg dilakukan di PT Mutiara Mukti
Farma (MUTIFA) Medan yang bertempat di Jl. Karya Jaya No. 68 Km. 8,5
Namorambe Medan.
3.2 Alat-alat
Alat-alat yang digunakan adalah Dissolution Tester merk Pharneg Lab
Type DISS-II, Spektrofotometri UV-Vis, timbangan analitis, kertas saring, kertas
perkamen, spatula, dan alat-alat gelas (beaker gelas, corong, gelas ukur, labu
tentukur, dan pipet volum).
3.3 Bahan-bahan
Bahan-bahan yang digunakan adalah tablet allopurinol 100 mg, baku
pembanding allopurinol, pelarut HCl 0,01 N.
3.4 Prosedur
3.4.1 Media Disolusi
Pembuatan media disolusi HCl 0, 01 N adalah:
a. Dipipet sebanyak 33,33 ml larutan HCl 3N (p), dimasukkan ke dalam labu
b. Dicukupkan dengan akuades sampai garis tanda, lalu dikocok.
3.4.2 Larutan Baku
a. Ditimbang seksama sejumlah 20,1 mg mg allopurinol baku pembanding
sekunder.
b. Dimasukkan ke dalam labu tentukur 100 ml.
c. Ditambahkan 5 ml NaOH 0,1 N, dikocok sampai larut.
d. Diencerkan dengan larutan HCl 0,01 N sampai garis tanda, dikocok (kons.
220 µg/ml).
e. Dipipet 5,0 ml larutan, dimasukkan ke dalam labu tentukur 100 ml.
f. Diencerkan dengan larutan HCl 0,01 N sampai garis tanda, dikocok (kons.
11µg/ml).
g. Diukur serapan larutan baku (A) dengan metode spektrofotometer UV
pada panjang gelombang 250 nm.
3.4.3 Larutan Uji
a. Disiapkan alat, dipastikan alat siap pakai.
b. Ditimbang masing-masing 6 tablet, dicatat hasilnya.
c. Dimasukkan 900 ml HCl 0,01 N ke dalam wadah (media disolusi), di
pasang alat dengan pengaduk bentuk dayung (alat 2).
d. Dijalankan alat pada suhu 37 ± 0,5ºC dengan laju kecepatan 75 rpm dan
waktu selama 45 menit. Segera dimasukkan 6 tablet allopurinol 100 mg ke
dalam masing-masing wadah secara serentak.
e. Setelah 45 menit, diambil sejumlah larutan pada daerah pertengahan antara
f. Disaring kedalam beaker gelas.
g. Dipipet 5 ml larutan ke dalam labu tentukur 50 ml.
h. Dilarutkan dan diencerkan dengan larutan HCl 0,01 N sampai garis tanda,
kocok (kons. 11,1µg/ml).
h. Diukur serapan masing-masing larutan uji menggunakan metode
Spektrofotometri UV dengan panjang gelombang 250 nm.
3.4.4 Penetapan Kadar secara Spektrofotometri UV
a. Dihidupkan power / on pada alat spektrofotometer.
b. Ditekan angka panjang gelombang.
c. Dibuka tempat kuvet, dimasukkan larutan blanko pada kuvet 1.
d. Dimasukkan juga larutan standar pada kuvet 2, tutup.
e. Kemudian dicatat absorbansinya.
f. Untuk mengukur absorbansi pada larutan uji dilakukan cara yang sama,
dimana larutan blanko pada posisi tetap di kuvet 1 dan larutan uji pada
kuvet 2.
3.4.5 Perhitungan
Perhitungan kadar zat berkhasiat tablet allopurinol 100 mg yang larut dalam
45 menit dapat dilakukan dengan menggunakan rumus:
K = Vm
Au = Absorbansi larutan uji Ab = Absorbansi larutan baku
Bb = Bobot baku yang ditimbang (mg)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Berdasarkan uji disolusi tablet allopurinol 100 mg yang dilakukan,
diperoleh hasil sebagai berikut:
Tabel. 4.1. Hasil Uji Disolusi
No. Berat Tablet (mg) Absorbansi Larutan
Uji (Au) Kadar Zat Terlarut (%)
Cara perhitungan yang diperoleh dapat dilihat pada Lampiran 1.
4.2 Pembahasan
Dari hasil uji disolusi tablet allopurinol 100 mg yang dilakukan diperoleh
kadar zat terlarut yaitu: 96,43 %, 96,73%, 96,83%, 98,92%, 99,00%, 98,97%.
Kadar tersebut sesuai dengan batas yang ditetapkan dalam Farmakope
Indonesia Edisi IV, dimana jumlah ke 6 tablet yang diuji pada tahap 1 (S1)
memenuhi kriteria penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang
diperoleh kurang dari (Q + 5%) yaitu (75% + 5% = 80%). Dari data di atas
dinyatakan bahwa tablet allopurinol 100 mg yang diproduksi oleh PT Mutiara
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil uji disolusi yang dilakukan, maka dapat disimpulkan bahwa
tablet allopurinol 100 mg yang diproduksi oleh PT Mutiara Mukti Farma
(MUTIFA) Medan telah memenuhi persyaratan uji disolusi sesuai dengan yang
ditetapkan dalam Farmakope Indonesia Edisi IV. Dimana persyaratan uji disolusi
tiap unit sediaan tidak satupun kadar kurang dari (Q+5%) yaitu (75%+5% = 80%).
Berarti hasil uji disolusi memenuhi persyaratan.
5.2 Saran
Diharapkan mutu tablet allopurinol yang diproduksi oleh PT Mutiara
Mukti Farma (MUTIFA) Medan tetap dipertahankan dan sesuai dengan
BAB II
TINJAUAN PUSTAKA 2.1 Tablet
2.1.1 Tablet secara umum
Tablet merupakan sediaan padat kompak yang dibuat dengan cara kempa
cetak, dalam bentuk umumnya tabung pipih, permukaannya rata atau cembung,
mengandung obat dengan atau tanpa zat pengisi (Admar, 2007).
Tablet dapat berbeda-beda ukuran, bentuk, berat, kekerasan, ketebalan,
daya hancur, dan aspek lainnya tergantung pada cara pemakaian tablet dan metode
pembuatannya. Umumnya tablet digunakan pada pemberian obat secara oral
(Ansel, 1989).
Untuk membuat tablet diperlukan bahan tambahan berupa:
a. Bahan pengisi (diluent)
Bahan ini dimaksudkan untuk memperbesar volume tablet. Zat-zat yang
digunakan seperti: saccharum lactis, amylum, calcii phosphas, calcii
carbonas.
b. Bahan pengikat (binder)
Bahan ini dimaksudkan agar tablet tidak pecah dan dapat merekat. Zat-zat
yang digunakan seperti: mucilago gummi arabici 10-20%, mucilago amyli
10%, larutan gelatin 10-20% (panas), larutan methylcellulose 5%.
c. Bahan penghancur (disintegrator)
Bahan ini dimaksudkan agar tablet dapat hancur dalam lambung. Zat-zat
d. Bahan pelicin (lubricant)
Bahan ini dimaksudkan agar tablet tidak lekat pada cetakan (matriks).
Zat-zat yang digunakan seperti: talcum, magnesii stearas, asam stearat.
Dalam pembuatan tablet, zat berkhasiat dan bahan tambahan, kecuali
bahan pelicin dibuat granul (butiran kasar), karena serbuk yang halus tidak
mengisi cetakan dengan baik. Dengan dibuat granul akan terjadi “free flowing”,
mengisi cetakan secara tetap dan dapat dihindari tablet menjadi “capping” (retak)
(Anief, 1987).
2.1.2 Pembagian Tablet
Menurut Ansel (1989), ada beberapa jenis tablet antara lain:
a. Tablet Kompresi
Tablet kompresi dibuat dengan sekali tekanan menjadi berbagai bentuk
tablet dan ukuran, biasanya ke dalam bahan obatnya, diberi tambahan
sejumlah bahan pembantu antara lain:
− Pengencer atau pengisi, yang ditambahkan jika perlu ke dalam
formulasi supaya membentuk ukuran tablet yang diinginkan.
− Pengikat atau perekat, yang membantu pelekatan partikel dalam
formulasi, memungkinkan granul dibuat dan dijaga keterpaduan
hasil akhir tabletnya.
− Penghancuratau bahan yang dapat membantu penghancuran, akan
membantu memecah atau menghancurkan tablet setelah pemberian
sampai menjadi partikel-partikel yang lebih kecil, sehingga lebih
− Zat pelincir, zat yang meningkatkan aliran bahan memasuki
cetakan tablet dan mencegah melekatnya bahan ini pada punch dan
die serta membuat tablet-tablet menjadi bagus dan berkilat.
− Bahan tambahan lain seperti zat warna dan zat pemberi rasa.
b. Tablet Kompresi Ganda
Tablet kompresi ganda atau tablet berlapis dibuat dengan cara
memasukkan satu campuran obat ke dalam cetakan dan ditekan, demikian
pula campuran obat sebagai lapisan berikutnya dimasukkan ke dalam
cetakan yang sama dan ditekan lagi, untuk membentuk dua atau tiga
lapisan tergantung pada jumlah obat yang ditambahkan secara terpisah
dalam satu tablet berlapis.
c. Tablet Salut Gula
Tablet ini diberi lapisan gula berwarna dan mungkin juga tidak, lapisan ini
larut dalam air dan cepat terurai begitu ditelan. Gunanya melindungi obat
dari udara dan kelembaban serta memberi rasa atau untuk menghindarkan
gangguan dalam pemakaiannya akibat rasa atau bau bahan obat.
d. Tablet Salut Selaput
Tablet ini disalut dengan selaput tipis dari polimer yang larut atau tidak
larut dalam air maupun membentuk lapisan yang meliputi tablet.
e. Tablet Salut Enterik
Tablet ini disalut dengan lapisan yang tidak melarut atau hancur di
f. Tablet Sublingual
Tablet yang disisipkan di pipi dan di bawah lidah biasanya berbentuk datar,
tablet oral yang direncanakan larut dalam kantung pipi atau di bawah lidah
untuk diabsorbsi melalui mukosa oral.
Contoh: tablet isosorbit dinitrat
g. Tablet Bukal
Disisipkan diantara gusi dan pipi.
Contoh: tablet progesteron.
h. Tablet Kunyah
Tablet kunyah lembut segera hancur ketika dikunyah atau dibiarkan
melarut dalam mulut.
Contoh: antasida.
i. Tablet Effervescent
Tablet berbuih dibuat dengan cara kompresi granul yang mengandung
garam effervescent atau bahan-bahan lain yang mampu melepaskan gas
ketika bercampur dengan air.
Contoh: tablet Ca Sandoz.
2.1.3 Persyaratan Tablet
Menurut Farmakope Indonesia Edisi IV, tablet harus memenuhi
persyaratan sebagai berikut:
a. Keseragaman Bobot
Tablet harus memenuhi uji keseragaman bobot untuk menjamin
diharapkan memiliki kandungan bahan obat yang sama, sehingga
mempunyai efek terapi yang sama.
b. Kekerasan
Tablet harus memiliki kekuatan atau kekerasan agar dapat bertahan
terhadap berbagai guncangan pada saat pengepakan dan pengangkutan. Uji
ini dilakukan dengan menggunakan alat yang disebut Hardness Tester.
Tablet diletakkan diantara alat penekan punch dan dijepit dengan memutar
sekrup pengatur sampai tanda lampu menyala, lalu ditekan tombol
sehingga tablet pecah. Tekanan dapat ditunjukkan melalui skala yang
tertera. Umumnya kekuatan tablet berkisar 4-8 kg.
c. Kerenyahan
Uji ini dilakukan untuk mengetahui kerenyahan tablet, karena tablet yang
rapuh dan rusak kandungan zat berkhasiatnya berkurang sehingga
mempengaruhi efek terapi. Kerenyahan ditandai dengan massa partikel
yang berjatuhan dari tablet. Uji ini menggunakan alat yang disebut Roche
Friabilator yang terdiri dari sebuah tabung yang berputar, ke arah radial
disambungkan sebuah bilah lengkung. Tablet dimasukkan ke dalam drum
tersebut, dihidupkan alat maka drum berputar dan tablet bergulir jatuh
sampai pada putaran berikutnya dipegang kembali oleh bilah. Pemutaran
dilakukan 100 kali dengan persyaratan tablet tidak boleh kehilangan berat
d. Waktu Hancur
Uji ini dimaksudkan untuk mengetahui kesesuaian batas waktu hancur
yang tertera dalam masing-masing monografi, kecuali pada etiket
dinyatakan bahwa tablet dirancang untuk pelepasan kandungan obat
secara bertahap dalam jangka waktu tertentu atau melepaskan obat dalam
dua periode berbeda atau lebih dengan jarak waktu yang jelas diantara
periode pelepasan tersebut. Uji waktu hancur tidak menyatakan bahwa
sediaan atau bahan aktifnya terlarut sempurna. Interval waktu hancur yaitu
tidak lebih dari 15 menit. Sediaan dinyatakan hancur sempurna bila tidak
ada sisa sediaan yang tidak larut tertinggal pada kasa.
e. Disolusi
Uji ini digunakan untuk mengetahui kesesuaian dengan persyaratan
disolusi yang tertera dalam monografi pada sediaan tablet kecuali pada
etiket dinyatakan bahwa tablet harus dikunyah atau tidak memerlukan uji
disolusi.
f. Penetapan Kadar Zat Berkhasiat
Penetapan kadar ini dilakukan untuk mengetahui apakah tablet tersebut
memenuhi syarat sesuai dengan etiket. Bila kadar obat tersebut tidak
memenuhi syarat, berarti obat tersebut tidak memiliki efek terapi yang
baik dan tidak layak dikonsumsi. Penetapan kadar dilakukan dengan
menggunakan cara-cara yang sesuai tertera pada monografi antara lain di
2.2 Obat Yang Digunakan Pada Pengobatan Penyakit Gout
Pirai (gout) adalah suatu penyakit metabolisme, yang ditandai oleh
peninggian kadar asam urat dalam darah (Hiperurisemia). Asam urat merupakan
produk akhir penguraian purin pada manusia. Peninggian kadar asam urat dalam
darah dapat disebabkan baik oleh peningkatan pembentukan asam urat, maupun
oleh pengurangan ekskresinya (Vieweg, 1983).
Hiperurisemia ini mengakibatkan deposisi kristal natrium urat dalam
jaringan, terutama pada ginjal dan sendi. Hiperurisemia tidak selalu menyebabkan
gout, tetapi gout selalu didahului oleh hiperurisemia. Kebanyakan strategi
pengobatan gout adalah menurunkan kadar asam urat sampai di bawah titik jenuh,
dengan demikian mencegah terjadinya pembentukan asam urat. Ini dapat
dilakukan dengan jalan (1) mempengaruhi sintetis asam urat dengan allopurinol,
(2) meningkatkan ekskresi asam urat dengan probenesid atau sulfinpirazon, (3)
menghambat masuknya leukosit ke dalam sendi yang terkena dengan kolkisin
(Mycek, 2001).
2.3 Uraian Umum Allopurinol 2.3.1 Tablet Allopurinol
Uraian umum allopurinol menurut Farmakope Indonesia Edisi IV (1995):
Nama Kimia : 1H-Pirazolol (3,4)dipirimidin -4-ol[315-30-0]
Rumus Molekul : C5H4N4O
Berat Molekul : 136,11g/mol
Pemerian : Serbuk halus putih hingga hampir putih, berbau lemah.
Susut Pengeringan : Suhu 105°C selama tidak kurang dari 0,5%, dilakukan
pengeringan pada suhu 105°C selama 5 jam.
Persyaratan : Allopurinol mengandung tidak kurang dari 93,0% dan
tidak lebih dari 107,0% C5H4N4O, dari jumlah yang
tertera pada etiket.
Kelarutan : Sangat sukar larut dalam air dan etanol, larut dalam
larutan kalium dan natrium hidroksida, praktis tidak larut
dalam kloroform dan eter.
Penyimpanan : Dalam wadah tertutup baik, terlindung dari cahaya. Pada
suhu tidak lebih dari suhu ruang 30oC.
Penandaan : Pada etiket harus juga tertera kadaluarsa.
Allopurinol adalah obat penyakit pirai (gout) yang dapat menurunkan
kadar asam urat dalam darah. Obat ini mengurangi produksi asam urat dengan
jalan menghambat secara kompetitif dua langkah terakhir biosintesis asam urat,
Pengobatan jangka panjang mengurangi frekuensi serangan, menghambat
pembentukan tofi, memobilisasi asam urat dan mengurangi besarnya tofi
(Setiabudy, 2007).
2.3.2 Farmakokinetik
Allopurinol kira-kira 80% diserap setelah pemakaian oral. Seperti uric
acid, allopurinol sendiri dimetabolisme oleh xanthine oxidase. Persenyawaan
hasilnya, alloxanthine, mempertahankan kemampuannya untuk menghambat
xanthine oxidase dan mempunyai durasi kerja yang cukup panjang sehingga
allopurinol cukup diberikan satu kali sehari (Katzung, 2002).
2.3.3 Farmakodinamika
Obat ini bekerja dengan menghambat xantin oksidase, enzim yang
mengubah hipoxantin menjadi xantin dan selanjutnya menjadi asam urat. Melalui
mekanisme umpan balik allopurinol menghambat sintetis purin yang merupakan
prekursor xantin (Setiabudy, 2007).
2.3.4 Efek Farmakologi
Pemberian allopurinol menimbulkan aktivitas gabungan dari dua senyawa
ini. Waktu paruh allopurinol dalam plasma pendek (2 jam), sedangkan waktu
paruh oksipurinol panjang (15 jam). Jadi, hambatan efektif xantin oksidase dapat
dipelihara dengan dosis sekali sehari. Obat dan metabolitnya diekskresikan ke
dalam tinja dan urin (Mycek, 2001).
2.3.5 Efek samping
Terjadi reaksi kulit. Bila kemerahan kulit timbul, obat harus dihentikan
seperti demam, kelainan darah, juga gangguan lambung usus, nyeri kepala, pusing
dan rambut rontok (Tjay dan Rahardja, 2007).
2.3.6 Indikasi
Profilaksis gout dan batu asam urat serta kalsium oksalat di ginjal.
2.3.7 Kontra indikasi
Bukan pengobatan untuk gout akut, terapi diteruskan jika terjadi serangan
ketika sudah memakai allopurinol, dan diatasi serangan secara khusus (Sukandar,
2009).
2.3.8 Dosis
Pada hiperurisemia dengan dosis per hari 100 mg sesudah makan, bila
perlu dinaikkan setiap minggu dengan 100 mg sampai maksimum 10 mg/kg/hari.
Profilaksis dengan sitostatika: 600 mg sehari dimulai 3 hari sebelum terapi
(Tjay,2007).
Dosis awal allopurinol adalah 100 mg sehari, allopurinol dapat dikonsumsi
sampai 300 mg/hari tergantung pada respon uric acid serum (Katzung, 2002).
2.4 Disolusi
Disolusi didefinisikan sebagai proses suatu zat padat masuk ke dalam
pelarut menghasilkan suatu larutan (proses zat padat melarut).Kecepatan disolusi
adalah kecepatan obat mulai melarut dari permukaan padat menjadi bentuk larutan
pada saat tablet atau bentuk sediaan padat lainnya dimasukkan ke dalam gelas
Kecepatan disolusi obat juga merupakan tahap sebelum obat berada dalam
darah. Apabila suatu sediaan padat berada dalam saluran cerna, bahan berkhasiat
harus terlarut, sesudah itu barulah obat tersebut dapat melewati membran saluran
cerna. Obat yang larut baik dalam air akan melarut cepat dan berdifusi secara
pasif. Sebaliknya, obat yang kelarutannya kecil, kecepatan melarutnya sediaan
tersebut berlangsung lama (Syukri, 2002).
2.4.1 Alat Uji Disolusi
Dari jenis alat, ada dua tipe alat uji disolusi sesuai dengan yang tertera
dalam masing-masing monografi:
a. Alat 1 (Metode Basket)
Alat terdiri atas wadah tertutup yang terbuat dari kaca atau bahan
transparan lain yang inert, dilengkapi dengan suatu motor atau alat
penggerak. Wadah tercelup sebagian dalam penangas sehingga dapat
mempertahankan suhu tablet atau kapsul granul atau agregat partikel halus
obat dalam larutan obat dalam darah, cairan, dan dalam jaringan lain
dalam wadah 37° ± 0,5°C selama pengujian berlangsung. Bagian dari alat
termasuk lingkungan tempat alat diletakkan tidak dapat memberikan
gerakan, goncangan, atau getaran signifikan yang melebihi gerakan akibat
perputaran alat pengaduk. Wadah disolusi dianjurkan berbentuk silinder
dengan dasar setengah bola, tinggi 160-175 mm, diameter dalam 98-106
mm, dengan volume sampai 1000 ml. Batang logam berada pada posisi
dan tanpa goyangan yang berarti. Suatu alat pengatur mempertahankan
kecepatan alat.
b. Alat 2 (Metode Dayung)
Sama seperti alat 1, tetapi pada alat ini digunakan dayung yang terdiri atas
daun dan batang sebagai pengaduk. Batang dari dayung tersebut sumbunya
tidak lebih dari 2 mm dan berputar dengan halus tanpa goyangan yang
berarti. Jarak antara daun dan bagian dalam dasar wadah dipertahankan
selama pengujian berlangsung. Daun dan batang logam yang merupakan
satu kesatuan dapat disalut dengan suatu penyalut inert yang sesuai.
Sediaan dibiarkan tenggelam ke dasar wadah sebelum dayung mulai
berputar (Ditjen POM, 1995).
2.4.2 Prosedur Pengujian Disolusi
Pada tiap pengujian, dimasukkan sejumlah volume media disolusi (seperti
yang tertera dalam masing-masing monografi) ke dalam wadah, pasang alat dan di
biarkan media disolusi mencapai temperatur 37°C. Satu tablet dicelupkan dalam
keranjang atau dibiarkan tenggelam ke bagian dasar wadah, kemudian pengaduk
diputar dengan kecepatan seperti yang ditetapkan dari media diambil cuplikan
pada daerah pertengahan antara permukaan media disolusi dan bagian atas dari
keranjang berputar atau dari alat dayung tidak kurang 1 cm dari dinding wadah
untuk dianalisis penetapan kadar dari bagian obat yang terlarut. Tablet harus
memenuhi syarat seperti yang terdapat pada monografi untuk kecepatan disolusi
2.4.3 Kriteria Penerimaan Hasil Uji Disolusi
Persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang
diuji sesuai dengan tabel penerimaan. Pengujian dilakukan sampai tiga tahap.
Pada tahap 1 (S1), 6 tablet diuji. Bila pada tahap ini tidak memenuhi syarat, maka
akan dilanjutkan ke tahap berikutnya yaitu tahap 2 (S2). Pada tahap ini 6 tablet
tambahan diuji lagi. Bila tetap tidak memenuhi syarat, maka pengujian dilanjutkan
lagi ke tahap 3 (S3). Pada tahap ini 12 tablet tambahan diuji lagi. Kriteria
penerimaan hasil uji disolusi dapat dilihat sesuai dengan tabel di bawah ini.
Tabel. 2.1. Penerimaan Hasil Uji Disolusi
Keterangan:
S1 : Tahap pertama S2 : Tahap kedua S3 : Tahap ketiga
Q : Jumlah zat aktif yang terlarut yang tertera dalam masing-masing monografi. Tahap
Tiap unit sediaan tidak kurang dari Q + 5%
S2 6
Rata – rata dari 12 unit (S1+ S2) adalah sama dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q – 15%
S3 12
Harga Q adalah jumlah zat aktif yang terlarut dalam persen dari jumlah
yang tertera pada etiket. Angka 5% dan 15% dalam tabel adalah persentase kadar
pada etiket, dengan demikian mempunyai arti yang sama dengan Q. Kecuali
dinyatakan lain dalam masing-masing monografi, persyaratan umum untuk
penetapan satu titik tunggal ialah terdisolusi 75% dalam waktu 45 menit dengan
menggunakan alat 1 pada 100 rpm atau alat 2 pada 50 rpm (Lachman, 1994).
2.4.4 Faktor yang Mempengaruhi Disolusi Zat Aktif
Menurut Syukri (2002), faktor yang mempengaruhi laju disolusi dari
bentuk sediaan, antara lain:
a. Faktor yang berkaitan dengan sifat fisikokimia obat
Sifat-sifat fisikokimia obat yang mempengaruhi laju disolusi meliputi:
kelarutan zat aktif, bentuk kristal, kompleksasi serta ukuran partikel. Sifat
fisikokimia lain seperti kekentalan dapat menimbulkan masalah disolusi.
b. Faktor yang berkaitan dengan formulasi sediaan
Formulasi sediaan berkaitan dengan bentuk sediaan, bahan tambahan dan
cara pengolahan. Pengaruh bentuk sediaan terhadap laju disolusi
tergantung kecepatan pelepasan bahan aktif yang terkandung didalamnya.
Penggunaan bahan tambahan sebagai bahan pengisi, pengikat, penghancur
dan pelicin dalam proses formulasi dapat menghambat atau mempercepat
laju disolusi tergantung bahan tambahan yang digunakan. Cara pengolahan
bahan baku, bahan tambahan dan prosedur yang dilakukan dalam
formulasi sediaan padat peroral juga berpengaruh terhadap laju disolusi.
granul-granul besar, keras dan padat sehingga pada proses pencetakan dihasilkan
tablet dengan waktu hancur dan disolusi yang lama. Faktor formulasi yang
mempengaruhi laju disolusi diantaranya: kecepatan disintegrasi, interaksi
obat dengan eksipien (bahan tambahan) dan kekerasan.
c. Faktor yang berkaitan dengan alat uji disolusi dan parameter uji
Faktor ini dipengaruhi oleh lingkungan selama percobaan meliputi:
kecepatan pengadukan, suhu medium, pH medium dan metode uji yang
digunakan. Pengadukan mempengaruhi penyebaran partikel-partikel dan
tebal lapisan difusi sehingga memperluas permukaan partikel yang kontak
dengan pelarut. Suhu medium berpengaruh terhadap kelarutan zat aktif.
Zat yang kelarutannya tidak tergantung pH, perubahan pH medium
disolusi tidak akan mempengaruhi laju disolusi. Pemilihan kondisi pH
pada percobaan in vitro penting karena kondisi pH akan berbeda pada
lokasi obat di saluran cerna. Metode penentuan laju disolusi yang berbeda
dapat menghasilkan laju disolusi sama atau berbeda, tergantung pada
metode uji yang digunakan.
2.5 Penetapan Kadar
Penetapan kadar dipilih berdasarkan sifat senyawa. Untuk penetapan kadar
dapat dilakukan dengan metode fisikokimia yaitu spektrofotometri UV-Visibel,
fluorometri dan konduktometri (Devissaquest, 1993).
Metode yang dipilih dalam penetapan kadar uji disolusi tablet allopurinol
yaitu spektrofotometri ultraviolet. Spektrofotometri ultraviolet adalah pengukuran
untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum
ultraviolet mempunyai bentuk yang lebar dan hanya sedikit informasi tentang
struktur yang didapatkan, tetapi spektrum ini sangat berguna untuk pengukuran
secara kuantitatif (Dachriyanus, 2004).
Analisis spektrofotometri cukup teliti, cepat dan sangat cocok untuk
digunakan pada kadar yang kecil. Senyawa yang dianalisis harus mempunyai
gugus kromofor. Pengamatan spektrum bermanfaat, karena dapat membandingkan
spektrum sebelum dan sesudah partisi (Sardjoko, 1993).
Umumnya pelarut yang sering dipakai untuk analisis spektrofotometri
adalah air, etanol, sikloheksana dan isopropanol. Dalam pemilihan pelarut, yang
perlu diperhatikan yaitu polaritas pelarut yang dipakai karena sangat berpengaruh
terhadap pergeseran spektrum molekul yang dianalisis (Mulja dan Suharman
BAB I PENDAHULUAN
1.1 Latar Belakang
Obat merupakan zat aktif yang berasal dari nabati, hewani, kimiawi alam
maupun sintesis dalam dosis atau kadar tertentu dapat digunakan untuk preventif,
rehabilitasi, terapi, diagnosa terhadap suatu keadaan penyakit pada manusia
ataupun hewan. Namun zat aktif tersebut tidak dapat dipergunakan begitu saja
sebagai obat, terlebih dahulu harus dibuat dalam bentuk sediaan. Oleh karena itu
muncul sediaan pil, kapsul, tablet, sirup, supositoria, suspensi, salep, dan lain-lain
(Admar, 2007).
Beberapa bahan obat dapat dipakai untuk mengurangi sakit kepala, nyeri,
demam, aktivitas kelenjar tiroid, bersin, rinitis, insomnia, keasaman lambung,
mabuk perjalanan, dan depresi mental. Sedangkan beberapa obat lain dapat
meningkatkan semangat, tekanan darah atau aktivitas kelenjar endokrin.
Obat-obatan tertentu dapat melawan infeksi, membasmi cacing di usus atau bertindak
sebagai bahan penawar (antidot) dari obat lain (Ansel, 1989).
Obat yang telah memenuhi persyaratan keseragaman bobot, kekerasan,
kerenyahan, waktu hancur dan penetapan kadar zat berkhasiat belum dapat
menjamin bahwa suatu obat memenuhi efek terapi, karena itu uji disolusi harus
Sebelum melakukan uji disolusi, metode analisis yang digunakan harus
ditetapkan terlebih dahulu dan dikaji dengan seksama antara lain: komposisi
media disolusi, jumlah media dalam ml, waktu dalam menit, kecepatan
pengadukan (dalam rotasi per menit = rpm), prosedur penetapan konsentrasi dan
toleransi. Setelah pengambilan sampel uji disolusi, dilanjutkan dengan proses
analisis penetapan kadar zat aktif dalam sampel (Siregar, 2008).
Faktor yang harus diperhatikan dalam uji disolusi yaitu: ukuran dan bentuk
yang akan mempengaruhi laju dan tingkat kelarutan, selain itu sifat media
pelarutan juga akan mempengaruhi uji kelarutan. Beberapa kegunaan uji disolusi
antara lain: menjamin keseragaman suatu batch, menjamin bahwa obat akan
memberikan efek terapi yang diinginkan, dan diperlukan dalam rangka
pengembangan suatu obat baru (Ditjen POM, 1995).
Berdasarkan hal tersebut, penulis tertarik untuk memilih judul tentang “Uji
Disolusi Tablet Allopurinol Yang Diproduksi Oleh PT Mutiara Mukti Farma
(MUTIFA) Medan” dengan menggunakan metode spektrofotometri ultraviolet
karena analisis dengan metode ini cepat dan teliti.
1.2 Tujuan Dan Manfaat
1.2.1 Tujuan
Uji disolusi bertujuan untuk mengetahui apakah tablet allopurinol 100 mg
yang diproduksi oleh PT Mutiara Mukti Farma (MUTIFA) Medan memenuhi
1.2.2 Manfaat
Uji disolusi bermanfaat untuk menambah wawasan dari penulis agar dapat
mengetahui cara penetapan kadar tablet allopurinol 100 mg dan agar pembaca
dapat mengetahui apakah sediaan tersebut layak untuk didistribusikan dan
Allopurinol Tablet Dissolution Test Produced By PT Mutiara Mukti Farma (MUTIFA) Medan
ABSTRACT
Allopurinol is a medicine for gout (gout) which can lower uric acid levels in the blood. This drug reduces the production of uric acid by inhibiting competitively the last two steps of uric acid biosynthesis, which dikatalisir by xanthine oxidase. Purpose of this test is to determine whether allopurinol tablets produced Farma PT MutiaraMukti (MUTIFA) Medan dissolution in accordance with the requirements set by the Indonesian Pharmacopoeia Edition IV.
Dissolution test of the 6 pieces of allopurinol 100 mg tablet was conducted using a paddle on medium 900 ml of HCl 0.01 N, a temperature of 37 ± 0.5 º C at a rate of speed of 75 rpm and a time for 45 minutes. Soluble substances specified levels by ultraviolet spectrophotometric method.
The test results showed that allopurinol tablets are tested to meet the requirements of Indonesian Pharmacopoeia dissolution Edition IV, the solute concentration is obtained 96.43%, 96.73%, 96.83%, 98.92%, 99.00%, 98.97% . These results meet the acceptance criteria for dissolution test results according to the Indonesian Pharmacopoeia Edition IV, ie none of the levels that are less than the provisions of the (Q +5%), ie (75% +5% = 80%).
Uji Disolusi Tablet Allopurinol Yang Diproduksi Oleh PT Mutiara Mukti Farma (MUTIFA) Medan
ABSTRAK
Allopurinol adalah obat penyakit pirai (gout) yang dapat menurunkan kadar asam urat dalam darah. Obat ini mengurangi produksi asam urat dengan jalan menghambat secara kompetitif dua langkah terakhir biosintesis asam urat, yang dikatalisir oleh xantin oksidase. Tujuan pengujian ini adalah untuk mengetahui apakah tablet allopurinol yang diproduksi PT Mutiara Mukti Farma (MUTIFA) Medan memenuhi persyaratan disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV.
Uji disolusi terhadap 6 buah tablet allopurinol 100 mg dilakukan dengan metode dayung pada media 900 ml HCl 0,01 N, suhu 37 ± 0,5ºC dengan laju kecepatan 75 rpm dan waktu selama 45 menit. Zat yang larut ditetapkan kadarnya dengan metode spektrofotometri ultraviolet.
Hasil pengujian menunjukkan bahwa tablet allopurinol yang diuji disolusinya memenuhi persyaratan Farmakope Indonesia Edisi IV, diperoleh kadar zat terlarut yaitu 96,43 %, 96,73%, 96,83%, 98,92%, 99,00%, 98,97%. Hasil ini memenuhi kriteria penerimaan hasil uji disolusi menurut Farmakope Indonesia Edisi IV, yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan yakni (Q+5%) yaitu (75%+5% =80%).
UJI DISOLUSI TABLET ALLOPURINOL
YANG DIPRODUKSI OLEH PT MUTIARA MUKTI FARMA
(MUTIFA) MEDAN
TUGAS AKHIR
OLEH:
HARDINITA HASUGIAN NIM 102410005
PROGRAM STUDI DIPLOMA III
ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
UJI DISOLUSI TABLET ALLOPURINOL
YANG DIPRODUKSI OLEH PT MUTIARA MUKTI FARMA
(MUTIFA) MEDAN
TUGAS AKHIR
Diajukan Untuk Memenuhi Salah Satu Syarat Untuk Memperoleh Gelar Ahli Madya Pada Program Studi Diploma III Analis Farmasi dan Makanan
Fakultas Farmasi Universitas Sumatera Utara
Oleh:
HARDINITA HASUGIAN NIM 102410005
Medan, Mei 2013 Disetujui Oleh: Dosen Pembimbing,
Drs. Suryanto, M.Si., Apt. NIP 196106191991031001
KATA PENGANTAR
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT yang telah
memberikan rahmat dan karunia-Nya, sehingga penulis dapat menyusun dan
menyelesaikan tugas akhir berjudul “UJI DISOLUSI TABLET
ALLOPURINOL YANG DIPRODUKSI OLEH PT MUTIARA MUKTI FARMA (MUTIFA) MEDAN”. Tugas akhir ini disusun sebagai salah satu syarat untuk dapat menyelesaikan pendidikan pada Program Diploma III Analis
Farmasi dan Makanan di Fakultas Farmasi Universitas Sumatera Utara, Medan.
Selama penulisan tugas akhir penulis banyak menerima bimbingan dan
dukungan dari berbagai pihak, teristimewa kepada kedua Orangtuaku tercinta,
Ayahanda Junjungan Hasugian dan Ibunda Nurmainah Simanjuntak yang telah
membesarkan dan mendidik penulis dengan penuh kasih sayang dan cinta dari
kecil hingga saat ini, memberikan motivasi dan restu.
Penulis menyadari sepenuhnya bahwa tanpa bantuan dari berbagai pihak,
penulis tidak akan dapat menyelesaikan tugas akhir ini sebagaimana mestinya.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada berbagai pihak
antara lain:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., sebagai Dekan Fakultas
2. Bapak Drs. Suryanto, M.Si., Apt., sebagai Dosen Pembimbing yang telah
memberikan bimbingan dan pengarahan kepada penulis dalam penyusunan
laporan tugas akhir ini.
3. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., sebagai Ketua Program
Studi Diploma-III Analis Farmasi dan Makanan di Fakultas Farmasi
Universitas Sumatera Utara.
4. Bapak Donald Situmeang, S.Si., Apt., sebagai Pembimbing Lapangan
yang telah membimbing dan memberikan sarana serta petunjuk selama
pelaksanaan Praktik Kerja Lapangan di PT Mutiara Mukti Farma
(MUTIFA) Medan.
5. Bapak Amiruddin Pinem, SH., selaku personalia, Bapak Drs. Budiono,
Apt., selaku manager produksi, Ibu Octarina, S.Farm., Apt., selaku
manager R&D, dan Ibu Sumantri, S.Farm., Apt., selaku manager QC di
PT Mutiara Mukti Farma (MUTIFA) Medan yang telah memberikan
tempat serta bimbingan untuk melaksanakan Praktik Kerja Lapangan ini.
6. Staf dan pegawai PT Mutiara Mukti Farma (MUTIFA) yang telah banyak
membantu selama pelaksanaan Praktik Kerja Lapangan di PT Mutiara
Mukti Farma (MUTIFA) Medan.
7. Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara
atas semua ilmu, didikan dan bimbingan kepada penulis selama di
perguruan tinggi ini.
8. Staf administrasi di Fakultas Farmasi yang telah membantu kami dalam
9. Untuk saudara-saudaraku (bang Sardo, kak Susi, kak Sry) yang telah
memberikan semangat dan doa.
10.Untuk sahabat-sahabatku (Yuli, Mia, Nita, Salimah, Rizky, Vera, Jhoey,
Mely, dan Linda ) yang telah memberikan semangat dan dukungan.
11.Teman-teman Analis Farmasi dan Makanan stambuk 2010 semuanya
tanpa terkecuali, adik-adik stambuk 2011 dan 2012 yang tidak dapat
disebutkan namanya satu per satu, terima kasih buat kebersamaan dan
semangatnya selama ini, serta masukan dalam penyusunan tugas akhir ini.
12.Serta pihak-pihak yang telah ikut membantu penulis namun tidak
tercantum namanya.
Penulis menyadari bahwa sepenuhnya isi dari tugas akhir ini masih
terdapat kekurangan dan kelemahan serta masih jauh dari kesempurnaan,
untuk itu dengan segala kerendahan hati, penulis mengharapkan saran dan
kritik yang sifatnya membangun demi kesempurnaan tugas akhir ini.
Akhir kata, penulis sangat berharap semoga tugas akhir ini dapat
memberikan manfaat kepada semua pihak yang memerlukan. Amin.
Medan, Mei 2013
Penulis,
Hardinita Hasugian
Allopurinol Tablet Dissolution Test Produced By PT Mutiara Mukti Farma (MUTIFA) Medan
ABSTRACT
Allopurinol is a medicine for gout (gout) which can lower uric acid levels in the blood. This drug reduces the production of uric acid by inhibiting competitively the last two steps of uric acid biosynthesis, which dikatalisir by xanthine oxidase. Purpose of this test is to determine whether allopurinol tablets produced Farma PT MutiaraMukti (MUTIFA) Medan dissolution in accordance with the requirements set by the Indonesian Pharmacopoeia Edition IV.
Dissolution test of the 6 pieces of allopurinol 100 mg tablet was conducted using a paddle on medium 900 ml of HCl 0.01 N, a temperature of 37 ± 0.5 º C at a rate of speed of 75 rpm and a time for 45 minutes. Soluble substances specified levels by ultraviolet spectrophotometric method.
The test results showed that allopurinol tablets are tested to meet the requirements of Indonesian Pharmacopoeia dissolution Edition IV, the solute concentration is obtained 96.43%, 96.73%, 96.83%, 98.92%, 99.00%, 98.97% . These results meet the acceptance criteria for dissolution test results according to the Indonesian Pharmacopoeia Edition IV, ie none of the levels that are less than the provisions of the (Q +5%), ie (75% +5% = 80%).
Uji Disolusi Tablet Allopurinol Yang Diproduksi Oleh PT Mutiara Mukti Farma (MUTIFA) Medan
ABSTRAK
Allopurinol adalah obat penyakit pirai (gout) yang dapat menurunkan kadar asam urat dalam darah. Obat ini mengurangi produksi asam urat dengan jalan menghambat secara kompetitif dua langkah terakhir biosintesis asam urat, yang dikatalisir oleh xantin oksidase. Tujuan pengujian ini adalah untuk mengetahui apakah tablet allopurinol yang diproduksi PT Mutiara Mukti Farma (MUTIFA) Medan memenuhi persyaratan disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV.
Uji disolusi terhadap 6 buah tablet allopurinol 100 mg dilakukan dengan metode dayung pada media 900 ml HCl 0,01 N, suhu 37 ± 0,5ºC dengan laju kecepatan 75 rpm dan waktu selama 45 menit. Zat yang larut ditetapkan kadarnya dengan metode spektrofotometri ultraviolet.
Hasil pengujian menunjukkan bahwa tablet allopurinol yang diuji disolusinya memenuhi persyaratan Farmakope Indonesia Edisi IV, diperoleh kadar zat terlarut yaitu 96,43 %, 96,73%, 96,83%, 98,92%, 99,00%, 98,97%. Hasil ini memenuhi kriteria penerimaan hasil uji disolusi menurut Farmakope Indonesia Edisi IV, yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan yakni (Q+5%) yaitu (75%+5% =80%).
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... vii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan dan Manfaat ... 2
1.2.1. Tujuan ... 2
1.2.2. Manfaat ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1. Tablet ... 4
2.1.1. Tablet secara Umum ... 3
2.1.2. Pembagian Tablet ... 5
2.1.3. Persyaratan Tablet ... 7
2.2. Obat Yang Digunakan Pada Pengobatan Penyakit Gout ... 10
2.3. Uraian Umum Allopurinol ... 10
2.3.1. Tablet Allopurinol ... 10
2.3.3. Farmakodinamika ... 12
2.3.4. Efek Farmakologi ... 12
2.3.5. Efek Samping ... 12
2.3.6. Indikasi ... 13
2.3.7. Kontra Indikasi ... 13
2.3.8. Dosis ... 13
2.4. Disolusi ... 13
2.4.1. Alat Uji Disolusi ... 14
2.4.2. Prosedur Pengujian Disolusi ... 15
2.4.3. Kriteria Penerimaan Hasil Uji Disolusi ... 16
2.4.4. Faktor Yang Mempengaruhi Disolusi Zat Aktif .... 17
2.5. Penetapan Kadar ... 18
BAB III METODOLOGI ... 20
3.1. Tempat ... 20
3.2. Alat-alat ... 20
3.3. Bahan-bahan ... 20
3.4. Prosedur ... 20
3.4.1. Media Disolusi ... 20
3.4.2. Larutan Baku ... 21
3.4.3. Larutan Uji ... 21
3.4.4. Penetapan Kadar Secara Spektrofotometri UV ... 22
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1. Hasil ... 24
4.2. Pembahasan ... 24
BAB V KESIMPULAN DAN SARAN ... 25
5.1. Kesimpulan ... 25
5.2. Saran ... 25
DAFTAR PUSTAKA ... 26
Lampiran 1. Perhitungan Penetapan Kadar Allopurinol ... 28
DAFTAR TABEL
Halaman Tabel 2.1. Penerimaan Hasil Uji Disolusi ... 16
DAFTAR GAMBAR
Halaman Gambar 1. Pengaduk Tipe 1 (Metode Keranjang) ... 31