PENGARUH PREBIOTIK PADA POPULASI MIKROFLORA
SALURAN PENCERNAAN IKAN MAS (
Cyprinus carpio
)
SERTA KONTRIBUSINYA TERHADAP EFISIENSI
RETENSI PROTEIN DAN PERTUMBUHAN
DYAHRURI SANJAYASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengaruh Prebiotik pada Populasi Mikroflora Saluran Pencernaan Ikan Mas (Cyprinus carpio) serta Kontribusinya Terhadap Efisiensi Retensi Protein dan Pertumbuhan, adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2010
ABSTRACT
DYAHRURI SANJAYASARI. The Effect of Prebiotics to Intestinal Microflora Population of Common Carp (Cyprinus carpio) and Its Contribution in Protein Retention Efficiency and Growth. Under suprvised by DEWI APRI ASTUTI and RIDWAN AFFANDI.
The intensification of fish production in Indonesia has made it essential to develop complete and supplemental diets for use in aquaculture. Dietary supplements such as immunostimulants and prebiotics hold promise as a potential replacement of antibiotics in maintaining fish health and as growth promoter. The research objectives were to determind the effect of antibiotics to microflora population and evaluation of intestinal microflora contribution of common carp to protein retention efficiency and growth performance. The effect of antibiotics to microflora population was used factorial completely randomized design 3x3. The first factor was antibiotic type (streptomycine, tetracycline and amphicyline), and the second factor was dose of antibiotics; 100, 150, and 200 ppm. Microflora population and death presentation of microflora were counted using MRSA (DeMan Rogosa Sharp Agar) with pour plate method. Each treatment had 3 replications. The most effective combination of antibiotic and dose which decreased intestinal microflora population was used as negative control in the next research. Furthermore, the evaluation of common carp intestinal microflora contributions to protein efficiency ratio and growth performance consists of four pellet treatments, antibiotic feed (negative control), control feed (basal diet), basal diet supplement with 2% Fermacto® and 2% Mannanoligosacharide (MOS). It was used completely randomized design with five replications. The measured variables were; Feed Intake (FI), Protein Efficiency Ratio (PER), protein retention efficiency (PRE), Spesific Growth Rate (SGR), Survival Rate (SR), microflora population [Log(cfu/ml)] and contribution of intestinal microflora to protein efficiency. While, growth rate model of each treatment analzed with regression.The result showed that, tetacycline 200 ppm significantly (P<0.05) decreased intestinal microflora population up to 87.82% and used as negative control. In the other hand, there were no significant differences in FI, PER and SGR for all treatments. Meanwhile, 2% MOS in the basal diet gave the best microflora population 8.35 Log (cfu/ml), growth performance in PRE 9.08% (P<0.05) and highest contribution of intestinal microflora to protein retention efficiency 5.45%.
RINGKASAN
DYAHRURI SANJAYASARI. Pengaruh Prebiotik pada Populasi Mikroflora Saluran Pencernaan Ikan Mas (Cyprinus carpio) serta Kontribusinya Terhadap Efisiensi Retensi Protein dan Pertumbuhan. Dibimbing oleh DEWI APRI ASTUTI dan RIDWAN AFFANDI.
Intensifikasi budidaya perairan di Indonesia membutuhkan pengembangan pakan komplit dan pakan suplemen yang murah sehingga dapat menekan biaya pakan dalam proses produksi budidaya perairan. Suplemen pakan seperti imunostimulan dan prebiotik memegang peranan penting dan potensial sebagai pengganti antibiotik dalam menjaga kesehatan dan memacu pertumbuhan. Tujuan dari penelitian ini adalah; (1) untuk menganalisis efektivitas antibiotik terhadap penurunan populasi total mikroflora saluran pencernaan ikan mas yang selanjutnya digunakan sebagai kontrol negatif, (2) mengevaluasi kontribusi mikroflora saluran pencernaan ikan mas pada pakan yang diberi prebiotik komersial dan alami terhadap efisiensi retensi protein dan pertumbuhan.
Penelitian ini terdiri dari dua tahap percobaan. Percobaan pertama adalah efektivitas antibiotik terhadap penurunan populasi total mikroflora menggunakan Rancangan Acak Lengkap (RAL) faktorial 3x3. Faktor pertama merupakan jenis antibiotik (A) yang terdiri dari; A1 = streptomisin, A2 = tetrasiklin dan A3 = amphisilin dan faktor kedua merupakan dosis antibiotik (B) yang digunakan; B1 = 100 ppm, B2 = 150 ppm dan B3 = 200 ppm. Masing-masing perlakuan diulang sebanyak 3 kali. Pengamatan parameter total populasi mikroflora dan persen kematian mikroflora dilakukan dengan media MRSA (DeMan Rogosa Sharp Agar) menggunakan metode agar tuang. Kombinasi perlakuan yang paling efektif menurunkan populasi total mikroflora saluran pencernaan ikan mas dan memiliki persen kematian mikroflora tertinggi, ditetapkan sebagai kontrol negatif untuk penelitian selanjutnya. Percobaan kedua adalah evaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisiensi retensi protein dan pertumbuhan, terdiri dari empat perlakuan pakan. Perlakuan pakan yang diberikan adalah; P1 = pakan kontrol negatif (dengan antibiotik), P2 = pakan kontrol positif (pakan basal), P3 = pakan dengan 2% Fermacto® (prebiotik komersial) dan P4 = pakan dengan 2% Mananoligosakarida (MOS). Desain percobaan yang digunakan adalah RAL dengan 5 ulangan. Parameter yang diamati meliputi; konsumsi pakan (FI), rasio efisiensi protein (PER), laju pertumbuhan spesifik (SGR), laju kelangsungan hidup (SR), total populasi mikroflora [Log (cfu/ml)], efisiensi retensi protein (ERP), dan kontribusi mikroflora saluran pencernaan terhadap pertambahan efisiensi retensi protein.
menurunkan populasi total mikroflora saluran pencernaan hingga 5 log (cfu/ml) dengan persen kematian mikroflora mencapai 87,82%. Hal tersebut menjelaskan bahwa antibiotik tetrasiklin memiliki sifat bakterisidal lebih besar dibandingkan dengan jenis antibiotik yang lain. Oleh karena itu, jenis antibiotik tetrasiklin dengan dosis 200 ppm ditetapkan sebagai kontrol negatif untuk percobaan kedua. Parameter konsumsi pakan (P), protein efisiensi rasio (PER) dan laju pertumbuhan spesifik (SGR) untuk semua perlakuan pada percobaan kedua tidak menunjukkan perbedaan nyata (P>0,05). Perlakuan dengan penambahan 2% MOS memberikan hasil terbaik (P<0,05) untuk total populasi mikroflora sebesar 8,35 log (cfu/ml), nilai ERP tertinggi 9,08% dan memberikan kontribusi mikroflora saluran pencernaan terhadap penambahan ERP sebesar 5,45%. Hasil penelitian menjelaskan, prebiotik merupakan substrat yang tidak dapat di cerna yang sangat bermanfaat untuk mikroflora saluran cerna dan secara selektif memacu pertumbuhan, mengaktifkan metabolisme serat, meningkatkan kesehatan tubuh inang maupun mikroflora dan menjaga keseimbangan mikroflora.
© Hak cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENGARUH PREBIOTIK PADA POPULASI MIKROFLORA
SALURAN PENCERNAAN IKAN MAS (
Cyprinus carpio
)
SERTA KONTRIBUSINYA TERHADAP EFISIENSI
RETENSI PROTEIN DAN PERTUMBUHAN
DYAHRURI SANJAYASARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Ilmu Nutrisi dan Pakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul Tesis : Pengaruh Prebiotik pada Populasi Mikroflora Saluran Pencernaan Ikan Mas (Cyprinus carpio) serta Kontribusinya Terhadap Efisiensi Retensi Protein dan Pertumbuhan
Nama : Dyahruri Sanjayasari NRP : D152080031
Program Studi : Ilmu Nutrisi dan Pakan
Disetujui
Komisi Pembimbing
Ketua
Dr. Ir. Dewi Apri Astuti, MS
Anggota
Dr. Ir. Ridwan Affandi, DEA
Diketahui
Ketua Mayor Ilmu Nutrisi dan Pakan Dekan Sekolah Pasca Sarjana IPB
Dr. Ir. Dwierra Evvyernie A. MS., MSc Prof. Dr. Ir. Khairil A. Notodiprutro MS
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala limpahan rizky dan karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dilaksanakan sejak bulan Desember 2009 sampai Mei 2010 dengan judul Peran Prebiotik Terhadap Kontribusi Mikroflora Saluran Pencernaan Untuk Efisiensi Retensi Protein Dan Pertumbuhan Ikan Mas (Cyprinus Carpio)..
Karya ilmiah ini tidak akan pernah terselesaikan tanpa bantuan dan dorongan dari berbagai pihak. Oleh karena itu ucapan terimakasih disampaikan kepada, Rektor Universitas Jendral Soedirman dan Dekan Fakultas Sains dan Teknik, Universitas Jendral Soedirman, Purwokerto yang telah memberikan kesempatan mengikuti pendidikan program Magister pada Sekolah Pascasarjana Institut Pertanian Bogor. Departemen Pendidikan Nasional dalam hal ini Direktorat Jendral Pendidikan tinggi yang telah membiayai penulis selama mengikuti pendidikan program Magister di Institut Pertanian Bogor melalui dana BPPS (Beasiswa Pendidikan Program Pascasarjana).
Terimakasih kepada Ibu Dr. Ir. Dewi Apri Astuti MS dan Bapak Dr. Ir. Ridwan Affandi, DEA, selaku komisi pembimbing atas segala petunjuk, saran dan bimbingannya. Kepala beserta staf Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi, Laboratorium Bahan pakan dan Teknologi Pakan Fakultas Peternakan dan Laboratorium Fisiologi Hewan Air Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor, yang telah memberikan izin dan fasilitas selama penelitian. Direktur SEAFAST Center (South East Asian Food and Agricultural Science and Technology Center) yang telah memberikan izin dan fasilitas selama penelitian. Rekan-rekan seperjuangan angkatan 2008 pada Program Studi Ilmu Nutrisi dan Pakan, Sekolah Pascasarjana Institut Pertanian Bogor, serta semua pihak atas kerja samanya selama penulis mengikuti pendidikan di IPB.
Khusus kepada kedua orangtua penulis Susanto dan Ir. Endang Purwati, kedua mertuaku Abd. Rahman dan Riona (Alm), suamiku Amron S.Pi, M.Si yang telah membantuku secara moral maupun spiritual, serta seluruh keluarga atas dukungan, bantuan, pengertian dan doa yang senantiasa menyertai penulis selama mengikuti pendidikan di IPB.
Semoga Allah SWT memberikan pahala yang berlipat ganda atas segala bantuan yang telah diberikan.
Akhir kata, semoga karya ilmiah ini bermanfaat.
RIWAYAT HIDUP
Penulis dilahirkan di Purworejo, Jawa Tengah pada tanggal 20 Juli 1983 sebagai anak ke-2 dari 4 bersaudara dari pasangan Susanto dan Ir. Endang Purwati. Pendidikan sarjana ditempuh di Fakultas Peternakan Universitas Jendral Soedirman, lulus pada tahun 2005. Pada tahun 2008 penulis mendapatkan kesempatan untuk melanjutkan ke Program Magister di Sekolah Pascasarjana IPB Program Studi Ilmu Nutrisi dan Pakan. Beasiswa BPPS diperoleh dari Dirjen Dikti, Departemen Pendidikan Nasional, Republik Indonesia.
Selama menjadi mahasiswa di sekolah pascasarjana Institut Pertanian Bogor, penulis aktif mengikuti seminar yang bersifat nasional maupun internasional. Beberapa makalah ilmiah yang telah di publikasikan antara lain; pada seminar internasional The first Intrnational Seminar on Animal Industry 2009 (ISAI 1st
Penulis bekerja sebagai staf pengajar pada Program Studi Budidaya Perairan, Jurusan Perikanan dan Kelautan Fakultas Sains dan Teknik Universitas Jendral Soedirman Purwokerto, sejak tahun 2006 sampai dengan sekarang.
DAFTAR ISI
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiii
1 PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
2 TINJAUAN PUSTAKA 2.1 Saluran Pencernaan dan Makanan Ikan Mas ... 4
2.2 Kebutuhan Nutrisi Ikan Mas ... 5
2.3 Mikroflora Saluran Pencernaan Ikan ... 6
2.4 Daya Kerja Antibiotik ... 9
2.5 Prebiotik ... 10
3 BAHAN DAN METODE 3.1 Efektivitas antibiotik terhadap penurunan populasi total mikroflora saluran pencernaan ikan mas . ... 13
3.1.1 Tempat dan waktu ... 13
3.1.2 Materi ... 13
3.1.3 Prosedur kerja ... 14
3.1.4 Analisis data ... 16
3.2 Evaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisiensi retensi protein dan pertumbuhan ... 17
3.2.1 Tempat dan waktu ... 17
3.2.2 Materi ... 17
3.2.3 Prosedur kerja ... 19
3.2.4 Analisis data ... 23
4 HASIL DAN PEMBAHASAN 4.1 Efektivitas antibiotik terhadap penurunan populasi total mikroflora saluran pencernaan ikan mas ... 24
4.1.1 Hasil ... 24
4.1.2 Pembahasan ... 26
4.2 Evaluasi kontribusi mikroflora saluran pencernaan terhadap efisiensi retensi protein dan pertumbuhan ... 28
4.2.1 Hasil ... 28
4.2.2 Pembahasan ... 32
5 PEMBAHASAN UMUM ... 36
6 SIMPULAN DAN SARAN ... 39
DAFTAR TABEL
1 Komposisi pakan untuk melihat efektivitas jenis dan dosis antibiotik terhadap penurunan populasi mikroflora saluran pencernaan setiap
perlakuan (% BK) ... 14
2 Komposisi pakan percobaan untuk evaluasi kontribusi mikroflora terhadap efisiensi retensi protein dan pertumbuhan (%BK) ... 18
3 Analisis proksimat pakan uji evaluasi kontribusi mikroflora saluran pencer- naan ikan mas terhadap efisensi retensi protein dan pertumbuhan ... 18
4 Populasi mikroflora saluran pencernaan ikan mas pada dua media yang berbeda TSA dan MRSA [Log (cfu/ml)] ... 24
5 Persen kematian mikroflora saluran pencernaan ikan mas pada dua media yang berbeda TSA dan MRSA ... ` 26
6 Parameter kualitas air masing-masing perlakuan selama pemeliharaan ... 28
7 Parameter pertumbuhan untuk tiap perlakuan selama pemeliharaan ... 29
8 Konsumsi pakan (g) dan rasio efisiensi protein pada tiap perlakuan ... 31
DAFTAR GAMBAR
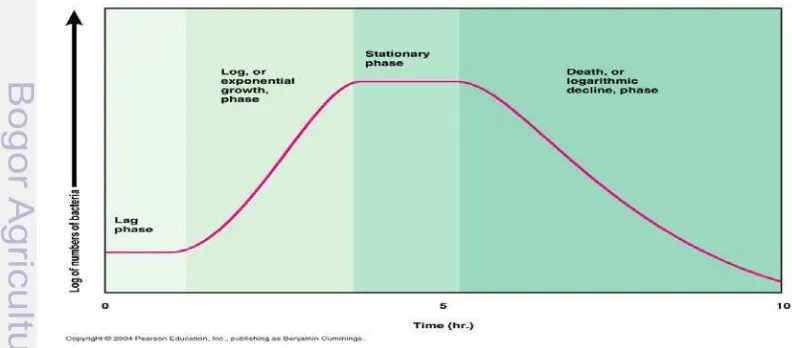
1 Fase hidup mikroba pada media kultur ... 8 2 Populasi total mikroflora saluran pencernaan ikan mas pada pakan kontrol
dan pakan mengandung antibiotik tetrasiklin 200 ppm ... 25 3 Model pertumbuhan tiap perlakuan terhadap lama pemeliharaan (minggu) . 30
DAFTAR LAMPIRAN
1 Ukuran rata-rata ikan mas yang digunakan pada percobaan efektivitas antibiotik terhadap penurunan populasi total mikroflora ... 46 2 Populasi mikroflora saluran pencernaan ikan mas pada dua media yang
berbeda TSA dan MRSA [Log (cfu/ml)] ... 46 3 Hasil analisis ragam untuk populasi mikroflora saluran pencernaan pada
percobaan efektivitas antibiotik terhadap penurunan populasi total mikroflora... 46 4 Hasil analisis uji lanjut Duncant test untuk populasi mikroflora saluran
pencernaan pada percobaan efektivitas antibiotic terhadap penurunan populasi total mikroflora ... 47 5 Hasil analisis ragam untuk persen kematian mikroflora saluran pencernaan pada percobaan efektivitas antibiotik terhadap penurunan populasi total
mikroflora ... 48 6 Parameter berat ikan uji (g), persen laju pertumbuhan spesifik (SGR),
jumlah ikan hidup (ekor) dan persen laju kelangsungan hidup (SR) selama pemeliharaan pada masing-masing perlakuan. ... 48 7 Hasil analisis ragam untuk persen laju kelangsungan hidup (SR) masing
masing perlakuan selama pemeliharaan ... 49 8 Hasil uji lanjut Duncan test persen laju kelangsungan hidup (SR) ikan uji
selama pemeliharaan... 49 9 Data konsumsi pakan (g), konsumsi protein (g) dan rasio efisiensi protein
(PER) selama pemeliharaan ... 50 10 Rataan proksimat protein kasar tubuh ikan uji pada sebelum dan setelah
pemberian pakan uji... 50 11 Populasi mikroflora saluran pencernaan ikan mas pada masing-masing
perlakuan (in vitro) ... 51 12 Analisis ragam populasi mikroflora saluran pencernaan pada masing-masing perlakuan (in vitro). ... 51 13 Uji lanjut populasi mikroflora saluran pencernaan pada masing-masing
perlakuan (in vitro) dengan menggunakan Duncan test. ... 52 14 Persentase efisiensi retensi protein (ERP) pada masing-masing perlakuan .. 52 15 Analisis ragam untuk efisiensi retensi protein (ERP). ... 53 16 Uji lanjut Duncan test untuk efisiensi retensi protein... 53 17 Analisis ragam untuk kontribusi mikroflora saluran pencernaan terhadap
penambahan efisiensi retensi protein (ERP) ... 53 18 Uji lanjut Duncan test untuk kontribusi mikroflora saluran pencernaan
1
1 PENDAHULUAN
1.1 Latar Belakang
Budidaya perikanan merupakan suatu kegiatan pemeliharaan organisme akuatik pada lingkungan terkontrol dengan tujuan mendapatkan keuntungan. Salah satu kegiatan budidaya ikan konsumsi yang banyak dilakukan petani ikan adalah ikan mas (Cyprinus carpio). Ikan mas (Cyprinus carpio) memiliki potensi sangat baik untuk dikembangkan karena pemeliharaannya mudah, daya tumbuh kembangnya cepat, harganya terjangkau oleh masyarakat, disukai konsumen, serta mempunyai nilai gizi yang cukup tinggi sebagai sumber protein hewani. Namun, produksi nasional ikan mas sejak tahun 2002- 2008 mengalami penurunan. Produksi tahun 2002 mencapai 287.000 ton/tahun dan terus menurun pada tahun 2008 menjadi 243.000 ton/tahun (Kementrian Kelautan & Perikanan 2010). Salah satu penyebab turunnya produksi pada kegiatan budidaya ikan mas secara intensif adalah pakan.
Pakan ikan merupakan faktor penting dalam menunjang keberhasilan usaha budidaya, akan tetapi biaya yang dikeluarkan untuk pengadaan pakan relatif besar mencapai 35-70% dari total biaya produksi, (Webster & Lim 2002). Pakan ikan memiliki harga relatif mahal, disebabkan oleh tingginya kandungan protein dalam pakan. Melonjaknya harga pakan ikan tidak terlepas dari kondisi bangsa Indonesia yang hingga kini masih mengimpor tepung ikan sebagai bahan baku utama pakan ikan, mencapai Rp 2 - 4,5 miliar per tahun (Wawa 2006). Pada ikan, protein lebih efektif digunakan sebagi sumber energi pertumbuhan dibandingkan dengan karbohidrat. Hal ini dikarenakan komposisi penyusun tubuh ikan terbesar setelah air adalah protein. Kandungan protein pada ransum ikan mas sesuai dengan kebutuhannya berkisar 30-35% (Takeuchi et al. 2002). Penurunan kandungan protein pakan diharapkan akan menghemat biaya produksi, tanpa harus menurunkan produktivitas sehingga total biaya produksi dapat ditekan.
2 (mulbery leaf) dan biji-bijian (biji kapas dan biji daun matahari). Akan tetapi, substitusi tepung ikan dengan protein asal tanaman memiliki kendala seperti zat anti nutrisi yang cukup tinggi dan ketersediaan akan asam amino lisin dan metionin sangat kurang.
Usaha lain yang telah dilakukan adalah memberikan berbagai zat pemacu pertumbuhan seperti antibiotik dan prebiotik. Menurut Thyman et al. (2007) antibiotik dapat meningkatkan kapasitas kecernaan protein dengan cara menekan perkembangan bakteri patogen pada kegiatan budidaya. Akan tetapi, hal ini bertentangan dengan Dietze et al. (2005), yang menyatakan bahwa penggunaan antibiotik yang berlebihan dengan tujuan untuk menekan populasi bakteri patogen, akan membahayakan bagi mikroflora saluran pencernaan dan inang. Pemberian jenis antibiotik tertentu pada ikan akan memberikan efek yang berbeda terhadap aktivitas mikroflora. Penelitian mengenai mikroflora saluran pencernaan telah banyak dilakukan baik pada ikan mas maupun jenis ikan yang lain. Kajian yang dilakukan meliputi populasi mikroflora, aktivitas enzim selulase dan protease akibat penambahan jenis antibiotik dengan dosis tertentu. Menurut Nakayama et al. (1994) dan Jankauskiene (2002) pemberian streptomisin 100 mg/l mengakibatkan penurunan populasi mikroflora hingga 94% dibandingkan pakan basal. Menurut Tae (2003) dan Aslamiyah (2006) bahwa pakan yang mengandung antibiotik dapat menurunkan populasi total bakteri proteolitik hingga 99,92% dan penurunan aktivitas enzim protease hingga 40%. Berdasarkan informasi tersebut, antibiotik yang ditambahkan dalam pakan dapat digunakan sebagai kontrol negatif untuk melihat peran mikroflora saluran pencernaan. Pemilihan penggunaan zat pemacu pertumbuhan pada kegiatan budidaya perlu diperhatikan, agar tidak membahayakan inang dan mikroflora saluran pencernaan. Oleh karena itu, upaya untuk menurunkan biaya pakan dalam kegiatan produksi masih perlu dilakukan.
3 pakan, dapat berperan menjaga keseimbangan populasi mikroflora serta dapat bersifat sebagai growth promotor atau mengaktifkan beberapa strain bakteri bermanfaat yang terdapat dalam saluran pencernaan (Mazurkiewiecz et al. 2008). Mikroflora sebagai penghasil enzim akan meningkatkan ketersediaan pakan tercerna yang siap diabsorbsi oleh tubuh sehingga efisiensi pakan meningkat. Selain berperan sebagai penghasil enzim, mikroflora saluran pencernaan juga berfungsi sebagai sumber protein. Hal ini terjadi apabila mikroflora mengalami fase lethal dan mengalami lisis kemudian diabsorbsi oleh tubuh ikan. Mikroflora saluran pencernaan mampu menghambat perkembangan bakteri patogen, sehingga membantu keseimbangan populasi total mikroflora. Keseimbangan populasi mikroflora saluran pencernaan akan berpengaruh terhadap peningkatan produksi enzim eksogen. Hal tersebut menyebabkan peningkatan ketersediaan nutrien dalam proses penyerapan, yang selanjutnya akan dimanfaatkan untuk metabolisme, pembentukan jaringan tubuh dan pertumbuhan
Berdasar pada informasi tersebut, perlu dilakukan penelitian untuk mengetahui dan mengevaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisiensi retensi protein dan pertumbuhan ikan mas. Peningkatan efisiensi retensi protein dan pertumbuhan merupakan hal yang esensial dalam upaya peningkatan produksi dan efisiensi pakan pada usaha budidaya ikan mas. 1.2 Tujuan Penelitian
Penelitian ini bertujuan:
1. Menganalisis efektivitas jenis dan dosis antibiotik terhadap penurunan populasi mikroflora, yang selanjutnya digunakan sebagai kontrol negatif.
4
2 TINJAUAN PUSTAKA
2.1 Saluran Pencernaan dan Makanan Ikan Mas
Alat pencernaan pada ikan mas terdiri atas saluran pencernaan dan kelenjar pencernaan. Saluran pencernaan ikan mas meliputi segmen-segmen yang meliputi mulut, rongga mulut, faring, esophagus, lambung, pylorus, usus, rectum dan anus. Kelenjar pencernaan terdiri dari hati dan pankreas. Terdapat perbedaan anatomis pada alat pencernaan ikan berdasarkan kebiasaan makanan. Salah satunya yang sangat mencolok terletak pada struktur gigi pada rongga mulut, struktur tapis insang pada segmen faring, keberadaan dan bentuk lambung, dan panjang usus. Ikan mas bertapis insang sedang, dengan lambung berbentuk kantung. Berdasarkan ukuran panjang usus, ikan mas termasuk dalam kategori omnivora yang cenderung herbivora (usus sedang) yaitu 2-3 kali panjang tubuhnya (Affandi et al. 2009).
Kelenjar pencernaan pada ikan mas terdiri dari hati dan pankreas yang berperan mensekresikan bahan yang akan masuk ke dalam usus. Hati berperan sangat penting sebagai secretor bahan untuk proses pencernaan. Hati ikan mas hampir tidak memiliki bentuk yang jelas, karena letaknya terdapat pada lekukan usus (Smith 2009). Pankreas merupakan organ yang mensekresikan enzim yang berperan dalam proses pencernaan. Enzim yang diproduksi antara lain, protease yang terdiri dari tripsin, kemotripsin, elastase dan karboksi peptidase, amylase, lipase dan kitinase, (Affandi dkk. 2009).
5 bahan-bahan organik. Setiap fase hidup ikan mas memiliki kebiasaan makan yang berbeda. Induk ikan mas dipelihara pada kolam pemijahan membutuhkan 70% tumbuhan dan 30% pakan hewani dengan vitamin dan mineral. Ikan mas ukuran 10-18 g di beri pakan tumbuhan dan pellet komersial (Takeuchi et al. 2002). 2.2 Kebutuhan Nutrisi Ikan Mas
Penyusunan pakan ikan yang dapat memenuhi kebutuhan standar maupun produksi didukung oleh pemenuhan sumber protein dan energinya. Kandungan nutrisi ikan mas yang baik untuk protein adalah 30 - 38%, kandungan lemak 4 - 15%, dan karbohidrat 30-40 %. Protein merupakan sumber energi yang paling efektif dan efisien yang digunakan untuk pertumbuhan dibandingkan karbohidrat (Takeuchi et al. 2002). Menurut Furuichi (1988) dari beberapa studi kadar optimum karbohidrat pakan untuk golongan ikan karnivora adalah 10-20% dan golongan omnivore adalah 30-40%. Karbohidrat dalam pakan digunakan sebagai protein sparring effet untuk memenuhi kebutuhan energi metabolisme basal dan
maintenance. Sedangkan, protein pakan dapat dipergunakan sepenuhnya untuk pertumbuhan.
Pengetahuan kebutuhan ikan budidaya sangat diperlukan guna mencapai pertumbuhan yang optimal dan keberlangsungan sebagai industri. Protein adalah salah satu nutrien yang sangat diperlukan oleh ikan. Menurut Webster & Lim (2002) menyatakan bahwa kebutuhan protein harian untuk maintanance ikan mas adalah 1g/ kg berat badan, sedangkan untuk memperoleh retensi protein optimal pada tubuhnya membutuhkan protein 12 g/kg berat badan. Protein yang dibutuhkan proses pertumbuhan adalah 7-8 g protein per berat badan per hari. Kebutuhan ikan akan protein dipengaruhi oleh berbagai faktor antara lain jenis ikan, umur ikan, ukuran ikan, kualitas protein, pakan, kecernaan pakan, dan kondisi lingkungan. Asam amino esensial yang wajib ada pada komposisi pakan ikan adalah lisin (Furuichi 1988).
6 mamalia dan burung. Pakan yang dikonsumsi ikan akan menyediakan energi yang sebagian besar digunakan untuk metabolisme yang meliputi energi untuk hidup pokok, energi untuk aktivitas, energi untuk pencernaan makanan dan energi untuk pertumbuhan, sedangkan sebagian yang lainnya dikeluarkan dalam bentuk feses dan bahan ekskresi lainnya (Webster & Lim 2002). Sumber energi lain yang berperan sebagai protein sparring effect selain karbohidrat adalah lemak. Lemak mempunyai peranan penting bagi ikan karena berfungsi sebagai sumber energi dan asam lemak esensial, memelihara bentuk dan fungsi membran atau jaringan yang penting bagi organ tubuh tertentu, membantu dalam penyerapan vitamin yang larut dalam lemak dan untuk mempertahankan daya apung tubuh (NRC 1993). Ikan mas dapat secara efektif memanfaatkan lemak dan karbohidrat sebagai sumber energi non-protein. Energi untuk seluruh aktivitas tersebut diharapkan sebagian besar berasal dari nutrien non protein (lemak dan karbohidrat). Apabila sumbangan energi dari bahan non protein tersebut rendah, maka protein akan didegradasi untuk menghasilkan energi, sehingga fungsi protein sebagai nutrien pembangun jaringan tubuh akan berkurang. Menurut Shiau & Huang (1990); Peres & Teles (1999), menyatakan bahwa, protein sparing effect
oleh karbohidrat dan lemak dapat menurunkan biaya produksi (pakan) dan mengurangi pengeluaran limbah nitrogen ke lingkungan.
Kebutuhan vitamin dan mineral pada pakan ikan mas, dipengaruhi oleh berbagai faktor seperti ukuran ikan, temperatur media pemeliharaan, dan komposisi pakan. Pada pembuatan pakan komersial pemberian vitamin dan mineral dapat dilebihkan menjadi dua hingga lima kali dari kebutuhan dasar. Hal ini dikarenakan pada proses pembuatan pellet, mengalami tekhnik extrution yang menggunakan suhu tinggi, sehingga memungkinkan vitamin dan mineral rusak dan larut, (Takeuchi et al. 2002).
2.3 Mikroflora Saluran Pencernaan Ikan
7 sapi, domba, dan kuda. Pada hewan air, tipe fermentasi mikroba yang mirip dengan hewan darat tidak dikenal kecuali hanya pada ikan herbivore yaitu dari family Kyposidae. Jenis ikan ini merupakan ikan pemakan rumput (Browser) yang tidak memiliki suatu mekanisme penumbukan atau penghancuran secara mekanik pada bahan makanan yang dikonsumsi. Mekanismenya adalah potongan makanan yang tercabik akan ditelannya, proses pencernaan selanjutnya berlangsung dikantung-kantung caeca pada usus bagian belakang. Di tempat tesebut fermentasi secara mikroba berlangsung secara intensif yang melibatkan berbagai jenis bakteri, flagelata dan protozoa bersilia, (Affandi dkk. 2009).
Komponen sel tumbuhan yang relatif sulit untuk dicerna adalah dinding sel, hal ini dikarenakan dinding sel tumbuhan tersusun oleh komponen selulosa dan lignin (polisakarida). Komponen tersebut di dalam saluran pencernaan hanya dapat dihidrolisis oleh enzim selulase. Pada umumnya ikan tidak dapat memproduksi selulase. Enzim selulase biasa diproduksi oleh mikroflora yang hidup bersimbiosis di dalam saluran pencernaan, sebagaimana yang ditemukan pada ikan mas koki, Carasius auratus, (Migita & Hashimoto 1995) dan ikan mas,
Cyprinus carpio (Scherbina & Kazlaushene 1994). Menurut Clarke & Bouchop (1977) menyimpulkan bahwa aktivitas selulase ada hubungannya dengan kebiasaan ikan mengkonsumsi detritus.
Pada saluran pencernaan, mikroflora yang berkembang biak bukan saja sekretor enzim selulase, tetapi juga dapat menghasilkan berbagai jenis enzim dari kelompok enzim protease, lipase dan amylase. Berbagai enzim yang dihasilkan selanjutnya akan berperan dalam pencernaan ekstraseluler pada lumen saluran pencernaan. Jenis mikroflora pada saluran pencernaan sangat beragam, sebagai contoh mikroflora dari kelompok bakteri dapat terdiri dari: Lactobacillus sp, Vibrio sp, Pseudomonas sp, Aeromonas sp, Bacillus sp, Flavobacterium sp, dan
Citrobacter sp. Mikroflora berperan dalam proses pencernaan (penghasil berbagai jenis enzim), juga berperan sebagai penghambat pertumbuhan mikroba pathogen baik yang hidup di saluran pencernaan maupun di media hidup biota air tersebut.
8 beberapa isolasi mikrob saluran pencernaan ikan digunakan suhu 250
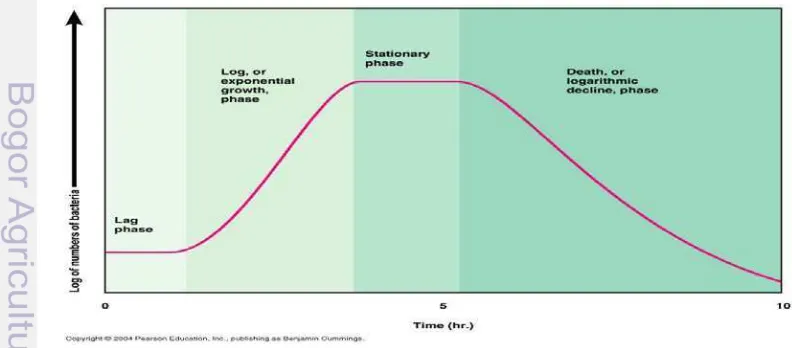
Pertumbuhan mikroba pada media kultur menurut Gurmmings (2004), dapat dibedakan menjadi 4 model pertumbuhan; (a) Fase lag, selama tahap ini bakteri beradaptasi dengan lingkungan pertumbuhan. Periode ini merupakan tahap pematangan bakteri dan belum dapat membelah diri. Pada siklus pertumbuhan lag phase, sintesis RNA, enzyme dan molekul lain terjadi, (b) Fase Log (eksponential phase), pada fase ini dicirikan dengan terjadinya penggandaan sel, jumlah dari bakteri yang baru bermunculan per unit waktu yang proporsional dengan populasi awal. Jika pertumbuhan tidak dibatasi , maka penggandaan sel akan terus terjadi hingga lajunya konstan, sehingga perbanyakan sel dan populasinya menjadi dua kali lipat seiring berurutan waktu. Pada fase ini merupakan fase pertumbuhan spesifik, pertambahan sel per unit waktu. Fase ini tidak dapat terjadi secara terus menerus, karena lama-kelamaan nutrien media akan berkurang dan terjadi penumpukan sisa metabolism, (c) Fase stationer, pada fase ini terjadi pertumbuhan yang lamban karena kekurangan nutrien pada media dan akumulasi produk toksik. Fase ini dicapai ketika bakteri sudah kehabisan energi untuk memenuhi nutrisi dari media hidupnya. Fase ini memiliki nilai yang konstan, laju pertumbuhan bakteri sama dengan tingkat kematian bakteri, pada fase ini mikroba cenderung memproduksi senyawa metabolit sekunder seperti enzim, antibiotik dan lain sebagainya dan (d) Fase kematian (death phase), pada fase ini, bakteri kehabisan nutrien dan mati.
C, (Clarke dan Bouchop, 1977).
9 Mikroba yang mengalami fase lethal, akan lisis dan dapat dijadikan sumber protein bagi inang. Model pertumbuhan mikroba pada media kultur dapat diamati pada Gambar 1. Berdasarkan kebutuhan akan oksigen, mikroorganisme dapat dibedakan menjadi tiga kelompok yaitu aerob, anaerob dan fakultatif. Mikroba aerob adalah, mikroorganisme yang dapat tumbuh jika terdapat oksigen di lingkungannya. Oksigen diperlukan karena energi hanya dapat diperoleh melalui respirasi aerobik, seperti halnya hewan dan manusia. Kelompok kedua adalah mikroba anaerob, yaitu mikroorganisme yang tidak membutuhkan oksigen untuk pertumbuhannya, pertumbuhannya akan terhambat dengan adanya oksigen bahkan diantaranya ada yang sangat sensitive dan akan mati. Mikroorganisme ini mendapat energi dengan respirasi anaerobik. Kelompok ketiga adalah mikroba fakultatif, yaitu mikroorganisme yang dapat tumbuh tanpa atau dengan adanya oksigen. Kebutuhan energi dapat dipenuhi dengan bergantung pada kondisi lingkungan sekitar, (Waluyo 2008).
2.4 Daya Kerja Antibiotik
Salah satu jenis zat antimikroba disebut dengan antibiotik. Antibiotik adalah suatu substansi (zat kimia) yang diperoleh dari atau dibentuk dan dihasilkan oleh mikroorganisme. Kelebihan dari antibiotik adalah, meskipun dalam jumlah yang sedikit mempunyai daya hambat kegiatan mikroorganisme lain. Antibiotika memiliki beberapa sifat antara lain; menghambat atau membunuh bakteri pathogen, dapat bersifat bakterisidal dan bakteriostatik, berspektrum luas, tetap aktif dalam plasma, cairan badan atau eksudat, dan larut didalam air. Ada beberapa mekanisme kerja antibiotik antara lain; (1) mempengaruhi dinding sel seperti; amphisilin, sikloserin dan vankomisin, (2) mempengaruhi fungsi membran sel seperti; polimiksin, kolistin dan nistatin, (3) menghambat sintesis protein seperti; streptomisin, tetrasiklin dan kloramphenikol, (4) menghambat sintesis asam nukleat seperti; novobiosin, sulfonamide dan trimetoprim (Waluyo 2008).
10 ikan mas sebagai ikan omnivora yang memiliki kecenderungan ke herbivora. Selulase diproduksi oleh mikroflora usus. Selulase mikroflora pada usus ikan mas telah ditemukan oleh Scherbina & Kazlauskene (1971). Das & Tripatih (1991) melaporkan aktivitas enzim selulase pada ikan grass carp (Cyprinus sp) menurun ketika diberi pakan yang mengandung tetrasiklin. Jenis ikan Cherac quadricarinatus yang diberi pakan mengandung 100 IU/mL penicilin dan 100 mg/L streptomycin per kg pakan selama 8 hari, menunjukkan penurunan aktivitas enzim selulase pada saluran pencernaan sebanyak 40% dan populasi mikroflora 94% lebih rendah dibandingkan kontrol.
Penggunaan senyawa antibiotik untuk sub terapeutik (prophylactic) seperti pencegahan penyakit dan memacu pertumbuhan ternak terrestrial dan akuatik terus meningkat menyebabkan tekanan selektif pada mikroba serta memacu munculnya resistensi pada berbagai bakteri, sehingga untuk sejumlah kasus penyakit pengendaliannya menjadi lebih sulit (WHO 1998). Penggunaan antibiotik pada panti pembenihan Pecten maximus berhasil menurunkan populasi bakteri Vibrio sp secara signifikan, tetapi 1 dari 21 strain yang ada terbukti menjadi resisten terhadap khloramfenikol (Irianto 2003). Permasalahan tidak hanya karena terbentuknya dan berkembangnya bakteri-bakteri yang resisten setelah terpapar antibiotik tersebut, tetapi juga terjadinya transfer gen-gen resisten ke bakteri lainnya yang sebelumnya tidak pernah terpapar antibiotik tersebut (White et al, 1999). Berdasarkan kekahwatiran tersebut, alternative pengendalian penyakti telah dilakukan, antara lain penggunaan vaksin dan immunostimulan non-spesifik (WHO 1998).
2.5 Prebiotik
11 mikroflora untuk immunostimulan. Menurut Ringo, Gatesoupe (1998), menyatakan bahwa komposisi mikroflora saluran pencernaan ikan sehat didominasi oleh bakteri asam laktat. Pada umumnya bakteri asam laktat mampu berperan sebagai mikroba bermanfaat bagi inang. Prebiotik akan memacu pertumbuhan dan meningkatkan aktivitas mikroba bermanfaat (bakteri asam laktat, bifidobacterium) dalam saluran cerna. Prebiotik merupakan komposisi pakan yang mudah untuk diaplikasikan dalam pakan kering (pellet) karena bersifat stabil setelah melewati proses pembuatan pakan dan penyimpanan.
Prebiotik berperan sebagai feed supplement yang berada di dalam pakan atau sengaja ditambahkan di dalam pakan, yang dapat bersifat sebagai growth promotore dan mengaktifkan beberapa strain bakteri yang terdapat dalam saluran pencernaan, (Mazurkiewiecz et al. 2008). Telah banyak penelitian yang menunjukkan bahwa suatu bahan dinyatakan dapat digunakan sebagai prebiotik jika mengandung oligosacharida. Oligosacharida merupakan turunan dari fruktosa: inulin, oligofruktosa, fruktooligosacharida (FOS), dan turunan dari glukosa, maltose-oligosacharida. Inulin dan oligofruktosa terkandung di dalam berbagai tanaman, seperti asparagus, kacang tanah, dan tanaman umbi. Prebiotik mampu mengikat air pada lumen usus dan meningkatkan volume padat isi saluran usus dan feses. Hal ini sama dengan soluble food dan insoluble food yang dapat diidentifikasi dan dapat mengoptimalkan pembersihan saluran pencernaan serta memfermentasi substrat untuk probiotik, (Ziemer, Gibson 1998; Fooks et al.
1999).
Menurut Gatlin III et al. (2006) jenis prebiotik yang sudah diuji cobakan pada ikan antara lain, scFOS (short chain fructooligisaccharide), inulin, xylooligosakarida (XOS) dan mananoligosakarida (MOS). Hasil penelitian yang memberikan perlakuan 0,375% FOS pada pakan ikan red drum (Ceaenos ocelatus) signifikan meningkatkan populasi mikroflora saluran pencernaan yang bersifat aerob. Penelitian lain yang dilakukan oleh Mahious et al. 2006), menyatakan bahwa pada larva ikan turbot (Psetta maxima) yang diberi pakan mengandung 2 % inulin secara signifikan meningkatkan populasi mikroflora
13
3 MATERI DAN METODE
Penelitian ini memiliki dua tahap percobaan yang bertujuan untuk mempermudah mencapai tujuan utama penelitian. Percobaan pertama adalah efektivitas jenis dan dosis antibiotik terhadap penurunan populasi total mikroflora saluran pencernaan ikan mas. Percobaan kedua adalah evaluasi kontribusi mikroflora saluran pencernaan terhadap efisiensi retensi protein dan pertumbuhan. Dua tahap percobaan yang dilakukan diuraikan sebagai berikut.
3.1 Efektivitas jenis dan dosis antibotik terhadap penurunan populasi mikroflora saluran pencernaan ikan mas
Percobaan pertama, bertujuan untuk menganalisis efektivitas jenis dan dosis antibiotik dalam menurunkan populasi total mikroflora saluran pencernaan dan selanjutnya akan digunakan sebagai kontrol negatif pada percobaan kedua. 3.1.1 Tempat dan Waktu
Penelitian dilakukan di Laboratorium Fisiologi Hewan Air, Fakultas Perikanan, Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi, Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan serta Laboratorium SEAFAST (South East Asian Food and Agricultural Science and Technology) Center, IPB. Penelitian dilaksanakan selama 2 bulan, mulai bulan Desember 2009 sampai dengan Februari 2010.
3.1.2 Materi
a. Hewan uji
Hewan uji yang digunakan berupa ikan mas dengan ukuran berat 15-20 g per ekor. Jumlah ikan yang digunakan sebanyak 108 ekor. Masing-masing ditempatkan pada aquaria berukuran 50x40x40 cm dan setiap akuarium berisi sebanyak 4 ekor per unit percobaan. Satu unit percobaan mewakili satu ulangan. b. Sumber inokulum
14 MRSA merupakan media sensitif yang digunakan untuk menguji keberadaan bakteri gram positif, khususnya bakteri asam laktat.
c. Pakan uji
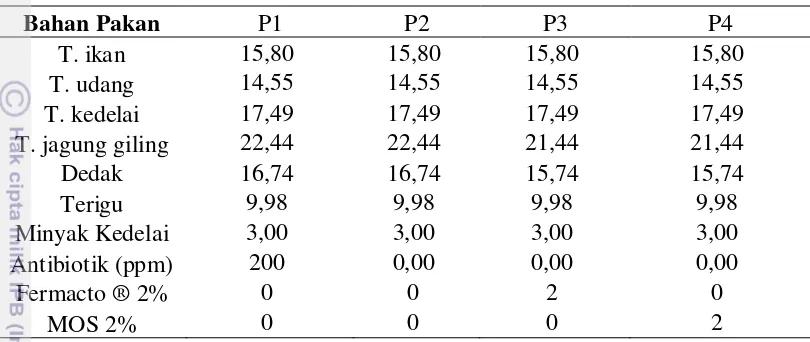
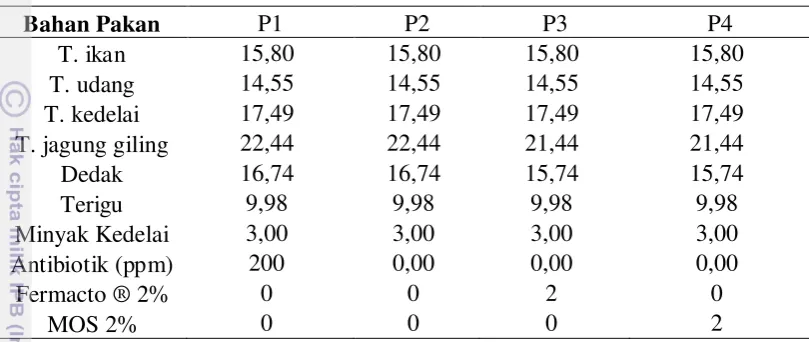
Pakan uji yang digunakan dalam penelitian ini merupakan pakan iso-energi dan iso-protein yang disusun dengan komposisi nutrien yang telah disesuaikan dengan kebutuhan hewan uji, dengan kandungan protein sebesar 26%. Pakan perlakuan terdiri dari pakan kontrol (tanpa antibiotik) dan pakan yang dicampur dengan 3 jenis antibiotik berbeda; streptomisin (S), tetrasiklin (T), dan amphisilin (A) dengan dosis berbeda; 100, 150 dan 200 ppm. Pakan basal tanpa antibiotik merupakan pakan kontrol, yang digunakan sebagai pembanding pada pakan dengan penambahan antibiotik. Komposisi pakan dapat diamati pada Tabel 1.
Tabel 1 Komposisi pakan untuk melihat efektivitas jenis dan dosis antibiotik terhadap penurunan populasi mikroflora saluran pencernaan setiap perlakuan (% BK)
Bahan Pakan K S100 S150 S200 T100 T150 T200 A100 A150 A200
T. ikan 15,80 15,80 15,80 15,80 15,80 15,80 15,80 15,80 15,80 15,80 T. udang 14,55 14,55 14,55 14,55 14,55 14,55 14,55 14,55 14,55 14,55 T. kedelai 17,49 17,49 17,49 17,49 17,49 17,49 17,49 17,49 17,49 17,49 T. jagung giling 22,44 22,44 22,44 22,44 22,44 22,44 22,44 22,44 22,44 22,44 Dedak 16,74 16,74 16,74 16,74 16,74 16,74 16,74 16,74 16,74 16,74 Terigu 9,98 9,98 9,98 9,98 9,98 9,98 9,98 9,98 9,98 9,98 Minyak Kedelai 3,00 3,00 3,00 3,00 3,00 3,00 3,00 3,00 3,00 3,00 Streptomisin (ppm) 0,00 100 150 200 0 0 0 0 0 0
Tetrasiklin (ppm) 0 0 0 0 100 150 200 0 0 0 Amphisilin (ppm) 0 0 0 0 0 0 0 100 150 200 Keterangan: K: Kontrol, S100, S150, S200 (Streptomisin dosis 100, 150, 200 ppm), T100, T150,
T200 (Tetrasiklin dosis 100, 150, 200 ppm) dan A100, A150, A200 (Ampisilin dosis 100, 150, 200 ppm)
Pellet yang telah dibuat diukur gross energinya dan analisis kimia proksimat (AOAC 1993). Hasil komposisi kimiawi pellet pada Tabel 1 terdiri dari kadar air (6,6%), abu(8,7%), lemak kasar (8,6%), protein kasar (26,0%), serat kasar (3,8%), BETN (52,8%) dengan gross energi pellet (3465,3 Kal/kg).
3.1.3 Prosedur kerja
15 diakibatkan oleh lingkungan. Untuk menghindari ikan tidak melompat, dibagian atas aquarium ditutup dengan menggunakan kassa nyamuk, yang sisin-sisinya dijepit. Sebelum digunakan, wadah dan semua peralatannya didisinfektan terlebih dahulu menggunakan kaporit (CaCO3
Perlakuan pemberian pakan dimulai pada hari pertama setelah pemuasaan 24 jam pasca aklimasi hingga hari ke-8. Pakan uji diberikan dua kali sehari secara
ad libitum pada pagi hari pukul 8.00 WIB dan sore hari pukul 14.00 WIB. Setelah 8 hari diberi pakan uji, ikan uji diamati populasi total mikroflora pada saluran cerna dengan cara pengambilan saluran pencernaan ikan mas sebagai sumber inokulum. Pengambilan sampel dilakukan dengan pemingsanan hewan uji dengan zat anastesi minyak cengeh 1 ppm. Pembedahan dilakukan dengan menggunakan gunting yang telah disterilkan dengan alkohol 70% dan dikerjakan dekat api bunsen untuk mencegah kontaminasi. Organ pencernaan (usus) dikeluarkan dari ikan mas yang telah dimatikan. Organ pencernaan di ukur panjangnya dan ditimbang 1,2 g. Organ pencernaan digerus, setelah dihaluskan 1 g diencerkan dengan 9 ml cairan fisiologis (NaCl 0.85%) steril. Prosedur isolasi mikroba mengacu pada metode yang dilakukan pada hewan terrestrial seperti petunjuk Hungate (1966), serta mengkombinasikannya dengan prosedur isolasi mikroba dari saluran pencernaan ikan seperti metode yang dilakukan oleh Nakayama et al.
(1994) dan Tae (2003). Kultur mikroba dilakukan dalam suasana aerob. Pengenceran berseri di lakukan dari 10
). Aquarium diisi air sebanyak 40-45 L dan direndam dengan kaporit 24 jam, kemudian dibilas dengan rendaman air bersih sebanyak 3 kali dan didiamkan selama 24 jam. Ikan mas dengan bobot rata-rata 15-20g ditebar dengan kepadatan 4 ekor per aquarium (1 unit percobaan). Sebelum di tebar, ikan diaklimasi terlebih dahulu selama 1 minggu dan diberi pakan pellet, hal ini bertujuan untuk mengadaptasi ikan dengan lingkungan pemeliharaan. Setelah masa aklimasi selesai ikan uji dipuasakan selama 24 jam dengan tujuan menghilangkan sisa pakan dalam tubuh.
-1
16 (dengan vortex) selalu dilakukan sebelum rangkaian kegiatan pengenceran dilakukan. Hasil pengenceran 10-4 – 10-7 ditransfer sebanyak 0,1 ml ke dalam media kultur padat MRSA. Media MRSA ditujukan untuk melihat perlakuan terhadap respon populasi bakteri asam laktat pada saluran pencernaan. Kultur dalam media agar (in vitro) menggunakan metode agar tuang ke dalam cawan petri sebanyak 10 ml. Hasil kultur diinkubasi pada suhu 290
Keterangan:
C selama 48 jam. Parameter yang diukur merupakan populasi total mikroflora berdasarkan jumlah koloni mikroba yang dihasilkan, data disajikan dalam bentuk Log (cfu/ml) dengan menggunakan rumus (Bergeys, 2002) sebagai berikut:
PM = Populasi mikroba (cfu/ ml) K = Jumlah Koloni
A = Volume inokulasi dalam media pengencer (ml)
B = Pada pengenceran keberapa koloni mikrobanya dihitung C = Volume inokulasi dari media pengencer ke media padat (ml)
Pengamatan perlakuan terhadap respon persen kematian dilakukan untuk melihat efektivitas antibiotik terhadap penurunan populasi total mikroflora, dengan rumus sebagai berikut:
Persen kematian mikroflora
Jenis dan dosis antibiotik yang paling efektif menurunkan populasi mikroflora ditetapkan sebagai kontrol negatif pada percobaan kedua.
3.1.4 Analisis Data
17 Yijk= µ + αi +βj + (αβ)ij+ ε
Y
ijk
ijk adalah nilai pengamatan pada faktor A (jenis antibiotik) taraf ke i, faktor B (dosis) taraf ke-j dan kelompok ke k. (µ, αi, βj) adalah komponen aditif dari rataan, pengaruh utama jenis antibiotik dan dosis. (αβ)ij merupakan komponen interaksi dari jenis antibiotik dan dosis. (εijk) adalah pengaruh acak yang menyebar normal (0,σε2
Data yang diperoleh dianalisis dengan menggunakan sidik ragam (ANOVA) menggunakan SPSS 13.0 apabila terdapat perbedaan pada perlakuan akan dilakukan uji lanjut dengan Duncan test.
).
3.2 Evaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisiensi retensi protein dan pertumbuhan
Percobaan kedua, bertujuan untuk mengevaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisiensi retensi protein dan pertumbuhannya pada pakan yang menggunakan prebiotik komersial dan alami. 3.2.1 Tempat dan Waktu
Penelitian dilakukan di Laboratorium Fisiologi Hewan Air, Fakultas Perikanan, Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi dan Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan, IPB. Penelitian dilaksanakan selama 3 bulan, mulai bulan Februari 2010 sampai dengan Mei 2010.
3.2.2 Materi
a. Hewan uji
Hewan uji yang digunakan berupa ikan mas dengan ukuran berat 15-20 g per ekor. Jumlah ikan yang digunakan sebanyak 80 ekor. Masing-masing ditempatkan pada aquaria berukuran 50x40x40 cm dan setiap akuarium berisi sebanyak 4 ekor per unit percobaan. Satu unit percobaan mewakili satu ulangan. b. Pakan uji
18 kontrol positif, P3 = pakan + 2% Fermacto® (prebiotik komersial dari Behn-Meyer), P4 = pakan + 2% MOS (mananolighosakarida) prebiotik alami.
Tabel 2 Komposisi pakan percobaan untuk evaluasi kontribusi mikroflora terhadap efisiensi retensi protein dan pertumbuhan (%BK)
Bahan Pakan P1 P2 P3 P4
T. ikan 15,80 15,80 15,80 15,80
T. udang 14,55 14,55 14,55 14,55
T. kedelai 17,49 17,49 17,49 17,49
T. jagung giling 22,44 22,44 21,44 21,44
Dedak 16,74 16,74 15,74 15,74
Terigu 9,98 9,98 9,98 9,98
Minyak Kedelai 3,00 3,00 3,00 3,00
Antibiotik (ppm) 200 0,00 0,00 0,00
Fermacto ® 2% 0 0 2 0
MOS 2% 0 0 0 2
Keterangan: P1 = pakan + antibiotik (tetrasiklin 200 ppm), P2 = pakan tanpa antibiotik maupun prebiotik, P3 = pakan + 2% Fermacto ® (Marlyn 2007), P4 = pakan + 2% MOS (Gatesoupe et al. 2005)
Prebiotik komersial yang digunakan adalah Fermacto ®. Fermacto® terbuat dari substrat terfermentasi oleh strain Aspergillus sp, yang dapat secara efektif meningkatkan pertumbuhan dan menjaga keseimbangan populasi mikroflora saluran pencernaan. Prebiotik alami yang digunakan merupakan MOS yang diperoleh dari bungkil inti sawit. Penggunaan prebiotik pada ikan belum banyak dilakukan dan memiliki peluang besar dalam upaya meningkatkan pertumbuhan. Komposisi pakan dapat diamati pada Tabel 2. Pembuatan pakan uji dilakukan dengan mencampur seluruh bahan pakan hingga homogen. Pencampuran antibiotik dan prebiotik di campurkan pada akhir proses bersamaan dengan pencampuran minyak sebagai emulsifier. Suhu pelleting yang digunakan adalah 50-600
Tabel 3 Analisis proksimat pakan uji evaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisensi retensi protein dan pertumbuhan
C. Hasil analisis proksimat pakan uji, dapat diamati pada Tabel 3.
Bahan pakan KA Abu LK PK SK BETN GE
Tanpa prebiotik 6,6 8,7 8,6 26,06 3,8 52,84 3465,3 Berprebiotik 8,06 12,07 8,4 25,98 4,81 48,74 3435 Keterangan: KA = kadar air (%), LK = lemak kasar (%), PK = protein kasar (%), SK = serat
19 3.2.3 Prosedur kerja
a. Persiapan aquarium dan kualitas air
Hewan uji dipelihara di dalam aquarium dan bagian sisi wadah ditutup dengan terpal berwarna gelap, untuk meminimalisir stress pada ikan yang diakibatkan oleh lingkungan. Untuk menghindari ikan tidak melompat, dibagian atas aquarium ditutup dengan menggunakan kassa nyamuk, yang sisin-sisinya dijepit. Sebelum digunakan, wadah dan semua peralatannya didisinfektan terlebih dahulu menggunakan kaporit (CaCO3). Aquarium diisi air sebanyak 40-45 L dan direndam dengan kaporit 24 jam, kemudian dibilas dengan rendaman air bersih sebanyak 3 kali dan didiamkan selama 24 jam. Ikan mas dengan bobot rata-rata 15-20g ditebar dengan kepadatan 4 ekor per aquarium (1 unit percobaan). Sebelum di tebar, ikan diaklimasi terlebih dahulu selama 1 minggu dan diberi pakan pellet, hal ini bertujuan untuk mengadaptasi ikan dengan lingkungan pemeliharaan. Setelah masa aklimasi selesai ikan uji dipuasakan selama 24 jam dengan tujuan menghilangkan sisa pakan dalam tubuh. Pemberian pakan dilakukan sebanyak 3% dari berat biomass dengan frekuensi pemberian 2 kali sehari yaitu pukul 8.00 dan 15.00 WIB. Jumlah pakan yang diberikan dan sisa pakan selama penelitian dicatat untuk mengetahui tingkat konsumsi pakan sebagai dasar dalam menghitung tingkat konsumsi pakan dan efisiensi retensi protein. Perlakuan terdiri dari 5 ulangan, dengan pengamatan selama 40 hari. Kualitas air yang diamati meliputi, suhu (thermometer), pH (pH meter), NH3
b. Analisis proksimat
, dan oksigen terlarut (DO meter) diukur setiap minggu saat penimbangan bobot biomass.
Analisis proksimat dilakuan pada tubuh ikan sebelum dan setelah diberi perlakuan pada tiap-tiap perlakuan (AOAC 1990). Analisis proksimat terdiri atas protein kasar, lemak kasar, serat kasar abu, bahan ekstrak tanpa nitrogen (BETN) dan kadar air dari masing-masing bahan antara lain; daging ikan dan pakan uji. Analisis proksimat bahan pakan dan pakan uji dilakukan pada awal penelitian sedangkan analisis tubuh ikan dilakukan pada awal dan akhir penelitian yang bertujuan untuk menghitung tingkat retensi protein dan retensi lemak.
20 Kjedahl, lemak kasar dengan metode ekstraksi dengan alat soxhlet, kadar abu melaui pemanasan sampel dalam tanur pada suhu 400-6000C, kadar serat kasar dengan metode pelarutan sampel dalam asam dan basa kuat serta pemanasan dan kadar air dengan metode pemanasan dalam oven pada suhu 105-1100
c. Perhitungan populasi total mikroflora
C. Analisis proksimat pakan uji dilakukan di awal penelitian sedangkan analisis proksimat tubuh ikan dilakukan pada awal percobaan diambil 5 ekor ikan yang dipilih secara acak dari stok dan pada akhir percobaan diambil 2 ekor ikan pada tiap perlakuan dengan 5 ulangan.
Populasi total mikroflora saluran pencernaan ikan mas diamati pada akhir penelitian. Metode yang digunakan untuk memperoleh mikroflora adalah metode Hungate (1966) yang telah dimodifikasi oleh Nakayama et al. (1993) dan Tae (2003). Kultur mikrob dilakukan dalam suasana aerob. Sumber inokulum merupakan saluran pencernaan ikan mas, digerus seberat 1 gram, dan diencerkan ke dalam 9 ml NaCl fisiologis (0,85%). Pengenceran berseri di lakukan dari 10-4 sampai 10-7, dengan cara mengambil 0,5 ml dari kultur mikroba pada media cair dan dimasukkan ke dalam 4,50 ml media pengencer pertama (cairan fisiologis NaCl 0,85%), selanjutnya dari media pengencer pertama diambil 0,5 ml dan dimasukkan ke dalam 4,50 ml media pengencer kedua dan seterusnya hingga media pengencer terakhir. Homogenisasi (dengan vortex) selalu dilakukan sebelum rangkaian kegiatan pengenceran dilakukan. Hasil pengenceran terakhir ditransfer sebanyak 0,1 ml ke dalam media padat MRSA. Penggunaan media MRSA ditujukan untuk melihat respon perlakuan terhadap populasi bakteri asam laktat pada saluran pencernaan. Kultur dalam media agar (in vitro) menggunakan metode agar tuang ke dalam cawan petri sebanyak 10 ml. Hasil kultur diinkubasi pada suhu 290
d. Pengumpulan data
C selama 24 sampai 48 jam. Parameter yang diukur merupakan populasi total mikroflora berdasarkan jumlah koloni mikroba yang dihasilkan sesuai dengan metode BAM (Bacterial Assesment Method) Bergeys (2002), data disajikan dalam bentuk Log (cfu/ml).
21 1993). Peubah yang diamati antara lain; laju pertumbuhan spesifik (SGR), laju kelangsungan hidup (SR) dan konsumsi pakan (P). Sebagai penunjang efisiensi pakan adalah rasio efisiensi protein (PER) (Guillaume, et al. 2001) dan efisiensi retensi protein (ERP) (Rawles et al. 2010).
Kontribusi mikroflora terhadap efisiensi pemanfaatan protein untuk pertumbuhan dapat di presentasikan dengan pengurangan efisiensi retensi protein (ERP) kontrol (X) dengan pakan antibiotik (Y). Kontribusi mikroflora terhadap efisiensi retensi protein untuk pertumbuhan dengan penambahan prebiotik, adalah dengan mengurangkan (ERP) prebiotik (Z) dan pakan antibiotik (Y). Parameter yang diamati selama penelitian diuraikan sebagai berikut.
Pertumbuhan
Produksi utama dari usaha budidaya adalah daging ikan yang dapat dievaluasi secara mudah dengan memonitor pertumbuhan biomass yang sering disebut dengan berat. Pertumbuhan yang diamati merupakan laju pertumbuhan spesifik (SGR) menurut Guillaume et al. (2001) dengan rumus sebagai berikut:
Keterangan:
SGR = Spesifik Growth Rate (%) Bt = Rataan bobot akhir (g) Bo = Rataan bobot awal (g)
t = waktu lama pemeliharaan (hari) Laju Kelangsungan Hidup (SR)
Laju kelangsungan hidup atau survival rate diukur guna mengetahui respon perlakuan terhadap kualitas hidup hewan uji. SR dapat dihitung menurut Hui-yuan et al. (2007) dengan menggunakan rumus:
Konsumsi Pakan
22 Rasio efisiensi protein (PER)
Salah satu komponen dalam menganalisis efisiensi pakan adalah dengan mengevaluasi rasio efisiensi protein (PER). PER dapat digunakan untuk mendeskripsikan pemanfaatan konsumsi protein pakan untuk pertumbuhan. Rasio efisiensi protein (PER) dapat diukur menurut Mc Donald (2002) dengan menggunakan perhitungan sebagai berikut:
Efisiensi retensi protein (ERP)
Efisiensi retensi protein (ERP), dapat mendeskripsikan pemanfaatan konsumsi protein pakan terhadap persentase penambahan protein tubuh. Menurut Rawles et al. (2010) efisiensi retensi protein (ERP) dapat diukur dengan menggunakan perhitungan sebagai berikut:
Populasi total mikroflora Log (cfu/ml)
Perhitungan populasi total mikroflora dilakukan untuk melihat populasi total mikroflora saluran pencernaan yang diberi perlakuan pakan dengan penambahan antibiotik dan prebiotik, menggunakan metode Bergeys (2002) dengan rumus:
Keterangan:
PM = Populasi mikroba (cfu/ ml) K = Jumlah Koloni
A = Volume inokulasi dalam media pengencer (ml)
B = Pada pengenceran keberapa koloni mikrobanya dihitung C = Volume inokulasi dari media pengencer ke media padat (ml)
Kontribusi Mikroflora terhadap Sumbangan Protein untuk Pertumbuhan
23 terhadap efisiensi pemanfaatan protein untuk pertumbuhan dengan penambahan prebiotik, adalah dengan mengurangkan (ERP) prebiotik (Z) dan pakan antibiotik (Y). Persamaan dapat dirumuskan sebagai berikut:
Kontribusi mikroflora = X – Y
Kontribusi mikroflora dengan prebiotik = Z – Y 3.2.4 Analisis Data
Rancangan percobaan yang digunakan untuk mengevaluasi kontribusi mikroflora terhadap efisiensi retensi protein dan pertumbuhan adalah Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan 5 ulangan. Adapun model matematika rancangan tersebut adalah, sebagai berikut:
Yij= µ + αi +ε Y
ij
ij adalah nilai pengamatan pada perlakuan ke i, µ adalah komponen aditif dari rataan, pengaruh utama dari perlakuan dan (εij) adalah pengaruh acak yang menyebar normal (0,σε2
Sedangkan, untuk melihat model parameter pertumbuhan dianalisis menggunakan regresi.
24
4 HASIL DAN PEMBAHASAN
4.1 Efektivitas jenis dan dosis antibiotik terhadap penurunan populasi mikroflora saluran pencernaan ikan mas
4.1.1 Hasil
Hasil pengamatan populasi mikroflora saluran pencernaan ikan mas pada media MRSA yang telah diberi pakan uji selama 8 hari dapat dilihat pada Tabel 4. Hasil analisis data masing-masing perlakuan terhadap respon total populasi mikroflora menunjukkan bahwa terdapat interaksi antara jenis antibiotik dan dosis yang digunakan (P<0.05) terhadap penurunan populasi mikroflora. Hasil uji lanjut menunjukkan terdapat perbedaan nyata (P<0,05) pada; masing-masing faktor jenis antibiotik (A), dosis (B) dan interaksi dua faktor (jenis antibiotik x dosis (AxB). Tabel 4 Populasi mikroflora saluran pencernaan ikan mas pada media MRSA
[Log (cfu/ml]
Antibiotik
Dosis
Rataan Antibiotik
100 150 200
Streptomisin 7,07±0,27c 7,01±0,12c 6,96±0,14c 7,01±0,06β Tetrasiklin 6,89±0,07c 5,39±0,03b 5,00±0,06a 5,76±0,95
Ampisilin
α
6,95±0,05c 6,89±0,02c 6,71±0,09c 6,85±0,13 Rataan Dosis
β
6,97±0,09β 6,41±0,90α 6,35±1,07α 6,57±0,45 Keterangan: Perlakuan pakan kontrol memiliki populasi total mikroflora 7,34 log (cfu/ml),
Angka yang diikuti huruf berbeda menunjukan perbedaan nyata (P<0,05) berdasarkan interaksi faktor jenis antibiotik x dosis (AxB),
Angka yang diikuti simbol berbeda menunjukan perbedaan nyata (P<0,05) berdasarkan rataan masing-masing faktor jenis antibiotik (A) dan dosis (B).
25 populasi mikroflora paling tinggi dibandingkan perlakuan yang menggunakan antibiotik.
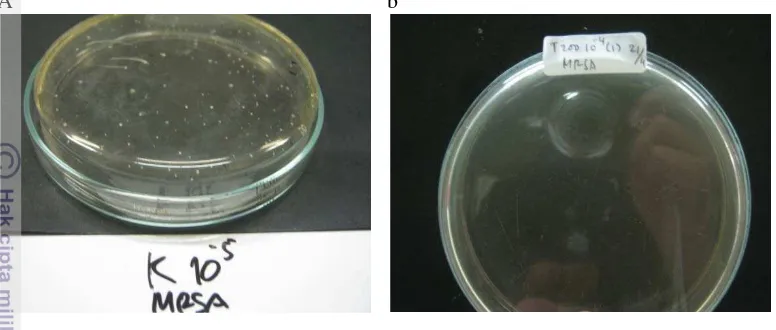
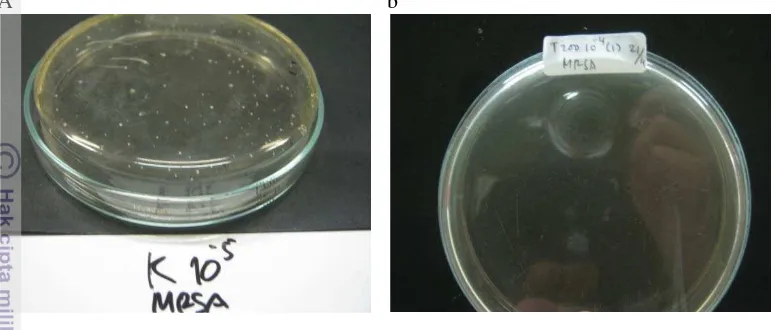
[image:40.595.115.503.132.297.2]A b
Gambar 2. Populasi total mikroflora saluran pencernaan pada; (a) perlakuan kontrol (tanpa antibiotik) pengenceran 10-5 dan (b) perlakuan yang diberi antibiotik tetrasiklin 200 ppm pengenceran 10-4
Dapat diamati pada Gambar 2, merupakan gambaran populasi total mikroflora saluran pencernaan ikan mas pada perlakuan pakan kontrol dan pakan dengan penambahan tetrasiklin 200 ppm dengan pengenceran yang berbeda. Pengenceran yang digunakan pada perlakuan kontrol adalah 10
pada media MRSA.
-5
, hal ini dikarenakan pengenceran 10-4 pada perlakuan kontrol >250 koloni. Perlakuan kontrol memiliki jumlah koloni tertinggi dibandingkan dengan perlakuan dengan penambahan jenis dan dosis antibiotik. Perlakuan pakan dengan penambahan tetrasiklin 200 ppm paling efektif menurunkan populasi total mikroflora saluran pencernaan, hal ini dibuktikan dengan pengenceran 10-4
Penurunan populasi mikroflora saluran pencernaan ikan mas berbanding lurus dengan persen kematian mikroflora (%) pada Tabel 5. Hasil analisis ragam menunjukkan terdapat interaksi antara faktor jenis antibiotik dan dosis (P<0,05) terhadap persen kematian mikroflora. Berdasarkan hasil analisis uji lanjut menunjukkan terdapat perbedaan nyata (P<0,05) pada masing-masing faktor jenis antibiotik (A) dan dosis (B) serta interaksi pada dua faktor jenis antibiotik x dosis (AxB).
26 Tabel 5 Persen kematian mikroflora saluran pencernaan ikan mas pada dua media
MRSA (%)
Antibiotik
Dosis
100 150 200 Rataan Antibiotik Streptomisin 29,9±2,1a 63,8±2,4b 74,1±1,7c 55,9±21,5α
Tetrasiklin 77,6±5,2c 81,4±2,4cd 87,8±0,5d 82,2±5,3 Ampisilin
β
68,9±3,5bc 78,5±3,8c 83,8±2,4cd 77,1±7,1 Rataan Dosis
β
58,8±22,9α 74,6±9,9β 81,9±6,3λ 77,1±7,1 Keterangan: Persen kematian mikroflora pada pakan kontrol sebesar 0,0%,
Angka yang diikuti huruf yang berbeda menunjukan perbedaan nyata (P<0,05) berdasarkan interaksi faktor jenis antibiotik x dosis (AxB),
Angka yang diikuti simbol yang berbeda menunjukan perbedaan nyata (P<0,05) berdasarkan masing-masing faktor jenis antibiotik (A) dan dosis (B).
Semakin tinggi dosis antibiotik yang diberikan pada media MRSA menunjukkan nilai persen kematian tertinggi. Perlakuan dengan antibiotik tetrasiklin 200 ppm pada media MRSA signifikan (P<0,05) memiliki nilai persen kematian mikroflora tertinggi 87,82%. Angka persen kematian ini senada dengan populasi mikroflora pada Tabel 4. Perlakuan tetrasiklin 200 ppm di media MRSA nyata (P<0,05) efektif menurunkan populasi total mikroflora dengan nilai terendah yaitu 5 Log cfu/ml.
4.1.2 Pembahasan
27 spektrum luas, berarti antibiotik efektif digunakan bagi banyak spesies bakteri, baik bentuk kokus, basil maupun spiril. Tetrasiklin efektif bagi kokus, basil dan jenis spiril tertentu, oleh karena itu tetrasiklin tergolong antibiotik berspektrum luas. Antibiotik dapat dikatakan bakterisidal bila bersifat mematikan, bukan hanya menghambat pertumbuhan mikroba. Berkaitan dengan daya kerja antibiotik tetrasiklin, yang pertama dilakukan adalah, merusak dinding sel mikroflora dan mencegah sintesis dinding sel, selanjutnya mikroflora tidak akan mampu membelah diri dan populasi mikroflora akan menurun.
Media MRSA menunjukkan respon penurunan yang sangat ekstrim. Mikroflora saluran pencernaan ikan mas terdiri dari gram positif dan gram negatif. Media MRSA merupakan media yang biasa digunakan untuk screening mikroba dengan sensitivitas yang tinggi. Media MRSA sensitif mendeteksi bakteri asam laktat (BAL) khususnya jenis Bacillus sp (Pery et al. 2004). Pernyataan tersebut menjelaskan, bahwa pemberian tetrasiklin 200 ppm akan menurunkan bakteri gram positif saluran pencernaan yang bermanfaat bagi inang sepeti Bacillus sp. Mikroflora gram positif dapat bertahan hidup dalam saluran pencernaan inang, mempunyai waktu generasi yang pendek dan atau kemampuan kolonisasi pada permukaan usus. Sedangkan, penambahan tetrasiklin pada pakan dapat memusnahkan bakteri gram positif saluran pencernaan ikan mas, sehingga peluang tumbuh bakteri asam laktat menurun.
28 penelitian ini, bahwa dengan penambahan tetrasiklin 200 ppm dapat memusnahkan mikroflora saluran pencernaan yang bermanfaat bagi inang. Selanjutnya, antibiotik tetrasikln dengan dosis 200 ppm ditetapkan sebagai kontrol negatif untuk mengevaluasi kontribusi mikroflora terhadap efisiensi retensi protein dan pertumbuhan ikan mas.
4.2 Evaluasi kontribusi mikroflora saluran pencernaan ikan mas terhadap efisiensi retensi protein dan pertumbuhan
4.2.1 Hasil
Parameter kualitas air dapat diamati pada Tabel 6. Hasil kualitas air menunjukkan tidak terdapat perbedaan pada masing-masing perlakuan. Hal ini dikarenakan manajemen pemeliharaan yang dilakukan sesuai dengan kebutuhan ikan mas.
Tabel 6 Parameter kualitas air masing-masing perlakuan selama pemeliharaan
Perlakuan Kualitas Air
Temperatur (OC) pH DO (mg/L) NH3 (mg/L) P1 25,5-27,0 7,50-7,71 4,55-5,75 0,16-0,19 P2 25,5-27,0 7,71-7,89 5,25-7,00 0,12-0,14 P3 25,5-27,0 7,60-7,85 5,50-7,23 0,12-0,13 P4 25,5-27,0 7,60-7,89 5,55-7,23 0,12-0,13 Keterangan: P1= pakan dengan antibiotik tetrasiklin 200 ppm (kontrol negatif), P2 = pakan
basal tanpa antibiotik maupun prebiotik (kontrol positif), P3 = pakan dengan 2% Fermacto ® dan P4 = Pakan dengan 2% MOS. Oksigen terlarut dengan simbol DO (Dissolved oxygen).
Hasil penelitian untuk pertumbuhan pada Tabel 7, menunjukkan seluruh perlakuan tidak memberikan respon berbeda (P>0,05) pada parameter bobot akhir dan laju pertumbuhan spesifik. Pakan yang diberi tambahan prebiotik maupun antibiotik memberikan respon yang sama terhadap pertumbuhan. Uji sidik ragam tidak mampu menunjukkan efek perlakuan yang diberikan terhadap model pertumbuhan yang optimal, oleh karena itu parameter pertumbuhan dianalisis regresi untuk memperoleh model pertumbuhannya.
29 penambahan antibiotik tetrasiklin 200 ppm signifikan (P<0,05) mematikan hewan uji sebesar 35 %. Perlakuan pakan dengan penambahan 2% mananoligosakarida
(MOS) memiliki nilai persentase SR tertinggi 100%, yang berarti tidak terdapat hewan uji yang mati (0%) selama masa pemeliharaan.
Tabel 7 Parameter pertumbuhan untuk tiap perlakuan selama pemeliharaan Perlakuan Bobot (g) SGR
(%)
SR
Awal Akhir (%)
P1 18,59±2,85 31,60±5,40 1,98±0,56 65±1,45a
P2 17,06±2,56 31,06±3,50 2,09±0,26 90±0,13
P3
b
17,11±1,50 33,39±4,12 2,21±0,25 95±1,05 P4
b
17,51±2,35 33,96±3,18 2,20±0,15 100±0,01b Keterangan: Angka yang diikuti huruf berbeda pada kolom yang sama menunjukan perbedaan
nyata (P<0,05). P1= pakan dengan antibiotik tetrasiklin 200 ppm (kontrol negatif), P2 = pakan basal tanpa antibiotik maupun prebiotik (kontrol positif), P3 = pakan dengan 2% Fermacto ® dan P4 = Pakan dengan 2% MOS. Laju pertumbuhan spesifik (SGR), laju kelangsungan hidup (SR).
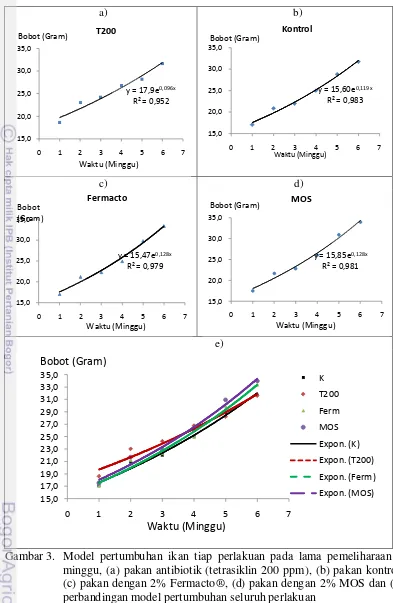
30
a) b)
c) d)
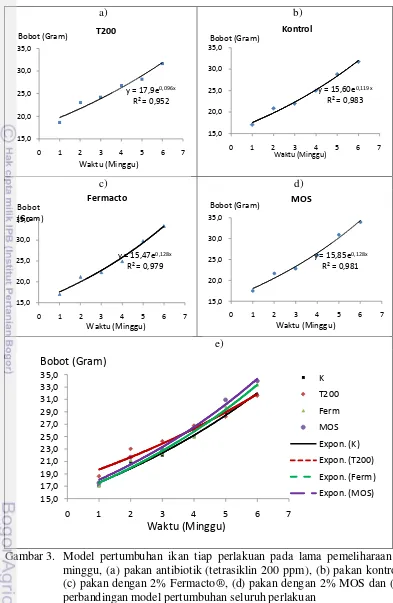
[image:45.595.109.502.79.682.2]e)
Gambar 3. Model pertumbuhan ikan tiap perlakuan pada lama pemeliharaan 7 minggu, (a) pakan antibiotik (tetrasiklin 200 ppm), (b) pakan kontrol, (c) pakan dengan 2% Fermacto®, (d) pakan dengan 2% MOS dan (e) perbandingan model pertumbuhan seluruh perlakuan
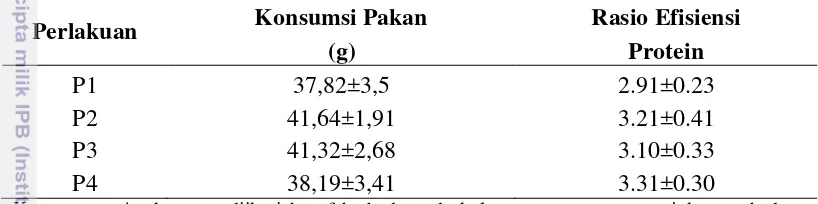
Parameter efisiensi pakan yang terdiri dari konsumsi pakan dan rasio efisiensi protein (PER) pada penelitian ini dapat diamati pada Tabel 8. Hasil uji
y = 17,9e0,096x
R² = 0,952
15,0 20,0 25,0 30,0 35,0
0 1 2 3 4 5 6 7
T200
Waktu (Minggu) Bobot (Gram)
y = 15,60e0,119x
R² = 0,983
15,0 20,0 25,0 30,0 35,0
0 1 2 3 4 5 6 7
Kontrol
Bobot (Gram)
Waktu (Minggu)
y = 15,47e0,128x
R² = 0,979
15,0 20,0 25,0 30,0 35,0
0 1 2 3 4 5 6 7
Fermacto
Waktu (Minggu) Bobot
(Gram)
y = 15,85e0,128x
R² = 0,981
15,0 20,0 25,0 30,0 35,0
0 1 2 3 4 5 6 7
MOS Bobot (Gram) Waktu (Minggu) 15,0 17,0 19,0 21,0 23,0 25,0 27,0 29,0 31,0 33,0 35,0
0 1 2 3 4 5 6 7
31 secara statistik menunjukkan perlakuan yang diberikan tidak memberikan perbedaan (P>0,05) pada tingkat konsumsi pakan (g) dan rasio efisiensi protein. Hal ini menunjukkan bahwa pakan uji yang diberikan dapat diterima oleh hewan uji, sehingga memberikan respon yang sama dengan kontrol. Parameter populasi total mikroflora [Log(cfu/ml)], efisensi retensi protein (ERP) (%) dan kontribusi mikroflora saluran pencernaan terhadap penambahan ERP dapat diamati pada Tabel 9.
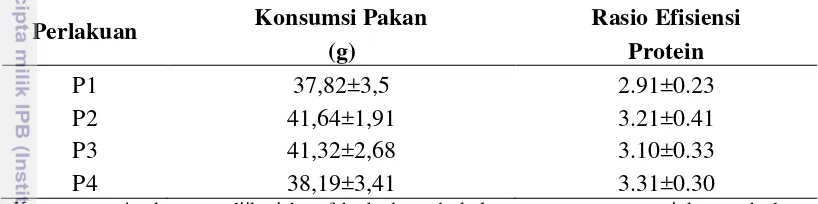
Tabel 8 Konsumsi pakan (g) dan rasio efisiensi protein pada tiap perlakuan Perlakuan Konsumsi Pakan Rasio Efisiensi
(g) Protein
P1 37,82±3,5 2.91±0.23
P2 41,64±1,91 3.21±0.41
P3 41,32±2,68 3.10±0.33
P4 38,19±3,41 3.31±0.30
Keterangan: Angka yang diikuti huruf berbeda pada kolom yang sama menunjukan perbedaan nyata (P<0,05). P1= pakan dengan antibiotik tetrasiklin 200 ppm (kontrol negatif), P2 = pakan basal tanpa antibiotik maupun prebiotik (kontrol positif), P3 = pakan dengan 2% Fermacto ® dan P4 = Pakan dengan 2% MOS.
32 Tabel 9 Populasi mikroflora saluran pencernaan, efisiensi retensi protein (ERP)
dan kontribusi mikroflora saluran pencernaan terhadap penambahan persentase ERP pada tiap perlakuan
Perlakuan
Populasi Mikroflora Efisiensi Retensi Penambahan [Log (cfu/ml)] Protein (%) ERP (%)
P1 5,00±0,63a 3,63±0,62a 0,00a
P2 7,30±0,35b 6,52±0,61b 2,89
P3
b
8,31±0,43c 7,14±0,71b 3,51
P4
b
8,35±0,75c 9,08±0,85c 5,45c
Keterangan: Angka yang diikuti huruf berbeda pada kolom yang sama menunjukan perbedaan nyata (P<0,05). P1= pakan dengan antibiotik tetrasiklin 200 ppm (kontrol negatif), P2 = pakan basal tanpa antibiotik maupun prebiotik (kontrol positif), P3 = pakan dengan 2% Fermacto ® dan P4 = Pakan dengan 2% MOS.
Hasil kontribusi mikroflora pada pakan dengan penambahan prebiotik 2% Fermacto ® sebesar 3,51% dan dengan penambahan 2% prebiotik MOS sebesar 5,45%.
4.2.2 Pembahasan
Parameter kualitas air temperatur (0C), pH, oksigen terlarut dan amoniak selama pemeliharaan untuk masing-masing perlakuan masih dalam ambang batas syarat budidaya ikan mas. Syarat kualitas air minimal pada kolam air tenang menurut SNI (1999) yang dibutuhkan ikan mas yaitu temperatur 25-300
Kontribusi mikroflora saluran pencernaan terhadap efisiensi retensi protein dan pertumbuhan memiliki beberapa parameter yang diamati antara lain, pertumbuhan, konsumsi pakan, rasio efisiensi protein, efisiensi retensi protein dan kontribusi mikroflora terhadap sumbangan protein untuk pertumbuhan. Parameter pertumbuhan dapat diamati pada Tabel 6. Bobot akhir, pertumbuhan total dan laju pertumbuhan spesifik (SGR) tidak memberikan respon berbeda dengan pakan kontrol. Hal ini menunjukkan bahwa pakan yang diberi tambahan prebiotik maupun antibiotik memberikan respon yang sama terhadap pertumbuhan. Laju kelangsungan hidup survival rate (SR) memberikan perbedaan (P<0,05). Persentase SR dengan penambahan antibiotik tetrasiklin 200 ppm signifikan (P<0,05) mematikan hewan uji sebesar 35 %. Sedangkan perlakuan pakan dengan penambahan 2% mananoligosakarida (MOS) memiliki nilai persentase SR
33 tertinggi 100%, yang berarti tidak terdapat hewan uji yang mati (0%) selama masa pemeliharaan. Hasil penelitian ini mendukung pernyataan Gatesoupe (2005) yang menyatakan bahwa, prebiotik merupakan substrat yang tidak dapat di cerna yang sangat bermanfaat untuk mikroflora saluran cerna dan secara selektif memacu pertumbuhan, mengaktifkan metabolisme serat, meningkatkan kesehatan tubuh inang maupun mikroflora dan menjaga keseimbangan mikroflora. Menurut Hui-yuan et al. (2007) dengan pemberian prebiotik, baik FOS (Fructooligosakarida), GOS (Galaktooligosakarida) atau MOS (Mananoligosakarida) dapat menurunkan konsentrasi amoniak pada feses. Terbukti pada kualitas air selama penelitian mengandung konsentrasi NH3
Analisis regeresi yang diperoleh untuk pola pertumbuhan masing-masing perlakuan sesuai dengan teori Muller-Feuga, (1990) yang menyatakan bahwa kurva pertumbuhan terhadap lama pemeliharaan yang sebenarnya hanya fungsi eksponensial dalam kurun waktu tertentu, (fase larva-juvenile atau juvenile-pembesaran). Penambahan prebiotik dalam pakan dapat meningkatkan kesehatan dan keseimbangan mikroflora inang, sehingga dapat memacu pertumbuhan, (Gibson, et al. 2004). Penelitian ini menggunakan bobot awal ikan 15-20g, sehingga fase yang dialami hewan uji merupakan fase juvenile-pembesaran.
sebesar 0,12-0,16 mg/L.
Perlakuan pakan dengan penambahan prebiotik Fermacto® dan 2%MOS menunjukkan populasi mikroflora paling tinggi dibandingkan perlakuan antibiotik dan kontrol. Hasil efisiensi retensi protein pada perlakuan dengan prebiotik menunjukkan nilai lebih tinggi dibandingkan perlakuan pakan kontrol dan pakan antibiotik. Menurut Aslamiyah (2006), menyatakan bahwa pada ikan bandeng yang diberi perlakuan pakan dengan penambahan antibiotik dan tanpa antibiotik menujukkan perbedaan populasi mikroflora proteolitik dan aktivitas enzim protease. Penurunan populasi mikroflora proteolitik akibat penambahan antibiotik pada pakan mencapai 99,92% dengan penurunan aktivitas enzim protease mencapai 36,12%. Pernyataan tersebut menunjukkan bahwa mikroflora saluran pencernaan berperan terhadap aktivitas enzim. Semakin tinggi populasi mikroflora, akan semakin tinggi aktivitas enzim.
34 pada umbi-umbian dan dinding sel hewan dan dapat mendeteks