SKRIPSI
PENGEMBANGAN EDIBLE FILM KOMPOSIT PEKTIN/KITOSAN DENGAN POLIETILEN GLIKOL (PEG) SEBAGAI PLASTICIZER
Oleh :
FENNY SUPRIOTO F24061488
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
SKRIPSI
PENGEMBANGAN EDIBLE FILM KOMPOSIT PEKTIN/KITOSAN DENGAN POLIETILEN GLIKOL (PEG) SEBAGAI PLASTICIZER
Oleh :
FENNY SUPRIOTO F24061488
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
2010
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Judul Skripsi : Pengembangan Edible Film Komposit Pektin/Kitosan dengan Polietilen Glikol (PEG) sebagai Plasticizer
Nama : Fenny Suprioto
NIM : F24061488
Menyetujui
Bogor, 2 September 2010
Pembimbing Akademik,
(Dr. Nugraha Edhi Suyatma, STP, DEA) NIP: 19701220.199512.1.001
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Pangan
(Dr. Ir. Dahrul Syah) NIP: 19650814. 199002. 1. 001
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 03 September 1988 dan merupakan anak ke empat dari lima bersaudara pasangan Hoover Suprioto dan Lina Setiawan. Penulis menyelesaikan pendidikan dasar pada tahun 2000 di SD Dharma Buddhi Bhakti, Jakarta, kemudian melanjutkan pendidikan menengah pertama di SLTP Dharma Buddhi Bhakti, Jakarta, hingga tahun 2003, dan menamatkan pendidikan menengah atas di SMAK IPEKA Sunter, Jakarta, pada tahun 2006. Penulis melanjutkan pendidikan tinggi di Institut Pertanian Bogor, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian melalui jalur SPMB pada tahun 2006.
Development of Pectin/Chitosan Composite Edible Film with
Polyethylene Glycol (PEG) as Plasticizer
Fenny Suprioto1, Nugraha E. Suyatma2 1, 2
Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor, Kampus IPB Darmaga Bogor 16002, Indonesia.
Abstract
Interest in maintaining food quality while reducing packaging waste has encouraged further research on edible films. Considerable attention has been given to pectin because it is widely available from underutilized agricultural waste material and is readily modified through demethylation to form excellent films. The scope of composite films made from pectin and other polysaccharides was widened to include chitosan for several reasons.
The aims of this study were to prepare homogenous pectin/chitosan composite edible films, characterize and investigate the effect of different pectin to chitosan ratio on film properties. Pectin/chitosan composite edible film with PEG (10%) as plasticizer was prepared by solution casting method in this study. Five pectin to chitosan ratios (100:0, 75:25, 50:50, 25:75, 0:100) were used. The prepared films were characterized in terms of physicochemical and mechanical properties. Result showed that as chitosan content in composite edible film increased; pH, yellowish color, film thickness, and elongation percentage increased, while tensile strength and water vapor transmission rate decreased. PEG addition as plasticizer in edible film increased film thickness, elongation percentage, and water vapor transmission rate, whereas water activity of the plasticized film decreased.
Fenny Suprioto. F24061488. Pengembangan Edible Film Komposit Pektin/Kitosan dengan Polietilen Glikol sebagai Plasticizer. Dibawah bimbingan Dr. Nugraha Edhi Suyatma, STP, DEA.
RINGKASAN
Perhatian pemerintah dan masyarakat untuk mengurangi limbah pengemas pangan serta permintaan konsumen yang terus meningkat terhadap kualitas, kemudahan, dan keamanan pangan mendorong dilakukannya penelitian lebih lanjut mengenai kemasan edible. Pektin sering digunakan sebagai bahan baku kemasan edible karena banyak terdapat pada bahan limbah pertanian yang tidak termanfaatkan lagi dan dapat dimodifikasi melalui demetilasi guna memperoleh kemampuan membentuk film yang baik. Lingkup pembuatan kemasan edible dari komposit pektin dengan polisakarida lainnya meluas mencakup kitosan untuk beberapa alasan.
Penelitian ini bertujuan untuk menghasilkan kemasan edible yang homogen dari komposit pektin/kitosan, mengkarakterisasi kemasan edible komposit pektin/kitosan, dan mempelajari pengaruh perbandingan komposisi pektin/kitosan dan penggunaan PEG terhadap karakteristik kemasan edible yang dihasilkan. Lima perbandingan komposisi pektin/kitosan yang digunakan yaitu 100:0, 75:25, 50:50, 25:75, dan 0:100, sedangkan PEG yang digunakan sebesar 10% dari total berat padatan. Analisis yang dilakukan meliputi sifat fisikokimia dan sifat mekanik, dengan parameter yang diujikan yaitu pH larutan edible, warna, aktivitas air, ketebalan, nilai kuat tarik dan persen pemanjangan, serta aktivitas antimikroba film. Selain itu dilakukan juga analisis terhadap edible film yang dihasilkan dengan DSC, XRD, dan FTIR.
Edible film yang dihasilkan memiliki pH yang berkisar antara 2,02 - 3,36, berwarna transparan hingga kekuningan, nilai aw yang berkisar 0,63 - 0,70, ketebalan
film berkisar 41,7 - 118,3 µm, nilai kuat tarik 5,3 - 35,4 MPa, persen pemanjangan 28,3 - 97,9%, laju transmisi uap air berkisar 27,9 - 442, 7 g/m²/24 jam, aktivitas antimikroba dengan diameter penghambatan terhadap Escherichia coli 1,31 - 1,47 cm, dan diameter penghambatan terhadap Bacillus cereus 1,76 - 2,51 cm. Suhu transisi gelas dari edible film yang dihasilkan tidak dapat diamati dengan analisis menggunakan DSC. Dari hasil analisis dengan XRD terlihat bahwa edible film komposit pektin/kitosan memiliki struktur semikristalin. Analisis film menggunakan FTIR menunjukkan adanya interaksi antara pektin dan kitosan dalam film komposit.
Semakin tinggi komposisi kitosan dalam film komposit maka pH, warna kekuningan, ketebalan, dan persen pemanjangan film semakin meningkat, sedangkan kuat tarik dan laju transmisi uap air film menurun. Penambahan PEG sebagai plasticizer dalam edible film menurunkan nilai aw, meningkatkan ketebalan film,
KATA PENGANTAR
Puji dan syukur yang tak terhingga penulis haturkan ke hadirat TRI RATNA yang telah melimpahkan bimbingan dan perlindungan-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penyusunan skripsi, yang berjudul “PENGEMBANGAN EDIBLE FILM KOMPOSIT PEKTIN/KITOSAN DENGAN POLIETILEN GLIKOL (PEG) SEBAGAI PLASTICIZER” ini didasarkan pada pelaksanaan penelitian yang telah dilaksanakan sejak Januari 2010 sampai Juli 2010 di Laboratorium Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada:
1. Papa Hoover Suprioto dan Mami Lina Setiawan, yang tiada henti-hentinya
memberikan kasih sayang, doa, nasihat, dan dukungan moril maupun materi kepada penulis.
2. Almh. Mama Nancy Mantik yang telah menunjukkan betapa berharganya
sebuah kehidupan kepada penulis, dan mengajari penulis untuk belajar hidup mandiri.
3. Bapak Dr. Nugraha Edhi Suyatma, STP, DEA selaku dosen pembimbing yang selalu menyediakan waktu di tengah-tengah kesibukannya memberikan saran, arahan, dan bimbingan yang sangat berarti kepada penulis.
4. Bapak Ir. Arif Hartoyo, M.Si dan Bapak Faleh Setiabudi, ST, MT atas waktu dan kesediannya sebagai dosen penguji pada sidang skripsi penulis.
5. Ibu Elvira Syamsir, STP, M.Si, Ibu Dr. Ir. C. Hanny Wijaya, M.Agr, Ibu Dr. Dra Suliantari M.S, dan Ibu Dr. Ir. Nuri Andarwulan, M.Si. Terima kasih atas bimbingan dan konsultasi yang diberikan selama penulis menjalani penelitian dan menyusun skripsi.
7. Antony Demas tersayang, yang selama ini selalu bersabar menghadapi semua sifat buruk dan ego penulis, yang selalu memotivasi dan menyayangi penulis dengan tulus.
8. Sofian Suprioto, Jimmy Suprioto, Albert Setiawan, dan William Suprioto, atas nasehat, kepedulian, dan hiburan yang diberikan kepada penulis.
9. Arini Handayani, sebagai teman yang telah menjalankan penelitian satu proyek bersama, atas kerja keras dan dukungan yang diberikan kepada penulis.
10. Sahabat-sahabat terbaik penulis di Perwira 99, Puri Riveria: Feriana Chandra, Margaret Octavia, Yurina Haryanti, Limas Agung, Ivan Suwandi, Deni Setiawan, Suhendri, Glenn Chandra, Kenchi Tantra, Handika Gani, Dial Sugianto, Martin Dwiko, Henricus Ramadhani, Stevanus Budi Santoso, Loisa, Rheiner Sukarya, Goto Giok, Steffany Dharmawan, Ferry Rianto, Irsha, dan semua penghuni lainnya yang telah memberi dukungan, hiburan, dan kehangatan kepada penulis layaknya keluarga.
11. Sahabat terbaik penulis sejak IPEKA Sunter hingga ITP 43: Syenny Ihsan,
Richie Rich, Stephanie Gabriela Handy, Yoanna Anggraini Wiryadi, yang memberikan keberanian kepada penulis untuk akhirnya memutuskan berkuliah bersama di kampus tercinta ini, terima kasih atas dukungan, kebersamaan, dan kepedulian yang diberikan kepada penulis.
12. Sahabat-sahabat terbaik penulis di ITP 43: Erinna Nidya Wijaya, Stephanie, Leonardus Stefanus, Felicia, Dyas, Daisy Natalia, Nina Ivana, Stella Darmadi, Jessica, Dessyana, Prima, Federika, Safiera Karleen, Mario Wibowo, Septi, Sandra Mariska, Riza Albarn, Wonojatun, Manik Kharda, Anto, Rijali Aroni, Helena Suri, Dhimas, Yohanes Zega, dan teman-teman ITP 43 yang tidak dapat disebutkan satu persatu. Terimakasih atas dukungan, doa, kebersamaan, dan nasehatnya.
teman-teman KMB yang tidak dapat disebutkan satu persatu. Terima kasih atas dukungan, kehangatan, dan motivasi kalian selama ini.
14. Kakak-kakak ITP 42 dan IPN: Leonardus Adi Wijaya, Marcel Segara, Irene, Eveline, Teresia, Stella, Yusi, Catherine Haryasyah, Diana Lo, Belinda, Cha Cha, Kalista, Esther, Tuthie, Midun, Sina, Nono, Alina, Meivie Lintang, Mutiara, Anas, Dito. Terima kasih atas bantuan, motivasi, saran, dan bimbingannya selama penelitian dan saat pengolahan data
15. Sahabat-sahabat terbaik penulis di Jakarta: Christina Agustin, Stephanie Rosanto, Fransisca Tania, Vina Stephanie, Kenny Shibaura, Rudi, Ciputra, Andreas, Maria Gunawan, Cynthia, dan seluruh alumni IPEKA Sunter. Terima kasih atas dukungan dan motivasinya.
16. Pak Wahid, Pak Gatot, Pak Yahya, Pak Rojak, Bu Antin, Bu Rubiah, Pak Sobirin, Mbak Ari, Bu Sari, Mas Edi, Mas Aldi, dan teknisi lainnya. Terimakasih atas bantuannya, bimbingannya, masukkan, dan nasehat yang diberikan kepada penulis selama di melaksanakan penelitian.
17. Bapak dan Ibu di PITP, yang selalu melayani penulis dengan senang hati
mencari skripsi, buku, artikel, jurnal, dan fotokopi semua bahan-bahan tersebut untuk kepentingan penulisan skripsi ini.
18. Para staf di UPT ITP: Bu Novi, Mbak Ani, Bu kokom, dan Bu Sofi. Terima
kasih atas kesediaannya membantu penulis dalam menyelesaikan masalah birokrasi dan administrasi.
Penulis sangat mengharapkan kritik dan saran yang membangun dari berbagai pihak untuk memperbaiki dan menyempurnakan penulisan skripsi ini. Penulis juga berharap semoga skripsi ini dapat berguna dan bermanfaat bagi semua pihak.
Bogor, Agustus 2010
DAFTAR ISI
Halaman
RINGKASAN ... i
KATA PENGANTAR ... ii
RIWAYAT HIDUP ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 2
II. TINJAUAN PUSTAKA ... 3
A. KEMASAN EDIBLE ... 3
B. PEKTIN ... 6
C. KITOSAN ... 8
D. PEMBENTUKAN EDIBLE FILM KOMPOSIT PEKTIN/KITOSAN ... 10
E. PLASTICIZER ... 12
III. BAHAN DAN METODOLOGI ... 15
A. BAHAN DAN ALAT ... 15
B. METODE PENELITIAN ... 15
1. Pembuatan Edible Film ... 15
2. Karakterisasi Film Komposit Pektin/Kitosan ... 17
IV. HASIL DAN PEMBAHASAN ... 24
A. PEMBUATAN EDIBLE FILM ... 24
B. KARAKTERISASI FILM KOMPOSIT PEKTIN/KITOSAN ... 27
1. Pengukuran Warna dengan Chromameter ... 27
2. Pengukuran Aktivitas Air (aw) ... 30
DAFTAR TABEL
DAFTAR GAMBAR
Halaman Gambar 1. Transfer yang berpotensi untuk dikontrol oleh kemasan edible . 5 Gambar 2. Segmen berulang dari molekul pektin dan grup fungsional (a):
karboksil (b), ester (c), amida dalam rantai pektin (d) ... 6
Gambar 3. Diagram skematik percabangan rantai pektin, S = gula netral ... 7
Gambar 4. Perbandingan struktur kimia kitin (a) dan kitosan (b) ... 9
Gambar 5. Pembentukan edible film komposit ... 11
Gambar 6. Mekanisme plastifikasi tingkat molekuler ... 14
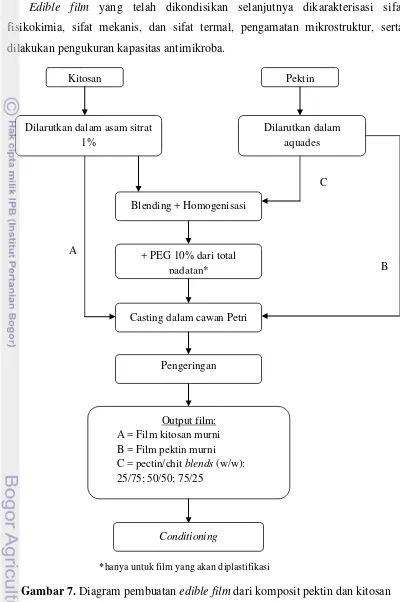
Gambar 7. Diagram pembuatan edible film dari komposit pektin dan kitosan ... 17
Gambar 8. Pengukuran nilai aw Edible film ... 18
Gambar 9. Pengukuran kuat tarik dan persentase pemanjangan edible film ... 19
Gambar 10. Pengukuran laju transmisi uap air metode gravimetri: (a) kontrol dan (b) edible film ... 20
Gambar 11. Diagram alir persiapan kultur uji ... 21
Gambar 12. Diagram alir metode cakram ... 22
Gambar 13. Grafik nilai pH larutan komposit pektin/kitosan ... 25
Gambar 14. Proses pelepasan film yang telah terbentuk dari cawan ... 26
Gambar 15. Grafik pengukuran nilai L edible film komposit pektin/kitosan . 27 Gambar 16. Grafik pengukuran nilai a edible film komposit pektin/kitosan .. 28
Gambar 17. Grafik pengukuran nilai b edible film komposit pektin/kitosan . 29 Gambar 18. Grafik pengukuran aw edible film ... 31
Gambar 19. Grafik pengukuran ketebalan edible film ... 32
Gambar 20. Grafik pengukuran nilai kuat tarik edible film ... 33
Gambar 21. Grafik pengukuran persentase pemanjangan film ... 34
Gambar 22. Efek perubahan fase pada transfer massa ... 36
Gambar 23. Grafik pengukuran laju transmisi uap air edible film ... 37
DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil Analisis Sidik Ragam terhadap Nilai pH
Larutan Edible ... 56 Lampiran 2. Hasil Analisis Sidik Ragam terhadap Nilai L Edible Film .... 57 Lampiran 3. Hasil Analisis Sidik Ragam terhadap Nilai a Edible Film ... 59 Lampiran 4. Hasil Analisis Sidik Ragam terhadap Nilai b Edible Film ... 60 Lampiran 5. Hasil Analisis Sidik Ragam terhadap aw Edible Film ... 62
Lampiran 6. Hasil Analisis Sidik Ragam terhadap Ketebalan
Edible Film ... 63 Lampiran 7. Hasil Analisis Sidik Ragam terhadap Kuat Tarik (TS)
Edible Film ... 64 Lampiran 8. Hasil Analisis Sidik Ragam terhadap Persen Elongasi
Edible Film ... 66 Lampiran 9. Hasil Analisis Sidik Ragam terhadap Laju Transmisi
Uap Air (WVTR) Edible Film ... 68 Lampiran 10. Hasil Analisis Sidik Ragam terhadap Diameter
Penghambatan Edible Film terhadap Escherichia coli ... 70 Lampiran 11. Hasil Analisis Sidik Ragam terhadap Diameter
Gambar 25. Daerah penghambatan edible film komposit pektin/kitosan
terhadap: (a) Escherichia coli dan (b) Bacillus cereus ... 39
Gambar 26. Grafik hasil pengamatan kapasitas antimikroba edible film komposit pektin/kitosan (D = 1 cm) terhadap Escherichia coli dan Bacillus cereus ... 40
Gambar 27. Representasi skematik sistem DSC ... 42
Gambar 28. Kurva hasil analisis termal sampel dengan DSC ... 44
Gambar 29. Hasil analisis sampel dengan difraksi sinar-X ... 47
4. Pengukuran Kuat Tarik dan Persentase Pemanjangan ... 32
5. Laju Transmisi Uap Air Metode Gravimetri... 35
6. Pengujian Aktivitas Antimikroba... 38
7. Analisis dengan Differential Scanning Calorimeter (DSC) ... 42
8. Analisis dengan X-ray Diffraction ... 45
9. Analisis dengan FTIR Spectroscopy ... 48
V. KESIMPULAN DAN SARAN ... 50
DAFTAR PUSTAKA ... 51
I. PENDAHULUAN
A. LATAR BELAKANG
Peningkatan jumlah penduduk ditambah dengan penggunaan sumber daya alam dan energi secara besar-besaran mengakibatkan terciptanya sampah yang menumpuk dalam jumlah sangat besar. Sebagian besar dari sampah tersebut merupakan limbah kemasan pangan (food package waste) yang umumnya terbuat dari material yang tidak dapat terurai secara biologis (non-biodegradable), yaitu berupa plastik dan laminat.
Sepanjang daur hidup kemasan pangan, dari pembuatannya hingga menjadi limbah, memberikan dampak terhadap lingkungan yang tidak sedikit. Dampak keseluruhan (resultant impacts) proses pembuatan, penggunaan dan pembuangan bahan pengemas mencakup konsumsi energi, emisi gas-gas yang menyebabkan rumah kaca, dan deplesi sumber daya alam. Pembuangan limbah kemasan pangan secara bebas ke lingkungan maupun penimbunan terpusat di Tempat Pembuangan Akhir (TPA) serta proses insenerasi akan menimbulkan pencemaran, meskipun dalam aras yang berbeda (Widianarko, 2010).
Perhatian pemerintah dan masyarakat untuk mengurangi limbah pengemas pangan serta permintaan konsumen yang terus meningkat terhadap kualitas, kemudahan, dan keamanan pangan mendorong dilakukannya penelitian lebih lanjut mengenai kemasan edible. Kemasan edible memiliki potensi untuk mengurangi kompleksitas kemasan (Melia, 1997) sehingga dapat mengurangi limbah pengemas pangan jika digunakan dalam industri. Kemasan edible tersebut juga dapat menggantikan beberapa jenis material kemasan sintetis yang digunakan untuk mengawetkan dan melindungi makanan (Schou et al., 2004).
selulosa (Tuil et al., 2000),dan tersedia secara komersial dari sumber yang dapat diperbaharui. Kedua, kitosan memiliki kemampuan membentuk film yang baik, bersifat edible, biodegradable, biocompatible, dan mempunyai kapasitas sebagai anti bakteri dan anti kapang (Tsai et al., 2000; Coma et al., 2003). Ketiga, kitosan dapat berinteraksi secara elektrostatis dengan pektin yang telah mengalami demetilasi parsial.
Hingga saat ini aplikasi kemasan edible berbahan dasar pektin dan kitosan dalam bidang pangan masih terbatas pada aplikasi secara multilayer. Dalam penggunaan metode multilayer ini diperlukan beberapa langkah sehingga waktu pembuatannya lebih lama, pelarut yang digunakan lebih banyak, dan penanganannya lebih sulit (Perez-Gago dan Krochta, 2005). Pembentukan kemasan edible secara langsung dari komposit pektin/kitosan dengan sistem emulsi diharapkan dapat menghasilkan film dengan sifat yang lebih baik dibandingkan dengan film yang dihasilkan dengan metode multilayer.
Penelitian ini bertujuan untuk menghasilkan kemasan edible yang homogen dari komposit pektin/kitosan, mengkarakterisasi, dan mempelajari pengaruh perbandingan komposisi pektin/kitosan terhadap karakteristik kemasan edible yang dihasilkan.
B. TUJUAN PENELITIAN
1. Menghasilkan kemasan edible yang homogen dari komposit pektin/kitosan.
2. Mengkarakterisasi kemasan edible komposit pektin/kitosan.
3. Mempelajari pengaruh perbandingan komposisi pektin/kitosan dan penggunaan PEG terhadap karakteristik kemasan edible yang dihasilkan.
C. MANFAAT PENELITIAN
II.TINJAUAN PUSTAKA
A. KEMASAN EDIBLE
Kemasan edible didefinisikan sebagai bermacam bahan yang digunakan untuk menutupi (coating atau wrapping) makanan, dapat dimakan bersama dengan makanan tersebut, dan bertujuan untuk memperpanjang umur simpan produk (Pavlath dan Orts, 2009). Menurut Krochta (1992), kemasan edibel adalah suatu lapisan tipis yang dibuat dari bahan yang dapat dimakan, dibentuk di atas komponen makanan (coating) atau diletakkan di antara komponen makanan (film) dan dapat berfungsi sebagai penahan (barrier) perpindahan massa (seperti kelembaban, oksigen, lipida, zat terlarut) dan atau sebagai pembawa (carrier) bahan tambahan makanan seperti bahan pengawet untuk meningkatkan kualitas dan umur simpan makanan. Film dan coating dibedakan berdasarkan konsep bahwa coating diaplikasikan dan dibentuk langsung di atas permukaan makanan, sedangkan film merupakan struktur yang diaplikasikan pada makanan setelah dibentuk secara terpisah (Gontard dan Guilbert, 1994).
Edible film banyak mendapat perhatian karena beberapa keunggulannya dibanding kemasan sintetis. Keunggulan utama edible film terhadap kemasan sintetis tradisional adalah edible film dapat dikonsumsi bersamaan dengan produk yang dikemas. Tidak ada kemasan yang dibuang, dan meskipun tidak dikonsumsi edible film tetap berkontribusi dalam mereduksi pencemaran lingkungan. Proses produksi edible film menghasilkan lebih sedikit limbah dan polusi. Selain itu, edible film secara eksklusif dibuat dari bahan yang dapat diperbaharui, bersifat edible, dan lebih mudah terdegradasi dibanding material polimer (Bourtoom, 2008).
memberikan stabilitas mekanis. Materi tersebut dapat dimanfaatkan secara individual atau sebagai komposit untuk membentuk film dengan sifat yang diinginkan.
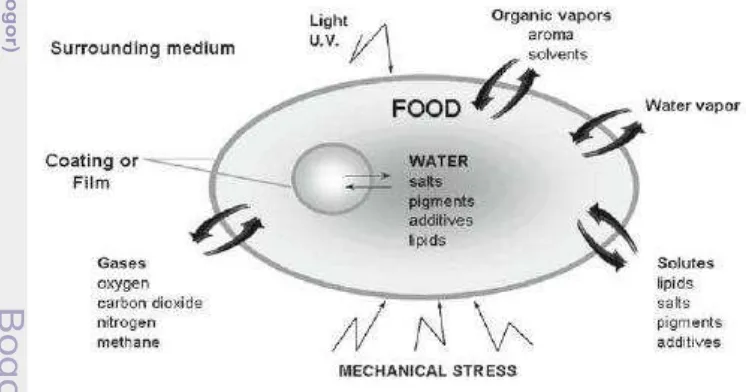
Edible film harus memenuhi beberapa persyaratan fungsional spesifik seperti barrier terhadap kelembaban, padatan, dan/atau gas, solubilitas dalam air atau lemak, warna dan penampakan, karakteristik mekanis dan rheologi, keamanan, dan sebagainya. Sifat fungsional tersebut dipengaruhi oleh beberapa faktor, yaitu material yang digunakan, pembentukan film, dan pengaplikasian film. Berbagai tujuan fungsional penggunaan edible film tertera pada Tabel 1, sedangkan ilustrasi transfer yang dapat dikontrol dengan edible film ditunjukkan pada Gambar 1.
Tabel 1. Tujuan Penggunaan Edible Film (Donhowe dan Fennema, 1994)
Penggunaan Materi yang sesuai
Menghambat migrasi kelembaban Lipid, komposit Menghambat migrasi gas Hidrokoloid, komposit Menghambat migrasi minyak/lemak Hidrokoloid
Menghambat migrasi padatan Hidrokoloid, lipid, atau komposit Meningkatkan integritas struktural atau
kemudahan penanganan
Hidrokoloid, lipid, atau komposit
Mempertahankan komponen flavor yang bersifat volatil
Hidrokoloid, lipid, atau komposit
Membawa bahan tambahan pangan Hidrokoloid, lipid, atau komposit
Menurut Pavlath dan Orts (2009), edible film yang ideal harus memiliki karakteristik sebagai berikut:
Tidak mengandung senyawa berbahaya, komponen yang menimbulkan alergi dan yang tidak dapat dicerna
Memberikan kestabilan struktural dan mencegah kerusakan mekanis selama
transportasi, penanganan, dan penjualan
Memiliki kemampuan adhesi yang baik dan seragam pada permukaan makanan
yang dilindungi
Mengkontrol migrasi air baik masuk maupun keluar dari makanan yang
Memberikan sifat semi permeable untuk menjaga equilibrium internal gas
yang terlibat dalam respirasi aerobik dan anaerobik, sehingga menghambat senescense
Mencegah kehilangan komponen yang menstabilkan aroma, flavor, nutrisi, dan karakteristik organoleptik yang penting bagi penerimaan konsumen, dan tidak mempengaruhi rasa atau penampakan
Memberikan kestabilan biokimia dan mikrobial permukaan sekaligus
melindungi dari kontaminan, infestasi serangga, proliferasi mikroba, dan kerusakan lainnya
Menjaga dan meningkatkan nilai estetik dan atribut sensori (penampakan, rasa, dan lainnya) dari produk
Berfungsi sebagai pembawa bahan tambahan yang diinginkan seperti flavor,
aroma, pewarna, nutrisi, dan vitamin. Penambahan antioksidan dan agen antimikroba dapat dibatasi pada permukaan dengan penggunaan edible film sehingga meminimalkan biaya dan perubahan rasa
Mudah diproduksi dan terjangkau secara ekonomi
Gambar 1. Transfer yang berpotensi untuk dikontrol oleh kemasan edible (Debeaufort dan Voilley, 2009)
B. PEKTIN
Pektin adalah gabungan kompleks polisakarida yang menyusun sepertiga bagian dari substansi dinding sel tanaman tingkat tinggi. Proporsi pektin yang lebih rendah ditemukan dalam rerumputan. Pektin terkonsentrasi dalam lamela tengah dinding sel, dan jumlahnya semakin menurun pada dinding sel yang berbatasan dengan membran plasma. Pektin sering digunakan sebagai bahan baku kemasan edible karena banyak terdapat pada bahan limbah pertanian yang tidak termanfaatkan lagi dan dapat dimodifikasi melalui demetilasi guna memperoleh kemampuan membentuk film yang baik.
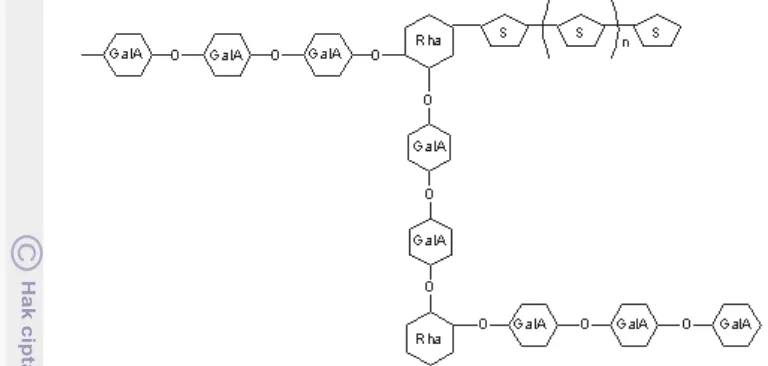
Seperti kebanyakan polisakarida lainnya, pektin bersifat polidispersi dan polimolekular, komposisinya bervariasi tergantung sumber dan kondisi yang diterapkan pada saat isolasi. Pektin secara utama tersusun oleh unit asam D-galakturonat (GalA) dengan ikatan a-(1-4) glikosidik. Asam uronat ini memiliki grup karboksil, beberapa di antaranya secara natural berada dalam bentuk metil ester dan sisanya yang telah mengalami modifikasi dengan amonia menjadi grup karboksamide. Susunan rantai molekul pektin dapat dilihat pada Gambar 2
(Sriamornsak, 2003).
Gambar 2. Segmen berulang dari molekul pektin dan grup fungsional (a): karboksil (b), ester (c), amida dalam rantai pektin (d) (Sriamornsak, 2003)
Gambar 3. Diagram skematik percabangan rantai pektin, S = gula netral
(Sriamornsak, 2003)
Pektin diklasifikasi berdasarkan derajat esterifikasinya (DE). Jika derajat esterifikasi (DE) pektin lebih besar dari 50% maka pektin dikategorikan ke dalam derajat esterifikasi tinggi (high methoxyl pectin), sedangkan bila derajat esterifikasinya kurang dari 50% diklasifikasikan ke dalam derajat esterifikasi rendah (low methoxyl pectin). Kisaran nilai DE untuk pektin HM komersial adalah 60 -75% dan untuk pektin LM berkisar antara 20 - 40%. Karena kemampuan pektin untuk membentuk gel bergantung pada ukuran molekul dan derajat esterifikasi, pektin yang berasal dari sumber yang berbeda memiliki kemampuan membentuk gel yang berbeda pula.
Untuk pembentukan gel, pektin HM membutuhkan pH di bawah 3,5 dengan kisaran optimum 2,8-3,0 dan keberadaan padatan gula 60-65%, pemanasan juga diperlukan untuk sepenuhnya menghidrasi dan mengaktivasi molekul pektin. Pengaturan pH diperlukan untuk protonasi unit asam galakturonat yang tidak teresterifikasi untuk mengurangi muatan negatif dan penolakan antar sesama molekul pektin. Kombinasi konsentrasi gula yang tinggi dan protonasi atau penetralan muatan negatif pada grup asam galakturonat menyebabkan asosiasi intermolekular dari rantai polimer melalui ikatan hidrogen, menghasilkan pembentukan gel. Pektin LM konvensional membutuhkan penambahan kalsium, gula berkisar 20-55% dan pH antara 3,0-5,0 untuk membentuk gel. Pembentukan gel pektin LM dengan jembatan kalsium di antara dua rantai heliks, membentuk struktur yang disebut dengan ‘egg-box’ junction zone. Dibutuhkan minimal 14-20 residu asam galakturonat untuk membentuk junction zone. Kekuatan gel meningkat seiring peningkatan Ca2+, tetapi menurun dengan meningkatnya suhu dan keasaman atau penurunan pH di bawah 3,0. Pektin yang diamidasi, sebaliknya, hanya membutuhkan sumber kalsium dan pengaturan pH. Pektin amida ini dapat membentuk gel, baik dalam formula bebas gula maupun dalam formula gula tinggi yang mengandung gula hingga sebesar 80%. Gel yang dihasilkan oleh pektin LM bersifat thermoreversible, artinya gel tersebut dapat dicairkan dan dibentuk kembali saat pendinginan.
Film dari pektin bersifat tidak terlalu kuat dibanding film dari polisakarida lainnya. Substitusi gugus metil (gugus yang lebih besar dibanding –COOH) dan keberadaan cabang pada rantai molekul pektin memberikan formasi yang kurang kompak (Nieto, 2009).
C. KITOSAN
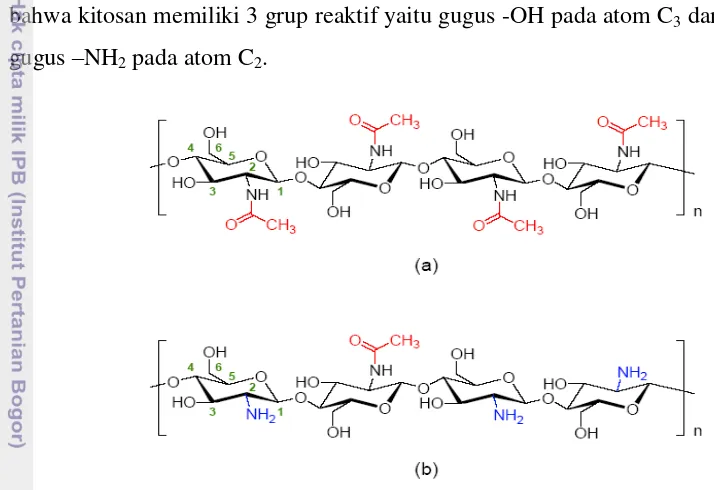
polisakarida yang hampir sepenuhnya terasetilasi, dan diregangkan oleh penolakan elektrostasis. Kitosan dalam bentuk amina bebas tidak larut dalam air pada pH netral. Kitosan larut dalam asam asetat glasial dan HCl, tetapi tidak larut dalam larutan asam sulfat pada suhu ruang. Lebih rendahnya pH pelarut tidak menjamin kelarutan kitosan yang lebih besar, mengindikasikan bahwa mekanisme pelarutan kitosan tidak hanya dengan protonasi dari gugus amina, tetapi juga interaksi antara kitosan dan asam (Po et al., 2007). Dari Gambar 4, dapat dilihat bahwa kitosan memiliki 3 grup reaktif yaitu gugus -OH pada atom C3 dan C6 serta
gugus –NH2 pada atom C2.
Kitosan memiliki banyak gugus amina di sepanjang rantainya (bersifat kationik) sehingga mampu membentuk kompleks atau berinteraksi dengan komponen lain dan memperoleh karakter spesifik dari interaksi tersebut. Pada pH asam, terjadi protonasi gugus –NH2 menjadi -NH3+, yang dapat berasosiasi
dengan polianion untuk membentuk kompleks dan mengikat sisi anionik pada permukaan sel bakteri dan fungi. Pada pH yang lebih tinggi (>4), kitosan dapat membentuk kompleks dengan pewarna dan logam berat (Nieto, 2009). Kemampuan kitosan ini dapat bermanfaat dalam hal memperpanjang umur simpan dan keamanan produk makanan, serta mencegah proses oksidasi yang dikatalis oleh logam bebas pada makanan.
Edible film kitosan yang telah banyak digunakan pada buah dan sayur menunjukkan aktivitas antimikroba terhadap Bacillus cereus, Brochothrix thermosphacta, Lactobacillus curvatus, Lactobacillus sakey, Listeria monocytogenes, Pediococcus acidilactici, Photobacterium phosphoreum, Pseudomona fluorescens, Candida lambica, Cryptococcus humiculus, dan Botrytis cinerea (Olivas dan Barbosa-Cánovas, 2009). Karena kemampuannya membentuk film semipermeabel yang baik, kitosan diharapkan dapat memodifikasi atmosfer internal juga menurunkan kehilangan karena transpirasi dan memperlambat pematangan dari buah dan sayuran. Film kitosan memiliki sifat mekanik yang baik, fleksibel, dan sulit dirusak, juga merupakan barrier yang baik terhadap oksigen. Selain itu, film kitosan juga mampu mengkontrol pencoklatan enzimatis pada buah (Lacroix dan Tien, 2005). Meskipun sifat hidrofilik dari film kitosan dapat mempengaruhi karakteristiknya sebagai kemasan, film tersebut tetap menunjukkan hasil yang baik saat diaplikasikan terhadap buah dan sayuran segar (Olivas dan Barbosa-Cánovas, 2009).
campuran dari dua atau lebih polimer memungkinkan untuk meningkatkan laju biodegradasi film kompositnya dibandingkan polimer asal (Ikejima et Inoue, 2000). Dalam proses blending ini, perlu dipelajari kriteria miscibilitas antar polimer penyusunnya untuk mencegah adanya pemisahan fase selama proses dan penggunaannya.
Edible film komposit pektin/kitosan dapat diproduksi sebagai film multilayer, bi-layer, atau dispersi yang stabil. Pada film multilayer dan bi-layer, kitosan membentuk lapisan lain di atas lapisan pektin, sedangkan pada komposit film dispersi, kitosan dilarutkan bersamaan dengan larutan pektin. Sistem film multilayer dan bi-layer dibuat dengan teknik dua langkah yang melibatkan casting lapisan kitosan di atas film pektin yang telah dibuat sebelumnya. Sistem film dispersi melibatkan dispersi larutan kitosan ke dalam larutan pektin membentuk campuran yang stabil dan tahap pengeringan untuk pembentukan film. Stabilisasi dispersi dihasilkan dari keseimbangan gaya dari materi yang berbeda, terutama gaya elektrostatis dan hidrofobik. Gambar 5 menunjukkan struktur edible film yang dibuat dengan sistem multilayer, bi-layer, dan sistem dispersi.
Gambar 5. Pembentukan edible film komposit (Perez-Gago dan Krochta, 2005) Pembentukan film pektin/kitosan dengan metode multilayer telah dilakukan oleh Hoagland dan Parris (1996). Pada penggunaan metode multilayer tersebut ditemui adanya pertumbuhan fungi di antara kedua lapisan film dan permukaan film yang terbentuk tidak rata. Film bi-layer memiliki kecenderungan untuk
terlepas antara lapisannya dan memberikan sifat mekanik yang lebih buruk dibanding film emulsi. Kesulitan lainnya adalah teknik ini membutuhkan beberapa langkah sehingga waktu pembuatannya lebih lama, penggunaan pelarut lebih banyak, dan penanganan lebih sulit (Perez-Gago dan Krochta, 2005).
E. PLASTICIZER
Plasticizer seringkali dibutuhkan pada edible film, terutama yang terbuat dari polisakarida dan protein. Struktur film ini sering bersifat rapuh dan mudah patah karena interaksi antara molekul polimer yang kuat (Krochta, 2002). Han dan Gennadios (2005) mendefinisikan plasticizer sebagai bahan berbobot molekul rendah yang ditambahkan dalam materi pembentuk film polimerik, yang dapat menurunkan suhu transisi gelas polimer. Menurut Lee dan Wan (2006), plasticizer
adalah substansi bersifat non volatil, memiliki titik didih yang tinggi, tidak memisah, yang ketika ditambahkan ke dalam materi lain mengubah sifat fisik dan mekanik dari material tersebut.
Plasticizer mampu menempatkan dirinya di antara molekul polimer sehingga mengganggu interaksi polimer-polimer dan meningkatkan fleksibilitas. Plasticizer
meningkatkan volume bebas struktur polimer atau mobilitas molekular molekul polimer. Sifat ini menunjukkan bahwa plasticizer menurunkan perbandingan bagian kristalin terhadap bagian amorf yang menyebabkan menurunnya suhu transisi gelas. Penggunaan plasticizer tidak hanya mempengaruhi modulus elastik dan sifat mekanik lainnya, tetapi juga permeabilitas edible film terhadap gas dan uap air. Kebanyakan plasticizer bersifat sangat hidrofilik dan higroskopis sehingga mengikat molekul air dan membentuk kompleks dinamik plasticizer - air. Pada edible film yang terbuat dari polisakarida dan air, plasticizer
mengganggu ikatan hidrogen inter- dan intra-molekular, dan memperbesar jarak antara molekul polimer (Krochta, 2002).
Molekul air dalam film juga berfungsi sebagai plasticizer. Air merupakan
Menurut Sothernvit dan Krochta (2001) ada dua tipe plasticizer, yaitu:
1. Bahan yang mampu membentuk banyak ikatan hidrogen dan berinteraksi dengan polimer dengan cara mengganggu ikatan polimer-polimer serta menciptakan jarak antara rantai polimer
2. Bahan yang mampu berinteraksi dengan air dalam jumlah besar untuk mencegah kehilangan lebih banyak molekul air, sehingga menghasilkan kadar air yang lebih tinggi dan radius hidrodinamik yang lebih besar.
Akan tetapi, karena air, biopolimer, dan plasticizer secara alami memiliki sifat hidrofilik, dan karena banyaknya ikatan hidrogen di dalam strukturnya, sangatlah sulit untuk memisahkan dua mekanisme tersebut. Sothernvit dan Krochta (2001) menyebutkan bahwa terdapat beberapa faktor dari plasticizer yang digunakan yang mempengaruhi efisiensi plastifikasi, termasuk ukuran/bentuk dari molekul
plasticizer, jumlah atom oksigen, jarak spasial dalam struktur plasticizer, dan kapasitas mengikat air. Disamping efek dari ikatan hidrogen, gaya tolak menolak di antara molekul yang bermuatan sama atau antara polimer polar-non polar dapat memperbesar jarak antara polimer dan memberikan fungsi yang sama dari plastifikasi pada kasus struktur film polimerik yang bermuatan. Dibandingkan dengan film polimer yang netral, fleksibilitas film dari polimer bermuatan dapat dipengaruhi lebih signifikan oleh pengaturan pH dan penambahan garam pada tingkat aktivitas air yang sama (Han dan Gennadios, 2005).
Verrier (2005) mengemukakan beberapa teori untuk menjelaskan mekanisme cara kerja plasticizer:
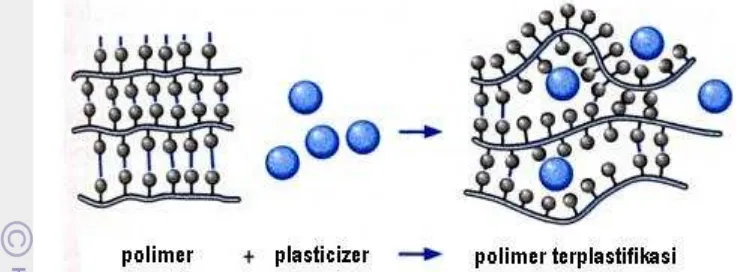
Teori lubrifikasi: menyatakan bahwa plasticizer dengan menginsersikan
dirinya diantara dua ikatan polimer, akan menurunkan interaksi intermolekuler (Gambar 6)
Teori gel: menyatakan bahwa rigiditas suatu polimer disebabkan karena struktur tridimensional. Plasticizer bekerja dengan melemahkan sejumlah besar interaksi intermolekuler yang ada
Teori volume bebas: menjelaskan bahwa plasticizer dapat meningkatkan
Gambar 6. Mekanisme plastifikasi tingkat molekuler (Trotignon et al, 1996) Plasticizer yang umum digunakan dalam sistem film adalah monosakarida,
disakarida, atau oligosakarida (glukosa, fruktosa-glukosa sirup, sukrosa, madu),
poliols (gliserol, sorbitol, turunan gliseril, polietilen glikol), dan lipid serta
turunannya (fosfolipid, asam lemak, dan surfaktan). Pemilihan plasticizer
dilakukan berdasarkan kompatibilitas antara plasticizer dan substansi yang akan
diplastifikasi. Untuk film polisakarida (umumnya berbasis air), plasticizer paling efektif adalah yang paling mendekati struktur polisakarida, sehingga plasticizer
hidrofilik yang memiliki gugus hidroksil adalah yang paling sesuai. Jumlah dan posisi gugus hidroksil serta jumlah ikatan hidrogen yang dapat berikatan dengan makromolekul mempengaruhi efisiensi plastifikasi. Plasticizer yang umum digunakan dalam film polisakarida antara lain gliserol, sorbitol, xylitol, mannitol,
polietilen glikol (dengan bobot molekul 400-8000), etilen glikol, dan propilen
glikol. Secara umum plasticizer dibutuhkan sekitar 10-60% dari berat kering,
tergantung dari kekakuan polimer (Sothernvit dan Krochta, 2005). Penggunaan beberapa plasticizer dapat menghambat pertumbuhan fungi (Lacroix dan Tien,
III. BAHAN DAN METODOLOGI
A. BAHAN DAN ALAT
Bahan utama yang digunakan dalam penelitian ini adalah pektin citrus komersial HM SS (high methoxyl slow set) yang diperoleh dari Cargill Deutschland GmbH, dan kitosan DD 90,2% yang diperoleh dari Biotech Surindo, Indonesia. Bahan kimia yang digunakan antara lain aquades, asam sitrat, polietilen glikol (PEG) 400, dan HCl 0,1 N. Bahan-bahan yang digunakan untuk uji aktivitas antimikroba, yaitu Nutrient Agar, Nutrient Broth, alkohol 70% dan kultur uji yaitu Bacillus cereus dan Eschericia coli.
Peralatan yang digunakan antara lain neraca analitik, gelas piala, gelas ukur, erlenmeyer, magnetic stirrer, sudip, pipet tetes, pipet mohr, labu takar, penyaring vakum, cawan petri, pH meter, oven pengering, aluminium foil, kertas saring, kaleng, mikropipet, ose, bunsen, tabung reaksi, heater, dan autoklaf. Sedangkan peralatan analisis yang akan digunakan adalah chromameter, aw meter, tensile
strength elongation tester, micrometer, permeabilitas uap air dengan metode gravimetri, Differential Scanning Calorimetry (DSC), X-Ray Diffraction (XRD), dan FTIR Spectroscopy.
B. METODE PENELITIAN
Penelitian ini dibagi menjadi dua tahap, yaitu: (1) pembuatan edible film komposit pektin/kitosan yang homogen, dan (2) karakterisasi edible film komposit pektin/kitosan yang dihasilkan.
1. Pembuatan Edible Film
Larutan edible film komposit pektin kitosan dibuat dengan memodifikasi metode pembentukan gel yang homogen oleh Hiorth et al. (2005). Sebanyak 1% (b/v) pektin dilarutkan dalam aquades menggunakan magnetic stirrer selama 20-30 menit hingga larut sempurna. Dalam wadah yang terpisah, kitosan dilarutkan dengan cara yang sama ke dalam asam sitrat 1%.
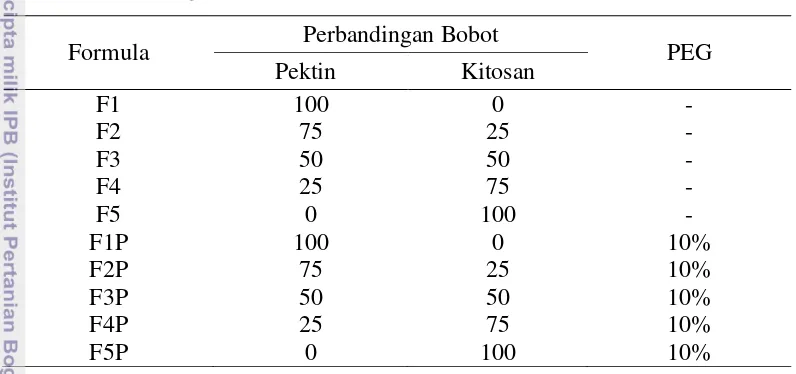
adalah 1,5 gram dengan volume total pelarut 150 ml (1% dari total pelarut), tidak termasuk volume HCl 0,1 N yang digunakan. Khusus untuk film yang akan diplastifikasi, ke dalam larutan kemudian ditambahkan 10% PEG 400 yang berfungsi sebagai plasticizer. Pengadukan dilakukan dengan menggunakan magnetic stirrer saat pencampuran dilakukan dan diteruskan selama 15 menit setelah penambahan PEG hingga terbentuk campuran yang homogen. Formulasi pembuatan edible film dapat dilihat pada Tabel 2.
Tabel 2. Perbandingan bobot pektin/kitosan dalam formulasi
Formula Perbandingan Bobot PEG
Pektin Kitosan
1.1 Pengukuran Nilai pH Larutan
Larutan komposit pektin/kitosan yang dihasilkan kemudian diukur derajat keasamannya menggunakan pH-meter. Sebelum pengukuran, pH-meter harus distandarisasi dengan menggunakan buffer standar pH 4 dan pH 7. Pengukuran dilakukan dengan cara elektroda dibilas dengan akuades dan dikeringkan dengan kertas tisue. Sampel dimasukkan ke dalam gelas piala 100 ml kemudian elektroda dicelupkan hingga tenggelam pada larutan sampel dan dibiarkan kurang lebih selama satu menit hingga diperoleh angka yang stabil lalu nilai dicatat.
2. Karakterisasi Film Komposit Pektin/Kitosan
Edible film yang telah dikondisikan selanjutnya dikarakterisasi sifat fisikokimia, sifat mekanis, dan sifat termal, pengamatan mikrostruktur, serta dilakukan pengukuran kapasitas antimikroba.
*hanya untuk film yang akan diplastifikasi
Gambar 7. Diagram pembuatan edible film dari komposit pektin dan kitosan + PEG 10% dari total
padatan*
C
A
B
Casting dalam cawan Petri
Pengeringan
Output film: A = Film kitosan murni B = Film pektin murni C = pectin/chit blends (w/w): 25/75; 50/50; 75/25
Kitosan Pektin
Dilarutkan dalam asam sitrat 1%
Dilarutkan dalam aquades
Blending + Homogenisasi
2.1Pengukuran Warna dengan Chromameter
Pengukuran warna dilakukan menggunakan Chromameter CR 300 Minolta. Sampel edible film ditempatkan pada alas putih. Pengukuran menghasilkan nilai L, a, dan b. L menyatakan parameter kecerahan (warna akromatis, 0: hitam sampai 100: putih). Sedangkan a dan b adalah koordinat-koordinat chroma. Parameter a adalah cahaya pantul yang menghasilkan warna kromatik campuran merah - hijau dengan nilai +a (positif a) dari nol sampai 100 (merah) dan nilai -a (negatif a) dari nol sampai 80 (hijau). Parameter b adalah warna kromatik campuran biru - kuning dengan nilai +b (positif b) dari nol sampai 70 (kuning) dan nilai -b (negatif b) dari nol sampai 70 (biru).
2.2Pengukuran Aktivitas Air (aw)
Pengukuran aktivitas air dilakukan dengan menggunakan aw-meter
Shibaura WA-360. Sebelum dilakukan pengukuran, terlebih dahulu alat dikalibrasi dengan menggunakan larutan garam jenuh NaCl. Pencatatan dilakukan terhadap nilai aw.
Gambar 8. Pengukuran nilai aw Edible film
2.3Pengukuran Ketebalan
2.4Pengukuran Kuat Tarik dan Persentase Pemanjangan
Kuat tarik dan persentase pemanjangan diukur dengan menggunakan Tensile Strength and Elongation Tester Industries model SSB 0500. Kuat tarik ditentukan berdasarkan beban maksimum pada saat film pecah dan persentase pemanjangan didasarkan atas pemanjangan film saat film pecah.
Kuat tarik (MPa) = F/A
Keterangan: F = gaya kuat tarik (N) ; A = luas bidang gaya (mm2)
% Elongasi =b−a
a × 100%
Keterangan: a: panjang awal
b: panjang setelah putus
Gambar 9. Pengukuran kuat tarik dan persentase pemanjangan edible film
2.5Laju Transmisi Uap Air Metode Gravimetri
Laju transmisi uap air terhadap film diukur dengan menggunakan metode gravimetri. Bahan penyerap uap air (CaCl2) diletakkan dalam
kaleng. Kemudian sampel berukuran 3x3 cm diletakkan di atas kaleng tersebut dengan metode jendela menggunakan aluminium foil sedemikian rupa sehingga menutupi kaleng tersebut. Tutup dengan parafin untuk menutupi bagian antara wadah dengan aluminium foil sehingga tidak ada udara masuk.
pertambahan berat dari cawan. Selanjutnya dibuat grafik hubungan antara pertambahan berat dan waktu. Nilai WVTR dihitung dengan rumus:
WVTR = slope / luas sampel (m2) = g/m2/24 jam (90% RH, 30oC) k/x = WVTR / [(P2-P1) x RH ruangan] P2 : tekanan uap air jenuh di luar kaleng (mm Hg)
P1 : tekanan uap air jenuh di dalam kaleng (mm Hg)
Gambar 10. Pengukuran laju transmisi uap air metode gravimetri: (a) kontrol dan (b) edible film
2.6Analisis dengan Differential Scanning Calorimeter (DSC)
Sifat-sifat termal film komposit pektin/kitosan dianalisis dengan DSC (M-DSC 2920, TA Instruments, USA) untuk menentukan suhu transisi gelas (Tg) dan titik leleh bahan (Tm). Sebanyak 7-10 mg bahan diletakkan pada cawan aluminium DSC dengan menggunakan cawan DSC kosong sebagai pembanding. Scanning dilakukan dengan kecepatan peningkatan panas diatur 10°C/menit.
2.7Analisis dengan X-Ray Diffraction (XRD)
Pola difraksi sinar-X film komposit pektin/kitosan dianalisis dengan
Rigaku X-ray diffractometer (Rigaku D/maks 2500v/pc) pada kondisi
operasi 40kV dan 200 mA. Sebelum dianalisis, film terlebih dahulu
dikeringkan secara alami pada suhu ruang.
2.8Analisis dengan FTIR Spectroscopy
Analisis dengan FTIR spectroscopy digunakan untuk melihat ada tidaknya interaksi spesifik pektin dan kitosan dalam campuran. Analisis dengan spectroskop FTIR dilakukan dengan pellet KBr dengan menambahkan 1 mg film dalam bentuk tepung halus ke dalam 200 mg KBr. Spektra FTIR untuk setiap sampel direkam pada suhu kamar dalam selang 400-4000 cm-1, dengan menggunakan 100 scan dan resolusi 4 cm-1.
2.9 Pengujian Aktivitas Antimikroba (Pranoto et al., 2005)
Pengujian aktivitas antimikroba edible film dilakukan dengan metode cakram (Pranoto et al., 2005).
a) Persiapan kultur uji
Kultur uji disiapkan terlebih dahulu dengan menginokulasikan satu ose kultur murni dari agar miring Nutrient Agar (NA) ke dalam 10 ml medium cair Nutrient Broth (NB) secara aseptik. Kultur uji kemudian diinkubasi 37oC selama 24 jam. Kultur uji yang digunakan dalam penelitian ini adalah Bacillus cereus dan Eschericia coli. Diagram alir persiapan kultur uji dapat dilihat pada Gambar 11.
Gambar 11. Diagram alir persiapan kultur uji b) Pengujian aktivitas antimikroba dengan metode cakram
Pengujian aktivitas antimikroba film komposit pektin/kitosan dapat diukur dengan menggunakan metode cakram. Kultur uji diinokulasikan sebanyak 0,2 ml ke dalam media NA 100 ml sehingga diperoleh konsentrasi 0,2% yang telah siap dituang ke cawan petri steril. Selanjutnya 20 ml media NA yang telah berisi kultur uji dituangkan ke cawan petri.
Kultur murni
Diinkubasi pada suhu 37ºC selama 24 Diinokulasikan ke dalam 10 ml Nutrient
Media agar dibiarkan membeku, kemudian film yang berdiameter 1 cm diletakkan di atas media yang berisi kultur uji tersebut. Media yang telah diletakkan film kemudian disimpan pada inkubator 37oC selama 24 jam. Setelah diinkubasi, akan terlihat zona penghambatan yang diperlihatkan dengan daerah bening di sekitar film yang telah ditempelkan di atas media. Diagram alir metode cakram dalam pengujian aktivitas antimikroba film komposit pektin/kitosan dapat dilihat pada Gambar 12.
Gambar 12. Diagram alir metode cakram
3. Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap faktorial dengan dua faktor. Perlakuan yang diterapkan berturut-turut adalah penggunaan plasticizer PEG (dengan dan tanpa PEG) dan formulasi perbandingan pektin/kitosan (100:0, 75:25, 50:50, 25:75, dan 0:100). Rancangan
Dibuat potongan film biokomposit
pektin/kitosan dengan diameter 1 cm
Ditempelkan potongan film (D = 1 cm) ke dalam cawan Kultur
uji
Diinokulasikan 0,2% ke dalam 20 ml NB
Dituang ke dalam petri dan dibiarkan membeku
Diinkubasi pada suhu 37oC selama 24 jam
ini digunakan untuk uji statistika terhadap analisis nilai pH, warna, aw, ketebalan,
kuat tarik, persentase pemanjangan, nilai WVTR, dan diameter penghambatan terhadap Escherichia coli dan Bacillus cereus. Model rancangan percobaan yang digunakan yaitu:
Yijk=μ+αi+βj+(αβ)ij+εijk
Dimana:
Yijk = Respon yang ditimbulkan pengaruh bersama oleh faktor ke-i (i =1, 2)
faktor penggunaan plasticizer PEG, dan faktor ke-j (j=1, 2, 3, 4, 5) faktor formulasi perbandingan pektin/kitosan
μ = Nilai tengah (rata-rata) dari seluruh nilai pengamatan
α1 = Pengaruh yang ditimbulkan oleh faktor penggunaan plasticizer PEG
βj = Pengaruh yang ditimbulkan oleh faktor formulasi perbandingan
pektin/kitosan
(αβ)ij = Pengaruh yang ditimbulkan oleh interaksi interaksi antara α1 dan βj
εijk = Pengaruh kesalahan percobaan
IV. HASIL DAN PEMBAHASAN
A. PEMBUATAN EDIBLE FILM
Larutan edible film komposit pektin kitosan dibuat dengan memodifikasi metode pembentukan gel yang homogen oleh Hiorth et al. (2005). Film dibuat dengan solution casting method dari campuran larutan kedua polimer yang telah disiapkan terlebih dahulu. Pektin dilarutkan dalam aquades hingga larut sempurna, artinya tidak ada pektin yang masih menggumpal, sedangkan kitosan dilarutkan dalam asam sitrat 1%. Kitosan tidak larut dalam air, larut pada hampir semua larutan asam organik pada pH sekitar 4,0 tapi tidak larut pada pH lebih besar. Salah satu pelarut yang dapat digunakan adalah asam organik lemah seperti asam asetat 10% dan asam sitrat 10% (Sugita et al., 2009). Dalam penelitian ini, asam sitrat dipilih sebagai pelarut kitosan karena asam sitrat lebih cocok digunakan untuk aplikasi film terhadap buah.
Proses pembuatan film komposit pektin kitosan sangat dipengaruhi oleh nilai pH. Kombinasi pektin dan kitosan membentuk polielektrolit kompleks (PEC) pada kisaran nilai pH 3-6. Selain melalui pembentukan PEC, pada pH rendah (pH<2) pektin dan kitosan juga berinteraksi melalui ikatan hidrogen. Pada pH ini, pektin hampir tidak bermuatan dan interaksi elektrosatik ditekan, sehingga interaksi antara pektin dan kitosan akan mungkin terjadi melalui ikatan hidrogen (Nordby et al., 2003). Ghaffari et al. (2007) merepresentasikan reaksi pembentukan PEC antara pektin (P - COOH) dan kitosan (C - NH2) secara
skematik sebagai berikut:
P - COOH + C - NH3+⇄ P - COO-+NH3 - C + H+
Standards for Food Additives. Hasil pengukuran nilai pH larutan komposit pektin/kitosan dapat dilihat pada Gambar 13.
Gambar 13. Grafik nilai pH larutan komposit pektin/kitosan
Larutan komposit pektin/kitosan memiliki nilai pH yang berada pada kisaran 2,02 - 3,36. Penambahan plasticizer PEG ke dalam larutan tidak menyebabkan perubahan nilai pH yang signifikan. Berdasarkan analisis sidik ragam pada taraf α = 5% terhadap nilai pH (Lampiran 1), terdapat perbedaan yang signifikan dalam setiap formulasi larutan. Larutan pektin atau kitosan murni memiliki pH yang lebih tinggi dibandingkan larutan kompositnya karena dalam pembuatan larutan komposit pektin/kitosan digunakan HCl 0,1 N untuk menurunkan pH agar dapat melarutkan PEC. Jumlah HCL 0,1 N yang digunakan untuk setiap larutan komposit adalah sama.
Pada grafik terlihat adanya peningkatan nilai pH seiring dengan peningkatan jumlah kitosan dalam larutan komposit. Hal ini sesuai dengan yang dinyatakan oleh Chen et al. (2007) bahwa kitosan dalam larutan berperan sebagai reagen dasar dan menetralisasi proton yang dilepaskan oleh asam. Proses netralisasi ini juga menyebabkan kitosan larut dalam fase aquaeous karena gugus amina kitosan terionisasi oleh proton menjadi bermuatan positif.
PEG ditambahkan ke dalam larutan edible film sebagai plasticizer. Penambahan plasticizer bertujuan untuk meningkatkan fleksibilitas atau plastisitas dari polimer. Beberapa studi terhadap plastifikasi film kitosan menunjukkan
100 : 0 75 : 25 50 : 50 25 : 75 0 : 100
PEG 3.36 2.03 2.14 2.24 3.00
Tanpa PEG 3.32 2.02 2.13 2.23 2.96
bahwa PEG dapat memperbaiki elastisitas film. Suyatma et al. (2005) menyebutkan bahwa PEG memiliki efisiensi dan stabilitas plastifikasi yang lebih baik terhadap kitosan dibanding beberapa plasticizer lainnya. Selain berfungsi sebagai plasticizer, PEG juga dapat berfungsi sebagai antifoaming yang diperlukan untuk mencegah pembentukan busa akibat pengadukan saat proses pembuatan edible film.
Pengadukan terus dipertahankan agar interaksi antara pektin/kitosan dengan pelarutnya dan PEG dapat berjalan dengan baik. Penyaringan dengan kertas saring dilakukan karena pektin yang digunakan adalah pektin teknis, sehingga masih ada pengotor yang tidak ikut terlarut dalam aquades. Pengotor tersebut dapat merupakan bagian tanaman tidak berpektin (pectin-less plant raw material) yang ikut terbawa saat proses ektraksi pektin.
Pengeringan dilakukan pada suhu 50oC selama kurang lebih 2x24 jam, pada suhu dan waktu tersebut tidak terjadi reaksi pencoklatan yang berlebihan dari edible film yang dikeringkan. Suhu yang digunakan untuk pengeringan akan sangat berpengaruh terhadap kecepatan pembentukan film dan penguapan bahan pelarut. Jika suhu terlalu tinggi akan mengakibatkan film menjadi sangat tipis, kering, dan mudah retak, karena proses pengeringan berjalan lebih cepat dibandingkan proses pembentukan film. Jika suhu terlalu rendah akan mengakibatkan lamanya proses pengeringan larutan sehingga mudah terjadi kontaminasi dan proses tidak efisien (Sumarto, 2008).
Gambar 14. Proses pelepasan film yang telah terbentuk dari cawan
kelembaban tinggi. Meskipun RH mendekati 50% lebih sering digunakan, namun RH 75% juga banyak digunakan (Veiga-Santos et al., 2005). RH lingkungan terbuka terlalu tinggi untuk penyimpanan dalam jangka waktu yang dibutuhkan selama analisis.
B. KARAKTERISASI FILM KOMPOSIT PEKTIN/KITOSAN 1. Pengukuran Warna dengan Chromameter
Pengukuran intensitas warna edible film dilakukan dengan Chromameter Minolta CR-310. Alat ini menggunakan sistem Hunter Lab.
Gambar 15. Grafik pengukuran nilai L edible film komposit pektin/kitosan L menyatakan parameter kecerahan (warna kromatis, 0: hitam dan 100: putih). Semakin tinggi nilai L yang terukur, maka semakin cerah warna aktual yang terlihat. Nilai L dari edible film yang tidak diplastifikasi (tanpa PEG) berkisar antara 84,3 - 85,4, sedangkan nilai L yang diplastifikasi (PEG) berkisar antara 83,6 - 88,2. Analisis sidik ragam menggunakan SPSS 15.0 terhadap nilai L pada taraf α = 5% (Lampiran 2), menunjukkan bahwa terdapat perbedaan yang signifikan antara film yang diplastifikasi dengan film yang tidak diplastifikasi, yaitu film dengan penambahan PEG cenderung memiliki tingkat kecerahan yang lebih tinggi dibanding film tanpa PEG. Namun secara subjektif, tidak terlihat perbedaan tingkat kecerahan yang signifikan dari kedua kelompok film.
100 : 0 75 : 25 50 : 50 25 : 75 0 : 100
PEG 86.7 88.2 86.3 83.6 84.8
Tanpa PEG 85.4 84.4 84.3 84.3 84.6
Pada kedua kelompok film, teramati bahwa jumlah kitosan berbanding terbalik dengan tingkat kecerahan film, semakin besar kitosan yang digunakan dalam formulasi maka tingkat kecerahan film akan semakin menurun. Film yang terbuat dari pektin murni lebih cerah dibandingkan dengan film yang dibuat dengan kitosan murni. Oleh karena itu, film komposit pektin/kitosan dengan jumlah pektin lebih banyak memiliki tingkat kecerahan yang lebih tinggi.
Kecerahan merupakan salah satu parameter kualitas kemasan edible yang penting. Dari hasil pengukuran diketahui bahwa edible film komposit pektin/kitosan yang dihasilkan memiliki tingkat kecerahan yang cukup tinggi.
Nilai a dan b merupakan koordinat-koordinat chroma. Parameter a adalah cahaya pantul yang menghasilkan warna kromatik campuran merah - hijau dengan nilai +a (positif a) dari nol sampai 100 (merah) dan nilai -a (negatif a) dari nol sampai 80 (hijau). Parameter b adalah warna kromatik campuran biru - kuning dengan nilai +b (positif b) dari nol sampai 70 (kuning) dan nilai -b (negatif b) dari nol sampai 70 (biru). Hasil pengukuran nilai a dan b edible film komposit pektin/kitosan dapat dilihat pada Gambar 16 dan Gambar 17.
Gambar 16. Grafik pengukuran nilai a edible film komposit pektin/kitosan Penambahan PEG dalam pembentukan film memperbesar nilai a, artinya penambahan PEG menyebabkan peningkatan intensitas warna merah edible film yang dihasilkan. Analisis sidik ragam pada taraf α = 5% terhadap nilai a (Lampiran 3), mengindikasikan adanya perbedaan yang signifikan untuk setiap
formulasi. Film pektin murni memiliki nilai a positif yang menunjukkan warna cenderung merah, sedangkan film kitosan murni memiliki nilai a negatif yang menunjukkan warna cenderung hijau. Namun pada film komposit, jumlah kitosan dalam film berbanding lurus dengan nilai a.
Gambar 17. Grafik pengukuran nilai b edible film komposit pektin/kitosan Hasil analisis sidik ragam menggunakan SPSS 15.0 terhadap nilai b pada taraf α = 5% (Lampiran 4), menunjukkan bahwa terdapat perbedaan yang signifikan terhadap warna edible film komposit pektin/kitosan. Semakin besar jumlah kitosan yang digunakan, maka semakin besar nilai b, artinya warna film cenderung semakin kuning. Hal ini disebabkan karena sifat alami kitosan yang berwarna kekuningan. Hasil analisis sidik ragam juga menunjukkan bahwa penggunaan PEG tidak memberikan perbedaan yang signifikan terhadap nilai b edible film.
2. Pengukuran Aktivitas Air (aw)
Aktivitas air (aw) adalah jumlah air bebas yang dapat digunakan oleh
mikroorganisme untuk pertumbuhannya. Air bebas merupakan air yang secara fisik dalam jaringan matriks bahan seperti membran, kapiler, dan serat. Air tipe ini mudah diuapkan dan dapat dimanfaatkan untuk pertumbuhan mikroba dan reaksi-reaksi kimiawi (Winarno, 1997).
Nilai aw sangat menentukan kualitas edible film yang akan digunakan sebagai
bahan pengemas primer. Jika edible film yang dihasilkan mempunyai nilai aw
yang dapat menghambat pertumbuhan mikroorganisme perusak makanan, maka film tersebut mempunyai potensi yang besar untuk melindungi makanan (Sumarto, 2008). Tabel 3 menunjukkan masalah penurunan kualitas yang berkaitan dengan perubahan nilai aw.
Tabel 3. Penurunan kualitas yang berkaitan dengan aw (Pavlath dan Orts, 2009)
aw Masalah Penurunan Kualitas
0,2 Pencoklatan non enzimatis
0,4 Kehilangan kerenyahan
0,6 Pertumbuhan kapang
0,7 Pertumbuhan khamir
0,8 Pertumbuhan bakteri
Hasil pengukuran nilai aw edible film yang dihasilkan dapat dilihat pada
Gambar 18. Nilai aktivitas air film yang diplastifikasi berkisar antara 0,63 - 0,68, sedangkan untuk film yang tidak diplastifikasi berkisar antara 0,65 - 0,70. Menurut Winarno (1997) aw minimum yang dibutuhkan oleh pertumbuhan kapang
adalah 0,60 - 0,70, khamir 0,80 - 0,90, dan bakteri 0,90. Berdasarkan nilai aw yang
diperoleh, maka dapat disimpulkan bahwa edible film tersebut aman dari pertumbuhan mikroba, terutama bakteri dan khamir.
Dari grafik dapat dilihat bahwa penambahan PEG menyebabkan menurunnya aktivitas air dalam film. Analisis sidik ragam terhadap nilai aw pada taraf α = 0,5%
(Lampiran 5), menunjukkan adanya perbedaan nyata antara film yang diplastifikasi dengan film yang tidak diplastifikasi. PEG dapat menurunkan aw
menurun. Farhat et al. (2002) juga menyebutkan bahwa PEG memiliki tekanan uap rendah yang mengakibatkan penurunan aw.
Gambar 18. Grafik pengukuran aw edible film
3. Pengukuran Ketebalan Film
Ketebalan film dipengaruhi oleh banyaknya total padatan dalam larutan, luas cetakan, dan tinggi (volume) larutan saat pencetakan (Park et al., 1992). Dengan cetakan yang sama, film yang terbentuk dapat berbeda ketebalannya apabila volume yang dituangkan berbeda. Semakin besar volume, semakin tebal film yang dihasilkan. Demikian juga dengan total padatan, semakin banyak total padatan maka film akan semakin tebal. Total padatan dalam semua larutan edible film yang dibuat dalam penelitian ini sama, yaitu 1% dari volume pelarut, dan volume larutan yang dicetak adalah keseluruhan dari satu formulasi. Ketebalan juga mempengaruhi sifat barrier dan sifat mekanik film.
Ketebalan edible film yang diplastifikasi berkisar antara 58,9 - 118,3 µm, sedangkan ketebalan film yang tidak diplastifikasi berkisar antara 41,7 - 95,6 µm. Grafik hasil pengukuran ketebalan film dapat dilihat pada Gambar 19. Analisis sidik ragam terhadap ketebalan film pada taraf α = 5% (Lampiran 6), menunjukkan adanya perbedaan yang signifikan antara film PEG dengan film tanpa PEG. Penggunaan PEG menambah jumlah padatan dan meningkatkan
100 : 0 75 : 25 50 : 50 25 : 75 0 : 100
PEG 0.68 0.63 0.66 0.67 0.65
Tanpa PEG 0.70 0.65 0.68 0.69 0.67
0.58 0.60 0.62 0.64 0.66 0.68 0.70 0.72
aw
volume dalam film sehingga film yang terbentuk lebih tebal dibandingkan dengan film tanpa PEG.
Formulasi film juga memberikan perbedaan yang signifikan terhadap ketebalan film. Semakin banyak kitosan yang digunakan, semakin tebal film yang dihasilkan. Hal ini dapat dijelaskan dengan perbedaan berat molekul dari pektin dan kitosan yang digunakan. Berat molekul rata-rata pektin berkisar antara 50 - 150 kDa (Sriamornsak, 2003), lebih rendah bila dibandingkan dengan rata-rata berat molekul kitosan yang berkisar antara 100 – 500 kDa (Kumar, 1999). Oleh karena itu, film dengan konsentrasi kitosan yang lebih tinggi memiliki ketebalan yang lebih tinggi pula.
Gambar 19. Grafik pengukuran ketebalan edible film
4. Pengukuran Kuat Tarik dan Persentase Pemanjangan
Kuat tarik (tensile strength) merupakan gaya tarik maksimum yang dapat ditahan oleh sebuah film hingga terputus. Kuat tarik merupakan parameter penting bagi sebuah edible film. Kuat tarik yang kecil mengindikasikan bahwa film yang bersangkutan tidak dapat dijadikan kemasan karena karakter fisiknya kurang kuat dan tidak dapat dicetak untuk kemasan rigid (Astuti, 2008).
Nilai kuat tarik film PEG berkisar antara 10,6 - 34,8 MPa, dan nilai kuat tarik film tanpa PEG berkisar antara 5,3 - 35,4 MPa. Gambar 20 menunjukkan grafik pengukuran nilai kuat tarik film. Dari grafik terlihat bahwa pada film pektin atau
100 : 0 75 : 25 50 : 50 25 : 75 0 : 100
PEG 58.9 66.1 84.4 92.8 118.3
Tanpa PEG 41.7 56.1 62.2 79.4 95.6
kitosan murni, penambahan PEG menyebabkan penurunan nilai kuat tarik, sesuai dengan sifat umum penggunaan plasticizer. Pada film komposit, efek penggunaan plasticizer terhadap nilai kuat tarik film tidak terlihat, sebaliknya terjadi peningkatan nilai kuat tarik. Efek yang berkebalikan dari penggunaan plasticizer ini dikenal dengan fenomena antiplastifikasi. Interaksi yang kuat antara polimer dan plasticizer dalam jumlah kecil menghasilkan efek ikatan silang (Suyatma et al., 2005), yang memungkinkan terjadinya peningkatan distribusi kuat tarik dalam film. Perbedaan efek plastifikasi terhadap nilai kuat tarik antara film murni dengan film komposit juga ditemui oleh García et al. (2009) yang melakukan plastifikasi pada film komposit kitosan/metil selulosa dengan gliserol.
Gambar 20. Grafik pengukuran nilai kuat tarik edible film
Analisis sidik ragam terhadap nilai kuat tarik pada taraf α = 5% menggunakan SPSS 15.0 (Lampiran 7) menunjukkan adanya perbedaan yang signifikan antara formulasi. Film pektin atau kitosan murni memiliki nilai kuat tarik yang lebih besar dibandingkan film komposit pektin/kitosan. Hal ini sesuai dengan yang dinyatakan oleh Kim et al. (2006) bahwa keberadaan counter ion (pektin negatif sedangkan kitosan positif) dapat mengurangi kekuatan film yang dihasilkan. Semakin besar kitosan dalam film komposit, semakin menurun nilai kuat tarik. Hal ini menunjukkan bahwa kitosan memiliki adhesi interfasial yang rendah terhadap matriks komposit sehingga menurunkan distribusi kuat tarik dalam film
100 : 0 75 : 25 50 : 50 25 : 75 0 : 100
PEG 26.7 24.1 12.0 10.6 34.8
Tanpa PEG 32.0 21.2 10.9 5.3 35.4
komposit pektin/kitosan, atau dapat pula berkaitan dengan efektivitas PEG sebagai plasticizer.
Krochta dan Johnston (1997) melaporkan bahwa kisaran nilai kuat tarik yang dapat diaplikasikan untuk edible film yang standar antara 10 – 100 MPa. Dengan demikian, meskipun terjadi penurunan nilai kuat tarik dalam film komposit pektin/kitosan, film yang dihasilkan tersebut masih sesuai untuk diaplikasikan sebagai edible film karena nilai kuat tariknya masih berada pada kisaran tersebut.
Pengukuran kuat tarik film biasanya diikuti dengan pengukuran persen pemanjangan (elongasi). Persen pemanjangan merupakan perubahan panjang maksimum sebelum edible film terputus (Sumarto, 2008). Persen pemanjangan mempresentasikan kemampuan film untuk meregang secara maksimum. Persen pemanjangan edible film yang diplastifikasi berkisar antara 29,1 - 97,9%, dan pada film yang tidak diplastifikasi persen pemanjangan berkisar antara 28,3 - 60,3%. Grafik hasil pengukuran persen pemanjangan film dapat dilihat pada Gambar 21.
Gambar 21. Grafik pengukuran persentase pemanjangan film
Analisis sidik ragam terhadap persentase pemanjangan pada taraf α = 5% (Lampiran 8) menunjukkan perbedaan yang signifikan akibat penggunaan plasticizer dan formulasi film. Film yang diplastifikasi dengan PEG memiliki persen pemanjangan yang lebih besar dari film yang tidak diplastifikasi. Plasticizer meningkatkan fleksibilitas film dengan mengurangi derajat ikatan
100 : 0 75 : 25 50 : 50 25 : 75 0 : 100
PEG 51.7 29.1 54.9 60.8 97.9
Tanpa PEG 30.9 28.3 53.1 52.3 60.3
hidrogen dan meningkatkan jarak intermolekular dari polimer (Lee dan Wan, 2006).
Persen pemanjangan film berbanding lurus dengan jumlah kitosan. Semakin besar jumlah kitosan dalam film, semakin besar pula persen pemanjangan. Hal ini menunjukkan bahwa plasticizer yang digunakan, yaitu PEG 400, lebih sesuai atau efektif terhadap kitosan dibandingkan terhadap pektin. Efektivitas plasticizer ini juga terlihat dari nilai kuat tarik film komposit yang semakin rendah seiring dengan peningkatan jumlah kitosan. Krochta dan Johnston (1997) melaporkan karakteristik edible film standar mempunyai persen pemanjangan 10 - 50%. Edible film komposit pektin/kitosan yang dihasilkan memiliki persentase pemanjangan yang mendekati kisaran tersebut.
Penggunaan plasticizer cenderung menurunkan nilai kuat tarik dan meningkatkan persen pemanjangan karena plasticizer dapat mengurangi gaya antar molekul, dan meningkatkan mobilitas rantai biopolymer (McHugh dan Krochta, 1994). Plasticizer mengganggu ikatan rantai dan menurunkan rigiditas sehingga menghasilkan struktur film yang tidak teratur.
Kondisi lingkungan saat produksi, penyimpanan, dan penggunaan bahan mempengaruhi sifat mekanis film. Fenomena ageing juga menyebabkan penurunan sifat mekanis, terutama persentase pemanjangan film (García et al., 2009). Edible film memiliki nilai kuat tarik yang lebih rendah daripada plastik (PET, PVC, polistiren, dan poliamide), sedangkan persen pemanjangannya sangat bervariasi. Beberapa edible film memiliki persen pemanjangan yang dapat dibandingkan dengan plastik pada umumnya. Pada kondisi RH yang tinggi, kekuatan fisik film lebih rendah dibanding pada kondisi RH rendah karena uap air yang diserap berfungsi sebagai plasticizer. Suhu juga merupakan variabel penting yang mempengaruhi sifat fisik dan mekanis edible film. Kekuatan fisik bahan menurun secara dramatis ketika suhu meningkat di atas suhu transisi gelas (Han dan Gennadios, 2005).
5. Laju Transmisi Uap Air Metode Gravimetri