1.1 Latar Belakang
Jabon (Anthocepalus cadamba (Roxb.) Miq.) merupakan salah satu fast growing spesies. Tanaman jabon mempunyai banyak manfaat, yaitu: (1) Semua bagian dari tanaman jabon mulai dari akar, batang, buah, bunga, dan daun mengandung zat-zat yang dapat dimanfaatkan dalam bidang farmasi (Dubey et al.
2011); (2) Kayu jabon digunakan dalam industri perkayuan untuk veneer, kayu lapis, papan lamina, industri kertas (pulp and paper), kayu pertukangan, dan meubel (Nugroho 2011); (3) Pohon jabon juga dapat berfungsi sebagai peneduh dan pelindung tanaman; (4) Digunakan dalam program reboisasi dan penghijauan, rehabilitasi lahan pasca tambang dan (5) Dapat memperbaiki sifat-sifat fisika dan kimia tanah di bawah tegakan (Orwa et al. 2009). Selain itu jabon mempunyai keunggulan sifat fisik, yaitu kemampuan beradaptasi pada berbagai tempat tumbuh tinggi, bebas dari hama dan penyakit serius, dan perlakuan silvikultur mudah (Krisnawati et al. 2011). Dengan berbagai manfaat dan keunggulan tersebut, membuat jabon digunakan sebagai tanaman jenis baru pada Hutan Tanaman Industri (HTI), hutan rakyat, maupun sebagai tanaman pionir pada rehabilitasi lahan bekas tambang. Hal ini membuat permintaan pasar dari tanaman jabon meningkat.
Pemenuhan permintaan pasar dari bibit jabon sampai saat ini dilakukan melalui perbanyakan generatif dengan benih. Meskipun benih jabon melimpah, dan perbanyakan vegetatif konvensionalnya tidak sulit, perlu teknik budidaya yang lebih efektif, efisien dan mampu menghasilkan bibit yang unggul, dan seragam dalam skala besar yaitu melalui kultur jaringan.
dalam kultur jaringan. Residu dari kegiatan sterilisasi yang tidak sempurna juga dapat mengakibatkan matinya jaringan eksplan yang akan mengakibatkan matinya eksplan. Kandungan fenol dari tanaman berkayu dapat teroksidasi yang akan mengakibatkan browning pada eksplan. Kontaminasi dan browning ini dapat mengganggu jalannya kegiatan kultur jaringan serta menurunkan produksi bibit. Prinsip dari proses sterilisasi eksplan adalah semaksimal mungkin menghilangkan mikroorganisme kontaminan yang tidak diinginkan dengan gangguan sekecil mungkin pada jaringan eksplan. Oleh karena itu, perlu adanya metode sterilisasi jabon yang tepat dalam perbanyakannya secara in vitro.
1.2 Tujuan
Tujuan dari penelitian ini ialah:
1. Menetapkan metode sterilisasi yang tepat untuk memperoleh eksplan jabon (Anthocepalus cadamba (Roxb.) Miq.) yang steril secara in vitro.
BAB II
TINJAUAN PUSTAKA
2.1 Jabon (Anthocepalus cadamba (Roxb.) Miq.)Jabon (A. cadamba Roxb. Miq.) merupakan jenis pohon cepat tumbuh yang masuk dalam famili Rubiaceae dan genus Anthocepalus. A. cadamba Roxb. Miq. ini bersinonim dengan A. chinensis (Lamk) A Rich, A. macrophyllus (Roxb.) Havil, A. indicus A. Rich., A. morindaefolius Korth, Nauclea cadamba (Roxb.),
Neolamarkcia cadamba (Roxb) Bosser, Sarcocephalus cadamba (Roxb) Kurz. Jabon memiliki nama daerah galupai, johan, kalampain, kelempi (Sumatera); jabon, jabun, hanja, kalampeyan, kelampaian (Jawa); jabon, jabun, haja, kelampeyan (Kalimantan); pontua, suge manai, pekaung, toa (Sulawesi); gumpayan, kelapan, mugawe (Nusa Tenggara); paribe, masarambi (Irian Jaya) ( Mansur et al. 2010).
Jabon adalah pohon berukuran besar dengan batang lurus dan silindris serta memiliki tajuk yang tinggi seperti payung dengan sistem percabangan yang khas mendatar. Kulit batang pada waktu muda berwarna abu-abu tanpa alur, sedangkan kulit pohon tua kasar dan sedikit beralur (Krisnawati et al. 2011).
Daun jabon merupakan daun tunggal, bertangkai panjang 1,5−4 cm dengan helaian daun agak besar (panjang 15−30 cm dan lebar 7−8 cm). Di awal pertumbuhannya, yakni 2−3 bulan setelah tanam, pada tanah yang subur dan cukup air, daun jabon dapat berkembang hingga berukuran panjang 68 cm dan lebar 38 cm (Mansur et al. 2010). Umumnya, jabon mulai berbunga pada umur 4−5 tahun. Buah jabon berupa buah majemuk yang berbentuk bulat dan lunak. Bagian atas bakal buah beruang yang terdiri atas jutaan biji berukuran sangat kecil, dari 1 kilogram buah jabon rata-rata dihasilkan 18−26 butir biji (Mulyana 2011).
menjadi kurang optimal apabila ditanam pada lahan berdrainase jelek (Mansur et al. 2010).
Cahaya merupakan faktor yang sangat penting bagi pertumbuhan jabon. Suhu maksimum yang dapat ditoleransi jabon adalah 32º−42ºC dan suhu minimum berkisar antara 3−15,5ºC. Rata-rata curah hujan di habitat alaminya adalah 1500−5000 mm per tahun (Krisnawati et al. 2011). Ketinggian yang dapat ditoleransi jabon yaitu pada kisaran 0−1000 m dpl. Ketinggian optimal untuk mencapai produktivitas maksimumnya ialah kurang dari 500 m dpl (Mansur et al. 2010).
Penelitian di India menyebutkan bahwa semua bagian dari tanaman jabon berfungsi dalam bidang farmasi. Kulit batang jabon mengandung zat analgesik, antipiretik, antiradang (Mondal et al. 2009), antidiabetes (Bussa et al. 2010), antimikroba (Chandel et al. 2011), antioksidan, penawar racun (Hossain et al. 2011), penenang, dan penurun tekanan darah (Gurjar et al. 2010). Daun jabon mengandung zat antimikroba (Chandrashekar et al. 2009) dan penurun tekanan darah (Ahmed et al. 2011). Bunga jabon mengandung zat antidiare dan penurun tekanan darah (Alam et al. 2008, 2011). Buah jabon mengandung zat antijamur dan anti bakteri (Mishra et al. 2011). Akar jabon mengandung antimikroba, anti cacing dan penurun tekanan darah (Acharrya et al. 2010, 2011).
2.2 Teknik Perbanyakan Kultur Jaringan 2.2.1 Pengertian
Kultur jaringan merupakan suatu teknik budidaya sel, jaringan, ataupun organ dari suatu tanaman dibawah kondisi aseptik (bebas segala bentuk mikroorganisme) dan didalam lingkungan yang terkontrol (Evans et al. 2003). Zulkarnain (2009) mengatakan bahwa kultur jaringan merupakan upaya mengisolasi bagian-bagian tanaman (protoplas, sel, jaringan, dan organ), kemudian mengkulturkannya pada nutrisi buatan yang steril dibawah kondisi lingkungan terkendali sehingga bagian-bagian tanaman tersebut dapat beregenerasi menjadi tanaman yang lengkap kembali.
lengkap dan utuh apabila ditempatkan pada kondisi yang sesuai (Kumar et al. 2011).
Tahapan kultur jaringan meliputi inisiasi, multiplikasi, perpanjangan dan induksi akar (pengakaran), dan aklimatisasi. Kegiatan inisiasi meliputi persiapan eksplan, sterilisasi eksplan hingga mendapatkan eksplan yang bebas dari mikroorganisme kontaminan. Multiplikasi merupakan tahap perbanyakan eksplan dengan subkultur (pemindahan eksplan dalam media baru yang berisi Zat Pengatur Tumbuh (ZPT)) secara berulang-ulang untuk mempertahankan stok bahan tanaman (eksplan). Pengakaran merupakan kegiatan terakhir sebelum planlet dipindahkan ke kondisi luar. Aklimatisasi ialah proses pemindahan/pengadaptasian planlet dari kondisi in vitro ke kondisi luar/lapangan (Kumar et al. 2011).
Kegunaan utama dari kultur jaringan adalah untuk mendapatkan tanaman baru dalam jumlah banyak dan waktu relatif singkat, sifat fisiologi dan morfologi yang sama dengan induknya, efisien tempat dan waktu, tidak tergantung musim dan dapat diperbanyak secara kontinyu, dan untuk skala besar biayanya lebih murah. Menurut Zulkarnain (2009) manfaat dari kultur jaringan di antaranya: (1) keseragaman genetik (identik dengan induk), (2) kondisi aseptik (bebas patogen), (3) seleksi tanaman, (4) stok tanaman mikro, (5) lingkungan terkendali, (6) pelestarian plasma nutfah, (7) produksi tanaman sepanjang tahun, (8) memperbanyak tanaman yang sulit diperbanyak secara konvensional, dan (9) perbanyakan klon secara cepat.
2.2.2 Eksplan
Eksplan merupakan potongan tanaman yang diisolasi untuk inisiasi kultur jaringan. Respon masing-masing eksplan dalam kultur jaringan akan berbeda. Kemampuan regenerasi eksplan dalam kultur jaringan sangat dipengaruhi oleh tipe eksplan, varietas eksplan, umur tanaman induk sumber eksplan, konsisi fisiologis, dan ukuran eksplan.
2005, Chaudhry et al. 2010). Hal ini dikarenakan adanya perbedaan kandungan hormon pada masing-masing bagian eksplan (Kumar et al. 2011). Varietas eksplan juga merupakan faktor yang penting dalam mempengaruhi regenerasi eksplan (Kamal et al. 2007, Michel et al. 2008).
Peluang keberhasilan kultur jaringan dipengaruhi juga oleh umur tanaman. Semakin muda tanaman, maka akan semakin besar keberhasilan dalam kultur jaringan. Jaringan muda (juvenile) memiliki sel-sel yang aktif membelah dengan kecepatan pembelahan sel yang tinggi sehingga jaringan muda merupakan bahan eksplan yang baik. Naughmouchi et al. (2008) mengatakan respon eksplan akan menurun seiring pertambahan umur eksplan.
Kondisi fisiologi eksplan berperan penting dalam keberhasilan teknik kultur jaringan. Pada umumnya bagian vegetatif lebih siap beregenerasi daripada bagian generatif. Kondisi fisiologis dari suatu tanaman bervariasi secara alami, sejalan dengan pertumbuhan tanaman yang dipengaruhi oleh lingkungannya. Pengaturan lingkungan tanaman yang bersih dan higienis, dengan pengubahan status fisiologi tanaman induk seperti memanipulasi cahaya, suhu, suplai air, suplai hara dan zat pengatur tumbuh akan mempengaruhi fisiologi eksplan (Zulkarnain 2009).
Ukuran eksplan menentukan laju kehidupan bahan eksplan. Eksplan yang berukuran kecil, lebih mudah disterilisasi sehingga akan memperkecil peluang kontaminasi baik secara internal maupun eksternal, namun kemampuan beregenerasi juga kecil sehingga diperlukan media kompleks dalam pertumbuhannya. Semakin besar ukuran eksplan maka akan semakin besar kemampuan beregenerasi, namun peluang untuk kontaminasi juga semakin besar (Zulkarnain 2009).
2.2.3 Zat Pengatur Tumbuh (ZPT)
Zat Pengatur Tumbuh merupakan senyawa organik dalam konsentrasi rendah yang dapat merangsang, menghambat, atau secara kualitatif mempengaruhi pertumbuhan tanaman. Contoh ZPT ialah sitokinin dan Giberelin.
pembentukan organ tanaman. Sitokinin yang paling banyak digunakan dalam kultur jaringan tanaman adalah kinetin, benzil adenin (BA), benzil amino purin (BAP), dan zeatin (Zulkarnain 2009). Beyl (2000) mengatakan bahwa pada konsentrasi tinggi sitokinin dapat menginduksi perbanyakan tunas, tetapi menghambat pembentukan akar.
Giberelin (GA3) terdiri atas kira-kira 60 macam senyawa, giberelin merupakan ZPT yang paling banyak ditemukan dalam tanaman (Zulkarnain 2009). Menurut Evans et al. (2003) fungsi utama dari giberelin pada tanaman yaitu menstimulasi pemanjangan ruas batang dan pembungaan. Giberelin juga ditemukan pada cadangan makanan dari endosperma pada tahap pertumbuhan embrio dan perkecambahan. Beyl (2000) mengatakan, giberelin berfungsi untuk merangsang pertumbuhan ruas dan dibutuhkan untuk pertumbuhan meristem. Menurut Zulkarnain (2009) biasanya giberelin digunakan dalam medium kultur untuk meningkatkan pemanjangan pucuk-pucuk yang sangat kecil dan merangsang pembentukan embrio dari kalus.
2.2.4 Sterilisasi Eksplan
Proses sterilisasi merupakan kegiatan mengeliminasi dan mematikan mikroorganisme sampai ke tingkat yang tidak memungkinkan lagi berkembang biak dan menjadi sumber kontaminan. Eksplan yang didapat tidak dari perlakuan steril, misalnya dari rumah kaca, sangat besar kemungkinannya terkontaminasi debu dan mikroorganisme.
Beberapa sumber kontaminasi mikroorganisme pada sistem kultur jaringan, adalah: (1) media, (2) lingkungan kerja yang kurang steril dan pelaksana penanaman yang kurang hati-hati dan kurang teliti, (3) eksplan, secara internal (kontaminan terbawa di dalam jaringan tanaman), (4) eksplan, secara eksternal (kontaminan berada di permukaan eksplan akibat prosedur sterilisasi yang kurang sempurna, (5) serangga atau hewan kecil yang masuk ke botol kultur setelah diletakkan pada ruang kultur. Dari semua sumber kontaminasi, yang paling sulit diatasi ialah yang berasal dari eksplan. Oleh karena itu, dalam memilih suatu metode sterilisasi dan bahan sterilisasi (Tabel 1) haruslah selektif, dengan prinsip semaksimal mungkin menghilangkan mikroorganisme kontaminan yang tidak diinginkan dengan gangguan sekecil mungkin pada jaringan eksplan (Zulkarnain 2009).
Tabel 1 Bahan sterilisasi yang biasa digunakan dalam sterilisasi permukaan
2.2.5 Medium
Medium merupakan salah satu komponen yang penting dalam metode kultur jaringan. Kesuksesan aplikasi prosedur kultur jaringan sebagian besar dipengaruhi oleh medium dengan komposisi yang tepat (Evans et al. 2003). Kebutuhan nutrisi untuk pertumbuhan kultur jaringan yang optimal bervariasi antar jenis ataupun antar varietas. Bahkan jaringan yang berasal dari bagian tanaman yang berbeda akan berbeda pula kebutuhan nutrisinya. Meskipun demikian, medium dasar MS (Murashige and Skoog) merupakan yang paling banyak digunakan di antara medium yang lain (Zulkarnain 2009). Menurut Evans
et al. (2003) secara umum medium MS mengandung unsur-unsur yang dibutuhkan tanaman, yaitu air, hara makro, hara mikro, vitamin, dan sumber karbon berupa glukosa.
Bahan Kimia Konsentrasi
Sodium hipoklorit 0,5-5%
Pemutih komersial 10-20%
Kalsium hipoklorit 9-10%
Hidrogen peroksida 3-12%
Mercuri klorida 0,1-1%
2.2.6 Antibiotik
Antibiotik merupakan senyawa yang dihasilkan oleh mikroorganisme seperti cendawan dan bakteri yang digunakan untuk membunuh mikrorganisme lain. Amoksilin merupakan antibiotik yang termasuk pada golongan penisilin kelas B-Lactams. Amoksilin mempunyai sifat bakteriostatik, yaitu cara kerja antibakteri dengan menghambat pertumbuhan bakteri. Amoksilin mengganggu pertumbuhan bakteri dengan cara menghambat sintesis dinding sel bakteri. Amoksilin merupakan antibakteri dengan spektrum sedang (moderate spectrum), yang hanya aktif pada beberapa bakteri dan cendawan saja (Joshi 2011).
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat PenelitianPenelitian dilaksanakan di Laboratorium Bioteknologi Lingkungan Pusat Penelitian Lingkungan Hidup (PPLH) Institut Pertanian Bogor, Laboratorium Kultur Jaringan Silvikultur, dan rumah kaca Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan Juni 2011 hingga April 2012.
3.2 Bahan dan Alat
Bahan bahan yang digunakan meliputi: a. Bahan tanaman (eksplan)
Bahan tanaman yang dipakai adalah tunas jabon berumur ± 3 bulan (Gambar 1A) yang dibeli dari petani. Bibit jabon kemudian diletakkan di dalam sungkup yang berada di rumah kaca. Sungkup tersebut ditutup dengan menggunakan
insectnet. Bibit jabon diberikan ZPT (Zat Pengatur Tumbuh) berupa BAP, GA3, dan pupuk daun dengan cara disemprotkan pada daun setiap hari selama 2 minggu. Peletakan bibit jabon dipisahkan berdasarkan perlakuan karantina, yaitu tanpa karantina, karantina 7 hari, dan karantina 14 hari. Bibit tanpa karantina hanya diberikan ZPT, sedangkan bibit yang dikarantina diberi ZPT dan perlakuan antibiotik berupa steptomisin, amoksilin, dan kloramfenikol setiap hari selama 7 hari dan 14 hari. Tunas tanaman yang diambil mulai dari bagian pucuk sampai buku kedua (Gambar 1).
b. Bahan media
Media yang digunakan dalam penelitian ini adalah media MS (Murashige dan Skoog), yang terdiri atas hara makro, hara mikro, larutan vitamin, glukosa, dan dipadatkan dengan agar-agar tanpa menggunakan ZPT.
c. Bahan sterilisasi
d. Bahan Bahan dan air kra
Alat a
air flow c
magnetic cawan Pe meter, pla korek api, komputer. 3.3 Me Ta sterilisasi eksplan de media MS Ste autoklaf d n lain n lain yang
an.
lat yang dig
cabinet), au
stirrer, lab etri, pipet b astik, kuas, tissue, ove . Gamba etode Kerj ahapan-tahap lingkungan engan bebe S, serta pem erilisasi ala dengan cara digunakan gunakan da utoklaf, aera bu Erlenme bulb, penga karet gelan n, masker, j
ar 1 Bagian t eksplan ±3 bula
a
pan dalam n kerja, pem erapa perlak meliharaan d
at dan bah mengisika dalam pene alam penelit ator, timban yer, gelas aduk, pinset ng, botol ku jas laborato
tunas jabon y n (tanda pana an
penelitian milihan dan
kuan, penan an pengama han. Akuad an air akuad
elitian ini m
tian ini ialah ngan denga
piala, gelas t, spatula, l ultur, alumu
orium, kame
yang digunak ah) pada jabo
ini meliput pengambila naman ekpla atan eksplan des disteril des tersebut
meliputi det
h meja kerj an ketelitian
s ukur 10 lampu spirt
unium foil, era, tally she
kan sebagai on berumur
ti sterilisasi an bahan ek an dalam bo n.
isasi denga ke dalam b
tergen, air
ja steril (lam
n 10-3, hot
ml dan 100 tus, sprayer corong, gun
eet, alat tuli
dengan isi setengah botol kaca ±100 ml. Botol ditutup dengan plastik dan diikat dengan karet. Sterilisasi dilakukan pada temperatur 121ºC pada tekanan 1 atm selama 1 jam. Akuades yang telah disterilisasi diletakkan dalam plastik transparan, untuk menghindari mikroba masuk ke botol. Alat-alat tanam seperti pinset, gunting, dan skalpel disterilkan setiap akan dipakai dengan dicelupkan pada alkohol 70% kemudian dibakar pada lampu spirtus dan selanjutnya dicelupkan dalam air steril. Alat-alat dari logam yang disterilkan dalam autoklaf dibungkus dalam kertas tebal. Temperatur yang digunakan dalam sterilisasi alat ini ialah 121ºC pada tekanan 1 atm selama 20 menit. Cawan Petri dan alat tanam setelah disterilisasi disimpan dalam oven, dalam keadaan terbungkus kertas sampai digunakan kembali.
Sterilisasi lingkungan kerja. Sterilisasi dilakukan dengan cara menyemprot permukaan laminar air flow cabinet (LAFC) dengan menggunakan alkohol 70% dan menyalakan lampu ultraviolet minimal 30 menit sebelum digunakan, untuk mematikan kontaminan yang ada di permukaan meja. Pekerja menyemprot tangannya dengan alkohol, sebelum bekerja menggunakan masker dan jas laboratorium. Setelah selesai digunakan, permukaan meja disemprot kembali dengan menggunakan alkohol 70%.
Pemilihan dan pengambilan eksplan. Eksplan diambil pada pagi hari dari bibit jabon di rumah kaca dengan panjang eksplan sekitar 2−2,5 cm. Eksplan dipotong dengan menggunakan skalpel yang terlebih dahulu disemprot menggunakan alkohol 70%. Potongan eksplan dimasukkan ke dalam botol yang berisikan air steril dan langsung ditutup.
0,5 mg dalam 100 ml air oksigen selama 1 hari dan 2 hari. Eksplan tanpa perlakuan perendaman antibiotik, dibilas kembali dengan air steril sebanyak 2 kali, masing-masing tiga menit. Sterilisasi lanjutan dilakukan dalam LAFC dengan perendaman larutan NaOCl 7,5 % dan 5 % selama 3-5 menit, dan dibilas dengan air steril sebanyak 4 kali, masing-masing selama 3 menit. Eksplan kemudian dipotong menggunakan skalpel dengan panjang ± 1 cm di dalam cawan Petri. Daun dan bekas bahan sterilisasi dibersihkan dan dibuang dari eksplan. Setelah dipotong, eksplan direndam dalam larutan betadine selama 10 menit dan dibilas kembali dengan menggunakan air steril 1 kali. Selanjutnya, eksplan ditiriskan dalam tissue steril yang diletakkan pada cawan Petri. Perlakuan yang diberikan dalam penelitian ini meliputi:
A. Bibit tanpa karantina
A.1 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman dalam 100 ml larutan bakterisida, fungisida, dan detergen Perendaman larutan NaOCl 7,5 % selama 3-5 menit
Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
A.2 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman dalam 100 ml larutan bakterisida, fungisida, dan detergen Perendaman eksplan dalam larutan antibiotik selama semalam
Perendaman larutan NaOCl 7,5 % selama 3-5 menit Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
A.3 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman dalam 100 ml larutan bakterisida, fungisida, dan detergen Perendaman eksplan dalam larutan antibiotik selama dua malam Perendaman larutan NaOCl 7,5 % selama 3-5 menit
Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
B. Bibit dengan karantina 7 hari
B.1 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman eksplan dalam larutan antibiotik selama semalam Perendaman larutan NaOCl 7,5 % selama 3-5 menit
Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
B.2 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman dalam 100 ml larutan bakterisida, fungisida, dan detergen Perendaman eksplan dalam larutan antibiotik selama 2 malam
Perendaman larutan NaOCl 7,5 % selama 3-5 menit Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
C. Bibit dengan karantina 14 hari
C.1 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman dalam 100 ml larutan bakterisida, fungisida, dan detergen Perendaman eksplan dalam larutan antibiotik selama semalam
Perendaman larutan NaOCl 7,5 % selama 3-5 menit Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
C.2 Pengolesan permukaan eksplan dengan alkohol 70%
Perendaman dalam 100 ml larutan bakterisida, fungisida, dan detergen Perendaman eksplan dalam larutan antibiotik selama 2 malam
Perendaman larutan NaOCl 7,5 % selama 3-5 menit Perendaman larutan NaOCl 5 % selama 3-5 menit Perendaman larutan betadine 10 menit
Penanaman eksplan. Penanaman eksplan dilakukan di dalam LAFC. Eksplan yang telah dipotong dengan ukuran ± 1 cm ditanam di botol-botol kultur yang berisi media MS dengan bantuan pinset yang telah disterilisasi. Botol kultur ditutup rapat dengan menggunakan plastik dan diikat dengan karet, lalu dilapisi dengan aluminium foil, dilapisi dengan plastik kembali dan diikat dengan karet, dan direkatkan dengan menggunakan plastik wrap. Botol kultur selanjutnya diletakkan dalam rak-rak kultur.
cendawan segera dipisahkan untuk menghindari penyebaran cendawan ke botol kultur yang lain, sedangkan kontaminasi oleh bakteri tidak perlu dipisahkan sampai akhir pengamatan.
3.4 Pengamatan dan Pengambilan Data
Peubah yang diamati meliputi persen kontaminasi bakteri, cendawan, persen browning, persen hidup.
1. Persen kontaminasi bakteri
Persen kontaminasi bakteri diukur dengan cara menghitung jumlah tanaman yang terkontaminasi mulai 1 hari setelah eksplan ditanam dan selanjutnya setiap hari sampai akhir pengamatan, kemudian dihitung dengan rumus:
% Kontaminan= ∑ eksplan terkontaminasi bakteri/ ∑ eksplan yang ditanam. 2. Persen kontaminasi cendawan
Persen kontaminasi cendawan diukur dengan cara menghitung jumlah tanaman yang terkontaminasi mulai 1 hari setelah eksplan ditanam dan selanjutnya setiap hari sampai akhir pengamatan, kemudian dihitung dengan rumus:
% Kontaminan= ∑ eksplan terkontaminasi cendawan/ ∑ eksplan yang ditanam. 3. Persen browning
Persen browning diukur dengan cara menghitung jumlah tanaman yang mengalami browning mulai 1 hari setelah eksplan ditanam dan selanjutnya setiap hari sampai akhir pengamatan, kemudian dihitung dengan rumus:
% browning = ∑ eksplan mengalami browning/ ∑ eksplan yang ditanam 4. Persen hidup
Persen hidup diukur dengan cara menghitung jumlah tanaman yang hidup sampai akhir pengamatan, kemudian dihitung dengan rumus:
% hidup = ∑ eksplan hidup/ ∑ eksplan yang ditanam. 5. Persen multiplikasi
Persen diukur dengan cara menghitung jumlah tanaman yang bisa dimultiplikasi pada akhir pengamatan, kemudian dihitung dengan rumus:
3.5 Analisis Data
BAB IV
HASIL DAN PEMBAHASAN
4.1 HasilKontaminasi dan pencoklatan (browning) eksplan merupakan masalah utama yang sering muncul pada tahap inisiasi. Inisiasi merupakan tahap awal kultur jaringan yang bertujuan menghasilkan eksplan yang bebas dari mikroorganisme kontaminan. Pengamatan kontaminasi dan browning dilakukan terhadap kultur jaringan jabon selama 4 minggu. Eksplan berasal dari indukan berumur ± 3 bulan yang diberi 2 macam perlakuan yaitu karantina dan lama perendaman dalam antibiotik.
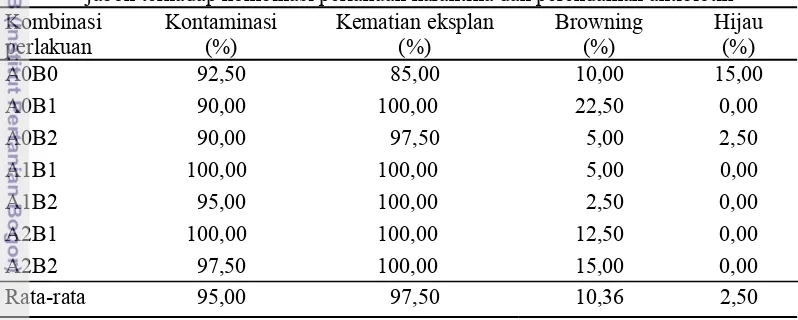
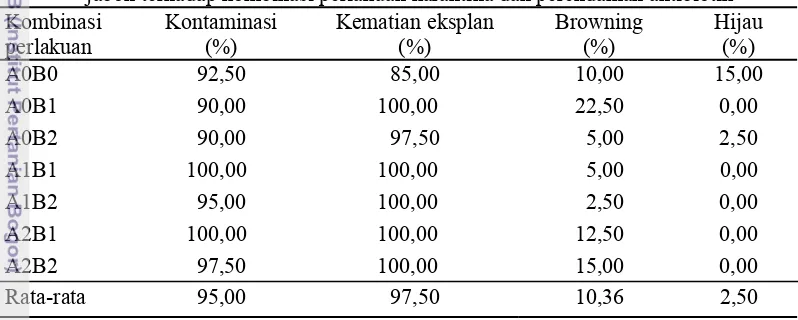
Tabel 2 Tingkat kontaminasi, kematian eksplan, browning dan tingkat hidup eksplan jabon terhadap kombinasi perlakuan karantina dan perendaman antibiotik Kombinasi
perlakuan
Kontaminasi (%)
Kematian eksplan (%)
Browning (%)
Hijau (%)
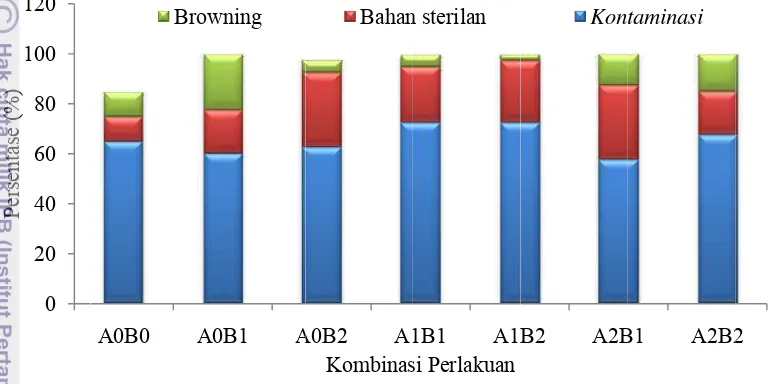
A0B0 92,50 85,00 10,00 15,00
A0B1 90,00 100,00 22,50 0,00
A0B2 90,00 97,50 5,00 2,50
A1B1 100,00 100,00 5,00 0,00 A1B2 95,00 100,00 2,50 0,00 A2B1 100,00 100,00 12,50 0,00 A2B2 97,50 100,00 15,00 0,00
Rata-rata 95,00 97,50 10,36 2,50
A0: karantina 0 hari, A1: karantina 7 hari, A2: karantina 14 hari, B0: perendaman 0 hari, B1: perendaman 1 hari, B2: perendaman 2 hari
Tabel 3 Jenis kontaminan pada eksplan jabon
Jenis kontaminan Persentase(%)
Bakteri 9,28 Cendawan 10,36 Bakteri+cendawan 75,36
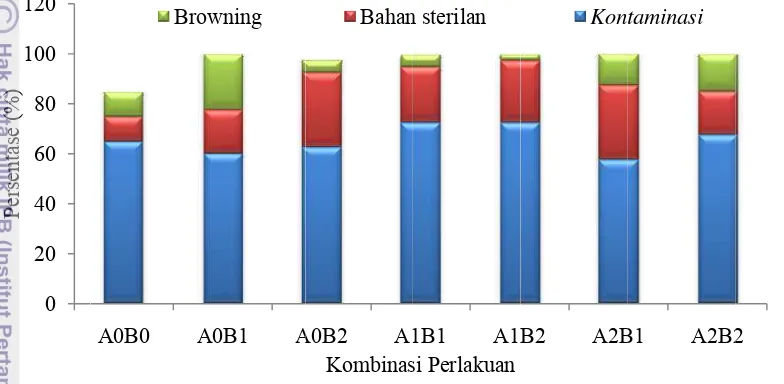
eksplan te pada kom eksplan ja oleh bakt 10,36% da Gambar 2 Gambar 3 Ke kontamina 0 20 40 60 80 100 120 Persentase (%) 0.0 20.0 40.0 60.0 80.0 100.0 120.0 Persentase (%) ertinggi pad mbinasi perl abon melip teri+cendaw an kontamin Eksplan y karantina perendam Eksplan ya hari, A1: k perendama ematian ter asi kemudia A0B0 A Bro A0B0 B da kombina lakuan A1B puti bakteri wan sebany nasi bakteri yang menga 0 hari, A man 0 hari, B1
ang terkontam karantina 7 h an 1 hari, B1
rtinggi pada an diikuti b A0B1 A owning A0B1 Bakteri+cend asi perlakua B2 sebesar dan cenda yak 75,36% i sebanyak 9
alami kemat A1: karantina
1: perendama
minasi selam ari, A2: kara : perendaman
a semua pe bahan steri A0B2 A1 Kombinas Bahan A0B2 A Kombina dawan
an A0B1 se 2,5% (Tab awan. Perse %, kontam 9,28% (Tab
tian selama a 7 hari, A an 1 hari, B2
ma 4 minggu antina 14 har
n 2 hari)
erlakuan ste ilan dan br
1B1 A1 si Perlakuan n sterilan A1B1 A1 asi perlakuan Cendaw ebesar 22,5 el 2). Jenis entase kont minasi cend el 3). 4 minggu A2: karanti 2: perendama pengamatan ri, B0: peren
erilisasi dis
rowning (G B2 A2B Kon
1B2 A2B
n wan
5% dan tere s kontamin taminasi ek dawan seba
pengamatan na 14 hari an 2 hari)
n (A0: karan ndaman 0 har
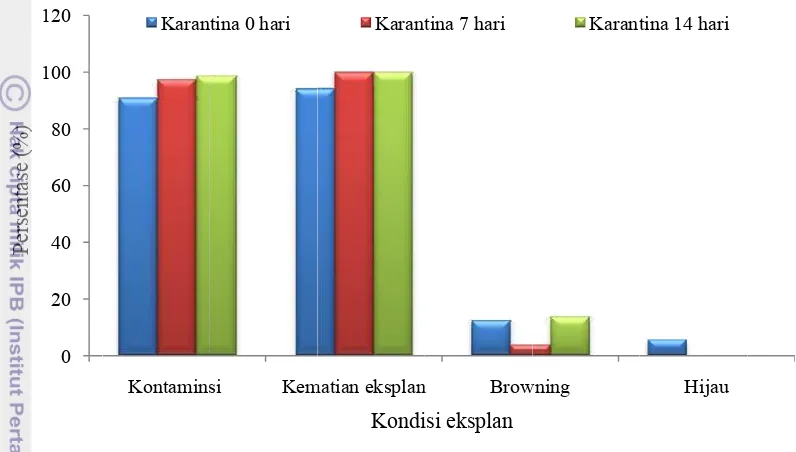
kontamina kontamina kemudian Gambar 4 Pe karantina browning perlakuan Persentase lebih rend eksplan pa sama. Per dibanding hijau/hidu (Gambar 4 0 20 40 60 80 100 120 Persentase (%)
an yang a an terbanya diikuti han Pengaruh pe ke-4 penga ersentase ko tinggi dib dan hijau/ karantina e kontamin dah dibandin ada perlaku rsentase bro gkan dengan up sampai a
4).
Kontamins Karan
ada pada k pada sem nya bakteri d
erlakuan kara amatan
ontaminasi bandingkan /hidup. Pers
7 hari dan nasi dan kem
ngkan deng uan karantin owning pada n karantina akhir penga si Kem tina 0 hari
eksplan be mua kombina dan hanya c
antina terhad
dan kema n dengan p
sentase kon n 14 hari
matian eks gan karantin na 0 hari dan a perlakuan a 0 hari d amatan terd matian eksplan Kondi Karant erupa bakt asi perlakua cendawan (G
dap kondisi e
atian ekspl persentase ntaminasi d
mempunyai plan pada na 7 dan 14 n 14 hari me n karantina dan karantin dapat pada
n Brow
isi eksplan tina 7 hari
teri dan c an adalah ba Gambar 3).
eksplan jabon
an pada s eksplan y dan kematia
i nilai yan perlakuan 4 hari. Pers
empunyai n 7 hari lebih na 14 hari
perlakuan wning
Karant
cendawan. akteri+cend
n pada mingg
emua perla yang meng
an eksplan ng hampir s karantina 0 entase brow
nilai yang ha h rendah ap i. Eksplan karantina 0
Hijau tina 14 hari
Gambar 5
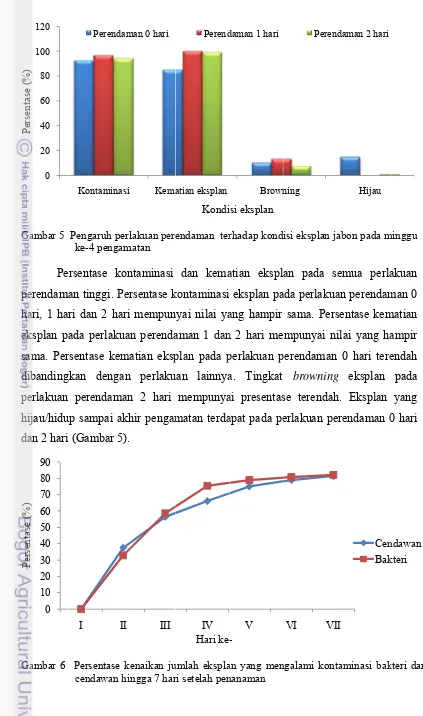
Pe perendam hari, 1 ha eksplan p sama. Per dibanding perlakuan hijau/hidu dan 2 hari
Gambar 6 0 20 40 60 80 100 120 Persentase (%) 0 10 20 30 40 50 60 70 80 90 Persentase (%) Pengaruh pe ke-4 penga ersentase ko an tinggi. P ari dan 2 ha ada perlaku rsentase kem gkan denga
perendam up sampai a i (Gambar 5
Persentase cendawan h Kontamina Perenda I I erlakuan pere amatan ontaminasi Persentase k ari mempun uan perenda matian eksp an perlaku man 2 hari
akhir pengam 5).
kenaikan ju hingga 7 har
asi Kema
aman 0 hari
II III
endaman ter
dan kema kontaminasi nyai nilai ya
aman 1 dan plan pada p uan lainnya mempunya matan terda
umlah ekspla ri setelah pen atian eksplan Kondi Perend IV Hari ke-rhadap kond atian ekspl eksplan pa ang hampir n 2 hari me
perlakuan p a. Tingkat ai presentas apat pada pe
an yang men nanaman
Brown
isi eksplan daman 1 hari
V
-isi eksplan ja
an pada s ada perlakua sama. Pers empunyai ni perendaman browning se terendah erlakuan pe ngalami kont ning Peren VI VI
abon pada m
emua perla an perendam sentase kem
ilai yang ha 0 hari tere
g eksplan h. Eksplan erendaman 0
taminasi bak Hijau daman 2 hari
Ko mengalam pada hari (Gambar 6 Gam Da dimultipli mengandu dengan pe eksplan pa
A
ontaminasi mi kenaikanke-5 dan m 6).
mbar 7 Kondi terko (C) E tidak dimu alam penel kasi. Ekspl ung ZPT BA enambahan
ada akhir pe
D
bakteri dan sampai har mulai konsta
isi eksplan p ontaminasi ja Eksplan men k mengalami ultiplikasi litian ini an tersebut AP 1,5 mg/
ZPT menga engamatan d
B
n cendawa ri ke-6. Kon
an pada har
pada minggu amur, (B) Ek ngalami brow pertumbuha
dihasilkan kemudian /l. Eksplan y
alami pertam dapat diliha
B
n terjadi p ntaminasi m ri ke-6 sam
ke-4 pengam ksplan terkon wning, (D) Ek
an,(E) Ekspla
3 botol dipindahka yang dipind mbahan tin at pada Gam
E
pada hari k mencapai per mpai pada ak
matan; (A) Ek ntaminasi bak ksplan hijau an yang siap
eksplan ja an kedalam dahkan ke d ggi, ruas da mbar 7.
C
ke-2 inisias rsentase tert khir pengam ksplan kteri, tetapi abon yang media MS dalam medi an daun. Ko4.2 Pembahasan
4.2.1 Kondisi Bahan Tanaman
Eksplan yang digunakan dalam penelitian ini merupakan tunas dari tanaman jabon yang berumur ± 3 bulan yang merupakan tanaman dengan jaringan muda yang sedang aktif tumbuh. Kavitha et al. (2009) melakukan penelitian respon pertumbuhan eksplan jabon terhadap perbedaan jenis eksplan. Eksplan jabon dari jaringan muda tanaman yang aktif tumbuh akan memberikan respon pertumbuhan yang baik dalam kultur jaringan dibandingkan dengan tunas dorman ataupun tunas yang sudah berkayu. Waktu bertunas dan banyaknya tunas eksplan jabon akan maksimum apabila yang digunakan adalah jaringan muda yang sedang aktif tumbuh, sedangkan jaringan tua tidak memberikan respon, bahkan akan mengalami pencoklatan dan mati.
Naghmouchi et al. (2008) menyatakan bahwa eksplan carob (Ceratonia siliqua) yang mempunyai karakteristik juvenile akan memberikan respon yang bagus dalam pembentukan tunas dan kecepatan pembentukan akar dalam media kultur. Penggunaan eksplan muda akan lebih optimal dalam pembentukan tunas dibandingkan dengan penggunaan eksplan yang sudah berlignin. Respon eksplan akan menurun seiring dengan naiknya umur eksplan.
Eksplan yang berasal dari jaringan tanaman yang masih muda memiliki kandungan fenol yang lebih rendah dibandingkan jaringan tanaman yang sudah tua. Penggunaan tanaman muda dapat mengurangi kemungkinan browning yang terjadi pada eksplan.
4.2.2 Karantina Tanaman dan Perendaman Antibiotik
Karantina penting dilakukan karena sterilisasi permukaan tidak cukup membunuh mikroba kontaminan. Konsentrasi bahan sterilisasi yang rendah dan waktu yang singkat pada sterilisasi permukaan, tidak bisa membunuh mikroba kontaminan. Namun, jika konsentrasi dan waktu perendaman eksplan dengan bahan sterilisasi dinaikkan, mikroba akan terbunuh dan dapat mematikan eksplan. Kegiatan karantina dilakukan sebagai kontrol pertumbuhan cendawan dan bakteri secara kontinyu. Kegiatan karantina ini juga sebagai penurun tingkat kontaminasi secara internal dan secara tidak langsung mengurangi besarnya konsentrasi bahan sterilisasi serta lamanya waktu sterilisasi yang akan merusak eksplan.
Perendaman eksplan dengan antibiotik dilakukan sebagai bagian dari sterilisasi internal jaringan eksplan. Eksplan yang telah terpotong masih membutuhkan oksigen untuk melakukan aktivitas selnya. Eksplan tersebut diberikan oksigen dengan menggunakan aerator dalam air kaya oksigen dalam proses peredamannya. Seperti dalam proses karantina, perendaman antibiotik dilakukan untuk membunuh ataupun mengeliminir mikroba yang ada di dalam jaringan eksplan.
Kontaminasi eksplan paling rendah pada perlakuan tanpa perendaman. Hal ini disebabkan jaringan eksplan yang sebelumnya dioles alkohol mengalami luka dan saat perendaman mikroba dari jaringan eksplan yang lain akan sangat mudah masuk jaringan yang luka. Air sebagai sarana metabolisme eksplan juga diduga dapat memobilisasi mikroba ke jaringan eksplan. Dosis dan waktu perendaman antibiotik yang tidak tepat juga mengakibatkan tujuan perendaman yaitu menurunkan tingkat kontaminasi belum tercapai.
4.2.3 Tingkat Browning Eksplan
Browning (pencoklatan) merupakan gejala munculnya warna coklat pada eksplan sehingga akan menghambat pertumbuhan eksplan. Queiroz et al. (2008) mengemukakan bahwa browning terjadi akibat adanya enzim polifenol oksidase yang mengakibatkan terjadinya oksidasi senyawa fenol menjadi quinon yang memproduksi pigmen berwarna coklat ketika jaringan terluka. Kavitha et al.
ini mengalami oksidasi akibat adanya pelukaan terhadap eksplan. Senyawa fenol yang teroksidasi pada media mengakibatkan eksplan tidak dapat mengambil nutrisi dari media sehingga pertumbuhan eksplan terhambat dan akhirnya eksplan akan mati.
Persentase browning pada penelitian ini rendah, yaitu sebesar 10,36%. Usaha untuk mengurangi browning dalam penelitian ini diantaranya ialah penggunaan bahan tanaman yang masih muda. Tanaman muda mempunyai kandungan fenol yang lebih rendah dibandingkan dengan tanaman tua. Kandungan fenol yang lebih rendah akan menurunkan tingkat browning yang terjadi. Peristiwa pencoklatan pada eksplan saat ditanam dapat dikurangi dengan melakukan pembilasan air secara berulang. Hal ini dilakukan untuk melarutkan senyawa fenol yang ada dalam jaringan tanaman.
Kavitha et al (2009) menyarankan untuk menginkubasi eksplan jabon pada medium baru di dalam ruangan yang gelap untuk mengurangi tingkat browning
yang terjadi. Onuoha et al. (2011) dalam penelitiannya untuk mencegah browning pada kultur jaringan pisang (Musa parasidiaca) menyarankan untuk merendam eksplan dengan menggunakan antioksidan berupa potassium sitrat-sitrat selama 2 jam sebelum dilakukan pengkulturan. Poudyal et al. (2008) mengkaji masalah browning pada jenis pear Yali, Ainkansui dan Abbe Fetel. Poudyal menyarankan penambahan asam askorbat atau dengan penambahan Polivinil Pirolidon (PVP) pada media kultur, inkubasi eksplan pada kondisi gelap selama 96 jam, dan perlakuan dingin dengan disimpan dalam kulkas selama 12 jam. Perlakuan ini terbukti mampu mengontrol browning pada eksplan pear.
4.2.4 Tingkat Kontaminasi Eksplan
kontamina terlihat se ketika tun akibatnya dalam kul Gambar 8 Tin karantina tinggi pad terjadi pad karantina menguran Suwandi ( toksisitas kemampu tersebut a mikroba y kombinasi efektifnya rentang w
A
asi pada ek ehat dan se nas dikultu cendawan tur jaringan Kondisi tan yang sehat Kondisi sem ngkat kont dibandingk da perlakua da tanaman belum tun ngi mikroba (1992) men antibiotik an mikroba akan dituru yang lebih i dari tiga a antibiotik waktu pembe ksplan yang gar, diduga urkan patog akan cepat n sangat pen
naman induk t, (B) Kond mai jabon ya
aminasi ek kan dengan an karantina yang diberi ntas, sehin a justru ak ngatakan ba k. Resisten a untuk be unkan dari h tahan terh
jenis anti ini disebab erian antibio
B
dikulturka a sudah teri gen tersebu
tumbuh dal nting pemak
kan jabon di disi tanaman ang mati terk
ksplan jabon n perlakuan
a diduga ka ikan antbiot ngga karant kan mengha ahwa mikrob nsi muncul
eradaptasi d i generasi hadap antib biotik belu bkan karen otik yang ku
B
n (Altan et
infeksi dida ut akan iku
lam botol-b kaian ekspla
i rumah kaca n jabon yang kena serangan
n lebih ren n karantina. arena adany tik. Resisite tina yang asilkan mik ba akan ber l dengan dengan ling ke genera biotik. Pen um dapat b na kurangny urang lama.
t al. 2009). alam jaring ut terbawa botol kultur. an yang ben
a; (A) Kond g mulai ters
n lodoh
ndah pada . Kontamin ya resisitens ensi ini terja bertujuan kroba yang rusaha bera adanya f gkungannya asi sehingg nyebab lain berfungsi m ya dosis an
C
Tanaman gannya, seh
dalam jari . Oleh karen nar-benar se
disi tanaman serang lodoh
perlakuan nasi yang c
si mikroba adi karena p membunuh g lebih res adaptasi terh fleksibilitas
Kontaminasi secara umum dipengaruhi oleh beberapa faktor, yaitu faktor eksplan, faktor manusia, faktor media dan faktor lingkungan. Kontaminasi dari faktor eksplan dicirikan dengan awal muncul sumber kontaminasi berasal dari eksplan (Gambar 9A). Dalam penelitian ini banyak didapatkan juga kontaminasi yang berawal dari ruas antar tangkai daun (Gambar 9D). Kavitha et al (2009) mengatakan bahwa kontaminasi paling banyak dari kultur jaringan tunas jabon adalah cendawan. Cendawan sebagian besar berawal dari stipula yang berada di antara tangkai daun. Kontaminasi di bagian stipula dapat dihilangkan dengan menggunakan bahan kimia pada eksplan. Dengan cara ini persentase kontaminasi pada bagian stipula oleh cendawan dapat dikurangi. Kontaminasi ini biasa terjadi akibat adanya sterilisasi permukaan yang tidak sempurna. Pemilihan bahan sterilisasi, dosis serta lama waktu sterilisasi mempengaruhi keefektifan dalam membunuh kontaminan yang ada di permukaan eksplan.
Kontaminasi yang muncul dari media juga terkadang bisa terjadi. Kontaminasi dari faktor media disebabkan karena kurang rapatnya penutup botol sehingga mikroba bisa masuk lewat celah penutup botol. Kontaminasi yang berasal dari media kultur ditandai dengan munculnya cendawan atau bakteri berawal pada media (Gambar 9B). Faktor manusia dan lingkungan juga menjadi penyebab tingat kontaminasi yang cukup tinggi, kurang terampilnya pekerja serta kurang sterilnya peralatan yang dipakai juga bisa mempengaruhi persen kontaminasi pada eksplan. Odutayo et al (2007) menyatakan bahwa ada hubungan antara jenis kontaminan dengan lingkungan laboratorium, pekerja, dam peralatan yang digunakan. Bakteri dan cendawan yang ditemukan sebagai kontaminan, jenisnya sama dengan bakteri dan cendawan yang ada di udara laboratorium, peralatan laboratorium, kulit pekerja, serta sarung tangan pekerja ketika melakukan penelitian.
banyak m dari pada kelamaan Ga Ko dan terus mencapai Kontamin Sebagian +cendawa mengandung pertumbuh akan menu
ambar 9 Kon cen me tan ontaminasi b meningkat persentase nasi yang t
besar ekspl an.
A
C
g nutrisi, m han eksplan tupi eksplan ntaminasi cen ndawan bera enutupi ekspl ngkai daun bakteri dan t pada ming
e tertinggi erjadi seba lan mengala
menyebabkan nnya. Cend n yang akhi
ndawan; (A) awal dari med
lan, (D) cend
n cendawan ggu pertam
pada har anyak 95%
ami dua jen
n pertumbu dawan yang irnya memb
cendawan b dia, (C) cend dawan yang b
mulai mun a. Kontami ri ke-5 set dari selur nis kontami
B
D
uhan cenda g menyeran bunuh ekspl berawal dari dawan tumbu berawal darincul pada ha inasi cenda telah pena ruh eksplan inasi sekalig wan lebih ng eksplan an (Gambar eksplan, (B) uh cepat dan i sipula antar
ari kedua in wan dan ba anaman eks
n yang dita gus yaitu ba
4.2.5 Toksisitas Antibiotik dan Bahan Sterilisasi
Antibiotik merupakan senyawa yang dihasilkan oleh mikroorganisme seperti cendawan dan bakteri yang digunakan untuk membunuh mikrorganisme lain. Aktivitas antibiotik ialah mengganggu kinerja sel bakteri. Aktivitas antibiotik dalam mengganggu sel bakteri juga bisa mengganggu aktivitas sel tanaman yang akhirnya mematikan eksplan. Cantika (2006) menyatakan bahwa konsentrasi antibiotik yang terlalu tinggi akan dapat mematikan sel tanaman. Pemakaian bahan-bahan sterilisasi dengan konsentrasi yang terlalu tinggi ataupun waktu yang terlalu lama juga akan bersifat toksik bagi tanaman. Residu dari bahan sretilan yang masih tertinggal di eksplan juga akan dapat mematikan eksplan jika pembilasan kurang bersih.
Bahan sterilisasi digunakan untuk sterilisasi permukaan eksplan. Bahan sterilisasi bersifat toksik, oleh karena itu konsentrasi tidak boleh terlalu tinggi dan waktu sterilisasi tidak boleh terlalu lama. Bahan sterilisasi yang digunakan dalam penelitian ini dan diduga mengakibatkan terjadinya kematian eksplan adalah alkohol 70% dan NaOCl. Alkohol 70% merupakan bahan sterilisasi yang kuat dan dapat membunuh kontaminan, akan tetapi jika terlalu banyak akan mematikan jaringan tanaman. Dalam penelitian pendahuluan dilakukan percobaan penggunaan alkohol 70% selama 3 menit, akan tetapi 85%−90% eksplan mengalami kematian. Alkohol 70% digunakan dengan cara dioles di permukaan eksplan, hal ini dimaksukan untuk menghilangkan kontaminan yang ada di permukaan eksplan. Akan tetapi, Widyaningrum (2000) menyatakan bahwa penggunaan alkohol 70% dapat mengakibatkan eksplan mengalami dehidrasi yang diikuti pengeluaran klorofil dari jaringan eksplan. Hal ini dapat terlihat dari hilangnya warna hijau pada eksplan jabon yang dioles dengan menggunakan alkohol 70% (Gambar 10A). Hilangnya klorofil dari jaringan tanaman mengakibatkan jaringan eksplan mati setelah ditanam.
(Gambar membunu yang men menguran Konsentra dengan se sangat efe yang dina karena Na Gambar 10 4.2.6 Ke Ek botol eksp Kavitha e
panjang d eksplan ja tinggi bis lemah den (2009) m untuk ind perbanyak
A
10C). Ko uh kontamin neliti tentan ngi tingkat asi NaOCl edikit kerusa ektif dalam aikkan akan aOCl dalam0 Kerusaka coklat se eksplan m
emungkina ksplan jabon
plan dilak
et al. (2009 dari tunas d abon adalah sa menghas ngan lebih enyatakan duksi tunas kan dan pe
onsentrasi N nan. Hal ini ng efek per kontamina yang tepa akan pada e m mengontro n secara dr m konsentras
an jaringan etelah dioles mengalami k
an Dilakuka n yang tidak kukan pem
9) menyat dari jabon. K
dengan BA silkan lebih
panjang ta BAP meru s dan rege erkembanga
B
NaOCl ya i sesuai den rbedaan kon asi eksplan at dapat ef eksplan. Na ol tingkat k rastis mena si tinggi ber
eksplan ole s alkohol, (B kematian akib
an Multipl k mengalam indahan ke takan BAP Konsentrasi AP 1 mg/l da
h banyak tu angkai, sert upakan horm
nerasi tuna an tunas da
B
ng terlalu ngan pernya
nsentrasi N n alpukat fektif dalam aOCl merup kontaminasi aikkan pula sifat toksik
h bahan ste B) eksplan bat kerusaka
likasi mi kontamin
e media ho P bisa men i paling bai alam mediu unas, akan ta ukuran mon sitokin as. Penamb ari alpukat rendah ju ataan Zulfiq NaOCl terha
(Persea am
m mengont pakan bahan i, tetapi kon a persen ke
bagi tanam
erilisasi; (A) memutih ka an jaringan.
nasi dan tum ormon MS+ nghasilkan
ik untuk pe um ½ MS. K
tetapi tuna daun kecil. nin yang u bahan BAP
(Persea a
C
uga tidak qar et al. (2 adap keefek
mericana m trol kontam n sterilisasi nsentrasi N ematian eks man.
) eksplan m arena NaOC mbuh, seban +BAP 1,5 tunas sehat erbanyakan Konsentrasi
as yang m . Zulfiqar mum digun P penting u
americana M akan 2009) ktifan mill.). minasi yang NaOCl splan, enjadi Cl, (C) nyak 3 mg/l. t dan tunas lebih muncul
BAB V
KESIMPULAN DAN SARAN
5.1 KesimpulanProses karantina yang dilakukan belum tepat sehingga kontaminasi yang terjadi pada eksplan jabon masih tinggi. Perendaman antibiotik tidak bisa mengurangi tingkat kontaminasi eksplan karena dosis dan waktu perendaman kurang tepat. Eksplan jabon steril yang ditumbuhkan pada medium MS+BAP 1,5 mg/l mempunyai peluang multiplikasi.
5.2 Saran
SECARA
IN VITRO
LILIS PURNAWATI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
DAFTAR PUSTAKA
Acharrya S, Dash GK, Mondal S, Dash SK. 2010. Studies on glucose lowering efficacy of the Anthocephalus cadamba (Roxb.) Miq. roots. International Journal of Pharma and Bio Sciences 1(2):1−9.
Acharrya S, Rathore DS, Kumar HKS, Panda N. 2011. Screening of
Anthocephalus cadamba (Roxb.) Miq. root for antimicrobial and anthelmintic activities. International Journal Of Research in Pharmaceutical and Biomedical Sciences 2(1):297−300.
Ahmed F, Rahman S, Ahmed N, Hossain M, Biswas A, Sarkar S, Banna H, Khatun MA, Chowdhury MH, Rahmatullah M. 2011. Evaluation of
Neolamarckia cadamba (Roxb) Bosser leaf extract on glucose tolerance in glucose-induced hyperglycemic mice. Afr J Tradit Complement Altern Med
8(1):79−81.
Alam MA, Akter R, Subhan N, Rahman MM, Majumder MM, Nahar L, Sarker SD. 2008. Antidiarrhoeal property of the hydroetanolic extract of the flowering tops of Anthocephalus cadamba. Brazilian Journal of Pharmacognosy 18(2):155−159.
Alam MA, Subhan N, Chowdhury SA, Awal MA, Mustofa M, Rashid MA, Hasan CM, Nahar L, Sarker SD. 2011. Anthocephalus cadamba extract shows hypoglycemic effect and eases oxidative stress in alloxan-induced diabetic rats. Brazilian Journal of Pharmacognosy 21(1):155−164.
Altan F, Burun B, sahin N. 2009. Fungal contamination observed during micropagation of Lilium candidum L. and the effect of chemotherapeutic substances applied after sterilization. African Journal of Biotechnology
9(7):991−995.
Bausher MG, Niedz RP. 1998. A discussion of in vitro contamination control of explants from greenhouse and field grown trees. Proc Fla State Hort Soc
111:260−263.
Beyl CA. 2000. Getting Started With Tissue Culture-Media Preparation, Sterile Technique, And Labolatory Equipment. Di dalam: Trigiano RN, Gray DJ, editor. Plant Tissue Culture Concepts and Labolatory Exercise. Ed ke-2. London: CRC Press. hlm 21−53.
Boyce JS. 1961. Forest Pathology. New York: McGraw-Hill Co. Inc.
Bussa SK, Pinnapareddy J. 2010. Antidiabetic activity of stem bark of
Cantika. 2006. Pegaruh jenis dan Konsentrasi antibiotic terhadap kontaminasi dan perkembangan eksplan Heliconia psittacorum L.f. cv. Lady Di [skripsi]. Bogor : Fakultas Pertanian. Institut Pertanian Bogor.
Chandel M, Kaur S, Kumar S. 2011. Studies on the genoprotective/antioxidant potential of methanol extract of Anthocephalus cadamba (Roxb) Miq.
Journal of Medicinal Plants Research 5(19):4764−4770.
Chandrashekar KS, Prasanna KS. 2009. Antimicrobial activity of Anthocephalus cadamba Linn. Journal of Chemical and Pharmacentical Research
1(1):268−270.
Chaudhry Z, Abbas S, Yasmin A, Rashid H, Ahmed H, Anjum MA. 2010. Tissue culture studies in tomato (Lycopersicon esculentum) var. Moneymaker. Pak J Bot 42(1):155−163.
Dubey A, Nayak S, Goupale DC. 2011. Anthocephalus cadamba: a review.
Pharmacognosy Journal 2(18):71-76.
Evans DE, Coleman JOD, Kears A. 2003. Plant Cell Tissue. London: Bios Scientific Publisher.
Gurjar H, Jain SK, Irchhaiya R, Nandanwar R, Sahu VK, Saraf H. 2010. Hypoglicemic effects of methanolic extract of Anthocephalus cadamna bark in alloxan induced diabetic rats (Roxb) Miq. International Journal of Pharmaceutical Science and Research 1(3):79−83.
Hossain MA, Sultan MZ, Chowdhury AMS, Hasan CM, Rashid MA. 2011. Preliminary cytotoxicity and antimicrobial investigation of Anthocephalus chinensis. Journal of Scientific Research 3(3):689−692.
Jabeen N, Chaudhry Z, Rashid H, Mirza B. 2005. Effect of genotype and explants type on in vitro shoot regeneration of tomato (Lycopersicon esculentum
Mill). Pak J bot 37(4):899−903.
Joshi A. 2011. To study the effect of flow rate, concentration, and stop time on in vitro recovery of amoxicillin using a novel intermittent microdialysis technique [desertation]. New York: Faculty of the Arnold and marine Schwartz college. Long Island University Brooklyn.
Kamal GB, Lllich KG, Asadollah A. 2007. Effect of genotype, explant type, and nutrient medium components on canola (Brassica napus L) shoot in vitro organogenesis. Africal Journal of Biotechnology 6(7):861−867.
Kavitha M, Kalaimagal I, Mercy S, Sangeetha N, Ganesh D. 2009. In vitro plant regeneration from apical bud and nodal segments of Anthocephalus cadamba-an important sacred and medicinal tree. Journal of Forest Science
25(2):111−118.
Krisnawati H, Kallio M, Kanninen M. 2011. Anthocephalus cadamba Miq.: Ekologi, Silvikultur dan Produktivitas. Bogor: CIFOR.
Kumar N, Reddy MP. 2011. In vitro plant propagation: a review. Journal of Forest Science 27(2):61−72.
Mansur I, Tuheteru FD. 2010. Kayu Jabon. Jakarta: Penebar Swadaya
Michel Z, Hilaire KT, Mongomake K, Georges AN, Justin KY. 2008. Effect of genotype, explants, growth regulators, and sugar on callus inductionin cotton (Gossypium hirsutum L.). Australian Journal of Crop Science.
2(1):1−9.
Mishra RP, Siddique L. 2011. Antifungal properties of Anthocephalus cadamba
fruits. Asian Journal of Plant Science and Research 1(2):81−87.
Mishra RP. 2011. Antibacterial properties of Anthocephalus cadamba fruits.
Original Article 2(8):1−13.
Mondal S, Dash GK, Acharyya S. 2009. Analgesic, anti-inflammatory and antipyretic studies of Neolamarckia cadamba barks. Journal of Pharmacy Research 2(6):1133−1136.
Mulyana D, Asmarahman C, Fahmi I. Panduan Lengkap Bisnis dan Bertanam Kayu Jabon. 2011. Jakarta: Agromedia.
Naghmouchi S, Khouja ML, Rejeb MN, Boussaid M. 2008. Effect of growth regulators and explant origin on in vitro propagation of Ceratonia siliqua L. via cuttings. Biotechnol Agron Soc Environ 12(3):251−258.
Nugroho N. 2011. Kualitas kayu jabon dan potensi pemanfaatannya. Di dalam:
Seminar Nasional dan Pelatihan Budidaya Jabon Menuju Hutan Rakyat Produktif; Bogor, 30 Sep 2011.
Odutayo OI, Amusa NA, Okutade OO, Ogunsanwo YR. 2007. Determination of the sources of microbial contaminants of cultured plant tissue. Plant Pathology Journal 6(1): 77−81.
Onuoha IC, Eze CJ, Unamba CIN. 2011. In vitro prevention of browning in plantain culture. Journal of Biological Science 11(1):13−17.
Orwa C, Mutua A, Kindt R, Jamnadass R, Anthory S. 2009. Agroforestry tree database. A tree reference and selection guide version 4.0. http://www.worldagroforestry.org/treedb2/AFTPDFS/Anthocephalus
Poudyal BK, Du G, Zhang Y, Liu J, Shi Q. 2008. Studies on browning problem and phenols content on shoots of Yali, Aikansui and Abbe Fetel pears for in vitro culture. Front Agric China 2(3):321−330.
Queiroz C, Lopes MLM, Fialho E, Mesquita VLV. 2008. Polyphenol oxidase: characteristics and mechanism of browning control. Food Reviews International 24:361−375.
Suwandi U. 1992. Resistensi mikroba terhadap antibiotik. Cermin Dunia Kedokteran 70:46−49.
Widyaningrum WE. 2000. Teknik sterilisasi dalam kultur jaringan eksplan tunas aksilar bambu tali (Gigantochloa apus Kurz) [skripsi]. Bogor: Fakultas Kehutanan. Institut Pertanian Bogor.
Zulfiqar B, Abbasi NA, Ahmad T, Hafiz IA. 2009. Effect explant sources and different concentrations of plant growth regulators on in vitro shoot proliferation and rooting of avocado (Persea americana Mill.) CV. Fuerte.
Pak J Bot 41(5):2333−2346.
SECARA
IN VITRO
LILIS PURNAWATI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
SECARA
IN VITRO
LILIS PURNAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada
Departemen Silvikultur
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
secara in Vitro. Dibimbing oleh ARUM SEKAR WULANDARI dan EDHI SANDRA.
Jabon (Anthocephalus cadamba (Roxb.) Miq.) digunakan sebagai tanaman
jenis baru pada HTI, hutan rakyat, maupun sebagai tanaman pionir pada rehabilitasi lahan bekas tambang. Selama ini jabon diperbanyak dengan menggunakan benih. Meskipun benih jabon melimpah serta perbanyakan vegetatif konvensionalnya tidak sulit, namun perlu teknik budidaya yang lebih efektif, efisien, dan mampu menghasilkan bibit yang unggul dalam skala besar yaitu melalui kultur jaringan. Teknik kultur jaringan dapat dilaksanakan setelah diperoleh eksplan yang steril. Eksplan yang steril dapat diperoleh dengan menerapkan teknik sterilisasi yang tepat. Sterilisasi yang tidak tepat dapat mengakibatkan kontaminasi. Tujuan dari penelitian ini adalah untuk menetapkan
metode sterilisasi yang tepat untuk memperoleh eksplan jabon (Anthocephalus
cadamba (Roxb.) Miq.) yang steril secara in vitro dan siap dimultiplikasi.
Percobaan dilakukan dengan dua perlakuan. Perlakuan yang pertama yaitu karantina yang terdiri dari karantina 0 hari, karantina 7 hari dan karantina 14 hari. Perlakuan kedua ialah perendaman antibiotik yang terdiri dari perendaman 0 hari, perendaman 1 hari dan perendaman 2 hari. Penelitian dilakukan dengan 7 kombinasi perlakuan. Masing-masing kombinasi perlakuan diulang sebanyak 8 kali. Setiap ulangan terdiri atas 5 satuan percobaan berupa botol kultur. Peubah
yang diamati adalah persen kontaminasi oleh cendawan, bakteri, persen browning,
persen hidup, serta persen multiplikasi dari eksplan.
Proses karantina yang dilakukan belum tepat sehingga kontaminasi yang terjadi pada eksplan jabon masih tinggi. Perendaman antibiotik tidak dapat mengurangi tingkat kontaminasi eksplan karena dosis dan waktu perendaman kurang tepat. Penggunaan tanaman jabon muda yang berumur ± 3 bulan sebagai
bahan eksplan dapat membuat persentase browning dari eksplan rendah. Tingkat
kematian eksplan tertinggi disebabkan karena adanya kontaminasi, sebab kedua
oleh bahan sterilisasi, dan ketiga karena browning. Tingkat kontaminasi eksplan
keseluruhan sebesar 95%, dengan kontaminasi oleh cendawan sebesar 10,36%, kontaminasi bakteri sebesar 9,28%, dan bakteri+cendawan sebesar 75,36%.
Persentase browning eksplan sebesar 10,35% dari seluruh eksplan yang ditanam.
Eksplan jabon yang hidup sebesar 2,5% dari seluruh eksplan yang ditanam dengan
1,25% eksplan hidup akan tetapi tidak mengalami pertumbuhan (stagnan) dan
1,25% eksplan steril. Eksplan jabon steril ini mempunyai peluang 100% untuk dimultiplikasi pada media MS+BAP 1,5 mg/l.
LILIS PURNAWATI. Sterilization Shoot of Jabon Getting Sterile Explants Under Aseptic Condition. Supervised by ARUM SEKAR WULANDARI and EDHI SANDRA
Jabon (Anthocephalus cadamba (Roxb.) Miq.) is used as a new species in
plantation crops, forests, as well as pioneer plants in the rehabilitation of former mining land. During this species propagated using seeds. Although seeds overflow and vegetative conventional propagation is not difficult, but necessary techniques of cultivation is more effective, efficient, and able to produce superior seedling on a large scale is through tissue culture. Tissue culture technique can be implemented after the sterile explants obtained. Sterile explants can be obtained by applying the proper sterilization technique. Improper sterilization can result in contamination. This study aim to determined the appropriate method of sterilization to obtain explants jabon are sterile in vitro and ready multiplication.
The experiments were conducted with two treatment. The first treatment is made up of quarantine. That is quarantine 0 days, 7 days and 14 days. The second treatment consist of antibiotics was submersion. That is 0 day of immersion, 1 day, and 2 day. The study was conducted with 7 combined treatment. Each treatment combination was repeated 8 times. Each test trial consisted of 5 unit of culture bottles. Observed variable is the percent of contamination by fungus, bacteria, percent browning, percent survival, and multiplication of explants percents.
Quarantine process is done right so that the contamination has not occurred in explants jabon still high. Soaking antibiotics have no effect on the level of contamination and explants because the dose is less appropriate soaking time. The use of young jabon ±3 month old as the explants material can make a low percentage of browning of explants. The highest death rate due ti explants contamination because both the sterilization of materials and the third because of browning. Overall level of contamination of explants by 95%, with contamination by the fungus by 10,36%, 9,28% contamination by bacteria, and 75,36 percent contamination by bacteria+fungus. The percentage of explant browning of 10,35% of the explants grown. Jabon living explants of 2,5% of the explants grown by 1,25% explants alive but stagnant and 1,25% sterile explants. Jabon sterile explants has a 100% chance to multiplication on MS+BAP 1,5 mg/l medium.
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Sterilisasi
Tunas Jabon untuk Mendapatkan Eksplan Steril secara in Vitro” adalah benar
benar hasil karya saya sendiri dengan bimbingan dosen pembimbing dan belum
pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga
manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan
maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam daftar pustaka di bagian akhir dari skripsi ini.
Bogor, Juni 2012
Puji syukur kehadirat Allah SWT yang telah melimpahkan karunia serta
nikmatNya yang begitu tak terhingga, sehingga penulis dapat menyelesaikan
karya ilmiah yang berjudul “Sterilisasi Tunas Jabon untuk Mendapatkan Eksplan
Steril secara in Vitro”. Karya ilmiah ini merupakan salah satu syarat untuk
memperoleh gelar Sarjana Kehutanan di Departemen Silvikultur Fakultas
Kehutanan Institut Pertanian Bogor.
Penulis menyadari sepenuhnya bahwa masih banyak kekurangan dan
kelemahan dalam penulisan karya ilmiah ini. Oleh karena itu dengan segala
kerendahan hati penulis mengharapkan saran dan kritik yang membangun dari
semua pihak. Penulis berharap karya ilmiah ini bermanfaat bagi penulis
khususnya dan bagi semua pihak yang membutuhkan pada umumnya.
Bogor, Juni 2012
Pada kesempatan ini, penulis dengan kerendahan hati menyampaikan ucapan
terimakasih kepada:
1. Dr. Ir. Arum sekar Wulandari, MS dan Ir. Edhi Sandra M.Si sebagai dosen
pembimbing yang telah memberikan pengarahan, semangat, dorongan,
saran, serta doa dengan penuh kesabaran sampai terselesaikannya skripsi
ini.
2. Keluarga besar tersayang, Ayah, Ibu, kakak (Akhlis Aminuddin, Nina
Virani), adik (Mustofa Akhadinnur, Mohammad Zaenal Mustaqim,
Muhammad Hisyam Anwar, Nurul Hidayati, Ika Dwi Pertiwi), serta
keponakan tersayang (Faishal Daffa Mustofa) atas segala dukungan,
semangat, doa, dan kasih sayangnya.
3. Keluarga besar Departemen Silvikultur Fakultas Kehutanan, Institut
Pertanian Bogor.
4. Keluarga Laboratorium Kultur Jaringan (teh Puja, pak Santa, bi Ita, kak
Elin, kak Sabar, kak Dita, Santi, Revi) terimaksih atas bantuan, bimbingan
dan keramah-tamahannya selama penulis melakukan penelitian.
5. Seluruh pihak Laboratorium Kultur Jaringan PPLH IPB, (mba Yuli
Fitriyani S. Hut, Neti, mas Rahmat, mas Dennish) terimakasih atas
bantuan dan keramah tamahannya.
6. Keluarga besar ikhwah fahutan.
7. Keluarga besar DKM Ibaadurrahman.
8. Keluarga besar Silvikultur 44 (Adi, Adit, Alex, Budi, Cyntia, Dana, Dian,
Dik2, Dyah, Eko, Fitri, Hendra, Indah, Ipin, Izzu, Jenny, Rahmat, Rama,
Ranny, Ririn, Rinal, Rizki, Rovan, Romi, Rusdi, Said, Tya, Wiwit, Yani,
Yuda) terimakasih untuk doa, semangat, pelajaran, serta kebersamaannya.
9. Sahabat (Lilik, Miftah, Mput, Pita, Mpa, Nunung, Ijah, Aziz, Eka, Dhinda,
Laswi, Anien, kak Reytha, Ucik, Andri, Eri, Arif) yang selalu
menyemangati, menghibur, membantu, menemani, dan membesarkan hati.
10.Keluarga kedua (Ami, Yuyun, Nani, Fasta, Butik, Cici, Leni, Nesia, mba
Pondok Ratna.
11.Keluarga besar HKRB, HKRB 44 (Betari, Ria, Mumun, Sumi, Ida, Woro,
Yunda, Irwanto, Hendro, Mustofa, Yayan).
12.Keluarga besar BKPH Pangalengan dan BKPH Gunung Halu KPH
Bandung Selatan.
13.Semua pihak yang tidak dapat disebutkan satu per satu, tanpa mengurangi
Penulis dilahirkan di Lasem kabupaten Rembang, Jawa Tengah pada
tanggal 2 Maret 1989, sebagai anak kedua dari enam bersaudara dari pasangan
Nur Mudjiono dan Rukilah. Penulis memulai pendidikan dasar di MI
An-Nashriyyah Lasem tamat pada tahun 2001, kemudian melanjutkan pendidikan di
MTsN Lasem dan tamat pada tahun 2004, selanjutnya meneruskan pendidikan di
MAN Lasem dan tamat pada tahun 2007. Pada tahun 2007 juga, penulis diterima
di departemen Silvikultur Fakultas Kehutanan Institut Pertanian Bogor (IPB)
melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama kuliah penulis aktif di dalam organisasi kemahasiswaan, yaitu
DKM Ibaadurrahman sebagai staf divisi keputrian (2008-2009) dan korwat divisi
informasi dan komunikasi (2009-2010), penulis juga aktif di Himpunan Profesi
Silvikultur staf bendahara divisi HRD (2008-2009), dan staf divisi HRD
(2009-2010). Semasa perkuliahan penulis juga dipercaya sebagai asisten praktikum mata
kuliah Silvikultur semester ganjil tahun ajaran 2009-2010.
Kegiatan praktek yang telah dilakukan penulis di bidang kehutanan yaitu
Praktek Pengenalan Ekosistem Hutan (P2EH) di Kamojang dan Sancang pada
tahun 2009, kemudian Praktek Pengelolaan Hutan (P2H) pada tahun 2010 di
Hutan Pendidikan Gunung Walat (HPGW) Sukabumi, KPH Cianjur, dan Taman
Nasional Gunung Gede Pangrango (TNGP). Pada tahun 2011 penulis melakukan
Kuliah Kerja Profesi (KKP) di BKPH Pangalengan dan BKPH Gunung Halu KPH
Bandung Selatan.
Sebagai salah satu syarat memperoleh gelar sarjana kehutanan, penulis
melakukan penelitian yang berjudul “Sterilisasi Tunas Jabon untuk Mendapatkan
Eksplan Steril secara in Vitro” di bawah bimbingan Dr. Ir. Arum Sekar
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB II TINJAUAN PUSTAKA ... 3
2.1 Jabon (Anthocephalus cadamba (Roxb.) Miq.) ... 3
2.2 Teknik Perbanyakan Kultur Jaringan ... 4
2.2.1 Pengertian ... 4
2.2.2 Eksplan ... 5
2.2.3 Zat Pengatur Tumbuh (ZPT) ... 6
2.2.4 Sterilisasi Eksplan ... 7
2.2.5 Medium ... 8
2.2.6 Antibiotik ... 9
BAB III METODOLOGI ... 10
3.1 Waktu dan Tempat Penelitian ... 10
3.2 Bahan dan Alat ... 10
3.3 Metode Kerja ... 11
3.4 Pengamatan dan Pengambilan Data ... 15
3.5 Analisis Data ... 16
BAB IV HASIL DAN PEMBAHASAN ... 17
4.1 Hasil ... 17
4.2 Pembahasan ... 22
4.2.1 Kondisi Bahan Tanaman ... 22
4.2.2 Karantina Tanaman dan Perendaman Antibiotik .. 22
4.2.3 Tingkat Browning Eksplan ... 23
4.2.4 Tingkat Kontaminasi Eksplan ... 24
4.2.5 Toksisitas Antibiotik dan Bahan Sterilisasi ... 28
4.2.6 Kemungkinan Dilakukan Multiplikasi ... 29
1 Bahan sterilisasi yang biasa digunakan dalam sterilisasi
permukaan ... 8
2 Tingkat kontaminasi, kematian eksplan, browning, dan tingkat
hidup eksplan jabon terhadap kombinasi perlakuan karantina
dan perendaman antibiotik ... 17
1 Pemotongan tunas jabon sebagai eksplan pada tanaman jabon
berumur ±3 bulan ... 11
2 Eksplan yang mengalami kematian selama 4 minggu
pengamatan ... 18
3 Eksplan yang terkontaminasi selama 4 minggu
pengamatan ... 18
4 Pengaruh perlakuan karantina terhadap kondisi eksplan jabon
pada minggu ke-4 pengamatan ... 19
5 Pengaruh perlakuan perendaman terhadap kondisi eksplan jabon
pada minggu ke-4 pengamatan ... 20
6 Persentase kenaikan jumlah eksplan yang mengalami kontaminasi
bakteri dan cendawan hingga 7 hari setelah penanaman ... 20
7 Kondisi eksplan pada minggu ke-4 pengamatan ... 21
8 Kondisi tanaman indukan jabon di rumah kaca ... 25
9 Kontaminasi cendawan ... 27
1.1 Latar Belakang
Jabon (Anthocepalus cadamba (Roxb.) Miq.) merupakan salah satu fast growing spesies. Tanaman jabon mempunyai banyak manfaat, yaitu: (1) Semua bagian dari tanaman jabon mulai dari akar, batang, buah, bunga, dan daun mengandung zat-zat yang dapat dimanfaatkan dalam bidang farmasi (Dubey et al.
2011); (2) Kayu jabon digunakan dalam industri perkayuan untuk veneer, kayu lapis, papan lamina, industri kertas (pulp and paper), kayu pertukangan, dan meubel (Nugroho 2011); (3) Pohon jabon juga dapat berfungsi sebagai peneduh dan pelindung tanaman; (4) Digunakan dalam program reboisasi dan penghijauan, rehabilitasi lahan pasca tambang dan (5) Dapat memperbaiki sifat-sifat fisika dan kimia tanah di bawah tegakan (Orwa et al. 2009). Selain itu jabon mempunyai keunggulan sifat fisik, yaitu kemampuan beradaptasi pada berbagai tempat tumbuh tinggi, bebas dari hama dan penyakit serius, dan perlakuan silvikultur mudah (Krisnawati et al. 2011). Dengan berbagai manfaat dan keunggulan tersebut, membuat jabon digunakan sebagai tanaman jenis baru pada Hutan Tanaman Industri (HTI), hutan rakyat, maupun sebagai tanaman pionir pada rehabilitasi lahan bekas tambang. Hal ini membuat permintaan pasar dari tanaman jabon meningkat.
Pemenuhan permintaan pasar dari bibit jabon sampai saat ini dilakukan melalui perbanyakan generatif dengan benih. Meskipun benih jabon melimpah, dan perbanyakan vegetatif konvensionalnya tidak sulit, perlu teknik budidaya yang lebih efektif, efisien dan mampu menghasilkan bibit yang unggul, dan seragam dalam skala besar yaitu melalui kultur jaringan.
dalam kultur jaringan. Residu dari kegiatan sterilisasi yang tidak sempurna juga dapat mengakibatkan matinya jaringan eksplan yang akan mengakibatkan matinya eksplan. Kandungan fenol dari tanaman berkayu dapat teroksidasi yang akan mengakibatkan browning pada eksplan. Kontaminasi dan browning ini dapat mengganggu jalannya kegiatan kultur jaringan serta menurunkan produksi bibit. Prinsip dari proses sterilisasi eksplan adalah semaksimal mungkin menghilangkan mikroorganisme kontaminan yang tidak diinginkan dengan gangguan sekecil mungkin pada jaringan eksplan. Oleh karena itu, perlu adanya metode sterilisasi jabon yang tepat dalam perbanyakannya secara in vitro.
1.2 Tujuan
Tujuan dari penelitian ini ialah:
1. Menetapkan metode sterilisasi yang tepat untuk memperoleh eksplan jabon (Anthocepalus cadamba (Roxb.) Miq.) yang steril secara in vitro.
BAB II
TINJAUAN PUSTAKA
2.1 Jabon (Anthocepalus cadamba (Roxb.) Miq.)Jabon (A. cadamba Roxb. Miq.) merupakan jenis pohon cepat tumbuh yang masuk dalam famili Rubiaceae dan genus Anthocepalus. A. cadamba Roxb. Miq. ini bersinonim dengan A. chinensis (Lamk) A Rich, A. macrophyllus (Roxb.) Havil, A. indicus A. Rich., A. morindaefolius Korth, Nauclea cadamba (Roxb.),
Neolamarkcia cadamba (Roxb) Bosser, Sarcocephalus cadamba (Roxb) Kurz. Jabon memiliki nama daerah galupai, johan, kalampain, kelempi (Sumatera); jabon, jabun, hanja, kalampeyan, kelampaian (Jawa); jabon, jabun, haja, kelampeyan (Kalimantan); pontua, suge manai, pekaung, toa (Sulawesi); gumpayan, kelapan, mugawe (Nusa Tenggara); paribe, masarambi (Irian Jaya) ( Mansur et al. 2010).
Jabon adalah pohon berukuran besar dengan batang lurus dan silindris serta memiliki tajuk yang tinggi seperti payung dengan sistem percabangan yang khas mendatar. Kulit batang pada waktu muda berwarna abu-abu tanpa alur, sedangkan kulit pohon tua kasar dan sedikit beralur (Krisnawati et al. 2011).
Daun jabon merupakan daun tunggal, bertangkai panjang 1,5−4 cm dengan helaian daun agak besar (panjang 15−30 cm dan lebar 7−8 cm). Di awal pertumbuhannya, yakni 2−3 bulan setelah tanam, pada tanah yang subur dan cukup air, daun jabon dapat berkembang hingga berukuran panjang 68 cm dan lebar 38 cm (Mansur et al. 2010). Umumnya, jabon mulai berbunga pada umur 4−5 tahun. Buah jabon berupa buah majemuk yang berbentuk bulat dan lunak. Bagian atas bakal buah beruang yang terdiri atas jutaan biji berukuran sangat kecil, dari 1 kilogram buah jabon rata-rata dihasilkan 18−26 butir biji (Mulyana 2011).
menjadi kurang optimal apabila ditanam pada lahan berdrainase jelek (Mansur et al. 2010).
Cahaya merupakan faktor yang sangat penting bagi pertumbuhan jabon. Suhu maksimum yang dapat ditoleransi jabon adalah 32º−42ºC dan suhu minimum berkisar antara 3−15,5ºC. Rata-rata curah hujan di habitat alaminya adalah 1500−5000 mm per tahun (Krisnawati et al. 2011). Ketinggian yang da