DETEKSI DAN IDENTIFIKASI NEMATODA PURU AKAR
PADA TANAMAN KRISAN BERDASARKAN
KARAKTER MORFOLOGI DAN MOLEKULER
NURUL DWI HANDAYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Deteksi dan Identifikasi Nematoda Puru Akar pada Tanaman Krisan Berdasarkan Karakter Morfologi dan Molekuler” adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2012
Nurul Dwi Handayani
ABSTRACT
NURUL DWI HANDAYANI. Detection and Identification of Root Knot Nematodes in Chrysanthemum Based on Morphological and Molecular Characters. Supervised by ABDUL MUNIF and GEDE SUASTIKA.
Chrysanthemum (Dendranthema grandiflorum Tzvelev) is a horticultural commodity that has significant economic value for Indonesia. One of the constraints in the production of chrysanthemum is infection of root knot nematodes (Meloidogyne spp.). The objective of this research was to identify species of Meloidogyne associated with chrysanthemum in West Java based on morphological and molecular characters. Morphological identification method is based on the shape and size of eggs, second stage juveniles, males and females perineal pattern of nematodes. Molecular identification was done through polymerase chain reaction (PCR) using primer pairs specific to M. incognita, M. javanica and M. arenaria. The result showed identification morphologically was found three species of Meloidogyne namely M. javanica, M. incognita and M. arenaria based on the molecular characterization, M. javanica is the only one of species that associated with chrysanthemum in West Java.
RINGKASAN
NURUL DWI HANDAYANI. Deteksi dan Identifikasi Nematoda Puru Akar pada Tanaman Krisan Berdasarkan Karakter Morfologi dan Molekuler. Dibimbing oleh ABDUL MUNIF dan GEDE SUASTIKA.
Nematoda puru akar (NPA) merupakan nematoda parasit yang menyebabkan penyakit pada tanaman dan mengakibatkan penurunan produktivitas maupun kualitas tanaman. Gejala tanaman krisan yang terinfeksi NPA tampak pada bagian tanaman di atas permukaan tanah yaitu pertumbuhan tanaman terhambat, daun menguning dan layu, sedangkan gejala pada bagian akar adalah terbentuknya puru.
Penelitian ini dilakukan untuk mendeteksi dan mengidentifikasi NPA yang menginfeksi tanaman krisan. Sampel tanaman diperoleh dari tiga lokasi sentra produksi krisan di Jawa Barat yaitu Bogor, Cianjur dan Sukabumi. Dari setiap lokasi diambil dua varietas krisan sebagai sampel. Pengambilan sampel tanaman untuk mengetahui gejala, kejadian penyakit dan identifikasi spesies NPA. Identifikasi NPA berdasarkan karakter morfologi dilakukan di Laboratorium Nematologi Institut Pertanian Bogor (IPB) dan Laboratorium Fitopatologi Balai Uji Terap Teknik dan Metode Karantina Pertanian, Bekasi. Identifikasi NPA berdasarkan karakter molekuler dilakukan di Laboratorium Virologi IPB. Penelitian dilakukan pada bulan Oktober 2011 sampai dengan Maret 2012.
Identifikasi NPA menggunakan karakter morfologi dilakukan dengan mengamati dan mengukur panjang dan lebar telur; panjang tubuh dan panjang stilet larva; panjang tubuh, panjang stilet, ukuran knob dan panjang spikula nematoda jantan; dan pola perineal (perineal pattern) nematoda betina dewasa. Hasil identifikasi morfologi digunakan untuk menentukan primer spesifik spesies yang akan digunakan pada identifikasi NPA berdasarkan karakter molekuler.
Identifikasi spesies NPA berdasarkan karakter molekuler dilakukan dengan metode Polymerase Chain Reaction (PCR) menggunakan primer spesifik spesies untuk M. javanica, M. incognita dan M. arenaria. DNA diekstraksi dari puru akar krisan sejumlah 1, 3, 5 7, 9 puru dan nematoda betina dewasa sejumlah 1, 3, 5, 7, 9 ekor. Bufer yang digunakan untuk ekstraksi DNA dari puru adalah
hexadecyltrimethylammonium bromide (CTAB), sedangkan ekstraksi DNA nematoda betina dewasa digunakan bufer sodium dodecyl sulfate (SDS). Hasil PCR digunakan untuk sikuen nukleotida DNA, selanjutnya dilakukan analisis homologi dan pembentukan pohon filogeni menggunakan metode Neighbour Joining dengan program Mega 5.05.
Cina. Pohon filogeni menggambarkan bahwa M. javanica yang menginfeksi krisan di Jawa Barat memiliki hubungan kekerabatan dengan M. javanica yang ada di Cina. Deteksi NPA menggunakan metode PCR dapat dilakukan dengan sampel dari satu nematoda betina dewasa atau tiga puru akar krisan.
©Hak Cipta milik Insitut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
DETEKSI DAN IDENTIFIKASI NEMATODA PURU AKAR
PADA TANAMAN KRISAN BERDASARKAN
KARAKTER MORFOLOGI DAN MOLEKULER
NURUL DWI HANDAYANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama Mahasiswa NRP
Tanaman Krisan Berdasarkan Karakter Morfologi dan Molekuler
Nurul Dwi Handayani A352100074
Disetujui Komisi Pembimbing
Dr. Ir. Abdul Munif. MSc. Ag[. Dr. Ir. Qede Suastika. MSc.
Ketua Anggota
Diketahui
Ketua Program Studi Fitopatologi Dekan Sekolah Pascasarjana
Dr. Ir. Sri Hendrastuti Hidayat, MSc.
PRAKATA
Bismillahirrahmanirrahim,
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis dengan judul “Deteksi dan Identifikasi Nematoda Puru Akar pada Tanaman Krisan Berdasarkan Karakter Morfologi dan Molekuler”. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Fitopatologi Sekolah Pascasarjana IPB.
Pada kesempatan ini, penulis menyampaikan terima kasih yang tak terhingga kepada Dr. Ir. Abdul Munif, MSc. Agr. dan Dr. Ir. Gede Suastika, MSc. atas bimbingan, kesabaran, tambahan wawasan, saran, kritik dan dukungan moril yang sangat besar perannya dalam penyelesaian tesis ini. Ucapan terima kasih juga disampaikan kepada Ir. Banun Harpini, MSc., selaku Kepala Badan Karantina Pertanian, atas kesempatan yang diberikan kepada penulis untuk mengikuti program magister di IPB.
Penulis juga mengucapkan terima kasih kepada Dr. Ir. Bonny Poernomo Wahyu Soekarno, MS. sebagai penguji luar komisi pada ujian tesis serta Dr. Ir. Kikin H. Mutaqin MSi., sebagai perwakilan dari Program Studi Fitopatologi yang telah memberikan saran dalam perbaikan penulisan tesis ini. Tak lupa pula ucapan terima kasih penulis sampaikan kepada Dr. Ir. Antardjo Dikin, MSc., Ir. Ummu Salamah Rustiani, MSi serta rekan-rekan di Balai Uji Terap Teknik dan Metode Karantina Pertanian (BUTTMKP) atas bantuan dan dukungannya. Kepada rekan-rekan kuliah Jony Hidayat, Sri Setyowati, Selamet, Aulia Nusantara, Aprida Cristin, Dwi Wahidati Oktarima, Catur Yoga Hendro Utomo, Ratih Rahayu, Arif Kurniawan, Yuli Fitriati, Nur Fitriawati, Erna Maryana, Rahma Susila Handayani dan Lulu Sugiarto, terima kasih atas persahabatan dan kerjasamanya. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Abdul Mu’in Adnan MSi., Pak Gatut dan rekan-rekan dari laboratorium Nematologi IPB serta Dr. Ir. Sri Hendrastuti Hidayat, MSc., Mbak Tuti dan rekan-rekan dari laboratorium Virologi IPB atas persahabatan dan bantuannya selama penelitian.
Rasa hormat yang setinggi-tingginya penulis sampaikan kepada kedua orang tua tercinta, ayahanda Darmayana, ibunda Haryati yang telah memberikan kasih sayang, do’a dan nasihat. Ucapan terima kasih yang tak terhingga kepada suami tercinta Rohadyan Hanantyo Seno dan ananda tercinta Muhammad Dharil Pradipta atas do’a, kesabaran, kasih sayang dan dukungannya. Ucapan terima kasih disampaikan pula kepada keluarga Bapak Soeseno atas do’a dan dukungannya selama ini.
Akhir kata penulis haturkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis ini. Semoga hasil penelitian ini bermanfaat untuk kepentingan umat manusia dan ilmu pengetahuan.
Bogor, Mei 2012
RIWAYAT HIDUP
Penulis dilahirkan di Pati, Jawa Tengah pada tanggal 21 Juni 1975 sebagai anak kedua dari tiga bersaudara, pasangan H. Darmayana dan Hj. Haryati. Penulis menikah dengan Rohadyan Hanantyo Seno, ST pada tahun 1999 dan dikaruniai anak bernama Muhammad Dharil Pradipta pada tahun 2005.
Pada tahun 1993 penulis melanjutkan pendidikan sarjana di Universitas Muhammadiyah Yogyakarta pada jurusan Agronomi, lulus pada tahun 1998. Tahun 2000 penulis diterima sebagai tenaga teknis pada Badan Karantina Pertanian, Departemen Pertanian dan ditempatkan di Balai Besar Karantina Pertanian (BBKP) Soekarno Hatta. Pada tahun 2004 hingga 2007 penulis berkesempatan mengambil pendidikan sarjana pada jurusan Hama dan Penyakit Tanaman di Universitas Islam Nusantara Bandung sebagai syarat untuk menjadi petugas Pengendali Organisme Pengganggu Tumbuhan (POPT) Karantina.
DAFTAR ISI
Halaman
DAFTAR TABEL ………. xii
DAFTAR GAMBAR ……… xiii
PENDAHULUAN ………. 1
Latar Belakang ………. 1
Tujuan Penelitian ..………... 3
Hipotesis .…..………... 3
Manfaat Penelitian …...……….... 3
TINJAUAN PUSTAKA ……….... 4
Klasifikasi Nematoda Puru Akar (NPA) ………. 4
Biologi, Ekologi dan Distribusi Geografis NPA ………... 4
Biologi NPA …...……….... 4
Ekologi NPA …...………... 8
Distribusi Geografis NPA …...………... 8
Morfologi NPA ……….……….….. 9
Morfologi M. javanica ...……… 10
Morfologi M. arenaria ...……… 10
Morfologi M. hapla ……… 11
Morfologi M. incognita ..……… 11
Karakterisasi NPA Berdasarkan Molekuler ………... 11
BAHAN DAN METODE ………... 15
Tempat dan Waktu ...……… 15
Metode penelitian …………..………. 15
Pengamatan Gejala Penyakit Tanaman ……….. 15
Identifikasi Spesies Meloidogyne Berdasarkan Karakter Morfologi ………..………. 18
Identifikasi Spesies Meloidogyne Berdasarkan Karakter Molekuler …………..………...… 19
HASIL DAN PEMBAHASAN ……….…… 23
Gejala Penyakit NPA di Jawa Barat …………..………..… 23
Identifikasi Meloidogyne spp. Berdasarkan Karakter Morfologi .. 26
Identifikasi Meloidogyne spp. Berdasarkan Karakter Molekuler .. 32
Deteksi Meloidogyne spp. secara Molekuler……..………..… 34
KESIMPULAN DAN SARAN ....………. 37
DAFTAR PUSTAKA ………... 38
DAFTAR TABEL
Halaman
1 Indeks massa telur Meloidogyne spp. berdasarkan jumlah massa
telur per tanaman (Shurtleff & Averre 2000) ... 17 2 Ukuran telur, larva dan nematoda jantan Meloidogyne spp. ... 31 3 Persentase populasi Meloidogyne spp. berdasarkan identifikasi
pola perineal nematoda betina dewasa ... 32 4 Homologi sikuen nukleotida DNA M. javanica dari Bogor dan
DAFTAR GAMBAR
Halaman
1 Siklus hidup Meloidogyne spp. : Telur (A), Larva I (B), Larva II (C), Larva III (D), Larva IV (E), Larva V (dewasa) (F), Nematoda jantan dan betina (G)
6
2 Pola perineal M. javanica, M. arenaria, M. hapla, M. incognita
10
3 Pola pengambilan sampel tanaman krisan …... 14 4 Gejala infeksi NPA pada pertanaman krisan di daerah Bogor (A)
dan Cianjur (B), Pertumbuhan tanaman menjadi terhambat dan
layu (C) dan bagian akar terdapat puru (D dan E) ... 23 5 Pertanaman krisan di Sukabumi (A), Akar krisan tidak
menunjukkan gejala puru (B) ... 25 6 Telur Meloidogyne dengan perbesaran mikroskop 200x terdapat
pada krisan varietas 04 (A), Puma (B), Elza (C) dan Karyushi (D) 27 7 Bagian anterior (A) dan posterior (B) larva Meloidogyne spp.,
dengan perbesaran mikroskop 400x ... 28 8 Nematoda jantan Meloidogyne spp. dengan perbesaran mikroskop
50x ...……….………..… 28 9 Bagian anterior nematoda jantan M. javanica (A), Bagian anterior
nematoda jantan M. incognita (B), Bagian posterior nematoda
jantan (C) dengan perbesaran mikroskop 400x ... 29 10 Nematoda betina dewasa Meloidogyne yang terdapat pada
pertanaman krisan di Bogor dan Cianjur (A), Pola perineal M.
javanica (B),M. incognita (C), M.arenaria (D) ... 30 11 Visualisasi hasil PCR Meloidogyne spp. dari empat varietas krisan
di Bogor dan Cianjur dengan primer M. javanica (720 bp) pada 1% gel agarose: M = marker 100 bp, 1 = varietas 04, 2 = varietas
Puma, 3 = varietas Elza, 4 = varietas Karyushi ...……... 32 12 Visualisasi hasil PCR Meloidogyne spp. dari empat varietas krisan
di Bogor dan Cianjur dengan primer M. arenaria (420 bp) dan M. incognita (999 bp) pada 1% gel agarose, M = marker 100 bp dan 1 Kb ; 1 = varietas 04, 2 = varietas Puma, 3 = varietas Elza, 4 =
varietas Karyushi ...………... 33 13 Pohon filogeni M. javanica yang menginfeksi krisan di Jawa Barat
(Indo-5E-F dan Indo 7H-F) dengan M. javanica yang ada di Cina dan M. arenaria yang ada di USA menggunakan metode
14 Visualisasi fragmen DNA hasil PCR Meloidogyne spp. dari empat varietas krisan di Bogor dan Cianjur menggunakan primer M. javanica pada elektroforesis gel agarose 1%. K(+) = DNA 5♀, K (-) = DNA tanaman, M = marker 100 bp;1P, 3P, 5P, 7P dan 9P = DNA Meloidogyne dari puru akar krisan; 1♀, 3♀, 5♀,7♀dan 9♀=
PENDAHULUAN
Latar Belakang
Krisan (Dendranthema grandiflorum Tzvelev) merupakan komoditas hortikultura penting yang menempati urutan kedua setelah Gerbera dalam tiga besar trend komoditas ekspor tanaman hias di Indonesia selama tahun 2010 (Barantan 2011). Kebutuhan masyarakat terhadap bunga krisan semakin meningkat dari tahun ke tahun ditandai dengan peningkatan produksi selama sebelas tahun terakhir. Pada tahun 2000 produksi krisan tercatat 2.3 juta tangkai. Pada tahun 2001 dan 2002 meningkat menjadi masing-masing 7.4 dan 25.8 juta tangkai, dan hingga pada tahun 2010 tercatat 185.3 juta tangkai. Namun demikian, selama periode 2009-2010 terjadi penurunan luas panen krisan di beberapa sentra produksi krisan di Indonesia seperti Sumatera Utara, Sumatera Barat, Jawa Barat dan Sulawesi Utara (BPS 2011).
Sistem usaha pertanian krisan di Indonesia menghadapi berbagai kendala yang berkaitan dengan produktivitas dan kualitas tanaman. Salah satu penyebabnya adalah infeksi penyakit oleh nematoda parasit tanaman, yaitu nematoda puru akar (NPA). NPA adalah nama umum untuk spesies Meloidogyne. Nematoda ini mampu menyerang lebih dari 2000 spesies tanaman dan mengakibatkan kehilangan hasil panen sebesar 5-20% (Agrios 2005). Kehilangan hasil pada berbagai tanaman pertanian yang disebabkan oleh Meloidogyne spp. sendiri maupun kombinasi dengan penyakit lain diperkirakan sebesar 10-12% per tahun, terutama di daerah tropis dan subtropis (Sasser et al. 1981). Philis (1997) melaporkan bahwa kehilangan hasil panen carnation (Dianthus caryophillus) di Cyprus yang diakibatkan oleh infeksi NPA mencapai 25%.
tanaman tidak drastis, bahkan sering tertutup oleh gejala infeksi penyakit lain (Mustika 2010).
Berdasarkan pada lampiran Peraturan Menteri Pertanian Nomor 93/Permentan/OT.140/12/2011, Tanggal 29 Desember 2011, Tentang Jenis-jenis Organisme Pengganggu Tumbuhan Karantina (OPTK) Golongan I Kategori A1 dan A2, Golongan II Kategori A1 dan A2, Tanaman Inang, Media Pembawa dan Daerah Sebarnya, terdapat enam OPTK A2 yang berpotensi menurunkan produktivitas dan kualitas tanaman krisan, yaitu : Meloidogyne hapla Chitwood,
Chaetanaphothrips orchidii, Liriomyza trifolii Burgess, Erwinia chrysanthemi
(Bulkholder, Mc. Fadden & Dimock), Pseudomonas cichorii, Tomato spotted wilt tospovirus. OPTK A2 adalah organisme pengganggu tumbuhan yang sudah ada di Indonesia dan keberadaannya masih terbatas.
Indonesia mengekspor krisan berupa bibit maupun bunga potong ke beberapa negara seperti Jepang, Belanda, Thailand, Saudi Arabia dan Timor Leste (Barantan 2011). Menghadapi era pasar global yang ditandai oleh persaingan yang ketat antar negara, segenap pelaku pada sistem agribisnis harus mengetahui, memahami dan mempraktekkan berbagai peraturan Sanitary and Phytosanitary Measures (SPS) dan Technical Barrier to Trade (TBT) dalam rangka perencanaan dan pelaksanaan ekspor produk pertanian. Salah satunya dengan memenuhi persyaratan kesehatan tanaman yang disertifikasi oleh Badan Karantina Pertanian.
International Plant Protection Convention (IPPC) dan SPS Agreement
Tujuan Penelitian
Penelitian ini bertujuan mengidentifikasi spesies NPA yang berasosiasi dengan tanaman krisan di sentra produksi krisan di Jawa Barat menggunakan karakter morfologi dan molekuler.
Hipotesis
1. Terdapat beberapa spesies Meloidogyne yang berasosiasi dengan tanaman krisan.
2. Metode deteksi Meloidogyne spp. berdasarkan karakter molekuler memberikan hasil yang cepat dan akurat.
Manfaat Penelitian
1. Memberikan informasi baru tentang NPA yang berasosisasi dengan tanaman krisan yang terdapat di sentra produksi krisan di Jawa Barat.
2. Hasil identifikasi nematoda dapat digunakan sebagai dasar ilmiah dalam menentukan tindakan karantina untuk tujuan ekspor.
TINJAUAN PUSTAKA
Klasifikasi Nematoda Puru Akar (NPA)
Nematoda puru akar adalah nama umum untuk spesies Meloidogyne. Kata
Meloidogyne berasal dari bahasa Yunani melon (apel atau labu) + oides, oid (menyerupai) + gyne (betina) = betina berbentuk apel (apple-shaped female) (Singh & Sitaramaiah 1994). Klasifikasi Meloidogyne spp. terdiri dari: super kingdom Eukaryota, kingdom Metazoa, phylum Nematoda, kelas Chromadorea, ordo Tylenchida, family Meloidogynidae, subfamili Meloidogyninae, genus
Meloidogyne (CABI 2007).
Meloidogyne spp. merupakan nematoda penyebab penyakit tanaman (phytonematodes) paling dikenal di seluruh dunia karena gejala pada bagian akar sangat menonjol dan spesifikyaitu menyebabkan puru pada akar tanaman. Hingga saat ini sekitar 100 spesies Meloidogyne yang telah dideskripsikan (Mitkowski & Abawi 2003). Sebanyak enam spesies diantaranya menjadi perhatian utama karena dapat menurunkan produksi tanaman dan merugikan secara ekonomi, yaitu
M. incognita, M. javanica, M. arenaria , M. hapla, M. chitwoodi dan M. fallax
(Adam et al. 2007).
Biologi, Ekologi dan Distribusi Geografis NPA
Biologi NPA
Meloidogyne spp. termasuk nematoda endoparasit menetap dan bersifat obligat pada bagian akar dan umbi tanaman monokotil, dikotil, perdu dan berkayu. NPA termasuk penyebab penyakit utama pada tanaman pangan, sayuran, buah dan tanaman hias yang tumbuh di daerah tropis, subtropis, dan iklim sedang (Nickle 1991).
Cara reproduksi dan siklus hidup Meloidogyne spp. sangat bervariasi antar spesies, beberapa bereproduksi secara amfimiksis (cross-fertilization), ada juga yang bereproduksi secara partenogenesis (obligatory mitotic parthenogenesis), dan yang lain dengan cross-fertilization dan partenogenesis (facultative meiotic parthenogenesis) (Eisenback et al. 1981). M. incognita, M. arenaria, M. hapla
M. exigua dan M. hapla (ras A) bereproduksi secara meiosis partenogenesis (Trianthaphyllou 1982) dan M. carolinensis, M. microtyla bereproduksi secara amfimiksis (Castagnone-Sereno 2006). Spesies NPA yang partenogenesis mempunyai perbandingan jenis kelamin bersifat epigenetik, yaitu sangat dipengaruhi oleh faktor lingkungan, seperti kepadatan koloni, kualitas tanaman inang dan suhu. Ketika kondisi lingkungan menguntungkan, larva berkembang menjadi betina, tetapi dalam kondisi lingkungan yang tidak menguntungkan, berkembang menjadi nematoda jantan (Trianthaphyllou 1982).
Pada dasarnya semua spesies Meloidogyne mempunyai siklus hidup yang sama. Skema siklus hidup Meloidogyne spp. sebagai berikut:
Gambar 1 Siklus hidup Meloidogyne spp. : Telur (A), Larva I (B), Larva II (C), Larva III (D), Larva IV (E), Larva V (dewasa) (F), Nematoda jantan dan betina (G)
Tahap pertama siklus hidup dimulai dari telur. Nematoda betina dewasa berada di dalam akar menghasilkan telur yang disimpan dalam massa gelatin (paket telur), sebagian atau semuanya melekat pada jaringan akar, menyelubungi telur dan bertindak sebagai penghalang kehilangan air (CABI 2007). Terdapat sekitar 400-500 telur berbentuk oval dalam satu paket telur, bahkan menurut Shurtleff dan Averre (2000) sampai 1000 atau lebih. Ukuran paket telur kadang lebih besar dari ukuran nematoda betina dewasa (Singh & Sitaramaiah 1994).
Selain nematoda dewasa dan telur, ada empat fase larva dan empat kali ganti kulit dalam siklus hidup M. incognita. Larva I berkembang dalam telur, dan ganti kulit pertama biasanya terjadi di dalam cangkang, kemudian berkembang menjadi larva II, yang menembus ke dalam tanah atau jaringan tanaman. Larva II bergerak ke arah akar dan menumpuk di ujung akar, membuat luka kecil atau penetrasi bagian akar. Selanjutnya masuk ke jaringan korteks akar, kemudian bergerak di dalam akar secara interseluler untuk mencari tempat makan di dalam jaringan vaskuler. Meloidogyne spp. dapat menyebabkan terjadinya pembesaran sel yang merupakan respon tanaman terhadap sekresi nematoda (CABI 2007).
Setelah nematoda mulai makan pada jaringan tanaman inang, ganti kulit kedua, ketiga dan keempat terjadi sehingga masing-masing menjadi larva stadia ketiga, keempat dan kelima atau dewasa. Fase ganti kulit, pertumbuhan dan perkembangan nematoda bersamaan dengan perkembangan sistem reproduksi pada kedua jenis kelamin. Larva II berganti kulit sebanyak tiga kali untuk menjadi imago jantan dengan tubuh seperti cacing (vermiform). Imago jantan hidup di luar akar dan tidak menginfeksi akar. Nematoda betina berbentuk seperti buah pir/bulat (pyriform), menetap di dalam jaringan tanaman dengan bagian posterior tubuhnya berada di permukaan akar. Betina dewasa mampu menghasilkan telur dalam jumlah banyak dan sebagian besar spesies NPA bereproduksi secara partenogenesis (Bekal & Lambert 2002).
nematoda ini kurang toleran terhadap kondisi suhu yang tinggi. Suhu optimum untuk siklus hidup M. javanica, M. incognita, dan M. arenaria sekitar 25-30 ºC.
M. javanica melengkapi siklus hidupnya selama 21-25 hari pada suhu 26-27 ºC tetapi pada suhu 14-16 ºC siklus hidupnya selama 50-60 hari (Singh & Sitaramaiah 1994). Satu generasi M. arenaria berlangsung selama 3 minggu, sedangkan pada kondisi dingin, siklus hidupnya berlangsung selama 2-3 bulan (CABI 2007). Beberapa jam setelah dihasilkan telur oleh betina, terjadi perkembangan embrio menjadi dua, empat, delapan sel dan seterusnya sampai terbentuk larva melingkar di membran telur dengan dilengkapi stilet (Singh & Sitaramaiah 1994).
Ekologi NPA
Nematoda parasit tanaman menggunakan kombinasi antara strategi bertahan hidup dan perilaku fisiologis untuk mengatasi kendala faktor biotik dan abiotik. Bagi nematoda endoparasit, bertahan di dalam jaringan tanaman atau membatasi mobilitas di lingkungan tanah merupakan cara menghindari kendala faktor biotik seperti serangan predator. Beberapa nematoda mempunyai kutikula yang tebal untuk melindungi diri dari serangan predator. Nematoda ektoparasit mempunyai strategi pertahanan diri dengan cara berpindah-pindah dari satu inang ke inang yang lain. Faktor suhu dan ketersediaan air menjadi kendala faktor abiotik bagi nematoda. Kemampuan cryptobiosis yang dimiliki nematoda menjadikan nematoda mampu mengatasi kekeringan, panas dan dingin sehingga dapat bertahan hidup (Bekal & Lambert 2002).
Distribusi Geografis
Kebanyakan NPA terdapat di daerah sekitar perakaran tanaman antara 5 sampai 25 cm dari permukaan tanah. Penyebaran NPA terutama oleh air atau tanah yang menempel pada peralatan pertanian atau terinfeksi oleh bahan tanam yang diangkut dari daerah terinfeksi ke daerah yang bebas infeksi (Agrios 2005).
M. javanica sudah ditemukan di Jawa, Sumatera, Nusa Tenggara dan Sulawesi. Nematoda tersebut juga ditemukan dan tersebar di wilayah Asia, Amerika, Oceania, Eropa dan Afrika. Keberadaan M. chitwoodi masih terbatas di Eropa, Afrika Selatan dan Amerika sedangkan M. fallax terdapat di Eropa dan wilayah Oceania (CABI 2007).
Delapan spesies NPA yang belum terdapat di Indonesia dan tercantum dalam daftar OPTK A1 Badan Karantina Pertanian, yaitu : M. acronea, M. brevicauda, M. chitwoodi, M. cofeicola, M. decalineata, M. exigua Goeldi, M. naasi, M. oteifae (elm).
Morfologi NPA
Bentuk pola perineal (perineal pattern) nematoda betina dewasa merupakan karakter utama dalam identifikasi spesies NPA secara morfologi. Karakter lain yang dapat digunakan untuk idenfitikasi secara morfologi, yaitu bentuk nematoda pada setiap tahap siklus hidup, bentuk bagian tubuh dan ukuran dari larva dan nematoda jantan (Eisenback et al. 1980).
Larva nematoda fase pertama dan kedua berbentuk seperti cacing dan berkembang di dalam telur masing-masing. Nematoda jantan dan betina dewasa spesies NPA mudah dibedakan berdasarkan bentuknya. Nematoda jantan berbentuk vermiform, yaitu bentuk tubuhnya seperti cacing dengan panjang tubuh 1.2-1.5 mm dan diameter 30-36 µm (Agrios 2005). Pada bagian kepala terdapat lubang mulut, bibir, stilet, lubang kelenjar dorsal (Dorsal Esophageal Gland Orifice/DEGO) dan median bulb. Bagian tubuh terdapat oesophagus
(kerongkongan) dan intestine (usus) serta bagian ekor terdapat spikula dan gubernakulum (Nickle 1991). Nematoda betina dewasa berbentuk pyriform, yaitu bentuk tubuhnya seperti buah pir/bulat dengan panjang tubuh 0.40-1.30 mm dan lebar 0.27-0.75 mm (Agrios 2005).
Metode pola perineal (perineal pattern) sering digunakan untuk membedakan spesies NPA berdasarkan bentuk lengkungan pada bagian posterior
nematoda betina dewasa (Eisenback et al. 1980). Bentuk lengkungan pada bagian
posterior dijadikan penciri utama untuk membedakan spesies NPA (Gambar 2).
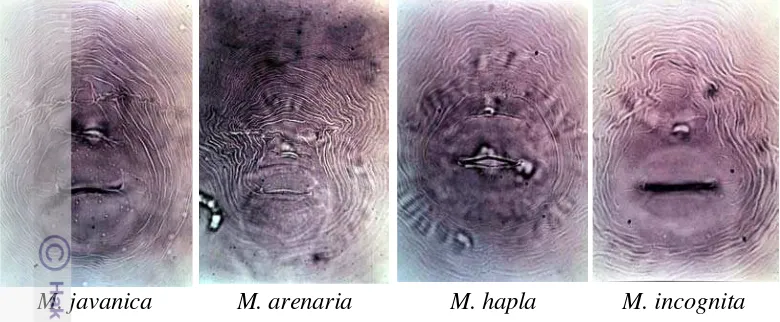
M. javanica M. arenaria M. hapla M. incognita
Gambar 2 Pola perineal M. javanica, M. arenaria, M. hapla, M. incognita
(http://plpnemweb.ucdavis.edu/nemaplex/taxadata/G076.HTM)
Morfologi M. javanica
M. javanica memiliki telur berbentuk oval dengan panjang 71-89 (81) µm dan lebar 27-35 (30) µm. Larva berbentuk vermiform dengan ukuran panjang 402-560 µm. Panjang ekor berukuran 51-63 µm dengan ujung ekor yang membulat hingga runcing, panjang stilet 10-12 µm. Nematoda jantan berbentuk
vermiform memiliki panjang tubuh 757-1297 µm, stilet kuat dengan panjang sekitar 18-22 µm. M. javanica betina berbentuk pyriform dengan ukuran panjang 541-804 (657) µm dan lebar 311-581 (431)µm. Memiliki stilet yang kuat dengan panjang 14-18 (16) µm. Pola perineal dengan ciri utama adanya garis lateral yang memisahkan lengkung dorsal dan lengkung ventral (Eisenback et al. 1991).
Morfologi M. arenaria
seperti bahu, ujung tonjolan kutikula bercabang seperti garpu (Eisenback et al. 1991).
Morfologi M. hapla
M. hapla memiliki telur berbentuk oval dengan ukuran panjang 71-91 (78) µm dan lebar 26-40 (31) µm. Larva memiliki panjang tubuh berukuran 312-355 (337) µm, panjang ekor 33-48 (43) µ m dan panjang stilet 10-12 (11) µm. Nematoda jantan memiliki panjang tubuh berukuran 791-1432 (1139) µm, panjang stilet 17.3-22.7 (20.0) µm dan lebar pangkal stilet 2.5-5.0 (3.5) µm, panjang spikula 21.6-28.1 (25.7) µm dan panjang gubernakulum 7.2-9.4 (8.2) µm. Nematoda betina berbentuk pyriform dengan ukuran panjang 419-845 (612) µm dan lebar 311-561 (430) µm, memiliki stilet yang panjangnya 10-13 (11) µm dan lebar pangkal stilet 2-3 (2) µm. Pola perineal memiliki ciri adanya tonjolan-tonjolan seperti duri pada daerah ujung ekor (Eisenback et al. 1991).
Morfologi M. incognita
M. incognita memiliki telur berbentuk oval dengan panjang 63-90 µm dan lebar 24-37 µm (32 µm). Larva berbentuk vermiform dengan ukuran panjang 346-463 (405) µm. Panjang ekor berukuran 42-63 (52) µm dengan ujung ekor yang membulat hingga runcing, panjang stilet 10-12 µm. Nematoda jantan berbentuk
vermiform, panjang tubuh 1108-1953 µm memiliki stilet yang kuat dengan panjang 23-25 µm dan bagian ujungnya runcing. Nematoda betina berbentuk
pyriform, dengan ukuran panjang 500-723 (609) µm dan lebar 331-520 (415) µm. Betina M. incognita dilengkapi stilet yang kuat dengan ukuran panjang 13-16 (14) µm. Pola perineal memiliki ciri lengkung dorsal berbentuk persegi (Eisenback et al. 1991).
Karakterisasi NPA Berdasarkan Molekuler
Metode identifikasi berdasarkan karakter morfologi memerlukan banyak
keterampilan dan sering tidak meyakinkan untuk suatu spesies karena mempunyai
variasi bentuk dan ukuran dalam suatu populasi. Identifikasi NPA berdasarkan
karakter molekuler dengan metode Polymerase Chain Reaction (PCR)
Reaksi berantai PCR adalah suatu metode enzimatis untuk
melipatgandakan secara eksponensial suatu sikuen nukleotida tertentu dengan cara
in vitro. Empat komponen utama pada proses PCR adalah (1) DNA cetakan, yaitu
fragmen DNA yang akan dilipatgandakan, (2) oligonukleotida primer, yaitu suatu
sikuen oligonukleotida pendek (15-25 basa nukleotida) yang digunakan untuk
mengawali sintesis rantai DNA, (3) deoksiribonukleotida trifosfat (dNTP) terdiri
atas dATP, dCTP, dGTP, dTTP, dan (4) enzim DNA polimerase, yaitu enzim
yang melakukan katalisis reaksi sintesis rantai DNA. Komponen lain yang juga
penting adalah senyawa bufer. Proses PCR terjadi di dalam mesin PCR yang
disebut thermocycler (Yuwono 2006).
PCR dilakukan untuk 30-40 siklus dalam mesin thermocycler dengan program pemanasan dan pendinginan. Tiap siklus reaksi PCR terdiri atas tiga tahap, yaitu pemisahan untai DNA(denaturation) terjadi pada suhu 95 °C selama 3-4 menit, penempelan primer (annealing) pada suhu 55-60 °C selama 1-2 menit dan pembentukan untai DNA baru (extension) pada suhu 70 °C selama 1-2 menit (Hooper et al. 2005).
Metode diagnosa berbasis PCR telah dikembangkan di Inggris dan Amerika Serikat. Teknik ini cepat dan relatif mudah digunakan walaupun di laboratorium terpencil dan laboratorium dengan fasilitas terbatas (Dickinson 2005). Kondisi ini berbeda dengan di Indonesia, untuk deteksi dengan metode PCR diperlukan persiapan sarana, prasarana dan sumber daya manusia (SDM) yang memadai.
Peralatan yang diperlukan dalam proses PCR adalah mesin PCR, gel elektroforesis, alat dan sistem untuk memvisualisasikan hasil (UV transilluminator dan kamera). Sumber daya utama yang diperlukan adalah enzim-enzim, bahan kimia dan peralatan plastik sekali pakai (Dickinson 2005).
Menurut Adam et al. (2007) beberapa metode identifikasi molekuler yang pernah dilakukan untuk mendeteksi Meloidogyne spp yaitu PCR oleh Harris et al. (1990) berhasil melakukan amplifikasi DNA mitokondria dari larva dengan reaksi PCR. Metode tersebut dikembangkan oleh Power dan Harris (1993) dengan merancang primer untuk amplifikasi daerah antara kode gen mitokondria untuk oksidasi sitokrom sub unit II dan primer 16S rRNA dan digunakan untuk mengidentifikasi lima spesies Meloidogyne yaitu : M. incognita, M. javanica, M. arenaria, M. hapla dan M. chitwoodi.
Metode identifikasi NPA berdasarkan PCR juga dilakukan oleh Cenis (1993) dengan amplifikasi hasil random amplified polymorphic DNA (RAPD) dari larva nematoda dalam dua reaksi terpisah berhasil menghasilkan amplifikasi pita spesies diagnostik dengan beberapa pita minor, meskipun sebagian reaksi tidak berhasil mengamplifikasi pita. Sementara itu Williamson et al. (1997) berhasil mengidentifikasi M. hapla dan M. chitwoodi menggunakan primer khusus
sequence characterized amplified region (SCAR) untuk amplifikasi ekstrak DNA dari larva nematoda menggunakan metode gabungan proteinase K. Pada tahun 2000, Ziljstra menggunakan metode nested PCR untuk mengidentifikasi M. hapla,
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Nematologi, Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dan Laboratorium Fitopatologi Balai Uji Terap Teknik dan Metode Karantina Pertanian (BUTTMKP) Bekasi, sejak Oktober 2011 hingga Maret 2012.
Metode Penelitian
Pengamatan Gejala Penyakit Tanaman
Pemilihan lahan dan pendataan. Lahan yang digunakan untuk
pengambilan sampel krisan adalah sentra produksi krisan di daerah Jawa Barat, yaitu: Bogor, Cianjur dan Sukabumi. Pada saat pengambilan sampel dilakukan pendataan untuk mendapatkan informasi tentang lokasi kebun, luas kebun, ketinggian tempat, jenis tanah, suhu, kelembaban, varietas krisan yang ditanam dan teknik budidaya.
Pengambilan sampel tanaman krisan. Pengambilan sampel tanaman krisan dilakukan untuk mengetahui kejadian penyakit akibat infeksi NPA pada lahan pertanaman dan untuk identifikasi nematoda dari tanaman bergejala NPA.
Sampel tanaman diambil secara sistematis (Gambar 3) berdasarkan pola pengambilan sampel menurut Coyne et al. (2007).
Keterangan: = sampel tanaman krisan = tanaman krisan dalam bedengan
Jumlah sampel yang diambil untuk masing-masing varietas krisan sebanyak 20 tanaman, dari setiap sentra produksi yang mewakili kondisi lahan pada pertanaman krisan.
Sampel yang diambil berupa akar dan tanah di daerah perakaran. Tanaman yang bergejala dicabut kemudian dipisahkan antara bagian akar dan tanahnya. Selanjutnya sampel dimasukkan dalam polybag, diberi label yang berisi keterangan tentang lokasi kebun, umur tanaman, varietas dan tanggal pengambilan sampel kemudian diletakkan dalam tempat terlindung untuk mencegah terjadinya kerusakan akibat fluktuasi suhu dan kelembaban selama perjalanan ke laboratorium Nematologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian IPB.
Menghitung kejadian penyakit akibat infeksi Meloidogyne spp.
Kerusakan tanaman oleh infeksi nematoda merupakan kerusakan mutlak atau yang dianggap mutlak. Penilaian kejadian penyakit tanaman menurut Agrios (2005):
Kejadian penyakit =
Jumlah sampel tanaman yang terifeksi
x 100% Jumlah semua sampel tanaman
Tabel 1 Indeks massa telur Meloidogyne spp. berdasarkan jumlah massa telur per tanaman (Shurtleff & Averre 2000)
Jumlah massa telur Indeks massa telur
0 0
1-2 1
3-10 2
11-30 3
31-100 4
>100 5
Ekstraksi sampel untuk mendapatkan nematoda Meloidogyne spp.
Sampel akar dan tanah yang didapatkan dari sentra produksi krisan diekstraksi dengan metode pengabutan (Mistifier technique) dan metode corong Baermann (Baermann Funnel) yang dimodifikasi (Luc et al. 2005).
Metode corong Baermann yang dimodifikasi dilakukan dengan mengambil sampel tanah sebanyak 100 gram kemudian diletakkan di atas kertas tisu pada corong Baermann. Selanjutnya diisi air bersih secara perlahan-lahan sampai seluruh tanah di atas kertas tissue terendam dan diinkubasikan selama 48 jam. Setelah 48 jam klem pada ujung selang dibuka dan air rendaman ditampung ke dalam gelas Beaker. Apabila jumlah air terlalu banyak maka nematoda dapat disaring melalui saringan Ø 20 µm (625≠), nematoda yang terperangkap pada saringan diambil dengan cara menyemprotkan air dengan botol semprot, dan airnya ditampung pada gelas beaker.
Identifikasi Spesies Meloidogyne Berdasarkan Karakter Morfologi
Hasil ekstraksi puru akar tanaman krisan diperiksa menggunakan mikroskop stereo. Identifikasi diawali dengan mengumpulkan massa telur yang tampak berwarna merah setelah diberi pewarna phloxine-B sehingga memudahkan dan memperjelas dalam identifikasi. Sebanyak 25 massa telur diambil kemudian dibuat preparatnya. Bagian akar yang membengkak dibedah dengan jarum pengait untuk mendapatkan nematoda betina.
Pembuatan preparat untuk nematoda betina sebanyak 25 slide dengan cara memotong bagian anterior dan posterior dengan scalpel kemudian bagian posterior dibersihkan dengan 45% asam laktat menggunakan jarum pengait nematoda. Setelah itu potongan nematoda betina dipindahkan ke atas gelas objek yang telah ditetesi dengan lactophenol blue dan ditutup dengan gelas penutup. Gelas penutup direkat dengan cat kuku kemudian preparat diamati menggunakan mikroskop kompon dengan perbesaran 400 x (Southey 1985).
Pembuatan preparat untuk fase telur, larva dan nematoda jantan dilakukan dengan mengumpulkan masing-masing 25 preparat untuk telur, larva dan nematoda jantan pada tempat terpisah, kemudian nematoda jantan dan larva difiksasi dengan formalin acetic acid (FAA) dan diletakkan pada gelas objek yang telah ditetesi lactophenol blue atau lactoglycerol lalu ditutup dengan gelas penutup. Gelas penutup direkat dengan cat kuku kemudian preparat diamati menggunakan mikroskop kompon dengan perbesaran 400 x (Shouthey 1985).
Identifikasi spesies Meloidogyne secara morfologi berdasarkan bentuk dan ukuran dari telur, larva, nematoda jantan dan pola perineal (perineal pattern) nematoda betina dewasa. Karakter morfologi yang digunakan adalah panjang dan lebar telur; panjang tubuh dan panjang stilet larva; serta panjang tubuh, spikula, stilet, knob stilet dan lebar knob stilet nematoda jantan. Pengukuran karakter morfologi (morfometri) dilakukan dengan mikroskop kompon Zeiss type Scope. A1-Axio dengan program Axio vision Release 4.8.2.
spesies nematoda berdasarkan kunci identifikasi pad kunci identifikasi Meloidogyne spp. oleh Eisenback et al. (1981) dan kunci identifikasi NPA oleh Eisenback et al. (1991).
Identifikasi Spesies Meloidogyne Berdasarkan Karakter Molekuler
Identifikasi NPA berdasarkan karakter molekuler dilakukan dengan metode PCR. Tahapan identifikasi terdiri dari ekstraksi dan isolasi DNA, PCR, sikuen hasil PCR.
Ekstraksi dan Isolasi DNA. Pada tahap ini dilakukan persiapan bahan kimia yang akan digunakan untuk PCR dan ekstraksi DNA nematoda. Isolasi DNA dilakukan dari puru akar dan nematoda betina dewasa Meloidogyne berdasarkan metode Zouhar et al. (2000) yang dimodifikasi. Bahan kimia yang digunakan adalah bufer ekstrak hexadecyltrimethylammonium bromide (CTAB) untuk ekstraksi DNA dari puru akar. Bufer ekstrak CTAB terdiri dari : 50 mM Tris HCl pH 8.0, 0.7 M NaCl, 10 mM ethylene-diamine-tetraacetic acid (EDTA), 1% CTAB, 1% ß-mercaptoethanol. Bufer ekstrak untuk ekstraksi DNA nematoda betina terdiri dari : 200 mM Tris HCl pH 8.5, 250 mM NaCl, 25 mM EDTA pH 8.0 dan 0.5% sodium dodecyl sulfate (SDS). Cara pembuatan bufer dicantumkan pada Lampiran 1.
(endapan DNA) dan disentfifugasi pada kecepatan 12 000 rpm selama 10 menit. Cairan ethanol dibuang dan endapan DNA dikeringkan. Bufer TE pH 8.0 sebanyak 30-100 µl ditambahkan sesuai ketebalan endapan DNA kemudian DNA yang didapatkan disimpan pada suhu -20 ºC hingga digunakan.
Ekstraksi DNA dari nematoda betina dewasa dilakukan dengan memasukkan masing-masing sebanyak 1, 3, 5, 7 dan 9 nematoda betina dewasa ke dalam tabung mikro 2 ml. Sampel tersebut ditambah bufer ekstrak (200 mM Tris HCl pH 8.5, 250 mM NaCl, 25 mM EDTA pH 8.0 dan 0.5% SDS) sebanyak 150 µl dan digerus sampai halus menggunakan conical grinder steril. Selanjutnya ditambahkan CI sebanyak 150 µl kemudian disentrifugasi dengan kecepatan 11 000 rpm selama 10 menit. Supernatan diambil 100 µl dimasukkan ke dalam tabung mikro baru, ditambah larutan CH3COONa 3 M, pH 5.2 sebanyak 0.5 volume, dibolak-balik kemudian disimpan pada suhu -20 ºC selama 10 menit. Suspensi disentrifugasi dengan kecepatan 12 000 rpm selama 20 menit. Supernatan diambil dan ditambah isopropanol, dibolak-balik kemudian disimpan pada suhu ruang selama 30 menit. Suspensi disentrifugasi dengan kecepatan 12 000 rpm selama 20 menit, supernatan dibuang dan ditambahkan ethanol 80%. Suspensi disentrifugasi selama 15 menit dengan kecepatan 12 000 rpm, supernatan dibuang dan endapan DNA dikeringkan. Bufer TE pH 8.0 sebanyak 30-100 µl ditambahkan sesuai ketebalan endapan DNA kemudian disimpan pada suhu -20 ºC hingga digunakan.
Polymerase Chain Reaction. Setiap reaksi PCR terdiri dari 9.5 µl air bebas nuklease, 12.5 µl 2x GoTaq ® Green Master mix, 1 µl primer Forward 10 µM, 1 µl primer Reverse 10 µM ditambah 1 µl DNA template sehingga jumlah volume 25 µl.
DNA diamplifikasi menggunakan tiga primer spesifik spesies M. javanica, M. incognita, dan M. arenaria (Zijlstra et al. 2000). Proses tersebut terjadi dalam mesin PCR Gene Amp PCR system 9700 (Applied biosystem). Primer forward
untuk M. javanica adalah 5’-GGT GCG CGA TTG AAC TGA GC-3’dan reverse
30 siklus yang melalui tiga tahapan, yaitu pemisahan rantai DNA pada suhu 94 ºC selama 30 detik, penempelan primer pada suhu 55 ºC selama 45 detik dan sintesis DNA pada suhu 72 ºC selama 1 menit. Siklus terakhir ditambah tahapan sintesis selama 7 menit, kemudian siklus berakhir pada suhu 4 ºC.
Primer spesifik spesies untuk M. incognita adalah Finc 5’-CTC TGC CCA ATG AGC CGT TCC-3’. Rinc 5’-CTC TGC CCT CAC ATT AGG -3’ dengan target DNA hasil amplifikasi berukuran 999 bp. Amplifikasi DNA dilakukan dengan denaturasi awal pada suhu 95 ºC selama 2 menit, kemudian dilanjutkan dengan 35 siklus yang melalui tiga tahapan, yaitu pemisahan rantai DNA pada suhu 94 ºC selama 30 detik, penempelan primer pada suhu 57 ºC selama 45 detik dan sintesis DNA pada suhu 72 ºC selama 2 menit. Siklus terakhir ditambah tahapan sintesis selama 10 menit, kemudian siklus berakhir pada suhu 4 ºC.
Primer spesifik spesies untuk M. arenaria adalah Far 5’-TCG GCG ATA GAG GTA AAT GAC-3’. Rar 5’-TCG GCG ATA GAC ACT ACA AACT-3’ dengan target DNA hasil amplifikasi berukuran 420 bp. Amplifikasi DNA dilakukan dengan denaturasi awal pada suhu 94 ºC selama 4 menit, kemudian dilanjutkan dengan 35 siklus yang melalui tiga tahapan, yaitu pemisahan rantai DNA pada suhu 94 ºC selama 30 detik, penempelan primer pada suhu 55 ºC selama 45 detik dan sintesis DNA pada suhu 72 ºC selama 1 menit. Siklus terakhir ditambah tahapan sintesis selama 7 menit, kemudian siklus berakhir pada suhu 4 ºC.
DNA nematoda hasil amplifikasi dianalisis dengan elektroforesis. Larutan agarose 1% (0.4 gr agarose dimasukkan ke dalam 40 ml buffer TBE (Tris-HCl 45 mM, asam borat 45 mM, dan EDTA 1 mM) 0.5 x selanjutnya dipanaskan dengan
microwave oven selama ± 2 menit agar gel agarose dapat larut dengan baik. Dalam keadaan hangat ditambahkan 2 µl ethidium bromide kemudian larutan agarose dituang ke dalam gel box yang dipasang sisir pada ujungnya untuk membuat lubang. Gel agarose dibiarkan dingin selama 10 menit pada suhu ruang. Setelah gel memadat, sisir dicabut sehingga terbentuk lubang-lubang kecil/sumuran (Yuwono 2005).
incognita. Masing-masing sampel sebanyak 15 µl diisikan pada sumuran gel menggunakan mikro pipet dan dicatat urutan produk PCR di dalam sumuran.
[image:35.595.72.486.72.819.2]Setelah DNA dimasukkan ke dalam lubang sampel, gel box ditutup dan arus listrik dialirkan. Kutub yang sejajar dengan lubang sampel DNA berupa kutub negatif, sedangkan kutub yang lainnya positif. Oleh karena DNA bermuatan negatif maka molekul-molekul DNA akan bergerak dari kutub negatif ke arah kutub positif (Yuwono 2005). Elektroforesis dilakukan pada tegangan 70 Volt selama 45 menit. Hasil elektroforesis divisualisasi dengan UV transiluminator, gambar pita-pita DNA direkam dengan kamera.
Sikuen hasil PCR. Sikuen hasil PCR dilakukan terhadap sampel yang positif. Sikuen dilakukan oleh PT. Macrogen Incorporation Seoul, Korea Selatan. Hasil sikuen dianalisis menggunakan program Basic Local Alignment Search Tool
(BLAST) dengan program optimasi untuk mendapatkan urutan basa DNA yang terdapat dalam situs National Center for Biotechnology Information (NCBI) dengan software Clustal W (Bioedit version 7.0.5) dan program Mega version
HASIL DAN PEMBAHASAN
Gejala Penyakit NPA di Jawa Barat
Gejala penyakit yang disebabkan oleh NPA ditemukan pada pertanaman krisan di Bogor dan Cianjur. Pada lahan tersebut bagian tanaman yang berada di atas permukaan tanah pertumbuhannya terhambat, layu dan warna daun menguning bahkan beberapa tanaman mati. Setelah tanaman dicabut, bagian akar terdapat puru. Gambar 4 menunjukkan lahan krisan yang terinfeksi NPA terlihat bagian-bagian yang kosong karena beberapa tanaman mati.
Gambar 4 Gejala infeksi NPA pada pertanaman krisan di daerah Bogor (A) dan Cianjur (B), Pertumbuhan tanaman menjadi terhambat dan layu (C) dan bagian akar terdapat puru (D dan E)
Meloidogyne spp. bersifat infektif pada saat menetas sebagai larva II kemudian menembus ke dalam tanah atau jaringan tanaman inang. Larva bergerak ke arah akar dan menumpuk di ujung akar, membuat luka kecil dengan stilet (CABI 2007). Pada saat makan jaringan tanaman inang, nematoda mengeluarkan enzim hidrolitik dari kelenjar esofagus yang menghancurkan dinding sel atau berfungsi sebagai enzim pencernaan (Singh & Sitaramaiah 1994). Sekresi enzim
A B
[image:36.595.112.491.130.811.2]tersebut menyebabkan timbulnya respon dari tanaman inang. Dinding sel tanaman rusak, nekrosis, hipertropi, hiperplasia dan terhambatnya pertumbuhan (Sinaga 2003). Sekresi enzim selulase dan pektinase juga mampu mendegradasi sel hingga ujung akar luka dan pecah, hal ini menyebabkan auksin tidak aktif. Tidak aktifnya auksin maka pertumbuhan tanaman terhambat (Supramana et al. 2008).
Meloidogyne spp. yang menginfeksi akar tanaman juga menyebabkan terjadinya diseases complex dengan cendawan dan bakteri penyebab penyakit tanaman. NPA sebagai pembuka jalan bagi masuknya patogen tersebut karena cendawan tular tanah dan bakteri penyebab penyakit tanaman tidak mempunyai kemampuan secara langsung untuk masuk ke dalam jaringan tanaman inang. Adanya luka yang disebabkan oleh tusukan stilet nematoda mempermudah bagi cendawan seperti Fusarium dan Verticillium serta bakteri Pseudomonas solanacearum masuk ke dalam jaringan tanaman sehingga menyebabkan penyakit layu (Singh & Sitaramaiah 1994).
Kejadian penyakit pada tanaman krisan di Bogor sebesar 25% untuk varietas 04 dengan nilai indeks massa telur 4.0, sedangkan untuk varietas Puma kejadian penyakit sebesar 30% dengan indeks massa telur 4.7. Pada tanaman krisan di Cianjur, kejadian penyakit untuk varietas Elza sebesar 100% dengan nilai indeks massa telur 2.0. Kejadian penyakit untuk varietas Karyushi sebesar 55% dengan indeks massa telur 4. Hal ini menunjukkan bahwa krisan merupakan salah satu inang bagi Meloidogyne spp. Menurut Shurtleff dan Averre (2000) tanaman inang dengan nilai indeks massa telur rata-rata 2.0 atau kurang ditetapkan sebagai inang yang tahan, sedangkan pada tanaman tomat diberikan nilai indeks 4.0 atau lebih. Nilai tersebut juga menunjukkan tingkat kemampuan reproduksi Meloidogyne
spp. yang berasosiasi dengan tanaman krisan. Perbandingan jenis kelamin bersifat epigenetik, yaitu sangat dipengaruhi oleh faktor lingkungan, seperti kepadatan
koloni, kualitas tanaman inang dan suhu (Trianthaphyllou 1982).
Tanaman krisan yang terserang NPA pada awal masa pertumbuhan (satu minggu setelah tanam) tidak mampu berproduksi karena gangguan translokasi nutrisi dan unsur hara akibat adanya puru akar yang disebabkan oleh NPA.
terhambatnya nutrisi ke arah batang. Hal ini menjadikan pertumbuhan tanaman terhambat dan tanaman menjadi kerdil (Nickle 1991). Jika serangan NPA terjadi saat tanaman berumur tiga minggu setelah tanam, tanaman masih mampu berproduksi dengan hasil yang rendah.
Hasil pengamatan gejala pada tanaman krisan di Sukabumi, bagian tanaman yang berada di atas permukaan tanah terlihat pertumbuhan tanaman terhambat, layu dan setelah tanaman dicabut tidak terdapat puru akar (Gambar 5). Padahal adanya puru pada akar tanaman merupakan gejala khas infeksi Meloidogyne spp. (Marwoto 2007). Keberadaan nematoda betina dewasa Meloidogyne spp. dalam puru akar maupun larva Meloidogyne di sekitar perakaran krisan merupakan tanda penyakit yang disebabkan NPA. Oleh karena itu, terindikasi bahwa pada tanaman krisan di Sukabumi tidak terinfeksi NPA.
Gambar 5 Pertanaman krisan di Sukabumi (A), Akar krisan tidak menunjukkan gejala puru (B)
Kecenderungan ini dikuatkan dari hasil pemeriksaan lebih detail dengan mikroskop bahwa nematoda yang ditemukan di sekitar perakaran krisan bukan
Meloidogyne spp., nematoda tersebut adalah Aphelenchoides sp., Pratylenchus
sp., Helicotylenchus sp., Dorylaimus sp. Rhabditis sp. dan Mononchus sp. Infeksi nematoda pada bagian akar tanaman mempengaruhi penyerapan air dan mineral sehingga menyebabkan gejala seperti kekurangan air dan hara.
Tanaman krisan di Sukabumi tidak terinfeksi NPA diduga adanya salah satu faktor penyebab penyakit yang tidak mendukung terjadinya penyakit. Faktor tersebut kemungkinan karena tanah belum terinfestasi Meloidogyne spp. dan
[image:38.595.103.509.68.825.2]kondisi tanah yang tidak sesuai bagi perkembangan nematoda tersebut. Budidaya krisan di Sukabumi dilakukan dengan menggunakan bahan organik pada saat pengolahan tanah dan pengendalian hama. Disamping itu setiap tahun dilakukan rotasi tanaman krisan dengan jagung dan kenaf. Pada saat pengolahan tanah, ditambahkan bokashi (bahan organik yang difermentasikan) pada lahan pertanaman. Bokashi adalah pupuk kompos yang dihasilkan dari proses fermentasi atau peragian bahan organik dengan teknologi EM4 (Effective Microorganisms 4). EM4 mengandung Azotobacter sp., Lactobacilus sp., ragi, bakteri fotosintetik dan jamur pengurai selulosa (Deptan 2012). Bahan yang digunakan dalam pembuatan bokashi adalah dedak, tulang ikan dan kotoran ayam. Pengendalian hama dilakukan dengan penyemprotan pestisida botani dari ekstrak daun cabe, sirsak dan tanaman jarak.
Menurut Singh dan Sitaramaiah (1994) penambahan bahan organik dan pupuk kandang ke dalam tanah dapat mengurangi kejadian penyakit tanaman yang disebabkan oleh nematoda. Penguraian bahan organik menyebabkan perubahan penting terhadap sifat fisik, kimia dan biotik tanah. Aktivitas mikroba selama proses penguraian bahan organik meningkatkan jumlah mikroflora dan fauna yang dapat menghancurkan nematoda parasit tanaman. Bahan organik yang ditambahkan ke dalam tanah akan merangsang tumbuhnya cendawan saprofit yang akan memakan nematoda (nematophagous fungi).
Identifikasi Meloidogyne spp. Berdasarkan Karakter Morfologi
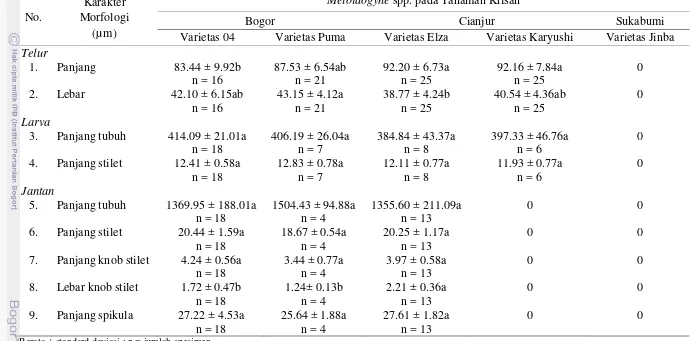
Hasil identifikasi NPA berdasarkan karakter morfologi didapatkan bentuk telur, larva, nematoda jantan dan betina dewasa. Selain pengamatan secara morfologi dilakukan pengukuran karakter morfologi (morfometri) larva dan nematoda jantan. Hasil pengukuran dapat dilihat pada Tabel 2.
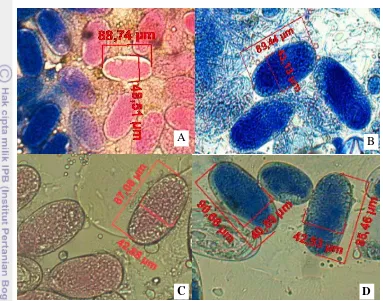
Meloidogyne yang terdapat pada keempat varietas krisan tersebut mempunyai bentuk yang sama, yaitu oval (Gambar 6).
Gambar 6 Telur Meloidogyne dengan perbesaran mikroskop 200x terdapat pada krisan varietas 04 (A), Puma (B), Elza (C) dan Karyushi (D)
Larva pada keempat varietas krisan mempunyai bentuk tubuh seperti cacing (vermiform). Hasil sidik ragam (Tabel 2) menunjukkan tidak ada perbedaan panjang tubuh (384.84-414.09 µm) dan panjang stilet (11.93-12.83 µm) pada larva nematoda di Bogor dan Cianjur. Karakter morfologi yang lain, yaitu kepala lurus (not set off), mengecil ke arah depan dan ujung kepala datar, stilet halus dan knob stilet membulat (Gambar 7 A). Bagian ekor mengecil ke arah ujung, terdapat bagian hyaline pada ujung ekor dan bentuk ujung ekor tumpul (Gambar 7 B). Karakter morfologi tersebut merupakan genus Meloidogyne (Eisenback, et. al
1991).
A B
Gambar 7 Bagian anterior (A) dan posterior (B) larva Meloidogyne spp., dengan perbesaran mikroskop 400x.
Nematoda jantan berbentuk vermiform (Gambar 8) ditemukan pada krisan varietas 04 dan Puma (Bogor) dan varietas Elza (Cianjur), namun tidak ditemukan pada varietas Karyushi (Cianjur). Menurut Trianthaphyllou (1982) reproduksi
Meloidogyne spp. terjadi secara partenogenesis dan perbandingan jenis kelamin bersifat epigenetik, yaitu sangat dipengaruhi oleh faktor lingkungan, seperti kepadatan koloni, kualitas tanaman inang dan suhu.
Gambar 8 Nematoda jantan Meloidogyne spp. dengan perbesaran mikroskop 50x
Ketika kondisi lingkungan menguntungkan, larva berkembang menjadi betina, tetapi dalam kondisi lingkungan yang tidak menguntungkan, berkembang menjadi nematoda jantan. Dengan demikian dapat dikatakan bahwa krisan varietas Karyushi merupakan inang yang sesuai bagi Meloidogyne spp., sehingga larva berkembang menjadi betina. Hal ini juga didukung oleh nilai indeks massa telur sebesar 4.0. Nilai indeks tersebut menunjukkan jumlah massa telur per tanaman. Semakin tinggi nilai indeks semakin banyak massa telur yang ditemukan pada akar tanaman krisan.
Hasil pengamatan morfologi nematoda jantan pada tiga varietas krisan di Bogor dan Cianjur tampak bagian anterior dengan bentuk kepala menonjol, ujung kepala tinggi dan membulat (Gambar 9 A). Terdapat pula nematoda jantan dengan bentuk kepala lurus dan ujung kepala rata (Gambar 9 B). Nematoda jantan yang ditemukan mempunyai ujung stilet berbentuk kerucut, bagian tengah stilet berbentuk silindris dan pangkal stilet (knob) berbentuk membulat dengan panjang stilet 18.67-20.44 µm. Pada bagian posterior terdapat alat reproduksi nematoda jantan yaitu spikula dan gubernaculum. Panjang spikula nematoda jantan 15.90-36.35 µm. Hasil sidik ragam panjang tubuh, panjang stilet, panjang knob stilet dan panjang spikula tidak terdapat perbedaan pada nematoda jantan di Bogor dan Cianjur. Perbedaan terdapat pada lebar knob stilet (Tabel 2). Berdasarkan karakter morfologi, nematoda tersebut diidentifikasi sebagai M. javanica dan M. incognita (Eisenback, et. al (1991).
Gambar 9 Bagian anterior nematoda jantan M. javanica (A), Bagian anterior nematoda jantan M. incognita (B), Bagian posterior nematoda jantan (C) dengan perbesaran mikroskop 400x.
[image:42.595.101.510.183.809.2]Jika ditinjau dari kondisi geografi, daerah Bogor dan Cianjur sesuai untuk perkembangan M. javanica dan M. incognita karena nematoda tersebut hidup di daerah dengan iklim tropis (Luc et al. 2005). Suhu rata-rata harian pada pertanaman krisan di Bogor 26-27 °C dengan ketinggian tempat 670 m dpl, sedangkan suhu rata-rata harian di Cianjur 25-27 °C dengan ketinggian tempat 960 m dpl.
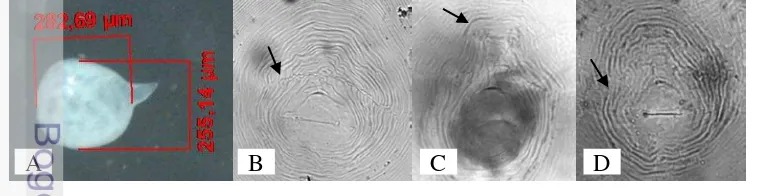
Hasil pengamatan dengan mikroskop stereo ditemukan nematoda betina dewasa Meloidogyne berbentuk seperti buah pir/bulat (pyriform) (Gambar 10 A). Nematoda betina dewasa Meloidogyne berada di dalam puru akar tanaman. Hasil identifikasi berdasarkan pada pola perineal (perineal pattern) nematoda betina dewasa didapatkan ciri-ciri sebagai berikut: ada garis lateral yang memisahkan lengkung dorsal dan lengkung ventral seperti ditunjukkan oleh anak panah pada Gambar 10 B. Ciri tersebut sesuai dengan M. javanica (Eisenback 1981). Selain
M. javanica ditemukan pola perineal dengan ciri lengkung dorsal berbentuk persegi (90 °) seperti ditunjukkan oleh anak panah Gambar 10 C yang merupakan ciri dari M. incognita (Eisenback 1981). Pola perineal pada Gambar 10 D dengan adanya pertemuan lengkung dorsal dan ventral membulat dan membentuk seperti bahu, merupakan ciri dari M. arenaria. Menurut Eisenback (1981) terdapat variasi pola perineal dalam satu spesies Meloidogyne sehingga diperlukan ketrampilan dan kecermatan dalam identifikasi spesies Meloidogyne secara morfologi.
Gambar 10 Nematoda betina dewasa Meloidogyne yang terdapat pada pertanaman krisan di Bogor dan Cianjur (A), Pola perineal M. javanica (B), M. incognita (C), M. arenaria (D)
[image:43.595.94.473.520.618.2]Tabel 1 Ukurana telur, larva dan nematoda jantan Meloidogyne spp.
No.
Karakter Morfologi
(µm)
Meloidogyne spp. pada Tanaman Krisan
Bogor Cianjur Sukabumi
Varietas 04 Varietas Puma Varietas Elza Varietas Karyushi Varietas Jinba
Telur
1. Panjang 83.44 ± 9.92b n = 16
87.53 ± 6.54ab n = 21
92.20 ± 6.73a n = 25
92.16 ± 7.84a n = 25
0
2. Lebar 42.10 ± 6.15ab
n = 16
43.15 ± 4.12a n = 21
38.77 ± 4.24b n = 25
40.54 ± 4.36ab n = 25
0
Larva
3. Panjang tubuh 414.09 ± 21.01a n = 18
406.19 ± 26.04a n = 7
384.84 ± 43.37a n = 8
397.33 ± 46.76a n = 6
0 4. Panjang stilet 12.41 ± 0.58a
n = 18
12.83 ± 0.78a n = 7
12.11 ± 0.77a n = 8
11.93 ± 0.77a n = 6
0
Jantan
5. Panjang tubuh 1369.95 ± 188.01a n = 18
1504.43 ± 94.88a n = 4
1355.60 ± 211.09a n = 13
0 0
6. Panjang stilet 20.44 ± 1.59a n = 18
18.67 ± 0.54a n = 4
20.25 ± 1.17a n = 13
0 0
7. Panjang knob stilet 4.24 ± 0.56a n = 18
3.44 ± 0.77a n = 4
3.97 ± 0.58a n = 13
0 0
8. Lebar knob stilet 1.72 ± 0.47b n = 18
1.24± 0.13b n = 4
2.21 ± 0.36a n = 13
0 0
9. Panjang spikula 27.22 ± 4.53a n = 18
25.64 ± 1.88a n = 4
27.61 ± 1.82a n = 13
0 0
a
Rerata ± standard deviasi ; n = jumlah spesimen
Angka yang diikuti dengan huruf yang sama pada baris yang sama tidak berbeda nyata pada taraf 5% berdasarkan uji Tukey
Identifikasi Meloidogyne spp. Berdasarkan Karakter Molekuler
[image:45.595.80.482.26.811.2]Populasi Meloidogyne yang ditemukan pada tanaman krisan di Bogor dan Cianjur berdasarkan pola perineal betina dewasa, sebanyak 76-96% adalah M. javanica, 4-24% M. incognita dan 0-4% M. arenaria (Tabel 3). Hasil identifikasi berdasarkan karakter morfologi tersebut kemudian dikonfirmasi dengan metode PCR menggunakan primer spesifik spesies M. javanica, M. incognita dan M. arenaria.
Tabel 3. Persentase populasi Meloidogyne spp. berdasarkan identifikasi pola perineal nematoda betina dewasa
Sentra
produksi krisan Varietas Spesies Meloidogyne
M. javanica M. incognita M. arenaria
Bogor 04 84 12 4
Puma 76 20 4
Cianjur Elza 96 4 0
Karyushi 76 24 0
Visualisasi hasil amplifikasi DNA dari puru akar krisan dan nematoda betina dewasa pada empat varietas krisan dengan primer spesifik spesies M. javanica terdapat pita DNA pada target berukuran 720 bp (Gambar 11), namun tidak terdapat pita DNA dengan primer spesifik spesies M. arenaria (420 bp) maupun M. incognita (999 bp) (Gambar 12).
Gambar 11 Visualisasi hasil PCR Meloidogyne spp. dari empat varietas krisan di Bogor dan Cianjur dengan primer M. javanica (720 bp) pada 1% gel agarose: M = marker 100 bp, 1 = varietas 04, 2 = varietas Puma, 3 = varietas Elza, 4 = varietas Karyushi
±720 bp
Gambar 12 Visualisasi hasil PCR Meloidogyne spp. dari empat varietas krisan di Bogor dan Cianjur dengan primer M. arenaria (420 bp) dan M. incognita (999 bp) pada 1% gel agarose, M = marker 100 bp dan 1 Kb ; 1 = varietas 04, 2 = varietas Puma, 3 = varietas Elza, 4 = varietas Karyushi
Hasil PCR dari puru akar dan nematoda betina dewasa dengan primer spesifik spesies M. javanica dilanjutkan dengan sikuen untuk mengetahui runutan nukleotida dari isolat yang ditemukan di Bogor dan Cianjur. Hasil analisis homologi sikuen nukleotida DNA M. javanica dari Bogor (Indo-7H-F) dan Cianjur (Indo-5E-F) mempunyai homologi sebesar 92.1 % dengan DNA M. javanica dari Cina (Tabel 4). Tingkat homologi yang tinggi ini menandakan bahwa spesies nematoda tersebut adalah sama yaitu M. javanica. Tingkat homologi sikuen DNA ini (M. javanica) akan sangat rendah bila dibandingkan dengan sikuen DNA nematoda spesies lain, misalnya dengan M. arenaria yang hanya 40.6 % (Tabel 4).
Tabel 4 Homologi sikuen nukleotida DNA M. javanica dari Bogor dan Cianjur dengan sikuen DNA yang ada di Gen Bank
No. Isolat Homologi (%)
1 2 3 4 5 6 7 8
1 China-JN34 -
2 China-JN36 100 -
3 China-JN37 100 100 -
4 China-JN38 100 100 100 -
5 China-JN39 100 100 100 100 -
6 USA-CF3585 40.8 40.8 40.8 40.8 40.8 -
7 Indo-5E-F 92.1 92.1 92.1 92.1 92.1 40.6 -
8 Indo-7H-F 92.1 92.1 92.1 92.1 92.1 40.6 100 -
±420 bp
M 1 2 3 4 M 1 2 3 4
Pohon filogeni (Gambar 13) menggambarkan dengan jelas bahwa nematoda yang diisolasi dari tanaman krisan di daerah Bogor dan Cianjur merupakan M. javanica dan bukan spesies lain seperti misalnya M. arenaria.
Gambar 13 Pohon filogeni M. javanica yang menginfeksi krisan di Jawa Barat (Indo-5E-F dan Indo 7H-F) dengan M. javanica yang ada di Cina dan
M. arenaria yang ada di USA menggunakan metode Neighbour Joining dengan program Mega 5.05.
Deteksi Meloidogyne spp. secara Molekuler
Deteksi Meloidogyne spp. secara molekuler dengan bahan ekstraksi DNA dari puru akar wortel pernah dilakukan oleh Kurniawan (2010). Berkaitan dengan tugas karantina, deteksi spesies Meloidogyne secara molekuler dari DNA satu puru akar krisan maupun dari DNA satu ekor betina Meloidogyne sangat membantu dalam pemeriksaan karantina. Hasil deteksi secara molekuler terhadap empat varietas krisan di Bogor dan Cianjur dengan primer spesifik spesies M. javanica didapatkan ukuran fragmen DNA 720 bp (Gambar 14). Amplifikasi DNA dari satu puru pun masih terlihat adanya pita DNA walaupun pita yang terbentuk tidak begitu jelas. Pita DNA jelas terlihat jika digunakan tiga puru. Sementara itu, amplifikasi DNA dari satu nematoda betina menunjukkan pita DNA yang jelas.
M. javanica
M. arenaria China-JN36
China-JN37 China-JN34 China-JN38 China-JN39
INDO-5E-F INDO-7H-F
[image:47.595.74.488.50.809.2]Gambar 14 Visualisasi fragmen DNA hasil PCR Meloidogyne spp. dari empat varietas krisan di Bogor dan Cianjur menggunakan primer M. javanica pada elektroforesis gel agarose 1%. K(+) = DNA 5♀, K (-) = DNA tanaman, M = marker 100 bp;1P, 3P, 5P, 7P dan 9P = DNA
Meloidogyne dari puru akar krisan; 1♀, 3♀, 5♀,7♀dan 9♀= DNA
Meloidogyne darinematoda betina (♀)
Amplifikasi DNA dari satu puru pun masih terlihat adanya pita DNA walaupun pita yang terbentuk tidak begitu jelas. Pita DNA jelas terlihat jika digunakan tiga puru. Sementara itu, amplifikasi DNA dari satu nematoda betina menunjukkan pita DNA yang jelas.
[image:48.595.106.493.50.797.2]Hasil PCR puru akar dan nematoda betina dewasa dari empat varietas krisan di Bogor dan Cianjur menggunakan primer spesifik M. javanica bersesuaian dengan jumlah nematoda betina dalam puru akar seperti Gambar 15.
Gambar 15 Frekuensi nematoda betina Meloidogyne spp. dalam setiap puru
±720 bp
[image:48.595.117.476.500.704.2]KESIMPULAN DAN SARAN
Kesimpulan
Identifikasi nematoda puru akar (NPA) pada tanaman krisan berdasarkan karakter morfologi ditemukan tiga spesies, yaitu M. javanica, M. incognita dan
M. arenaria. Berdasarkan karakter molekuler diidentifikasi M. javanica. Deteksi
M. javanica berbasis molekuler menggunakan metode PCR dapat dilakukan dengan sampel satu nematoda betina dewasa atau tiga puru akar. Metode ini sangat bermanfaat dalam membantu tugas karantina karena mempunyai akurasi tinggi, sensitif dan cepat. Metode deteksi dan identifikasi nematoda berdasarkan karakter morfologi yang didukung dengan molekuler dapat juga digunakan dalam pemeriksaan karantina sehari-hari.
Saran
DAFTAR PUSTAKA
Adam MAM, Phillips MS, Blok VC. 2007. Molecular diagnostic key for identification of single juveniles of seven common and economically import species of root-knot nematode (Meloidogyne spp.). Plant Pathology (56): 190-197.
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York (US): Academic Press. [Barantan]. Badan Karantina Pertanian 2009. Pedoman Pembuatan dan
Pengelolaaan Koleksi Penyakit Tumbuhan. Jakarta (ID): Departemen Pertanian.
[Barantan]. Badan Karantina Pertanian 2011. E-Plaq Data Ekspor. Jakarta (ID): Departemen Pertanian. http://karantina.deptan.go.id [26 Oktober 2011]. Bekal S dan Lambert K. 2002. Introduction to Plant-Parasitic Nematodes. The
Plant Health Instructor. University of Illinois, Department of Crop Sciences, Urbana, IL
[BPS] Badan Pusat Statistik. 2011. Luas Panen, Produksi dan Produktivitas TanamanKrisan,2009-2010.
[CABI] CAB International. 2007. Crop Protection Compendium. (CD-Rom). Wallingford (UK): CABI. 2nd CD-Rom dengan penuntun didalamnya. Castagnone-Sereno P. 2006. Review Genetic variability and adaptive evolution in
parthenogenetic root- knot nematodes. Heredity (96): 282-289.
Cenis JL. 1993. Idenfitification of four major Meloidogyne spp. by random amplified polymorphic DNA (RAPD-PCR). Phytopatology (83): 76-80. CharlesPapp.2011.Meloidogyne.
2011]
Coyne DL, Nicol JM, Claudius-Cole B. 2007. Practical plant nematology: A field and laboratory guide. SP-IPM Secretariat, International Institute of Tropical Agriculture (IITA), Cotonou. Benin.
[Deptan]. Departemen Pertanian. 2012. Bokashi (Bahan organik kaya akan sumber hayati).
Mitkowski NA dan Abawi GS. 2003. Root-knot nematodes. The Plant Health Instructor.
Mustika Ika. 2010. Konsepsi dan Strategi Pengendalian Nematoda Parasit
Tanaman di Indonesia. Pengembangan Inovasi Pertanian 3(2): 81-101. Bogor.
Nickle WR. 1991. Manual of Agricultural Nematology. New York (US): Marcel Dekker, Inc.
Papp Charles. 2011. The Root-Knot Nematodes.
2012]
Philis J. 1997. Outlook on plant nematodes and their control in Cyprus. 2012]
Powers TO dan Harris TS. 1993. A polymerase chain reaction for identification of five major Meloidogyne species. Journal of Nematology 25(1): 1-6.
Randig O, Leroy F, Bongiovanni M, Castagnone-Sereno P. 2001. Abstract. RAPD characterization of single females of the root-knot nematodes, Meloidogyne
spp. European Journal of Plant Pathology (107): 639-643.
Sasser JN. 1981. Proceeding of Third Research Planning Conference on Root Knot Nematodes, Meloidogyne spp. July 20-24, 1981. Jakarta (ID).
Shurtleff MC dan Charles WA. 2000. Diagnosing Plant Diseases Caused by Nematodes. St. Paul. Minnesota. (US): APS Press.
Sinaga Meity Suradji. 2003. Dasar-dasar Penyakit Tumbuhan. Penebar Swadaya: Jakarta (ID).
Singh RS dan Sitaramaiah. 1993. Plant Patogens The Plant Parasitic Nematodes. New York (US): International Science Publisher.
Southey JF. 1986. Laboratory Methods for Work with Plant and Soil Nematodes. London (UK): Ministry of Agriculture, Fisheries and Food.
Supramana, Supriadi, Rita Harni. 2008. Seleksi dan Karakterisasi Bakteri Endofit untuk Mengendalikan Nematoda Peluka Akar (Pratylenchus brachyurus) pada Tanaman Nilam. Laporan Hasil Penelitian. Bogor (ID): Institut Pertanian Bogor.
Dickinson M. 2005. Molecular Plant Pathology. School of Biosciences, University of Nottingham,UK. London (UK) and New York (US): BIOS Scientific Publishers.
Eisenback JD, Hirschmann H, Triantaphyllou CA. 1980. Morphological Comparison of Meloidogyne Female Head Strusture, Perineal Pattern, and Stylets. Journal of Nematology. Vol. 12 (4): 300-313.
Eisenback JD, Hirshmann H, Sasser JN, Triantaphyllou AC. 1981. A Guide to The Four Most Common Species of Root-Knot Nematodes (Meloidogyne
sp