i
RINGKASAN
Eka Sari. D14080071. 2012. Penggunaan Gen Chromo Helicase DNA Binding
(CHD) sebagai Marker Penentu Jenis Kelamin pada Aves. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. Pembimbing Anggota : Maria Ulfah, S. Pt., M.Sc.Agr.
Jenis kelamin merupakan informasi yang penting dalam budidaya unggas dan penangkaran burung. Penentuan jenis kelamin pada sebagian burung sulit dilakukan karena memiliki ciri-ciri fenotipik yang sangat mirip antara jantan dan betina, bahkan setelah mencapai dewasa kelamin (monomorfis). Hal ini menjadi suatu permasalahan bagi para breeder karena mereka belum yakin dengan jenis kelamin burung yang mereka identifikasi. Identifikasi jenis kelamin sejak dini sangat bermanfaat dalam pengembangbiakan serta menekan biaya perawatan untuk proses reproduksi di penangkaran. Penentuan jenis kelamin secara molekuler merupakan suatu solusi efektif bagi para breeder karena dapat dilakukan sejak dini dan dideteksi dari DNA sehingga hasilnya lebih akurat. Penentuan jenis kelamin secara molekuler dilakukan berdasarkan gen Chromo Helicase DNA Binding (CHD) dengan menggunakan primer P2 dan P8. Tujuan penelitian ini yaitu untuk mengidentifikasi jenis kelamin Aves menggunakan primer P2 dan P8 berdasarkan DNA dari hasil ekstraksi darah dan bulu.
Jenis-jenis Aves yang digunakan dalam penelitian ini yaitu ayam kampung, puyuh, itik, merpati, beo nias, kakatua molukan dan kakatua kecil jambul kuning yang seluruhnya berjumlah 21 sampel. Sampel penelitian diperoleh dari darah dan bulu yang kemudian diekstraksi untuk mendapatkan DNA total. Sampel darah diekstraksi dengan menggunakan metode konvensional (phenol-chloroform), sedangkan bulu diekstraksi dengan menggunakan kit ekstraksi. DNA total diamplifikasi dengan menggunakan primer P2 dan P8 dan dielektroforesis pada gel agarose. Genotyping dilakukan dengan melihat jumlah pita yang dihasilkan yaitu satu pita menunjukkan jantan dan dua pita menunjukkan betina.
Hasil penelitian ini menunjukkan bahwa kualitas DNA darah lebih tinggi dibandingkan dengan bulu. Gen CHD berhasil diamplifikasi menggunakan primer P2 dan P8 dengan ukuran berkisar 300-400 bp. Hasil amplifikasi gen CHD menunjukkan bahwa primer P2 dan P8 berhasil mengidentifikasi jenis kelamin pada merpati, beo nias, kakatua molukan dan kakatua kecil jambul kuning dengan elektroforesis pada gel agarose 2%. Namun primer P2 dan P8 tidak berhasil mengidentifikasi jenis kelamin pada ayam, puyuh dan itik dengan gel agarose 2% karena perbedaan ukuran fragmen spesifik CHD-Z dan CHD-W yang kecil sehingga pita Z dan W tidak terpisah pada gel agarose 2%.
ii
ABSTRACT
The Application of Chromo Helicase DNA Binding (CHD) Gene as A Marker for Avian Sex Determination
Sari, E., C. Sumantri, and M. Ulfah
Many avian spesies are difficult to distinguish between male and female based on their morphology. Male and female must be kept in the same cage for reproduction. DNA-based sex identification provides a solution. CHD genes are preserved within avian Z and W sex chromosomes. The aim of this research was to determine avians sex based on CHD gene using P2 and P8 primers. DNA was extracted from avians blood and feather. The Polymerase Chain Reaction (PCR) with a single of primers P2 and P8 on a 2% agarose gel was used to decide the avian sex of chickens, quails, ducks, rock pigeons, common hill myna, yellow-crested cockatoos, and salmon-crested cockatoos. Sex identifification of avian spesies based on bands the Z and W, males had a single band (ZZ), and females had two (ZW) on a agarose gel. The CHD gene amplified by the P2 and P8 primers had the fragment size of 300-400 bp. P2 dan P8 primers had no success for sex identification in chickens, quails and ducks. However, the primers could be used to identify the sex of rock pigeons, common hill myna, yellow-crested cockatoos and salmon-crested cockatoos.
1
PENDAHULUAN
Latar Belakang
Jenis kelamin merupakan informasi yang penting dalam budidaya unggas dan penangkaran burung. Penentuan jenis kelamin pada sebagian burung sulit dilakukan karena memiliki ciri-ciri fenotipik yang sangat mirip antara jantan dan betina, bahkan setelah mencapai dewasa kelamin (monomorfis). Namun, proses perkawinan di suatu penangkaran dilakukan dengan menyatukan jantan dan betina dalam satu kandang. Hal ini menjadi suatu permasalahan bagi para breeder karena mereka belum yakin dengan jenis kelamin burung yang mereka identifikasi. Identifikasi jenis kelamin sejak dini sangat bermanfaat dalam pengembangbiakan serta menekan biaya perawatan untuk proses reproduksi di penangkaran.
Secara umum identifikasi jenis kelamin dapat dilakukan berdasarkan dari morfologi, kondisi hormonal dan molekuler. Identifikasi berdasarkan morfologi dan kondisi hormonal hanya dapat dilakukan setelah mengalami dewasa kelamin. Penentuan jenis kelamin secara molekuler merupakan suatu solusi efektif bagi para breeder karena dapat dilakukan sejak dini dan dideteksi dari DNA sehingga hasilnya lebih akurat. Sumber DNA untuk identifikasi jenis kelamin Aves dapat berasal dari darah dan bulu. Penggunaan bulu dapat menghindari rasa sakit saat koleksi sampel sehingga mengurangi stres yang terjadi pada burung. Penangkar burung biasanya menggunakan jasa identifikasi jenis kelamin dengan sumber DNA dari bulu dan mengirim sampel tersebut ke luar negeri karena masih terbatasnya jasa sexing burung di Indonesia.
2 mengidentifikasi jenis kelamin burung endemik Indonesia seperti kakatua kecil jambul kuning, kakatua molukan dan beo nias.
Tujuan
3
TINJAUAN PUSTAKA
Aves (Bangsa Burung)
Burung atau aves adalah hewan yang memiliki bulu, tungkai atau lengan depan termodifikasi untuk terbang, tungkai belakang teradaptasi untuk berjalan, berenang dan hinggap, paruh tidak bergigi, jantung memiliki empat ruang, rangka ringan memiliki kantong udara, berdarah panas, tidak memiliki kandung kemih dan bertelur (Welty, 1982). Burung diklasifikasikan dalam kingdom Animalia, filum Chordata, subfilum Vertebrata, dan kelas Aves.
Alikondra (2010) menjelaskan bahwa domestikasi adalah suatu urutan proses pembentukan spesies dalam suatu populasi yang semakin lama semakin disesuaikan dengan keadaan tidak liar, melalui mekanisme-mekanisme penjinakan dari banyak generasi untuk mendekati/mencapai tuntutan kebutuhan manusia. Berdasarkan proses domestikasi kelas Aves terbagi menjadi unggas dan burung.
Unggas
Unggas merupakan jenis (spesies) burung yang telah mengalami domestikasi dan mempunyai manfaat utama sebagai penghasil pangan (Donham dan Haase, 1980). Beberapa jenis unggas seperti ayam Kampung, itik, puyuh dan merpati dijelaskan dibawah ini:
Ayam Kampung. Ayam kampung (Gallus gallus domesticus) memiliki kekerabatan yang dekat dengan dua sub spesies dari ayam hutan merah (G. gallus spadiceus) di China dan ayam hutan merah (G. gallus gallus) di Thailand (Sulandari dan Zein, 2009). Ayam kampung didefinisikan sebagai ayam yang tidak mempunyai ciri-ciri khas tertentu, dengan kata lain penampilan fenotipenya masih sangat beragam. Sifat-sifat kualitatif seperti warna bulu, warna kulit dan bentuk jengger yang sangat bervariasi (Sartika dan Iskandar, 2007; Sartika, 2000). Ayam kampung jantan memiliki bulu ekor sama panjang dengan panjang tubuh dan berpenampilan gagah, sedangkan betina bulu ekor lebih pendek dari panjang tubuh, memiliki ukuran badan dan kepala lebih kecil (Gambar 1).
4 itik betina (Brahmantiyo et al., 2003). Itik liar mengalami perubahan morfologi yang bervariasi sesuai dengan tempat berkembangnya setelah mengalami domestikasi seperti itik alabio, itik tegal, itik mojosari dan lain-lain (Srigandono, 1997). Pola warna bulu itik mojosari sebagian besar didominasi oleh warna lurik-coklat gelap. Variasi warna diantaranya adalah kombinasi warna lurik dengan belang putih pada daerah leher dan bagian dada. Dari sebagian kecil dari populasi itik mojosari muncul warna bulu putih polos (Suparyanto, 2003) (Gambar 1).
Puyuh. Puyuh merupakan jenis Aves yang tidak dapat terbang, ukuran tubuh relatif kecil dan berkaki pendek. Puyuh merupakan penghasil daging dan telur sehingga sering dipelihara oleh masyarakat (Minvielle, 2004). Puyuh jantan dan betina dapat dibedakan dari pola warna. Ciri-ciri puyuh jantan yaitu pada bagian bulu kepala sampai ke bagian belakang terdapat warna putih yang berbentuk garis melengkung tebal, bulu leher, dan dadanya yang berwarna cokelat muda (cinamon) tanpa ada bercak kehitaman, bulu punggung berwarna campuran cokelat gelap, abu-abu dengan garis putih dan bulu sayap seperti bulu punggung dengan belang kehitaman. Ciri-ciri puyuh betina yaitu warna bulu pada kerongkongan dan dada bagian atas berwarna cokelat muda lebih terang (sawo matang) dengan bercak cokelat tua atau kehitam-hitaman (Kasiyati, 2009) (Gambar 1).
5
Burung
Burung merupakan salah satu jenis satwa liar yang hidup di dalam ekosistem alam dengan jumlah populasi yang tinggi. Fimbel et al (2001) menyebutkan bahwa fungsi ekologis burung yaitu sebagai pollinator, penyebar dan pemangsa benih. Indonesia memiliki kekayaan hayati berupa burung yang berlimpah. Populasi burung saat ini mengalami penurunan karena meningkatnya populasi manusia sehingga habitat asli burung menjadi terganggu. Tingginya permintaan pasar juga salah satu faktor yang menyebabkan menurunnya populasi burung endemik Indonesia di alam. Hal ini menyebabkan perlunya pengembangbiakan yang diharapkan mampu meningkatkan populasi dan kelestariannya dengan upaya penangkaran. Alikondra (2010) menyebutkan bahwa penangkaran satwa liar adalah perkembangbiakan dan pemeliharaan satwa liar dalam keadaan terkurung oleh manusia untuk mencapai sasaran tertentu. Beberapa jenis burung yang saat ini populasinya menurun akibat tingginya permintaan pasar yaitu kakatua kecil jambul kuning, kakatua molukan dan beo Nias.
Kakatua Kecil Jambul Kuning dan Kakatua Molukan. Burung kakatua merupa-kan jenis burung yang sangat dekat dan banyak digemari oleh masyarakat karena perilaku yang khas, lucu, riang dan suka menirukan suara. Burung kakatua merupakan spesies endemik Indonesia (Gambar 1). Indonesia memiliki 77 spesies dari burung paruh bengkok (Ordo: Psttaciformes, Family: Pssittacidae) yaitu 61 spesies diantaranya masuk ke dalam daftar perdagangan pasar internasional sejak tahun 1983-1999. Hal ini menyebabkan populasi burung ini mendekati kepunahan akibat permintaan pasar yang tinggi. Semua burung paruh bengkok Indonesia terdaftar dalam Appendix CITES yaitu Appendix I (terancam punah) sebanyak 4 spesies dan Appendix II (genting) sebanyak 73 spesies. Salah satu spesies yang termasuk dalam Appendix I yaitu kakatua molucan (Cacatua moluccensis) (Soehartono dan Mardiastuti, 2002).
Beo Nias
6 Inggris disebut Mynah (Campbell dan Lack, 1985). Burung beo adalah burung monomorfik yaitu sulit dibedakan antara jantan dan betina. Hampir semua jenis burung beo terancam kelestariannya akibat penangkapan dari habitat alaminya. Burung beo termasuk daftar burung paruh bengkok yang popular dalam pedagangan burung internasional (Soehartono dan Mardiastuti, 2002).
Gambar 1. Beberapa Jenis Aves: Ayam Kampung Jantan (A.1) dan Betina (A.2)1, Puyuh Jantan (B.1) dan Betina (B.2)2, Itik Jantan (C.1) dan Betina (C.2)3, Merpati (D)4, Beo Nias (E)5, Kakatua Molukan (F)6, dan Kakatua Kecil Jambul Kuning (G)7.
Sumber: 1(Candrawati, 2007)
2
(www.cybex.deptan.go.id)
3
(www.litbang.deptan.go.id)
4
(www.karantina.deptan.go.id)
5
(Shepherd, 2006)
6
(Harrison, 2005)
7
(Harrison, 2005)
Penentuan Jenis Kelamin pada Aves
7 Autosexing. Penentuan jenis kelamin day old chick (DOC) merupakan pekerjaan yang sangat penting dalam reproduksi di suatu pembibitan. Fakta menarik mengenai jenis kelamin DOC yang baru menetas dapat diketahui dari bulu menggunakan gen marker K-k yang berlokasi pada kromosom sex Z. Saat menetas jantan dilihat dari pertumbuhan bulu primer yang lambat, sementara itu betina diketahui dari pertumbuhan bulu primer yang lebih cepat. Hal ini menjadi cara yang mudah, tingkat akurasi yang tinggi dan cepat dalam menentukan jenis kelamin pada ayam sehingga sering digunakan di pembibitan unggas skala industri (Mincheva et al., 2012). Autosexing ayam diketahui dari warna bulu akibat mutasi yang terpaut kelamin. Jantan dan betina dapat diidentifikasi saat penetasan melalui warna bulunya yang unik (Elbrecht dan Smith, 1992).
Vent Sexing. Vent sexing merupakan metode yang dipopulerkan oleh seorang profesor Jepang, Kiyoshi Masui pada tahun 1930. Metode ini mengidentifikasi jenis kelamin berdasarkan area kloaka untuk melihat keberadaan alat kelamin jantan. Metode itu membutuh orang yang terlatih dan banyak pengalaman. Vent sexers yang sangat terlatih dengan mudah mengidentifikasi jenis kelamin day old chick (DOC) dengan tingkat keberhasilan hingga 95%. Seorang ahli juga dapat mengalami kesalahan dalam mengidentifikasi burung yang monomorfik (Bramwell, 2003).
Laparoskopi (Pembedahan). Karakteristik saluran reproduksi dapat langsung dilihat dengan menggunakan laparoskopi. Gonad burung dewasa lebih mudah divisualisasi dibandingkan dengan anakan. Metode ini dilakukan dengan penyayatan kecil pada sisi kiri tubuh burung sehingga memiliki resiko yang tinggi yaitu cedera pada organ vital burung yang dibedah. Pemeriksaan ini dapat berbahaya dan bahkan mematikan burung tersebut (Swengel, 1996; Cerit dan Avanus, 2007a).
8 Karyotyping. Sumber untuk isolasi kromosom dan penentuan kariotipe dapat diperoleh dari kultur sel yang umumnya berasal dari bulu atau sel darah. Sebagian besar kromosom spesies burung adalah mikrokromosom sehingga sulit untuk menghitung mikrokromosom ini secara akurat. Kromosom Z memiliki ukuran yang lebih besar dibandingkan dengan kromosom W (Archawaranon, 2004). Kelemahan dari metode ini yaitu prosedur yang memakan waktu lama (Cerit dan Avanus, 2007a)
Gen CHD (Chromo Helicase DNA Binding)
Gen Chromo Helicase DNA binding (CHD) merupakan suatu gen penanda jenis kelamin pada Aves. Gen CHD berada di kromosom Z dan W, yang terdiri dari CHD-Z (berada pada kromosom Z) dan CHD-W (berada pada kromosom W) (Dubiec dan Zagalska-Neubauer, 2006). Gen CHD (chromo helicase DNA binding) merupakan gen pertama yang berlokasi di kromosom W (CHD-W) pada aves (Griffiths and Tiwari, 1995). CHD-Z berlokasi pada kromosom Z (Griffiths and Korn 1997), yang ada pada dua jenis kelamin (ZZ dan ZW). Struktur protein dari CHD-Z dan CHD-W diketahui memiliki perbedaan yang sangat sedikit (Fridolfson dan Ellergen, 1999). Sejauh ini hanya sedikit gen yang terdapat pada kromosom W untuk mengidentifikasi jenis kelamin pada Aves, namun gen yang paling umum digunakan yaitu gen CHD.
Aves mempunyai kromosom sex yang berbeda dibandingkan dengan mamalia. Sifat heterogametik pada burung dimiliki oleh betina (ZW) sedangkan jantan merupakan homogametik (ZZ) (Ellergren, 1996). Gen CHD (Chromo Helicase DNA binding) dapat menunjukkan perbedaan antara alel Z dan W pada betina (Griffiths et al., 1996). Perbedaan ini terjadi karena adanya keterpautan (linkage) antara posisi gen CHD dengan kromosom kelamin pada Aves (kromosom Z dan W) (Griffith dan Korn, 1997).
9
Isolasi DNA Total
Teknik PCR memerlukan suatu DNA cetakan (DNA template) yang nantinya akan diperbanyak secara in vitro. DNA cetakan didapatkan dari hasil ekstraksi dan purifikasi suatu sel, jaringan atau organ. Sebagian besar DNA pada sel hewan terdapat di dalam inti dan sebagian yang lain terdapat di organel seperti mitokondria. Ekstraksi dan purifikasi DNA pada prinsipnya adalah suatu cara atau metoda untuk memisahkan DNA total dari komponen sel lainnya (Sulandari dan Zein, 2003). Setiap sel atau jaringan yang memiliki DNA memungkinkan untuk dilakukan ekstraksi DNA. Namun kualitas dan jumlah DNA yang diperoleh dapat bervariasi tergantung asal jaringan, metode penyimpanan, dan cara ekstraksi. Ekstraksi DNA dari fosil, rambut atau bulu, dan feses biasanya lebih sulit dilakukan (Taberlet et al. 1996).
Prinsip metode purifikasi pada semua jaringan hewan tidak jauh berbeda, yaitu terdiri atas tiga tahapan utama. Tiga tahapan tersebut secara berurutan adalah penghancuran (lisis) membran sel, pemisahan material DNA dari material organik sel lain, dan pemisahan DNA dari larutannya (presipitasi) (Sambrook et al. 1989). Secara umum dalam studi molekuler burung, DNA total didapatkan dari hasil ekstraksi dan purifikasi darah lengkap (whole blood). Inhibitor (penghambat) yang terdapat pada beberapa jaringan memerlukan perlakuan khusus dalam proses ekstraksi sehingga hasilnya akan sulit untuk di PCR. Ekstraksi DNA dapat dilakukan secara manual ataupun menggunakan DNA extraction kit (kit). Ekstraksi DNA dengan menggunakan kit umumnya menghasilkan DNA dengan kualitas yang lebih baik (Schill, 2007).
Bulu merupakan struktur khusus sebagai penciri dalam kelas Aves. Bulu burung mempunyai prospek menjadi sumber DNA karena pada pangkal bulu (calamus) banyak mengandung sel epitel. Bulu dapat diperoleh secara langsung (pada saat mabung) maupun tak langsung (dicabut) dengan tingkat resiko kecil pada burung tersebut. Namun karena pada bulu banyak mengandung unsur keratin dan sudah mengeras, maka sulit untuk didapatkan DNAnya. Komponen bulu terdiri dari
10
Seleksi Menggunakan Penanda Molekuler
Metode seleksi sederhana berdasarkan informasi fenotipe telah banyak dilakukan untuk perbaikan produktivitas ternak, namun terdapat beberapa keterbatasan seperti perbedaan jenis kelamin dan sifat-sifat yang sulit atau mahal untuk diukur dan diamati (Vischer et al., 2000). Salah satu metode untuk mengatasi kelemahan tersebut adalah dengan melakukan seleksi menggunakan penanda molekuler.
Poymerase Chain Reaction (PCR) merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan nukleotida yang posisinya diapit sepasang primer. Primer yang berada sebelum daerah target disebut sebagai primer forward dan yang berada setelah daerah target disebut primer reverse. Enzim yang digunakan sebagai pencetak rangkaian molekul DNA baru dikenal sebagai enzim polymerase. Untuk mencetak rangkaian tersebut dalam teknik PCR, diperlukan juga dNTPs (deoxynucleoside triphosphat) yang mencakup dATP (nukleotida berbasa Adenine), dCTP (Cytosine), dGTP (Guanine) dan dTTP (Tymine) (Muladno, 2002).
11 Gambar 2. Proses Poymerase Chain Reaction (PCR)
(Nicholas, 2004)
Polymerase Chain Reaction-Single Strand Comformation Polymorphism (PCR-SSCP) merupakan salah satu metode analisis lebih lanjut yang memanfaatkan produk PCR. Metode ini merupakan pemisahan asam nukleat rantai tunggal (single stranded nucleic acids) hasil amplifikasi PCR dengan elektroforesis melalui gel poliakrilamid dan berdasarkan pada perbedaan berat model pasangan basa, sehingga dapat menghasilkan perbedaan struktur sekuen gen (Orita et al., 1989). Prinsip yang mendasari metode analisis SSCP adalah perbedaan asam nukleotida yang akan mempengaruhi bentuk fragmen DNA untai tunggal (Bastos et al., 2001) akan menyebabkan pola migrasi pada saat elektroforesis dalam gel poliakrilamid (Baroso et al., 1999) walaupun perbedaannya hanya satu nukleotida saja (Nataraj et al., 1999).
Elektroforesis
12 diekstrak dari rumput laut. Gel agarose memiliki pori berukuran besar dan kegunaan utamanya untuk memisahkan molekul yang sangat besar dengan berat molekul lebih dari 200 kiladalton (Sambrook et al., 1989). Posisi molekul yang terseparasi dapat dilihat dengan pewarnaan gel. Untuk mendeteksi potongan-potongan DNA berupa larik DNA pada gel agarose digunakan pewarna yang mengandung fluorescen dengan konsentrasi rendah seperti ethidium bromide (EtBr) (Fatchiyah, 2006).
Resolusi optimal dalam separasi fragmen DNA akan didapatkan apabila pemilihan konsentrasi gel tepat. Besar kecilnya pori-pori pada agarose ditentukan oleh konsentrasinya, makin tinggi konsentrasi agarose, maka makin kecil pori yang terbentuk. Pori-pori ini berfungsi sebagai saringan molekul, dimana migrasi fragmen DNA yang besar akan lebih lambat daripada fragmen yang lebih kecil (Fatchiyah, 2006).
Gel poliakrilamida terbentuk tanpa pemanasan, melainkan dengan pencampuran larutan akrilamida dengan ammonium sulfat dan TEMED (N,N,N’,N’-tetramethylethylenediamine). Pencampuran ini akan mengakibatkan monomer akrilamida mengalami polimerisasi menjadi rantai panjang. Penambahan senyawa lain N,N’-methylene bis-akrilamida (bis-akrilamida) di dalam proses polimerisasi, terbentuk cross-linker antar rantai panjang sehingga terbentuk gel yang tingkat porositasnya ditentukan oleh panjang rantai dan derajat penyilangan antar rantai (cross-link). Panjang rantai polimer akrilamida ditentukan oleh konsentrasi akrilamida di dalam reaksi polimerisasi (antara 3.5% dan 20%). Senyawa bis- akrilamida yang berfungsi sebagai cross-linker ditambahkan dengan perbandingan 1:29 terhadap akrilamida (Muladno, 2002).
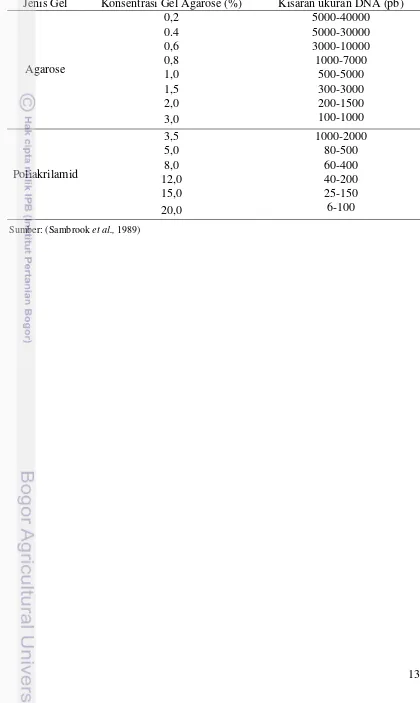
13 Tabel 1. Karakteristik Gel Agarose dan Poliakrilamid
Jenis Gel Konsentrasi Gel Agarose (%) Kisaran ukuran DNA (pb)
Agarose
0,2 5000-40000
0.4 5000-30000
0,6 3000-10000
0,8 1000-7000
1,0 500-5000
1,5 300-3000
2,0 200-1500
3,0 100-1000
Poliakrilamid
3,5 1000-2000
5,0 80-500
8,0 60-400
12,0 40-200
15,0 25-150
20,0 6-100
14
MATERI DAN METODE
Lokasi dan Waktu
Penelitian dilaksanakan pada bulan Februari hingga Mei 2012. Koleksi sampel darah unggas dilakukan di Laboratorium Lapang Fakultas Peternakan, Institut Pertanian Bogor. Koleksi sampel bulu dilakukan di Penangkaran Burung “Megananda Bird Orchid Farm”, Ciluer, Bogor. Analisis identifikasi jenis kelamin Aves dilakukan di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetik Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Materi
Sampel
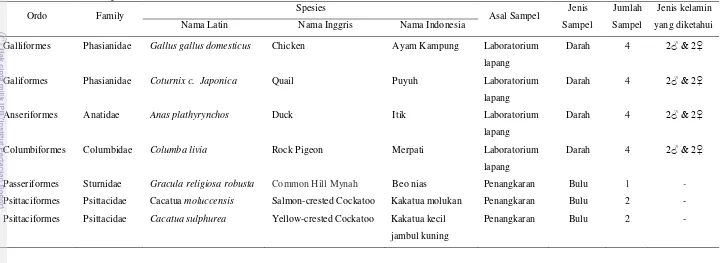
Sampel yang digunakan dalam penelitian ini yaitu 16 sampel darah unggas yang terdiri dari ayam kampung, puyuh, itik dan merpati serta 5 sampel bulu burung yang terdiri dari kakatua kecil jambul kuning, kakatua molukan dan beo nias (Gambar 3). Identitas sampel penelitian ditampilkan pada Tabel 2.
Pengambilan Sampel
Bahan-bahan yang digunakan untuk pengambilan sampel adalah alkohol 70%, kapas dan EDTA. Alat yang digunakan adalah jarum venojeck, tabung eppendorf 1,5 ml dan pipa kapiler.
Ekstraksi DNA
15 Tabel 2. Identitas Sampel Penelitian
Ordo Family Spesies Asal Sampel Jenis
Sampel
Jumlah
Sampel
Jenis kelamin
yang diketahui
Nama Latin Nama Inggris Nama Indonesia
Galliformes Phasianidae Gallus gallus domesticus Chicken Ayam Kampung Laboratorium
lapang
Darah 4 2♂ & 2♀
Galiformes Phasianidae Coturnix c. Japonica Quail Puyuh Laboratorium
lapang
Darah 4 2♂ & 2♀
Anseriformes Anatidae Anas plathyrynchos Duck Itik Laboratorium
lapang
Darah 4 2♂ & 2♀
Columbiformes Columbidae Columba livia Rock Pigeon Merpati Laboratorium
lapang
Darah 4 2♂ & 2♀
Passeriformes Sturnidae Gracula religiosa robusta Common Hill Mynah Beo nias Penangkaran Bulu 1 -
Psittaciformes Psittacidae Cacatua moluccensis Salmon-crested Cockatoo Kakatua molukan Penangkaran Bulu 2 -
Psittaciformes Psittacidae Cacatua sulphurea Yellow-crested Cockatoo Kakatua kecil jambul kuning
Penangkaran Bulu 2 -
16
Gambar 3. Jenis Sampel: Ayam Kampung Jantan (A.1) dan Betina (A.2), Puyuh Jantan (B.1) dan Betina (B.2), Itik (C), Merpati (D), Beo Nias (E), Kakatua Molukan (F), dan Kakatua Kecil Jambul Kuning (G).
Sumber : Dokumentasi pribadi
Primer Sexing
17
Amplifikasi DNA
Amplifikasi DNA menggunakan bahan-bahan yaitu sampel DNA, buffer, MgCl2, dNTP (deoxy Nukleotida Triposfat), enzim Taq Polymerase, destilated water
(DW) dan pasangan primer. Alat-alat yang digunakan dalam amplifikasi DNA yaitu satu set mikropipet dan tip, mesin thermocycler, sentrifuge, rak, vortex dan tabung eppendorf.
Elektroforesis
DNA yang telah diamplifikasi dielektroforesis menggunakan gel agarose konsentrasi 2%. Bahan yang digunakan untuk elektroforesis gel agarosa adalah produk PCR, agarose, loading dye, marker 100 bp, 0,5 x TBE, dan Ethidium Bromide. Alat yang digunakan adalah tip pipet, mikropipet 10 P Gilson, gelas kimia, gelas ukur, stirrer, microwave, gel tray, pencetak untuk sumur (comb), power supply electrophoresis 100 volt, alat foto UV trans iluminator, dan sarung tangan.
Prosedur
Ekstraksi DNA
Ekstraksi DNA dilakukan dari darah dan bulu. Prosedur ekstraksi DNA darah mengikuti metode phenol-chloroform (Sambrook et al., 1989) dan ekstraksi DNA dari bulu dilakukan dengan menggunakan kit ekstraksi.
Ekstraksi DNA Darah. Sampel darah diambil sebanyak 50 µl dipindahkan ke dalam tabung 1,5 ml dan ditambahkan 800 µl RBC lisis buffer kemudian dihomogenkan menggunakan vortex selama ± 5 menit. Campuran tersebut kemudian disentrifugasi dengan kecepatan 8000 rpm (rotation per minutes) selama 5 menit dan bagian supernatannya dibuang. Bagian sel darah yang diperoleh ditambahkan dengan 40 µl SDS 10%, 10 µl Prot K 5 mg/ml dan 300 µl 1 x STE, dikocok pelan dalam inkubator pada suhu 55 ºC selama 2 jam. Molekul DNA dimurnikan dengan cara penambahan larutan fenol sebanyak 400 µl, 400 µl CIAA dan 40 µl NaCl 5M, kemudian dikocok pelan pada suhu ruang selama 1 jam.
18 Molekul DNA kemudian dipisahkan dari EtOH absolut dengan disentrifugasi pada kecepatan 12.000 rpm selama 5 menit kemudian dibuang bagian supernatan sehingga diperoleh endapan molekul DNA. Endapan tersebut didiamkan dalam keadaan terbuka hingga kering dan disuspensikan dalam 100 µl TE (tris-EDTA) 80% dan disimpan dalam freezer sampai akan digunakan.
Ekstraksi DNA Bulu. Ekstraksi DNA dari bulu dilakukan dengan kit ekstraksi. Sampel calamus dipotong kecil lalu diletakkan di tabung effendorf 1,5 ml, kemudian ditambahkan “yang with urea” 1000 µl, dan prot K 10 mg/ml kemudian diinkubasi sambil digoyang pada suhu 38 ºC selama satu malam. Sampel diberi prot K 10 mg/ml 20 µl dan diinkubasi pada suhu 55 ºC selama 2 jam lalu disentrifugasi dengan kecepatan 2000 rpm selama 5 menit. Sampel sebanyak 500 µl ditambahkan 2500 µl PB buffer, kemudian sampel diambil 750 µl dan dipindahkan ke tabung spin lalu disentrifugasi dengan kecepatan 13000 rpm selama satu menit dan diulangi hingga semua campuran sampel dan PB buffer habis. Tabung ungu dipindahkan ke tabung 1,5 ml, ditambahkan 100 µl EB, didiamkan selama 5 menit dan disentrifugasi dengan kecepatan 13000 rpm selama satu menit. Sampel DNA akan tertampung di tabung 1,5 ml.
Kualitas DNA
Kualitas DNA dapat diketahui dengan cara spektrofotometer dan elektroforesis. Sampel 3 µl dan 597 µl destilated water (DW) dan blanko kemudian dispektrofotometer untuk mengetahui kualitas DNA dari sampel. Selain itu sampel 5 µl dicampurkan dengan loading dye kemudian dielektroforesis pada gel agarose 1,5 %.
Amplifikasi Gen CHD
Amplifikasi gen CHD secara in vitro menggunakan teknik PCR dengan mesin thermocycler. Pereaksi PCR terdiri dari sampel DNA 1 µl, destilated water (DW) 18,9 µl, primer 0,3 µl, dNTP 0,2 µl, MgCl2 1 µl, dream taq
19 anneling pada suhu 60 ºC selama 45 detik, dan elongasi pada suhu 72 ºC selama satu menit. Kemudian tahap terakhir adalah elongasi akhir 72 ºC selama lima menit.
Elektroforesis
Produk PCR sebanyak 5 µl dicampurkan dengan loading dye (bromothymol blue 0,01%, xylene cyanol 0,01%, dan gliserol 50%) sebanyak 1 µl dengan menggunakan mikropipet lalu dimasukkan dalam sumur-sumur gel dan satu sumur gel dimasukkan marker sebanyak 2 µl yang digunakan sebagai penanda. Kemudian gel ditempatkan ke dalam gel tray elektroforesis yang sudah berisi larutan buffer dan dialiri listrik 100 volt selama 30 menit, molekul DNA yang bermuatan negatif pada pH netral akan bergerak (bermigrasi) ke arah positif. Gel agarose yang telah selesai dielektoforesis kemudian diambil untuk melihat panjang pita DNA dengan menggunakan sinar ultraviolet dalam trans illuminator. Panjang pita DNA dapat diketahui dengan cara menarik garis lurus masing-masing pita sampel DNA dengan posisi pita DNA marker.
Rancangan dan Analisis Data
Genotyping
Jenis kelamin setiap individu ditentukan berdasarkan pita-pita yang muncul pada gel agarosa dan poliakrilamid. Jenis kelamin jantan menghasilkan satu pita dan betina dua pita (Griffith et al., 1998). Penentuan genotipe dari setiap individu ditampilkan pada Gambar 3.
Gambar 4. Penentuan Genotipe Gen CHD pada Aves
20
HASIL DAN PEMBAHASAN
Isolasi DNA
Sumber DNA pada Aves biasanya berasal dari darah. Selain itu bulu juga dapat dijadikan sebagai alternatif sumber DNA. Hal ini karena pada sebagian jenis Aves memiliki pembuluh darah yang kecil seperti kakatua (Psittacidae) dan beo (Sturnidae) sehingga ekstraksi DNA dari darah sulit dilakukan. Selain itu penggunaan bulu dapat mengurangi stres pada burung dan mempermudah pengambilan sampel pada jenis Aves yang ukuran tubuhnya kecil (Bello et al., 2001). Cerit dan Avanus (2007b) menambahkan bahwa penggunaan bulu dapat menghindari rasa sakit pada burung dan menurunkan resiko kontaminasi sehingga biaya yang dibutuhkan lebih rendah.
Metode ekstraksi DNA dari sampel harus ditentukan dengan tepat. Ekstraksi DNA pada penelitian ini dilakukan secara konvensional dan menggunakan extraction kit (kit). Ekstraksi DNA yang berasal dari darah dilakukan dengan menggunakan metode konvensional atau phenol chloroform, sedangkan ekstraksi DNA yang berasal dari bulu dilakukan dengan menggunakan kit. Hal ini karena darah merupakan sumber DNA yang paling umum digunakan sehingga dapat digunakan metode phenol chloroform untuk efisiensi biaya. Dubiec dan Zagalska-Neubaurer (2005) menjelaskan bahwa ekstraksi DNA dengan metode phenol chloroform (Sambrook et al., 1989) menghasilkan kualitas dan kuantitas DNA yang optimal dengan biaya lebih murah. Hickman et al. (1984) menyatakan bahwa sumber DNA pada bulu didapat dari pangkal bulu (calamus) yang banyak mengandung sel epitel dan mengandung penghambat (inhibitor) yaitu keratin sehingga proses ekstraksi menjadi cukup sulit. Hasil ekstraksi DNA dengan menggunakan kit menghasilkan kualitas DNA yang lebih baik, namun penggunaaan kit akan meningkatkan biaya.
Kualitas DNA
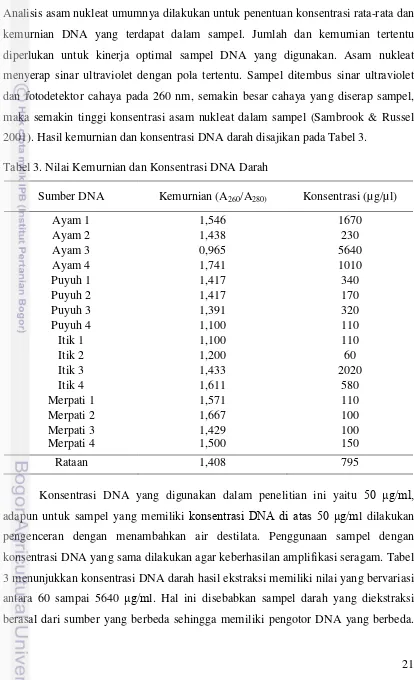
21 Pengukuran jumlah DNA dengan spektrofotometer didasarkan pada prinsip iradiasi sinar ultraviolet yang diserap oleh nukleotida dan protein dalam larutan. Analisis asam nukleat umumnya dilakukan untuk penentuan konsentrasi rata-rata dan kemurnian DNA yang terdapat dalam sampel. Jumlah dan kemurnian tertentu diperlukan untuk kinerja optimal sampel DNA yang digunakan. Asam nukleat menyerap sinar ultraviolet dengan pola tertentu. Sampel ditembus sinar ultraviolet dan fotodetektor cahaya pada 260 nm, semakin besar cahaya yang diserap sampel, maka semakin tinggi konsentrasi asam nukleat dalam sampel (Sambrook & Russel 2001). Hasil kemurnian dan konsentrasi DNA darah disajikan pada Tabel 3.
Tabel 3. Nilai Kemurnian dan Konsentrasi DNA Darah
Sumber DNA Kemurnian (A260/A280) Konsentrasi (µg/µl)
Ayam 1 1,546 1670
Ayam 2 1,438 230
Ayam 3 0,965 5640
Ayam 4 1,741 1010
Puyuh 1 1,417 340
Puyuh 2 1,417 170
Puyuh 3 1,391 320
Puyuh 4 1,100 110
Itik 1 1,100 110
Itik 2 1,200 60
Itik 3 1,433 2020
Itik 4 1,611 580
Merpati 1 1,571 110
Merpati 2 1,667 100
Merpati 3 1,429 100
Merpati 4 1,500 150
Rataan 1,408 795
22 Adanya bahan pengotor pada sumber DNA akan mempengaruhi konsentrasi DNA yang diperoleh.
Hasil rasio absorbansi pada panjang gelombang 260/280 nm menunjukkan tingkat kemurnian dari DNA. Tabel 3 menunjukkan bahwa rata-rata kemurnian DNA darah sebesar 1,408 yang berarti DNA yang dihasilkan tidak terlalu murni. Sambrook et al. (1989) menjelaskan DNA dapat dikatakan murni apabila rasio absorbansi pada panjang gelombang 260/280 nm dalam kisaran 1,8 – 2,0. Hal ini disebabkan oleh adanya pengotor yang terdapat pada darah seperti protein sehingga menjadi sumber kontaminan pada DNA. Selain itu enzim proteinase tidak bekerja secara optimal saat proses ekstraksi DNA darah yang dilakukan dengan metode konvensional. Sambrook et al, (1989) menjelaskan bahwa rasio A260/A280 akan semakin besar atau kecil dari
nilai 1,8-2,0 jika ditemukan kontaminasi dari protein atau fenol. Secara umum DNA darah hasil ekstraksi dapat digunakan untuk proses amplifikasi.
Bulu burung merupakan suatu modifikasi dari jaringan kulit yang menanduk. Bulu dapat dijadikan sebagai alternatif sebagai sumber DNA. Hasil kemurnian dan konsentrasi DNA bulu disajikan pada Tabel 4.
Tabel 4. Nilai Kemurnian dan Konsentrasi DNA Bulu
Sumber DNA Kemurnian (A260/A280) Konsentrasi (µg/µl)
Beo nias 1,429 200
Kakatua molukan 1 1,273 280
Kakatua molukan 2 1,643 230
Kakatua kecil jambul kuning 1 1,250 200
Kakatua kecil jambul kuning 2 1,400 210
Rataan 1,399 224
23 Pengujian kualitas DNA dengan menggunakan gel ditentukan oleh intensitas cahaya dari pita DNA pada media gel. Penilaian kualitas DNA dilakukan dengan elektroforesis pada gel agarose 1,5% dengan tegangan 100 volt selama 45 menit. Hasil uji kualitas DNA pada gel agarose 1% disajikan pada Gambar 5.
Darah Bulu M
Gambar 5. Elektroforesis DNA Hasil Ekstraksi pada Gel Agarose 1,5%
Pita DNA darah lebih terang daripada pita DNA bulu pada gel agarose 1,5% (Gambar 5). Hal ini disebabkan oleh konsentrasi DNA darah yang lebih tinggi dibandingkan konsentrasi DNA bulu. Hasil ekstraksi darah pada gambar terlihat ada bagian smear. Smear merupakan bagian DNA yang terdegradasi sehingga menghasilkan DNA dalam berbagai ukuran. Sampel DNA yang berkualitas baik, tidak mengandung DNA yang terdegradasi. Tebalnya smear yang terlihat pada gambar dapat disebabkan oleh kurangnya TE (Tris-EDTA) ketika melarutkan sampel DNA.
Amplifikasi Gen Chromo Helicase DNA Binding (CHD)
24 kelamin pada Aves. Griffith et al. (1998) membuktikan bahwa primer P2 dan P8 ini berhasil mengamplifikasi 27 jenis dari 28 spesies burung yang diteliti.
Amplifikasi gen Chromo Helicase DNA Binding (CHD) dilakukan pada mesin thermal cycler dengan suhu annealing 60 ºC. Penentuan jenis kelamin dengan primer P2 dan P8 dilakukan dengan melihat jumlah pita hasil elektroforesis. Jantan memiliki satu pita dan betina memiliki dua pita. Hal ini karena Aves memiliki kromosom sex yang berbeda dengan mamalia. Sifat heterogametik pada burung dimiliki oleh betina (ZW) sedangkan jantan merupakan homogametik (ZZ) (Ellergren, 1996). Gen CHD (Chromo Helicase DNA binding) dapat menunjukkan perbedaan antara alel Z dan W pada betina (Griffiths et al,. 1996). Perbedaan ini terjadi karena adanya keterpautan (linkage) antara posisi gen CHD dengan kromosom kelamin pada Aves (kromosom Z dan W) (Griffith dan Korn, 1997).
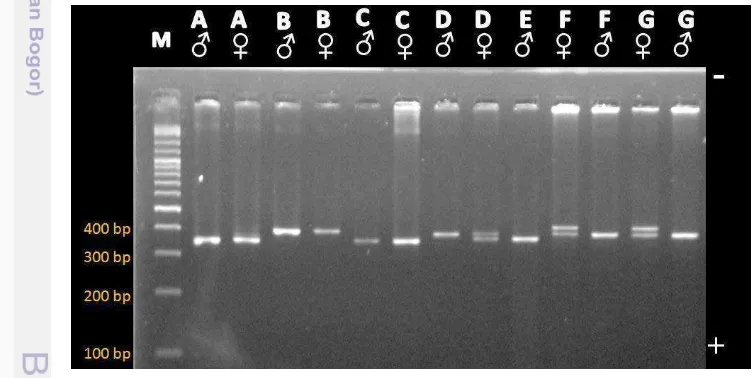
Sebanyak 21 sampel Aves telah berhasil diamplifikasi dengan menggunakan primer P2 dan P8. Hasil amplifikasi gen CHD menggunakan primer P2 dan P8 disajikan pada Gambar 6.
Gambar 6. Hasil Amplifikasi Gen CHD Menggunakan Primer P2 dan P8 pada Ayam Kampung (A), Puyuh (B), Itik (C), Merpati (D), Beo Nias (E), Kakatua Molukan (F) dan Kakatua Kecil Jambul Kuning (G) dengan Elektroforesis Gel Agarose 2%.
25 gel agarose 2%. Penelitian ini menggunakan sembilan spesies Aves yang berbeda sehingga setiap spesies memiliki ukuran fragmen yang berbeda pula karena memiliki urutan basa yang berbeda. Panjang produk hasil amplifikasi gen CHD pada penelitian ini dengan menggunakan primer P2 dan P8 berkisar antara 300-400 bp. Hal ini sesuai dengan Griffiths et al. (1998) yang menemukan panjang produk hasil amplifikasi gen CHD menggunakan primer P2 dan P8 dengan kisaran yang sama. Fridolfsson & Ellergen (1999) dan Jensen et al. (2003) menjelaskan bahwa perbedaan ukuran antara fragmen spesifik Z dan W pada primer P2 dan P8 sekitar 10-80 bp.
Hasil amplifikasi gen CHD pada ayam kampung (Gallus gallus domesticus) tidak menunjukkan pola pita yang berbeda antara jantan dan betina pada gel agarose 2% (Gambar 6). Sekuen gen CHD yang ditemukan dari genBank berasal dari ayam hutan (Gallus gallus) memiliki panjang fragmen spesifik Z dan W yaitu 345 bp dan 362 bp yang diketahui dari sekuen gen CHD-Z (GenBank Nomor Akses AF006659) dan CHD-W (GenBank Nomor Akses AF006660) sehingga memiliki perbedaan fragmen Z dan W sebesar 17 bp (Gambar 7). Sekuen gen ini dapat dijadikan sebagai acuan untuk ayam kampung dengan perbedaan fragmen yang tidak jauh berbeda dengan ayam hutan (Gallus gallus).
Hasil amplifikasi gen CHD pada puyuh yang tidak menunjukkan pola pita yang berbeda antara jantan dan betina (Gambar 6). Hal ini disebabkan oleh perbedaan ukuran pita Z dan W yang tipis yang mengakibatkan pita Z dan W berimpit. Hal ini terbukti dengan panjang fragmen spesifik Z dan W adalah 385 dan 379 dari sekuen gen CHD-Z (GenBank Nomor Akses HQ175997) dan CHD-W (GenBank Nomor Akses HQ175998) (Gambar 7). Perbedaan ukuran fragmen hanya 6 bp yang mengakibatkan pita Z dan W tidak terpisah pada gel agarose 2%. Morinha et al. (2011) menyebutkan dalam penelitiannya bahwa primer P2 dan P8 tidak berhasil membentuk pola pita yang berbeda antara jantan dan betina di gel agarosa, namun mendapat hasil yang berbeda dengan menggunakan resolusi gel yang sangat tinggi yaitu PCR-SSCP pada Coturnix c. japonica.
26 gel agarose 2%. Informasi mengenai sekuen gen CHD-Z dan CHD-W pada itik belum ditemukan sehingga perbedaan ukuran fragmen spesifik Z dan W belum dapat diketahui.
Gambar 7. Sekuen Gen CHD-Z dan CHD-W pada Merpati (Cl), Puyuh (Ccj), Ayam (Gg) dan Posisi Primer (warna kuning) (gen bank code ; GU289183, GU289184, HQ175997, HQ175998, AF006659, dan AF006660)
forward (P8)
Cl_CHD-Z : CTCCCAAGGATGAGGAACTGTGCAAAACAGGTGTGTCTTGGTTCTGATTGACTTGTGCTTTTGTGTTGCT
Cl_CHD-W : CTCCCAAGGATGAGGAACTGTGCAAAACAGGTATCTCTGGGTTTTGACCAACTAACTTCTTGTTGTTGTG
Ccj_CHD-Z : CTCCCAAGGATGAGGAACTGTGCAAAACAGGTACCTCTGGGTTTTGACTGTATTGTGTTTTTATTTTGAT Ccj_CHD-W : CTCCCAAGGATGAGGAACTGTGCAAAACAGGTATCGTTGGGTTTTGACTGATTTTTTTTCTTTGATACTT Gg_CHD-Z : CTCCCGAGGATGAGAAACTGTGCAAAACAGGTACCTCTGGGTTTTGACTGTCTTGCGTCTTTATGTTGAT Gg_CHD-W : CTTCCAAGAATGAGAAACTGTGCAAAACAGGTATCTCTGGGTTCTGACTGATTTTTTTCTTTGATACTTC
Cl_CHD-Z : GTTGGTTTAGTTTGTTGGGGATTGTTGTTGGGTTTTGTTTTTTTAGGGTTTTTTCCGTTTTCTGAACACG Cl_CHD-W : TTTCTTTGTTTTTTCATTACTGTTGTTTTTGGCTTGTACTTTTCACCCCCCATTTTTGACAGGCTAGATA Ccj_CHD-Z : ATTTTGATTTTGGTTTTTGCCTTCGTGTTTTGTTTTGTTTTGTTTTTTGTTTGTTTTTTGGTTTTTTTCT Ccj_CHD-W : CCATTGCTGATGTTTTGGCTTGTACTTTTGTGTTGCGTGGTTTTCATCTGTTTTCCCCCCCAAATATTTT
Gg_CHD-Z : ATTTTCATTTGAGTTTTTGCCTTTTTTCCCCCTTCTCTGAATTCATATTTTTGTCAGGCTAGATAAGACT
Gg_CHD-W : TATTGCTGATGTTTTGACTTGTACTTTTGTGTTGTGTGGTTTTCGTGTGTTTTTCCCCCAAAATATTTTT
Cl_CHD-Z : TATTTTTGACAGGTTAGGCAAAACTTGACCTGTGTTTGTCAATCGCATAGCTTTGAACTACTTATTCTGA
Cl-CHD-W : GCACATTATTAAAATGTTTTAGTCACATAGCTTTGAACTACTTAATCTGAAATTCCAGATCAGCTTTAAT
Cl_CHD-Z : CGAACCATTCCTCGAGAAAATATTAAAGGATTTAGCGATGCAGA (370)
Cl_CHD-W : TATTAAAGGATTTAGCGATGCAGA (350)
Ccj_CHD-Z : AAGCGTGGGAGACCTCGAACTATTCCTCGAGAAAATATTAAAGGATTTAGCGATGCAGA (385) Ccj_CHD-W : GGACGACCACGAACTATTCCCCGTGAAAACATTAAAGGATTTAGCGATGCAGA (379)
Gg_CHD-Z : AAGGATTTAGTGATTGCAGA (345)
Gg_CHD-W : TCCCCGTGAAAACAATTAAAGGATTTAGTGATGCAGA (362)
27 Hasil amplifikasi gen CHD menunjukkan pola pita yang berbeda antara jantan dan betina pada merpati (Gambar 6). Hal ini dibuktikan dengan ukuran fragmen pita Z dan W yaitu 350 bp (GenBank Nomor Akses GU289184) dan 370 bp (GenBank Nomor Akses GU289183) sehingga memiliki perbedaan ukuran fragmen sebesar 20 bp (Gambar 7). Perbedaan 20 bp dapat membentuk pola pita yang terpisah antara jantan dan betina.
Hasil amplifikasi gen CHD pada beo nias, kakatua molukan dan kakatua kecil jambul kuning menunjukkan terdapat perbedaan pola pita antara jantan dan betina (Gambar 6). Hal ini diduga bahwa perbedaan ukuran fragmen pita Z dan W relatif besar sehingga dapat terpisah pada media gel agarose 2%. Belum adanya informasi mengenai sekuen gen CHD-Z dan CHD-W dari spesies-spesies tersebut menyebabkan perbedaan ukuran pita Z dan W belum dapat diketahui. Sekuen gen CHD-Z pada merpati (Columba livia), puyuh (Coturnix coturnix japonica) dan ayam (Gallus gallus) ditampilkan pada Gambar 7.
Implementasi Penentuan Jenis Kelamin secara Molekuler dalam Pengembangan Riset dan Studi Keilmuan
Hasil yang didapatkan dalam penelitian ini menunjukkan bahwa primer spesifik P2 dan P8 dapat mengidentifikasi jenis kelamin pada merpati, kakatua kecil jambul kuning, kakatua molukan dan beo Nias. Namun primer spesifik P2 dan P8 belum bisa mengidentifikasi jenis kelamin pada ayam, puyuh dan itik.
Identifikasi jenis kelamin sangat penting dilakukan untuk memperbaiki manajemen dalam budidaya ternak. Ayam dan itik telah dapat diketahui jenis kelaminnya sejak masih anakan, namun pada puyuh sulit dilakukan sehingga saat ini anakan puyuh masih dijual dipasaran secara unsex. Saat ini para peternak telah mengetahui cara menentukan jenis kelamin pada ayam, puyuh maupun itik baik secara fenotipik maupun vent sexing yang berdasarkan kloaka. Identifikasi jenis kelamin secara molekuler pada ayam, puyuh dan itik dalam penelitian ini dilakukan sebagai acuan lebih lanjut dalam studi molekuler.
28 Appendix I (terancam punah) sebanyak 4 spesies dan Appendix II (genting) sebanyak 73 spesies. Salah satu spesies yang termasuk dalam Appendix I yaitu kakatua molucan (Cacatua moluccensis) dan kakatua kecil jambul kuning (Cacatua shulpurea) termasuk dalam Appendix II.
Upaya yang dapat dilakukan untuk meningkatkan populasi burung endemik Indonesia yaitu pengembangbiakan, salah satunya penangkaran. Penangkaran burung endemik masih belum berkembang di Indonesia. Hal ini karena para penangkar masih sulit untuk menentukan jenis kelamin. Identifikasi jenis kelamin merupakan hal yang utama dalam pengembangbiakan burung endemik Indonesia karena sebagian besar burung termasuk jenis yang monomorfik. Identifikasi jenis kelamin ini dapat bermanfaat untuk memperbaiki manajemen penangkaran, seperti pemasangan ring pada anakan, menyatukan anakan jantan dan betina pada satu kandang, meningkatkan ekonomi masyarakat dan sebagai studi keilmuan.
29
KESIMPULAN DAN SARAN
Kesimpulan
Penentuan jenis kelamin berhasil dilakukan pada merpati, kakatua kecil jambul kuning, kakatua molukan dan beo nias, namun belum berhasil pada ayam, puyuh dan itik berdasarkan gen Chromo Helicase DNA Binding dengan menggunakan primer P2 dan P8 pada media gel agarose 2%. Kualitas DNA darah memiliki kemurnian dan konsentrasi DNA yang lebih tinggi dibandingkan dengan bulu.
Saran
PENGGUNAAN GEN CHROMO HELICASE DNA BINDING
(CHD) SEBAGAI MARKER PENENTU JENIS
KELAMIN PADA AVES
SKRIPSI
EKA SARI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
PENGGUNAAN GEN CHROMO HELICASE DNA BINDING
(CHD) SEBAGAI MARKER PENENTU JENIS
KELAMIN PADA AVES
SKRIPSI
EKA SARI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
i
RINGKASAN
Eka Sari. D14080071. 2012. Penggunaan Gen Chromo Helicase DNA Binding
(CHD) sebagai Marker Penentu Jenis Kelamin pada Aves. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. Pembimbing Anggota : Maria Ulfah, S. Pt., M.Sc.Agr.
Jenis kelamin merupakan informasi yang penting dalam budidaya unggas dan penangkaran burung. Penentuan jenis kelamin pada sebagian burung sulit dilakukan karena memiliki ciri-ciri fenotipik yang sangat mirip antara jantan dan betina, bahkan setelah mencapai dewasa kelamin (monomorfis). Hal ini menjadi suatu permasalahan bagi para breeder karena mereka belum yakin dengan jenis kelamin burung yang mereka identifikasi. Identifikasi jenis kelamin sejak dini sangat bermanfaat dalam pengembangbiakan serta menekan biaya perawatan untuk proses reproduksi di penangkaran. Penentuan jenis kelamin secara molekuler merupakan suatu solusi efektif bagi para breeder karena dapat dilakukan sejak dini dan dideteksi dari DNA sehingga hasilnya lebih akurat. Penentuan jenis kelamin secara molekuler dilakukan berdasarkan gen Chromo Helicase DNA Binding (CHD) dengan menggunakan primer P2 dan P8. Tujuan penelitian ini yaitu untuk mengidentifikasi jenis kelamin Aves menggunakan primer P2 dan P8 berdasarkan DNA dari hasil ekstraksi darah dan bulu.
Jenis-jenis Aves yang digunakan dalam penelitian ini yaitu ayam kampung, puyuh, itik, merpati, beo nias, kakatua molukan dan kakatua kecil jambul kuning yang seluruhnya berjumlah 21 sampel. Sampel penelitian diperoleh dari darah dan bulu yang kemudian diekstraksi untuk mendapatkan DNA total. Sampel darah diekstraksi dengan menggunakan metode konvensional (phenol-chloroform), sedangkan bulu diekstraksi dengan menggunakan kit ekstraksi. DNA total diamplifikasi dengan menggunakan primer P2 dan P8 dan dielektroforesis pada gel agarose. Genotyping dilakukan dengan melihat jumlah pita yang dihasilkan yaitu satu pita menunjukkan jantan dan dua pita menunjukkan betina.
Hasil penelitian ini menunjukkan bahwa kualitas DNA darah lebih tinggi dibandingkan dengan bulu. Gen CHD berhasil diamplifikasi menggunakan primer P2 dan P8 dengan ukuran berkisar 300-400 bp. Hasil amplifikasi gen CHD menunjukkan bahwa primer P2 dan P8 berhasil mengidentifikasi jenis kelamin pada merpati, beo nias, kakatua molukan dan kakatua kecil jambul kuning dengan elektroforesis pada gel agarose 2%. Namun primer P2 dan P8 tidak berhasil mengidentifikasi jenis kelamin pada ayam, puyuh dan itik dengan gel agarose 2% karena perbedaan ukuran fragmen spesifik CHD-Z dan CHD-W yang kecil sehingga pita Z dan W tidak terpisah pada gel agarose 2%.
ii
ABSTRACT
The Application of Chromo Helicase DNA Binding (CHD) Gene as A Marker for Avian Sex Determination
Sari, E., C. Sumantri, and M. Ulfah
Many avian spesies are difficult to distinguish between male and female based on their morphology. Male and female must be kept in the same cage for reproduction. DNA-based sex identification provides a solution. CHD genes are preserved within avian Z and W sex chromosomes. The aim of this research was to determine avians sex based on CHD gene using P2 and P8 primers. DNA was extracted from avians blood and feather. The Polymerase Chain Reaction (PCR) with a single of primers P2 and P8 on a 2% agarose gel was used to decide the avian sex of chickens, quails, ducks, rock pigeons, common hill myna, yellow-crested cockatoos, and salmon-crested cockatoos. Sex identifification of avian spesies based on bands the Z and W, males had a single band (ZZ), and females had two (ZW) on a agarose gel. The CHD gene amplified by the P2 and P8 primers had the fragment size of 300-400 bp. P2 dan P8 primers had no success for sex identification in chickens, quails and ducks. However, the primers could be used to identify the sex of rock pigeons, common hill myna, yellow-crested cockatoos and salmon-crested cockatoos.
iii
PENGGUNAAN GEN CHROMO HELICASE DNA BINDING
(CHD) SEBAGAI MARKER PENENTU JENIS
KELAMIN PADA AVES
EKA SARI
D14080071
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
iv
Judul : Penggunaan Gen Chromo Helicase DNA Binding (CHD) Sebagai Marker Penentu Jenis Kelamin pada Aves
Nama : Eka Sari
NIM : D14080071
Menyetujui,
Tanggal Ujian: 2 Juli 2012 Tanggal Lulus : Mengetahui,
Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) NIP. 19591212 198603 1 004
Pembimbing Anggota,
(Maria Ulfah, S.Pt., M.Sc.Agr.) NIP. 19761101 199903 2 001 Pembimbing Utama,
v
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 17 Desember 1989 di Pekanbaru, Riau. Penulis anak ketiga dari tiga orang bersaudara dari pasangan Bapak Azwar dan Ibu Sari Banun. Penulis memulai pendidikan dasar di SD Negeri 05 Sukajadi, Pekanbaru pada tahun 1996 hingga 2002. Pendidikan menengah pertama ditempuh penulis di SMP Negeri 13 Pekanbaru pada tahun 2002 hingga 2005. Penulis melanjutkan pendidikan menengah atas di SMA Negeri 1 Harau, Payakumbuh pada tahun 2005 hingga 2008.
Penulis diterima di Institut Pertanian Bogor pada tahun 2008 melalui jalur Ujian Seleksi Masuk IPB (USMI) dan diterima di Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor. Selama mengikuti pendidikan di perguruan tinggi, penulis aktif dalam organisasi Badan Eksekutif Mahasiswa Keluarga Mahasiswa Institut Pertanian Bogor (BEM KM IPB) kabinet IPB Gemilang periode 2008-2009 sebagai anggota Kementrian Kebijakan Kampus, Badan Eksekutif Mahasiswa Fakultas Peternakan (BEM D) periode 2010-2011 sebagai anggota RPM Internal, Majalah Emulsi periode 2010-2010-2011 sebagai anggota Divisi Marketing dan Ikatan Pelajar Mahasiswa Payakumbuh (IKMP) periode 2008-2012 sebagai anggota. Penulis juga aktif dalam organisasi nasional yaitu Ikatan Senat Mahasiswa Peternakan Indonesia (ISMAPETI) Wilayah II periode 2009-2011 sebagai anggota.
vi
KATA PENGANTAR
Alhamdulillahirabbil’alamin, puji dan syukur kehadirat Allah SWT atas segala karunia dan rahmatNya sehingga penulis mampu menyelesaikan studi, penelitian dan skripsi dengan judul Penggunaan Gen Chromo Helicase DNA
Binding (CHD) Sebagai Marker Penentu Jenis Kelamin pada Aves. Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Beberapa hal yang mendasari penelitian ini dilakukan diantaranya, yaitu: (1) populasi burung endemik Indonesia yang semakin menurun akibat permintaan pasar yang tinggi sehingga butuh perhatian khusus mengenai pengembangbiakannya; (2) pentingnya informasi mengenai jenis kelamin dalam budidaya unggas dan penangkaran burung terutama jenis Aves yang monomorfik; (3) minimnya informasi mengenai studi identifikasi jenis kelamin pada unggas dan burung endemik Indonesia.
Penelitian ini bertujuan untuk mengidentifikasi jenis kelamin pada kelas Aves berdasarkan gen Chromo Helicase DNA Binding menggunakan primer P2 dan P8. Hasil yang diperoleh dari penelitian ini berupa informasi identifikasi jenis kelamin pada ayam, puyuh, itik, merpati, beo nias, kakatua molukan dan kakatua kecil jambul kuning secara molekuler. Hasil penelitian ini diharapkan dapat menjadi solusi yang akurat dalam identifikasi jenis kelamin pada Aves yang monomorfik sehingga dapat membantu dalam memperbaiki manajemen reproduksi dan menekan biaya perawatan. Selain itu dengan adanya penelitian ini, identifikasi jenis kelamin pada burung endemik Indonesia seperti beo nias, kakatua molukan dan kakatua kecil jambul kuning dapat dilakukan dengan mudah sehingga populasinya dapat meningkat. Penulis berharap skripsi ini dapat menjadi inspirasi bagi mahasiswa lainnya untuk mengembangkan informasi mengenai pemanfaatan gen CHD untuk identifikasi jenis kelamin pada Aves. Semoga skripsi ini dapat memberikan sumbangan manfaat bagi dunia peternakan Indonesia. Amiin.
Bogor, Juli 2012
vii Penentuan Jenis Kelamin pada Aves ... 6 Gen CHD (Chromo Helicase DNA Binding) ... 8 Isolasi DNA Total ... 9 Seleksi Menggunakan Penanda Molekuler ... 10 Elektroforesis ... 11 MATERI DAN METODE ... 14 Lokasi dan Waktu ... 14 Materi ... 14 Sampel ... 14 Pengambilan Sampel ... 14 Ekstraksi DNA ... 14 Amplifikasi Gen CHD ... 18 Elektroforesis ... 19 Rancangan dan Analisis Data ... 19
viii Genotyping ... 19 HASIL DAN PEMBAHASAN ... 20 Isolasi DNA ... 20 Kualitas DNA ... 20 Amplifikasi Gen Chromo Helicase DNA Binding (CHD) ... 23 Implementasi Penentuan Jenis Kelamin secara Molekuler dalam Pengembangan Riset dan Studi Keilmuan ... 27 KESIMPULAN DAN SARAN ... 29 Kesimpulan ... 29 Saran ... 29 UCAPAN TERIMA KASIH ... 30 DAFTAR PUSTAKA ... 31 LAMPIRAN ... 35
ix
DAFTAR GAMBAR
Nomor 1. Beberapa Jenis Aves: Ayam Kampung Jantan dan Betina, Puyuh
Jantan dan Betina, Itik Jantan dan Betina, Merpati, Beo Nias, Kakatua Molukan dan Kakatua Kecil Jambul Kuning ... 6 2. Proses Polymerase Chain Reaction (PCR) ... 11 3. Jenis Sampel: Ayam Kampung Jantan dan Betina, Puyuh Jantan
dan Betina, Itik Jantan dan Betina, Merpati, Beo Nias, Kakatua
Molukan dan Kakatua Kecil Jambul Kuning ... 16 4. Penentuan Genotipe Gen CHD pada Aves ... 19 5. Elektroforesis DNA Hasil Ekstraksi pada Gel Agarose 1,5 % ... 23 6. Hasil Amplifikasi Gen CHD Menggunakan Primer P2 dan P8
pada Ayam Kampung, Puyuh, Itik, Merpati, Beo Nias, Kakatua Molukan dan Kakatua Kecil Jambul Kuning dengan Elektroforesis Gel Agarose 2 % ... 24 7. Sekuen Gen CHD-Z dan CHD-W pada Columba livia, Coturnix
x
DAFTAR TABEL
Nomor 1. Karakteristik Gel Agarose dan Poliakrilamid ... 13 2. Identitas Sampel Penelitian ... 15 3. Nilai Kemurnian dan Konsentrasi DNA Darah ... 21 4. Nilai Kemurnian dan Konsentrasi DNA Bulu ... 22
xi
DAFTAR LAMPIRAN
Nomor 1. Sekuen Gen CHD-Z pada Ayam (Gallus gallus) ... 37 2. Sekuen Gen CHD-W pada Ayam (Gallus gallus) ... 38 3. Sekuen Gen CHD-Z pada Puyuh (Coturnix coturnix japonica) ... 39 4. Sekuen Gen CHD-W pada Puyuh (Coturnix coturnix japonica) .... 40 5. Sekuen Gen CHD-Z pada Merpati (Columba livia) ... 41 6. Sekuen Gen CHD-W pada Merpati (Columba livia) ... 42
1
PENDAHULUAN
Latar Belakang
Jenis kelamin merupakan informasi yang penting dalam budidaya unggas dan penangkaran burung. Penentuan jenis kelamin pada sebagian burung sulit dilakukan karena memiliki ciri-ciri fenotipik yang sangat mirip antara jantan dan betina, bahkan setelah mencapai dewasa kelamin (monomorfis). Namun, proses perkawinan di suatu penangkaran dilakukan dengan menyatukan jantan dan betina dalam satu kandang. Hal ini menjadi suatu permasalahan bagi para breeder karena mereka belum yakin dengan jenis kelamin burung yang mereka identifikasi. Identifikasi jenis kelamin sejak dini sangat bermanfaat dalam pengembangbiakan serta menekan biaya perawatan untuk proses reproduksi di penangkaran.
Secara umum identifikasi jenis kelamin dapat dilakukan berdasarkan dari morfologi, kondisi hormonal dan molekuler. Identifikasi berdasarkan morfologi dan kondisi hormonal hanya dapat dilakukan setelah mengalami dewasa kelamin. Penentuan jenis kelamin secara molekuler merupakan suatu solusi efektif bagi para breeder karena dapat dilakukan sejak dini dan dideteksi dari DNA sehingga hasilnya lebih akurat. Sumber DNA untuk identifikasi jenis kelamin Aves dapat berasal dari darah dan bulu. Penggunaan bulu dapat menghindari rasa sakit saat koleksi sampel sehingga mengurangi stres yang terjadi pada burung. Penangkar burung biasanya menggunakan jasa identifikasi jenis kelamin dengan sumber DNA dari bulu dan mengirim sampel tersebut ke luar negeri karena masih terbatasnya jasa sexing burung di Indonesia.
2 mengidentifikasi jenis kelamin burung endemik Indonesia seperti kakatua kecil jambul kuning, kakatua molukan dan beo nias.
Tujuan
3
TINJAUAN PUSTAKA
Aves (Bangsa Burung)
Burung atau aves adalah hewan yang memiliki bulu, tungkai atau lengan depan termodifikasi untuk terbang, tungkai belakang teradaptasi untuk berjalan, berenang dan hinggap, paruh tidak bergigi, jantung memiliki empat ruang, rangka ringan memiliki kantong udara, berdarah panas, tidak memiliki kandung kemih dan bertelur (Welty, 1982). Burung diklasifikasikan dalam kingdom Animalia, filum Chordata, subfilum Vertebrata, dan kelas Aves.
Alikondra (2010) menjelaskan bahwa domestikasi adalah suatu urutan proses pembentukan spesies dalam suatu populasi yang semakin lama semakin disesuaikan dengan keadaan tidak liar, melalui mekanisme-mekanisme penjinakan dari banyak generasi untuk mendekati/mencapai tuntutan kebutuhan manusia. Berdasarkan proses domestikasi kelas Aves terbagi menjadi unggas dan burung.
Unggas
Unggas merupakan jenis (spesies) burung yang telah mengalami domestikasi dan mempunyai manfaat utama sebagai penghasil pangan (Donham dan Haase, 1980). Beberapa jenis unggas seperti ayam Kampung, itik, puyuh dan merpati dijelaskan dibawah ini:
Ayam Kampung. Ayam kampung (Gallus gallus domesticus) memiliki kekerabatan yang dekat dengan dua sub spesies dari ayam hutan merah (G. gallus spadiceus) di China dan ayam hutan merah (G. gallus gallus) di Thailand (Sulandari dan Zein, 2009). Ayam kampung didefinisikan sebagai ayam yang tidak mempunyai ciri-ciri khas tertentu, dengan kata lain penampilan fenotipenya masih sangat beragam. Sifat-sifat kualitatif seperti warna bulu, warna kulit dan bentuk jengger yang sangat bervariasi (Sartika dan Iskandar, 2007; Sartika, 2000). Ayam kampung jantan memiliki bulu ekor sama panjang dengan panjang tubuh dan berpenampilan gagah, sedangkan betina bulu ekor lebih pendek dari panjang tubuh, memiliki ukuran badan dan kepala lebih kecil (Gambar 1).
4 itik betina (Brahmantiyo et al., 2003). Itik liar mengalami perubahan morfologi yang bervariasi sesuai dengan tempat berkembangnya setelah mengalami domestikasi seperti itik alabio, itik tegal, itik mojosari dan lain-lain (Srigandono, 1997). Pola warna bulu itik mojosari sebagian besar didominasi oleh warna lurik-coklat gelap. Variasi warna diantaranya adalah kombinasi warna lurik dengan belang putih pada daerah leher dan bagian dada. Dari sebagian kecil dari populasi itik mojosari muncul warna bulu putih polos (Suparyanto, 2003) (Gambar 1).
Puyuh. Puyuh merupakan jenis Aves yang tidak dapat terbang, ukuran tubuh relatif kecil dan berkaki pendek. Puyuh merupakan penghasil daging dan telur sehingga sering dipelihara oleh masyarakat (Minvielle, 2004). Puyuh jantan dan betina dapat dibedakan dari pola warna. Ciri-ciri puyuh jantan yaitu pada bagian bulu kepala sampai ke bagian belakang terdapat warna putih yang berbentuk garis melengkung tebal, bulu leher, dan dadanya yang berwarna cokelat muda (cinamon) tanpa ada bercak kehitaman, bulu punggung berwarna campuran cokelat gelap, abu-abu dengan garis putih dan bulu sayap seperti bulu punggung dengan belang kehitaman. Ciri-ciri puyuh betina yaitu warna bulu pada kerongkongan dan dada bagian atas berwarna cokelat muda lebih terang (sawo matang) dengan bercak cokelat tua atau kehitam-hitaman (Kasiyati, 2009) (Gambar 1).
5
Burung
Burung merupakan salah satu jenis satwa liar yang hidup di dalam ekosistem alam dengan jumlah populasi yang tinggi. Fimbel et al (2001) menyebutkan bahwa fungsi ekologis burung yaitu sebagai pollinator, penyebar dan pemangsa benih. Indonesia memiliki kekayaan hayati berupa burung yang berlimpah. Populasi burung saat ini mengalami penurunan karena meningkatnya populasi manusia sehingga habitat asli burung menjadi terganggu. Tingginya permintaan pasar juga salah satu faktor yang menyebabkan menurunnya populasi burung endemik Indonesia di alam. Hal ini menyebabkan perlunya pengembangbiakan yang diharapkan mampu meningkatkan populasi dan kelestariannya dengan upaya penangkaran. Alikondra (2010) menyebutkan bahwa penangkaran satwa liar adalah perkembangbiakan dan pemeliharaan satwa liar dalam keadaan terkurung oleh manusia untuk mencapai sasaran tertentu. Beberapa jenis burung yang saat ini populasinya menurun akibat tingginya permintaan pasar yaitu kakatua kecil jambul kuning, kakatua molukan dan beo Nias.
Kakatua Kecil Jambul Kuning dan Kakatua Molukan. Burung kakatua merupa-kan jenis burung yang sangat dekat dan banyak digemari oleh masyarakat karena perilaku yang khas, lucu, riang dan suka menirukan suara. Burung kakatua merupakan spesies endemik Indonesia (Gambar 1). Indonesia memiliki 77 spesies dari burung paruh bengkok (Ordo: Psttaciformes, Family: Pssittacidae) yaitu 61 spesies diantaranya masuk ke dalam daftar perdagangan pasar internasional sejak tahun 1983-1999. Hal ini menyebabkan populasi burung ini mendekati kepunahan akibat permintaan pasar yang tinggi. Semua burung paruh bengkok Indonesia terdaftar dalam Appendix CITES yaitu Appendix I (terancam punah) sebanyak 4 spesies dan Appendix II (genting) sebanyak 73 spesies. Salah satu spesies yang termasuk dalam Appendix I yaitu kakatua molucan (Cacatua moluccensis) (Soehartono dan Mardiastuti, 2002).
Beo Nias
6 Inggris disebut Mynah (Campbell dan Lack, 1985). Burung beo adalah burung monomorfik yaitu sulit dibedakan antara jantan dan betina. Hampir semua jenis burung beo terancam kelestariannya akibat penangkapan dari habitat alaminya. Burung beo termasuk daftar burung paruh bengkok yang popular dalam pedagangan burung internasional (Soehartono dan Mardiastuti, 2002).
Gambar 1. Beberapa Jenis Aves: Ayam Kampung Jantan (A.1) dan Betina (A.2)1, Puyuh Jantan (B.1) dan Betina (B.2)2, Itik Jantan (C.1) dan Betina (C.2)3, Merpati (D)4, Beo Nias (E)5, Kakatua Molukan (F)6, dan Kakatua Kecil Jambul Kuning (G)7.
Sumber: 1(Candrawati, 2007)
2
(www.cybex.deptan.go.id)
3
(www.litbang.deptan.go.id)
4
(www.karantina.deptan.go.id)
5
(Shepherd, 2006)
6
(Harrison, 2005)
7
(Harrison, 2005)
Penentuan Jenis Kelamin pada Aves
7 Autosexing. Penentuan jenis kelamin day old chick (DOC) merupakan pekerjaan yang sangat penting dalam reproduksi di suatu pembibitan. Fakta menarik mengenai jenis kelamin DOC yang baru menetas dapat diketahui dari bulu menggunakan gen marker K-k yang berlokasi pada kromosom sex Z. Saat menetas jantan dilihat dari pertumbuhan bulu primer yang lambat, sementara itu betina diketahui dari pertumbuhan bulu primer yang lebih cepat. Hal ini menjadi cara yang mudah, tingkat akurasi yang tinggi dan cepat dalam menentukan jenis kelamin pada ayam sehingga sering digunakan di pembibitan unggas skala industri (Mincheva et al., 2012). Autosexing ayam diketahui dari warna bulu akibat mutasi yang terpaut kelamin. Jantan dan betina dapat diidentifikasi saat penetasan melalui warna bulunya yang unik (Elbrecht dan Smith, 1992).
Vent Sexing. Vent sexing merupakan metode yang dipopulerkan oleh seorang profesor Jepang, Kiyoshi Masui pada tahun 1930. Metode ini mengidentifikasi jenis kelamin berdasarkan area kloaka untuk melihat keberadaan alat kelamin jantan. Metode itu membutuh orang yang terlatih dan banyak pengalaman. Vent sexers yang sangat terlatih dengan mudah mengidentifikasi jenis kelamin day old chick (DOC) dengan tingkat keberhasilan hingga 95%. Seorang ahli juga dapat mengalami kesalahan dalam mengidentifikasi burung yang monomorfik (Bramwell, 2003).
Laparoskopi (Pembedahan). Karakteristik saluran reproduksi dapat langsung dilihat dengan menggunakan laparoskopi. Gonad burung dewasa lebih mudah divisualisasi dibandingkan dengan anakan. Metode ini dilakukan dengan penyayatan kecil pada sisi kiri tubuh burung sehingga memiliki resiko yang tinggi yaitu cedera pada organ vital burung yang dibedah. Pemeriksaan ini dapat berbahaya dan bahkan mematikan burung tersebut (Swengel, 1996; Cerit dan Avanus, 2007a).
8 Karyotyping. Sumber untuk isolasi kromosom dan penentuan kariotipe dapat diperoleh dari kultur sel yang umumnya berasal dari bulu atau sel darah. Sebagian besar kromosom spesies burung adalah mikrokromosom sehingga sulit untuk menghitung mikrokromosom ini secara akurat. Kromosom Z memiliki ukuran yang lebih besar dibandingkan dengan kromosom W (Archawaranon, 2004). Kelemahan dari metode ini yaitu prosedur yang memakan waktu lama (Cerit dan Avanus, 2007a)
Gen CHD (Chromo Helicase DNA Binding)
Gen Chromo Helicase DNA binding (CHD) merupakan suatu gen penanda jenis kelamin pada Aves. Gen CHD berada di kromosom Z dan W, yang terdiri dari CHD-Z (berada pada kromosom Z) dan CHD-W (berada pada kromosom W) (Dubiec dan Zagalska-Neubauer, 2006). Gen CHD (chromo helicase DNA binding) merupakan gen pertama yang berlokasi di kromosom W (CHD-W) pada aves (Griffiths and Tiwari, 1995). CHD-Z berlokasi pada kromosom Z (Griffiths and Korn 1997), yang ada pada dua jenis kelamin (ZZ dan ZW). Struktur protein dari CHD-Z dan CHD-W diketahui memiliki perbedaan yang sangat sedikit (Fridolfson dan Ellergen, 1999). Sejauh ini hanya sedikit gen yang terdapat pada kromosom W untuk mengidentifikasi jenis kelamin pada Aves, namun gen yang paling umum digunakan yaitu gen CHD.
Aves mempunyai kromosom sex yang berbeda dibandingkan dengan mamalia. Sifat heterogametik pada burung dimiliki oleh betina (ZW) sedangkan jantan merupakan homogametik (ZZ) (Ellergren, 1996). Gen CHD (Chromo Helicase DNA binding) dapat menunjukkan perbedaan antara alel Z dan W pada betina (Griffiths et al., 1996). Perbedaan ini terjadi karena adanya keterpautan (linkage) antara posisi gen CHD dengan kromosom kelamin pada Aves (kromosom Z dan W) (Griffith dan Korn, 1997).
9
Isolasi DNA Total
Teknik PCR memerlukan suatu DNA cetakan (DNA template) yang nantinya akan diperbanyak secara in vitro. DNA cetakan didapatkan dari hasil ekstraksi dan purifikasi suatu sel, jaringan atau organ. Sebagian besar DNA pada sel hewan terdapat di dalam inti dan sebagian yang lain terdapat di organel seperti mitokondria. Ekstraksi dan purifikasi DNA pada prinsipnya adalah suatu cara atau metoda untuk memisahkan DNA total dari komponen sel lainnya (Sulandari dan Zein, 2003). Setiap sel atau jaringan yang memiliki DNA memungkinkan untuk dilakukan ekstraksi DNA. Namun kualitas dan jumlah DNA yang diperoleh dapat bervariasi tergantung asal jaringan, metode penyimpanan, dan cara ekstraksi. Ekstraksi DNA dari fosil, rambut atau bulu, dan feses biasanya lebih sulit dilakukan (Taberlet et al. 1996).
Prinsip metode purifikasi pada semua jaringan hewan tidak jauh berbeda, yaitu terdiri atas tiga tahapan utama. Tiga tahapan tersebut secara berurutan adalah penghancuran (lisis) membran sel, pemisahan material DNA dari material organik sel lain, dan pemisahan DNA dari larutannya (presipitasi) (Sambrook et al. 1989). Secara umum dalam studi molekuler burung, DNA total didapatkan dari hasil ekstraksi dan purifikasi darah lengkap (whole blood). Inhibitor (penghambat) yang terdapat pada beberapa jaringan memerlukan perlakuan khusus dalam proses ekstraksi sehingga hasilnya akan sulit untuk di PCR. Ekstraksi DNA dapat dilakukan secara manual ataupun menggunakan DNA extraction kit (kit). Ekstraksi DNA dengan menggunakan kit umumnya menghasilkan DNA dengan kualitas yang lebih baik (Schill, 2007).
Bulu merupakan struktur khusus sebagai penciri dalam kelas Aves. Bulu burung mempunyai prospek menjadi sumber DNA karena pada pangkal bulu (calamus) banyak mengandung sel epitel. Bulu dapat diperoleh secara langsung (pada saat mabung) maupun tak langsung (dicabut) dengan tingkat resiko kecil pada burung tersebut. Namun karena pada bulu banyak mengandung unsur keratin dan sudah mengeras, maka sulit untuk didapatkan DNAnya. Komponen bulu terdiri dari
10
Seleksi Menggunakan Penanda Molekuler
Metode seleksi sederhana berdasarkan informasi fenotipe telah banyak dilakukan untuk perbaikan produktivitas ternak, namun terdapat beberapa keterbatasan seperti perbedaan jenis kelamin dan sifat-sifat yang sulit atau mahal untuk diukur dan diamati (Vischer et al., 2000). Salah satu metode untuk mengatasi kelemahan tersebut adalah dengan melakukan seleksi menggunakan penanda molekuler.
Poymerase Chain Reaction (PCR) merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai primer dalam suatu thermocycler. Panjang target DNA berkisar antara puluhan sampai ribuan nukleotida yang posisinya diapit sepasang primer. Primer yang berada sebelum daerah target disebut sebagai primer forward dan yang berada setelah daerah target disebut primer reverse. Enzim yang digunakan sebagai pencetak rangkaian molekul DNA baru dikenal sebagai enzim polymerase. Untuk mencetak rangkaian tersebut dalam teknik PCR, diperlukan juga dNTPs (deoxynucleoside triphosphat) yang mencakup dATP (nukleotida berbasa Adenine), dCTP (Cytosine), dGTP (Guanine) dan dTTP (Tymine) (Muladno, 2002).
11 Gambar 2. Proses Poymerase Chain Reaction (PCR)
(Nicholas, 2004)
Polymerase Chain Reaction-Single Strand Comformation Polymorphism (PCR-SSCP) merupakan salah satu metode analisis lebih lanjut yang memanfaatkan produk PCR. Metode ini merupakan pemisahan asam nukleat rantai tunggal (single stranded nucleic acids) hasil amplifikasi PCR dengan elektroforesis melalui gel poliakrilamid dan berdasarkan pada perbedaan berat model pasangan basa, sehingga dapat menghasilkan perbedaan struktur sekuen gen (Orita et al., 1989). Prinsip yang mendasari metode analisis SSCP adalah perbedaan asam nukleotida yang akan mempengaruhi bentuk fragmen DNA untai tunggal (Bastos et al., 2001) akan menyebabkan pola migrasi pada saat elektroforesis dalam gel poliakrilamid (Baroso et al., 1999) walaupun perbedaannya hanya satu nukleotida saja (Nataraj et al., 1999).
Elektroforesis