METODE CEPAT PENENTUAN FLAVONOID TOTAL
MENIRAN (
Phyllantus niruri
L.) BERBASIS TEKNIK
SPEKTROMETRI INFRAMERAH DAN KEMOMETRIK
INDAH KURNIASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
INDAH KURNIASARI. Metode Cepat Penentuan Flavonoid Total Meniran (
Phyllantus
niruri
L.) Berbasis Teknik Spektroskopi Inframerah dan Kemometrik. Dibimbing oleh
LATIFAH K. DARUSMAN dan RUDI HERYANTO.
Teknik spektroskopi inframerah (IR) yang digabungkan dengan kemometrik
digunakan sebagai metode alternatif untuk mengukur kadar flavonoid total dalam
simplisia tanaman obat. Sampel meniran dari tiga daerah berbeda dianalisis dengan teknik
spektroskopi inframerah transformasi Fourier dan kadar flavonoid totalnya diukur
menggunakan metode kolorimetrik.
Principal component analysis
digunakan untuk
mengelompokkan spektrum IR berdasarkan pada daerah asal meniran, sedangkan p
artial
least square
digunakan untuk membuat model prediksi kadar flavonoid total.
Prapemrosesan dan segmentasi spektrum IR dilakukan untuk memperoleh
pengelompokan dan model prediksi terbaik. Spektrum IR dengan prapemrosesan
menunjukkan pengelompokan yang lebih baik dibandingkan dengan spektrum IR tanpa
prapemrosesan. Pengelompokan terbaik dihasilkan dari spektrum IR utuh, yaitu pada
kisaran bilangan gelombang 3996 –399 cm
-1(set data ke-5) dan dari spektrum IR
gabungan segmen I dan II, yaitu pada 3730–2812 dan 1890–399 cm
- 1(set data ke-8). Dua
ABSTRACT
INDAH KURNIASARI. A Rapid Method for Total Flavonoid Determination of Meniran
(
Phyllantus niruri
L.) Based on Infrared Spectroscopy and Chemometrics. Under the
direction of LATIFAH K. DARUSMAN and RUDI HERYANTO.
Infrared spec troscopy technique combined with chemometrics was used as an
alternative method to determine flavonoid content in herbal simplicia. Meniran samples
from three different origins was analysed using Fourier transform infrared spectroscopy
technique and their total flavonoid content was determined using colorimetric method.
Principal compo nent analysis was used to get the spectral classification based on sample
origins, whereas partial least square was used to establish the total flavonoid content
prediction model. The preprocessing technique and segmentation was applied to IR
spectra to get the best classification and prediction model. The preprocessed IR spectra
showed better classification result as compared with the non-preprocessed IR spectra. The
best classific ation was obtained from entire spectral data in the wavenumber range on
3996- 399 cm
-1(5
t hdata set) and from combination of the 2
ndand the 1
s tsegment spectral
data in the range of 3730–2812 and 1890–399 cm
-1(8
thMETODE CEPAT PENENTUAN FLAVONOID TOTAL
MENIRAN (
Phyllantus niruri
L.) BERBASIS TEKNIK
SPEKTROSKOPI INFRAMERAH DAN KEMOMETRIK
INDAH KURNIASARI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Metode Cepat Penentuan Flavonoid Total Meniran (
Phyllantus niruri
L.)
Berbasis Teknik Spektroskopi Inframerah dan Kemometrik
Nama : Indah Kurniasari
NIM : G44201061
Meny etujui:
Pembimbing I, Pembimbing II,
Prof. Dr. Ir. Latifah K. Darusman, MS Rudi Heryanto, S.Si., M.Si.
NIP 130536681 NIP 132311929
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor,
Dr. Ir. Yonny Koesmaryono, MS
NIP 131437 999
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas limpahan rahmat dan
hidayah- Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi berjudul Metode
Cepat Penentuan Flavonoid Total Meniran (
Phyllantus niruri
L.) Berbasis Teknik
Spektroskopi Inframerah dan Kemometrik ini merupakan salah satu syarat untuk
memperoleh gelar sarjana sains pada Program Studi Kimia FMIPA IPB.
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Latifah K. Darusman, MS dan
Rudi Heryanto S.Si., M.Si. sebagai pembimbing atas arahan, saran, dan dorongan yang
telah diberikan kepada penulis selama pelaksanaan penelitian dan penulisan skripsi ini.
Terima kasih disampaikan pula kepada Program Penelitian Dasar Direktorat Jenderal
Pendidikan Tinggi Departemen Pendidikan Nasional, melalui Pusat Studi Biofarmaka,
LPPM IPB yang telah mendanai penelitian ini. Ucapan terima kasih juga penulis
sampaikan kepada Ir. Jajang, MS yang telah memberikan bantuan analisis statistik.
Terima kasih penulis ucapkan kepada Papah, Mamah, Mas Giga, dan Olyn atas doa
dan kasih sayangnya. Terima kasih juga penulis ucapkan kepada Om Eman, seluruh
laboran Kimia Analitik, Kak Atep, seluruh staf Pusat Studi Biofarmaka, dan Mas Heri
atas seg ala kemudahan yang diberikan dalam penelitian. Terima kasih kepada
rekan-rekan Kimia 38, rekan-rekan-rekan-rekan Laboratorium Kimia Analitik, keluarga besar Cirahayu 6
(Etta, Erika, Mbak Ade, Mbak Sulis, Levy, Ninin, Mbak Desi, Yuli, Nia, dan Ega),
Annis, Opie, Inul, serta Helmy atas dorongan dan semangat yang tiada henti.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2006
RIWAYAT HIDUP
Penulis dilahirkan di Temanggung pada tanggal 5 April 1983 dari ayah Iding
Chaidir dan ibu Maharsi. Penulis merupakan anak kedua dari tiga bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 70 Jakarta dan pada tahun yang sama
lulus seleksi masuk IPB melalui jalur ujian masuk perguruan tinggi negeri (UMPTN).
Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum mata kuliah
Kimia Analitik I, Kimia Lingkungan, dan Kimia Analitik Dasar pada tahun ajaran
2004/2005, serta mata kuliah Kimia Analitik III dan Kimia Dasar pada tahun ajaran
2005/2006. Penulis aktif sebagai staf Departemen Kewirausahaan dalam kepengurusan
Ikatan Mahasiswa Kimia periode 2002- 2003.
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ...1
TINJAUAN PUSTAKA
Meniran ...1
Flavonoid ...2
Spektroskopi Inframerah Transformasi Fourier (FTIR) ...2
Analisis Kemometrik Spektrum IR...3
PCA ...3
PLS ...3
BAHAN DAN METODE
Bahan dan Alat...4
Metode Penelitian...4
PEMBAHASAN
Kadar Flavonoid Meniran ...5
Spektrum IR Meniran ...5
Klasifikasi Spektrum IR Serbuk Kering Meniran dengan PCA ...7
Pembentukan Model Prediksi Kadar Flavonoid Meniran dengan PLS ...9
SIMPULAN DAN SARAN
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1
Segmentasi spektrum IR...5
2
Penamaan set data ...5
3
Kadar flavonoid total meniran ...5
4 Hasil statistik model prediksi kadar flavonoid total meniran dengan metode PLS ...9
DAFTAR GAMBAR
Halaman
1
Tanaman meniran...1
2
Struktur umum flavonoid ...2
3
Prinsip PCA...3
4
Prinsip PLS ...4
5
Perbandingan spektrum IR standar kuersetin (a) dengan sampel serbuk kering
meniran (b). ...6
6
Spektrum IR sampel serbuk kering meniran dari tiga daerah berbeda ...6
7
Score plot
dua PC pertama dari spektrum IR serbuk kering meniran ...8
DAFTAR LAMPIRAN
Halaman
1
Bagan alir percobaan... 14
2
Pengolahan data dalam analisis kemometrik dengan program Unscrambler ... 15
3
Hasil pengukuran kadar flavonoid total meniran dengan metode Depkes RI ... 20
4
Uji-
F
kadar flavonoid total meniran ... 25
5
Uji-
t
kadar flavonoid total meniran ... 26
6
Hasil pe ngukuran kadar air ... 27
7
Spektrum IR utuh dari sampel serbuk kering meniran tanpa
prapemrosesan spektrum ... 28
8
Spektrum IR segmen I dari sampel serbuk kering meniran tanpa
prapemrosesan spektrum ... 28
9
Spektrum IR segmen II dari sampel serbuk kering meniran tanpa
prapemrosesan spektrum ... 29
10
Spektrum IR gabungan segmen I dan II dari sampel serbuk kering meniran tanpa
prapemrosesan spektrum ... 29
11
Spektrum IR utuh dari sampel serbuk kering meniran dengan
prapemrosesan spektrum ... 30
12
Spektrum IR segmen I dari sampel serbuk kering meniran dengan
prapemrosesan spektrum ... 30
13
Spektrum IR segmen II dari sampel serbuk kering meniran dengan
prapemrosesan spektrum ... 31
14
Spektrum IR gabungan segmen I dan II dari sampel serbuk kering meniran dengan
prapemrosesan spektrum ... 31
13
Scatter plot
dari spektrum IR tanpa prapemrosesan... 32
PENDAHULUAN
Meniran (Phyllantus niruri L.) telah banyak digunakan untuk mengatasi batuk, flu, demam, diabetes, malaria, disentri, batu ginjal, tumor, dan hepatitis (Taylor 2003). Efek pengobatan yang dimiliki oleh tanaman ini antara lain disebabkan oleh senyawa-senyawa aktif seperti flavonoid, lignan, alkaloid, triterpenoid, tanin, dan asam lemak yang terkandung di dalam meniran (Subarnas & Sidik 1993). Flavonoid dalam tanaman ini telah diketahui berperan dalam pengobatan penyakit kulit, kelebihan asam urat, dan batu ginjal (Chairul 1999).
M etode analisis yang biasa digunakan untuk menentukan kadar flavono id dalam simplisia tanaman obat antara lain dengan spektrofotometri ultraviolet (UV) (Depkes RI 2000), kromatografi cair kinerja tinggi (KCKT) (Merken & Beecher 2000), dan elektroforesis kapiler (Marchart et al. 2003). Metode-metode tersebut melibatkan serangkaian tahapan yang membutuhkan waktu lama dalam pelaksanaannya.
Teknik spektrometri inframerah (IR) yang digabungkan dengan kemometrik dapat digunakan sebagai metode alternatif untuk mengukur kadar flavonoid. Teknik ini telah digunakan dalam berbagai penelitian, seperti kuantifikasi minyak esensial dan komposisi kimia dari tanaman genus Umbelliferiae
(Schulz et al. 1998), penentuan kandungan metabolit sekunder pada daun Mentha (Schulz
et al. 1999), klasifikasi Orthosiphon stamineus berdasarkan pada daerah asalnya (Chew et al. 2004), pengelompokan ekstrak daun jati belanda (Guazuma ulmifolia Lamk.) (Jajang 2004), penentuan kadar polifenol dalam tembakau (Shao & Zhuang 2004), identifikasi dan kuantifikasi harpagosida pada akar Harpagophytum procumbens (Baranska
et al. 2005), serta kendal i mutu obat herbal (Zou et al. 2005).
Teknik spektroskopi IR berpotensi sebagai metode analisis cepat karena analisis dapat dilakukan secara langsung pada serbuk kering sampel tanpa tahapan pemisahan terlebih dahulu. Spektrum IR yang dihasilkan merupakan hasil interaksi antara senyawa-senyawa kimia dalam matriks sampel yang sangat kompleks. Spektrum ini sangat rumit dan perbedaan tipis antar spektrum dari tanaman yang sejenis tidak tampak dengan jelas dan pada umumnya tidak dapat terlihat dengan mata telanjang (Chew et al. 2004). Untuk itu, diperlukan suatu metode kemometrik untuk mendapatkan informasi
tersembunyi yang bersifat kualitatif dan kuantitatif dari spektrum IR tersebut.
Kemometrik digunakan untuk menemukan korelasi statistik antara data spekt rum dan informasi yang telah diketahui dari sampel. Penelitian ini bertujuan mendapatkan pengelompokan spektrum IR serbuk kering meniran berdasarkan pada daerah asalnya dengan menggunakan teknik principal component analysis (PCA) dan membentuk model prediksi kadar flavonoid total meniran dengan menggunakan teknik partial least square (PLS) sebagai upaya pencarian metode analisis cepat dalam menentukan flavonoid total meniran.
TINJAUAN PUSTAKA
Meniran
Meniran diklasifikasikan dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dikotiledonae, bangsa Geraniales, suku Euphorbiaceae, marga Phyllantus, dan spesies
P. niruri (USDA 2005). Meniran tumbuh di dataran rendah pada ketinggian 1–1000 m dpl, di tempat terbuka, di ladang, tepi sungai, dan pantai. Selain di Indonesia, tumbuhan ini juga terdapat di India, Cina, Malaysia, Filipina, Australia, Amerika, dan Afrika (Heyne 1987, diacu dalam Subarnas & Sidik 1993).
Meniran termasuk tanaman kecil, terna semusim, dan tumbuh tegak dengan tinggi 30–50 cm. Batangnya berwarna hijau pucat, berbentuk bulat, dan basah. Helaian daun berwarna hijau, berbentuk bulat telur sampai bulat memanjang, ujung tumpul, pangkal membulat, serta bertepi rata dengan panjang sekitar 1.5 cm dan lebar sekitar 7 mm (Achyad & Rasyidah 2000). Meniran memiliki bunga berwarna putih, tunggal, dan berada di dekat tangkai anak daun. Buah berbentuk kotak, bulat, berdiameter sekitar 2 mm, berwarna hijau keunguan dengan biji kecil, keras, dan berwarna cokelat (Soedibyo 1998). Gambar 1 memperlihatkan bentuk tanaman meniran.
Kandungan utama meniran adalah triterpen, flavonoid, tanin, alkohol, dan asam fenolat. Meniran dilaporkan mengandung senyawa-senyawa kimia golongan lignan, seperti filantin, hipofilantin, niranin, nirtetralin, dan fitetralin. Akar dan daun tanaman ini kaya akan senyawa flavonoid, antara lain kuersetin, kuersetrin, isokuersetin, astragalin, dan rutin (Nara et al. 1977 dalam Subarnas & Sidik 1993). Minyak bijinya telah diketahui mengandung asam lemak, saponin, kalium, damar, dan zat samak (Chairul 1999).
Meniran digunakan secara luas sebagai obat tradisional, antara lain untuk mengatasi batuk, malaria, disentri, demam, flu, tumor, sakit kuning, anemia, dan batu ginjal (Taylor 2003). Hasil penelitian fa rmakologi menunjukkan bahwa meniran mempunyai efek hipoglikemik, diuretik, dan hipotensif (Srividya & Periwal 1995), antihepatotoksik (Syamasundar et al. 1985), analgesik (Santos
et al. 1994), antitumor dan antikarsinogen (Rajeshkumar et al. 2002), dan antimalaria (Tona et al 2001). Ekstrak meniran juga telah diketahui efektif dalam menghambat pembentukan kristal kalsium oksalat sebagai pembentuk batu ginjal (Campos & Schor 1999). Hingga kini penelitian untuk menggali manfaat meniran terus dikembangkan, ter utama setelah diketahui bahwa ekstrak air tanaman ini mampu menghambat kerja virus HIV (Naik & Juvekar 2003).
Flavonoid
Golongan flavonoid memiliki kerangka karbon yang terdiri atas dua cincin benzena tersubstitusi yang disambungkan oleh rantai alifatik tiga karbon (Gambar 2). Pengelompokan flavonoid berdasarkan pada cincin heterosiklik-oksigen tambahan dan gugus hidroksil yang tersebar menurut pola yang berlainan (Robinson 1995). Golongan terbesar flavonoid memiliki cincin piran yang yang menghubungkan rantai tiga -karbon dengan salah satu cincin benzena. Pada umumnya, flavonoid terikat pada gula sebagai glikosida dan aglikon flavonoid, dapat pula berada dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida (Harborne1987).
Gambar 2 Struktur umum flavonoid .
Sejumlah tanaman obat yang mengandung flavonoid telah dilaporkan memiliki aktivitas antioksidan, antibakteri, antivirus, antiradang, antialergi, dan antikanker (Miller 1996). Efek antioksidan senyawa ini disebabkan oleh penangkapan radikal bebas melalui donor atom hidrogen dari gugus hidroksil flavonoid. Beberapa penyakit seperti arterosklerosis, kanker, diabetes, parkinson, alzheimer, dan penurunan kekebalan tubuh telah diketahui dipengaruhi oleh radikal bebas dalam tubuh manusia (Amiæ et al. 2003).
Kadar flavonoid dalam sampel herbal dapat ditentukan dengan berbagai metode. Metode yang diakui oleh Departemen Kesehatan RI adalah spektrofotometri UV yang berdasar pada prinsip kolorimetri. Pada metode ini, reaksi antara AlCl3 dan gugus keto
C-4 dan gugus hidroksil C-3 atau C-5 dari flavon dan flavonol akan menghasilkan senyawa kompleks (Chang et al. 2002). Absorbans dari warna yang terbentuk diukur dengan spektrometer UV. Kadar kuersetin dihitung sebagai kadar flavonoid total dalam sampel (Depkes 2000). Perhitungan ini berdasarkan pada hukum Lambert-Beer yang menunjukkan hubungan lurus antara absorbans dan kadar analat.
Spektroskopi Inframerah Transformasi Fourier (FTIR)
Metode spektrofotometrik mengukur jumlah radiasi yang diserap oleh larutan sampel. Jumlah serapan ini berkaitan dengan konsentrasi analat dalam larutan. Ada tiga proses dasar penyerapan radiasi oleh molekul yang semuanya melibatkan kenaikan molekul ke tingkat energi yang lebih tinggi, yaitu radiasi, vibrasi, dan transisi elektronik. Peningkatan energi yang terjadi setara dengan energi radiasi yang diserap oleh molekul (Christian 1986).
Spektrum IR terletak pada kisaran bilangan gelombang 12 800–10 cm- 1. Dilihat dari segi aplikasi dan instrumentasi, spektrum IR dibagi ke dalam tiga jenis radiasi, yaitu IR dekat, pertengahan, dan jauh. FTIR termasuk dalam kategori radiasi IR pertengahan (bilangan gelombang 4000 –200 cm-1) (Nur & Adijuwana 1989).
interferometer. Interferometer membuat spektrometer ma mpu mengukur semua frekuensi optik secara serempak dengan mengatur intensitas dari setiap frekuensi tunggal sebelum sinyal sampai ke detektor. Hasil dari pindai interferometer yang berupa interferogram (plot antara intensitas dan posisi cermin) ini tidak dapat diinterp retasikan dalam bentuk aslinya. Proses transformasi Fourier akan mengubah interferogram menjadi spektrum antara intensitas dan frekuensi (George & McIntyre 1987).
Analisis Kemometrik Spektrum IR
Spektrum IR sangat kaya akan informasi sktruktur molekular yang terdiri atas gerak rotasi dan vibrasi. Banyaknya gerakan molekular dari molekul poliatom akan membentuk serangkaian pita serapan yang spesifik untuk masing-masing molekul. Hal ini membuat spektroskopi IR menjadi metode analisis kualitatif yang sangat berguna, tetapi sulit dilakukan akibat adanya kemiripan dari setiap respons spektrum. Analisis kuantitatif spektrum IR juga sangat sulit karena adanya tumpang tindih spektrum serapan dari molekul-molekul dalam sampel. Untuk dapat mengekstraksi informasi dari data spektrum IR yang rumit tersebut, diperlukan suatu metode kemometrik berupa analisis multivariat (Stchur et al. 2002).
Analisis multivariat menyediakan metode untuk mengurangi data berukuran besar yang diperoleh dari instrumen, seperti spektrofotometer. Metode kalibrasi multivariat dapat berupa multiple linear regression, principal component regression, PLS, dan artificial neural network (ANN) (Brereton 2000). Selain itu, analisis multivariat dapat digunakan untuk pengenalan pola dal am sampel melalui metode PCA,
discriminant analysis, K-nearest neighbour,
soft independent modelling of class anology, dan cluster analysis (Miller & Miller 2000).
PCA
PCA merupakan suatu metode analisis peubah ganda yang bertujuan memperkecil dimensi peubah asal sehingga diperoleh peubah baru (principal component, P C) yang tidak saling berkorelasi tetapi menyimpan sebagian informasi yang terkandung pada peubah asal. Pemilihan PC dilakukan sehingga PC pertama memiliki variansi terbesar dalam set data, sedangkan PC kedua tegak lurus terhadap PC pertama dan memiliki
variansi terbesar selanjutnya. Dua PC pertama pada umumnya digunakan sebagai bidang proyeksi untuk inspeksi visual dari data (Miller & Miller 2000).
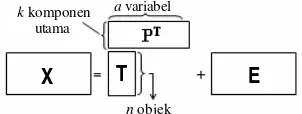
Teknik PCA berdasar pada dekomposisi matriks data X (N
×
K) menjadi dua matriksT (N
×
A) dan matriks P (K×
A) yang saling tegak lurus (Gambar 3). Matriks T yangdisebut dengan matriks scores
menggambarkan variansi dalam objek, sedangkan matriks P yang disebut dengan matriks loading menjelaskan pengaruh variabel terhadap komponen utama. Matriks P
terdiri atas data asli dalam sistem koordinat baru. Error dari model yang terbentuk dinyatakan dalam E (Lohninger 2004).
Gambar 3 Prinsip PCA (Lohninger 2004).
PLS
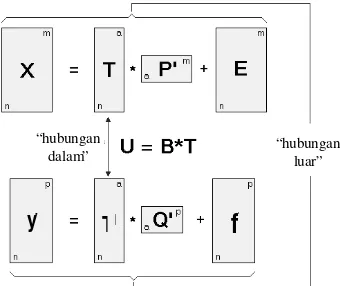
PLS digunakan untuk memprediksi serangkaian variabel tak bebas dari variabel bebas (prediktor) yang jumlahnya sangat banyak, memiliki struktur sistematik linier atau nonlinier, dengan atau tanpa data yang hilang, dan memiliki kolinearitas yang tinggi. Metode ini membentuk model dari variabel-variabel yang ada untuk membentuk serangkaian respons dengan menggunakan regresi kuadrat terkecil dalam bentuk matriks (Herve 2003).
Parameter -parameter dalam PLS sebagai metode kalibrasi adalah factors, loadings, dan
scores. Model PLS berdasar pada komponen utama dari data bebas X dan data tak bebas y. Inti dari PLS adalah untuk menghitung nilai (scores) dari matriks X dan y dan untuk membuat model regresi antara nilai-nilai tersebut (Dieterle 2003).
Gambar 4 menunjukkan bahwa matriks data X diuraikan menjadi matriks T (matriks
scores), matriks P (matriks loading), dan matriks error E, sedangka n matriks y
diuraikan menjadi U, Q, dan errorf. Kedua persamaan ini disebut ‘hubungan luar’. Hasil dari T dan P mendekati data spektrum, sedangkan hasil U dan Q mendekati konsentrasi sebenarnya. Tujuan dari algoritma PLS adalah meminimalkan f dengan terus menjaga korelasi antara X dan y dalam ‘hubungan dalam’ U=BT (Lohninger 2004).
k komponen utama
a variabel
n objek
Gambar 4 Prinsip PLS (Lohninger 2004).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah sampel daun meniran berusia tiga bulan yang diperoleh dari tiga daerah (Bantar Kambing, Darmaga, dan Cisarua), etanol, larutan 0.5% heksametilenatetramina, aseton, larutan 25% HCl dalam air, etil asetat, larutan asam asetat glasial 5% dalam metanol, standar kuersetin (Sigma), AlCl3 2% dalam asam asetat 5%,
akuades, dan kapas.
Alat-alat yang digunakan adalah Spektronik-20, spektrometer FTIR Tensor 37 (Bruker), satu unit komputer TOSHIBA Mobile Intel Pentium III dengan spesifikasi:
prosesor : Intel Pentium III
memori : 128 MB
hardisk : 10 GB
sistem operasi : Microsoft Windows XP Professional
Perangkat lunak yang digunakan adalah OPUS versi 4.2, Microsoft Excel, dan The Unscrambler versi 9.5 (Camo Inc.).
Metode Penelitian
Penentuan Kadar Flavonoid (Depkes RI)
Sebanyak 10 g serbuk daun meniran kering dimaserasi menggunakan 60 mL etanol selama 6 jam di atas alat kocok kemudian disaring. Filtrat disimpan, sedangkan residu direfluks dalam 40 mL etanol selama 3 jam. Hasil refluks disaring dan filtratnya dipindahkan ke labu lain. Residu direfluks kembali dengan etanol. Filtrat hasil maserasi dan refluks digabungkan dan dipekatkan dengan evaporator putar sampai terbentuk ekstrak kental. Ekstrak kental di masukkan ke dalam oven untuk menghilangkan sisa etanol.
Ekstrak kering lalu ditimbang setara dengan 200 mg simplisia lalu dihidrolisis dengan 1.0 mL larutan 0.5% (b/v) heksametilenatetramina, 20.0 mL aseton, dan 2.0 mL larutan 25% HCl dalam air. Hidrolisis dilakukan dengan pemanasan sampai mendidih selama 30 menit. Campuran hasil hidrolisis disaring menggunakan kapas ke dalam labu takar 100 mL, kemudian residu hidrolisis ditambah 20 mL aseton untuk dididihkan kembali sebentar. Penambahan aseton dan pendidihan ini dilakukan sebanyak 2 kali. Filtrat lalu dikumpulkan ke dalam labu takar. Setelah labu ukur dingin, volume ditepatkan sampai tera dan dikocok sampai tercampur sempurna. Sebanyak 20 mL filtrat hasil hidrolisis dipindahkan ke dalam corong pisah, lalu ditambahkan 20 mL akuades. Ekstraksi kocok dilakukan dengan 15 mL etil asetat (satu kali) dan 10 mL etil asetat (dua kali). Fraksi etil asetat dikumpulkan ke dalam labu ukur 50.00 mL dan 25.00 mL, lalu ditera dengan etil asetat. Untuk replikasi spektrofotometri prosedur dilakukan 3 kali.
Analisis spektrofotometri diawali dengan memindahkan 10 mL larutan fraksi etil asetat ke dalam labu ukur 25 mL, kemudian ditambahkan 1 mL larutan 2 g AlCl3 dalam
100 mL larutan asam asetat glasial 5% (dalam metanol) . Larutan asam asetat glasial 5% v/v ditambahkan sampai tepat 25.00 mL. Sebagai standar digunakan larutan kuersetin murni dalam etil asetat dengan konsentrasi 3, 6, 12, 15, dan 24 ppm, lalu diukur pada ëmax 370.8
nm.
Spektroskopi FTIR
Sebanyak 0.5 mg sampel daun meniran yang telah dikeringkan dan dihaluskan dicampur dengan 180 mg KBr untuk dijadikan pelet. Pelet dibuat menggunakan hand press
Shimadzu dengan tekanan sebesar 8 ton selama 10 menit. Pengukuran spektrum dilakukan menggunakan spektrometer FTIR. Sebuah komputer personal yang dilengkapi dengan perangkat lunak OPUS digunakan untuk mengontrol kerja spektrometer pada kisaran daerah 4000–400 cm-1. Spektrum yang dihasilkan lalu disimpan dalam f ormat OPUS.
Spektrum IR dalam satuan transmitans diubah terlebih dahulu menjadi absorbans sebelum diberikan perlakuan prapemrosesan. Data spektrum lalu dinormalisasi min-max
sehingga absorbans terkecil diset menjadi bernilai 0, sedangkan absorbans tertinggi menjadi bernilai 2. Hasil normalisasi kemudian diberikan koreksi garis dasar untuk “hubungan
dalam” “hubungan luar”
T
membuat garis dasar spektrum berada pada absorbans 0, dilanjutkan dengan derivatisasi pertama spektrum dan penghalusan metode Savitsky Golay 13 titik.
Analisis Data Seca ra Kemometrik
Spektrum IR dalam format OPUS disimpan dalam format data point table (DPT) yang dapat dibuka dengan menggunakan program Microsoft Excel. Data absorbans dari spektrum IR dengan dan tanpa prapemrosesan kemudian dipotong pada bilangan gelombang 2499–2250 cm-1 untuk menghilangkan serapan CO2. Data kemudian dibagi menjadi
empat jenis, yaitu data absorbansi utuh, segmen I, segmen II, serta gabungan segmen I dan II. Segmentasi spektrum ini diperlihatkan pada Tabel 1.
Tabel 1 Segmentasi spektrum IR Kisaran bilangan gelombang
(cm-1) Spektrum utuh 3999–399
Segmen I 3730–2812
Segmen II 1890–399
Gabungan segmen I dan II 3730–2812 dan 1890–399
Analisis kemometrik dilakukan menggunakan set data dengan dan tanpa pember ian prapemrosesan. Selanjutnya set data dinamakan berdasarkan pada diberikan atau tidaknya perlakuan prapemrosesan dan segmentasi terhadap data. Penamaan ini dapat dilihat pada Tabel 2.
Tabel 2 Penamaan set data Set
data
Perlakuan Pembagian data
1 Spektrum utuh
2 Segmen I
3 Segmen II
4
tanpa prapemrosesan
Gabungan segmen I dan II
5 Spektrum utuh
6 Segmen I
7 Segmen II
8
dengan prapemrosesan
Gabungan segmen I dan II
Lampiran 1 menunjukkan bagan alir percobaan secara umum. Analisis kemometrik PCA dan PLS dari kadar flavonoid yang diperoleh dari metode referensi dan spektrum IR serbuk kering meniran dilakukan dengan menggunakan perangkat lunak The Unscrambler 9.5, tahapan -tahapan analisis dapat dilihat pada Lampiran 2.
PEMBAHASAN
Kadar Flavonoid Meniran
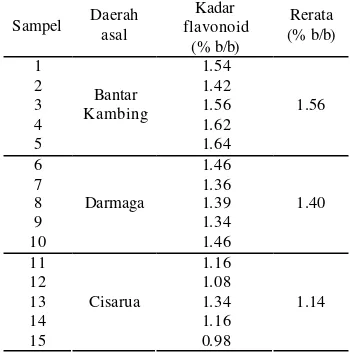
Tabel 3 menunjukkan kadar flavonoid total meniran dari daerah Bantar Kambing, Darmaga, dan Cisarua yang diukur menggunakan metode Depkes. Perhitungan lengkapnya dapat dilihat pada Lampiran 3. Uji-F menunjukkan bahwa hasil pengukuran kadar flavonoid total meniran dari ketiga daerah memiliki ketelitian yang tidak berbeda nyata (Lampiran 4), sedangkan hasil uji-t
menunjukkan nilai kadar flavonoid total yang berbeda nyata antara ketiga daerah asal sampel (Lampiran 5). Perbedaan kadar flavonoid yang terkandung dalam tanaman dapat disebabkan oleh perbedaan lingkungan tempat tumbuhnya tanaman tersebut. Perbedaan kondisi lingkungan dapat mempengaruhi konstituen kimia tanaman (Summanen 1999). Kadar flavonoid dan senyawa fenolik lain di dalam tanaman berbeda-beda di antara set iap ba gian, jaringan, dan umur tanaman, serta dipengaruhi oleh faktor-faktor lingkungan. Faktor -faktor ini adalah temperatur, sinar ultraviolet dan tampak, nutrisi, ketersediaan air, dan kadar CO2 pada atmosfer (Bohm 1987, diacu dalam
Estierte et al. 1999). Kadar air ketiga sampel meniran dapat dilihat pada Lampiran 6.
Tabel 3 Kadar flavonoid total meniran Sampel Daerah
asal
Kadar flavonoid
(% b/b)
Rerata (% b/b)
1 1.54
2 1.42
3 1.56 1.56
4 1.62
5
Bantar Kambing
1.64
6 1.46
7 1.36
8 1.39 1.40
9 1.34
10
Darmaga
1.46
11 1.16
12 1.08
13 1.34 1.14
14 1.16
15
Cisarua
0.98
Spektrum IR Meniran
serbuk kering meniran. Uji fitokimia yang dilakukan menunjukkan terkandungnya alkaloid, triterpenoid, steroid, dan tanin di dalam sampel. Vibrasi gugus-gugus dalam senyawa-senyawa ini turut memberikan pengaruh terhadap spektrum IR bersama dengan matriks sel tanaman tersebut.
Gugus-gugus dalam molekul kuersetin yang dapat memberikan serapan, antara lain C=C dan C-C aromatik, C-C, C-O, O-H, C=O, dan C-H. Pada Gambar 5a terlihat bahwa spektrum kuersetin terdapat serapan gugus O-H pada bilangan gelombang 3400– 3200 cm-1, gugus C=O keton pada 1725 –1705 cm- 1, gugus C=C aromatik pada 1600 dan 1475 cm-1, dan gugus C-O pada 1260–1000 cm- 1. Perbedaan antara spektrum kuersetin dan meniran yang tampak dengan jelas, antara lain pada bilangan gelombang 3699 dan 3622 cm- 1 dari spektrum meniran Cisarua yang merupakan serapan gugus O-H. Ketiga spektrum sampel meniran juga memiliki puncak serapan C-H yang tajam pada 2919 dan 2850 cm-1.
a
b Keterangan:
: meniran Bantar Kambing : meniran Darmaga : meniran Cisarua
Gambar 5 Perbandingan spektrum IR standar kuersetin (a) dengan sampel serbuk kering meniran (b).
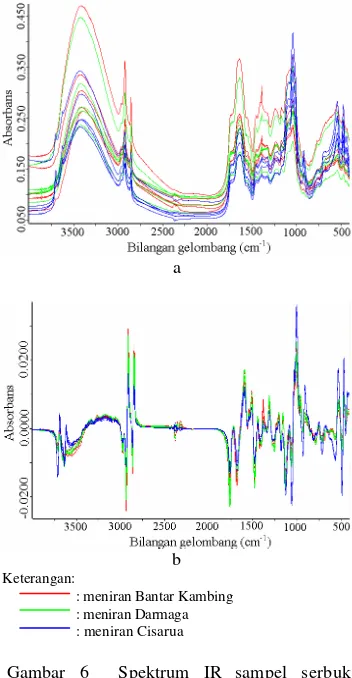
Gambar 6a menunjukkan spektrum IR sampel serbuk kering meniran dari tiga daerah berbeda, dengan ulangan pengukuran sebanyak lima kali untuk setiap daerah. Meniran-meniran ini memiliki pola absorbansi yang serupa satu sama lain, hanya berbeda pada nilai kuantitatif absorbansi dari masing-masing spektrum. Perbedaan spektrum IR dari masing-masing daerah tidak dapat terlihat dengan jelas. Gambar 6b menunjukkan spektrum setelah diberikan prapemrosesan. Terlihat bahwa kelimabelas spektrum menjadi lebih seragam. Teknik prapemrosesan ini dapat menghilangkan gangguan garis dasar spektrum dan mengurangi derau acak pada spektrum awal sehingga akan meningkatkan hasil analisis kemometrik (Naes et al. 2002). Derivatisasi akan menghilangkan pergeseran garis dasar dan tumpang tindih puncak sehingga informasi spektrum yang berguna untuk analisis selanjutnya akan meningkat (Stchur et al. 2002).
a
b Keterangan:
: meniran Bantar Kambing : meniran Darmaga : meniran Cisarua
Segmentasi spektrum IR dilakukan dengan membuang spektrum pada kisaran bilangan gelombang tertentu yang tidak menunjukkan serapan berarti. Menurut Vazquez et al.
(2000), penggunaan data spektrum pada kisaran tertentu akan meningkatkan hasil analisis kemometrik. Segmentasi dapat mengurangi wilayah spektrum IR yang mengandung banyak derau dan tidak memiliki informasi penting untuk analisis selanjutnya. Namun segmentasi juga dapat menurunkan hasil analisis karena sebagian informasi berharga juga mungkin turut terbuang (Zou et al. 2005). Oleh karena itu, pemilihan kisaran spektrum untuk segmentasi ini harus dilakukan dengan cermat. Segmentasi pada spektrum IR sampel serbuk kering meniran diperlihatkan pada Lampiran 7–14.
Klasifikasi Spektrum IR Serbuk Kering Meniran dengan PCA
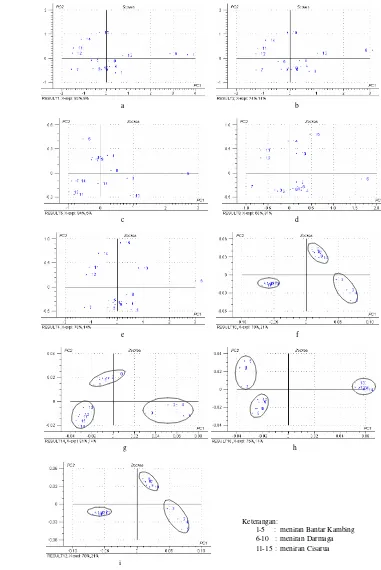
Teknik PCA dapat mengurangi dimensi dari data awal, yaitu dari ribuan dimensi (sebanyak jumlah bilangan gelombang spektrum IR) menjadi hanya dua dimensi. Proyeksi sampel terhadap dua variabel baru ini ditunjukkan pada score plot. Score plot
untuk dua P C pertama biasanya paling berguna dalam analisis karena kedua PC ini memiliki variansi terbanyak dalam data. Gambar 7 menunjukkan score plot dari kelimabelas spektrum IR sampel serbuk kering meniran dari tiga daerah berbeda. Plot ini memper lihatkan pola yang terdapat pada spektrum IR, semakin dekat satu titik dengan titik yang lain, maka semakin besar kemiripan di antara spektrum IR sampel tersebut. Pengelompokan diperoleh berdasarkan pada daerah asal sampel meniran.
Pengelompokan dari spektrum IR tanpa prapemrosesan ditunjukan pada Gambar 7a-e.
Score plot dari spektrum IR ini tidak menunjukkan pemisahan yang jelas antara ketiga kelompok sampel meniran. Gambar 7a memperlihatkan bahwa score plot dua PC pertama dari data spektrum IR tanpa segmentasi mampu menjelaskan 92% dari variansi total (PC1 = 83%, PC2 = 9%). Pola pengelompokan sampel tidak terlihat dengan jelas. Walaupun plot samp el meniran dari Cisarua telah terlihat berdekatan, sampel-sampel meniran Bantar Kambing dan Darmaga masih saling bercampur dan belum dapat terlihat pengelompokannya. Sampel nomor 1 terlihat sangat terpisah dari kelompoknya dan program Unscrambler mengidentifikasinya sebagai pencilan.
Pencilan ini dapat disebabkan oleh adanya galat pengukuran, sampel dari kategori lain, atau kesalahan instrumental (Stchur et al.
2002). Sampel nomor 1 kemudian dihilangkan dan tidak disertakan lagi dalam proses analisis selanjutnya.
Gambar 7b-e menunjukkan score plot dari data spektrum tanpa melalui tahap prapemrosesan dengan telah di hilangkannya pencilan. Terlihat bahwa data spektrum dengan segmen I (Gambar 7c) memberikan hasil pengelompokan yang terbaik di antara data yang lain, yaitu mampu menjelaskan 99% dari variansi total pada kedua PC pertamanya (PC1 = 94%, PC2 = 5%). Walaupun demikian, pengelompokan ini diperkirakan lebih dipengaruhi oleh kadar air yang terkandung pada masing-masing sampel. Segmen I ini melibatkan absorbans sampel pada bilangan gelombang 3730–2812 cm-1, dengan serapan gugus OH pada 3000–3700 cm-1. Score plot dari absorbans utuh (Gambar
7b) hanya mampu menjelaskan 88% variansi (PC1 = 74%, PC2 = 14%), segmen II (Gambar 7d) mampu menjelaskan 97% variansi (PC1 = 66%, PC2 = 31%), sedangkan gabungan segmen I dan II (Gambar 7e) mampu memberikan pengelompokan dengan menjelaskan 90% variansi (PC1 = 76%, PC2 = 14%).
Gambar 7f-i memperlihatkan pengaruh pemberian perlakuan prapemrosesan spektrum IR terhadap pengelompokan sampel. Pengelompokan dapat terlihat jelas dari saling berdekatannya sampel-sampel yang berasal dari satu daerah. Dua PC pertama pada score plot dari data spektrum utuh mampu menjelaskan 91% dari variansi total (PC1 = 70%, PC2 = 21%), sedangkan score plot dari data segmen I, II, serta gabungan segmen I dan II bertur ut-turut menjelaskan variansi sebesar 95% (PC1 = 81%, PC2 = 14%), 89% (PC1 = 75%, PC2 = 14%), dan 91 % (PC1 = 70%, PC2 = 21%).
a b
c d
e f
g h
i
Gambar 7 Score plot dua PC pertama dari spektrum IR serbuk kering meniran: a. utuh tanpa prap emrosesan dengan pencilan, b. utuh tanpa prapemrosesan, c. segmen I tanpa prapemrosesan, d. segmen II tanpa prapemrosesan, e. gabungan segmen I dan II tanpa prapemrosesan, f. utuh dengan prapemrosesan, g. segmen I dengan prapemrosesan, h. segmen II dengan prapemrosesan, i. gabungan segmen I dan II dengan prapemrosesan.
Keterangan:
Pembentukan Model Prediksi Kadar Flavonoid Meniran dengan PLS
Metode PLS digunakan untuk menghubungkan spektrum IR serbuk kering meniran terhadap konsentrasi flavonoid total yang diperoleh dari pengukuran dengan metode Depkes. Model kalibrasi dibentuk dari nilai absorbansi sebagai variabel x (prediktor) dan nilai konsentrasi flavonoid total sebagai variabel y (respons).
Kemampuan prediksi model dapat dilihat dari beberapa parameter ter utama nilai korelasi dan root mean square error prediction (RMSEP ) model tersebut. Model prediksi yang baik memiliki nilai korelasi antara nilai y prediksi dan nilai y referensi yang tinggi dan RMSEP yang rendah (Naes et al. 2002). Selain korelasi dan RMSEP, nilai
error standar model juga harus diperhatikan.
Error validasi (prediksi) yang jauh lebih besar daripada error kalibrasi menandakan terjadinya overfitting pada model. Model tersebut melibatkan terlalu banyak komponen sehingga variansi yang dimilikiny a akan menjadi terlalu besar. Hal ini menurunkan kemampuan prediksi model. Oleh karena itu, dalam memilih model terbaik, kedekatan nilai korelasidan error antara validasi dan kalibrasi juga perlu diperhatikan (Baranska et al. 2004).
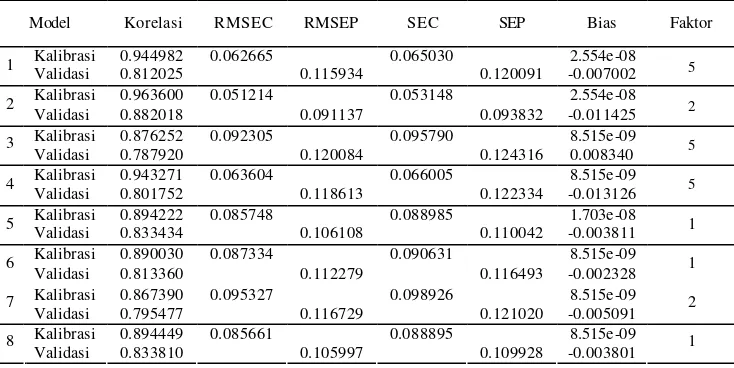
Hasil statistik kedelapan model yang diperoleh dengan metode PLS ditunjukkan pada Tabel 4. Korelasi validasi terbesar dimiliki oleh model 2, yaitu sebesar 0.882018. Model ini juga memiliki nilai RMSEP terendah, yaitu 0.091137. Nilai error standar model ini sebesar 0.053148 untuk SEC (standard error of calibration) dan 0.093832 untuk SEP (standard error of prediction).
Walaupun demikian, model 2 tidak dipilih sebagai model prediksi terbaik karena model ini berasal dari data absorbans pada kisaran bilangan gelombang 3730–2812 cm-1 yang meliputi daerah serapan gugus OH sehingga dikhawatirkan model prediksi akan lebih dipengaruhi oleh kadar air sampel.
Model 5 dan 8 memiliki kemampuan prediksi yang hampir sama, hal ini dapat dilihat dari parameter-parameter prediksi seperti korelas i, RMSEP, RMSEC, SEC, SEP, dan bias yang bernilai tak jauh berbeda antara kedua model. Kedua model ini memiliki kemampuan prediksi yang terbaik di antara model -model lain. Model 5 memiliki nilai korelasi validasi dan kalibrasi sebesar 0.894222 dan 0.833434. Nilai ini tidak jauh berbeda dengan model 8, yaitu sebesar 0.894449 dan 0.833810. Kedua model juga memiliki perbedaan nilai korelasi validasi dan kalibrasi yang paling kecil dibandingkan dengan kedelapan model lainnya. Nilai SEC dan SEP juga tidak jauh berbeda, yaitu 0.88985 dan 0.110042 untuk model 5 dan 0.88895 dan 0.109928 untuk model 8. Selain itu, kedua model ini juga memiliki nilai RMSEP terendah, yaitu 0.106108 dan 0.105997.
Secara keseluruhan, model 8 memiliki kemampuan prediksi yang sedikit lebih baik dibandingkan dengan model 5. Hal ini disebabkan oleh adanya pemotongan variabel prediktor (x) pada model 8. Model 5 berasal dari data spektrum IR utuh, sedangkan model 8 berasal dari data spektrum IR gabungan segmen I dan II. Hal ini menunjukkan bahwa pemotongan variabel prediktor yang tidak memberikan informasi berarti dapat meningkatkan kemampuan prediksi model.
Tabel 4 Hasil statistik model prediksi kadar flavonoid total meniran dengan metode PLS Model Korelasi RMSEC RMSEP SEC SEP Bias Faktor
Kalibrasi 0.944982 0.062665 0.065030 2.554e-08 1
Validasi 0.812025 0.115934 0.120091 -0.007002 5 Kalibrasi 0.963600 0.051214 0.053148 2.554e-08 2
Validasi 0.882018 0.091137 0.093832 -0.011425 2 Kalibrasi 0.876252 0.092305 0.095790 8.515e-09 3
Validasi 0.787920 0.120084 0.124316 0.008340 5 Kalibrasi 0.943271 0.063604 0.066005 8.515e-09 4
Validasi 0.801752 0.118613 0.122334 -0.013126 5 Kalibrasi 0.894222 0.085748 0.088985 1.703e-08 5 Validasi 0.833434 0.106108 0.110042 -0.003811 1
Kalibrasi 0.890030 0.087334 0.090631 8.515e-09 6
Validasi 0.813360 0.112279 0.116493 -0.002328 1 Kalibrasi 0.867390 0.095327 0.098926 8.515e-09 7
Validasi 0.795477 0.116729 0.121020 -0.005091 2 Kalibrasi 0.894449 0.085661 0.088895 8.515e-09 8
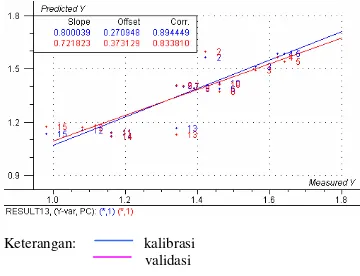
Gambar 8 menunjukkan scatter plot antara kadar flavonoid total meniran yang diprediksi oleh model 8 dengan kadar flavonoid total sebenarnya yang diperoleh dari metode referensi. Plot ini dapat memperlihatkan seberapa baik model regresi yang dihasilkan. Model yang baik memiliki nilai korelasi yang tinggi dan menghasilkan titik-titik yang berdekatan sepanjang garis lurus dengan nilai slope mendekati 1 (sudut 45°). Kedekatan nilai kalibrasi dan validasi juga menunjukkan kebaikan dari model prediksi yang dibentuk. Scatter plot dari kedelapan model dapat dilihat pada Lampiran 15 dan 16.
Keterangan: kalibrasi validasi
Gambar 8 Scatter plot dua dime nsi antara kadar flavonoid prediksi dan kadar flavonoid sebenarnya dari model 8.
SIMPULAN DAN SARAN
Simpulan
Sampel meniran dari daerah uji Bantar Kambing, Darmaga, dan Cisarua memiliki kadar flavonoid total yang berbeda. Teknik PCA mampu menunjukkan pengelompokan spektrum IR dari ketiga jenis sampel meniran ini. Pengelompokan terbaik dihasilkan dari set data ke-5 dan ke-8, yaitu data dengan prapemrosesan spektrum IR utuh dan spektrum IR gabungan segmen I dan II. Model prediksi kadar flavonoid meniran dapat dibentuk dengan teknik PLS. Kemampuan prediksi terbaik dimiliki oleh model 8 (r
kalibrasi = 0.894449, r validasi = 0.833810, RMSEC = 0.085661, RMSEP = 0.105997, SEC = 0.88895, SEP = 0.109928, bias kal ibrasi = 8.515e-09, dan bias validasi = -0.003801). Teknik spektroskopi IR yang digabungkan dengan kemometrik mampu
digunakan sebagai metode cepat penentuan flavonoid total meniran dari ketiga daerah uji.
Saran
Jumlah ulangan pengukuran perlu diperbesar agar lebih sebanding dengan banyaknya variabel pengukuran. Pembuatan model prediksi dapat pula menggunakan metode ANN dan dibandingkan hasilnya dengan model dari metode PLS. Setelah model prediksi terbentuk sebaiknya dilanjutkan dengan tahapan validasi. Pembuatan model prediksi juga dapat dilakukan dengan menggunakan nilai respons kadar flavonoid yang dihasilkan dari metode KCKT atau metode lain yang diakui secara internasional.
DAFTAR PUSTAKA
Achyad DE, Rasyidah R. 2000. Meniran (Phyllantus Urinaria Linn.). [terhubung berkala]. http://www.asiamaya.com/jamu/ isi/meniran_phyllanthusurinaria.htm [22 April 2005].
Amiæ D, Dušanka DA, Bešlo D, Trinasjtiæ. 2003. Structure-radical scavenging activity relationships of flavonoids . Croatia Chem Acta 76:55 -61.
Baranska M et al. 2005. Quality control of
Harpagophytum procumbens and its related phytopharmaceutical products by means of NIR-FT-Raman spectroscopy.
Biopolymers 77:1 –8.
Brereton RG. 2000. Introduction to multivariate calibration in analytical chemistry. Analyst 125:2125 –2154.
Campos AH, Schor N. 1999. Phyllantus niruri
inhibits calcium oxalate endocytosis by renal tubular cells: its role in urolithiasis
Nephron 81:393–397.
Chairul. 1999. Tempuyung untuk mengh adang asam urat. [terhubung berkala]. http://www.indomedia.com/ intisari/1999/juni/tempuyung.htm [22 April 2005].
Chang CC, Yang MH, Wen HM, Chern JC. 2002. Estimation of total flavonoid content in propolis by two complementary colorimetric methods. J Food Drug Anal
Chew OS, Hamdan MR, Ismail Z, Ahmad MN. 2004. Assessment of herbal medicines by chemometrics – assisted interpretation of FTIR spectra. J Anal Chim Acta, in press.
Christian GD. 1986. Analytical Chemistry. Ed ke-4. New York: J Wiley.
[Depkes RI] Departemen Kesehatan Republik Indonesia. Direktorat Pengawasan Obat Tradisional. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Depkes RI.
Dieterle F. 2003. Multianalyte quantif icat ions by means of integration of artificial neural networks, genetic algorithms and chemometrics for time-resolved analytical data. http://www.frank-dieterle.de/phd/ 6_ 1.html. [28 April2005].
Estierte M et al. 1999. Free-air CO2
enrichment of wheat: leaf flavonoid concentration throughout the growth cycle.
Physiologia Plantarium 105:423 –433.
George B, McIntyre P. 1987. Infrared Spectroscopy. London: J Wiley.
Harborne JB. 1987. Metode Fitok imia. Padmawinata K dan Soediro I, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Phytochemical Methods.
Herve A. 2003. Partial least square (regression). http:// www.utdallas.edu/ ~herve /Abdi -PLS-pretty.pdf. [28 April 2005].
Jajang. 2004. Penerapan analisis artificial neural networks (ANN) dalam pengelompokan ekstrak daun jati belanda (Guazuma ulmifolia Lamk.) [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Lohninger H. 2004. Multivariate calibration. [terhubung berkala]. http://www.vias.org/ tmdatanaleng /cc_multivarcal. html [28 Maret 2005].
Marchart E, Krenn L, Kopp B. 2003. Quantification of the flavonoid glycosides in Passiflora incarnata by capillary electrophoresis. Planta Med 69:452–456.
Merken HM , Beecher GR. 2000. Liquid chromatographic method for the separation and quantification of prominent flavonoid aglycones. J Chromatogr A
897:177–184.
Miller AL. 1996. Antioxidant flavonoids: structure, function, and clinical usage. Alt Med Rev 1:103-111.
Miller JC, Miller JN. 2000. Statistic and Chemometrics for Analytical Chemistry. Ed ke-4. Harlow: Pearson Education.
Naes T, Isaksson T, Fearn T, Davies T . 2002.
A User -Friendly Guide to Multivariate Calibration and Classification. Chichester: NIR Publications.
Naik AD, Juvekar AR. 2003. Effect of alkaloidal extract of Phyllantus niruri on HIV replication. Indian J Med Sci 57:387– 393.
Nur MA, Adijuwana H. 1989. Teknik Spektroskopi dalam Analisis Biologi. Bogor: PAU Ilmu Hayat, IPB.
Rajeshkumar NV et al. 2002. Antitumour and anticarcinogenic activity of Phyllantus amarus extract. J Ethnopharmacol 81:17– 22.
Robinson T. 1995. Kandungan Organik Tumbuha n Tinggi. Ed ke-6. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari : The Organic Constituent of Higher Plants.
Santos AR et al. 1994. Analgesic effects of callus culture extract s from selected species of Phyllantus in mice. J Pharm Pharm acol 49:755–759.
Schulz H, Drews HH, Quilitszsh R, Kruger H. 1998. Application of near infrared spectroscopy for the quantification of quality parameters in selected vegetables and essent ial oil plants. J Near Infrared Spectrosc 6:A125–A130.
Schulz H, Drews HH, Kruger H. 1999. Rapid NIRS determination of quality parameters in leaves and isolated essential oils of
Shao X, Zhuang Y. 2004. Determination of chlorogenic acid in plant samples by using near-infrared spectrum wit h wavelet transform preprocessing. Anal Sci 20:451– 454.
Skoog DA, Holler FJ, Nieman TA. 1998.
Principles of Instrumental Analysis. Ed ke-5. Philadelphia: Harcourt Brace.
Soedibyo M. 1998. Alam Sumber Kesehatan, Manfaat, dan Kegunaan. Jakarta: Balai Pustaka.
Srividya N, Periwal S. 1995. Diuretic, hypotensive, and hypoglycaemic effect of
Phyllantus amarus. Indian J Exp Biol
33:861 –864.
Stchur P, Cleveland D, Zhou J, Michel RG. 2002. A review of recent applications of near infrared spectroscopy, and the characteristics of a novel PbS CCD array -based near infrared spectrometer. Appl Spect Rev 37:383–428.
Subarnas A, Sidik. 1993. Phyllantus niruri
Linn., kimia, farmakologi, dan penggunaannya sebagai obat tradisional.
Warta Tumbuhan Obat Indonesia 2:13–15.
Summanen JA. 1999. A chemical and ethnopharmalogical study on Phyllantus emblica (Euphorbiaceae) [disertasi]. Helsinki: Faculty of Science, University of Helsinki.
Syamasundar KV, Singh B, Thakur RS, Husain A, Kiso Y. 1985. Antihepatotoxic principles of P. niruri herbs. J Ethnopharmacol 14:41–44.
Taylor L. 2003. Technical data report for chanca piedra “stone breaker” (Phyllantus niruri). [terhubung berkala]. http://www. rain-tree.com/chanca-techreport.pdf [14 Febuari 2006].
Tona L et al. 2001. In-vivo antimalarial activity of Cassia occidentalis, Morinda morindoides, and Phyllantus niruri. Ann Trop Med Parasitol 95:45–57.
[USDA] United States Department of Agriculture. 2005. Plant profile for
Phyllanthus debilis (niruri). [terhubung berkala]. http://www.plants.usda.gov/cgi_
bin/plant_profile.cgi?sy mbol=PHDE4 [15 Mei 2005].
Vazquez PP, Galera M , Frenich AG, Vidal JM. 2000. Comparison of calibration methods with and without feature selection for the analysis of HPLC data. Anal Sci
16:49 –55.
14
Lampiran 1 Bagan alir percobaan
Sampel
meniran
Metode Referensi
(Depkes 2000)
Konsentrasi
flavonoid
Variabel
y
(respons
)
Pengukuran FTIR
Absorbans
Variabel
x
(prediktor)
15
Lampiran 2 Pengolahan data dalam analisis kemometrik dengan program Unscrambler
1.
Buka program Unscrambler
2.
Klik
File
, pilih
New
Format
: pilih
Plain 2- D data table
Size
:
Variables
: jumlah variabel
y
(15)
Samples
: jumlah variabel
x
(sejumlah bilangan gelombang spektrum IR)
16
5.
Klik
Task
, pilih PCA
6.
Pada
variable
set klik
Define,
kemudian
Add
7. Ketik nama, pilih
data type: Spectra
, masukkan nomor kolom variabel
x
pada bagian
interval, pilih
All variables
, lalu klik
OK
17
9. Pada tampilan PCA klik
OK,
tunggu hingga analisis selesai, lalu klik
View
10. Klik
file
, pilih
save result
18
12. Hasil yang diperoleh kemudian disimpan
13. Pada analisis menggunakan PLS, tampilan dikembalikan ke dalam bentuk data awal.
Kemudian klik
Task
, pilih
Regression
.
14. Pada method dipilih PLS 1, masukkan set variabel
x
dan variabel
y
.
15. Pilih
Cross Validation
pada
Validation Method
, lalu klik
OK
19
17. Untuk menampilkan parameter -parameter statistik, klik kanan pada plot keempat,
lalu pilih
View
,
Source
, dan
Calibration
atau
Validation
20
Lampiran 3 Hasil pengukuran kadar flavonoid total meniran dengan metode Depkes RI
Hasil Pengukuran ke -1
•
Perhitungan rendemen
Sampel Bobot sampel (g) Bobot ekstrak (g)
Rendemen (%)
Bobot ekstrak untuk hidrolisis (g)
A3 10.0030 1.5653 15.65 0.0315
B5 10.0045 1.8377 18.37 0.0368
C2 10.0045 1.5803 15.80 0.0320
Contoh perhitungan:
100%
sampel
bobot
ekstrak
bobot
Rendemen
=
×
100% g 0030 . 10 g 1.5653 × =
=
15.65%
•
Pengukuran Spektrofotometri
Pembuatan kurva standar
Konsentrasi (ppm) %T A
0 100.0 0.0000
3 73.6 0.1331
6 54.6 0.2628
12 29.6 0.5287
15 21.8 0.6615
24 9.0 1.0458
Pengukuran sampel
Sampel Ulanganpengocokan
Ulangan pemipetan
%T Absorbans Konsentrasi (ppm)
Rataan (ppm)
Konsentrasi (% b/b)
1 71.4 0.1463 3.3050
2 71.2 0.1475 3.3326
1
3 71.2 0.1475 3.3326
3.3234 1.55
1 71.4 0.1463 3.3050
2 71.0 0.1487 3.3601
A3
2
3 71.0 0.1487 3.3601
3.3417 1.56
1 72.8 0.1379 3.1124
2 73.0 0.1367 3.0849
1
3 73.2 0.1355 3.0573
3.0849 1.44
1 72.4 0.1403 3.1674
2 72.8 0.1379 3.1124
B5
2
3 72.6 0.1391 3.1399
3.1399 1.47
1 78.6 0.1046 2.3486
2 78.6 0.1046 2.3486
1
3 79.0 0.1024 2.2982
2.3318 1.08
1 78.4 0.1057 2.3739
2 78.8 0.1035 2.3234
C2
2
3 78.8 0.1035 2.3234
2.3402 1.08
Persamaan garis:
21
Contoh perhitungan:
100% (mg) ekstrak bobot 100 rendemen mL 20 mL 100 mL 10 mL 75 mL 25 mL 1000 L 1 Kadar(ppm) b) [flav](%b/ × × × × × × × = 100% mg 10 0.0315 100 15.65 mL 20 mL 100 mL 10 mL 75 mL 25 mL 1000 L 1 L mg 3234 .3 3 ×
× × × × × × × = = 1.55%
Hasil Pengukuran ke -2
•
Perhitungan rendemen
Sampel Bobot sampel (g) Bobot ekstrak (g)
Rendemen (%)
Bobot ekstrak untuk hidrolisis (g)
A5 10.0026 1.6705 16.70 0.0334
B1 10.0004 2.0944 20.94 0.0419
C3 10.0013 1.8512 18.51 0.0370
•
Pengukuran Spektrofotometri
Pembuatan kurva standar
Konsentrasi (ppm) %T A
0 100.0 0.0000
3 76.6 0.1158
6 58.4 0.2336
12 33.6 0.4737
15 25.0 0.6021
24 9.6 1.0177
Pengukuran sampel
Sampel Ulanganpengocokan
Ulangan pemipetan
%T Absorbans Konsentrasi (ppm)
Rataan (ppm)
Konsentrasi (% b/b)
1 73.4 0.1343 3.5355
2 73.4 0.1343 3.5355
1
3 73.6 0.1331 3.5071
3.5260 1.65
1 74.0 0.1308 3.4526
2 73.6 0.1331 3.5071
A5
2
3 73.4 0.1343 3.5355
3.4984 1.64
1 75.6 0.1215 3.2322
2 76.2 0.1180 3.1493
1
3 76.2 0.1180 3.1493
3.1769 1.49
1 76.6 0.1158 3.0972
2 77.0 0.1135 3.0426
B1
2
3 76.6 0.1158 3.0972
3.0790 1.44
1 78.4 01057 2.8578
2 78.6 0.1046 2.8318
1
3 78.4 0.1057 2.8578
2.8491 1.34
1 78.4 0.1057 2.8578
2 78.6 0.1046 2.8318
C3
2
3 78.8 0.1035 2.8057
2.8318 1.33
Persamaan garis:
22
Hasil Pengukuran ke -3
•
Perhitungan rendemen
Sampel Bobot sampel (g) Bobot ekstrak (g)
Rendemen (%)
Bobot ekstrak untuk hidrolisis (g)
A2 10.0047 1.4376 14.37 0.0286
B2 10.0048 1.7024 17.02 0.0338
C4 10.0043 1.5882 15.88 0.0324
•
Pengukuran Spektrofotometri
Pembuatan kurva standar
Konsentrasi (ppm) %T A
0 100.0 0.0000
3 74.8 0.1261
6 56.4 0.2487
12 31.6 0.5003
15 23.6 0.6271
24 10.0 1.0000
Pengukuran sampel
Sampel Ulanganpengocokan
Ulangan pemipetan
%T Absorbans Konsentrasi (ppm)
Rataan (ppm)
Konsentrasi (% b/b)
1 74.8 0.1343 3.0216
2 75.0 0.1343 2.9928
1
3 74.8 0.1331 3.0216
3.0120 1.42
1 75.2 0.1308 2.9664
2 74.4 0.1331 3.0767
A2
2
3 74.8 0.1343 3.0216
3.0216 1.42
1 75.8 0.1215 2.8825
2 76.2 0.1180 2.8827
1
3 75.8 0.1180 2.8825
2.8826 1.36
1 76.0 0.1158 2.8561
2 75.6 0.1135 2.9113
B2
2
3 75.6 0.1158 2.9113
2.8929 1.36
1 78.4 01057 2.5324
2 78.8 0.1046 2.4796
1
3 78.4 0.1057 2.5324
2.5148 1.16
1 78.8 0.1057 2.4796
2 78.4 0.1046 2.5324
C4
2
3 78.4 0.1035 2.5324
2.5148 1.16
Persamaan garis:
23
Hasil Pengukuran ke -4
•
Perhitungan rendemen
Sampel Bobot sampel (g) Bobot ekstrak (g)
Rendemen (%)
Bobot ekstrak untuk hidrolisis (g)
A1 10.0009 1.5888 15.89 0.0315
B3 10.0018 1.5937 15.93 0.0318
C5 10.0015 1.4781 14.78 0.0303
•
Pengukuran Spektrofotometri
Pembuatan kurva standar
Konsentrasi (ppm) %T A
0 100.0 0.0000
3 76.4 0.1169
6 59.0 0.2291
12 34.6 0.4609
15 26.4 0.5784
24 11.4 0.9431
Pengukuran sampel
Sampel Ulanganpengocokan
Ulangan pemipetan
%T Absorbans Konsentrasi (ppm)
Rataan (ppm)
Konsentrasi (% b/b)
1 75.0 0.1249 3.2832
2 75.0 0.1249 3.2832
1
3 75.2 0.1238 3.2551
3.2738 1.55
1 75.2 0.1238 3.2551
2 75.0 0.1249 3.2832
A1
2
3 75.2 0.1238 3.2551
3.2645 1.54
1 77.0 0.1135 2.9923
2 77.2 0.1124 2.9643
1
3 77.2 0.1124 2.9643
2.9736 1.40
1 77.4 0.1112 2.9337
2 77.2 0.1124 2.9643
B3
2
3 77.4 0.1112 2.9337
2.9439 1.38
1 83.2 0.0799 2.1352
2 83.0 0.0809 2.1607
1
3 83.2 0.0799 2.1352
2.1437 0.98
1 83.0 0.0809 2.1607
2 82.8 0.0820 2.1888
C5
2
3 83.0 0.0809 2.1607
2.1701 0.99
Persamaan garis:
24
Hasil Pengukuran ke -5
•
Perhitungan rendemen
Sampel Bobot sampel (g) Bobot ekstrak (g)
Rendemen (%)
Bobot ekstrak untuk hidrolisis (g)
A4 10.0024 1.4808 14.80 0.0305
B4 10.0008 1.7588 17.59 0.0362
C1 10.0006 1.5505 15.50 0.0319
•
Pengukuran Spektrofotometri
Pembuatan kurva standar
Konsentrasi (ppm) %T A
0 100.0 0.0000
3 75.4 0.1226
6 57.2 0.2426
12 33.2 0.4789
15 25.0 0.6020
24 10.8 0.9666
Pengukuran sampel
Sampel Ulanganpengocokan
Ulangan pemipetan
%T Absorbans Konsentrasi (ppm)
Rataan (ppm)
Konsentrasi (% b/b)
1 72.0 0.1427 3.5423
2 72.0 0.1427 3.5423
1
3 71.8 0.1439 3.5721
3.5522 1.62
1 71.8 0.1439 3.5721
2 71.6 0.1451 3.6020
A4
2
3 72.0 0.1427 3.5423
3.5721 1.62
1 76.0 0.1192 2.9577
2 75.4 0.1226 3.0432
1
3 76.0 0.1192 2.9577
2.9859 1.36
1 76.2 0.1180 2.9279
2 76.4 0.1169 2.9005
B4
2
3 76.2 0.1180 2.9279
2.9188 1.33
1 78.6 0.1046 2.5945
2 79.0 0.1024 2.5398
1
3 78.8 0.1035 2.5672
2.5672 1.17
1 79.0 0.1024 2.5398
2 79.0 0.1024 2.5398
C1
2
3 79.0 0.1024 2.5398
2.5398 1.16
Persamaan garis:
25
Lampiran 4 Uji-
F
kadar flavonoid total meniran
§
Daerah Bantar Kambing dan Darmaga
Bantar Kambing
Darmaga
Rerata
1.556
1.402
Ragam
0.00748
0.00312
Jumlah pengamatan
5
5
Derajat bebas
4
4
F
F
4,4(
P
= 0.05)
2.397435897
9.605
F
hitung<
F
tabelvariansi kedua hasil pengukuran tidak berbeda nyata
§
Daerah Cisarua dan Bantar Kambing
Cisarua
Bantar Kambing
Rerata
1.144
1.556
Ragam
0.01748
0.00748
Jumlah pengamatan
5
5
Derajat bebas
4
4
F
F
4,4(
P
= 0.05)
2.336898396
9.605
F
hitung<
F
tabelvariansi kedua hasil pengukuran tidak berbeda nyata
§
Daerah Cisarua dan Darmaga
Cisarua
Darmaga
Rerata
1.144
1.402
Ragam
0.01748
0.00312
Jumlah pengamatan
5
5
Derajat bebas
4
4
F
F
4,4(P = 0.05)
5.602564103
9.605
26
Lampiran 5 Uji-
t
kadar flavonoid total meniran
§
Daerah Bantar Kambing dan Darmaga
Bantar Kambing
Darmaga
Rerata
1.556
1.402
Ragam
0.00748
0.00312
Jumlah pengamatan
5
5
Pooled Variance
0.0053
Hipotesis perbedaan rerata
0
Derajat bebas
8
t
Stat
3.344666269
t
4(
P
= 0.05)
2.306004133
t
hitung>
t
tabelKadar flavonoid meniran dari kedua daerah berbeda nyata
§
Daerah Bantar Kambing dan Cisarua
Bantar Kambing
Cisarua
Rerata
1.556
1.144
Ragam
0.00748
0.01748
Jumlah pengamatan
5
5
Pooled Variance
0.01248
Hipotesis perbedaan rerata
0
Derajat bebas
8
t
Stat
5.831226726
t
4(
P
= 0.05)
2.306004133
t
hitung>
t
tabelKadar flavonoid meniran dari kedua daerah berbeda nyata
§
Daerah Darmaga dan Cisarua
Darmaga
Cisarua
Rerata
1.402
1.144
Ragam
0.00312
0.01748
Jumlah pengamatan
5
5
Pooled Variance
0.0103
Hipotesis perbedaan rerata
0
Derajat bebas
8
t
Stat
4.019491346
t
4(
P
= 0.05)
2.306004133
27
Lampiran 6 Hasil pengukuran kadar air
Bobot cawan + sampel (g)
Sampel
Ulangan
Bobot
sampel (g)
awal
akhir
Kadar air
(%)
Rerata
(%)
1
3.0037
6.8501
6.6128
7.90
2
3.0083
6.7963
6.5559
7.99
A
3
3.0002
6.7962
6.5538
8.08
7.99
1
3.0003
6.6885
6.4970
6.38
2
3.0019
6.7117
6.5182
6.44
B
3
3.0021
6.7884
6.5886
6.66
6.49
1
3.0042
6.8480
6.6440
6.79
2
3.0025
6.7870
6.5848
6.73
C
3
3.0027
6.7927
6.5844
6.94
6.82
Contoh perhitungan:
100%
sampel
bobot
sampel)
bobot
cawan
(bobot
-sampel)
bobot
cawan
(bobot
air
Kadar
=
+
awal+
akhir×
100%
g
3.0037
g
6.6128
-g
6.8501
×
=
28
Lampiran 7 Spektrum IR utuh dari sampel serbuk kering meniran tanpa prepemrosesan
spektrum
Lampiran 8 Spektrum IR segmen I dari sampel serbuk kering meniran tanpa
prepemrosesan spektrum
: meniran Bantar Kambing : meniran Darmaga : meniran Cisarua
29
Lampiran 9 Spektrum IR segmen II dari sampel serbuk kering meniran tanpa
prepemrosesan spektrum
Lampiran 10 Spektrum IR gabungan segmen I dan II dari sampel serbuk kering meniran
tanpa prepemrosesan spektrum
: meniran Bantar Kambing : meniran Darmaga : meniran Cisarua
30
Lampiran 11 Spektrum IR utuh dari sampel serbuk kering meniran dengan
prepemrosesan
Lampiran 12 Spektrum IR segmen I dari sampel serbuk kering meniran dengan
prepemrosesan
: meniran Bantar Kambing : meniran Darmaga : meniran Cisarua
31
Lampiran 13 Spektrum IR segmen II dari sampel serbuk kering meniran dengan
prepemrosesan
Lampiran 14 Spektrum IR gabungan segmen I dan II dari sampel serbuk kering meniran
dengan prepemrosesan
: meniran Bantar Kambing : meniran Darmaga : meniran Cisarua
32
32
Lampiran 15
Scatter plot
dari spektrum IR tanpa prapemrosesan: a. spektrum utuh, b. segmen I, c. segmen II, d. gabungan segmen I dan II
a b
33
32
Lampiran 16
Scatter plot
dari spektrum IR dengan prapemrosesan: a. spektrum utuh, b.segmen I, c. segmen II, d. gabungan segmen I dan II
a b
c d