DINAMIKA INTERAKSI PROTEIN HORMON GLP-1 DAN
ANALOGNYA (
Exenatide
dan
Liraglutide
) TERHADAP
PROTEIN MEMBRAN GLP-1R
ALFI AFIFAH
PROGRAM STUDI BIOFISIKA SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
DINAMIKA INTERAKSI PROTEIN HORMON GLP-1 DAN
ANALOGNYA (
Exenatide
dan
Liraglutide
) TERHADAP
PROTEIN MEMBRAN GLP-1R
ALFI AFIFAH
PROGRAM STUDI BIOFISIKA SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Tesis
PERNYATAAN MENGENAI THESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa thesis berjudul Dinamika Interaksi Protein Hormon GLP-1 dan Analognya (Exenatide dan Liraglutide) Terhadap
Protein Membran GLP-1R adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir thesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
Alfi Afifah
RINGKASAN
ALFI AFIFAH. Dinamika Protein Hormon GLP-1 dan Analognya (Exenatide dan Liraglutide) Terhadap Protein Membran GLP-1R. Dibimbing oleh TONY
SUMARYADA dan LAKSMI AMBARSARI.
Penelitian pengobatan penyakit diabetes melitus tipe II ditujukan untuk mengembangkan analog dari hormon GLP-1 yang berfungsi untuk mengatur sekresi insulin. Exenatide dan liraglutide adalah analog GLP-1 yang sudah teruji
secara klinis dan diproduksi secara komersil. Tujuan utama dari penelitian ini adalah untuk mengidentifikasi asam amino yang berperan dalam interaksi antara GLP-1, exenatide, dan liraglutide dengan protein membran GLP-1R, serta
menganalisa kestabilan interaksi masing-masing pasangan. Hasil dari penelitian ini dapat digunakan untuk mengembangkan analog GLP-1 yang lebih baik.
Penelitian dilakukan dalam dua tahap. Pada tahap pertama, molekul GLP-1, exenatide dan liraglutide ditambatkankan dengan N-terminal domain dari
GLP-1R. Setiap proses penambatan menghasilkan 10 formasi penambatan dalam bentuk file .pdb. Kesepuluh hasil penambatan ini kemudian dianalisa untuk mengidentifikasi binding site dan asam amino yang aktif berinteraksi. Analisa ini
digunakan untuk memilih satu formasi penambatan yang memiliki pasangan asam amino aktif terbanyak. Formasi penambatan yang terpilih kemudian diproses dalam simulasi dinamika molekul selama 20 ns pada suhu fisiologis 310 K. Setelah simulasi dinamika molekul selama 20 ns, diidentifikasi bahwa binding site GLP-1R berada pada struktur beta-sheet yang terlatak pada asam amino F80 sampai asam amino E125. Formasi penambatan GLP-1 dengan GLP-1R relatif stabil, sementara pasangan penambatan GLP-1R dan exenatide serta GLP-1R dan liraglutide terbelah
selama trajectory.
Analisa terhadap energi interaksi non ikatan dari masing-masing pasangan menunjukkan bahwa interaksi antara exenatide dan GLP-1R adalah yang terkuat
dibandingkan pasangan lainnya. Evaluasi lebih lanjut terhadap energi interaksi non-ikatan dari pasangan asam amino menunjukkan bahwa interaksi polar antara S39 and K113 menjadi penguat interaksi protein hormon dan reseptornya.
SUMMARY
ALFI AFIFAH. Interaction Dynamics of Protein GLP-1 and Its Analogs (Exenatide
and Liraglutide) to Membrane Protein GLP-1R. Supervised by TONY
SUMARYADA and LAKSMI AMBARSARI.
The type II diabetes mellitus drug design is aimed to develop the analog of hormone GLP-1 which function to regulate insulin secretion. Exenatide and liraglutide are GLP-1 analogs which have been clinically tested and approved. The
objectives of this research are to identify the amino acids which play significant role in the interaction between GLP-1, exenatide, and liraglutide to GLP-1R; and
to analyze their interaction stability. The result of this research can be used further to develop a better GLP-1 analog.
The experiment was conducted in two stages. In the first stage, the molecular structures of GLP-1, exenatide and liraglutide were docked to N-terminal
domain of GLP-1R. Each docking process produced 10 docking formations in the form of the pdb file. The 10 docking formations of each pair were then analyzed using VMD to identify binding site and active amino acids. The result of this analysis then is used to choose one docking formation with most active amino acids. The docking formation chosen from each pair is processed further in molecular dynamic simulation for 20 ns. After 20 ns molecular dynamic simulation at 310K, the binding site of GLP-1R is identified on beta-sheet structure located at F80-E125. The docking formation of GLP-1 and GLP-1R is relatively stable, whilst the docking formation of exenatide-GLP-1R and liraglutide-GLP-1R split off during the trajectory.
Analysis on non-bond interaction energy discovered that the interaction between exenatide and GLP-1R is the strongest among others. Exenatide-GLP1R
interaction is bound by strong polar interaction between S39 and K113.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biofisika
DINAMIKA INTERAKSI PROTEIN HORMON GLP-1 DAN
ANALOGNYA (
Exenatide
dan
Liraglutide
) TERHADAP
PROTEIN MEMBRAN GLP-1R
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga penelitian ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini adalah mengenai kestabilan interaksi protein hormon untuk pengobatan diabetes, dengan judul Dinamika Interaksi Protein Hormon GLP-1 dan Analognya (Exenatide dan Liraglutide) terhadap Protein Membran GLP-1R.
Terima kasih penulis ucapkan kepada Bapak Dr. R. Tony Ibnu S. Wijaya Puspita S.Si, M.Si dari Program Studi Biofisika dan Ibu Dr. Dra Laksmi Ambarsari MS dari Program Studi Biokimia atas bimbingannya selama pelaksanaan penelitian dan penyusunan laporan hasil penelitian ini. Terima kasih atas masukan dan arahan yang diberikan sehingga penelitian ini lebih terarah dan lebih mendalam.
Semoga hasil penelitian ini dapat dilaksanakan sepenuhnya dan memberikan hasil yang bermanfaat.
Bogor, Desember 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Manfaat Penelitian 4
Ruang Lingkup Penelitian 5
2 TINJAUAN PUSTAKA 6
GLP-1 dan Analog GLP-1 6
GLP-1 Receptor 10
3 METODE 12 Bahan 12 Alat 12 Metode 12
Prosedur Analisis Data 13 4 HASIL DAN PEMBAHASAN 15
Analisis Hasil Docking 15
Analisis Simulasi Dinamika Molekul 24
Analisis Energi Interaksi Non-ikatan 34
5 SIMPULAN DAN SARAN 44
Simpulan 44
Saran 45
DAFTAR TABEL
2.1 Perbandingan fungsi biologis protein GLP-1, exenatide dan liraglutide 8
4.1 Analisa hasil penambatan protein hormon GLP-1 dengan GLP-1R 16 4.2 Analisa hasil penambatan protein hormon exenatide dengan GLP-1R 17
4.3 Analisa hasil penambatan protein hormon liraglutide dengan GLP-1R 20
4.4 Ringkasan statistik jarak antara residu aktif pada interaksi molekul protein GLP-1 dengan molekul GLP-1R selama 20 ns 27 4.5 Ringkasan statistik jarak antara residu aktif pada interaksi molekul
protein exenatide dengan molekul GLP-1R selama 10 ns 30
4.6 Ringkasan statistik jarak antara residu aktif pada interaksi molekul
protein liraglutide dengan molekul GLP-1R selama 15 ns 33
4.7 Ringkasan statitistik energi interaksi elekstrostatik dan Van der Waals antara pasangan residu aktif pada formasi penambatan GLP-1 dengan
GLP-1R 34
4.8 Ringkasan statitistik energi interaksi elekstrostatik dan Van der Waals antara pasangan residu aktif pada formasi penambatan exenatide
dengan GLP-1R 37
4.9 Ringkasan statitistik energi interaksi elekstrostatik dan Van der Waals antara pasangan residu aktif pada formasi penambatan liraglutide
dengan GLP-1R 40
4.10 Perbandingan interaksi WR1 (GLP-1 dan GLP-1R), ER1 (exenatide dan
GLP-1R), serta LR1 (liraglutide dan GLP-1R) 43
DAFTAR GAMBAR
2.1 Hasil visualisasi VMD 1.9.1 dari struktur protein GLP-1 6 2.2 Hasil visualisasi VMD 1.9.1 dari struktur protein exendin-4 7 2.3 Hasil visualisasi VMD 1.9.1 dari struktur protein liraglutide 8 2.4 Perbandingan struktur protein GLP-1, exenatide dan liraglutide 9
4.1 Formasi hasil penambatan protein GLP-1 (merah) dengan GLP-1R (biru) 16 4.2 Interaksi antar asam amino pada hasil penambatan protein GLP-1dan
GLP-1R formasi WR1 17
4.3 Formasi hasil penambatan exenatide (merah) dengan GLP-1R (biru) 17
4.4 Interaksi antar asam amino pada hasil penambatan protein exenatide dan
GLP-1R formasi ER1 19
4.5 Formasi hasil penambatan liraglutide (merah) dengan GLP-1R (biru) 19
4.6 Interaksi antar asam amino pada hasil penambatan protein liraglutide dan
GLP-1R formasi LR1 21
4.7 Binding site GLP-1R dan asam amino yang aktif berinteraksi 21
4.8 Binding site protein a) GLP-1, b) exenatide dan c) liraglutide dengan
GLP-1R 22
4.9 Kemiripan morfologi antara residu yang berperan penting dalam proses
penambatan 23
4.11 Dinamika interaksi molekul protein GLP-1 dengan GLP-1R pada
suhu 310K 25
4.12 Dinamika radius pasangan residu aktif antara GLP-1 dengan GLP-1R
selama trajectory 20 ns 26
4.13 Dinamika interaksi molekul protein exenatide dengan GLP1R pada
suhu 310K 28
4.14 Dinamika radius pasangan residu aktif antara exenatide dengan
GLP-1R selama trajectory 20 ns 29
4.15 Dinamika interaksi molekul protein liraglutide dengan GLP1R pada
suhu 310K 31
4.16 Dinamika radius pasangan residu aktif antara liraglutide dengan
GLP-1R selama trajectory 20 ns 32
4.17 Energi interaksi non-ikatan antara pasangan residu aktif pada formasi
penambatanGLP-1 dengan GLP-1R selama trajectory 20 ns 35
4.18 Energi interaksi non-ikatan antara residu aktif pada formasi penambatan
exenatide dengan GLP-1R selama trajectory 20 ns 38
4.19 Energi interaksi non-ikatan total antara residu S39-K113 pada formasi penambatan exenatide dengan GLP-1R selama trajectory 20 ns 39
4.20 Energi interaksi jembatan garam antara residu E15-R121 pada formasi penambatan exenatide dengan GLP-1R selama trajectory 20 ns 39
4.21 Energi interaksi non-ikatan total pada formasi docking liraglutide
dengan GLP-1R selama trajectory 20 ns 41
1
PENDAHULUAN
Latar Belakang
Kesehatan menjadi salah satu isu penting di abad 21 ini, terbukti berbagai profesi di bidang medis masih menjadi profesi paling favorit dan menjanjikan pendapatan yang cukup tinggi sampai tahun 2025 menurut US Weekly. Salah satu kelompok penyakit yang dapat berakhir pada kematian adalah diabetes mellitus. Menurut data WHO terjadi peningkatan prevalensi penderita diabetes dari tahun ke tahun. WHO memprediksi jumlah penderita diabetes akan bertambah dari 171 juta jiwa pada tahun 2000 menjadi 366 juta jiwa pada tahun 2030 atau meningkat 114% dalam 3 dasawarsa terakhir. Di Indonesia sendiri terdapat 8,4 juta jiwa penderita diabetes pada tahun 2000 dan diperkirakan akan mencapai 21 juta jiwa pada tahun 2030, atau meningkat kurang lebih 150%. Hal ini menempatkan Indonesia pada posisi ke-4, negara dengan prevalensi diabetes tertinggi (www.who.int/ diabetes/facts/world-figures/en/ index.html).
Diabetes Mellitus (DM) adalah kelompok penyakit yang diakibatkan karena gangguan metabolik yang ditandai dengan hiperglikemia atau tingginya kadar gula dalam darah. Gangguan metabolik ini dapat disebabkan karena sekresi insulin yang tidak normal, kelainan kerja insulin atau keduanya (ADA, 2013). Insulin adalah hormon yang berperan mengatur kadar gula dalam darah. Apabila kadar gula dalam darah tinggi, maka pankreas akan memproduksi insulin. Insulin bekerja dengan mendorong glukosa dalam darah untuk masuk ke dalam sel, sehingga sel-sel dapat menjalankan fungsinya. Ketiadaan insulin atau kurangnya jumlah insulin menyebabkan kadar glukosa dalam darah tinggi dan sel tidak mendapatkan pasokan energi, akibatnya berbagai gangguan kesehatan muncul (WHO, 1999).
Sejak tahun 1999, WHO merevisi pengelompokan penyakit diabetes mellitus menjadi: DM tipe I, DM tipe II, Gestational Diabetes Mellitus (GDM) dan DM tipe lainnya (WHO, 1999). DM tipe I mengalami ketergantungan terhadap insulin karena tubuh penderita DM tipe I tidak mampu memproduksi insulin sendiri. Penderita DM tipe ini memiliki ketidaknormalan sistem kekebalan tubuh, dimana tubuh memproduksi antibodi terhadap sel β pankreas sehingga sel-sel ini mengalami kerusakan, akibatnya sekresi insulin terhambat (ADA, 2013). Jumlah penderita DM tipe I meliputi 5-10% dari keseluruhan populasi penderita DM. Penderita DM tipe II yang meliputi 90-95% populasi. Penderita DM tipe II masih mampu memproduksi insulin sendiri namun dalam jumlah yang kurang, mengalami pengurangan fungsi insulin atau biasa disebut insulin resistance dan meningkatnya
jumlah EGO (endogenous glucose output) (Weyer et al, 1999). GDM adalah
gangguan metabolik hiperglikemia yang terjadi pada masa kehamilan dan biasanya akan hilang dengan sendirinya setelah melahirkan. DM tipe yang lain meliputi gangguan metabolik hiperglikemia yang disebabkan antara lain: konsumsi obat tertentu yang mempengaruhi fungsi pankreas, infeksi atau trauma pada pankreas, mutasi pada insulin reseptor, dan beberapa sindrom genetik yang berhubungan dengan ketidaknormalan fungsi pankreas (ADA, 2013).
2
mempertahankan kadar gula darah pada level normal dengan menjaga makanan dan menyesuaikan gaya hidup, juga harus mendapat suntikan insulin. Penderita diabetes mellitus tipe II (DM tipe II) disamping menjalani terapi diet, dapat mengkonsumsi beberapa jenis obat yang mampu mengatasi hiperglikemia. Penggunaan obat-obatan tersebut dapat mengakibatkan beragam efek samping; antara lain hipoglikemia, gangguan ginjal bahkan sampai gagal jantung. Para peneliti berupaya mencari pengobatan DM tipe II yang efektif namun aman untuk organ-organ vital yang lain. Salah satu penelitian menunjukkan adanya hubungan antara menurunnya fungsi insulin dengan sekresi insulin, menurunnya fungsi insulin biasanya diikuti dengan meningkatnya sekresi insulin (Ahren dan Pacini, 2004). Dari penelitian yang lain menunjukkan bahwa hal ini tidak terjadi pada penderita DM tipe II dimana penuruan fungsi insulin tidak dibarengi dengan peningkatan sekresi insulin, akibatnya terjadi ketidakseimbangan. Untuk itu pengobatan DM tipe II ditujukan untuk menstabilkan sekresi insulin agar dapat mengimbangi turunnya fungsi insulin (Weyer et al, 1999).
Sekresi insulin dipicu oleh beberapa faktor yang salah satunya adalah hormon GLP-1 (Glucagon-like peptide 1) dengan mekanisme berikut. Pada saat pencernaan mekanik berlangsung di dalam mulut, sel L di dalam usus halus terstimulasi untuk mensekresi hormon GLP-1 (Muoio dan Newgard, 2008). Respon sel L dalam usus halus pada penderita DM tipe II terhadap rangsangan pencernaan mekanik di mulut lemah, sehingga hormon GLP-1 yang dihasilkan sedikit. GLP-1 kemudian berikatan dengan reseptornya yaitu protein membran GLP-1R yang terletak pada sel β dalam pankreas dan selanjutnya memicu aktivasi kerja adenylate cyclase dan produksi cAMP (Baggio dan Drucker, 2008).
Selanjutnya pada kondisi berikatan dengan GLP-1R, GLP-1 mengatur aktivitas tiga ion channel dalam sel β pankreas yaitu: KATP channel, Ca2+ channel dan K+ channel. Melalui fungsi ketiga channel inilah, rangsangan sekresi insulin berlangsung. Pengobatan DM tipe II dengan GLP-1 menjadi alternatif yang menarik karena di samping memicu sekresi insulin, GLP-1 juga mampu berfungsi meregenerasi sel β (Muoio dan Newgard, 2008).
Yang menjadi perhatian adalah setelah disekresi, hormon GLP-1 hanya mampu bertahan selama kurang dari 2 menit sebelum akhirnya terurai dari GLP-1 (7-36) dan GLP-1 (7-36)NH2 menjadi GLP-1 (9-37) atau GLP-1 (9-36)NH2 yang bersifat tidak aktif (Baggio dan Drucker, 2008). Interaksi antara hormon GLP-1 dengan enzim DPP IV (dipeptidil peptidase IV) menyebabkan GLP-1 terdegradasi dan hanya 50% yang tersisa untuk menjalankan fungsinya (Vilsbøll et.al, 2007).
Sampai saat ini penelitian mengenai pengobatan penyakit DM terutama tipe II difokuskan pada dua hal yaitu meningkatkan aktivitas GLP-1R dengan mengembangkan analog protein hormon GLP-1 dan mengembangkan DPP-IV inhibitor untuk mempertahankan jumlah GLP-1 dalam tubuh. Di antara analog GLP-1 berdasarkan hasil penelitian mampu berfungsi seperti halnya GLP-1 adalah
exendin-4 (Briones dan Bajaj, 2006), liraglutide (Vilsbøll et al, 2007), albiglutide
dan taspoglutide (Ahrén, 2011). Exenatide, bentuk sintetik dari exendin-4, telah
lolos uji klinis dan telah digunakan untuk pengobatan diabetes mulai tahun 2005, sedangkan liraglutide dapat digunakan secara klinis mulai tahun 2009. Sementara albiglutide dan taspoglutide sampai saat ini masih dalam tahapan uji klinis untuk
3
Exenatide dan liraglutide memiliki ketahanan yang cukup baik terhadap
enzim DPP IV sehingga dapat bertahan lebih lama di dalam tubuh. Exenatide
memiliki waktu paruh 1,5 - 2 jam sedangkan liraglutide memiliki waktu paruh 11 – 15 jam. Kedua analog GLP-1 ini juga dapat berikatan dengan GLP-1 reseptor (GLP-1R) yang terdapat pada jaringan pankreas dan jaringan lain dalam tubuh. GLP-1 reseptor adalah protein trans-membran yang berfungsi mengikat GLP-1 atau analognya dan memberikan tempat untuk bekerja merangsang pengeluaran insulin oleh pankreas (Baggio dan Drucker, 2008).
Docking atau penambatan protein hormon GLP-1, exenatide dan liraglutide
pada GLP-1R dapat terbentuk dalam berbagai formasi dan titik docking yang
berbeda. Dengan menggunakan simulasi komputer, keseluruhan kemungkinan formasi dan titik penambatan dapat diketahui. Afinitas protein trans-membran terhadap protein hormon GLP-1, exenatide dan liraglutide juga dapat diprediksi
melalui simulasi komputer dengan menggunakan aplikasi simulasi dinamika molekul.
Perumusan Masalah
Berdasarkan latar belakang di atas dapat dikatakan bahwa pengobatan DM tipe II melalui pengembangan analog hormon GLP-1 sampai saat ini masih menjadi perhatian. Penelitian in vivo menunjukkan bahwa exenatide dan liraglutide
memiliki ketahanan terhadap DPP IV lebih baik daripada GLP-1 dalam tubuh mamalia di laboratorium maupun dalam tubuh manusia ((Vilsbøll et al, 2007 dan
Mann, et.al, 2010) dan juga memiliki fungsi yang sama dengan GLP-1. Yang menjadi permasalahan sampai saat ini obat-obatan tersebut harus dikonsumsi secara terus menerus dengan frekuensi satu kali sehari untuk liraglutide dan dua kali sehari
untuk exenatide. Hal ini menjadikan pengobatan DM tipe II membutuhkan biaya
yang tidak sedikit, bahkan salah satu penelitian menunjukkan bahwa biaya pengobatan ini lebih besar daripada pengobatan DM tipe I yang harus mendapat suntikan insulin (Edwards et al, 2006). Untuk itu perlu dikembangkan analog
hormon GLP-1 yang di samping dapat berfungsi seperti halnya GLP-1, tahan terhadap enzim DPP IV dan juga tersedia dengan harga terjangkau.
Pada saat ini, penelitian terhadap pengobatan DM tipe II difokuskan pada dua hal yaitu mengembangkan analog hormon GLP-1 dan mengembangkan senyawa inhibitor DPP IV. Fokus penelitian ini adalah untuk mendukung pengembangan analog hormon GLP-1. Pengembangan analog hormon GLP-1 menarik untuk diteliti lebih lanjut, mengingat salah satu analog GLP-1, exendin-4, diperoleh dari
kelenjar ludah kadal Heloderma suspectum yang memiliki habitat di benua
Amerika. Tidak menutup kemungkinan analog hormon GLP-1 dapat dikembangkan dari bagian tubuh atau hasil sekresi satwa lain, atau bahkan satwa asli Indonesia.
4
1. Bagaimana interaksi antara protein hormon GLP-1, dan analognya (exenatide dan liraglutide) dengan protein trans-membran GLP-1R
terjadi? Asam amino apa saja yang bertanggung jawab terhadap interaksi protein hormon dengan reseptornya?
2. Bagaimana kestabilan protein hormon GLP-1, dan analognya (exenatide
dan liraglutide) setelah berikatan dengan protein trans-membran
GLP-1R?
3. Bagaimana kestabilan interaksi antara antara pasangan asam amino aktif dari protein hormon GLP-1 dan analognya dengan protein trans-membran GLP-1R? Asam amino apa saja yang memiliki kestabilan interaksi paling tinggi?
Tujuan Penelitian
Berdasarkan perumusan masalah di atas, maka tujuan dari penelitian terhadap protein hormon GLP-1, exenatide dan liraglutide adalah untuk:
1. Mengidentifikasi asam amino dari protein hormon GLP-1, exenatide dan liraglutide yang paling berperan dalam menjalin interaksi dengan protein
reseptor GLP-1R.
2. Membandingkan kestabilan interaksi protein hormon GLP-1, exenatide
dan liraglutide setelah berikatan dengan protein trans-membran GLP1-R.
3. Mengidentifikasi pasangan asam amino yang memiliki ikatan paling stabil dari setiap interaksi protein hormon GLP-1, exenatide dan liraglutide dengan protein reseptor GLP-1R.
Tujuan jangka panjang dari penelitian ini adalah mengembangkan analog protein GLP 1 yang memiliki ketahanan lebih baik terhadap enzim DPP IV dan memiliki afinitas yang lebih baik dengan protein membran GLP1-R, sehingga dapat digunakan sebagai alternatif pengobatan diabetes mellitus tipe II.
Manfaat Penelitian
Dengan mengetahui perbandingan kestabilan protein hormon GLP-1,
exenatide dan liraglutide serta asam amino yang paling berperan dalam
menstabilkan protein serta kestabilan protein-protein tersebut setelah berikatan dengan protein trans-membran GLP-1R, dapat digunakan sebagai dasar untuk penelitian lebih lanjut mengenai:
1. Modifikasi protein-protein tersebut sehingga didapatkan protein hormon yang memiliki kestabilan lebih baik
2. Rancangan pengobatan diabetes mellitus yang lebih efektif dan efisien, mengingat exenatide harus diberikan dua kali dalam sehari dan liraglutide satu kali dalam sehari, maka perlu dirancang hormon yang
5
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah membandingkan kestabilan protein hormon GLP-1 (PDB ID: 1D0R), exenatide (PDB ID: 1JRJ) dan liraglutide (PDB
6
2
TINJAUAN PUSTAKA
GLP-1 dan Analog GLP-1
GLP-1 (glucagon-like peptide-1) adalah protein yang diproduksi oleh sel L dalam epitel usus halus sebagai respon terhadap stimulus pencernaan nutrisi (termasuk glukosa) dan memiliki kemampuan mendorong produksi insulin. Produksi GLP-1 berlangsung Struktur protein yang dihasilkan memiliki 50% kemiripan dengan glucagon, sehingga diberi nama glucagon-like peptide. Ada dua jenis GLP yang dihasilkan oleh tubuh, yaitu 1 dan 2, namun hanya GLP-1 yang memiliki kemampuan mendorong sekresi insulin (Baggio dan Drucker, 2007). Sel L pada usus halus langsung memproduksi GLP-1 begitu terjadi proses pencernaan di dalam mulut. Drucker (2001) menyebutkan bahwa fungsi dari GLP-1 dalam tubuh antara lain: meningkatkan sekresi insulin, menurunkan sekresi
glucagon, menurunkan laju pengosongan perut, meningkatkan differensiasi sel islet,
meningkatkan skresi somatostatin, menurunkan sekresi asam lambung, menurunkan asupan makanan, meningkatkan respon tekanan CNS, dan menyeimbangkan fungsi hypothalamic pituitary.
Protein GLP-1 tersusun dari 30 asam amino dengan susunan sebagai berikut: Histidina (His/H1) - Alanina (Ala/A2) - Asam Glutamat (Glu/E3) - Glisina (Gly/G4) - Treonina (Thr/T5) - Fenilalanina (Phe/F6) - Treonina (Thr/T7) – Serina (Ser/S8)- Asam Aspartat (Asp/D9 ) - Valina (Val/V10) - Serina (Ser/S11) - Serina (Ser/S12) – Tirosina (Tyr/Y13) – Leusina (Leu/L14) - Asam Glutamat (Glu/E15) - Glisina (Gly/G16) – Glutamina (Gln/Q17) - Alanina (Ala/A18) - Alanina (Ala/A19) – Lisina (Lys/K20) - Glutamina (Gln/Q21) - Fenilalanina (Phe/F22) - Isoleusina (Ile/I23) - Alanina (Ala/A24)- Triptofan (Trp/W25) – Leusina (Leu/L26) – Valina (Val/V27) - Lisina (Lys/K28) - Glisina (Gly/G29) – Arginina (Arg/R30). Struktur protein GLP-1 seperti terlihat pada Gambar 2.1 tediri dari α-heliks yang terbentuk oleh residu S8 sampai residu K28, turn serta coil. Struktur sekunder α-heliks ini
sebenarnya tersusun dari dua segmen α-heliks yang terhubung oleh jembatan garam antara K20 dan E21. Pada mamalia, berbagai formasi GLP-1 terbentuk antar lain: GLP-1 (1-37), GLP-1(1-36)NH2, GLP-1 (7-37) dan GLP-1 (7-36)NH2. Dua formasi yang pertama bersifat tidak aktif, sedangkan dua formasi berikutnya bersifat aktif. Dalam tubuh manusia, sebagai besar GLP-1 yang dihasilkan memiliki formasi GLP-1 (7-36)NH2 (Baggio dan Drucker, 2007).
Waktu paruh GLP-1 yang aktif di dalam tubuh kurang dari 2 menit, karena di dalam usus terdapat enzim penernaan DPP IV (dipeptidil peptidase) yang memiliki spesialisasi membelah protein yang mengandung alanina dan prolina di posisi 2. GLP-1 yang memiliki residu alanina pada rantai kedua menjadi objek DPP IV yang menyebabkan 2 rantai pertama terpotong sehingga terurai menjadi GLP-1 (9-37)
7 atau GLP-1 (9-36)NH2 yang bersifat tidak aktif. Hal ini menyebabkan kurang lebih 50% dari GLP-1 yang yang tersirkulasi menjadi tidak aktif (Baggio dan Drucker, 2007).
Salah satu analog GLP-1, Exendin-4, lebih tahan terhadap aktivitas enzim DPP IV sehingga memiliki waktu paruh yang lebih lama di dalam plasma yaitu 1,5 – 2 jam (Ahren, 2011). Hal ini dikarenakan rantai ke-2 dari Exendin-4 bukan alanina melainkan glisina sehingga tidak menjadi target aktivitas enzim DPP IV (Drucker, 2001). Lebih lanjut Drucker menyebutkan bahwa Exendin-4 terbukti lebih potensial daripada GLP-1 untuk pengobatan DM tipe II pada percobaan in vivo dengan tikus sebagai objeknya. Penggunaan Exendin-4 pada pasien penderita DM tipe II selama 30 minggu terbukti mampu menurunkan kadar HbA1c sebesar 0,8–0,9% dari sebelumnya 8,2-8,6% (Ahren, 2011). Dengan waktu paruh yang lebih panjang, Exendin-4 dapat bertahan di dalam tubuh pasien selama 6-8 jam, untuk itu pasien perlu mendapatkan injeksi Exendin-4 dua kali dalam sehari. Saat ini peneliti sedang mengembangkan Ex-4 dalam kemasan biodegradable polymer untuk memperpanjang masa pelepasan Ex-4 sehingga pemberian injeksi dapat dilakukan satu kali dalam satu minggu.
Ex-4 dapat berikatan dengan GLP-1R dan mengaktivasi fungsi GLP-1R dengan baik, bahkan dengan afinitas yang lebih besar dari GLP-1 (Maturana et al,
2003)). Hormon Ex-4 diperoleh dari kelenjar ludah kadal Heloderma suspectum,
kadal ini mensekresikan Ex-4 beberapa saat setelah menggigit mangsanya. Rantai Ex-4 lebih panjang daripada GLP-1, yaitu terdiri dari 39 asam amino dan 50% dari rantai asam amino Ex-4 beririsan dengan rantai GLP-1. Struktur molekul hampir menyerupai GLP-1 dengan tambahan 9 residu pada rantai C-terminus (Neidigh et al, 2001) dengan susunan sebagai berikut: Histidina (His/H1) - Glisina (Gly/G2) -
Asam Glutamat (Glu/E3) - Glisina (Gly/G4) - Treonina (Thr/T5) - Fenilalanina (Phe/F6) - Treonina (Thr/T7) – Serina (Ser/S8)- Asam Aspartat (Asp/D9 ) - Leusina (Leu/L10) - Serina (Ser/S11) - Lisina (Lys/K12) – Glutamina (Gln/Q13) – Metionina (Met/M14) - Asam Glutamat (Glu/E15) - Asam Glutamat (Glu/E16) – Asam Glutamat (Glu/E17) - Alanina (Ala/A18) - Valina (Val/V19) – Arginina (Arg/R20) - Leusina (Leu/L21) - Fenilalanina (Phe/F22) - Isoleusina (Ile/I23) - Alanina (Ala/A24)- Triptofan (Trp/W25) – Leusina (Leu/26L) – Lisina (Lys/K27) – Asparagina (Asn/N28) - Glisina (Gly/G29) - Glisina (Gly/G30) – Prolina (Pro/P31) - Serina (Ser/S32) - Serina (Ser/S33) - Glisina (Gly/G34) - Alanina (Ala/A35) - Prolina (Pro/P36) - Prolin (Pro/P37) - Prolin (Pro/P38) - Serin (Ser/S39). Struktur molekul Ex-4 dapat dilihat pada Gambar 2.2 berikut.
8
Rantai asam amino liraglutide, analog yang lain dari GLP-1, 95% sama
dengan GLP1 dengan penggantian asam amino L28 menjadi Arginina, penambahan asam amino Glysin pada C-terminus Arginina dan penambahan asam lemak C-16 pada residu ke-26 (Russel-Jones, 2008). Keberadaan asam lemak ini cukup signifikan karena mengakibatkan liraglutide dapat membentuk ikatan kovalen
dengan albumin. Hal ini menyebabkan liraglutide tidak mudah terdegradasi oleh
enzim DPP IV dapat bertahan lebih lama dalam sistem pencernaan (Ahren, 2011).
Liraglutide dapat bertahan selama 11-15 jam di dalam sistem pencernaan, lebih
lanjut Knudsen et al (2000) memvariasikan posisi ikatan asam lemak ini sehingga
waktu paruhnya dapat mencapai 20 jam. Madsen et al (2007) memvariasikan
panjang asam lemak dari C10 – C18 dan menemukan bahwa penambahan asam lemak C18 dapat memperpanjang waktu paruh menjadi 21 jam, namun mengurangi ikatannya dengan GLP-1 reseptor. Susunan asam amino liraglutide adalah sebagai
berikut: Histidina (His/H7) - Alanina (Ala/A8) - Asam Glutamat (Glu/E9) - Glisina (Gly/G10) - Treonina (Thr/T11) - Fenilalanina (Phe/F12) - Treonina (Thr/T13) – Serina (Ser/S14)- Asam Aspartat (Asp/D15) - Valina (Val/V16) - Serina (Ser/S17) - Serina (Ser/S18) – Tirosina (Tyr/Y19) – Leusina (Leu/L20) - Asam Glutamat (Glu/E21) - Glisina (Gly/G22) – Glutamina (Gln/Q23) - Alanina (Ala/A24) - Alanina (Ala/A25) – Lisina (Lys/K26) - Glutamina (Gln/Q27) - Fenilalanina (Phe/F28) - Isoleusina (Ile/I29) - Alanina (Ala/A30)- Triptofan (Trp/W31) – Leusina (Leu/L32) – Valina (Val/V33) - Arginina (Arg/R34) - Glisina (Gly/G35) – Arginina (Arg/R36) - Glisina (Gly/G37). Struktur molekul liraglutide dapat dilihat
pada gambar 2.3 berikut.
Hasil uji klinis pada pasien penderita DM tipe II yang mendapatkan pengobatan liraglutide selama 6 bulan menunjukkan penurunan kadar HbA1c antara
1,1 – 1,5% dari 8,2 -8,5% (Russel-Jones, 2009). Pengujian in vivo pada tikus menunjukkan bahwa penggunaan liraglutide dalam jangka panjang dapat memicu
resiko munculnya tumor sel tiroid, namun kasus ini tidak muncul dalam pengujian pada manusia. Namun untuk sebagai antisipasi, obat ini tidak disarankan digunakan oleh pasien DM tipe II yang memiliki riwayat keluarga penderita kanker atau tumor kelenjar tiroid.
Perbandingan struktur molekul GLP-19(7-36)amida, exenatide (bentuk
sintetik dari Ex-4) serta liraglutide dapat dilihat pada Gambar 4. Pada gambar di
bawah ini dapat dilihat bahwa 17 residu dari 39 residu pada exenatide beririsan
dengan residu pada GLP-1. Sedangkan pada liraglutide, 29 residu dari 30 residu
pada protein ini beririsan dengan GLP-1. Kemiripan ini menyebabkan exenatide
dan juga liraglutide dapat berikatan dengan GLP-1 reseptor sama baiknya dengan
protein hormon GLP-1.
9
Di samping membandingkan struktur molekul protein GLP1, exenatide dan liraglutide seperti terlihat di atas, Drucker dan Nauck juga melakukan inventarisasi
fungsi-fungsi biologis dari protein protein GLP1, exendin-4 dan liraglutide seperti
disajikan pada tabel 1. Berdasarkan tabel 1 dapat dilihat bahwa baik GLP1,
exenatide dan liraglutide berdasarkan hasil uji invivo mampu menjalankan fungsi
dengan sama baiknya. Beberapa hal yan menjadi pertimbangan dalam pemilihan obat yang akan digunakan antara lain, metode deliveri obat, dosis penggunaan, efek samping dari masing-masing obat dan tentu saja harga.
Tabel 2.1. Perbandingan fungsi biologis protein GLP1, exenatide dan liraglutide
Fungsi Biologis pada penderita DM tipe II
GLP-1 (wild type)
Exenatide Liraglutide
Merangsang sekresi insulin √ √ √
Peningkatan sekresi insulin
setelah makan √ √ √
Meningkatkan aktivitas incretin √ √ √
Menekan sekresi glucagon √ √ √
Meningkatkan sekresi glucagon pada saat kadar glucosa dalam plasma rendah
√ √ √
Meningkatan pembentukan
proinsulin √ √ √
Meningkatkan massa sel β pada
pankreas √ √ √
Menghambat apoptosis sel β √ √ √
Memperlambat pengosongan
lambung √ √ √
Menekan nafsu makan √ √ √
Menurunkan berat badan √ √ √
Sumber : Drucker and Nauck, 2006
Gambar 2.4. Perbandingan struktur protein GLP1, exenatide dan liraglutide
10
GLP-1 Receptor
GLP-1R adalah protein transmembran yang termasuk dalam protein kelas B, di mana protein-protein lain dalam kelas ini juga berfungsi sebagai reseptor bagi glukagon, GLP-2 dan GIP (gastric inhibitory polypeptide). Pada manusia dan
binatang pengerat, GLP-1R ditemukan pada beragam jaringan antara lain: pankreas, paru-paru, jantung, ginjal, lambung, usus, kulit dan beberapa area di hipotalamus dan batang otak (Baggio dan Drucker, 2008). Aktivasi GLP-1R oleh GLP-1 memicu aktivasi kerja adenylate cyclase dan produksi cAMP. Selanjutnya cAMP
mengaktifkan protein kinase A serta Epac 1 dan 2 yang berujung pada stimulus sekresi insulin.
Struktur molekul GLP-1R terdiri dari 463 asam amino, namun yang paling berperan dalam proses ikatan dengan ligannya adalah area N-terminal domain (NTD) yang terletak pada bagian ekstraselular dan tersusun dari 100 – 150 asam amino (Mann et al, 2010). Afinitas antara protein ligand dengan GLP-1R akan
lebih baik apabila berikatan dengan molekul GLP-1R utuh, namun justru di area NTD inilah terdapat perbedaan interaksi antara GLP-1R dengan GLP-1 dan glucagon (Runge et al, 2008). Perbedaan ini menjadi penting karena interaksi
dengan kedua protein ini menghasilkan efek yang berbeda, interaksi GLP-1R dengna GLP-1 akan merangsang sekresi insulin sementara interaksi GLP-1R dengan glucagon justru akan merangsang sekresi glukosa. Struktur molekul NTD dari GLP-1R dapat dilihat pada gambar 5. NTD dari GLP-1R berinteraksi dengan C-terminal dari protein ligand dalam hal ini GLP-1 menghasilkan ikatan dengan afinitas yang rendah (Coopman et al, 2011). Sedangkan interaksi NTD dari
GLP-1R dengan C-terminal dari protein ligand exendin-4 menghasilkan ikatan dengan afinitas yang lebih tinggi. Hal ini dapat disebabkan karena struktur sekunder α- heliks pada exendin-4 lebih stabil dibandingkan dengan struktur sekunder α- heliks GLP-1 yang merupakan gabungan dari 2 segmen α- heliks.
12
3
METODE
Bahan
Keseluruhan prosedur pada penelitian ini akan menggunakan protein hormon GLP-1 dengan PDB ID: 1D0R (Chang et al, 2001), exenatide dengan PDB ID: 1JRJ
(Neidigh et al, 2001) dan liraglutide dengan PDB ID: 4APD (Steensgaard et al,
2003), serta protein trans-membran GLP-1R diambil dari struktur protein dengan PDB ID: 3C59 (Runge et al, 2008). Data-data mengenai protein diperoleh dari
Protein Data Bank (www.rscb.com) dalam bentuk file .pdb yang berisi data-data meliputi: nama molekul, nama residu, identitas residu, hirarki struktur protein, koordinat molekul, temperature dan identitas segmen.
Alat
Penelitian ini menggunakan perangkat keras berupa alat tulis kantor, notebook dengan spesifikasi prosesor icore-7, memori RAM 4 GB, sistem operasi Windows 8.1 dari Hewlett Packard. Sedangkan perangkat lunak yang digunakan adalah program NAMD (Not just Another Molecular Dynamics) versi 2.9 yang dikembangkan oleh Theoritical Biophysics Group, University of Illinois dan Beckman Institute untuk melakukan simulasi dinamika molekul (Phillips et al,
2005). Program VMD (Visual Molecular Dynamics) versi 1.9.1, yang juga dikembangkan oleh Theoritical Biophysics Group, University of Illinois dan Beckman Institute untuk melihat visualisasi dinamika molekul (Humphrey et al,
1996). Analisis hasil simulasi NAMD juga dilakukan dengan VMD 1.9.1.
Prosedur penambatan protein hormon pada protein trans-membran dilakukan dengan menggunakan server ZDOCK 3.0.2 yang dijalankan oleh University of Massachussetts. Program algorithma penambatan ZDOCK terbukti menunjukkan performa yang kompetitif dalam memprediksi formasi penambatan dengan menghasilkan rata-rata 52 hit atau 52 hasil yang mendekati struktur asli untuk setiap
percobaan penambatan dibandingkan program algoritma penambatan yang lain (Chen dan Weng, 2002).
Metode
Tahap pertama, persiapan molekul protein dilakukan dengan mengunduh data protein hormon dan protein trans-membran dari Protein Data Bank dalam format .pdb. File protein hormone dalam format .pdb yang sudah diunduh kemudian diatur dengan menggunakan program VMD. Pengaturan yang dilakukan antara lain adalah: menentukan satu frame, menghilangkan atom hydrogen dari dalam system, dan kemudian menggeser pusat koordinat ke titik pusat (0, 0, 0). Selanjutnya membuat protein structure file dalam format .psf. Proses ini menggunakan
automatic psf builder atau psfgen. Hasil dari proses ini adalah file psf.psf dan
13 file .psf ini. Prosedur preparasi dilanjutkan dengan menempatkan protein dalam kotak air dengan dimensi sesuai dimensi protein yaitu berukuran 12Å lebih besar ukuran molekul. Air berperan sebagai media pelarut dan jumlah selalu tetap. Hasil yang dihasilkan dari proses ini adalah file dalam format –solvent.psf dan solvent.pdb. Terakhir sebelum dilakukan simulasi, molekul harus distabilkan dan dinetralkan terlebih dahulu. Penetralan perlu dilakukan karena molekul yang dilarutkan masih mengandung ion-ion dari residu polar. Proses ini menghasilkan file dengan format –ion.pdb atau -ion.psf.
Tahapan berikutnya adalah melakukan prosedur penambatan protein hormon pada protein trans-membran dengan menggunakan prosedur dalam server ZDOCK (Kirkpatrik et al, 2012). Dari hasil penambatan didapatkan masing-masing 10
formasi yang berbeda dalam bentuk file .pdb. Hasil setiap formasi kemudian dianalisis dengan VMD untuk melihat binding site serta residu-residu baik dari protein hormon sebagai ligand maupun protein trans-membran sebagai reseptor yang berperan dalam menjalin interaksi. Hal ini dilakukan dengan mengidentifikasi pasangan residu yang berada pada jarak 2,5 Å. Hasil dari analisa dari kesepuluh formasi docking tersebut kemudian dibandingkan untuk diidentifikasi residu-residu yang paling aktif dengan melihat residu-residu dari ligand dan reseptor yang paling sering menjalin interaksi. Tahapan berikutnya adalah memilih satu formasi yang memiliki residu aktif paling banyak dibandingkan formasi lainnya.
File .pdb dari formasi yang dianggap paling favorable kemudian dipersiapkan
untuk prosedur simulasi dinamika molekul dengan menjalani prosedur preparasi seperti di atas namun pemanasan dilakukan sampai 310K, yaitu suhu fisiologis tubuh manusia. Selanjutnya dilakukan prosedur anealing atau pemanasan dengan simulasi dinamika molekul pada formasi hasil penambatan selama masing-masing 20ns (Kirkpatrik et al, 2012).
Analisis Data
Hasil docking dalam format file.pdb akan dianalisis dengan menggunakan program VMD. Kesepuluh hasil docking dari masing-masing pasangan akan diidentifikasi residu yang berjarak kurang dari 2,5Å. Sebagai pembanding jarak ikatan jembatan garam 3,2Å, pertimbangan diambil jarak 2,5Å adalah untuk mendapatkan pasangan interaksi yang memiliki interaksi lebih kuat dari interaksi jembatan garam untuk mengidentifikasi titik penambatan atau binding site.
Pasangan residu dalam jarak kurang dari 2,5Å dari setiap hasil penambatan di analisis dan dipilih residu yang paling aktif atau paling banyak melakukan interaksi pada 10 hasil penambatan. Interaksi ini selanjutnya diidentifikasi sebagai interaksi polar, hidrofobik atau merupakan jembatan garam. Residu yang paling banyak melakukan interaksi pada kesepuluh hasil penambatan dianggap sebagai residu aktif. Selanjutnya dipilih formasi penambatan yang memiliki jumlah pasangan residu aktif paling banyak.
Hasil simulasi dalam format md.dcd akan dianalisis dengan menggunakan program VMD. Untuk melihat kestabilan interaksi melalui analisis beberapa parameter. Parameter yang pertama adalah jarak antara residu dalam setiap pasangan selama trajectory. Interaksi elektrostatik adalah interaksi antara dua atom
14
saling menolak dan atom yang berlawanan muatannya akan saling tarik menarik. Interaksi elektrostatik dapat digambarkan secara sederhana dengan hukum Coulomb sebagai berikut:
Vc =
� (3.1)
dimana ε adalah konstanta dielektrik dari medium. Dalam simulasi dinamika molekul, gaya elektrostatik diperhitungkan dengan metode Particle Mesh Ewald (Phillips et al, 2005).
Gaya van der Waals adalah jumlah gaya tarik menarik atau tolak menolak antar molekul atau antar bagian dalam molekul yang sama. Dalam simulasi dinamika molekul, interaksi van der Waals diperhitungkan dengan menggunakan persamaan Lennard-Jones 6-12 sebagai berikut:
VLJ= 4εij
[
� 12 - � 6]
(3.2)Potensial Lennard-Jones hanya terdiri dari dua parameter, diameter tumbukan σij
(jarak dimana energi sama dengan nol) dan kedalaman εij. Bagian tarik menarik diberikan proporsi r-6 dan bagian yang tolak menolak diberikan proporsi r-12 (Kar,
2010).
Selain parameter-parameter di atas, parameter lain yang menjadi indikasi kestabilan molekul adalah RMSD (Root Mean Square Deviation), jembatan garam,
perubahan native contact dan perubahan struktur sekunder. RMSD dari struktur
suatu protein adalah akar dari rata-rata kuadrat jarak atom tertentu (�⃗⃗⃗ �) terhadap satu atom koordinat yang menjadi acuan (�⃗⃗⃗⃗ � ). Biasanya yang diukur bukan
Struktur x memiliki jarak tertentu terhadap atom acuan x0, setelah prosedur simulasi selama t, xtmengalami pergeseran atau deviasi. RMSD sebesar 2 – 3 Å disebabkan oleh perubahan suhu, apabila RMSD bernilai lebih besar dari 3 Å, maka dapat disimpulkan telah terjadi perubahan konformasi struktur molekul (Stumpe, 2007). Pada penelitian ini RMSD sebesar lebih dari 2,5 Å dianggap sudah terjadi perubahan struktur, hal ini mengacu pada pedoman algoritma docking dimana
struktur docking dianggap sebagai hit (memiliki kemiripan dengan struktur asli)
apabila nilai RMSD kurang dari 2,5 Å (Cheng dan Weng, 2002).
Jembatan garam adalah interaksi antara residu-residu yang bermuatan positif dan negatif dengan jarak kurang dari 3,2 Å pada protein dalam hal ini protein reseptor dan protein ligand. Residu-residu pada protein dikatakan memiliki native contact apabila jarak pasangan atom terdekat tidak lebih dari 0,4 nm (Stumpe, 2007).
4
HASIL DAN PEMBAHASAN
Penelitian dilakukan dalam dua tahap; tahapan pertama adalah penambatan antara protein hormon GLP-1 (PDB ID: 1D0R) dan analognya yaitu exenatide
(PDB ID: 1JRJ) dan liraglutide (PDB ID: 4APD) dengan protein trans-membran
GLP-1R (PDB ID: 3C59). Hasil penambatan GLP-1 dengan GLP-1R, exenatide
dengan GLP-1R dan liraglutide dengan GLP-1R dianalisis dan dipilih satu formasi
penambatan dari masing-masing pasangan untuk dilakukan tahapan berikutnya. Tahapan kedua, simulasi dinamika molekul dengan masing-masing hasil penambatan yang terpilih pada suhu 310K.
Proses penambatan protein dengan server ZDOCK 3.0.2 dari masing-masing pasangan protein menghasilkan 10 formasi penambatan, sehingga secara keseluruhan didapatkan 30 hasil formasi penambatan. Simulasi dinamika molekul dengan NAMD 2.9 dilakukan hanya pada formasi penambatan yang terpilih dari masing-masing pasangan, sehingga diperoleh 3 hasil simulasi dinamika molekul untuk dianalisis.
Analisis hasil penambatan
Setelah dilakukan proses penambatan protein hormon GLP-1, exenatide dan liraglutide terhadap protein trans-membran GLP-1R, diperoleh 10 formasi
penambatan untuk masing-masing pasangan protein hormon dan protein trans-membran. Selanjutnya dilakukan identifikasi asam amino yang menjalin interaksi dari masing-masing formasi penambatan dengan menggunakan analisis dan visualisasi VMD. Hasil identifikasi ini kemudian digunakan untuk memilih satu formasi yang memiliki pasangan asam amino aktif paling banyak untuk selanjutnya dilakukan pengujian terhadap kestabilan interaksi dengan NAMD.
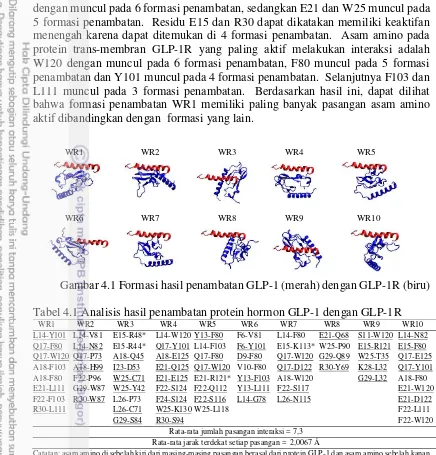
Protein hormon GLP-1 adalah protein yang dihasilkan oleh tubuh manusia dalam sel epitel usus halus. GLP-1 berperan sebagai regulator dalam sekresi insulin oleh pankreas. Protein GLP-1 berikatan dengan protein GLP-1R pada membran pankreas untuk selanjutnya bekerja merangsang pembentukan insulin. Mengingat protein hormon GLP-1 adalah hormon alami yang dihasilkan oleh tubuh, maka protein ini dianggap sebagai protein wild type. Formasi hasil penambatan antara
protein hormon GLP-1 dengan protein trans-membran GLP-1R diberi label WR1 (wild type– reseptor), WR2 dan seterusnya sampai WR10. Perbedaan antara
ke-sepuluh formasi penambatan yang diamati terdapat pada perbedaan binding site
atau lokasi penambatan pada protein reseptor GLP-1R dan juga perbedaan residu pada protein hormon GLP-1 yang berinteraksi atau menempel pada reseptor. Perbedaan lokasi penambatan dan juga residu protein hormon GLP-1 yang menambat menghasilkan formasi penambatan yang berbeda-beda (Gambar 4.1). Analisis lebih lanjut terhadap setiap formasi penambatan diperoleh beberapa pasangan residu dari protein GLP-1 dan protein GLP-1R yang melakukan interaksi (tabel 4.1).
16
dengan muncul pada 6 formasi penambatan, sedangkan E21 dan W25 muncul pada 5 formasi penambatan. Residu E15 dan R30 dapat dikatakan memiliki keaktifan menengah karena dapat ditemukan di 4 formasi penambatan. Asam amino pada protein trans-membran GLP-1R yang paling aktif melakukan interaksi adalah W120 dengan muncul pada 6 formasi penambatan, F80 muncul pada 5 formasi penambatan dan Y101 muncul pada 4 formasi penambatan. Selanjutnya F103 dan L111 muncul pada 3 formasi penambatan. Berdasarkan hasil ini, dapat dilihat bahwa formasi penambatan WR1 memiliki paling banyak pasangan asam amino aktif dibandingkan dengan formasi yang lain.
WR1 WR2 WR3 WR4 WR5
WR6 WR7 WR8 WR9 WR10
Gambar 4.1 Formasi hasil penambatan GLP-1 (merah) dengan GLP-1R (biru) Tabel 4.1 Analisis hasil penambatan protein hormon GLP-1 dengan GLP-1R
WR1 WR2 WR3 WR4 WR5 WR6 WR7 WR8 WR9 WR10 Rata-rata jumlah pasangan interaksi = 7,3
Rata-rata jarak terdekat setiap pasangan = 2,0067 Å
Catatan: asam amino di sebelah kiri dari masing-masing pasangan berasal dari protein GLP-1 dan asam amino sebelah kanan dari protein GLP-1R, interaksi hidrofobik (tanpa label), interaksi polar (garis bawah), jembatan garam (asteriks)
Pada formasi WR1, dari 8 pasangan interaksi yang berinteraksi, 7 diantaranya melibatkan asam amino aktif. Residu L14, Q17, A18, E21 dan F22 pada protein hormon GLP-1 adalah merupakan asam amino yang aktif berinteraksi. Demikian juga dengan residu aktif pada GLP-1R yaitu F80, Y101 dan W120, ketiganya dapat ditemukan pada formasi penambatan WR1. Residu L14 berinteraksi dengan Y101, Q17 berinteraksi dengan F80 dan W120, A18 berinteraksi dengan F80 dan F103, E21 berinteraksi dengan L111, F22 berinteraksi dengan F103, dan R30 berinteraksi dengan L111. Binding site atau lokasi
penambatan antara protein protein GLP-1 dengan GLP-1R adalah pada residu ke-80 sampai residu ke-120 yang merupakan daerah beta-sheet, coil dan turn.
Sedangkan residu protein GLP-1 yang aktif berinteraksi adalah residu ke-14 sampai ke-25 yang berada pada rantai alpha-helix. Protein hormon GLP-1 menambat
17
Hasil analisis VMD tidak menemukan adanya ikatan hidrogen dan jembatan garam antara protein GLP-1 dengan GLP1-R. Interaksi yang terbentuk adalah interaksi non-ikatan antara residu polar (Q17, Y101, Y120), residu bermuatan positif (R30), residu bermuatan negatif (E21) dan sebagian besar adalah residu non-polar. Interaksi yang terbentuk antara residu non polar dengan residu polar atau bermuatan adalah interaksi Van der Waals. Interaksi ini terjadi karena keberadaan residu polar atau bermuatan menginduksi residu non-polar di sekelilingnya sehingga bersifat polar untuk sementara. Interaksi Van der Waals tidak sekuat ikatan hidrogen atau jembatan garam, namun banyaknya gaya Van der Waals yang bekerja dapat menghasilkan interaksi yang cukup kuat.
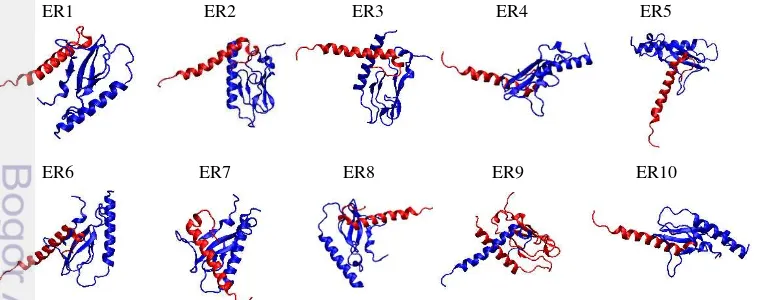
Proses penambatan selanjutnya dilakukan antara protein yang merupakan analog protein hormon GLP-1 yaitu exenatide dengan protein trans-membran
GLP-1R. Sepuluh formasi hasil penambatan exenatide dengan GLP-1R diberi label ER1
(exenatide – reseptor), ER2, dan seterusnya sampai ER10 (Gambar 4.3), analisis
hasil penambatan menunjukkan perbedaan residu yang berinteraksi (Tabel 4.2).
ER1 ER2 ER3 ER4 ER5
ER6 ER7 ER8 ER9 ER10
Gambar 4.3 Formasi hasil penambatan exenatide (merah) dengan GLP-1R
(biru)
18
Tabel 4.2 Analisis hasil penambatan protein hormon exenatide dengan GLP-1R
ER1 ER2 ER3 ER4 ER5 ER6 ER7 ER8 ER9 ER10
Rata-rata jumlah pasangan interaksi = 5,9 Rata-rata jarak terdekat setiap pasangan = 1,8297 Å
Catatan: asam amino di sebelah kiri dari masing-masing pasangan berasal dari protein exenatide dan asam amino sebelah kanan dari protein GLP-1R, interaksi hidrofobik (tanpa label), interaksi polar (garis bawah), jembatan garam (asteriks)
Hasil analisis masing-masing formasi penambatan menunjukkan bahwa ada dua residu protein exenatide yang sangat aktif melakukan interaksi dengan
GLP-1R, yaitu S39 yang muncul di kesepuluh formasi penambatan dan F22 yang muncul di 9 formasi penambatan. Residu lain yang dapat dikategorikan aktif berinteraksi adalah E15 yang teridentifikasi di 6 formasi penambatan, dan P31 yang muncul di 5 formasi penambatan. Sedangkan V19 dan P37 masing-masing muncul dalam 4 formasi penambatan. Aktivitas yang tinggi ditunjukkan oleh residu S39 yang muncul di semua formasi penambatan, hal ini menunjukkan pentingnya residu S39 dalam interaksi antara protein exenatide dengan GLP-1R. Demikian juga dengan
residu F22, memiliki peranan besar dalam interaksi ligand-reseptor. Pada protein GLP-1R, hasil yang tidak jauh berbeda dengan hasil penambatan antara GLP-1 dengan GLP-1R didapat, yaitu residu F80 termasuk paling aktif dengan muncul pada 7 formasi penambatan, D122 muncul pada 5 formasi penambatan. Sedangkan E68, L111 dan W120 masing-masing muncul dalam 4 pasangan penambatan. Formasi ER1 diidentifikasi memiliki pasangan residu aktif paling banyak dibandingkan dengan formasi penambatan yang lain.
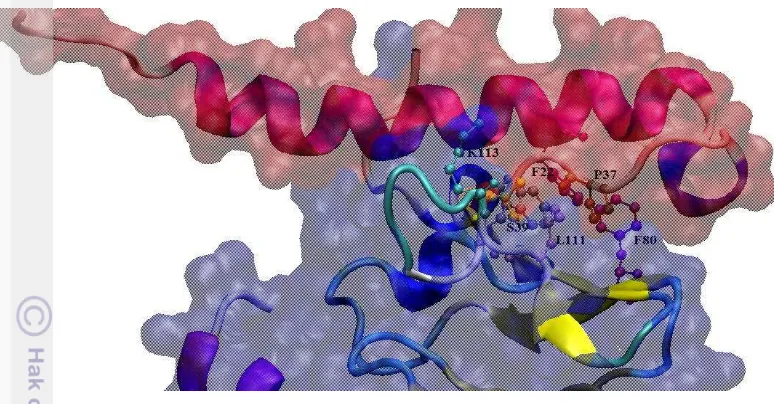
Pada formasi penambatan ER1, teridentifikasi 9 pasangan interaksi dan 7 diantaranya melibatkan asam amino aktif baik dari molekul protein exenatide
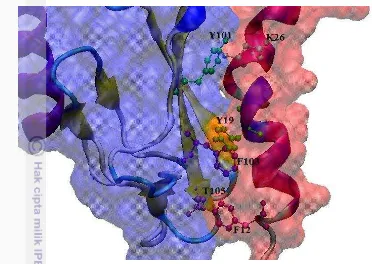
maupun dari molekul protein GLP-1R. Pasangan interaksi dari residu yang kurang aktif adalah P37-F103 dan pasangan S39-K113. Residu yang paling aktif berinteraksi, S39 terlihat berinteraksi dengan K113 dan W120 (Gambar 4.4). F22 berinteraksi dengan F80 dan W120, sedangkan P37 berinteraksi dengan L111 dan F103. Keseluruhan pasangan residu ini melibatkan residu non polar hydrophobic,
kecuali S39 yang bersifat polar berinteraksi dengan W120 yang juga bersifat polar. Diduga interaksi Van der Waals S39 dengan W120 lebih kuat dari pada pasangan yang lain, namun masih perlu dibuktikan lebih lanjut melalui simulasi dinamika molekul. Hasil analisis VMD tidak menemukan ikatan hidrogen antara protein
exenatide dengan protein GLP-1R dan ditemukan satu jembatan garam antara
residu E15 pada exenatide dengan R121 pada GLP-1R. Residu E15 merupakan
salah satu residu yang aktif berinteraksi karena juga muncul pada formasi penambatan yang lain, namun interaksi yang berupa jembatan garam hanya dapat diidentifikasi pada formasi penambatan ER3 dan ER9 dimana di kedua formasi ini E15 berinteraksi dengan R40. Sedangkan interaksi dengan R121 hanya diidentifikasi pada formasi penambatan ER1. Peranan jembatan garam dalam menstabilkan interaksi ligand-reseptor dapat dilihat pada analisis hasil simulasi
19
Gambar 4.4 Interaksi antar asam amino pada hasil penambatan protein
exenatide dan GLP-1R formasi ER1
Berbeda dengan GLP-1 dan exenatide, struktur protein liraglutide dimulai
dari H7 sampai G37 serta terdiri dari dua alpha-helix yang dihubungkan oleh koil yang tersusun dari residu G22, Q23 dan A24. Hasil penambatan antara liraglutide
dan protein trans-membran GLP-1R diberi label LR1 (liraglutide– reseptor), LR2
dan seterusnya. Seperti halnya dua protein sebelumnya yaitu GLP-1 dan exenatide,
protein liraglutide menambat pada protein reseptor GLP-1R pada lokasi penambatan yang berbeda-beda, residu liraglutide yang berinteraksi juga berbeda
sehingga dihasilkan sepuluh formasi penambatan yang berbeda (Gambar 4.5). Analisis terhadap ke-sepuluh formasi penambatan liraglutide pada GLP-1R
menunjukkan adanya variasi yang cukup besar antara masing-masing hasil penambatan (Tabel 4.3). Formasi penambatan LR1 dan LR7 hanya memiliki 6 pasangan interaksi, sedangkan formasi penambatan LR6 dan LR10 memiliki 14 pasangan interaksi. Interaksi yang terbentuk antara protein liraglutide dengan
protein GLP-1R didominasi oleh interaksi polar, antara residu yang bersifat polar atau yang terpolarisasi.
LR1 LR2 LR3 LR4 LR5
LR6 LR7 LR8 LR9 LR10
Gambar 4.5 Formasi hasil penambatan liraglutide (merah) dengan GLP-1R
20
Tabel 4.3 Analisis hasil penambatan protein hormon liraglutide dengan GLP-1R
LR1 LR2 LR3 LR4 LR5 LR6 LR7 LR8 LR9 LR10 Rata-rata jumlah pasangan interaksi = 9,1
Rata-rata jarak terdekat setiap pasangan = 1,94739 Å
Catatan: asam amino di sebelah kiri dari masing-masing pasangan berasal dari protein liraglutide dan asam amino sebelah kanan dari protein GLP-1R, interaksi hidrofobik (tanpa label), interaksi polar (garis bawah), jembatan garam (asteriks)
Proses penambatan antara protein liraglutide dengan GLP-1R tidak
menunjukkan kecenderungan adanya binding site yang tetap. Binding site pada
GLP-1R dari 10 formasi penambatan yang diamati menyebar di beberapa tempat, namun ada dua residu yang diidentifikasi cukup aktif menjalin interaksi, yaitu residu F80 dan Y101. Kedua residu ini berperan dalam menjalin interaksi pada 5 formasi penambatan. Di luar kedua residu tersebut, tidak ditemukan residu yang cukup menonjol dalam berinteraksi dengan protein ligand dalam hal ini liraglutide.
Sebaliknya pada protein liraglutide, ditemukan beberapa residu yang cukup aktif
dalam menjalin interaksi dengan reseptor; Y19 ditemukan di 9 formasi penambatan, F12 dan F28 muncul di 8 formasi penambatan, A25 muncul dalam 6 formasi penambatan, sedangkan D15 dan W31 ditemukan di 5 formasi penambatan. Ketiadaan binding site yang tetap menyebabkan sulitnya memilih satu formasi
penambatan yang paling disukai untuk dilakukan tahapan penelitian berikutnya. Formasi penambatan LR1 dipilih karena meskipun jumlah pasangan residu yang berinteraksi tidak banyak namun jumlah pasangan residu aktifnya relatif lebih banyak dibandingkan formasi penambatan yang lain .
Pada formasi penambatan LR1 ditemukan 6 pasangan interaksi dan ke-enam pasangan interaksi tersebut seluruhnya melibatkan residu aktif baik dari protein
liraglutide maupun protein GLP-1R. Lima residu liraglutide yang sangat aktif
melakukan interaksi yaitu F12, D15, Y19, A25, dan F28 dapat ditemukan pada formasi penambatan ini, demikian juga dua residu aktif dari protein GLP-1R yaitu F80 dan Y101 juga ditemukan pada formasi penambatan ini. Karena hanya enam residu liraglutide yang teridentifikasi berinterikasi dengan GLP-1R pada formasi
LR1, maka tidak keseluruhan molekul protein liraglutide menambat atau
berimpitan pada protein GLP-1R. Area interaksi terlihat hanya pada sebagian kecil molekul liraglutide (Gambar 4.6). Hal ini berbeda dengan formasi penambatan
GLP-1 dan GLP-1R, dimana hampir sepanjang molekul GLP-1 berimpitan dengan GLP-1R. Belum ada penelitian yang mengaitkan jumlah pasangan interaksi dengan kekuatan interaksi, untuk itu akan dilakukan analisis lebih lanjut terhadap afinitas
liraglutide terhadap GLP-1R dari hasil simulasi dinamika molekul terutama
21
Gambar 4.6 Interaksi antar asam amino pada hasil penambatan protein
liraglutide dan GLP-1R formasi penambatan LR1
Setelah membandingkan formasi penambatan dari tiga pasangan ligan-reseptor yaitu: GLP-1 dengan GLP-1R, exenatide dengan GLP-1R dan liraglutide
dengan GLP-1R, ditemukan bahwa binding site terletak pada daerah residu F80
sampai residu E125 dengan pemeran utama F80, Y101, D122 dan W120 yang aktif melakukan interaksi (Gambar 4.7). Pada beberapa formasi, daerah penambatan dapat diperluas dari E68 sampai E128. Hasil ini sejalan dengan penelitian sebelumnya bahwa binding site GLP-1R berada pada daerah E68-E128 (Runge et al, 2008). Residu F103, L111, D122 dan E125 memiliki keaktifan interaksi yang
mendukung terbentuknya binding site di area ini.
22
Visualisasi VMD dengan metode penggambaran surface menunjukkan
bahwa residu F80, Y101 dan W120 membentuk semacam celah yang menjadikannya sebagai lokasi yang tepat untuk berikatan. Residu-residu ini terletak pada struktur betha-sheet sehingga memberikan permukaan yang luas bagi protein
lain yang akan berikatan. Dengan struktur ini memungkinkan protein ligand untuk berikatan dengan residu lain selain ketiga residu di atas. Ditinjau dari sifatnya, Fenilalanina dan Leusina adalah asam amino yang bersifat non-polar hydrophobic,
Triptofan adalah asam amino non-polar namun memiliki kecenderungan polar, Tirosina adalah asam amino polar sedangkan asam aspartat dan asam glutamat memiliki muatan negatif. Dengan melihat sifat residu aktif ini, interaksi yang dapat terbentuk adalah interaksi Van der Waals, interaksi hidrofobik, jembatan garam dan ikatan hidrogen. Hasil analisis VMD tidak menemukan adanya ikatan hidrogen antara ligand dengan reseptor dan hanya ditemukan satu jembatan garam antara protein exenatide dengan GLP-1R yaitu antara E15 dengan R121. R121 bukan
residu yang aktif berinteraksi meskipun berada pada daerah binding site, untuk itu
analisis lebih lanjut difokuskan pada interaksi Van der Waals dan interaksi hidrofobik dalam simulasi dinamika molekul.
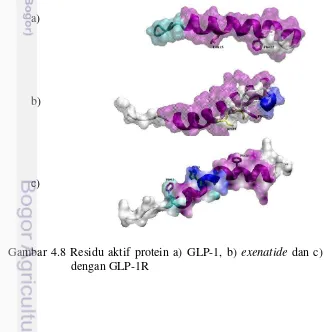
Pada protein ligand GLP-1, binding site berada pada residu L12 sampai residu
F22, dengan pemeran utama L14, Q17, A18 dan F22. GLP-1 memiliki 30 asam amino, residu L14 sampai F22 terletak pada struktur alpha-helix pada bagian tengah asam amino. Hasil visualisasi memperlihatkan bahwa residu L14 dan F22 lebih menonjol dibandingkan permukaan yang lain, hal ini menyebabkan kedua residu ini mampu memasuki celah pada molekul protein GLP-1R dan menjalin interaksi (Gambar 4.8). Morfologi residu fenilalanina yang memanjang membentuk tonjolan pada permukaan molekul sehingga memudahkan residu tersebut untuk memasuki celah atau kantong pada molekul reseptor, seperti terlihat pada F22 dari exenatide,
F12 dan F28 dari liraglutide (Gambar 4.8).
a)
b)
c)
Gambar 4.8 Residu aktif protein a) GLP-1, b) exenatide dan c) liraglutide
23
Protein exenatide memiliki 39 asam amino dari H1 sampai S39. Binding site
berada pada residu P22 sampai S39 dengan pemeran utama P22 dan S39, residu lain yang juga berperan aktif adalah P31 dan P37. Yang menarik dari exenatide
adalah residu kunci yang paling aktif berinteraksi, S39, dan residu P31 dan P37 terletak pada rantai tambahan atau rantai terakhir. Sedangkan asam amino pada rantai awal exenatide tidak terlalu berperan dalam menjalin interaksi dengan protein
GLP-1R. Hal ini menunjukkan bahwa penambahan rantai pada exenatide berperan
penting dalam afinitas protein ini dengan reseptornya. Pada Gambar 4.8.b terlihat bahwa residu P22, P37 dan S39 membentuk tonjolan untuk berinteraksi dengan molekul lain.
Protein liraglutide memiliki 31 asam amino dari H7 sampai G37. Binding site berada pada residu F12 sampai F28 dengan pemeran utama F12, Y19 dan F28.
Apabila penomoran disamakan dengan penomoran residu GLP-1 dan exenatide,
maka pemeran utama interaksi ligand-reseptor adalah F6, Y13 dan F22. Residu F6
dan Y13 berada pada rantai awal protein liraglutide. Yang menarik adalah liraglutide memiliki kemiripan 95% dengan GLP-1, namun memiliki karakteristik
penambatan yang berbeda dengan GLP-1. Penggantian residu K28 dengan arginina, penambahan residu glisina pada akhir rantai serta asam lemak C-16 pada residu K16 berpengaruh besar terhadap proses penambatan dan interaksinya dengan
protein GLP-1R.
Perbandingan posisi binding site pada ketiga protein tersebut menunjukkan
hasil yang menarik. Binding site protein GLP-1 berada di tengah rantai, analog GLP-1 yang mendapatkan rantai tambahan yaitu exenatide memiliki binding site di
ujung rantai, sedangkan analog GLP-1 yang menggandeng asam lemak C-16 yaitu liraglutide memiliki binding site di awal rantai. Temuan lain yang menarik adalah residu F22 berperan penting dalam binding site di ketiga protein tersebut. Hal ini
penting karena salah satu residu yang juga berperan penting dalam binding site
GLP-1R adalah fenilalanina, selain itu triptofan dan tirosina. Gambar 4.9 berikut menunjukkan kemiripan morfologi antara ketiga residu ini. Ketiganya memiliki struktur yang memanjang sehingga memudahkan molekul protein ini terinduksi dari non-polar menjadi polar dibandingkan dengan protein yang berbentuk bola atau persegi. Sifat ini sangat diperlukan dalam membangun interaksi Van der Waals dengan molekul lain. Residu lain yang menjadi pemeran utama penambatan pada molekul exenatide, S39, bersifat polar sehingga struktur morfologi tidak
berpengaruh terhadap kemampuannya berinteraksi dengan molekul lain. a) b) c)
24
Analisis simulasi dinamika molekul
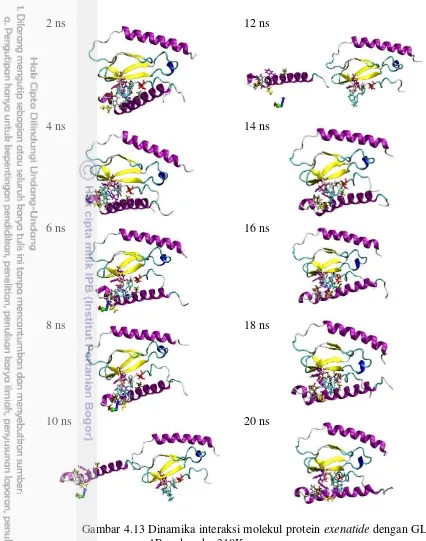
Formasi penambatan yang telah terpilih dari masing-masing pasangan kemudian disimulasikan pada suhu tubuh yaitu 310K selama 20 ns untuk melihat kestabilan interaksi antara kedua molekul protein. Analisis simulasi dinamika molekul yang pertama dilakukan adalah melihat dinamika RMSD selama trajectory
20 ns. Apabila ditemukan perubahan RMSD lebih dari 3Å maka diasumsikan telah terjadi perubahan konformasi molekul, dalam hal ini terjadi perubahan konformasi penambatan.
Dinamika RMSD ketiga pasangan interaksi selama trajectory menunjukkan perbedaan yang cukup signifikan (Gambar 4.10). RMSD formasi penambatan molekul GLP-1 dan GLP-1R ditunjukkan oleh grafik WR1. Selama trajectory 20
ns, terjadi fluktuasi RMSD yang tidak terlalu signifikan dan tidak lebih dari 3Å, sehingga disimpulkan tidak terjadi perubahan formasi penambatan pada interaksi GLP-1 dengan GLP-1R. RMSD formasi penambatan exenatide dengan GLP-1R
ditunjukkan oleh grafik ER1. Pada grafik tersebut, terlihat adanya peningkatan yang cukup signifikan pada RMSD sebesar lebih dari 10Å pada frame ke 5000 atau
setelah 10 ns, kemudian turun lagi dan terjadi lagi peningkatan RMSD sehingga mencapai lebih dari 20Å setelah 11 ns. Peningkatan RMSD yang cukup siginifikan juga terlihat pada pasangan interaksi liraglutide dengan GLP-1R yang ditunjukkan
oleh grafik LR1. Setelah kurang lebih 15 ns, RMSD mengalami peningkatan sehingga mencapai nilai lebih besar dari 15Å dan terus mengalami fluktuasi sampai menjelas 18 ns. Berdasarkan analisis terhadap dinamika RMSD ini dapat disimpulkan telah terjadi perubahan formasi penambatan pada pasangan exenatide
dan GLP-1R serta pasangan liraglutide dan GLP-1R.
Untuk memperkuat kesimpulan di atas, maka dilihat visualisasi masing-masing formasi penambatan dengan menggunakan VMD. Formasi penambatan WR1 antara GLP-1 dengan GLP-1R dapat dilihat pada Gambar 4.2. Dinamika
0 5 10 15 20 25
0 2000 4000 6000 8000 10000
RMSD
(Å)
waktu ( x 1/500 ns) WR1
ER1
LR1
25 interaksi antara ligan dalam hal ini GLP1 dan reseptornya (GLP-1R) selama
trajectory cukup stabil (Gambar 4.11). Terlihat ikatan antara molekul protein
GLP-1 dan protein GLP-GLP-1R stabil. Tidak ada pergerakan residu yang cukup signifikan dan merubah formasi penambatan. Pergerakan kecil terlihat dilakukan oleh residu Q17 dan E21, setelah 8 ns kedua residu tersebut menjauh dari pasangannya yaitu F80 dan L111. Pada 12 ns, kedua residu tersebut kembali ke posisi awal. Secara umum dapat dikatakan interaksi antara GLP-1 dan GLP-1R stabil dalam kurun waktu 20ns pada suhu 310K. Analisis terhadap radius antar residu pada masing-masing pasangan interaksi selama trajectory mendukung kesimpulan ini (Gambar
4.12).
2 ns 12 ns
4 ns 14 ns
6 ns 16 ns
8 ns 18 ns
10 ns 20 ns
26 a)
b)
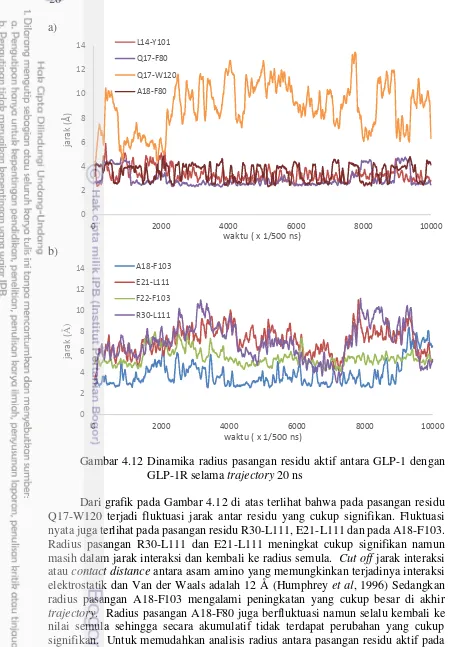
Gambar 4.12 Dinamika radius pasangan residu aktif antara GLP-1 dengan GLP-1R selama trajectory 20 ns
Dari grafik pada Gambar 4.12 di atas terlihat bahwa pada pasangan residu Q17-W120 terjadi fluktuasi jarak antar residu yang cukup signifikan. Fluktuasi nyata juga terlihat pada pasangan residu R30-L111, E21-L111 dan pada A18-F103. Radius pasangan R30-L111 dan E21-L111 meningkat cukup signifikan namun masih dalam jarak interaksi dan kembali ke radius semula. Cut off jarak interaksi
atau contact distance antara asam amino yang memungkinkan terjadinya interaksi
elektrostatik dan Van der Waals adalah 12 Å (Humphrey et al, 1996) Sedangkan
radius pasangan A18-F103 mengalami peningkatan yang cukup besar di akhir
trajectory. Radius pasangan A18-F80 juga berfluktuasi namun selalu kembali ke
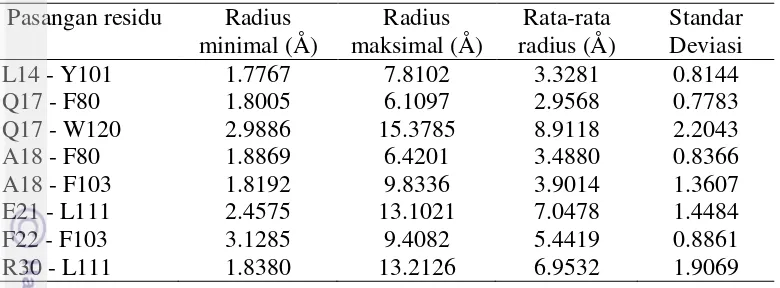
nilai semula sehingga secara akumulatif tidak terdapat perubahan yang cukup signifikan. Untuk memudahkan analisis radius antara pasangan residu aktif pada interaksi GLP-1 dengan GLP-1R, disusun ringkasan statistik jarak antara residu dari ke-8 pasangan yang meliputi radius terpendek, terjauh dan rata-rata serta standar deviasi ( Tabel 4.4).
0 2000 4000 6000 8000 10000
ja
0 2000 4000 6000 8000 10000