UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH WAKTU DAN TEMPERATUR
PENYIMPANAN TERHADAP TINGKAT
DEGRADASI KADAR AMOKSISILIN DALAM
SEDIAAN SUSPENSI AMOKSISILIN
–
ASAM
KLAVULANAT
SKRIPSI
ADINA SITI MARYAM TALOGO
1110102000068
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UIN SYARIF HIDAYATULLAH JAKARTA
PENGARUH WAKTU DAN TEMPERATUR
PENYIMPANAN TERHADAP TINGKAT
DEGRADASI KADAR AMOKSISILIN DALAM
SEDIAAN SUSPENSI AMOKSISILIN
–
ASAM
KLAVULANAT
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
ADINA SITI MARYAM TALOGO
1110102000068
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah benar hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk telah saya nyatakan benar.
Nama : Adina Siti Maryam Talogo NIM : 1110102000068
Tanda tangan :
iv
HALAMAN PERSETUJUAN PEMBIMBING
Nama : Adina Siti Maryam Talogo
NIM : 1110102000068
Program Studi : Farmasi
Judul Proposal : Pengaruh Waktu dan Temperatur Penyimpanan Terhadap Tingkat Degradasi Kadar Amoksisilin dalam Sediaan Suspensi Amoksisilin – Asam Klavulanat
Disetujui oleh
Pembimbing I Pembimbing II
Drs. Umar Mansur, M.Sc., Apt. Nelly Suryani, Ph.D., Apt. NIP. 196510242005012001
Mengetahui,
Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
v
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Adina Siti Maryam Talogo
NIM : 1110102000068
Program Studi : Farmasi
Judul Skripsi : Pengaruh Waktu dan Temperatur Penyimpanan Terhadap Tingkat Degradasi Kadar Amoksisilin dalam Sediaan Suspensi Amoksisilin – Asam Klavulanat
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing 1 : Drs. Umar Mansur, M.Sc., Apt. ( )
Pembimbing 2 : Nelly Suryani, Ph.D., Apt. ( )
Penguji 1 : Supandi, M.Si., Apt. ( )
Penguji 2 : Yuni Anggraeni, M.Farm., Apt. ( )
Ditetapkan di Tanggal
vi
UIN Syarif Hidayatullah Jakarta ABSTRAK
Nama : Adina Siti Maryam Talogo
Program Studi : Farmasi
Judul Proposal : Pengaruh Waktu dan Temperatur Penyimpanan Terhadap Tingkat Degradasi Kadar Amoksisilin dalam Sediaan Suspensi Amoksisilin – Asam Klavulanat
Sediaan suspensi amoksisilin-asam klavulanat merupakan obat lini pertama pada daftar obat esensial untuk pengobatan infeksi yang disebabkan oleh beta-laktamase mikroorganisme. Pada penggunaan terapi tunggal amoksisilin sering ditemukan kasus resistensi, untuk menghindari terjadinya resistensi dan memperpanjang kerja terapi amoksisilin, amoksisilin sering dikombinasikan dengan asam klavulanat yang merupakan beta-laktamase inhibitor sehingga dapat memperpanjang kerja terapi dari amoksisilin. Stabilitas zat aktif dalam sediaan sangat penting untuk diperhatikan, dengan adanya penambahan air pada sediaan suspensi amoksisilin-asam klavulanat akan mempengaruhi stabilitas amoksisilin yang terkandung didalamnya. Reaksi hidrolisis merupakan salah satu reaksi kimia yang kemungkinan besar akan terjadi selama masa penyimpanan sediaan suspensi, di mana reaksi ini akan menyebabkan terjadinya degradasi kadar amoksisilin. Waktu dan temperatur penyimpanan mempengaruhi tingkat degradasi amoksisilin dalam sediaan suspensi. Pada penelitian ini, persentase kadar amoksisilin dalam sediaan diukur dengan menggunakan metode HPLC berasaskan USP 30 dengan cara reverse phase; fase gerak yang digunakan Buffer fosfat : Metanol HPLC 95:5 pH 4,4 menggunakan kolom C18 (4mm x 30 cm, 2-10µm), laju alir 2ml/min, panjang gelombang 220 nm. Suspensi amoksisilin-asam klavulanat disimpan dalam suhu kamar (27-29oC) dan suhu kulkas (4-8oC) selama 7 hari. Persen degradasi kadar amoksisilin dalam suhu kamar (27-29oC) hari ke - 0, 3, 5, dan 7 sebagai berikut; 0 %, 55,05 %, 56,36 %, 56,58 %, sedangkan dalam suhu kulkas (4-8oC) sebagai berikut 0%, 1,46%, 5,22%, 10,9%. Kadar amoksisilin pada sediaan suspensi amoksisilin-asam klavulanat yang disimpan selama 5 hari dalam suhu kulkas (4-8oC) masih dapat diterima, sesuai dengan ketentuan kadar zat aktif dalam sediaan. Amoksisilin lebih stabil bila disimpan dalam temperatur rendah dibandingkan temperatur tinggi.
Kata Kunci : Suspensi amoksisilin – asam klavulanat, amoksisilin, stabilitas,
vii
Storage towards Degradation Level of Amoxicillin Concentration in Amoxicillin – Clavulanic Acid Suspension
Amoxicillin – clavulanic acid suspension is first choice in drug of essential drugs list for infection therapy caused by betalactamase microorganism. Generally, people have been resistant to amoxicillin, so by combining clavulanic acid which is betalactamase inhibitor can extend the therapy effect of amoxicillin. It is very important to maintain the stability of the active ingredient in suspension, the addition of water in suspension will affect the stability of amoxicillin in it. There will be hydrolysis reaction that will cause degradation of amoxicillin concentration. In this research, there is influence of time and temperature of storage in maintaining amoxicillin concentration. This research used HPLC method to obtain amoxicillin concentration in specific time and temperature storage, based on USP 30th Edition in reverse phase; by using buffer phosphate and methanol with ratio 95:5 and pH 4,4 as mobile phase; C18 column (4mm x 30 cm, 2-10µm); flow rate 2 ml/min; λ 220 nm. Amoxicillin – clavulanic acid stored in room temperature (27-29 oC) and refrigerator temperature (4-8oC) for seven days. Percentage of degradation of amoxicillin concentration at room temperature (27-29 oC) from 0, 3, 5, and 7 days; 0 %, 55,05 %, 56,36 %, 56,58 %. Meanwhile, percentage of degradation of amoxicillin concentration at refrigerator temperature (4-8oC) are 0%, 1,46%, 5,22%, 10,9%. Amoxicillin concentration in amoxicillin-clavulanic acid suspension which was stored for five days at refrigerator temperature (4-8oC) was accepted according to standard regulation of suspension. Amoxicillin is more stable if stored in low temperature than high temperature.
viii
UIN Syarif Hidayatullah Jakarta KATA PENGANTAR
Alhamdulillahirabbil’alamiin, segala puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini hingga selesai. Penulisan
skripsi yang berjudul “Pengaruh Waktu Dan Temperatur Penyimpanan Terhadap Tingkat Degradasi Kadar Amoksisilin Dalam Sediaan Suspensi Amoksisilin – Asam Klavulanat” bertujuan untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Neger Syarif Hidayatullah Jakarta.
Pada kesempatan ini penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini, sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, saya mengucapkan terim kasih dan penghargaan sebesar-besarnya kepada :
1. Drs. Umar Mansur, M.Sc., Apt dan Nelly Suryani, PhD., Apt., selaku dosen pembimbing yang telah banyak memberikan bimbingan, waktu, tenaga, saran, dan dukungan dalam penelitian ini.
2. Prof. Dr. (hc) dr. M.K. Tadjudin, Sp. And, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Neger Syarif Hidayatullah Jakarta.
3. Drs. Umar Mansur, M.Sc., Apt. Selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
4. Seluruh dosen di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
5. Kedua orang tua, Ayahanda tersayang Amorn Sudarno Talogo dan
ix
UIN Syarif Hidayatullah Jakarta
6. Kedua adik jagoanku Aditya Rama Talogo dan Adikemal Aliyy Talogo yang telah memberikan doa, dukungan, dan semangat sehingga penelitian ini dapat berjalan dengan lancar
7. Kakak bimbingan penelitian Gian Pertela, S.Far dan Rani Hestiningrum, A.Ma atas ilmu, tenaga, kerjasama, dan dukungannya selama penelitian hingga terselesaikan penelitian ini
8. Seluruh keluarga besar Prodi Farmasi FKIK yang telah memberikan kesempatan dan kemudahan untuk melakukan penelitian serta dukungan yang amat besar. yang selalu ada, bertukar fikiran, dan saling membantu satu sama lain. 12.Teman-teman ETD-TED keluarga keduaku dari bangku SMA sampai
sekarang yang selalu membuat hati ini ceria, yang telah memberikan dukungan, semangat, dan doanya. Semoga kalian semua tanpa terkecuali selalu dalam lindungan Allah SWT.
13.Teman-teman seperjuangan “Andalusia” Farmasi UIN 2010 atas kebersamaan kita.
14.Teman-teman PSM UIN Jakarta sebagai mood booster di kala suntuk organisasi ini selalu membuat mood menjadi semangat lagi, terimakasih atas dukungan dan semangat kalian.
x
UIN Syarif Hidayatullah Jakarta
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya. Akhir kata, penulis berharap Allah SWT berkenan membalas segala kebaikan semua pihak yang telah membantu saya dalam penelitian ini.
xi
UIN Syarif Hidayatullah Jakarta HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS
AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya bertanda tangan di bawah ini :
Nama : Adina Siti Maryam Talogo
NIM : 1110102000068
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan (FKIK) Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul
PENGARUH WAKTU DAN TEMPERATUR PENYIMPANAN TERHADAP TINGKAT DEGRADASI KADAR AMOKSISILIN DALAM
SEDIAAN SUSPENSI AMOKSISILIN – ASAM KLAVULANAT
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta
Dengan demikian persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada Tanggal : 8 Juli 2014
Yang menyatakan,
xii
UIN Syarif Hidayatullah Jakarta DAFTAR ISI
HALAMAN JUDUL ...
HALAMAN PERNYATAAN ORISINALITAS ...
HALAMAN PERSETUJUAN PEMBIMBING ...
LEMBAR PENGESAHAN SKRIPSI ...
ABSTRAK ...
ABSTRACT ...
KATA PENGANTAR ...
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ...
DAFTAR ISI ... 2.3.2. Suspensi Oral Antibiotik ... 2.3.3. Suspensi Oral Amoksisilin – Asam Klavulanat ... 2.4. Stabilitas Obat ... 2.4.1. Degradasi Kimia ... 2.4.2. Degradasi Fisika ... 2.5. Kromatografi Cair Kinerja Tinggi (KCKT) ...
xiii
UIN Syarif Hidayatullah Jakarta
2.5.1. Pengertian Umum ... 2.5.1.1. Jenis Kromatografi Cair Kinerja Tinggi ... 2.5.1.2. Proses Pemisahan dalam Kolom KCKT ... 2.5.1.3. Instrumen KCKT ... 2.5.2. Penentuan Kadar Amoksisilin ...
BAB 3 METODOLOGI PENELITIAN ... 3.3.2. Penentuan λ Maksimum Amoksisilin dan
Asam Klavulanat ...
3.3.3. Pembuatan Kondisi Optimum HPLC... 3.3.4. Pembuatan Kurva Kalibrasi... 3.3.5. Uji Kesesuaian Sistem ... 3.3.6. Pengamatan Kualitatif ... 3.3.7. Analisa Degradasi Kadar Amoksisilin dan
Asam Klavulanat ...
BAB 4 HASIL DAN PEMBAHASAN ...
4.1 Penentuan Panjang Gelombang Maksimum ... 4.2 Pemilihan Fase Gerak dan Kondisi Optimum HPLC ... 4.3 Pembuatan Kurva Kalibrasi Amoksisilin ... 4.4 Uji Kesesuaian Sistem ... 4.5 Pengamatan Kualitatif ... 4.6 Pengukuran Kadar Amoksisilin dalam Sampel ...
xiv
UIN Syarif Hidayatullah Jakarta DAFTAR GAMBAR
Gambar 2.1. Struktur Amoksisilin Trihidrat ... Gambar 2.2. Jalur Hidrolisis cincin β-laktam pada rentang pH
netral-basa ... Gambar 2.3. Hidrolisis pada Gugus Ester ...
Gambar 2.4. Hidrolisis pada Gugus Amida ... Gambar 2.5. Instrumen Kromatografi Cair Kinerja Tinggi (KCKT) ... Gambar 4.1. Kurva Kalibrasi Amoksisilin ... Gambar 4.2. Sampel Uji pada Suhu Kamar (27-29oC) ... Gambar 4.3. Sampel Uji pada Suhu Kulkas (4-8oC) ... Gambar 4.4 Grafik Perbandingan Suhu Penyimpanan Terhadap Waktu
Penyimpanan ... Gambar 4.5 Pemecahan cincin β-laktam yang mengandung gugus amida
dan ester ... 7
9 13 13 15 22 25 25
29
xv
UIN Syarif Hidayatullah Jakarta DAFTAR TABEL
Tabel 2.1. Struktur Antibiotik golongan β-laktam... Tabel 4.1. Konsentrasi Amoksisilin dan Luas Area ... Tabel 4.2. Parameter Uji Kesesuaian Sistem ... Tabel 4.3. Persentase Kadar Amoksisilin pada Suhu Kamar 27-29oC ...
Tabel 4.4. Persentase Kadar Amoksisilin pada Suhu Kulkas 4-8oC ... Tabel 4.5. Analisis Statistik ANOVA Data Persentase Kadar
Amoksisilin Suhu Kamar 27-29oC... Tabel 4.6. Data Statistik Persentase Kadar Amoksisilin
Suhu Kamar 27-29oC ... Tabel 4.7.Analisis Statistik ANOVA Data Persentase Kadar
Amoksisilin Suhu Kulkas 4-8oC ... Tabel 4.8. Data Statistik Persentase Kadar Amoksisilin
Suhu Kulkas 4-8oC ... Tabel 4.9. Tabel Perbandingan Kadar Rata-Rata Amoksisilin pada
Suhu Kamar 27-29oC dan Suhu Kulkas 4-8oC ... Tabel 4.10. Persentase Tingkat Degradasi Kadar Amoksisilin pada
Suhu Kamar 27-29oC dan Suhu Kulkas 4-8oC ... 6
23 23 26 27
27
28
28
28
29
xvi
UIN Syarif Hidayatullah Jakarta DAFTAR LAMPIRAN
Lampiran 1. Alur Kerja ... Lampiran 2. Gambar Alat dan Bahan Penelitian ... Lampiran 3. Scanning Panjang Gelombang Maksimum Amoksisilin ... Lampiran 4. Scanning Panjang Gelombang Maksimum
Amoksisilin – Asam Klavulanat ... Lampiran 5. Kromatogram Standar Amoksisilin... Lampiran 6. Kromatogram Sampel Amoksisilin – Asam Klavulanat ... Lampiran 7. Perhitungan Persiapan Kurva Kalibrasi ... Lampiran 8. Perhitungan Preparasi Sampel ... Lampiran 9. Perhitungan Konsentrasi Akhir Amoksisilin ... Lampiran 10. Sertifikat Analisis Amoksisilin ... Lampiran 11. Hasil Uji Kesesuaian Sistem ...
37 38 39
xvii
UIN Syarif Hidayatullah Jakarta DAFTAR ISTILAH
AMRI-Study : Antimicrobial Resistance in Indonesia
HPLC : High Performance Liquid Chromatography
KCKT : Kromatografi Cair Kinerja Tinggi
1
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Penyakit infeksi merupakan salah satu masalah kesehatan masyarakat, khususnya di negara berkembang seperti Indonesia. Salah satu obat andalan untuk mengatasi masalah tersebut adalah antimikroba antara lain antibakteri/antibiotik, antijamur, antivirus, antiprotozoa. Antibiotik merupakan obat yang paling banyak digunakan pada infeksi yang disebabkan oleh bakteri (PERMENKES, 2011).
Intensitas penggunaan antibiotik yang relatif tinggi menimbulkan berbagai permasalahan dan merupakan ancaman global bagi kesehatan terutama resistensi bakteri terhadap antibiotik. Berdasarkan hasil penelitian yang dilakukan Antimicrobial Resistance in Indonesia (AMRIN-Study) membuktikan dari 2494 individu di masyarakat, 43% Escherichia coli
resisten terhadap berbagai jenis antibiotik antara lain; ampisilin (34%), kotrimoksazol (29%) dan kloramfenikol (25%) (PERMENKES, 2011).
Amoksisilin merupakan analog dari ampisilin. Antibiotik semisintetik berspektrum luas ini digunakan untuk mengobati berbagai infeksi pada anak-anak dan orang dewasa. Beberapa penyakit umum yang pengobatannya menggunakan amoksisilin meliputi; radang tenggorokan, infeksi telinga dan sinus, bakteri pneumonia, bronkitis, radang amandel, infeksi saluran kemih, dan penyakit lyme (Frynkewicz, 2013).
Antibiotik amoksisilin sering diresepkan untuk anak-anak dan cukup sering diresepkan untuk dewasa. Hal ini dianggap sebagai antibiotik spektrum luas karena mengobati infeksi yang disebabkan oleh berbagai bakteri baik gram positif maupun negatif (Frynkewicz, 2013).
Dalam mengurangi terjadinya resistensi amoksisilin, amoksisilin dikombinasikan dengan asam klavulanat. Asam klavulanat termasuk dalam
golongan inhibitor β-laktamase, dimana enzim β-laktamase bekerja dengan cara mendegradasi cincin β-laktam yang terdapat pada amoksisilin dan mengakibatkan amoksisilin ini tidak memiliki aktivitas antibakteri, sehingga
2
UIN Syarif Hidayatullah Jakarta
antibiotik amoksisilin dalam menyerang bakteri. Antibiotik amoksisilin dan asam klavulanat pertama kali ditemukan dan dikenal dengan nama Augmentin, digunakan dalam pengobatan infeksi pada bakteri yang
menghasilkan enzim β-laktamase. Kombinasi ini efektif dalam melawan bakteri Staphylococcus aureus, E.coli, K. Pneumonia, Enterobacter H (Alburyhi, 2013).
Mengetahui kadar antibiotik pada suatu sediaan termasuk dalam faktor-faktor yang harus dipertimbangkan pada penggunaan antibiotik. Sangat diperlukan untuk menetapkan jenis dan dosis antibiotik secara tepat. Agar dapat menunjukkan aktivitasnya sebagai bakterisida ataupun bakteriostatik. Semakin tinggi kadar antibiotik semakin banyak tempat ikatannya pada sel bakteri (PERMENKES, 2011).
Amoksisilin memiliki gugus cincin β-laktam yang berperan sebagai
antibakteri, akan tetapi cincin β-laktam ini mudah terhidrolisis. Dengan terjadinya hidrolisis maka kadar amoksisilin dalam sediaan dapat
terdegradasi. Sediaan amoksisilin yang beredar berupa tablet dan suspensi. Pada sediaan suspensi yang mengandung air dapat memungkinkan terjadinya hidrolisis. Hal ini menyebabkan amoksisilin dibuat dalam bentuk sediaan sirup kering, di mana sediaan akan dibuat suspensi ketika akan digunakan. Hal ini bertujuan untuk menjaga stabilitas zat aktif pada masa penyimpanan. Perubahan stabilitas zat aktif dengan adanya penurunan kadar dapat memproyeksikan kepada resistensi antibiotik.
Temperatur sangat mempengaruhi degradasi kimiawi, fisik, dan mikrobiologi. Degradasi kimia, seperti oksidasi atau hidrolisis dapat terjadi dengan meningkatnya temperatur. Keterangan bahwa sediaan disimpan dalam lemari es atau suhu kamar pada etiket menunjukkan bahwa temperatur penyimpanan sediaan juga mempengaruhi stabilitas zat aktif. Suspensi amoksisilin – asam klavulanat yang telah direkonstitusi dengan air suling, kadarnya dipengaruhi oleh peningkatan suhu (Alburyhi, 2013). Suspensi amoksisilin – asam klavulanat sangat stabil pada suhu di bawah 10oC dalam jangka waktu 7 hari. Dan kedua zat aktif ini tidak stabil pada suhu 30oC dan 40oC (Owusu, 2011).
3
UIN Syarif Hidayatullah Jakarta
dengan Owusu (2011) adalah temperatur yang digunakan, pada penelitian ini menggunakan temperatur kulkas (4-8oC) dan temperatur kamar (27-29oC). Sediaan suspensi digunakan sebagai objek penelitian, dilihat dari pemberian antibiotik amoksisilin yang sering diresepkan untuk anak-anak dalam bentuk sediaan suspensi (Frynkewicz, 2013). Temperatur penyimpanan yang digunakan adalah temperatur kulkas (4-8oC) dan kamar (27-29oC), pemilihan temperatur ini disesuaikan dengan temperatur penyimpanan obat yang umum di masyarakat. Dalam pengujian ini adanya tahap perubahan kadar zat aktif, membutuhkan metode analisis yang mempunyai selektivitas dan sensitifitas tinggi, dikarenakan banyaknya komponen lain yang terdapat dalam sediaan. Oleh karena itu dalam penelitian ini digunakan metode analisis dengan menggunakan Kromatografi Cair Kinerja Tinggi (KCKT).
1.2 Rumusan Masalah
1. Apakah ada pengaruh waktu 7 hari dalam penyimpanan terhadap persentase degradasi kadar amoksisilin dalam sediaan suspensi amoksisilin – asam klavulanat?
2. Apakah ada pengaruh temperatur kamar (27 – 29oC) dan refrigerator (4 – 8oC) dalam penyimpanan terhadap persentase degradasi kadar amoksisilin dalam sediaan suspensi amoksisilin – asam klavulanat?
1.3 Hipotesa
Adanya penurunan kadar amoksisilin dalam sediaan suspensi amoksisilin – asam klavulanat yang dipengaruhi oleh lama waktu penyimpanan
Adanya penurunan kadar amoksisilin dalam sediaan suspensi amoksisilin – asam klavulanat yang dipengaruhi oleh temperatur penyimpanan
1.4Tujuan Penelitian
4
UIIN Syarif Hidayatullah Jakarta
1.5 Manfaat Penelitian
Mengetahui berapa lama waktu dan temperatur penyimpanan pada sediaan suspensi amoksisilin – asam klavulanat yang efektif.
5
BAB 2
TINJAUAN PUSTAKA
2.1 Antibiotik β-laktam
Antibiotik adalah senyawa yang dihasilkan oleh berbagai jenis mikroorganisme (bakteri, fungi, aktinomisetes) yang menekan pertumbuhan mikroorganisme lainnya. Namun penggunaannya secara umum sering kali memperluas istilah antibiotik hingga meliputi senyawa antimikroba sintetik, seperti sulfonamida dan kuinolon (Goodman&Gilman, 2007).
Secara historis, klasifikasi senyawa antibiotik yang paling umum didasarkan pada struktur kimia dan mekanisme kerja yang diajukan sebagai berikut: (1) senyawa yang menghambat sintesis dinding sel bakteri; (2) senyawa yang bekerja langsung pada membran sel mikroorganisme, mempengaruhi permeabilitas dan menyebabkan
kebocoran senyawa-senyawa intraselular; (3) senyawa mempengaruhi fungsi subunit ribosom 30S atau 50S sehingga menyebabkan penghambatan sintesis protein yang reversibel; (4) senyawa yang berikatan dengan subunit ribosom 30S dan mengubah sintesis protein; (5) senyawa yang mempengaruhi metabolisme asam nukleat bakteri; (6) kelompok antimetabolit; (7) senyawa antivirus (Goodman&Gilman, 2007).
6
UIN Syarif Hidayatullah Jakarta
Mekanisme kerja dari antibiotik β-laktam dengan mengikat trans- penicillin-binding proteins (PBP) dan karboksipeptidase yang terdapat dalam formasi rantai peptidoglikan pada membran dalam bakteri. Hasil interaksi antara PBP dengan antibiotik β-laktam dapat mengganggu sintesis peptidoglikan, menghentikan pembelahan sel, dan sel mati. Ikatan antibiotik dengan PBP dipengaruhi oleh afinitas dari β-laktam terhadap active-site PBP. Dalam hal ini dapat diketahui bahwa yang memberikan aktivitas antibakteri dari antibiotik β-laktam adalah cincin β-laktam (Rubtsova, et.al. 2010).
Tabel 2.1. Struktur Antibiotik golongan β-laktam Sumber : Rubtsova, et.al. 2010
7
UIN Syarif Hidayatullah Jakarta
Struktur dasar penisilin, terdiri dari atas cincin tiazolidindion yang terhubung dengan cincin β-laktam, dan pada cincin ini berikatan suatu rantai samping. Inti penisilin sendiri merupakan syarat struktur utama yang diperlukan untuk aktivitas biologisnya; transformasi metabolik atau perubahan kimia pada bagian molekul ini menyebabkan hilangnya semua aktivitas antibakteri yang berarti (Goodman&Gilman, 2007).
Penisilin spektrum luas yaitu; ampisilin dan amoksisilin, aktif dalam melawan bakteri Gram positif yang tidak menghasilkan β-laktamase, dan karena obat tersebut berdifusi ke dalam bakteri Gram negatif lebih mudah, obat ini juga aktif melawan banyak strain Escherichia coli, Haemophilus influenzae, dan Salmonella. Untuk pemberian oral, amoksisilin merupakan obat pilihan karena diabsorpsi lebih baik daripada ampisilin, yang seharusnya diberikan secara parenteral. Amoksisilin dan ampisilin diinaktivasi oleh bakteri penghasil penisilinase. Organisme yang resisten terhadap amoksisilin meliputi sebagian besar Staphylococcus aureus, 50%
strain Escherichia coli, dan sampai dengan 15% strain Haemophilus influenzae (at a glance Farmakologi medis, 2005).
2.2 Amoksisilin
Gambar 2.1. Struktur Amoksisilin Trihidrat Sumber : Japanese Pharmacopoiea Ed.15
Nama Senyawa : Amoksisilin trihidrat
Nama IUPAC : Asam
(2S,5R,6R)-6-[(R)-(-)-2-amino-2-(p-hidroksifenil) asetamidol]-3,3-dimetil-7-okso-4-tia-1 azabisiklo[3,2,0]-heptana-2-karboksilat trihidrat [61336-70-7]
Berat Molekul : C16H19N3O5S.3H2O 419,45 Anhidrat [26787-78-0] 365,40
8
UIN Syarif Hidayatullah Jakarta
2.2.1 Pengertian Umum
Amoksisilin merupakan antibiotik dari penisilin semisintetik yang stabil dalam suasana asam, kerja bakterisida, atau pembunuh bakterinya seperti ampisilin. Amoksisilin dapat dirusak oleh β-laktamase sehingga amoksisilin tidak efektif untuk melawan bakteri yang memproduksi β -laktamase (Unal, 2008).
Amoksisilin diabsorbsi dengan cepat dan baik di saluran pencernaan,
tidak tergantung adanya makanan dalam lambung dan setelah 1 jam konsentrasinya dalam darah sangat tinggi sehingga efektivitasnya tinggi. Amoksisilin diekskresikan atau dibuang terutama melalui ginjal, dalam air kemih terdapat dalam bentuk aktif. Amoksisilin sangat efektif terhadap organisme gram positif dan gram negatif. Penggunaan amoksisilin seringkali dikombinasikan dengan asam klavulanat untuk meningkatkan potensi dalam membunuh bakteri (Junaidi, 2009).
Dosis : oral 3 dd 375-1000mg, anak-anak < 10 tahun 3 dd 10mg/kg, 3-10 tahun 3 dd 250 mg, 1-3 tahun 3 dd 125 mg, 0-1 tahun 3 dd 100 mg. Juga diberikan secara i.m/i.v (Tjay dan Kirana, 2002).
Kelarutan : Sukar larut dalam air dan metanol; tidak larut dalam benzena, dalam karbon tetraklorida dan dalam kloroform
Identifikasi : Spektrum serapan inframerah zat yang didispersikan dalam kalium bromida P menunjukkan maksimum hanya pada panjang gelombang yang sama seperti pada Amoksisilin BPFI
9
UIN Syarif Hidayatullah Jakarta
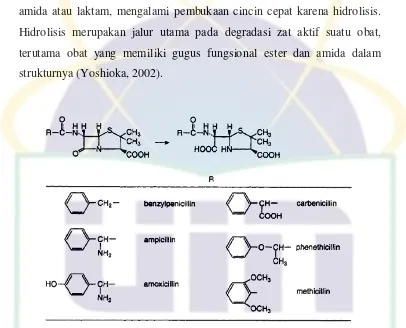
1.2.2 Stabilitas
Amoksisilin termasuk antibiotik β-laktam memiliki rantai siklik amida atau laktam, mengalami pembukaan cincin cepat karena hidrolisis. Hidrolisis merupakan jalur utama pada degradasi zat aktif suatu obat, terutama obat yang memiliki gugus fungsional ester dan amida dalam strukturnya (Yoshioka, 2002).
Gambar 2.2Jalur hidrolisis cincin β-laktam pada rentang pH netral-basa
Sumber : Stability of Drugs and Dosage Forms, 2002
2.3 Suspensi Amoksisilin – Asam Klavulanat 2.3.1 Sediaan Suspensi
Suspensi adalah sediaan cair yang mengandung partikel padat tidak larut yang terdispersi dalam fase cair. Sediaan yang digolongkan sebagai suspensi adalah sediaan seperti tersebut diatas, dan tidak termasuk kelompok suspensi yang lebih spesifik, seperti suspensi oral, suspensi topikal, dan lain-lain (FI IV, 1995).
Suspensi adalah sediaan yang mengandung bahan obat padat dalam bentuk halus dan tidak larut, terdispersi dalam cairan pembawa. Zat yang terdispersi harus halus, tidak boleh cepat mengendap, dan bila digojog perlahan-lahan, endapan harus segera terdispersi kembali (Moh.Anief, 1997).
10
UIN Syarif Hidayatullah Jakarta
pendispersi. Preparat oral dengan tipe ini, paling banyak medium dispersinya adalah air. Dispersi yang berisi partikel kasar, biasanya dengan ukuran 1 sampai 100 mikron, disebut juga sebagai dispersi kasar dan mencakup suspensi serta emulsi. Dispersi yang mengandung partikel dengan ukuran lebih kecil disebut dispersi halus dan bila partikel-partikel yang ada dalam batas koloid disebut dispersi koloid. Magma dan gel adalah dispersi halus seperti itu (Ansel, 1989).
Sesuai sifatnya, partikel yang terdapat dalam suspensi dapat mengendap pada dasar wadah bila didiamkan. Pengendapan seperti ini dapat mempermudah pengerasan dan pemadatan sehingga sulit terdispersi kembali, walaupun dengan pengocokan. Untuk mengatasi masalah tersebut, dapat ditambahkan zat yang sesuai untuk meningkatkan kekentalan dan bentuk gel suspensi seperti tanah liat, sufaktan, poliol, polimer atau gula. Yang sangat pening adalah bahwa suspensi harus dikocok baik sebelum digunakan untuk menjamin distribusi bahan padat
yang merata dalam pembawa, hingga menjamin keseragaman dan dosis yang tepat. Suspensi harus disimpan dalam wadah tertutup rapat (FI IV, 1995).
Suspensi dapat dibagi dalam 2 jenis, yaitu suspensi yang siap digunakan atau yang dikonstitusikan dengan sejumlah air untuk injeksi atau pelarut lain yang sesuai sebelum digunakan. Suspensi tidak boleh diinjeksikan secara intravena dan intratekal (FI IV, 1995).
Suspensi dalam bentuk serbuk kering awalnya menunjukkan bahwa zat aktif yang digunakan tidak stabil untuk disimpan dalam periode waktu tertentu dengan adanya pembawa air, lebih sering diberikan sebagai campuran serbuk sering untuk dibuat suspensi pada waktu akan diberikan (Ansel, 1989).
2.3.2 Suspensi Oral Antibiotik
Suspensi oral Antibiotik, kebanyakan bahan-bahan antibiotika tidak stabil bila berada dalam larutan, untuk waktu lama yang diinginkan dan oleh sebab itu dilihat dari stabilitias. Fase pendispersi dari suspensi
11
UIN Syarif Hidayatullah Jakarta
Sebagai seorang ahli farmasi penting untuk menambahkan secara tepat jumlah air yang ditetapkan untuk mencampurkan serbuk kering apabila ingin dihasilkan konsentrasi yang tepat per unit dosis. Juga penggunaan air murni lebih baik daripada air ledeng untuk menghindari penambahan pengotoran yang dapat merusak serta memberi efek kebalikan dari efek stabilitas sediaan yang dihasilkan. Ahli farmasi harus memberitahukan pasien mengenai sifat-sifat ini dan mengharuskannya untuk mengocok isinya baik-baik sesaat sebelum pemaikaian dan obat disimpan secara tepat (Ansel, 1989).
2.3.3 Suspensi Oral Amoksisilin – Asam Klavulanat
Kombinasi antibiotik oral yang mengandung amoksisilin dan asam klavulanat. Asam klavulanat adalah suatu betalaktam dengan struktur seperti penisilin yang dapat menon-aktifkan enzim-enzim betalaktamase yang biasa ditemukan pada mikroorganisme yang resisten terhadap
penisilin dan amoksisilin bekerja menghindarkan sintesa dinding sel kuman. Kombinasi ini dapat memperkuat kerjanya (potensiasi) dan menghambat terjadinya resistensi.
2.4 Stabilitas Obat
Stabilitas obat adalah kemampuan suatu produk untuk mempertahankan sifat dan karakteristiknya agar sama dengan yang dimilikinya pada saat diproduksi (identitas, kekuatan, kualitas, kemurnian) dalam batasan yang ditetapkan sepanjang periode penyimpanan dan penggunaan (shelf-life).
Stabilitas didefinisikan sebagai kemampuan suatu produk obat untuk bertahan dalam batas spesifikasi yang ditetapkan sepanjang periode penyimpanan dan penggunaan untuk menjamin identitas, kekuatan, kualitas dan kemurnian produk tersebut. Sediaan obat yang stabil adalah suatu sediaan yang masih berada dalam batas yang dapat diterima selama periode penyimpanan dan penggunaan, dimana sifat dan karakterisiknya sama dengan yang dimilikinya pada saat diproduksi.
12
UIN Syarif Hidayatullah Jakarta
Tujuan dari pengujian stabilitas adalah untuk memberikan bukti tentang bagaimana kualitas zat aktif atau produk farmasi dengan waktu yang bervariasi juga dibawah pengaruh berbagai faktor lingkungan seperti suhu, kelembaban, dan cahaya. Selain itu faktor yang terkait dalam stabilitas suatu produk misalnya sifat kimia dan fisik dari zat aktif maupun zat tambahan atau eksipien, bentuk sediaan dan komposisi, proses manufaktur, sifat wadah dan penutup, dan sifat-sifat kemasan bahan. Selain itu stabilitas eksipien yang mungkin mengandung atau membentuk produk degradasi reaktif, harus dipertimbangkan (WHO, 2009).
Beberapa efek tidak diinginkan yang potensial dari ketidakstabilan produk farmasi, yaitu : (Carstensen and Rhodes 2000)
1. Hilangnya zat aktif
2. Konsentrasi zat aktif meningkat 3. Bioavailability berubah
4. Hilangnya keseragaman kandungan
5. Menurunnya status mikrobiologis
6. Hilangnya elegansi produk dan ‘patient acceptability’ 7. Pembentukkan hasil urai yang toksik
8. Hilangnya kekedapan kemasan 9. Menurunnya kualitas label
10.Modifikasi faktor hubungan fungsional
Stabilitas obat perlu diperhatikan untuk mengurangi terjadinya penguraian pada zat yang terkandung dalam obat, sehingga tidak mencapai efek terapi atau memberikan efek lainnya. Terdapat beberapa jenis degradasi, yaitu; degradasi kimia, fisika, biologi, dan kombinasi.
2.4.1 Degradasi Kimia
Zat aktif yang digunakan sebagai obat-obatan memiliki struktur molekul yang beragam, oleh karena itu rentan terhadap banyak variabel dan jalur degradasi. Kemungkinan jalur degradasi meliputi hidrolisis, dehidrasi, isomerisasi, eliminasi, oksidasi, fotofegradasi, dan interaksi yang kompleks dengan eksipien dan obat-obatan lainnya. Hal ini akan sangat
13
UIN Syarif Hidayatullah Jakarta
Salah satu dari jalur degradasi kimia adalah hidrolisis. Pada sebagian besar produk parenteral, zat aktif dapat kontak dengan air dan bahkan sediaan dalam bentuk padat mengalami kelembaban, meskipun dalam jumlah yang rendah. Dengan demikian hidrolisis salah satu reaksi yang paling umum terlihat pada obat. Hidrolisis merupakan jalur utama degradasi suatu obat, terutama pada zat aktif yang memiliki gugus fungsional ester dan amida (Stability of Drugs and Dosage Forms, 2002).
Gambar 2.3. Hidrolisis pada gugus ester Sumber : Stability of Drugs and Dosage Forms, 2002
Gambar 2.4. Hidrolisis pada gugus amida
Sumber : Stability of Drugs and Dosage Forms, 2002
2.4.2 Degradasi Fisika
Komponen obat-obatan (zat aktif dan eksipien) yang ada di berbagai keadaan fisik mikroskopik dengan derajat yang berbeda dari pemerian. Contohnya adalah amorf dan berbagai kristal, terhdrasi, dan bagian
terlarut. Dengan waktu zat aktif atau eksipien mungkin berubah dari satu kondisi, dari yang tidak stabil atau metastabil menjadi kondisi stabil secara termodinamika. Tingkat konversi tergantung pada potensi kimia sesuai dengan perbedaan energi bebas antara kondisi dan hambatan energi yang
14
UIN Syarif Hidayatullah Jakarta
2.5 Kromatografi Cair Kinerja Tinggi (KCKT) 2.5.1 Pengertian Umum
Kromatografi merupakan teknik pemisahan satu atau lebih komponen dari suatu sampel yang dibawa fase gerak melewati fase diam (dapat berbentuk padat atau cairan). Kromatografi Cair Kinerja Tinggi (KCKT) atau High Performance Liquid Chromatography (HPLC) adalah kromatografi cair kolom modern, dimana teori dasarnya bukanlah baru tetapi hasil pengembangan dari kromatografi cair kolom klasik. Kemajuan dalam teknologi kolom, pompa tekanan tinggi dan detektor yang peka telah menyebabkan perubahan kromatografi kolom cair menjadi suatu sistem pemisahan yang cepat dan efisien. Pada KCKT diperkenalkan penggunaan fase diam yang berdiameter kecil dalam kolom yang efisien. Teknologi kolom partikel kecil (3-5 µm) ini memerlukan sistem pompa bertekanan tinggi yang mampu mengalirkan fase gerak dengan tekanan tinggi agar tercapai laju aliran 1-2ml/menit. Oleh karena sampel yang digunakan
sangat kecil (<20µg) maka diperlukan detektor yang sangat peka. Dengan teknologi ini, pemisahan berlangsung sangat cepat dengan daya pisah sangat tinggi (DepKes, 1995, Ditjen POM, 1993, Slamet Ibrahim, 1998).
KCKT merupakan metode yang sering digunakan untuk menganalisis senyawa obat. KCKT dapat digunakan untuk pemeriksaan kemurnian bahan obat, pengawasan proses sintesis dan pengawasan mutu (Quality Control) (Ahuja, 2005).
2.5.1.1 Jenis Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi (KCKT) dapat dibagi menjadi beberapa metode, yakni: kromatografi fase normal (normal phase chromatography), kromatografi fase balik (reversed-phase chromatography), kromatografi penukar ion (ion-exchange chromatography) dan kromatografi eksklusi ukuran (size-exclusion chromatography) (Kazakevich, 2007).
Kromatografi fase balik merupakan kebalikan dari kromatografi fase normal. Kromatografi fase balik menggunakan fase diam yang bersifat
15
UIN Syarif Hidayatullah Jakarta
Hampir 90% senyawa kimia dapat dianalisis dengan kromatografi jenis ini (Meyer, 2004; Kazakevich, 2007).
2.5.1.2 Proses Pemisahan dalam Kolom KCKT
Pemisahan analit dalam kolom kromatografi berdasarkan pada aliran fase gerak yang membawa campuran analit melalui fase diam dan perbedaan interaksi analit dengan permukaan fase diam sehingga terjadi perbedaan waktu perpindahan setiap komponen dalam campuran (Kazakevich, 2007).
Masuknya eluen yang baru ke dalam kolom akan menimbulkan kesetimbangan baru: molekul sampel dalam fase gerak diadsorpsi sebagian oleh permukaan fase diam berdasarkan pada koefisien distribusinya, sedangkan molekul yang sebelumnya diadsorpsi akan muncul kembali di fase gerak. Setelah proses ini terjadi berulang kali, kedua komponen akan terpisah. Komponen yang lebih suka dengan fase gerak akan berpindah
lebih cepat daripada komponen yang cenderung menetap di fase diam, sehingga komponen akan muncul terlebih dahulu dalam kromatogram, kemudian baru diikuti oleh komponen yang suka dengan fase diam (Meyer, 2004).
2.5.1.3 Instrumen KCKT
Instrumen KCKT terdiri atas 6 bagian, yakni wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector), kolom (column), detektor (detector) dan perekam (recorder) (McMaster, 2007).
16
UIN Syarif Hidayatullah Jakarta
a. Wadah Fase Gerak (Reservoir)
Wadah fase gerak menyimpan sejumlah fase gerak yang secara langsung berhubungan dengan sistem (Meyer, 2004). Wadah haruslah bersih dan inert, seperti botol pereaksi kosong maupun labu gelas. Adalah hal yang penting untuk men-degass fase gerak sebelum digunakan karena gelembung gas kecil dalam fase gerak dapat terkumpul di pump head atau pun detektor sehingga akan mengganggu kondisi KCKT (Brown and DeAntonis, 1997).
b. Pompa (Pump)
Pompa yang digunakan pada KCKT haruslah merupakan instrumen yang kokoh untuk menghasilkan tekanan tinggi hingga 350 bar atau bahkan 500 bar. Tipe pompa yang umum digunakan adalah pompa piston bersilinder pendek ( short stroke piston pump). Laju alir dapat bervariasi dari 0,1 hingga 5 atau 10 ml/menit. Kebanyakan pompa saat ini telah memiliki saluran pembilas yang
biasanya air dapat bersirkulasi. Larutan ini berfungsi untuk membilas piston agar bersih dari garam dapar (Meyer, 2004).
c. Tempat Injeksi Sampel (Injector)
Ada 3 jenis macam injektor, yakni syringe injector, sampling valve dan automatic injector. Syringe injector merupakan bentuk injektor yang paling sederhana (Synder and Kirkland, 1979).
Sampling valve atau manual injector mengandung 6 katup saluran dilengkapi dengan rotor, sample loop dan saluran jarum suntik (needle port). Larutan sampel akan disuntikkan ke dalam
sampel loop dengan jarum suntik gauge 22 pada posisi “load “ dan larutan sampel yang ada di sample loop kemudian akan dialirkan ke kolom dengan memutar rotor ke posisi “inject”. Ukuran sample loop eksternal bervariasi antara 6µl hingga 2 ml (Ornaf and Dong, 2005).
Automatic injector atau disebut juga autosampler memiliki prinsip yang mirip, hanya saja sistem penyuntikkan bekerja secara otomatis (Meyer, 2004).
d. Kolom (Column)
17
UIN Syarif Hidayatullah Jakarta
tertentu. Ukuran kolom untuk tujuan analitik berkisar antara panjang 10 hingga 25 cm dan diameter dalam 2 hingga 9 mm (Brown and DeAntonis, 1997).
e. Detektor (Detector)
Karakteristik detektor yang baik adalah sensitif, batas deteksi rendah, respon yang linierr, mampu mendeteksi solut secara universal, tidak destruktif, mudah dioperasikan, memiliki dead volume yang kecil dan tidak senstitif terhadap perubahan temperatur serta kecepatan fase gerak (Hamilton and Sewell, 1977).
Beberapa detektor yang paling sering digunakan dalam HPLC adalah detektor spektrofotometri UV-Vis, photoiodide-array (PDA), fluoresensi, indeks bias dan detektor elektrokimia (Rohman, 2007). f. Perekam (Recorder)
Alat pengumpul data seperti komputer, integrator dan rekorder dihubungkan ke detektor. Alat ini akan menangkap sinyal elektronik
dari detektor dan memplotkannya ke dalam kromatogram sehingga dapat di evaluasi oleh analis (Brown and DeAntonis, 1997).
2.5.2 Penentuan Kadar Amoksisilin
Kromatografi cair kinerja tinggi dilengkapi dengan detektor 230 nm dan kolom 4mm x 25 cm berisi bahan pengisi. Laju aliran lebih kurang 1,5 ml per menit. Lakukan kromatografi terhadap larutan baku dan rekam
respon puncak seperti yang tertera pada prosedur : faktor kapasitas, k’,
antara 1,1 – 2,8; efisiensi kolom tidak kurang dari 1700 lempeng teoritis; faktor tailing tidak lebih dari 2,5; dan simpangan baku relatif pada penyuntikan ulang tidak lebih dari 2,0%.
Prosedur kerja dengan menyuntikkan secara terpisah sejumlah
volume yang sama (lebih kurang 10 µl) larutan baku dan larutan uji ke dalam kromatograf, rekam kromatogram dan ukur respon puncak utama.
Pengencer : Kalium Fosfat adjust pH 5,0 0,1 menggunakan kalium hidroksida 45% b/b Fase Gerak : Kalium Fosfat : Asetonitril (96:4)
18
UIN Syarif Hidayatullah Jakarta
Hitung jumlah dalam µg C16H19N3O5S per mg yang digunakan dengan rumus :
200 ( ) ( )
19
BAB 3
METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Januari 2014 hingga Juni 2014, bertempat di Laboratorium Farmakognosi dan Fitokimia, Laboratorium Analisa Obat, dan Laboratorium Penelitian 2 Fakultas Kedokteran dan Ilmu Kesehatan (FKIK) UIN Syarif Hidayatullah Jakarta yang berada di jalan Kertamukti – Ciputat, Tangerang Selatan.
3.2 Alat dan Bahan 3.2.1 Alat
Alat yang digunakan dalam penelitian ini adalah Kromatografi Cair Kinerja Tinggi (Dyonex), ultrasonic waterbath (Branson), lemari pendingin, dry vacuum pump (Welch), pH meter (Horiba), magnetic stirer, mikropipet, erlenmeyer (Approx), becker glass (Pyrex), gelas ukur (Pyrex), pipet ukur (Pyrex), pipet tetes, syringe 3 ml (Terumo), syringe 10 ml (Terumo), balb, filter syringe 0,20µm (sartorius stedim), filter syringe RC 0,45µm, filter fase gerak 0,45µm, dan tube.
3.2.2 Bahan Uji
Bahan uji yang digunakan adalah sediaan suspensi kering kombinasi amoksisilin dan asam klavulanat.
3.2.3 Bahan Kimia
Bahan-bahan yang digunakan dalam penelitian ini adalah metanol (HPLC Grade), aquadest, natrium dihidrogen fosfat, asam orto fosfat, natrium hidoksida.
3.3 Prosedur Kerja
3.3.1 Cara Pemilihan Sampel
20
UIN Syarif Hidayatullah Jakarta
3.3.2 Penentuan λ Maksimum Amoksisilin dan Asam Klavulanat
Diukur serapan maksimum Amoksisilin dengan pelarut aquadest. Pengukuran panjang gelombang dalam rentang scanning 200 – 400 nm.
3.3.3 Pembuatan Kondisi Optimum HPLC
Kondisi optimum yang digunakan untuk menganalisa kombinasi amoksisilin dan asam klavulanat sebagai berikut: (USP 30-NF35)
Fase gerak : NaH2PO4 : CH3OH (95:5 v/v) pH 4,4
a. Pembuatan Buffer Natrium Fosfat (NaH2SO4)
Sebanyak 7,8 gram Natrium Fosfat dilarutkan dalam 900 ml aquadest, kemudian adjust pH menggunakan asam fosfat (H2PO4) atau natrium hidroksida (NaOH) 10 N sampai pH yang ditentukan yaitu pH 4,4 tambahkan air sampai 1000 ml aduk hingga homogen. b. Preparasi Sediaan
Sediaan antibiotik amoksisilin dan asam klavulanat yang masih dalam bentuk sirup kering dikeluarkan dari wadah, kemudian dibagi menjadi beberapa sampel (0, 3, 5, 7, hari) pengujian dilakukan secara triplo. Berat total masing-masing sampel 0,35 gram. Sampel direkonstitusi sesuai dengan waktu yang telah ditentukan (0, 3, 5, 7 hari).
c. Preparasi Pengukuran Sediaan
Sediaan yang digunakan memiliki dosis 125mg/5ml, sediaan dikeluarkan dalam wadah kemudian ditimbang total berat serbuk di dalamnya, total berat serbuk adalah 7 gram yang setara dengan 1,5 gram amoksisilin. Serbuk di bagi menjadi 0,35 gram yang setara dengan 0,075 gram amoksisilin, untuk masing-masing sampel
21
UIN Syarif Hidayatullah Jakarta
sampel yang sudah dilarutkan dalam 250 ml diambil 3,5 ml ad dengan aquadest sebanyak 10 ml.
3.3.4 Pembuatan Kurva Kalibrasi
Dibuat seri konsentrasi larutan amoksisilin disuntikkan ke dalam kolom pada kondisi terpilih. Luas puncak yang diperoleh dicatat dan dibuat kurva kalibrasi antara luas puncak dengan konsentrasi larutan.
3.3.5 Uji Kesesuaian Sistem
Larutan amoksisilin dengan konsentrasi tertentu disuntikkan ke dalam kolom HPLC (High Performance Liquid Chromatography). Larutan amoksisilin di injek sebanyak 5x injekkan, lalu dihitung efisiensi kolom, faktor tailing, dan simpangan baku (RSD). Efisiensi kolom ditentukan dari masing-masing peak analit yang tidak kurang dari 1700 theoritical plates. Faktor tailing dari peak masing-masing analit tidak lebih dari 2,5. Simpangan Baku (RSD) peak retention dan peak areas dalam
pengulangan penyuntikkan tidak lebih dari 2,0% (USP 30, 2007).
3.3.6 Pengamatan Kualitatif
Uji stabilitas merupakan bagian penting dalam program uji bahan obat karena ketidakstabilan produk ditentukan oleh tiga syarat utama yaitu kualitas, efikasi, dan keamanan (Carstensen and Rhodes, 2000). Salah satu uji stabilitas dengan pengamatan kualitatif. Pengamatan kualitatif dilakukan dengan cara melihat perubahan organoleptis sediaan . Hal ini dapat mewakilkan pengujian stabilitas dari segi kualitas zat aktif tersebut. Perubahan organoleptis ini dilihat dari perubahan warna pada suspensi per harinya.
3.3.7 Analisa Degradasi Kadar Amoksisilin dan Asam Klavulanat
Sediaan suspensi kombinasi amoksisilin dan asam klavulanat yang telah direkonstitusi kemudian disimpan pada suhu kamar (27-29oC) dan kulkas (4-8oC) selama 7 hari, diuji degradasi kadar amoksisiliin terkandung didalamnya dengan menggunakan HPLC, dilihat dari perubahan luas area
22
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum dilakukan dengan menggunakan spektrofotomer ultraviolet-visibel, diperoleh serapan
maksimum amoksisilin dan kombinasi amoksisilin-asam klavulanat yaitu pada panjang gelombang 227 nm. Berdasarkan penelitian Tippa (2010) panjang gelombang amoksisilin pada kisaran 210 – 240 nm dan asam klavulanat pada kisaran 210 – 230 nm.
4.2 Pemilihan fase gerak dan kondisi optimum HPLC
Fase gerak yang digunakan pada penelitian ini berdasarkan literatur USP 30 yaitu buffer fosfat : metanol (95 : 5) dengan laju alir 2 mL/menit, volume injeksi 20µL pada panjang gelombang 227 nm, menggunakan kolom C-18 30 cm dengan lampu detektor UV.
4.3 Pembuatan Kurva Kalibrasi Amoksisilin
Gambar 4.1 Kurva Kalibrasi Standar Amoksisilin
23
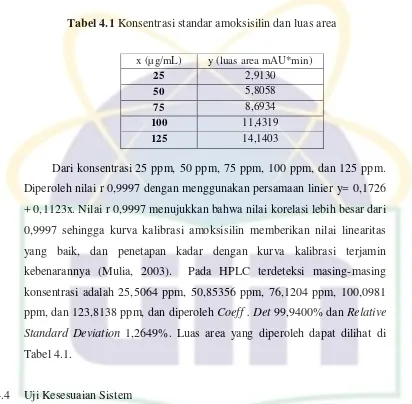
UIN Syarif Hidayatullah Jakarta Tabel 4.1 Konsentrasi standar amoksisilin dan luas area
Dari konsentrasi 25 ppm, 50 ppm, 75 ppm, 100 ppm, dan 125 ppm. Diperoleh nilai r 0,9997 dengan menggunakan persamaan linier y= 0,1726 + 0,1123x. Nilai r 0,9997 menujukkan bahwa nilai korelasi lebih besar dari 0,9997 sehingga kurva kalibrasi amoksisilin memberikan nilai linearitas yang baik, dan penetapan kadar dengan kurva kalibrasi terjamin kebenarannya (Mulia, 2003). Pada HPLC terdeteksi masing-masing konsentrasi adalah 25,5064 ppm, 50,85356 ppm, 76,1204 ppm, 100,0981 ppm, dan 123,8138 ppm, dan diperoleh Coeff . Det 99,9400% dan Relative
Standard Deviation 1,2649%. Luas area yang diperoleh dapat dilihat di Tabel 4.1.
4.4 Uji Kesesuaian Sistem
Pada uji kesesuaian sistem sampel di injekkan sebanyak lima kali. Parameter untuk menetapkan kesesuaian sistem sebelum analisis, yaitu daya pisah/resolusi, efisiensi kolom, faktor tailing, simpangan baku (RSD) Peak Retention, dan simpangan baku (RSD) Peak Areas. Lihat Lampiran 11.
Tabel 4.2 Parameter Uji Kesesuaian Sistem
Keterangan: Hasil uji rata-rata kesesuaian sistem amoksisilin pada konsentrasi 100 µg/mL dengan komposisi fase gerak buffer fosfat – metanol (pH : 4,4) (95:5 v/v) pada kecepatan alir 2 mL/menit, panjang gelombang 227 nm dan volume penyuntikan 20 µl
Parameter Uji Persyaratan Hasil Uji Rata-rata Efisiensi kolom >1700 theoritical plates 2526,4
24
UIN Syarif Hidayatullah Jakarta
Berdasarkan hasil yang tertera pada tabel, hasil uji kesesuaian sistem memenuhi persyaratan, yang menyatakan bahwa metode kerja sesuai dengan sistem HPLC yang digunakan dan dapat menghasilkan akurasi dan presisi yang dapat diterima.
Dalam menentukan waktu retensi, sampel yang digunakan mengandung 2 zat aktif yaitu amoksisilin dan asam klavulanat. Sehingga terdapat 2 peak dengan waktu retensi tertentu yang terpisah dengan baik. Berdasarkan literatur, dengan menggunakan fase gerak Buffer fosfat : Metanol (95:5) akan diperoleh peak amoksisilin dan asam klavulanat yang resolusi/daya pisah tidak lebih dari 3,5 menit.
Asam klavulanat lebih bersifat polar dibandingkan dengan amoksisilin karena dilihat dari kromatogram, terlihat lebih dulu peak asam klavulanat kemudian dilanjutkan dengan peak amoksisilin. Asam klavulanat muncul pada menit ke – 1.607 dan amoksisilin muncul pada menit ke – 2.583. Kromtogram dapat dilihat pada Lampiran 5 dan 6.
4.5 Pengamatan Kualitatif
Pengamatan kualitatif yang dapat dilihat dari sisi organoleptis obat, salah satunya yaitu adanya perubahan warna pada sampel selama masa penyimpanan, menunjukkan ketidakstabilan obat tersebut selama penyimpanan.
25
UIN Syarif Hidayatullah Jakarta Keterangan : a). Gambar sampel dalam penyimpanan suhu kamar (27-29oC) hari ke – 0, 3,
5, dan 7; b). Gambar sampel hari ke – 7.
Gambar 4.2 Gambar Sampel Uji pada Suhu Kamar (27-29oC)
Suatu obat dikatakan stabil apabila obat tersebut memiliki kemampuan untuk tetap dalam spesifikasi yang telah ditetapkan, untuk mempertahankan identitasnya, kekuatan, kualitas, kemurnian, dan seluruh tes sampai periode kadaluarsa. Pengujian stabilitas zat aktif atau produk jadi memberikan informasi tentang bagaimana kualitasnya yang dipengaruhi oleh berbagai faktor lingkungan seperti suhu, kelembaban, dan cahaya (Peace,2012). Dari hasil yang diperoleh menunjukan bahwa sampel yang disimpan dalam suhu kamar tidak stabil.
Perubahan warna pada sampel dapat terjadi karena beberapa hal, dan sering terjadi pada sediaan lainnya. Zat aktif yang terkandung di dalamnya merupakan bahan kimia yang dapat bereaksi karena faktor lingkungan, seperti panas, kelembaban, cahaya, mikroba, dan debu (Peace, 2012).
Keterangan : Sampel dalam penyimpanan suhu kulkas (4-8oC) hari ke – 0, 3, 5, dan 7 Gambar 4.3 Gambar Sampel Uji pada Suhu Kulkas (4-8oC)
b
0 3 5 7
0 3 5 7
26
UIN Syarif Hidayatullah Jakarta
Pada sampel penyimpanan suhu kulkas (4-8oC) tidak ada perubahan warna baik dalam penyimpanan hari ke-0, 3, 5, dan 7. Warna larutan bening dan tidak ditumbuhi jamur, hal ini menunjukkan bahwa sediaan suspensi kombinasi amoksisilin – klavulanat lebih stabil dalam suhu kulkas (4-8oC) sesuai dengan etiket penyimpanan obat yang sudah tertera dalam produk obat tersebut.
4.6 Pengukuran Kadar Amoksisilin dalam Sampel
Sediaan suspensi kering kombinasi amoksisilin – asam klavulanat diuji dalam perbedaan waktu dan temperatur penyimpanan. Waktu yang ditentukan dalam pengujian sampel adalah 0, 3, 5, 7 hari dan temperatur yang digunakan adalah suhu kamar (27-29oC) dan suhu kulkas (4-8oC).
Tabel 4.3 Persentase Kadar Amoksisilin pada Suhu Kamar Hari Area Konsentrasi
Awal kemudian berdasarkan perhitungan yang telah disesuaikan dengan kurva kalibrasi sehingga didapat konsentrasi akhir amoksisilin untuk mendapatkan persentase kadar amoksisilin dalam sampel. Pada sampel dengan penyimpanan hari ke-0 persen kadar rata-rata amoksisilin 95,42%.
Kadar amoksisilin hari ke-0 masih sesuai dengan ketentuan sediaan pada literatur. Berdasarkan literatur USP 30, kandungan amoksisilin dalam sediaan suspensi amoksisilin – asam klavulanat adalah tidak kurang dari 90% dan tidak lebih dari 120%.
27
UIN Syarif Hidayatullah Jakarta
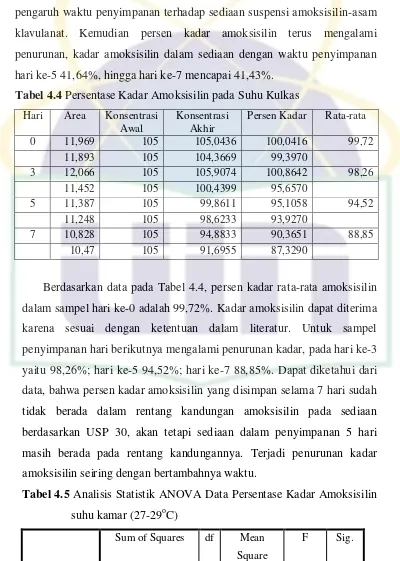
tidak memenuhi ketentuan USP 30. Hal ini menunjukkan bahwa adanya pengaruh waktu penyimpanan terhadap sediaan suspensi amoksisilin-asam klavulanat. Kemudian persen kadar amoksisilin terus mengalami penurunan, kadar amoksisilin dalam sediaan dengan waktu penyimpanan hari ke-5 41,64%, hingga hari ke-7 mencapai 41,43%.
Tabel 4.4 Persentase Kadar Amoksisilin pada Suhu Kulkas Hari Area Konsentrasi
Awal
Berdasarkan data pada Tabel 4.4, persen kadar rata-rata amoksisilin dalam sampel hari ke-0 adalah 99,72%. Kadar amoksisilin dapat diterima karena sesuai dengan ketentuan dalam literatur. Untuk sampel penyimpanan hari berikutnya mengalami penurunan kadar, pada hari ke-3 yaitu 98,26%; hari ke-5 94,52%; hari ke-7 88,85%. Dapat diketahui dari data, bahwa persen kadar amoksisilin yang disimpan selama 7 hari sudah tidak berada dalam rentang kandungan amoksisilin pada sediaan berdasarkan USP 30, akan tetapi sediaan dalam penyimpanan 5 hari masih berada pada rentang kandungannya. Terjadi penurunan kadar amoksisilin seiring dengan bertambahnya waktu.
Tabel 4.5 Analisis Statistik ANOVA Data Persentase Kadar Amoksisilin
suhu kamar (27-29oC)
28
Std. Error Sig. 95% Confidence Interval Lower
Bound
Upper Bound
0
3 52,5378500* 1,4045218 ,000 48,638272 56,437428 5 53,7802500* 1,4045218 ,000 49,880672 57,679828 7 53,9922500* 1,4045218 ,000 50,092672 57,891828 Keterangan : Signifikansi <0,05 persentase kadar amoksisilin
Hasil pengolahan data menggunakan statistik SPSS 20 menunjukkan bahwa hasil persentase kadar amoksisilin setiap hari terdapat adanya perbedaan yang signifikan, hal ini terlihat dari nilai signifikansi ANOVA yang dihasilkan memiliki signifikasi <0,05. Persentase kadar amoksisilin pada hari ke-0 dan ke-3; hari ke-0 dan ke-5; hari ke-0 dan ke-7 menunjukkan adanya perbedaan yang bermakna. Adanya penurunan kadar
amoksisilin yang sangat tinggi antara hari ke-0 dengan hari ke-3,5, dan 7 sehingga hasil dari signifikansi menunjukkan <0,05.
Tabel 4.7 Analisis Statistik ANOVA Data Presentase Kadar Amoksisilin suhu kulkas (4-8oC)
Sum of Squares df Mean Square F Sig. Between Groups 177,176 3 59,059 13,995 ,007 Within Groups 21,099 5 4,220
Total 198,275 8
Keterangan : Signifikansi <0,05 persentase kadar amoksisilin
Tabel 4.8 Data Statistik Persentase Kadar Amoksisilin suhu kulkas (4-8oC)
(I)
Keterangan : Signifikansi <0,05 persentase kadar amoksisilin
29
UIN Syarif Hidayatullah Jakarta
hari ke-0 dan ke-7 terdapat perbedaan konsentrasi yang bermakna, dengan nilai signifikansi 0,02.
Keterangan : Signifikansi <0,05 persentase kadar amoksisilin
Berdasarkan hasil pengolahan data perbandingan kadar rata-rata pada suhu penyimpanan (27-29oC) dan (4-8oC) terdapat perbedaan yang signifikan. Dilihat dari mean difference, kadar amoksisilin suhu kamar (27-29oC) lebih rendah dari suhu kulkas (4-8oC), didapatkan dari hasil selisih rata-rata kadar amoksisilin suhu kamar dengan suhu kulkas memberikan hasil negatif, begitupun sebaliknya.
Gambar 4.4 Grafik Perbandingan Suhu Penyimpanan Terhadap Waktu
Penyimpanan
30
UIN Syarif Hidayatullah Jakarta
disimpulkan bahwa penyimpanan suhu kulkas lebih stabil dibandingkan suhu kamar guna mempertahankan kadar amoksisilin dalam sediaan suspensi amoksisilin-asam klavulanat.
Penurunan kadar amoksisilin dalam suspensi amoksisilin-asam klavulanat penyimpanan suhu kamar, pada hari ke-0 dengan ke-3 mengalami penurunan drastis, terjadi penguraian amoksisilin didalamnya. Akan tetapi pada penyimpanan hari ke-3 dengan ke-5 dan ke-7 penurunan kadar tidak berbeda secara signifikan. Hal ini dapat disebabkan adanya reaksi kimia selama masa penyimpanan, yaitu reaksi hidrolisis. Setelah amoksisilin mengalami hidrolisis, memungkinkan terjadinya reaksi kesetimbangan karena cincin β-laktam terbuka
Tabel 4.10 Persentase Tingkat Degradasi Kadar Amoksisilin pada Suhu
Kamar (27-29oC) dan Suhu Kulkas (4-8oC)
Persentase degradasi didapatkan dari perhitungan selisih kadar akhir dengan kadar awal atau kadar hari ke-0. Tingkat degradasi kadar amoksisilin pada suhu kamar (27-29oC) lebih dari 50%, pada suhu kulkas (4-8oC) tingkat degradasi lebih dari 10% Berdasarkan data yang didapat,
terjadi peningkatan persen degradasi pada hari ke-0 menuju hari ke-3, kemudian terus meningkat hari berikutnya hingga hari ke-7. Akan tetapi tidak mengalami peningkatan yang signifikan. Ada beberapa kemungkinan hal yang dapat terjadi disini. Amoksisilin mengalami penguraian pada hari ke-0 menuju hari ke-3 karena ketidakstabilannya dalam suhu kamar (27-29oC), setelah menuju hari ke-5 dan ke-7 mengalami kesetimbangan kimia karena peningkatan persen degradasi tidak berbeda signifikan. Hidrolisis
31
UIN Syarif Hidayatullah Jakarta Gambar 4.5Pemecahan cincin β-laktam yang mengandung gugus amida.
Cincin β-laktam amoksisilin dapat mengalami kerusakan,
amoksisilin termasuk antibiotik β-laktam memiliki rantai siklik amida atau laktam mengalami pembukaan cincin cepat karena hidrolisis (Yoshioka, 2002). Penambahan air pada sediaan suspensi amoksisilin-asam klavulanat dapat mempercepat terjadinya hidrolisis, karena setelah bereaksi dengan amoksisilin air akan mengikat gugus H+ dan OH- dari gugus amida yang terkandung untuk membentuk H2O (Carstensen, 2000).
Kemungkinan besar terjadi reaksi kesetimbangan setelah gugus
amoksisilin terurai karena terhidrolisis. Hal ini yang menyebabkan baik konsentrasi maupun tingkat degradasi amoksisilin konstan karena amoksisilin tidak mengalami penguraian, dan reaksi akan terus bolak-balik sampai reaksi berhenti.
Suhu penyimpanan mempengaruhi tingkat degradasi zat aktif kelembaban, dan pH dapat mempengaruhi degradasi kadar amoksisilin (Naidoo, 2006). Kemasan obat yang digunakan untuk penyimpanan dibawah kondisi yang tidak pantas juga dapat mempengaruhi terjadinya degradasi. Sehingga penting untuk memperhatikan dimana letak penyimpanan suatu sediaan obat untuk menjaga stabilitas zat aktif yang terkandungnya untuk memberikan potensi terapeutik yang baik.
32
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dengan bertambahnya waktu penyimpanan semakin rendah
persentase kadar amoksisilin dan semakin meningkat persentase degradasi amoksisilin dalam sediaan suspensi amoksisilin – asam klavulanat.
2. Suhu penyimpanan memberikan pengaruh terhadap kadar amoksisilin di dalam sediaan suspensi amoksisilin-asam klavulanat. Dalam keadaan suhu kulkas (4-8oC) kadar amoksisilin lebih stabil dibandingkan dalam suhu kamar (27-29oC).
3. Sampel dapat digunakan sampai 5 hari penyimpanan dengan kondisi penyimpanan suhu kulkas (4-8oC)
5.2Saran
1. Diperlukan pengujian dengan waktu penyimpanan diperpanjang.
33
UIN Syarif Hidayatullah Jakarta DAFTAR PUSTAKA
Ahuja, S, dan M.W. Dong. 2005. Handbook of Pharmaceutical Analysis by HPLC. Volume 7. New York : Elsevier Academic Press. Hal : 35
Alburyhi, Mahmoud Mahyoob, Abdulwali Ahmad Siaf, dan Maged Alwan Noman. 2013. Stability study of six brands of amoxicillin trihydrate and clavulanic acid oral suspension present in Yemen markets. Journal of Chemical and Pharmaceutical Research. Vol.5, Hal : 293 – 296.
Anief, Moh. 1997. Ilmu Meracik Obat; Teori dan Praktik. Gajah Mada University Press. Yogyakarta.
Ansel, H.C. 1989. Pengantar Bentuk Sediaan Farmasi. Edisi 4. UI Press. Jakarta.
Beg, S., M.S. Hasnain, S. Swain, dan K. Kohli. 2011. Validated Stability – Indicating LC Method for Estimation of Amoxicillin Trihydrate in Pharmaceutical Dosage Forms and Time – Dependent Release Formulations. International Journal of Pharmaceutical Sciences and Nanotechnology. Vol.4, Issue 2.
Brown, P, dan K. DeAntonis. 1997. High Performance Liquid Chromatography. In: F.A. Settle (eds). Handbook of Instrumental Techniques for Analytical Chemistry. New Jersey : Prentice-Hall, Inc. Pages 149-154.
Carstensen, J.T, dan Rhodes, C.T. 2000. Drug Stability Principles and Practices, Third Edition. NewYork.
Castro, Silvana Calafatti de., dan Pedrazzoli, Jose Jr. 2003. HPLC Determination of Amoxicillin Comparative Bioavailability in Healthy Volunteers After a Single Dose Administration. J Pharm Pharmaceutical Sci. Hal: 223 – 230. Corwin, Elizabeth J. 2009. Buku Saku Patofisiologi Corwin. Jakarta : Aditya
34
UIN Syarif Hidayatullah Jakarta
Ditjen POM. 1995. Farmakope Indonesia Edisi IV. Jakarta : Departemen Kesehatan Republik Indonesia.
Finlay, Jane., Linda Miller., dan James A. Poupard. 2003. A Review of the antimicrobial activity of clavulanate. Journal of Antimicrobial Chemotherapy.
Foulstone, Mark., dan Christopher Reading. 1982. Assay of Amoxicillin and Clavulanic Acid, the Components of Augmentin, in Biological Fluids with High Performance Liquid Chromatography. Antimicrobial Agents and Chemotherapy. Vol.22, No.5, Hal : 753 -762.
Frynkewicz, Heidi., Hannah Feezle., dan Melinda Richardson. 2013. Thermostability Determination of Broad Spectrum Antibiotics at High Temperatures by Liquid Chromatography – Mass Spectrometry. Proceedings of The National Conference On Undergraduate Research
(NCUR) 2013 University of Wisconsin La Crosse, WI.
Goodman and Gilman. 2007. Dasar Farmakologi Terapi. Jakarta. EGC : Vol 2.
Hamilton, R.J, dan P.A. Sewell. 1977. Introduction to High Performance Liquid Chromatography. Liverpool : Chapman dan Hall, Ltd. Hal :1, 53-54.
IMS Institute For Healthcare Informatics. 2012. The Use of Medicines in the United States : Review of 2011. USA.
Kazakevich, Y., dan R. LoBrutto. 2007. Method Validation. In: LoBrutto, R., dan T. Patel., Editors. HPLC for Pharmaceutical Scientist. New Jersey : John Wiley & Sons, Inc.
KK, Naidoo, Nompuku P., Mkalali SN., Shabangu K, Nkabinde L, dan Singh V. 2006. Post-marketing Stability Surveillance : Amoxicillin. SA Fam Pract, Vol 48, Hal 14.
McMaster, M.C. 2007. HPLC A Practical User’s Guide, 2nd Edition. New Jersey
: John Wiley & Sons, Inc. Page 106.
35
UIN Syarif Hidayatullah Jakarta
Mycek, M.J., Harvey, R.A., dan Champe C.C. 2001. Farmakologi Ulasan
Bergambar. Lippicontt’s Illustrated Reviews: Farmacology. Penerjemah Azwar Agoes. Edisi II. Jakarta. Widya Medika. Hal 301-313.
Neal, M.J. 2007. At a Glance Farmakologi Medis. Jakarta : Penerbit Erlangga.
Ornaf, R.M, dan M.W. Dong. 2005. Key Concepts of HPLC in Pharmaceutical Analysis. Dalam: S. Ahuja dan M.W. Dong (eds). Handbook of Pharmaceutical Analysis by HPLC. San Diego : Elsevier, Inc. Hal : 22-29.
Owusu, Patrick. 2011. HPLC Method Development For The Quantification and
Stability Studies Of Amoxicillin and Clavulanic Acid In Liquid Oral
Formulation. The Departement of Pharmaceutical Chemistry, Faculty of Pharmacy and Pharmaceutical Sciences.
Peace, Nwokoye, Oyetunde Olubukola, dan Akinleye Moshood. 2012. Stability
of Reconstituted Amoxicillin Clavulanate Potassium Under Simulated in Home Storage Conditions. Journal of Applied Pharmaceutical Science, Vol.02, Hal. 28-31.
Ready, D., H. Lancaster, F.Qureshi, R. Bedi, P. Mullany, dan M.Wilsom . 2004. Effect of Amoxicillin Use on Oral Microbiota in Young Children. Antimicrobial Agents and Chemotherapy, Vol.48, No. 8, Hal : 2883-2887.
Rohman, A. 2007. Kimia Farmasi Analisis. Cetakan Pertama. Yogyakarta. Pustaka Pelajar. Hal : 465-469.
Rubtsova, M.Yu., M.M. Ulyashova, T.T Bachmann, R.D. Schmid, dan A.M. Egorov. 2010. Multiparametric Determination of Genes and Their Point
Mutations for Identification of Beta – Lactamases. Biochemistry
(Moscow). Vol. 75, No.13, Hal : 1628 – 1649.
Shargel, Leon., Andrew B.C.YU. 1988. Biofarmasetika dan Farmakokinetika Terapan. Edisi 2. Surabaya. Airlangga University Press. Hal: 21-24.
36
UIN Syarif Hidayatullah Jakarta
Sulistyowaty, Melanny Ika, et.al. 2010. Perbandingan Kinetika Peruraian Amoksisilin dan N-benzoilamoksisilin yang ditetapkan secara kalorimetri. Majalah Farmasi Airlangga, Vol. 8, No.1, Hal 29-35.
Synder, L.R, dan J.J Kirkland. 1979. Introduction to Modern Liquid
Chromatography, 2nd Edition. New York : John Wiley & Sons, Inc. Hal :
52, 250.
The United State Pharmacopeial Convention. 2006. The United States Pharmacopeia (USP,. 30th Edition. United States. Hal : 1026.
Tippa, Durga Mallikarjuna Rao, dan Singh Narendra. 2010. Development and Validation of Stability Indicating HPLC Method for Simultaneous Estimations of Amoxicillin and Clavulanic Acid in Injection. American Journal od Analytical Chemistry. Hal : 95 – 101.
Ünal, Kemal, Palabiyik, Murat. I., Karacan, Elif, Onur, Feyyaz. 2008. Spectrophotometric Determination of Amoxicillin In Pharmaceutical Formulations. Turk J.Pharm. Sci. Vol. 5, Hal. 1-16.
37
Lampiran 1. Alur Kerja
38
Lampiran 2.Gambar Alat dan Bahan Penelitian
Waterbath Ultrasonic Vakum Penyaring fase gerak
pH meter HPLC &
Komputer
Stirer Timbangan
Analitik
Sampel Metanol
HPLC
Aqua Pro Injection
Natrium Dihidrogen
Fosfat
Asam Ortofosfat
Aquadest Standar
39
Lampiran 3. Scanning Panjang Gelombang Maksimum Amoksisilin
Lampiran 4. Scanning Panjang Gelombang Maksimum Amoksisilin-Asam
40
Lampiran 5. Kromatogram Standard Amoksisilin