PENGARUH FAKTOR FISIKOKIMIA TERHADAP
PEMBENTUKAN PIGMEN OLEH BAKTERI LAUT
MESOPHILOBACTER SP.
ENDANG S. SRIMARIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Pengaruh Faktor
Fisikokimia terhadap Pembentukan Pigmen oleh Bakteri Laut
Mesophilobacter sp. adalah karya saya dengan arahan dari komisi pembimbing
Dr. Ir. Linawati Hardjito, M.Sc; Dr. Ir. Anwar Bey Pane, DEA; dan
Dr. Ir. Sukarno, M.Sc. dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2000
Endang S. Srimariana
ABSTRACT
ENDANG S. SRIMARIANA. The effect of physicochemical factors on the
pigment formation by a marine bacteria, Mesophilobacter sp. Supervised by
LINAWATI HARDJITO, ANWAR BEY PANE, and SUKARNO.
It has been conducted an observations on the effect of environmental factors especially physicochemical factors on the growth and pigment formation by a marine bacteria Mesophilobacter sp. The objectives of this research were to study the effect of : 1) cultivation temperature (25oC, 30oC and 35oC); 2) pH of growth medium (5, 7, and 9); 3) salinity of growth medium (0 ppt, 10 ppt, 20 ppt, 30 ppt and 40 ppt), 4) carbon sources (glucose, acetate, citrate, and maltose), and 5) nitrogen sources (peptone, yeast extract, sodium nitrate, and ammonium sulfate) on the growth of bacteria and the pigment formation. Bacteria were cultivated in 500 ml flasks with a working volume of 250 ml in marine broth and incubated on a shaker incubator with the agitation speed of 120 rpm for seven days. Variables that were observed during the cultivation process involved bacterial growth (cell concentration), pigment concentration, and pH. Observations were carried out up to 168 hours. The cell and pigment concentrations were monitored spectrophotometrically. The results indicated that
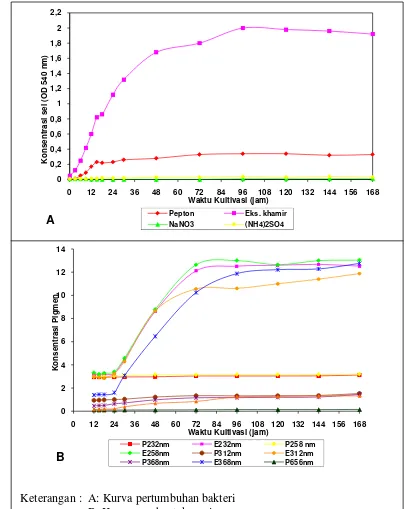
Mesophilobacter sp. grew well and formed the highest concentration of pigment (P) at temperature 30oC, with value of P 0.12 + 0.003 (λ 463 nm). At pH experiment the highest average P was obtained from medium with pH 9 was 0.14 + 0.006 (λ 463 nm) and significantly different from pH 7 (p <0.5). At salinity experiment, the highest average P obtained from the growth medium with 10 ppt salinity is 3.54 + 0.11 in λ 368 nm. At carbon source experiment, the highest average of P were obtained from maltose, with value 12.13 + 1.33 (λ 232 nm) and 15.86 + 0.52 (λ 258 nm), while in λ 312 nm, λ 368 nm and λ 656 nm that obtained from glucose were 11.59 + 0.28, 7.22 + 0.44 and 1.50 + 0.05. At nitrogen source experiment, the result showed that Mesophilobacter sp. grew rapidly in the medium with yeast extract. The pigment has a maximum absorbance
at five wavelengths, namely λ 232 nm, 258 nm, 312 nm, 368 nm, and 658 nm.
The average concentration of cells and pigment, showed that yeast extract is the best nitrogen source in cell growth and pigment formation (p <0.05). The highest average P is 12.49 + 0.22 (λ 232 nm); 12.86 + 0.21 (λ 258 nm); 11.09 + 0.56 (λ 312 nm) ; 11.88 + 0.97 (λ 368 nm) and 1.29 + 0.04 (λ656 nm).
RINGKASAN
ENDANG S. SRIMARIANA. Pengaruh Faktor FisikoKimia terhadap
Pembentukan Pigmen oleh Bakteri Laut Mesophilobacter sp. Dibimbing oleh
LINAWATI HARDJITO, ANWAR BEY PANE, dan SUKARNO.
Kondisi lingkungan baik kondisi fisika maupun kimia (nutrien) merupakan faktor penting yang menentukan produktifitas mikroorganisme. Kedua kondisi tersebut merupakan faktor eksternal yang dapat dikendalikan untuk keberhasilan suatu proses yang memanfaatkan organisme (bioproses). Penelitian ini bertujuan untuk : 1) menentukan suhu kultivasi, 2) menentukan pH kultivasi, 3) menentukan intensitas cahaya, 4) menentukan salinitas, 5) menentukan sumber karbon, 6) menentukan sumber nitrogen yang sesuai baik untuk pertumbuhan maupun untuk
sintesa biopigmen dari bakteri laut Mesophilobacter sp. yang diisolasi dari
terumbu karang.
Dalam penelitian ini kultivasi dilakukan dalam labu erlenmeyer 500 ml dengan volume kerja 250 ml pada inkubator goyang dengan kecepatan 121 rpm.
Suhu kultivasi yang digunakan adalah 25oC, 30oC dan 35oC; pH medium
pertumbuhan yang dicoba adalah 5, 7, dan 9; intensitas cahaya yang dicoba adalah
2350Wm-2 (kondisi tanpa penambahan cahaya), 4710Wm-2, dan 12500Wm-2;
salinitas medium pertumbuhan yang dicoba adalah 0 permil, 10 permil, 20 permil, 30 permil dan 40 permil; sumber karbon yang diuji adalah glukosa, asetat, sitrat, dan maltosa; dan sumber nitrogen yang diuji adalah pepton, ekstrak khamir, sodium nitrat, dan ammonium sulfat. Variabel yang diamati selama proses kultivasi meliputi pertumbuhan bakteri (konsentrasi sel), konsentrasi pigmen, dan pH. Selain itu dihitung juga laju spesifik pertumbuhan sel (µ), laju spesifik
pembentukan pigmen (qp
Percobaan ini menggunakan Rancangan Acak Lengkap dengan perlakuan yang sesuai dengan setiap faktor fisika dan kimia yang hendak dipelajari. Pengaruh suhu, pH, cahaya, salinitas, sumber karbon dan sumber nitrogen terhadap pertumbuhan sel dan pembentukan pigmen dianalisis dengan Analisis Sidik Ragam (Anova). Jika terdapat perbedaan akibat adanya perlakuan terhadap pertumbuhan sel dan pembentukan pigmen, maka pengujian dilanjutkan dengan menggunakan uji Beda Nyata Terkecil (BNT) (Koopmans, 1987).
) dan rendemen biomassa (sel). Pengamatan dilakukan sampai kultur berumur 168 jam.
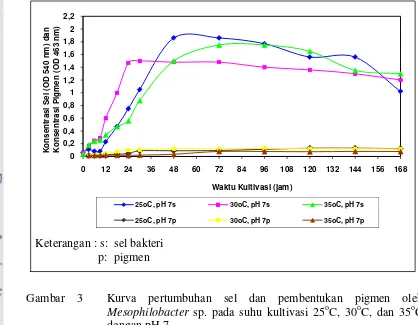
Pada percobaan suhu; laju spesifik pertumbuhan sel (µ) dan laju spesifik pembentukan pigmen (qp) tertinggi yang diolah selama bakteri berada pada fase
logaritmik, diperoleh dari medium yang diinkubasi pada suhu 30oC dengan nilai µ sebesar 0,24 jam-1 dan qp 0,02 jam-1 berturut-turut. Rata-rata konsentrasi pigmen
(P) tertinggi diperoleh dari inkubasi suhu 25oC dan 30oC, yaitu sebesar 0,12 + 0,02 dan 0,12 + 0,003 (λ 463 nm). Diperoleh hasil bahwa suhu yang baik dalam pembentukan pigmen adalah 30oC. Suhu 30o
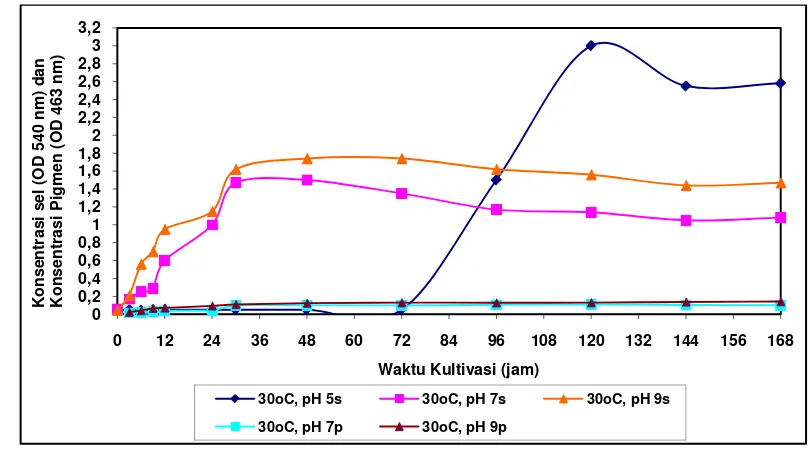
Pada percobaan pH; µ dan q
C digunakan sebagai suhu kultivasi dalam percobaan berikutnya.
p tertinggi diperoleh dari medium pertumbuhan
dengan pH 9, dengan nilai µ sebesar 0,42 jam-1 dan qp sebesar 0,04 jam-1
walaupun konsentrasi sel tertinggi diperoleh pada pH ini. Rata-rata P tertinggi diperoleh dari medium dengan pH 9 yaitu sebesar 0,14 + 0,006 (λ 463 nm) dan berbeda nyata dengan pH 7 (p<0,5). pH optimum dalam pembentukan pigmen adalah 9, kemudian pH 9 digunakan sebagai pH medium pertumbuhan dalam percobaan berikutnya.
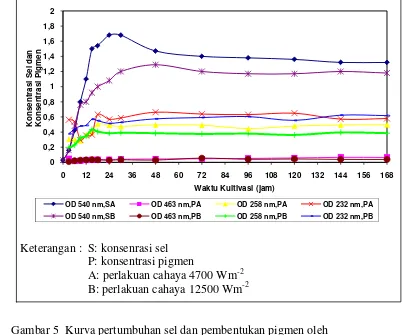
Pada percobaan intensitas cahaya; µ dari medium yang disertai penambahan cahaya 12500 Wm-2 adalah yang tertinggi dengan nilai µ 0,46 jam-1, akan tetapi qp tanpa penambahan cahaya memiliki nilai tertinggi yaitu sebesar 0,04 jam-1.
Rata-rata P hasil kultivasi tanpa penambahan cahaya (suhu 30oC) adalah yang tertinggi dengan P sebesar 0,14 + 0,006 (λ 463 nm). Hasil analisis sidik ragam terhadap pertumbuhan sel dan pembentukan pigmen pada fase stasioner terlihat bahwa perlakuan cahaya berpengaruh nyata (p<0,05). Pengujian dilanjutkan
dengan uji BNT, dengan hasil uji bahwa : suhu 30oC tanpa penambahan cahaya
memberikan hasil terbaik dan berbeda nyata (p<0,05) dalam pertumbuhan
Mesophilobacter sp. dan pembentukan pigmen dibanding dengan perlakuan
penambahan cahaya 4700Wm-2 dan 12500 Wm-2
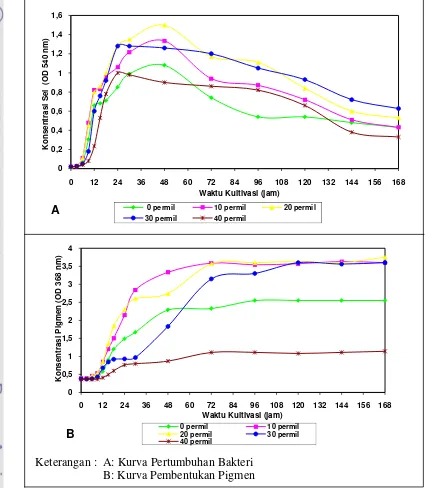
Pada percobaan salinitas; µ tertinggi adalah 0,38 jam .
-1
yang diperoleh dari medium pertumbuhan dengan salinitas 0 permil, 10 permil dan 20 permil, sedangkan qp tertinggi diperoleh dari medium pertumbuhan dengan salinitas 10
permil, yaitu sebesar 1,68 jam-1
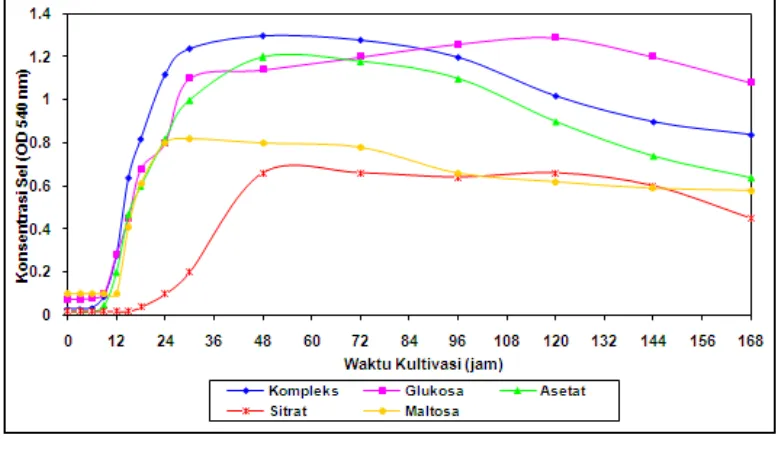
Pada percobaan sumber karbon, µ terbesar diperoleh dari media yang
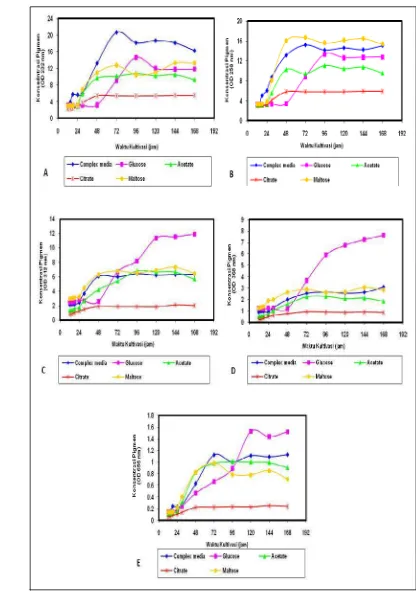
menggunakan sumber karbon asetat dengan nilai µ 0,36. Pigmen yang dihasilkan pada penelitian ini memiliki absorban maksimum pada lima panjang gelombang, yaitu λ 232 nm, 258 nm, 312 nm, 368 nm, dan 658 nm. Pada λ 232 nm dan 258 nm, rata-rata P tertinggi diperoleh dari sumber karbon maltosa, yaitu sebesar (12,13 + 1,33) dan (15,86 + 0,52), sedangkan pada λ 312 nm, 368 nm dan 656 nm diperoleh dari glukosa dengan rata-rata (11,59 + 0,28), (7,22 + 0,44) dan (1,50 + 0,05).
. Rata-rata P tertinggi diperoleh dari medium pertumbuhan dengan salinitas 10 permil yaitu 3,54 + 0,11 pada λ 368 nm. Dari hasil percobaan ini, disimpulkan bahwa salinitas terbaik adalah 10 permil.
Pada percobaan sumber nitrogen; µ dan qp tertinggi dari Mesophilobacter
sp. diperoleh dari media dengan sumber nitrogen ekstrak khamir dengan nilai µ 0,24 jam-1 dan nilai qp pada λ 232 nm, 258 nm, 312 nm, 368 nm dan 656 nm
secara berturut-turut adalah 1,55 jam-1; 1,59 jam-1; 1,38 jam-1; 1,48 jam-1 dan 0,16 jam-1. Dari hasil ini terlihat bahwa Mesophilobacter sp. tumbuh dengan cepat pada media dengan sumber nitrogen ekstrak khamir. Sumber nitrogen yang dapat menghasilkan pigmen pada penelitian ini adalah pepton dan ekstrak khamir, yang
mempunyai absorban maksimum pada lima panjang gelombang, yaitu λ 232 nm,
© Hak Cipta milik IPB, tahun 2000
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. pengutipan tersebut tidak merugikan kepentingan yang wajar bagi IPB.
PENGARUH FAKTOR FISIKOKIMIA TERHADAP
PEMBENTUKAN PIGMEN OLEH BAKTERI LAUT
MESOPHILOBACTER SP.
ENDANG S. SRIMARIANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Faktor Fisikokimia terhadap Pembentukan Pigmen oleh Bakteri Laut Mesophilobacter sp.
Nama Mahasiswa : Endang S. Srimariana
Nomor Pokok : 97388
Program Studi : Teknologi Kelautan
Disetujui
Komisi Pembimbing
Ketua
Dr. Ir. Linawati Hardjito, M.Sc.
Dr. Ir. Anwar Bey Pane, DEA
Anggota Anggota
Dr. Ir. Sukarno, M.Sc.
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Teknologi Kelautan
Prof. Dr. Ir. John Haluan, M.Sc. Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan pada Allah Bapa atas anugrahNya
sehingga tesis ini dapat diselesaikan dengan baik. Tesis dengan judul Pengaruh Faktor FisikoKimia terhadap Pembentukan Pigmen oleh Bakteri Laut
Mesophilobacter sp. disusun sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada Program Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini, dengan penuh ketulusan hati penulis menyampaikan
penghargaan dan terima kasih yang besar kepada Dr. Ir. Linawati Harjito, M. Sc.
selaku ketua komisi pembimbing yang juga mendanai penelitian ini dengan
menyediakan segala fasilitas yang dibutuhkan sehingga penelitian ini dapat
dilaksanakan. Dr. Ir. Anwar Bey Pane, DEA dan Dr. Ir. Sukarno masing-masing
selaku anggota komisi pembimbing, terima kasih atas pengarahan dan bimbingan
yang diberikan sejak penyusunan proposal hingga tesis ini dapat diselesaikan.
Dekan Fakultas Perikanan dan Rektor Universitas Pattimura Ambon yang telah
memberikan ijin untuk menempuh pendidikan pada Program Pascasarjana di
Institut Pertanian Bogor. Ketua Program Studi Teknologi Kelautan (TKL), serta
seluruh Staf Pengajar S2
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu
penulis mengharapkan masukan-masukan demi penyempurnaan tesis ini.
Akhirnya, semoga tesis ini dapat bermanfaat bagi yang memerlukannya.
PS TKL Program Pascasarjanan IPB, atas pelayanan,
fasilitas dan kesempatan yang diberikan. Suami dan anak-anak tercinta serta mami
papi yang saya hormati serta seluruh keluarga yang telah memberikan doa,
dorongan, pengorbanan dan semangat dengan penuh kesetiaan dan pengertian
untuk dapat melanjutkan studi sampai selesai.
Bogor, Desember 2000
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 12 Oktober 1961 di Airmadidi (Minahasa)
sebagai anak pertama dari enam bersaudara, dari keluarga bapak Bondan Bandono
dan ibu Fintje Wudan Waroh.
Pendidikan Sekolah Dasar ditempuh di SDK. St. Angela, Surabaya dari
tahun 1968 dan lulus pada tahun 1973. Pada tahun 1974 penulis menempuh
pendidikan di SMPK. Stella Maris, Surabaya dan lulus pada tahun 1976,
kemudian melanjutkan pendidikan di SMA Negeri II, Surabaya dan lulus pada
tahun 1980.
Pada tahun akademik 1980/1981, penulis diterima sebagai mahasiswa
Institut Pertanian Bogor, Bogor melalui Proyek Perintis II dan diterima pada
Fakultas Perikanan IPB pada tahun akademik 1981/1982, pada program studi
Pemanfaatan Sumberdaya Perikanan. Lulus sebagai Sarjana Perikanan pada tahun
1985.
Pada tahun 1986, penulis diangkat sebagai staf pengajar pada Fakultas
Kedokteran Hewan Universitas Airlangga, Surabaya hingga tahun 1994,
kemudian pindah pada Fakultas Perikanan Universitas Pattimura, Ambon pada
Jurusan Pengolahan Hasil Perikanan dari tahun 1994 hingga sekarang.
Penulis memperoleh kesempatan mengikuti pendidikan Program Pra
Pascasarjana, IPB pada tahun akademik 1996/1997 dan lulus pada tahun 1997
dengan beasiswa dari URGE-DIKTI. Selanjutnya pada tahun itu juga penulis
kembali memperoleh kesempatan mengikuti pendidikan Program Pascasarjana
pada Program Studi Teknologi Kelautan, IPB dengan beasiswa dari BPPS-DIKTI
dan ujian untuk mendapatkan gelar Magister Sains dilakukan pada tanggal 27 Juli
x
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
1.3 Manfaat Penelitian ... 4
1.4 Permasalahan ... 4
1.5 Hipotesis Penelitian ... 4
2. TINJAUAN PUSTAKA ... 5
2.1 Bakteri ... 5
2.2 Bakteri laut penghasil pigmen ... 6
2.2.1 Bakteri fototrof yang mengandung bakterioklorofil ... 6
2.2.2 Bakteri gram negatif, aerobik, berbentuk batang dan kokus ... 9
2.2.3 Bakteri gram negatif, fakultatif an aerobik, berbentuk batang ... 10
2.2.4 Bakteri gram negatif, an aerobik, berbentuk batang dan kokus ... 10
2.3 Pertumbuhan bakteri ... 10
2.3.1 Siklus pertumbuhan ... 11
2.3.2 Pengaruh faktor-faktor lingkungan pada pertumbuhan .... 13
2.3.3 Pengukuran kuantitatif pertumbuhan bakteri ... 17
2.4 Pewarna alami ... 18
2.4.1 Pewarna makanan ... 21
3. METODOLOGI PENELITIAN ... 23
3.1 Bahan dan alat ... 23
3.1.1 Bahan ... 23
3.1.2 Alat ... 24
3.2 Metode penelitian ... 24
3.2.1 Penelitian tahap pertama : Identifikais bakteri ... 25
3.2.2 Penelitian tahap kedua ... 27
3.2.3 Penelitian tahap ketiga ... 31
3.2.4 Pengamatan ... 34
3.2.5 Rancangan percobaan ... 35
3.2.6 Analisis data ... 35
xi
4. PENGARUH FAKTOR FISIKOKIMIA TERHADAP
PERTUMBUHAN BAKTERI DAN ATAU PEMBENTUKAN
PIGMEN ... 36
4.1 Pengaruh suhu terhadap pertumbuhan bakteri dan pembentukan pigmen ... 36
4.2 Pengaruh pH terhadap pembentukan pigmen ... 39
4.3 Pengaruh cahaya terhadap pertumbuhan bakteri dan pembentukan pigmen ... 42
4.4 Pengaruh salinitas terhadap pertumbuhan bakteri dan pembentukan pigmen ... 46
4.5 Pengaruh sumber karbon terhadap pertumbuhan bakteri dan pembentukan pigmen ... 49
4.6 Pengaruh sumber nitrogen terhadap pertumbuhan bakteri dan ... pembentukan pigmen ... 54
5. KESIMPULAN DAN SARAN ... 58
5.1 Kesimpulan ... 58
5.2 Saran ... 59
DAFTAR PUSTAKA ... 60
xii
DAFTAR TABEL
Halaman
1. Perbedaan sifat bakteri Gram-positif dan bakteri Gram-negatif ... 5
2. Metode untuk mengukur pertumbuhan bakteri ... 18
3. Pigmen pada tumbuhan dan alga ... 20
4. Pigmen pada vertebrata ... 20
5. Komposisi ekstrak khamir ... 24
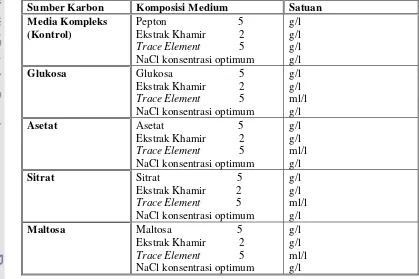
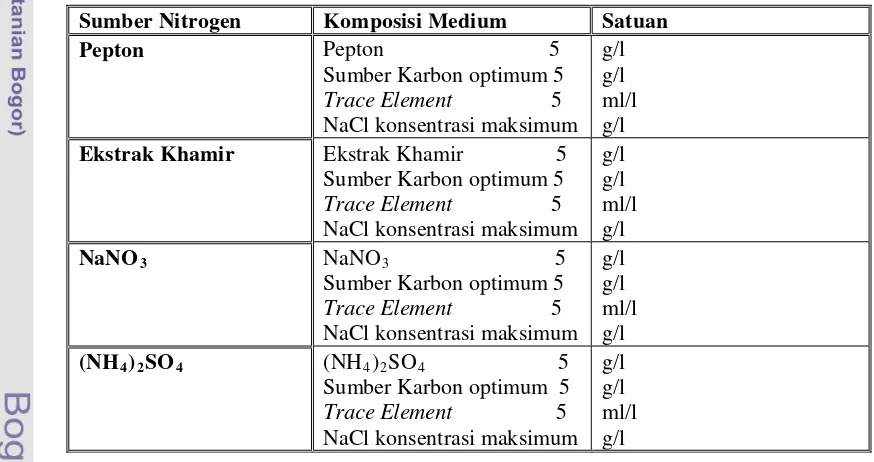
6. Komposisi medium cair yang digunakan pada percobaan sumber karbon ... 32
7. Komposisi medium cair yang digunakan pada percobaan sumber nitrogen ... 34
8. Hasil pengukuran beberapa variabel dari kultivasi Mesophilobacter sp. dalam media marine broth pada pH 7, suhu kultivasi berbeda. ... 38
9. Hasil pengukuran beberapa variabel dari kultivasi Mesophilobacter sp. dalam media marine broth pada pH percobaan 5, 7, dan 9; suhu kultivasi 30oC ... 42
10. Hasil pengukuran beberapa variabel dari kultivasi Mesophilobacter sp. dalam media marine broth dengan pH 9, suhu kultivasi 30oC serta perlakuan cahaya. ... 45
11. Hasil pengukuran beberapa variabel dari kultivasi Mesophilobacter sp. dalam media marine broth dengan pH 9 dan salinitas yang berbeda; serta suhu kultivasi 30oC. ... 48
12. Nilai hasil pengukuran variabel dari kultivasi Mesophilobacter sp. pada pH 9, sumber karbon yang berbeda, sumber nitrogen ekstrak khamir dan dikultivasi pada suhu 30oC dalam labu kocok. ... 51
13. Nilai hasil pengukuran beberapa parameter dari kultivasi Mesophilobacter sp. pada pH 9, sumber nitrogen yang berbeda, sumber karbon glukosa dan dikultivasi pada suhu 30oC dalam labu kocok ... 56
xiii
DAFTAR GAMBAR
Halaman
1. Susunan membran intrasitoplasma yang ditemukan pada bakteri
fotosintesis (Austin, 1988) ... 8
2. Kurva pertumbuhan bakteri (Schlegel dan Schmidt, 1994) ... 12
3. Kurva pertumbuhan sel dan pembentukan pigmen oleh
Mesophilobacter sp. pada suhu kultivasi 25oC, 30oC, dan 35oC
dengan pH 7 ... 36
4. Kurva pertumbuhan sel dan pembentukan pigmen oleh
Mesophilobacter sp. pada media pertumbuhan dengan pH 5, 7, dan 9 suhu 30oC ... 40
5 Kurva pertumbuhan sel dan pembentukan pigmen oleh
Mesophilobacter sp. pada suhu 30oC, pH 9 yang disertai dengan
perlakuan cahaya ... 43
6. Kurva pertumbuhan sel dan pembentukan pigmen oleh
Mesophilobacter sp. pada auhu 30 oC, pH 9 yang disertai dengan
perlakuan salinitas ... 47
7. Kurva pertumbuhan sel oleh Mesophilobacter sp. pada suhu 30 °C, pH 9, salinitas 10 permil dalam medium pertumbuhan dengan
berbagai sumber karbon ... 50
8. Kurva pertumbuhan sel dan pembentukan pigmen oleh
Mesophilobacter sp. pada suhu 30 oC, pH 9, salinitas 10 permil dalam medium pertumbuhan dengan berbagai sumber karbon ... 53
9. Kurva pertumbuhan sel dan pembentukan pigmen oleh
xiv
DAFTAR LAMPIRAN
Halaman
1. Hasil identifikasi bakteri ... 65
2. Konsentrasi sel dan pigmen pada masing-masing perlakuan faktor fisika dengan OD 540 nm ... 66
3. Contoh perhitungan laju pertumbuhan spesifik ... 68
4. Perhitungan analisis statistika dengan menggunakan Rancangan Acak Lengkap.. ... 69
5. Konsentrasi sel dan pigmen pada perlakuan sumber karbon ... 83
6. Konsentrasi sel dan pigmen pada perlakuan sumber nitrogen ... 84
7. Peralatan yang digunakan dalam penelitian ... 85
8. Perubahan warna pada media pertumbuhan selama kultivasi ... 86
9. Perubahan pH medium selama kultivasi ... 88
1
1.
PENDAHULUAN
1.1 Latar belakang
Indonesia adalah negara tropis yang dikelilingi oleh perairan dengan luas
lebih dari 60% wilayah teritorialnya. Indonesia memiliki sumberdaya hayati laut
dengan keragaman yang tinggi. Di antara sumberdaya hayati laut yang besar itu,
organisme yang dimanfaatkan sebagian besar adalah ikan, udang,
kerang-kerangan, dan rumput laut. Sumberdaya hayati lain yang juga mempunyai potensi
yang besar untuk dikembangkan adalah mikroorganisme laut, namun belum
banyak mendapat perhatian terutama di Indonesia.
Mikroorganisme laut yang meliputi bakteri, fitoplankton, mikroalga dan
lain-lain merupakan sumber bahan aktif dan bahan kimia yang sangat potensial.
Dari biota laut tersebut dapat dihasilkan berbagai bahan alami yang bermanfaat
antara lain untuk industri farmasi (seperti anti-tumor/anti-cancer, antibiotik,
anti-inflammatory), bidang pertanian (fungisida dan pestisida), industri kosmetik dan
makanan (pigmen dan polisakarida) (Zilinkas dan Lundin, 1993; Fenical dan
Jensen, 1993). Selanjutnya dari biota laut juga dapat dihasilkan protein serta
bahan diet sebagai sumber makanan sehat (asam lemak tak jenuh omega-3,
vitamin, asam amino, berbagai jenis gula rendah kalori) dan lain-lain.
Perkembangan bioteknologi dewasa ini memungkinkan pemanfaatan
mikroorganisme untuk menghasilkan produk-produk tersebut di atas.
Dalam industri pangan (makanan dan minuman) atau non pangan
(obat-obatan, kosmetika, dan farmasi), pigmen merupakan bagian terpenting yang tidak
bisa diabaikan. Selain ikut menentukan penerimaan produk oleh konsumen,
pigmen juga berperan sebagai salah satu indikator mutu pangan dan non pangan.
Karena pentingnya zat pewarna tersebut, maka berbagai upaya dilakukan untuk
membuat produk pangan dan non pangan dengan warna yang menarik.
Penambahan zat pewarna ke dalam produk pangan maupun non pangan baik
pewarna alami maupun sintetik merupakan hal yang tidak dapat dihindari.
Sejalan dengan berkembangnya industri di Indonesia maka penggunaan
pewarna sintetik juga semakin meningkat. Penggunaan pewarna sintetik ini perlu
2
kesehatan manusia (Jenie et al., 1994) seperti azorubin dan tartrazin yang terbukti
menyebabkan alergi (Fabre et al., 1993) dan bersifat karsinogenik (Blanc et al.,
1994). Berbeda dengan pewarna sintetik, pewarna alami tidak mengandung bahan
yang berbahaya bagi konsumen (Winarno, 1992). Dengan adanya kenyataan ini
maka penggunaan pewarna alami yang aman bagai kesehatan perlu ditingkatkan.
Biopigmen atau zat pewarna alami merupakan bahan yang penting dalam
industri baik pangan maupun non-pangan. Permintaan dan penggunaan zat
pewarna alami akan terus meningkat sejalan dengan meningkatnya kesadaran
masyarakat tentang arti keamanan dan kesehatan bagi kehidupan dan lingkungan.
Kebutuhan tersebut telah mendorong dilakukannya penelitian ke arah penemuan
dan atau produksi zat warna alami.
Bakteri diketahui dapat memproduksi pewarna alami yang menyerupai
pewarna alami yang terdapat di tanaman (Hendry, 1992). Bacillus megaterium
merupakan bakteri penghasil pigmen merah (Mitchell et al., 1986);
Flavobacterium dehydrogenans (Djafar, 1987 in Fardiaz dan Rini, 1994),
Rhodobacter sphaeroides, Rhodobacter sulfidophilus (Urakami dan Yoshida,
1993), Rhodopseudomonas spheroides (Goodwin et al., 1955) merupakan bakteri
penghasil pigmen karotenoid; Streptomyces sp. MAFF 10-06015 menghasilkan
pigmen biru (Yanagimoto et al., 1988); Actinomycetes menghasilkan pigmen
violet kehitaman dan pigmen kuning (Tanabe et al., 1995). Urakami dan Yoshida
(1993) menyatakan bahwa khlorofil merupakan pigmen yang sangat berguna pada
industri makanan.
Pewarna alami (biopigmen) dapat diproduksi melalui kultur
mikroorganisme (Evans dan Wang, 1984; Nelis dan Leenheer, 1991; Lin dan
Demain, 1993) serta kultur sel dan jaringan tanaman (Taya et al., 1992; Hanagata
et al., 1993; Taya et al., 1994) atau ekstraksi langsung dari tanaman atau bagian
tanaman. Dibandingkan dengan ekstraksi langsung dari tanaman atau bagian
tanaman maka produksi biopigmen dengan kultur mikroorganisme dan kultur sel
atau jaringan tanaman lebih baik karena faktor lingkungan yang mempengaruhi
produksi biopigmen dapat dikendalikan dengan baik.
Produksi pigmen dari bakteri laut, berkaitan erat dengan kondisi lingkungan
3
kondisi fisik maupun kondisi kimiawi sesuai, maka pertumbuhan bakteri juga juga
akan baik dan cepat yang ditandai dengan meningkatnya jumlah sel dalam media
pertumbuhan.
Mikroorganisme yang digunakan pada penelitian ini adalah bakteri laut
Gram-negatif yang diisolasi dari terumbu karang di Florida, Amerika Serikat.
Penelitian ini merupakan kerja sama antara Pusat Kajian Sumberdaya Pesisir dan
Lautan dengan Center of Marine Biotechnology, University of Maryland.
Identifikasi awal telah dilakukan, bakteri tersebut termasuk bakteri Gram negatif,
katalase positif, mereduksi nitrat menjadi nitrit dan dapat menghasilkan pigmen.
Untuk sementara bakteri tersebut diduga termasuk dalam genus Mesophilobacter
sp. dan akan dilakukan identifikasi lanjut untuk memastikan golongan bakteri
tersebut.
1.2 Tujuan penelitian
Tujuan penelitian ini adalah mengetahui pengaruh faktor fisika dan kimia
yang meliputi suhu, pH, cahaya, salinitas, sumber karbon dan sumber nitrogen
terhadap pertumbuhan sel bakteri laut Mesophilobacter sp. dan pembentukan
pigmennya, yang dapat dirinci sebagai berikut :
(1) Menentukan suhu kultivasi (25°C, 30°C dan 35°C) yang sesuai baik untuk pertumbuhan maupun untuk sintesa biopigmen.
(1) Menentukan pH kultivasi (5, 7 dan 9) yang sesuai untuk sintesa biopigmen.
(2) Menentukan intensitas cahaya (2350 Wm-2 : kondisi tanpa penambahan
cahaya, 4710 Wm-2, dan 12500 Wm-2
(3) Menentukan salinitas (0 permil, 10 permil, 20 permil, 30 permil dan 40
permil) yang sesuai baik untuk pertumbuhan maupun untuk sintesa
biopigmen.
) yang sesuai baik untuk pertumbuhan
maupun untuk sintesa biopigmen.
(4) Menentukan sumber karbon (glukosa, maltosa, asam asetat dan asam sitrat)
yang sesuai baik untuk pertumbuhan maupun untuk sintesa biopigmen.
(5) Menentukan sumber nitrogen (pepton, ekstrak khamir, natrium nitrat dan
amonium sulfat) yang sesuai baik untuk pertumbuhan maupun untuk sintesa
4
1.3 Manfaat penelitian
Manfaat penelitian ini adalah sebagai sumber informasi baik bagi peneliti
maupun bagi industri dalam memproduksi pigmen dari bakteri laut baik yang
berkaitan dengan pertumbuhan sel bakteri dan pembentukan pigmen.
Selanjutnya hasil penelitian ini diharapkan mampu memicu perkembangan
industrialisasi di Indonesia khususnya industri yang berlandaskan bioproses.
Biopigmen yang dihasilkan diharapkan dapat dimanfaatkan oleh industri di bidang
makanan dan minuman, farmasi, kosmetika dan lainnya.
1.4 Permasalahan
Permasalahan dalam penelitian ini adalah belum diketahuinya faktor
lingkungan baik faktor fisika maupun kimia yang meliputi suhu, pH, cahaya,
salinitas, sumber karbon dan sumber nitrogen yang berpengaruh pada
pertumbuhan bakteri dan ataupun pada pembentukan pigmen.
1.5 Hipotesis penelitian
Hipotesis yang diajukan dalam penelitian ini adalah:
(1) Suhu media pertumbuhan berpengaruh dalam pertumbuhan bakteri laut dan
pembentukan pigmen.
(2) pH media pertumbuhan berpengaruh dalam pembentukan pigmen oleh
bakteri laut.
(3) Cahaya media pertumbuhan berpengaruh dalam pertumbuhan bakteri laut dan
pembentukan pigmen.
(4) Salinitas media pertumbuhan berpengaruh dalam pertumbuhan bakteri laut
dan pembentukan pigmen.
(5) Sumber karbon media pertumbuhan berpengaruh dalam pertumbuhan bakteri
laut dan pembentukan pigmen.
(6) Sumber nitrogen media pertumbuhan berpengaruh dalam pertumbuhan
5
2. TINJAUAN PUSTAKA
2.1 Bakteri
Bakteri adalah sel prokariotik yang khas, uniseluler, dan tidak mengandung
struktur yang dibatasi membran di dalam sitoplasmanya. Dinding sel bakteri
merupakan struktur yang unik secara biokimia. Dinding sel pada beberapa bakteri
mengandung murein, yang juga dikenal sebagai peptidoglikan atau mucopeptida.
Lapisan peptidoglikan ini tidak ditemukan pada organisme eukariotik (Atlas,
1984).
Berdasarkan bentuknya, bakteri dibagi menjadi tiga kelompok utama, yaitu
bentuk kokus (bulat), bentuk basil (silinder atau batang), dan bentuk spiral (batang
melengkung atau melingkar-lingkar). Berdasarkan struktur dan dinding sel,
bakteri dibedakan menjadi bakteri Gram-positif dan bakteri Gram-negatif.
Perbedaan sifat bakteri Gram-positif dan bakteri Gram-negatif disajikan pada
Tabel 1 (Tortora et al., 1989).
Tabel 1 Perbedaan sifat bakteri Gram-positif dan bakteri Gram-negatif
Ciri-ciri Gram-positif Gram-negatif
Struktur dinding sel : Tebal (15 – 80 nm) Berlapis tunggal (mono)
Tipis (10 – 15 nm) Berlapis 3 (multi)
Komponen dinding sel : - Kandungan lipid dan
lipoprotein - Peptidoglikan
- Kandungan
lipopolisakarida (LPS) - Asam tekoat
- Toksin yang dihasilkan
Rendah
Komponen utama (90% dari dinding sel) Tebal (multilayer)
Tidak ada Kebanyakan ada, terutama eksotoksin
Tinggi
Jumlah sedikit (10% dari dinding sel)
Tipis (single layer)
Tinggi
Tidak ada, terutama indotoksin
Ketahanan terhadap pengeringan
Tinggi Rendah
Ketahanan terhadap gangguan fisik
Tinggi Rendah
6
2.2 Bakteri laut penghasil pigmen
Austin (1988) mengatakan bahwa sebagian besar bakteri yang terdapat pada
perairan laut terdiri dari bakteri Gram-negatif, sedangkan bakteri Gram-positif
sebagian besar terdapat pada sedimen. Pada umumnya, kebanyakan dari
bakteri-bakteri ini merupakan penghasil pigmen terutama pigmen kuning, oranye, atau
merah pada media padat.
2.2.1 Bakteri fototrof yang mengandung bakteriokhlorofil
Dikatakan pula kalau bakteri gram-negatif fototrof umumnya terdapat pada
permukaan perairan. Bakteri yang mengandung bakteriokhlorofil yang ditemukan
pada perairan laut, diwakili oleh lima famili, yaitu Chlorobiaceae (green sulphur
bacteria), Chromatiaceae (purple sulphur bacteria), Ectothiorhodospiraceae
(purple sulphur bacteria), Rhodospirillaceae (purple non-sulphur bacteria), dan
Thiocapsaceae (purple sulphur bacteria).
Selanjutnya Austin menyebutkan bahwa Famili Chlorobiaceae, yang
terdapat pada perairan laut adalah Chlorobium dan Prosthecochloris. Chlorobium
adalah bakteri an-aerob yang tidak dapat bergerak, berbentuk batang lurus atau
melengkung dengan vakuola yang tidak mengandung gas, mengandung pigmen
bakteriokhlorofil c, d, atau e, dan karotenoid, chlorobactene dan isorenieratene.
Pigmen-pigmen ini menyebabkan massa sel berwarna dari kuning – hijau – coklat,
yang terkandung pada vesikel yang terdapat di bawah dan melekat pada membran
sitoplasma (Gambar 1). Chlorobium yang terisolasi dari perairan laut adalah C.
limicola dan C. vibrioforme. Genus kedua adalah Prosthecochloris, yang
berbentuk bulat dan mengandung pigmen bakteriokhlorofil c atau e bersama-sama
dengan karotenoid, chlorobactene dan isorenieratene yang terdapat pada vesikel.
Prosthecochloris yang terisolasi dari lumpur pantai dan estuari adalah P. aestuarii
dan P. phaeoasteroidea.
Sedangkan Famili Chromatiaceae yang terdapat pada perairan laut adalah
Chromatium, Thiocystis dan Thiospirillum. Chromatium merupakan bakteri
an-aerob, tidak mempunyai vakuola, berbentuk batang dan menghasilkan lendir,
dapat bergerak dengan flagella polar. Memerlukan hidrogen sulfida untuk
fotosintesis, sedangkan sulfur yang dihasilkan disimpan pada sel intraseluler.
7
berbentuk bulat dengan diameter kira-kira 3,0 µm, mengandung okenone dan atau rhodopinal sebagai karotenoid yang memberikan warna purple – violet – merah
pada massa sel. Thiocystis yang ditemukan pada perairan dan lumpur pantai yang
mengandung hidrogen sulfida adalah T. gelatinosa dan T. violacea. Thiospirillum
jenense berbentuk spiral, mengandung likopene dan rhodopin sebagai karotenoid,
dan menyebabkan massa sel berwarna oranye – coklat.
Genus Ectothiorhodospira merupakan bakteri an-aerob yang berbentuk
spiral, sel tidak mempunyai vakuola, yang jika dapat bergerak karena memiliki
flagella polar. Bakteriokhlorofil a atau b terdapat pada stacked membrane
(Gambar 1), dan massa sel berwarna hijau atau merah. Hidrogen sulfida dioksidasi
selama fotosintesis dan melepaskan sulfur yang kemudian disimpan pada bagian
luar sel. Yang ditemukan pada perairan pantai adalah E. halochloris, E. halophila
dan E. mobilis (Truper dan Imhoff, 1981 in Austin, 1988).
Famili Rhodospirillaceae meliputi Rhodocyclus, Rhodomicrobium,
Rhodopseudomonas dan Rhodospirillum. Dari genus Rhodocyclus, contohnya
adalah R. purpureus, merupakan bakteri mikro-aerofilik, tidak bergerak,
merupakan sel dengan pigmen purple – violet. Karotenoid meliputi rhodopin dan
rhodopinal. Pigmen fotosintesis terdapat pada membran intrasitoplasma, tersusun
seperti tabung (Gambar 1) (Truper dan Pfennig, 1981 in Austin, 1988).
Rhodomicrobium, meliputi R. vannielii, merupakan bakteri Gram-negatif yang
an-aerob, mampu melakukan metabolisme oksidasi pada kondisi mikro-aerofilik dan
aerobik. Organisme ini memiliki sebuah sistem membran lamellar (Gambar 1),
mengandung bakteriokhlorofil a, karotenoid grup I dan β-karoten (Moore, 1981 in Austin, 1988). Rhodopseudomonas mempunyai dua spesies yang telah diisolasi
dari air laut, yaitu R. marina (Imhoff, 1983 in Austin, 1988) dan R. sulfidophila
(Hansen dan Veldkamp, 1973 in Austin, 1988). Bakteri ini dikenal sebagai purple
non-sulphur bacteria, toleran terhadap konsentrasi sulfida yang rendah yang tidak
dioksidasi menjadi sulfat, tetapi dioksidasi menjadi thiosulfat dan sulfur. Bakteri
berbentuk batang pendek, bergerak dengan flagella polar. Pigmen fotosintesis,
yaitu bakteriokhlorofil a dan karotenoid dari spirilloxanthine, yang terdapat pada
membran intrasitoplasma, tersusun seperti stacks (Gambar 1) dan terletak sejajar
8
contohnya adalah spesies R. salexigens, bakteri Gram-negatif, berbentuk spiral
atau melengkung yang bergerak dengan flagella bipolar. Pigmen utama adalah
bakteriokhlorofil a dan spirilloxanthine yang terdapat pada membran
intrasitoplasma, tersusun sejajar dengan membran sitoplasma (Drews, 1981 in
Austin, 1988).
Dari genus Thiocapsa, yang ditemukan pada lumpur estuarin dan lumpur
pantai adalah T. pfennigii dan T. roseopersicina. Sel bakteri berbentuk bulat
dengan diameter 1,2 – 3,0 µm, tidak mempunyai vakuola, tidak bergerak, pigmen sel terdiri dari orange – coklat – pink – merah. Karotenoid merupakan
spirilloxanthine dan tetrahydrospirilloxanthine. Bersama dengan bakteriokhlorofil
a dan b, pigmen terdapat pada membran intrasitoplasma yang berbentuk vesicular
atau tube (Gambar 1) (Austin, 1988).
Keterangan :
1 = tubes, ditemukan pada Rhodocyclus, Rhodopseudomonas dan Rhodospirillum;
2 = bundled tubes seperti yang ditemukan pada Thiocapsa;
3 = stacks, ditemukan pada Ectothiorhodospira dan Rhodospirillum;
4 = membran seperti pada Rhodomicrobium dan Rhodopseudomonas;
5 = vesicle, yang umum pada Chromatium, Rhodopseudomonas, Rhodospirillum,
Thiocapsa dan Thiospirillum.
Gambar 1 Susunan membran intrasitoplasma yang ditemukan pada bakteri fotosintesis (Austin, 1988).
Dua genera yang lain, yaitu Chloroherpeton dan Erythrobacter.
9
Gram-negatif, berbentuk batang panjang, merupakan organisme green sulphur,
gliding dan obligat fototrof, mempunyai pigmen bakteriokhlorofil c dan sedikit
bakteriokhlorofil a bersama γ - karoten, memerlukan CO2 dan sulfida untuk
tumbuh. Sulfur disimpan di luar sel (Gibson et al., 1984 in Austin, 1988).
Erythrobacter, dengan spesies E. longus, tidak tumbuh secara fototrofik. Tetapi
selnya mengandung bakteriokhlorofil a, berbentuk batang oval, bergerak dengan
flagella sub-polar, aerobik, memerlukan biotin, memproduksi katalase, oksidase
dan fosfatase, menguraikan gelatin, menggunakan atau memanfaatkan glukosa,
asetat, butirat, glutamat dan piruvat sebagai sumber karbon (Shiba dan Simidu,
1982 in Austin, 1988).
2.2.2 Bakteri Gram-negatif, aerobik, berbentuk batang dan kokus
Organisme halofilik, yang memerlukan 15% NaCl, merupakan famili
Halobacteriaceae, dan terdapat pada lingkungan lautan adalah Halobacterium dan
Halococcus. Halobacterium yang terisolasi dari laut adalah H. denitrificans, H.
mediterranei, H. pharmaconis, H. saccharovorum, H. salinarium, H. sodomense
dan H. volcanii. Halobacterium merupakan bakteri Gram-negatif berbentuk
batang, dapat bergerak atau tidak, memiliki metabolisme respiratory, dan
memproduksi katalase dan oksidase. Bakteri ini menghasilkan koloni berwarna
pink, merah, atau oranye. Pertumbuhan terbaik pada NaCl 20 - 26 %. Ciri-ciri
yang sama juga dilaporkan pada Halococcus, yang terisolasi dari laut dan
diklasifikasikan sebagai H. morrhuae merupakan bakteri yang menghasilkan
pigmen pink, merah atau oranye, Gram-negatif tidak bergerak, berbentuk kokus
dan memproduksi katalase dan oksidase. Pembelahan sel dengan septasi.
Metabolisme dengan respiratory (Larsen, 1984 in Austin, 1988).
Alteromonas, merupakan bakteri Gram-negatif berbentuk batang yang
bergerak dengan flagellum tunggal yang polar. Bakteri ini melakukan
metabolisme secara respiratif, serta ditemukan pada perairan pantai dan lautan
terbuka. A. rubra membentuk pigmen warna merah, A. aurantia menghasilkan
pigmen warna oranye, A. citrea menghasilkan pigmen warna kuning lemon dan A.
10
Genera Chromobacterium dan Janthinobacterium merupakan bakteri
aerobik berpigmen purple, berbentuk batang, Gram-negatif, dan bergerak dengan
flagellum tunggal yang polar. Janthinobacterium lividum terdapat dalam jumlah
yang rendah pada perairan pantai (Austin, 1988).
2.2.3 Bakteri Gram-negatif, fakultatif an-aerobik, berbentuk batang
Serratia rubidea berpigmen merah, Gram-negatif, berbentuk batang, yang
menghasilkan katalase tetapi tidak oksidase, bergerak dengan flagella peritrichous
(Grimont dan Grimont, 1984).
Vibrio merupakan genus bakteri yang banyak ditemukan pada perairan
pantai dan estuarin. Berbentuk batang, menghasilkan katalase dan oksidase,
fermentatif, bergerak dengan flagella polar. V. fischeri merupakan bakteri yang
memancarkan cahaya, berpigmen oranye kekuningan. V. gazogenes menghasilkan
koloni dengan warna merah, Vibrio nigripulchritudo menghasilkan koloni dengan
pigmen biru kehitaman (Austin, 1988).
2.2.4 Bakteri Gram-negatif, an-aerobik, berbentuk batang dan kokus
Menurut Austin, 1988 dari famili Desulfurococcaceae, yang ditemukan di
laut dan menghasilkan pigmen adalah Desulfuromonas. Contoh bakteri ini adalah
D. acetoxidans, dengan ciri-ciri antara lain berbentuk batang, bergerak dengan
flagellum tunggal yang polar, membentuk koloni yang mengandung pigmen
peach – pink.
2.3 Pertumbuhan bakteri
Pada umumnya pertumbuhan didefinisikan sebagai peningkatan secara
teratur pada semua komponen-komponen kimiawi sel dan struktur sel. Kecepatan
pertumbuhan untuk sistem uniseluler didefinisikan sebagai peningkatan jumlah sel
atau massa sel per satuan waktu. Setiap terjadi pembelahan sel disebut dengan
satu generasi, waktu yang diperlukan untuk pembelahan disebut waktu generasi.
Waktu generasi bervariasi antara mikroorganisme : biasanya bakteri memerlukan
satu sampai tiga jam untuk membelah diri tetapi ada juga yang hanya memerlukan
10 – 20 menit sedangkan mikroba yang lain memerlukan waktu 24 jam atau
11
Bakteri dapat tumbuh pada sistem tertutup, yang dikenal sebagai batch
culture atau pada sistem terbuka, dimana proses berlangsung secara kontinu. Pada
sistem terbuka, pertumbuhan dikontrol dengan menambahkan nutrien segar dan
membuang medium sisa dan sel-sel dari wadah pertumbuhan.
2.3.1 Siklus pertumbuhan
Pertumbuhan suatu populasi bakteri pada sistem tertutup hanya terwakili
pada tahap atau fase eksponensial (Gambar 2). Pertumbuhan bakteri dapat
dinyatakan secara grafik dengan menggunakan data hasil pengukuran populasi
bakteri yang hidup dalam kultur media cair pada selang waktu yang tetap.
Pertumbuhan bakteri terdiri dari beberapa fase (tahap) yaitu : (1) tahap
ancang-ancang (lag phase), (2) tahap eksponensial (logaritmic phase), (3) tahap
stasioner (stationair phase) dan (4) tahap kematian (death phase) (Middelbeek et
al., 1992 a
Pada lag phase, tidak ada peningkatan jumlah sel atau turbiditas karena
bakteri sedang beradaptasi dengan lingkungan yang baru. Hal ini dapat
disebabkan oleh beberapa faktor, diantaranya adalah adanya kemungkinan
medium tidak optimal untuk organisme sehingga organisme perlu mensintesa
enzym agar mampu menggunakan substrat sebagai sumber energi atau untuk
sintesis material sel. Selama fase ini massa sel dapat berubah tanpa adanya suatu
perubahan jumlah sel (Sa’id, 1987). ).
Schlegel dan Schmidt (1994) menjelaskan bahwa, tahap ancang-ancang
mencakup interval waktu antara saat penanaman dan saat tercapainya kecepatan
pembelahan maksimum. Lamanya tahap ancang-ancang tergantung dari
konsentrasi awal, umur, bahan yang ditanam dan sifat medium pertumbuhan.
Dikatakannya pula bahwa tahap pertumbuhan eksponensial atau logaritmik
ditandai oleh kecepatan pembelahan maksimum yang konstan. Kecepatan
pembelahan pada fase logaritmik bersifat spesifik untuk tiap jenis bakteri dan
tergantung pada kondisi lingkungan, misalnya suhu dan komposisi medium kultur
(Middelbeek et al., 1992a). Karena kecepatan pembelahan diri relatif konstan pada tahap logaritmik, maka dapat digunakan untuk mempelajari pengaruh
12
pertumbuhan dan untuk mengetahui kemampuan mikroorganisme menggunakan
berbagai substrat.
Y
(3)
(2) (4)
(1)
X
Keterangan : X Waktu inkubasi
Y Jumlah sel bakteri (1) Tahap ancang-ancang
(2) Tahap eksponensial (3) Tahap stasioner
(4) Tahap menuju kematian
Gambar 2 Kurva pertumbuhan bakteri (Schlegel dan Schmidt, 1994).
Secara matematis, pertumbuhan eksponensial dapat didekati dengan dua
cara. Pendekatan pertama dengan menentukan jumlah awal sel. Perubahan jumlah
sel karena pembelahan atau pertumbuhan, diekspresikan dengan persamaan
(Middelbeek et al., 1992a Nt = No . 2
) :
Log Nt = log No + n log 2
n
n/t = (log Nt – log No) / t log 2
dimana : Nt = jumlah sel setelah waktu tertentu No = jumlah awal sel
N = banyaknya pembelahan
n/t = banyaknya pembelahan per satuan waktu yang disebut juga dengan konstanta kecepatan pertumbuhan (k)
Pendekatan lain adalah dengan menggambarkan kecepatan pertumbuhan
populasi sebagai suatu reaksi autokatalitik. Kecepatan reaksi katalis tergantung
pada banyaknya katalis. Pada kasus ini, biomassa merupakan katalis yang
13
biomassa pada waktu tertentu. Pertumbuhan eksponensial dapat dihitung dengan
menggunakan persamaan (Middelbeek et al., 1992 a
Banyaknya biomassa pada satuan waktu tertentu : Xt = Xo . e ) : dx/dt = µ.X
Kecepatan pertumbuhan spesifik adalah : µ = (ln Xt – ln Xo) / t µt
dimana : dx/dt = kecepatan pertumbuhan
µ = kecepatan pertumbuhan spesifik
X = banyaknya biomassa
Tahap stasioner dimulai ketika sel-sel sudah tidak tumbuh lagi. Kecepatan
pertumbuhan tergantung dari kadar substrat. Menurunnya kecepatan pertumbuhan
sudah terjadi ketika kadar substrat berkurang sebelum substrat habis terpakai.
Penurunan kecepatan pertumbuhan juga disebabkan oleh kepadatan populasi yang
tinggi, tekanan parsial oksigen yang rendah dan timbunan produk metabolisme
yang bersifat toksik (mengintroduksi tahap stasioner). Pada tahap stasioner
bahan-bahan simpanan masih dapat digunakan, sebagian ribosom dapat diuraikan dan
masih ada pembentukan enzim. Selama energi yang dibutuhkan untuk
mempertahankan sel-sel masih dapat diperoleh dengan respirasi bahan simpanan
dan protein, bakteri masih mampu mempertahankan hidupnya untuk masa yang
cukup panjang. Masa bakteri yang dicapai pada tahap stasioner dinamakan hasil
atau keuntungan.
Tahap kematian dan sebab-sebab kematian sel bakteri dalam larutan biak
normal belum banyak diteliti. Pada tahap ini terjadi penimbunan asam misalnya
pada bakteri Escherichia coli dan Lactobacillus sp. Jumlah sel hidup dapat
berkurang secara eksponensial. Ada kemungkinan sel-sel diuraikan kembali oleh
enzim yang dihasilkan sendiri oleh sel (autolisis).
2.3.2 Pengaruh faktor lingkungan pada pertumbuhan
Ada beberapa faktor lingkungan yang mempengaruhi pertumbuhan bakteri
yaitu faktor-faktor fisika dan faktor-faktor kimia. Faktor-faktor fisika yang
mempengaruhi pertumbuhan bakteri antara lain yaitu suhu, ketersediaan air, pH,
tekanan hidrostatik dan cahaya (Middelbeek dan Drijver – de Haas, 1992).
Faktor-faktor kimia sebagai sumber nutrisi yang juga mempengaruhi pertumbuhan yaitu
14
Co, Mo, Ni, Cu, dan Cl) dan faktor-faktor pertumbuhan (Middelbeek et al.,
1992b
Faktor Fisiko Kimiawi
).
(1) Suhu
Pengaruh suhu pada kecepatan pertumbuhan bakteri sebagian
menggambarkan pengaruh suhu pada kecepatan reaksi-reaksi (bio)kimia.
Berdasarkan toleransi suhu pertumbuhan, bakteri dapat diklasifikasikan menjadi
tiga kelompok : Psikrofil, yaitu bakteri yang dapat tumbuh pada suhu yang
rendah, pada perairan Arctic dan Antarctic (di bawah 0oC), perairan laut dengan suhu 1oC sampai 5oC. Suhu optimum bagi pertumbuhan bakteri psikrofil adalah 15oCatau lebih rendah dan suhu minimum 0oC. Bakteri fakultatif psikrofil atau
psikrotrop yaitu bakteri yang mempunyai suhu optimum pertumbuhan pada 25oC
sampai 30oC dan suhu maksimum pertumbuhan pada 35oC. Mesofil, yaitu bakteri yang hidup pada manusia dan hewan berdarah panas, pada daratan dan perairan di
daerah beriklim sedang dan tropis. Kisaran suhu bagi bakteri mesofil adalah 20oC
dan 40oC, dengan suhu optimum untuk pertumbuhan adalah 37oC. Thermofil,
yaitu bakteri yang pertumbuhannya optimum pada suhu 50oC sampai 70o
(2) pH
C
(Middelbeek dan Drijver-de Haas, 1992).
Semua mikroorganisme mempunyai kisaran pH tertentu dimana mereka
dapat tumbuh dan biasanya pada kisaran itu merupakan pH optimum dimana
mereka tumbuh dengan sangat baik. Pada umumnya bakteri tumbuh baik pada
kisaran pH 6,5 - 7,5.
Nilai pH air laut berkisar antara 7,5 dan 8,5 (Austin, 1988). Pada bakteri
yang dibiakkan di laboratorium, pH medium merupakan salah satu faktor penting
yang mempengaruhi pertumbuhan dan pembentukan produk. Selain itu, pH
medium juga sangat dipengaruhi oleh hasil metabolisme dari bakteri, oleh sebab
itu pH medium mempunyai kecenderungan berubah.
Pada proses fermentasi, bakteri menghasilkan asam organik (asam laktat,
asam asetat dan lain-lain) dan amonia yang dilepaskan ke medium saat asam
amino terfermentasi, sehingga pH medium mempunyai kecenderungan berubah.
15
larutan (di bawah pH 9) berbentuk NH4+; mikroorganisme kemudian
menggabungkannya dengan sel sebagai R-NH3+, dimana R adalah suatu gugus
karbon. Pada saat proses fermentasi berlangsung, sebuah ion H+ tertinggal di dalam medium. Bila nitrat adalah sumber nitrogen, maka ion-ion nitrogen diambil
dari medium untuk mereduksi NO3 menjadi R-NH3+
(3) Cahaya
, dan pH cenderung naik.
Untuk mempertahankan pH medium, dapat ditambahkan asam chlorida atau
natrium hidroksida.
Persyaratan cahaya hanya penting untuk pertumbuhan mikroorganisme
fotosintetik. Untuk mendapatkan pertumbuhan mikroorganisme fototropik dari
jenis yang berbeda, harus menggunakan cahaya dengan panjang gelombang yang
tepat. Eukariot dan alga biru hijau mengabsorbsi cahaya pada spektrum merah
terakhir sedangkan bakteri fotosintetik pada spektrum infra merah (Middelbeek et
al., 1992b
Cahaya dapat menyebabkan kerusakan pada sel bakteri dan dapat juga
menyebabkan kematian. Banyak dari mikroorganisme mempunyai
komponen-komponen sel yang sensitif terhadap cahaya. Komponen-komponen-komponen sel yang
menyerap cahaya yaitu sitokhrom, flavin dan khlorofil menjadi aktif ketika
menyerap cahaya dan menghasilkan energi yang lebih tinggi. Mereka kemudian
dapat mengembalikan energi tersebut seperti semula melalui pemancaran cahaya
(fluorescens) atau mentransfer energi ke komponen sel yang lain. Transfer energi
dapat menguntungkan organisme (fotosintesis) tetapi dapat juga merusak
organisme. Pada kasus yang terakhir, ada dua mekanisme yang menimbulkan
pengaruh berbahaya, salah satunya adalah molekuler oksigen. Kerusakan karena
oksigen bebas disebabkan oleh pembentukan radikal bebas (O ).
2
-(4) Unsur-unsur nutrisi
) yang sangat
reaktif dan destruktif (Middelbeek dan Drijver – de Haas, 1992).
Bakteri seperti organisme lain agar dapat tumbuh memerlukan nutrisi
esensial tertentu dari medium tempat hidup. Nutrisi esensial dibagi dalam dua
kelompok, yaitu nutrien yang diperlukan sebagai suplai energi untuk tumbuh dan
nutrien yang diperlukan sebagai suplai elemen-elemen kimia yang diperlukan
16
menggunakan energi kimia dan cahaya untuk tumbuh (Sokatch, 1973). Nutrien
yang diperlukan dalam jumlah yang cukup besar dan yang merupakan bagian
terbesar dari berat kering dalam sel, disebut dengan makro nutrien. Yang termasuk
dalam makro nutrien adalah C (50 %), O (20 %), N (14 %), H (8 %), P (3 %), dan
S (1 %) serta K, Na, Ca, Mg dan Fe (Middelbeek et al., 1992b
Elemen-elemen yang disebut sebagai mikronutrien atau disebut juga trace
element adalah Mn, Zn, Co, Mo, Ni, Cu dan Cl. Biasanya trace element
diperlukan sebagai kofaktor enzim atau sebagai aktivator. ).
Kelompok nutrien yang merupakan bahan-bahan organik yang tidak dapat
disintesis oleh sel bakteri disebut faktor-faktor pertumbuhan, oleh sebab itu
medium pertumbuhan harus mengandung kelompok nutrien ini. Berdasarkan
struktur kimiawi dan fungsi metaboliknya, faktor pertumbuhan dibagi dalam tiga
kelompok (Middelbeek et al., 1992b
Berdasarkan kebutuhan nutrisinya baik sebagai sumber energi maupun
sebagai sumber karbon, organisme diklasifikasikan oleh Middelbeek et al. (1992 ), yaitu : asam amino, sebagai unsur pokok
protein; purin dan pirimidin, sebagai unsur pokok asam nukleat; dan vitamin,
merupakan senyawa organik yang diperlukan sebagai kofaktor oleh enzim. Asam
amino, purin dan pirimidin diperlukan dalam jumlah yang cukup besar, karena
merupakan unsur pembentuk untuk sintesis biopolimer. Vitamin diperlukan dalam
jumlah yang kecil karena merupakan kofaktor bagi enzim.
b
- Fototrof, bila cahaya merupakan sumber utama energi.
)
sebagai berikut :
- Kemotrof, bila bahan kimiawi merupakan sumber utama energi.
- Autotrof, bila bahan anorganik merupakan sumber utama karbon.
- Heterotrof, bila bahan organik merupakan sumber utama karbon.
Dengan mengkombinasikan kelompok organisme tersebut di atas, dapat
dibentuk empat kelompok organisme yang lain, yaitu :
- Fotoautotrof, yaitu organisme yang menggunakan cahaya sebagai
sumber energi dan CO2
- Fotoheterotrof, yaitu organisme yang menggunakan cahaya sebagai
17
- Kemoautotrof, yaitu organisme yang menggunakan bahan kimiawi
sebagai sumber energi dan CO2
- Kemoheterotrof, yaitu organisme yang menggunakan bahan kimiawi
sebagai sumber energi dan bahan organik sebagai sumber karbon. sebagai sumber karbon.
Berdasarkan kebutuhan oksigen, bakteri dapat dibedakan atas bakteri aerob,
yaitu bakteri yang membutuhkan oksigen untuk hidup dan bakteri an-aerob, yaitu
bakteri yang tidak mampu menggunakan oksigen. Bakteri aerob dapat dibagi
dalam tiga kelompok yaitu bakteri aerob obligat, fakultatif, dan mikroaerofilik.
Bakteri aerob obligat memerlukan oksigen untuk pertumbuhannya, tetapi tidak
dapat tumbuh bila konsentrasi oksigen melebihi konsentrasi oksigen atmosfir (>
20%). Bakteri aerob fakultatif tidak memerlukan oksigen tetapi dapat tumbuh
dengan baik bila oksigen tersedia. Bakteri aerob mikroaerofilik memerlukan
oksigen tetapi dengan konsentrasi yang lebih rendah dari konsentrasi oksigen
atmosfir (2 – 10 % v/v). Bakteri an-aerob dapat dibagi dalam dua kelompok yaitu
bakteri an-aerob obligat dan bakteri an-aerob aerotoleran. Pada bakteri an-aerob
obligat, adanya oksigen dalam media pertumbuhannya merupakan racun dan
berbahaya bagi bakteri tersebut. Bakteri an-aerob aerotoleran yaitu bakteri yang
tidak dapat menggunakan oksigen untuk pertumbuhannya tetapi dapat
mentoleransi adanya oksigen (Tortora et al., 1989; Middelbeek et al., 1992).
2.3.3 Pengukuran kuantitatif pertumbuhan bakteri
Pengukuran kuantitatif pertumbuhan bertujuan untuk mengetahui berbagai
respon pertumbuhan mikroorganisme dalam berbagai media atau pada kondisi
yang berbeda-beda sehingga dapat digunakan dalam menilai daya dukung suatu
medium tertentu untuk menunjang pertumbuhan (Pelczar dan Chan, 1986).
Beberapa teknik untuk mengukur pertumbuhan mikroorganisme disajikan pada
Tabel 2.
Pertumbuhan populasi sel disertai juga dengan peningkatan total massa sel.
Pengukuran massa sel dapat dilakukan secara langsung atau tidak langsung
(Jenkins, 1992). Salah satu cara yang dapat digunakan untuk mengukur massa sel
secara langsung adalah dengan menentukan berat kering sel. Pengukuran berat
kering massa sel meliputi tiga tahap, yaitu : pemisahan organisme dari medium,
18
medium dengan filtrasi atau dengan sentrifugasi. Pencucian biomassa harus
dilakukan sedemikian rupa agar tidak terjadi lisis pada organisme karena pecah
akibat osmosis. Pengeringan biomassa biasanya dilakukan pada suhu 80oC selama 24 jam atau 110o
BK (g/l) = - x 10
C selama 8 jam (Jenkins, 1992). Berat Kering (BK) sel diperoleh
dengan cara sebagai berikut :
3
Pengukuran massa sel secara tidak langsung didasarkan pada kenyataan
bahwa sel bakteri memencarkan kembali cahaya yang membentur sel. Teknik
pengukuran ini merupakan teknik yang lebih cepat dan sensitif. Jumlah cahaya
yang tersebar adalah sebanding dengan konsentrasi sel yang ada. Banyaknya
cahaya yang menyebar dapat diukur dengan menggunakan spektrofotometer.
Dalam hal ini cahaya yang terukur sebanding dengan konsentrasi sel bakteri pada
tingkat absorbans yang rendah. Absorbans (A) didefinisikan sebagai logaritma
dari perbandingan antara intensitas cahaya yang melewati suspensi (Io) dengan
cahaya yang dipencarkan oleh suspensi (I), atau A = log(Io/I) (Jenkins, 1992). l
Tabel 2 Metode untuk mengukur pertumbuhan bakteri
Metode Beberapa penetapan
Hitungan mikroskopik Perhitungan bakteri dalam susu dan vaksin
Hitungan cawan Perhitungan bakteri dalam susu, air, makanan, tanah, biakan dan sebagainya
Membran atau filter molekuler Sama seperti hitungan cawan
Pengukuran kekeruhan Uji mikrobiologis, pendugaan hasil panen sel, biakan, atau suspensi berair
Penentuan nitrogen Pengukuran panen sel dari suspensi biakan kental untuk digunakan pada penelitian mengenai metabolisme
Penentuan berat kering Sama seperti penentuan nitrogen
Pengukuran aktivitas biokimia Uji mikrobiologis
Sumber : Pelczar dan Chan, 1986
2.4 Pewarna alami
Pewarna alami dalam sistem biologi didefinisikan sebagai pewarna yang
terbentuk dan terakumulasi dalam atau dikeluarkan dari sel hidup (Hendry, 1992).
19
jenis dari organisme (hewan, tumbuhan atau bakteri) penghasil pewarna tersebut.
Sehubungan dengan pewarna makanan, bakteri, fungi sel tunggal dan fungi
sederhana bersama-sama dengan alga sel tunggal dan juga zooplankton sederhana
dapat menjadi sumber pewarna baru karena potensinya untuk dieksploitasi dengan
teknik kultur. Pigmen dari organisme yang lebih tinggi seperti hewan, tumbuhan
dan fungi, lebih kecil kemungkinan untuk dieksploitasi karena struktur pigmennya
yang kompleks dengan jaringan sel yang kuat atau karena pigmen dari organisme
yang lebih tinggi hanya terbentuk pada saat-saat kritis dari perkembangan
organisme dalam suatu siklus hidup yang kompleks. Sebagai contoh, pigmen yang
berfungsi sebagai bahan perangsang dalam reproduksi seksual yang terbentuk
hanya setelah aspek-aspek lain dari siklus hidup selesai.
Klasifikasi pigmen pada sistem biologi menurut Hendry (1992) adalah
sebagai berikut :
(1) Tumbuh-tumbuhan termasuk alga
Pigmen dari tumbuhan merupakan penyumbang terbesar pewarna alami,
namun kisaran atau variasi pigmen yang terdapat pada tumbuhan adalah kecil.
Pewarna dominan yang berasal dari tumbuhan darat adalah khlorofil (2 jenis),
karotenoid (4 – 5 jenis) dari flavonoid (3 jenis). Dari lautan, terdapat 4 jenis
khlorofil yang umum, 6 atau 7 karotenoid dan 2 bentuk phycobilin. Kontribusi
pigmen lainnya dari tumbuhan, termasuk betalain, melanin, anthraquinon,
naphthaquinon, karoten yang tidak umum, xanthofil dan beberapa flavonoid yang
relatif tidak signifikan bila dilihat secara global. Pigmen-pigmen yang terdapat
pada tumbuhan termasuk alga disajikan pada Tabel 3.
(2) Hewan vertebrata
Pada hewan vertebrata, kelas-kelas yang menghasilkan pewarna adalah
burung, amphibi, ikan bertulang dan beberapa reptil. Pigmen tersebut disajikan
pada Tabel 4.
(3) Hewan invertebrata
Distribusi pigmen pada hewan lebih rendah lebih besar daripada vertebrata
20
Tabel 3 Pigmen pada tumbuhan dan alga
Pigmen Contoh Terdapat pada
Khlorofil a
b c, d
Semua organisme eukariot yang berfotosintesis Semua tumbuhan darat, beberapa alga
Alga coklat dan lainnya
Phycobilin Phycocyanin
Phycoerythrin
Alga biru –hijau dan lainnya Alga merah dan lainnya
Karotenoid Lutein
β-caroten
Violaxanthin Neoxanthin Fucoxanthin
Xanthofil lebih melimpah, umumnya pada organisme fotosintetik
Karoten lebih melimpah, umumnya pada organisme fotosintetik
Umum pada tumbuhan lebih tinggi Umum pada tumbuhan lebih tinggi Alga coklat dan lainnya
Anthocyanidin Cyanidin
Pelargonidin Delphinidin
Yang paling umum anthicyanidin, tersebar luas pada tumbuhan lebih tinggi
Umum pada tumbuhan lebih tinggi Umum pada tumbuhan lebih tinggi
Betalain Betacyanin Tersebar luas tetapi terbatas pada satu ordo timbuhan
Sumber : Hendry, 1992
Tabel 4 Pigmen pada vertebrata
Kelas Pigmen
Mamalia Terutama melanin
Burung (termasuk telurnya) Melamin
Karotenoid
Ikan bertulang rawan Melanin
Sumber : Hendry, 1992
(4) Fungi
Fungi, terutama fungi sel tunggal yang lebih sederhana dapat diambil untuk
kultur skala besar, mempunyai potensi yang sangat besar sebagai sumber pigmen
alami.
(5) Bakteri
Pada umumnya bakteri mengandung banyak pigmen yang sama atau identik
dengan pigmen dari organisme yang lebih kompleks terutama tumbuhan. Klorofil
21
Karotenoid dari bakteri mempunyai ciri tersendiri yang berbeda tetapi secara
struktural dan biosintetik berhubungan erat dengan karotenoid dari tumbuhan dan
hewan. Kebanyakan bakteri baik fotosintetik maupun non-fotosintetik juga
mengandung β- dan γ-karoten.
2.4.1 Pewarna makanan
Pada umumnya pewarna makanan dapat dibagi dalam tiga kategori utama
(Bauernfeind, 1981), yaitu :
(a) Pewarna organik alami yang berasal dari tumbuhan atau hewan, diekstrak dari
alam atau senyawa-senyawa identik yang dihasilkan melalui sintesis kimiawi.
(b) Pewarna inorganik yang diambil dari alam atau dihasilkan secara sintetis.
(c) Pewarna buatan, yaitu senyawa-senyawa sintetis yang tidak berasal dari alam
atau tidak terdapat pada makanan yang dikonsumsi.
Secara kimiawi menurut Bauernfeind (1981) pewarna makanan alami dapat
dibagi menjadi beberapa grup, yaitu :
(a) Derivat isoprenoid (warna-warna karotenoid)
(b) Derivat tetrapyrrol (warna-warna klorofil dan heme)
(c) Derivat benzopiran (anthosianin dan flavonoid)
(d) Senyawa betalain (warna betanin dan yang berhubungan)
(e) Flavin (seperti riboflavin)
(f) Pigmen inorganik
Alasan ditambahkannya pewarna pada makanan menurut Henry (1992)
antara lain adalah untuk memperkuat warna pada makanan, memastikan
keseragaman warna makanan, memulihkan warna awal makanan yang berubah
karena pengaruh pengolahan, dan untuk memberi warna pada makanan tertentu
yang sebenarnya tidak berwarna.
Pewarna alami untuk makanan merupakan kelompok pewarna yang
berbeda-beda karakteristik solubilitas dan stabilitasnya. Oleh sebab itu setiap pewarna
tersedia dalam beberapa bentuk aplikasi yang berbeda, yang diformulasikan agar
pewarna sesuai dengan sistem makanan tertentu. Suatu bentuk aplikasi produk
pewarna adalah suatu formula yang memungkinkan bahan tambahan pangan
dengan mudah dan efisien tercampur dalam produk-produk makanan. Beberapa
22
oleh ahli teknologi pangan adalah solubilitas, bentuk fisik, pH, kualitas
mikrobiologis dan bahan-bahan lain (Henry, 1992).
Karakteristik pewarna makanan yang baik menurut Bauernfeind (1981)
adalah sebagai berikut :
(1) Tidak toksik dan tidak bersifat karsinogenik pada berbagai level; tidak
mengandung bahan-bahan yang toksik.
(2) Kemampuan larut (solubilitas) dan kemampuan menyebar yang baik agar
dapat menyatu dengan produk-produk makanan dengan dasar air dan lemak.
(3) Tidak memberikan rasa atau bau yang berbeda terhadap produk-produk
makanan.
(4) Harus stabil terhadap cahaya, terhadap kisaran pH yang luas terutama pH 2 -
8, pada suhu panas, dan selama penyimpanan dan perlakuan sebelum
dikonsumsi.
(5) Tidak bereaksi dengan trace element atau dengan oxidizing atau
bahan-bahan pereduksi.
(6) Harus seragam pada tiap bagian dan dapat dimonitor baik dalam bentuk
konsentrat maupun dalam makanan dengan teknik analitis.
(7) Tersedia luas dan relatif ekonomis untuk digunakan pada makanan.
(8) Disetujui dan sesuai dengan spesifikasi pemerintah dan lebih baik bila
23
3. METODOLOGI PENELITIAN
3.1 Bahan dan alat
3.1.1 Bahan
1). Mikroorganisme
Mikroorganisme yang digunakan pada penelitian ini adalah bakteri laut
Gram-negatif yang diisolasi dari terumbu karang di Florida, Amerika Serikat yang
disediakan oleh Center of Marine Biotechnology, University of Maryland.
2). Media Pertumbuhan
Media yang digunakan terdiri dari media padat dan cair. Media padat
berfungsi untuk memelihara stok bakteri, yang dimodifikasi dari komponen
nutrien agar (Tortora et al., 1986). Media ini mengandung ekstrak khamir (2 g/l),
pepton (5 g/l), NaCl (20 g/l), agar (20 g/l). Komposisi ekstrak khamir dapat
dilihat pada Tabel 5. Media cair berfungsi sebagai media pertumbuhan bakteri dan
pembentukan pigmen. Media cair terdiri dari ekstrak khamir (2 g/l), pepton (5 g/l),
NaCl (20 g/l) dan trace element (5 ml/l). Komposisi trace element adalah
Na2EDTA (4,36 mg/l), FeCl36H2O (3,15 mg/l), CuSO45H2O (0,01 mg/l),
ZnSO47H2O (0,02 mg/l), CoCl26H2O (0,01 mg/l), MnCl24H2O (0,18 mg/l), dan
Na2MoO42H2O (0,006 mg/l). Untuk mempelajari pengaruh karbon dan nitrogen
dalam pertumbuhan dan pembentukan pigmen dari bakteri laut, maka digunakan
juga media cair yang terdiri dari sumber karbon dan sumber nitrogen. Sumber
karbon yang digunakan dalam penelitian ini adalah glukosa, asetat, sitrat,dan
maltosa. Sumber nitrogen yang digunakan adalah pepton, ekstrak khamir,
(NH4)2SO4, dan NaNO3. Selain sumber karbon dan nitrogen, di dalam medium
cair juga ditambahkan NaCl dan trace element. Bahan kimia lainnya adalah
24
Tabel 5 Komposisi ekstrak khamir
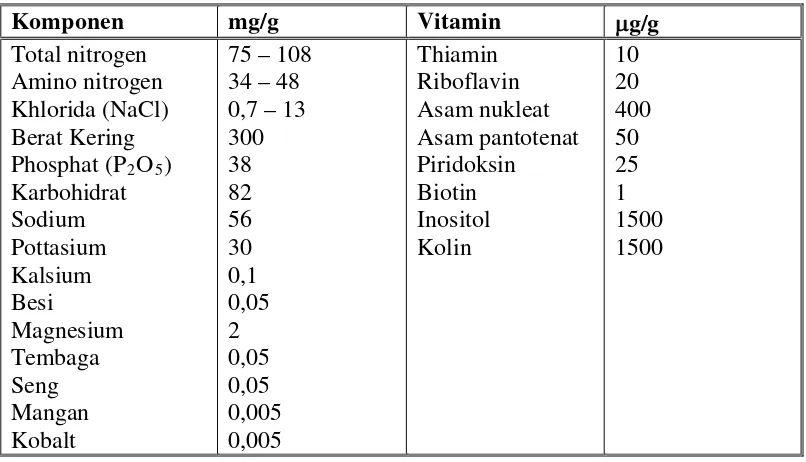
Komponen mg/g Vitamin µg/g
Sumber : Bridson and Brecker (1970) in Sikyta (1983)
3). Penentuan Gram pada Identifikasi Bakteri
Bahan yang digunakan untuk identifikasi gram bakteri laut adalah : kristal
violet, larutan lugol, etanol 95%, aseton, safranin dan aquades.
3.1.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi, cawan
petri, labu erlenmeyer, batang pengaduk, pipet, penjepit, lup inokulasi, vortex
mixer, inkubator, timbangan analitik, autoklaf, gelas ukur, sentrifus, clean bench,
inkubator goyang, spektrofotometer, refrigerator, kertas pH, tissue dan aluminium
foil.
3.2 Metode penelitian
Penelitian ini terdiri dari tiga tahap. Tahap pertama penelitian adalah
identifikasi bakteri. Tahap kedua adalah penelitian yang bertujuan untuk mencari
suhu, pH, cahaya dan salinitas optimum bagi pertumbuhan sel bakteri dan
pembentukan pigmen. Tahap ketiga adalah penelitian yang bertujuan untuk
mengetahui pengaruh sumber karbon dan sumber nitrogen terhadap pertumbuhan
25
Selain itu, sebelum penelitian dimulai dilakukan pembuatan media untuk
stok bakteri dan penyegaran bakteri yang digunakan dalam proses fermentasi,
dengan langkah-langkah sebagai berikut :
(a) Pembuatan media padat
Pembuatan media dilakukan dalam labu erlenmeyer 500 ml dengan volume
medium 250 ml. Komposisi media padat terdiri dari pepton 5 g, ekstrak khamir 2
g, NaCl 20 g, dan agar 20 g. Semua bahan dilarutkan dengan 1 liter aquades, pH
medium diatur pada 7. Media disterilkan dalam autoklaf pada suhu 121o
(b) Penyegaran bakteri
C selama
15 menit. Setelah itu media dituang ke dalam cawan petri, masing-masing
sebanyak 20 ml secara aseptik. Setelah media dingin dan padat, siap digunakan
untuk penyegaran bakteri.
Bakteri digoreskan pada media padat secara aseptik. Setelah itu bakteri
diinkubasikan dalam inkubator pada suhu 30oC selama 24 jam.
3.2.1 Penelitian tahap petama: Identifikasi bakteri
Identifikasi bakteri dilakukan berdasarkan morfologi dan ciri-ciri fisiologi
bakteri.
1). Morfologi
(1). Pewarnaan Gram
Bakteri dioles di atas gelas obyek sebanyak satu lup dan diratakan dengan
aquades secukupnya hingga ukuran 1 x 1 cm, kemudian difiksasi di atas api
hingga kering. Tetesi dengan pewarna kristal violet dan dibiarkan selama 1 menit.
Dicuci dengan larutan lugol dan dibiarkan selama 1 menit. Bilas dengan aquades,
kemudian dibilas lagi dengan campuran etanol 95% sebanyak 80 ml dan aseton 20
ml, selama 1 menit. Dibilas kembali dengan aquades, kemudian diwarnai dengan
safranin selama 1 menit. Selanjutnya dibilas dengan aquades dan dikeringkan.
Preparat siap diamati dengan mikroskop; bila berwarna violet gelap berarti
termasuk dalam bakteri Gram-positif, bila berwarna oranye maka termasuk dalam