1 PENDAHULUAN
1.1 Latar Belakang
Mikroalga Spirulina merupakan potensi hasil perairan yang telah luas digunakan sejak seratus tahun lalu sebagai suplemen dengan kandungan nutrisinya yang baik untuk manusia maupun hewan. Hal ini terkait dengan profil kandungan nutrisi dan protein yang tinggi (55-65%) berupa asam amino essensial
yang seimbang. Spirulina mengandung vitamin A, vitamin C, vitamin E, β-karoten, xanthofil, klorofil a, asam lemak omega-3, mineral-mineral, serta
fikobilliprotein (Cyano-fikosianin (CPC), Allo-fikosianin (APC), dan Cyano-fikoeritrin (CPE)). Cyano-fikosianin (CPC) merupakan yang relatif terbesar terkandung dalam Spirulina (Mishra et al. 2007).
Spirulina mempunyai kemampuan sebagai antiviral (Hayashi et al. 1993), anti kanker (Babu et al. 1995), hypokolesterol (Layam et al. 2007),
immunostimulant atau kemampuan meningkatkan daya tahan tubuh (Annapurna et al. 1991; Layam et al. 2007), serta menghasilkan senyawa
renoprotektif untuk cisplatin-induce oksidatif dan disfungsi ginjal. Spirulina juga diketahui dapat dijadikan makanan suplemen dan mengandung biopigmen fikosianin (Mathew et al. 1995; Kuhad et al. 2006; Minkova et al. 2003) yang berpotensi sebagai sumber bahan nutraceutical dan pharmaceutical.
Potensi mikroalga Spirulina sebagai suplementasi untuk penyakit diabetes melitus sebelumnya telah diuji oleh Mridha et al. (2010). Kadar glukosa darah
tikus menurun dari 166,9±44,95 mg/dl menjadi 111,81±15,46 mg/dl. Hasil penelitian Layam et al. (2007) juga menyatakan bahwa Spirulina platensis
mampu menurunkan kadar glukosa darah tikus dari 232,33 mg/dl menjadi 114,00 mg/dl dan mengontrol kestabilan bobot badan selama percobaan.
Fikosianin juga diketahui mampu meningkatkan sistem kekebalan tubuh, menjadi zat pewarna alami makanan, mempunyai aktivitas antioksidan untuk kosmetika serta obat-obatan. Menurut Belay (2002), fikosianin adalah komplek
protein pigmen biru yang terkandung pada beberapa spesies mikroalga seperti
Spirulina platensis dan Spirulina fusiformis (20-28% dari bobot keringnya), tidak beracun, dan mampu larut dalam air, sehingga dapat digunakan untuk tujuan pangan maupun pharmaceuticals.
Di lain pihak, prevalensi diabetes melitus pada populasi dewasa di seluruh dunia diperkirakan akan meningkat sebesar 35%, yaitu menjangkiti sekitar 300 juta orang dewasa pada tahun 2025(Gibney et al. 2008). Menurut survei yang dilakukan oleh organisasi kesehatan dunia (WHO), Indonesia menempati peringkat ke-4 terbesar dalam jumlah penderita diabetes melitus dengan prevalensi 8,6% dari total penduduk, sedangkan peringkat diatasnya adalah India, China, dan Amerika Serikat. Hasil yang tidak jauh berbeda dengan penelitian yang dilakukan Departemen Kesehatan bahwa prevalensi diabetes sebesar 12,7% dari seluruh penduduk. Data Departemen Kesehatan menyebutkan bahwa jumlah pasien diabetes melitus rawat inap maupun rawat jalan di rumah sakit menempati urutan pertama dari semua penyakit endokrin (Depkes 2005). Hal ini merupakan gambaran nyata bahwa diabetes melitus merupakan masalah kesehatan yang sangat serius dalam pembangunan kesehatan baik saat ini maupun di masa yang akan datang.
Diabetes mellitus tipe-2 merupakan jenis yang paling sering ditemukan di
Indonesia dan diperkirakan mencapai 90% dari semua jenis penderita diabetes melitus di Indonesia. Diabetes tipe-2 lebih dikenal sebagai diabetes
„tidak tergantung‟ insulin (non-insulin dependent diabetes mellitus, NIDDM). Komplikasi mikrovaskuler dan makrovaskuler sering ditemukan pada penderita diabetes melitus tipe-2, bahkan tidak jarang ditemukan beberapa komplikasi vaskuler sekaligus (Adam 2000).
jaringan otak rusak dan kerusakan jaringan saraf bersifat irreversible, tak terpulihkan. Efek samping lainnya adalah kehilangan nafsu makan, mual,
diare, dan, ruam pada kulit. Penggunaan obat sintetik antidiabetes oral juga
menyebabkan efek samping berupa kembung, diare, dan kram usus (Lee et al. 2007).
Kelebihan obat tradisional tentunya harus dibuktikan secara ilmiah.
Spirulina, sebagai substansi alam yang mempunyai potensi untuk mengatasi hiperglikemik, sehingga perlu dilakukan penelitian aktivitas antihiperglikemik dari biomasa dan fikosianin Spirulina fusiformis.
1.2 Tujuan
Penelitian ini bertujuan untuk menentukan umur panen dari mikroalga
Spirulina fusiformis dengan kadar fikosianin tertinggi, serta menguji potensinya sebagai antihiperglikemik secara in vivo pada tikus Sprague Dawley. Penelitian ini diharapkan dapat digunakan sebagai informasi dasar dalam pengembangan mikroalga Spirulina fusiformis dan fikosianin sebagai bahan neutraceutical
2 TINJAUAN PUSTAKA
2.1 Spirulina
Spirulina lebih banyak digunakan sebagai bahan pangan dari pada jenis mikroalga lain karena memiliki beberapa keunggulan. Spirulina adalah salah satu mikroalga yang relatif cepat bereproduksi dan mudah dalam sistem pemanenannya. Biomassa sel Spirulina jauh lebih mudah larut dalam pelarut polar seperti pada air dan buffer fosfat bila dibandingkan dengan pelarut kurang polar. Spirulina telah teruji aman untuk dikonsumsi. Selama bertahun-tahun berbagai badan pangan internasional telah melaporkan efek toksisitas yang negatif dari produk-produk Spirulina (Angka dan Suhartono 2000).
Spirulina merupakan kelompok Cyanobacteria yang secara fisiologi banyak galurnya. Spirulina telah dikoleksi dan dibiakkan melalui percobaan yang bertujuan untuk mendapatkan produksi yang intensif. Spirulina fusiformis adalah salah satu varian mikroalga Spirulina yang berasal dari Madurai, India. Secara taksonomi Spirulina diklasifikasikan (Bold dan Wyne 1978) sebagai berikut:
Kingdom : Protista Filum : Cyanobacteria Divisi : Cyanophyta Kelas : Cyanophyceae Ordo : Nostocales Famili : Oscillatoriaceae Genus : Spirulina
Spesies : Spirulina sp.
Spirulina fusiformis memilki tiga varian, yaitu: (1) varian tipe S memiliki ciri-ciri gulungan dengan jarak yang lebar; (2) varian tipe C memiliki ciri-ciri gulungan dengan jarak yang dekat; dan (3) varian tipe H memiliki ciri-ciri jarak gulungan yang paling dekat dan tipis (Richmond 1988). Morfologi Spirulina
Gambar 1 Spirulina
Spirulina memiliki kandungan 62% asam amino, sebagai sumber vitamin B-12 alami paling kaya, mengandung keseluruhan spektrum alami dari campuran
karoten dan xantofil (Kozlenko dan Henson 2007). Awalnya, Spirulina
merupakan bahan makanan tradisional penduduk asli Meksiko yang tinggal di dekat danau Texcoco dan penduduk Afrika yang bermukim di dekat danau Chad (Tietze 2004).
Pemanfaatan Spirulina lebih tinggi daripada mikroalga lainnya karena
Spirulina memiliki kualitas tinggi terutama dalam bentuk kering. Kandungan protein Spirulina berkisar 60-71% bk (Spolaroe et al. 2006). Komposisi kima
Spirulina disajikan pada Tabel 1.
Tabel 1 Komposisi kimia Spirulina
Komponen Konsentrasi (%w/w)
Protein 60-71
Lemak 6-7
Karbohidrat 13-16 Sumber: Spolaroe et al. (2006)
Spirulina merupakan mikroalga yang tidak menghasilkan kandungan lemak tinggi. Kandungan lemak Spirulina berkisar antara 6-7% (Spolaore et al. 2006). Kandungan karbohidrat Spirulina diperoleh melalui pembentukan glukosa selama proses fotosintesis memerlukan sumber karbon dan cahaya, selain sebagai larutan penyangga, NaHCO3 yang digunakan pada kultur Spirulina merupakan sumber karbon yang dibutuhkan untuk proses sintesis karbohidrat. Kandungan
karbohidrat yang terdapat pada alga hijau biru ini berkisar antara 15-25% (Belay et al. 2007).
kemampuan Spirulina platensis menurunkan kadar glukosa darah, kemudian menaikkan plasma insulin, C-peptida, dan hemoglobin darah tikus dengan kondisi diabetes. Perlakuan pemberian oral Spirulina terhadap tikus juga meningkatkan aktivitas enzim heksokinase dan menurunkan aktivitas enzim glukosa-6-fosfat (G6P).
Hasil penelitian dari Layam et al. (2007) dengan perlakuan pemberian oral
Spirulina platensis 15 mg/kg BB mampu menurunkan kadar glukosa darah dari tikus yang diinduksi streptozotocin yaitu, dari 232,33 mg/dl menjadi 114,00 mg/dl serta mampu mengontrol kestabilan bobot badan selama percobaan, yaitu berkisar antara 202,67 g – 213,50 g. Hasil penelitian Mridha et al. (2010) juga menunjukkan bahwa mikroalga Spirulina platensis dengan dosis 150 mg/kg BB mampu menurunkan kadar glukosa darah hingga 33% dari kondisi kontrol, yaitu dari 166,9±44,95 mg/dl menjadi 111,81±15,46 mg/dl.
2.1.1 Kultivasi Spirulina
Kondisi optimum kultivasi umumnya dicapai ketika berada pada fase pertumbuhan (logaritmik) dan berada dalam tingkat pertumbuhan yang maksimal (Pamungkas 2005). Faktor lingkungan sangat penting untuk diperhatikan karena dapat berpengaruh terhadap tingkat pertumbuhan dan perkembangbiakan
Spirulina (Richmond 1988).
Kultivasi atau produksi Spirulina pada dasarnya meliputi penumbuhan ganggang (kultur), pemanenan, pencucian, pengeringan dan penyimpanan produk (Angka dan Suhartono 2000). Faktor lingkungan yang berpengaruh utama pada kultivasi Spirulina adalah nutrien, suhu, dan cahaya. Pertumbuhan sel akan ditandai dengan bertambah pekatnya warna hijau kultur pada media dan bertambah tingginya nilai absorbansi pada 480 nm (Richmond 1988).
Nutrien dalam media tumbuh sangat berpengaruh dalam kultivasi
oleh pH optimum pertumbuhan 8,3-11,0. Larutan penyangga yang baik pada media tumbuh adalah 0,2 M NaHCO3 (Richmond 1988).
Suhu optimum untuk kultur Spirulina pada laboratorium berkisar antara 35-37°C (Richmond 1988). Suhu minimumnya berkisar antara 18-20°C
(Borowitzka dan Borowitzka 1988). Pada daerah beriklim tropis, Spirulina dapat tumbuh optimum pada kisaran suhu 25-35ºC (Kuniastuty dan Isnansetyo 1995).
Ukuran Spirulina cukup besar, sehingga dapat dipisahkan dari medium melalui filtrasi. Di negara berkembang seperti Chad Afrika, pemisahan Spiruina
cukup dilakukan dengan kain penyaring (Angka dan Suhartono 2000). Spirulina
segar difiltrasi dengan filter berukuran 20 m (Desmorieux dan Decaen 2006). Proses pengeringan pada produksi Spirulina komersial merupakan pertimbangan ekonomi yang sangat penting dan dapat mencapai 30% dari biaya produksi. Pemanenan dengan filtrasi dapat mempertahankan kandungan fikosianin lebih tinggi pada Spirulina (Mohammad 2007).
2.1.2 Pertumbuhan Spirulina
Pertumbuhan sel ditandai dengan bertambah pekatnya warna hijau kultur pada media dan bertambah tingginya nilai absorban. Cahaya merupakan faktor pembatas yang lebih dominan pada pertumbuhan Spirulina diikuti oleh nutrien dan temperatur. Ketersediaan cahaya untuk setiap sel pada kultur fotoautotropik merupakan fungsi dari intensitas serta lama pencahayaan dengan konsentrasi sel atau kepadatan populasi (Richmond 1988). Kultivasi Spirulina dengan intensitas cahaya ≥ 5400 lux dengan bantuan lampu TL (tube lamp) dapat menghasilkan pertumbuhan yang maksimal setelah beberapa hari periode waktu kultur (Vonshak 1985).
Gambar 2 Fase pertumbuhan sel alga (Fogg 1975)
(1: fase lag; 2: fase eksponensial; 3: fase deklinasi; 4: fase stasioner; dan :5 fase kematian)
Fase lag ditandai dengan peningkatan populasi yang tidak terlalu nyata. Fase ini juga disebut dengan fase adaptasi karena sel mikroalga sedang beradaptasi terhadap media pertumbuhannnya. Fase selanjutnya adalah fase eksponensial yang ditandai dengan tingginya laju pertumbuhan. Hal ini terjadi karena mikroalga sedang aktif berkembangbiak (Fogg 1975).
Setelah pertumbuhan yang begitu cepat, kandungan nutrisi mulai berkurang sehingga mulai mengalami penurunan laju pertumbuhan yang disebut sebagai fase deklinasi. Menurut Diharmi (2001), berkurangnya nitrogen dan fosfat, menurunnya konsentrasi CO2 dan O2, serta kenaikan pH medium menjadi faktor dalam penurunan laju pertumbuhan pada fase ini.
Dua tahap selanjutnya dalam fase pertumbuhan mikroalga adalah fase stasioner dan kematian. Fase stasioner, pada fase ini pertambahan jumlah populasi seimbang dengan laju kematian sehingga seperti tidak ada penambahan populasi. Pertumbuhan sel yang baru juga dihambat dengan keberadaan sel yang telah mati dan faktor pembatas lainnya (Fogg 1975). Fase kematian ditandai dengan penurunan produksi biomasa karena kematian dan sel lisis (Vonshak 1985).
2.2 Fikosianin
Gambar 3 Struktur kimia fikosianin bilin kromofor (a) dan bilirubin (b).
Fikosianin menyerap warna jingga, merah terang, dan memancarkan warna biru terang. Fikosianin umumya terdapat dalam divisi Rhodophyta (alga merah), Cyanophyta (alga biru-hijau) dan Cryptophyta (alga kriptomonad). Pigmen biru fikosianin memiliki absorbsi maksimum pada panjang gelombang 620 nm (Richmond 1988). Fikosianin juga dapat dikatakan sebagai senyawa penyimpan nitrogen dengan diketahuinya bahwa konsentrasi fikosianin tertinggi diperoleh ketika Spirulina platensis dikultivasi pada konsentrasi nitrogen yang tinggi (Boussiba dan Richmond 1979).
Fikosianin dari Spirulina, dapat menghambat radikal hidroksil (IC50= 0,91 mg/ml) dan alkoksil (IC50 = 0,76µg/ml ), menghambat peroksidasi
lemak pada mikrosomal hati dengan IC50 = 12 mg/ml (Romay et al. 1998); ekstrak metanol fikosianin mampu menghambat lebih dari 95% proksidasi otak tikus dengan IC50 = 180 mcg (Miranda et al. 1998); mempunyai aktifitas antioksidan lebih besar dari α-tokoferol, zeaxanthin, dan asam kafeiat pada basis molar (Hirata et al. 2000). Aktivitas antioksidannya juga dibandingkan dengan ekstrak mikroalga lainnya yaitu, ekstrak Chlorella, percobaan dengan metode DPPH menunjukkan EC50 19,39 ± 0,65 µmol asam askorbat/g ekstrak Spirulina lebih besar dibandingkan EC50 14,04 ± 1,06 µmol asam askorbat/g ekstrak Chlorella (Wu et al. 2005).
2.2.1 Ekstraksi Fikosianin
Menurut Boussiba dan Richmond (1979), diketahui bahwa biomasa sel
Fikosianin merupakan pigmen fotosintetik utama pada Spirulina disamping peranannya sebagai penyimpan cadangan nitrogen dan asam amino. Fikosianin merupakan protein yang bersifat larut air yang dapat dibebaskan secara sederhana yaitu oleh penghancuran mekanis, seperti perlakuan pembekuan kemudian dicairkan (freeze-thaw). Pada saat ini fikosianin dicanangkan sebagai bahan pewarna alami bagi pangan dan kosmetik (Angka dan Suhartono 2000).
Fikosianin dapat diperoleh dengan mengekstrak serbuk biomasa
Spirulina fusiformis dengan buffer fosfat pH 7 dan dibaca absorbansinya pada panjang gelombang 620 nm dengan buffer fosfat sebagai blanko. Kadar fikosianin dihitung secara kuantitatif dengan cara menghitung absorbansi yang didapat dari hasil ekstraksi (Lorenz 1998).
2.3 Diabetes Mellitus dan Hiperglikemia
Diabetes biasanya menunjukkan konsentrasi glukosa abnormal yang tinggi dalam darah, kondisi ini disebut hiperglikemia (Lechninger 1982). Kadar gula darah normal berkisar antara 60 mg/dl sampai 145 mg/dl. Tanda-tanda lain dari diabetes melitus meliputi poliuria (banyak kemih), polidipsia (banyak minum), polifagia (banyak makan), lemas, berat badan turun, dan kenaikan gula darah puasa ≥140 mg/dl (Gibney et al. 2008).
Klasifikasi yang ada sekarang ini meliputi berbagai stadium klinis dan tipe etiologi penyakit diabetes melitus serta kategori hiperglikemia lainnya, antara lain Toleransi Glukosa Terganggu (TGT), Diabetes tipe 1, Diabetes tipe 2, Diabetes gestasional, dan sindrom metabolik atau sindrom X, serta golongan resiko statistik, yaitu semua orang dengan toleransi glukosa normal tetapi mempunyai risiko yang lebih besar untuk mengidap DM (Gibney et al. 2008).
Kelompok toleransi glukosa terganggu (TGT, impaired glucose tolerant) merupakan tahap terjadinya gangguan pada regulasi glukosa karena keadaan ini dapat terlihat pada setiap kelainan hiperglikemia. Meskipun demikian, TGT sangat berpotensi untuk berkembang menjadi pasien DM. Kasus TGT akan menjadi kasus DM hingga 50% dalam waktu 2-12 tahun. Tanda-tanda TGT dapat dikenali dengan mudah melalui pemeriksaan TTGO (Tes Toleransi Glukosa Oral)
Gangguan toleransi glukosa pada penderita diabetes antara lain disebabkan menurunnya jumlah glukosa yang masuk ke dalam sel jaringan perifer dan gangguan fungsi glukostatik dalam hati. Pada keadaan defisiensi insulin, jumlah glukosa yang masuk ke dalam otot rangka, otot jantung, otot polos, dan jaringan lain berkurang. Walaupun pengambilan glukosa oleh hati juga menurun, tetapi hal ini tidak mempunyai efek secara langsung. Absorbsi glukosa dalam usus tidak terpengaruh, demikian pula penyerapan kembali dari urin oleh sel-sel tubuli ginjal. Pengambilan glukosa oleh sel-sel otak dan darah merah juga normal (Pranadji et al. 1999).
Hormon insulin dalam kondisi normal berfungsi untuk membantu sintesis glikogen dan menghambat output glukosa dari hati. Bila kadar gula dalam darah meningkat, dalam keadaan normal sekresi insulin juga meningkat dan glukoneogenesis akan menurun. Pada keadaan diabetes, fungsi ini tidak terdapat sehingga terjadi gangguan toleransi glukosa (Pranadji et al. 1999).
Metabolisme glukosa dapat berjalan secara normal melalui mekanisme timbal-balik hormon insulin-gukagon untuk menjaga kadar glukosa darah tetap normal. Peranan insulin adalah membantu mengubah glukosa menjadi energi bagi sel dengan cara mentransfer glukosa darah ke dalam sel-sel yang membutuhkan. Glukosa dalam darah tidak dapat digunakan sebagai energi, untuk itu glukosa harus ditranfer terlebih dahulu ke dalam sel melalui proses oksidasi dalam sel (respirasi). Kemudian, jika kondisi tubuh sedang lapar, konsentrasi
glukosa darah menurun. Hormon glukagon, yang disekresikan oleh sel α pankreas, glikogen hati akan dipecah menjadi glukosa dan dilepaskan
kembali ke dalam darah untuk menjaga konsentrasi darah tetap normal (Wijayakusuma 2006).
2.3.1 Efek hiperglikemia pada diabetes melitus
Peningkatan glukosa darah pasca makan (postprandial hyperglycemia) merupakan awal terganggunya metabolisme yang terjadi pada DM tipe-2. Kondisi ini mempercepat perkembangan penyakit diabetes melitus yang disebabkan toksisitas glukosa dalam otot dan sel beta pankreas juga menginisiasi
Hiperglikemia dapat menyebabkan gejala-gejala yang diakibatkan oleh hiperosmolaritas darah. Gula darah melebihi normal, sehingga gula ikut dikeluarkan oleh ginjal. Keadaan dengan adanya glukosa dalam urin disebut glukosuria. Gula yang bersifat menarik cairan ke dalam air kemih, akibatnya volume air kemih berlebih dan penderita menjadi sering kencing. Keadaan ini disebut poliuria. Kehilangan cairan yang berlebihan melalui urin menyebabkan terjadinya hipovolemia. Hipovolemia akan mengakibatkan timbulnya rasa haus sehingga penderita banyak minum atau polidipsia. Akibat adanya gangguan pada transportasi gula ke sel-sel jaringan, terutama sel-sel otot, sel-sel tersebut akan kekurangan energi. Disamping itu, adanya glukosuria berarti tubuh kehilangan energi secara percuma. Tubuh kehilangan 4,1 kkal untuk setiap gram glukosa. Penderita akan merasa lemas dan lapar, sehingga banyak makan. Hal ini disebut polifagia. Konsumsi karbohidrat berlebih akan menutupi kehilangan ini dengan mudah, tetapi sekaligus meningkatkan glukosa darah lebih lanjut dan meningkatkan glukosuria. Hal ini akan mengakibatkan mobilisasi protein
endogen dan cadangan lemak sehingga terjadi penurunan berat badan (Pranadji et al. 1999).
Salah satu pendekatan terbaik untuk menurunkan glukosa darah pasca makan ialah dengan memperlambat absorpsi glukosa melalui penghambatan kerja penghidrolisis karbohidrat seperti α-glukosidase. Usaha menjaga tingkat glukosa darah menjadi rendah atau normal dapat menurunkan angka penderita komplikasi diabetes melitus (Lee et al. 2007).
2.3.2 Pengobatan Diabetes Melitus
(1) golongan sulfonilurea, obat ini bekerja dengan cara merangsang sel β-pulau Langerhans pankreas untuk mensekresikan insulin. Contohnya
glibenclamide dan glibonuride;
(2) golongan biguanid, mekanisme kerja obat ini adalah mengurangi resistensi insulin, sehingga glukosa dapat memasuki sel-sel hati, otot, dan organ tubuh lainnya. Contoh obat yang termasuk dalam golongan ini adalah metformin, phenformin, dan buformin.
(3) golongan thiazolidinedion, mekanisme kerjanya sama dengan derivat biguanid. Contoh obat golongan ini adalah troglitazone.
(4) golongan miglitinida, obat ini bekerja dengan cara merangsang sekresi insulin dari pankreas segera setelah makan. Contoh obat golongan ini adalah replaginida. Efek samping dari penggunaan obat ini meliputi hipoglikemia dan kenaikan berat badan.
(5) golongan inhibitor α-glukosidase, mekanisme kerja obat golongan ini adalah dengan menginhibisi secara reversibel kompetitif terhadap enzim hidrolase α-amilase pankreatik dan enzim-enzim pencernaan di usus halus seperti isomaltase, sukrase, dan maltase. Enzim-enzim ini berperan pada hidrolisis karbohidrat makanan menjadi glukosa dan monosakarida lainnya. Obat yang termasuk dalam golongan ini antara lain adalah Acarbose dan
Miglitol.
Acarbose (merek dagang Precose® dan Glucobay®) adalah inhibitor α-glukosidase. Mekanisme kerja inhibitor α-glukosidase adalah dengan memperlambat pemecahan disakarida, polisakarida, dan karbohidrat kompleks lainnya menjadi monosakarida (Sugiwati 2005).
Pembuatan glukosa secara enzimatis dan absorpsi glukosa selanjutnya ditunda, dan dalam kondisi setelaah makan nilai glukosa darah yang tinggi pada penderita diabetes tipe II, dapat dikurangi dengan IAG. IAG tidak mencegah absorpsi karbohidrat dan gula kompleks, tetapi menunda absorpsinya. Kelemahannya adalah harus dimakan bersama makanan dan mempunyai efek
2.3.3 Tes Toleransi Glukosa
Diagnosis yang digunakan dalam mengidentifikasi penyakit diabetes melitus
dapat dilakukan dengan pemeriksaan darah. Standardisasi kriteria oleh
the National Diabetes Data Group of the USA (NDDG) dan komite pakar organisasi kesehatan dunia (WHO) menghasilkan keseragaman hingga taraf tertentu bagi berbagai penelitian global terhadap kelainan metabolik tersebut. Kriteria diagnosis yang lebih sensitif ditunjukkan oleh uji toleransi glukosa (Gibney et al. 2008).
Tes ini memerlukan puasa 12-18 jam sebelum darah diambil untuk pemeriksaan. Puasa adalah keadaan tanpa suplai makanan (kalori) selama minimum 8 jam, tetapi tetap diperbolehkan minum air putih. Jadi, bukan puasa makan dan minum seperti yang biasa dilakukan. Berdasarkan American Diabetes Association (ADA) 1998, terdapat dua tes yang dapat dijadikan sebagai dasar diagnosis terhadap diabetes mellitus yang didasarkan pada pemeriksaan kadar
glukosa plasma vena, yaitu kadar glukosa darah sewaktu (tidak puasa) ≥200 mg/dL; dan kadar glukosa darah puasa ≥ 126 mg/dL. Pada tes toleransi
glukosa oral (TTGO), kadar glukosa darah yang diperiksa kembali setelah 2 jam (Wijayakusuma 2006).
Glukosa pada penderita diabetes menumpuk di dalam darah, terutama pada keadaan setelah makan. Apabila pada penderita diabetes diberikan glukosa secara oral dengan dosis tertentu (75 g glukosa) maka gula darahnya akan meningkat lebih tinggi dari orang normal dan turunnya pun juga lebih lambat. Tes ini disebut sebagai “tes toleransi glukosa oral” (Pranadji et al. 1999).
2.4 Penentuan kadar glukosa darah dengan Glucose Test Strip
Kadar glukosa darah dapat ditentukan menggunakan prinsip reaksi enzimatik yang terjadi pada glucose test strip. Reaksi yang terjadi adalah reaksi enzimatik glukosa darah dengan enzim glukosa oksidase dan peroksidase yang dilapis pada kertas strip. Pada metode ini kertas strip dilapisi dengan membran selulosa tipis yang permeabel hanya untuk molekul-molekul kecil seperti glukosa. Persamaan reaksi enzimatik dari glukosa dengan enzim glukosa oksidase dan peroksidase (Soetarno et al. 1999) dapat dituliskan sebagai berikut:
β-D-Glukosa + O2 + H2O H2O2 + asam glukonat H2O2 + kalium iodida iodin + H2O
Apabila setetes darah dikenakan pada kertas strip, maka dengan adanya oksigen, glukosa darah dioksidasi secara enzimatik oleh glukosa oksidase menghasilkan hidrogen peroksida dan asam glukonat. Selanjutnya, peroksidase mengkatalis reaksi hidrogen peroksida dengan kromogen kalium iodida menghasilkan iodin yang berwarna coklat. Intensitas warna yang terbentuk adalah sebanding dengan jumlah glukosa dalam tetesan darah.
2.5 Model Hewan Percobaan Diabetes Mellitus
Hewan Diabetes Melitus (DM) dapat dijadikan sebagai model dari penyakit ini pada manusia. Pada kenyataannya tidak ada gejala diabetes melitus pada hewan yang tepat sama dengan tipe DM pada manusia (Soetarno et al. 1999).
Gejala diabetes melitus yang paling umum dijumpai pada hewan adalah berupa obesitas, hiperinsulinemia, dan resistensi insulin. Diabetes Mellitus (DM) selain terjadi secara spontan juga dapat dibuat secara eksperimental dengan infeksi virus, atau melalui pemberian hormon dan senyawa kimia (Subroto 2009). Model hewan DM baik spontan dan eksperimental dapat digunakan secara efektif untuk mempelajari komplikasi, pengobatan, dan pencegahan DM. Penggunaan senyawa kimia untuk menginduksi hewan menjadi DM memungkinkan mempelajari secara mendalam proses-proses biokimia, hormonal, dan morfologi yang terjadi selama dan setelah induksi senyawa kimia tersebut pada hewan. Senyawa kimia yang telah dipelajari secara ekstensif mampu menginduksi hewan coba menjadi DM, antara lain, aloksan dan streptozotocin.
glukosa oksidase
Kedua senyawa ini merusak sel β-pulau Langerhans pankreas, sehingga menyebabkan hiperglikemia permanen (Sugiwati S. 2005).
Tikus telah banyak digunakan dalam penelitian tentang neoplasia, daya kerja obat, toksikologi, caries gigi, metabolisme lemak, manfaat vitamin, tingkah laku, alkoholisme, sirosis, arthritis, phenylketonuria, penyakit kuning, intoleransi fruktosa, hipertensi, diabetes, dan beberapa penyakit menular (Smith dan Mangkoewidjojo 1988).
Tikus putih telah lama digunakan untuk penelitian karena hewan ini telah diketahui sifat-sifatnya dengan sempurna, mudah dipelihara dan cocok untuk berbagai macam penelitian. Tikus putih (Rattus novergicus) yang dapat digunakan untuk percobaan terdiri dari beberapa galur atau varietas yang memilki ciri spesifik, antara lain galur Sprague-dawley yang berwarna albino putih, berkepala kecil, dan ekornya lebih panjang daripada kepalanya; galur Wistar yang dicirikan dengan kepala besar dan ekor yang lebih pendek; dan galur long-evans
yang lebih kecil dari tikus putih dan memiliki warna hitam pada kepala dan tubuh bagian depan (Malole dan Pramono 1999).
Secara garis besar, fungsi dan bentuk organ, proses biokimia dan biofisik antara tikus dan manusia memiliki banyak kemiripan. Perbedaan antara tikus dan manusia antara lain terdapat pada struktur dan fungsi plasenta tikus; tingkat pertumbuhan tikus yang lebih cepat dari manusia; kekurangpekaan tikus pada senyawa neurotoksik dan teratogen. Secara umum, karakteristik fisiologis tikus disebutkan dalam Tabel 2.
Tabel 2 Nilai fisiologis tikus
Kriteria Nilai
Berat badan dewasa jantan 450-520 g Berat badan dewasa betina 250-300 g
Berat lahir 5-6 g
Suhu tubuh 35,9-37,5 °C
Konsumsi makanan 10 g/100 g/hari Konsumsi air minum 10-12 ml/100 g/hari Volume darah 54-70 ml/kg
Protein serum 5,6-7,6 g/dl Glukosa serum 50-135 mg/dl
Beberapa karakteristik anatomis dan fisiologis tikus Sprague Dawley
(Malole dan Pramono 1989), antara lain:
1) Rumus gigi tikus Sprague Dawley adalah 2 (I 1/1, M 3/3) = 16. Gigi seri tumbuh terus menerus. Tikus akan menggigit atau menjepit dengan gigi serinya yang tajam jika salah penanganan.
2) Esofagus masuk ke lambung melewati lubang yang kecil karena ada lipatan jaringan pada lambung. Karena struktur anatomis tersebut, tikus tidak mampu muntah.
3) Seperti kuda, tikus tersebut tidak mempunyai kantung empedu.
4) Paru-paru kiri terdiri dari satu lobus sementara paru-paru kanan terdiri atas empat lobus.
5) Tikus memiliki lima pasang kelenjar susu. Distribusi jaringan mammae
tersebar, dari garis tengah ventral melewati panggul, toraks dan bagian leher. 6) Uretra tikus betina tidak berhubungan dengan vagina atau vulva.
7) Kelenjar membran niktitasi (kelenjar Harderian) merupakan kelenjar lakrimal terpigmentasi yang teletak di belakang bola mata, melingkari saraf optik. Hasil sekresi dari kelenjar ini kaya akan lemak dan porfirin. Meskipun banyak spesies lain memiliki kelenjar Harderian, pada tikus kelenjar ini memiliki fungsi khusus. Selama masa stress dan atau sakit tertentu, air mata mengalir dan mewarnai wajah di sekitar mata dan hidung. Ketika air mata mengering, pigmen tersebut memberikan warna seperti darah kering. Pigmen tersebut akan berpendar saat dipaparkan pada sinar ultraviolet dan mengandung sedikit darah atau tidak sama sekali.
8) Respon tikus terhadap penurunan suhu ruang/kandang berupa termogenesis tanpa gemetar. Sedangkan saat suhu kandang meningkat, terjadi vaskularisasi pada ekornya yang panjang, yang juga berperan sebagai organ termoregulator. Sebagian besar termogenesis tersebut terjadi pada jaringan lemak yang coklat, konsentrasi yang paling tinggi ditemukan pada jaringan subkutan di antara skapula.
banyak kemiripan dengan manusia meliputi fungsi, bentuk organ, proses biokimia, dan biofisik. Penggunaan tikus Sprague Dawley dalam studi kesehatan dan penyakit pada manusia, merupakan model yang sangat bagus untuk toksikologi, reproduksi, farmakologi dan tingkah laku. Esofagus pada tikus
Sprague-Dawley masuk ke lambung melewati lubang kecil karena terdapat lipatan jaringan lambung sehingga tikus tidak mampu muntah. Tikus ini juga mudah diperoleh dan telah banyak digunakan dalam penelitian (Smith dan Mangkoewidjojo 1988).
Galur Sprague Dawley yang umum digunakan untuk penelitian mempunyai ciri berwarna putih albino, berkepala kecil dan ekornya lebih panjang dari badannya (Malole dan Pramono 1989). Tikus betina tidak digunakan karena terdapat siklus hormonal bulanan yang dapat memberikan pengaruh terhadap kadar glukosa darah yang akan diukur. Tikus dikandangkan dalam kandang
individual yang terbuat dari plastik dengan penambahan alas berupa sekam. Siklus gelap dan terang terjadi secara alami. Kondisi lingkungan diupayakan
pada suhu 22±2ºC dengan pemberian kipas angin. Hal ini sesuai dengan pernyataan Derelanko et al. (1994) bahwa suhu kandang yang baik untuk tikus berkisar antara 64,4-78,8ºF (18-26ºC).
2.6 Flavonoid dan aktivitas antidiabetes
Flavonoid adalah senyawaan fenol yang paling banyak ditemukan di alam karena sekitar 2% dari semua karbon yang disintesis tumbuhan diubah menjadi flavonoid. Struktur dasar dari flavonoid terdiri dari 15 atom karbon dengan
konfigurasi C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan dengan 3 karbon yang dapat atau tidak membentuk cincin ketiga (Markham 1988).
Flavonoid merupakan senyawa polar karena memiliki gugus hidroksil yang tidak tersubstitusi. Sifat fisik ini menjadikannya larut dalam pelarut polar seperti etanol, metanol, etil asetat, atau campuran pelarut dapat digunakan untuk mengekstrak flavonoid dari jaringan tumbuhan.
3 METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari-Desember 2010 bertempat di laboratorium Bioteknologi 2 dan laboratorium Biokimia, Departemen Teknologi Hasil Perairan, FPIK, untuk kultivasi Spirulina fusiformis dan analisis kuantitatif pigmen fikosianin, laboratorium Fisika Instrumen FMIPA untuk pengujian spektrum maksimum biopigmen, laboratorium imunologi, FKH, dan laboratorium Hewan Coba, Biokimia, FMIPA, Institut Pertanian Bogor, untuk uji kadar glukosa darah tikus percobaan.
3.2 Alat dan Bahan
Alat yang digunakan untuk kultivasi dan ekstraksi Spirulina fusiformis
meliputi akuarium, toples kaca, neraca analitik, tube light (TL) Philips 40 watt,
freeze dryer, oven, desikator, lemari es, nylon mesh 20 µm, pH-meter, spektrofotometer UV-Vis 2800 dan USB 2000 (dengan software Spectra Suite),
lux-meter, magnetic stirer serta sentrifuse. Alat untuk pemeliharaan tikus, meliputi kandang plastik, botol minum, wadah pakan, timbangan, alat sonde (syringe yang dilengkapi dengan jarum berujung bundar), glucose strip test, dan glukosa meter OneTouchUltra.
Bahan penelitian meliputi inokulum Spirulina fusiformis dari koleksi Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor; media Zarouk teknis (Lampiran 1) yang terdiri dari bahan-bahan berikut NaHCO3, KNO3, K2SO4, NaCl, FeCl3, Na2EDTA, serta trace element sebagai vitamin yang terdiri dari H3BO3, MnCl2.4H2O, ZnSO4.7H2O, Na2MoO4.2H2O, CuSO4.5H2O, COCl2.6H2O, Na2WO4.2H2O, NH4VO3, CaCl2, NiSO4.7H2O (Borowitzka dan Borowitzka 1988). Bahan bahan kimia untuk analisis kadar fikosianin adalah
100 mM larutan buffer fosfat pH 7 yang dibuat dari K2HPO4, KH2PO4 (Lorenz 1998) dan akuades. Bahan untuk pengujian hewan percobaan, meliputi
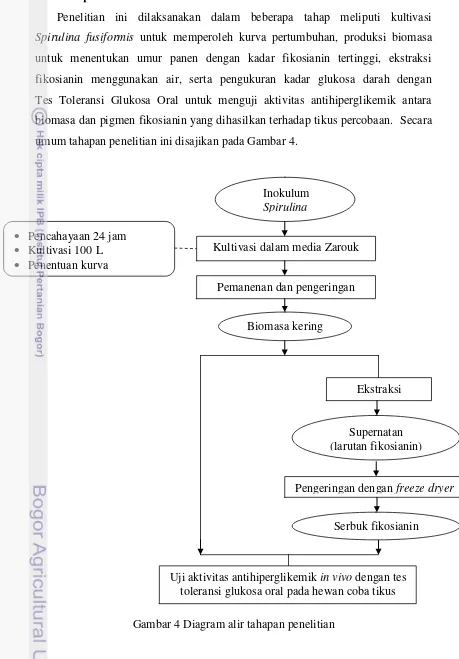
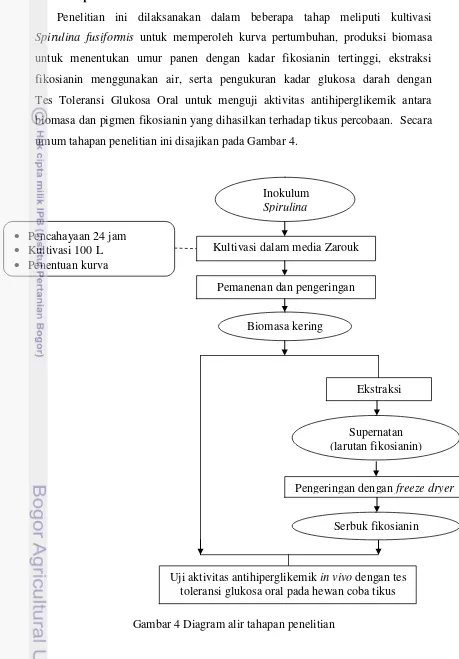
3.3 Tahapan Penelitian
Penelitian ini dilaksanakan dalam beberapa tahap meliputi kultivasi
Spirulina fusiformis untuk memperoleh kurva pertumbuhan, produksi biomasa untuk menentukan umur panen dengan kadar fikosianin tertinggi, ekstraksi
fikosianin menggunakan air, serta pengukuran kadar glukosa darah dengan Tes Toleransi Glukosa Oral untuk menguji aktivitas antihiperglikemik antara
biomasa dan pigmen fikosianin yang dihasilkan terhadap tikus percobaan. Secara umum tahapan penelitian ini disajikan pada Gambar 4.
Gambar 4 Diagram alir tahapan penelitian Inokulum
Spirulina
Kultivasi dalam media Zarouk Pencahayaan 24 jam
Kultivasi 100 L Penentuan kurva
Pemanenan dan pengeringan
Uji aktivitas antihiperglikemik in vivo dengan tes toleransi glukosa oral pada hewan coba tikus
Serbuk fikosianin Supernatan (larutan fikosianin)
Ekstraksi Biomasa kering
1) Kultivasi Spirulina fusiformis
Kurva Spirulina fusiformis diperoleh melalui kultivasi pada media Zarouk selama 90 hari. Spirulina yang akan diukur absorbansinya ditumbuhkan dalam sebuah toples plastik berisi 3 liter media Zarouk dengan volume inokulum 30 ml. Selama periode kultur pencahayaan diatur sebesar 5500 lux dengan mendekatkan akuarium pada sumber cahaya (lampu) kemudian diukur dengan lux meter, dan diberi aerasi udara. Sampling dilakukan setiap hari untuk dilihat kepadatannya.
Laju pertumbuhan Spirulina harian diukur berdasarkan kerapatan optik atau
optical density (OD) dengan menggunakan spektrofotometer pada panjang gelombang 480 nm. Data absorbansi yang didapatkan diplotkan pada kurva pertumbuhan (Achmadi et al. 2002).
2) Biomasa Spirulina fusiformis
Spirulina fusiformis dikultivasikan pada media Zarouk (Borowitzka 1988 dan
Muhammad 2007) dalam akuarium yang terdiri dari 100 L media dan 20 L inokulum dengan pencahayaan lampu 24 jam. Komposisi media Zarouk
disajikan pada Lampiran 1.
Kultur Spirulina fusiformis dipanen pada awal dan akhir fase log, serta awal dan akhir fase stasioner. Pemanenan biomasa dapat dilakukan dengan teknik filtrasi menggunakan kain nylon mesh ukuran 20 µm dan atau kain blacu. Biomasa basah dikering anginkan menggunakan kipas angin pada suhu ruang (±28oC) selama 5 jam agar tidak terjadi kerusakan akibat suhu, termasuk berkurangnya kadar fikosianin (Mohammad 2007).
3) Ekstraksi fikosianin
Ekstraksi fikosianin dilakukan menggunakan air. Prosesnya adalah biomasa
Spirulina yang telah dikeringkan disuspensikan ke dalam akuades, dibekukan pada suhu -15 oC selama ±48 jam, selanjutnya dilelehkan pada suhu 30oC selama satu jam dan diaduk menggunakan magnetic stirer. Sampel diusahakan tetap disimpan pada suhu chilling (± 4 oC) sampai disentrifugasi pada 3000 rpm selama 30 menit dengan suhu 4oC (Minkova et al. 2003).
fikosianin dengan absorbansi tertinggi digunakan dalam tahap pengujian in vivo, terlebih dahulu fikosianin dikeringkan menggunakan freeze dryer.
4) Pengujian aktivitas antihiperglikemik dengan metode Tes Toleransi Glukosa Oral (TTGO) pada hewan coba (Soetarno 1999)
Bahan uji yang diberikan terhadap tikus percobaan pada penelitian ini adalah biomasa dan fikosianin yang diperoleh dari kultur Spirulina fusiformis dengan umur panen 75 hari. Penggunaan dosis biomasa Spirulina fusiformis adalah berdasarkan hasil terbaik pada penelitian Mridha et al. (2010) yaitu 0,15 mg/g BB dan ditingkatkan menjadi 0,30 mg/g BB. Dosis pemberian fikosianin juga sama dengan dosis pemberian biomasa.
Sukrosa yang diberikan mengacu pada penelitian Sugiwati (2005) yang menyatakan bahwa larutan sukrosa 80% b/v mampu meningkatkan kadar glukosa darah setelah 1 jam pemberian oral hingga 140 mg/dl. Hal ini sesuai dengan pernyataan Gibney et al. (2008) bahwa hiperglikemia adalah kadar glukosa ≥126 mg/dl setelah 1 jam pemberian oral sukrosa.
Biomasa dan fikosianin yang digunakan terlebih dahulu dilarutkan dalam air mineral. Dosis pemberian Spirulina fusiformis adalah berdasarkan dosis terbaik hasil penelitian Mridha et al. (2010), sedangkan obat Acarbose dengan merek dagang Glucobay yang digunakan sebagai kontrol positif, diberikan atas dosis manusia dengan BB 50 kg (Sugiwati S. 2005). Tikus yang digunakan adalah tikus
jantan jenis Sprague-Dawley berumur 6-8 minggu (dengan bobot badan 180 – 200 g) yang diperoleh dari Balai Veteriner, Bogor.
Tikus diadaptasikan selama dua minggu sebelum melakukan percobaan, fungsinya untuk menyeragamkan cara hidup dan makanannya. Tikus dipelihara dalam kandang plastik, satu kandang berisi satu ekor tikus. Pembersihan kandang tikus setiap 3 hari sekali sedangkan pemberian pakan dan minum dilakukan setiap hari secara ad libitum (tak terbatas).
1) Kelompok perlakuan P (kontrol positif)
Pada kelompok perlakuan P, tikus dicekok obat Acarbose (Glucobay) dengan dosis 0,001 mg/g BB tikus.
2) Kelompok perlakuan B1
Pada kelompok B1, tikus dicekok biomasa kering Spirulina fusiformis
dengan dosis 0,15 mg/g BB tikus 3) Kelompok perlakuan B2
Pada kelompok B2, tikus dicekok biomasa kering Spirulina fusiformis
dengan dosis 0,30 mg/g BB tikus 4) Kelompok perlakuan F1
Pada kelompok F1, tikus dicekok fikosianin kering dengan dosis 0,15 mg/g BB tikus
5) Kelompok perlakuan F2
Pada kelompok F2, tikus dicekok fikosianin kering dengan dosis 0,30 mg/g BB tikus
6) Kelompok perlakuan N (kontrol negatif)
Pada kelompok N, tikus dicekok larutan sukrosa (80% b/v) sebanyak 1 ml
Sebelum pengujian, tikus dipuasakan selama 18 jam dengan tetap pemberian minum. Semua tikus pada masing-masing kelompok diambil darah untuk diukur kadar glukosa darah puasanya. Langkah selanjutnya adalah pada kelompok P (kontrol positif), B1, B2, F1, F2, dicekok bahan perlakuan yang dilarutkan terlebih dahulu dalam 2 ml air mineral.
Selang waktu 5 menit setelahnya, pada masing-masing kelompok P, B1, B2, F1, F2, dicekok dengan 1 ml larutan sukrosa 80% (b/v), sedangkan kelompok N (kontrol negatif) hanya dicekok dengan larutan sukrosa 80% (b/v). Pencekokan larutan dilakukan menggunakan alat sonde dan syringe steril. Selanjutnya, kadar glukosa darah pada masing-masing kelompok diukur setelah ½, 1, 2, dan 3 jam setelah perlakuan.
3.4 Prosedur Analisis
3.4.1 Kadar fikosianin
Kadar fikosianin dihitung berdasarkan nilai absorbansi yang dibaca spektrofotometer pada panjang gelombang 620 nm buffer fosfat sebagai blanko. Kadar fikosianin dapat dihitung dengan rumus (Doke 2005), sebagai berikut:
Kadar fikosianin % = A620× 10
7,3 × mg sampel × berat kering biomasa× 100%
Keterangan:
A620 = Absorbansi pada 620 nm
7.3 = Koefisien ekstensi fikosianin murni pada 620 nm 10 = total volume buffer fosfat.
3.4.2 Pengukuran komposisi kimia biomasa Spirulina fusiformis pada umur panen terpilih
Pengukuran komposisi kimia atau proksimat dari biomasa kering
Spirulina fusiformis pada umur panen terpilih (kadar fikosianin tertinggi) meliputi analisis kadar air, abu, protein, lemak, dan karbohidrat. Tahapan analisis ini adalah sebagai berikiut:
1) Analisis kadar air (AOAC 1995)
Cawan porselin dikeringkan dalam oven pada suhu 102-105 oC selama 30 menit. Cawan tersebut diletakkan ke dalam desikator selama lebih kurang 30 menit, kemudian didinginkan dan ditimbang hingga beratnya konstan.
Cawan dan sampel Spirulina fusiformis sebesar 1-2 g ditimbang dengan
timbangan digital. Cawan tersebut dimasukkan ke dalam oven pada suhu 102-105 oC selama kurang lebih 6 jam. Cawan tersebut kemudian dimasukkan ke
dalam desikator dan dibiarkan sampai dingin dan ditimbang sampai diperoleh berat yang konstan.
Perhitungan kadar air dapat dihitung dengan rumus: Kadar air (%) =
B−C
B−A x 100 %
Keterangan: A = Berat cawan kosong (g)
B = Berat cawan dengan sampel (g)
2) Analisis kadar lemak (AOAC 1995)
Sampel seberat 5 gram (W1) dimasukkan ke dalam kertas saring pada kedua ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan tabung Soxhlet. Selongsong lemak dimasukkan ke dalam
ruang ekstraktor tabung Soxhlet dan disiram dengan pelarut lemak (n-heksana p.a.). Kemudian dilakukan refluks selama 6 jam.
Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
Rumus perhitungan kadar lemak adalah:
% Kadar lemak =W3−W2
W1 × 100%
3) Analisis kadar protein (AOAC 1995)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl.
Sampel ditimbang sebanyak 0,25 gram, kemudian dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambahkan 0,25 gram selenium dan 3 ml H2SO4 p.a. pekat. Sampel didestruksi pada suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 ml akuades dan 20 ml NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100 oC.
Hasil destilasi ditampung dalam labu Erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol
green-methyl red yang berwarna merah muda (1:2). Setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan.
Keterangan : W1 = Berat sampel (gram)
Destilat dititrasi dengan HCl 0,10 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti sampel.
Kadar protein dihitung dengan rumus sebagai berikut:
% N = ml HCl−ml blanko × N HCl × 14,007
mg sampel × faktor koreksi alat∗ × 100%
*) Faktor koreksi alat = 2,5
% Kadar Protein = % N × faktor konversi∗
*) Faktor Konversi = 6,25
4) Analisis kadar abu (AOAC 1995)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api hingga tidak berasap lagi, dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 1 jam, kemudian ditimbang hingga diperoleh berat yang konstan.
Kadar abu dapat ditentukan dengan rumus:
Berat abu g = berat sampel dan cawan akhir g −berat cawan kosong (g)
Kadar abu berat basah = Berat abu (g)
Berat sampel awal (g)× 100%
5) Analisis karbohidrat (AOAC 1995)
Pengukuran kadar karbohidrat dilakukan secara by difference, yaitu hasil pengurangan dari 100% dengan kadar air, kadar abu, kadar protein, dan kadar lemak sehingga kadar karbohidrat tergantung pada faktor pengurangan. Hal ini karena karbohidrat sangat berpengaruh terhadap zat gizi lainnya. Kadar karbohidrat dapat dihitung dengan mengunakan rumus:
3.4.3 Pengujian senyawa flavonoid secara kualitatif (Harborne 1987)
Biomasa Spirulina fusiformis pada umur panen terpilih dan fikosianin yang dihasilkan, terlebih dahulu diuji senyawa flavonoid dan golongannya, sebagai berikut:
Pengujian senyawa flavonoid dilakukan dengan melarutkan 0,1 gram biomasa kering Spirulina fusiformis dalam 10 ml air panas yang kemudian didihkan selama 5 menit dan disaring. Sebanyak 10 ml filtrat ditambahkan 0,5 gram Mg, 1 ml HCl pekat, dan 1 ml amil alkohol. Campuran dikocok dengan kuat.
Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol. Setelah diperoleh bahwa positif terdapat flavonoid, selanjutnya dilakukan uji golongan flavonoid.
Pengujian golongan flavonoid dilakukan dengan melarutkan 0,5 gram biomasa kering Spirulina fusiformis dalam MeOH-HCl 1 N (1:1) dan dipanaskan dalam labu erlenmeyer pada suhu dengan etil asetat. Sebanyak 1 ml ekstrak etil asetat ditambah 3 tetes (CH3COO)2Pb lalu diamati warnanya. Falvon memberikan warna jingga hingga krem, kalkon memberikan warna jingga tua, dan auron memberikan warna merah.
Sebanyak 1 ml ekstrak etil asetat ditambahkan 2 tetes NaOH 0,1 N lalu diamati warnanya. Flavonol dan flavon memberikan warna kuning, sedangkan kalkon dan auron memberikan warna merah hingga ungu. Sebanyak 1 ml ekstrak etil asetat ditambahkan 3 tetes H2SO4 lalu diamati warnanya. Flavonol dan falvon memberikan warna kuning, falvanonol memberikan warna jingga hingga krem, dan kalkon memberikan warna krem hingga merah tua.
3.4.4 Pengukuran kadar glukosa darah (Sugiwati 2005)
Sampel darah diperoleh dari pembuluh vena di bagian ekor tikus. Ekor tikus
terlebih dalulu dipijat searah ke ujung ekor dan dibersihkan dengan alkohol 70% (v/v), kemudian bagian ujung ekor ditusuk menggunakan lancet streril.
Tetesan darah yang keluar diterapkan tepat pada ujung glucose test strip dan darah harus memenuhi bagian bawah membran. Kadar glukosa darah dapat dibaca oleh alat glukosa meter secara digital.
3.5 Rancangan percobaan dan analisis data
Model rancangannya adalah (Steel dan Torrie 1993): Y ij = + τi + ε ij
Keterangan:
Y ij = Nilai pengamatan kadar glukosa darah pada taraf ke-i dan ulangan ke-j (j=1,2,3,4,5)
= Nilai tengah atau rataan umum pengamatan
τi = Pengaruh perbedaan dosis pada taraf ke-i (i=1,2,3)
ε ijk = Galat atau sisa pengamatan taraf ke-i dengan ulangan ke-j
Perlakuan yang diberikan adalah perbedaan dosis yang diberikan secara oral pada hewan uji. Perlakuan perbedaan dosis biomasa Spirulina fusiformis terdiri
dari 4 taraf, yaitu N (larutan sukrosa tanpa biomasa atau kontrol negatif), P (larutan sukrosa dengan penambahan obat acarbose atau kontrol positif), B1 (larutan sukrosa dengan penambahan biomasa dosis 0,15 mg/g BB tikus), dan
B2 (larutan sukrosa dengan penambahan biomasa dosis 0,30 mg/g BB tikus). Perlakuan perbedaan dosis juga dilakukan pada pemberian oral fikosianin pada hewan uji. Taraf perlakuannya ada 4, meliputi N (larutan sukrosa tanpa fikosianin atau kontrol negatif), P (larutan sukrosa dengan penambahan obat acarbose atau kontrol positif), F1 (larutan sukrosa dengan penambahan fikosianin dosis 0,15 mg/g BB tikus), dan F2 (larutan sukrosa dengan penambahan fikosianin dosis 0,30 mg/g BB tikus).
Data kadar glukosa darah tikus yang diperoleh dianalisis dengan ANOVA (Analysis Of Variant) menggunakan uji F. Pengolahan data kadar glukosa darah dilakukan menggunakan perangkat lunak Statistical Package for Social Science
(SPSS) 14.0 for Windows.
Hipotesa terhadap data hasil uji aktivitas antihiperglikemik pada berbagai dosis pemberian biomasa Spirulina fusiformis adalah sebagai berikut:
Ho = Perbedaan dosis biomasa Spirulina fusiformis tidak memberikan pengaruh terhadap kadar glukosa darah tikus.
Hipotesa terhadap data hasil uji aktivitas antihiperglikemik pada berbagai dosis pemberian fikosianin Spirulina fusiformis adalah sebagai berikut:
Ho = Perbedaan dosis fikosianin tidak memberikan pengaruh terhadap kadar glukosa darah tikus.
H1= Perbedaan dosis fikosianin memberikan pengaruh terhadap kadar glukosa darah tikus.
Jika uji F pada ANOVA memberikan pengaruh yang berbeda nyata (tolak H0) terhadap kadar glukosa darah tikus maka dilanjutkan dengan uji lanjut Duncan (Least Significant Difference (LSD)), dengan rumus (Steel dan Torrie 1993):
LSD = tα/2; dbs 2 KTS
�
Keterangan :
4 HASIL DAN PEMBAHASAN
4.1 Kurva pertumbuhan Spirulina fusiformis
Kultivasi atau produksi Spirulina pada dasarnya meliputi penumbuhan kultur, pemanenan, pencucian, pengeringan, dan penyimpanan produk. Kultur Spirulina
dalam media Zarouk dilakukan dengan membiakkan inokulum mikroalga Spirulina fusiformis yang diperoleh dari koleksi Lembaga Ilmu
Pengetahuan Indonesia (LIPI).
Penyegaran inokulum Spirulina dilakukan dalam toples kaca ukuran 5 liter, agar Spirulina yang akan di kultivasi berada dalam keadaan optimum untuk tumbuh. Penyegaran dilakukan untuk mempercepat waktu yang dibutuhkan
Spirulina beradaptasi dengan lingkungan barunya. Kondisi optimum umumnya dicapai ketika berada pada fase pertumbuhan (logaritmik), Spirulina sedang berada dalam tingkat pertumbuhan yang maksimal (Pamungkas 2005).
Faktor lingkungan sangat penting diperhatikan karena dapat berpengaruh terhadap tingkat pertumbuhan dan perkembangbiakan Spirulina. Faktor lingkungan utama yang berpengaruh pada kultivasi Spirulina adalah nutrisi, suhu, dan cahaya (Richmond 1988). Kondisi lingkungan selama kultivasi pada
penelitian ini adalah pada kisaran suhu ruang 28-30 ºC; suhu air 28-29 ºC; pH 9-10; dan intensitas cahaya 5480 lux dari lampu TL (tube lamp).
Cahaya buatan dari lampu TL dapat mengganti fungsi sinar matahari pada kultur alga fotoautotrof yang dipelihara di dalam laboratorium (Diharmi 2001). Sinar lampu TL mencakup spektrum warna yang dapat berfungsi sebagai sumber energi cahaya pada proses fotosintesis. Reaksi fotosistem dijalankan oleh spektrum cahaya yang berbeda, yaitu fotosistem II yang bekerja pada panjang gelombang 680 nm dan fotosistem I pada panjang gelombang 700 nm. Cahaya yang berasal dari lampu TL sebenarnya merupakan sebaran cahaya dalam bentuk horizontal dari semua spektrum, yaitu spektrum ungu dan ultra ungu sampai merah dan infra merah (Hadioetomo 1993).
Pertumbuhan didefinisikan sebagai suatu peningkatan masa sel dan disertai
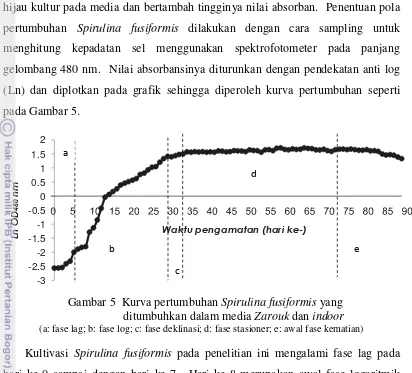
hijau kultur pada media dan bertambah tingginya nilai absorban. Penentuan pola pertumbuhan Spirulina fusiformis dilakukan dengan cara sampling untuk menghitung kepadatan sel menggunakan spektrofotometer pada panjang gelombang 480 nm. Nilai absorbansinya diturunkan dengan pendekatan anti log (Ln) dan diplotkan pada grafik sehingga diperoleh kurva pertumbuhan seperti pada Gambar 5.
Gambar 5 Kurva pertumbuhan Spirulina fusiformis yang ditumbuhkan dalam media Zarouk dan indoor
(a: fase lag; b: fase log; c: fase deklinasi; d: fase stasioner; e: awal fase kematian)
Kultivasi Spirulina fusiformis pada penelitian ini mengalami fase lag pada hari ke-0 sampai dengan hari ke-7. Hari ke-8 merupakan awal fase logaritmik yang ditandai dengan tingginya OD. Fase logaritmik atau eksponensial berlangsung hingga hari ke-31. Penentuan fase pada kurva pertumbuhan sel
Spirulina pada penelitian ini juga didukung oleh penggambaran fase pertumbuhan sel alga oleh Fogg dan Thake (1987) pada Gambar 2.
Kondisi pada kedua fase di atas didukung oleh pernyataan Fogg dan Thake (1987) bahwa fase lag ditandai dengan peningkatan populasi yang tidak terlalu nyata. Fase ini disebut juga dengan fase adaptasi karena sel mikroalga Spirulina
sedang beradaptasi terhadap media pertumbuhannya. Fase selanjutnya adalah fase eksponensial atau logaritmik yang ditandai dengan tingginya laju pertumbuhan karena mikroalga sedang aktif berkembangbiak.
Berakhirnya fase logaritmik menjadi awal terjadinya fase deklinasi pada kultivasi Spirulina fusiformis, yaitu pada hari ke-32 sampai dengan hari ke-34. Pertumbuhan dengan laju yang lebih lambat terjadi seiring dengan berkurangnya
Spirulina fusiformis mencapai akhir dari produksi biomasa selnya pada fase stasioner yang terjadi pada hari ke-35 sampai dengan hari ke-75. Bagian dasar akuarium berwarna hijau pucat pada hari ke-76 akibat banyaknya sel yang lisis dan tenggelam ke dasar akuarium. Sel Spirulina mengalami penurunan nilai absorbansi kultur pada panjang gelombang 480 nm. Nilai absorbansi kultur pada panjang gelombang 480 nm yang mencerminkan kepadatan sel Spirulina untuk masing-masing fase kultur dapat dilihat pada Lampiran 2.
Pertumbuhan sel baru juga dihambat dengan keberadaan sel yang telah mati dan faktor pembatas lainnya (Fogg dan Thake 1987). Penurunan kepadatan sel disebabkan sel mengalami kematian dan lisis. Proses lisis terjadi karena perbedaan tekanan osmotik di dalam sel dengan lingkungan. Sel Spirulina
kehilangan kemampuan untuk mempertahankan cairan intraseluler seiring dengan laju degradasi komponen biokimia di dalam sel (Vonshak 1985).
4.2 Biomasa Spirulina fusiformis
Kultivasi dilakukan pada akuarium yang terdiri dari 100 liter medium dan 20 liter inokulum di dalam laboratorium. Biomasa Spirulina fusiformis sangat dipengaruhi oleh sumber cahaya, kemudian diikuti oleh nutrient dan temperatur. Kondisi ini tetap dipertahankan seperti pada saat kultivasi untuk memperoleh kurva pertumbuhannya. Kultivasi Spirulina fusiformis ini disajikan secara deskriptif pada Gambar 6.
Kultivasi dilakukan secara kontinyu, artinya dalam satu akuarium dilakukan pemanenan beberapa kali. Waktu pemanenan berdasarkan kurva pertumbuhan
yang telah diperoleh. Pemanenan dilakukan pada fase logaritmik dan fase stasioner, meliputi awal fase log (8 hari), tengah fase log (15 hari), akhir fase log (31 hari), awal fase stasioner (35 hari), dan akhir fase stasioner (75 hari). Hal ini dikarenakan mikroalga pada fase logaritmik mengalami
percepatan pertumbuhan sedangkan pertumbuhan mikroalga pada fase stasioner mencapai tingkat maksimal (Fogg 1975).
Pemanenan biomasa basah dilakukan menggunakan metode filtrasi karena ukuran sel Spirulina besar (ukuran diameter filamennya adalah 50 µm) sehingga bisa digunakan kain nylon mesh ukuran 20 µm. Sel Spirulina fusiformis
berbentuk filamen sehingga akan mengambang pada permukaan kultur dan
memudahkan dalam pemanenan (Desmorieux dan Decaen 2006). Hasil pemanenan biomasa Spirulina fusiformis pada masing-masing umur panen
dapat dilihat pada Tabel 3.
Tabel 3 Berat biomasa Spirulina fusiformis pada masing-masing umur panen untuk skala 100 L medium (sistem kontinyu atau dalam satu akuarium) Umur panen (hari) Biomasa basah (g) Biomasa kering (g) Kadar air (%) Fase logaritmik
8 801 81,4 8,14
15 825 82,1 8,21
31 1002 110,6 8,46
Fase stasioner
35 1950 117,0 8,48
75 2006 123,5 8,77
Biomasa Spirulina fusiformis yang dipanen pada fase stasioner memiliki berat yang lebih besar jika dibandingkan dengan biomasa pada fase logaritmik. Pertambahan biomasa sel pada umur 75 hari menunjukkan bahwa setelah fase logaritmik Spirulina masih mengalami pertumbuhan. Umur kultur 75 hari adalah akhir fase stasioner yang merupakan akhir dari produksi biomasa sel.
Poses terakhir dalam produksi biomasa Spirulina fusiformis adalah pengeringan. Tahap pengeringan dilakukan untuk mendapatkan biomasa
bobot biomasa kering berkurang hingga 10% dari bobot biomasa basah, karena pada proses pengeringan air terbawa keluar dari biomasa sel.
Pengeringan dilakukan pada suhu ruang dengan bantuan kipas angin (27-28oC) karena berdasarkan peneltian Mohammad (2007), kondisi pengeringan suhu ruang dapat mempertahankan kandungan fikosianin lebih tinggi (8,09%) pada Spirulina fusiformis dibandingkan menggunakan AC dan blower heat. Pengeringan pada suhu ruang akan semakin mengefisienkan waktu dan biaya produksi untuk menghasilkan kadar fikosianin yang paling baik.
Fikosianin yang digolongkan dalam makromolekul protein dapat dilihat melalui ekspresi jumlah protein dalam biomasa Spirulina fusiformis yang
digunakan dalam ekstraksi. Pengukuran komposisi kimia biomasa
Spirulina fusiformis pada umur panen terpilih digunakan sebagai standar dalam pengujian aktivitas antihiperglikemiknya.
Biomasa Spirulina fusiformis menghasilkan jumlah komponen makromolekul yang berbeda pada setiap umur panen karena sintesis makromolekul sangat dipengaruhi oleh kandungan nutrient dalam medium, kondisi kultivasi yang dilakukan. Biomasa dengan bobot terbesar akan digunakan dalam analisis komponen kimianya. Pada umur panen 75 hari diperoleh bobot biomasa terbesar, yaitu 123,5 g biomasa kering. Secara umum komposisi kimia dalam biomasa umur 75 hari ini dapat dilihat pada Tabel 4.
Tabel 4 Komposisi kima biomasa kering Spirulina fusiformis umur panen 75 hari
Kandungan Jumlah (% bk)
Air 8,77
Mineral (abu) 8,69
Protein 54,55
Lemak 2,32
Karbohidrat* 25,67
*by difference
Hal ini berkebalikan dengan sintesis lemak. Kandungan lemak biomasa
Spirulina fusiformis umur panen 75 hari pada penelitian ini sangat rendah, yaitu 2,32%. Spirulina merupakan mikroalga yang tidak menghasilkan kandungan lemak tinggi. Hal ini sesuai dengan pernyataan Spolaore (2006) bahwa kandungan lemak Spirulina berkisar antara 6-7%.
Kandungan karbohidrat Spirulina fusiformis pada umur panen 75 hari mencapai 25,67%. Belay et al. (2007) menyatakan bahwa sintesa karbohidrat melalui pembentukan glukosa selama proses fotosintesis memerlukan sumber karbon dan cahaya. Komponen natrium bikarbonat (NaHCO3) sebagai larutan penyangga dalam medium kultivasi Spirulina fusiformis menyebabkan pH medium kultivasi tidak berfluktuatif yaitu, pada awal (pH 9) dan akhir (pH 10). Hal ini sesuai dengan pernyatan Zarouk (1966) bahwa fluktuasi pH yang terlalu tajam akan mengakibatkan kematian alga. Komponen natrium bikarbonat (NaHCO3), selain sebagai larutan penyangga yang digunakan pada kultur
Spirulina, juga merupakan sumber karbon yang dibutuhkan untuk proses sintesis karbohidrat. Kandungan karbohidrat yang terdapat pada alga hijau biru ini berkisar antara 15-25%.
4.3 Kandungan fikosianin dari Spirulina fusiformis
Ekstraksi fikosianin pada penelitian ini dilakukan dengan menggunakan air pada kultur umur 8, 15, 31, 35, dan 75 hari. Lorenz (1998) mengekstraksi fikosianin menggunakan buffer fosfat. Fikosianin kasar dapat diperoleh dengan mengekstrak serbuk Spirulina fusiformis dengan buffer fosfat pH 7 dan dibaca absorbansinya pada panjang gelombang 620 nm dengan buffer fosfat sebagai blanko. Kadar fikosianin dihitung secara kuantitatif dengan cara menghitung absorbansi yang diperoleh dari hasil ekstraksi (Lampiran 4).
Fikosianin merupakan pigmen fotosintetik utama pada Spirulina disamping
peranannya sebagai penyimpan cadangan nitrogen dan asam amino. Besar maupun kecilnya keberadaan fikosianin yang terkandung dalam biomasa sel
tergantung banyak sedikitnya suplai nitrogen yang dikonsumsi oleh Spirulina
Tabel 5 Nilai kadar fikosianin berdasarkan umur panen
Umur panen A 620 nm Kadar fikosianin (%)
8 hari1a 1,390 5,850
15 hari2a 1,610 6,717
31 hari3a 1,968 7,969
35 hari 1b 2,006 8,102
75 hari 2b 2,102 8,204
Keterangan: 1a = awal fase log; 2a = tengah fase log; 3a = akhir fase log 1b = awal fase stasioner; 2b = akhir fase stasioner
Ekstraksi biomasa Spirulina fusiformis menggunakan air menghasilkan kadar fikosianin yang berbeda untuk setiap umur panen, yaitu berkisar antara 5,850% - 8,204%. Fikosianin tertinggi dalam penelitian ini diperoleh ketika mikroalga
Spirulina fusiformis berada pada fase pertumbuhan stasioner. Fase stasioner merupakan akhir dari produksi biomasa. Kondisi ini dapat digambarkan sebagai suatu grafik pertumbuhan yang konstan (Gambar 5).
Fikosianin terdiri dari dua komponen fikobiliprotein, yaitu c-fikosianin dan allofikosianin. Fikosianin dapat bertindak sebagai material penyimpan nitrogen. Pada saat kondisi nitrogen melimpah, selain digunakan untuk pertumbuhan
Spirulina, nitrogen disimpan dalam bentuk fikosianin (Richmond 1988). Oleh karena itu, pada fase stasioner dengan umur panen 75 hari diperoleh
kandungan fikosianin yang lebih besar dibandingkan fikosianin pada umur panen yang lain.
Hasil penelitian ini menunjukkan bahwa kadar fikosianin tertinggi dihasilkan oleh ekstraksi air biomasa kering Spirulina fusiformis pada umur panen 75 hari, yaitu sebesar 8,204% dengan nilai absorbansi fikosianin pada A620 nm adalah 2,102 (Tabel 3) dan nilai absorbansi kultur Spirulina fusiformis pada A480 nm adalah 5,354 (Lampiran 2). Hal ini sesuai dengan hasil penelitian Achmadi et al.
(2002) yang menyatakan bahwa rapat optis (OD) optimum pada
Spirulina platensis untuk mendapatkan pigmen fikosianin terbaik adalah diatas 1,0 pada panjang gelombang 480 nm.
4.4 Aktivitas antihiperglikemik dari biomasa Spirulina fusiformis pada kadar glukosa darah tikus
penghidrolisis karbohidrat seperti α-glukosidase. Usaha menjaga tingkat glukosa darah menjadi rendah atau normal dapat menurunkan angka penderita komplikasi diabetes melitus (Lee et al. 2007). Berdasarkan hal tersebut, pada penelitian ini dipilih obat Acarbose sebagai kontrol positif yang merupakan obat standar oral pada penderita diabetes melitus tipe-2.
Mekanisme obat Acarbose adalah melalui inhibisi secara reversible yang kompetitif terhadap enzim sukrase. Obat Acarbose menghambat hidrolisis karbohidrat pada usus halus, berkompetisi dengan sukrosa atau karbohidrat lain untuk berikatan pada sisi aktif enzim sehingga absorbsi glukosa ke dalam darah menurun seiring tidak terbentuknya D-glukosa bebas (Info Obat Indonesia 2009).
Pengukuran kadar glukosa darah pada penelitian ini menggunakan metode Tes Toleransi Glukosa Oral (TTGO). Model hewan uji yang digunakan dalam penelitian ini tidak dibuat DM permanen, sehingga metabolisme karbohidrat seluruh hewan coba dianggap normal tanpa adanya defisiensi insulin, sehingga yang diharapkan terjadi adalah hambatan naiknya kadar glukosa darah setelah diberi perlakuan.
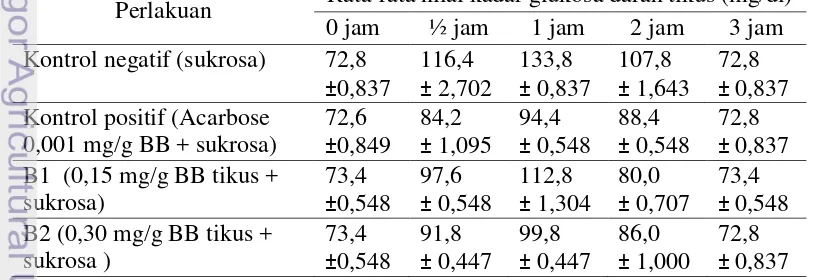
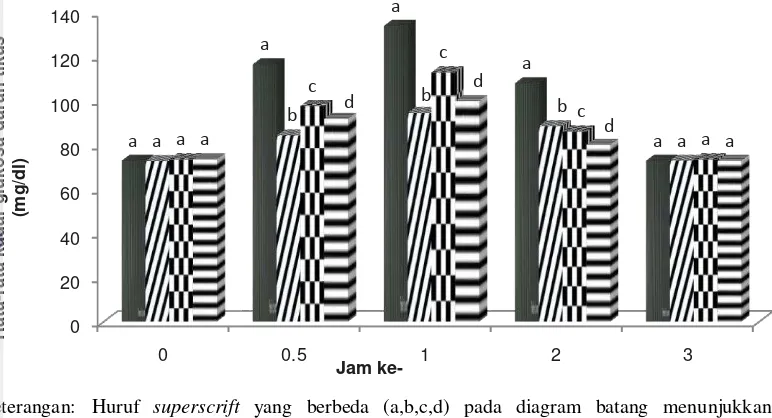
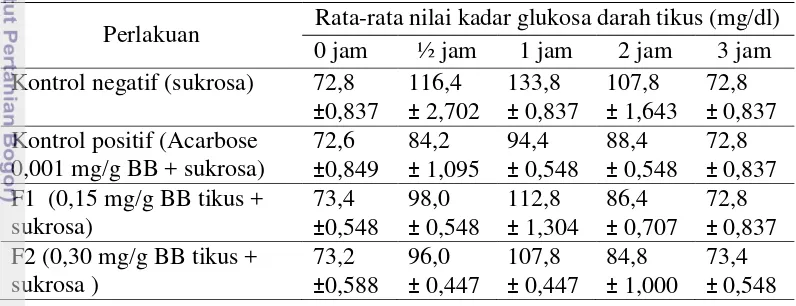
Pengujian kadar glukosa darah dilakukan setelah tikus dipuasakan selama 18 jam agar pada saat perlakuan, metabolisme yang terjadi merupakan metabolisme normal tanpa adanya defisiensi insulin serta untuk mendapatkan kadar glukosa darah puasanya. Sampel darah diambil sebelum perlakuan dan pada setiap ½, 1, 2, dan 3 jam setelah pemberian larutan sukrosa dan bahan uji per oral. Nilai rata-rata kadar glukosa darah tikus untuk masing-masing perlakuan ditampilkan pada Tabel 6.
Tabel 6 Nilai rata-rata kadar glukosa darah tikus untuk perlakuan dosis biomasa
Spirulina fusiformis
Perlakuan Rata-rata nilai kadar glukosa darah tikus (mg/dl) 0 jam ½ jam 1 jam 2 jam 3 jam Kontrol negatif (sukrosa) 72,8
Nilai rata-rata kadar glukosa darah tikus pada jam ke-0 berkisar antara 72,8-73,4 mg/dl. Pengamatan selanjutnya adalah pada nilai rata-rata kadar glukosa darah tikus ½ jam setelah perlakuan berkisar antara 116,4-84,2 mg/dl dan nilai rata-rata kadar glukosa darah tikus 1 jam setelah perlakuan berkisar antara 133,8-94,4 mg/dl. Nilai rata-rata kadar glukosa darah tikus selanjutnya, yaitu, 2 jam setelah perlakuan berkisar antara 107,8-80,00 mg/dl dan 3 jam setelah
perlakuan nilai rata-rata kadar glukosa darah tikus berkisar antara 72,8-73,4 mg/dl.
Tikus-tikus yang telah diadaptasikan dan dipuasakan tidak diberikan perlakuan apapun setelahnya, sehingga yang terukur pada jam ke-0 adalah kadar glukosa darah puasa tikus. Hal ini didukung oleh pernyataan Malole dan Pramono (1989) bahwa kadar glukosa darah tikus berkisar antara 50-135 mg/dl.
Produksi dan sekresi insulin dipacu oleh jumlah glukosa dalam darah. Jika jumlah glukosa telah mencapai kadar tertentu, insulin akan disekresikan dan “membuka” sel-sel dalam hati, otot, dan lemak sehingga memungkinkan glukosa masuk ke dalam sel-sel tersebut. Dengan demikian, glukosa tidak menumpuk dalam darah dan kadar glukosa tetap normal (Wijayakusuma 2006).
Pemberian sukrosa pada tes toleransi glukosa oral akan meningkatkan glukosa darah hingga puncaknya dalam waktu 60 menit (Gibney et al. 2008). Kadar glukosa darah tikus meningkat sejak ½ jam perlakuan dan mencapai nilai kadar glukosa tertinggi pada 1 jam setelah pemberian sukrosa. Rata-rata kadar glukosa darah tikus meningkat dari 72,8 mg/dl menjadi 133,8 mg/dl untuk kontrol negatif dengan hanya pemberian larutan sukrosa 80% b/v. Hal ini didukung oleh pernyataan Mridha et. al (2010) bahwa pencernaan sukrosa (karbohidrat) terjadi di dalam usus halus tikus, yaitu memecah karbohidrat menjadi molekul glukosa dan fruktosa.