PENYAKIT MYCOBACTERIOSIS DAN MOTILE AEROMONAS
SEPTICEMIA PADA IKAN GURAME (Osphronemus gouramy)
UNI PURWANINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Vaksin koktail sel utuh untuk pencegahan penyakit Mycobacteriosis dan Motile Aeromonas Septicemia (MAS) pada ikan gurame (Osphronemus gouramy) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2013
UNI PURWANINGSIH. Whole cell cocktail vaccine for Mycobacteriosis and Motile Aeromonas Septicemia in Gouramy (Osphronemus gouramy). Under direction of AGUSTIN INDRAWATI and ANGELA MARIANA LUSIASTUTI
Infections of Mycobacterium sp. and Aeromonas sp. both are considered severe fish pathogens on account of their ability to cause damaging disease outbreaks in gouramy (Osphronemus gouramy). The efficacy of cocktail vaccine was influenced by the concentrations of antigens, cross-reactions and competition among the different antigens. The aims of this reseach was to analyze the synergy and competence both antigens to inducing immunity and assess the effectiveness and efficacy of cocktail vaccine A. hydrophila and M. fortuitum to producing immune responses and improve survival rate in gouramy from Mycobacteriosis and Motile Aeromonas Septicemia (MAS) infection. The Lethal dose of co-infection used LD50 of A. hydrophila 108 cfu and M. fortuitum 107 cfu. Co-infection test of gouramy showed clinical sign was anorexia, nodules on the surface of the body and swelling in the abdominal cavity. The mortality of co-infection 25Mf: 75Ah was reached until 50% (LD50) within 28 days. The mortality patterns of Mycobacteriosis was chronic and MAS was acute infection. Hematocrit and hemoglobine values of co-infection was decreased because gouramy become sick that was caused invasion both of bacteria into the body. Pathology anatomy of co-infection showed bleeding in the kidneys and spleen, multifocal granulomas in liver and spleen, and ascites in the abdominal cavity. Histopathology showed congestion, multifocal granuloma in the liver and spleen, melano macrofag center (MMC) in the spleen and kidneys, inflammation and necrosis were also found in the kidney. The protein profile analysis of whole cell vaccine preparation M. fortuitum, A. hydrophila and cocktail vaccine showed fourteen, fifteen and five to ten bands. The efficacy of monovalent and cocktail vaccine showed phagocytic index, percentage of phagocytosis, total lymphocytes, respiratory burst activity, complement and antibody titers were significantly different (P <0.05), compared to controls. The evaluation of parameters from efficacy monovalent and cocktail vaccine M. fortuitum and A. hydrophila before and after challenge test were able to increased specific and non-specific immune response in gouramy. The value of relative percent survival from monovalent vaccine A. hydrophila was 92.32% and monovalent vaccine M. fortuitum was 78.57% when challenged by single infection but showed very low RPS when challenged by co-infection compared to cocktail vaccine. Monovalent vaccine M. fortuitum and A. hydrophila were only provide protection against homolog bacteria and no cross protection against other bacteria. Cocktail vaccine was not enough provides protection from mycobacteriosis and MAS when infected at the same time. Therefore, it need use the adjuvant to optimalize cocktail vaccine to inducting immune respon in gouramy.
RINGKASAN
UNI PURWANINGSIH. Vaksin koktail sel utuh untuk pencegahan penyakit Mycobacteriosis dan Motile Aeromonas Septicemia pada ikan gurame (Osphronemus gouramy). Dibimbing oleh AGUSTIN INDRAWATI dan ANGELA MARIANA LUSIASTUTI
Infeksi bakteri Mycobacterium sp. dan Aeromonas spp. menjadi salah satu kendala keberhasilan budidaya gurame di Indonesia. Timbulnya penyakit Mycobacteriosis (Fish Tubercullosis) dan Motile Aeromonas Septicaemia (MAS) mengakibatkan kerugian ekonomi karena menyebabkan kematian yang tinggi dan menurunkan kualitas produk perikanan. Saat ini, penggunaan antibiotik sebagai salah satu upaya pengendalian kedua jenis penyakit tersebut telah dilarang karena dampak bahaya residu, resistensi dan penurunan nilai keamanan pangan. Oleh karena itu diperlukan solusi alternatif yang efektif, efisien dan aplikatif melalui pemberian vaksin koktail M. fortuitum dan A. hydrophila. Keberhasilan vaksin koktail dipengaruhi oleh konsentrasi antigen , reaksi silang dan kompetisi di antara antigen yang berbeda. Penelitian ini bertujuan untuk menganalisis sinergitas dan kompetensi kedua antigen dalam menginduksi imunitas pada ikan gurame serta mengkaji efektifitas dan efikasi vaksin koktail dari bakterin M. fortuitum dan A. hydrophila dalam menghasilkan respons imun dan meningkatkan kelangsungan hidup pada ikan gurame untuk mencegah infeksi penyakit Mycobacteriosis dan Motile Aeromonas Septicemia.
Penelitian ini dilakukan di Laboratorium Mikrobiologi Departemen Ilmu Penyakit Hewan dan kesehatan Masyarakat Veteriner - Fakultas Kedokteran Hewan IPB dan Laboratorium Kesehatan Ikan Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor. Ikan uji yang digunakan berukuran 25
– 30 g per ekor dengan syarat memenuhi asumsi “Spesific Free Pathogen” terhadap Mycobacterium sp. dan Aeromonas sp. Isolat yang digunakan adalah M. fortuitum kode 31 dan A. hydrophila AHL 0905-2. Preparasi vaksin dilakukan berdasarkan modifikasi metode yang telah dikembangkan oleh Purwaningsih et al. (2012) dan Sugiani (2012).
ko-infeksi menunjukkan pendarahan pada ginjal dan limpa, multifokal granuloma pada hati dan limfa serta asites pada rongga perut. Histopatologi menunjukkan kongesti, granuloma multifokal pada hati dan limpa, melano macrofag centre (MMC) pada limpa dan ginjal dan peradangan dan nekrosis juga ditemukan pada organ ginjal.
Tahap kedua, preparasi sediaan vaksin inaktif dari isolat M. fortuitum dan A. hydrophila dengan inaktifasi menggunakan neutral buffer formalin 3%. Evaluasi terhadap vaksin dilakukan melalui uji keamanan, sterilitas dan karakter profil protein sediaan vaksin. Efikasi vaksin monovalen dan koktail tidak menyebabkan kematian setelah 24 jam pascainjeksi. Analisa profil protein terhadap vaksin sediaan sel utuh M. fortuitum, A. hydrophila dan koktail masing - masing menunjukkan jumlah pita protein yang bervariasi. Residu formalin vaksin 25 Mf : 75 Ah sebesar 0.205 mg/L, vaksin 50 Mf : 50 Ah sebesar 0.191 mg/L dan vaksin 75 Mf : 25 Ah sebesar 0.136 mg/L dan tidak terdeteksi pada semua sampel otot ikan perlakuan vaksin monovalen maupun koktail. Analisa histologi menunjukkan tidak ditemukan adanya perubahan pada organ hati, ginjal dan limpa pada perlakuan vaksin. Inaktifasi vaksin dengan menggunakan neutral buffer formalin 3 % terbukti aman karena kelangsungan hidup pada berbagai kelompok perlakuan 98 – 100 %.
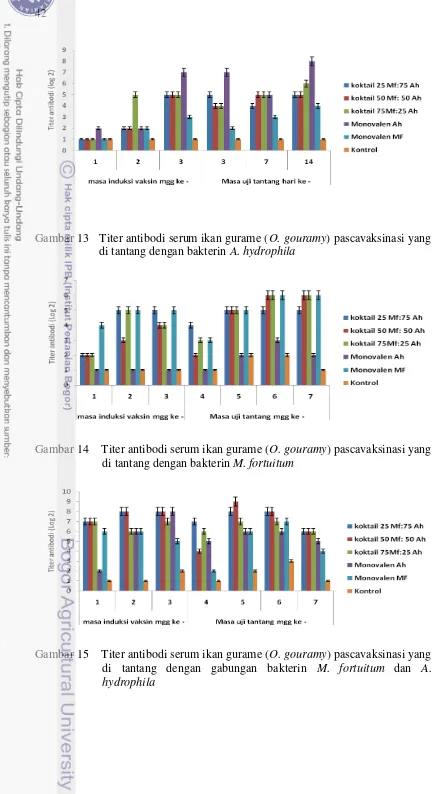
Tahap ketiga, menganalisis respon imun terhadap pemberian vaksin monovalen dan koktail M. fortuitum dan A. hydrophila sebagai penilaian terhadap parameter keberhasilan vaksinasi pada ikan gurame. Keberhasilan vaksinasi dapat diukur dari beberapa parameter imunologi untuk mengetahui keamanan dan level proteksi aplikasi vaksin pada ikan. Analisis bakterisidal serum dapat dijadikan komponen untuk melihat viabilitas patogen dalam inang yang ditunjukkan melalui aktifitas respiratory burst, titer antibodi dan komplemen. Pemeriksaan komponen darah dapat digunakan untuk mengetahui kondisi status kesehatan ikan, mengevaluasi pertahanan non spesifik pada spesies ikan dan mengetahui pengaruh stress terhadap kesehatan ikan. Ikan gurame pada perlakuan vaksin monovalen maupun koktail menunjukkan nilai indek fagositik, persentase fagositosis, total limfosit, aktivitas respiratory burst, komplemen dan titer antibodi yang berbeda nyata (P<0.05) dibanding kontrol. Titer antibodi mengalami peningkatan setelah 14 hari pascavaksinasi. Hasil evaluasi terhadap parameter – parameter diatas menunjukkan bahwa vaksin monovalen dan koktail M. fortuitum dan A. hydrophila mampu meningkatkan respon imun spesifik dan non spesifik pada ikan gurame.
setelah diuji tantang dengan bakteri A. hydrophila dan vaksin monovalen M. fortuitum sebesar 78.57% berbeda halnya ketika diuji tantang dengan bakteri ko-infeksi menunjukkan nilai RPS yang sangat rendah dibanding vaksin koktail. Vaksin monovalen M. fortuitum dan A. hydrophila hanya memberikan proteksi terhadap bakteri homolog dan tidak proteksi silang terhadap bakteri lain. Vaksin koktail belum cukup protektif memberikan perlindungan pada ikan gurame jika terinfeksi penyakit Mycobacteriosis dan MAS dalam waktu yang bersamaan. Oleh karena itu perlu dicoba penggunaaan adjuvan untuk mengoptimalkan kerja vaksin koktail dalam menginduksi respon imun pada gurame.
©Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENYAKIT MYCOBACTERIOSIS DAN MOTILE AEROMONAS
SEPTICEMIA DAN PADA IKAN GURAME
(Osphronemus gouramy)
UNI PURWANINGSIH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
pada ikan gurame (Osphronemus gouramy)
Nama : Uni Purwaningsih
NIM : B 253110051
Disetujui
Komisi Pembimbing
Dr.drh. Agustin Indrawati, M. BioMed Dr. drh. Angela M. Lusiastuti, M.Si Ketua Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana Mikrobiologi Medik
Prof. Dr.drh. Fachriyan H Pasaribu Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2012 – Juni 2013 ini adalah Vaksin koktail sel utuh untuk pencegahan penyakit Mycobacteriosis dan Motile Aeromonas Septicemia pada ikan gurame (Osphronemus gouramy).
Terimakasih penulis ucapkan kepada Dr. drh. Agustin Indrawati, M.BioMed dan Dr. drh. Angela Mariana Lusiastuti, M.Si selaku pembimbing yang memberi saran dan masukan. Terimakasih penulis ucapkan kepada Kementrian Kelautan dan Perikanan yang telah memberikan beasiswa periode September 2011 – Agustus 2013. Terima kasih kepada Kepala Balai Penelitian dan Pengembangan Budidaya Air Tawar atas bimbingan dan arahan selama penulis menyelesaikan pendidikan. Disamping itu, penghargaan penulis sampaikan kepada Ir. Taukhid, MSc; Dr. Desy Sugiani, M.Si ; Tuti Sumiati, SPi; Ahmad Wahyudi; Edy Farid Wadjdy; Bambang Priadi; Mikdarullah; serta seluruh staf peneliti dan karyawan-karyawati lingkup Balai. Terimakasih untuk teman - teman MKM 2011 silaturahmi kita tetap terjalin dan terima kasih untuk staf lab. Terpadu Mikrobiologi FKH IPB atas bantuannya selama penelitian. Ungkapan terimakasih juga disampaikan kepada Ayahanda Sri Purwanto dan Ibunda Suwarni serta ayahanda Saini dan Ibunda Siti Sulaminah yang selalu memberikan doa dan dukungannya. Suamiku tercinta drh. Agus Karyono, dua bidadari kecilku
“Fathia Qutrotunnada Alifa dan Fahira Amalia Khairunnisa” terima kasih atas semangat dan pengertiannya serta seluruh keluarga atas doa dan motivasi selama penulis menyelesaikan pendidikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2013
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 22 Januari 1981 sebagai anak pertama dari pasangan Sri Purwanto dan Suwarni. Pendidikan sarjana ditempuh di Jurusan Kedokteran Hewan, Fakultas Kedokteran Hewan, Universitas Gadjah Mada pada tahun 1999 dan lulus pada tahun 2004. Kesempatan untuk melanjutkan ke Program Magister pada Program Studi Mikrobiologi Medik IPB diperoleh dari program beasiswa KKP pada tahun 2011.
xii Penyakit Motile Aeromonas Septicemia (MAS) ... 5 6 Bakteri Mycobacterium fortuitum ... 7
Bakteri Aeromonas hydrophila ... 8
Imunologi Ikan ... 9
Vaksinasi pada ikan ... 11
III. BAHAN DAN METODE Waktu dan Tempat Penelitian ... 14
Ikan Uji ... 14 Tahap 1 : Patogenitas ko-infeksi M. fortuitum dan A. hydrophila pada ikan gurame (O. gouramy) ……….. 26
Tahap 2 : Kajian Preparasi vaksin M. fortuitum dan A hydrophila... 34
xiii
Halaman 1. Perlakuan ko-infeksi LD50………... 15
2. Komponen perlakuan vaksin ………... 19 3. Perlakuan proteksi vaksin monovalen dan koktail M. fortuitum
dan A. hydrophila……… 20 4. Hasil uji kadar formalin sediaan vaksin koktail yang diinaktifasi
dengan neutral buffer formalin 3% ………... 35 5. Deteksi kadar residu formalin pada daging ikan gurame yang
divaksinasi dengan vaksin koktail dan monovalen inaktifasi dengan neutral buffer formalin 3% ………... 36 6. Berat protein sediaan vaksin monovalen sel utuh yang diin-
aktifasi dengan neutral buffer formalin 3% ………. 38 7. Karakter berat molekul protein hasil SDS page vaksin
monovalen A. hydrophila dan M. fortuitum serta gabungan keduanya yang diinaktifasi dengan neutral buffer formalin 3% . 40 8. Parameter hematologi dan respon imun efikasi vaksin
monova-len dan koktail setelah diuji tantang dengan A. hydrophila……. 57 9. Parameter hematologi dan respon imun efikasi vaksin
monovalen dan koktail setelah diuji tantang dengan M. fortuitum………. 58 10. Parameter hematologi dan respon imun efikasi vaksin
monovalen dan koktail setelah diuji tantang ko-infeksi dengan M. fortuitum dan A. hydrophila………... 58 11. Tingkat RPS ikan gurame yang divaksinasi dengan vaksin
xiv
Halaman 1. Alur pelaksanaan penelitian Vaksin koktail untuk pencegahan
penyakit Mycobacteriosis dan Motile Aeromonas Septicemia pada ikan Gurame (O. gouramy) ………... 15 5. Total neutrofil ikan gurame hasil ko-infeksi M. fortuitum (Mf)
dan A. hydrophila (Ah) ………... 29 6. Total monosit ikan gurame hasil ko-infeksi M. fortuitum (Mf)
dan A. hydrophila (Ah) ……….. 30 7. Kematian ikan gurame perlakuan ko-infeksi M. fortuitum (Mf)
dan A. hydrophila (Ah) ………... 31
gurame ko-infeksi M. fortuitum dan A. hydrophila………... 33 11. Fotomikrograf organ hati (A), ginjal (B) dan limpa (C) gurame
uji yang divaksinasi dengan vaksin monovalen dan koktail inaktifasi dengan neutral buffer formalin 3% ………... 37 12. SDS-PAGE sediaan vaksin monovalen dan koktail inaktifasi
neutral buffer formalin 3% ………... 38 13. Titer antibodi serum ikan gurame pascavaksinasi yang diuji
tantang dengan bakterin A. hydrophila……….. 42 14. Titer antibodi serum ikan gurame pascavaksinasi yang diuji
tantang dengan bakterin M. fortuitum………... 42 15. Titer antibodi serum ikan gurame pascavaksinasi yang diuji
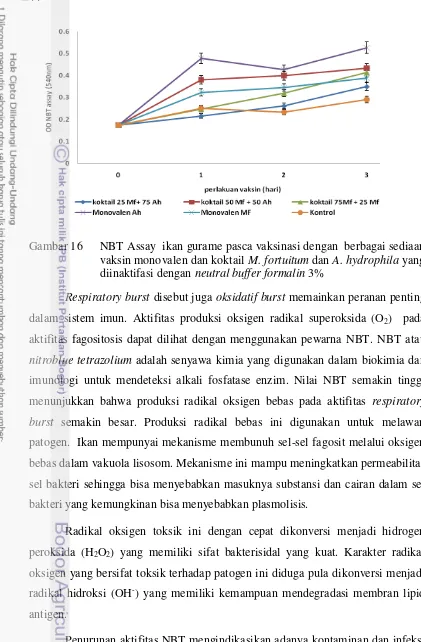
tantang dengan gabungan bakterin M. fortuitum dan A. hydrophila……….. 42 16. NBT Assay ikan gurame pasca vaksinasi dengan berbagai
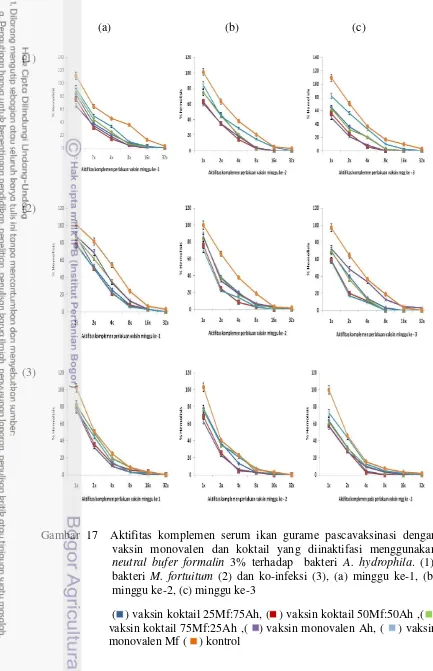
sediaan vaksin monovalen dan koktail M. fortuitum dan A. hydrophila yang diinaktifasi dengan neutral buffer formalin 3%.. 44 17. Aktifitas komplemen serum ikan gurame pascavaksinasi dengan
vaksin monovalen dan koktail yang diinaktifasi menggunakan neutral buffer formalin 3% terhadap bakteri A. hydrophila, M. fortuitum dan ko-infeksi………... 46 18. Kadar hemoglobin ikan gurame pasca vaksinasi dengan
berbagai sediaan vaksin ……… 48
19. Kadar hematokrit ikan gurame pasca vaksinasi dengan berbagai
xv
21. Indek fagositik ikan gurame pasca vaksinasi dengan berbagai
sediaan vaksin……… 51
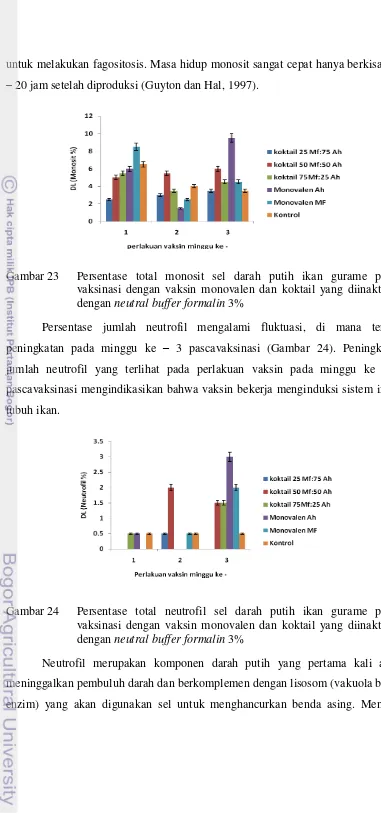
22. Persentase total limfosit sel darah putih ikan gurame pasca vaksinasi dengan vaksin monovalen dan koktail yang diinaktifasi dengan neutral buffer formalin 3%... 52 23. Persentase total monosit sel darah putih ikan gurame pasca
vaksinasi dengan vaksin monovalen dan koktail yang diinaktifasi dengan neutral buffer formalin 3%………... 53 24. Persentase total neutrofil sel darah putih ikan gurame pasca
vaksinasi dengan vaksin monovalen dan koktail yang diinaktifasi dengan neutral buffer formalin 3%……….... 53 25. Kematian kumulatif harian ikan gurame yang divaksinasi
dengan vaksin monovalen dan koktail yang diinaktifasi dengan neutral buffer formalin 3% setelah diuji tantang dengan bakteri A. hydrophila………... 54 26. Kematian kumulatif harian ikan gurame yang divaksinasi
dengan vaksin monovalen dan koktail yang diinaktifasi dengan neutral buffer formalin 3% setelah diuji tantang dengan bakteri M. fortuitum………... 55 27. Kematian kumulatif harian ikan gurame yang divaksinasi
xvi
Halaman
1. Fenotipik M. fortuitum………... 73
BAB I PENDAHULUAN 1.1 Latar belakang
Ikan gurame merupakan salah satu komoditas unggulan pada budidaya air tawar, sehingga banyak dibudidayakan oleh para pembudidaya saat ini. Menurut data FAO tahun 2010 produksi gurame sebesar 7,68% dari total produksi ikan air tawar. Data statistik perikanan budidaya tahun 2010 menunjukkan bahwa perkembangan ikan gurame sudah mencapai kehampir seluruh Indonesia. Sentra budidaya ikan gurame tidak lagi sebatas daerah pulau Jawa namun meluas hingga luar pulau Jawa.
Selain Jawa Barat yang dikenal sebagai provinsi utama penghasil gurame di Indonesia, diketahui juga ada beberapa provinsi lain penghasil ikan tersebut yaitu Sumatera Barat, Jawa Timur, Jawa Tengah, DI Yogyakarta, Lampung dan Sumatera Selatan bahkan juga mulai berkembang ke wilayah Indonesia Timur yaitu Bali, Sulawesi, Kalimantan, Nusa Tenggara dan Papua. Jawa Barat sebagai sentra budidaya ternyata setiap tahun rata-rata masih kekurangan sebelas ribu ton ikan gurame untuk kebutuhan konsumsi.
Demikian meluasnya penyebaran budidaya ikan gurame di Indonesia, sehingga diperlukan prosedur budidaya yang efektif, efisien dan aplikatif terutama jika dikaitkan dengan kendala penyakit yang seringkali menghambat budidaya. Vaksinasi sebagai salah satu solusi aplikatif menjadi sangat diperlukan dalam budidaya untuk mencegah terjadinya wabah dan penyebaran penyakit potensial pada perikanan budidaya.
Bogor (Purwaningsih et al. 2012 unpublished). Berdasarkan hasil uji identifikasi dan karakterisasi diperoleh dua jenis bakteri tersebut sebagai agen etiologinya.
Pada dasarnya A. hydrophila merupakan patogen oportunis sehingga sangat umum dijumpai di air dan memiliki beragam serotipe yang berbeda tingkatan virulensinya. Umumnya penyebaran terjadi secara horizontal lewat kontak langsung dengan air atau ikan yang sakit (Irianto, 2005). Penyakit biasanya timbul dalam tipe infeksi akut dengan kondisi klinis ditandai dengan munculnya peradangan yang sistemik dan mengakibatkan kematian dalam waktu 24 sampai 48 jam. Tipe infeksi kronis ditandai adanya kerusakan pada bagian sirip, lesi pada kulit, gerakan renang lemah dan menyebabkan kematian 10% sampai 70% dari total populasi di kolam budidaya (Ibrahem et al. 2008). Penyakit yang diakibatkan oleh infeksi A. hydrophila mulai yang bersifat akut hingga bersifat laten membentuk infeksi septisemia yang lebih dikenal dengan nama penyakit Hemorrhagic Septicaemia atau Aeromonas Septicemia (Ismail et al. 2010).
Penanggulangan penyakit MAS dan Mycobacteriosis akibat infeksi M. fortuitum dan A. hydrophila dengan metode vaksinasi monovalen telah banyak dilakukan. Bangkit (2011) menyatakan vaksin sediaan broth M. fortuitum yang diinaktifasi dengan formalin 1% (v/v) pada dosis 107 cfu mampu menginduksi respon kekebalan spesifik ikan gurame dengan nilai kelangsungan hidup relatif 80%. Gesti (2011) meneliti vaksin M. fortuitum sediaan Ekstracellular Produk (ECP) dengan dosis rendam 109 cfu mampu merangsang sistem imun ikan gurame dengan nilai kelangsungan hidup relatif sebesar 80.02% pasca uji tantang menggunakan bakteri M. fortuitum 106 cfu. Chen et al. (1998) juga menyatakan bahwa ikan nila yang divaksinasi dengan produk ECP M. fortuitum menunjukkan peningkatan jumlah nitroblue tetrazolium (NBT) dan aktivitas lisosim pada minggu ke 2 dan 6 pascavaksinasi. Ismail et al. (2010) telah meneliti vaksin A. hydrophila yang dibuat dalam bentuk sediaan sel utuh yang diinaktifasi menggunakan formalin untuk menghasilkan bakterin A. hydrophila. Vaksinasi ikan Lele (Clarias gariepinus) menggunakan sediaan vaksin sel utuh A. hydrophila isolat AHL0905-2 yang diinaktifasi menggunakan formalin (0,5% v/v) dan diaplikasikan melalui perendaman, menghasilkan relative percent survival (RPS) sebesar 98,75% dengan level titer antibodi log 2 pada nilai 4 setelah divaksinasi selama 21 hari (Sugiani et al. 2010).
Vaksinasi pada ikan merupakan upaya melindungi ikan terhadap infeksi berbagai patogen, dapat dilakukan dengan menggunakan vaksin monovalen atau koktail. Strategi vaksinasi harus mempertimbangkan penyakit spesifik apa yang menginfeksi, jenis vaksin, metoda vaksinasi, pemilihan waktu vaksinasi dan perlakuan vaksinasi ulang (booster). Vaksin koktail harus mampu melindungi dari semua serotipe dari tiap patogen penyebab penyakit tertentu, dengan memperhatikan kompetisi antigen spesifik yang mungkin terjadi terutama ketika vaksin diaplikasikan melalui injeksi (Toranzo et al. 2009).
kekebalan spesifik pada ikan gurame untuk mencegah penyakit Mycobacteriosis dan Motile Aeromonas Septicemia yang hingga saat ini masih sulit dikendalikan.
1.2 Tujuan Penelitian
Penelitian yang akan dilakukan bertujuan untuk :
1. Menganalisis patogenitas ko-infeksi bakteri M. fortuitum dan A. hydrophila pada ikan gurame.
2. Menganalisis sinergitas dan kompetensi kedua antigen dalam menginduksi imunitas pada ikan gurame.
3. Mengkaji efektifitas dan efikasi vaksin koktail dari bakterin M. fortuitum dan A. hydrophila dalam menghasilkan respons imun dan meningkatkan kelangsungan hidup pada ikan gurame.
1.3 Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan produk vaksin koktail M. fortuitum dan A. hydrophila untuk pencegahan wabah penyakit Mycobacteriosis dan MAS pada ikan gurame (Osphronemus gouramy).
1.4 Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut : 1. Bakteri M. fortuitum dan A. hydrophila memiliki perbedaan karakteristik
patogenisitas pada ikan gurame.
2. Bakteri M. fortuitum dan A. hydrophila memiliki sinergitas dan kompetensi dalam menginduksi imunitas pada ikan gurame.
BAB II
TINJAUAN PUSTAKA
Penyakit Mycobacteriosis
Mycobacteriosis atau fish tuberculosis merupakan penyakit bakterial yang bersifat kronis progresif yang disebabkan oleh bakteri Mycobacterium sp. Mycobacterium sp. adalah bakteri yang berbentuk batang, dengan ukuran 0.2-0.6x1.0-10 µm, bersifat tahan asam, tidak bergerak, tidak membentuk spora atau kapsul dan bersifat aerob. Bakteri ini banyak dijumpai di perairan tawar dan laut maupun tanah dengan suhu optimal pertumbuhannya 25-30oC. Tidak dapat tumbuh pada suhu 37oC kecuali M. marinum, M. fortuitum dan M. chelonei.
Ikan yang terinfeksi Mycobacterium sp. menunjukkan gejala bervariasi, namun sering pula tidak menunjukkan gejala klinis sama sekali (Kurnia 2010). Gejala klinis yang ditimbulkan oleh penyakit Mycobacteriosis antara lain ikan lemah, pembengkakan pada permukaan tubuh, mata menonjol (exopthalmia), lesi dan borok pada tubuh (Purwaningsih et al. 2009). Gejala klinis dapat dilihat ketika penyakit mulai akut setelah beberapa bulan sampai satu tahun, menginfeksi semua umur ikan dan semua jenis ikan baik ikan air tawar maupun ikan laut (Tappin 2007). M. fortuitum bersifat patogen karena memiliki faktor virulensi. Faktor virulensi dapat berupa material organik maupun bagian sel. Banyak bakteri patogen mampu menyerang seluruh bagian tubuh inang meskipun bakteri patogen tersebut hanya berkoloni di satu tempat saja. Hal itu karena bakteri mengeluarkan toksin (Purwoko 2007).
digunakan dalam jangka waktu lama akan berdampak negatif terhadap lingkungan dan saat ini penggunaan bahan-bahan tersebut sudah tidak direkomendasikan lagi.
Penyakit Motile Aeromonas Septicemia (MAS)
Menurut Kamiso et al. (1993) A. hydrophila merupakan salah satu bakteri patogen penyebab kematian pada ikan gurame. Gejala klinis dari ikan Gurame yang terinfeksi Motile Aeromonas Septicemia (MAS) ditandai dengan adanya septicemia, luka, cacat tulang, eksoptalmia dan nekrosis otot. Penelitian yang dilakukkan oleh Ibrahem et al. (2008) diperoleh hasil isolasi dan identifikasi jenis bakteri A. hydrophila dari bagian organ intestinal ikan yang sakit maupun ikan yang sudah sehat, hal ini dapat terjadi pada kondisi invasi penyakit ataupun kondisi MAS yang akut dengan adanya lokalisasi koloni bakteri A. hydrophila yang teridentifikasi dari jaringan hematopoetik. Pada kondisi posmortem ditemukan adanya luka fokal pada organ hati, limpa, dan ginjal serta terdapat cairan yang mengisi rongga abdominal.
Uji biokimia identifikasi terhadap Aeromonas hydrophila antara lain dengan reaksi voges-proskauer (VP), citrate utilization, lysine decarboxylase (LDC), arabinosa dan tes fermentasi amygadalin untuk melihat tingkat virulensi dari bakteri. Reaksi biokimia berkorelasi dengan tingkat virulensi. Variasi tingkat virulensi dari spesies penyebab Motile Aeromonas dapat dilihat dengan uji karakteristik biokimia dari bakteri A. hydrophila (Toranzo et al. 1986). Burke et al.(1983) mengemukakan hubungan yang signifikan antara tingkat virulensi A. hydrophila pada ikan dengan produksi asam dari arabinosa dan sukrosa, tes VP dan LDC, penambahan elastase dan aktifitas hemolitik.
hemolitik dan strain A. hydrophila non hemolitik. Ada suatu korelasi antara hemolisin dan virulensi isolat A. hydrophila. A. hydrophila mampu memproduksi hemolisin ekstraselular dengan membentuk zona hemolisis pada media agar darah. Terdapat korelasi yang kuat antara hasil dari uji biokimia, aktifitas enzimatik, aktifitas hemolitik dan tes patogenisitas dari isolat A. hydrophila dengan tingkat virulensinya. Sangat direkomendasikan untuk melakukan serangkaian uji tersebut untuk melihat tingkat virulensi dari isolat A. hydrophila (Ibrahem et al. 2008).
Bakteri Mycobacterium fortuitum
Najiah et al. (2011) menyatakan fenotipik bakteri M. fortuitum diketahui memiliki karakteristik yaitu tahan asam, memiliki panjang 3-6 µ, non photochromogenik, mampu tumbuh pada suhu 28 - 37°C, dapat tumbuh pada media Ogawa, Lowenstain Jenssen, Mac Conkey dengan kristal violet, Blood Agar, Tryptic Soy Agar, Briliant Heart Infusion Agar, Sauton Agar, Nutrient
Agar, Middlebrook 7H10, Baird Parker Agar, TCBs, EMB, NaCl 3 dan 5% ,mampu menghidrolisa tween, memiliki enzym arylsulfatase dan katalase, dapat mereduksi nitrat dan tellurite, mengurai amilum pada media acetat, suksinat, piruvat, glukosa, fruktosa, sukrosa, arabinose, trehalose, mannitol dan galaktosa, hal tersebut selengkapnya ditunjukkan pada Lampiran 1.
dimycocerosate), berperan memberikan dasar yang stabil untuk penyisipan lipid lain dan juga berperan sebagai pengubah fluiditas, yang fungsinya untuk memodulasi viskositas dinding sel (Takayama et al. 2005 ; Ronning et al. 2000; Briken et al. 2004).
Menurut Chen et al. (1997), bahwa Mycobacterium tuberculose memiliki aktivitas enzim mucinase, lipase, RNase, DNase tetapi tidak memiliki aktivitas protease. Aktivitas mucinase juga terdeteksi pada M. marinum sedangkan lipase dan RNase pada M. chelonei dan M. fortuitum. Aktivitas enzimatik tersebut dapat berperan sebagai faktor virulensi pada Mycobacterium.
Bakteri Aeromonas hydrophila
Noga (1997) mengemukakan bahwa isolat A. hydrophila merupakan bakteri gram negatif, berbentuk batang pendek berukuran 1-4 µm, oxidase-positif, mampu menfermentasi glukosa, mampu tumbuh dalam media agar Mac Conkey, bersifat motil dan koloni berbentuk bulat halus dengan diameter 2-3 mm, ukuran lebar sel 0.3-1 μm dan panjang sel 2-4.5 μm. Identifikasi juga dapat dilakukan menggunakan sistem tes kit API 20 NE. Media identifikasi selektif Rhimler-Shotts (media R-S) dibuat oleh Rhimler-Shotts dan Rhimler (1973) untuk mempermudah identifikasi jenis bakteri aeromonad yang akan membentuk koloni berwarna kuning pada media.
dan α-fukosidase.Aktifitas hemolitik ada yang bersifat ß –hemolitik, α- hemolitik, dan non-hemolitik (Ibrahem et al. 2008).
Menurut Rajeswari et al. (1999), Aeromonas merupakan mikroflora normal perairan, namun bakteri tersebut adalah patogen oportunistik pada berbagai golongan poikilotermal immunocompromised dan homeotermal. Infeksi A. hydrophila menyebabkan infeksi saluran pencernaan, luka dan infeksi sistemik. Faktor potensi virulensi bakteri tersebut termasuk endotoksin, hemolisin, sitotoksin dan protease. Sirirat et al. (1999) melaporkan bahwa protein yang berukuran 52 kDa adalah aerolisin yang merupakan protein permukaan S-layer dianggap sebagai salah satu faktor virulensi.
Imunologi Ikan
Pada mulanya ikan teleostei dianggap tidak memiliki suatu reaksi kekebalan, namun setelah ditemukan suatu reaksi kekebalan pada ikan salmon mengugurkan pendapat tersebut. Ikan seperti hewan pada umumnya, memiliki mekanisme pertahanan diri (sistem imun) terhadap patogen. Meskipun sistem imun belum selengkap pada vertebrata tingkat tinggi tetapi sistem imun ikan jauh lebih berkembang dibandingkan dengan sistem imun pada invertebrata. Respon imun dibentuk oleh organ limfoid, organ limfoid ikan letaknya menyatu dengan jaringan myeloid sehingga dikenal dengan jaringan limfomyeloid.
Sistem pertahanan spesifik tubuh ikan terbagi menjadi dua, yaitu pertahanan seluler (antibody production) dan pertahanan humoral (cell mediated immunity). Paparan antigen menghasilkan stimulasi sejumlah sel limfosit muda yang dapat mengenali antigen melalui reseptor spesifik. Pada awal kehidupannya, sistem pertahanan ikan yang mula-mula berfungsi adalah sistem pertahanan non-spesifik, sedangkan pertahanan spesifik pada ikan baru berkembang dan dapat berfungsi dengan baik sekitar umur beberapa minggu setelah telur menetas (Ellis. 1988).
kimiawi (mukus, kulit, sisik dan insang) dan pertahanan seluler (sel makrofag, leukosit seperti limfosit, monosit, neutrofil, eosinofil dan basofil). Mekanisme pertahanan tubuh yang sinergis antara pertahanan humoral dan seluler dimungkinkan oleh adanya interleukin, interferon dan sitokin, yang berperan sebagai komunikator dan amplikasi dalam mekanisme pertahanan humoral dan seluler ikan. Ellis (2001) mengemukakan bahwa respon dan faktor humoral terdiri dari serum amiloid protein,antibodi, lisosim, transferin, interferon, antiprotease, lektin, lisin, protease, protein C-reaktif, dan komplemen. Sedangkan respon dan faktor seluler antara lain adalah makrofag, killer cell, neutrofil, reaksi penolakan allograft dan hipersensitifitas.
Sistem kekebalan tubuh ikan terhadap antigen melalui mekanisme fagosit dengan perantara makrofag dan granular leukosit, sebagai contoh neutrofil menyerang mikroorganisme yang masuk melalui jaringan kulit ikan atau mukus. Selain itu ada lisosim dan komplemen lain yang merusak patogen. Komponen spesifik dalam sistem imun, terdiri dari humoral dan respon sel memori, walaupun memori imun pada ikan secara umum sangat kurang berkembang dibandingkan hewan tingkat tinggi lainnya. Tingkat induksi dan respons imun ikan sangat dipengaruhi oleh suhu perairan (Anderson, 1999).
Tanggap kebal adaptif dapat terbentuk pada kelompok teleostei seperti ikan dan dapat dideteksi dalam hitungan hari bahkan minggu (4-6 minggu) dari infeksi atau peradangan awal tergantung dari suhu lingkungan. Press & Evensen (1999) menyatakan bahwa tanggap kebal adaptif terdiri dari jaringan sel protein komplek, pengantar pesan biokimia (sitokin) dan gen yang bekerja sama untuk menghasilkan suatu induksi tanggap kebal spesifik yang memerlukan Abs (antibodi spesifik) dan Ags (antigen spesifik). Menurut Fujaya (2004) bahwa perolehan kekebalan aktif pada ikan tergantung pada peran serta jaringan dan sel – sel hospes setelah bertemu dengan imunogen.
Vaksinasi pada Ikan
Vaksinasi merupakan upaya untuk meningkatkan respon imun terhadap patogen tertentu yang berdasar pada dua elemen imunitas adaptif yaitu spesifitas dan memori. Antigen yang digunakan sebagai vaksin dapat berupa organisme hidup yang masih ganas atau sudah dilemahkan, organisme utuh yang dimatikan, fragmen subseluler dan antigen permukaaan sel, toksin yang diinaktifkan, rekombinan DNA dan anti – idiotipe.
Vaksin bakteri adalah antigen buatan yang berasal dari suatu jasad patogen yang tidak bersifat patogen lagi karena sudah dilemahkan atau dimatikan, yang akan merangsang sistem imun dengan cara meningkatkan kekebalan ikan dari infeksi patogen selanjutnya (Ellis. 1988). Umumnya ada dua tipe vaksin, yaitu vaksin mati (dead vaccine) dan vaksin hidup (live vaccine). Vaksin mati yang berupa organisme patogen yang dinonaktifkan (dimatikan) dengan cara pemanasan yaitu pada suhu 100oC (heat killed), formalin (formaline killed) dan penghancuran dengan menggunakan sonikator (sonic killed), sedangkan vaksin hidup yang berupa organisme patogen yang dilemahkan tanpa atau dengan mengurangi virulensinya (Ellis. 1988).
mempengaruhi level proteksi, efek samping dan biaya yang harus dikeluarkan untuk kegiatan vaksinasi. Pemberian vaksinasi melalui injeksi telah banyak digunakan pada skala industri dan kegiatan riset di laboratorium dengan hasil yang baik dan alur mekanisme pembentukan respons imunnya juga telah diketahui, akan tetapi pemberian vaksin melalui oral dan perendaman masih belum banyak diketahui alur penyerapan antigen dan presentasi antigen setelah diserap (Gudding et al. 1999).
Vaksin yang efektif harus memenuhi 3 syarat utama yaitu 1) mampu menginduksi imunitas yang tepat, 2) stabil dalam penyimpanan dan 3) bersifat imunogenik. Adanya perbedaan sifat antigenik yang beragam antara kelompok organisme yang komplek, maka diperlukan strategi penggunaan vaksinasi, baik dengan menggunakan monovalen dan vaksin koktail. Menurut Baba et al, (1988) bahwa vaksinasi dengan larutan antigen ekstraselular lebih efektif dalam memberikan perlindungan melawan serotipe yang heterolog dibandingkan dengan vaksin yang hanya terdiri dari satu jenis sel utuh dari antigen.
Formula vaksin ideal adalah sediaan vaksin koktail yang dapat memproteksi secara simultan terhadap beberapa patogen penting penyebab suatu penyakit dan efektif digunakan untuk spesies ikan yang luas. Vaksin koktail adalah sediaan vaksin yang terdiri dari dua atau lebih antigen yang berasal dari jenis atau strain yang berbeda. Formula vaksin koktail harus dibuat dengan teliti karena masalah kompetisi antigen dapat muncul terutama ketika vaksin tersebut diaplikasikan melalui injeksi (Toranzo et al. 2009).
BAB III
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Kesehatan Ikan Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT) Bogor, Laboratorium Mikrobiologi Departemen Ilmu Penyakit Hewan dan kesehatan Masyarakat Veteriner – Fakultas Kedokteran Hewan IPB, Laboratorium Terpadu – Fakultas Kedokteran Universitas Brawijaya dan Laboratorium Uji Balai Besar Pengolahan Produk Perikanan dan Bioteknologi (BBP3B) Jakarta. Penelitian dilakukan pada bulan Desember 2012 - Juni 2013.
Ikan Uji
Ikan uji menggunakan ikan Gurame (Osphronemus gouramy ) berukuran 25 - 30 g. Ikan yang digunakan harus memenuhi asumsi Spesifik Pathogen Free (SPF) bebas dari karakteristik yang akan muncul ketika terinfeksi penyakit Mycobacteriosis dan Motile Aeromonas Septicemia, melewati masa aklimatisasi selama 14 hari. Ikan uji yang digunakan dalam penelitian ini sebanyak 1.080 ekor, dengan rincian 150 ekor untuk uji tahap 1, 210 ekor untuk uji tahap 2 serta 720 ekor untuk uji tahap 3 dan 4.
Isolat Bakteri
Bakteri Mycobacterium fortuitum dan Aeromonas hydrophila menggunakan isolat koleksi BPPBAT Kementerian Kelautan dan Perikanan, Bogor. A. hydrophila diinokulasi dalam media Tryptic Soy Agar (TSA) menggunakan A. hydrophila isolat AHL0905-2 dan M. fortuitum diinokulasi dalam media Sauton Agar (SA) menggunakan M. fortuitum isolat 31.
Vaksin
sel utuh M. fortuitum (Purwaningsih et al. 2012) dan 3 sediaan vaksin koktail bakterin M. fortuitum dan A. hydrophila.
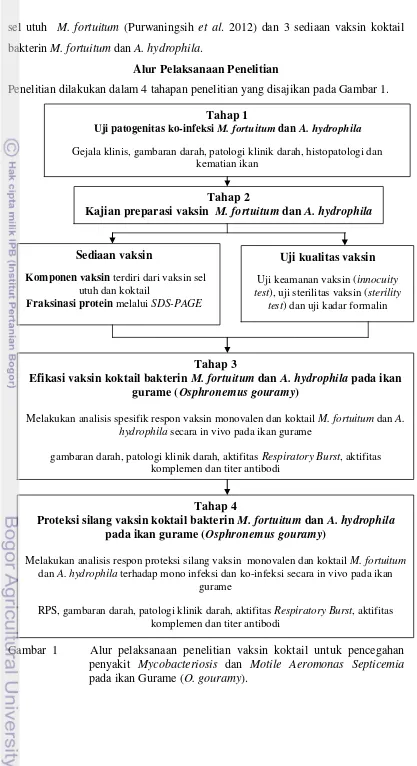
Alur Pelaksanaan Penelitian
Penelitian dilakukan dalam 4 tahapan penelitian yang disajikan pada Gambar 1.
Gambar 1 Alur pelaksanaan penelitian vaksin koktail untuk pencegahan penyakit Mycobacteriosis dan Motile Aeromonas Septicemia pada ikan Gurame (O. gouramy).
Tahap 2
Kajian preparasi vaksin M. fortuitum dan A. hydrophila
Sediaan vaksin
Komponen vaksin terdiri dari vaksin sel utuh dan koktail
Fraksinasi protein melalui SDS-PAGE
Uji kualitas vaksin
Uji keamanan vaksin (innocuity test), uji sterilitas vaksin (sterility
test) dan uji kadar formalin
Tahap 3
Efikasi vaksin koktail bakterin M. fortuitum dan A. hydrophila pada ikan gurame (Osphronemus gouramy)
Melakukan analisis spesifik respon vaksin monovalen dan koktail M. fortuitum dan A. hydrophila secara in vivo pada ikan gurame
gambaran darah, patologi klinik darah, aktifitas Respiratory Burst, aktifitas komplemen dan titer antibodi
Tahap 1
Uji patogenitas ko-infeksi M. fortuitum dan A. hydrophila
Gejala klinis, gambaran darah, patologi klinik darah, histopatologi dan kematian ikan
Tahap 4
Proteksi silang vaksin koktail bakterin M. fortuitum dan A. hydrophila pada ikan gurame (Osphronemus gouramy)
Melakukan analisis respon proteksi silang vaksin monovalen dan koktail M. fortuitum
dan A. hydrophila terhadap mono infeksi dan ko-infeksi secara in vivo pada ikan gurame
Tahap 1
Uji patogenitas ko-infeksi M. fortuitum dan A. hydrophila pada ikan gurame (O. gouramy)
Ko-infeksi adalah infeksi bersama dua atau lebih agen patogen yang dapat menyebabkan inang menjadi sakit. Uji patogenitas ko-infeksi M. fortuitum dan A. hydrophila pada ikan gurame dilakukan dengan menginjeksikan secara intraperitoneal yaitu M. fortuitum 107 cfu dan A. hydrophila 108 cfu. Infeksi A.
Perlakuan Tipe bakteri Perbandingan volume bakteri Kode 1
Kajian Preparasi vaksin M. fortuitum dan A. hydrophila
1. Preparasi sediaan vaksin
Vaksin yang akan dibuat pada penelitian ini adalah vaksin koktail yang berisi campuran dari sel utuh bakteri M. fortuitum dan A. hydrophila. Prosedur pembuatan vaksin yang akan dilakukan adalah sebagai berikut :
1.1 Sediaan vaksin sel utuh
Vaksin sel utuh bakteri M. fortuitum, dibuat dengan modifikasi metode Purwaningsih et al. (2012), bakteri M. fortuitum diinokulasi kedalam media Sauton broth diinkubasi di inkubator dengan shaker selama 72 jam pada suhu 37oC. Hasil kultur ditambahkan neutral buffer formalin 3%, kemudian dihomogenkan selama 24 jam. Hasil inaktifasi disentrifus pada 3000 g selama 30 menit, pelet sel bakteri dan supernatan dipisahkan, kemudian pelet diresuspensi dalam PBS pH 7,2 dengan rasio 1:10 (v/v).
Vaksin sel utuh A. hydrophila, dibuat dengan modifikasi metode Sugiani (2012). Bakteri A. hydrophila diinokulasi dalam media BHI, diinkubasi dalam inkubator dengan shaker selama 24 jam pada suhu 32oC. Kultur bakteri diinaktivasi dengan menambahkan neutral buffer formalin hingga konsentrasi akhir formalin menjadi 3% (v/v) selama 24 jam. Sel utuh bakteri Inaktif diperoleh dengan mensentrifus pada 3000 g selama 30 menit dan pelet (endapan) sel diresuspensi dengan PBS (pH 7,2) dengan rasio 1:10 (v/v).
Masing-masing suspensi M. fortuitum dan A. hydrophila dicuci sebanyak 3 kali dengan mensentrifus suspensi bakteri pada 10.000 g selama 10 menit pada suhu 4 oC, kemudian diresuspensi dengan PBS pH 7,2. Suspensi bakteri yang telah dicuci dikombinasikan dengan perbandingan tertentu (v/v) M. fortuitum : A. hydrophila untuk membentuk vaksin koktail.
2. Uji kualitas vaksin koktail
2.1 Uji keamanan vaksin (Innocuity test)
aman jika hasil dari reisolasi tidak diperoleh bakteri aktif yang sama dengan isolat vaksin.
2.2 Uji sterilitas vaksin (Sterility test)
Uji sterilisasi seperti yang dilakukan Aly (1981) dengan melakukan kultivasi sediaan vaksin dalam BHIA dan Sauton agar yang diinkubasi pada suhu 28°C selama 24 jam dan 37°C selama 72 jam untuk memastikan tidak ada bakteri yang tumbuh dari jenis A. hydrophila dan M. fortuitum yang sama seperti bakterin sediaan vaksin.
2.3 Uji kadar formalin vaksin
Uji kuantitatif untuk melihat residu kadar formalin yang terkandung dalam sediaan vaksin setelah inaktifasi dilakukan dengan menggunakan metode AOAC (1990). Tahapan analisis dapat dilihat pada Lampiran 2. Penyerapan warna dilihat dengan alat spektrofotometer pada absorban 415 nm.
Hasil analisis dimasukkan ke dalam rumus: Kadar formalin (ppm)
Keterangan :
Ca : Mikrogram formalin dari kurva W : berat contoh (gram)
F : faktor pengenceran
2.4 Analisa protein sel utuh menggunakan Sodium Dodecyl Sulphate– Polyacrylamide Gel Electrophoresis (SDS–PAGE)
Sel utuh disentrifus pada 16.000 g selama 30 menit pada suhu 4oC, dan supernatan dikumpulkan kemudian disimpan pada -80oC. Setiap isolat, berisi protein dalam 100 µL aliquot dipresipitasi menggunakan trichloroacetic acid / acetone dan diresuspensi pada volume yang sama dengan PBS, untuk menguji sterilitas dari protein dilakukan protein assays, di mana konsentrasi protein diuji menggunakan Micro BCA-Protein Assay (Pierce).
Whole-cell lysates dari setiap isolat dianalisa dengan SDS–PAGE (LaFrentz et al., 2004). Protein (25 μg) dipisahkan dalam 12% polyacrylamide gel menggunakan Mini-Protean Tetra Cell (Bio-Rad) dan kemudian diwarnai dengan Bio-Safe Coomassie (Bio-Rad). Precision Plus protein standards (Bio-Rad) digunakan untuk menghitung masa molekul dari pita protein. Gel kemudian di foto menggunakan Densitometer (Bio-Rad).
Tahap 3
Efikasi vaksin koktail bakterin M. fortuitum dan A. hydrophila pada ikan gurame (O. gouramy)
Pengujian vaksin koktail bakterin M. fortuitum dan A. hydrophila pada ikan gurame uji dilakukan mengunakan Rancangan Acak Lengkap (RAL) dengan komponen perlakuan sebagai berikut :
Tabel 2. Komponen perlakuan vaksin Perlakuan Komponen vaksin
Mf (Mycobacterium fortuitum), Ah (Aeromonas hydrophila), su (sel utuh), K (kontrol)
Tahap 4
Proteksi vaksin koktail bakterin M. fortuitum dan A. hydrophila pada ikan gurame (O. gouramy)
Kajian efektivitas vaksin koktail terhadap pengaruh mono infeksi dan ko-infeksi M. fortuitum dan A. hydrophila dilakukan pada hari ke – 21 pasca vaksinasi dengan menginjeksikan pada masing – masing perlakuan dengan mono infeksi M. fortuitum 107 cfu, A. hydrophila 108 cfu dan infeksi gabungan keduanya (Tabel 3).
Pengamatan terhadap uji tantang dengan monovalen A. hydrophila dilakukan selama 14 hari sedangkan uji tantang dengan monovalen M. fortuitum dan ko-infeksi diamati selama 28 hari. Parameter uji yang diukur dalam tahap ini antara lain titer antibodi, aktifitas respiratory burst, komplemen, aktifitas fagositosis, patologi klinik darah dan gambaran darah.
Tabel 3 Perlakuan proteksi vaksin monovalen dan koktail M. fortuitum dan A. hydrophila
Perlakuan Ulangan Komponen vaksin Komponen uji tantang 1
Parameter yang Diamati
Beberapa parameter uji yang diamati pada penelitian ini diantaranya adalah kematian ikan, gejala klinis dan gambaran sistem imun ikan.
Gejala klinis
Gejala klinis ikan diamati dengan melihat tingkah laku makan, berenang, respon terhadap kejutan dan perubahan anatomi bagian luar tubuh ikan maupun organ dalam ikan.
Hematologi dan gambaran sistem imun
Pengamatan hematologi dan gambaran sistem imun dilakukan dengan mengamati sampel darah yang diambil dari ikan perlakuan kemudian diukur kadar hemoglobin menurut metode Sahli (Wedenmeyer & Yasutake 1977). Kadar hematokrit menurut metode Anderson dan Siwicki (1995). Aktifitas fagositosis meliputi indek fagositik dan persen fagositosis dievaluasi menggunakan metode Zhang et al. (2008).
Produksi oksigen radikal dari fagositosis dalam darah dapat dilihat dengan pewarnaan nitroblue tetrazolium (NBT-Assay) seperti yang dilakukan Anderson dan Siwicki (1995). Aktifitas komplemen (Complement consumption assay) dilakukan menggunakan metode Vivas et al. (2005). Titer antibodi diukur dengan menggunakan aglutinasi langsung (direct aglutination) terhadap antigen-antibodi perlakuan.
1 Gambaran hematologi
Darah diambil secara intra muscular dari caudal vein ikan menggunakan spuit yang telah diberi heparin sebagai antikoagulan, darah disimpan pada suhu 15oC. kemudian diukur kadar hemoglobin menurut metode Sahli dengan salinometer (Wedenmeyer dan Yasutake 1977), kadar hematokrit menurut metode Anderson dan Siwicki (1993).
2 Indek fagositosis
diinkubasi selama 30 menit pada suhu 30 oC. Sebanyak 1 mL salin ditambahkan ke dalam tabung dan dihomogenkan. Solusi homogenat disentrifus dengan 3.000 g selama 5 menitl lalu 1 mL supernatan diambil kemudian dibuang dan sisa solusi dihomogenkan kembali. Diambil satu tetes homogenat, dibuat preparat ulas di atas slide glass. Preparat difiksasi dengan metanol selama 2-3 menit, kemudian dicuci dengan akuades, preparat dikeringanginkan, tahap akhir preparasi diwarnai dengan pewarna giemsa. Preparat diamati di bawah mikroskop. Persen Fagositosis (PF) dan Indek Fagositosis (IF) dihitung menggunakan rumus:
PF =(N1/100)x100 IF = N2/100 Keterangan :
N1 : total jumlah fagosit yang memakan (engulfing) bakteri secara acak dari 100 fagosit yang terhitung.
N2 : total jumlah bakteri yang dimakan oleh fagosit dari 100 fagosit yang terhitung.
3 Uji Respiratory burst (NBT-assay)
Produksi oksigen radikal dari fagositosis dalam darah dapat dilihat dengan pewarnaan nitroblue tetrazolium (NBT). Sebanyak 50µl sampel darah dengan heparin diletakkan pada sumur microplate well“U” diinkubasi selama 1 jam pada suhu 37ºC kemudian dicuci dengan PBS dan ditambahkan 50µl 0.2% NBT, suspensi NBT - sel darah diinkubasi selama 1 jam pada suhu 25°C. Setelah itu lakukan fiksasi dengan metanol 100% selama 2 – 3 menit dilanjutkan dengan metanol 30% sebanyak 3 kali. Kemudian dikeringanginkan, selanjutnya tambahkan 60 µl kalium hydroxide dan 70 µl larutan dimethylsulfoxide. Analisa produksi radikal oksigen dengan menggunakan NBT (nitroblue tetrazolium) dilakukan dengan menggunakan spektrofotometer dengan panjang gelombang 540 nm (Anderson and Siwicki, 1995).
4 Aktifitas komplemen
dengan PBS steril dalam 1,5 mL tabung Eppendorf. Sebanyak 200 µ L serum ikan dan 200 µ L suspensi bakteri M. fortuitum (108 cfu/mL) dicampurkan dengan PBS steril dalam 1,5 mL tabung Eppendorf. Sebanyak 200 µ L serum ikan dan 100 µL suspensi bakteri A. hydrophila dan 100 µ L suspensi bakteri M. fortuitum dicampurkan dengan PBS steril dalam 1,5 mL tabung eppendorf, untuk kontrol tabung eppendorf hanya diisi dengan PBS. Tabung diinkubasi selama 1,5 jam pada suhu 16 oC. Ditambahkan 400 µ L PBS ke dalam setiap tabung dan suspensi difilter menggunakan filter 0,22 µm.
Larutan hasil filtrasi dimasukkan ke dalam mikrotiter 25 µ L, ditambahkan secara serial (serial two-fold dilutions) 2% suspensi rabbit red blood cells (RaRBC) dalam PBS yang kemudian diinkubasi selama 1,5 jam pada 16 oC. Tahap selanjutnya ditambahkan 100 µ L 0,9% salin dingin (ice-cold), dan sel diendapkan dengan cara disentrifus (1.400 g, 5 menit, 4 oC). Absorban supernatan dilihat dengan 405 nm. 100% hemolisis diperoleh dengan menambahkan 25 µ L RaRBC dan 175 µL akuades sedangkan aktifitas lisis (spontaneous lysis) diperoleh dengan menambahkan 25 µL RaRBC dan 50 µ L PBS, setelah 1 jam diinkubasi ditambahkan 100 µ L 0,9% salin. Aktifitas komplemen dihitung dengan melihat hemolisis pada RaRBC, hasil dimasukkan dalam rumus berikut :
Percent haemolysis = {(A405(sampel) –A405(spontaneous lysis))/(A405 (100% haemolysis)- A405(spontaneous lysis)} x 100%
5 Titer Antibodi
dengan metode aglutinasi langsung melalui pengenceran serum darah sesuai dengan perlakuan. Jika dalam serum mengandung antibodi, maka ketika serum diberi antigen akan terjadi aglutinasi kompleks antigen-antibodi.
Uji titer antibodi menggunakan microplate well 96 berbentuk huruf „U‟. Serum ikan perlakuan vaksin sebagai antibodi dimasukkan ke dalam sumur no 1 (kontrol positif) dan sumur no 2 masing-masing 30 µ L, kemudian dilakukan pengenceran seri (serially two-fold diluted) dalam PBS 30 µ L (pH 7,2) sampai sumur ke – 11, pada sumur ke-12 hanya diisi PBS (kontrol negatif). Pengujian kelompok pertama dengan menambahkan antigen ke dalam sumur ke-1 sampai sumur ke – 12 sebanyak 30 µ L bakteri homolog A. hydrophila. Kelompok kedua, menambahkan ke dalam sumur ke-1 sampai sumur ke – 12 sebanyak 30 µ L bakteri homolog M. fortuitum. Kelompok terakhir, menambahkan ke dalam sumur ke – 1 sampai sumur ke – 12 sebanyak 15 µL bakteri A. hydrophila +15 µ L bakteri M. fortuitum. Microplate well “U” yang berisi antibodi dan antigen kemudian diinkubasi 24 pada suhu ruang dan titer aglutinasinya dihitung. Nilai titer dimasukkan dalam hitungan log 2.
Histopatologi
Pengamatan gambaran histopatologi dilakukan untuk mengetahui efek patologis dari penyakit Mycobacteriosis (infeksi M. fortuitum) MAS dan (infeksi A. hydrophila) terhadap ikan gurame.
Relative Percent Survival (RPS)
Analisis Data
BAB IV
HASIL DAN PEMBAHASAN Tahap 1
Patogenitas ko-infeksi M. fortuitum dan A. hydrophila pada ikan gurame (O. gouramy)
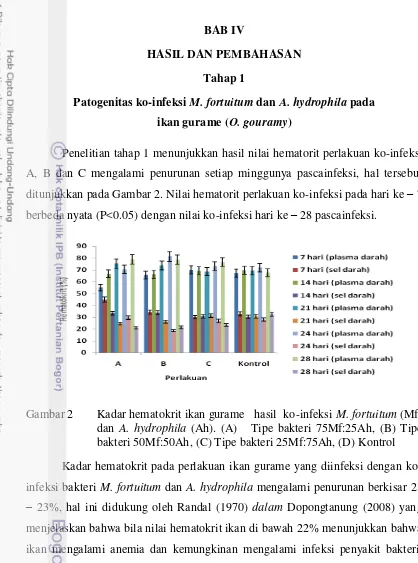
Penelitian tahap 1 menunjukkan hasil nilai hematorit perlakuan ko-infeksi A, B dan C mengalami penurunan setiap minggunya pascainfeksi, hal tersebut ditunjukkan pada Gambar 2. Nilai hematorit perlakuan ko-infeksi pada hari ke – 7 berbeda nyata (P<0.05) dengan nilai ko-infeksi hari ke – 28 pascainfeksi.
Gambar 2 Kadar hematokrit ikan gurame hasil ko-infeksi M. fortuitum (Mf) dan A. hydrophila (Ah). (A) Tipe bakteri 75Mf:25Ah, (B) Tipe bakteri 50Mf:50Ah, (C) Tipe bakteri 25Mf:75Ah, (D) Kontrol Kadar hematokrit pada perlakuan ikan gurame yang diinfeksi dengan ko-infeksi bakteri M. fortuitum dan A. hydrophila mengalami penurunan berkisar 21
Rata – rata kadar hemoglobin pada perlakuan ikan gurame yang diinfeksi dengan ko-infeksi M. fortuitum dan A. hydrophila mengalami penurunan dengan nilai berkisar 3 – 4 g 100 mL-1 dibanding kelompok kontrol (Gambar 3). Kadar hemoglobin pada perlakuan A, B dan C mengalami penurunan 1 minggu pascainfeksi dan mulai meningkat kembali pada minggu ke – 2 dan ke – 3 pascainfeksi hal ini diduga disebabkan tubuh mulai berespon adaptif terhadap invasi patogen yang masuk ke dalam tubuh, namun kadar hemoglobin kembali menurun pada minggu ke – 4 pascainfeksi setelah diinfeksi dengan A. hydrophila.
Gambar 3 Kadar hemoglobin ikan gurame hasil ko-infeksi M. fortuitum (Mf) dan A. hydrophila (Ah). (A) Tipe bakteri 75Mf:25Ah, (B) Tipe bakteri 50Mf:50Ah, (C) Tipe bakteri 25Mf:75Ah, (D) Kontrol Menurunnya nilai hemoglobin dalam darah berkaitan dengan rendahnya nilai eritrosit yang diduga karena darah ikan mengalami lisis. Lisis disebabkan oleh pecahnya eritrosit karena adanya toksin bakteri di dalam darah yang disebut haemolisin. Toksin ini akan melisis hemoglobin dan melepaskan hemoglobin. Kadar hemoglobin yang rendah dapat menjadi salah satu indikasi pada ikan atas terjadinya infeksi dalam hal ini yang disebabkan bakteri (Lucky. 1977).
Hasil perlakuan ko-infeksi pada ikan gurame dengan komposisi bakteri M. fortuitum dan A. hydrophila yang berbeda menunjukkan penurunan persentase jumlah limfosit dan sebaliknya terjadi peningkatan persentase jumlah monosit dan neutrofil. Persentase limfosit perlakuan A, B dan C pada minggu ke – 3 dan ke – 4 pascainfeksi berbeda nyata (P<0.05) dengan D (kontrol). Proporsi limfosit mengalami penurunan setiap minggunya setelah infeksi, di mana penurunan yang tajam terjadi pada minggu ke – 3 pascainfeksi M. fortuitum dan minggu ke – 4 pascainfeksi A. hydrophila, hal ini dapat dilihat pada Gambar 4.
Gambar 4 Total limfosit ikan gurame hasil ko-infeksi M. fortuitum (Mf) dan A. hydrophila (Ah).(A) Tipe bakteri 75Mf:25Ah, (B) Tipe bakteri 50Mf:50Ah, (C) Tipe bakteri 25Mf:75Ah, (D) Kontrol
Respon imun alamiah ikan terhadap serangan infeksi bakteri akan terbentuk dengan melibatkan peran sel darah putih (leukosit) sebagai barier pertahanan tubuh. Komponen sel darah putih terdiri dari limfosit, monosit, neutrofil, eosinofil dan basofil. Respon imun alami akan bertahan dan berfungsi dengan baik dalam waktu beberapa hari sampai minggu setelah invasi bakteri ke dalam tubuh.
Gambar 5 Total neutrofil ikan gurame hasil ko-infeksi M. fortuitum (Mf) dan A.hydrophila (Ah).(A) Tipe bakteri 75Mf:25Ah, (B) Tipe bakteri 50Mf:50Ah, (C) Tipe bakteri 25Mf:75Ah, (D) Kontrol
Neutrofil dan monosit merupakan fagosit kuat yang akan mengeliminasi patogen yang masuk ke dalam jaringan tubuh. Fulton et al. (2002) menyatakan bahwa komponen lipoarabinomannan yang merupakan komponen dinding sel bakteri akan mengaktifasi sel granulosit darah sebagai respon imun awal terhadap infeksi Mycobacterium. Infeksi A. hydrophila menyebabkan septisemia yang ditandai dengan terjadinya pendarahan pada organ ginjal dan limfa sehingga sel granulosit keluar dari pembuluh darah bergerak aktif ke daerah yang mengalami radang untuk memfagosit patogen yang masuk sehingga hal ini menyebabkan proporsi jumlah sel granulosit yaitu neutrofil di dalam darah cenderung menurun.
Persentase jumlah monosit pada perlakuan ko-infeksi dengan perbandingan bakteri M. fortuitum dan A. hydrophila yang berbeda mengalami peningkatan yang signifikan pada minggu ke – 3 dan ke – 4 pascainfeksi. Proporsi monosit pada perlakuan A, B dan C berbeda nyata (P<0.05) terhadap D (kontrol) (Gambar 6).
fortuitum, tubuh kembali diinfeksi dengan A. hydrophila yang akhirnya menyebabkan monosit meningkat kembali karena tubuh harus mengeliminasi dua agen patogen pada saat yang bersamaan. Monosit adalah perkusor dari makrofag yang berasal dari jaringan limfoid ikan, meninggalkan sirkulasi dan memulai tugas fagosit di jaringan untuk menghadang invasi patogen.
Gambar 6 Total monosit ikan gurame hasil ko-infeksi M. fortuitum (Mf) dan A. hydrophila (Ah).(A) Tipe bakteri 75Mf:25Ah, (B) Tipe bakteri 50Mf:50Ah, (C) Tipe bakteri 25Mf:75Ah, (D) Kontrol
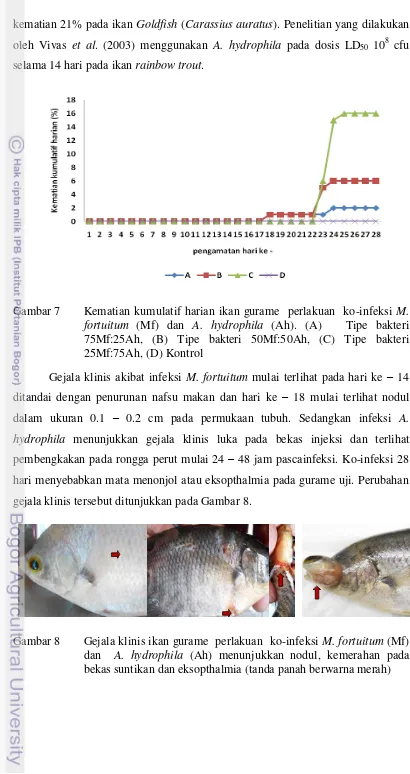
Kematian akibat infeksi M. fortuitum terjadi mulai hari ke – 18 pascainfeksi, sedangkan kematian akibat infeksi akut A. hydrophila dan M. fortuitum terjadi pada hari ke 23 – 25 pascainfeksi, hal tersebut dapat dilihat pada Gambar 7. Pola kematian akibat ko-infeksi bakteri M. fortuitum dan A. hydrophila merupakan hasil gabungan karakter dari kedua jenis bakteri tersebut. Infeksi kronis terjadi selama 28 hari masa pengamatan dan infeksi akut terjadi setelah 48 jam pascainjeksi dengan A. hydrophila. Jumlah ikan yang mengalami kematian setiap perlakuan berbeda – beda, hal ini terkait dengan perbedaan tingkat virulensi dari komposisi bakteri ko-infeksi yang berbeda. Pengujian ko-infeksi pada ikan gurame menggunakan M. fortuitum 107 cfu dan A. hydrophila 108 cfu.
kematian 21% pada ikan Goldfish (Carassius auratus). Penelitian yang dilakukan oleh Vivas et al. (2003) menggunakan A. hydrophila pada dosis LD50 108 cfu selama 14 hari pada ikan rainbow trout.
Gambar 7 Kematian kumulatif harian ikan gurame perlakuan ko-infeksi M. fortuitum (Mf) dan A. hydrophila (Ah). (A) Tipe bakteri 75Mf:25Ah, (B) Tipe bakteri 50Mf:50Ah, (C) Tipe bakteri 25Mf:75Ah, (D) Kontrol
Gejala klinis akibat infeksi M. fortuitum mulai terlihat pada hari ke – 14 ditandai dengan penurunan nafsu makan dan hari ke – 18 mulai terlihat nodul dalam ukuran 0.1 – 0.2 cm pada permukaan tubuh. Sedangkan infeksi A. hydrophila menunjukkan gejala klinis luka pada bekas injeksi dan terlihat pembengkakan pada rongga perut mulai 24 – 48 jam pascainfeksi. Ko-infeksi 28 hari menyebabkan mata menonjol atau eksopthalmia pada gurame uji. Perubahan gejala klinis tersebut ditunjukkan pada Gambar 8.
Patologi anatomi menunjukkan granuloma pada hati dan limpa mulai terbentuk pada hari ke – 21 pascainfeksi bakteri M. fortuitum (Gambar 9). Asites dalam rongga perut dan pendarahan pada organ ginjal dan limpa pada ko-infeksi terjadi mulai 24 – 48 jam post infeksi A. hydrophila. Perubahan histopatologi hari ke – 28 pascainfeksi menunjukkan tingkat kerusakan yang signifikan dibanding 21 hari pascainfeksi, hal ini disebabkan dua agen patogen yaitu M. fortuitum dan A. hydrophila telah bersinergis bersama – sama menimbulkan kerusakan jaringan Menurut Talaat et al. (1999) infeksi M. fortuitum 108 cfu pada ikan Goldfish menyebabkan lesi granulomatous pada berbagai organ internal yaitu peritoneum, pankreas, hati, limpa dan ginjal.
Gambar 9 Patologi anatomi ikan gurame perlakuan ko-infeksi M. fortuitum (Mf) dan A. hydrophila (Ah) menunjukkan granuloma pada berbagai organ internal. A. 21 hari infeksi ; B. 28 hari ko-infeksi
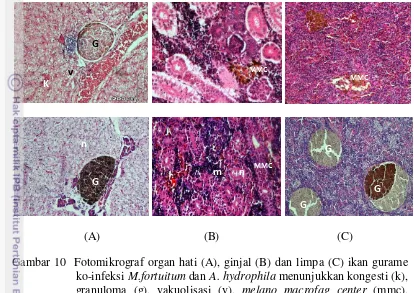
Perubahan histopatologi hasil ko-infeksi 21 hari dan 28 hari pascainfeksi menunjukkan kongesti, granuloma multifokal pada hati dan limpa, nekrosis pada sel hati dan sel ginjal, melano macrofag center (MMC) pada limpa dan ginjal serta peradangan dan hemorhagik juga ditemukan pada organ ginjal, hal tersebut dapat dilihat pada Gambar 10.
Mikobakteria kaya akan lipid, mencakup asam mikolat (asam lemak rantai panjang C78 – C90), lilin dan fosfatida. Dalam sel, lipid sebagian besar terikat pada protein dan polisakarida (Jewetz et al. 1996). Granuloma merupakan kerusakan jaringan yang terjadi akibat dipeptida muramil yang merupakan salah satu jenis protein yang dimiliki oleh jaringan terikat kompleks dengan asam mikolat yang dihasilkan oleh bakteri Mycobacterium spp. Granuloma terlihat sebagai kumpulan sel – sel epiteloid yang berasal dari histiosit. Nekrosis
ditemukan di daerah sentral granuloma. Di dalam granuloma juga ditemukan jaringan ikat fibrosit dan sejumlah limfosit.
(A) (B) (C)
Gambar 10 Fotomikrograf organ hati (A), ginjal (B) dan limpa (C) ikan gurame ko-infeksi M.fortuitum dan A. hydrophila menunjukkan kongesti (k), granuloma (g), vakuolisasi (v), melano macrofag center (mmc), hemorrhagic (h), inflamasi (m), necrosis (n), (Perbesaran 100 – 200x, Pewarnaan Hematoxylin-Eosin). Atas (hasil ko-infeksi 21 hari pascainfeksi, Bawah (hasil ko-infeksi 28 hari pascainfeksi)
Melano macrofag center (MMC) adalah agregat makrofag merupakan kumpulan sel yang mengandung pigmen pada jaringan. MMC ditemukan pada organ ginjal dan limpa ikan gurame perlakuan ko-infeksi. Melanomakrofag atau endapan coklat akibat ko-infeksi M. fortuitum dan A. hydrophila pada ikan gurame terjadi
karena adanya eksudasi kuman di jaringan. Infiltrasi sel radang yang ditemukan pada jaringan organ ikan gurame ko-infeksi mengindikasikan terjadinya peradangan pada jaringan tersebut. Toksin yang dihasilkan oleh bakteri M. fortuitum dan A. hydrophila menstimulasi bekerjanya respon imun non spesifik ikan gurame, hal ini ditandai dengan aktifitas sel granulosit yang keluar dari pembuluh darah bergerak aktif ke daerah yang mengalami kerusakan serta makrofag untuk mengeliminasi invasi patogen. Proses keradangan secara normal akan diikuti oleh peningkatan jumlah sel limfosit, makrofag maupun neutrofil. Menurut Darwis et al. (2000) infeksi menyebabkan peradangan pada tubulus maupun glomerulus
ginjal yang dapat melanjut menjadi nekrosis multifokal dan mempengaruhi proses metabolisme tubuh.
Alagappan et al. (2009) menyatakan bahwa infeksi A. hydrophila menyebabkan melano macrofag center (MMC) pada ginjal dan limfa serta kerusakan sel dan nekrosis pada hati dan ginjal, hal yang sama juga terjadi pada perlakuan infeksi 28 hari pascainfeksi. Kerusakan yang terjadi akibat ko-infeksi pada ikan gurame perlakuan disebabkan adanya toksin mematikan dari produk ekstraseluler yang bersifat virulen yang dihasilkan kedua bakteri tersebut.
Infeksi M. fortuitum dan A. hydrophila pada ikan gurame secara mikroskopik menyebabkan kongesti pada hati dan ginjal. Kongesti merupakan keadaan yang menunjukkan peningkatan volume darah karena pelebaran pembuluh darah kecil (Robbins dan Kumar. 1995). Menurut Smith and Jones (1961) kongesti terjadi akibat reaksi keradangan dan kerusakan bagian organ. Kongesti merupakan proses pasif yang disebabkan oleh menurunnya aliran darah vena. Kongesti akan menunjukkan perubahan warna merah, tergantung derajat oksigenasi darah. Kongesti juga merupakan gejala patologis pertama dari kerusakan jaringan dan terjadi peningkatan jumlah darah di dalam pembuluh darah sehingga akan tampak kapiler darah melebar dan sinusoid-sinusoid di hati terisi banyak eritrosit (Thomson. 1978). Kongesti dapat dikaitkan dengan aktifitas multiplikasi bakteri dan endotoksin atau eksotoksin dihasilkan oleh bakteri gram negatif (Brook et al. 1989).
Tahap 2
Kajian Preparasi vaksin M. fortuitum dan A. hydrophila