PENENTUAN AKTIVITAS DAN STABILITAS SUPEROKSIDA
DISMUTASE DARI SEL
Escherichia coli
MENGGUNAKAN
ZEOLIT BAYAH SEBAGAI BIOSENSOR ANTIOKSIDAN
DINIE DIANITA BAKRI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Penentuan Aktivitas
dan Stabilitas Superoksida Dismutase dari sel Escherichia coli menggunakan
Zeolit Bayah sebagai Biosensor Antioksidan adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Dinie Dianita Bakri
v
ABSTRAK
DINIE DIANITA BAKRI. Penentuan Aktivitas dan Stabilitas Superoksida
Dismutase dari Sel Escherichia coli menggunakan Zeolit Bayah sebagai
Biosensor Antioksidan. Dibimbing oleh DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan DEDEN SAPRUDIN.
Biosensor antioksidan merupakan inovasi dalam mengukur aktivitas dan kapasitas antioksidan yang lebih mudah, ketepatan hasil yang tinggi, dan
memanfaatkan makhluk hidup. Bakteri Escherichia coli diketahui menghasilkan
suatu enzim bernama SOD (superoksida dismutase) yang dapat dijadikan sebagai sensor senyawa antioksidan. Kondisi optimum aktivitas antioksidan yang
diperoleh berdasarkan response optimizer adalah suhu 30 oC, pH 9, dan zeolit 150
mg untuk sel bakteri utuh E. coli dan suhu 40 oC, pH 9, dan zeolit 150 mg untuk
ekstrak E. coli. Nilai KM app dan Vmaks app SOD dari sel bakteri utuh E. coli
ditentukan dengan metode Hones-Wolf. Nilai KM app sebesar 0.2691 mM dan Vmaks
app sebesar 1.1806 µA. Stabilitas biosensor antioksidan sel bakteri utuh yang
diperoleh hanya berkisar 2-4 jam dengan aktivitas antioksidan sebesar 56.35%.
Kata kunci: biosensor antioksidan, E. coli, superoksida dismutase.
ABSTRACT
DINIE DIANITA BAKRI. Superoxide Dismutase Activity and Stability from
Escherichia coli cell on Bayah Zeolites as Antioxidant Biosensor. Supervised by DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, and DEDEN SAPRUDIN.
Biosensor is an innovation in measuring antioxidant activity and antioxidant
capacity that is easier, higher accuracy, by utilizing living things. Escherichia coli
has been known to produce SOD (superoxide dismutase), which can be a good antioxidant sensor. The optimum conditions for antioxidant activity obtained by
response optimizer were 30 oC, pH 9, and 150 mg zeolites for E. coli whole cells
and 40 oC, pH 9, and 150 mg zeolites for the E. coli extract. KM app and Vmaks app
values of the SOD from E. coli cells were determined by Hones-Wolf method.
The KMapp and Vmaks app values were 0.2691 mM and 1.1806 µA, respectively.
Stability of antioxidants biosensor using bacterial cells was relatively stable between 2 and 4 hours, and the antioxidant activity was only 56.35%.
vii
PENENTUAN AKTIVITAS DAN STABILITAS SUPEROKSIDA
DISMUTASE DARI SEL
Escherichia coli
MENGGUNAKAN
ZEOLIT BAYAH SEBAGAI BIOSENSOR ANTIOKSIDAN
DINIE DIANITA BAKRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
ix
Judul : Penentuan Aktivitas dan Stabilitas Superoksida Dismutase dari Sel Escherichia coli Menggunakan Zeolit Bayah sebagai Biosensor Antioksidan
Nama : Dinie Dianita Bakri NIM : G44080049
Disetujui oleh
Prof Dr Dyah Iswantini Pradono, MSc Agr Pembimbing I
Dr Novik Nurhidayat Dr Deden Saprudin, MS
Pembimbing II Pembimbing III
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
xi
PRAKATA
Puji dan syukur kehadirat Allah SWT atas hidayah dan anugerah-Nya
sehingga penulis dapat menyelesaikan skripsi berjudul “Penentuan Aktivitas dan
Stabilitas Superoksida Dismutase dari Sel Escherichia coli menggunakan Zeolit
Bayah sebagai Biosensor Antioksidan”. Penelitian dilaksanakan dari bulan Juli
2012 – Februari 2013 di Laboratorium Genetika Mikrobiologi LIPI Cibinong,
Laboratorium Bersama IPB, dan Laboratorium Kimia Fisik IPB.
Penulis mengucapkan terima kasih kepada Prof Dyah Iswantini Pradono MSc Agr selaku pembimbing pertama, Dr Novik Nurhidayat selaku pembimbing kedua, dan Dr Deden Saprudin MS selaku pembimbing ketiga yang telah memberikan ilmu, bimbingan, dan saran selama penyusunan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Pak Acun, Pak Mail, Mas Eko, Pak Wawan, Mbak Ratih, dan Bu Ai yang telah membimbing selama penelitian berlangsung. Kepada Liyonawati, Okik Widyatmoko, Lukman La Gia, dan Kak Yuanita Eka selaku teman seperjuangan dalam penelitian biosensor.
Tak lupa untuk Papa, Mama, Kak Raisa Baharuddin, Wenny Oktalisa, Fauziah Husnu, Hafizhia Dhikrul, Abang Citra Yanto, Kak Felicia Nanda, teman-teman Kimia Angkatan 45 dan teman-teman-teman-teman karate yang juga telah memberikan doa dan semangat untuk menyelesaikan karya ilmiah ini.
Semoga karya ilmiah ini dapat bermanfaat dan ilmu yang tertulis bisa menjadi berkah bagi semuanya. Terima kasih.
Bogor, Juli 2013
Dinie Dianita Bakri
xiii
Escherichia coli dan Superoksida Dismutase 4
Zeolit Bayah 5
BAHAN DAN METODE 6
Alat dan Bahan 6
Aktivasi Zeolit 6
Pembuatan Elektrode Pasta Karbon dengan Mediator Ferosena 6
Pengukuran Arus Elektrode Pasta Karbon 7
Penumbuhan Sel Bakteri E. coli dan Ekstraksi Sel E. coli 7
Optimasi Aktivitas Antioksidan Sel E. coli dan Ekstrak kasar E. coli 7
Pengukuran Aktivitas Antioksidan Sel E. coli 8
Penentuan Stabilitas Biosensor Antioksidan Sel Bakteri E. coli 8
HASIL DAN PEMBAHASAN 8
Penumbuhan Sel E. coli dan Ekstraksi Sel E. coli 8
Arus Elektroda Pasta Karbon
Optimasi Aktivitas Antioksidan Sel E. coli
Aktivitas Antioksidan Sel E. coli
Stabilitas Biosensor Antioksidan Sel Bakteri E. coli
9 10 13 15
SIMPULAN DAN SARAN 17
DAFTAR PUSTAKA 17
LAMPIRAN 21
xiv
DAFTAR GAMBAR
1 Skema alat biosensor antioksidan 3
2 Mekanisme pengukuran biosensor antioksidan 3
3 Morfologi Escherichia coli 4
4 Struktur zeolit jenis klipnotilolit 5
5 Voltamogram siklik arus elektroda pasta karbon 9
6 Voltamogram siklik sel bakteri dengan penambahan zeolit 11
7 Kontur sel bakteri dengan penambahan zeolit 12
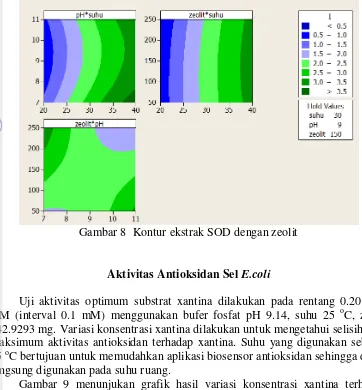
8 Kontur ekstrak SOD dengan zeolit 13
9 Hubungan konsentrasi xantina dengan aktivitas antioksidan sel E. coli
dengan zeolit 14
10 Rentang linier antara xantina dengan aktivitas antioksidan sel E. coli dengan
zeolit 14
11 Alur Hanes – Woolf sel bakteri E. coli dengan zeolit 15
12 Kurva stabilitas biosensor antioksidan berbabasil sel bakteri E. coli dengan
penambahan zeolit 16
DAFTAR LAMPIRAN
1 Bagan alir penelitian 21
2 Kombinasi faktor-faktor peubah bebas bakteri E. coli dengan penambahan
zeolit 22
3 Hasil optimasi bakteri E. coli dengan penambahan zeolit 23
4 Kombinasi faktor peubah bebas ekstrak kasar SOD E. coli dengan
penambahan zeolit 24
5 Hasil optimasi ekstrak kasar SOD E. coli dengan penambahan zeolit 25
6 Hasil pengukuran optimasi substrat xantina 26
7 Analisa kinetika dasar optimasi E. coli dengan metode Hones-Woolf 27
1
PENDAHULUAN
Antioksidan adalah senyawa yang dapat memperlambat atau mencegah proses oksidasi bila bereaksi dengan radikal bebas (Hudson 1990). Antioksidan juga berfungsi sebagai pencegah munculnya radikal bebas yang dapat mengganggu kesehatan tubuh. Tubuh mempunyai mekanisme antioksidan atau
antiradikal bebas secara endogenik (Dyatmiko et al. 2000). Namun, antioksidan
endogen tidak dapat mengatasi jumlah radikal bebas berlebih di dalam tubuh. Oleh karena itu, penambahan antioksidan eksogen berupa asupan sayur dan buah-buahan sangat diperlukan untuk menangkal radikal bebas. Saat ini, senyawa antioksidan juga dapat diaplikasikan pada produk kecantikan dan pengawet
makanan antara lain vitamin E, vitamin C, dan karotenoid (Bjelakovic et al.
2007). Adanya perkembangan teknologi menyebabkan metode konvensional untuk pengukuran antioksidan semakin ditinggalkan dan beralih ke metode yang lebih praktis salah satunya, yaitu biosensor.
Biosensor antioksidan merupakan salah satu inovasi baru dalam mengukur aktivitas dan kapasitas antioksidan yang lebih mudah, ketepatan hasil yang tinggi, dengan memanfaatkan makhluk hidup sebagai komponen pengenal hayati. Biosensor merupakan metode penentuan kapasitas antioksidan yang tidak dipengaruhi oleh cahaya dan diukur berdasarkan arus yang dihasilkan, salah satunya adalah biosensor elektrokimia. Keunggulan biosensor antara lain lebih sensitif dan sampel yang dibutuhkan sedikit sehingga dapat mendeteksi aktivitas biosensor dengan baik serta dapat menentukan jumlah enzim yang dihasilkan oleh
sel mikroba (Ikeda et al. 1998 dan 2000). Penelitian menggunakan biosensor telah
banyak dilakukan, antara lain pengembangan sensor kolin dengan imobilisasi
kolin oksidase ke lapisan nanoporus (Langer et al. 2004), pengukuran hibridasi
DNA berdasarkan interaksi nanokomposit PANI (Wu et al. 2005), pengukuran
aktivitas penangkapan radikal bebas berbasis sitokrom c (Cortina-Puig et al.
2007), dan biosensor glukosa menggunakan mikroba asal Indonesia sebagai
komponen pengenal hayati (Iswantini et al. 2011).
Biosensor antioksidan menggunakan enzim murni memiliki kekurangan, yaitu biaya yang mahal dan kestabilan enzim yang rendah. Kekurangan tersebut dapat diatasi dengan penggunaan mikroba yang menghasilkan enzim sebagai sensor. Sensor menggunakan mikroba memiliki keunggulan, yaitu sensor mikroba lebih tahan lama dan biaya lebih murah karena tidak memerlukan pengisolasian dan pemurnian enzim aktif. Selain itu, penggunaan sel bakteri dapat lebih mudah diperoleh melalui perkembangbiakan dan enzim yang terkandung dalam sel
bakteri lebih banyak dan lebih terbarudibandingkan dengan enzim murni.
Salah satu modifikasi yang dilakukan dalam penelitian biosensor, yaitu penambahan matrik imobilisasi yang bertujuan untuk meningkatkan stabilitas dan efisiensi enzim. Matriks imobilisasi yang sering digunakan antara lain biopolimer seperti selulosa, karagenan, kitin, dan kitosan (Nazaruddin 2007), polimer sintetik seperti polianilin dan polistirena, dan bahan anorganik seperti alumina berpori,
silika (Bhatia et al. 2000) dan zeolit (Balal et al. (2009), Goriushkina et al.
(2010).
2
Zeolit sering digunakan sebagai penjerap, penukar kation, dan katalis. Hal tersebut diakibatkan karena zeolit memiliki kemampuan selektivitas, stabil pada suhu
tinggi, stuktur yang stabil, dan stabil pada tekanan mekanik yang tinggi (Valdes et
al. 2006).
Zeolit terdiri dari zeolit sintetik dan zeolit alam. Zeolit sintetik memiliki kelemahan yaitu cukup mahal dengan pembuatan yang cukup rumit dan kelebihan yaitu nilai KTK tinggi diatas 100 cmol/kg. Kelebihan zeolit alam yaitu sudah tersedia di alam sedangkan kekurangannya yaitu nilai KTK lebih rendah dibandingkan dengan zeolit sintetik. Berdasarkan Arif (2011) jumlah zeolit alam di Indonesia sangatlah banyak dengan nilai Kapasitas Tukar Kation (KTK) yang hampir diatas 50 cmol/kg (cukup baik untuk dijadikan matriks imobilisasi). Dari hal inilah, zeolit dalam penelitian biosensor antioksidan menggunakan zeolit alam berasal dari Bayah, Jawa Barat.
Penelitian menggunakan zeolit telah dilakukan oleh Goriushkina et al
(2010) dalam imobilisasi glukosa oksidase, dan Balal et al (2009) untuk
memodifikasi elektrode pasta karbon untuk mengukur kadar dopamin dan triptofan. Hasil kedua penelitian tersebut, zeolit dapat meningkatkan nilai arus dan stabilitas lebih tinggi untuk percobaan yang dilakukan secara berulang-ulang. Selain itu, pengukuran yang diperoleh menjadi lebih selektif dan sensitif sesuai dengan syarat efektivitas suatu biosensor.
Penelitian tentang biosensor antioksidan dengan menggunakan zeolit Bayah telah dilakukan oleh Weniarti (2011). Penelitian tersebut menggunakan zeolit
pada ekstrak enzim SOD (superoksida dismutase) Deinococcus radiodurans
diperoleh nilai aktivitas SOD cenderung stabil selama 8 jam. Namun dalam penelitian tersebut zeolit yang digunakan belum diaktivasi, penentuan konsentrasi optimum ekstrak enzim SOD, dan stabilitas elektrode pasta karbon belum dilakukan. Selain itu, zeolit Bayah juga digunakan dalam penelitian Liyonawati (2013) dengan kestabilan biosensor selama 4 jam. Ini membuktikan bahwa zeolit Bayah, cocok untuk dijadikan sebagai matriks imobilisasi.
Selain itu, penelitian Weniarti menggunakan bakteri D. radiodurans sebagai
sumber enzim SOD. Bakteri tersebut merupakan suatu bakteri non patogen berbentuk bulat dengan diameter 3-5 µm serta memiliki dinding sel tebal
(Makarova et al 2001) sehingga sulit untuk mengekstraksi SOD. Selain itu,
bakteri ini memerlukan media yang cukup kompleks untuk menghasilkan koloni. Oleh karena itu, dicoba menggunakan bakteri lain penghasil SOD, yaitu
Escherichia coli.
Proses penumbuhan bakteri E.coli tergolong lebih mudah karena cukup
ditumbuhkan pada media sederhana serta mudah dalam penanganannya. Bakteri
E. coli memiliki tingkat stabilitas yang tinggi dan lebih potensial sebagai
biosensor dibandingkan dengan bakteri lainnya seperti B. subtilis dan T. filiformis
(Ikeda et al. 2001). Salah satu biosensor antioksidan menggunakan E. coli telah
dilakukan oleh Liyonawati (2013) dimana E. coli diimobilisasi dalam elektroda
pasta karbon. Berdasarkan beberapa alasan sebelumnya, maka penelitian ini
bertujuan menentukan aktivitas dan stabilitas enzim SOD dari sel bakteri E. coli
3
TINJAUAN PUSTAKA
Biosensor Antioksidan
Biosensor merupakan perangkat sensor yang menggabungkan senyawa biologi dengan suatu transduser. Senyawa aktif biologi tersebut berinteraksi dengan molekul yang akan dideteksi (molekul sasaran). Hasil interaksi berupa arus listrik, panas, potensial listrik yang ditunjukan oleh transduser dan diproses menjadi sinyal (Gambar 1). Biosensor terdiri dari tiga unsur, yaitu unsur biologi, transduser, dan sistem elektronik pemroses sinyal. Unsur biologi digunakan untuk mendesain biosensor seperti enzim, DNA, jaringan, organel, bakteri dan jasad renik.
Gambar 1 Skema umum tahapan operasi suatu biosensor secara elektrokimia
(Rivas et al. 2005)
Suatu biosensor berbasis elektrokimia pada dasarnya terdiri dari suatu elektrode yang dimodifikasi. Proses modifikasi menyebabkan interaksi dengan sampel melalui pengenalan urutan komplementernya, antara lain pH, kekuatan ion, dan temperatur tertentu (Marraza 1999). Prinsip penelitian biosensor elektrokimia berdasarkan pada daya hantar listrik yang memanfaatkan potensial reduksi dari reaksi reduksi-oksidasi dimana reaksi redoks akan menghasilkan arus yang akan sebanding dengan konsentrasi analat yang dianalisis (Martin 2011).
Salah satu biosensor yang sudah sering diujikan adalah biosensor antioksidan. Biosensor antioksidan ini menggunakan mekanisme pengukuran kapasitas antioksidan melalui reaksi redoks. Suatu enzim pengikat radikal (SOD)
akan mengoksidasi radikal superoksida yang berasal dari substrat menjadi O2 dan
H2O2. Hasil dari reaksi tersebut dideteksi oleh elektrode tranduser sebagai sinyal
listrik dan menghasilkan grafik arus listrik yang menunjukan reaksi oksidasi dan reduksi.
Gambar 2 Mekanisme pengukuran biosensor antioksidan
Kelebihan dari biosensor antioksidan berdasarkan penelitian terdahulu antara lain hasil aktivitas arus yang dihasilkan tinggi, selektif, dan spesifikasi
reaksi yang dikatalisnya (Mateo et al. 2007). Selain itu, menggunaan sampel dari
4
merah dan anggur putih (Campanella et al. 2004). Hasil korelasi yang sangat baik
antara metode biosensor dengan voltrametri siklik.
Escherichia coli dan Superoksida Dismutase
Bakteri Escherichia coli berasal dari filum Proteobacteria, kelas Gamma
Proteobacteria, ordo Enterobacteriales, family Enterobacteriaceae, genus
Escherichia, dan spesies Escherichia coli (Holt et al. 1994). Bakteri ini memiliki
diameter 0.5 µm dengan panjang tubuh 2 µm dan berbentuk batang (Gambar 3).
Bakteri E. coli termasuk dalam bakteri gram negatif dan biasa hidup di kisaran
suhu 20-40 oC dengan suhu optimum 37 oC . Habitat alami E. coli terletak di
dalam splotan usus manusia dan hewan tingkat tinggi lainnya (Herawati 2012). Selain itu, kelebihan bakteri ini antara lain memiliki tingkat stabilitas yang tinggi
dengan ketahanan periode hidup dan suhu tinggi (Iswantini et al. 2011).
Gambar 3 Morfologi Echerichia coli
Bakteri E. coli mengandung berbagai macam enzim didalam sitoplasma dan
permukaan periplasmanya. Enzim yang terdapat di bagian periplasma E. coli
antara lain glukosadehidrogenase (GDH) dan superoksida dismutase (SOD). SOD merupakan suatu metaloenzim dan enzim detoksifikasi yang dapat mengoksidasi radikal bebas menjadi oksigen dan hidrogen peroksida (Mc Cord dan Fridovich 1969). Enzim SOD dihasilkan oleh bakteri yang mengkonsumsi oksigen dimana enzim ini berperan sebagai pertahanan tubuh terhadap spesi oksigen reaktif hasil efek samping metabolisme dan respirasi. Bakteri penghasil SOD lainnya adalah
Thermothrix sp., Deinococcus radiodurans, Rhodothermus sp., dan Bacillus sp
(Benov et al. 1996).
Berdasarkan kofaktor logam utamanya, SOD terbagi atas Cu/Zn-SOD,
Mn-SOD, Fe-Mn-SOD, dan Ni-SOD (Buyukuslu et al. 2006). Mekanisme pembentukan
SOD berasal dari hasil oksidasi xantina dengan katalis xantina oksidae
(Campanella et al 2004), dengan mengkatalis radikal O2- menjadi hidrogen
peroksida (H2O2 dan oksigen) (Emregul 2005).
Xantin + H2O2 + O2 + Xantin oksidase asam urat + 2H+ + O2
O2- + O2- + 2H+ O2 + H2O2
Kelebihan enzim SOD antara lain spesifik mengatalis radikal superoksida menjadi oksigen dan peroksida, serta tahan terhadap panas saat diaplikasikan pada
makanan (Donnely et al. 1989). Faktor inilah yang menyebabkan SOD dapat
dimanfaatkan sebagai biosensor antioksidan.
Penelitian menggunakan E. coli sebagai biosensor telah sering dilakukan,
namun berbatas pada analisis enzim GDH sebagai biosensor glukosa. Iswantini et
5
murni untuk biosensor glukosa dan metode elektrokimia dalam pengukuran aktivitas enzim. Metode tersebut cukup efektif karena penggunaan enzim aktif
tidak memerlukan proses pemurnian. Selain itu, penggunaan E. coli sebagai
biosensor antioksidan juga telah dilakukan oleh Liyonawati (2013) dimana bakteri
dan ektrak kasar E. coli diimobilisasi dalam sebuah elektrode pasta karbon dan
diukur aktivitasnya. Dalam penelitian ini diperoleh hasil bahwa ekstrak E. coli
imobilisasi lebih stabil dibandingkan dengan bakteri E. coli imobilisasi.
Zeolit Bayah
Zeolit adalah batuan mineral berasal dari silika berbentuk halus dan merupakan produk sekunder yang stabil pada kondisi permukaan yang berasal dari proses pelapukan, sedimentasi, maupun aktivitas hidrotermal (Hamdan 2005). Zeolit terdiri dari pori yang terbuka ke permukaan luar partikel sehingga terjadi transfer massa. Pori memerangkap molekul atau ion dengan berbagai ukuran atau melepaskan molekul lain yang tidak sesuai pori.
Sistem penjerapan zeolit dalam mengikat cairan yang direaksikan antara lain karena faktor pori berukuran nano yang dimilikinya. Pori berukuran nano tersebut bervariasi tergantung pada zeolit yang digunakan. Akibat adanya variasi bentuk tersebut, pori memerangkap molekul atau ion dengan berbagai ukuran atau sebaliknya melepaskan molekul lain yang tidak sesuai dengan ukuran pori.
Sintesis polimer anorganik in situ dalam zeolit alam menghasilkan material baru
yang memiliki kandungan sifat fisik dan kimia yang sangat berbeda
(Hadiyawarman et al. 2008).
Salah satu zeolit yang digunakan sebagai matriks imobilisasi biosensor antioksidan adalah zeolit Bayah. Menurut PTBIN-BATAN, zeolit alam Bayah mempunyai diameter tinggi, tahan terhadap suhu tinggi, berstruktur sangkar dan termasuk dalam zeolit jenis klipnotilolit. Rumus molekul zeolit klipnotilolit yaitu
(Na4K4) (Al8Si40O96).24H2O dengan nilai kapasitas tukar kation pada zeolit Bayah
sebesar 48 cmol/kg (Arif 2011). Nilai kapasitas zeolit ini lebih rendah dibandingkan dengan zeolit sintesis sekitar 250-450 cmol/kg (Supandi 1998).
6
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah sel bakteri Escherichia coli, media
pertumbuhan bakteri, xantina oksidase (XO), xantina, etanol 8%, grafit, ferosena, larutan bufer fosfat pH 7-11, parafin cair, zeolit bayah, dan dimetil sulfoksida (DMSO).
Alat-alat yang digunakan adalah eDAQ, Potentiostat-Galvanostat yang dilengkapi dengan perangkat lunak Echem v2.1.0, sel elektrokimia,
DNA/Protein/Enzyme Analyzer BioSpec-1601 Shimadzu, Ultrasonic
Homogenizer UH-150, laminar air flow, High Speed Refrigerated Centrifuge
KUBOTA 6500, eppendorf Centrifuge 5415 R, inkubator, autoklaf, pipet mikro, dan alat kaca lazim.
Metode Penelitian
Penelitian ini terdiri dari beberapa tahap, yaitu aktivasi zeolit, pembuatan elektrode pasta karbon dengan mediator ferosena, pengukuran arus elektrode,
penumbuhan sel bakteri dan ekstraksi SOD, optimasi aktivitas sel E. coli dan
ekstrak SOD E. coli, pengukuran optimasi aktivitas antioksidan sel bakteri, dan
penentuan stabilitas biosensor antioksidan sel bakteri E. coli.
Aktivasi Zeolit
Zeolit sebanyak 50 gram dicuci dengan akuades hingga netral, disaring, dan
dikeringkan dalam oven pada suhu 105 oC. Zeolit yang telah dikeringkan
diaktivasi dengan menambahkan larutan HCl 3M sebanyak 250 mL dalam gelas piala dan diaduk selama 1 jam. Zeolit yang telah diaktivasi disaring dan dicuci dengan akuades sampai netral. Larutan hasil saringan diuji kandungan klorin
dengan AgNO3 dan dicuci kembali dengan akuades sampai tidak mengandung
klorin. Setelah larutan netral dan bebas klorin, zeolit dikeringkan pada suhu 300
o
C selama 3 jam. Zeolit yang telah diaktivasi kemudian dihaluskan dan diayak dengan ayakan 100 mesh.
Elektrode Pasta Karbon dengan Mediator Ferosena
Bubuk ferosena sebanyak 3 mg dilarutkan dengan 1 mL DMSO, kemudian ditambahkan dengan grafit sebanyak 100 mg. Campuran grafit didiamkan hingga cukup kering selama 2 jam dan diuapkan dengan pengering vakum. Grafit yang
telah kering ditambahkan dengan larutan parafin sebanyak 35 µL hingga terbentuk
7
Pengukuran Arus Elektrode Pasta Karbon
Elektrode pasta karbon yang telah diperoleh selanjutnya diukur besar arusnya dengan larutan elektrolit bufer fosfat pH 9. Elektrode dengan arus tertinggi digunakan sebagai elektrode dalam penelitian. Elektrode pasta karbon yang digunakan harus seragam panjang kawat Cu, besar diameter batang elektrode, dan tinggi grafit pasta karbon pada elektrode.
Penumbuhan Sel E. coli dan Ekstraksi Sel E.coli
Bakteri ditumbuhkan pada media LB (Luria Bertani) miring selama 24 jam
dengan suhu inkubator sebesar 37 oC. Bakteri yang telah tumbuh dipindahkan ke
media LB cair 5 mL sebagai starter dan diinkubasi selama 24 jam sehingga
mencapai nilai OD610 = 0.5-1.0. Bakteri kemudian diinokulasi ke dalam media LB
cair 50 mL dan diinkubasi kembali selama 24 jam dengan suhu 37 oC. Sel bakteri
dipanen dengan cara disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit
dan dicuci dengan akuades steril sebanyak 100 µL selama 10 menit. Setelah itu,
sel bakteri diresuspensikan dengan larutan buffer fosfat pH 7.5.
Pada pemecahan sel bakteri menjadi ekstrak kasar bakteri, suspensi
biomassa sel bakteri yang telah terpisah disonikasi dengan Ultrasonic
Homogenizer dengan pulse 50% dan output 5, dengan interval 10 x 2 menit dengan interval berhenti setiap 1 menit. Sel bakteri yang telah disonikasi kemudian disentrifugasi kembali dengan kecepatan 10.000 rpm selama 15 menit.
Ekstrak kasar bakteri diukur konsentrasinya dengan menggunakan
spektrofotometer dengan panjang gelombang 260 nm dan 280 nm.
Optimasi Aktivitas Sel E.coli dan Ekstrak kasar E. coli
Sel bakteri dicampur dengan nanokomposit zeolit. Zeolit disuspensikan ke dalam 5 mL larutan bufer fosfat yang telah dimasukkan sel bakteri sebanyak 20
µL. Campuran diaduk secara konstan selama beberapa saat. Hal ini bertujuan
untuk memberikan keadaan yang sama dengan lingkungan sebenarnya bagi bakteri. Elektrode pasta karbon dimasukkan dan dilakukan pengukuran aktivitas.
Ekstrak kasar bakteri dicampur dengan nanokomposit zeolit. Zeolit disuspensikan ke dalam 5 mL larutan bufer fosfat yang telah dimasukkan ekstrak
kasar bakteri sebanyak 20 µL. Campuran diaduk secara konstan selama beberapa
saat. Elektrode pasta karbon dimasukkan dan dilakukan pengukuran aktivitas.
Optimasi Aktivitas Antioksidan Sel E. coli dan Ekstrak kasar E. coli
Pengukuran secara elektrokimia dengan metode voltametri siklik menggunakan seperangkat alat potensiostat/galvanostat eDAQ dan komputer
dengan perangkat lunak pengolah data Echem V2.1.0. Elektrode yang digunakan
antara lain elektrode Ag/AgCl sebagai pembanding, elektrode Pt/Ti sebagai elektrode bantu, dan elektrode pasta karbon sebagai elektrode kerja. Parameter
8
Final E: -400 mV, Rate: 250 mV/s, Step W: 20 ms, Upper E: 600 mV, Lower E:
-400 mV, dan Range: 100 µV.
Senyawa radikal superoksida dihasilkan melalui reaksi enzimatis
xantina-XO (xantin oksidase). Radikal tersebut didismustasi menghasilkan senyawa O2
dan H2O2 dengan SOD. Larutan XO 0,1 U/mL sebanyak 100 μL ditambahkan
pada sel pengukuran dan puncak blangko adalah puncak arus anode yang terbentuk. Selanjutnya seluruh enzim baik yang ekstrak bakteri maupun sel bakteri utuh diukur masing-masing aktivitasnya. Substrat xantina 2,1 mM sebanyak 1 mL ditambahkan dan diukur kembali perubahan puncak arus anode yang terjadi (Trivadila 2011).
Variasi optimasi yang dilakukan pada sel dan ekstrak kasar bakteri meliputi
suhu 20-40 oC, pH 7-11, dan jumlah zeolit 50-250 mg. Variasi optimasi ini
diperoleh menggunakan perangkat lunak statistika Minitab dengan metode
Response Surface Method (RSM). Kombinasi yang diperoleh selanjutnya dilakukan untuk mendapatkan nilai aktivitas optimumnya.
Pengukuran Aktivitas Antioksidan Sel E. coli
Proses uji aktivitas dilakukan pada rentang konsentrasi xantina 0,20 – 1,00
mM dengan interval 0,1 mM pada prosedur pengukuran elektrokimia. Selanjutnya
dibuat kurva hubungan antara konsentrasi xantina dan aktivitas bakteri E. coli.
Penentuan Stabilitas Biosensor Antioksidan Sel Bakteri E. coli
Elektrode pasta karbon yang telah buat kemudian digunakan untuk
mengukur aktivitas E. coli secara langsung. Seluruh nilai aktivitas yang diperoleh
pada pengukuran awal dianggap sebesar 100%. Aktivitas diukur kembali selama 8 jam dengan interval 2 jam. Persen aktivitas SOD diukur dengan menggunakan
rumus : I saat ke-jam (A)
I saat awal (A) × 100%
HASIL DAN PEMBAHASAN
Penumbuhan Sel E. coli dan Ekstraksi Sel E. coli
9
Proses pertumbuhan bakteri pada penelitian ini diawali dengan peremajaan bakteri ke dalam media LB miring dan diinkubasi selama 24 jam. Setelah tumbuh, bakteri dipindahkan ke dalam media LB cair dan diinkubasi hingga mencapai nilai
OD610= 0.5. Nilai OD merupakan nilai kekeruhan kultur bakteri, dimana nilai
kekeruhan kultur berbanding lurus dengan jumlah sel bakteri (Purwoko 2007). Selanjutnya bakteri dipisahkan dari media tumbuhnya dengan cara di sentrifugasi dan direndam dengan larutan NaCl 0.85%. Larutan NaCl 0.85% berfungsi sebagai pelarut yang disamakan dengan habitat hidup bakteri.
Bakteri E. coli merupakan bakteri Gram negatif dimana kandungan enzim
lebih banyak terdapat di dalam sitoplasma tubuhnya sehingga harus dilakukan pemecahan sel bakteri. Enzim merupakan suatu molekul biologis bersifat selektif untuk substrat yang ditargetkan dan memiliki aktivitas katalitik yang tinggi (Putzbach 2013). Dinding sel bakteri yang berukuran sekitar 10-15 nm dipecah
menggunakan Ultrasonic Homogenizer dengan konsentrasi yang diperoleh
10680.60 µg/mL. Sel bakteri utuh dan ekstrak kasar bakteri yang diperoleh
kemudian diukur aktivitasnya.
Arus Elektroda Pasta Karbon
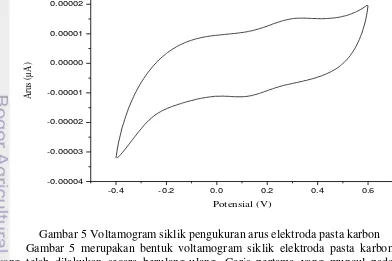
Penyeragaman elektroda pasta karbon dilakukan secara fisik dan kimia. Perlakuan fisik dilakukan dengan menyamakan panjang kawat Cu sebesar 10 cm, diameter batang elektrode sebesar 0.1 mm, dan tinggi grafit pasta karbon sebesar 0.1 mm. Perlakuan kimia dilakukan dengan pengukuran arus elektroda pasta karbon menggunakan larutan elektrolit bufer fosfat pH 9. Larutan bufer fosfat akan bereaksi dengan permukaan pasta karbon untuk menghasilkan arus berupa voltamogram. Berikut contoh voltamogram yang dihasilkan oleh pasta karbon.
Gambar 5 Voltamogram siklik pengukuran arus elektroda pasta karbon Gambar 5 merupakan bentuk voltamogram siklik elektroda pasta karbon yang telah dilakukan secara berulang-ulang. Garis pertama yang muncul pada
10
voltamogram menunjukan garis proses oksidasi dengan adanya puncak arus oksidasi. Garis kedua menunjukan proses reduksi yang terjadi pada elektrode pasta karbon. Elektrode yang memiliki puncak arus oksidasi-reduksi dan rentang voltamogram yang cukup seragam digunakan untuk pengukuran optimasi, uji aktivitas, dan stabilitas biosensor selanjutnya.
Optimasi Aktivitas Antioksidan Sel Optimasi sel bakteri dengan penambahan zeolit
Metode pengukuran optimasi aktivitas sel bakteri menggunakan metode voltametri siklik. Voltametri siklik adalah metode analisis elektrokimia yang didasarkan pada pengukuran arus listrik sebagai fungsi aliran potensial, dengan potensial awal sama dengan potensial akhir (Hattu 2009). Analisis voltammetri siklik sering dilakukan untuk analisis kimia salah satunya mempelajari reaksi katalisis enzimatik dimana lebih ditekankan pada kinetika dan dinamika reaksi (Skoog dkk.1998).
Optimasi aktivitas sel bakteri dilakukan beberapa variasi seperti suhu dan pH larutan bufer fosfat (Lampiran 2). Campuran kemudian ditambahkan dengan larutan XO dan xantina. Penambahan XO dan xantina pada bakteri akan terjadi reaksi enzimatis xantina dengan xantina oksidae menghasilkan radikal
superoksida. Radikal superoksida akan didismutasi membentuk O2 dengan katalis
enzim SOD sebagai reaksi :
2H+ + 2O2•- O2 + H2O2
Persamaan tersebut menjelaskan reaksi oksidasi-reduksi dalam
voltamogram yang secara bertahap menyebabkan kenaikan arus. Voltamogram merupakan grafik hubungan antara arus dan potensial listrik dengan reaksi reduksi dan oksidasi didalamnya (Hattu 2009). Berdasarkan hasil voltamogram, arus puncak oksidasi meningkat seiring ditambahkan larutan. Hal ini menandakan
adanya aktivitas antioksidan berupa transfer elektron antara enzim dari sel E. coli
pada larutan dengan permukaan elektrode pasta karbon.
Hasil voltamogram menunjukan terjadi peningkatan arus oksidasi yang menandakan bahwa zeolit mempengaruhi aktivitas antioksidan sel bakteri (Gambar 6). Kondisi tersebut disebabkan zeolit memiliki kemampuan adsoprsi terhadap adsorbat tertentu. Selain itu, kapasitas tukar ion dan selektivitas yang
tinggi dalam zeolit bisa digunakan untuk pengembangan biosensor (Valdes et al.
2006).
Mekanisme pengukuran biosensor antioksidan menggunakan elektrokimia antara lain radikal bebas yang telah terikat dengan enzim SOD akan menghasilkan elektron-elektron. Elektron-elektron tersebut akan ditangkap oleh mediator dan terjadi reaksi bolak-balik yang akan menghasilkan elektron bebas. Elektron bebas akan ditangkap oleh permukaan elektrode dan dikirimkan kepada transduser untuk diolah menjadi data, dalam bentuk voltamogram.
11
Gambar 6 Voltamogram siklik sel bakteri dengan penambahan zeolit
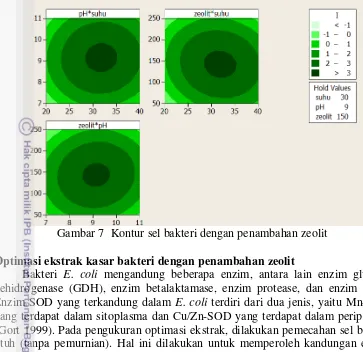
Hasil analisis RSM menunjukkan plot kontur yang baik dengan bulatan sempurna pada bulatan lebih gelap yang menjelaskan nilai arus tertinggi. Kontur merupakan garis-garis yang menunjukan nilai ekspektasi respon aktivitas berupa
arus minimum hingga maksimum. Plot kontur menunjukan Hold Values yang
akan digunakan sebagai Starting Value pada Response Optimizer. Response
Optimizer berfungsi untuk menganalisis kondisi optimum aktivitas antioksidan dari sel bakteri. Hasil optimum yang diperoleh untuk sel bakteri dengan zeolit,
yaitu suhu 30 oC, pH 9, dan zeolit 150 mg (Gambar 7).
Hasil optimasi sel bakteri dengan penambahan zeolit ini berbeda dengan hasil penelitian Weniarti (2011). Weniarti (2011) menunjukan bahwa dengan
menggunakan sel bakteri Deinococcus radiodurans dengan variasi pH, suhu, dan
zeolit yang sama, plot kontur tidak menunjukan nilai puncak maksimum sehingga bakteri tidak memiliki aktivitas untuk meningkatkan puncak oksidasi. Sehingga
dapat disimpulkan bahwa sel bakteri E. coli lebih baik digunakan sebagai
komponen pengenal hayati biosensor antioksidan dibandingkan dengan
12
Gambar 7 Kontur sel bakteri dengan penambahan zeolit
Optimasi ekstrak kasar bakteri dengan penambahan zeolit
Bakteri E. coli mengandung beberapa enzim, antara lain enzim glukosa
dehidrogenase (GDH), enzim betalaktamase, enzim protease, dan enzim SOD.
Enzim SOD yang terkandung dalam E. coli terdiri dari dua jenis, yaitu Mn-SOD
yang terdapat dalam sitoplasma dan Cu/Zn-SOD yang terdapat dalam periplasma (Gort 1999). Pada pengukuran optimasi ekstrak, dilakukan pemecahan sel bakteri utuh (tanpa pemurnian). Hal ini dilakukan untuk memperoleh kandungan enzim SOD yang lebih banyak. Selain itu, enzim merupakan komponen makhluk hidup yang secara bertahap akan kehilangan aktivitasnya. Sehingga dibutuhkan komponen tambahan lain berupa matriks imobilisasi seperti silika dan zeolit.
Pengukuran ekstrak kasar bakteri dengan penambahan zeolit dilakukan variasi jumlah ulangan yang sama persis dengan sel bakteri utuh. Hasil plot kontur
pada metode ini memberikan nilai Hold Values dengan suhu 30 oC, bufer fosfat
pH 9, dan jumlah zeolit 150 mg (Gambar 8). Namun, arus maksimum tidak terlihat pada grafik, tidak terjadi bulatan sempurna seperti pada plot kontur sel
bakteri, dan tidak memberikan nilai Response Optimizer. Hal dapat disebabkan
oleh rusaknya enzim SOD pada ekstrak kasar E. coli selama proses pengukuran.
Hasil penelitian apabila dibandingkan dengan Liyonawati (2013) sangat
berbeda, dimana ekstrak kasar E. coli memberikan nilai Response Optimizer
dengan suhu 40 oC, pH 7, dan jumlah zeolit 30 mg. Perbedaan tersebut disebabkan
oleh perbedaan proses pengukuran aktivitas. Liyonawati (2013) menggunakan teknik imobilisasi enzim dimana ekstrak kasar dengan zeolit ditaruh dalam permukaan elektrode pasta karbon. Berdasarkan hasil ini disimpulkan bahwa
13
Gambar 8 Kontur ekstrak SOD dengan zeolit
Aktivitas Antioksidan Sel E.coli
Uji aktivitas optimum substrat xantina dilakukan pada rentang 0.20-1.00
mM (interval 0.1 mM) menggunakan bufer fosfat pH 9.14, suhu 25 oC, zeolit
142.9293 mg. Variasi konsentrasi xantina dilakukan untuk mengetahui selisih arus maksimum aktivitas antioksidan terhadap xantina. Suhu yang digunakan sebesar
25 oC bertujuan untuk memudahkan aplikasi biosensor antioksidan sehingga dapat
langsung digunakan pada suhu ruang.
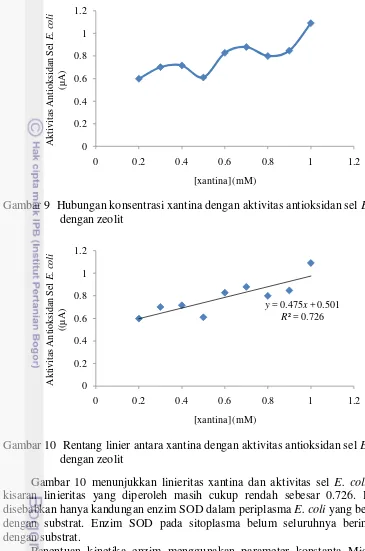
Gambar 9 menunjukan grafik hasil variasi konsentrasi xantina terhadap
aktivitas antioksidan sel bakteri E. coli dengan penambahan zeolit yang identik
dengan kurva Michaelis-Menten. Gambar 9 memperlihatkan aktivitas antioksidan yang berubah-ubah pada konsentrasi 0.5 mM dan 0.8 mM mengalami penurunan arus. Pada konsentrasi selanjutnya arus mengalami peningkatan hingga mencapai arus tertinggi di konsentrasi substrat xantina 0.7 mM. Hasil ini diambil rentang
linieritas sel bakteri E. coli 0.2-0.7 mM.
14
Gambar 9 Hubungan konsentrasi xantina dengan aktivitas antioksidan sel E. coli
dengan zeolit
Gambar 10 Rentang linier antara xantina dengan aktivitas antioksidan sel E. coli
dengan zeolit
Gambar 10 menunjukkan linieritas xantina dan aktivitas sel E. coli. Nilai
kisaran linieritas yang diperoleh masih cukup rendah sebesar 0.726. Hal ini
disebabkan hanya kandungan enzim SOD dalam periplasma E. coli yang berikatan
dengan substrat. Enzim SOD pada sitoplasma belum seluruhnya berinteraksi dengan substrat.
Penentuan kinetika enzim menggunakan parameter konstanta
Michaelis-Menten (KM app) dan laju reaksi maksimum nyata (Vmaks app). Parameter tersebut
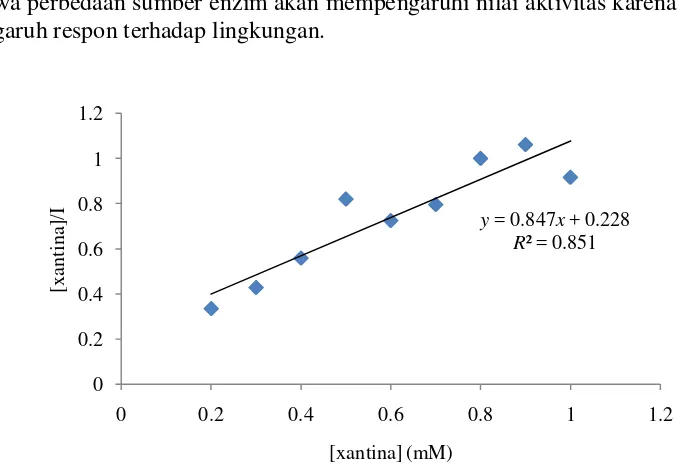
dimasukkan ke dalam metode Lineweaver-Burk, Hanes-Woolf, dan
Eadie-Hofstee. Berdasarkan nilai koefisien determinasi (R2), nilai metode Hanes-Woolf
lebih besar dibandingkan dengan kedua metode lainnya sehingga pada penelitian sel E. coli + zeolit secara langsung mengikuti metode Hanes-Woolf.
Berdasarkan metode Hanes-Woolf diperoleh persamaan garis y=0.847x +
15
disosiasi konstan antara enzim dengan substrat, semakin kecil nilai KM app maka
semakin kuat enzim mengikat substrat. Nilai Vmaks adalah indikator aktivitas enzim
dimana semakin besar nilainya maka semakin tinggi aktivitas enzim. Dari nilai KM
app dapat dikatakan bahwa enzim SOD E. coli lebih kuat mengikat substrat xantina
dan melalui nilai Vmaks dapat dikatakan bahwa aktivitas enzim SOD E. coli sangat
tinggi.
Nilai KM app ini lebih kecil dibandingkan nilai KM app pada penelitian Weniarti
(2011), yaitu 1.096 mM hampir mendekati nilai KM app SOD murni sebesar 0.355
mM (Sigma-Aldrich 2011). Perbedaan nilai tersebut berhubungan dengan perbedaan jenis bakteri penghasil SOD dan tingkat kemurnian enzim. Pada sel
bakteri E. coli, enzim SOD terdapat dalam periplasma tubuh dengan jumlah yang
lebih kecil sehingga enzim bisa lebih kuat mengikat substrat. Dapat disimpulkan bahwa perbedaan sumber enzim akan mempengaruhi nilai aktivitas karena adanya pengaruh respon terhadap lingkungan.
Gambar 11 Plot Hanes – Woolf sel bakteri E. coli dengan zeolit
Stabilitas Biosensor Antioksidan Sel Bakteri E. coli
Stabilitas aktivitas bakteri dipengaruhi oleh beberapa faktor, antara lain kestabilan elektrode, pengaruh matriks imobilisasi, serta pengaruh lingkungan seperti suhu dan pH. Salah satu elektrode kerja yang memiliki kestabilan cukup tinggi yaitu elektrode pasta karbon termodifikasi ferosena. Beberapa hal yang perlu diperhatikan pada pemilihan elektrode kerja, antara lain sifat redoks analit, arus latar belakang pada daerah potensial pengukuran, keberulangan permukaan elektrode, dan biaya pembuatannya (Wang 2000). Penambahan ferosena berfungsi sebagai mediator untuk meningkatkan sensitivitas karena sifatnya stabil, memiliki potensial redoks yang lebih rendah dari potensial analat, tidak bereaksi langsung dengan substrat enzim, dan kurang sensitif terhadap pH dan efek kekuatan ion (Trivadilla 2011). Selain itu, pemilihan matriks imobilisasi menggunakan zeolit alam yang memiliki sisi aktif pada permukaan pori untuk lebih melindungi bakteri dari perubahan suhu dan pH ekstrem.
16
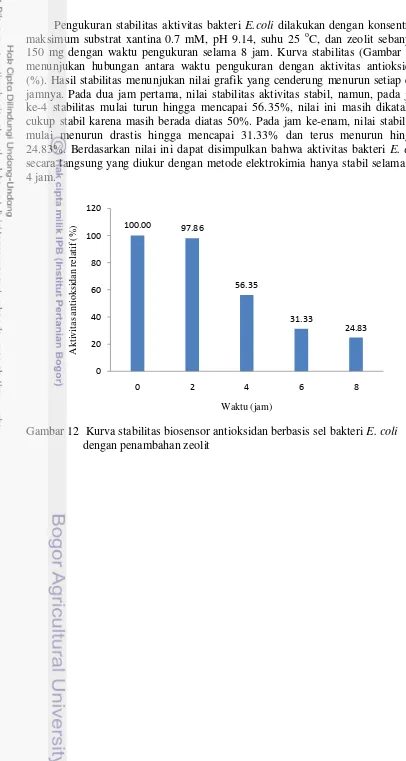
Pengukuran stabilitas aktivitas bakteri E.coli dilakukan dengan konsentrasi
maksimum substrat xantina 0.7 mM, pH 9.14, suhu 25 oC, dan zeolit sebanyak
150 mg dengan waktu pengukuran selama 8 jam. Kurva stabilitas (Gambar 12) menunjukan hubungan antara waktu pengukuran dengan aktivitas antioksidan (%). Hasil stabilitas menunjukan nilai grafik yang cenderung menurun setiap dua jamnya. Pada dua jam pertama, nilai stabilitas aktivitas stabil, namun, pada jam ke-4 stabilitas mulai turun hingga mencapai 56.35%, nilai ini masih dikatakan cukup stabil karena masih berada diatas 50%. Pada jam ke-enam, nilai stabilitas mulai menurun drastis hingga mencapai 31.33% dan terus menurun hingga
24.83%. Berdasarkan nilai ini dapat disimpulkan bahwa aktivitas bakteri E. coli
secara langsung yang diukur dengan metode elektrokimia hanya stabil selama 2 - 4 jam.
Gambar 12 Kurva stabilitas biosensor antioksidan berbasis sel bakteri E. coli
17
SIMPULAN
Simpulan
SOD pada sel bakteri dengan penambahan zeolit alam menghasilkan optimasi aktivitas yang lebih baik dibandingkan dengan ekstrak kasar bakteri yang
ditambahkan zeolit alam. Nilai Km app sel bakteri E. coli dengan zeolit sebesar
0.2691 mM dengan kestabilan aktivitas yang selama 2 - 4 jam. Hal ini
menunjukan bahwa pengukuran aktivitas sel bakteri E. coli lebih baik secara
langsung dibandingkan dengan proses imobilisasi.
Saran
Penelitian lanjutan menggunakan matriks imobilisasi selain zeolit alam serta
penggunaan mikroba lain selain E. coli sebagai penghasil enzim SOD perlu
dilakukan untuk meningkatkan kestabilan dan kinerja biosensor antioksidan.
Penggunaan jenis bakteri E. coli selain ATC220 untuk melihat seberapa banyak
kandungan enzim SOD didalam sel. Selain itu, penambahan rentang konsentrasi
substrat untuk memperoleh nilai maksimum aktivitas sel bakteri E. coli sebagai
biosensor antioksidan.
DAFTAR PUSTAKA
Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bagan media pendeteksi studi kasus: kromium heksavalen. [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Balal K, Mohammad H, Bahareh, Ali B, Maryam H, Mozhgan Z. 2009. Zeolite nanoparticle modified carbon paste elektrode as a biosensor for
simultaneous determination of dopamine and tryptophan. J Chin Chem 56:
789-796.
Battista JR et al. 2003. The structure of Deinococcus radiodurans. Science 302:
567-568.
Bhatia R, Gupta AK, Anup KS, Brinker CJ. 2000. Aqueous sol-gel process for
protein encapsulation. Chem. Mater 12: 2434-2441.
Benov LT, Beyer Jr WF, Stevens RD, Fridovich I. 1996. Purification and
characterization of the Cu, Zn SOD from Escherichia coli. Free Rad Bio
Med 21 (1): 117-121.
Bjelakovic G et al. 2007. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and
18
Brooks BW, Murray RCE. 1981. Nomenclature for Micrococcus radiodurans and
other radiation-resistant cocci: Deinococcaceae fam. nov. and Deinococcus
gen. nov., including five species. J of Sys Bact 31: 353-360.
Buyukuslu N, Celik O, Atak C. 2006. The effect of magnetic field on the activity
of superoxide dismutase. J Cell Mol Bio 5: 57 – 62.
Campanella L, Bonnani A, Tommaseti M. 2004. Biosensors for determination of total and natural antioxidant capacity of red and white wines: comparison
with other spectrophotometric and flourimetric methods. J Biosen Bioelect
19 : 641-651.
Campanella L, Martini E, Tommaseti M. 2005. Antioxidant capacity of the algae
using a biosensor method. J Talanta. 902-911.
Cortina-Puig M & Camp M. 2007. Electrochemichal biosensors as a tool for
antioxidant capacity assessment. J Sens Actup 129:459 – 466.
Dai Z, Liu S, Ju H. 2004. Direct electron transfer of cytochrome c immobiliced on
a NaY zeolite matrix and its application in biosensing. J Elec Act
49:2139-2144.
Dalimartha S and Soedibyo M. 1998. Awet Muda dengan Tumbuhan Obat dan
Diet Suplemen. Trubus Agriwidya. Jakarta
Donnelly JK, McLellan KM, Walker JL, Robinson DS. 1989. Superoxide
Dismutase in Foods. A Review. J Food Chem 33: 243 - 270.
Dyatmiko W, Santosa MH, Hafid AF. 2000. Aktifitas Penangkapan Radikal
Bebas dalam Sistem Molekuler dan Seluler Sari Air Rimpang Tanaman Obat Zingiberaceae. Lembaga Penelitian Universitas Airlangga. Pusat Penelitian Obat Tradisional Univ. Airlangga. Surabaya.
Emregul E. 2005. Development of a new biosensor for superoxide radicals. Anal
Bioanal Chem 383 : 947 – 954.
Goriushkina TB, Kurc BA, Jr. AS, Dzyadevych SV. 2010. Application of zeolites
for immobilization of glucose oxidase in amperometric biosensors. Sensors
Electronics and Microsystem Technologies 1:36-42.
Gort AS, Ferber DM, Imlay JA. 1999. The regulation and role the periplasmatic
copper, zinc superoxide dismutase of Escherichia coli. Molecular
Microbiology 32 (1) 179-191.
Hadiyawarman, Rijal A, Nuryadin BW, Abdullah M, Khairurrijal. 2008. Fabrikasi Material Nanokomposit Superkuat, Ringan dan Transparan Menggunakan
Metode Simple Mixing. J Nano Nanotek 1:14 – 21.
Hamdan H. 2005. Nanomaterials as catalysts in the production of fine chemicals.
Akta Kimindo 1:1 – 10.
Hattu N. 2009. Studi voltametri dan analisis antihistamin setirezin dihidroklorida dan deksklorfeniramin maleat dalam medium surfaktan menggunakan elektroda pasta karbon. Bandung: Institut Teknologi Bandung.
Hudson BJF. 1990. Food Antioxidants. Elsevier Applied Science. New York.
Holt et al. 1994. Determinative Bacteriology. NSA: Lippincot William & Wilkins.
Ikeda et al. 1998. Electrochemical monitoring of in vivo recronstitution of glucose
dehydrogenase in Escherichia coli cells with externally added
19
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor using selected
Indonesia bacteria. Microbiology Indonesia 5:9-14.
Kirdeciler SK et al. 2011. A novel urea conductometric biosensor based on zeolite
immobilized urease. J Talanta 85:1435-1441.
Li H, Liu S, Dai Z, Bao J, Yang X. 2009. Applications of Nanomaterials in
Electrochemical Enzyme Biosensors. Sensors. 9. : 8547-8561.
Liu ZQ, Ma L, Zhou B, Yang L, Liu Z. 2000. Antioxidative effects of green tea polyphenols on free radical initiated and photosensitized peroxidation of
human low density lipoprotein. J. Chem Phy Lip. 106 : 53-63.
Liu Song, Guo Xuefeng. 2012. Carbon nanomaterials field-effect-transistor-based.
Biosensors. NPG Asia Materials E23 (4)
Liyonawati. 2013. Aktivitas dan Stabilitas Superoksida Dismutase dari Ekstrak
Escherichia coli Diimobilisasi pada Zeolit Alam sebagai Biosensor Antioksidan. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Makarova KS, Aravind L, Wolf YI, Tatusov RL, Minton KW, Koonin EV, Daly MJ. 2001. Genome of the extremely radiation resistant bacterium
Deinococcus radiodurans viewed from the perspective of comparative
genomics. Microbiol Mol Biol Rev 65: 44-79.
Marraza G, Chianella I, Mascini M. 1999. Disposable SNA electrochemical
sensor for hybridization detection. Bisens. Bioelectron 14:43-51.
Martin C. 2011. Prinsip biosensor. [terhubung berkala].
http://www.newsmedical.net.health/Biosensor-Principle-(Indonesian).aspx. [2 April 2012].
Mateo C, Palono JM, Fernandez-Lorente G, Guisan JM, Fernandez-Lafuente R. 2007. Improvement of enzyme activity, stability and selectivity via
immobilization techniques. J. enzmictec 40:1451-1463.
McCord JM, Fridovich I. 1969. Superoxide dismutase An enzyme for
eryrhrocuprein (hemocuprein). J. Biol. Chem. 224 (22): 6049–6055.
Nazaruddin. 2007. Biosensor Urea Berbasis Biopolimer Khitin sebagai Matriks
Imobilisasi. Jurnal Rekayasa Kimia dan Lingkungan 6: 41-44.
Purwoko T. 2007. Fisiologi Mikroba. Jakarta: Bumi Aksara.
Putzbach W, Ronkainen NJ. 2013. Immobilization Techniques in the Fabrication
of Nanomaterial-Based Electrochemical Biosensors: A Review. Sensors 13:
4811-4840
Rivas G, Pedano ML, Ferreyra N. 2005. Electrochemical biosensor for
sequence-specific DNA detection. Anal. Letters 38:2653-2703.
Saiapina OY et al. 2011. Conductometric enzyme biosensors based on natural
zeolite clinoptilolite for urea determination. J Mat Sci Eng 31:1490-1497.
Sigma-Aldrich. 2011. Product information. [terhubung berkala].
http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Datasheet/2/s8160d at.Par.0001.File.tmp/s8160dat.pdf. [2 des 2012]
Skoog DA, Holler FJ, Nieman TA. 1998. Principles of Instrumentals Analysis, 5th
20
Supandi, Purwanto A, Laz T. 1998. Analisis Struktur Zeolit Alam Bayah dengan
Metoda Rietan. Prosiding Pertemuan Ilmiah Ilmu Pengetahuan dan
Teknologi Bahan. 1999. Puslitbang Iptek Bahan – BATAN : 1411-2213. Tawaha K, Alali FQ, Gharaibeh M, Mohammad M, El-Elimat T. 2007.
Antioxidant activity and total phenolic content of selected Jordanian plant
species. J. Foodchem 104: 1372-1378.
Trivadilla. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococcus radiodurans diimobilisasi pada permukaan elektroda pasta karbon dan parameter kinetikanya. [Tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Valdes MG, Perez-Cordoves AI, Diaz-Garcia ME. 2006. Zeolites and zeolite
based materials in analytical chemistry. J Trends Anal Chem 25: 24-30.
Wang J. 2000. Analytical Electrochemistry 2nd Edition, John Wiley & Sons
Publishers. Inc., USA
Wei Di, Ivaska A. 2006. Electrochemical biosensors based on polyaniline. Chem
Anal 51: 839-852.
Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase
Deinococcus radiodurans diimobilisasi pada nanokomposit zeolit alam Indonesia. [Tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yuan WY, Bing T, Yuejin H. 2007. A novel gene of Deinococcus radiodurans
21
Lampiran 1 Bagan alir penelitian
Penumbuhan dan Peremajaan Mikrob
Panen Mikrob
Ekstraksi Protein Sitoplasma
Escherichia coli
Aktivasi Zeolit
Uji Aktivitas
Antioksidan Sel E. coli
dengan penambahan zeolit
Optimasi Aktivitas
Antioksidan Sel E.coli
dan Ekstrak kasar E.
coli
Penentuan Stabilitas Elektrode Pembuatan Elektrode Pasta
Karbon Termodifikasi
23
Lampiran 3 Hasil optimasi bakteri E. coli dengan penambahan zeolit
25
Lampiran 5 Hasil optimasi ekstrak kasar SOD E.coli dengan penambahan zeolit
26
Lampiran 6 Hasil pengukuran optimasi substrat xantina rentang konsentrasi 0.2-1.0 mM
[xantina]
(mM)
Aktivitas Antioksidan
(µA)
0.2 0.5983
0.3 0.7017
0.4 0.7167
0.5 0.6100
0.6 0.8283
0.7 0.8800
0.8 0.8000
0.9 0.8483
27
Lampiran 7 Analisis kinetika dasar optimasi E.coli dengan metode Hanes-Woolf
[xantina]
Metode Lineweaver & Burk
28
Metode Eadie-Hofstee
Kinetika ekstrak kasar SOD E. coli terimobilisasi mengikuti plot Hoones-Wolf:
29
Lampiran 8 Stabilitas aktivitas bakteri E.coli menggunakan [xantina] 0.7 mM
Waktu (jam) Arus (µA) (%)
0 2.9483 100
2 2.8788 97.85
4 1.6261 56.35
6 1.0039 31.33
30
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi, 10 Maret 1991 sebagai anak tunggal dari Ayah H. Zulkarnain Bakri dan Ibu Hj. Sri Hardiyah. Penulis lulus dari SMA N 1 Subang pada tahun 2008 dan diterima melalui jalur PMDK di Institut Pertanian Bogor Departemen Kimia.
Selama masa perkuliahan, penulis pernah menjadi Asisten Praktikum Kimia TPB tahun 2009 dan Asisten Praktikum Kimia Lingkungan tahun 2012. Penulis melakukan praktik lapangan di PT Indofood Sukses Makmur Bogasari Flour Mill
periode 2011/2012 yang berjudul Analisis Mutu By Product Industri Tepung
Terigu (Bran, Industrial Flour, Pollard, dan Pelet) di PT ISM Bogasari Flour
Mills.