Pengembangan Marka Molekular yang Berasosiasi dengan
Karakter Apomiksis dan Kekuatan Dinding Sel Penyusun
Saluran Getah Kuning pada Manggis (
Garcinia mangostana
L.)
RISA ARYANTRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengembangan Marka Molekuler yang Berasosiasi dengan Karakter Apomiksis dan Kekuatan Dinding Sel Penyusun Saluran Getah Kuning pada Manggis (Garcinia mangostana L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Risa Aryantri
NRP G353110121
RINGKASAN
RISA ARYANTRI. Pengembangan Marka Molekuler yang Berasosiasi dengan Karakter Apomiksis dan Kekuatan Dinding Sel Penyusun Saluran Getah Kuning pada Manggis (Garcinia mangostana L.). Dibimbing oleh MIFTAHUDIN dan SOBIR.
Manggis (Garcinia mangostana L.) merupakan salah satu komoditi buah tropis yang menjadi unggulan ekspor Indonesia dan dijuluki sebagai “Queen of Tropical Fruits”. Saat ini terdapat dua isu utama dalam pengembangan tanaman
manggis dan kerabat dekatnya, yaitu sifat apomiksis dan adanya getah kuning pada buah manggis yang disebabkan rusaknya dinding sel penyusun saluran getah kuning, sehingga perlu dilakukan penelitian yang mempelajari aspek apomiksis pada Garcinia dan kekuatan dinding sel penyusun saluran getah kuning pada manggis. Penelitian ini terbagi menjadi dua topik utama, yaitu pengembangan marka molekuler terpaut karakter apomiksis pada Garcinia dan pengembangan marka molekuler terpaut karakter kekuatan dinding sel penyusun saluran getah kuning pada manggis.
Manggis memiliki mekanisme reproduksi apomiksis. Apomiksis merupakan sistem reproduksi yang terjadi secara alami, dimana embrio yang dihasilkan tidak melalui pembelahan miosis ataupun pembuahan ovum. Keturunan dari tanaman apomiksis memiliki konstitusi genetik yang sama dengan induk betinanya. Pada
Garcinia, bentuk apomiksisnya dikenal sebagai embrio edventif yang terbagi menjadi apomiksis obligat dan apomiksis fakultatif. Akan tetapi, identifikasi dan karakterisasi sifat apomiksis pada Garcinia sangat diperlukan dalam proses konservasi dan pemanfaatannya, sehingga perlu dilakukan pengembangan marka molekuler spesifik yang berasosiasi dengan sifat apomiksis sebagai alat yang digunakan dalam identifikasi, karakterisasi dan seleksi plasma nutfah Garcinia.
Bagian pertama dari penelitian ini bertujuan untuk mengembangkan marka molekuler terpaut karakter apomiksis yang dapat digunakan untuk mengetahui hubungan kekerabatan manggis dan kerabat dekatnya. Proses amplifikasi DNA dilakukan dengan menggunakan primer yang telah dikembangkan oleh Ozias akins et al. (1998) berdasarkan sekuen DNA Pennisetum. Primer tersebut digunakan untuk amplifikasi DNA dari 4 spesies Garcinia, yaitu Garcinia mangostana L., G. hambroniana Pierre., G. celebica L. dan G. malacensis T. Anderson. Hasil amplifikasi menunjukkan bahwa dari ke 4 spesies tersebut hanya
Garcinia hambroniana Pierre yang tidak teramplifikasi, sedangkan ketiga spesies lainnya menghasilkan fragmen pita dengan ukuran sama, yaitu ± 480 pb. Hasil analisis BLAST pada NCBI terhadap sekuen DNA dari hasil PCR tersebut menunjukkan tidak ada homologi dengan sekuen DNA dari tanaman lain, sehingga langkah selanjutnya didesain primer berdasarkan Single Nucleotide Polymorphism (SNP dari 3 sekuen pita DNA dari ke 3 spesies (G. mangostana L.,
G. celebica L. dan G. malacensis T. Anderson).
Pada penelitian ini telah didesain dan digunakan 3 set primer, yaitu (1) Apo_Fak1 (forward 5‟ACAATAATCACCACCATACC‟3 dan reverse 5‟GTCT
TTTCCACTTGGGCTGG‟3); (2); Apo_Fak2 (forward 5‟ACAATAATCACC
(forward 5‟ACAATAATCACCACCATACC‟3 dan reverse 5‟TCATTTCCCA
CTTGGGCTGT‟3). Ke tiga set primer tersebut diverifikasi menggunakan 3 spesies acuan (G. mangostana L., G. celebica L. dan G. malacensis T. Anderson) dan hasilnya menunjukkan pita berukuran ± 300 pb pada G. mangostana L. dan
G. celebica L. dan ± 317 pb G. malacensis T. Anderson yang berkaitan dengan sifat apomiksis dari tiap spesies. Dengan menggunakan marka molekuler tersebut 41 spesies Garcinia yang dianalisis dapat dikelompokkan ke dalam 3 kelompok, yaitu 14 spesies apomiksis obligat, 14 spesies apomiksis fakultatif dengan bunga dioecius dan 13 spesies apomiksis fakultatif dengan bunga hermaprodit.
Faktor lainnya yang perlu diperhatikan dalam pengembangan tanaman manggis adalah bagaimana menghilangkan getah kuning pada buah manggis. Getah kuning merupakan masalah utama yang dapat menurunkan kualitas buah manggis yang menyebabkan rasa buah menjadi tidak enak. Struktur saluran getah kuning pada manggis merupakan saluran besar yang dikelilingi oleh sel epitel yang berbentuk seperti kanal dan bercabang. Terdapatnya getah kuning pada buah diperkirakan karena terjadinya kerusakan dinding sel epitel penyusun saluran getah kuning. Pada manggis, getah kuning sering kali terdapat pada aril buah. Metode pemuliaan untuk mendapatkan manggis tidak bergetah sulit dilakukan, karena kerusakan dinding sel sangat dipengaruhi oleh lingkungan. Bagian kedua dari penelitian ini bertujuan untuk mengembangkan marka molekuler terpaut karakter kekuatan dinding sel penyusun saluran getah kuning pada buah manggis. Kekuatan dinding sel penyusun saluran getah kuning sangat berkaitan erat dengan sekresi getah kuning pada buah manggis. Marka molekuler yang terpaut karakter kekuatan dinding sel dapat digunakan untuk mengidentifikasi plasma nutfah manggis yang berpotensi menjafdi tetua yang menghasilkan buah tidak bergetah kuning. Marka ini dapat digunakan dalam proses seleksi keturunan pada program pemuliaan manggis.
Desain primer dilakukan secara tersarang (nested) berdasarkan sekuen gen
Frangile Fiber 1 (FRA 1). Dari 4 kombinasi primer yang digunakan hanya 1 kombinasi primer yang berhasil menghasilkan pita amplifikasi dan dapat membedakan antara sifat manggis bergetah dan tidak bergetah kuning. Pita tersebut disekuen ulang dan digunakan sebagai dasar untuk desain primer yang digunakan untuk mengembangkan marka molekuler terpaut kekuatan dinding sel. Marka molekuler yang berhasil dikembangkan merupakan pita DNA berukuran ± 260 pb, hasil amplifikasi menggunakan kombinasi primer forward 5‟CAA
AGGAATGGGAGCATAAG‟3 and reverse 5‟AGCGGACCACATTTAGAGT G„3. Marka tersebut dinamakan marka kekuatan dinding sel manggis (KDSM). Hasil verifikasi marka molekuler pada 39 aksesi manggis menunjukkan kesesuaian antara keberadaan pita dengan sifat kekuatan dinding sel. Aksesi yang tidak bergetah kuning menghasilkan pita DNA, sedangkan aksesi yang bergetah kuning tidak menghasilkan pita DNA.
Di antara 39 aksesi manggis yang telah dianalisis tersebut, 20 aksesi dengan buah bergetah kuning tidak menghasilkan pita DNA, sedangkan 19 aksesi dengan buah tidak bergetah kuning terbagi menjadi dua, yaitu 16 aksesi menghasilkan pita DNA, sedangkan 3 aksesi manggis lainnya tidak menghasilkan pita DNA.
SUMMARY
RISA ARYANTRI. Molecular Markers Development that is Associated with Apomixis Characters and the Strength of Cell Wall Composed Yellow Latex Secretory Duct on Mangosteen (Garcinia mangostana L.). Supervised by MIFTAHUDIN and SOBIR.
Mangosteen is one of the excellent export fruit commodity from Indonesia and well-known as Queen of Tropical Fruits. There are two current main development issues of mangosteen, which are apomixis and yellow latex secretion from the fruit caused by destruction of epithelial cell that form yellow latex secretory duct. Therefore, a research to study the aspects of apomixis and cell wall strength that form yellow latex secretory duct in mangosteen should be done. This research consisted of two main topics, the development of molecular marker that is associated with the apomixis characters in Garcinia and molecular marker that is associated with the cell wall strength characters that form yellow latex secretory duct in mangosteen.
Mangosteen reproduces through apomixis mechanism. Apomixis is a naturally occurring mode of reproduction that results in embryo formation without the involvement of meiosis or fertilization of the egg. Seed-derived progeny of an apomictic plant is genetically identical to the maternal parent. In Garcinia, apomixis form is called as adventitious embryony, which is divided into obligate and facultative apomixis. Identification and characterization of those apomixis in
Garcinia is important for conservation and utilization of Garcinia members. The development of specific molecular markers that associated with apomixis is necessary. The developed markers can then be used as a tool for identification, characterization and selection of Garcinia germplasms.
The first part of this research aimed to develop molecular markers related to apomixis character. The DNA ampilication was carried out using primer developed by Ozias-akins et al. (1998) based on the sequence of Pennisetum
DNA. The primer was used to amplify DNA from four Garcinia species, i.e. :
Garcinia mangostana L., G. hambroniana Pierre., G. celebica L. and G. malacensis T. Anderson. The result showed that only G. hambroniana Pierre. DNA could be not amplified, while the others showed the ampilication band with the size of ± 480 bp. The BLAST sequence analysis of the PCR frgment showed that there was no homology with other DNA sequences in database. Three set of primers were then designed based on Single Nucleotide Polymorphism (SNP) among three DNA sequences from those three species (G. mangostana L., G. celebica L. and G. malacensis T. Anderson).
celebica L., while a 317 bp produced from G. malacensis T. Anderson. Forty one species of Garcinia can be separated into three groups based on the developed molecular markers. Fourteen species were identified as obligate apomixis, fourteen species were facultative apomixis with dioecius flowers, and the other thirteen species were facultative apomixis with hermaprodit flowers.
Another aspect of mangosteen development that should be considered is how to eliminate yellow latex secretion from mangosteen fruit. Yellow latex is a major problem on mangosteen that could decrease fruit quality. The structure of yellow latex secretory ducts, which consist of big lumen, was surrounded by epithelial cells. The duct is canal-like form and branched. It is suggested that the destruction of epithelial cell that form yellow latex secretory duct caused yellow latex secretion. In mangosteen, yellow latex is often found in fruit aril. Since the yellow latex secretion character in mangosteen is largely influenced by environment, the breeding technique to develop free yellow latex fruit is quite difficult. The objective of the second part in this research was to develop a molecular marker that is associated with the fruit epithelial cell wall strength. The developed molecular marker which linked to cell wall strength character might be useful to identify mangosteen germplasm that potential as parent producing free yellow latex fruit. The marker could also be used in progeny selection in the mangosteen breeding program.
Nested primers were designed based on the Fragile Fiber 1 (FRA 1) gene sequences. Among four developed primer combinations only one primer combination could produce specific band that could discriminate the yellow latex producing plant and free yellow latex plant. The DNA band was resequenced and used to design a new set of primer (forward 5‟CAAAGGAATGG GAGCATAAG‟3 and reverse 5‟AGCG GACCACATTTAGAGTG„3) that was used to develop a molecular marker related to cell wall strength. The molecular marker were named as KDSM. The verification of molecular marker using thirty nine accessions of mangosteen showed close relation between marker KDSM and yellow latex secretion character. In general plants that secreted yellow latex did not have DNA band, while the other one hand a 260 bp DNA band.
Among thirty nine mangosteen accessions, twenty accessions that secreted yellow latex did not produce DNA band, while nineteen accessions that do not secreted yellow latex were divided into two groups. Sixteen accessions produce a 260 bp DNA band and three accessions did not produce DNA band.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Tumbuhan
Pengembangan Marka Molekular yang Berasosiasi denngan
Karakter Apomiksis dan Kekuatan Dinding Sel Penyusun
Saluran Getah Kuning pada Manggis (
Garcinia mangostana
L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Pengembangan Marka Molekuler yang Berasosiasi dengan Karakter Apomiksis dan Kekuatan Dinding Sel Penyusun Saluran Getah Kuning pada Manggis (Garcinia mangostana L.)
Nama : Risa Aryantri NRP : G353110121
Disetujui oleh Komisi Pembimbing
Dr Ir Miftahudin, MSi Ketua
Prof Dr Ir Sobir, MSi Anggota
Diketahui oleh
Ketua Program Studi Biologi Tumbuhan
Dr Ir Miftahudin, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2012 ini ialah karkater apomiksis dan ketahanan getah kuning, dengan judul Pengembangan Marka Molekuler yang Berasosiasi dengan Karakter Apomiksis dan Kekuatan Dinding Sel Penyusun Saluran Getah Kuning pada Manggis (Garcinia manggostana L.).
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Miftahudin, M.Si dan Bapak Prof. Dr. Ir. Sobir, M.Si selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Ibu Sulassih dari Pusat Kajian Hortikultura Tropik IPB Bogor, Ibu Dr. Ellina Mansyah berserta Bapak Wandi, Balai Penelitian Tanaman Buah Tropika Solok, serta Ibu Lina, pembudidaya manggis Desa Leuwiliang, yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 4
Manggis (Garcinia mangostana L.) dan Kerabat Dekatnya (Garcinia
spp.) 4
Apomiksis Garcinia mangostana L. dan Garcinia spp. 5
Getah Kuning (Gamboge Disorder) 5
Marka Molekuler 7
Sequence Tagged Sites (STS) dan Single Nucleotide Polymorphism
(SNP) 7
PENGEMBANGAN MARKA MOLEKULER TERPAUT KARAKTER
APOMIKSIS PADA MANGGIS DAN KERABAT DEKATNYA 8
Abstrak 8
Pendahuluan 9
Bahan dan Metode 9
Waktu dan Tempat 9
Bahan Tanaman 9
Metode 10
Hasil dan Pembahasan 12
Marka Molekuler Terpaut Karakter Apomiksis 12
Isolasi DNA Manggis (Garcinia mangostana L.) dan Kerabat
Dekatnya (Garcinia spp.) 12
Amplifikasi DNA Manggis dan Kerabat Dekatnya dengan Marka
Molekuler 13
Terpaut Karakter Apomiksis 13
Analisis Sekuan DNA dan Pengembangan Marka Molekuler untuk Indentifikasi Karakter Apomiksis pada Manggis dan Kerabat
Dekatnya 14
Verifikasi Marka Molekuler Terpaut Karakter Apomiksis dan
Analisis Data 16
Simpulan 21
PENGEMBANGAN MARKA MOLEKULER TERPAUT KEKUATAN DINDING SEL PENYUSUN SALURAN GETAH KUNING PADA
MANGGIS (Garcinia mangostana L.) 22
DAFTAR ISI (lanjutan)
Pendahuluan 22
Bahan dan Metode 23
Bahan Tanaman 23
Metode 24
Hasil dan Pembahasan 26
Desain Primer untuk Marka Molekuler Terpaut Karakter Kekuatan
Dinding Sel 26
Isolasi DNA Manggis (Garcinia mangostana L.) 28 Amplifikasi DNA Manggis dengan Marka Molekuler Terpaut
Karakter Kekuatan Dinding Sel 28
Analisis Sekuan DNA dan Pengembangan Marka Molekuler untuk
Indentifikasi Karakter Kekuatan Dinding Sel pada Manggis 29 Verifikasi Marka Molekuler Terpaut Kekuatan Dinding Sel dan
Analisis Data 30
Simpulan 31
PEMBAHASAN UMUM 32
SIMPULAN DAN SARAN 33
Simpulan 33
Saran 34
UCAPAN TERIMAKASIH 34
DAFTAR PUSTAKA 34
LAMPIRAN 38
DAFTAR TABEL
1. Sampel 41 spesies manggis dan kerabat dekatnya (Garcinia spp.) 10 2. Marka molekuler spesifik terpaut karakter apomiksis pada Garcinia 16 3. Hasil amplifikasi verifikasi marka molekuler terpaut karakter apomiksis 18
4. Karakter morfologi Garcinia spp. 20
5. Sampel 39 aksesi manggis buah bergetah dan tidak bergetah kuning 24 6. Aksesi tanaman yang digunakan sebagai acuan untuk mengembangkan 26 7. Primer untuk marka molekuler terpaut karakter kekuatan dinding sel 27 8. Kombinasi primer kekuatan dinding sel dengan nested PCRa 28 9. Primer untuk marka molekuler terpaut karakter kekuatan dinding sel dari 30
DAFTAR GAMBAR
1. Diagram alir penelitian pengembangan marka molekuler terpaut apomiksis dan kekuatan dinding sel pada manggis dan kerabat dekat 3 2. Habitus manggis (Garcinia mangostana L.) di kebun manggis
Leuwiliang Bogor 4
3. Getah kuning pada buah manggis. A = Getah kuning pada pericarp
dan B = Getah kuning pada endocarp 6
4. Hasil elektroforesis ektraksi DNA manggis dan kerabat dekatnya. M = 13 5. Hasil elektroforesis amplifikasi DNA manggis dan kerabat dekatnya 14 6. Hasil aligment sekuen DNA terpaut karakter apomiksis. bold =
variasi nukleotida, = primer apomiksis forward dan reverse, Apo_F = Primer apomiksis forward, Apo_1R = Primer apomiksis
reverse 1, Apo_2R = Primer apomiksis reverse 2 dan Apo_3R = Primer
apomiksis reverse 3 15
7. Hasil elektroforesis amplifikasi DNA manggis dan kerabat dekatnya. M = 1 kb, 1 = Garcinia celebica L. (2), 2 = Garcinia malaccensis T. Anderson, 3 = Garcinia mangostana L., Apo_Fak1 = marka molekuler apomiksis fakultatif 1, Apo_Fak2 = marka molekuler apomiksis fakultatif2 dan Apo_Obli = marka molekuler apomiksis obligat 17 8. Hasil aligment sekuen DNA terpaut karakter apomiksis. =
variasi nukleotida pada wilayah primer Apo_2R 19
9. Morfologi bunga dan buah Garcinia. A = bunga dioecius dengan cupat buah memanjang, B = bunga hermaprodit dengan cupat buah tidak memanjang, 1 = Garcinia celebica L. (2), 2 = Garcinia hambroniana
Pierre., 3 = Garcinia megaphylla Verd., 4 = Garcinia porrecta dan 5 =
Garcinia malaccensis T. Anderson 21
10. Urutan basa nukleotida terpaut kekuatan dinding sel (5‟–3‟) hasil seleksi Database Genbank. Hijau = marka molekuler K_1F, ungu = primer K_1R, biru = primer K_2F dan kuning = primer K_2R 27 11. Hasil elektroforesis ektraksi DNA manggis. M = Lamda, 1–3 = DNA
manggis buah tidak bergetah kuning dan 4–5 = DNA manggis buah
bergetah kuning 28
K_2R. M = 1 kb, 1 = DNA satu individu manggis dengan buah bergetah kuning dan 2 = DNA satu individu manggis dengan buah tidak bergetah
kuning 29
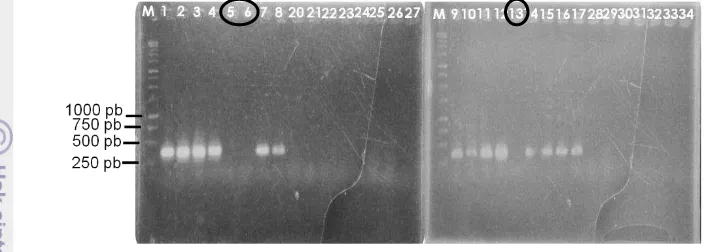
13. Contoh hasil elektroforesis amplifikasi DNA manggis menggunakan marka molekuler KDSM. M = 1 kb, 1–17 = aksesi manggis buah tidak bergetah dan 20–34 = aksesi manggis buah bergetah kuning 31
DAFTAR LAMPIRAN
1. Hasil kromatogram analisis runutan basa DNA Garcinia mangostana L.
forward terpaut karakter apomiksis 38
2. Hasil kromatogram analisis runutan basa DNA Garcinia malacenssis T.
Anderson forward terpaut karakter apomiksis 39
3. Hasil kromatogram analisis runutan basa DNA Garcinia celebica L.
forward terpaut karakter apomiksis 40
4. Hasil kromatogram Garcinia sp forward terpaut karakter kekuatan
dinding sel pada manggis. 41
5. Hasil kromatogram Garcinia megaphylla verd. forward terpaut karakter
kekuatan dinding sel pada manggis. 42
6. Hasil kromatogram Garcinia celebica L. forward terpaut karakter
kekuatan dinding sel pada manggis. 43
7. Desain marka molekuler dari sekuen acuan terpaut kekuatan dinding sel
tanamana 44
8. Hasil kromatogram analisis runutan basa DNA Garcinia mangostana L.
1
PENDAHULUAN
Latar Belakang
Manggis (Garcinia mangostana L.) merupakan salah satu komoditas buah tropik primadona ekspor Indonesia yang sangat disenangi dan diminati pasar internasional sehingga dijuluki “queen of tropical fruits” (Cox 1976). Manggis
bersifat apomiksis obligat (biji berkembang tanpa terjadi fertilisasi) dan berasal dari embrio adventif (Sprecher 1919). Peristiwa apomiksis merupakan pola unik dari pembentukan tanaman, dimana biji yang dihasilkan fertil dan memiliki konstitusi genetik yang sama dengan induk betinanya (Sinaga 2008). Apomiksis pada tanaman Garcinia terbagi menjadi dua, yaitu apomiksis obligat dan apomiksis fakultatif (reproduksi seksual masih dapat terjadi). Pada apomiksis obligat peristiwa seksual dihambat dan embrio terbentuk dari perkembangan sel nuselar dengan inti diploid, sedangkan pada apomiksis fakultatif sel nuselar tertentu mangalami reproduksi seksual dan sel nuselar lainnya mengalami reproduksi aseksual (Koltunow 1993).
Perbedaan dan pengetahuan dasar genetik mengenai sifat apomiksis obligat dan fakultatif pada manggis dan kerabat dekatnya diperlukan dalam analisis kekerabatan serta pengembangan tanaman manggis dan kerabat dekatnya, akan tetapi informasi ini belum banyak dipelajari. Oleh karena itu perlu dilakukan penelitian mengenai dasar genetik sifat apomiksis pada manggis dan kerabat dekatnya, untuk mendukung program pemuliaan (PKBT 2010) dan menambah pemahaman akan hubungan kekerabatan antar aksesi manggis dan kerabat dekatnya yang sangat berpengaruh terhadap peningkatan mutu serta memudahkan menejemen konservasinya (Roldan et al. 2001).
2
Marka molekuler yang berasosiasi dengan sifat apomiksis dan kekuatan dinding sel telah dikembangkan pada penelitian sebelumnya (PKBT 2010 dan Mansyah 2011). Berdasarkan marka molekuler tersebut, penelitian ini bertujuan untuk mendapatkan marka molekuler spesifik terpaut karakter apomiksis yang dapat digunakan dalam analisis kekerabatan manggis dan kerabat dekatnya serta marka molekuler terpaut karakter kekuatan dinding sel penyusun saluran getah kuning pada manggis yang dapat digunakan untuk identifikasi buah manggis yang berpotensi tidak mengeluarkan getah kuning akibat kerusakan dinding sel. Marka molekuler tersebut dikembangkan berdasarkan sekuen DNA dari tanaman manggis dan kerabat dekatnya.
Tujuan Penelitian
Penelitian ini bertujuan untuk: (1) mendapatkan marka molekuler spesifik yang berasosiasi dengan karakter apomiksis untuk analisis kekerabatan Garcinia
dan (2) mendapatkan marka molekuler spesifik yang berasosiasi dengan karakter kekuatan dinding sel pada manggis yang berguna untuk identifikasi buah manggis yang berpotensi tidak mengeluarkan getah kuning.
Manfaat Penelitian
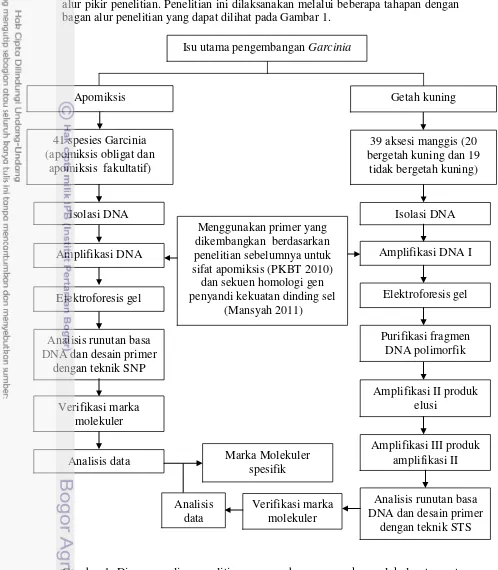
3 Berdasarkan tujuan dan ruang lingkup penelitian yang dilakukan disusun alur pikir penelitian. Penelitian ini dilaksanakan melalui beberapa tahapan dengan bagan alur penelitian yang dapat dilihat pada Gambar 1.
Gambar 1 Diagram alir penelitian pengembangan marka molekuler terpaut apomiksis dan kekuatan dinding sel pada manggis dan kerabat dekat
4
TINJAUAN PUSTAKA
Manggis (Garcinia mangostana L.) dan Kerabat Dekatnya (Garcinia spp.)
Garcinia termasuk ke dalam famili Cluciaseae yang terdiri atas 4 suku, yaitu Clusieae, Garciniaeae, Calophyylleae dan Symphonieae. Garciniaeae terdiri atas genus Ochrocarpos, Marialva, Micranthera dan Garcinia. Pada penelitian ini kami mengembangkan marka molekuler pada Garcinia. Karakter khas dari
Garcinia memiliki getah berwarna putih atau kuning pada seluruh bagian tanaman. Manggis (Garcinia mangostana L.) merupakan tanaman buah tropik dan berdasarkan beberapa penelitian diketahui bahwa manggis berasal dari Indonesia serta kawasan Asia Tenggara. Rhichards (1990), menyatakan bahwa manggis (jumlah kromosom 2n=96) memiliki morfologi intermediet antara dua kerabat dekatnya G. hambroniana Pierre. dan G. malaccensis T. Anderson yang merupakan agamospermy fakultatif dan merupakan hasil persilangan antara G. hombroniana Pierre dengan G. malaccensis T. Anderson. Manggis merupakan pohon hutan tahunan (perennial), dioecious, tinggi 6−20 meter, berbatang lurus
dengan cabang yang simetris (Gambar 2).
Mahkota daun (kanopi) tampak indah menyerupai setengah kerucut. Daunnya lebar dan tebal, tunggal (folium simplex), berhadapan, bentuk oval memanjang (oblongus), mengkilap, kaku dan ujung daun meruncing pendek, tangkainya memeluk pucuk, sehingga pasangan teratas menutupi kuncup terminalnya, dengan ibu tulang daun (midrib) yang berwarna hijau muda (Sunarjono 2000).
Gambar 2 Habitus manggis (Garcinia mangostana L.) di kebun manggis Leuwiliang Bogor
5 masing-masing mempunyai potensi untuk tumbuh. Manggis dan kerabat dekatnya memiliki ciri khusus yaitu seluruh bagian tumbuhan bergetah dan biji bersifat apomiksis (Satuhu 1994).
Apomiksis Garcinia mangostana L. dan Garcinia spp.
Apomiksis (apogami) merupakan bentuk reproduksi aseksual pada tumbuhan melalui biji. Pada apomiksis, kecambah muncul dari biji tetapi bukan berasal dari embrio, namun berasal dari jaringan maternal. Sehingga genetik tumbuhan baru yang muncul akan identik dengan tetua betinanya. Menurut Asker dan Jerling (1992) apomiksis merupakan proses reproduksi aseksual yang terjadi pada ovul tanaman berbunga sebagai struktur yang berkembang melaksanakan fungsi reproduksi seksual. Mekanisme apomiksis pada angiospermae berbeda dengan mekanisme amfiksis, dimana mekanisme amfiksis terjadi secara sporofitik membentuk mikrospora dan megaspore melalui meiosis, kemudian mengalami mitosis membentuk mikrogametofit dan megagametofit. Sedangkan fertilisasi ganda menghasilkan endosperm dan embrio zigotik.
Apomiksis pada Garcinia terbagi menjadi dua, yaitu apomiksis obligat dan apomiksis fakultatif. Pada apomiksis fakultatif proses reproduksi masih dapat terjadi, dimana sel nuselar yang satu mengalami reproduksi seksual dan sel nuselar lainnya mengalami reproduksi aseksual. Apomiksis terjadi secara
nonrecurrent (stabil), embrio haploid terjadi tanpa fertilisasi, maupun secara apomiksis recurrent, embrio terjadi tanpa reduksi mitotik dan fertilisasi, sehingga seluruh genotip maternal diwariskan kepada keturunannya (Sinaga 2008). Saat ini telah telah diperoleh pita-pita marka molekuler polimorfik antara karakter apomiksis dan non apomiksis (PKBT 2010) yang diperoleh dari hasil pengembangan marka SCAR (sequence characterized amplified region) terpaut sifat apomiksis pada Pennisetum squamulatum (Ozias askins et al. 1998) dan selanjutnya akan didesain marka molekuler spesifik karakter apomiksis pada buah manggis.
Getah Kuning (Gamboge Disorder)
6
(aril) sehingga rasa buah menjadi pahit dan tidak layak konsumsi (Gambar 3b). Getah kuning dapat dijumpai pada buah manggis yang masih muda maupun yang telah matang.
Gambar 3 Getah kuning pada buah manggis. A = Getah kuning pada
pericarp dan B = Getah kuning pada endocarp
Getah kuning diproduksi sebagai sistem pertahanan dan bagian dari metabolisme tanaman (Dorly 2009). Getah kuning dapat disebabkan karena tusukan Helopeltis antonii (Sunarjono 2000), peningkatan kadar air tanah secara tiba-tiba setelah mengalami kekeringan, terjadinya benturan, serangan cendawan
Fusarium oxysforum, gangguan serangga dan pada saat buah matang kondisi lingkungan sangat basah (Mansyah 2011). Pengendalian getah kuning dapat dilakukan dengan berbagai cara, yaitu membiarkan rerumputan disekitar tanaman manggis pada saat buah masih muda, pengaturan perairan dan perbaikan drainase kebun serta pemberian kalsium dan boron (Yenisbar 2011).
Getah kuning pada buah manggis juga dapat disebabkan karena rusaknya sel epitel pada saluran getah yang menyebabkan keluarnya getah kuning. Ini dapat terjadi karena perbedaan pertumbuhan antara biji dan aril dengan bagian perikarp buah dan terjadi perubahan tekanan tugor sel akibat fluktuasi kandungan air tanah selama fase perkembangan buah, sehingga dinding sel saluran getah kuning yang tidak kuat akan pecah dan mengeluarkan getah kuning. Lemahnya dinding sel pada buah manggis diperkirakan karena rendahnya mikrofibril selulosa penyusun dinding sel yang disintesis oleh tumbuhan.
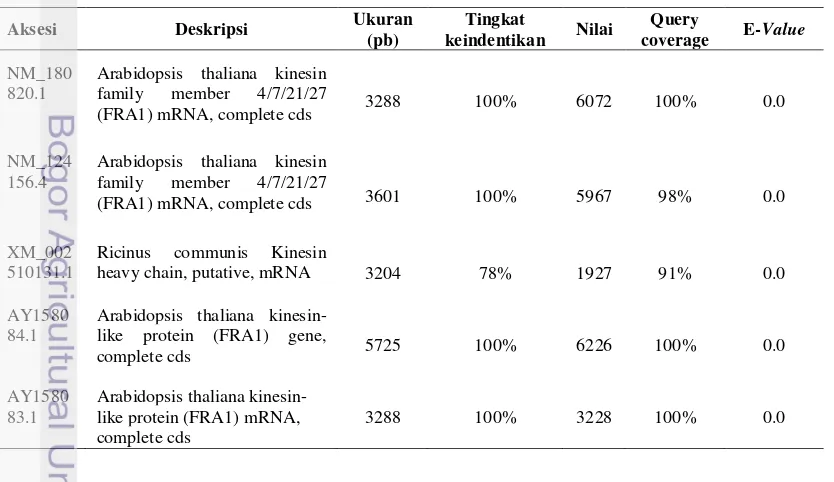
Kekuatan dinding sel (Cell Wall Strength/CWS) saluran getah kuning pada manggis berkaitan dengan penyusunan mikrofibril selulosa pada dinding sel tersebut. Sekuen gen Fragile Fiber 1 (FRA 1) merupakan gen penyandi mikrofibril selulosa penyusun dinding sel. Sehingga pada penelitian ini digunakan sekuen gen FRA 1 untuk menganalisis kekuatan dinding sel pada tanaman manggis yang di ambil dari beberapa tanaman, yaitu Arabidopsis thaliana kinesin-like protein (AY158083.1 dan AY158084.1), A. thaliana microtubule motor
(NM_180820.1 dan NM_124156.4) dan Ricinus communis kinesin heavy chain
(XM_002510131.1) yang selanjutnya akan didesain marka molekuler spesifik karakter kekuatan dinding sel pada buah manggis (Mansyah 2011).
7 Marka Molekuler
Marka molekuler merupakan alat bantu dalam mengidentifikasi genotipe yang dimiliki oleh suatu individu. Pengembangan marka molekuler untuk menyeleksi sifat yang diinginkan dari suatu organisme dapat dilakukan dengan mengidentifikasi marka molekuler yang terpaut dengan karakter tanaman yang dipelajari. Salah satu kelebihan dari metode ini adalah waktu pengujian yang cepat dan tidak dipengaruhi oleh faktor lingkungan. Marka molekuler hanya berguna apabila menghasilkan fragmen pita polimorfik dan terpaut dengan sifat yang akan diamati atau dengan marka molekuler lain, dimana marker molekular yang ideal juga bersifat kodominan, banyak terdapat dalam genom, aksesnya mudah dan memiliki konsistensi tinggi. Syarat polimorfik diperlukan karena penanda genetik harus bisa membedakan individu-individu dalam populasi yang diteliti. Suatu marka harus bisa mengelompokkan individu paling tidak dalam dua kelompok. Syarat terpaut dengan marka, gen atau sifat lain diperlukan karena fungsi marka molekuler adalah sebagai tanda pengenal yang harus melekat pada sifat yang diteliti.
Pengembangan marka molekuler untuk identifikasi buah manggis yang bergetah kuning dan tidak bergetah kuning telah dilakukan pada penelitian sebelumnya (Mansyah 2011), pada 27 aksesi manggis. Hasil penelitian tersebut menunjukkan adanya keterkaitan antara marka molekuler mangosteen cell wall strength (MCWS) dengan penyakit getah kuning pada buah manggis yang dapat digunakan sebagai marka untuk mengidentifikasi getah kuning buah manggis. Akan tetapi marka tersebut belum spesifik untuk sekuen DNA manggis, karena marka yang dikembangkan berdasarkan sekuen-sekuen DNA dari berbagai tanaman. Sehingga perlu dilakukan penelitian ini untuk mendapatkan marka spesifik terkait kekuatan dinding sel yang dikembangkan dari tanaman manggis. Saat ini marka molekuler terpaut karakter apomiksis pada Garcinia belum diidentifakasi, sehingga pada penelitian ini juga dilakukan pengembangan marka molekuler terpaut sifat apomiksis yang dikembangkan dari Garcinia untuk dapat digunakan dalam pengembangan tanaman Garcinia.
Sequence Tagged Sites (STS) dan Single Nucleotide Polymorphism (SNP) Marka STS merupakan marka berbasis PCR (Polymerase Chain Reaction) yang memiliki panjang primer 18-25 nukleotida dan diperoleh melalui hasil sekuensing fragmen gen yang sudah diketahui ukurannya atau berbasis pada informasi sekuen DNA. Primer yang didesain dapat dikembangkan dari fragmen spesifik yang merupakan penciri khusus pada genom organisme. Ini berdasarkan beberapa fragmen spesifik yang diperoleh dari fingerprinting berbasis PCR sebagai penciri karakter yang diinginkan dan dapat dianalisis lebih lanjut, seperti kloning fragmen ke dalam vektor, yang dilanjutkan dengan sekuensing dan desain primer spesifik.
8
bersifat kodominan, mudah diadopsi dan diterima dalam hal otomatisasi, serta menghasilkan amplifikasi yang stabil dan berulang-ulang dengan tipe polimorfik yang dideteksi berdasarkan pertukaran basa (Litbang-Deptan 2011).
Marka SNP merupakan marka molekuler yang berdasarkan variasi satu nukleotida dalam sekuen DNA individu, dimana variasi ini ditunjukkan dari terjadinya perubahan satu nukleotida oleh nukleotida lainnya yang dapat menyebabkan perubahan asam amino sehingga mempengaruhi penyusunan protein yang terbentuk pada individu tersebut. Identifikasi SNP secara langsung dapat dilakukan dengan melakukan sekuensing segmen DNA hasil PCR menggunakan marka molekuler spesifik untuk suatu sifat yang diinginkan dan membandingkan hasil sekuen segmen DNA tersebut sampai teridentifikasinya perbedaan nukleotida antar sekuen individu.
PENGEMBANGAN MARKA MOLEKULER YANG
BERASOSIASI DENGAN KARAKTER APOMIKSIS PADA
MANGGIS DAN KERABAT DEKATNYA
Abstrak
Manggis dan kerabat dekatnya memiliki mekanisme reproduksi apomiksis. Apomiksis merupakan sistem reproduksi yang terjadi secara alami, dimana embrio yang dihasilkan tidak melalui pembelahan miosis ataupun pembuahan ovum. Keturunan dari tanaman apomiksis memiliki konstitusi genetik yang sama dengan induk betinanya. Betuk apomiksis pada manggis dan kerabat dekatnya merupakan apomiksis embrio adventif. Sifat apomiksis pada manggis dan kerabat dekatnya, terdiri atas dua tipe, yaitu apomiksis obligat dan apomiksis fakultatif. Identifikasi dan karakterisasi plasma nutfah manggis dan kerabat dekatnya sangat diperlukan dalam proses konservasi dan peningkatan sumber genetiknya. Penelitian ini bertujuan untuk mengembangan marka molekuler spesifik terpaut karakter apomiksis yang dapat digunakan untuk mempelajari dan memahami mekanisme apomiksis pada manggis dan kerabat dekatnya. Pengembangan marka molekuler dilakukan berdasarkan sekuen DNA 3 spesies Garcinia (Garcinia mangostana L., Garcinia celebica L. dan Garcinia malacensis Hk. F
) yang diperoleh dari hasil amplifikasi menggunakan primer Ozias akins berdasarkan sekuen DNA Pennisetum. Berdasarkan sekuen tersebut dilakukan pengembangan tiga set primer, yaitu Apo_Fak1, Apo_Fak2 dan Apo_Obli.Hasil penelitian menunjukkan bahwa primer yang telah dikembangkan berhasil menghasilkan pita spesifik dengan ukuran ± 300 pb dan ± 317 pb pada masing-masing spesies terpaut karakter apomiksis dan mengelompokkan 41 spesies
Garcinia kedalam 3 kelompok, yaitu 14 spesies apomiksis obligat, 14 spesies apomiksis fakultatif dengan bunga dioecius dan 13 spesies apomiksis fakultatif dengan bunga hermaprodit. Informasi ini dapat digunakan sebagai informasi dasar dalam program pemuliana Garcinia.
9 Pendahuluan
Manggis (Garcinia mangostana L.) dan kerabat dekatnya (Garcinia spp.) merupakan anggota famili Gutiferae atau Cluciaseae. Mekanisme reproduksi pada manggis dan kerabat dekatnya bersifat apomiksis. Peristiwa apomiksis merupakan pola unik dari pembentukan tanaman, dimana biji yang dihasilkan bersifat fertil dan memiliki konstitusi genetik yang sama dengan induk betinanya (Sinaga 2008). Apomiksis pada tanaman Garcinia terbagi menjadi dua, yaitu apomiksis obligat dan apomiksis fakultatif (Sprecher 1919). Manggis bersifat apomiksis obligat (biji berkembang tanpa terjadi fertilisasi) dan berasal dari embrio adventif (Sprecher 1919). Menurut Den Nijs dan Van Dijk (1993) pada reproduksi apomiksis obligat, biji terbentuk tanpa terjadi reduksi jumlah kromosom dan terjadi reproduksi aseksual. Hal ini didukung Mansyah (2002), yang menyatakan bahwa pada berbagai tingkat perkembangan bunga secara visual dengan menggunakan lup pada bunga manggis menunjukkan tidak terlihat adanya serbuk sari. Sedangkan pada apomiksis fakultatif sel nuselar tertentu mangalami reproduksi seksual dan sel nuselar lainnya mengalami reproduksi aseksual (Koltunow 1993). Menurut Nogler (1984) ditemukannya variasi genetik pada tanaman apomiksis fakultatif, disebabkan karena terjadinya reproduksi seksual, sehingga menghasilkan individu yang bervariasi secara genetik dengan jumlah kromosom yang tetap.
Perbedaan dan pengetahuan dasar genetik mengenai sifat apomiksis obligat dan fakultatif pada manggis dan kerabat dekatnya diperlukan dalam analisis kekerabatan serta pengembangan tanaman Garcinia, akan tetapi informasi ini belum banyak dipelajari. Oleh karena itu perlu dilakukan penelitian mengenai dasar genetik sifat apomiksis pada manggis dan kerabat dekatnya, untuk mendukung program pemuliaan (PKBT 2010) dan menambah pemahaman akan hubungan kekerabatan antar aksesi manggis dan kerabat dekatnya yang sangat berpengaruh terhadap peningkatan mutu serta memudahkan menejemen konservasinya (Roldan et al. 2001). Berdasarkan informasi tersebut, penelitian ini bertujuan untuk mendapatkan marka molekuler spesifik terpaut karakter apomiksis yang dapat digunakan dalam analisis kekerabatan manggis dan kerabat dekatnya. Marka molekuler tersebut dikembangkan berdasarkan sekuen DNA dari tanaman manggis dan kerabat dekatnya.
Bahan dan Metode Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Pusat Kajian Hortikultura Tropik (PKHT) Institut Pertanian Bogor Jawa Barat, pada bulan Mei 2012 sampai dengan April 2013.
Bahan Tanaman
10
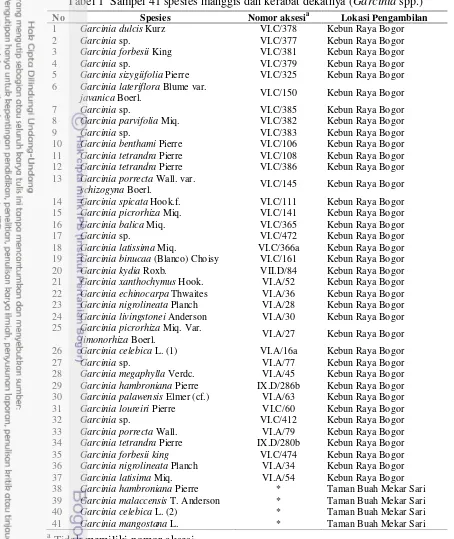
Tabel 1 Sampel 41 spesies manggis dan kerabat dekatnya (Garcinia spp.)
No Spesies Nomor aksesia Lokasi Pengambilan
1 Garcinia dulcis Kurz VI.C/378 Kebun Raya Bogor
2 Garcinia sp. VI.C/377 Kebun Raya Bogor
3 Garcinia forbesii King VI.C/381 Kebun Raya Bogor
4 Garcinia sp. VI.C/379 Kebun Raya Bogor
5 Garcinia sizygiifolia Pierre VI.C/325 Kebun Raya Bogor
6 Garcinia lateriflora Blume var.
javanica Boerl. VI.C/150 Kebun Raya Bogor
7 Garcinia sp. VI.C/385 Kebun Raya Bogor
8 Garcinia parvifolia Miq. VI.C/382 Kebun Raya Bogor
9 Garcinia sp. VI.C/383 Kebun Raya Bogor
10 Garcinia benthami Pierre VI.C/106 Kebun Raya Bogor
11 Garcinia tetrandra Pierre VI.C/108 Kebun Raya Bogor
12 Garcinia tetrandra Pierre VI.C/386 Kebun Raya Bogor
13 Garcinia porrecta Wall. var.
schizogyna Boerl. VI.C/145 Kebun Raya Bogor
14 Garcinia spicata Hook.f. VI.C/111 Kebun Raya Bogor
15 Garcinia picrorhiza Miq. VI.C/141 Kebun Raya Bogor
16 Garcinia balica Miq. VI.C/365 Kebun Raya Bogor
17 Garcinia sp. VI.C/472 Kebun Raya Bogor
18 Garcinia latissima Miq. VI.C/366a Kebun Raya Bogor
19 Garcinia binucaa (Blanco) Choisy VI.C/161 Kebun Raya Bogor
20 Garcinia kydia Roxb. VII.D/84 Kebun Raya Bogor
21 Garcinia xanthochymus Hook. VI.A/52 Kebun Raya Bogor
22 Garcinia echinocarpa Thwaites VI.A/36 Kebun Raya Bogor
23 Garcinia nigrolineata Planch VI.A/28 Kebun Raya Bogor
24 Garcinia livingstonei Anderson VI.A/30 Kebun Raya Bogor
25 Garcinia picrorhiza Miq. Var.
limonorhiza Boerl. VI.A/27 Kebun Raya Bogor
26 Garcinia celebica L. (1) VI.A/16a Kebun Raya Bogor
27 Garcinia sp. VI.A/77 Kebun Raya Bogor
28 Garcinia megaphylla Verdc. VI.A/45 Kebun Raya Bogor
29 Garcinia hambroniana Pierre IX.D/286b Kebun Raya Bogor
30 Garcinia palawensis Elmer (cf.) VI.A/63 Kebun Raya Bogor
31 Garcinia loureiri Pierre VI.C/60 Kebun Raya Bogor
32 Garcinia sp. VI.C/412 Kebun Raya Bogor
33 Garcinia porrecta Wall. VI.A/79 Kebun Raya Bogor
34 Garcinia tetrandra Pierre IX.D/280b Kebun Raya Bogor
35 Garcinia forbesii king VI.C/474 Kebun Raya Bogor
36 Garcinia nigrolineata Planch VI.A/34 Kebun Raya Bogor
37 Garcinia latisima Miq. VI.A/54 Kebun Raya Bogor
38 Garcinia hambroniana Pierre * Taman Buah Mekar Sari
39 Garcinia malaccensis T. Anderson * Taman Buah Mekar Sari
40 Garcinia celebica L. (2) * Taman Buah Mekar Sari
41 Garcinia mangostana L. * Taman Buah Mekar Sari
a
Tidak memiliki nomor aksesi. Metode
11 DNA hasil random amplified polymorphic DNA (RAPD). Marka molekuler terpaut karakter apomiksis yang digunakan pada penelitian ini yaitu, marka molekuler C4 (forward 5‟CCGCATCTACAATAATCA‟3 dan reverse
5‟GAAATAAAGGCACTGGGA‟3).
Isolasi DNA Manggis (Garcinia mangostana L.) dan Kerabat Dekatnya (Garcinia spp.). Isolasi DNA 41 tanaman manggis dan kerabat dekatnya, dilakukan mengikuti metode Doyle dan Doyle (1990) dengan beberapa modifikasi, menggunakan buffer ekstraksi(10% CTAB, 0.5 M EDTA (pH 8.0), 1 M Tris-HCl (pH 8.0), 5 M NaCl dan 1% β-mercaptoethanol) dengan penambahan
polivinilpyrolidon. Potongan daun muda sebanyak 0.15 mg digerus menggunakan mortar dengan menambahkan sekitar 0.6-0.8 ml buffer ekstraksi. Setelah digerus sampai halus, ekstrak daun tersebut dimasukkan ke dalam tabung eppendorf dan diinkubasi pada suhu 65°C selama 1 jam. Proses inkubasi ini dimaksudkan agar proses lisis dinding sel dapat berjalan dengan baik. Setelah diinkubasi, eppendorf
selanjutnya disentrifuse pada 11.000 rpm selama 10 menit setelah ditambahkan CIA (Chloroform:Isoamil Alcohol 24:1 v/v), supernatan diambil dan dipindahkan ke dalam tabung mikro steril 1000 µl baru dengan menambahkan 500 sampai 600 µl 2-propanol dingin dan diinkubasi dalam freezer overnight. Selanjutnya, disentrifuse dan supernatan dibuang. Pelet yang diperoleh dicuci dengan alkohol 70% dan dikering anginkan overnight. Pelet dilarutkan dalam 10 sampai 50 µl TE (1 M Tris-HCl (pH 8.0), 0.5 M EDTA (pH 8.0) dan Aquades).
Skrining Primer. Primer yang telah didesain sebelumnya, selanjutnya dilakukan skrining primer pada sampel tanaman manggis dan kerabat dekatnya yang telah dikoleksi. Skrining primer dilakukan dengan menggunakan mesin PCR (Termocycler Aplied Biosistems 2720 USA) dengan volume reaksi 25 µl (2 µl DNA template (10 ng/μl), masing-masing 1 µl primer (10 ng/μl), 12.5 µl Go Taq Green Master Mix (Promega M7122) dan 9.5 µl air murni). Proses amplifikasi PCR dilakukan sebanyak 35 siklus setelah denaturasi awal pada suhu 94°C selama 4. Setiap siklus terdiri dari denaturasi pada suhu 94°C selama 45 detik, annealing pada suhu 45-65°C selama 30 detik dan pemanjangan fragmen DNA pada suhu 72°C selama 20 detik. Amplifikasi PCR diakhiri dengan dilakukan ektensi pada suhu 72°C selama 10 menit.
Elektroforesis Fragmen DNA Manggis dan Kerabat Dekatnya Hasil PCR. Fragmen DNA hasil amplifikasi di elektroforesis bersama dengan DNA standar 1 kb DNA ladder pada gel agarose 1.2% dalam buffer TBE 1X selama 45 menit pada tegangan 50 volt dan diwarnai dengan 1% ethidium bromide selama 10 menit untuk melihat fragmen DNA manggis yang dihasilkan. Selanjutnya hasil elektroforesis didokumentasikan dan disimpan.
12
karakter apomiksis dari hasil analisis runutan basa DNA. Pengembangan marka molekuler terpaut karakter apomiksis akan dilakukan berdasarkan sekuen manggis dan kerabat dekatnya dengan teknik SNP.
Verifikasi Marka Molekuler. Verifikasi marka molekuler terpaut apomiksis dilakukan pada 41 tanaman manggis dan kerabat dekatnya, terdiri dari spesies yang bersifat apomiksis obligat dan apomiksis fakultatif.
Analisis Data. Analisis data dilakukan secara deskriptif untuk mengeksplorasi hubungan antara karakter variasi genotipe target dan fenotipe yang menunjukkan keterkaitan sifat dengan sekuen yang telah didesain primernya. Hal ini dilakukan dengan menyusun data setiap fragmen DNA hasil amplifikasi, dengan ketentuan tidak ada fragmen dan ada fragmen pada posisi yang sama. Hasil sekuen DNA selanjutnya dilakukan analisis homologi sekuen untuk melihat dan membuktikan bahwa sekuen yang telah dikembangkan merupakan marka molekuler untuk identifikasi karakter apomiksis pada Garcinia dengan menggunakan program Basic Local Alignment Search Tool-Nucleotida (BLAST-N) pada National Center for Biotechnology Information (NCBI) (www.ncbi.nlm.nih.gov).
Hasil dan Pembahasan Marka Molekuler Terpaut Karakter Apomiksis
Marka molekuler terpaut karakter apomiksis yang digunakan pada penelitian ini merupakan marka molekuler yang telah di desain dari penelitian sebelumnya (PKBT 2010), hasil rancangan Ozias akins et al. (1998). Pada penelitian tersebut telah diamplifikasikan beberapa marka molekuler, untuk mengidentifikasi karakter apomiksis pada manggis. Marka molekuler ini merupakan hasil pengembangan sequence characterized amplified region (SCAR) terpaut karakter apomiksis pada Pennisetum (Ozias akins et al. 1998).
Berdasarkan sekuen primer terpaut karakter apomiksis, maka dapat dilakukan skrining PCR. Dimana proses skrining PCR dilakukan untuk menghasilkan fragmen pita spesifik yang berkaitan dengan karakter apomiksis pada Garcinia. Temperatur annealing pada proses skrining PCR dilakukan berdasarkan nukleotida penyusun primer tersebut. Pada penelitian ini, skrining PCR dilakukan pada temperatur annealing 45-65°C dan konsentrasi reaksi PCR yang bervariasi. Sebab keberhasilan proses PCR menghasilkan fragmen pita dipengaruhi reaksi dari masing-masing komponen PCR dan temperatur yang digunakan (Kwok et al. 1994).
Isolasi DNA Manggis (Garcinia mangostana L.) dan Kerabat Dekatnya (Garcinia spp.)
Proses ekstraksi DNA 41 spesies manggis dan kerabat dekatnya dilakukan dengan beberapa modifikasi dari metode Doyle dan Doyle (1990), yaitu menggunakan senyawa CTAB (Cetyl Trimethyl Ammonium Bromide) 10% dengan NaCl 5N (Carmin del Castillo 2006) dan senyawa β-mercaptoethanol
13 dengan baik serta mendapatkan DNA dengan kualitas dan kuantitas yang cukup murni untuk analisis selanjutnya (Nkongolo et al. 1998). Hal ini dilakukan karena daun manggis dan kerabat dekatnya mengandung senyawa metabolit sekunder yang cukup tinggi, yaitu senyawa polifenol yang dapat menghasilkan aktivitas radikal bebas terhadap DNA dan menghambat kerja buffer ekstraksi dalam melisis dinding sel (Sinaga 2008). Tingginya senyawa fenolik pada daun terlihat dari cepatnya proses pencoklatan yang terjadi pada saat daun dipotong (Zainudin et al. 2010).
Proses ektraksi DNA pada penelitian ini juga menggunakan senyawa CIA (Chloroform:Isoamil Alcohol) yang bertujuan untuk menghilangkan sisa-sisa senyawa fenolik, sebab dapat penghambat proses amplifikasi DNA selanjutnya (Harini et al. 2008). Penambahan senyawa CIA tidak dapat mendenaturasi RNA, karena RNA tidak dapat larut didalam pelarut organik. Sehingga pada penelitian ini dilakukan penambahan senyawa RNAse yang bertujuan untuk menghilangkan RNA. Selain itu beberapa spesies kerabat manggis juga mengandung senyawa polisakarida yang tinggi, ini terlihat dari terbentuknya larutan kental pada saat penggerusan daun. Sehingga DNA tidak terisolasi dengan baik karena struktur polisakarida mirip dengan struktur asam nukleat dan dapat mengendap bersamaan dengan asam nukleat (Zainudin et al. 2010). Kesulitan ini dapat diatasi dengan melakukan perendaman hasil penggerusan dengan CTAB dalam waterbath selama semalaman pada suhu 65°C. Sebab senyawa CTAB umum dipakai pada proses ekstraksi sel tanaman yang banyak mengandung senyawa polifenol dan polisakarida (Jose & Usha 2000). Hasil ekstraksi DNA manggis dan kerabat dekatnya (Garcinia spp.) dapat dilihat pada Gambar 4.
Gambar 4 Hasil elektroforesis ektraksi DNA manggis dan kerabat dekatnya. M = DNA Lamda, 1 = Garcinia mangostana L., 2 = Garcinia hambroniana Pierre, 3 = Garcinia celebica L. (2) dan 4 = Garcinia malaccensis T. Anderson
Amplifikasi DNA Manggis dan Kerabat Dekatnya dengan Marka Molekuler Terpaut Karakter Apomiksis
14
fakultatif. Empat spesies acuan tersebut, yaitu G. mangostana L., G. hambroniana
Pierre, G. celebica L. (2) dan G. malaccensis T. Anderson.
Empat spesies Garcinia tersebut digunakan sebagai sekuen acuan untuk mengembangkan marka molekuler terpaut karakter apomiksis, disebabkan karena berdasarkan beberapa penelitian sebelumnya diketahui bahwa G. mangostana L. merupakan tanaman hibrid hasil dari satu kali persilangan antara G. hambroniana
Pierre dan G. malaccensis T. Anderson yang mewarisi sifat apomiksis obligat (Richards 1990). Serta Sulassih (2011), berdasarkan data morfologi dan penanda molekuler ISSR diketahui bahwa G. mangostana L. memiliki tingkat kemiripan yang lebih tinggi dengan G. malaccensis T. Anderson dan G. celebica L.. Hal ini juga didukung oleh penelitian sebelumnya (Sinaga 2008) yang menyatakan bahwa
G. celebica L. menghasilkan fragmen pita isoenzim dan AFLP yang lebih banyak sama dengan G. mangostana L. dibandingkan dengan fragmen pita yang dihasilkan pada G. hambroniana Pierre.
Gambar 5 Hasil elektroforesis amplifikasi DNA manggis dan kerabat dekatnya dengan marka molekuler C4. M = 1 kb, 1 = Garcinia mangostana L., 2 = Garcinia hambroniana Pierre, 3 = Garcinia celebica L. (2) dan 4 = Garcinia malaccensis T. Anderson
Pada Gambar 5 di atas, dapat diketahui bahwa hasil amplifikasi marka molekuler C4 dari ke empat spesies yang digunakan hanya tiga spesies yang menghasilkan fragmen pita dengan ukuran ± 480 pb. Sedangkan satu spesies lainnya, yaitu spesies G. hambroniana Pierre tidak menghasilkan fragmen pita. Hal ini diperkirakan karena karakter apomiksis pada G. hambroniana Pierre memiliki susunan basa DNA yang berbeda dengan primer yang digunakan, sehingga tidak menghasilkan fragmen pita walaupun memiliki sifat apomiksis dan telah dilakukan skrining PCR. Oleh karena itu untuk analisis runutan basa DNA pada penelitian ini selanjutnya hanya ke tiga spesies yang digunakan sebagai spesies acuan untuk mengembangkan marka molekuler terpaut karakter apomiksis, yaitu, G. celebica L. (2) (apomiksis fakultatif), G. malaccensisT. Anderson(apomiksis fakultatif) dan G. mangostana L. (apomiksis obligat).
Analisis Sekuan DNA dan Pengembangan Marka Molekuler untuk Indentifikasi Karakter Apomiksis pada Manggis dan Kerabat Dekatnya
Hasil kromatogram analisis sekuen DNA manggis dan kerabat dekatnya (Lampiran 1, 2 dan 3) selanjutnya dianalisis untuk dapat dilakukan uji homologi pada database GenBank NCBI. Sekuen DNA yang dihasilkan dengan
15 menggunakan marka molekuler terpaut karakter apomiksis pada penelitian ini tidak memiliki kemiripan sekuen DNA database GenBank ketika di uji homologi. Hal ini diperkirakan karena sekuen terpaut karakter apomiksis belum banyak dilaporkan khususnya untuk tanaman manggis (G. mangostana L.) dan kerabat dekatnya (Garcinia spp.).
Hasil analisis sekuen DNA terpaut karakter apomiksis yang telah diperoleh, selanjutnya dilakukan desain primer spesifik untuk membedakan
Garcinia berdasarkan sifat apomiksis yang dimiliki. Desain primer dilakukan dengan melihat variasi nukleotida hasil analisis runutan basa DNA pada tiga spesies acuan (G. celebica L. (2), G. malaccensis T. Anderson dan G. mangostana
L.), yang dikenal dengan istilah single nucleotide polymorphism (SNP). Desain primer dengan teknik SNP telah banyak dilakukan untuk pemetaan genetik, analisis keragaman, identifikasi kultivar dan seleksi karakter tertentu pada tanaman. Variasi nukleotida antar ke tiga spesies Garcinia acuan dapat dilihat terdapat variasi nukleotida terpaut karakter apomiksis antar spesies Garcinia. Desain primer spesifik terpaut karakter apomiksis berdasarkan sekuen DNA ke tiga spesies Garcinia, akan membedakan Garcinia apomiksis obligat dan fakultatif. Pada penelitian ini kami mendesain satu primer forward dan tiga primer
reverse dengan teknik SNP. Primer Apo_1R di desain berdasarkan variasi nukleotida sekuen DNA G. celebica L. (2) yang merupakan apomiksis fakultatif.
G. mangostana L. TCTACAATAA TCACCACCAT ACCAAAACCA ACCACTGCCC CTTATGTAAA [ 50]
G. malaccensis ... ... ... ... ... [ 50]
G. celebica L.(2) ... ... ... ... ... [ 50]
G. mangostana L. CAAAACCCAA GGCCCAACTA ACCCAACCAG CTCCACCAAC CTACAATGAG [100]
G. malaccensis ... ... ... ... ... [100]
G. celebica L.(2) ... ...T.. ... ... T... [100]
G. mangostana L. ACCATCGCCT ACCAATACCC TGAAACAAAT CCAACGACAA CCCAAAGATG [150]
G. malaccensis ... ... ... ... ... [150]
G. celebica L.(2) ... ... ... ... ... [150]
G. mangostana L. CCACCCAGTA ACTACACCAC CTTCAGTTGC TTCCCTCCAT GAAAAGGCTG [200]
G. malaccensis ... ... ... ... ... [200]
G. celebica L.(2) ... ... ... ... ... [200]
G. mangostana L. AATCCCAAGC TGCTTTCCCA AATCCTTCCA AACTAGCCTC AAAACCACCA [250]
G. malaccensis ... ... ... ... ... [250]
G. celebica L.(2) ... ... ... ... ... [250]
G. mangostana L. CCCCTTTTGT ACCGATCCAC CTTGAAGACC AAACCAAAAC GACCACATTC [300]
G. malaccensis ... ... ... ... ... [300]
G. celebica L.(2) ... ... ... ... ... [300]
G. mangostana L. CCAGCCCAAG TGGAAAA-GA CAACTAAGTT GAAGCCTGTC CCGCTATTCT [350]
16
Sedangkan primer Apo_2R di desain berdasarkan sekuen DNA G. malaccensis T. Anderson (apomiksis fakultatif) dan primer Apo_3R berdasarkan sekuen DNA G. mangostana L. yang merupakan apomiksis obligat. Marka molekuler yang telah dikembangkan dapat dilihat pada Tabel 2.
Desain primer berdasarkan variasi nukleotida dilakukan agar primer yang didesain bersifat spesifik, sehingga menempel pada fragmen DNA terpaut karakter apomiksis dan dapat digunakan untuk analisis kekerabatan Garcinia. Hal ini disebabkan karena desain primer dengan teknik SNP memiliki struktur dengan ujung 3‟OH yang bervariasi antar ke tiga spesies Garcinia, sehingga primer tersebut hanya akan mengenali dan menempel secara spesifik pada spesies yang memiliki nukleotida komplementer (Miftahudin 27 Februari 2013, komunikasi pribadi).
Tabel 2 Marka molekuler spesifik terpaut karakter apomiksis pada Garcinia
Marka
molekulera Sekuen primer (5’ –3’)
Suhu
Apo_Obli F = ACAATAATCACCACCATACC
63 300 B
R = GTCTTTTCCACTTGGGCTGG
a
Apo_Fak1: marka molekuler apomiksis fakultatif 1; Apo_Fak2: marka molekuler apomiksis fakultatif 2; Apo_Obli: marka molekuler apomiksis obligat, pb: pasang basa, A1: apomiksis fakultatif dengan bunga dioecious, A2: apomiksis fakultatif dengan bunga hermaprodit, B: apomiksis obligat.
Verifikasi Marka Molekuler Terpaut Karakter Apomiksis dan Analisis Data Primer yang telah di desain, selanjutnya di verifikasi dengan melakukan amplifikasi pada DNA manggis dan kerabat dekatnya. Verifikasi ini dilakukan untuk membuktikan bahwa primer yang telah dikembangkan berfungsi mengenali dan mengamplifikasi sesuai dengan sifat yang dikembangkan. Verifikasi marka molekuler terpaut karakter apomiksis dilakukan pada tiga spesies Garcinia acuan dan pada 41 spesies Garcinia. Verifikasi pada tiga spesies acuan dilakukan untuk membuktikan bahwa primer yang telah dikembangkan, akan menghasilkan fragmen pita yang sesuai. Sedangkan verifikasi pada 41 spesies Garcinia
dilakukan untuk analisis kekerabatan dan mengelompokkan Garcinia berdasarkan sifat apomiksis yang dimiliki. Hasil verifikasi pada tiga spesies acuan (G. celebica
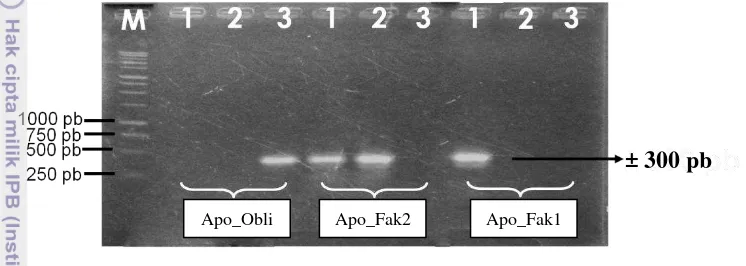
L. (2), G. malaccensis T. Anderson dan G. mangostana L.) dapat dilihat pada Gambar 7.
Pada Gambar 7 dapat diketahui bahwa marka molekuler yang telah dikembangkan menghasilkan fragmen pita DNA yang sesuai dengan rancangan primer, yaitu marka molekuler Apo_Fak1 menghasilkan fragmen pita pada G. celebica L. (2), Apo_Fak2 menghasilkan fragmen pita pada G. malaccensis T. Anderson dan G. celebica L. (2). Sedangkan Apo _Obli menghasilkan pita pada
17 nukleotida yang dimiliki dan komplementer dengan ujung 3‟OH primer tersebut. Oleh karena itu marka molekuler terpaut karakter apomiksis ini dapat digunakan untuk membedakan Garcinia berdasarkan karakter apomiksisnya. Marka molekuler terpaut karakter apomiksis ini selanjutnya dapat digunakan dalam analisis kekerabatan Garcinia dan dapat dikembangkan lebih lanjut untuk pemuliaan tanaman Garcinia. Sebab kemampuan suatu marka molekuler dalam mengelompokan dan membedakan spesies menunjukkan bahwa marka molekuler tersebut dapat digunakan.
Gambar 7 Hasil elektroforesis amplifikasi DNA manggis dan kerabat dekatnya. M = 1 kb, 1 = Garcinia celebica L. (2), 2 = Garcinia malaccensis, 3 =
Garcinia mangostana L., Apo_Fak1 = marka molekuler apomiksis fakultatif 1, Apo_Fak2 = marka molekuler apomiksis fakultatif 2 dan Apo_Obli = marka molekuler apomiksis obligat
Verifikasi pada 41 spesies Garcinia dilakukan untuk menganalisis kekerabatan antar Garcinia, hal ini dilakukan karena analisis kekerabatan dengan menggunakan penanda molekuler terpaut suatu karakter dapat menjelaskan hubungan kekerabatan baik di dalam maupun antar spesies (Hurtado et al. 2002). Menurut Roy et al. (2006), penanda molekuler dari suatu sifat tertentu akan memberikan informasi genetik yang sangat berguna pada tingkatan molekuler untuk analisis kekerabatan suatu individu. Berdasarkan hasil verifikasi pada 41 spesies Garcinia dengan menggunakan marka molekuler terpaut karakter apomiksis, maka dapat dilakukan pengelompokan antar spesies manggis dan kerabat dekatnya berdasarkan karakter apomiksis obligat dan fakultatif.
Fragmen pita yang terbentuk menunjukkan hubungan kekerabatan antar spesies, dimana muncul tidaknya fragmen pita menjelaskan bahwa adanya perbedaan sekuen DNA antar spesies yang dapat dideteksi primer. Suatu primer dapat mengenali dan mengamplifikasi DNA apabila terdapat urutan nukleotida yang homolog dan ada tidaknya variasi genotipe antara sekuen DNA sample dengan marka molekuler (Upadhyay et al. 2004). Hasil verifikasi pada 41 spesies
Garcinia dapat dilihat pada Tabel 3, dimana spesies Garcinia yang menghasilkan fragmen pita dengan menggunakan marka molekuler Apo_Fak1 (primer Apo_F dan Apo_1R) akan dimasukkan kelompok A1 (apomiksis fakultatif dengan bunga dioecious) dan kelompok A2 (apomiksis fakultatif dengan bunga hermaprodit) jika menghasilkan fragmen pita dengan menggunakan marka molekuler Apo_Fak2 (primer Apo_F dan Apo_2R). Sedangkan spesies Garcinia lainnya
± 300 pb
18
yang menghasilkan fragmen pita dengan menggunakan marka molekuler Apo_Obli (primer Apo_F dan Apo_3R) dimasukkan kelompok B (apomiksis obligat).
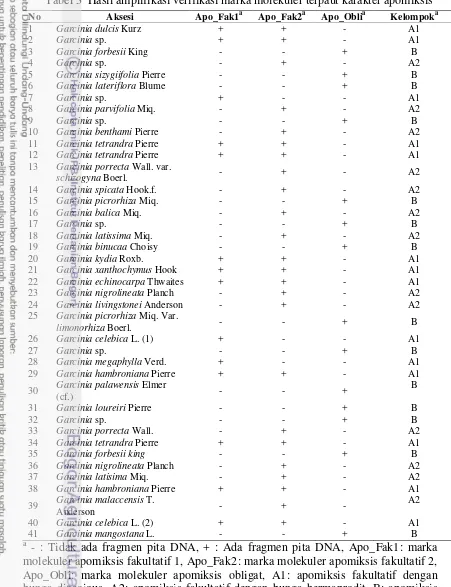
Tabel 3 Hasil amplifikasi verifikasi marka molekuler terpaut karakter apomiksis
No Aksesi Apo_Fak1a Apo_Fak2a Apo_Oblia Kelompoka
13 Garcinia porrecta Wall. var.
schizogyna Boerl. - + - A2
25 Garcinia picrorhiza Miq. Var.
limonorhiza Boerl. - - + B
26 Garcinia celebica L. (1) + - - A1
27 Garcinia sp. - - + B
28 Garcinia megaphylla Verd. + - - A1
29 Garcinia hambroniana Pierre + + - A1
30 Garcinia palawensis Elmer
(cf.) - - +
39 Garcinia malaccensis T.
19 Pada Tabel 3, dapat dilihat bahwa terdapat tiga spesies, yaitu Garcinia sp (spesies no. 7), G. megaphylla Verd. dan G. celebica L. (1) tidak menghasilkan fragmen pita dengan menggunakan marka molekuler Apo_Fak2, tetapi menghasilkan fragmen pita dengan Apo_Fak1. Hal ini diperkirakan karena adanya variasi nukleotida pada wilayah yang komplementer dengan primer Apo_2R, sehingga menyebabkan ke tiga spesies tersebut tidak menghasilkan fragmen pita. Hal ini didukung oleh Hughes dan Richards (1985) yang menyatakan bahwa pada tanaman apomitik kemungkinan untuk terjadinya variasi genetik cukup besar. Selain itu juga Richards (1996), menyatakan bahwa variasi genetik pada tanaman apomitik seperti manggis dan kerabat dekatnya merupakan hal umum yang dapat disebabkan mutasi dan proses rekombinasi somatik karena adanya aktivitas transposon. Untuk memastikan hal ini, maka dilakukan analisis runutan basa DNA ke tiga spesies tersebut (Lampiran 4, 5 dan 6) menggunakan primer Apo_F dan Apo_4R (5‟GAAATAAAGGCACTGGGACG‟3) serta di aligment dengan tiga spesies Garcinia acuan (Gambar 8).
Gambar 8 Hasil aligment sekuen DNA terpaut karakter apomiksis. = variasi nukleotida pada wilayah primer Apo_2R
Hasil aligment di atas menunjukkan bahwa, terdapat variasi nukleotida pada ke tiga spesies Garcinia (Garcinia sp, G. celebica L. (1) dan G. megaphylla
Verd.) dibandingkan dengan sekuen DNA acuan sebelumnya. Hal ini membuktikan bahwa tidak diperolehnya fragmen pita DNA menggunakan primer Apo_2R pada ke tiga spesies disebabkan karena terjadinya variasi nukleotida pada wilayah yang dikenali primer Apo_2R. Sedangkan wilayah desain primer Apo_1R pada ke tiga spesies tidak terdapat variasi nukleotida, sehingga dengan menggunakan primer Apo_1R menghasilkan fragmen pita DNA.
Pada penelitian ini dilakukan pengamatan morfologi dan membandingkan karakter tersebut dengan ke tiga spesies acuan untuk memastikan pengelompokannya (Tabel 4). Dimana pengelompokan dilakukan berdasarkan kemiripan karakter masing-masing spesies Garcinia, karakter yang diamati terdiri atas karakter pohon, daun, bunga dan buah.
Pada Tabel 4, dapat dilihat bahwa pada spesies Garcinia sp tidak memiliki karakter morfologi bunga dan buah. Hal ini disebabkan karena spesies Garcinia sp tersebut baru ditanam (5 tahun) dan belum menghasilkan bunga. Berdasarkan karakter morfologi, maka ke tiga spesies tersebut dikelompokkan ke dalam G. celebica L. dan diperkirakan apomiksis fakultatif. Oleh karena itu dapat disimpulkan bahwa Garcinia yang memiliki karakter apomiksis fakultatif akan menghasilkan fragmen pita DNA dengan menggunakan primer Apo_1R dan/atau Apo_2R. Berdasarkan hasil amplifikasi DNA dengan marka molekuler terpaut karakter apomiksis dan karakter morfologi, maka dapat dilakukan pengelompokan 41 spesies manggis dan kerabat dekatnya ke dalam 3 kelompok besar, yaitu kelompok A1 (14 spesies), A2 (13 spesies) dan B (14 spesies). Dimana Garcinia
G. mangostana L. CCAGCCCAAG TGGAAAA-GA CAACTAAGTT GAAGCCTGTC CCGCTATTCT [308]
G. malaccensis ... ...G...T.. ... ... ... [308]
G. celebica L. A... ...G...T.. ... ... ... [308]
Garcinia sp A... ...AT. ... ... ... [308]
G. megaphylla A... ...G...CC. ... ... ... [308]
20
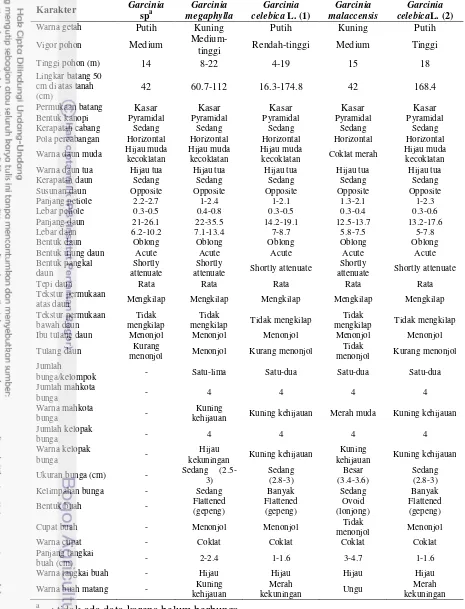
Tabel 4 Karakter morfologi Garcinia spp.
Karakter Garcinia
tinggi Rendah-tinggi Medium Tinggi
Tinggi pohon (m) 14 8-22 4-19 15 18
Lingkar batang 50 cm di atas tanah (cm)
42 60.7-112 16.3-174.8 42 168.4
Permukaan batang Kasar Kasar Kasar Kasar Kasar
Bentuk kanopi Pyramidal Pyramidal Pyramidal Pyramidal Pyramidal
Kerapatan cabang Sedang Sedang Sedang Sedang Sedang
Pola percabangan Horizontal Horizontal Horizontal Horizontal Horizontal
Warna daun muda Hijau muda
kecoklatan
Kerapatan daun Sedang Sedang Sedang Sedang Sedang
Susunan daun Opposite Opposite Opposite Opposite Opposite
Panjang petiole 2.2-2.7 1-2.4 1-2.1 1.3-2.1 1-2.3
Lebar petiole 0.3-0.5 0.4-0.8 0.3-0.5 0.3-0.4 0.3-0.6
Panjang daun 21-26.1 22-35.5 14.2-19.1 12.5-13.7 13.2-17.6
Lebar daun 6.2-10.2 7.1-13.4 7-8.7 5.8-7.5 5-7.8
Bentuk daun Oblong Oblong Oblong Oblong Oblong
Bentuk ujung daun Acute Acute Acute Acute Acute
atas daun Mengkilap Mengkilap Mengkilap Mengkilap Mengkilap
Tekstur permukaan
Ibu tulang daun Menonjol Menonjol Menonjol Menonjol Menonjol
Tulang daun Kurang
menonjol Menonjol Kurang menonjol
Tidak
menonjol Kurang menonjol
Jumlah
bunga/kelompok - Satu-lima Satu-dua Satu-dua Satu-dua
Jumlah mahkota
bunga - 4 4 4 4
Warna mahkota
bunga -
Kuning
kehijauan Kuning kehijauan Merah muda Kuning kehijauan
Jumlah kelopak
Kelimpahan bunga - Sedang Banyak Sedang Banyak
Bentuk buah - Flattened