PENGGUNAAN KULTUR STARTER UNTUK
MENGHAMBAT PERTUMBUHAN
Aspergillus flavus
dan
MEREDUKSI AFLATOKSIN SELAMA FERMENTASI GRITS
JAGUNG
MELINA SARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Penggunaan Kultur Starter untuk Menghambat Pertumbuhan Aspergillus flavus dan Mereduksi Aflatoksin Selama Fermentasi Grits Jagung adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
Melina Sari
ABSTRACT
MELINA SARI. Use of starter culture to inhibit the growth Aspergillus flavus and reduce aflatoxin during maize fermentation. Under the direction of HARSI D. KUSUMANINGRUM, RATIH DEWANTI- HARIYADI and NUR RICHANA
Aflatoxin is a human carcinogen produced as a secondary metabolite by Aspergillus flavus that frequently contaminates maize. Previous research indicated that spontaneous fermentation of maize grits can improve the quality of maize flour. This research aimed to develop starter cultures from indigenous microorganism isolated from spontaneous fermentation of maize and use them to improve the easiness of grinding as well as to inhibit the growth Aspergillus flavus and reduce aflatoxin during fermentation of local white corn grits varieties Pulut. The starter culture were developed using an amylolyitic Candida famata and a non amylolytic Lactobacillus plantarum found troughout corn spontaneous fermentation. Use of the starter culture for maize fermentation increased the percentage of fine flour as compared to that without fermentation. However the percentage of fine flour is similar to spontaneous fermentation. Fermentation for 72 h using mixed starter culture of L. plantarum and Candida famata resulted in the highest fine maize flour percentage (39.31%) during milling for 2 min. Single starter culture L. plantarum inhibited the growth of Aspergillus flavus the fastest after fermentation. The number of Aspergillus flavus declined for 1 log cfu/ml during 48 h fermentation. In addition, the highest reduction of aflatoxin was demonstrated by single starter culture L. plantarum. Fermentation for 72 h can reduce aflatoxin until 87.83%.
RINGKASAN
MELINA SARI. Penggunaan Kultur Starter untuk Menghambat Pertumbuhan Aspergillus Flavus dan Mereduksi Aflatoksin Selama Fermentasi Grits Jagung. Dibimbing oleh HARSI D. KUSUMANINGRUM, RATIH DEWANTI-HARIYADI and NUR RICHANA
Pembuatan tepung dari jagung putih lokal varietas Pulut mengalami kendala dikarenakan sifat endosperm jagung yang keras, sehingga secara tradisional masyarakat telah melakukan perendaman untuk mempermudah penggilingan. Disamping itu tingginya kandungan aflatoksin yang ada pada jagung menjadi permasalahan utama di Indonesia bahkan di dunia. Tujuan penelitian ini adalah mengembangkan kultur starter dari mikroorganisme indigenus yang tumbuh selama fermentasi spontan grits jagung untuk mengetahui pengaruhnya terhadap penghambatan Aspergillus flavus dan aflatoksin selama proses fermentasi grits jagung putih lokal varietas Pulut serta kemudahan penggilingan grits jagung menjadi tepung.
Penelitian ini dilakukan secara bertahap. Pada tahap awal penelitian dilakukan penyusunan formula kultur starter dari mikroorganisme indigenus yang berasal dari fermentasi grits jagung spontan. Pada tahap kedua dilakukan pengujian kemampuan formula kultur starter dalam menghambat pertumbuhan
Aspergillus flavus sp BCC F0219 serta mereduksi aflatoksin B1pada grits jagung selama fermentasi terkendali. Pada tahap ketiga dilakukan pengujian pengaruh formula kultur starter pada fermentasi terkendali grits jagung terhadap pertumbuhan mikroflora selama fermentasi grits jagung dan kemudahan penggilingan grits jagung.
Isolat yang digunakan dalam formula kultur starter adalah C. famata dan
L. plantarum dengan beberapa pertimbangan antara lain (1) Isolat kapang hasil isolasi belum teridentifikasi spesiesnya pada saat penelitian dilakukan (2) Pada fermentasi spontan, dari isolat BAL dan khamir hanya khamir C. famata yang bersifat amilolitik 3) Pertumbuhan L. plantarum selama fermentasi spontan meningkat tajam dari 2 log pada 4 jam fermentasi hingga 8,5 log pada 12 jam fermentasi. Hal ini menunjukkan bahwa L. plantarum pada 4-12 jam fermentasi berada pada fase log 4) Candida famata yang bersifat amilolitik dapat membantu pemecahan pati jagung, sehingga dapat dimanfaatkan oleh L. plantarum dan pertumbuhannya akan lebih cepat.
Susunan formula yang dibuat yaitu : (S1) L. plantarum yang ditambahkan pada awal fermentasi; (S2) L. plantarum + C. famata yang ditambahkan bersamaan pada awal fermentasi; dan (S3) C. famata yang ditambahkan pada awal fermentasi dan L. plantarum yang di tambahkan pada 12 jam fermentasi. Jumlah kultur starter yang ditambahkan untuk masing-masing isolat L. plantarum dan
Candida famata sebanyak 106 sel/gram grits jagung. Jumlah spora Aspergillus flavus BCC F0219 yang digunakan untuk mengkontaminasi grits jagung sebanyak 106 spora/gram grits jagung, dan jumlah ekstrak aflatoksin yang digunakan untuk mengkontaminasi grits jagung sebesar 64.30 ppb.
flavus. Formula kultur starter paling baik yang dapat digunakan dalam penghambatan Aspergillus flavus BCC F0219 selama fermentasi grits jagung adalah penggunaan kultur tunggal Lactobacillus plantarum (S1) dengan waktu penghambatan paling cepat yaitu 48 jam pasca inokulasi. Penggunaan formula kultur campuran dan ko-kultur (Candida famata + L. plantarum) juga dapat menghambat, namun membutuhkan waktu yang lebih lama.
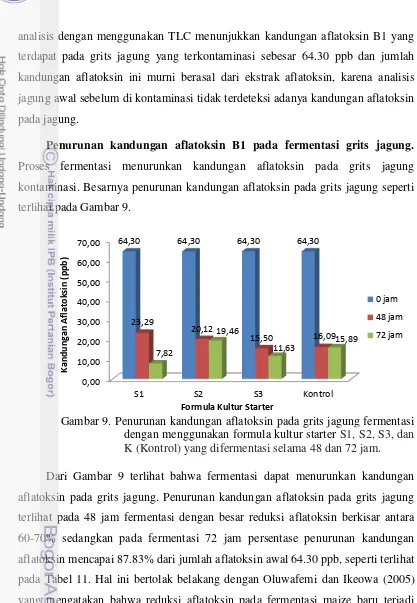
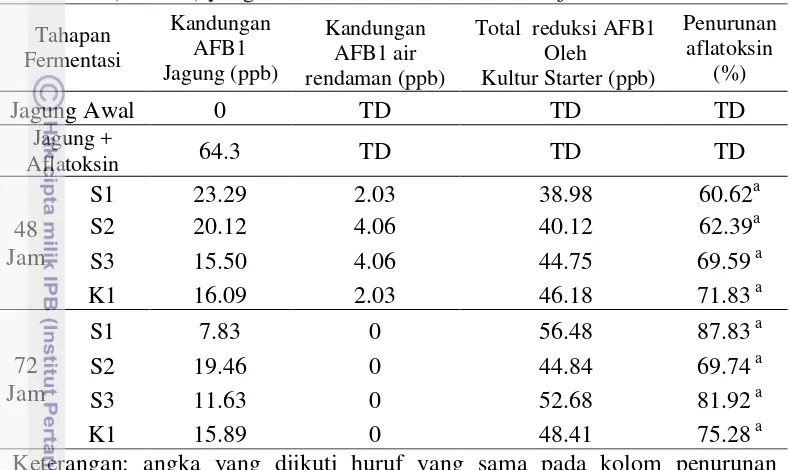
Penggunaan fermentasi spontan untuk mereduksi aflatoksin pada grits jagung dapat dilakukan, jika aflatoksin yang ada pada grits jagung dalam jumlah kecil kurang dari 64.30 ppb. Reduksi aflatoksin sudah terlihat pada 48 jam fermentasi, namun tidak sebesar reduksi setelah 72 jam fermentasi. Setelah 72 jam fermentasi, reduksi aflatoksin tertinggi ditunjukkan oleh formula kultur starter tunggal Lactobacillus plantarum (S1) dari 64.30 ppb turun menjadi 7.83 ppb (87.83%).
Lama waktu fermentasi grits jagung dapat mempengaruhi pH tepung dan jumlah tepung halus yang dihasilkan pada proses penggilingan. Semakin lama fermentasi semakin rendah pH tepung serta meningkatkan jumlah tepung halus yang dihasilkan dengan satu kali penggilingan. Formula kultur starter dan waktu yang paling baik dalam menghasilkan jumlah tepung halus paling tinggi yaitu formula S2 (L. plantarum+C. famata) pada 72 jam fermentasi.
Selama fermentasi berlangsung, pertumbuhan BAL meningkat secara signifikan baik dengan penambahan kultur starter maupun kontrol, sedangkan khamir cenderung menurun. Fermentasi menggunakan formula kultur starter selama 48 jam menurunkan jumlah khamir dari jumlah awal fermentasi dan mengalami sedikit kenaikan pada fermentasi selama 72 jam sedangkan pada Kontrol pertumbuhan khamir menurun hingga fermentasi 72 jam.
Fermentasi terkendali dengan menggunakan kultur starter dapat meningkatkan proporsi tepung dengan partikel halus yang lolos pada ayakan 100 mesh dengan pengayakan bertingkat selama 2 menit. Proporsi tepung dengan partikel halus terbanyak diperoleh setelah grits jagung difermentasi selama 72 jam dengan menggunakan kultur starter kultur campuran L. plantarum dan Candida famata (S2) (39.31%). Jumlah tepung halus yang dihasilkan menggunakan formula kultur campuran L. plantarum dan Candida famata (S2) menunjukkan
perbedaan yang signifikan (α<0.05) dan hampir mencapai dua kali lipat
dibandingkan dengan tepung tanpa difermentasi. Formula kultur yang menghasilkan tepung jagung lebih banyak pada ayakan 100 mesh selanjutnya adalah S1 sebesar 32.11%, namun jumlah ini tidak berbeda secara signifikan
(α>0.05) dibandingkan dengan tepung yang tidak difermentasi.
©
Hak cipta milik IPB, tahun 2012
Hak cipta dilindungi undang-undang
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber
a.
Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan,
penulisan kritik, atau tinjauan suatu masalah
b.
Pengutipan tidak merugikan kepentingan yang wajar IPB
2.
Dilarang mengumumkan dan memperbanyak sebagian atau
PENGGUNAAN KULTUR STARTER UNTUK
MENGHAMBAT PERTUMBUHAN
Aspergillus flavus
dan
MEREDUKSI AFLATOKSIN SELAMA FERMENTASI GRITS
JAGUNG
MELINA SARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Penggunaan Kultur Starter Untuk Menghambat Pertumbuhan Aspergillus flavus dan Mereduksi Aflatoksin Selama Fermentasi Grits Jagung
Nama : Melina Sari
NIM : F251090161
Disetujui Komisi Pembimbing
Dr. Ir. Harsi D. Kusumaningrum Ketua
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Anggota
Dr. Ir. Nur Richana, M.Si Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana IPB
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas berkat dan rahmat-Nya jualah penulis dapat menyelesaikan karya ilmiah yang
berjudul “Penggunaan Kultur Starter Untuk Menghambat Pertumbuhan
Aspergillus flavus dan Mereduksi Aflatoksin Selama Fermentasi Grits Jagung”. Penelitian dan penulisan tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Pangan, di Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terima kasih yang tulus kepada Dr. Ir .Harsi D. Kusumaningrum, Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc dan Dr. Ir. Nur Richana, M.Si selaku dosen pembimbing yang telah banyak meluangkan waktu untuk berdiskusi, memberikan arahan, bimbingan, masukan dan saran selama pelaksanaan penelitian dan penulisan karya ilmiah ini sehingga dapat menambah ilmu pengetahuan dan wawasan pada penulis. Terima kasih kepada Staf Pengajar di lingkungan Program Studi Ilmu Pangan yang telah memberikan ilmu dan pengalaman selama penulis menempuh pendidikan di IPB
Ucapan terima kasih juga disampaikan kepada Badan Penelitian dan Pengembangan Pertanian atas bantuan biaya penelitian yang diberikan kepada Tim Peneliti Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc melalui Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) tahun 2011 yang telah mendanai penelitian penulis.
Kepada Ayahanda Maas Jama dan ibunda Yulimar, penulis menyampaikan ungkapan rasa hormat, terima kasih yang mendalam atas didikan, doa, dorongan dan motivasi serta terima kasih juga kepada seluruh keluarga besar atas segala doa, motivasi, dan semangat yang telah diberikan.
Terima kasih juga penulis ucapakan kepada Staf laboratorium SEAFAST Center IPB Mba Ari, Mas Yerris, Bu Entin (Alm), Pak Taufik, Bu Sari, Pak Jun, Pak Deni, Pak Abah, atas bantuannya selama pelaksanaan penelitian, dan juga kepada Mba Mar yang telah memberikan kemudahan dalam menyelesaikan kelengkapan administrasi. Staf laboratorium Seameo Biotrop Service Laboratory ibu Santi, ibu Ely dan mba Neng yang telah memberikan bantuannya selama penulis berada di lab. Sahabatku Yandi, Hurriyah, Anna, Zulya yang selalu ada disaat penulis membutuhkan semangat, dukungan, tempat berbagi disaat suka dan duka. Teman-teman seperjuangan di IPN Riyanti, Tina, kak Wanny, Hermawan, Fenny, Mbak Wida, Rani, Rangga, Dede, mba Vanessa, Dian, Kiki, Kak Lina, Bu Tanti, Bu Indah, Pak Supriyadi, Bang Nandi, Pak Ikhsan, Kak Cicoy, Bu Rahma, Ni Fahma, mba Ria, Rion, Melinda terima kasih atas kebersamaannya selama ini. Keluarga Bpk Hj. Rahmat, Ibu, Teh Ika, Teh Iis, dd’ Fauzan yang telah memberikan kehangatan keluarga selama penulis berada di Bogor.
Terakhir penulis memohon maaf, apabila dalam penulisan karya ilmiah ini masih jauh dari kesempurnaan. Penulis masih mengharapkan kritik dan saran dari pembaca. Semoga karya ilmiah ini bermanfaat untuk kita semua.
Bogor, Juli 2012
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... xxiii
DAFTAR LAMPIRAN ... xxv
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah... ... 3
Tujuan Penelitian ... 4
Lingkup Penelitian ... 4
Hipotesis.. ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA Jagung ... 5
Tepung Jagung ... 7
Fermentasi Spontan Pada Proses Pengolahan Tepung Jagung ... 10
Aspergillus flavus dan Aflatoksin ... 13
Aflatoksin pada Jagung ... 16
Pengendalian Aflatoksin ... 18
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 21
Bahan dan Alat ... 21
Metode Penelitian ... 22
Metode Analisis ... 29
Analisis Statisttik ... 33
HASIL DAN PEMBAHASAN Pengembangan Kultur Starter ... 35
a. Kandidat Isolat Formula Kultur.. ... 35
b. Penyusunan Formula Kultur Starter ... 35
c. Konfirmasi Isolat ... 36
Pengaruh Penggunaan Formula Kultur Starter Terhadap Aspergillus flavus dan Aflatoksin ... 38
b. Penurunan Aflatoksin B1Selama Fermentasi Terkendali Grits Jagung Putih Varietas pulut... 41 Pertumbuhan Mikroflora Selama Fermentasi Grits Jagung
Dengan Menggunakan Formula Kultur Starter ... 46 Pengaruh Penggunaan Formula Kultur Sarter Terhadap
Kemudahan Penggilingan Grits Jagung dan Tepung yang dihasilkan .. 51 a. Kemudahan Penggilingan Grits Jagung Pada Produksi Tepung ... 51 b. Nilai pH dan Derajat Asam Tepung ... 53 KESIMPULAN DAN SARAN ... 57 DAFTAR PUSTAKA ... 59
DAFTAR TABEL
Halaman
1 Kandungan amilosa/amilopektin biji jagung dari beberapa varietas. ... 6
2 Komposisi kimia jagung putih dan kuning (basis kering) ... 7
3 Komposisi kimia (%) berbagai tipe jagung lokal ... 7
4 Syarat mutu tepung jagung berdasarkan SNI 01-3727-1995... 8
5 Penelitian proses fermentasi pembuatan tepung jagung dan umbi... 12
6 Kandungan aflatoksin pada jagung dan produknya di beberapa daerah di Indonesia... 17
7 Cemaran kapang dan Aspergillus flavus pada jagung di beberapa daerah di Indonesia... 18
8 Formulasi kultur starter yang digunakan... 24
9 Susunan formula kultur starter... . 36
10 Karakteristik mikroorganisme yang digunakan pada formulasi... 36
11 Penurunan kandungan aflatoksin pada grits jagung yang di fermentasi menggunakan formula kultur starter S1, S2, S3, dan K (Kontrol) yang difermentasi selama 48 dan 72 jam... . 44
12 Pertumbuhan BAL dan khamir (log koloni/ml) selama fermentasi grits jagung menggunakan formula kultur starter S1, S2, S3, dan K (Kontrol) yang difermentasi selama 48 dan 72 jam... 49
DAFTAR GAMBAR
Halaman 1 Bagian-bagian dari permukaan biji kernel jagung ... 9 2 Rumus struktur aflatoksin ... 15 3 Diagram alir tahapan penelitian ... 23 4 Proses fermentasi grits jagung terkontaminasi dengan formula kultur
Starter ... 26 5 Prose pembuatan tepung jagung dengan fermentasi menggunakan
Kultur starter... ... 28 6 Pembentukan zona bening disekitar sel khamir Candida famata ... 37 7 Identifikasi L.plantarum (A) Gram Positif, (B) Katalase Negatif),
(C) Penampakan L. plantarum pada media yang mengandung
CaCO3 0,5% ditandai dengan membentuk zona bening. ... 38
8 Penurunan jumlah Aspergillus flavus pada fermentasi grits
jagung menggunakan formula kultur starterS1, S2, S3, dan K (Kontrol) yang difermentasi selama 48 dan 72 jam... 39
9 Penurunan kandungan aflatoksin pada grits jagung fermentasi
dengan menggunakan formula kultur starter S1, S2, S3, dan K (Kontrol) yang difermentasi selama 48 dan 72 jam... 42
10 Pertumbuhan koloni BAL dan khamir pada fermentasi grits jagung menggunakan formula kultur starter S1(A), Formula kultur Starter S2 (B), formula kultur starter S3 (C) dan kontrol (D)
yang difermentasi selama 48 dan 72 jam... 47 11 Perubahan nilai pH air rendaman grits jagung fermentasi
menggunakan formula kultur starter S1, S2, S3 dan K (Kontrol) selama 0, 48, dan 72 jam fermentasi... 49 12 Persentase sebaran tepung hasil fermentasi pada berbagai tingkat waktu yang berbeda menggunakan formula kultur starter S1 (L. plantarum ), S2 (L. plantarum + C. famata), S3 (C. famata + L. plantarum), dan K (Kontrol) serta TP (Tanpa Fermentasi) dengan satu kali
penggilingan... 51
13 Perubahan nilai pH tepung jagung hasil fermentasi menggunakan formula kultur starter S1, S2, S3 dan K (Kontrol) selama 0, 48,
14 Derajat asam tepung jagung hasil fermentasi menggunakan formula kultur starter S1, S2, S3 dan K (Kontrol) selama 0, 48, dan
DAFTAR LAMPIRAN
Halaman 1 Hasil uji konfirmasi ulang ... 73 2 Analisis statistik pertumbuhan L. plantarum... 75 3 Analisis statistik pertumbuhan Aspergillus flavus... 76 4 Analisis statistik pertumbuhan C. famata... 77 5 Analisis statistik pH air rendaman ... 78 6 Analisis statistik derajat asam tepung ... 79 7 Analisis statistik Aflatoksin ... 80 8 Analisis statistik rendemen tepung dengan ukuran partikel < 60 mesh ... 81
Latar Belakang
Jagung (Zea mays L.) merupakan salah satu tanaman pangan sumber karbohidrat selain gandum, padi dan umbi-umbian. Di Indonesia produksi jagung sebagai bahan pangan pokok berada di urutan ketiga setelah padi dan ubi kayu. Produksi jagung nasional selama lima tahun terakhir menunjukkan kecenderungan meningkat dari sebesar 11 609 463 ton pada tahun 2006, 13 287 527 ton pada tahun 2007, 16 317 252 ton pada tahun 2008, 17 041 215 ton pada tahun 2009 dan menjadi 18 016 537 ton pada tahun 2010 (BPS 2010). Peningkatan produksi jagung juga diikuti dengan meningkatnya konsumsi (benih, pakan, konsumsi langsung, tercecer/susut, dan produk olahan) jagung dari tahun ke tahun sebesar 12 264 385 ton pada tahun 2005, 12 504 949 ton pada tahun 2006, 13 217 244 ton pada tahun 2007, 14 659 525 ton pada tahun 2008 dan 15 680 459 ton pada tahun 2009 (Purna & Hamidi 2010).
Jagung yang baru dipanen mempunyai kadar air tinggi sekitar 30%. Sauer (1986) mengatakan kadar air jagung yang melebihi 16% dengan kelembaban udara lebih dari 85% selama masa penyimpanan memberikan kesempatan pada
Aspergillus flavus untuk berkembang dan menghasilkan aflatoksin. Aflatoksin merupakan masalah keamanan jagung diseluruh dunia, termasuk Indonesia. Aflatoksin B1 dikenal sebagai aflatoksin yang paling bersifat karsinogen terhadap mamalia (Cary et al. 2000).
Peraturan tentang batasan maksimum aflatoksin dalam produk pangan dituangkan dalam SNI 7385:2009 mengenai Batasan Maksimum Kandungan Mikotoksin Dalam Pangan yang menyebutkan bahwa batas maksimum kandungan aflatoksin B1 (AFB1) pada jagung dan produk olahannya adalah 20 ppb (BSN 2009). Sementara itu berdasarkan SK Badan POM ditetapkan batas maksimal cemaran aflatoksin B1 pada produk dan olahan jagung adalah 15 ppb dengan batas maksimum total aflatoksin adalah 20 ppb. Namun demikian pada kenyataannya, data yang ada menunjukkan bahwa komoditi pertanian Indonesia masih mangandung cemaran aflatoksin lebih tinggi (> 20 ppb) (Bahri et al. 2005; Ali et al. 1998; Rahayu 2008; Tangendjaja et al. 2008; Kusumaningrum et al.
Salah satu jenis jagung varietas lokal yang berasal dari Sulawesi Selatan dan sedang dikembangkan di Indonesia adalah jagung putih varietas Pulut. Menurut the Ohio State University Extension (2010), jagung pulut (waxy corn) adalah jagung dengan jumlah kandungan amilopektin yang tinggi mendekati 100% sedangkan jagung normal mengandung amilopektin 75% dan 25% amilosa. Sifat lilin (waxy) jagung pulut dikendalikan oleh gen resesif tunggal, gen wx. Weatherwax (1922) menyatakan bahwa jagung pulut (waxy corn) memiliki endosperm yang keras seperti tipe flint corn. Pengolahan produk jagung pulut saat ini di Sulawesi Selatan baru sebatas pengganti makan pokok seperti binte, baro’bo, marning, jagung rebus dan jagung bakar (Syuryawati et al. 2010). Oleh karena itu perlu dilakukan upaya untuk dapat meningkatkan nilai ekonomi dari jagung pulut, misalnya dengan mengolah jagung menjadi tepung jagung.
Tepung jagung bersifat fleksibel karena dapat digunakan sebagai bahan baku berbagai produk pangan. Pengolahan jagung menjadi produk tepung telah banyak dilakukan diantaranya sebagai tepung komposit (terigu, ubi kayu dan jagung) dalam pembuatan mi (Yulmar et al. 1997), pengolahan jagung sebagai bahan baku dalam bentuk tepung komposit (Susila & Resmisari 2005), serta Suarni (2009) juga melakukan pengkajian terhadap prospek pemanfaatan tepung jagung untuk kue kering (cookies).
Secara umum terdapat dua jenis metode penepungan yang sering diterapkan dalam produksi tepung yaitu metode basah dan metode kering. Pada metode basah dilakukan perendaman bahan terlebih dahulu sebelum ditepungkan, sedangkan metode kering tidak dilakukan perendaman (Suardi et al. 2002). Upaya peningkatan kualitas tepung yang telah dilakukan yaitu dengan melakukan penambahan enzim atau fermentasi dengan menggunakan ragi tape pada proses penepungan. Tepung yang dihasilkan mengalami perubahan sifat fisikokimia dan fungsionalnya, yaitu kadar amilosa dan derajat polimerisasi menurun, sedangkan gula reduksi dan dekstrosa ekuivalen meningkat (BB-Pascapanen 2010). Selain itu tekstur tepung jagung yang dihasilkan lebih halus dibanding tepung aslinya.
beberapa sifat fisik, kimia dan fungsional dari tepung yang dihasilkan. Aini (2009) juga menyarankan untuk mengetahui jenis mikroorganisme yang tumbuh dominan selama fermentasi sehingga pertumbuhan dapat dikendalikan selama fermentasi.
Sefa-Dedeh dan Cornelius (2000) mengatakan bahwa perendaman biji-bijian dalam air yang berlebihan akan diikuti oleh pertumbuhan beberapa mikroorganisme seperti Bakteri Asam Laktat (BAL), khamir, dan kapang. Menurut Gratz (2007) BAL berpotensi dalam mendegradasi mikotoksin atau mengurangi bioavailabilitasnya, salah satunya dapat mengurangi availabilitas aflatoksin secara in vitro. Elsanhoty dan Azeke (2009) melakukan pengujian terhadap empat strain BAL dan bifidobacteria yang menunjukkan bahwa
Lactobacillus rhamnosus TISTR 541 memiliki kemampuan paling besar dalam mengikat aflatoksinsecara in vivo dan fermentasi tepung gandum terkontaminasi aflatoksin dengan menggunakan Lactobacillus rhamnosus TISTR 541 dan kamir roti paling efektif mereduksi aflatoksin dibandingkan hanya menggunakan khamir roti atau BAL saja selama fermentasi pembuatan roti Baladi.
Berdasarkan informasi dan permasalahan di atas, perlu dilakukan pengkajian pada proses fermentasi grits jagung dengan menggunakan formula kultur starter yang berasal dari mikroorganisme indigenus yang tumbuh selama fermentasi spontan jagung untuk mengetahui pengaruh kultur starter terhadap
Aspergillus flavus dan penurunan aflatoksin selama proses fermentasi grits jagung putih lokal varietas Pulut serta meningkatkan kemudahan penggilingan.
Perumusan Masalah
1. Jagung putih lokal varietas Pulut berpotensi untuk dikembangkan menjadi tepung jagung dan digunakan sebagai bahan baku ingredien sebagai alternatif tepung, tetapi jagung memiliki permasalahan keamanan pangan terkait aflatoksin serta memiliki endosperm yang keras.
3. Beberapa jenis BAL dan khamir pernah dilaporkan secara in vitro memiliki kemampuan dalam mereduksi aflatoksin, sehingga perlu diteliti lebih lanjut.
Tujuan
Secara umum penelitian ini bertujuan untuk mempelajari pengaruh fermentasi dengan kultur starter terhadap penghambatan pertumbuhan Aspergillus flavus dan reduksi kandungan aflatoksin pada grits jagung putih lokal varietas Pulut. Tujuan khusus dari penelitian ini :
1. Mengembangkan kultur starter dari mikroorganisme indigenus yang tumbuh selama fermentasi spontan pada grits jagung dan mengetahui pengaruhnya terhadap penghambatan pertumbuhan Aspergillus flavus dan reduksi aflatoksin selama proses fermentasi grits jagung putih lokal varietas Pulut. 2. Mengetahui pengaruh kultur starter dalam meningkatkan kemudahan
penggilingan grits jagung menjadi tepung. Lingkup Penelitian
Analisis pada tepung jagung yang dihasilkan hanya sebatas mengetahui jumlah rendemen tepung dengan tekstur halus yang lebih banyak dalam satu kali penggilingan, tidak mencakup perubahan karakter sifat fisiko kimia dan fungsional dari tepung jagung yang dihasilkan.
Hipotesis
1. Penggunaan kultur starter dapat menghambat pertumbuhan Aspergilllus flavus dan mereduksi aflatoksin pada grits jagung.
2. Penggunaan kultur starter akan meningkatkan kemudahan penggilingan grits jagung sehingga menghasilkan tekstur tepung halus yang lebih banyak dalam satu kali penggilingan.
Manfaat
TINJAUAN PUSTAKA
Jagung
Jagung dapat dikelompokkan menurut umur panen dan bentuk biji. Berdasarkan umur, jagung dibagi menjadi 3 golongan, yaitu: 1) Berumur pendek (genjah): 75-90 hari, contoh: Genjah Warangan, Genjah Kertas, Abimanyu dan
Arjuna. 2) Berumur sedang (tengahan): 90-120 hari, contoh: Hibrida C 1, Hibrida CP 1 dan CPI 2, Hibrida IPB 4, Hibrida Pioneer 2, Malin, Metro dan Pandu.
3) Berumur panjang: lebih dari 120 hari, contoh: Kania Putih, Bastar, Kuning,
Bima dan Harapan.
Berdasarkan bentuk biji, jagung dibagi menjadi 7 golongan, yaitu: Dent Corn, Flint Corn, Sweet Corn, Pop Corn, Flour Corn, Pod Corn, Waxy Corn.
Jagung dengan varietas unggul mempunyai sifat-sifat seperti produksi tinggi, umur pendek, tahan serangan penyakit utama dan sifat-sifat lain yang menguntungkan. Varietas unggul ini dapat dibedakan menjadi dua, yaitu: jagung hibrida dan varietas jagung bersari bebas (Prihatman 2000).
Di Indonesia ada beberapa jenis varietas jagung yang dikenal antara lain:
Abimanyu, Arjuna, Bromo, Bastar Kuning, Bima, Genjah Kertas, Harapan, Harapan Baru, Hibrida C 1 (Hibrida Cargil 1), Hibrida IPB 4, Kalingga, Kania Putih, Malin, Metro, Nakula, Pandu, Parikesit, Permadi, Sadewa, Wiyasa, Bogor Composite-2 (Prihatman 2000). Syuryawati et al. (2010) mengatakan jenis jagung yang disukai masyarakat sebagai pangan pokok adalah jagung putih varietas lokal, salah satunya yaitu jagung putih lokal varietas Pulut. Jagung putih lokal varietas Pulut berasal dari Sulawesi Selatan dan dikembangkan oleh Badan Penelitian Serealia Temanggung Jawa Tengah.
Tabel 1 Kandungan amilosa/amilopektin biji jagung dari beberapa varietas Varietas Amilosa (%) Amilopektin (%) Srikandi Putih -1
Srikandi Kuning -1 Anoman
Lokal non Pulut Takalar Lokal Pulut Takalar Sukmaraga 31.05 30.14 29.92 28.50 4.25 34.55 68.95 69.86 70.08 71.50 95.75 65.45 Sumber: Suarni dan Firmansyah (2005) dalam Suarni (2009)
Menurut the Ohio State University Extension (2010), kandungan amilopektin jagung pulut (waxy corn) mendekati 100% sedangkan jagung normal mengandung 75% amilopektin dan 25% amilosa. Berdasarkan kriteria tersebut maka jagung varietas lokal Pulut Takalar termasuk dalam waxy corn, sedangkan varietas lainnya yang tercantum pada Tabel 1 merupakan jagung normal. Amilopektin adalah bentuk pati yang terdiri dari sub unit glukosa bercabang sedangkan amilosa terdiri dari molekul glukosa tidak bercabang. Jagung pulut ditemukan di Cina pada tahun 1908 yang mempunyai sifat lilin (waxy) dan dikendalikan oleh gen resesif tunggal, gen wx. Menurut Fergason (1994) adanya gen tunggal waxy (wx) yang bersifat resesif epistasis pada kromosom sembilan akan mempengaruhi komposisi kimiawi pati, karena gen wx hanya memproduksi komponen amilopektin, dan tidak memiliki fraksi amilosa. Weatherwax (1922) menyatakan bahwa jagung pulut (waxy corn) memiliki endosperm yang keras seperti tipe flint corn.
Jagung putih dan kuning memiliki komposisi kimia yang cukup berbeda. Jagung putih memiliki kandungan kimia yang lebih tinggi, komposisi kimia beberapa tipe jagung dapat dilihat pada Tabel 2 dan 3.
Tabel 2 Komposisi kimia jagung putih dan kuning (basis kering)
Komposisi kimia Jagung kuning pipilana) Jagung putih pipilanb)
Protein (% bk) 9.5 10.36
Lemak (% bk) 4.3 4.9
Serat (%bk) 9.5 11.2
Kalsium (% bk) 0.03 0.008
Besi (mg/100 g) 3 2.16
Karotenoid total (mg/kg) 30 -
Vitamin B1 (mg/100 g) 0.33 0.38
Sumber: a) Watson (1987)
b)
Hasil pengolahan data asia maya.com (2009)
Tabel 3 Komposisi kimia (%) berbagai tipe jagung lokal Varietas Air Abu Protein Serat
Kasar
Lemak Karbohidrat Srikandi Putih*) 10.08 1.81 9.99 2.99 5.05 73.07 Srikandi Kuning*) 11.03 1.85 9.95 2.97 5.10 72.07
Anoman*) 10.07 1.89 9.71 2.05 4.56 73.77
Lokal pulut*) 11.12 1.99 9.11 3.02 4.97 72.81
Lokal non pulut*) 10.09 2.01 8.78 3.12 4.92 74.20
Bisi 2**) 9.07 1.00 8.40 2.20 3.60 75.10
Lamuru**) 9.80 1.20 6.90 2.60 3.20 76.30
*) Suarni dan Firmansyah (2005) **) Suharyono et al. (2005)
Tepung Jagung
Pengolahan produk jagung pulut saat ini di Sulawesi Selatan baru sebatas pengganti makan pokok seperti binte, baro’bo, marning, jagung rebus dan jagung bakar (Syuryawati et al. 2010). Beberapa penduduk daerah lainnya di Indonesia (Madura dan Nusa Tenggara) menggunakan jagung sebagai pangan pokok. Selain sebagai sumber karbohidrat, jagung juga digunakan sebagai pakan ternak, diambil minyak dan patinya atau dibuat tepung.
60 mesh dan minimal 70% lolos ayakan 80 mesh. Persyaratan mutu lain yang harus dipenuhi tepung jagung yang dihasilkan di Indonesia harus berdasarkan Standar Nasional Indonesia (SNI) seperti terlihat pada Tabel 4.
Tabel 4 Syarat mutu tepung jagung berdasarkan SNI 01-3727-1995
No Kriteria Uji Satuan Persyaratan
1 1.1 1.2 1.3 2 3 4 5 5.1 5.2 6 7 8 9 10 11 11.1 11.2 11.3 11.4 12 13 13.1 13.2 13.3 Keadaan Bau Rasa Warna Benda-benda asing
Serangga dalam bentuk stadia dan potongan-potongan
Jenis pati lain selain pati jagung Kehalusan
Lolos ayakan 80 mesh Lolos ayakan 60 mesh Air Abu Silikat Serat kasar Derajat asam Cemaran logam Timbal(Pb) Tembaga(Cu) Seng(Zn) Raksa(Hg) Cemaran arsen(As) Cemaran mikroba:
Angka lempeng total
E.coli Kapang - - - - - - % % % b/b %b/b % b/b %b/b ml.N.NaOH/100gr mg/kg mg/kg mg/kg mg/kg mg/kg koloni/gr APM/gr Koloni/gr Normal Normal Normal
Tidak boleh ada Tidak boleh ada Tidak boleh ada Min.70 Min.99 Maks.10 Maks.1.5 Maks.0.1 Maks.1.5 Maks.4.0 Maks.1.0 Maks.10.0 Maks.40.0 Maks.0.05 Maks. 0.5 Maks. 5x106 Maks. 10 Maks. 104
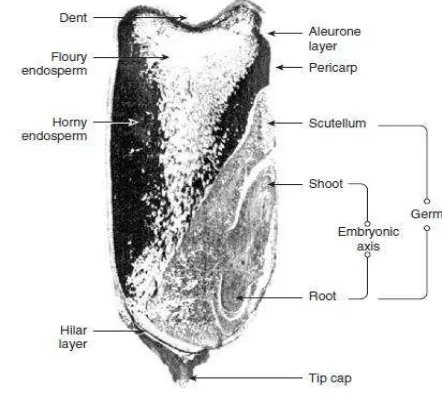
tepung. Bagian-bagian dari permukaan biji kernel jagung seperti terlihat pada Gambar 1.
Gambar 1. Bagian-bagian dari permukaan biji kernel jagung Sumber: Eckhoff & Watson 2009
Suardi et al. (2002) menyatakan dua jenis metode penepungan yang sering diterapkan dalam produksi tepung dan serealia yaitu metode basah dan metode kering. Pada metode basah dilakukan perendaman bahan terlebih dahulu sebelum ditepungkan, sedangkan metode kering tidak dilakukan perendaman. Richana dan Suarni (2005) melakukan proses pembuatan tepung jagung dengan metode basah, proses dilakukan dengan menggunakan jagung kering yang disosoh lalu direndam selama 4 jam, ditiriskan dan selanjutnya ditepungkan.
Untuk memperbaiki kualitas tepung, proses penepungan jagung juga dapat dilakukan dengan penambahan enzim maupun fermentasi dengan ragi tape. Tepung jagung yang diperoleh dengan cara seperti ini disebut tepung termodifikasi. Hal ini disebabkan karena tepung yang dihasilkan telah berubah sifat fisikokimia dan fungsionalnya, yaitu kadar amilosa dan derajat polimerisasi
menurun, sedangkan gula reduksi dan dekstrosa ekuivalen meningkat (BB-Pascapanen 2010). Selain itu tekstur tepung jagung termodifikasi lebih halus
2010). Pengolahan jagung menjadi produk olahan telah banyak dilakukan, diantaranya sebagai tepung komposit (terigu, ubi kayu dan jagung) dalam pembuatan mie (Yulmar et al. 1997), pengolahan jagung sebagai bahan baku dalam bentuk tepung komposit (Susila & Resmisari 2005) serta Suarni (2009) juga melakukan pengkajian terhadap prospek pemanfaatan tepung jagung untuk kue kering (cookies).
Fermentasi Spontan Pada Proses Pengolahan Tepung
Fermentasi adalah proses metabolik yang melepaskan energi dari gula atau molekul lain. Berbagai mikroorganisme dapat memfermentasi berbagai substrat dan produk akhir yang dihasilkan tergantung jenis mikroba yang tumbuh, substrat dan enzim yang berperan. Berdasarkan sumber mikroba yang berperan, proses fermentasi dibedakan menjadi tiga kelompok, yaitu fermentasi spontan, back slopping, dan fermentasi terkendali. Fermentasi spontan adalah fermentasi yang terjadi tanpa penambahan mikroba dalam bentuk starter atau ragi, proses fermentasi yang terjadi tergantung mikroba yang terdapat pada bahan baku. Fermentasi back slopping adalah proses fermentasi yang berlangsung dengan menggunakan mikroba yang terdapat pada produk fermentasi sebelumnya dan fermentasi terkendali adalah fermentasi yang berlangsung dengan menambahkan mikroba dalam jumlah dan jenis tertentu secara langsung pada bahan baku yang akan difermentasi. Cara pertama dapat menghasilkan mutu produk yang tidak seragam karena jumlah dan jenis mikroba yang berperan belum tentu sama dalam setiap proses. Demikian juga dengan cara kedua, kemungkinan gagal karena mutu tidak seragam cukup besar. Sebaliknya, dengan fermentasi terkendali kemungkinan berhasil (mutu produk seragam untuk setiap kali ulangan) sangat besar karena jumlah dan jenis mikroba awal diketahui sehingga hasilnya pun dapat diprediksi ( Tortora et al. 2004)
memecah pati menjadi gula-gula sederhana. Kapang yang bersifat proteolitik akan memecah protein menjadi asam amino dan kapang yang bersifat lipolitik akan memecah asam lemak san senyawa aromatik lainnya.
Nout et al. (1997) mengatakan bahwa mikroflora telah ada sejak tanaman jagung berada dalam masa pra-panen. Nout et al. (1997) juga mengatakan bahwa mikroflora baik berupa bakteri, kapang maupun khamir pada tanaman jagung pra-panen memegang peranan dalam menarik perhatian serangga dan juga interaksi terhadap pertumbuhan dan produksi mikotoksin oleh kapang. Jenis khamir yang lazim ditemukan meliputi Candida guilliermondii (55%) Candida zeylanoides (24%), Candida shehatae (11%), dan Debaryomyces hansenii (3%). Selain itu juga ditemukan Trichosporon cutaneum, Cryptococcus albidus var.
Aerius dan Pichia membranijaciens. Mayoritas khamir yang ditemukan pada jagung tidak dapat memfermentasi gula seperti sukrosa dan maltosa.
Sefa-Dedeh dan Cornelius (2000) melaporkan bahwa perendaman biji-bijian dalam air yang berlebihan akan diikuti oleh pertumbuhan beberapa mikroorganisme seperti BAL, khamir, dan kapang. Selain itu fermentasi juga banyak dilakukan pada serealia dan umbi-umbian untuk memperbaiki mutu, terutama pada produk singkong dan jagung. Akinrele (1970) mengatakan jenis mikroorganisme yang terdapat selama fermentasi spontan maize di Afrika berupa kapang Cephalosporium, Fusarium, Aspergillus dan Penicillium. BAL yang dominan yaitu Lactobacillus plantarum dan juga beberapa khamir Candida mycoderma, Saccharomyces cerevisiae dan Rhodotorula.
Di Afrika proses fermentasi spontan secara luas telah banyak digunakan dalam pengolahan serealia dalam membuat berbagai jenis makanan. Fermentasi spontan memberikan kontribusi dalam pengembangan tekstur, rasa, meningkatkan keamanan pangan, dan meningkatkan nilai gizi (kualitas protein) pada pangan berbasiskan jagung serta mengurangi faktor anti nutrisi (Afoakwa et al. 2007).
Tabel 5 Penelitian proses fermentasi pembuatan tepung jagung dan umbi Nama
produk
Perlakuan Karakteristik tepung Referensi
Tepug jagung dan singkong fermentasi
Perendaman dalam air pada suhu 20 atau 35 oC, 15 hari, dikeringkan sinar matahari 10-12 jam atau oven 40 oC 24 jam.
Selama fermentasi pH tepung jagung menurun lebih cepat dari tepung singkong. Tepung jagung memiliki kandungan asam yang lebih tinggi
namun tepung tidak mempunyai
kemampuan mengembang dalam
berbagai kondisi penelitian, diduga hal ini karena tingginya kandungan asam laktat yang dihasilkan.
Mestres et al. 2000
Tepung jagung
Fermentasi spontan pada wadah tertutup dengan
perbandingan jangung: aquadest (3kg:6L) pada suhu 27 oC selama 72 jam
1. Jagung yang difermentasi
spontan sampai 36 jam,memiliki
ukuran partikel tepung yang
terdistribusi dengan baik dari ukuran partikel 75 µm-150 µm. Sedangkan fermentasi 48 jam partikel jagung yang berukuran paling halus ( kurang dari 75µm) meningkat.
2. Fermentasi spontan
menurunkan kadar protein, lemak, serat kasar, abu, pati, gula reduksi, pH, Densitas kamba dan kapasitas penyerapan minyak pada tepung yang dihasilkan, sedangkan sudut curah, derajat putih dan kapasitas penyerapan air meningkat.
Aini 2009 Tepung jagung fortifikasi kacang tanah Bambara Fermentasi dengan mencampur tepung jagung:kacang bambara 70:30 direndam dengan air perbandingan 1:1 selama 72 jam pada suhu 28oC (susu ruang)
Selama proses fermentasi mikroflora secara bertahap berubah dari bakteri enterik gram negative, kapang, BAL dan khamir berubah menjadi BAL dan khamir yang mendominasi. Dan mikroorganisme yang tidak diinginkan seperti koliform dan kapang yang muncul di awal tereliminasi setelah 24 jam.
Mbata et al, 2009 Tepung jagung termodifik asi Grits jagung direndam dengan BAL dengan perbandingan 1 1kg grits: 1 gram
L.brevis / L. casei
direndam selama 1, 2, 3 hari.
Dengan penambahan BAL meningkatkan kualitas tepung dan produk roti yang dihasilkan. Berdasarkan komposisi kimia, sifat pati dan sifat tepung, perendaman terbaik adalah dengan L.casei selama 3 hari.
Aspergillus flavus dan Aflatoksin
Jagung yang baru dipanen biasanya mempunyai kadar air tinggi sekitar 30%. Sauer (1986) mengatakan kadar air jagung yang melebihi 16% dengan kelembaban udara lebih dari 85% selama masa penyimpanan memberikan kesempatan pada Aspergillus flavus untuk berkembang dan menghasilkan aflatoksin. Hal ini di dukung dengan iklim hujan tropis di Indonesia yang menyebabkan kondisi kelembaban udara tinggi (RH>80%) dengan suhu rata-rata 28-33 oC. Kondisi ini sesuai dengan syarat pertumbuhan dan perkembangan
A. flavus serta menghasilkan aflatoksin.
Aflatoksin telah lama dikenal sejak tahun 1960-an, lebih dari seratus ribu ternak kalkun mati di Inggris setelah memakan kacang yang diimpor dari Afrika dan Amerika Selatan. Dari pakan tersebut diisolasi Aspergillus flavus dan toksin yang dihasilkan oleh kapang ini yang dikenal dengan aflatoksin (Jay 2000).
Selain A. flavus, aflatoksin juga dihasilkan oleh A. paraciticus.
Aspergillus flavus menghasilkan Aflatoksin B1 (AFB1) dan Aflatoksin B2 (AFB2) dan A. parasiticus menghasilkan empat komponen utama aflatoksin yaitu aflatoksin B1, G1, B2 dan G2 (Jay 2000). Jenis lain yang juga diketahui
menghasilkan aflatoksin seperti A. nomius, A. bombycis, A. pseudotamartii dan
A. ochraceoroseus (Jay 2000). Aflatoksin bersifat mutagen dan karsinogen tarhadap manusia. Memakan makanan yang mengandung aflatoksin dapat menyebabkan kanker liver pada manusia (Calvo 2004).
Kapang A. flavus dapat dibedakan dengan A. parasiticus berdasarkan karakteristik morfologinya. A. flavus memproduksi konidia dengan ukuran dan bentuk yang bervariasi, dinding sel konidia tipis dan teksturnya bervariasi dari halus hingga kasar. Sedangkan konidia yang diproduksi oleh A. parasiticus
berbentuk bulat, dinding sel konidia tebal dan bertekstur kasar. Selain itu vesikel pada A. flavus lebih besar dengan diameter > 50 µm, sedangkan A. parasiticus
jarang ditemukan lebih dari 30 µm (Pitt & Hocking 1997)
dengan aw paling rendah 0.8, sedangkan suhu optimal untuk pertumbuhan adalah
25-42 oC. Pertumbuhan kapang dan perkecambahan konidium ideal pada aw lebih
dari 0.9 dan akan terhambat jika aw kurang dari 0.7 (Bhatnagar et al. 2000).
Dewanti-Hariyadi et al. (2008) mengamati waktu optimum biosintesis aflatoksin oleh A. parasiticus pada media Potato Dextrose Broth (PDB) yang diinkubasi selama 10 hari pada suhu 28-30 oC. Jumlah aflatoksin B1 yang dihasilkan hampir mencapai 20 ppb, sedangkan dengan pengkayaan media menggunakan Malt Extract Broth (MEB) 50% dengan penambahan filtrat
Saccharomyces dan M rouxii dapat mempercepat biosintesis dan meningkatkan produksi aflatoksin 40-800 ppb. Purwijatiningsih et al. (2005) melaporkan dengan menggunakan spora A. flavus sebanyak 106 spora/ml, waktu optimum terbentuknya aflatoksin terjadi pada hari ke-9 selama inkubasi menggunakan
100 ml media PDB di suhu ruang dengan total aflatoksin berkisar 35000-42500 ppb. Menurut Marth dan Doyle (1979) A. flavus menghasilkan
aflatoksin dalam jumlah maksimal setelah 5 sampai 9 hari. Inkubasi selanjutnya produksi aflatoksin akan menurun. Penurunan tersebut disebabkan karena aktifitas enzim P450 monooksigenase yang berperan dalam mendegradasi aflatoksin secara endogen (Hamid et al. 1987).
Aspergillus parasiticus memiliki konidiofora yang muncul dari permukaan hifa dengan ukuran panjang 250-500 µm, tidak berwarna atau coklat muda dan berdinding halus. Vesikel berbentuk bulat dengan diameter 20-35 µm dan hanya ¾ bagian permukaan vesikel yang subur (fertile). Vesikel membentuk phialide
dengan panjang 7-11µm yang memproduksi konidia berbentuk bulat. Biasanya berdiameter 4-6 µm, dinding selnya bertekstur kasar dan biasanya akan membentuk kepala konidia yang bulat (Pitt & Hocking 1997). A. parasiticus
dapat tumbuh pada suhu antara 12-42 oC dengan suhu optimal pertumbuhan 32 oC. Nilai aw minimum untuk pertumbuhan adalah 0.82 pada suhu 25 oC, 0.81
pada suhu 30 oC dan 0.80 pada suhu 37 oC serta pH antara 2.4-10.5 pada ketiga suhu tersebut (Pitt & Hocking 1997).
Hocking 1997). Kemampuan kapang untuk membentuk dan menimbun aflatoksin tergantung pada beberapa faktor, yaitu potensi genetik kapang, persyaratan lingkungan (substrat, kelembaban, suhu dan pH) serta lamanya kontak antara kapang dengan subtrat (Jay 2000).
Ada empat macam aflatoksin yang telah dikenal yaitu B1, B2, G1 dan G2. Istilah B dan G barasal dari warna biru (blue) dan hijau (green) sinar fluoresens dibawah lampu UV pada alat Kromatografi Lapis Tipis. Angka 1 dan 2 menunjukkan perbedaan antara senyawa utama dan minor (Pitt & Hocking 1997). Aflatoksin B2 merupakan derivat dari dihidroaflatoksin B1, sedangkan aflatoksin G2 merupakan derivat dari aflatoksin G1. Rumus struktur dari aflatoksin B1, B2, G1 dan G2 dapat dilihat seperti pada Gambar 2. Jika dilihat sepintas antara aflatoksin B1 dan B2, tidak nampak adanya perbedaan sama sekali, demikian halnya dengan aflatoksin G1 dan G2. Namun bila diperhatikan secara baik-baik terdapat perbedaan pada ikatan rangkapnya (Syarief et al. 2003)
Gambar 2. Rumus struktur aflatoksin
kelembaban relatif ruang simpan hingga dibawah 80% sehingga didapat aw sekitar
0.65-0.70 akibatnya kapang akan terhambat pertumbuhannya.
Aflatoksin merupakan mikotoksin yang paling toksik dan mendapat perhatian dalam dunia kesehatan karena bersifat hepatotoksik, mutagenik, teratogenik dan impulsif. Efek biologis dari aflatoksin dapat bersifat akut, kronis dan kerusakan dari ketahanan dan respon imun. Sifat akut dari aflatoksin dapat terjadi apabila toksin yang terkonsumsi dalam jumlah besar. Pada dasarnya target organ utama dari aflatosikosis ini adalah liver dan juga merupakan salah satu faktor penyebab penyakit sirosis hati (Cary et al. 2000; Kuniholm et al. 2008). Selain itu Tchana et al. (2010) menemukan adanya AFB1 dalam urin anak-anak yang kekurangan gizi. Hal ini dapat menyebabkan risiko penurunan potensi pertumbuhan selama perkembangan mereka karena aflatoksin menghambat sintesis protein. Kasus keracunan terbesar di dunia selama 20 tahun terakhir terjadi pada 2004 dari 317 kasus dilaporkan 125 orang meninggal (Lewis et al.
2005).
Aflatoksin Pada Jagung
Aflatoksin merupakan salah satu senyawa karsinogen yang mengkontaminasi bahan pangan dan pakan. Aflatoksin sering mengkontaminasi jagung, kacang-kacangan, cotton, gandum, sorghum dan minyak dari biji-bijian. Dharmaputra (2002) mengatakan bahwa permasalahan aflatoksin merupakan masalah dunia, terutama masalah di negara berkembang. Dimana keamanan pangan dan sistem keamanan belum berkembang dengan baik untuk melindungi konsumen dari produk yang tidak aman. Di negara maju, konsumen sudah lebih peduli terhadap isu keamanan seperti aflatoksin
Codex Alimentarius Commission merekomendasikan kandungan maksimum aflatoksin sebesar 15 ppb (B1+B2+G1+G2) pada kacang dan 0.05 ppb aflatoksin M1 pada susu (Jay 2000), sedangkan batas maksimum aflatoksin yang diperbolehkan dalam makanan dan pakan ternak oleh FDA di Amerika Serikat sebesar 20 ppb (Bhatnagar et al. 2000).
batas maksimum kandungan aflatoksin B1 (AFB1) pada jagung dan produk olahannya adalah 20 ppb (BSN 2009).
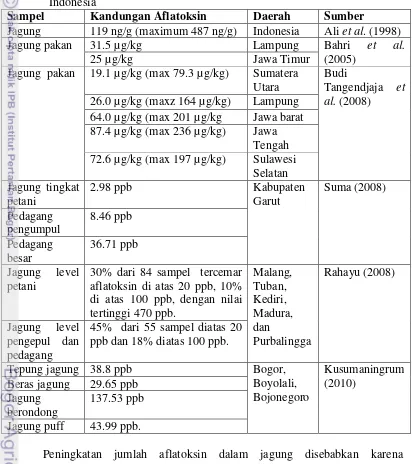
[image:43.595.107.520.213.677.2]Komoditi jagung di Indonesia mengandung aflatoksin dengan kadar relatif tinggi. Hal ini terlihat dari hasil mapping aflatoksin dibebepara daerah sentra produksi jagung seperti terlihat pada Tabel 6.
Tabel 6 Kandungan aflatoksin pada jagung dan produknya di beberapa daerah di Indonesia
Sampel Kandungan Aflatoksin Daerah Sumber
Jagung 119 ng/g (maximum 487 ng/g) Indonesia Ali et al. (1998)
Jagung pakan 31.5 µg/kg Lampung Bahri et al.
(2005)
25 µg/kg Jawa Timur
Jagung pakan 19.1 µg/kg (max 79.3 µg/kg) Sumatera Utara
Budi
Tangendjaja et al. (2008) 26.0 µg/kg (maxz 164 µg/kg) Lampung
64.0 µg/kg (max 201 µg/kg Jawa barat 87.4 µg/kg (max 236 µg/kg) Jawa
Tengah 72.6 µg/kg (max 197 µg/kg) Sulawesi
Selatan Jagung tingkat
petani
2.98 ppb Kabupaten
Garut Suma (2008) Pedagang pengumpul 8.46 ppb Pedagang besar 36.71 ppb Jagung level
petani
30% dari 84 sampel tercemar aflatoksin di atas 20 ppb, 10% di atas 100 ppb, dengan nilai tertinggi 470 ppb.
Malang, Tuban, Kediri, Madura, dan Purbalingga Rahayu (2008)
Jagung level pengepul dan pedagang
45% dari 55 sampel diatas 20 ppb dan 18% diatas 100 ppb.
Tepung jagung 38.8 ppb Bogor,
Boyolali, Bojonegoro
Kusumaningrum (2010)
Beras jagung 29.65 ppb Jagung
berondong
137.53 ppb Jagung puff 43.99 ppb.
Tabel 7 Cemaran kapang dan Aspergillus flavus pada jagung di beberapa daerah di Indonesia
Lokasi Tingkat distribusi
Rata-rata A.flavus
(Log cfu/g) Rata-rata Kapang (Log cfu/g) Bogor (Jagung manis) Petani Pengumpul Pasar Induk Pengecer < 1.0 < 1.0 1.9±2.6 < 1,0 5.9±0.0 6.2±0.0 6.2±0.0 6.0±0.2 Boyolali (Jagung pipil) Petani pemipil Pengumpul Pasar Induk Pengecer 1.0±0.0 2.6±0.0 2.7±1.2 2.6±0.5 1.7±1.4 4.5±0.0 3.9±0.0 4.7±0.1 4.4±0.6 4.1±1.6 Bojonegoro (Jagung pipil) Petani pemipil Pengumpul Pasar Induk Pengecer 0.9±1.1 1.8±1.3 1.3±1.2 2.2±1.1 1.9±1.4 3.7±0.7 3.5±1.4 3.0±1.4 3.7±1.0 3.6±0.4
Sumber: Kusumaningrum et al. (2010)
Pengendalian Aflatoksin
Teknik pengendalian mikotoksin dilakukan ketika kontaminasi kapang tidak lagi dapat dicegah. Salah satunya dengan dekontaminasi sebelum bahan baku digunakan untuk keperluan pangan dan pakan. Teknik pengendalian aflatoksin dapat dilakukan secara fisik, kimiawi dan biologis. Detoksifikasi secara kimia untuk mendegradasi aflatoksin dapat menggunakan asam, basa, bisulfit, klorin dan agent oksidasi (King & Prudente 2005). Hasil penelitian Tabata et al.
(1994) memperlihatkan larutan asam klorida dan asam sulfat dengan konsentrasi 1% dapat mendegradasi aflatoksin B1 dan G1, sedangkan larutan basa Na2CO3,
NaOH dan NaOCl dengan konsentrasi masing-masing 1% dapat mendegradasi keempat jenis aflatoksin (B1, B2, G1 dan G2). Aflatoksin B1 dan B2 pada jagung dapat direduksi dengan menggunakan bisulfit. Ketika jagung yang sudah dikeringkan ditambahkan 250 ppb AFB1 dengan beberapa perlakuan, 1% sodium bisulfit dapat mereduksi 28.2% selama 72 jam, selain itu 0.2% H2O2 ditambahkan
2010), amonia (Bagley 1979), dan menggunakan larutan elektrolisis Anoda NaCl (Suzuki et al. 2002),
Metode lain adalah dengan pengendalian secara biologis yang menggunakan mikroorganisme kompetitor yang diharapkan dapat mencegah pertumbuhan Aspergillus flavus dan biosintesis aflatoksin. Nannocytis exedens
Reichenbach yang merupakan bakteri tanah diketahui berpotensi sebagai biokompetitor bagi A. flavus dan A. parasiticus (Taylor & Draughon 2001). Selain itu aktivitas khamir sebagai anti kapang dan anti aflatoksin juga telah dilaporkan oleh beberapa peneliti. Candida krusei WRL-038 dan Pichia anomala memiliki daya hambat paling tinggi terhadap biosintesis aflatoksin (Hua et al. 1999).
Saccharomyces cerevisiae efektif mengurangi pengaruh negatif aflatoksin pada ayam (Stanley et al. 1993). Hai (2006) juga melakukan penelitian untuk menghambat pembentukan aflatoksin dengan menggunakan Bacillus subtilis.
Penghambatan pertumbuhan dan produksi aflatoksin oleh A.flavus juga dilakukan dengan menggunakan Rhizopus oligosporus dan Candida yang berasal dari ragi tempe. Ragi tempe tersebut dapat menghambat dengan mereduksi aflatoksin berturut-turut sebesar 37.21% dan 99.96% (Purwijatiningsih et al.
2005). Dewanti-Hariyadi et al. (2008) melakukan reduksi aflatoksin yang dihasilkan oleh A. parasiticus dengan menggunakan ragi yang mengandung M. Rouxii, Saccharomyces sp berturut-turut sebesar 99.7% dan 98.1%.
Karunaratne et al. (1990) dalam penelitiannya menunjukkan bahwa isolat BAL dari silase komersial yaitu Lactobacillus acidophillus, L. bulgaricus dan
L. plantarum dapat menghambat pertumbuhan A. flavus dan produksi aflatoksin. Campuran ketiga kapang tersebut dapat menghambat secara total perkecambahan spora kapang. Pertumbuhan sel L. plantarum efektif mencegah pertumbuhan kapang dengan adanya pengaruh pH dan kompetisi antar mikroorganisme, dan hasil metabolit nya efektif mereduksi jumlah aflatoksin.
Sedangkan Lactococcus spp. RS3 and L. brevis WS3 hanya mampu menghambat
A. parasiticus C7, A. flavus B5 dan C6 .
Elsanhoty dan Azeke (2009) melakukan pengujian terhadap empat strain BAL dan bifidobacteria yang menunjukkan bahwa Lactobacillus rhamnosus TISTR 541 memiliki kemampuan paling besar dalam mengikat aflatoksin secara
in vivo dan fermentasi tepung gandum terkontaminasi aflatoksin dengan menggunakan L. rhamnosus TISTR 541 dan kamir roti paling efektif mereduksi dibandingkan dengan hanya khamir roti atau bal saja.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Agustus 2011 sampai dengan April 2012 di laboratorium South East Asian Food & Agriculture Science & Technology
(SEAFAST) Center IPB, laboratorium Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB, serta Seameo Biotrop Service Laboratory.
Bahan Dan Alat
Bahan utama penelitian ini adalah jagung putih lokal varietas Pulut dari Balai Penelitian Serealia Maros, Sulawesi Selatan. Mikroorganisme yang digunakan antara lain Aspergillus flavus sp BCC F0219 isolat lokal dari koleksi kultur Bbalivet, Candida famata dan L. plantarum untuk pembuatan kultur starter yang merupakan kultur koleksi Rahmawati. Media pertumbuhan mikroorganisme yang digunakan adalah Potato-Dextrose Agar (PDA), deMan Rogosa Sharpe
(MRS), Oxytetracycline Glucose Yeast Extract Agar (Ogye Agar) dan API kit 20C AUX dan API CHL 50 untuk konfirmasi khamir dan BAL yang digunakan.
Bahan kimia yang digunakan dalam penelitian ini adalah air destilata, larutan pengencer garam fisiologis (5 g pepton, 8.5 g NaCl, 1000 ml air destilisasi, pH 7.0 ± 0.2), alkohol, etanol, indikator fenolptalin, NaOH 0.1N, larutan gram-iodin (0.5% kristal iodin ditambahkan pada larutan 1.5% larutan kalium iodida) sedangkan bahan kimia untuk analisis aflatoksin menggunakan metanol, NaCl 2.2%, n-heksan, Na2SO4 anhidrat, kloroform, serta menggunakan
standar aflatoksin B1.
Alat yang digunakan dalam penelitan ini adalah seperangkat alat pembuatan tepung seperti pin disc mill, ayakan (60, 80 dan 100 mesh) serta alat-alat analisa meliputi timbangan, cawan petri, tabung reaksi, erlenmeyer, mikro pipet beserta tipnya, bunsen, jarum ose, gelas ukur, pipet Mohr, gelas objek dan cover glass, colony counter, mikroskop, oven, corong gelas, corong pemisah, mikro syringe, hemasitometer, vial, pH meter, desikator, vortex, autoclave, pelat TLC Silica gel 60 F254 Merck, buret, corong pemisah, gyratotry shaker,
Metode Penelitian
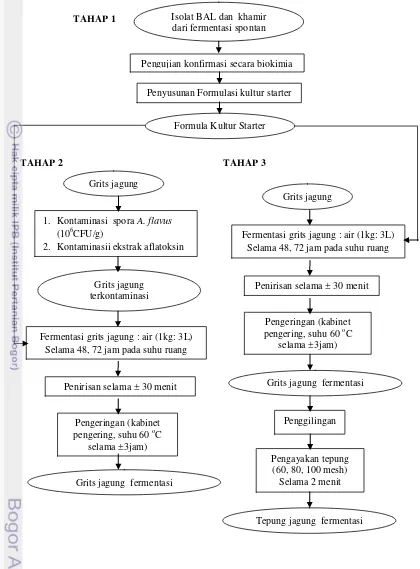
Penelitian dilakukan dalam tiga tahap. Tahap pertama penelitian adalah tahap pendahuluan yaitu menyusun formula kultur starter dari mikroorganisme indigenus. Sebelum penyusunan formula kultur dilakukan konfirmasi ulang terlebih dahulu secara biokimiawi terhadap mikroorganisme indigenus yang akan digunakan. Tahap kedua bertujuan untuk menguji kemampuan formula kultur starter dalam menghambat pertumbuhan Aspergillus flavus sp BCC F0219 serta mereduksi aflatoksin B1 selama fermentasi grits jagung. Tahap ketiga, melihat kemampuan formula kultur starter terhadap pertumbuhan mikroflora selama fermentasi grits jagung dan kemudahan penggilingan yang ditandai dengan meningkatnya proporsi rendemen tepung jagung yang halus saat penggilingan grits jagung dengan satu kali penggilingan. Secara keseluruhan, diagram alir tahapan penelitian ini disajikan pada Gambar 3.
Gambar 3. Diagram alir tahapan penelitian
TAHAP 1
TAHAP 2
Pengeringan (kabinet pengering, suhu 60 oC
selama ±3jam)
Fermentasi grits jagung : air (1kg: 3L) Selama 48, 72 jam pada suhu ruang
Penirisan selama ± 30 menit Grits jagung
Grits jagung fermentasi
Pengayakan tepung (60, 80, 100 mesh) Selama 2 menit
Penggilingan
Tepung jagung fermentasi Pengeringan (kabinet
pengering, suhu 60 oC selama ±3jam)
Fermentasi grits jagung : air (1kg: 3L) Selama 48, 72 jam pada suhu ruang
1. Kontaminasi spora A. flavus
(106CFU/g)
2. Kontaminasii ekstrak aflatoksin
Grits jagung
Grits jagung terkontaminasi
Penirisan selama ± 30 menit
Grits jagung fermentasi
Pengujian konfirmasi secara biokimia Isolat BAL dan khamir dari fermentasi spontan
TAHAP 3
Penyusunan Formulasi kultur starter
Tabel 8 Formulasi kultur starter yang digunakan
Formulasi Jenis Formula mikroorganisme Waktu Inokulasi S1
S2 S3
Kultur tunggal (BAL)
Kultur campuran (BAL + Khamir) Ko-kultur (Khamir + BAL)
Jam ke -0 Jam ke- 0
Jam ke-0 (khamir) dan jam ke-12 (BAL) 2. Persiapan Kultur Starter
a. Persiapan kultur BAL (Jenie et al. 2000 dan Nuraida et al. 2008) Isolat BAL yang diperoleh dari hasil isolasi pada fermentasi spontan dipindahkan ke dalam MRS Broth lalu diinkubasi selama 2 hari. Selanjutnya satu ose kultur diinokulasikan ke media agar tegak semisolid MRSA yang ditambah 1% CaCO3 lalu diinkuasi selama 2 hari pada suhu 37 oC (kultur
stok). Kultur stok disimpan dalam refrigerator.
Kultur kerja dibuat dengan menumbuhkan BAL pada medium cair MRS selama 24 jam. Selanjutnya sel dipisahkan dengan cara disentrifus berpendingin. Kultur BAL sebanyak 10 ml ditempatkan dalam centrifuge tube volume 10 ml secara aseptis, kemudian disentrifuse pada kecepatan 3500 rpm, selama 10 menit pada suhu 5 oC. Media MRSB dipisahkan secara aseptis, kemudian sel BAL yang tertinggal diencerkan dengan menambahkan 10 ml larutan garam fisiologis. Jumlah BAL dalam kultur dihitung dengan menggunakan metode tuang pada media agar MRS.
b. Persiapan Spora Kapang dan Sel Khamir ( Kim et al. 2000)
Kultur murni kapang dan khamir disegarkan dengan cara menggoreskan kembali kultur murni tersebut pada agar miring PDA yang baru, kemudian diinkubasi pada suhu 28-30 oC selama 7 hari untuk kapang, 4 hari untuk khamir.
3. Pengaruh Formula Kultur Starter Dalam Menghambat Pertumbuhan Aspergillus flavus sp BCC F0219 Dan Mereduksi Aflatoksin B1 Pada Fermentasi Grits Jagung
a. Kontaminasi Aspergillus flavus sp BCC F0219 Pada Grits Jagung (Khanafari et al. 2007)
Kontaminasi jagung dilakukan mengikuti metode Khanafari et al. (2007) yang dimodifikasi. Lima puluh gram butiran grits jagung yang telah terlebih dahulu direndam, dibersihkan kotorannya dan ditiriskan, kemudian ditambah spora Aspergillus flavus sp BCC F0219 sehingga diperoleh konsentrasi spora sekitar 106 spora/gr grits jagung lalu diaduk rata dan diinkubasi semalam pada suhu 25 oC. Jagung yang telah dikontaminasi spora
Aspergillus flavus sp BCC F0219 digunakan dalam fermentasi gris jagung seperti terlihat pada bagan fermentasi grits jagung terkontaminasi pada Gambar 4.
b. Ekstraksi Aflatoksin Murni dari A. flavus sp BCC F0219 (Afiandi 2011 dan Koehler et al. 1975)
Aflatoksin diekstraksi dari suspensi 108 spora/ml Aspergillus flavus sp BCC F0219 yang terlebih dahulu diinokulasikan sebanyak 2.5 ml pada erlenmeyer yang berisi 250 ml media Potato Dextrose Broth (PDB) dengan pengaturan pH 4.00, sehingga diperoleh 106 spora/ml pada media yang siap ditumbuhkan. Kemudian di inkubasi selama 5-9 hari pada suhu ruang.
Ekstraksi aflatoksin yang dilakukan dengan metode Koehler et al.
(1975)yang dimodifikasi yaitu dengan menghancurkan hifa Aspergillus pada media PDB dengan menggunakan stomacher. Hifa Aspergillus flavus yang telah hancur dimasukkan kembali ke dalam erlenmeyer berisi media PDB secara aseptis. Kloroform sebanyak 250 ml ditambahkan ke dalam erlenmeyer yang berisi 250 media PDB yang telah bercampur Aspergillus flavus sp BCC F0219 (1:1), kemudian di shaker selama 15 menit pada
Total aflatoksin dalam ekstrak kloroform diukur dengan menggunakan Thin Layer Chromatography (TLC).
Gmbar 4. Proses fermentasi grits jagung terkontaminasi dengan formula kultur starter
c. Kontaminasi Aflatoksin pada Grits Jagung (Khanafari et al. 2007) Grits jagung sebanyak 200 gram kontaminasi dengan ekstrak aflatoksin sebesar 69 ppb (11ml ekstrak yang mengandung 1.26 µl/ml) lalu di aduk rata dan di kering uapkan dengan oven pada suhu 50 oC selama ±10 menit untuk menghilangkan kloroform dari jagung.
1. Spora A.flavus
106spora/gram
2. Ekstrak aflatoksin
Analisis : -Total A.flavus
-Perubahan pH
Analisis : -Total aflatoksin -Total A.flavus
Analisis : -Total aflatoksin -Total A.flavus
Analisis :
-Perubahan pH -Total asam -Total aflatoksin
Fermentasi grits jagung (1kg: 3L) dengan air destilasi steril Selama 48, 72 jam pada suhu ruang
.
Penggilingan kasar grits jagung ± 4mm
Perendaman dan Pembersihan penghilangan kotoran, perikarp & bagian-bagian yang mengapung selama5 menit dengan air steril
Penirisan selama ±30 menit
Pengeringan (kabinet pengering, suhu 60 oC selama ±3 jam) Penirisan selama ±30 menit
Butiran jagung
Grits jagung
Grits jagung terkontaminasi
Kultur starter : S1, S2, S3
d. Fermentasi Grits Jagung Terkontaminasi Dengan Formula Kultur Starter
Proses fermentasi grits jagung dengan menggunakan formula kultur starter terpilih mengikuti metode Aini (2009) dengan beberapa modifikasi. Modifikasi dilakukan dengan mengganti jagung yang digunakan dengan jagung yang terlebih dahulu telah dikontaminasi Aspergillus flavus sp BCC F0219 atau jagung yang dikontaminasi dengan ekstrak aflatoksin. Pada saat jagung direndam dalam air destilasi steril dilakukan penambahan formula kultur starter yang diketahui jenis mikroba dan jumlahnya kemudian difermentasi selama 48 dan 72 jam. Setelah fermentasi selesai dilakukan penirisan dengan menggunakan saringan selama 30 menit, lalu dikeringkan dengan menggunakan pengering kabinet pada suhu 60 oC selama ±3 jam. Produk akhir grits jagung diuji total asam tertitrasi, kadar air, perubahan pH dan total aflatoksin. Bagan proses seperti terlihat pada Gambar 4.
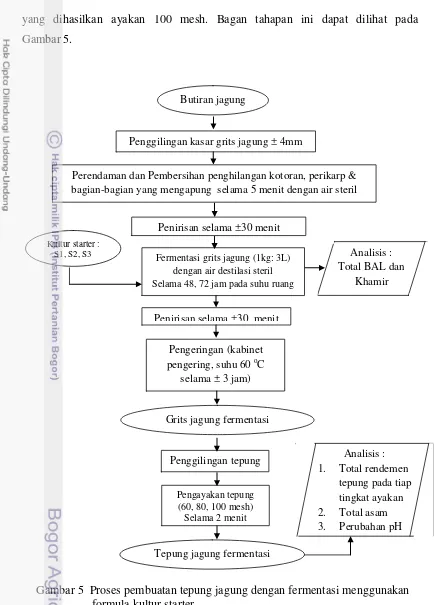
4. Pengaruh Formula Kultur Starter pada Fermentasi Grits Jagung terhadap Pertumbuhan Mikroflora Selama Fermentasi Grits Jagung dan Kemudahan Penggilingan Grits Jagung.
yang dihasilkan ayakan 100 mesh. Bagan tahapan ini dapat dilihat pada Gambar 5.
Gambar 5 Proses pembuatan tepung jagung dengan fermentasi menggunakan formula kultur starter
Analisis :
1. Total rendemen
tepung pada tiap tingkat ayakan
2. Total asam
3. Perubahan pH
Analisis : Total BAL dan
Khamir Kultur starter :
S1, S2, S3 Fermentasi grits jagung (1kg: 3L)
dengan air destilasi steril Selama 48, 72 jam pada suhu ruang
.
Pengeringan (kabinet pengering, suhu 60 oC
selama ± 3 jam) Penirisan selama ±30 menit Penggilingan kasar grits jagung ± 4mm
Perendaman dan Pembersihan penghilangan kotoran, perikarp & bagian-bagian yang mengapung selama 5 menit dengan air steril
Penirisan selama ±30 menit Butiran jagung
Grits jagung fermentasi
Penggilingan tepung
Pengayakan tepung (60, 80, 100 mesh) Selama 2 menit
Metode Analisis
1. Analisis total BAL dengan metode tuang (Nago et al. 1998 dan BAM 2001)
Sebanyak 5 gram grits jagung dan 15 ml air fermentasi di ambil secara aseptis, kemudian stomacher hingga halus. Sebanyak 5 ml sampel ditambahkan ke dalam 45 ml larutan pengencer garam fisiologis-pepton (5 g pepton, 8.5 g NaCl, 1000 ml air destilisasi, pH 7.0 ± 0.2) kemudian dibuat pengenceran desimal (1:10, 1:100, 1:1000, dan seterusnya). Pemupukan dalam metode tuang dilakukan dengan cara mengambil sampel yang telah diencerkan sebanyak 1 ml kemudian dimasukkan ke dalam cawan petri steril lalu ditambahkan MRS Agar steril yang telah ditambahkan CaCO3 0.5% secara double-layer sebanyak 15-20 ml. Jumlah
koloni dihitung setalah inkubasi selama 48 jam. Koloni bakteri dapat dihitung dengan rumus Standar Plate Count sebagai berikut:
Keterangan:
N = jumlah Koloni per ml atau per gram produk ∑C = jumlah semua koloni yang dihitung dari 2 cawan n1 = jumlah cawan pada pengenceran pertama
n2 = jumlah cawan pada pengenceran kedua
d = pengenceran peertama yang dihitung
Limit deteksi berkisar 25 hingga 250 koloni. Ketika dalam cawan terdapat koloni kurang dari 25, maka dalam pelaporannya dikatakan bahwa jumlahnya 2.5x101 CFU/ml. Jika tidak ditemukan koloni dalam cawan hingga pengenceran terendah, maka pelaporannya sebanyak 1.0x101 CFU/ml. Namun jika koloninya melebihi 250, maka dianggap sebagai TBUD (tidak bisa dihitung). Dengan demikian, hanya cawan yang jumlah koloninya berkisar 25 hingga 250 saja yang dapat dihitung sebagai jumlah koloni bakteri yang diinokulasikan.
2. Total koloni kapang dan khamir (Nago et al. 1998 dan BAM 2001) Metode ini pada prinsipnya sama dengan perhitungan jumlah sel BAL yaitu 5 gram grits jagung dan 15 ml air fermentasi diambil secara aseptis, kemudian
atas permukaan cawan petri steril lalu tambahkan Potato-Dextrose Agar (PDA) yang telah ditambahkan asam tartarat 10% (14ml dalam 1L) untuk menghitung total kapang, Oxytetracycline Glucose Yeast Extract Agar (Ogye Agar) yang telah ditambahkan kloramphenikol 0.01% untuk menghitung khamir kemudian di simpan pada inkubator 25 oC selama 3 hari. Jumlah koloni yang dihitung dengan limit deteksi berkisar 10 hingga 150 koloni.
3. Perhitungan spora kapang dengan Petroff-Hauser (Fardiaz, 1992)
Dalam metode petroff-Hauser, hitungan mikroskopik dilakukan dengan pertolongan kotak-kotak skala, dimana dalam setiap ukuran skala seluas 1mm2 terdapat 25 kotak besar dengan luas 0.04 mm2 dan tiap kotak besar terdiri dari 16 kotak kecil. Tinggi contoh yang terletak diantara gelas obyek dengan gelas penutup adalah 0.02 mm. Jumlah spora dalam beberapa kotak besar dihitung, kemudian jumlah spora rata-rata dalam 1 kotak besar. Jumlah spora per ml dihitung sebagai berikut:
∑spora per contoh (spora/ml) = ∑ spora per kotak besar x 25 kotak x 1/0,02 x 103 = ∑ spora per kotak besar x 1.25 x 105
4. Pengukuran pH dengan metode potentiometric (AOAC 1995)
5. Uji derajat asam tepung (SNI 1995)
Timbang tepung 10 gram, masukkan kedalam erlenmeyer 250 ml, tambahkan 100 ml alkohol 96% netral dan biarkan selama 24 jam sambil sesekali digoyang kemudian di saring. Titar dengan menggunakan NaOH 0.05 N dengan menggunakan larutan indikatornPP
De