Lampiran 2. Gambar tumbuhan nipah
Lampiran 3. Gambar daun nipah segar
Daun nipah segar
Lampiran 3 (Lanjutan) Gambar serbuk simplisia daun nipah
Lampiran 3 (Lanjutan) Gambar mikroskopik serbuk simplisia daun nipah
Mikroskopi serbuk simplisia daun nipah Keterangan:
1. Berkas pembuluh bentuk spiral 2. Stomata tipe parasitik
3. Minyak atsiri
1 2
Lampiran 4. Bagan Kerja penelelitian
1. Pembuatan simplisia daun nipah, karakterisasi, dan skrining
Dibersihkan dari kotoran
Skrining Fitokimia untuk pemeriksaan : a. Alkaloida a. Penetapan kadar air
b. Penetapan kadar sari larut air c. Penetapan kadar sari larut etanol d. Penetapan kadar abu total
Lampiran 4 (Lanjutan)
2. Pembuatan ekstrak n-heksan daun nipah
Dimaserasi dengan pelarut n-heksana dalam wadah gelap sampai terendam selama 2 hari sambil sesekali diaduk Disaring
Dimaserasi dengan n-heksana dan dibiarkan selama 2 hari Disaring
Serbuk simplisia
Ekstrak n-heksana
Ampas Maserat II
Ampas Maserat I
Dimaserasi dengan n-heksana dan dibiarkan selama 2 hari Disaring
Ampas Maserat III
Dikumpulkan Diuapkan dengan
rotary evaporator
Lampiran 4 (lanjutan)
3. Bagan isolasi senyawa triterpenoid/steroid dari ekstrak n-heksana daun nipah
Ekstrak n-heksana
heksana : etilasetat pada berbagai perbandingan, fase diam = silika gel GF254, penampak bercak LB
Lampiran 5.Perhitungan hasil karakterisasi serbuk simplisia daun nipah
I. Perhitungan penetapan kadar air simplisia
% Kadar air =0,20 ml
5,0120 gx100% = 3,93%
% Kadar air =0,25ml
5,0230gx 100 % = 4,98%
% Kadar air =0,3
0 ml
5,0160 gx 100 % = 5,98 %
% Kadar air rata-rata = 3,93 % + 4,98 % + 5,98 %
3 = 4,98 %
No Berat sampel (gram) Volume air (ml)
1 5,0120 g 0,20 ml
2 5,0230 g 0,25 ml
3 5,0160 g 0,30 ml
% Kadar air= volume air (ml)
Lampran 5 (lanjutan)
II. Perhitungan penetapan kadar sari yang larut dalam air
No Berat sampel
% Kadar sari larut dalam air rata-rata=21,18 % + 21,82 %+ 23,97 %
3 = 22,32%
% kadar sari yang larut dalam air =berat sari air berat sampelx
100
Lampiran 5 (lanjutan)
III. Perhitungan penetapan kadar sari yang larut dalam etanol
Kadar sari larut dalam air = 0,154 g
% Kadar sari larut dalam etanol rata-rata = 15,27% + 20,27%+ 18,52%
3 = 18,02 %
No Berat sampel (gram) Berat sari etanol (gram)
1 5,0430 0,154
2 5,0320 0,204
3 5,0210 0,186
% kadar sari yang larut dalam etanol =berat sari air berat sampelx
100
Lampiran 5 (lanjutan)
IV. Perhitungan penetapan kadar abu total
% Kadar abutotal =0,1634
2,0105x 100 % = 8,12 %
% Kadar abutotal =0,1521
2,0311x 100 % = 7,43 %
% Kadar abu total =0,1674
2,0163x 100 % = 8,30 %
% Kadar abu total rata-rata = 8,12%+ 7,43%+8,30%
3 = 7,96 %
No Berat sampel (gram) Berat abu (gram)
1 2,0105 0,1634
2 2,0311 0,1521
3 2,0163 0,1674
% kadar abu total = berat abu
% Kadar abu tidak larut asam = berat abu tidak larut asam
berat sampel x 100 % Lampiran 5 (lanjutan)
V.Perhitungan penetapan kadar abu yang tidak larut dalam asam
% Kadar abu tidak larut asam =0,0396
2,0105x 100 % = 1,97 %
% Kadar abu tidak larut asam =0,0424
2,0311x 100 % = 2,09 %
% Kadar abu tidak larut asam =0,0401
2,0163x 100 % = 1,99 %
% Kadar abu tidak larut asam rata-rata = 1,97% +2,09%+ 1,99%
3 = 2,02 %
No Berat sampel (gram)
Berat abu tidak larut asam (gram)
1 2,0105 0,0396
2 2,0311 0,0424
Lampiran 6.Gambar kromatogram ekstrak n-heksanadaun nipah dengan fase gerak n-heksana-etilasetat.
Keterangan:
Fase diam = plat pra lapis tipis silika gel 60 F254, penampak bercak = Liebermann-Burchardt, tp = titik awal penotolan, bp = batas pengembang, 1 = merah ungu, 2 = ungu.
90 : 10 80 : 20 70 : 30 60 : 40 50 : 50
tp bp
1
1
1
1 1
2
2
2
2
Lampiran 7.Gambar kromatogram ekstrak daun nipah dengan KLT preparatif
Keterangan:
Fase diam = plat pra lapis silika gel 60 F254, fase gerak= n-heksana:etilaset(70 : 30),penampak bercak = Liebermann burchadt, tp = titik awal penotolan, bp = batas pengembang, u = ungu, mu = merah ungu.
bp
tp mu
Lampiran 8.Gambar kromatogram KLT satu arah dari isolat I dengan fase gerak yang berbeda.
Keterangan:
Fase diam = plat pra lapis silika gel GF254, fase gerak= I. n-heksana-etilasetat(90:10), II. benzen-n-heksana-etilasetat(90:10), III. n-heksana-etilasetat(70:30), penampak bercak = Liebermann burchadt, tp = titik awal penotolan, bp = batas pengembang,
= merah ungu
1 II III
Lampiran 9.Gambar kromatogram KLT satu arah dari isolat II dengan fase gerak yang berbeda.
Keterangan:
Fase diam = plat pra lapis silika gel GF254, fase gerak = I. n-heksana-etilasetat(70:30), II. benzen-n-heksana-etilasetat(70:30), III. n-heksana-etilasetat(30:70), penampak bercak = Liebermann burchadt, tp = titik awal penotolan, bp = batas pengembang,
= ungu.
I II III
Lampiran 10.Gambar kromatogram KLT dua arah isolat I dengan fase gerak yang berbeda.
Keterangan:
Fase diam = plat pra lapis silika gel GF254, fase gerak1 = benzen-etilasetat(90:10), fase gerak 2 = n-heksana-etilasetat(70:30), penampak bercak = Liebermann burchadt, tp = titik awal penotolan, = merah ungu
tp
Fase Gerak II
F
as
e G
er
ak
Lampiran 11.Gambar kromatogram KLT dua arah isolat II dengan fase gerak yang berbeda.
Keterangan:
Fase diam = plat pra lapis silika gel GF254, fase gerak1 = benzen-etilasetat(70:30), fase gerak 2 = n-heksana-etilasetat(70:30), penampak bercak = Liebermann burchadt, tp = titik awal penotolan, = ungu
tp
F
as
e G
er
ak I
Lampiran 13. Gambar spektrum senyawa triterpenoid/steroid isolat I dengan spektrofotometer inframerah
Lampiran 15. Gambar spektrum senyawa triterpenoid/steroid isolat II dengan spektrofotometer inframerah isolat
DAFTAR PUSTAKA
Adnan, M. (1997).Teknik Kromatografi Untuk Analisis Bahan Makanan. Yogyakarta: ANDI. Hal: 9-22.
Batee, E. (2014). Karakterisasi Dan Isolasi Senyawa Triterpenoid/Steroid Daun Kelapa Sawit (Elaeis guineensisJacq.). Skripsi. Medan: Fakultas Farmasi Universitas Sumatera Utara. Hal: 5.
Creswell, C.J., Runguist, O. A., dan Campbell, M. M. (1982).Spectrum Analysis Of Organic Compound. Penerjemah: Padmawinata, K., dan Soediro, I. (2005).Analisis Spektrum Senyawa Organik. Edisi Ketiga. Bandung: Penerbit ITB. Hal. 29.
Dachriyanus. (2004).Analisis Struktur Senyawa Organik Secara Spektroskopi.Padang: Andalas University Press. Hal.21-37.
Depkes, RI.(1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI.Hal.127-138.
Depkes, RI.(2000). Parameter Pembuatan Ekstrak Tumbuhan Obat.Jakarta: Departemen Kesehatan RI. Hal.10-11.
Ditjen, POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 7.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants.Journal of Pharmaceutical Science. March 1996 Volume 55 Number 3. Hal: 252-253
Gandjar, I.G., dan Rohman, A.,(2012). Analisis Obat Secara Spektrofotometri dan Kromatografi.Yogyakarta. Pustaka Pengajar. Hal. 59-118.
Gritter, R.J., Bobbit, J., dan Schwarting, A.E. (1985).Introduction To Chromatography. Penerjemah: Padmawinata, K. (1991).Pengantar Kromatografi. Bandung: ITB. Hal.107-146.
Grover, V.K., Babu, R., dan Bedi, S. P. S. (2007).Steroid Therapy – Current Indications in Practice.Indian Journal of Anaesthesia. 51(5): 389-391. Harborne, J.B. (1984).Phytochemical Methods. Penerjemah: Padmawinata, K.,
dan Soediro, I. (1987).Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan.Edisi kedua.Bandung: Penerbit ITB.Hal. 147. Harmita.(2007). Analisis Fisikokimia Potensiometri Dan Spektroskopi.Jakarta:
Heriyanto, N.M., Subiandono, E., dan Karlina, E. (2011).Potensi Dan Sebaran Nipah (Nypa fruticans Wurmb.) Sebagai Sumberdaya Pangan. Bogor: Pusat Litbang Konversi dan Rehabilitasi. Hal. 328.
Hernani, dan Djauhariya, E. (2004).Gulma Berkhasiat Obat. Jakarta: Penebar Swadaya. Hal. 1.
Heyne, K. (1950). De Nuttige Planten Van Indonesie. Penerjemah: Badan Litbang Kehutanan. (1987).Tumbuhan Berguna Indonesia. Jilid I. Jakarta: KKDK. Hal: 487-488
Hostettmann, K., Hostettmann, M., dan Marston, A. (1986).Preparative Chromatography Techniques.Penerjemah: Padmawinata, K. (1995).Cara Kromatografi Preparatif.Bandung: ITB. Hal.9-11.
Johnson, E. L., dan Stevenson, R. (1978).Basic Liquid Chromatography.Penerjemah: Padmawinata, K. (1991).Dasar Kromatografi Cair. Bandung: ITB. Hal: 1.
Muktiningsih, S.R., Muhammad, S., Harsana, I.W., Budi, M., dan Panjaitan, P. (2001).Riview Tanaman Obat Yang Digunakan Oleh Pengobat Tradisional di Sumatera Utara, Sumatera Selatan, Bali, dan Sulawesi Selatan. Media Lithang Kesehatan Volume XI Nomor 4.Hal. 25.
Natsir, R. (2013). Hubungan Salinitas Perairan Dengan Kuantitas Bioetanol Yang Dihasilkan Oleh Nipah (Nypa fruticans) Pada Berbagai Metode.Skripsi.
Makassar: Universitas Hasanuddin. Hal: 1-2.
Nurani, P. (2015). Skrining Fitokimia Dan Uji Aktivitas Antibakteri Ekstrak Etanol Daun Nipah Terhadap Staphylococcus aureus Dan Escherichia coli.Skripsi. Medan: Fakultas Farmasi Universitas Sumatera Utara. Hal: 40 dan 62.
Purnobasuki, H. (2004). Potensi Mangrove Sebagai Tanaman Obat. Surabaya: Universitas Airlangga. Hal. 125.
Putri, I.J., Fauziah, dan Elfita. (2012). Aktivitas Antioksidan Daun dan Biji Buah Nipah (Nypa Fruticans) Asal Pesisir Banyuasin Sumatera Selatan Dengan Metode DPPH dalam Maspari Journal Volume 5 Nomor 1.Palembang: Universitas Sriwijaya. Hal. 2.
Rizki, Sari, T, M., dan Leilani, I. (2012).Jenis Tumbuhan Mangrove Yang diManfaatkan Masyarakat Sebagai Bahan Obat di Kanagarian Mangguang Pariaman dalam BioETI.Padang: FMIPA.Universitas Negeri Padang.Hal. 114.
Rohman, A. (2009). Kromatografi Untuk Analisis Obat. Yogyakarta: Graha Ilmu. Hal. 51.
Sari, D. P., Agus, P., dan Kansih, S. H. (2012).Analisis Finansial Pemanfaatan Daun Nipah (Nypa fruticans Wurmb.) Sebagai Bahan Baku Pembuatan Pembungkus Rokok.Medan: Universitas Sumatera Utara.Hal.1-2.
Sastrohamidjojo, H. (1985).Kromatografi.Yogyakarta: Liberty. Hal. 22-36. Sastrohamidjojo, H.(1985).Dasar Spektroskopi. Yogyakarta: Liberty.Hal. 71. Silverstein, R.M., Bassler, G.C., dan Morrill, T. C. (1981).Spectrometric
Identification Of Organic Compounds. Fourth Edition. Penerjemah: Hartomo, A. J., dan Purba, A. V. (1984).Penyidikan Spektrofotometri Senyawa Organik.Edisi Keempat. Jakarta: Erlangga. Hal.95-105.
Siregar, B. S. (2012). Analisis Finansial Serta Prospek Pengolahan Buah Nipah (Nypa fruticans) Menjadi Berbagai Produk Olahan.Skripsi. Medan: Fakultas Pertanian Universitas Sumatera Utara. Hal.5-6.
Stahl, E. (1973). Drug Analysis By Chromatography And Microscopy: A Practical Supplement To Pharmacopoias. Penerjemah: Padmawinata, K., dan Sudiro, I. (1985).Analisis Obat Secara Kromatografi dan Mikroskopi.Bandung: ITB. Hal.3-18.
Steenis, V., Bloemberger.S., dan Eyma, P.J. (1947).Flora. Penerjemah: Surjowinoto, M., Hardjosuwarno, S., Adisejewo, S. S., Wibisono.,Partodidjojo, M., dan Wirjahardja, S. (1975). Flora.Jakarta: PT. Pradnya Paramita. Hal.135-136.
Supratman, U. (2010). Elusidasi Struktur Senyawa Organik Metode Spektroskopi Untuk Penentuan Senyawa Organik. Bandung: Widya Padjajaran.Hal. 1. Tsuji, K., Ghazalli, M. N. F., Ariffin, Z., Nordin, M. S., Khaidizar, M. I., Dullo,
M. E., dan Sebastian, L. S., (2011). Biological and Ethanobotanical Characteristics of Nipa Palm (Nypa fruticans Wurmb.).Malaysia: Sains Malaysiana.Hal. 1408.
Wagner, H., Bladt, S., danZyainski, E.M. (1984).Plant Drug Analysis a Thin Layer Chromatography Atlas. New York: Springer Verlay. Hal. 301.
Watson, D.G, (2005).Pharmaceutical Analysis: A Textbook For Pharmacy Students And Pharmaceutical Chemists. Second Edition.Penerjemah: Syarief, W. R. (2007). Analisis Farmasi Edisi kedua.Jakarta: Buku Kedokteran EGC. Hal.144-149.
BAB III
METODOLOGI PENELITIAN
Metode penelitian ini dilakukan secara eksperimental meliputi pengumpulan dan pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis fraksi n-heksana yang dilanjutkan dengan isolasi senyawa triterpenoid/steroid mengunakanKLT preparatif.Isolat yang diperoleh diuji kemurniannya dengan KLT satu arah dan dua arah, karakterisasi isolat dengan spektrofotometri ultraviolet dan inframerah.
3.1. Alat-alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas (Iwaki Pyrex), blender (Philips), mikroskop (Olympus), neraca analitik (Vibra AJ), neraca kasar (Homeline), oven listrik (Memmert), penangas air, penguap vakum putar (Stuart), seperangkat alat kromatografi lapis tipis, seperangkat alat penentu kadar air (Pyrex), spektrofotometer UV dan IR (Shimadzu) dan tanur (Nabertherm).
3.1.2 Bahan-bahan
Sampel yang digunakan adalah helaian daun nipah (Nypa fruticans
-heksana,raksa (II) klorida, silika gel 60GF254, serbuk magnesium, timbal (II) asetat dan toluen serta air suling.
3.2 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi meliputi pereaksi Liebermann-Bouchard (Wagner, dkk., 1984), asam sulfat 2 N, Molisch, Mayer, besi (III) klorida 1%, Dragendorff, Bouchardat, natrium hidroksida 2 N, asam nitrat 0,5 N dan timbal (II) asetat 0,4 M (Depkes, RI., 1995).
3.2.1 Pereaksi Liebermann-Burchard
Campur secara perlahan 5 ml asam asetat anhidrida dengan 5 ml asam sulfat pekat tambahkan etanol hingga 50 ml (Wagner, dkk., 1984)
3.2.2 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml asam sulfat pekat diencerkan dengan air suling secukupnya hingga volume 100 ml (Depkes, RI., 1995).
3.2.3 Pereaksi Molisch
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes, RI., 1995).
3.2.4 Pereaksi Mayer
Sebanyak 1,359 g raksa(II) klorida dilarutkan dalam air suling hingga 60 ml. Sebanyak 5 g kalium iodida pada wadah lain dilarutkan dalam 10 ml airsuling, kemudian keduanya campur dan ditambahkan air suling hingga 100 ml (Depkes, RI., 1995).
3.2.5 Pereaksi besi (III) klorida 10%
sehingga diperoleh larutan 100 ml (Depkes, RI., 1995). 3.3.6 Pereaksi Dragendorff
Sebanyak 0,6 g bismuth (III) nitrat ditimbang, dilarutkan dalam 2 ml asam klorida pekat, lalu ditambahkan 10 ml air suling. Pada wadah lain dilarutkan 6g kalium iodida dalam 10 ml air suling. Kemudian kedua larutan dicampurkan dengan 7 ml asam klorida pekat dan 15 ml air suling (Depkes, RI., 1995).
3.2.7 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling dan sebanyak 2 g iodium dilarutkan dalam larutan kalium iodida dan dicukupkan dengan air suling hingga 100 ml (Depkes, RI., 1995).
3.2.8 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 gkristal natrium hidroksida ditimbang, dilarutkan dalam air suling sehingga diperoleh larutan 100 ml (Depkes, RI., 1995).
3.2.9 Pereaksi asam nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga 100 ml (Depkes, RI., 1995).
3.2.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas CO2 hingga 100 ml (Depkes, RI., 1995).
3.3 Pengambilan Dan Pengolahan Sampel 3.3.1 Pengambilan sampel
Sumatera Utara. Pengambilan sampeldilakukan secara purposif tanpamembandingkan dengan sampel yang sama dari daerah lain.
3.3.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Jl. Raya Jakarta – Bogor Km. 46 Cibinong 16911 Bogor – Indonesia (Nurani, 2015).
3.3.3 Pembuatan simplisia
Helaian daun nipah dibersihkan daripengotor dan tulang daunnya dibuang,dicucidengan air bersih,ditiriskan lalu ditimbang berat basahnya.Selanjutnya dikeringkan di lemari pengering pada suhu ± 40°C hingga rapuh.Sampel yang telah kering diserbuk dengan blender dan disimpan dalam wadah kering tertutup rapat.
3.4 Karakterisasi Simplisia
Karakterisasi simplisia meliputi penetapan kadar air (WHO, 1998), penetapan kadarabu, penetapan kadar abu tidak larut dalam asam, penetapan kadar sari yang larut dalam air dan penetapan kadar sari yang larut dalam etanol (Depkes, RI., 1995).
3.4.1 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alatterdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung dan tabung penerima 10 ml.
a. Penjenuhan toluen
alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 g simplisia yang telah ditimbang seksama dimasukkan kedalam labu alas bulat.Kemudian labu dipanaskan selama 15 menit.Setelah toluen mulai mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan dinaikkan sampai 4 tetes untuk tiap detik.Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen.Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat di dalam bahan yang diperiksa. Kadar air dihitung dalam persen terhadap berat sampel yang telah dikeringkan.
3.4.2 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia yang telah digerus ditimbang seksama, dimasukkan ke dalam krus porselen yang telah terlebih dahulu dipijar dan ditara, kemudian diratakan.Krus dipijarkan sampai bobot tetap.Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara.
3.4.3 Penetapan kadar abu yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas. Residu dankertas saring dipijar sampai bobot tetap.Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara.
3.4.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisiadimaserasi selama 24 jam dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasarkan rata yang telah ditara.Sisa dipanaskan sampai kering pada suhu 105oC hingga bobot tetap.Kadar sari yang larut dalam air dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
3.4.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dengan 100 ml etanol (95%) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring dengan cepat untuk menghindarkan penguapan dari etanol, sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara.Sisa dipanaskan sampai kering pada suhu 105oC hinggabobot tetap.Kadar sari yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
3.5 Skrining Fitokimia
3.5.1 Pemeriksaan triterpenoid/steroid
Sebanyak 1 gserbuk simplisiadirendam dengan 20 ml n-heksana selama 2 jam kemudian disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisanya ditambahkan pereaksi Liebermann-Burchard(LB) (Farnsworth, 1966).Timbulnya warna merah ungu atau hijau biru menunjukkan adanya triterpenoid/steroid.
3.5.2 Pemeriksaan alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
a. diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer b. diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat c. diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan di atas.
3.5.3 Pemeriksaan glikosida
digunakan untuk percobaan berikut: larutan sisa dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air, sisanya ditambahkan 2 ml air dan 5 tetes pereaksi Molisch kemudian ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung. Jika terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya gula.
3.5.4 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, ditambahkan 5 ml asam sulfat 2 N, dipanaskan sebentar, didinginkan. Ditambahkan 10 ml benzena, dikocok dan didiamkan.Lapisan benzena dipisahkan dan disaring.Lapisan benzena dikocok dengan 2 ml natrium hidroksida 2 N dan didiamkan.Jika lapisan air berwarna merah intensif dan lapisan benzena tidak berwarna menunjukkan adanya glikosida antrakinon.
3.5.5 Pemeriksaan flavonoid
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, kedalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol.
3.5.6 Pemeriksaan saponin
3.5.7 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, disari dengan 10 ml air suling selama 15 menit lalu disaring. Filtratnya diencerkan dengan air suling sampai tidak berwarna.Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes larutan pereaksi besi (III) klorida 10 %.Apabila terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin.
3.6 Pembuatan Ekstrak
Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut n -heksana.
Cara kerja:
Serbuk simplisia sebanyak 400 g dimasukkan ke dalam wadah kaca berwarna gelap, lalu ditambahkan pelarut n-heksana sampai serbuk simplisia terendam, dibiarkan selama 2 hari sambil sekali-kali diaduk. Pisahkan maserat, ampas dimaserasi kembali dengan pelarut n-heksanadengan cara yang sama di atas, maserat dipisahkan. Semua maserat yang diperolehdigabung, kemudian diuapkan dengan alat rotary evaporatordengan suhu ±40oC, hasilnya diperoleh ekstrak.
3.7 Analisis Ekstrak n-Heksana Secara KLT
Cara kerja:
Ekstrak n-heksana daun nipah ditotolkan pada plat pra lapis silikal gel 60 GF254 yang sebelumnya telah diaktifkan, kemudian dimasukkan ke dalam chamber yang telah jenuh dengan uap pengembang dan ditutup rapat. Sesudah pengembangan selesai plat dikeluarkan dan dikeringkan di udara, plat disemprot dengan larutan penampak bercak pereaksi LB. Warna bercak yang terjadi diamati dan dihitung harga Rf-nya.
3.8 Isolasi Senyawa Triterpenoid/Steroid Secara KLT Preparatif
Isolasi senyawa triterpenoid/steroid dilakukan secara KLT preparatif, sebagai fase gerak digunakan n-heksana-etilasetat (70:30)dan sebagai penampak bercak digunakan pereaksi LB.
Cara kerja:
dielusidenganpelarutmetanol,kemudiandilakukanujikemurnian terhadap isolat yang diperoleh.
3.9 Uji Kemurnian Isolat
3.9.1 Uji kemurnian isolat dengan KLT satu arah
Terhadap isolat I dilakukan uji kemurnian dengan KLT satu arah menggunakanfase diam plat pra lapis silika gel 60 GF254, fase gerak n -heksana-etilasetat(70:30), benzen-etilasetat (90:10), dann-heksana-etilasetat (90:10) dan sebagai penampak bercak digunakan pereaksi LB,sedangkan terhadap isolat II dilakukan uji kemurnian dengan KLT satu arah menggunakanfase diam plat pra lapis silika gel 60 GF254,fase gerak n-heksana-etilasetat(70:30), benzen-etilasetat (70:30)dan n-heksana-etilasetat (30:70), sebagai penampak bercak digunakan pereaksi LB.
Cara kerja:
Isolat ditotolkan pada plat pra lapis silika gel 60 GF254 yang sebelumnya telah diaktifkan, kemudian dimasukkan ke dalam masing-masing bejana kromatografi yang telah jenuh dengan uap pengembang dan ditutup rapat. Sesudah elusi selesai plat dikeluarkan dari bejana kromatografi dan dikeringkan di udara, kemudian plat disemprot dengan larutan penampak bercak pereaksi LB. Warna bercak yang terjadi diamati dan dihitung harga Rf-nya.
3.9.2 Uji kemurnian isolat dengan KLT dua arah
sebagai penampak bercak digunakan pereaksi LB. Sedangkan terhadap isolat II dilakukan uji kemurnian dengan KLT dua arah menggunakan fase diam plat pra lapis silika gel 60 GF254, fase gerak pertama benzen-etilasetat (70:30), fase gerak kedua n-heksana-etilasetat (70:30) dan sebagai penampak bercak digunakan pereaksi LB.
Cara kerja:
Isolat ditotolkan pada plat pra lapis silika gel 60 GF254 yang sebelumnya telah diaktifkan, kemudian dimasukkan ke dalam bejana kromatografi yang telah jenuh uap pengembang fase gerak pertamadan ditutup rapat. Sesudah pengembangan selesai plat dikeluarkan dari bejana kromatografi, lalu diputar 90o dimasukkan ke dalambejana kromatografi yang telah jenuh uap pengembang fase gerak kedua dan ditutup rapat. Setelah selesai elusi plat dikeluarkan dan dikeringkan di udara, kemudian plat disemprot dengan larutan penampak bercak pereaksi LB. Warna bercak yang terjadi diamati dan dihitung harga Rf-nya.
3.10 Karakterisasi Isolat
Karakterisasi senyawa triterpenoid/streroid hasil isolasi dilakukan dengan spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
3.10.1 Karakterisasi isolat dengan spektrofotometri UV
Karakterisasi isolat dengan spektrofotometri ultraviolet dilakukan dengan caramelarutkan senyawa hasil isolasi dengan metanol kemudian diukur
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sampel
Hasil identifikasi yang dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI) terhadap bahan yang diteliti adalah tumbuhan nipah(Nypa fruticansWurmb.) suku Arecaceae (Nurani, 2015).Hasilnya dapat dilihat pada Lampiran 1, halaman 47 dan Gambar tumbuhan pada Lampiran 2, halaman 48.
4.2 Karakterisasi Simplisia
Hasil karakterisasi simplisia daun nipah dapat dilihat pada Tabel 4.1 dibawah ini dan perhitungannya pada Lampiran 5, halaman 55-59.
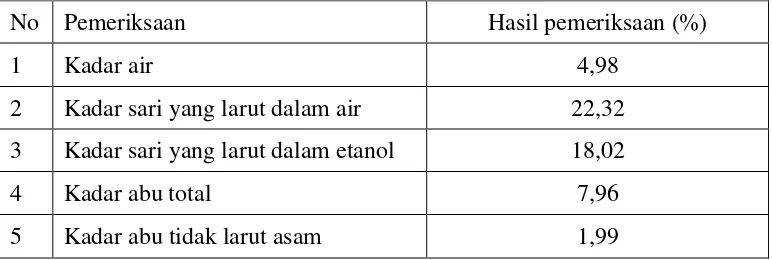
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia daun nipah
No Pemeriksaan Hasil pemeriksaan (%)
1 Kadar air 4,98
2 Kadar sari yang larut dalam air 22,32 3 Kadar sari yang larut dalam etanol 18,02
4 Kadar abu total 7,96
Hasil pengujian karakterisasi simplisia daun nipah diperoleh kadar air sebesar 4,98%, ini memenuhi persyaratan pada MMI yaitu tidak lebih dari 10 %, karena jika melebihi persyaratan, memungkinkan terjadinya pertumbuhan jamur.
Penetapan kadar sari yang larut dalam air dilakukan untuk mengetahui zat-zatyang tersari dalam pelarut air. Sedangkan penetapan kadar sari yang larut dalam etanol menyatakan zat-zat yang tersari dalam pelarut etanol, yang bersifat polar dan non polar.Kadar sari yang larut dalam air sebesar 22,32% lebih tinggi dibandingkan yang larut dalametanol sebesar 18,02%.Halini menunjukan bahwa zat-zat yang terlarut lebih banyak pada pelarut air.Penetapan kadar abu dilakukan untuk mendestruksi serta menguapkan senyawa organik dan turunannya sehingga yang tersisa senyawa anorganik, misalnya logam Cd, Pb dan silika sedangkan kadar abu tidak larut asam untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam misalnya silika (Depkes,RI.,2000).
4.3 Skrining Fitokimia
Skrining fitokimia terhadap simplisia daun nipah dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang ada didalam simplisia daun nipah.Hasil skrining fitokimia serbuk simplisia daun nipah dapat dilihat pada Tabel 4.2 dibawah.
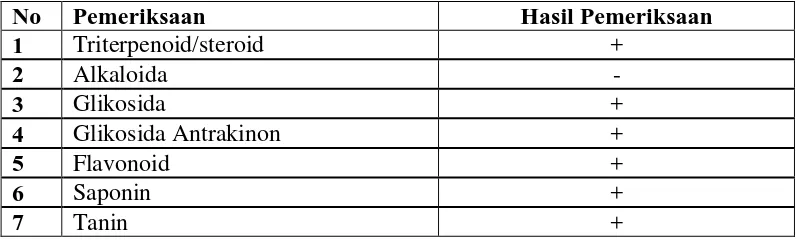
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia daun nipah
No Pemeriksaan Hasil Pemeriksaan
1 Triterpenoid/steroid +
Keterangan: (+) = mengandung golongan senyawa (–)= tidak mengandung golongan senyawa
Skrining fitokimia simplisia daun nipah diperoleh senyawa golongan glikosida, saponin, flavonoid, tanin, dan triterpenoid/steroid.Penambahan pereaksi Molisch dan asam sulfat pekat membentuk cincin berwarna ungu yang menunjukkanadanya senyawa glikosida. Terbentuknya busa yang stabil dengan pengocokan dalam air dan tidak hilang dengan penambahan HCl 2N menunjukkan adanya senyawa saponin (Depkes, RI., 1995). Penambahan serbuk Mg dan asam klorida pekat menghasilkan larutan warna merah dan dengan penambahan amil alkohol, warna merah tertarik pada lapisan amil alkohol yang menunjukkan adanya flavonoid. Penambahan FeCl3 memberikan warna biru kehitaman yang menunjukkan adanya senyawatanin. Penambahan pereaksi LBmembentuk warna biru-hijau, ungu, dan merah ungu yang menunjukkan adanya senyawa triterpenoid/steroid (Farnsworth, 1966). Sedangkan penambahan larutan pereaksi mayer, bouchardat, dan dragendorf tidak memberikan hasil sehingga tidak terbuktikan adanya kandungan senyawa alkaloid pada sampel.
4.4 Ekstraksi Serbuk Simplisia
Hasil ekstraksi serbuk simplisia secara maserasi dengan pelarut n-heksana dari 400 g diperoleh ekstrak kering sebanyak 4,06 g (rendemen 1,015 %).
4.5 Analisis Ekstrak n-Heksana Secara KLT
perbandingan (90:10), (80:20),(70:30), (60:40) dan (50:50)diperoleh kromatogram yang dapatdilihat pada Lampiran 6, halaman60 dan harga Rf darimasing-masing perbandingan fase gerak dilihat pada Tabel 4.3.
Tabel 4.3 Harga Rf Hasil analisis KLT ekstrak n-heksana daun nipah.
NO
Harga Rf
Fase gerak N-heksana-etilasetat, fase diam plat lapis tipis silika gel 60GF254 90 : 10 80 : 20 70 : 30 60 : 40 50 : 50 1 0,05 (h) 0,16 (h) 0,36 (h) 0,62 (h) 0,85 (u) 2 0,14 (u) 0,25 (h) 0,56 (h) 0,77 (u) 0,91 (h) 3 0,25 (mu) 0,36 (h) 0,61 (u) 0,81 (h) 0,95 (mu)
4 - 0,40 (u) 0,68 (h) 0,87 (mu) -
5 - 0,56 (mu) 0,73 (mu) - -
Keterangan: h = hijau, u = ungu, mu= merah ungu
Hasil KLT menunjukan fase gerak yang memberikan pemisahan terbaik adalah n-heksana-etilasetat dengan perbandingan(70:30) karena memberikanbercak lebihdominan.Terlihat padaGambar 4.1 berikut:
1
Gambar 4.1. Kromatogram ekstrak heksana daun nipah dengan fase gerak n-heksana-etilasetat (70:30), 1 = merah ungu, 2 = ungu
Selanjutnya dilakukan pemisahandengan KLT preparatifmenggunakan fasegerakn-heksan–etilasetat dengan perbandingan (70:30) untuk mendapatkan senyawa triterpenoid/steroid dalam jumlah yang lebih banyak.
4.6 KLT Preparatif
Hasil KLT preparatif dari ekstrak n-heksan daun nipah denganfase gerak n-heksan-etilasetat (70:30), fase diam silika gel 60 GF254, dan penampak bercak Liebermann Burchard diperoleh dua noda triterpenoid/steroid yaitu noda I berwarna merah ungu dan noda II berwarna ungu. Gambar kromatogram dapat dilihat pada Lampiran 7,halaman 61.
4.7 Uji Kemurnian Isolat 4.7.1 Isolat I
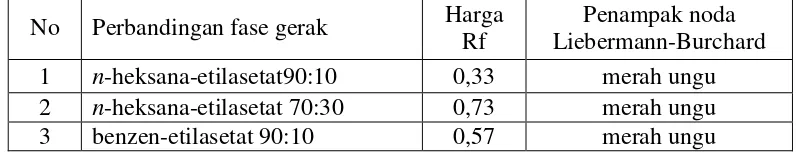
Hasil uji kemurnian dari KLT satu arahmenggunakan fase gerak n -heksana-etilasetat dengan perbandingan (90:10), (70:30) dan benzen-etilasetat (90:10) dengan penampak pereaksi LB menunjukkan satu bercak tunggal berwarna merah ungu. Harga Rf dapat dilihat pada Tabel 3.4 dan hasil kromatogram dapat dilihat pada Lampiran 8, halaman 62.
Tabel 4.4Harga Rfuji kemurnian isolat I
No Perbandingan fase gerak Harga Rf
Hal ini menunjukkan bahwa triterpenoid/steroid yang dihasilkan dari proses KLT preparatif telah menunjukan satu noda.
Pemeriksaan uji kemurnian isolat I dengan KLT dua arah menggunakan fase gerak pertamabenzen-etilasetat (90:10), dan fase gerak kedua n-heksan-etilasetat (70:30) dengan penampak bercak pereaksi LB, hasilnya tetap memberikan satu bercak warna merah ungu dengan harga Rf 0,73. Gambar kromatogram dapat dilihat pada Lampiran 10, halaman 64.
Hasil KLT satu arah dan KLT dua arah terhadap isolat I telah diperoleh satu bercak tunggal berwarna merah ungu. Hal ini menunjukan bahwa isolat I yang diperoleh dianggap telah murni.
4.7.2 Isolat II
Hasil uji kemurnian dari KLT satu arah menggunakan fase gerak n -heksana-etilasetat dengan perbandingan (70:30), (30:70) dan benzen-etilasetat (70:30) dengan penampak pereaksi LB menunjukkan satu bercak tunggal berwarna ungu. Harga Rf dapat dilihat pada Tabel 3.5 dan hasil kromatogram dapat dilihat pada Lampiran 9, halaman 63.
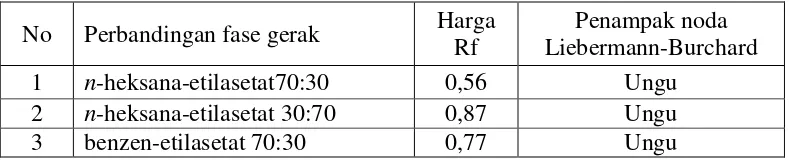
Tabel 4.5Harga Rfuji kemurnian isolat II
No Perbandingan fase gerak Harga Rf
Penampak noda Liebermann-Burchard 1 n-heksana-etilasetat70:30 0,56 Ungu
2 n-heksana-etilasetat 30:70 0,87 Ungu 3 benzen-etilasetat 70:30 0,77 Ungu
Pemeriksaan uji kemurnian isolat II dengan KLT dua arah menggunakan fase gerak pertamabenzen-etilasetat (70:30), dan fase gerak kedua n-heksan-etilasetat (70:30) dengan penampak bercak pereaksi LB, hasilnya tetap memberikan satu bercak warna ungu dengan harga Rf 0,56. Gambar kromatogram dapat dilihat pada Lampiran 11, halaman 65.
Hasil KLT satu arah dan KLT dua arah terhadap isolat II diperoleh satu bercaktunggal berwarna ungu. Hal ini menunjukan bahwa isolat II yang diperoleh dianggap telah murni.
4.8 Karakterisasi Isolat Dengan Spektrofotometri UV dan IR
Spektrum ultraviolet isolat I dan isolat II memberikan panjang gelombang absorpsi maksimum yang sama yaitu pada panjang gelombang201,8nm.Gambar spektrum spektrofotometri UV dapat dilihat pada Lampiran 12 dan 14 halaman 66 dan 68.
Absorpsi cahaya dapat terjadi akibat adanya gugus kromofor yang terdapat pada isolat I dan isolat II (Silverstein, dkk., 1986).Energi yang diserap oleh gugus kromofor akan menyebabkan terjadinya transisi elektron ke tingkat yang lebih tinggi. Gugus kromofor yang memberikan transisi elektron dari π π* akan menyerap pada panjang gelombang maksimum sekitar 200 nm. Contoh gugus
kromofor jenis π π* yaitu C=C dan C≡C (Creswell, dkk., 1972).
Sedangkan molekul yang memerlukan energi lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang (Supratman,2010).
Hasil spektrofotometriinframerahisolat I menunjukkan pita serapan yang melebar pada daerah bilangan gelombang3402,43 cm-1 yang diduga merupakan gugus fungsi OH (3200-3600 cm -1), namun masih perlu dilakukan identifikasi untuk mengetahui apakah gugus OH ini berasal dari isolat I atau berasal dari pelarut, karena pelarut yang digunakan adalah metanol. Gugus OH diperkuat dengan adanya serapan pada 1091,71 cm-1yang merupakan serapan dari gugus fungsi C-O. Serapan pada 2916,37 cm-1 dan 2850,79 cm-1 menunjukkan adanya gugus C-H alifatik, dan 1620,21 cm-1 menunjukkan adanya gugus C=C, pada1462,04 cm- menunjukkan adanya CH2. Pada Isolat I tidak ditemukan adanya cincin aromatik karena tidak diperoleh serapan C-H aromatik pada bilangan gelombang diatas 3000 cm-1(Watson, D.G, 2005; Dachriyanus, 2004; Harmita, 2009; Silverstein, dkk., 1981). Gambar spectrum inframerah isolat I dapat dilihat pada Lampiran 13, halaman 67.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil karakterisasi serbuk simplisia daun nipah (Nypa fruticansWurmb.)yaitu kadar air 4,98%, kadar sari yang larut dalam air 22,32%, kadar sari yang larut dalam etanol 18,02% kadar abu total 7,96% dan kadar abu yang tidak larut dalam asam 1,99%.
b. Hasil skrining fitokimia serbuk simplisia diperoleh adanya senyawa flavonoid, glikosida,antrakuinon, tanin, saponin dan triterpenoid/steroid.
c. Hasil isolasi ekstrak n-heksana daun nipah (Nypa fruticans Wurmb.)
diperoleh isolat I harga Rf 0,73 dan isolat II harga Rf 0,56 dengan fase gerak n-heksana-etilasetat (70:30). Hasil spektrofotometri ultraviolet untuk isolat I dan II mempunyai panjang gelombang absorpsi maksimum yang sama yaitu 201,8 nm.Spektrofotometri inframerah untuk isolat I menunjukkan adanya gugus O-H, C-H alifatis, CH2, C=C dan C-O dan untuk isolat IIadanya gugus O-H, C-H alifatis, C-O, dan C=C.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan 2.1.1 Morfologi tumbuhan
Nipah mirip sekali dengan tumbuhan sago muda, akan tetapi nipah tidak berduri dan tidak berbatang. Daun-daunnya timbul pada sebuah rimpang mendatar yang terbenam di dalam tanah berlumpur (Heyne, 1950).Akar serabut dapat mencapai panjang 13 meter. Dari rimpang tumbuh daun majemuk setinggi 3-8,5 meter dengan tangkai daun sekitar 1-1,5 m (Steenis, dkk., 1947). Panjang anak daun dapat mencapai 100 cm dan lebar daun 4-7 cm. Daun nipah yang masih muda berwarna kuning sedangkan yang tua berwarna hijau.Daunnya seperti susunan daun kelapa (Siregar, 2012).
Bunga nipah majemuk muncul dari ketiak daun dengan bunga betina terkumpul di ujung membentuk bola dan bunga jantan tersusun dalam malai serupa untai merah, jingga atau kuning pada cabang di bawahnya.Panjang tangkai bunga mencapai 100-170 cm. Tandan bunga inilah yang dapat disadap untuk diambil niranya (Siregar, 2012).
Buah nipah berbentuk bulat telur dan gepeng, berwarna coklat kemerahan.Panjang buahnya sekitar 13 cm dengan lebar 11 cm (Siregar, 2012).Buah berkelompok membentuk bola berdiameter sekitar 30 cm, dalam satu tandan dapat terdiri antara 30-50 butir buah (Steenis, dkk., 1947).
2.1.2 Habitat tumbuhan
pasang surut air laut dan tumbuhan ini dikelompokan ke dalam ekosistem mangrove (Heriyanto, dkk., 2011).
2.1.3 Sistematika tumbuhan
Sistematika tumbuhan nipah menurut Nurani (2015), sebagai berikut: Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Class : Monocotyledoneae
Nipah dikenal dengan nama attap palm (Singapura), nipa palm (Filipina), chak (Thailand), dua la (Vietnam), dani (Myanmar) (Siregar, 2012; Tsuji, dkk., 2011).
2.1.5 Nama daerah
2.1.6Kandungan kimia
Nipah merupakan tumbuhan mangrove yang tumbuh secara berkelompok pada daerah yang terpengaruh oleh pasang surut air laut. Berdasarkan penelitian yang telah dilakukan hanya sedikit informasi tentang kandungan dari daun nipah, tetapi pada umumnya tumbuhan mangrove mengandung senyawa kimia seperti: senyawa alkaloid, saponin, tanin, benzoquinon, naphthoquinon, flavonoid, polifenol, sesquiterpen, diterpen, triterpen, sterol, karbohidrat, dan lemak (Purnobasuki, 2004).
2.1.7Kegunaan tumbuhan
Masyarakat telah menggunakan nipah dalam bidang pengobatan seperti obat sakit perut, diabetes, dan obat penurun panas oleh masyarakat pesisir perairan Banyuasin Sumatera Selatan. Masyarakat Kalimantan menggunakan arang dari akar tumbuhan nipah sebagai obat sakit gigi, dan sakit kepala (Putri,dkk., 2012), sebagai obat maag (Rizki, dkk., 2012), dan sebagai obat sinusitis (Purnobasuki, 2004).
2.2Uraian Kimia
2.2.1 Triterpenoid/steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualen. Senyawa tersebut mempunyai struktur siklik yang relatif kompleks kebanyakan merupakan suatu alkohol, aldehid atau asam karboksilat. Triterpenoid adalah senyawa tanpa warna, berbentuk kristal, sering kali bertitik leleh tinggi dan aktif optik, dapat dibagi atas 4 kelompok senyawa yaitu triterpen sebenarnyasteroid, saponin dan glikosida jantung (Harborne, 1984). Struktur kimia isopren dapat dilihat pada Gambar 2.1.
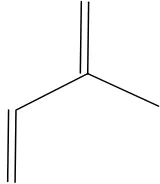
Gambar 2.1 Struktur kimia isoprene (Robinson, 1991)
Pembagian triterpenoid berdasarkan jumlah cincin yang terdapat pada struktur molekulnya (Robinson, 1991), antara lain:
a. triterpenoid asiklik, yaitu triterpenoid yang tidak mempunyai cincin tertutup dalam cincin molekulnya, contohnya skualen.
b. triterpenoid trisiklik, yaitu triterpenoid yang mempunyai tiga cincin tertutup dalam cincin molekulnya, contohnya ambrein.
d. triterpenoid pentasiklik, yaitu triterpenoid yang mempunyai lima cincin tertutup dalam cincin molekulnya, contohnya α-amirin. Contoh struktur kimia triterpenoid dapat dilihat pada Gambar 2.2- 2.6.
Gambar 2.2. Struktur dasar triterpen (Robinson, 1991)
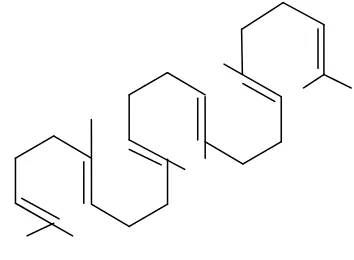
Gambar 2.3.Skualen (Robinson, 1991)
Gambar 2.5. Lanosterol (Robinson, 1991)
Gambar 2.6.α-Amirin (Harbone, 1984)
Steroid adalah triterpen yang kerangka dasarnya sistem cincin siklopentana perhidrofenanten (Harborne, 1984), dapat dilihat pada Gambar 2.7 berikut ini:
Gambar 2.7.Struktur dasar steroid dan sistem penomorannya (Robinson, 1991)
2
1
4 5
6 3
7 8
0 1
2
3
4 5
6
Senyawa steroid dahulu dianggap sebagai senyawa yang hanya terdapat pada hewan tetapi sekarang ini makin banyak senyawa steroid yang ditemukan dalam tumbuhan (fitosterol).Fitosterol merupakan senyawa steroid yang berasal dari tumbuhan.Senyawa fitosterol yang biasa terdapat pada tumbuhan tinggi yaitu sitosterol, stigmasteroldankampesterol (Harborne, 1984).
2.2.2 Alkaloid
Menurut Harborne, alkaloid adalah senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen yang terletak dalam sistem siklik. Alkaloid mempunyai aktivitas fisiologi yang menonjol sehingga digunakan secara luas dalam bidang pengobatan.
Ada tiga pereaksi yang sering digunakan dalam skrining fitokimia untuk mendeteksi golongan senyawa alkaloid sebagai pereaksi pengendapan yaitu pereaksi Mayer, Bouchardat dan Dragendroff (Farnsworth, 1966).
2.2.3 Glikosida
Glikosida adalah senyawa organik yang bila dihidrolisis menghasilkan satu atau lebih gula yang disebut glikon dan bagian bukan gula disebut aglikon.Gula yang paling sering dijumpai dalam glikosida adalah glukosa.Sacara kimia dan fisiologi, glikosida alam cenderung dibedakan berdasarkan bagian aglikonnya (Robinson, 1991).
Menurut Farnsworth (1966), berdasarkan hubungan ikatan antara aglikon dan glikonnya, glikosida dapat dibagi menjadi empat yaitu:
glikon dengan aglikon melalui atom N, contoh: krotonosidin.d. tipe C-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom C, contoh: barbaloin. 2.2.4 Flavonoid
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6, artinya kerangka karbonya terdiri atas dua gugus C6 (cincin benzene tersubstitusi) disambungkan oleh rantai alifatik tiga karbon (Robinson, 1991).Flavonoid mencangkup banyak pigmen yang banyak terdapat pada tumbuhan mulai dari jamur sampai angiospermae.Pada tumbuhan tinggi, flavonoid terdapat baik dalam bagian vegetatif maupun dalam bunga. Fungsi flavonoid pada tumbuhan adalah dapat menarik burung dan serangga yang membantu proses penyerbukan, pengatur tumbuh, pengatur fotosintesis, kerja antimikroba dan antivirus (Robinson, 1991).
2.2.5 Saponin
Saponin adalah sekelompok senyawa dengan struktur triterpenoid yang mengikat satu atau lebih gula sehingga memiliki sisi hidrofil dan lipofil dengan penggocokan akan menimbulkan buih (Batee, 2014). Saponin merupakan senyawa aktif permukaan yang kuat, dapat menimbulkanbusa jika dikocok dalam air, pada konsentrasi rendah sering menyebabkan hemolisis sel darah merah (Robinson, 1991). Uji saponin sederhana adalah dengan mengocok ekstrak alkohol air dari tumbuhan dalam tabung reaksi, maka akan terbentuk busa yang bertahan lama pada permukaan cairan (Harborne, 1984).
2.2.6 Tanin
mempunyai rasa sepat dan memiliki kemampuan menyamakan kulit.Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu (Harborne, 1984).
2.3 Ekstraksi
Ekstraksiadalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut menggunakanpelarut cair.Simplisia yang diekstraksi mengandung senyawa aktifyangdapat larut dan senyawa yang tidak dapat larut seperti serat, karbohidrat,protein dan lain-lain. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan kedalam golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Mengetahui senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dengan cara yang tepat(Depkes,RI., 2000).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan danmassa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Ditjen, POM., 1995).
2.3.1 Metode ekstraksi
Menurut Depkes, RI., (2000), ada beberapa metode ekstraksi yaitu: 1. Cara dingin
Ekstraksi dengan cara dingin terdiri dari: a. Maserasi
denganbeberapa kali pengocokan atau pengadukan pada temperatur ruang (kamar). Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus menerus).Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan maserat selanjutnya.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruang. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2. Cara panas
Ekstraksi dengan cara panas terdiri dari: a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya pada metode ini dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinue dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
ruangan, yaitu secara umum dilakukan pada temperatur 40-50°C. d. Infudasi
Infudasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 15 menit.
e. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit.
2.4 Kromatografi
Kromatografi adalah istilah umum untuk berbagai cara pemisahan berdasarkan partisi cuplikan antara fase bergerak, dapat berupa gas atau zat cair, dan fase diam, dapat berupa zat cair atau zat padat. Pada tahun 1903 Tswett menguraikan karyanya mengenai pemakaian kolom kapur untuk memisahkan pigmen dalam daun.Istilah kromatografi digunakan Tswett untuk menggambarkan daerah berwarna yang bergerak ke bagian bawah kolom (Johnson dan Stevenson, 1978).
Menurut Sastrohamidjojo (1985), cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari fase diam, yang berupa zat padat atau cair. Jika fase diam berupa zat padat disebut kromatografi serapan,jika berupa zat cair disebut kromatografi partisi. Karena fasegerak berupazat cair atau gas maka terdapat 4 macam sistem kromatografi, yaitu:
a. fase gerak zat cair - fase diam padat (kromatografi serapan): - kromatografi lapis tipis
- kromatografi kolom
- kromatografi gas - padat
c. fase gerak zat cair - fase diam zat cair (kromatografi partisi) - kromatografi kertas
d. fase gerak gas - fase diam cair - kromatografi gas - cair - kromatografi kolom kapiler
Pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan fase diam dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo, 1985).
2.4.1 Kromatografi lapis tipis
Kromatografi lapis tipis (KLT) adalah metode pemisahan fisikokimia.Lapisan yang memisahkan, yang terdiri atas bahan berbutir-butir (fase diam), ditempatkan pada penyangga berupa pelatgelas, logam, atau lapisan yang cocok. Campuran yang akan dipisahkan, berupa larutan, ditotolkan berupa bercak atau pita. Setelah plat atau lapisan diletakkan dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler. Senyawa yang tidak berwarna harus ditampakkan/dideteksi (Stahl,1973).
a. Fase diam (lapisan penyerap)
mikron.Partikel dengan butiran yang kasar tidak akan memberikan hasil pemisahan yang memuaskan (Sastrohamidjojo, 1985).Fase diam yang umum digunakan dalam KLT ada empat, yaitu: silika gel, alumina, kieselguhr, dan selulosa.
1. Silika gel
Silika gel merupakanfase diam yang paling sering digunakan dalam KLT. Adabeberapajenis silika gel yang dapat digunakan, yaitu: silika gel G,
silika gel H,dan silika gel PF (Adnan, 1997). 2. Alumina
Penggunaan alumina dalam KLT tidak sesering silikagel. Aluminadapat digunakan dalam memisahkan bermacam-macam senyawa seperti terpena, alkaloid, steroid, dan senyawa-senyawa alisiklik, alifatik, serta aromatik. Sebagai fase diam, alumina tidak mengandung zat perekat, mempunyai sifat sedikit alkalis dan dapat digunakan baik tanpa maupun dengan aktivasi (Adnan, 1997).
3. Kieselguhr dan selulosa
Kieselguhr dan selulosa merupakan bahan penyangga yang berbeda penggunaannya dari silika gel dan alumina karena fase diam ini digunakan dalam memisahkan senyawa polar seperti asam amino, karbohidrat, nukleotida (Gritter, dkk., 1991).
b. Fase gerak (pelarut pengembang)
yang bertujuan untuk memperoleh pemisahan senyawa yang baik. Kombinasi pelarut adalah berdasarkan atas polaritas masing-masing pelarut, sehingga dengan demikian akan diperoleh sistem pengembang yang cocok. Pelarut pengembang yang digunakan dalam kromatografi lapis tipis antara lain: n-heksana, karbontetraklorida, benzen, kloroform, eter, etilasetat, piridian, aseton, etanol, metanol dan air (Gritter, dkk., 1991).
c. Visualisai dan identifikasi noda
Visualisasi dimaksudkan untuk melihat komponen penyusun yang sudah terpisah setelah proses pengembangan. Visualisasi dapat dilakukan dengan berbagai macam cara, misalnya dapat digunakan uap iodium, sinar ultraviolet khususnya apabila digunakan adsorben yang mengandung fosfor. Cara lain yaitu dengan charringatau dengan penyemprotan menggunakan reagensia tertentu (Adnan, 1997).
d. Harga Rf
Mengidentifikasi noda-noda dalam kromatografi lapis tipis sangat lazim menggunakan harga Rf (Retardation Factor) mulai dari 0 sampai 1.
�� = Jarak titik pusat bercak dari titik awal Jarak garis depan pelarut dari titik awal
Faktor-faktor yang mempengaruhi harga Rf yaitu struktur kimia dari senyawa yang dipisahkan, sifat penjerap, tebal dan kerataan dari lapisan penjerap, pelarut dan derajat kemurniannya, derajat kejenuhan uap pengembang dalam bejana, teknik percobaan, jumlah cuplikan yang digunakan, suhu dan kesetimbangan (Sastrohamidjojo, 1985).
Salah satu metode pemisahan yang memerlukan pembiayaan paling murah dan memakai peralatan paling dasar adalah kromatografi lapis tipis preparatif (KLTP). Berbagai penelitian telah dilakukan untuk memeriksa pengaruh ketebalan dari penjerap terhadap kualitas pemisahan, tetapi ketebalan penjerap yang paling sering digunakan adalah 0,5-2 mm. Ukuran plat kromatografi yang digunakan biasanya 20 x 20 cm. Fase diam yang paling sering digunakan adalah silika gel dengan ukuran partikel dan mutu yangsamadengan yang digunakan pada kromatografi lapis tipis (Hostettmann, dkk., 1986).
Penotolan cuplikan dilakukan dengan melarutkan cuplikan dalam sedikit pelarut.Cuplikan ditotolkan berupa pita dengan jarak sesempit mungkin karena pemisahan tergantung pada lebar pita.Penotolan dapat dilakukan dengan pipet tetapi lebih baik dengan penotol otomatis.Pelarut yang baik untuk melarutkan cuplikan adalah pelarut yang atsiri. Pengembangan plat KLT preparatif dilakukan dalam bejana kaca yang dapat menampung beberapa plat. Bejana dijaga tetap jenuh dengan pelarut pengembang dengan bantuan kertas saring yang diletakkan berdiri disekeliling permukaan bagian dalam bejana. Pita ditampakkan dengan cara yang tidak merusak maka senyawa yang tidak berwarna dengan penjerap dikerok dari plat kaca. Cara ini berguna untuk memisahkan campuran beberapa senyawa sehingga diperoleh senyawa murni (Gritter, dkk., 1991).
2.4.3 Kromatografi lapis tipis dua arah
tertentu sehingga memungkinkan untukmelakukan pemisahan analit yang mempunyai tingkat polaritas yang hampir sama(Rohman, 2009).
Kromatografi lapis tipis dua arah dilakukan dengan melakukan penotolan sampel disalah satu sudut lapisan lempeng tipis dan mengembangkannya sebagaimana biasa dengan eluen pertama.Lempeng kromatografi selanjutnya dipindahkan dari chamber yang menggunakan eluen kedua sehingga pengembangan dapat terjadi pada arah kedua yang tegak lurus dengan arah pengembangan yang pertama.Suksesnya pemisahan tergantung pada kemampuan untuk memodifikasi selektifitas eluen kedua dibandingkan dengan selektifitas eluen pertama (Rohman, 2009).
2.5 Spektrofotometri Ultraviolet
Spektrofotometer UV pada umumnya digunakan untuk menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari suatu senyawa organik, menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa dan mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer (Dachriyanus, 2004).
Elektron yang terlibat dalam beberapa molekul organik padapenyerapan sinar UV adalah elektron sigma (δ), elektro phi (π) dannon bonding electron (n).Elektron δ merupakan elektron yang membentukikatan tunggal dan elektron π
terdapat ikatan rangkap (Gandjar dan Rohman, 2012).
Spektra inframerah mengandung banyak serapan yang dihubungkan dengan sistem vibrasi yang berinteraksi dalam molekul, dan karenamempunyai karakteristik yang unik untuk setiap molekul maka dalam spektrum memberikan pita-pita serapan yang karakteristik juga (Sastrohamidjojo, 1985).
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia memiliki keanekaragaman hayati yang luar biasa, yaitu 40.000 jenis tumbuhan, dari jumlah tersebut 1.300 diantaranya digunakan sebagai obat tradisional. Berdasarkan potensi ini produk obat tradisional Indonesia dapat dikembangkan secara luas (Mukhtiningsih,dkk.,2001).
Nipah atau Nypa fruticans Wurmb adalah anggota suku Arecaceae, tumbuh disepanjang sungai yang terpengaruh pasang surut air laut dan tumbuhan ini dikelompokkan kedalam ekosistem mangrove (Heriyanto,dkk., 2011). Secara tradisional telah digunakan sebagai obat seperti obat sakit perut, diabetes, dan obat penurun panas oleh masyarakat pesisir perairan Banyuasin Sumatera Selatan.Masyarakat Kalimantan menggunakan arang dari akar tumbuhan nipah sebagai obat sakit gigi, dan sakit kepala(Putri,dkk., 2012),sebagai obat maag (Rizki, dkk., 2012), dan sebagai obat sinusitis (Purnobasuki, 2004).
Senyawa triterpenoid/steroidmenunjukkan berbagai macam aktivitas fisiologi yang telah digunakan untuk pengobatan seperti penyakit diabetes, gangguan mensturasi, patukan ular, gangguan kulit, kerusakan hati, malaria dan beberapa senyawa lainnya yang bekerja sebagai antifungi, insektisida, antibakteri atau antivirus (Robinson, 1991), sebagai obat antiinflamasi, analgesik, antiemetik, mengatasi edema dan kerusakan saraf tulang belakang (Grover, dkk., 2007).
Menurut Hernani (2004),tumbuhan berkhasiat obat harus dilakukan upaya untuk isolasi senyawa murni dan turunannya sebagai bahan dasar obat modern atau pembuatan ekstrak untuk obat fitofarmaka. Salah satu cara yang dapat digunakan untuk mengidetifikasi senyawa murni hasil isolasi adalah dengan menggunakan metode spektroskopi karena dapat dilakukan dalam waktu singkat dan jumlah sampel yang sedikit (Supratman, 2010).
1.2 Perumusan Masalah
Perumusan masalah pada penelitian ini adalah:
a. apakah golongan senyawa triterpenoid/steroid, alkaloid, flavonoid, glikosida, glikosida antrakuinon, saponin, dan tanin terdapat didalam serbuk simplisia daun nipah?
b. apakah senyawa triterpenoid/steroiddaun nipah dapat dipisahkan dengan menggunakan KLT preparatif?
c. apakah senyawa triterpenoid/steroid hasil isolasi dapat dikarakterisasi secara spektrofotometri ultraviolet (UV) dan inframerah (IR)?
1.3 Hipotesis
Hipotesis pada penelitian ini adalah:
a. serbuk simplisia daun nipah terdapat triterpenoid/steroid, alkaloid, flavonoid, saponin, glikosida, glikosida antarkuinon dan tanin.
b. senyawa triterpenoid/steroid yang terdapat pada daun nipah dapat dipisahkan dengan menggunakan KLT preparatif.
c. senyawa triterpenoid/steroid hasil isolasi dapat dikarakterisasi secara spektrofotometri UV dan IR.
1.4 Tujuan Penelitian
Tujuan pada penelitian ini adalah:
a. mengetahui karakterisasi simplisia daun nipah.
c. mengisolasi senyawa triterpenoid/steroid dari daun nipahdankarakterisasi senyawa hasil isolasi secara spektrofotometri UV dan IR.
1.5 Manfaat
KARAKTERISASI DAN ISOLASI SENYAWA TRITERPENOID/STEROID DARI DAUN NIPAH
(Nypa fruticans Wurmb.) ABSTRAK
Nipah (Nypa fruticans Wurmb.) merupakan tumbuhan palem yang banyak dijumpai di Indonesia dan memiliki peranan penting di kawasan hutan mangrove, secara tradisional digunakan sebagai obat sakit perut, diabetes, obat penurun panas, dan obat sakit gigi.Salah satu kandungan kimia dari daun tumbuhan ini adalah triterpenoid/steroid yang bermanfaat untuk pengobatan seperti antidiabetes, analgetik, antipiretik, dan antiinflamasi.Tujuan penelitian ini adalah melakukan isolasi dan karakterisasi senyawa triterpenoid/steroiddari daun nipah dengan spektrofotometer ultraviolet (UV) dan inframerah (IR).
Serbuk simplisia dikarakterisasi dan skrining fitokimia kemudian diekstraksi dengan cara maserasi menggunakan pelarut n-heksana. Maseratyang diperoleh dipekatkan dengan rotary evaporator(± 40°C), selanjutnya dianalisis secara kromatografi lapis tipis (KLT) dengan fase gerak n-heksana-etilasetat dengan beberapa perbandingan, sebagai penampak bercak Liebermann-Burchard. Ekstrak
n-heksana dipisahkan dengan KLT preparatif menggunakan fase gerak n -heksana-etilasetat (70:30) selanjutnya dilakukan uji kemurnian secara KLT satu arah dan KLT dua arah. Isolat yang diperoleh dikarakterisasi menggunakan spektrofotometer UV dan IR.
Hasil karakterisasi serbuk simplisia diperoleh kadar air 4,98%, kadar sari yang larut dalam air 22,32%, kadar sari yang larutdalam etanol 18,02%, kadar abu total 7,96%, dan kadar abu yang tidak larut dalam asam 1,99%. Hasil skrining fitokimia dari simplisia diperoleh senyawa flavonoid, triterpenoid/steroid, glikosida, glikosida antrakuinon, tanin dan saponin. Hasil pemisahan dengan KLT diperoleh dua senyawa triterpenoid/steroid yaitu isolat I (Rf 0,73) berwarna merah ungu dan isolat II (Rf 0,56) berwarna ungu dengan pereaksi Liebermann-Burchard. Hasil analisis dengan spektrofotometri UV terhadap isolat I dan isolat II memberikan absorbansi maksimum pada panjang gelombang (λ) yang sama yaitu, 201.80 nmyang menunjukkan adanya gugus kromofor dan hasil spektrofotometri IR diketahui adanya gugus O-H, C-H alifatis, CH2, C=C, C-O untuk isolat I dan O-H, C-H alifatis, C=C, dan C-O untuk isolat II.
CHARACTERIZATION AND ISOLATION OF
TRITERPENOID/STEROID COMPOUND FROM NYPA PALM LEAVES (Nypa fruticans Wurmb.)
ABSTRACT
Nypa (Nypa fruticans Wurmb.) is one of the most widely distributed in Indonesia and useful palm in the mangrove forests. It is traditionally used as antidiarrhea drug, antidiabetic drug, antipyretic drug, and analgetic drug. One of the chemical constituents of these leaves is triterpenoid/steroid that can be useful for the treatment like antidiabetic, analgetic, antipyretic, and antiinflamation. This study aimed to isolate and to characterize the triterpenoid/steroid from nypa palm leaves by means of spectrophotometries ultraviolet (UV) and infrared (IR).
The simplicia powder was characterized and phytochemically screened then extracted by maceration with n-hexane. The maserate was concentrated in rotary evaporator (± 40°C), then analyzed by thin-layer chromatography (TLC) with mobile phase n-hexane-ethyl acetate at varied composition with Liebermann-Burchard reagent. The n-hexane extract was separated into its components by preparative TLC using n-hexane-ethyl acetate (70:30) as mobile phase and the purity was confirmed by one-dimensional and two-dimensional TLC. Isolate was identified by UV and IR spectrophotometries.
The simplicia characterization gave water content 4.98%, water soluble extract 22.32%, ethanol soluble extract 18.02%, total ash soluble value 7.96% and acid insoluble ash 1.99%. Phytochemical screening showed that the simplicia contains flavonoid, triterpenoid/steroid, glycoside, antraquinon glycoside, tannin and saponin. The isolation result by TLC got two componens triterpenoid/steroid that is isolate I(Rf 0.73) a red purple colour and isolate II (Rf 0.56) a purple with Liebermann-Burchard reagent. The resulting isolate I and II was then analyzed by UV spectrophotometry that exhibited maximum absorption at same wavelength 201.80 nmto indicate the presence of chromophore and the result of IR spectrophotometry indicated the presence of O-H, C-H alifatis, CH2, C=C, and C-O functional groups for isolate I and O-H, C-H alifatis, C=C, and C-O for isolate II.
KARAKTERISASI DAN ISOLASI SENYAWA
TRITERPENOID/STEROID DARI DAUN NIPAH
(Nypa fruticans Wurmb.)
SKRIPSI
OLEH:
MUHAMMAD FAUZAN LUBIS
NIM 131524052
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI DAN ISOLASI SENYAWA
TRITERPENOID/STEROID DARI DAUN NIPAH
(Nypa fruticans Wurmb.)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MUHAMMAD FAUZAN LUBIS
NIM 131524052
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI DAN ISOLASI SENYAWA
TRITERPENOID/STEROID DARI DAUN NIPAH
(Nypa fruticans Wurmb.)
OLEH:
MUHAMMAD FAUZAN LUBIS NIM 131524052
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 17 Desember 2015 Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Prof. Dr. Ginda Haro, M.Sc., Apt. Prof. Dr. rer nat. Effendy De Lux Putra, S.U., Apt NIP195108161980031002 NIP 195306191983031001
Prof. Dr. Ginda Haro, M.Sc., Apt. Pembimbing II, NIP 195108161980031002
Dr. Marline Nainggolan, M.S., Apt. Drs. Suryadi Achmad, M.Sc., Apt. NIP 195709091985112001 NIP195109081985031002
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan anugerah-Nya sehingga penulis menyelesaikan skripsi ini yang berjudul “Karakterisasi dan Isolasi Senyawa Triterpenoid/Steroid Dari Daun Nipah (Nypa fruticansWurmb.)”.Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis mengucapkan terimakasih yang sebesar-besarnya kepada Ibu Dr. Masfria, M.S., Apt. Selaku Pejabat Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama masa pendidikan. BapakProf. Dr. Ginda Haro, M.Sc., Apt., dan Ibu Dr. Marline Nainggolan, M.S., Apt., selaku pembimbing yang telah memberikan waktu, bimbingan, dan nasehat selama penelitian dan penulisan skripsi ini berlangsung. Bapak Prof. Dr. rer nat. Effendy De Lux Putra, S.U., Apt., Bapak Drs. Suryadi Achmad, M.Sc., Apt., dan ibu Dra. Herawaty Ginting, M.Si., Apt., selaku dosen penguji yang memberikan masukan, kritikan, arahan, dan saran dalam penyusunan skripsi ini. Ibu Almh.
Dra. Aswita Hafni Lubis, M.Si., Apt. selaku Kepala Laboratorium Fitokimia Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas,
Penulis mengucapkan terimakasih yang tak terhingga dan penghargaan yang tulus kepada ayahanda Imran Lubis, ibunda Rofiah, adik Husnul Amir Lubis, Muhammad Alfi Syahrin Lubis dan Luthfi Azmi Lubis, teman-teman saya di Fakultas Farmasi USU. Terima kasih atas doa, dorongan dan pengorbanan baik moril maupun materil dalam penyelesaian skripsi ini.
Penulis menyadari skripsi ini masih belum sempurna, oleh karena itu diharapkan kritik dan saran yang membangun untuk penyempurnaannya. Harapan saya semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan kefarmasian.
.
Medan, Desember 2015 Penulis,