PENAPISAN DAN KARAKTERISASI AKTINOMISET
PENGHASIL SENYAWA ANTIBAKTERI
Escherichia coli
ATCC 35218 RESISTEN ANTIBIOTIK BETA LAKTAM
DYAH NOOR HIDAYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penapisan dan Karakterisasi Aktinomiset Penghasil Senyawa Antibakteri Escherichia coli ATCC 35218 Resisten Antibiotik Beta-laktam adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
Dyah Noor Hidayati
RINGKASAN
DYAH NOOR HIDAYATI. Penapisan dan Karakterisasi Aktinomiset Penghasil Senyawa Antibakteri Escherichia coli ATCC 35218 Resisten Antibiotik Βeta-Laktam. Dibimbing oleh YULIN LESTARI dan BAMBANG MARWOTO.
Diare dan gastroenteritis yang disebabkan oleh mikrob patogen, salah satunya E. coli, merupakan salah satu penyebab kematian tertinggi di Indonesia. Pengobatan yang paling umum adalah dengan pemberian antibiotik,namun, yang menjadi masalah adalah meningkatnya resistensi patogen terhadap antibiotik, khususnya golongan beta-laktam. Masalah tersebut menjadikan penemuan antibiotik baru sangat penting dan aktinomiset merupakan sumber yang sangat menjanjikan sebagai penghasil penghasil senyawa aktif baru tersebut. Tujuan dari penelitian ini adalah untuk mendapatkan aktinomiset asli Indonesia yang menghasilkan senyawa antibakteri E. coli ATCC 35218 resisten antibiotik beta-laktam dan mengidentifikasi ciri-ciri morfologi dan molekuler isolat aktinomiset penghasil senyawa antibakteri E. coli ATCC 35218 resisten antibiotik beta-laktam tersebut.
Sembilan puluh enam isolat aktinomiset dari kultur stok koleksi
Biotechnology Microbial Culture Collection (BioMCC), BPPT, diremajakan di dalam media ISP2 (International Streptomyces Project) dan diinkubasikan pada suhu 28 oC selama 14-21 hari. Pengelompokan aktinomiset ke dalam kelompok
Streptomyces dan non-streptomyces dilakukan berdasarkan morfologi mikroskopis dari biakan di dalam media agar ISP2 umur 21 hari. Penapisan aktivitas antibakteri dilakukan menggunakan metode agar plug dan adanya aktivitas antibakteri ditandai dengan zona bening di sekitar isolat aktinomiset setelah inkubasi selama 24-48 jam pada suhu 36±1oC. Isolat aktinomiset yang menunjukkan aktivitas antibakteri selanjutnya dilakukan karakterisasi pola aktivitas antibakteri berdasarkan umur isolatdi dalam media agar Karakterisasi pola aktivitas antibakteri dari kultur agar dilakukan dengan menumbuhkan isolat aktinomiset pada media agar ISP2 dalam cawan selama 15 hari pada suhu 28 oC. Setiap 3 hari, dari kultur agar diambil untuk dilakukan uji aktivitas antibakteri menggunakan metode agar plug. Karakterisasi pola aktivitas antibakteri isolat aktinomiset aktif dari kultur cair dilakukan dengan memfermentasikan isolat di dalam media cair ISP2 dan diinkubasikan pada suhu 28 oC, 220 rpm, selama 15 hari. Setiap 3 hari fermentasi dilakukan pengambilan sampel dan dilakukan penyarian senyawa aktif dengan cara ekstraksi menggunakan pelarut etil asetat, dengan perbandingan 1:1 (v/v). Ekstrak etil asetat yang diperoleh dipekatkan dan selanjutnya digunakan untukuji aktivitas antibakteri menggunakan metode Kirby-Bauer pada konsentrasi 1 mg/disc.
220 rpm. Setiap 3 hari sampel diambil dan dilakukan pengukuran volume padatan selnya (% PMV).
Karakterisasi morfologi mikroskopis isolat aktif dilakukan dengan pengamatan langsung terhadap kultur di dalam media ISP2 agar umur 21 hari dengan mikroskop pada perbesaran 500-1000x. Karakterisasi molekuler isolat aktif dilakukan berdasarkan sekuen parsial 16S rRNA dan dibandingkan dengan sekuen 16S rRNA yang terdapat di GenBank dengan blastn. Tingkat kekerabatan di analisis menggunakan perangkat lunak MEGA 5. Ekstrak etil asetat isolat aktinomiset dengan aktivitas antibakteri paling tinggi dilakukan analisis menggunakan Kromatografi Cair Kinerja Tinggi (KCKT) dan pendugaan berat molekul senyawa aktif dilakukan menggunakan quadrupole time of flight mass sphectrometry (QTOF-MS).
Pengelompokan isolat aktinomiset berdasarkan morfologi dan warna, dari 96 isolat aktinomiset, 8 isolat termasuk dalam kelompok Streptomyces dan 88 isolat non-streptomyces. Penapisan aktivitas antibakteri mendapatkan tiga isolat, yaitu BioMCC-at.HH-64, BioMCC-at.HH-78, dan BioMCC-at.HH-259 yang menunjukkan aktivitas antibakteri terhadap E. coli ATCC 35218 dengan rata-rata diameter penghambatan masing-masing adalah 13,55, 13,88 and 14,71 mm. Hasil karakterisasi pola aktivitas antibakteri dari kultur padat menunjukkan sampai umur 15 hari ketiga isolat masih memperlihatkan aktivitas antibakteri dan aktivitas tertinggi dihasilkan oleh kultur umur 9 hari. Hasil karakterisasi pola aktivitas antibakteri dari ekstrak etil asetat menunjukkan bahwa ekstrak etil asetat dari isolat BioMCC-at.HH-64 sampai hari ke-15 fermentasi tidak menunjukkan aktivitas antibakteri. Aktivitas antibakteri ditunjukkan oleh ekstrak etil asetat dari isolat BioMCC-at.HH-78 dan BioMCC-at.HH-259 setelah 12 hari fermentasi, dan peningkatan aktivitas antibakteri ditunjukkan oleh ekstrak etil asetat dari fermentasi isolat BioMCC-at.HH-259 selama 15 hari.
Hasil karakterisasi pola pertumbuhan isolat aktinomiset aktif, baik dalam media agar maupun cair ketiga isolat menunjukkan pola pertumbuhan yang relatif berbeda untuk media yang berbeda. Pola pertumbuhan paling baik ditunjukkan ketika isolat aktinomiset ditumbuhkan di dalam media ISP4. Hasil pengamatan morfologi mikroskopis menunjukkan bahwa ketiga isolat memiliki spora tunggal berbentuk bola, yang tumbuh pada pangkal atau percabangan hifa dan termasuk dalam genus Micromonospora. Hasil blastn menunjukkan bahwa ketiga isolat memiliki tingkat homologi tertinggi dengan M.chersina sebesar 99%. Berdasarkan hasil analisis kemiripan, isolat BioMCC-at.HH-64 memiliki tingkat kemiripan 99,17 % dengan BioMCC-at.HH-259. Sedangkan, isolat BioMCC-at.HH-78 memiliki tingkat kemiripan 42,57 % dengan BioMCC-at.HH-64 dan 42,74 % dengan BioMCC-at.HH-259. Hasil pendugaan terhadap berat molekul senyawa aktif adalah sebesar 186,12 Da yang merujuk pada senyawa
napthylethylenediamine. Aktivitas antibakteri senyawa tersebut terhadap E coli
ATCC 35218 belum pernah dilaporkan. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa aktinomiset asli Indonesia memiliki potensi sebagai penghasil senyawa aktif antibakteri yang mampu menghambat E.coli ATCC 35218 resisten antibiotik beta-laktam.
SUMMARY
DYAH NOOR HIDAYATI. Screening and characterization of actinomycetes with antibacterial activity against Escherichia coli ATCC 35218 beta-lactam resistant. Supervised by YULIN LESTARI and BAMBANG MARWOTO.
Diarrhea and gastroenteritis caused by microbial pathogens, such as E. coli, was one of cause death in Indonesia. The most common treatment was with antibiotics. However, the rates of resistance to some antibiotics were significantly higher, especially to beta-lactam classes. Therefore, the discovery of new antibiotics was very important and actinomycetes are very promising as a source of new active compounds producer. The objectives of this research are to obtain indigenous Indonesian actinomycetes producing antibacterial activity againts resistant beta-lactam antibiotic E. coli ATCC 35218, and to characterize morphologically and genetically of the active isolates as well as for their active compounds.
Ninety six actinomycetes isolates from Biotechnology Microbial Culture Collection (BioMCC), BPPT were cultured on ISP2 medium and incubated at 28 o
C for 14-21 days. The actinomycetes isolates were grouped into Streptomyces
and non-streptomyces genus according to their microscopic morphology from 21 days old culture on ISP2 medium. The colour of actinomycetes colonies were observed on Yeast Starch Agar (YSA) Medium from 14-21 days old cultures. Antibacterial activity screening was performed by agar plug method and the activities were indicated by the clearing zone around the actinomycetes isolates after 24-48 incubation at 36 ± 1 oC. Furthermore, the active isolates were characterized their antibacterial activity patterns based on the age of the isolates, both from agar and liquid cultures. Antibacterial activity patterns characterization from agar cultures was performed by inoculating the isolates in ISP2 agar medium and incubated at 28 oC, 15 days. Every 3 days of interval incubation, the cultures were sampled and assayed for their antibacterial activities by agar plug method. Antibacterial activity patterns characterization from liquid cultures was done by inoculating the isolates in ISP2 broth medium and incubated in a rotary shaker at 28 oC, 220 rpm, 15 days. Every 3 days of incubation the culture broth were sampled and extracted using ethyl acetate, 1:1 (v/v), and concentrated. The extracts were assayed for their antibacterial activities by Kirby-Bauer method at concentration of 1 mg/disc.
comparing to the genbank (NCBI) databases. The phylogenetic degree was analyzed by MEGA 5 software. The most active ethyl acetate extract from actinomycetes isolate was characterized its bioactive compound using High Performance Liquid Chromatography (HPLC) and estimated of its molecular weight by quadrupole time of flight mass sphectrometry(QTOF-MS).
Actinomycetes isolates grouping based on morphology were grouped 8 isolates into Streptomyces and 88 isolates into non-Streptomyces. Three selected isolates, BioMCC-at.HH-64, BioMCC-at.HH-78, and BioMCC-at.HH-259 showed their antibacterial activity againts E. coli ATCC 35218. The diameter of inhibition were 13,55, 13,88 and 14,71 mm, respectively. The characterization of antibacterial activity pattern based on the age of the isolates, showed that up to 15 days of culture, all of the isolates still showed their antibacterial activities. The highest activities were at 9 days of culture. The characterization of antibacterial activity pattern from ethyl acetate extracts, showed that the ethyl acetate extracts from BioMCC-at.HH-64 fermentation broth didn’t show their antibacterial activity. Meanwhile, BioMCC-at.HH-78’s extract showed its antibacterial activity from 12 days of fermentation, and BioMCC-at.HH-259’s extract showed its antibacterial activity from 12 days fermentation and increased after 15 days of fermentation.
The growth patterns characterization of actinomycetes isolates resulted that both on solid and liquid cultures they showed varied growth patterns, and their best growth were in ISP4 medium. The morphological obsevation under microscope showed that all active isolates were formed single sperical spores which grows on the tip of hyphae or spreads on the mycelial brancing and belong to the genera of Micromonospora. The blastn search from partial sequnces of 16S rRNA were obtained, showed that all active actinomycetes have 99% similarity to
M. chersina. Based on the results of similarity analysis, isolate BioMCC-at.HH-64 has a level of 99,17% similarity with BioMCC-at.HH-259. Meanwhile, isolate BioMCC-at.HH-78 has a level of 42,57% similarity with BioMCC-at.HH-64 and 42,74% with 259. The ethyl acetate extract of BioMCC-at.HH-259 was analyzed by HPLC and QTOF-MS. The molecular weight estimation of active compound from BioMCC-at.HH-259 was 186,12 Da which referred to
napthylethylenediamine. The antibacterial activity of this compound against E. coli ATCC 35218 has not been reported. From the results of this study we concluded that Indonesian indigenous actinomycetes are potential producers of antibacterial bioactive compounds with activity against antibiotic resistant beta-lactam Escherichia coli ATCC 35218.
Key words : actinomycetes, antibacteria, resistant beta lactam, Micromonospora,
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
PENAPISAN DAN KARAKTERISASI AKTINOMISET
PENGHASIL SENYAWA ANTIBAKTERI
Escherichia coli
ATCC 35218 RESISTEN ANTIBIOTIK BETA LAKTAM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
2
3
Judul Tesis : Penapisan dan Karakterisasi Aktinomiset Penghasil Senyawa Antibakteri Escherichia coli ATCC 35218 Resisten Antibiotik Beta-Laktam
Nama : Dyah Noor Hidayati NIM : G351100081
Disetujui oleh Komisi Pembimbing
Dr Ir Yulin Lestari Ketua
Dr Bambang Marwoto Apt, MEng. Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc, Agr
4
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2011 ini adalah tentang bioprospeksi aktinomiset sebagai penghasil senyawa antibakteri, dengan judul Penapisan dan Karakterisasi Aktinomiset Penghasil Senyawa Antibakteri
Escherichia coli ATCC 35218 Resisten Antibiotik Βeta-Laktam.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Yulin Lestari dan Bapak Dr Bambang Marwoto Apt, MEng. selaku pembimbing atas arahan dan bimbingannya, Ibu Dr Laksmi Ambarsari selaku penguji dari luar komisi atas saran dan masukannya yang sangat berharga, Program Studi Mikrobiologi, Jurusan Biologi, IPB dan seluruh pengajar atas ilmu yang diberikan, Kementrian Riset dan Teknologi atas beasiswa yang diberikan, dan Kepala Balai Pengkajian Bioteknologi BPPT dan jajarannya atas sarana dan prasarana yang diberikan. Ungkapan terima kasih yang sebesar-besarnya penulis sampaikan untuk suami tercinta atas pengorbanan, kesabaran dan doa’nya, dan juga untuk bapak, ibu, mamah, kakak-kakak dan adik-adik atas seluruh do’anya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2014
5
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xiv
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 3
Aktinomiset 3
Micromonospora 4
Antimikrob 4
Antibiotik Βeta-Laktam 5
Escherichia coli ATCC 35218 6
Pengujian Aktivitas Antibakteri 7
3 METODE 7
Waktu dan Tempat Penelitian 7
Peremajaan dan Pembuatan Kultur Kerja Isolat Aktinomiset 8
Pengelompokan Isolat Aktinomiset 8
Penapisan Aktivitas Antibakteri 8
Karakterisasi Pola Aktivitas Antibakteri 8
Karakterisasi Pola Pertumbuhan dan Morfologi
Aktinomiset Aktif 9
Karakterisasi Molekuler Isolat Aktinomiset Aktif 10 Karakterisasi Awal dan Pendugaan Berat Molekul Senyawa
Aktif Antibakteri 11
Digram Alir Peelitian 12
4 HASIL DAN PEMBAHASAN 12
5 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
LAMPIRAN 30
6
DAFTAR TABEL
1 Daftar beberapa senyawa aktif yang dihasilkan oleh isolat aktinomiset 4 2 Pola pertumbuhan isolat aktinomiset aktif pada berbagai media agar 16 3 Hasil kuantifikasi konsentrasi dan kemurnian DNA hasil isolasi 19 4 Hasil pensejajaran sekuens parsial 16S rRNA isolat aktinomiset aktif
dengan galur acuan yang terdapat pada databaseGenBank 19 5 Persentase nilai jarak genetik dan tingkat homologi antar isolat
aktinomiset aktif 20
DAFTAR GAMBAR
1 Struktur kimia penicillin G dan sefalosporin 6
2 Bagan ruang lingkup penelitian 12
3 Aktivitas antibakteri isolat aktinomiset at.HH-64, BioMCC-at.HH-78 dan BioMCC-at.HH-259 terhadap E. coli ATCC 35218 13 4 Pola aktivitas antibakteri isolat aktinomiset BioMCC-at.HH-64,
BioMCC-at.HH-78 dan BioMCC-at.HH-259 dari kultur agar 14 5 Pola aktivitas antibakteri ekstrak etil asetat isolat aktinomiset berdasar
lama fermentasi 14
6 Morfologi makroskopis isolat aktinomiset aktif di dalam 4 jenis media
agar setelah 21 hari inkubasi 16
7 Pola pertumbuhan isolat aktinomiset aktif di dalam media cair, ISP2,
ISP4, MS dan BM 17
8 Morfologi mikroskopis isolat aktinomiset aktif setelah inkubasi 21 hari
pada media agar ISP2 18
9 Dendogram filogenetik berdasar sekuen gen 16S rRNA isolat
aktinomiset aktif dan genus lainnya 21
10 Spektrum massa senyawa dari ekstrak etil asetat isolat
BioMCC-at.HH-259 23
11 Struktur kimia naphtylethylenediamine dan N-(1-Naphthyl)
1,2-ethanediaminedihydrochloride 23
DAFTAR LAMPIRAN
1 Daftar isolat aktinomiset yang digunakan dan pengelompokannya
berdasarkan morfologi mikroskopis 30
2 Hasil karakterisasi pola aktivitas antibakteri isolat aktinomiset dari
kultur agar 32
3 Hasil karakterisasi pola aktivitas antibakteri isolat aktinomiset dari
ekstrak etil asetat 33
4 Komposisi media untuk karakterisasi pola pertumbuhan isolat
aktinomiset aktif 34
5 Elektoferogram hasil analisis 16S rRNA isolat aktinomiset
7 6 Elektoferogram hasil analisis 16S rRNA isolat aktinomiset
BioMCC-at.HH-64 menggunakan primer reverse 36
7 Elektoferogram hasil analisis 16S rRNA isolat aktinomiset
BioMCC-at.HH-78 menggunakan primer forward 37
8 Elektoferogram hasil analisis 16S rRNA isolat aktinomiset
BioMCC-at.HH-78 menggunakan primer reverse 38
9 Elektoferogram hasil analisis 16S rRNA isolat aktinomiset
BioMCC-at.HH-259 menggunakan primer forward 39
10 Elektoferogram hasil analisis 16S rRNA isolat aktinomiset
BioMCC-at.HH-259 menggunakan primer reverse 40
11 Sekuen konsensus 16S rRNA isolat aktinomiset aktif 41 12 Kromatogram KCKT ekstrak etil asetat isolat aktinomiset
BioMCC-at.HH-259 dan BioMCC-at.HH-78 42
1 PENDAHULUAN
Latar Belakang
Penyakit infeksi hingga saat ini masih menjadi salah satu penyebab tertinggi kematian di Indonesia, dan infeksi saluran pencernaan masih menduduki posisi ke-2 penyebab kematian secara umum setelah pneumonia. Berdasarkan profil data kesehatan Indonesia tahun 2011, penyakit infeksi masih mendominasi 10 besar penyakit rawat inap di rumah sakit pada tahun 2010. Diare dan gastroenteritis yang disebabkan oleh infeksi patogen dilaporkan menempati posisi tertinggi, dengan jumlah kasus pasien rawat inap sebanyak 73.889, dan 1.289 (1,79%) dilaporkan meninggal dunia (Kemenkes RI 2012).
Penyebab infeksi saluran pencernaan yang terjadi di Indonesia antara lain diakibatkan oleh infeksi patogen Escherichia coli, dan pengobatan yang umum digunakan adalah dengan penambahan nutrisi dan cairan serta pemberian antimikrob. Antimikrob yang umum digunakan di Indonesia untuk pengobatan infeksi tersebut antara lain adalah siprofloksasin, ampisilin, kloramfenikol, dan gentamisin. Intensitas penggunaan antimikrob yang relatif tinggi menimbulkan berbagai permasalahan dan merupakan ancaman global bagi kesehatan terutama munculnya resistensi bakteri terhadap antimikrob, selain berdampak pada morbiditas dan mortalitas, juga memberi dampak negatif terhadap ekonomi dan sosial yang sangat tinggi. Resistensi pada awalnya terjadi di tingkat rumah sakit, tetapi lambat laun juga berkembang di lingkungan masyarakat, termasuk E. coli.
Hasil studi berkenaan dengan resistensi antimikrob di Indonesia menyatakaan bahwa dari 2494 individu di masyarakat, 53% E. coli resisten terhadap berbagai jenis antimikrob yang ada di pasaran, antara lain: ampisilin (34%), kotrimoksazol (29%) dan kloramfenikol (15%). Hasil penelitian terhadap 781 pasien yang dirawat dirumah sakit didapatkan 81% E. coli resisten terhadap lebih dari satu jenis antimikrob, yaitu ampisilin (73%), kotrimoksazol (56%), kloramfenikol (43%), siprofloksasin (22%), dan gentamisin (18%) (Lestari et al.
2005; Duerink et al. 2007). Penelitian lain juga melaporkan bahwa beberapa galur E. coli di Indonesia telah mengalami mutasi gen, dari sensitif menjadi resisten terhadap antimikrob golongan fluoroquinolon (Kuntaman et al. 2005). Resistensi E. coli terhadap antimikrob juga dilaporkan oleh peneliti di dunia (Livermore et al. 2003).
Masalah resistensi E. coli terhadap antimikrob yang sudah ada di pasaran terutama golongan beta-laktam, harus segera diatasi. Salah satu caranya adalah dengan senantiasa mencari antimikrob baru dengan potensi yang lebih tinggi dan mekanisme yang berbeda dalam menghambat atau membunuh patogen penyebab infeksi. Di sisi lain, munculnya galur baru yang resisten lebih cepat dibandingkan dengan tingkat penemuan antimikrob baru yang semakin lambat (Donadio et al.
2
17,6% berturut-turut diisolasi dari kapang dan bakteri. Dari 8700 antimikrob yang diisolasi dari aktinomiset, 6550 diantaranya diisolasi dari genus Streptomyces dan sisanya, 2250 dari kelompok non-streptomyces atau rare actinomycetes. Penemuan antimikrob baru dari rare actinomycetes juga dilaporkan oleh beberapa peneliti di dunia (Hopmann et al. 2002; Beltrametti et al. 2006).
Di Indonesia, penelitian untuk mendapatkan antimikrob baru dengan memanfaatkan mikrob asli Indonesia masih sangat sedikit, dikarenakan biaya yang dibutuhkan cukup besar dan memakan waktu yang cukup lama. Berdasarkan latar belakang di atas, maka dilakukan penelitian dengan tema penapisan dan karakterisasi aktinomiset penghasil senyawa antibakteri E. coli resisten antibiotik, dengan memanfaatkan biodiversitas aktinomiset asli dari alam Indonesia yang di koleksi BP Bioteknologi, BPPT.
Perumusan Masalah
Munculnya resistensi patogen E. coli penyebab penyakit infeksi saluran pencernaan terhadap antibiotik yang sudah ada di pasaran. Di sisi lain, penyakit infeksi saluran pencernaan masih menjadi salah satu penyebab kematian tertinggi di dunia dan Indonesia. Masih kurangnya pemanfaatan keragaman mikrob asli Indonesia, terutama aktinomiset sebagai sumber pencarian bahan obat baru.
Tujuan Penelitian
Berdasarkan perumusan masalah di atas, maka tujuan yang ingin dicapai dari penelitian ini adalah mendapatkan isolat aktinomiset asli Indonesia sebagai penghasil senyawa antibakteri E. coli ATCC 35218 resisten antibiotik beta-laktam dan ciri-ciri morfologi serta molekuler isolat aktinomiset penghasil senyawa antimikrob E. coli ATCC 35218 resisten antibiotik beta-laktam.
Ruang Lingkup Penelitian
3
2 TINJAUAN PUSTAKA
Aktinomiset
Aktinomiset merupakan bakteri gram-positif aerob yang membentuk filamen bercabang atau hifa, tidak membentuk kepingan-kepingan dan memproduksi spora aseksual, yang menyerupai kapang dalam morfologinya. Pertumbuhan aktinomiset di dalam media padat atau agar akan membentuk percabangan hifa yang tumbuh baik pada permukaan atau menembus ke dalam agar. Pada umumnya, septa membagi hifa ke dalam bentuk sel yang panjang (20 µ m atau lebih) yang berisi beberapa nucleoid, beberapa membentuk struktur yang menyerupai jaringan yang disebut sebagai thallus. Beberapa aktinomiset juga memiliki miselia aerial yang terbentang di atas substrat atau agar dan membentuk konidia (spora aseksual dengan dinding tipis) atau konidiospora pada ujung filamen. Spora berada di dalam sporangium dan memiliki bentuk sangat bervariasi. Spora aktinomiset berkembang dari pembentukan septa pada ujung filamen, pada umumnya merupakan respon terhadap makanan yang berkurang, sebagian besar tidak tahan terhadap pemanasan tetapi tahan terhadap pengeringan dengan baik (Kar 2008).
Aktinomiset banyak dijumpai pada tanah terutama bagian rizosfer, namun saat ini aktinomiset banyak diisolasi dari sumber lainnya antara lain dari air, tanaman, sedimen laut dan organisme laut (Pathom-aree 2006; Ceyclan et al 2008; Imada et al 2010). Sebagian besar aktinomiset yang berhasil diisolasi dari alam merupakan kelompok Streptomyces, dan untuk mendapatkan aktinomiset dari kelompok non-streptomyces, para peneliti di dunia telah melakukan pengembangan teknik isolasi dan modifikasi media isolasi (Gavrish et al 2008).
4
Tabel 1 Daftar beberapa senyawa aktif yang dihasilkan oleh aktinomiset Organisme penghasil Senyawa Aplikasi Sumber Referensi
Micromonospora sp.
Micromonospora merupakan aktinomiset yang termasuk dalam famili
Micromonosporaceae. Ciri-ciri dari genus Micromonospora antara lain, mempunyai miselia bercabang, spora tidak bergerak (non-motile), berupa spora tunggal yang melekat pada sporofor pendek atau panjang yang ditemukan dalam kelompok-kelompok percabangan. Miselia aerial tidak ditemukan, atau pada beberapa kultur ditemukan sebagai pengembangan koloni yang tidak teratur, dan hanya berwarna putih atau keabu-abuan (Holt et al. 2000). Isolasi
Micromonospora dapat dilakukan dari habitat aslinya di alam, antara lain dari tanah rizosfer (Cheng et al. 2011), tanah gambut (Thawai et al. 2005), air (Trujillo
et al. 2005), tanaman (Kirby dan Meyers 2010), dan bahkan dari lingkungan yang sangat ekstrim seperti sedimen laut dalam (Gärtner et al. 2011) dan bebatuan di Antartica (Hirsch et al. 2004).
Micromonospora dikenal sebagai penghasil antibiotik, khususnya antibiotik aminoglikosida (gentamisin dan netamisin), enedin, dan oligosakarida (Berdy 2005). Beberapa senyawa aktif baru dilaporkan berhasil diisolasi dari
Micromonospora, di antaranya adalah lupinacidin, suatu antitumor yang dihasilkan oleh M. lupini (Igarashi et al. 2007); levantilide A dan B, golongan makrolida baru (Gärtner et al. 2011); serta retymicin, galtamycin B dan
saquayamycin Z yang dihasilkan oleh Micromonospora sp. Tü 6368 (Antal et al.
2005).
Antimikrob
5 semakin meningkat, produk yang diperoleh dari hasil fermentasi di modifikasi secara kimia. Beberapa senyawa kimia sintetis juga digunakan untuk kemoterapi infeksi penyakit, seperti sulfonamid dan kuinolon. Ribuan antimikrob telah banyak dikenal dan setiap tahunnya lusinan antimikrob ditemukan, namun hanya sebagian kecil yang digunakan secara klinis untuk pengobatan (Berdy 2005; Jayaraman 2009).
Sampai saat ini antimikrob masih sangat dibutuhkan, karena merupakan satu-satunya obat untuk penyakit infeksi yang masih menjadi salah satu penyebab tertinggi kematian di dunia, terutama di negara berkembang. Berdasarkan cara kerjanya antimikrob bekerja dengan mengganggu pembentukan dinding sel bakteri (golongan beta-laktam dan glikopeptida), menghambat sintesis protein (golongan makrolida dan aminoglikosida), mengganggu sintesis asam nukleat (fluorokuinolon dan rifampin), merusak struktur membran (polimiksin dan daptomisin), dan menghambat jalur metabolisme (sulfonamid) (Tenover 2006). Penggunaan antimikrob secara terus menerus yang tidak sesuai dapat menimbulkan resistensi bakteri. Resistensi dapat terjadi melalui beberapa cara, yaitu merusak antimikrob dengan enzim yang diproduksi, mengubah reseptor titik tangkap antimikrob, mengubah fisiko-kimiawi target sasaran antimikrob pada sel bakteri, antimikrob tidak dapat menembus dinding sel akibat perubahan sifat dinding sel bakteri, dan antimikrob masuk ke dalam sel bakteri, namun segera dikeluarkan dari dalam sel melalui mekanisme transport aktif keluar sel (Levy dan Marshall 2004; Saga dan Yamaguchi 2009).
Antibiotik Βeta-Laktam
Antibiotik beta-laktam merupakan golongan antibiotik yang cukup besar dan paling banyak digunakan. Semua antibiotik yang termasuk dalam golongan β–laktam mempunyai struktur molekul yang mengandung gugus beta-laktam. Golongan antibiotik ini meliputi penicillin dan turunannya, cephalosporin,
monobactam, dan carbapenem (Gambar 1). Antibiotik beta-laktam bekerja dengan menghambat pembentukan dinding sel bakteri, yaitu dengan mengikat enzim yang membentuk dinding sel, penicillin binding proteins (PBPs). Penghambatan PBPs melemahkan dinding sel, yang mengakibatkan terhambatnya pertumbuhan sel dan perlahan-lahan akan menyebabkan kematian sel (Babic et al.
2006).
Kelompok besar antibiotik golongan beta-laktam adalah turunan
6-aminopenicillanic acid (6-APA) dan sefalosporin (Gambar 2). Antibiotik yang merupakan turunan 6-APA antara lain penicillin G, penicillin V, ampicillin,
6
Staphylococcus tidak resisten meticilin, dan terkadang mencapai sistem saraf pusat sehingga digunakan untuk pengobatan meningitis (Rice 2012).
Gambar 1 Struktur kimia penicillin G (kiri) dan sefalosporin (kanan) (Babic et al.
2006)
Mekanisme resistensi terhadap antibiotik beta-laktam meliputi, penurunan kemampuan antibiotik untuk mencapai PBPs, menurunkan afinitas pengikatan PBPs, dan merusak antibiotik melalui ekspresi enzim beta-laktamase. Enzim beta -laktamase bekerja dengen mengikat dan memotong cincin beta-laktam. Pada bakteri Gram-positif, antibiotik memiliki kebebasan untuk menjangkau membran sitoplasma bakteri, dimana terdapat PBPs. Pada bakteri Gram-negatif, membran terluar dari bakteri (yang tidak dijumpai pada Gram-positif) mampu membatasi masuknya laktam dan memusatkan molekul laktamase. Molekul beta-laktam apabila tidak mampu mencapai ruang periplasma, baik karena terjadi penurunan kemampuan jangkauan atau karena meningkatnya efluk. Pengumpulan beta-laktamase, walaupun relatif lemah, akan dapat menyebabkan tingkat resistensi yang tinggi (Poole 2004; Wilke et al. 2005; Bockstael dan Aerschot 2008).
Escherichia coli ATCC 35218
Bakteri E. coli merupakan kelompok gram-negatif yang tidak membentuk spora, berbentuk batang anaerob fakultatif dan tergolong ke dalam famili
Enterobacteriaceae. Sebagian besar E. coli spp. merupakan penghuni yang tidak berbahaya di dalam usus manusia dan hewan berdarah-panas lainnya, namun, beberapa galur dapat menimbulkan penyakit. Berdasarkan penyakit yang ditimbulkan E. coli digolongkan menjadi ETEC (Enterotoxigenic E. coli), EPEC (Enteropathogenic E. coli), EIEC (Enteroinvasive E. coli), EHEC (Enterohemorrhagic E. coli) dan EAEC (Enteroaggregative E. coli). Kejadian infeksi tertinggi di negara berkembang, termasuk Indonesia, diakibatkan EHEC, salah satunya akibat patogen E. coli serotype O157:H7. Infeksi terjadi akibat konsumsi daging, buah, sayuran dan air yang tercemar (Miller et al. 2001; Kiranmayi et al. 2010).
Dalam penelitian-penelitian uji kerentanan E. coli serotype O157:H7 terhadap suatu antimikrob, karena sifatnya yang sangat patogen, maka untuk keselamatan dan keamanan menggunakan bakteri pengganti yang tidak bersifat patogen namun memiliki sifat yang paling mirip, yaitu menggunakan E. coli
7 mencapai target penicillin-binding proteins (PBPs). Βeta-laktamase yang dihasilkan adalah TEM-1 yang termasuk dalam beta-laktamase kelompok A (penicillinase). Βeta-laktamase kelompok A adalah kelompok yang paling luas penyebarannya, enzim tersebut dibawa dalam plasmid, sensitif terhadap inhibitor yang secara komersial ada di pasaran dan resisten terhadap penisilin dan sefalosporin turunan pertama (Gupta 2007). Jenis enzim tersebut banyak dijumpai pada isolat klinis dan dapat dihambat oleh clavulanat, sulbaktam and tazobaktam. Pada bakteri gram negatif termasuk E. coli, enzim beta-laktamase terdapat pada bagian periplasma, tempat bakteri melawan antimikrob sebelum sampai pada situs reseptor (Bradford 2001; Miller et al. 2001).
Mekanisme resistensi E. coli terhadap antimikrob yang terjadi kemungkinan karena menerima gen penyandi enzim beta-laktamase yang berfungsi merusak antimikrob sebelum antimikrob memberikan reaksi. Mekanisme ke dua, bakteri menerima tekanan dari dalam sel yang dapat menghancurkan antimikrob sebelum mencapai sasaran (mekanisme effluks). Mekanisme ke tiga, bakteri menerima gen untuk siklus metabolisme yang memungkinkan dinding sel mengubah tempat pelekatan suatu agen antimikrob sehingga antimikrob tidak dapat melekat (Rupp dan Fey 2003; Tenover 2006).
Pengujian Aktivitas Antibakteri
Munculnya resistensi antimikrob mendorong para peneliti untuk mencari senyawa antimikrob baru, salah satunya menggunakan mikrob sebagai sumber pencarian dengan berbagai metode pengujian. Dalam uji aktivitas antimikrob dari mikrob beberapa peneliti melakukan pengujian awal untuk mengetahui ada tidaknya aktivitas antibakteri yang dihasilkan oleh isolat mikrob tersebut. Metode ini bersifat kualitatif dan menggunakan mikrob uji yang tidak atau sedikit bersifat patogen, selanjutnya dilakukan penapisan dengan metode pengenceran, metode ini bersifat kuantitatif dan biasanya menggunakan mikrob yang benar-benar patogen (Smania-Jr et al. 2007). Penapisan awal aktivitas antibakteri dapat dilakukan dengan berbagai cara, antara lain adalah dengan metode streak (Ogunmwonyi et al. 2010), metode agar overlay (Thakur et al. 2007), metode agar well, metode difusi agar (Al-Zahrani 2007), dan metode difusi cakram (Ilic et al. 2007).
3 METODE
Waktu dan Tempat Penelitian
8
Peremajaan dan Pembuatan Kultur Kerja Isolat Aktinomiset
Isolat aktinomiset yang digunakan merupakan koleksi BP Bioteknologi BPPT hasil isolasi dari tanah beberapa daerah di Indonesia. Peremajaan isolat aktinomiset dilakukan dengan menumbuhkan kembali isolat aktinomiset dari stok dalam gliserol beku pada media agar International Streptomyces Project (ISP) 2 dan diinkubasikan pada suhu 28 oC selama 14-21 hari. Koloni tunggal yang diperoleh ditumbuhkan di dalam 5 ml media ISP1 dan diinkubasi pada suhu 30 oC selama 72 jam. Kultur dalam media ISP1 kemudian diinokulasikan sebanyak 200 µ l ke dalam media ISP2 dalam tabung dan di inkubasi pada suhu 28 oC selama 14-21 hari. Isolat aktinomiset dalam tabung selanjutnya digunakan sebagai kultur kerja dan disimpan di dalam lemari pendingin pada suhu 2-5 o C.
Pengelompokan Isolat Aktinomiset
Pengelompokan isolat aktinomiset menjadi kelompok Streptomyces dan non-streptomyces, dilakukan berdasarkan morfologi mikroskopis. Pengamatan morfologi mikroskopis secara langsung dilakukan terhadap koloni yang tumbuh pada media agar ISP2 (14-21 hari) pada perbesaran 400x menggunakan mikroskop (Olympus BX51). Karaktersistik morfologi yang diperoleh dibandingkan dengan panduan yang terdapat pada Bergey’s Manual (Kawamoto 1989).
Penapisan Aktivitas Antibakteri
Penapisan aktivitas antibakteri dilakukan terhadap 96 isolat menggunakan metode agar plug pada media Mueller Hinton Agar (MHA). Isolat aktinomiset di dalam media agar ISP2 dalam cawan (21 hari) dipotong (diameter ± 7 mm) dan diletakkan di atas media uji Mueller Hinton Agar (MHA) yang telah diinokulasi dengan bakteri uji sebanyak 106 cfu/ml. Cawan di inkubasi selama 24 jam pada suhu 36 ± 1oC dan dilakukan pengamatan aktivitas antibakteri, yang ditandai dengan zona bening disekitar isolat aktinomiset. Aktivitas daya hambat diperoleh dengan mengukur diameter zona bening di sekitar isolat menggunakan jangka sorong (Mitutoyo, Japan) (Sharma et al. 2011).
Karakterisasi pola aktivitas antibakteri
Karakterisasi pola aktivitas antibakteri dari kultur agar dilakukan dengan menumbuhkan isolat aktinomiset aktif pada media agar ISP2 dalam cawan dan diinkubasikan pada suhu 28 oC selama 15 hari. Setiap 3 hari inkubasi, kultur diambil dan dilakukan uji aktivitas antibakteri menggunakan metode agar plug
9 Takasaki Scientific Instruments Corp). Setiap 3 hari inkubasi, 350 ml kultur diambil dan dilakukan ekstraksi menggunakan pelarut etil asetat (1:1 v/v). Campuran di kocok dalam pengocok (Resipro Shaker SR-2s, Taitec) dengan kecepatan 300 stroke/menit selama 60 menit, dan kemudian disentrifugasi pada kecepatan 3000 x g (Kubota 7780) selama 20 menit. Fase organik dipisahkan dari fase air dan dipekatkan pada suhu 40 oC, ± 3 jam dalam labu rotavapor sampai diperoleh kurang lebih 20 ml ekstrak. Pemekatan dilanjutkan dengan memindahkan ekstrak ke dalam tabung dan proses dilakukan dengan alat pemekat pada suhu 30 oC, ± 90 menit (Sakuma EC-2000) sehingga diperoleh ekstrak etil asetat pekat. Ekstrak etil asetat kemudian dilarutkan dalam metanol (HPLC
Grade 99% kemurnian) dan dibuat pada konsentrasi 30000 mg/l. Uji aktivitas antibakteri dilakukan dengan metode Kirby-Bauer (Bauer et al. 1966). Ekstrak etil asetat dalam metanol diteteskan ke dalam kertas cakram diameter 6 mm sampai konsentrasi 1 mg/disc (30 µ l) dan dikering anginkan. Kertas cakram selanjutnya diletakkan di atas media MHA yang telah di inokulasi dengan bakteri uji (106 cfu/ml) dan di inkubasi pada suhu 36 ± 1 oC selama 24-48 jam. Kontrol negatif yang digunakan adalah etil asetat dan metanol, dan sebagai kontrol positif adalah ampisilin pada konsentrasi 30 µg/disc, juga dilakukan uji aktivitas antibakteri.
Karakterisasi pola pertumbuhan dan morfologi aktinomiset aktif
Karakterisasi pola pertumbuhan di dalam media agar dilakukan dengan menumbuhkan isolat pada empat jenis media agar dalam cawan, yaitu Yeast-extract malt-Yeast-extract (ISP2), Inorganic salt-starch (ISP4), MicromonosporaStarch Medium (MS), dan Bennett’s Medium (BM) (Lampiran 4). Inkubasi selama selama 21 hari pada suhu 28 oC dan dilakukan pengamatan yang meliputi warna koloni, pertumbuhan miselia, dan pertumbuhan spora. Karakterisasi pola pertumbuhan isolat aktinomiset di dalam media cair dilakukan dengan menumbuhkan masing-masing kultur murni aktinomiset ke dalam 30 ml media vegetatif (ISP2 cair). Kultur vegetatif sebanyak 10 % (v/v)(106 spora/mL) dipindahkan ke dalam 45 ml media fermentasi cair setelah 72 jam inkubasi pada suhu 28 oC, 220 rpm Fermentasi dilakukan pada kondisi yang sama selama 15 hari dan setiap selang waktu 3 hari kultur di panen. Sepuluh mililiter kultur dimasukkan ke dalam tabung dan disentrifugasi pada kecepatan 3000 x g selama 5 menit pada suhu 4 oC untuk memisahkan miselia dari partikel-partikel di dalam media (dilakukan menggunakan Kubota 7780). Miselia yang telah terpisah dilarutkan kembali dengan larutan salin (0,85% natrium klorida) sampai diperoleh volume awal. Tahap ini di ulang sampai 3 kali, kemudian tabung dibiarkan selama 20 menit agar miselia mengendap. Padatan miselia atau packed mycelial volume
(PMV) di ukur dan dinyatakan sebagai persen (%) sel terhadap volume (10 ml) cairan (Rho et al. 1991).
10
Karakterisasi Molekuler Isolat Aktinomiset Aktif
Isolasi DNA
DNA isolat aktinomiset diekstraksi menggunakan Instagene Matrix
(BioRad) dan dilakukan sesuai prosedur dari pabrik. Koloni tunggal aktinomiset pada media agar diambil dan dimasukkan ke dalam tabung mikro yang telah diisi dengan 10 µ l ddH2O, kemudian ditambahkan kedalamnya 90 µ l larutan Instagene Matrix. Tabung yang berisi campuran tersebut selanjutnya dipanaskan pada suhu 100 ºC selama 15 menit dan disentrifugasi pada kecepatan 12500 rpm/16500 x g (TOMY MX-301, USA) selama 3 menit. Supernatan diambil sebanyak 8 µ l untuk dilakukan amplifikasi menggunakan PCR (PCR Thermal Cycler, Takara, Japan). Konsentrasi dan kemurnian DNA hasil isolasi ditentukan dengan spektrofotometer (Nanodrop ND-1000).
Amplifikasi Polymerase Chain Reaction (PCR) DNA hasil ekstraksi
Amplifikasidilakukan menggunakan Master mix dari produk Go Taq Green Master Mix (Promega) dalam campuran yang terdiri dari ddH2O 1.6 µL, DMSO 1 µ l, primer universal 178 F (5′-GATCCACATGATGTATTAGTGC) 0.2 µ l, primer universal 179 R (5'-GGTGTTGTCGTTGTTCCAGTAGAGGATGTC) 0.2 µ l, Master Mix 9 µ l, dan template 8 µL. Semua bahan dicampur dengan pipet dan larutan dispindown dengan disentrifugasi. Kondisi PCR yang digunakan adalah sebagai berikut : pre-denaturasi 96 oC, 2 menit; denaturasi 96 oC, 20 detik;
annealing 60 oC, 20 detik; elongasi 72 oC, 1 menit; elongasi akhir 72 oC, dan dilakukan sebanyak 35 siklus.
Pemurnian produk PCR
Tahap ini dilakukan menggunakan Gel/PCR DNA fragments Extraction Kit
11
Amplifikasi Polymerase Chain Reaction (PCR) DNA hasil pemurnian
Tahap ini dilakukan menggunakan Master mix dari produk Go Taq Green Master Mix (Promega). Amplifikasi dilakukan dalam campuran yang terdiri dari ddH2O 1.6 µl, DMSO 1 µ l, primer 178 F 0.2 µ l, primer 179 R 0.2 µ l, Master Mix 9 µ l, dan Template 8 µ l. Kondisi PCR yang digunakan adalah sebagai berikut : pre-denaturasi 96 oC, 2 menit; denaturasi 96 oC, 20 detik; annealing 60 oC, 20 detik; elongasi 72 oC, 1 menit; elongasi akhir 72 oC, dan dilakukan sebanyak 35 siklus. Produk PCR yang telah dilakukan pemurnian disekuens menggunakan ABI 3130 Genetic Analyzer. Hasil sekuens 16S rRNA dibandingkan dengan database yang ada di genebank National Center Biotechnology Information (NCBI) dengan
Basic Aligment Search Tool (BLAST). Sekuen 16S rRNA selanjutnya disejajarkan menggunakan program CLUSTAL W2. Analisis filogenetik dilakukan menggunakan perangkat lunak MEGA 5. Jarak genetik dikomputasi menggunakan metode p-distance (Tamura et al. 2011).
Karakterisasi awal dan pendugaan berat molekul senyawa aktif antibakteri
Ekstrak etil asetat isolat aktinomiset aktif yang telah dikeringkan dibuat larutan pada konsentrasi 1000 mg/l menggunakan metanol (HPLC Grade). Larutan selanjutnya, dianalisis menggunakan kromatografi cair kinerja tinggi (KCKT). Sistem KCKT yang digunakan adalah Waters 2695, dengan kolom C18
12
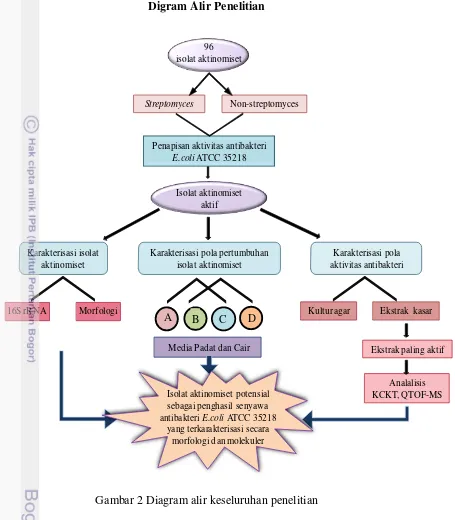
Digram Alir Penelitian
96 isolat aktinomiset
Streptomyces Non-streptomyces
Penapisan aktivitas antibakteri
E.coliATCC 35218
Isolat aktinomiset aktif
Karakterisasi isolat aktinomiset
Karakterisasi pola aktivitas antibakteri Karakterisasi pola pertumbuhan
isolat aktinomiset
Morfologi 16S rRNA
A B C D
Media Padat dan Cair
Kultur agar Ekstrak kasar
Ekstrak paling aktif
Analalisis KCKT, QTOF-MS Isolat aktinomiset potensial
sebagai penghasil senyawa antibakteriE.coliATCC 35218
yang terkarakterisasi secara morfologi dan molekuler
Gambar 2 Diagram alir keseluruhan penelitian
4 HASIL DAN PEMBAHASAN
Hasil pengelompokan isolat aktinomiset berdasarkan morfologi mikroskopis diperoleh 8 isolat yang termasuk ke dalam kelompok Streptomyces dan 88 isolat termasuk dalam kelompok non-streptomyces. Hasil selengkapnya disajikan pada Lampiran 1. Penapisan aktivitas antibakteri terhadap 96 isolat aktinomiset diperoleh 3 isolat yang menunjukkan aktivitas penghambatan terhadap E. coli
BioMCC-at.HH-13 78 dan BioMCC-at.HH-259, berturut-turut dengan diameter penghambatan sebesar 13,55, 13,88 and 14,71 mm (Lampiran 2). Aktivitas antibakteri ditunjukkan oleh zona bening di sekitar isolat (Gambar 3).
Gambar 3 Aktivitas antibakteri isolat aktinomiset BioMCC-at.HH-64, BioMCC-at.HH-78 dan BioMCC-at.HH-259 terhadap E.coli ATCC 35218 (ditandai oleh tanda panah)
Dari hasil pengelompokan isolat aktinomiset yang digunakan pada penelitian ini, dapat disimpulkan bahwa 92% isolat aktinomiset yang digunakan merupakan kelompok non-streptomyces atau aktinomiset langka. Aktinomiset langka merupakan sumber potensial untuk penapisan senyawa aktif, dalam hal ini senyawa antibakteri, yang berasal dari mikrob (Berdy 2005). Hal ini terbukti dengan adanya aktivitas antibakteri dari isolat aktinomiset yang diujikan, yaitu diperoleh tiga isolat yang mampu menghambat E. coli ATCC 35218. Aktivitas antibakteri tertinggi dihasilkan oleh isolat BioMCC-at.HH-259 dengan diameter hambat 14,7 mm. Tingkat penghambatan yang dihasilkan oleh isolat aktinomiset BioMCC-at.HH-259 dan dua isolat lainnya termasuk dalam kategori lemah. Tingkat penghambatan diperoleh dengan mengurangi diameter penghambatan yang terbentuk dengan diameter kultur aktinomiset yang diujikan. Tingkat penghambatan 5 < 10 mm termasuk dalam kategori lemah, 10 < 20 mm kategori sedang, dan > 20 mm termasuk dalam kategori kuat (El-Tarabily et al. 2000).
14
Gambar 4 Pola aktivitas antibakteri isolat aktinomiset BioMCC-at.HH-64 (○), BioMCC-at.HH-78 (□) dan BioMCC-at.HH-259 (∆) berdasarkan umur kultur pada media agar
Pola aktivitas antibakteri ekstrak etil asetat kasar isolat aktinomiset aktif berdasarkan lama fermentasi di dalam kultur cair disajikan dalam Gambar 5. Hasil menunjukkan sampai hari ke-15 fermentasi, ekstrak etil asetat dari isolat BioMCC-at.HH-64 tidak menunjukkan aktivitas antibakteri. Ekstrak etil asetat isolat BioMCC-at.HH-78 menunjukkan aktivitas antibakteri setelah fermentasi 12 hari dan aktivitas antibakteri tidak terlihat pada ekstrak hasil fermentasi 15 hari. Ekstrak etil asetat isolat BioMCC-at.HH-259 juga menunjukkan aktivitas antibakteri setelah fermentasi 12 hari dan aktivitas antibakteri meningkat setelah fermentasi 15 hari. Dibandingkan dengan kontrol positif yang digunakan, yaitu ampisilin, aktivitas antibakteri ekstrak etil asetat dari BioMCC-at.HH-259 setelah 15 hari fermentasi pada konsentrasi 1 mg per disc setara dengan aktivitas antibakteri ampisilin pada konsentrasi 30 µg per disc (Lampiran 3). Perbedaan konsentrasi yang cukup tinggi tersebut kemungkinan dikarenakan ekstrak etil asetat aktinomiset masih banyak mengandung pengotor baik dari media fermentasi maupun senyawa lainnya, sedangkan kontrol sudah merupakan senyawa murni dengan tingkat kemurnian 99%.
0
15 Pola aktivitas antibakteri yang dihasilkan dari kultur agar dan cair pada penelitian ini sangatlah berbeda. Perbedaan tersebut dimungkinkan ketika uji aktivitas antibakteri dilakukan terhadap kultur agar isolat aktinomiset, maka banyak campuran senyawa lainnya yang memiliki aktivitas antibakteri terhadap
E.coli ATCC 35218 dan ketika dilakukan ekstraksi, senyawa tersebut tidak dapat larut di dalam etil asetat. Kasus seperti ini mungkin dikarenakan pelarut yang kurang sesuai dan proses pengocokan campuran yang tidak cukup (Gurung et al.
2009). Kemungkinan lainnya adalah karena perbedaan morfologi aktinomiset ketika ditumbuhkan di dalam media agar dan cair, yaitu sebagai miselia berfilamen di dalam media agar dan sebagai potongan-potongan miselia di dalam media cair, atau karena adanya modifikasi kimia dari senyawa aktif yang menjadi tidak aktif di dalam kultur cair (Bushell 1993). Aktivitas antibakteri ekstrak etil asetat dari kultur cair, selain dipengaruhi oleh kondisi fermentasi termasuk komposisi media, aerasi dan jumlah inokulum; juga dipengaruhi oleh proses ekstraksi, termasuk pelarut yang digunakan dan lamanya pengocokan campuran (Qin et al. 2012).
Aktivitas antibakteri ekstrak etil asetat isolat aktinomiset baru terlihat setelah 12 hari fermentasi, yaitu lebih lambat dibandingkan aktivitas antibakteri dari kultur agar. Pada kelompok aktinomiset dan mikrob berspora lainnya, produksi metabolit sekunder terjadi bersamaan, atau sedikit lebih awal, sebelum dimulainya sporulasi, hal ini terjadi ketika ditumbuhkan pada media agar atau padat. Dari hasil penelitian ini, isolat BioMCC-at.HH-259 menunjukkan aktivitas antibakteri yang lebih lambat dibandingkan dua isolat lainnya, kemungkinan karena dimulainya proses sporulasi yang juga lebih lambat. Produksi metabolit sekunder maupun sporulasi terjadi hampir bersamaan pada awal fase stasioner, dapat diduga bahwa kedua proses tersebut diatur oleh mekanisme yang tumpang tindih. Pada beberapa kasus tidak ada keterkaitan antara pembentukan spora dan produksi antibiotik, khususnya, oleh organisme yang tidak berspora. Dalam kultur cair, produksi metabolit sekunder umumnya terbatas sampai pada fase stasioner, dan lebih sering terjadi karena keterbatasan nutrisi (Bibb 2005; Glazer dan Nikaido 2007). Berdasarkan pola aktivitas antibakteri yang diperoleh di atas, menunjukkan bahwa produksi senyawa antibakteri E. coli ATCC 35218 oleh isolat aktinomiset BioMCC-at.HH-64, 78, dan 259 dipengaruhi oleh umur kultur dan lama fermentasi. Penggunaan media agar atau padat dalam penelitian ini lebih sesuai untuk produksi senyawa aktif antibakteri, karena membutuhkan waktu yang lebih cepat, namun penelitian lebih lanjut perlu dilakukan.
16
Tabel 2 Pola pertumbuhan isolat aktinomiset aktif pada berbagai media agar
1 2 3 1 2 3 1 2 3
ISP2 Bagus Hitam Hitam Sedang Hitam
kecoklatan Hitam Bagus Hitam Hitam
ISP4 Bagus Hitam Tidak berwarna Bagus Hitam Tidak berwarna Bagus Hitam Tidak berwarna
MS Kurang bagus Oranye-hitam
kecoklatan Tidak berwarna Bagus
Hitam
kecoklatan Tidak berwarna Bagus Hitam Tidak berwarna
BM Sedang Oranye-hitam
kecoklatan Tidak berwarna Bagus Hitam Tidak berwarna Sedang Krem Tidak berwarna BioMCC-at.HH-78
BioMCC-at.HH-64 BioMCC-at.HH-259
Media
17 melekat erat pada media melalui hifa yang menembus ke dalam media (Kalakoutskii dan Agre 1976). Berdasarkan tipe-tipe koloni di atas, ketiga isolat aktinomiset termasuk ke dalam tipe yang pertama.
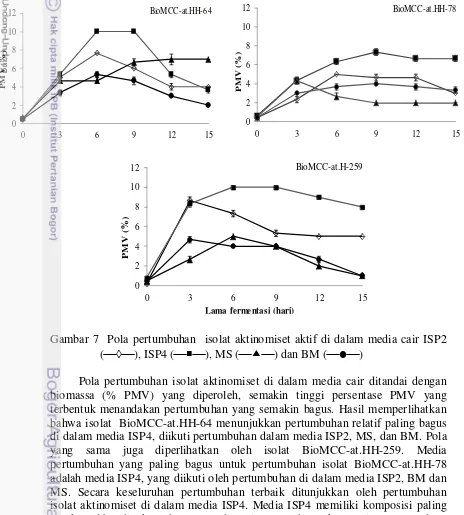
Hasil karakterisasi pola pertumbuhan isolat aktinomiset di dalam empat jenis media cair bervariasi antar isolat (Gambar 7). Berdasarkan PMV yang diperoleh, pertumbuhan ketiga isolat di dalam media ISP4 menunjukkan pertumbuhan yang relatif lebih bagus dibandingkan di dalam media lainnya.
Gambar 7 Pola pertumbuhan isolat aktinomiset aktif di dalam media cair ISP2 (), ISP4 (), MS () dan BM ()
Pola pertumbuhan isolat aktinomiset di dalam media cair ditandai dengan biomassa (% PMV) yang diperoleh, semakin tinggi persentase PMV yang terbentuk menandakan pertumbuhan yang semakin bagus. Hasil memperlihatkan bahwa isolat BioMCC-at.HH-64 menunjukkan pertumbuhan relatif paling bagus di dalam media ISP4, diikuti pertumbuhan dalam media ISP2, MS, dan BM. Pola yang sama juga diperlihatkan oleh isolat BioMCC-at.HH-259. Media pertumbuhan yang paling bagus untuk pertumbuhan isolat BioMCC-at.HH-78 adalah media ISP4, yang diikuti oleh pertumbuhan di dalam media ISP2, BM dan MS. Secara keseluruhan pertumbuhan terbaik ditunjukkan oleh pertumbuhan isolat aktinomiset di dalam media ISP4. Media ISP4 memiliki komposisi paling lengkap dibandingkan dengan media lain yang digunakan, yaitu mengandung
soluble starch, ammonium sulfat, dan kalium fosfat, berturut-turut adalah sebagai
18
sumber karbon, nitrogen, dan fosfat. Media tersebut juga menyediakan elemen mikro sebagai sumber logam, seperti zat besi dan mangan. Pola pertumbuhan di dalam media ini juga bervariasi antar isolat, hal ini dimungkinkan karena kemampuan untuk mencerna komponen media juga bervariasi (Kalakoutskii dan Agre 1976; Glazer dan Nikaido 2007).
Pertumbuhan dan produksi antibiotik oleh aktinomiset dan mikrob lain yang berspora di dalam batch culture, terutama dipengaruhi oleh dua faktor. Pertama adalah sifat dasar dan konsentrasi komposisi media yang berbeda seperti karbon, nitrogen, fosfat, dan sumber logam. Sumber karbon yang dapat secara langsung tersedia untuk pertumbuhan, seperti glukosa, seringkali menekan produksi antibiotik namun sangat bagus untuk pertumbuhan. Polisakarida seperti, pati, lebih sering digunakan dalam produksi antibiotik. Kedua, kondisi kultivasi seperti suhu, pH, waktu inkubasi, ketersediaan oksigen, serta tipe dan konsentrasi inokulum. Dalam kultur kocok, faktor paling penting yang berpengaruh terhadap perpindahan massa gas dalam media kultivasi adalah bentuk dan volume labu kultivasi, volume media, agitasi, dan kekentalan media (El-Enshasy et al. 2000; Himabindu dan Jetty 2006).
Hasil pengamatan morfologi mikroskopis isolat aktinomiset aktif menunjukkan bahwa semua isolat termasuk ke dalam kelompok non-streptomyces, yaitu genus Micromonospora. Berdasarkan morfologinya isolat aktinomiset aktif memiliki spora tunggal berbentuk bola dengan ukuran 0,6 -0,9 µ m yang terletak pada pangkal cabang hifa yang pendek atau panjang, dan beberapa berkembang dalam satu kelompok (Gambar 8).
Micromonospora merupakan salah satu genus aktinomiset selain
Streptomyces, yang dikenal sebagai penghasil antibiotik dunia, dan genus ini masih sangat sedikit diteliti dibandingkan dengan Streptomyces. Beberapa senyawa bioaktif baru merupakan hasil isolasi dari spesies Micromonospora, dan menunjukkan aktivitas antitumor, antiparasit, and antimikrob (Charan et al. 2004; Igarashi et al. 2007; Gärtner et al. 2011; Sakai et al. 2012). Anggota dari genus
Micromonospora yang dikenal sebagai penghasil antibiotik antara lain adalah M. purpurea dan M. echinospora, keduanya merupakan penghasil gentamisin, dan M. chalcea yang merupakan penghasil izumenolida. Gentamisin merupakan 18 antibiotik dengan spektrum luas, bersifat basa, dan terlarut dalam air, dengan aktivitas tinggi terhadap bakteri Gram-negatif dan Mycobacterium tuberculosis
19 (Himabindu dan Jetty 2006), sedangkan, izumenolida merupakan inhibitor beta-laktamase (Liu et al. 1980). Dari hasil pengamatan morfologi dapat disimpulkan bahwa isolat aktinomiset aktif dalam penelitian ini termasuk dalam kelompok non-streptomyces (aktinomiset langka).
Hasil isolasi DNA isolat aktinomiset aktif dilakukan elektroforesis di dalam gel agarose dan hasil pengamatan menunjukkan terbentuknya pita tunggal pada gel dengan ukuran ± 700 pb. Gambar elektroforesis DNA di dalam gel agarose tidak disajikan karena kualitas gambar yang tidak bagus. Hasil kuantifikasi konsentrasi DNA isolat aktinomiset adalah 62,62 ng/ul untuk isolat BioMCC-at.HH-64, 39,48 ng/ul untuk BioMCC-at.HH-78 dan 90,24 ng/ul untuk isolat. Tingkat kemurnian masing-masing amplikon adalah 1,90 untuk isolat BioMCC-at.HH-64, 1,79 untuk BioMCC-at.HH-78 dan 1,93 untuk BioMCC-at.HH-259 (Tabel 3).
Tabel 3 Hasil kuantifikasi konsentrasi dan kemurnian DNA hasil isolasi
Kode Isolat Konsentrasi (ng/ul) Kemurnian
BioMCC-at.HH-64 62,62 1,90
BioMCC-at.HH-78 39,48 1,78
BioMCC-at.HH-259 90,24 1,93
Berdasarkan hasil kuantifikasi konsentrasi DNA hasil isolasi di atas menunjukkan bahwa DNA yang diperoleh cukup untuk dilakukan amplifikasi, demikian juga dengan tingkat kemurnian yang diperoleh. DNA dapat dikatakan murni atau terbebas dari kontaminan protein jika memiliki kemurnian 1,8 – 2,0. Sekuens 16S rRNA dari produk PCR dengan ABI Genetic Analyzer menunjukkan hasil yang cukup bagus dan dapat dilihat dari kromatogram yang terbentuk (Lampiran 5-10), panjang sekuens yang diperoleh berkisar antara 610-720 pb dari total sekitar 1500 pb sekuen 16S rRNA. Hasil sekuens parsial selanjutnya dilakukan analisis menggunakan perangkat lunak BioEdit untuk mendapatkan sekuen konsensus (Lampiran 11).
Hasil pensejajaran sekuen parsial 16S rRNA dari ketiga isolat aktinomiset aktif dengan sekuen di database GenBank menggunakan program blastn
menunjukkan bahwa ketiga isolat memiliki tingkat kemiripan tertinggi dengan
Micromonospora chersina sebesar 99 % (Tbael 4).
Tabel 4 Hasil pensejajaran sekuens parsial 16S rRNA isolat aktinomiset aktif dengan galur acuan yang terdapat pada databaseGenBank
Kode isolat Panjang
sekuens (pb) Strain acuan No Akses
Tingkat kemiripan (%)
BioMCC-at.HH-64 724 M. chersina R-Ac 138 FN649453 99
BioMCC-at.HH-78 613 M. chersina RT III8 EU274367 99
BioMCC-at.HH-259 647 M. chersina R-Ac 135 FN649452 99
BioMCC-at.HH-20
259 dengan jarak genetik 0,8. Isolat aktinomiset BioMCC-at.HH-78 memiliki tingkat homologi 42 % dengan kedua isolat aktinomiset lainnya.
Tabel 5 Persentase nilai jarak genetik (bawah diagonal) dan homologi (atas diagonal) antara isolat aktinomiset aktif
A B C D
A 99,00 42,40 98,50
B 1,0 42,57 99,17
C 57,6 57,4 42,74
D 1,5 0,8 57,3
AM. chersina DSM44151, B BioMCC-at.HH-64, C BioMCC-at.HH-78, D BioMCC-at.HH-259
Hasil analisis molekuler terhadap ketiga isolat aktif diperoleh sekuen parsial dengan panjang masing-masing adalah 724, 613, dan 647 pb untuk isolat BioMCC-at.HH-64, BioMCC-at.HH-78, dan BioMCC-at.HH-259. Masing-masing sekuen 16S rRNA dari isolat selanjutnya dibandingkan dengan sekuen 16S rRNA yang tersedia di database GenBank dengan blastn. Hasil menunjukkan bahwa ketiga isolat memiliki kemiripan dengan Micromonospora chersina,
dengan tingkat kemiripan 99 %, yaitu BioMCC-at.HH-64 memiliki kedekatan tertinggi dengan M. chersina R-Ac138 (FN649453), isolat HH-78 dengan M. chersina RtIII8 (EU274367), dan isolat BioMCC-at.HH-259 dengan M. chersina
R-Ac135 (FN649452). Isolat aktif aktinomiset, meskipun ketiganya teridentifikasi 99% memiliki kedekatan dengan M. chersina, namun berdasarkan penghitungan jarak genetik antar sekuen 16S rRNA dari ketiga isolat tersebut ternyata memiliki jarak genetik yang cukup jauh. Isolat BioMCC-at.HH-78 hanya memiliki tingkat homologi sekitar 42% dengan dua isolat lainnya, dan isolat BioMCC-at.HH-64 dan BioMCC-at.HH-259 memiliki tingkat homologi 99,17 % satu sama lain.
21
Gambar 9 Dendogram filogenetik berdasar sekuen gen 16S rRNA isolat aktinomiset aktif dan genus lainnya (akar dari bootstrap). Isolat aktif ditunjukkan oleh simbol tebal. Persentasi bootstrap value
berdasar pada 500 kali ulangan data ditunjukkan pada nodes;
bootstrap value lebih rendah dari 40 % dibuang
22
isolat BioMCC-at.HH-78 memiliki jarak genetik yang cukup jauh dengan dua isolat aktinomiset aktif lainnya, yaitu 57 % dengan tingkat homologi 42 %. Berbeda dengan kedua isolat aktif lainnya, yang memiliki jarak genetik cukup dekat yaitu 0,8 dengan tingkat homologi 99,17 %. Menurut Koch et al. (1996), tingkat kekerabatan Micromonospora spp. tinggi, berkisar dari 97-99%, dan tingkat kemiripan untuk beberapa tipe galur Micromonospora juga sangat tinggi (>98%), sehingga untuk menentukan status suatu spesies tidak bisa hanya dengan data hasil sekuen 16S rRNA, namun perlu dilakukan hibridisasi DNA-DNA untuk memastikan tipe galur dari spesies tersebut. Dua isolat dapat dianggap sebagai satu spesies apabila hibridisasi DNA-DNA lebih dari 70% (Goris et al. 2007). Kasus seperti ini banyak dilaporkan terjadi pada kelompok aktinomiset, terutama pada beberapa tipe galur dari spesies Micromonospora. Sebagai contoh kasus adalah M. echinospora subsp. ferruginea dan M. echinospora subsp. echinospora,
memiliki sekuen 16S rRNA yang sangat identik (tingkat kemiripan 99,7%); namun subspesies ke tiga, M. echinospora subsp. pallida, memiliki keterkaitan yang jauh dengan kedua subspesies lainnya. Hal ini kemungkinan karena perbedaan konsentrasi menakuinon dan komposisi asam lemak yang terkandung dalam isolat tersebut(Koch et al. 1996).
Micromonospora chersina pertama kali dipublikasikan oleh Tomita et al. (1992), miselia muda dari spesies ini bercabang secara monopodial dan membentuk spora tunggal (berbentuk bola dengan duri tumpul yang pendek) yang tidak bertangkai atau muncul pada sporofor yang pendek atau panjang, dan tidak membentuk miselia aerial. Isolat ini dikenal sebagai penghasil dienemisin, yaitu suatu antitumor-antibiotik, dengan aktivitas spektrum luas, tidak hanya aktif terhadap sel tumor namun juga aktif terhadap bakteri dan cendawan (Konishi et al. 1991). Dienemisin, khususnya dienemisin A hingga saat ini masih diteliti untuk kemungkinan penggunaannya dalam pengobatan (Tuttle et al. 2005). Publikasi mengenai aktivitas anti beta-laktamase yang dihasilkan oleh species ini belum pernah dilaporkan.
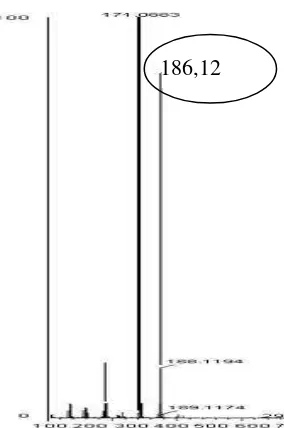
23
Gambar 10 Spektrum massa senyawa dari ekstrak etil asetat isolat BioMCC-at.HH-259
Kromatogram ekstrak etil asetat isolat BioMCC-at.HH-259 menunjukkan perbedaan yang cukup nyata dengan kromatogram dari isolat BioMCC-at.HH-78. Hasil analisis KCKT memperlihatkan bahwa dari kromatogram ekstrak etil asetat isolat BioMCC-at.HH-259 terdapat satu puncak yang dominan yang muncul pada waktu retensi 15-16 menit. Berdasarkan hasil ini, selanjutnya ekstrak dilakukan analisis menggunakan QTOF-MS untuk pendugaan awal berat molekul senyawa aktif. Hasil menunjukkan bahwa senyawa dari ekstrak etil asetat isolat BioMCC-at.HH-259 mempunyai berat molekul ±186,12 Da. Hasil pencarian melalui database yang terdapat pada ChemSpider, senyawa yang memiliki berat molekul paling mendekati adalah senyawa naphtylethylenediamine (N-(1-Naphthyl
)-1,2-ethanediamine), dengan rumus molekul C12H14N2. Senyawa ini bersifat polar dan dapat larut dalam air. Aktivitas antibakteri dari senyawa tersebut belum pernah dilaporkan, namun senyawa turunannya, N-(1-Naphthyl)-1,2-ethanediamine dihydrochloride, telah digunakan sebagai pereaksi kuantitatif (sebagai coupling agent) untuk analisis dengan metode spektrofotometrik protein tiol (Verma et al.1991); sulfonamid dan thallium (III) (Nagaraja et al. 2008). Struktur molekul
naphtylethylenediamine dan senyawa turunannya, N-(1-Naphthyl
)-1,2-ethanediaminedihydrochloride dapat dilihat pada Gambar 11.
Gambar 11 Struktur molekul naphtylethylenediamine (kiri) dan N-(1-Naphthyl) 1,2-ethanediaminedihydrochloride (kanan)
24
Senyawa bioaktif yang dihasilkan isolat aktinomiset pada penelitian ini kemungkinan adalah inhibitor beta-laktamase atau senyawa antibakteri yang sedikit dihidrolisis atau tidak dapat dihidrolisis oleh aktivitas beta-laktamase yang dihasilkan oleh bakteri target (Babic et al. 2006). Bakteri E. coli ATCC 35218 merupakan bakteri resisten beta-laktam, tidak bersifat patogen dan memproduksi beta-laktamase tipe TEM-1. Dalam studi uji tantang mikrob, bakteri tersebut digunakan sebagai bakteri pengganti untuk EHEC E. coli O157:H7 (Gurtler et al. 2010). Pada bakteri Gram-negatif, beta-laktamase merupakan mekanisme resistensi yang sangat penting terhadap antibiotik beta-laktam. Beta-laktamase merupakan enzim yang diproduksi oleh bakteri yang menghidrolisis cincin beta-laktam dan menjadikan antibiotik tidak aktif sebelum target penicillin binding protein (PBP). Terdapat dua prinsip untuk menghadapi resistensi terhadap beta-laktam termasuk menemukan inhibitor dan inactivator beta-laktamase dan antibiotik baru yang menunjukkan daya ikat yang lebih kuat terhadap PBP dan tidak atau sedikit dihidrolisis oleh beta-laktamase (Babic et al. 2006). Pada saat ini terdapat 3 jenis inhibitor beta-laktamase yang digunakan untuk pengobatan: asam klavulanat, sulbaktam, dan tazobaktam, yang penggunaannya dikombinasikan dengan antibiotik lainnya (Miller et al. 2001).
Agen antibakteri merupakan salah satu metabolit sekunder yang diproduksi oleh aktinomiset. Metabolit sekunder diproduksi sebagai respon akan terbatasnya ketersediaan nutrisi, dan tidak diperlukan untuk pertumbuhan mikrob penghasilnya, akan tetapi menyediakan fungsi pertahanan diri untuk hidup di alam. Berbeda dengan metabolit sekunder, metabolit primer berhubungan dengan pertumbuhan dan pemeliharaan hidup, yang berkenaan dengan pelepasan energi dan penyusunan makromolekul penting seperti gula, protein, asam nukleat, dan asam organik. Suatu organisme akan mengalami kematian jika metabolisme primer berhenti (Demain dan Fang 1995).
Pada penelitian ini, dari 96 isolat aktinomiset yang digunakan untuk penapisan aktivitas antibakteri terhadap E. coli ATCC 35218, sebanyak 3 isolat yang menunjukkan aktivitas antibakteri, yaitu at.HH-64, BioMCC-at.HH-78 dan BioMCC-at.HH-259. Karakterisasi pola aktivitas antibakteri dari kultur agar ketiga isolat aktif tersebut menunjukkan aktivitas antibakteri tertinggi dihasilkan oleh kultur umur 9 hari, sedangkan aktivitas antibakteri dari ekstrak kasar etil asetat, dihasilkan oleh ekstrak hasil fermentasi selama 12 hari. Aktivitas antibakteri tertinggi dihasilkan oleh isolat aktinomiset BioMCC-at.HH-259. Ekstrak kasar dari isolat BioMCC-at.HH-259 ini selanjutnya dilakukan analisis KCKT dan pendugaan berat molekul dengan QTOF-MS. Karakterisasi pola pertumbuhan isolat aktinomiset aktif di dalam media agar maupun cair menunjukkan bahwa pertumbuhan terbaik adalah di dalam media ISP4. Karakterisasi morfologi makroskopis dan mikroskopis menunjukkan bahwa ketiga isolat termasuk ke dalam genus Micromonospora, spora yang dihasilkan mempunyai bentuk seperti bola-bola tunggal yang melekat pada pangkal atau percabangan hifa. Hasil analisis 16S rRNA sekuen parsial isolat aktinomiset menunjukkan bahwa ketiga isolat memiliki kedekatan tertinggi (99%) dengan
Micromonospora chersina.