EFEKTIVITAS TANAMAN HERBAL TERHADAP
FERMENTASI RUMEN, EMISI GAS METAN DAN POPULASI
PROTOZOA
IN VITRO
NURSANTI LAIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis efektivitas tanaman herbal terhadap fermentasi rumen, emisi gas metan dan populasi protozoa in vitro adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
.
RINGKASAN
NURSANTI LAIA. Efektivitas Tanaman Herbal terhadap Fermentasi Rumen, Emisi Gas Metan dan Populasi Protozoa In Vitro. Dibimbing oleh MUHAMMAD RIDLA, SRI SUHARTI dan ANURAGA JAYANEGARA.
Sektor peternakan khususnya ternak ruminansia, memegang peranan besar terhadap laju emisi gas metan yang berkontribusi terhadap pemanasan global sekaligus merupakan bentuk representasi dari sejumlah kehilangan energi bagi ternak. Salah satu pendekatan meminimalisasi emisi gas metan pada ternak ruminansia adalah melalui strategi pemberian pakan. Kelor, kunyit dan kedawung merupakan tanaman herbal yang mampu menurunkan populasi bakteri metagonenik. Tanaman-tanaman herbal mengandung saponin yang mampu menurunkan protozoa dan meningkatkan bakteri rumen, sehingga memperbaiki metabolisme rumen.
Penelitian ini menggunakan teknik fermentasi in vitro. Media inkubasi yang digunakan adalah cairan rumen + larutan buffer bikarbonat yang ditempatkan dalam botol dan diinkubasi dalam water bath bersuhu 39-41ᵒC selama 72 jam. Cairan rumen diambil dari sapi peranakan Friesian Holstein berfistula di BALITNAK Ciawi, Bogor. Penelitian terdiri dari dua tahap. Tahap 1 adalah screening terhadap tujuh tanaman herbal yang dirancang dengan menggunakan rancangan acak kelompok dengan 7 perlakuan dan 3 ulangan. Kriteria screening berdasarkan tanaman yang dapat menghasilkan produksi gas yang tinggi serta populasi protozoa yang rendah. Tahap 2 adalah pengujian 3 tanaman herbal berdasarkan hasil yang didapat dari pengujian tahap 1 yang dirancang dengan menggunakan rancangan acak kelompok dengan 8 perlakuan dan 3 ulangan. Rancangan perlakuannnya adalah R1= 100% bungkil inti sawit, R2 = 70% bungkil inti sawit + 30 % tepung daun kelor, R3 = 70% bungkil inti sawit + 30 % tepung kunyit, R4 = 70% bungkil inti sawit + 30 % tepung biji kedawung, R5 = 70% bungkil inti sawit + 15% tepung kelor + tepung kunyit, R6 = 70% bungkil inti sawit + 15% tepung kelor + 15% tepung kedawung, R7 = 70% bungkil inti sawit + 15% tepung kunyit + 15% tepung kedawung, R8 = 70% bungkil inti sawit+ 10% tepung kelor + 10% tepung kunyit + 10% tepung kedawung.
Hasil tahap 1 menunjukkan bahwa dari 7 tanaman herbal didapatkan 3 tanaman herbal yang dapat meningkatkan produksi gas dan populasi protozoa yang rendah secara in vitro yaitu kelor, kunyit dan biji kedawung. Hasil produksi gas total antar setiap tanaman menunjukkan adanya perbedaan (P<0.05). Produksi gas total paling tinggi terdapat pada tanaman kedawung, kelor dan kunyit. Populasi protozoa yang paling rendah terdapat pada tanaman kelor.
Hasil tahap 2 menunjukkan bahwa pemberian tanaman herbal nyata meningkatkan KCBK berkisar 56.72% sampai 65.77%, KCBO berkisar 52.10% sampai 59.54% dan NH3 berkisar 13.20 mM sampai 17.91 mM, VFA parsial, potensi produksi gas total, emisi gas metan dibandingkan kontrol (P<0.05).
SUMMARY
NURSANTI LAIA. Effectiveness Herb Plants on Rumen Fermentation, Methane Gas Emissions and Population Protozoa In Vitro Supervised by MUHAMMAD RIDLA, SRI SUHARTI dan ANURAGA JAYANEGARA.
Ruminant livestock sector plays a major role on the rate of methane gas emissions that contribute to global warming as well as a form of representation of the amount of energy loss for the animal. One approach to minimize emissions of methane in ruminant livestock is through feeding strategies. Moringa oileifera, turmeric and kedawung are some herbal plants that are able to reduce the methanogenic bacterial population. Herbal plants contain saponins that can lower rumen protozoa population and increase bacteria,thus improving rumen metabolism.
This research used in vitro fermentation techniques. Incubation mediums were rumen fluid and bicarbonate buffer solution which are placed in bottles and incubated in a water bath 39-41°C temperature for 72 hours. Rumen fluid was taken from fistulated Holstein Friesian cow. The study consisted of two stages. Phase 1 is the screening of seven herbs that are designed using a completely randomized block design with 7 treatments and 3 replications. Screening criteria which wasbased on plants that could produce high total gas production and low protozoa population. Phase 2 is testing three herbs which wasbased on the results that were obtained from the phase 1. It was designed with a completely randomized block design with 8 treatments and 3 replications. The treatments were R1 = 100% palm oil waste, R2 = 70% palm oil waste + 30% moringa leaves powder, R3 = 70% palm oil waste + 30% turmeric powder, R4 = 70% palm oil waste + 30% kedawung powder, R5 = 70% palm oil waste + 15% moringa powder+ 15% turmeric powder, R6 = 70% palm oil waste + 15% moringa powder + 15% kedawung powder, R7 = 70% palm oil waste + 15% turmeric powder + 15 % kedawung powder, R8 = 70% palm oil waste + 10% moringa powder+ 10% turmeric powder+ 10% kedawung powder.
The result of phase 1 showed that three herbs (moringa, turmeric and kedawung) increased the production of total gas and decrease protozoa population. Results showed that total gas production between each plant were significantly different (P<0.05). The highest total gas production is kedawung plant, moringa and turmeric. The lowest protozoa population found in the moringa plant.
The resulut of phase 2 showed that the supplementation of herbal plants increased dry matter digestibility (DMD) which ranged from 56.72% to 65.77%, organic matter digestibility (OMD) ranged from 52.10% to 59.54%, NH3 concetration ranged 13.20 mM-17.91 mM, VFA partial, total gas production, emissions of methane compared with control (P<0.05 ).
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Nutrisi dan Pakan
EFEKTIVITAS TANAMAN HERBAL TERHADAP FERMENTASI RUMEN, EMISI GAS METAN DAN POPULASI PROTOZOA
IN VITRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Efektivitas Tanaman Herbal terhadap Fermentasi Rumen, Emisi Gas Metan dan Populasi Protozoa In Vitro
Nama : Nursanti Laia NIM : D251140121
Disetujui oleh Komisi Pembimbing
Dr Ir M. Ridla, MAgr Ketua
Dr Sri Suharti, SPt MSi Anggota
Dr Anuraga Jayanegara, SPt MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Nutrisi dan Pakan
Prof Dr Ir Yuli Retnani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 15 Agustus 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2015 sampai Maret 2016 dengan judul Efektivitas Tanaman Herbal terhadap Fermentasi Rumen, Emisi Gas Metan dan Populasi Protozoa In Vitro. Sebagian isi dari karya ilmiah ini telah diseminarkan dalam seminar internasional pada kegiatan The 6th Basic Science International Conference 2016 yang diselenggarakan oleh Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Brawijaya dengan judul Effectiveness Herb Plants on Rumen Fermentation , Methane Gas Emissions and Population Protozoa In Vitro.
Terima kasih penulis ucapkan kepada Dr Ir M. Ridla, MAgr, Dr Sri Suharti, SPt MSi dan Dr Anuraga Jayanegara, SPt MSc, yang telah memberikan bimbingan selama pelaksanaan penelitian hingga penulisan karya ilmiah ini. Kepada Bapak Antonius Caniago staf pegawai Loka Penelitian Kambing Potong Sei Putih, Sumatera Utara yang telah memberikan dana beasiswa pada studi Magister. Kepada teman-teman mahasiswa prodi INP14 terkhusus (Arief, Aa Win, Pak Rudi, Servis, Dimar dan Mai) atas segenap bantuan dan kerjasamanya. Penulis juga menyampaikan terimakasih kepada mas Supri dan ibu Ade selaku tenaga kependidikan pada sekretariat INP yang telah memberikan bantuannya, serta semua pihak yang telah membantu terkait dengan penyelesaian penelitian dan karya ilmiah ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini dapat menjadi referensi yang bermanfaat bagi pembaca.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 2
2 METODE 2
Waktu dan Lokasi 2
Bahan 2
Alat 2
Ternak dan Pakan 2
Metode Penelitian 2
3 HASIL DAN PEMBAHASAN 9
Tahap I Screening Tujuh Tanaman Herbal 9
Tahap II In Vitro 10
4 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 16
5 DAFTAR PUSTAKA 17
LAMPIRAN
DAFTAR TABEL
1 Hasil analisis proksimat bahan pakan 3
2 Susunan ransum perlakuan 3
3 Kandungan fitokimia kualitatif daun kelor, kunyit dan biji kedawung 4 4 Rataan persentase KCBK, KCBO, Konsentrasi NH3 dan pH pada
berbagai perlakuan ransum 12
5 Rataan konsentrasi VFA Total dan Konsentrasi Parsial ( asam asetat,
asam propionat dan asam butirat) 13
6 Nilai rata-rata potensi produksi gas dan laju produksi gas per jam 14 7 Rata-rata produksi gas metan dan populasi protozoa pada berbagai
perlakuan 15
DAFTAR GAMBAR
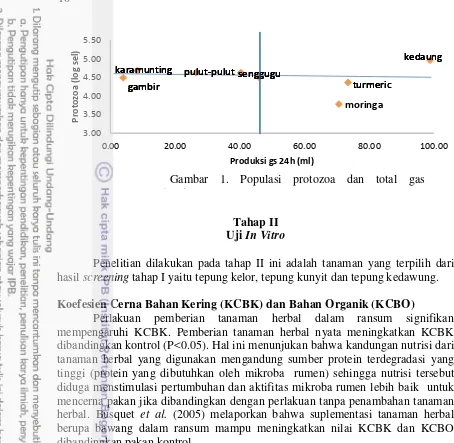
1 Populasi protozoa dan total gas 10
DAFTAR LAMPIRAN
1 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap kecernaan
bahan kering (KCBK) 18
2 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap kecernaan
bahan organik (KCBO) 18
3 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap
konsentrasi Amonia (NH3) 18
4 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap pH 18 5 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap asetat 18 6 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap propionat 19 7 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap butirat 19 8 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap VFA total 19 9 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap produksi
total gas 19
10 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap laju
produksi gas 19
1
PENDAHULUAN
Latar Belakang
Pemanasan global (global warming) merupakan permasalahan lingkungan utama yang dihadapi oleh manusia khususnya pada abad terakhir ini. Akar permasalahan pemanasan global telah diketahui berkaitan dengan sangat tingginya laju akumulasi sejumlah gas rumah kaca pada lapisan atmosfer seperti karbon dioksida (CO2), metan (CH4), nitrogen oksida (N2O) dan kloro fluoro karbon (CFC) sebagai akibat dari semakin tingginya intensitas berbagai aktivitas manusia (Thorpe 2009). Gas metan (CH4) merupakan hasil fermentasi anaerob karbohidrat struktural maupun non struktural oleh metanogen (bakteri penghasil metan) di dalam rumen ternak ruminansia, dan selanjutnya dikeluarkan ke atmosfer melalui proses eruktasi. Menurut Johnson (1995) dan Pelchen dan Peters (1998), gas CH4 yang dikeluarkan dari rumen mengindikasikan energiyang hilang dari tubuh ternak ruminansia dengan variasi 7% sampai 12% dari energi yang terkonsumsi. Selain itu, CH4 yang dihasilkan oleh ternak ruminansia mempunyai kontribusi yang signifikan terhadap pemanasan global. Moss (1993) menyatakan bahwa populasi ruminansia mempunyai kontribusi sebesar 12% sampai 15% dari pencemaran CH4 di atmosfer.
Populasi protozoa di dalam rumen diketahui berbanding lurus dengan produksi gas metan, artinya produksi gas metan berkurang bila populasi protozoa rumen menurun. Dengan demikian, emisi gas metan dapat dikurangi dengan memberikan zat defaunator protozoa pada populasi bakteri pencerna serat seperti saponin (Thalib 2008). Sementara tanin dapat menurunkan emisi gas metan melalui kinerjanya dalam mereduksi populasi metanogen dalam rumen (Bhatta et al. 2009) dan juga melalui penghambatan pencernaan komponen serat pakan sehingga mengurangi produksi H2 (Tavendale et al. 2005).
Salah satu pendekatan meminimalisasi emisi gas metan pada ternak ruminansia adalah melalui strategi pemberian pakan. Menurut Clark (2009), metode untuk menurunkan produksi gas metan telah banyak dilakukan, antara lain dengan pendekatan manajemen pemberian pakan seperti penggunaan hijauan yang berkualitas, meningkatkan jumlah konsentrat dalam ransum, pemberian lemak dan minyak dalam ransum serta penambahan metabolit tanaman-tanaman sekunder (zat aktif). Makkar et al. (2007) melaporkan bahwa penggunaan tanaman herbal di dalam ransum mampu menurunkan produksi gas metan. Sementara peneliti lain (Kongmun et al. 2011) menyatakan bahwa dengan penggunaan bawang putih dan minyak kelapa mampu menurunkan populasi bakteri metagonik penghasil metan.
2
1994), sehingga reduksi populasi protozoa juga dapat menurunkan emisi gas metan. Jika kedua senyawa tersebut digunakan secara simultan dalam pakan, baik pada pakan dengan proporsi hijauan tinggi maupun pakan dengan proporsi konsentrat tinggi, diharapkan akan menghasilkan efek yang lebih signifikan dalam menurunkan emisi gas metan. Penelitian ini dapat dimanfaatkan sebagai pemberi informasi, rekomendasi dan alternatif tanaman herbal terbaik di dalam ransum komplit dalam rangka mengurangi emisi gas metan, meningkatkan karakteristik fermentasi rumen serta menurunkan populasi protozoa pada ternak ruminansia secara in vitro. Tujuan dari penelitian ini adalah mengevaluasi pengaruh suplementasi tanaman herbal terhadap fermentasi rumen, karakteristik rumen dan emisi gas metan secara in vitro.
2 METODE PENELITIAN
Waktu dan Lokasi
Penelitian ini dilaksanakan pada bulan November 2015 sampai dengan Maret 2016. Analisis proksimat, Van Soest dan in vitro dilaksanakan di Laboratorium Ilmu dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor dan Analisa proporsi molar VFA di Laboratorium Pusat Studi Pangan dan Gizi, Universitas Gajah Mada (UGM).
Bahan
Ransum komplit (70% bungkil inti sawit (BIS) dan kombinasi tanaman herbal (30%). Bahan kimia yang digunakan adalah cairan buffer rumen (NaHCO3 0.98 g, Na2HPO4, 7H2O 0.7 g, KCl 0.057 g, NaCl 0.0472 g, MgSO4, 7H2O 0.012 g).
Alat
Peralatan yang digunakan antara lain timbangan digital, waterbath, magnetic stirer, spoit, sentrifuse, termos berskala 2 liter, kain penyaring, syringe berskala 100 ml, labu Erlenmeyer, oven 60°C, tabung fermentor, tutup karet, pipet volumetik dan mikro 0.1 ml, bulp, discmill ukuran kecil, gelas ukur, spatula, tabung gas CO2, kertas saring Whatman no.41, pH meter, tabung eppendorf, pompa vakum,oven 105oC, tanur, pengaduk, eksikator, thermostat, freezer, cawan Conway.
Ternak dan Pakan
Sumber cairan rumen yang digunakan berasal sapi perah peranakan Frisian Holstein (FH) berfistula di kandang Balai Penelitian Ternak (Balitnak) Ciawi Bogor, pada pagi hari sebelum sapi diberi pakan.
3 Tabel 1. Hasil analisis proksimat bahan pakan
Nutrien
Sumber: Hasil analisa proksimat pada Laboratorium Pusat Antar Univeristas IPB dan Van soest di Laboratorium BALITNAK Ciawi (2016).
Keterangan: td*= tidak diujikan, BK= Bahan Kering, PK= Protein Kasar, LK= Lemak Kasar, SK= Serat Kasar, NDF= Neutral Detergent Fibre, ADF= Acid Detergen Fiber
Tabel 2. Komposisi ransum perlakuan
Tumbuhan pada umumnya memiliki kandungan senyawa aktif dalam bentuk metabolit sekunder seperti alkaloid, steroid, tanin, saponin, dan lain-lain. Harbone (1987) menyatakan untuk mendapatkan informasi kandungan senyawa metabolit sekunder suatu bahan dapatdiidentifikasi dengan analisis fitokimia. Hasil analisis fitokimia secara kualitatif pada daun kelor, kunyit dan biji kedawung. Disajikan pada tabel 3.
Tabel 3. Kandungan fitokimia kualitatif daun kelor, kunyit dan biji kedawung
Parameter Daun Kelor Kunyit Biji Kedawung
Flavanoid + + -
4
Metode Penelitian
Tahap I
Screening Tujuh Tanaman Herbal
Penelitian ini melakukan observasi terhadap tujuh tanaman herbal yaitu tepung kelor, tepung karamuntiang, tepung senggugu, tepung kunyit, tepung pulut-pulut, tepung gambir dan tepung biji kedawung. Hasil observasi tersebut akan dipilih tiga tanaman yang terbaik berdasarkan tanaman yang menghasilkan produksi gas yang tinggi serta populasi protozoa untuk dilakukan penelitian tahap II.
Inkubasi In Vitro
Cairan rumen disaring menggunakan kain penyaring dan dimasukkan ke dalam termos untuk kemudian dibawa ke laboratorium. Inkubasi substrat secara in vitro menggunakan metode yang telah dijelaskan oleh Theoudorou dan Brooks (1994). Substrat sebanyak 0.75 g dimasukkan ke botol vial injection berukuran 100 ml. Ke dalam botol tersebut ditambahkan 75 ml cairan buffer dan rumen yang telah dijenuhkan untuk digunakan sebagai media inkubasi.
Substrat beserta cairan buffer dan rumen yang sudah bercampur di dalam botol, dialiri gas CO2, kemudian ditutupi dengan penutup karet dan penutup aluminium menggunakan alat penekan. Selanjutnya dilakukan inkubasi ke dalam water bath pada suhu 39o C.
Kecepatan Produksi Gas dan Total Produksi Gas
Kecepatan produksi gas dan total produksi gas diukur pada jam ke 2, 4, 8,12, 24, 36, 48, 60 dan 72 setelah inkubasi. Pengukuran ini menggunakan syringe plastik dengan volume 60 ml. Gas total yang dihasilkan akan mendorong bagian dalam syringe ke atas. Setelah gas mendorong syringe secara sempurna, dilakukan pembacaan manual pada skala yang terdapat pada syringe. Nilai total volume gas (ml) akan diketahui.
Kecepatan produksi gas dan total produksi gas akan diestimasi
menggunakan persamaan Orskov’s (Orskov and McDonald 1979). Bentuk persamaannya sebagai berikut :
Gas = b (1-exp-c.t) Keterangan :
p : produksi gas kumulatif pada waktu t jam
b : produksi gas maksimum pada t = ∞ (ml)
c : kecepatan produksi gas (ml/jam) t : waktu inkubasi (h)
Pengukuran Populasi Protozoa
5 dilakukan dengan mikroskop pada pembesaran 10 kali. Populasi protozoa dapat dihitung dengan rumus :
Populasi protozoa ml-1 cairan rumen = 1000 x C x FP 0.1 x 0.0625 x 16 x 16 C = jumlah protozoa terhitung
FP = faktor pengencer
Rancangan dan Analisis Data
Rancangan percobaan yang digunakan pada penelitian ini adalah Rancangan Acak Kelompok (RAK) dengan menggunakan tujuh tanaman herbal. Masing-masing perlakuan dilakukan pengulangan sebanyak 3 kali. Model matematika dari rancangan ini adalah:
Yij = μ + Pi + Kj + єij i = 1, 2, 3,…,k dan j = 1, 2, 3,…,p
Keterangan :
Yij : Pengamatan jenis bakteri ke-i dan kelompok ke-j
μ : Rataan umum
Pi : Pengaruh jenis bakteri ke-i Kj : Pengaruh kelompok ke-j
Єij : Galat jenis bakteri ke-i dan kelompok ke-j
Data yang telah diperoleh dianalisa secara statistik menggunakan analisis sidik ragam (ANOVA) dan jika terdapat perbedaan nyata maka dilakukan uji Duncan. Analisis data dilakukan dengan menggunakan aplikasi SPSS versi 16.0.
Peubah yang Diamati
Peubah yang diamati dalam penelitian tahap I ini adalah: 1. Total produksi gas dan kecepatan produksi gas
2. Populasi protozoa
Tahap II Uji In Vitro
Berdasarkan hasil yang didapat dari pengujian tahap 1 akan didapatkan tiga tanaman tropis. Semua tanaman tropis diidentifikasi senyawa bioaktifnya (tanin dan saponin), kemudian dilihat hubungan antara senyawa metabolit sekunder semua tanaman tropis ini dengan semua parameter uji in vitro yang dilakukan pada tahap 1. Harbone (1987) menyatakan untuk mendapatkan informasi kandungan senyawa aktif dalam bentuk metabolit sekunder seperti alkaloid, steroid, tannin, saponin dan lain-lain dapat diidentifikasi dengan analisis fitokimia.
Peubah yang diamati dalam penelitian tahap II adalah:
1. Degradabilitas bahan kering (KCBK) dan bahan organik (KCBO) 2. Konsentrasi N-NH3 (Amonia)
3. pH cairan rumen
4. Konsentrasi VFA parsial (asam asetat, asam propionate, asam butirat) 5. Kecepatan produksi gas dan total produksi gas
6
7. Populasi total protozoa yang dihitung dengan metode Ogimoto dan Imai (1981)
Rancangan Percobaan
Rancangan penelitian yang digunakan adalah rancangan acak kelompok (RAK) dengan 8 perlakuan dan 3 kelompok berdasarkan waktu pengambilan cairan rumen untuk uji in vitro. Data yang diperoleh dianalisis menggunakan Excell untuk data analisis proksimat dan Van Soest. Analisis ragam ANOVA untuk analisis in vitro, jika menunjukkan perbedaan yang signifikan dilanjutkan dengan uji lanjut Duncan menggunakan SPSS 16.0. Model analisis ragam pada penelitian ini adalah :
= μ + + + Keterangan :
: pengamatan pada perlakuan ke-i dan kelompok ke-j
μ : rataan umum
: pengaruh perlakuan ke-i : pengaruh kelompok ke-j
: eror (galat) pada perlakuan ke-i kelompok ke-j Adapun perlakuan terdiri atas :
1. R1 = Kontrol/ tanpa suplementasi 2. R2 = R1+ tepung kelor (30%)
Analisis Proksimat dan Van Soest
Sampel tanaman terpilih selanjutnya dianalisis kandungan nutrient. Komposisi nutrien pakan dianalisa menggunakan analisis proksimat (AOAC, 2002) dan analisis serat Neutral Detergent Fiber (NDF) dan Acid Detergent Fiber (ADF) menggunakan analisis Van Soest (Van Soest et al. 1991).
Inkubasi In Vitro
Cairan rumen disaring menggunakan kain penyaring dan dimasukkan ke dalam termos untuk kemudian dibawa ke laboratorium. Inkubasi substrat secara in vitro menggunakan metode yang telah dijelaskan oleh Theoudorou dan Brooks (1994). Substrat sebanyak 0.75 g dimasukkan ke botol vial injection berukuran 100 ml. Ke dalam botol tersebut ditambahkan 75 ml cairan buffer dan rumen yang telah dijenuhkan untuk digunakan sebagai media inkubasi.
7
Pengukuran KCBK dan KCBO (Tilley dan Terry 1963).
Kecernaan bahan kering (KCBK) dan bahan organik (KCBO) mengacu pada metode Tilley dan Terry (1963).Tabung fermentor yang telah diisi dengan 0.5 g sampel, ditambahkan 40 mL larutan McDougall. Tabung dimasukkan ke dalam shaker bath dengan suhu 39 °C, kemudian diisi cairan rumen 10 mL, tabung dikocok dengan dialiri CO2 selama 30 detik, dicek pH (6.5–6.9), kemudian ditutup dengan karet berventilasi, dan difermentasi selama 48 jam. Setelah 48 jam, dibuka tutup karet tabung fermentor, diteteskan 2-3 tetes HgCl2 untuk membunuh mikroba. Tabung fermentor dimasukkan ke dalam sentrifugasi kemudian dilakukan sentrifugasi dengan kecepatan 4 ribu rpm selama 10 menit. Substrat akan terpisah menjadi endapan di bagian bawah dan supernatan yang bening berada di bagian atas. Supernatan dibuang dan endapan hasil sentrifugasi pada kecepatan 4 ribu rpm selama 15 menit ditambahkan 50 mL larutan pepsin-HCl 0.2%. Campuran ini lalu diinkubasi kembali selama 48 jam tanpa tutup karet. Sisa pencernaan disaring dengan kertas saring Whatman no. 41 (yang sudah diketahui bobotnya) dengan bantuan pompa vakum.Endapan yang ada di kertas saring dimasukkan ke dalam cawan porselen, setelah itu dimasukkan ke dalam oven 105°C selama 24 jam. Setelah 24 jam, cawan porselen dan kertas saring dan residu dikeluarkan, dimasukkan ke dalam eksikator dan ditimbang untuk mengetahui kadar bahan keringnya. Selanjutnya bahan dalam cawan dipijarkan atau diabukan dalam tanur listrik selama 6 jam pada suhu 450–600°C, kemudian ditimbang untuk mengetahui kadar bahan organiknya. Sebagai blanko dipakai residu asal fermentasi tanpa bahanpakan.
Pengukuran ammonia (NH3) menggunakan metode Mikrodifusi Conway (General Laboratory Procedures 1966). Supernatan sampel yang berasal dari 4 jam inkubasi disentrifuge pada kecepatan 3500 rpm selama 15 menit diambil dicampurkan dengan supernatan hingga merata dengan cara menggoyang-goyangkannya dan memiringkannya, sehingga akan terlepas gas amonia dan didiamkan selama 24 jam. Kemudian asam borat dititrasi dengan H2S04 0.005 M sampai terjadi perubahan warna dari biru ke merah. Kadar amonia dapat dihitung dengan rumus:
NH3 (mM) = ml H2SO4 x N H2SO4 x 1000
g sampel x BK sampel.
Pengukuran Konsentrasi VFA
8
asam pekat bertujuan untuk menstabilkan sampel yang akan diukur gasnya. Pengukuran produksi VFA total dan parsial (asam asetat, propionat, butirat menggunakan alat Gas Chromatography dengan spesifikasi GC 8A, Shimadzu Crop, Kyoto, Japan dengan kolom berisi 10% SP-1200, 1% H3PO4on 80/100 Cromosorb WAW. Secara berturut-turut sebanyak 1 μl larutan standar diinjeksikan pada GC setelah itu diinjekkan sampel hasil inkubasi dengan volume yang sama. Hasil analisa nilai VFA standar dan sampel dibaca dalam kromatogram. Konsentrasi VFA sampel dihitung menggunakan rumus: dilakukan kalibrasi dengan menggunakan cairan pH 7.
Kecepatan Produksi Gas dan Total Produksi Gas
Kecepatan produksi gas dan total produksi gas diukur pada jam ke 2, 4, 6, 8, 10, 12, 24, 48, 72 setelah inkubasi. Pengukuran ini menggunakan syringe plastik dengan volme 60 ml. Syringe pada bagiannya ujungnya ditusukkan melewati penutup karet ke dalam botol menuju ke bagian ruang dari botol tanpa mengenai permukaan cairan yang ada di dalam botol. Gas total yang dihasilkan akan mendorong bagian dalam syringe ke atas. Setelah gas mendorong syringe secara sempurna, dilakukan pencabutan syringe dari karet botol. Melalui pembacaan manual pada skala yang terdapat pada syringe, nilai total volume gas (ml) akan diketahui.
Kecepatan produksi gas dan total produksi gas akan diestimasi
menggunakan persamaan Orskov’s (Orskov dan McDonald 1979). Bentuk persamaannya sebagai berikut:
p = b (1-exp-c.t) Keterangan :
p : produksi gas kumulatif pada waktu t jam
b : produksi gas maksimum pada t = ∞ (ml)
c : kecepatan produksi gas (ml/jam) t : waktu inkubasi (h)
Emisi Gas Metan
Pengukuran emisi gas metan dilakukan pada jam inkubasi yang sama dengan pengukuran total produksi gas. Emisi gas metan diukur menggunakan metode penjeratan CO2 (CO2 traping) dengan bahan penjerat yang bersifat alkalis
9 dihubungkan dengan saluran masuk pada syringe berskala 10 ml yang dipasang pada buret dengan posisi ujung berada dibawah.
Setelah Syringe dihubungkan dengan saluran masuk pada larutan NaOH, bagian batang dari syringe didorong secara perlahan hingga total produksi gas akan melalui larutan NaOH. Pada saat total produksi gas melalui larutan NaOH, komponen gas berupa CO2 yang terdapat dalam total produksi gas tersebut akan dijerat oleh larutan NaOH, sedangkan komponen gas berupa metan (CH4) akan lolos melalui saluran keluar dari erlenmeyer dan masuk kedalam saluran masuk pada syringe berskala 10 ml. Volume gas (ml) metan dapat diketahui melalui pembacaan manual pada skala tersebut.
Populasi Protozoa
Sebanyak 1 ml sampel hasil inkubasi ditambah 1 ml larutan triphan blue formaline saline (TBFS). Larutan TBFS dibuat dari campuran formalin 4% ditambah dengan larutan NaCl fisiologis 0.9% dalam 100 ml larutan. Sebanyak ± 2 tetes campuran tersebut lalu ditempatkan pada counting chamber dengan ketebalan 0.1 mm, luas kotak terkecil 0.0625 mm2 yang terdapat 16 kotak dan jumlah kotak yang dibaca sebanyak 16 kotak. Perhitungan populasi protozoa dilakukan dengan mikroskop pada pembesaran 10 kali. Populasi protozoa dapat dihitung dengan rumus :
Populasi protozoa ml-1 cairan rumen = 1000 x C x FP 0.1 x 0.0625 x 16 x 16 C = jumlah protozoa terhitung
FP = faktor pengencer
3
HASIL DAN PEMBAHASAN
Tahap I
Screening Tujuh Tanaman Herbal
Kecepatan Produksi Gas dan Total Produksi Gas
Hasil produksi gas total antar setiap tanaman menunjukkan adanya perbedaan (P<0.05). Produksi gas total paling tinggi terdapat pada tanaman kedawung. Produksi gas total tertinggi kedua setelah kedawung adalah tanaman kelor dan kunyit. Produksi gas tertinggi ketiga adalah tanaman pulut-pulut dan senggugu. Produksi gas total yang terendah ditunjukkan oleh tanaman gambir dan karamuntiang.
Populasi Protozoa
10
Tahap II Uji In Vitro
Penelitian dilakukan pada tahap II ini adalah tanaman yang terpilih dari hasil screening tahap I yaitu tepung kelor, tepung kunyit dan tepung kedawung.
Koefesien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO)
Perlakuan pemberian tanaman herbal dalam ransum signifikan mempengaruhi KCBK. Pemberian tanaman herbal nyata meningkatkan KCBK dibandingkan kontrol (P<0.05). Hal ini menunjukan bahwa kandungan nutrisi dari tanaman herbal yang digunakan mengandung sumber protein terdegradasi yang tinggi (protein yang dibutuhkan oleh mikroba rumen) sehingga nutrisi tersebut diduga menstimulasi pertumbuhan dan aktifitas mikroba rumen lebih baik untuk mencerna pakan jika dibandingkan dengan perlakuan tanpa penambahan tanaman herbal. Busquet et al. (2005) melaporkan bahwa suplementasi tanaman herbal berupa bawang dalam ransum mampu meningkatkan nilai KCBK dan KCBO dibandingkan pakan kontrol.
11 KCBK perlakuan pemberian tanaman herbal sampai 30% dalam ransum pada penelitian ini berkisar 56.72-65.77%. Nilai KCBK sesuai dengan penelitian Muchlas (2014) menggunakan tepung gaplek (20%) + tepung silase kulit ketela pohon (30%) + tepung daun kelor (50%) berkisar 56.96+1.24%. Hal ini menunjukkan bahwa penambahan tanaman herbal mampu meningkatkan kecernaan bahan dengan serat kasar rendah.
Peningkatan KCBK berbanding lurus dengan KCBO. Perlakuan pemberian tanaman herbal dalam ransum nyata meningkatkan KCBO dibandingkan kontrol (P<0.05). Namun demikian nilai KCBO antar perlakuan tanaman herbal tidak berbeda nyata (Tabel 4). Hal ini diduga ransum yang diberikan tanaman herbal memiliki kualitas yang sama. Selain itu menunjukkan bahwa tanaman herbal tidak mengganggu aktivitas mikroba dalam proses fermentasi. Sehingga tidak mengganggu kecernaan bahan organik.
KCBO perlakuan pemberian tanaman herbal dalam ransum pada penelitian ini berkisar 52.10-59.54%. Sesuai dengan penelitian Muchlas (2014) yaitu 55.34+3.09%. Hal ini membuktikan bahwa tanaman herbal tidak mengganggu mikroba rumen dalam mencerna bahan organik ransum. Selain itu juga tanaman herbal tidak merubah komposisi nutrien ransum yang dapat menyebabkan menurunnya kecernaan nutrien ransum.
Konsentrasi NH3 (Amonia)
Hasil penelitian menunjukkan bahwa adanya pengaruh pemberian tanaman herbal pada konsentrasi NH3. Pemberian tanaman herbal dalam ransum meningkatkan produksi NH3 terhadap ransum kontrol (P<0.05). Hal ini menunjukkan bahwa tanaman herbal mampu meningkatkan aktivitas mikroba dalam degradasi protein di rumen.Hasil ini didukung oleh Kurniawati (2007) yang menjelaskan bahwa kelor mengandung protein mudah terdegradasi yang mampu meningkatkan pertumbuhan mikroba rumen. Meningkatnya protein yang terdegradasi akan meningkatkan produksi NH3 dalam rumen.
Rataan NH3 perlakuan tanaman herbal pada penilitian ini berkisar 11-17 mM. Kisaran NH3 penelitian sesuai dengan kisaran optimum NH3 dalam rumen antara 85-300 mg/l atau 6-21 mM (McDonald 2002). Hal ini menunjukkan bahwa ransum pemberian tanaman herbal tidak mengganggu aktivitas mikroba rumen.
Konsentrasi NH3 rumen merupakan pencerminan dari aktivitas degradasi protein pakan dan endogenous protein oleh mikroba rumen melalui mekanisme keseimbangan N dari tubuh ternak.Jika pakan defisien protein atau tinggi kandungan protein yang lolos degradasi, maka konsentrasi NH3 rumen akan rendah (lebih rendah dari 50 mg/1 atau 3.57mM) dan pertumbuhan organisme rumen akan lambat. Sebaliknya, jika degradasi protein lebih cepat dari pada sintesis protein mikroba maka NH3 akan terakumulasi dan melebihi konsentrasi optimumnya.
Derajat Keasaman (pH) Cairan Rumen
12
Van Soest (1994) menyatakan aktivitas bakteri selulolitik terhambat apabila pH cairan rumen dibawah 6.2 dan aktivitas akan optimal di dalam rumen pada pH 6.7 + 0.5. Nilai pH pada inkubasi kedelapan pakan perlakuan berkisar antara 6.63-6.82. Nilai tersebut secara statistik tidak berbeda nyata. Hal ini menunjukkan bahwa kedelapan perlakuan pakan dapat memberikan keseimbangan pH di dalam cairan rumen untuk mendukung ekosistem mikroorganisme di dalamnya. Nilai pH yang tidak berbeda nyata diduga karena lamanya waktu inkubasi (pH diukur pada jam ke 24 setelah inkubasi) sehingga mengakibatkan semakin sedikit tersedianya bahan pakan yang akan difermentasi oleh mikroba.
Tabel 4. Rataan persentase KCBK, KCBO, Konsentrasi NH3 dan pH pada berbagai perlakuan ransum
Perlakuan Variabel
KCBK (%) KCBO (%) NH3 (mM) pH R1 42.84a±3.53 34.77a±4.04 11.71a±0.76 6.80±0.06 R2 63.82c ± 3.25 57.74b±8.34 13.20b±1.46 6.82±0.08 R3 59.34bc±6.61 58.48b±8.61 13.30b±1.49 6.77±0.05 R4 62.17bc±9.79 53.84b±13.04 13.23b±1.63 6.75±0.12 R5 65.77c±5.94 52.10b±5.30 17.07c±2.19 6.63±0.12 R6 65.16c±4.46 59.54b±2.70 17.02c±2.47 6.70±0.13 R7 60.56b±3.48 56.68b±5.80 17.14c±2.11 6.73±0.14 R8 56.72b±3.66 53.15b±7.77 17.91c±1.57 6.68±0.04 Superscrip berbeda pada kolom yang sama menunjukkan perbedaaan nyata (P<0.05).
Keterangan : R1 (100% bungkil inti sawit), R2 (70% bungkil inti sawit + 30 % tepung daun kelor), R3 (70% bungkil inti sawit + 30 % tepung kunyit), R4 (70% bungkil inti sawit + 30 % tepung biji kedwaung), R5 (70% bungkil inti sawit + 15% tepung kelor + tepung kunyit), R6 (70% bungkil inti sawit + 15% tepung kelor + 15% tepung kedawung), R7 (70% bungkil inti sawit + 15% tepung kunyit + 15% tepung kedawung), R8 (70% bungkil inti sawit+ 10% tepung kelor + 10% tepung kunyit + 10% tepung kedawung
Kisaran pH antara 6.63-6.82 yang didapat dalam penelitian ini, masih berada pada kisaran pH normal rumen sebesar 5.5-7.2 sesuai Owens dan Goestsch (1988) mengimplikasikan berlangsungnya aktivitas bakteri selulotik yang optimal (6.7 ± 0.5) sesuai Van Soest (1994). Sehingga dapat disimpulkan bahwa penggunanan tanaman herbal pada ransum tidak berpengaruh terhadap kondisi pH cairan rumen yang normal, sehingga aktivitas fermentasi mekroorganisme rumen tidak terganggu.
Konsetrasi VFA Parsial dan Konsentrasi VFA Total
Konsentrasi VFA yang diamati dalam penelitian ini meliputi asam asetat, asam propionat dan asam butirat.Asam VFA ini merupakan salah satu produk akhir dari fermentasi karbohidrat dan protein dan merupakan sumber energi bagi ternak ruminansia. Hasil Konsentrasi asam asetat, asam propionat, asam butirat dan VFA total dari masing-masing perlakuan dan kontrol dapat dilihat pada Tabel 5.
13 al. (2003) menyatakan bahwa kisaran komposisi VFA dalam rumen adalah asetat 60 mM, propionat 20 mM dan butirat 10 mM.Nilai rata-rata VFA total dalam penelitian ini adalah 34.99–44.71 mM. McDonald (2002) mengatakan bahwa konsentrasi VFA total yaitu 70-150 mM. Nilai rata-rata VFA total dalam penelitian ini masih berada dibawah nilai normal konsentrasi VFA total. Hal ini diduga karena lamanya waktu inkubasi yang melebihi waktu optimum kenaikan VFA. Lamanya waktu inkubasi akan mengakibatkan semakin sedikit tersedianya bahan pakan yang akan difermentasi oleh mikroba, sehingga berdampak terhadap laju produksi VFA yang semakin berkurang sebagai indikasi menurunnya ketersediaan energi bagi ternak ruminansia (Jayanegara et al. 2006).
Tabel 5. Rataan konsentrasi VFA total dan konsentrasi parsial ( asam asetat, asam propionat dan asam butirat)
R1 64.27ab±6.71 21.45±2.24 14.28±1.20 35.80±10.06 R2 64.87a±8.49 20.98±2.63 14.15±2.00 38.68±12.94 R3 61.51a±8.61 22.98±2.94 15.51±2.06 34.94±13.41 R4 61.88ab±10.72 22.65±3.07 15.47±2.69 38.40±16.23 R5 62.29ab±3.67 21.93±1.47 15.77±1.28 41.99±6.15 R6 62.85ab±5.39 22.02±1.32 15.13±1.63 41.60±8.21 R7 63.99ab±1.81 21.98±0.71 14.02±1.10 44.71±1.97 R8 64.25ab±2.02 21.04±0.77 14.71±0.91 40.00±3.33 Superscrip berbeda pada kolom yang sama menunjukkan perbedaaan nyata (P<0.05).
Keterangan : R1 (100% bungkil inti sawit), R2 (70% bungkil inti sawit + 30 % tepung daun kelor), R3 (70% bungkil inti sawit + 30 % tepung kunyit), R4 (70% bungkil inti sawit + 30 % tepung biji kedawung), R5 (70% bungkil inti sawit + 15% tepung kelor + tepung kunyit), R6 (70% bungkil inti sawit + 15% tepung kelor + 15% tepung kedawung), R7 (70% bungkil inti sawit + 15% tepung kunyit + 15% tepung kedawung), R8 (70% bungkil inti sawit + 10% tepung kelor + 10% tepung kunyit + 10% tepung kedawung
Rataan Produksi Gas dan Laju Produksi Gas per Jam
Hasil penelitian menunjukan bahwaada pengaruh nyata (P<0.05) pemberian tanaman herbal terhadap produksi gas total (Tabel 6). Perlakuan pemberian tanaman herbal yaitu tanaman kelor, kunyit, kedawung, maupun kombinasinya meningkatkan produksi gas total dibandingkan dengan perlakuan kontrol (P<0.05). Hal ini menunjukkan bahwa pemberian tanaman herbal dapat meningkatkan aktivitas mikroba dalam rumen. Meningkatkanya aktivitas mikroba dalam rumenakan meningkatkan proses fermentasi nutrient pakan. Proses fermentasi yang meningkat akan menghasilkan produksi gas yang tinggi sebagai hasil proses fermentasi tersebut.
14
penambahan kombinasi tanaman herbal. HU et al. (2005) melaporkan terjadinya peningkatan produksi gas sebagai akibat adanya zat aktif saponin pada tanaman herbal sehingga bakteri rumen bekerja dengan baik untuk mendegradasi bahan organik di dalam rumen.
Laju produksi gas per jam antar pelakuan tidak berbeda nyata (P>0.05). Perlakuan pemberian tanaman herbal sebanding dengan perlakuan kontrol (Tabel 6). Hal ini menunjukkan bahwalaju produksi gas in vitro semakin berkurang seiring dengan meningkatnya waktu inkubasi, disebabkan substrat yang dapat difermentasi juga semakin berkurang jumlahnya (Hungate 1966; Jayanegara dan Sofyan 2008).
Tabel 6. Nilai rata-rata potensi produksi gas dan laju produksi gas per jam
Superscrip berbeda pada kolom yang sama menunjukkan perbedaaan nyata (P<0.05).
Keterangan : R1 (100% bungkil inti sawit), R2 (70% bungkil inti sawit+ 30 % tepung daun kelor), R3 (70% bungkil inti sawit + 30 % tepung kunyit), R4 (70% bungkil inti sawit + 30 % tepung biji kedawung), R5 (70% bungkil inti sawit + 15% tepung kelor + tepung kunyit), R6 (70% bungkil inti sawit + 15% tepung kelor + 15% tepung kedawung), R7 (70% bungkil inti sawit + 15% tepung kunyit + 15% tepung kedawung), R8 (70% bungkil inti sawit + 10% tepung kelor + 10% tepung kunyit + 10% tepung kedawung
Emisi Gas Metan
15
Populasi Protozoa
Hasil penelitian menunjukan pada perlakuan pakan kontrol (R1) dengan penambahan salah satu tepung tanaman herbal ataupun penambahan secara kombinasi (R2, R3, R4, R6 , R7 dan R8 ) tidak berpengaruh nyata terhadap penurunan populasi protozoa. Berdasarkan data produksi CH4 dan populasi protozoa terlihat bahwa populasi protozoa dalam rumen tidak merupakan faktor dominan pada proses metanogenesis. Hasil penelitian ini didukung dengan hasil penelitian Patra et al. (2006). Sebagian kecil dari metanogen yang menempel pada permukaan sel protozoa, sehingga peranan protozoa dalam metanogenesis menjadi tidak dominan (Hess et al. 2003).
Tabel 7. Rata-rata produksi gas metan dan populasi protozoa pada berbagai perlakuan
Perlakuan ml metan/g BOT Protozoa (LogCFU/ml)
R1 140b± 40.88 4.421 ± 0.123
Superscrip berbeda pada kolom yang sama menunjukkan perbedaaan nyata (P<0.05).
Keterangan : R1 (100% bungkil inti sawit), R2 (70% bungkil inti sawit+ 30 % tepung daun kelor), R3 (70% bungkil inti sawit + 30 % tepung kunyit), R4 (70% bungkil inti sawit + 30 % tepung biji kedawung), R5 (70% bungkil inti sawit + 15% tepung kelor + tepung kunyit), R6 (70% bungkil inti sawit + 15% tepung kelor + 15% tepung kedawung), R7 (70% bungkil inti sawit + 15% tepung kunyit + 15% tepung kedawung), R8 (70% bungkil inti sawit + 10% tepung kelor + 10% tepung kunyit + 10% tepung kedawung.
4
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil evaluasi penggunanan kombinasi tepung daun kelor dan tepung kunyit efektif meningkatkan persentase KCBK dan persentase KCBO yang lebih mudah terdegradasi, meningkatkan laju produksi gas total dan menurunkan emisi gas metan dan populasi protozoa pada fermentasi rumen dibanding dengan perlakuan kontrol.
Saran
16
17
DAFTAR PUSTAKA
Bhatta R, Uyeno Y, Tajima K, Takenaka A,Yabumoto Y, Nonaka I, Enishi O, Kurihara M. 2009. Difference in the nature of tannins on in vitro ruminal methane and volatile fatty acid production and on methanogenic archaea and protozoa populations. J Dairy Sci. 92: 5512-5522.
AnnisonE. F. and Bryden, W. L.. 1998. Prespectives on Ruminant Nutrition and Metabolism. J Nutrition Research Review. 11, 173-198.
Busquet, M., S. Calsamiglia, A. Ferret, W. Cardozo, C. Kamel. 2005. Effect of Cinnamaldehyde and garlic oil on Rumen Microbial fermentation in a Dual Flow Continous Culture. J Dairy Sci. 88:2508-2516.
Clark, H. 2009.Reducing CH4 Emissions from Grazing Ruminants in New Zealand. Asian-Aust. J Anim Sci. Vol. 24, No. 2 : 295 – 302.
Finlay DJ, Esteban G, Clarke KJ, Williams AG, Embley TM, Hirt RP. 1994. Some rumen ciliates have endosymbiotic methanogenesis. FEMS Microbiol Letters. 117: 157-162.
General Laboratory Procedures [GLP].1966.J Dairy Sci. Madison (USA): University of Wisconsin.
Goetsch, A.L. 1998. Splanchnic tissue energy use in ruminants that consume forage ad libitum. J Anim Sci.76:2737–2746.
Harbone JB. 1987. Metode Fitokimia Edisi ke-2. Bandung (ID) : ITB Pr.
Hess HD, Kreuzer M, Diaz TE, Lascano CE, Carulla JE, Soliva CR, Machmuller A. 2003. Saponin rich tropical fruits affect fermentation and methanogenesis in faunated and defaunated rumen fluid. J Anim Feed Sci. 109: 79-94.
Hu, W.L., W. Yue-Ming, L. Jian-Xin, G. Yan-Qiu and Y. Jun-An. 2005. Tea saponins affect in vitro fermentation and metanogenesis in faunated and defaunated rumen fluid. Zhejiang Univ Sci. 6B: 787-792.
Hungate, R.E. 1966. The Rumen and Its Microbes.Academic Press, New York. Jayanegara A, Tjakradidjaja AS, Sutardi T. 2006. Fermentabilitas dan kecernaan
in vitro ransumlimbah agroindustri yang disuplementasikromium anorganik dan organik. J Med Pet. 29(2):54-62.
Jayanegara, A., A. Sofyan.2008c. Penentuanaktifitas biologis tannin beberapa hijauansecara in vitro menggunakan ‘HohenheimGas Test’ dengan polietilen glikol sebagaideterminan. J Med Pet. 31: 44-52.
Johnson, K.A and D.E. Johnson. 1995. Methane emissions from cattle.J Anim Sci. 73:2483- 2492. Volume produksi gas dan kecernaan bahan pakan. J for the Applications of Isotopes and Radiation. Vol. 3(1).
18
Makkar HPS, Francis G, Becker K. 2007. Bioactivity of phytochemicals in some lesser known plants and their effects and potential applications in livestock and aquaculture production systems. J AnimSci. 1: 1371-1391.
McAllister TA, Newbold CJ. 2008. Redirecting rumen fermentation to reduce methanogenesis. J of Exprm Agric. 48: 7-13.
McDonald, P., R.A. Edwards and J.F.D. Greenhalgh. 2002. Animal Nutrition.6th Edition. Longman Scientific and Technical, New York.
Moss, A. R. 1993.Methane Global Warming and Production by Animals. Chalcombe Publications, Canterbury.p.105.
Muchlas M, Kusmarton, Marjuki. 2014. Pengaruh penambahan daun pohon terhadap kadar VFA dan kecernaan secara invitro ransum berbasis ketela pohon. J Ilmu-Ilmu Peternakan. 24 (2):8 – 19.
Ogimoto. K and S. Imai. 1981. Atlas of Rumen Microbiology. Japan Science societes Press, Tokyo.
Oluduro, A.O. Evaluation of antimicrobial properties and nutritional potentials of Moringa oleifera Lam. leaf in South Western Nigeria. J Microbiol of Malaysian. 8(2), 2012, 59-67.
Ørskov, E. R., I. McDonald. 1979. The estimation protein degradability in the rumen from incubation measurements weighted according to rate of passage. J Agric Sci. 92:499-503.
Patra, A. K, D.N. Kamra, N. Agarwal.2006.Effect of plant extracts on in vitro methanogenesis, enzyme activities and fermentation of feed in rumen liquor of buffalo. J Anim Sci. 128:276-291.
Putra, S., A. W. Puger. 1995. Manipulasi Mikroba dalam Fermentasi Rumen Salah Satu Alternatif untuk Meningkatkan Efisiensi Penggunaan Zat-zat Makanan. Denpasar. Fapet.Unud.
Putra, S. 2006. Pengaruh Suplementasi Agensia Defaunasi Segar dan Waktu Inkubasi Terhadap Degradasi Bahan Kering, Bahan Organik, dan Produks Fermentasi Secara In vitro. Jurusan Nutrisi dan Makanan Ternak, Fak.Peternakan, Universitas Udayana. J Protein. Vol 13 No 2.
Soliva, C. R., A. B. Zeleke, C. Clement, H. D. Hess, V. Fievez, M. Kreuzer. 2008. Invitro screening of various tropical foliages,seeds, fruits and medicinal plants for low methane and high ammonia generating potentials in the rumen. J Anim Sci. 147: 53-71.
Tavendale MH, Meagher LP, Pacheco D, Walker N, Attwood GT, Sivakumaran S. 2005. Methane production from in vitro rumen incubations with Lotus pedunculatus and Medicago sativaand effects of extractable condensed tannin fractions on methanogenesis. J Anim Sci. 123: 403-419.
Thalib, A. 2008. Buah Lerak Mengurangi Emisi Gas Metan Pada Hewan Ruminansia.Warta Penelitian dan Pengembangan Pertanian Vol 30 N0 2. Thalib, A., Y. Widiawati, W. Puastuti, Firsoni. 2011. Use a chamber method
toverify the effectiveness of a complete rumenmodifier reducing the enteric methane onruminants. Submitted. Proc. of 6th Int. Symp.on Non-CO2 Greenhouse Gas.
19 Thorpe A. 2009. Enteric fermentation and ruminant eructation: the role of
methane in the climate change debate. Climate Change.93: 407-431.
Tilley, J.M.A., R.A. Terry. 1963. A two stage technique for the in vitro digestion of forage crops. J Brit Grassl Soc. 18:104-111.
20
21 Lampiran 1 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap kecernaan bahan kering (KCBK)
Lampiran 2 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap kecernaan bahan organik (KCBO)
Lampiran 3 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap konsentrasi Amonia (NH3)
Lampiran 4 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap pH Sumber
22
Lampiran 6 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap propionat
Lampiran 7 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap butirat Sumber
Lampiran 9 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap produksi total gas
23 Lampiran 11 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap gas
metan Sumber keragaman (SK)
Jumlah kuadrat (JK)
Derajat bebas (db)
Kuadrat tengah
(KT)
Fhitung F0.05
Perlakuan 6134.88 7 876.41 2.46 0.35
Kelompok 13723.49 2 6861.75 19.28 0
Galat 13521.04 38 355.82
Total 656104.09 48
Lampiran 12 Uji ANOVA pengaruh penggunaan tanaman herbal terhadap protozoa
Sumber keragaman (SK)
Jumlah kuadrat (JK)
Derajat bebas (db)
Kuadrat tengah
(KT)
Fhitun
g F0.05
Perlakuan 0.46 7 0.07 15.94 0
Kelompok 0.10 2 0.05 12.28 0.001
Galat 0.58 14 0.004
24
RIWAYAT HIDUP
Penulis dilahirkan di Teluk Dalam pada tanggal 18 Juni 1989. Penulis merupakan anak kedua dari empat bersaudara dari pasangan Bapak Bezatulo Laia dan Ibu Fonitimae
Bu’ulolo. Penulis menyelesaikan program sarjana pada program studi Produksi Ternak Fakultas Peternakan Universitas HKBP Nommensen Medan tahun 2013. Penulis diterima sebagai mahasiwa Sekolah Pascasarjana Institut Pertanian Bogor yang disponsori oleh program Beasiswa DIPA DIKTI tahun 2014.
Selama mengikuti kuliah di Sekolah Pascasarjana IPB penulis aktif dalam organisasi kegiatan mahasiswa. Penulis dan tim berhasil meraih juara 1 lomba Badminton pada kegiatan Pasca Cup 2015 yang diselenggarakan oleh Forum Mahasiswa Pascasarjana (FORUM WACANA) IPB dan juara 1 lomba Badminton pada tahun 2016 yang diselenggarakan oleh Badan Ekseskutif Mahasiswa (BEM) Fakultas Peternakan IPB.