PENAPISAN DAN PEMANFAATAN KAPANG ENDOFIT
DALAM PEMBUATAN BIOETANOL DARI LIMBAH
PENGOLAHAN AGAR-AGAR
AULIA ANDHIKAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul “Penapisan dan Pemanfaatan Kapang Endofit dalam Pembuatan Bioetanol dari Limbah Pengolahan Agar-Agar” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Aulia Andhikawati
RINGKASAN
AULIA ANDHIKAWATI
.
Penapisan dan Pemanfaatan Kapang Endofit dalam Pembuatan Bioetanol dari Limbah Pengolahan Agar-agar. Dibimbing oleh BUSTAMI IBRAHIM dan KUSTIARIYAH TARMAN.Sumber bahan bakar minyak di Indonesia yang semakin berkurang tetapi kebutuhannya semakin meningkat, mendorong berbagai kalangan untuk mencari sumber-sumber energi baru untuk menggantikan minyak bumi, seperti bahan bakar dari sumberdaya hayati. Salah satu contoh bahan bakar dari sumberdaya hayati adalah bioetanol. Bahan bakar bioetanol dapat berasal dari limbah pengolahan rumput laut. Limbah yang masih memiliki kandungan lignin, selulosa dan hemiselulosa sangat potensial untuk dimanfaatkan menjadi bioetanol. Selulosa yang terkandung pada limbah sebesar 15-25%. Salah satu cara untuk mengkonversikan komponen pati dan selulosa menjadi etanol yaitu dengan hidrolisis enzim yang diikuti dengan fermentasi. Degradasi selulosa dapat dilakukan dengan menggunakan aktivitas mikroba potensial contohnya kapang untuk menghasilkan gula dan selanjutnya khamir Saccharomyces cerevisiae untuk produksi etanol.
Penelitian ini bertujuan untuk: (1) menentukan kapang laut endofit selulolitik yang berpotensi; (2) menentukan umur kapang, konsentrasi kapang dan waktu hidrolisis terbaik; dan (3) menentukan waktu fermentasi terpilih untuk menghasilkan etanol.
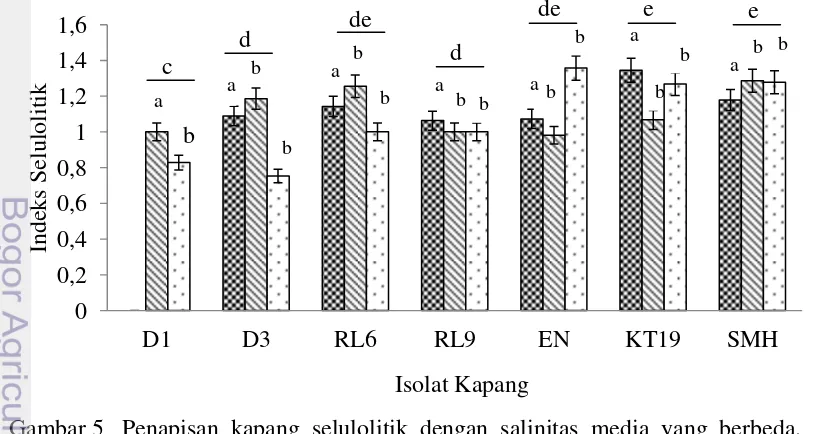
Penelitian ini menunjukkan hasil isolasi kapang endofit pada rumput laut dan daun mangrove diperoleh masing-masing dua isolat kapang yaitu isolat RL6, RL9, D1 dan D2. Keempat jenis isolat kapang yang telah diisolasi dan isolat kapang koleksi (Isolat EN, KT19 dan SMH) dapat tumbuh pada berbagai media dengan salinitas NaCl 3%, air laut dan air tawar. Media dengan penambahan air laut dan air tawar, semua isolat kapang dapat menghasilkan zona bening, sedangkan pada media dengan penambahan NaCl 3% hanya isolat D1 yang tidak menghasilkan zona bening. Isolat EN memiliki nisbah zona bening terbesar yaitu 1,36.
Proses hidrolisis limbah pengolahan agar-agar selama tiga hari dengan perlakuan konsentrasi kapang 20% menghasilkan nilai gula pereduksi sebesar 0,04% (b/b). Umur kapang yang digunakan pada proses hidrolisis yaitu 9 hari. Fermentasi terpilih untuk uji crude etanol yaitu fermentasi selama 3 hari. Jumlah kepadatan ragi komersial dan nilai glukosa selama fermentasi 3 hari yaitu sebesar 5,02x109 CFU dan 0,04% (b/b). Nilai pH yang terukur yaitu 3,9. Konsentrasi
crude etanol pada proses fermentasi dianalisis dengan menggunakan HPLC.
Crude etanol yang didapat pada fermentasi hari ketiga yaitu sebesar 3892 ppm.
SUMMARY
AULIA ANDHIKAWATI
.
Screening andUtilization of Endophytic Marine Fungi for Bioethanol Production from Agar Extraction Waste. Supervised by BUSTAMI IBRAHIM and KUSTIARIYAH TARMAN.The increase in fossil fuel prices, issues of national security and environmental concerns have led to an overwhelming interest among researchers to develop economically viable process for production of alternative transportation fuels. Alternative fuel is renewable source of energy. Biological resources based energy are expected to reduce the problem caused on fossil fuels, such as fuel shortage and environmental pollution since renewable source is more environmental friendly. Bioethanol, a renewable source of energy, can be derived from materials that contain sugar, starch or cellulose. Bioethanol can also derived from processing industrial waste. Industrial waste that still containing lignin, cellulose and hemicelluloses can be utilized as bioethanol. One of the components in seaweed (cellulose) is a component that can be converted into bioethanol. Cellulose contained in the seaweed waste reaches 15-25%. One of methods of converting cellulose to ethanol is enzyme hydrolysis followed by fermentation. Cellulose degradation and fermentation process can be running due to potential microbial activity, such as fungi and yeast.
This study has three main objectives that include the following: (1) to determine the potential of cellulolytic marine fungi; (2) to determine the influence of harvest time of fungi, concentration of fungi and hydrolysis time; and (3) to determine the fermentation time for bioethanol production.
Endophytic fungi were obtained four isolates of fungi from seaweed and mangrove leaves including RL6, RL9, D1 and D2. These four isolates of fungi and isolates from collection (EN, KT19 and SMH isolates) can grow in different salinity of medium, such as NaCl 3%, marine water and fresh water. All isolates of fungi can produce a clear zone in medium with salinity of marine water and fresh water, while D1 isolates can not produce a clear zone in salinity of medium 3% NaCl. EN isolate showed the largest ratio of clear zone (1.35).
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENAPISAN DAN PEMANFAATAN KAPANG ENDOFIT
DALAM PEMBUATAN BIOETANOL DARI LIMBAH
PENGOLAHAN AGAR-AGAR
AULIA ANDHIKAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Penapisan dan Pemanfaatan Kapang Endofit dalam Pembuatan Bioetanol dari Limbah Pengolahan Agar-agar
Nama : Aulia Andhikawati NIM : C351110091
Program Studi : Teknologi Hasil Perairan
Disetujui Komisi Pembimbing
Dr Ir Bustami Ibrahim, MSc Dr Kustiariyah Tarman, SPi, MSi Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala rahmat dan karunia-Nya penulis dapat menyelesaikan tesis dengan judul Penapisan dan Pemanfaatan Kapang Endofit dalam Pembuatan Bioetanol dari Limbah Pengolahan Agar-agar. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam menyelesaikan tesis ini, terutama kepada: 1 Dr Ir Bustami Ibrahim, MSc dan Dr Kustiariyah Tarman, SPi, MSi. sebagai
dosen pembimbing tesis yang telah senantiasa memberikan arahan dan bimbingan selama menyelesaikan tesis ini.
2 Bapak yang saya banggakan Dr. M. Sukardjo, MPd, ibu yang saya cintai Dedeh Rosidah, SPd, adik-adik yang saya sayangi Ari Ameliani Utami, SSt dan M. Waliyya Amananto.
3 Keluarga besar mahasiswa sekolah pascasarjana Teknologi Hasil Perairan, yang telah memberikan dorongan semangat baik selama penelitian maupun saat penyusunan tesis ini.
4 Teman-teman dan semua pihak yang tidak bisa disebutkan satu persatu.
5 Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan Republik Indonesia yang telah membiayai penelitian ini melalui Program Penelitian Unggulan Perguruan Tinggi atas nama Ketua Peneliti Dr Kustiariyah Tarman, SPi, MSi dengan judul Pengembangan Teknologi Produksi Bioetanol melalui Pemanfaatan Limbah Industri Rumput Laut dengan Kapang Endofit Indigenous Laut Indonesia (No. 58/IT3.41.2/L1/SPK/2013).
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan tesis ini. Penulis sangat mengharapkan kritik dan saran yang membangun. Semoga tulisan ini bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, September 2014
DAFTAR ISI
Tahap Isolasi dan Penapisan Kapang 5
Tahap Hidrolisis 6
Tahap Fermentasi 8
Prosedur Pengujian 8
Uji Kadar Selulosa (SNI 0444; 2009) 8 Uji Kadar Lignin (SNI 0492:2008) 9 Penentuan Nilai Glukosa Metode DNS (Miller 1959) 9
Penentuan Kadar Etanol 10
Analisis Data 10
3 HASIL DAN PEMBAHASAN 11
Tahap Isolasi dan Penapisan Kapang 11
Isolat Kapang Endofit 11
Penapisan Kapang Selulolitik 13 Pertumbuhan Isolat Kapang EN 15
Tahap Hidrolisis 17
Konsentrasi Kapang dan Waktu Hidrolisis 18
Umur Kapang 20
Tahap Fermentasi 21
Waktu Fermentasi 21
Konsentrasi Crude etanol 24
DAFTAR TABEL
Halaman
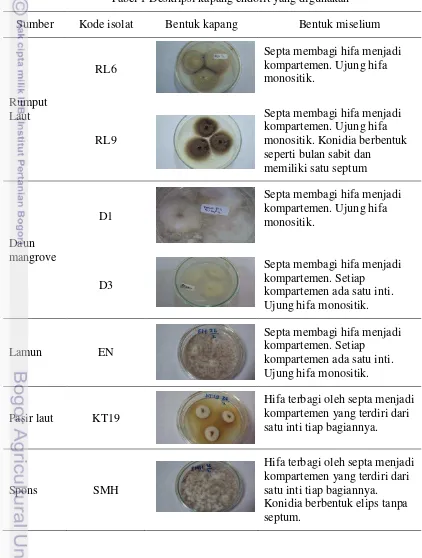
1 Deskripsi kapang endofit yang digunakan 12 2 Hasil karakterisasi limbah padat agar-agar kertas (%) 17 3 Komposisi selulosa setelah proses hidrolisis 21
DAFTAR GAMBAR
Halaman
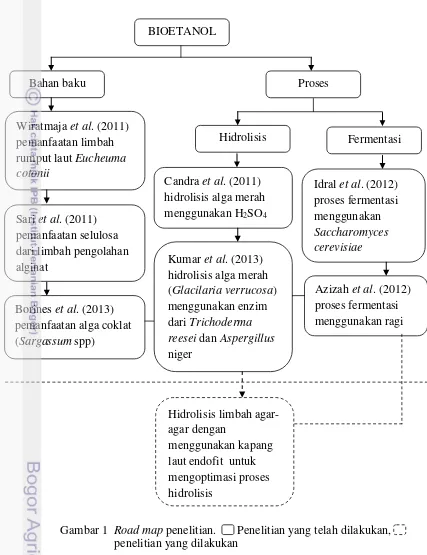
1 Road map penelitian 4
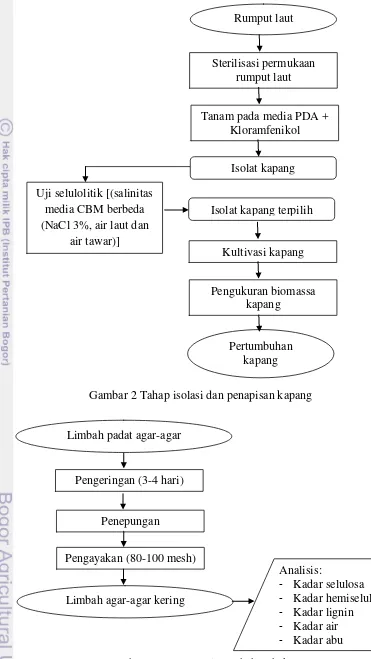
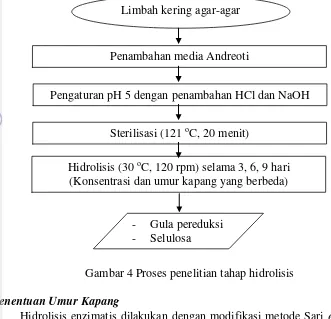
2 Tahap isolasi dan penapisan kapang 7 3 Proses persiapan bahan baku 7 4 Proses penelitian tahap hidrolisis 8 5 Penapisan kapang selulolitik dengan salinitas media yang berbeda 13 6 Isolat EN (a) pada media PDA, (b) konidia yang tumbuh pada miselia 15 7 Isolat kapang EN pada media PDB 16 8 Kurva pertumbuhan isolat kapang EN selama 27 hari 16 9 Pengaruh konsentrasi kapang dan lama waktu hidrolisis terhadap total
gula pereduksi 19
10 Pengaruh umur kapang terhadap nilai total glukosa 20 11 Kurva pertumbuhan ragi komersial selama fermentasi 7 hari 21 12 Kurva pengaruh waktu fermentasi terhadap total gula pereduksi 22 13 Kurva nilai pH selama fermentasi 7 hari 23
DAFTAR LAMPIRAN
Halaman
1 PENDAHULUAN
LatarBelakang
Sumber bahan bakar minyak di Indonesia yang semakin berkurang tetapi kebutuhannya semakin meningkat, mendorong berbagai kalangan untuk mencari sumber-sumber energi baru untuk menggantikan minyak bumi. Salah satunya adalah bahan bakar dari sumberdaya hayati. Bahan bakar berbasis sumberdaya hayati diharapkan dapat mengurangi terjadinya kelangkaan bahan bakar yang berasal dari bahan baku fosil dan juga mengurangi pencemaran lingkungan, sehingga lebih ramah lingkungan. Salah satu contoh bahan bakar dari sumberdaya hayati adalah bioetanol. Bioetanol dapat dibuat dari bahan-bahan bergula, berpati, atau berserat. Bahan baku yang biasa digunakan sebagai bioetanol antara lain adalah singkong atau ubi kayu, tebu, nira, sorgum, ubi jalar, ganyong, rumput laut dan lain-lain (Hambali et al. 2007). Bahan bakar bioetanol juga dapat berasal dari limbah industri pengolahan. Limbah yang masih memiliki kandungan lignin, selulosa dan hemiselulosa sangat potensial untuk dimanfaatkan menjadi bioetanol. Pemanfaatan limbah akan mengurangi dampak terjadinya konflik atau kompetisi terhadap pemenuhan bahan pangan.
Produksi rumput laut di Indonesia meningkat yaitu 2,791 juta ton pada tahun 2009 dan 3,399 juta ton pada tahun 2010 (KKP 2012). Kandungan limbah yang dihasilkan oleh pengolahan rumput laut tersebut salah satunya adalah selulosa. Selulosa yang terkandung di limbah tersebut mencapai 15-25 % (Kim et al. 2008).
Selulosa merupakan komponen yang dapat dikonversi menjadi bioetanol. Etanol yang diproduksi secara selulolitik dapat digunakan sebagai bahan bakar alternatif yang dapat diperbaharui. Salah satu cara untuk mengkonversikan komponen pati dan selulosa menjadi etanol yaitu dengan hidrolisis yang diikuti dengan fermentasi (Samsuri et al. 2007).
Proses degradasi selulosa atau fermentasi menggunakan aktivitas mikroba potensial contohnya kapang untuk menghasilkan gula dan selanjutnya khamir
Saccharomycess cerevisiae untuk produksi etanol. Produksi selulase dapat
diperoleh dari mikroorganisme terpilih melalui proses sakarifikasi. Proses penapisan aktivitas enzim dan pre-treatment dapat meningkatkan kerja enzim dan meningkatkan hasil akhir proses hidrolisis. Hidrolisis selulosa pada rumput laut selama ini menggunakan larutan asam dan aktivitas enzim contohnya pada penelitian Candra et al. (2011), hidrolisis rumput laut Eucheuma cotonii yang menggunakan H2SO4 5%, sedangkan pada penelitian Kumar et al. (2013)
hidrolisis rumput laut coklat Sargassum spp menggunakan enzim selulase dan
2
Kemampuan kapang dalam mendegradasi komponen polisakarida menjadi gula dibantu oleh enzim yang dimilikinya, contohnya enzim selulase dan xilanase. Gula yang dihasilkan oleh kapang, selanjutnya diolah lebih lanjut untuk menghasilkan etanol melalui proses fermentasi. Kapang sangat berperan dalam industri fermentasi. Hal ini disebabkan kemampuannya dalam menghasilkan etanol yang paling komersial saat ini (Sari et al. 2008). Selama ini kapang yang digunakan dalam sakarifikasi pembentukan gula sederhana yaitu kapang darat contohnya Trichoderma harzianum yang diisolasi dari tanah dan hasil pelapukan kayu yang berasal dari hutan hujan tropis Amazon (Delabona et al. 2012).
Kapang endofit yang telah diisolasi berjumlah sekitar 6500 yaitu berasal dari tanaman herbal dan pohon serta alga untuk mengetahui aktivitas biologis dan profil kimianya. Proporsi kapang endofit yang diisolasi dari tanaman, alga dan tanah untuk menghasilkan aktivitas biologis masing-masing sebesar 80%, 83% dan 64% (Schulz et al. 2002). Kapang laut endofit umumnya diisolasi dari daun mangrove, cangkang hewan laut, sedimen laut, alga dan koral. Beberapa tanaman laut menghasilkan metabolit sekunder yang berpotensi sebagai antibakteri, antifungi, antimalaria, antibakteri dan antitumor (Raghukumar 2008). Kapang endofit menghasilkan aktivitas metabolit sekunder yang lebih aktif, sehingga kapang endofit dari organisme maupun tumbuhan laut juga memiliki potensi dalam mendegradasi selulosa namun keberadaannya belum banyak dikaji lebih lanjut. Oleh karena itu, sangat penting untuk mengetahui potensi kapang endofit dari laut dalam proses pembuatan bioetanol dengan limbah rumput laut. Penelitian ini bertujuan untuk menentukan kapang selulolitik yang berpotensi, konsentrasi kapang, umur kapang, waktu hidrolisis dan fermentasi terbaik dalam pembuatan bioetanol.
Perumusan Masalah
Pada tahun 2010 produksi industri rumput laut meningkat sebesar 607.749 ton per tahun. Adanya peningkatan produksi rumput laut tersebut dapat menyebabkan peningkatan limbah industri rumput laut yang dihasilkan. Limbah yang dihasilkan pada setiap pengolahan rumput laut sekitar 65-75%. Limbah yang tidak ditangani secara baik dan benar akan dapat mencemari lingkungan. Salah satu cara mengurangi pencemaran limbah produksi rumput laut yaitu dengan memanfaatkan limbah tersebut menjadi produk yang bernilai tambah. Limbah pengolahan rumput laut (agar-agar kertas) dapat dimanfaatkan sebagai substrat pembuatan bioetanol karena adanya kandungan selulosa yang terdapat pada limbah rumput laut. Pembuatan bioetanol dilakukan dengan metode hidrolisis enzimatis dan fermentasi sehingga perlu dilakukan optimasi pada proses hidrolisis dan fermentasi untuk dapat menghasilkan kadar etanol yang tinggi.
Tujuan
1 Menentukan isolat kapang selulolitik terbaik
Manfaat Penelitian
Manfaat dari penelitian ini yaitu tersedianya informasi tentang proses hidrolisis limbah agar-agar dengan menggunakan isolat kapang laut endofit yang dapat membantu optimasi proses hidrolisis dan dapat difermentasi menjadi etanol.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut: 1 Penggunaan isolat kapang dan salinitas media yang berbeda memberikan
pengaruh terhadap nilai zona bening.
2 Penggunaan konsentrasi kapang, umur kapang dan waktu hidrolisis yang berbeda memberikan pengaruh terhadap nilai glukosa.
4
Road map mengenai kajian literatur penelitian bioetanol yang telah ada dan perkembangan penelitian yang telah dilakukan dapat dilihat pada Gambar 1.
2 METODE
Lokasi dan Waktu Penelitian
Penelitian dilakukan mulai Bulan November 2012 sampai April 2014 di Laboratorium Mikrobiologi Hasil Perairan, Laboratorium Bioteknologi Hasil Perairan II, dan Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan; Laboratorium Nutrisi Pakan, Fakultas Peternakan; Laboratorium Pendidikan dan Layanan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor; Laboratorium Balai Pengkajian Bioteknologi, Badan Pengkajian dan Penerapan Teknologi, Serpong.
Alat dan Bahan
Bahan yang digunakan untuk pembuatan bioetanol termasuk untuk analisisnya adalah limbah agar-agar kertas di Pameungpeuk, kapang koleksi dari Kustiariyah Tarman (Dosen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan IPB) yaitu Isolat EN dari Enhalus di Pulau Karya Kepulauan Seribu, Veronaea sp. KT19 dari pasir laut, dan Isolat SMH dari spons; kapang hasil isolasi dari rumput laut dan daun mangrove, ragi komersial (Fermipan),
Potato Dextrose Agar (Difco), Potato Dextrose Broth (Difco), reagen Asam
3,5-dinitrosalisilat (DNS) (Sigma), glukosa (Merck), NaCl (Merck), Carboxyl Methyl
Cellulose (CMC), congo red (Sigma), media Andreoti dapat dilihat pada
Lampiran 1, dan media Cellulolysis Basal Medium (CBM).
Alat-alat yang digunakan pada penelitian ini yaitu mikroskop (Cole Palmer), inkubator (Thermoline 42000), autoclave (YamatoSM 52), sentrifuse (Himac CR 21G), pipet mikro (Gilson), Clean Banch (Thermo Scientific 1300 series A2), pH-meter, spektrofotometer (Yamato), oven (Yamato SH 62), orbital
shaker, High Performance Liquid Chromatography (HPLC).
Pelaksanaan Penelitian
Penelitian ini terdiri dari tiga tahap, yaitu tahap pertama yaitu isolasi dan penapisan kapang. Tahap kedua yaitu optimasi hidrolisis dengan menentukan konsentrasi kapang, umur kapang dan waktu hidrolisis terbaik. Tahap ketiga yaitu optimasi waktu proses fermentasi berdasarkan nilai gula pereduksi dan jumlah kepadatan ragi selama proses fermentasi sehingga mendapatkan konsentrasi etanol yang tinggi.
Tahap Isolasi dan Penapisan Kapang Isolasi Kapang Endofit (Tarman 2011)
6
Penapisan Kapang Selulolitik (Purwadaria et al. 2003)
Penapisan kapang selulolitik dengan metode zona bening dilakukan dengan menggunakan pewarnaan merah kongo 0,1%. Proses isolasi dan penapisan kapang dapat dilihat pada Gambar 2. Isolat kapang ditumbuhkan pada media
Cellulolysis Basal Medium (CBM) yang berbeda (air tawar, air laut dan NaCl 3%)
dengan sumber karbonnya yaitu CMC. Kapang diinkubasi selama 6 hari pada suhu ruang. Penentuan kapang selulolitik dilihat dari indeks selulolitik zona bening yang terbentuk. Indeks selulolitik merupakan nisbah antara diameter zona bening dengan diameter koloni. Semakin besar indeks selulolitik yang dihasilkan maka semakin besar enzim yang dihasilkan oleh koloni kapang tersebut. Indeks selulolitik diperoleh dengan menggunakan rumus sebagai berikut:
Diameter zona bening (mm) Diameter koloni (mm)
Pengukuran Pertumbuhan Kapang (Subowo 2010)
Isolat kapang endofit rumput laut yang terpilih berdasarkan uji zona bening ditumbuhkan pada media cair PDB. Kultur kemudian diinkubasi pada suhu ruang selama 21 hari. Pengukuran bobot biomassa kapang dilakukan setiap 3 hari. Miselium kapang yang tumbuh di dalam media PDB kemudian disaring dengan menggunakan kertas saring Whatman No 1 dan dikeringkan dalam oven selama 24 jam pada suhu 80oC. Bobot kering miselium ditentukan dengan menghitung selisih bobot antara kertas saring kosong dengan kertas saring yang berisi miselium.
Tahap Hidrolisis
Bahan baku yang digunakan yaitu limbah padat agar-agar yang didapatkan dari industri agar-agar kertas Cap Apel di daerah Pameungpeuk, Garut. Skema persiapan bahan baku dapat dilihat pada Gambar 3. Pada penelitian tahap hidrolisis ini terdiri dari penentuan jumlah konsentrasi kapang, umur kapang dan lama waktu hidrolisis. Proses penelitian tahap hidrolisis dapat dilihat pada Gambar 4.
Penentuan Konsentrasi Kapang dan Waktu Hidrolisis
Hidrolisis enzimatis dilakukan dengan modifikasi metode Sari et al. (2011) dan media Andreoti yang digunakan mengacu pada Muthuvelayudham dan Viruthagiri (2006). Limbah agar-agar kering dihidrolisis pada pH 5,66 secara enzimatis dengan menggunakan kapang terpilih dengan konsentrasi yang berbeda (2, 4, 6, 8, 10, 12, 14, 16, 18, 20%). Konsentrasi limbah yang digunakan adalah 1,5%. Lama waktu hidrolisis yang digunakan yaitu 3, 6, dan 9 hari dan ditentukan berdasarkan nilai gula pereduksi (Miller et al. 1960).
Gambar 2 Tahap isolasi dan penapisan kapang
Gambar 3 Proses persiapan bahan baku Sterilisasi permukaan
rumput laut
Tanam pada media PDA + Kloramfenikol
Rumput laut
Isolat kapang Uji selulolitik [(salinitas
media CBM berbeda (NaCl 3%, air laut dan
air tawar)]
Isolat kapang terpilih
Kultivasi kapang
Pengukuran biomassa kapang
Pertumbuhan kapang
Pengeringan (3-4 hari)
Pengayakan (80-100 mesh) Limbah padat agar-agar
Limbah agar-agar kering
Analisis:
- Kadar selulosa - Kadar hemiselulosa - Kadar lignin
- Kadar air - Kadar abu
8
Gambar 4 Proses penelitian tahap hidrolisis
Penentuan Umur Kapang
Hidrolisis enzimatis dilakukan dengan modifikasi metode Sari et al. (2011) dan modifikasi media Andreoti (Muthuvelayudham dan Viruthagiri 2006). Limbah agar-agar kering dihidrolisis secara enzimatis dengan menggunakan kapang dengan konsentrasi yang terpilih (20% b/v) dengan lama waktu hidrolisis yang terbaik (3 hari). Kapang yang digunakan yaitu dengan umur 3, 6, 9, 12, 15, 18, dan 21 hari. Umur kapang ditentukan berdasarkan nilai gula pereduksi yang dihasilkan (Miller et al.1960).
Tahap Fermentasi
Proses fermentasi dilakukan berdasarkan modifikasi metode Azizah et al. (2012). Hidrolisat yang akan digunakan diset menjadi pH 5,01; kemudian disterilisasi pada suhu 121 oC selama 20 menit. Inokulasi ragi komersial (10%) (Lampiran 2) ditambahkan ke dalam media. Proses fermentasi berlangsung selama 7 hari pada suhu 32 oC. Pengambilan sampel dilakukan selama 24 jam untuk dianalisis tingkat pertumbuhan yeast berdasarkan nilai Total Plate Count (TPC) dan pH. Pengujian etanol dilakukan pada sampel yang terbaik berdasarkan nilai gula pereduksi dan pertumbuhan ragi komersial selama fermentasi.
Prosedur Pengujian
Uji Kadar Selulosa (SNI 0444; 2009)
Kadar Holoselulosa (Hemiselulosa dan Selulosa)
Limbah agar-agar sebanyak 2,5 gram ditambahkan dengan 100 mLakuades, 1 gram natrium klorit dan 1 mL asam asetat glasial kemudian dipanaskan pada suhu 80 oC. Selama pemanasan dilakukan penambahan 1 gramnatrium klorit dan
Penambahan media Andreoti
Sterilisasi (121 oC, 20 menit)
Hidrolisis (30 oC, 120 rpm) selama 3, 6, 9 hari (Konsentrasi dan umur kapang yang berbeda) Pengaturan pH 5 dengan penambahan HCl dan NaOH
- Gula pereduksi - Selulosa
0,2 mL asam asetat setiap 1 jam hingga 4 kali. Limbah disaring dan dicucidengan air panas kemudian ditambahkan 25 mL asam asetat 10% selanjutnya dicuci kembali hingga bebas asam. Limbah yang telah bebas asam (holoselulosa) kemudian dikeringkan dengan oven pada suhu 105 oC selama 6 jam.
Holoselulosa, % = (A/B) x 100% dengan:
A = bobot holoselulosa (gram) B = bobot kering sampel (gram)
Kadar Selulosa
Limbah agar-agar sebanyak 2,5 gram ditambahkan dengan 125 mL larutan asam sitrat 3,5% kemudian dipanaskan selama 12 jam pada suhu 80 oC. Limbah disaring hingga tidak berwarna dan dikeringkan pada suhu ruang, kemudian ditambahkan 125 mL larutan campuran NaOH dan Na2SO3 dan dipanaskan
selama 2 jam pada suhu 50 oC. Limbah disaring dan selanjutnya dicuci kembali dengan air hingga filtrat tidak berwarna. Filtrat limbah kemudian ditambah 50 mL larutan natrium klorit 10% dan dilakukan pencucian dengan menggunakan air hingga diperoleh endapan berwarna putih kemudian ditambahkan 100 mL asam asetat 10% dan dilakukan pencucian hingga bebas asam. Untuk mendapatkan kadar selulosa maka filtrat dikeringkan pada suhu 105 oC selama 6 jam.
Selulosa, % = (A/B) x 100% A = bobot selulosa, gram B = bobot kering sampel, gram
Kadar Hemiselulosa
Kadar hemiselulosa diperoleh dari pengurangan persentase kadar holoselulosa dengan kadar selulosa.
Hemiselulosa (%) = holoselulosa (%) – selulosa (%)
Uji Kadar Lignin (SNI 0492:2008)
Limbah agar-agar sebanyak 2 gram diekstraksi dengan alkohol benzen (1:2). Ekstrak limbah direndam selama 2 jam dalam asam sulfat 72% sebanyak 40 mL pada suhu 20 °C kemudian dimaserasi selama 2-3 menit. Ekstrak limbah dipanaskan hingga mendidih selama 4 jam kemudian didinginkan hingga endapan lignin mengendap sempurna. Endapan lignin disaring dan dicuci dengan air panas hingga bebas asam kemudian dikeringkan pada suhu 105 oC selama 6 jam.
Berat sampel kering (g) Berat endapan lignin (g)
Penentuan Nilai Glukosa Metode DNS (Miller 1959) Penyiapan Pereaksi DNS
Pereaksi DNS dibuat dengan melarutkan 10,6 g asam 3,5 dinitrolisilat dan 19,8 NaOH ke dalam 1416 mL air. Setelah itu ditambahkan 306 g Na-K Tatrat, 7,6 g fenol yang dicairkan pada suhu 50 oC dan 8,3 g Na-Metabisulfit. Larutan ini diaduk rata, kemudian 3 mL larutan ini dititrasi dengan HCl 0,1 N dengan indikator fenolftalein. Banyaknya titran berkisar 5–6 mL, jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap mL kekurangan HCl 0,1 N.
10
Penentuan Kurva Standar
Kurva standar dibuat dengan mengukur nilai gula pereduksi (glukosa) dengan interval 0,2–0,5 mg/L. Kemudian nilai glukosa dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam grafik secara linear.
Penetapan Nilai Glukosa
Pengujian glukosa menggunakan kurva standar DNS adalah sebagai berikut: 1 mL sampel dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 3 mL pereaksi DNS. Larutan tersebut ditempatkan dalam air mendidih selama 5 menit kemudian didinginkan pada suhu ruang. Pengukuran absorbansi sampel pada panjang gelombang 550 nm.
Penentuan Kadar Etanol
Analisis crude etanol sampel dilakukan menggunakan HPLC (High
Performance Liquid Chromatography). Water 1525EF Binary HPLC Pump
dengan spesifikasi sebagai berikut:
Fase gerak : H2SO4 0.008 N
Kolom : Aminex® HPX-87H, 300 mm x 7.8 mm
Detektor : Reactive Index
Laju aliran : 1 mL/min
Volume injeksi : 20 µ L
Suhu kolom : 35 oC
Back Pressure : 1176 psi
Perhitungan kadar etanol (g/L) yaitu sebagai berikut: Konsentrasi standar (g/L)
Luas area standar
Analisis Data
Data pada perlakuan penapisan kapang selulolitik dan penentuan hidrolisis terbaik dianalisis dengan menggunakan rancangan percobaan faktorial. Rancangan percobaan pada penapisan kapang selulolitik yaitu menggunakan faktorial 7x3 yang terdiri dari jenis kapang sebanyak 7 taraf faktor (isolat kapang EN, KT19, SMH, D1, D3, RL6, RL9) dan jenis salinitas media sebanyak 3 taraf faktor (NaCl 3%, air laut, air tawar ). Pada perlakuan hidrolisis menggunakan rancangan percobaan fakorial 10x3 yang terdiri dari konsentrasi kapang sebanyak 10 taraf faktor (2, 4, 6, 8, 10, 12, 14, 16, 18, 20%) dan waktu hidrolisis sebanyak 3 taraf faktor (3, 6, 9 hari). Perlakuan ini dianalisis menggunakan Univariate
Analysis of Variance dengan kaidah pengambilan keputusan sebagai berikut (Steel
and Torrie 1993):
Yijk = µ + αi+ βj+ (αβ)ij+ εijk
Keterangan :
Yijk : Hasil pengamatan pada ulangan ke-k yang menerima taraf ke-i dari
faktor konsentrasi kapang/ jenis isolat kapang dan taraf ke-j dari faktor waktu hidrolisis/ jenis salinitas media
µ : Nilai tengah umum
αi : Pengaruh faktor konsentrasi kapang/ isolat kapang pada taraf ke i
εijk : Komponen galat pada taraf ke-i, taraf ke-j dan interaksi yang ke-i dan
ke-j, serta pada ulangan ke-k.
Berdasarkan uji Univariate Analysis of Variance, perlakuan pada tahap penentuan kapang selulolitik yang memberikan pengaruh nyata (p<0,05) pada nilai indeks selulolitik dan perlakuan pada tahap hidrolisis yang memberikan pengaruh nyata (p<0,05) terhadap nilai glukosa maka masing-masing akan diuji lanjut dengan Duncan Multiple Range Test (DMRT) menggunakan software SPSS 13.0.
Data pada perlakuan umur kapang dan lama fermentasi terhadap nilai glukosa dianalisis dengan menggunakan Rancangan Acak Lengkap (RAL) dengan percobaan satu faktor. Perlakuan ini dianalisis menggunakan Analysis of Variance
(ANOVA) dengan kaidah pengambilan keputusan sebagai berikut (Steel and Torrie 1993):
Keterangan :
Yij : Hasil pengamatan pada ulangan ke-j yang menerima taraf ke-i dari nilai
gula pereduksi (glukosa)
µ : Nilai tengah umum pengamatan
τi : Pengaruh perbedaan perlakuan pada umur kapang/ lama fermentasi pada
taraf ke i
εij : Komponen galat pada taraf ke-i dan ulangan ke-j
Berdasarkan uji Analysis of Variance (ANOVA), perlakuan pada tahap penentuan kapang selulolitik yang memberikan pengaruh nyata (p<0,05) pada nilai indeks selulolitik dan perlakuan pada tahap hidrolisis yang memberikan pengaruh nyata (p<0,05) terhadap nilai glukosa maka masing-masing akan diuji lanjut dengan Duncan Multiple Range Test (DMRT) menggunakan software SPSS 13.0.
3 HASIL DAN PEMBAHASAN
Tahap Isolasi dan Penapisan Kapang
Isolat Kapang Endofit
Kapang endofit yang digunakan pada penelitian ini diisolasi dari rumput laut dan daun mangrove serta kapang endofit koleksi Kustiariyah yang diisolasi dari spons, pasir laut dan lamun tersaji pada Tabel 1. Hasil isolasi kapang endofit pada rumput laut dan daun mangrove diperoleh masing-masing dua isolat kapang. Media yang digunakan untuk isolasi kapang ini ditambahkan kloramfenikol
12
sebanyak 1 ppm. Hal ini dilakukan untuk mencegah pertumbuhan bakteri pada media. Keempat isolat kapang hasil isolasi (D1, D3, RL6 dan RL9) dan tiga isolat kapang koleksi Kustiariyah Tarman (EN, KT19 dan SMH) diremajakan pada media PDA cawan dan dilihat secara mikroskopik pada bagian miselia kapang. Pada penelitian Kumala dan Siswanto (2007), kapang endofit dapat tumbuh pada media PDA yang telah ditambahkan dengan kloramfenikol (0,005% b/v) sebagai bahan antibakteri untuk pertumbuhan kapang.
Tabel 1 Deskripsi kapang endofit yang digunakan Sumber Kode isolat Bentuk kapang Bentuk miselium
0 pertumbuhannya dan memiliki bentuk miselia yang berbeda-beda. Miselia pada kapang baru akan terlihat jelas pada hari pertama hingga hari ketiga. Keempat jenis isolat kapang yang telah diisolasi (isolat D1, D3, RL6, RL9) dapat tumbuh pada berbagai media yaitu media NaCl 3%, air laut dan air tawar. Hal ini diduga kapang yang tumbuh merupakan kapang laut fakultatif sehingga dapat tumbuh pada berbagai salinitas media yang berbeda. Menurut Gandjar et al. (2006), kapang laut umumnya diisolasi dari tumbuhan yang hidup di dalam laut dan sekitarnya, dari alga, hewan laut dan juga dari buih air laut. Kapang laut dapat bersifat fakultatif yaitu kapang yang berasal dari lingkungan air tawar atau terrestrial tetapi mampu tumbuh dan bersporulasi di lingkungan laut.
Kapang yang diisolasi dari lingkungan laut dapat tumbuh pada kondisi lingkungan dengan salinitas air yang berbeda-beda, contohnya salinitas air laut dengan konsentrasi garam 3-3,5%, salinitas air tawar dengan konsentrasi garam 0,05% dan lingkungan dengan salinitas yang sangat tinggi (hipersalin) yang mengandung garam sebesar 5-10% (Raghukumar et al. 2008).
Penapisan Kapang Selulolitik
Penapisan secara cepat pada mikroba selulolitik dapat dilakukan dengan pengukuran daerah bening, walaupun demikian penentuan tersebut hanya merupakan deteksi semi kuantitatif. Penapisan kuantitatif merupakan suatu konfirmasi dan hasilnya belum tentu sama dengan penapisan daerah bening (Teater and Wood 1992)
Tiga jenis isolat kapang koleksi Kustiariyah Tarman dan empat jenis isolat kapang yang telah diisolasi kemudian ditapis berdasarkan indeks selulolitiknya dengan salinitas media yang berbeda-beda yaitu dengan penambahan NaCl 3%, air laut dan air tawar. Hasil penapisan isolat kapang selulolitik terhadap nilai indeks selulolitiknya dapat dilihat pada Gambar 5.
14
Hasil analisis ragam Univarate Analysis of Variance penapisan kapang (Lampiran 3) menunjukkan bahwa pada perlakuan penggunaan jenis isolat kapang (D1, D3, RL6, RL9, EN, KT19, SMH) dan salinitas media yang berbeda (NaCl 3%, air laut dan air tawar) memberikan perbedaan yang nyata pada taraf uji 0,05%. Hal ini berarti bahwa nilai indeks selulolitik berpengaruh nyata (p<0,05) pada penggunaan jenis isolat kapang dan salinitas media yang berbeda. Pada hubungan interaksi penggunaan jenis isolat kapang dengan jenis salinitas media memberikan hasil yang berbeda nyata. Hal ini berarti bahwa nilai indeks selulolitik memberikan pengaruh nyata (p<0,05) antara perlakuan jenis isolat kapang dan salinitas media.
Hasil analisis lanjutan dilakukan menggunakan uji Duncan (Lampiran 4). Hasil uji lanjut terhadap pengaruh perbedaan salinitas media pada media dengan penambahan NaCl 3% menunjukkan nilai indeks selulolitik yang berbeda nyata dengan media dengan penambahan air laut dan air tawar. Nilai indeks selulolitik pada media dengan penambahan air laut tidak berbeda nyata terhadap media dengan penambahan air tawar. Hal ini dapat diketahui dari jilai selisih rata-rata indeks selulolitik tiap perlakuan. Berdasarkan hasil uji lanjut terhadap pengaruh perbedaan jenis isolat menunjukkan bahwa pada isolat kapang D1 memberikan pengaruh yang nyata terhadap isolat kapang lainnya. Pengunaan isolat kapang EN dan RL6 tidak memberikan pengaruh nyata terhadap indeks selulolitik pada isolat kapang D3, RL9, KT19, SMH, sedangkan pada isolat kapang D3 dan RL9 memberikan pengaruh yang nyata terhadap indeks selulolitik isolat kapang KT19 dan SMH. Berdasarkan hasil uji lanjut interaksi antara salinitas media dengan jenis isolat kapang menunjukkan bahwa media dengan penambahan air tawar dengan isolat kapang EN memiliki rata-rata indeks selulolitik tertinggi yaitu 1,36 dan tidak berbeda nyata dengan interaksi antara air tawar dengan KT19, air tawar dengan SMH, NaCl dengan isolat RL6, NaCl dengan KT19, NaCl dengan isolat SMH, air laut dengan isolat D3, air laut dengan RL6, air laut dengan SMH.
Hasil nisbah zona bening terbesar diperoleh pada isolat kapang EN artinya isolat ini memiliki potensi yang lebih efisien dalam menghasilkan enzim selulase. Semakin besar indeks selulolitik yang dihasilkan maka semakin besar enzim yang dihasilkan oleh koloni kapang tersebut. Kapang EN memiliki nilai indeks selulolitik sebesar 1,36. Nilai ini tidak jauh berbeda dengan nilai indeks selulolitik pada kapang-kapang selulolitik dari jenis Trichoderma harzianum sebesar 1, dan
Rhizopus sp. sebesar 0-4 (Jahangeer et al. 2005), Aspergillus flavus sebesar 1,4 (Purwadaria et al. 2003). Adanya zona bening yang terbentuk karena diduga adanya sekresi enzim selulase pada kapang selulolitik dan terjadi degradasi media yang mengandung selulosa sehingga mampu membentuk zona bening.
Pewarna merah kongo dapat berikatan dengan selulosa yang masih kompleks apabila selulosa pada media mampu didegradasi oleh kapang maka pewarna merah kongo tidak akan berikatan dengan media sehingga terbentuk zona bening. Apabila nutrisi pada medium tumbuhnya habis maka mikroorganisme akan memanfaatkan sumber karbon selulosa dengan mensintesis enzim selulase. Kemampuan membentuk zona bening pada substrat amorf, contohnya CMC menunjukkan adanya enzim endo-β-1,4 glukanase (CMCase) yang dapat
Perbedaan nilai indeks selulolitik diduga karena adanya pengaruh interaksi antara salinitas media dengan isolat kapang yang digunakan. Kandungan mineral pada media dapat berpengaruh pada sekresi enzim selulase. Pada media dengan penambahan air laut dan air tawar, semua isolat kapang dapat menghasilkan zona bening dengan rata-rata indeks selulolitik yang berbeda selama 6 hari inkubasi pada suhu ruang, sedangkan pada media dengan penambahan NaCl 3% hanya isolat D1 yang tidak menghasilkan zona bening. Kemampuan kapang untuk tumbuh pada media spesifik Cellulolysis Basal Medium (CBM) menunjukkan bahwa kapang tersebut mampu memanfaatkan selulosa pada CMC sebagai salah satu sumber karbon untuk pertumbuhan. Kapang yang tidak bersifat selulolitik dalam penelitian ini diduga karena tahap dekompisisi kapang terhadap selulosa berada pada kondisi yang tidak optimum untuk mensekresikan enzim selulase, dimana media dengan NaCl 3% diduga merupakan kondisi yang sesuai dengan isolat kapang D3 sehingga isolat kapang tidak memproduksi enzim selulase yang menyebabkan tidak terdeteksinya aktivitas selulase berdasarkan uji zona bening.
Toleransi mikroorganisme terhadap salinitas bukan hanya sekedar kemampuannya tumbuh pada salinitas yang berada sesuai dengan lingkungannya tetapi mengenai respon suatu spesies terhadap perubahan salinitas (Hogarth 2007).
Pertumbuhan Isolat Kapang EN
Isolat kapang EN dari hasil tahap penapisan selulolitik memiliki potensi sebagai kapang selulolitik dengan salinitas media air tawar, selanjutnya isolat kapang EN ditumbuhkan pada media PDA air tawar selama 6 hari dan diremajakan pada media cair selama 7 hari. Bentuk isolat kapang EN pada media cawan dan bentuk miselia secara mikroskopik dapat dilihat pada Gambar 6. Miselia pada isolat kapang EN memiliki ciri-ciri seperti septa yang membagi hifa menjadi kompartemen dan setiap kompartemen ada satu inti serta ujung hifa monositik. Pertumbuhan isolat EN dilakukan pada media cair yaitu PDB (Potato
Dextrose Broth) yang diinkubasi selama 27 hari pada suhu ruang dengan kondisi
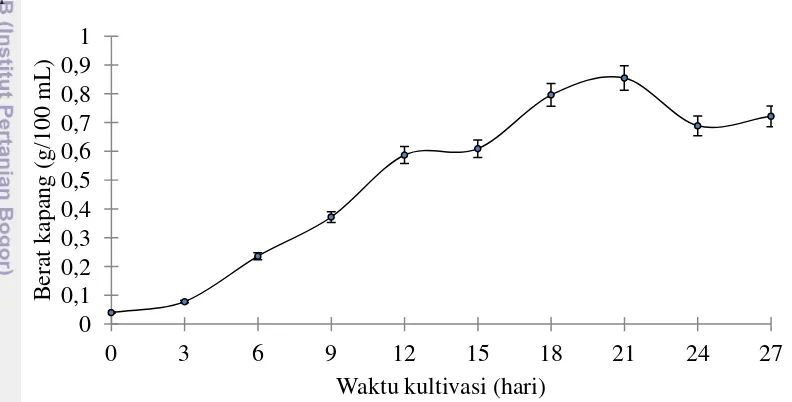
statis. Proses inkubasi pertumbuhan kapang selama 27 hari menghasilkan miselium kapang berwarna putih. Miselium berada pada bagian atas media dan menutupi seluruh permukaan media seperti yang terlihat pada Gambar 7. Bobot biomassa kering pada pertumbuhan isolat kapang EN dihitung berdasarkan berat kering miselia kapang yang telah dikeringkan selama 24 jam. Bobot biomassa meselia kering pada tingkat pertumbuhan isolat kapang EN berada pada kisaran 0,078 sampai 0,8 gram/100 mL media.
(a) (b)
16
Gambar 7 Isolat kapang EN pada media PDB
Pertumbuhan isolat kapang EN yang dilakukan selama 27 hari dapat dilihat pada Gambar 8.
Gambar 8 Kurva pertumbuhan isolat kapang EN selama 27 hari.
Bobot biomassa miselia kering tertinggi dicapai pada kultur hari ke 21 dengan berat mencapai 0,855 gram per 100 mL media. Pada kurva pertumbuhan isolat kapang EN selama 27 hari dapat diketahui bahwa pertumbuhan isolat kapang EN memiliki fase adaptasi untuk menyesuaikan dengan kondisi media cair selama 3 hari. Pada kultur hari ke-3 hingga ke-12, isolat kapang EN memasuki fase pertumbuhan eksponensial dimana miselium timbuh dengan cepat dan konstan. Hal ini diduga karena kapang memanfaatkan semua nutrien media untuk pertumbuhan sehingga kapang mengalami peningkatan bobot miselianya dengan cepat. Fase pertumbuhan lambat terjadi pada kultur hari ke-12 hingga ke-21. Kecepatan pertumbuhan pada fase ini menurun dibandingkan pada fase log. Pada kultur hari ke-21 hingga ke-27, isolat kapang EN memasuki tahap fase stasioner. Berat kering miselium kapang tetap bahkan cenderung turun.
Tahapan pertumbuhan mikroorganisme dalam suatu media dipengaruhi oleh faktor lingkungan dan media. Pada fase adaptasi, mikroorganisme dipengaruhi
oleh mediumnya yaitu jika medium dan lingkungan pertumbuhannya sama maka tidak diperlukan waktu adaptasi tetapi jika nutrien medianya berbeda dari sebelumnya maka diperlukan waktu penyesuaian untuk mensintesa enzim. Jumlah sel awal akan mempengaruhi kecepatan fase adaptasi. Pada fase lag, kecepatan pertumbuhan dipengaruhi oleh medium tumbuhnnya seperti pH, suhu, kelembaban dan kandungan nutrien. Pada fase ini kultur paling sensitif terhadap lingkungan. Pada akhir fase log, kecepatan pertumbuhan populasi menurun karena nutrient di dalam media sudah berkurang serta adanya hasil metabolisme yang dapat menghambat pertumbuhan mikroorganisme. Fase stasioner jumlah sel tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati. Pada fase ini nutrient sudah berkurang sehingga kemungkinan komposisi sel pada fase ini berbeda dengan sel yang tumbuh pada fase log. Ukuran sel menjadi lebih kecil karena sel tetap membelah meskipun nutrien sudah berkurang.
Media pertumbuhan kapang yang digunakan yaitu PDB, dimana media ini mengandung sumber karbon yang berasal dari kentang dan dextrose. Menurut Kumala dan Muhamad (2008), senyawa-senyawa sumber karbon dan nitrogen merupakan komponen terpenting dalam medium karena sel-sel mikroorganisme sebagian besar terdiri dari unsure-unsur karbon dan nitrogen, selain itu juga mengandung garam-garam organik dan beberapa mineral.
Tahap Hidrolisis
Bahan baku yang digunakan merupakan limbah padat agar-agar dalam bentuk kering dengan ukuran partikel ±100 mesh. Pencacahan bahan baku bertujuan untuk membantu mempercepat proses penguraian selulosa oleh kapang. Semakin luas permukaan yang tersedia bagi mikroorganisme maka akan mempercepat proses degradasi material-material organik yang terdapat di dalam substrat oleh mikroorganisme pengurai. Sebelum pembuatan bioetanol, bahan baku (limbah) dikarakterisasi terlebih dahulu. Hasil karakterisasi limbah tersaji pada Tabel 2.
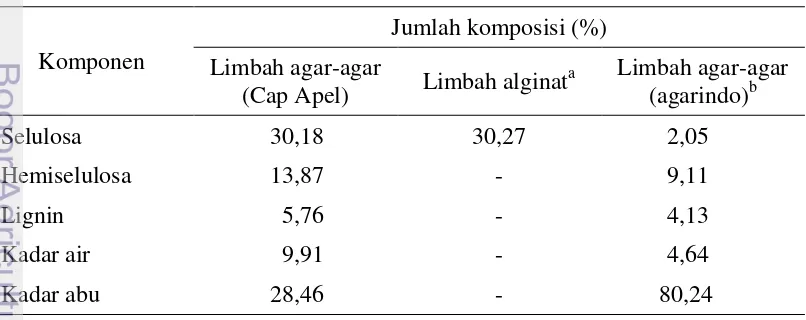
Tabel 2 Hasil karakterisasi limbah padat agar-agar kertas (%)
18
Kadar air limbah agar-agar pada penelitian ini sebesar 9,91%, nilai tidak berbeda dengan nilai kadar air pada penelitian Setyaningsih et al. (2011) yang memiliki kadar air bahan baku sebesar 4,64%. Kandungan air pada bahan berpengaruh terhadap kesegaran dan daya simpan bahan baku (Sari et al. 2011). Menurut Loebis (2008) bahwa kandungan air berpengaruh terhadap pertumbuhan kapang dan aktivitas enzim.
Kadar abu pada limbah mencapai 28,46% tetapi nilai ini lebih rendah dibandingkan dengan kadar abu pada penelitian Setyaningsih et al. (2011) yaitu memiliki nilai kadar abu pada bahan baku sebesar 80,24%. Kadar abu yang tinggi pada bahan baku ini diduga karena masih banyak pengotor selama pengolahan agar-agar kertas, contohnya kerikil, kayu dan lain-lain yang terbawa pada bahan baku (limbah).
Kandungan selulosa pada bahan baku sebesar 30,18%. Kandungan selulosa pada limbah padat agar-agar kertas ini memiliki jumlah selulosa yang tidak jauh berbeda dengan kandungan selulosa pada limbah padat pengolahan alginat dari rumput laut coklat yang digunakan oleh Sari et al. (2011) untuk produksi bioetanol yaitu sebesar 30,27%. Kandungan lignin pada penelitian ini jauh lebih rendah yaitu sebesar 5,76% dibandingkan dengan kandungan lignin pada bahan baku yang digunakan oleh Samsuri et al. (2007) yaitu 24,2% tetapi tidak jauh berbeda dengan limbah agar-agar dari Agarindo yaitu sebesar 4,13%. Lignin yang terdapat pada bahan baku dapat menghalangi atau memperlambat akses enzim dalam memecah polisakarida pada proses hidrolisis sehingga dapat mempengaruhi jumlah etanol yang dihasilkan (Sun et al. 2002).
Lignin merupakan penyusun jaringan tumbuhan selain selulosa dan hemiselulosa. Senyawa ini merupakan polimer aromatik dari phenilpropanoid. Lignin berfungsi sebagai perekat pada jaringan pengangkut tumbuhan dan melindungi struktur yang tersusun dari polisakarida (selulosa dan hemiselulosa) dari serangan organisme lain sehingga lignin bersifat rekalsitran (Subowo 2010) sehingga enzim selulase akan sulit memecah selulosa apabila substratnya masih banyak mengandung lignin. Jaringan lignin dapat didegradasi menjadi senyawa yang lebih sederhana oleh mikroorganisme xilanolitik yang memiliki enzim fenol oksidase sehingga dapat diserap oleh mikroorganisme lain.
Konsentrasi Kapang dan Waktu Hidrolisis
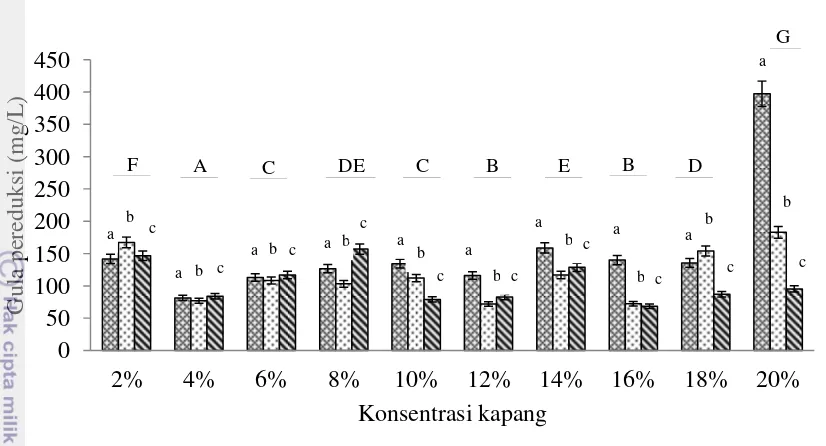
Nilai gula pereduksi dalam proses hidrolisis merupakan indikator penentuan konsentrasi kapang dan lama waktu hidrolisis. Hasil penentuan konsentrasi kapang dan waktu hidrolisis terhadap nilai gula pereduksi (glukosa) dapat dilihat pada Gambar 9.
0
Hasil analisis lanjutan dilakukan menggunakan uji Duncan (Lampiran 6). Hasil uji lanjut terhadap pengaruh perbedaan waktu hidrolisis selama 3 hari menunjukkan nilai gula pereduksi yang berbeda nyata dengan perlakuan yang dihidrolisis selama 6 dan 9 hari. Nilai gula pereduksi selama 6 hari hidrolisis berbeda nyata dengan nilai gula pereduksi yang dihidrolisis selama 9 hari. Hal ini dapat diketahui dari nilai selisih rata-rata gula pereduksi tiap perlakuan. Berdasarkan hasil uji lanjut terhadap pengaruh perbedaan konsentrasi kapang menunjukkan bahwa penggunaan konsentrasi 2% memberikan hasil yang berbeda nyata terhadap nilai gula pereduksi pada semua perlakuan konsentrasi kapang. Beberapa perlakuan memberikan hasil yang tidak berbeda nyata yaitu pada perlakuan konsentrasi kapang 6% dengan 10% dan konsentrasi kapang 12% dengan 16%. Penggunaan konsentrasi kapang 8% memberikan hasil yang tidak berbeda dengan konsentrasi kapang 14% dan 18%. Berdasarkan hasil uji lanjut interaksi antara penggunaan konsentrasi kapang dengan waktu hidrolisis yang berbeda menunjukkan bahwa penggunaan konsentrasi kapang 20% dengan waktu hidrolisis 3 hari memiliki nilai rata-rata glukosa tertinggi yaitu 397,33 mg/L dan hasilnya berbeda signifikan dibandingkan dengan perlakuan lainnya.
Nilai gula pereduksi pada perlakuan konsentrasi kapang 20% lebih tinggi dibandingkan dengan konsentrasi kapang lainnya. Hal ini diduga adanya kerja enzim selulase yang semakin tinggi dengan seiring banyaknya konsentrasi kapang yang digunakan, sedangkan pada perlakuan lama waktu hidrolisis terjadi penurunan nilai gula hingga hari kesembilan. Peningkatan nilai gula pereduksi yang dihasilkan menunjukkan adanya aktivitas selulolitik pada kapang. Enzim selulase pada kapang dapat memutus ikatan β-1,4 glikosidik dengan produk akhir gula sederhana, contohnya glukosa, maltosa, maltoheksosa dan maltopentosa. Penurunan nilai gula pereduksi selama hidrolisis diduga karena adanya pemanfaatan gula-gula sederhana oleh kapang selulolitik untuk proses metabolisme pertumbuhan kapang. Total gula pereduksi dengan penggunaan
20
konsentrasi kapang 20% selama 3 hari hidrolisis sebesar 0,04% (b/v). Pada penelitian Sari et al. (2011) didapatkan nilai total gula pereduksi tertinggi (0,25%, b/b) pada limbah alginat yang dihidrolisis oleh kapang Thrichoderma viride pada hari ketiga dan cenderung turun hingga hari kesembilan. Hal ini diduga adanya serangan selulase secara sinergis antara CMCase, selobiohidrolase dan beta-glukosidase dalam memecah ikatan selulosa yang kompleks.
Umur Kapang
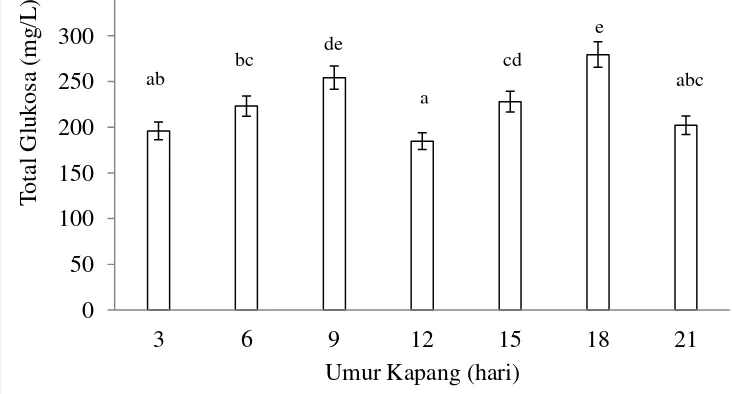
Pada proses hidrolisis dilakukan optimasi umur kapang terhadap nilai gula pereduksi yang dihasilkan. Hasil gula pereduksi (glukosa) terhadap penggunaan umur kapang yang berbeda dapat dilihat pada Gambar 10.
Gambar 10 Pengaruh umur kapang terhadap nilai total glukosa. Huruf
yang berbeda menunjukkan perbedaan yang nyata (p<0,05). Berdasarkan hasil analisis statistik diketahui bahwa penggunaan umur panen kapang yang berbeda memberikan pengaruh yang nyata (p<0,05) terhadap nilai gula pereduksi yang dihasilkan (Lampiran 7). Hasil uji lanjut penggunaan umur kapang terhadap nilai glukosa (Lampiran 8) menunjukkan konsentrasi total glukosa tertinggi dicapai pada kapang dengan umur 18 hari, tetapi total gula pada umur kapang 9 hari dengan 18 hari memberikan hasil yang tidak berbeda nyata.
Total glukosa meningkat pada umur kapang 9 hari, kemudian konsentrasi gula menurun pada hidrolisis dengan umur kapang 12 hari hingga 21 hari. Hal ini diduga kapang dengan umur 9 hari mengalami fase logaritmik. Pada kurva pertumbuhan isolat kapang EN diketahui bahwa fase logaritmik/eksponensial terjadi pada hari ke 9 hingga hari ke 12. Selain itu, aktivitas enzim selulase mencapai nilai maksimum karena pada fase pertumbuhan kapang akan mengurai polimer yang lebih kompleks (selulosa) sebagai nutrisi pertumbuhannya. Selulosa pada limbah agar-agar dimanfaatkan olek isolat kapang sebagai sumber karbon untuk proses pertumbuhannya. Molekul yang terlalu besar untuk diserap akan dihancurkan oleh enzim ekstraseluler sehingga pada fase ini aktivitas enzim akan maksimum. Apabila aktivitas enzim pada kapang selulolitik besar, maka proses degradasi material substrat (selulosa) akan lebih cepat dan menghasilkan nilai
0 mengurai selulosa menjadi senyawa karbon yang lebih sederhana sehingga dapat dimanfaatkan sebagai sumber energi selama pertumbuhan.
Perlakuan terpilih dari proses hidrolisis kemudian dilanjutkan ke tahap selanjutnya yaitu fermentasi. Perlakuan terpilih pada proses hidrolisis enzimatis limbah agar-agar menggunakan isolat kapang EN yaitu dengan menggunakan kapang berumur 3 hari dengan konsentrasi 20% yang dihidrolisis selama 3 hari. Komposisi kandungan selulosa limbah agar-agar yang terhidrolisis tersaji pada Tabel 3.
Tabel 3 Komposisi selulosa setelah proses hidrolisis
Komposisi Jumlah Sebelum
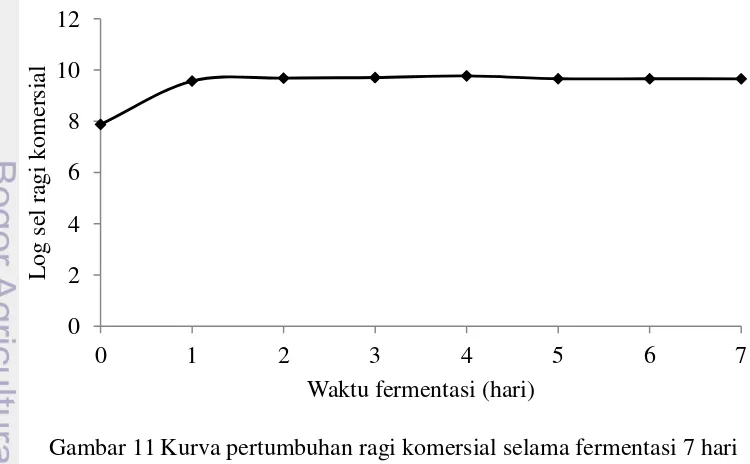
Fermentasi merupakan aplikasi metabolisme mikroba untuk mengubah suatu bahan baku menjadi produk yang bernilai tinggi, contohnya asam-asam organik, biopolimer dan alkohol. Proses fermentasi alkohol yaitu suatu proses yang mengubah gula sederhana contohnya glukosa menjadi alkohol dengan bantuan mikroorganisme (khamir) pada kondisi yang sesuai (Hartoto 1992). Pada proses fermentasi, substrat yang digunakan adalah filtrat hasil hidrolisis limbah agar-agar oleh isolat kapang EN. Hasil pengukuran pertumbuhan ragi komersial pada media fermentasi dapat dilihat pada Gambar 11.
22
Hasil pengukuran pertumbuhan ragi komersial selama fermentasi menunjukkan bahwa kepadatan ragi komersial dalam hidrolisat sebanyak 7,48x107 CFU sampai 5,84x109 CFU. Gambar 11 menunjukkan bahwa pertumbuhan ragi komersial memasuki fase pertumbuhan lambat pada fermentasi hari ke 0 hingga hari ke 1. Selanjutnya pertumbuhan ragi komersial memasuki fase stasioner hingga hari ke 7 fermentasi. Pada awal fermentasi, pertumbuhan ragi komersial tidak menunjukkan adanya fase adaptasi. Hal ini dikarenakan gula-gula pereduksi yang terdapat di dalam substrat fermentasi dapat langsung dimanfaatkan oleh ragi.
Peningkatan jumlah sel khamir pada fase logaritmik dikarenakan adanya pemanfaatan gula pereduksi yang digunakan untuk pertumbuhan sel. Pada fase logaritmik, mikroorganisme mampu membelah dengan cepat dan semua sel mempunyai kemampuan untuk berkembang biak dengan memanfaatkan semua nutisi yang tersedia di dalam substrat (Syamsu et al. 2008).
Glukosa merupakan salah satu indikator dalam menentukan proses fermentasi. Pengaruh lama fermentasi selama 7 hari terhadap nilai glukosa yang dihasilkan dapat dilihat pada Gambar 12.
Gambar 12 Kurva pengaruh waktu fermentasi terhadap total gula pereduksi
Berdasarkan hasil analisis statistik diketahui bahwa waktu fermentasi selama 7 hari memberikan pengaruh yang signifikan (p<0,05) terhadap nilai gula pereduksi (glukosa) yang dihasilkan (Lampiran 9). Hasil uji lanjut waktu fermentasi selama 7 hari terhadap nilai glukosa (Lampiran 10) menunjukkan bahwa lama fermentasi selama 1, 2, 3, 4 hari memberikan hasil total glukosa yang tidak berpengaruh nyata. Lama fermentasi selama 5 hari memiliki nilai total glukosa yang tidak berbeda signifikan dengan lama fermentasi selama 6 hari.
Pada proses fermentasi selama 7 hari terjadi penurunan nilai total glukosa. Penurunan jumlah glukosa pada awal fermentasi hingga 24 jam pertama sangat cepat yaitu dari 0,058% menjadi 0,039%, selanjutnya nilai gula pereduksi relatif stabil hingga hari terakhir fermentasi. Menurut Syamsu et al. (2008), penurunan gula pereduksi selama proses fermentasi menunjukkan bahwa gula yang ada pada
0,0
substrat digunakan oleh khamir untuk melakukan pertumbuhan dan memproduksi etanol.
Khamir yang digunakan untuk proses fermentasi memiliki 2 jenis enzim yaitu enzim invertase yang digunakan untuk mengubah sukrosa menjadi gula sederhana contohnya glukosa dan fruktosa. Enzim lainnya yaitu enzim zimase yang berfungsi sebagai pengkonversi glukosa menjadi etanol (Hartoto 1992).
Menurut penelitian Candra et al (2011), mikroorganisme dalam proses fermentasi terbaik yaitu berasal dari ragi, sel khamir (yeast) contohnya S.
cereviceae dan Candida tropicalis. Ragi merupakan campuran beberapa
mikroorganisme contohnya kapang, khamir dan bakteri sehingga dapat meningkatkan hasil akhir fermentasi.
Salah satu indikator pembentukan etanol yaitu dipengaruhi oleh nilai pH. Pengaruh nilai pH selama proses fermentasi 7 hari dapat dilihat pada Gambar 13.
Gambar 13Kurva nilai pH selama fermentasi 7 hari
Nilai pH yang terukur selama proses fermentasi yaitu berkisar 4,93 sampai 2,95. Penurunan pH yang terjadi selama proses fermentasi ini diduga terbentuknya senyawa asam organik lain yang mempengaruhi nilai pH. Sampel yang diuji dengan HPLC terdeteksi mengandung asam laktat sebanyak 0,006% sebagai hasil samping proses fermentasi.
Menurut penelitian Syamsuri et al. (2008), asam laktat dapat terbentuk selama proses fermentasi alkohol karena adanya bakteri kontaminan yang hidup dan tumbuh bersama ragi, contohnya Lactobacillus sp. yang dapat mengubah glukosa menjadi asam laktat. Menurut Syamsu et al. (2008) khamir mengkonsumsi gula untuk membentuk massa sel selama fermentasi dalam bentuk R-NH3+, dimana R adalah rantai karbon. Peningkatan NH3+ akan melepaskan ion
H+ ke lingkungannya sehingga selama fermentasi ion H+ pada larutan akan semakin banyak dan mengakibatkan penurunan pH.
24
pH 4,5. Menurut Idral et al. (2012), penurunan pH disebabkan karena sel khamir selain menghasilkan alkohol sebagai metabolit primer juga menghasilkan asam organik sebagai hasil sampingan.
Konsentrasi Crude Etanol
Konsentrasi crude etanol pada proses fermentasi dianalisis dengan menggunakan HPLC. Crude etanol yang didapat pada fermentasi hari ketiga yaitu sebesar 3892 ppm. Hasil ini lebih besar dari penelitian Sari et al. (2011) yaitu menghasilkan etanol sebesar 320 ppm selama 24 jam fermentasi atau 0,25% (b/b) bahan baku selulosa limbah alginat. Fermentasi alkohol dipengaruhi oleh jenis gula yang digunakan, karena tidak semua gula sederhana dapat dimanfaatkan oleh khamir. Jenis gula yang digunakan khamir dalam proses fermentasi yaitu glukosa, galaktosa, dan fruktosa. Proses fermentasi limbah agar-agar oleh ragi selama 3 hari menghasilkan kandungan gula yang tersisa yaitu jenis maltoheptosa. Maltoheptosa merupakan komponen oligosakarida yang memiliki rantai karbon lebih panjang. Maltoheptosa merupakan komponen gula non fermentable sugar
sehingga tidak dapat dimanfaatkan oleh khamir untuk dikonversi menjadi etanol (Rusdianto 2010).
Crude etanol diuji pada fermentasi hari ketiga. Hal ini dikarenakan nilai gula pereduksi dan tingkat pertumbuhan yeast memiliki nilai yang rendah sehingga diduga yeast sudah tidak memanfaatkan gula pereduksi tersebut untuk pertumbuhan melainkan untuk mengkonversi gula menjadi etanol dan ditentukan berdasarkan hasil uji lanjut analisis statistik pada nilai glukos. Hasil terbaik diperoleh pada fermentasi hari pertama hingga hari keempat dengan nilai yang tidak berbeda signifikan.
Lama fermentasi dipengaruhi oleh beberapa faktor yang secara langsung ataupun tidak langsung berpengaruh terhadap proses fermentasi, antara lain substrat, suhu, pH dan mikroba (Azizah et al. 2012). Menurut Sari et al. (2008), bahwa lama fermentasi yang paling optimal untuk proses pembuatan bioetanol adalah 3 hari. Jika fermentasi dilakukan lebih dari 3 hari, maka kadar alkoholnya dapat berkurang. Kadar alkohol berkurang disebabkan oleh perubahan alkohol menjadi senyawa lain, contohnya ester.
4 SIMPULAN DAN SARAN
Simpulan
Saran
Penelitian lebih lanjut perlu dilakukan pre-treatment menggunakan kapang lignolitik, asam (HCl), dan basa (NaOH) untuk megurangi kandungan lignin pada limbah sehingga dapat mempermudah proses hidrolisis enzimatis. Perlu dilakukan optimasi konsentrasi limbah pada tahap hidrolisis agar nilai total gula pereduksi yang terbentuk meningkat. Perlu dilakukan optimasi waktu fermentasi terhadap nilai etanol yang dihasilkan agar didapatkan laju pembentukan etanol.
DAFTAR PUSTAKA
Azizah N, Al-Baarri AN, Mulyani S. 2012. Pengaruh lama fermentasi terhadap kadar etanol, pH, dan produksi gas pada proses fermentasi bioetanol dari
whey dengan substitusi kulit nanas. Aplikasi Teknologi Pangan 1(2): 72-77.
Candra KP, Sarwono, Sarinah. 2011. Study on bioethanol production using red seaweed Eucheuma cotonii from Bontang sea water. J Coast Dev 15(1): 45-50.
Delabona PS, Farinas CS, da Silva MR, Azzon SF, da Cruz Pradella JG. 2012. Use of a new Trichoderma harzianum strain isolated from the Amazon rainforest with pretreated sugar cane bagasse for on-site cellulase production. Bioresource Technol. 107: 517–521.
Elevri PA, Putra SR. 2006. Produksi etanol menggunakan Saccharomyces
cerevisiae yang diamobilisasi dengan agar batang. Akta kamindo 1(2):
105-114.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Yayasan Jakarta: Obor Indonesia.
Goto M, Furukawa K, Hayashida S. 1992. An avicel affinity site in an avicel-digesting exocellulose from Trichoderma viride mutant. Biosci Biotechnol
Biochem. 56(10): 1523-1528.
Hambali E, Mudjadlipah S, Tambunan AH, Pattiwiri AW, Hendroko R. 2007. Teknologi Bioenergi. Jakarta (ID): Agromedia Pustaka.
Hartoto L. 1992. Teknologi Fermentasi. Bogor (ID): IPB Press
Hogarth PJ. 2007. The Biology of Mangroves and Seagrasses. New York (US): Oxford University Press.
Idral DD, Salim M, Mardiah E. 2012. Pembuatan bioetanol dari mapas sagu dengan proses hidrolisis asam dan menggunakan Saccharomyces
cerevisiae. Kimia Unand. 1(1): 34-39.
26
Kataria R and Ghosh S. 2011. Saccharification of kans grass using enzyme mixture from Trichoderma reesei for bioethanol production. Bioresource
Technol. 102(21) : 9970 – 9975.
[KKP] Kementerian Kelautan dan Perikanan. 2012. Statistik Produksi Hasil Perikanan. Jakarta: Pusat Data, Statistik, dan Informasi, Sekretariat Jenderal, Kementerian Kelautan dan Perikanan.
Kim GS, Myung KS, Kim YJ, Oh KK, Kim JS, Ryu HJ, Kim KH. 2007. Method
of Producing Biofuel Using Sea Algae. Seoul: World Intelectual Property
Organization.
Kumala S, Siswanto EB. 2007. Isolation and screening of endophytic microbes from Morinda citrifolia and their ability to produce anti-microbial substances. Jurnal Mikrobiologi Indonesia 3(1): 145-148.
Kusumaningtyas E, Natasia M, Darmono. 2010. Potensi metabolit kapang endofit rimpang lengkuas merah dalam menghambat pertumbuhan Eschericia coli
dan Staphylococcus aureus dengan media fermentasi PDB dan PDY.
Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner (6)10:
819-824
Miller GL, Blum R, Glennon WE, Burton AL. 1960. Measurement of carboxymethylcellulase activity. Anal Biochem. 1(2):127–132.
Muthuvelayudham R dan Viruthagiri T. 2006. Fermentative production and kinetics of cellulase protein on Trichoderma reesei using sugarcane bagasse and rice straw. Afr J Biotechnol. 5(20):1873-1881.
Purwadaria T, Marbun PA, Sinurat AP, Ketaren PP. 2003. Perbandingan aktivitas enzim selulase dari bakteri dan kapang hasil isolasi dari rayap. Jurnal Ilmu
Ternak dan Veteriner 8(4): 213-219.
Raghukumar C. 2008. Marine fungal biotechnology: an ecological perspective.
Fungal Diversity 31: 19-35.
Rusdianto AS. 2010. Proses produksi etanol dari ubi kayu dengan daur ulang vinasse sebagai umpan balik proses fermentasi. [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Samsuri M, Gozan M, Mardias R, Baiquni M, Hermansyah H, Wijarnako A, Presetya B, Nasikin M. 2007. Pemanfaatan selulosa bagas untuk produksi etanol melalui sakarifikasi dan fermentasi serentak dengan enzim xylanase. Makara Teknologi 1(11): 17-24.
Sari IM, Noverita, Yulneriwani. 2008. Pemanfaatan jerami padi dan alang-alang dalam fermentasi etanol menggunakan kapang Trichoderma viride dan khamir Saccharomycess cerevisiae. VisVitalis 2 (1): 55-62.
Sari RN, Utomo BSB, Gunawan. 2011. Pemanfaatan selulosa dari limbah hasil ekstraksi alginate rumput laut coklat (Sargassum duplicatum) untuk produksi bioetanol. Prosiding Seminar Nasional Inovasi Teknologi
Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan III,
Schulz B, Boyle C, Draeger S, Römmert AK, Krohn K. 2002. Endophytic fungi: a source of novel biologically active secondary metabolites. Mycol Res.
106(9): 996-1004.
Setyaningsih D, Chasanah E, Utomo BSB, Krismatin, Yudiarto A, Windarwati S. 2011. Produksi bioetanol makroalga melalui teknik sakarifikasi enzimatik, adaptasi ragi, dan co-fermentasi simultan. [Laporan akhir]. Bogor (ID): Institut Pertanian Bogor.
Steel GD, Torrie JH. 1991. Prinsip dan Prosedur Statistika Suatu Pendekatan Biometrik. Edisi II. Jakarta: PT Gramedia Pustaka Utama. 356 hlm. [SNI] Standar Nasional Indonesia. 2008. SNI 0492:2008 Cara uji kadar lignin
metode Klason. Jakarta : Badan Standarisasi Nasional.
[SNI] Standar Nasional Indonesia. 2008. SNI 7390:2008 Bioetanol. Jakarta: Badan Standarisasi Nasional.
[SNI] Standar Nasional Indonesia. 2009. SNI 0444:2009 Pulp-cara uji kadar selulosa alfa, beta dan gamma. Jakarta: Badan Standarisasi Nasional. Subowo YB. 2010. Uji aktivitas enzim selulase dan ligninase dari beberapa jamur
dan potensinya sebagai pendukung pertumbuhan tanaman terong (Solanum
molongena). Berita Biologi 10(1): 1-6.
Syamsu K, Richana N, Budianto A. 2008. Rekayasa bioproses produksi bioetanol dari hidrolisat pati ubi jalar (Ipomoea batatas L) menggunakan
Saccharomyces cerevisiae. [Laporan akhir]. Bogor (ID): Institut Pertanian
Bogor.
Tarman K. 2011. Biological and chemical investigations of Indonesian marine-derived fungi and their secondary metabolites [dissertation]. Germany (DE): University of Greifswald.
28
Lampiran 1 Komposisi media hidrolisis Media untuk produksi Enzim (g/l) KH2PO4 2
Urea 0,3 MgSO4.7H2O 0,3
CaCl2.2H2O 0,3
Komposisi garam Mineral (mg/l): FeSO4.7H2O 5
MnSO4.H2O 1,6
ZnSO4.7H2O 1,4
CoCl2.6H2O 2
Pepton 0,1% Tween 80 0,1% Limbah agar-agar 1,5%
Lampiran 2 Penyiapan starter Saccharomyces cerevisiae
Starter yang digunakan adalah ragi roti dengan merk Fermipan yang ditumbuhkan dalam substrat pertumbuhan. Substrat pertumbuhan terdiri dari konsentrasi gula 10% kemudian ditambahkan 50 gram Fermipan, selanjutnya diinkubasi pada suhu 30 oC selama 8 jam.
Lampiran 3 Analisis ragam Univariate Analysis of Variance penapisan kapang Faktor subyek
N Jenis media Nacl 3% 14
Air laut 14 Air tawar 14 Jenis kapang D1 6
D3 6
RL6 6
RL9 6
EN 6
KT19 6
30
Hasil uji Univariate ANOVA menunjukan bahwa jenis media, jenis isolat kapang, dan interaksi antara jenis media dan kapang memberikan hasil yang berpengaruh signifikan dengan p-value < 5%, artinya terdapat perbedaan antara perlakuan.
Uji lanjut interaksi Jenis*Kapang
Interaksi N
Subset
1 2 3 4 5
NaCL3D1 2 0,0000
AkuadesD3 2 0,7577 AkuadesD1 2 0,8113
Air_lautEN 2 0,9966 0,9966 Air_lautD1 2 1,0000 1,0000 Air_lautRL9 2 1,0000 1,0000 AkuadesRL6 2 1,0000 1,0000 AkuadesRL9 2 1,0000 1,0000
NaCL3RL9 2 1,0635 1,0635 Air_lautKT19 2 1,0735 1,0735 NaCL3EN 2 1,0816 1,0816 NaCL3D3 2 1,0889 1,0889
NaCL3RL6 2 1,1429 1,1429 1,1429 NaCL3SMH 2 1,1770 1,1770 1,1770 Air_lautD3 2 1,2002 1,2002 1,2002 AkuadesKT1
9 2 1,2667 1,2667
Air_lautRL6 2 1,2738 1,2738 AkuadesSMH 2 1,2775 1,2775
NaCL3KT19 2 1,3452
Air_lautSMH 2 1,3500
AkuadesEN 2 1,3589
Sig. 1,000 0,052 0,107 0,089 0,085
32
Lampiran 5 Analisis ragam Univariate Analysis of Variance hidrolisis Dependent Variable: Glukosa
Source Sum of Squares Df Mean Square F Sig. Corrected Model 316726,691(a) 29 10921,610 203,092 0,000 Intercept 1412089,383 1 1412089,383 2,626E4 0,000 Konsentrasi 138934,494 9 15437,166 287,061 0,000 Hari 40639943 2 20319,972 377,859 0,000 Konsentrasi * hari 137152,254 18 7619,570 141,689 0,000 Error 3226,593 60 53,777
Total 1732042,667 90 Corrected Total 319953,284 89 a. R Squared = 0,990 (Adjusted R Squared = 0,985)
Hasil uji Univariate ANOVA menunjukan bahwa penggunaan konsentrasi kapang, waktu hidrolisis (hari) dan interaksi antara konsentrasi dan waktu hidrolisis memberikan hasil yang berpengaruh signifikan terhadap nilai glukosa dengan p-value 0.000 <5%, artinya terdapat perbedaan antara perlakuan.
Lampiran 6 Uji lanjut Duncan pada proses hidrolisis Uji lanjut waktu hidrolisis
Hari N
Subset
1 2 3
9 30 104,63
6 30 116,64
3 30 154,50
Uji lanjut konsentrasi kapang
34
Berdasarkan hasil uji lanjut interaksi antara konsentrasi kapang dengan waktu hidrolisis (hari) menunjukkan bahwa konsentrasi kapang 20% pada waktu hidrolisis 3 hari memiliki nilai rata-rata glukosa tertinggi dan berbeda signifikan dibandingkan yang lainnya.
Lampiran 7 Analisis ANOVA umur kapang terhadap nilai glukosa
Dependent variable: Glukosa berbeda memberikan hasil yang berpengaruh signifikan terhadap nilai glukosa dengan p-value 0.001 <5%, artinya terdapat perbedaan antara perlakuan.
Lampiran 8 Uji lanjut Duncan umur kapang
umur panen N Subset for alpha = 0,05 Means for groups in homogeneous subsets are displayed.
a Uses Harmonic Mean Sample Size = 2.000.