AKTIVITAS ANTIBAKTERI FRAKSI SEMI-MURNI DARI
KAPANG ENDOFIT MANGROVE BAR1.5 DAN PENGARUH
EKSTRAKNYA TERHADAP MORFOLOGI SEL BAKTERI
ALIF KHOLIFATUL JANNAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul aktivitas antibakteri fraksi semi-murni dari kapang endofit mangrove BAR1.5 dan pengaruh ekstraknya terhadap morfologi sel bakteri adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
Alif Kholifatul Jannah
RINGKASAN
ALIF KHOLIFATUL JANNAH. Aktivitas Antibakteri Fraksi Semi-murni dari Kapang Endofit Mangrove BAR1.5 dan Pengaruh Ekstraknya terhadap Morfologi Sel Bakteri. Dibimbing oleh KUSTIARIYAH TARMAN dan DESNIAR.
Tumbuhan mangrove di Indonesia khususnya di Sulawesi Selatan telah banyak dimanfaatkan oleh masyarakat pesisir sebagai sumber obat-obatan. Hampir semua spesies tanaman di dunia termasuk mangrove memiliki satu atau lebih mikroba endofit. Mikroba endofit adalah mikroba yang hidup di dalam jaringan tumbuhan dan mampu membentuk koloni tanpa membahayakan inangnya. Kapang endofit mampu memproduksi senyawa bioaktif yang sama dengan inangnya. Endofit di dalam mangrove sebagai tanaman inangnya yang sangat beranekaragam di Indonesia telah diteliti dalam jumlah yang sedikit. Kapang endofit telah berhasil diisolasi dari daun mangrove R. stylosa di perairan Barru, Sulawesi Selatan yang diberi kode BAR1.5. Ekstrak kasarnya diketahui memiliki aktivitas penghambatan terhadap bakteri B. subtilis. Penemuan tersebut perlu diteliti lebih lanjut terutama mengenai fraksi yang aktif sebagai antibakteri dan pengaruh yang dihasilkan dari ekstrak terhadap morfologi sel bakteri.
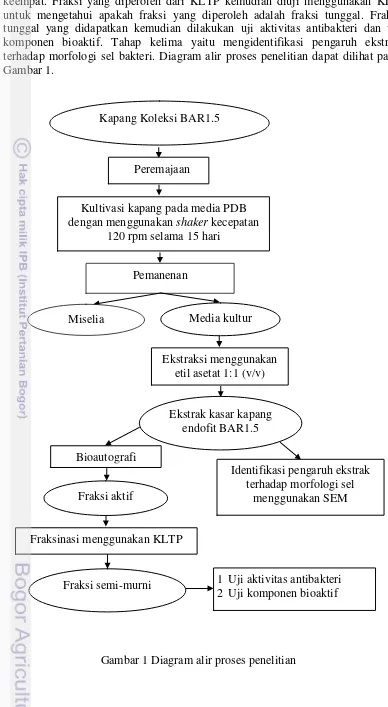
Penelitian ini dilakukan dalam 5 tahap. Tahapan pertama adalah kultivasi kapang endofit mangrove BAR1.5, selanjutnya tahap yang kedua yaitu mengekstrak media kultur kapang. Tahap ketiga, ekstrak yang diperoleh dilakukan uji bioautografi. Hasil bioautografi berupa fraksi aktif. Fraksi yang aktif sebagai antibakteri tersebut dijadikan acuan untuk pengambilan fraksi semi-murni pada KLTP sebagai tahapan yang keempat. Fraksi yang diperoleh dari KLTP kemudian diuji menggunakan KLT untuk mengetahui apakah fraksi yang diperoleh adalah fraksi tunggal. Fraksi tunggal yang didapatkan kemudian dilakukan uji aktivitas antibakteri dan uji komponen bioaktif. Tahap kelima yaitu mengidentifikasi pengaruh ekstrak terhadap morfologi sel bakteri menggunakan SEM.
Fraksi antibakteri dari kapang endofit BAR1.5 dapat diperoleh dengan menggunakan KLTP. Fraksi semi-murni antibakteri yang diperoleh adalah sebanyak tiga fraksi (F1, F2, dan F3). Aktivitas antibakteri F1 dan F2 lebih tinggi dibandingkan dengan ekstrak kasar yang memiliki zona hambat masing-masing 19 mm dan 20 mm terhadap B. subtilis. F3 tidak memiliki aktiviitas antibakteri yang baik dalam bentuk fraksi tunggal. Komponen bioaktif pada F1 adalah flavonoid, F2 polifenol, dan F3 triterpenoid. Senyawa antibakteri dalam kapang endofit BAR1.5 menyebabkan pembengkakan, pengerutan dan lisis pada morfologi sel B. subtilis, sedangkan pada morfologi sel P. aeruginosa menyebabkan pengerutan, sel transparan dan lisis.
SUMMARY
ALIF KHOLIFATUL JANNAH. Antibacterial Activity of semipurified Fraction from Mangrove Endophytic Fungus BAR1.5 and Effects of its Extract on Bacteria Cell Morphology. Supervised by KUSTIARIYAH TARMAN dan DESNIAR.
Mangroves in Indonesia, especially in Southern Sulawesi has been used widely by coastal communities as sources of medicines. Almost all plant species in the world, including mangroves have one or more endophytic microbes. Endophytic microbes are microbes that live inside plant tissues and it is able to form colonie without harming the host. One of the superiority endophytic microbes is its ability producing bioactive compounds that same as its host. Endophytes in mangrove as host plant that very diverse in Indonesia has been explored in a lesser extent. Endophytic fungi of mangrove plant Rhizopora stylosa in Barru waters, South Sulawesi was isolated and coded BAR1.5. Crude extract of endophytic fungus BAR1.5 had antimicrobial activity against Bacillus subtilis. The invention need further study, especially regarding the active fractions as antibacterial and effects of its extract on bacteria cell morphology.
This research had been conducted in five stages. The first step was to cultivate of mangrove endophytic fungi BAR1.5. The second step was to extract the culture broth. The third step was bioautography test of extract. The result of bioautography test was active fraction. The active fraction was used as a reference for obtain antimicrobial fraction at KLTP as the fourth step. The antimicrobial fraction was tested by thin layer cromatography (TLC) and observed under UV light, for confirmation as a single fraction. The single fraction from endophytic fungus BAR1.5 was tested the antimicrobial activity and the bioactive compound. The fifth step was to identify the effects of its extract on bacteria cell morphology by SEM.
The result showed that 3 fractions obtained by P-TLC showed antimicrobial activity. The antimicrobial activity of fractions F1 and F2 were higher than the crude extracts against Gram-positive bacteria. The diameter of inhibitory zone of F1 and F2 were 19 mm and 20 mm respectively. The content of
the bioactive compound in F1, F2 and F3 were flavonoids, polyphenols, and triterpenoids respectively. Antibacterial compounds in endophytic fungi BAR1.5
caused swelling, wrinkle and lysis on B. subtilis cell morphology, however on
P. aeruginosa cell morphology caused wrinkle, transparent and lysis.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
AKTIVITAS ANTIBAKTERI FRAKSI SEMI-MURNI DARI
KAPANG ENDOFIT MANGROVE BAR1.5 DAN PENGARUH
EKSTRAKNYA TERHADAP MORFOLOGI SEL BAKTERI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2014 sampai dengan November 2015 ini ialah penelitian lanjutan dari kapang endofit mangrove BAR1.5 yang potensial, dengan judul Aktivitas Antibakteri Fraksi Semi-Murni dari Kapang Endofit Mangrove BAR1.5 dan Pengaruh Ekstraknya terhadap Morfologi Sel Bakteri.
Terima kasih penulis ucapkan kepada kepada Dr Kustiariyah Tarman S.Pi, M.Si dan Dr Desniar, S.Pi, M.Si selaku dosen pembimbing yang telah banyak membagikan ilmunya serta memberikan saran dan masukan selama penelitian dan penyusunan tesis ini. Ucapan terima kasih penulis sampaikan kepada Dr Ir Wini Trilaksani, M.Sc selaku ketua Program Studi Teknologi Hasil Perairan. Penulis juga menyampaikan terimakasih kepada Prof. Dr. Ir. Linawati Hardjito, MS yang telah bersedia menjadi dosen penguji dalam sidang akhir tesis ini sehingga menambah khazanah keilmuan dan nasehat untuk kebaikan tesis ini, terimakasih juga disampaikan kepada Dr. Ir. Iriani Setyaningsih, MS yang bersedia memberikan masukan dalam penulisan tesis ini.
Terimakasih juga disampaikan kepada Direktorat Jenderal Dikti yang telah memberikan beasiswa selama penulis belajar di pascasarjana IPB, dan kepada LPDP (Lembaga Pengelola Dana Pendidikan) yang telah memberikan beasiswa untuk penelitian tesis. Penulis juga berterimakasih kepada staf pengajar, staf adiministrasi dan staf laboratorium yang telah membantu atas kelancaran penelitian ini. Ungkapan terima kasih penulis sampaikan kepada orang tua penulis Ayahanda Khoirul Anam dan ibu Sri Marliyah, serta seluruh keluarga atas segala doa, motivasi, dan kasih sayang yang telah diberikan, dan juga kepada teman-teman pascasarjana THP 2013 atas semangat yang selama ini selalu membersamai. Dengan segala kerendahan hati, penulis memohon maaf atas segala kekurangan selama pelaksanaan maupun penyusunan tesis. Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2016
DAFTAR ISI
Ekstraksi Media Kultur Kapang Endofit 6
Pengujian bioautografi 6
Fraksinasi menggunakan KLTP 7
Uji aktivitas antibakteri 7
Uji komponen bioaktif 8
Analisis kerusakan sel bakteri menggunakan SEM 8
Analisis Data 8
3 HASIL DAN PEMBAHASAN 9
Fraksi Semi-Murni kapang endofit BAR1.5 9
Fraksi pada KLT 9
Fraksi aktif pada uji bioautografi 10
Fraksi pada KLTP 11
Fraksi tunggal 11
Aktivitas Antibakteri Fraksi Semi-Murni 12
Komponen Bioaktif Fraksi Semi-Murni 15
Komponen F1 15
Komponen F2 16
Komponen F3 18
Pengaruh Ekstrak terhadap Morfologi Sel Bakteri 19 Pengaruh ekstrak terhadap morfologi bakteri B. subtilis 19 Pengaruh ekstrak terhadap morfologi bakteri P. aerogenosa 20
DAFTAR TABEL
1 Aktivitas antibakteri fraksi kapang endofit BAR1.5 14
2 Hasil pengujian komponen bioaktif F1 16
3 Hasil pengujian komponen bioaktif F2 17
4 Hasil pengujian komponen bioaktif F3 18
DAFTAR GAMBAR
1 Diagram alir proses penelitian 5
2 Kromatogram fraksinasi ekstrak pada KLT dan bioautografi 10
3 Kromatograf fraksinasi ekstrak pada KLTP 11
4 Kromatogram fraksi antibakteri 12
5 Hasil uji antibakteri F1, F2, dan F3 13
6 Morfologi sel bakteri B. subtilis pada pengamatan SEM 20
7 Morfologi sel bakteri P. aeruginosa pada pengamatan SEM 21
DAFTAR LAMPIRAN
1 Isolat kapang endofit mangrove BAR1.5 pada media PDA 31
2 Kultur kapang endofit mangrove BAR1.5 pada media PDB 31
3 Ekstrak kasar kapang endofit mangrove BAR1.5 31
4 Data nilai Rf fraksi 32
5 Perolehan fraksi kapang endofit mangrove BAR1.5 dari KLTP 32
11
I
PENDAHULUAN
Latar Belakang
Tumbuhan mangrove di Indonesia merupakan yang terbanyak di dunia, baik dari segi luasan maupun jumlah spesies (Spalding et al. 2001). Ekstrak tumbuhan mangrove telah digunakan berabad-abad oleh masyarakat pesisir untuk mengobati berbagai penyakit (Amudha et al. 2013). Banyak obat-obatan yang berasal dari mangrove untuk menyembuhkan luka, diare, sakit kepala, gigitan ular, penyakit kulit, rematik dan pendarahan (Selvaraj et al. 1995). Masyarakat Indonesia seperti di Sulawesi Selatan memanfaatkan tumbukan daun mangrove (Rhizopora sp.) sebagai obat luka, sedangkan rebusannya sebagai obat diare (Gunawan 2004). Kombinasi kulit, bunga, daun dan akar dari Rhizopora sp. digunakan untuk pengobatan hepatitis (Purnobasuki 2004). Abeysingher et al. (2003) melaporkan bahwa ekstrak mangrove memiliki aktivitas antibakteri yang dapat melawan bakteri patogen Staphylococcus sp. E.coli dan Pseudomonas sp.
Hampir semua spesies tanaman yang ada di bumi memiliki satu atau lebih mikroba endofit (Strobel dan Daisy 2003). Mikroba endofit adalah mikroba yang hidup di dalam jaringan tumbuhan dan mampu membentuk koloni tanpa membahayakan inangnya. Keunggulan mikroba endofit adalah kemampuannya dalam memproduksi senyawa bioaktif yang sama dengan inangnya (Tan dan Zou 2001). Mikroba endofit dapat berupa bakteri atau jamur, tetapi yang lebih banyak dieksplorasi adalah jamur endofit seperti kapang endofit (Sinaga et al. 2009). Jumlah metabolit sekunder yang diproduksi kapang endofit lebih banyak dibandingkan kelas mikroorganisme endofit lain dan telah banyak dilaporkan memproduksi senyawa antibakteri (Schulz et al. 2002), oleh karena itu kapang endofit pada tumbuhan mangrove merupakan sumber antibakteri yang menjanjikan.
Penemuan senyawa antibakteri yang efektif telah banyak dilaporkan dari kapang endofit mangrove yang diisolasi dari perairan luar negeri, sedangkan di Indonesia kapang endofit yang potensial tersebut jarang diteliti. Bharathidsan dan Panneerselvam (2015) melaporkan bahwa ekstrak kapang endofit yang diisolasi dari mangrove di perairan India memiliki aktivitas antibakteri terhadap bakteri patogen Baillus substilis, Enterobacter aerogenes, Enterococcus faecalis Escherichia coli and Klebsiella oxytoca. Bai et al. (2014) mendapatkan senyawa antibakteri flavipesins A dan flavipesins B dari kapang endofit mangrove yang diisolasi dari perairan Cina dengan efektifitasnya dalam melawan bakteri patogen
Staphylococcus aureus dan B. subtilis. Tarman dan dela Cruz (2014) telah berhasil mengisolasi 40 isolat kapang endofit mangrove Rhizopora stylosa dengan kode BAR dari Perairan Indonesia. Kode BAR diambil dari nama tempat pengambilan mangrove yaitu perairan Barru, Sulawesi Selatan. Beberapa jenis kapang endofit BAR dalam laporannya menunjukkan adanya aktivitas antibakteri yang potensial, salah satunya yaitu kapang endofit BAR1.5. Sabiliilaika et al. 2015 melaporkan bahwa ekstrak kasar kapang endofit BAR1.5 memiliki aktivitas antibakteri terhadap B. subtilis.
2
(Collins et al. 1991). Spora B. subtilis tahan terhadap panas dan dapat
bertahan selama pembakaran dengan suhu maksimum 97°C sampai 101°C (Rocken et al. 1995; Rosenkvist et al. 1995). Anggota dari kelompok B. subtilis
dilaporkan menghasilkan zat-zat beracun pada sel mamalia seperti lichenysin A.
(Salkinoja-Salonen et al. 1999). Anggota dari kelompok B. subtilis juga telah dilaporkan menghasilkan peptida beracun ionophoric, amylosin, yang menyebabkan keracunan makanan (Constantin et al. 2008). Bakteri lain yang merugikan adalah Pseudomonas aeruginosa,Breidensein et al. (2011)melaporkan
P. aeruginosa dapat menyebabkan pneumonia, infeksi saluran kemih serta menyebabkan morbiditas dan mortalitas tinggi pada pasien dengan fibrosis kistik karena infeksi kronis yang akhirnya menyebabkan kerusakan paru. Spencer (1993) melaporkann bahwa P. aeruginosa sebagai penyebab infeksi dari mata. Dennis et al. (1980) melaporkan P. aeruginosa merupakan salah satu bakteri penyebab utama kerusakan kornea mata manusia.
Penemuan antibakteri dengan memanfaatkan hasil perairan berupa kapang endofit mangrove terhadap kedua bakteri merugikan tersebut menjadi fokus dalam penelitian ini. Elias et al. (2006) menyatakan produk yang berasal dari mikroorganisme merupakan sumber yang menarik untuk bahan obat sehingga banyak industri yang tertarik dalam penggunaan bioteknologi mikrobial modern, oleh karena itu penelitian lebih lanjut dari ekstrak kasar kapang endofit mangrove BAR1.5 mengenai fraksinasi sangat dibutuhkan untuk memperoleh kelompok senyawa yang berperan sebagai antibakteri.
Penelitian lebih lanjut dari ekstrak kasar tersebut juga diperlukan untuk menentukan bagimana pengaruh ekstrak kapang endofit BAR1.5 terhadap kerusakan morfologi kedua sel bakteri yang merugikan tersebut. Pengaruh antibakteri terhadap pertumbuhan bakteri terdapat berbagai macam, sementara jenis pengaruh ekstrak kapang endofit BAR1.5 terhadap kerusakan sel bakteri belum diketahui. Madigan et al. (2000) menyatakan bahwa senyawa antibakteri mempunyai beberapa efek terhadap sel, diantaranya memberikan efek dengan cara membunuh sel tetapi tidak terjadi lisis atau pecah, tetapi ada yang menyebabkan dinding sel lisis atau pecah. Burt dan Reinders (2003) melaporkan kerusakan dinding sel bakteri akibat interaksi dengan senyawa antibakteri dapat dipelajari dengan SEM (scanning electron microscope).
Perumusan Masalah
3
mengenai fraksi yang aktif sebagai antibakteri dan pengaruh yang dihasilkan dari ekstraknya terhadap morfologi sel bakteri.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mendapatkan fraksi semi murni antibakteri kapang endofit mangrove BAR1.5 dan aktivitasnya serta menentukan pengaruh dari ekstraknya terhadap morfologi sel bakteri.
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi cara mendapatkan fraksi antibakteri dari kapang endofit mangrove BAR1.5 beserta aktivitas antibakteri dan komponen bioaktifnya. Manfaat yang lain yaitu memberikan informasi mengenai pengaruh ekstrak kapang endofit mangrove BAR1.5 terhadap kerusakan sel bakteri. Informasi ini dapat dijadikan sebagai rujukan dalam penelitian selanjutnya. Manfaat penelitian ini juga sebagai informasi bahwa hasil produk perairan berupa mikroba dapat menjadi sumber bahan baku farmasi yang potensial.
Ruang Lingkup Penelitian
4
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Desember 2014 sampai November 2015 bertempat di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; Laboratorium Terpadu, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; Laboratorium Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; Laboratorium Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia, Cibinong.
Bahan dan Alat
Bahan yang digunakan adalah isolat kapang endofit BAR1.5 yang merupakan hasil isolasi dari daun mangrove R. stylosa dari Perairan Barru, Sulawesi Selatan, koleksi Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan. Bahan utama lainnya yaitu Potato Dextrose Agar
(PDA) (BD company), Potato Dextrose Broth (PDB) (BD company), Media
Nutrient Agar (NA) (Oxoid), Nutrient Broth (NB) (Oxoid), dan Mueller Hinton Agar (MHA) (Oxoid), etil asetat, n-heksana, diklorometana, alkohol 70%, akuades, paper dish, pereaksi warna, plat silika gel PF254 (Merck), silica gel bubuk 60 GF 254 (Merck), dan antibiotik kloramfenikol. Bakteri uji yang digunakan yaitu B. subtilis dan P. aeruginosa.
Alat yang digunakan dalam penelitian ini adalah clean bench (Thermo Scientific 1300 Series A2), oven, autoklaf (Yamato SM52), inkubator (Thermolyne type 42000), vacum rotary evaporator, shaker (Heidolph VV2000), vortex (Pasolina type NS-8), pipet mikro (Eppendorf), timbangan digital (Sartorius TE214S), scanning electron microscopy (SEM) (JSM 5000), pisau steril, corong pemisah, kertas saring, kaca kromatografi lapis tipis preparatif, dan alat-alat gelas yaitu cawan petri, gelas ukur, labu Erlenmeyer, pipet volumetrik dan tabung reaksi.
Prosedur Penelitian
5
keempat. Fraksi yang diperoleh dari KLTP kemudian diuji menggunakan KLT untuk mengetahui apakah fraksi yang diperoleh adalah fraksi tunggal. Fraksi tunggal yang didapatkan kemudian dilakukan uji aktivitas antibakteri dan uji komponen bioaktif. Tahap kelima yaitu mengidentifikasi pengaruh ekstrak terhadap morfologi sel bakteri. Diagram alir proses penelitian dapat dilihat pada Gambar 1.
Gambar 1 Diagram alir proses penelitian Ekstraksi menggunakan
etil asetat 1:1 (v/v)
Identifikasi pengaruh ekstrak terhadap morfologi sel
menggunakan SEM
1 Uji aktivitas antibakteri 2 Uji komponen bioaktif Ekstrak kasar kapang
endofit BAR1.5 Kapang Koleksi BAR1.5
Kultivasi kapang pada media PDB dengan menggunakan shaker kecepatan
120 rpm selama 15 hari Peremajaan
Pemanenan
Miselia Media kultur
Fraksinasi menggunakan KLTP
Fraksi semi-murni Bioautografi
6
Kultivasi Kapang Endofit (Srikandace et al. 2007)
Kapang endofit terlebih dahulu dilakukan peremajaan dengan cara memotong kapang koleksi yang telah dikultur di media PDA dan telah disimpan pada suhu 4°C, kemudian dipindahkan ke media PDA baru. Proses tersebut dilakukan dengan steril di dalam clean bench, kemudian diinkubasi pada suhu ruang selama 7 hari. Setelah 7 hari akan dihasilkan kultur kapang yang ditandai dengan pertumbuhan miselium. Isolat yang dihasilkan kemudian siap untuk dikultivasi skala kecil atau prekultur pada media PDB. Isolat kapang endofit mangrove BAR1.5 pada media PDA dapat dilihat pada Lampiran 1.
Kapang endofit yang telah diremajakan di PDA kemudian dilakukan pre kultur dalam media PDB 50 mL dan diinkubasi pada suhu ruang selama 7 hari. Sebanyak 10 mL hasil prekultur dipindahkan ke dalam labu erlenmeyer 500 mL yang berisi 200 mL media PDB untuk kultur masal. Waktu yang digunakan untuk kultur masal yaitu sesuai dengan waktu optimal dalam menghasilkan aktvitas antibakteri terbaik. Sabiliilaika et al. (2015) melaporkan hasil ekstrak yang memiliki aktivitas terbaik yaitu pada hari ke15, oleh karena itu kultur masal kapang endofit BAR1.5 yaitu selama 15 hari. Kultur kapang endofit mangrove BAR1.5 selama 15 hari dapat dilihat pada Lampiran 2.
Semua proses pemindahan baik pre kultur dan kultur masal dilakukan secara steril dalam clean bench, dilakukan dalam keadaan digoyang menggunakan
shaker dengan kecepatan 120 rpm pada suhu ruang. Pemanenan dilakukan dengan cara menggunakan kertas saring untuk memisahkan biomassa dan media kultur. Media kultur yang diperoleh kemudian diekstraksi untuk mendapatkan ekstrak kasar.
Ekstraksi Media Kultur Kapang Endofit (Nursid et al. 2010).
Pertama yang dilakukan yaitu media dievaporasi untuk meminimalisir air yang ada di dalam media kultur (ekstraseluler), kemudian dilakukan ekstraksi secara maserasi menggunakan pelarut etil asetat dengan perbandingan 1:1 (v/v). Proses maserasi dilakukan menggunakan shaker dengan kecepatan 120 rpm selama 15 hari pada suhu ruang. Hasil maserasi akan terlihat antara lapisan etil asetat dan lapisan media kultur, kemudian kedua lapisan tersebut dipisahkan menggunakan corong pisah. Lapisan etil asetat ditampung untuk dikumpulkan, lapisan media kultur dimaserasi kembali dengan menggunakan pelarut dan perbandingan yang sama yaitu etil asetat 1:1 (v/v). Hal tersebut dilakukan sebanyak 3x24 jam.
Lapisan etil asetat yang ditampung kemudian dievaporasi menggunakan
vacum rotary evaporator suhu 45°C untuk menguapkan pelarut yang digunakan. Hasil yang didapatkan dalam bentuk pekatan yang merupakan ekstrak kasar. Perolehan ekstrak kasar dapat dilihat pada Lampiran 3.
Pengujian Bioautografi (Betina 1972)
7
ekstrak kapang endofit BAR1.5 menggunakan eluen terbaik yang telah ditentukan pada penelitian Sabiliilaika et al. (2016) yaitu etil asetat: diklorometana: heksana dengan perbandingan 3:2:1 (v/v/v).
Media MHA steril sebanyak 10 ml dituang ke cawan petri steril kemudian ditunggu hingga memadat, setelah memadat lalu diletakkan plat KLT yang mengandung ekstrak terfraksinasi. Plat KLT yang berada di atas media MHA steril kemudian dituangi media MHA yang berisi bakteri sebanyak 20 µL dengan OD 0.5-0.8. Fraksi aktif dapat ditandai dengan adanya zona bening di sekitar fraksi.
Fraksinasi Menggunakan KLT-Preparatif
Hasil bioautografi tersebut hanya digunakan untuk menentukan fraksi yang memiliki aktivitas antibakteri namun tidak bisa digunakan untuk memperoleh fraksi yang terbentuk. Penelitian ini menggunakan KLT-preparatif untuk memperoleh tiga fraksi yang telah ditentukan. Devmurari et al. (2010) menyatakan bahwa jumlah mikrogram dari campuran komponen organik yang dipisahkan oleh TLC dapat ditingkatkan jumlahnya dalam jumlah miligram (10-50 mg) dengan menggunakan KLTP.
Fraksi dari KLT yang memiliki aktivitas antibakteri selanjutnya diisolasi dengan metode KLT-preparatif menggunakan fase diam silika gel. Prosedur kerja mengacu pada Gritter et al. (1991) yaitu menggunakan KLT-preparatif ukuran 20 x 20 cm2 dengan menggunakan fase diam silika gel PF254, yang telah diaktifkan dengan cara pemanasan selama 1 jam pada suhu 110 oC. Ekstrak kasar ditotol memanjang pada lempeng plat KLT-preparatif kemudian dielusi menggunakan eluen terpilih sebagai fase gerak. Pita-pita yang terbentuk diamati dengan sinar UV 254 nm atau 366 nm. Pengambilan fraksi hasil KLT-preparatif dengan cara dikerik dan hasilnya dilarutkan dengan pelarut awal ekstrak yaitu etil asetat, kemudian dikeringkan. Fraksi yang terpilih dikumpulkan kemudian diuji menggunakan KLT dan dilihat di bawah UV, untuk mengkonfirmasi bahwa fraksi antibakteri yang didapatkan adalah fraksi tunggal. Fraksi tunggal yang diperoleh merupakan fraksi semi-murni yang kemudian dilakukan pengujian aktivitas antibakteri.
Uji Aktivitas Antibakteri
Uji aktivitas antibakteri fraksi semi-murni dilakukan terhadap bakteri
P.aurogenosa dan B.subtilis. Uji dilakukan dengan menggunakan metode disc diffusion dengan mengacu Qaralleh et al. (2010) yaitu pertama yang dilakukan adalah bakteri uji dikultur di media NA dengan inkubasi selama 24 jam pada suhu 37°C. Bakteri yang telah dikultur kemudian disuspensikan ke dalam media NB steril dan diinkubasi selama 24 jam dengan suhu 37°C. Sebanyak 20 µL NB yang berisi bakteri uji dengan OD berkisar 0.5-0.8 dimasukkan ke dalam 20 mL media MHA steril. Proses selanjutnya yaitu dihomogenisasi menggunakan vortex, dituang ke dalam cawan petri steril, ditunggu hingga memadat. Paper disc steril disiapkan kemudian diberi senyawa antibakteri sebanyak 1 mg/disc .
Konsentrasi yang digunakan berdasarkan Saad et al. (2012); Kowti et al.
8
senyawa yang masih campuran atau belum murni yaitu dengan konsentrasi 1.0 sampai 1.5 mg/disc.
Penelitian ini menggunakan fraksi yang masih mengandung campuran atau semi-murni sehingga dalam penelitian ini dipilih konsentrasi 1 mg/disc. Kontrol positif yang digunakan yaitu antibiotik kloramfenikol dengan konsentrasi 30 µg/disc dan kontrol negatif yaitu etil asetat. Paper disc yang telah diberi perlakuan kemudian diletakkan di atas media MHA yang telah memadat, kemudian diinkubasi pada suhu 37oC selama 24 jam. Pengukuran diameter zona hambat yang terbentuk di sekeliling paper disc dilakukan dengan cara mengurangi diameter zona hambat yang terbentuk dengan diameter paper disc (6 mm).
Uji Komponen Bioaktif (Wagner 1996)
Pengujian polifenol dilakukan dengan menggunakan pereaksi semprot FeCl3. Pereaksi FeCl3 dibuat dengan cara melarutkan 0.1 gram FeCl3 ke dalam 10 mL akuades. Pereaksi ini kemudian siap untuk disemprotkan ke KLT yang mengandung fraksi. Kandungan fraksi dinyatakan positif mengandung polifenol jika terbentuk warna hitam. Pereaksi semprot lain yang digunakan yaitu pereaksi anisaldehid asam sulfat untuk mendeteksi senyawa terpenoid. Hasil positif apabila terdapat noda berwarna ungu-merah atau ungu. Uap amonia digunakan untuk mendeteksi senyawa flavonoid, hasil positif dapat ditunjukkan dengan adanya noda warna kuning atau orange kecoklatan.
Analisis Kerusakan Sel Bakteri Menggunakan SEM
Pengamatan dengan SEM dilakukan untuk mempelajari pola perubahan morfologi dan struktur sel bakteri patogen B. subtilis dan P. aeruginosa akibat dari pemberian ekstrak kapang endofit BAR1.5. Pengamatan ini mengacu pada Jeol (1995) yaitu suspensi bakteri uji dikontakkan dengan ekstrak selama 4 jam. Suspensi bakteri dilakukan proses sentrifugasi dengan kecepatan 3500 rpm selama 20 menit, cairan dibuang untuk mendapatkan masa sel bakteri berupa pellet, selanjutnya pellet dicuci dengan buffer sebanyak 2 kali.
Pelet direndam dengan glutaraldehid 2% selama semalam, lalu ditambahkan chocodylate buffer, dan direndam selama 20 menit. Larutan uji dilakukan proses sentrifugasi dan supernatan dipisahkan. Pelet ditambahkan osmium tetraoksida 1% dan direndam selama 1 jam, selanjutnya dikeringkan dengan alkohol berturut turut 70%, 80%, 95% dan alkohol absolut masing masing selama 20 menit. Pellet disuspensikan dengan penambahan butanol, kemudian suspensi diletakkan diatas cover slip yang telah mengering kemudian dilapisi dengan emas melalui proses vakum selama 20 menit dan diamati dengan SEM perbesaran 5000x.
Analisis Data
9
3 HASIL DAN PEMBAHASAN
Fraksi Semi-Murni Kapang Endofit BAR1.5
Fraksi antibakteri kapang endofit BAR1.5 diperoleh dengan uji bioautografi terlebih dahulu. Pengujian dilakukan untuk menentukan fraksi yang aktif sebagai antibakteri. Pengujian bioautografi membutuhkan proses fraksinasi ekstrak kasar pada KLT. Nilai Rf yang dihasilkan pada KLT untuk uji bioautogrfi penelitian ini dicocokan dengan nilai Rf fraksi pada KLT di penelitian sebelumnya. Pencocokan hasil nilai Rf pada penelitian ini dengan penelitian sebelumnya dilakukan untuk mengkonfirmasi kebenaran fraksi yang dihasilkan. Ketentuan Fraksi aktif yang dihasilkan pada uji bioautografi menjadi pedoman untuk pengambilan fraksi di KLTP sebagai fraksi semi murni antibakteri.
Fraksi pada KLT
Fraksinasi ekstrak kasar kapang endofit pada KLT dilakukan karena pada pengujian bioautografi dibutuhkan KLT yang sudah mengandung ekstrak terfraksinasi. Fraksinasi pada KLT dalam penelitian ini menghasilkan 7 fraksi. Nilai Rf yang dihasilkan dari bawah ke atas yaitu 0.27; 0.35; 0.56; 0.60; 0.85; 0.89; 0.94 (Gambar 2A). Perhitungan nilai Rf dapat dilihat pada Lampiran 4. Jumlah fraksi yang sama yaitu sebanyak 7 dan nilai Rf yang tidak jauh berbeda dari penelitian sebelumnya Sabiliilaika et al. (2015) yaitu dari bawah ke atas 0.27; 0.32; 0.54; 0.58; 0.86; 0.90; 0.96. Hasil tersebut menunjukkan bahwa fraksinasi pada KLT yang dilakukan dalam penelitian ini adalah benar.
Fraksi Aktif pada Uji Bioautografi
Fraksi aktif dari hasil uji bioautografi yaitu ditandai dengan adanya zona penghambatan di sekitar fraksi. Hasil bioautografi dapat dilihat pada (Gambar 2B). Zona penghambatan yang dihasilkan yaitu sebanyak 3, seperti yang ditunjukkan dengan panah merah. Tiga zona penghambatan tersebut terbentuk pada fraksi yang memiliki ciri-ciri yaitu fraksi pertama (F1) merupakan fraksi urutan pertama dari bawah yang memiliki warna merah. Fraksi kedua (F2) adalah fraksi urutan kedua yang berwarna orange. Fraksi ketiga (F3) yaitu fraksi urutan kelima yang berwarna kuning.
Urutan susunan fraksi yang terpisah dari bawah ke atas menunjukkan tingkat kepolaritasan dari senyawa yang ada di dalam fraksi. Hasil penelitian ini menunjukkan bahwa urutan fraksi berdasarkan tingkat polaritasnya dari polar ke nonpolar adalah F1, F2, kemudian F3. Spangenberg et al. (2011) menyatakan bahwa suatu pelarut yang bersifat relatif polar dapat membuat pelarut yang tidak
polar menjauh dari ikatannya dengan silica gel. Prinsipnya yaitu berdasarkan “like dissolved like”, semakin dekat kepolaran antara senyawa dengan eluen maka
10
Gambar 2 Kromatogram fraksinasi ekstrak kapang endofit mangrove BAR1.5 etil asetat: diklorometana: heksana (3:2:1) (A) pada KLT di bawah sinar UV 254 nm, (B) hasil uji bioautografi terhadap B. subtilis
Fraksi pada KLTP
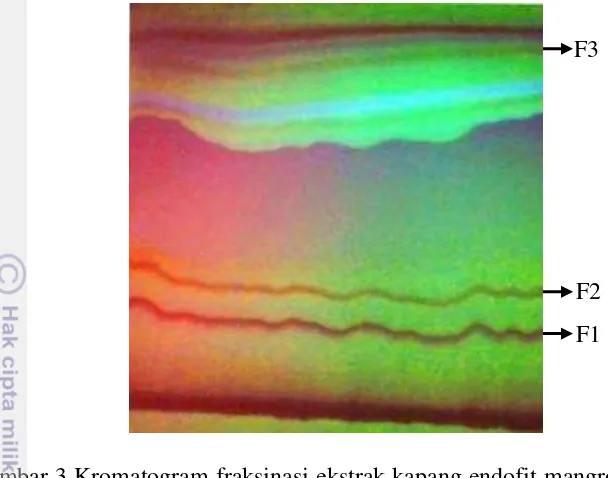
Hasil bioautografi hanya digunakan untuk menentukan fraksi yang memiliki aktivitas antibakteri namun tidak bisa digunakan untuk mengambil fraksi yang terdeteksi antibakteri. Ciri-ciri warna dan urutan fraksi pada F1, F2, dan F3 menjadi ketentuan untuk pengambilan fraksi. Penelitian ini menggunakan KLTP untuk mengambil tiga fraksi yang telah ditentukan. Hasil KLTP pada penelitian ini dapat dilihat pada Gambar 3. Kromatogram dari KLTP menunjukkan bahwa terdapat 7 fraksi dari hasil elusidasi etil asetat: diklorometana: n-heksana (3:2:1). Tujuh fraksi tersebut sesuai dengan jumlah fraksi pada KLT. Tiga fraksi (F1, F2, dan F3) dengan ciri-ciri yang telah ditentukan pada penentuan fraksi aktif juga muncul pada KLTP. Kromatogram KLTP menunjukkan bahwa F1 adalah urutan fraksi pertama dari bawah yang memiliki warna merah. F2 adalah urutan fraksi kedua yang memiiki warna orange. Fraksi 3 (F3) adalah urutan fraksi kelima yang memiliki warna kuning.
Tiga fraksi tersebut berdasarkan urutan dan warna fraksi sesuai dengan ketentuan 3 fraksi aktif hasil dari uji bioautografi. Hasil tersebut menunjukkan bahwa untuk memperoleh 3 fraksi aktif antibakteri dari kapang endofit mangrove BAR1.5 dapat dilakukan dengan menggunakan KLTP. Perolehan tiga fraksi antibakteri kapang endofit mangrove BAR1.5 dapat dilihat pada Lampiran 5. Rendemen terbanyak yaitu pada F1 sebesar 25%, nilai rendemen pada F2 dan F3 masing-masing memiliki nilai rendemen sebesar 20%. Hasil ini menunjukkan bahwa ekstrak kasar sebesar 100 mg dapat menghasilkan fraksi antibakteri sekitar 20-25%. Perhitungan nilai rendemen dapat dilihat pada Lampiran 6.
11
Gambar 3 Kromatogram fraksinasi ekstrak kapang endofit mangrove BAR1.5 etil asetat: diklorometana: heksana (3:2:1) pada KLTP di bawah sinar UV 254 nm
Noda fraksi yang diperoleh terlihat nyata perbedaan warna di setiap fraksinya. Hal tersebut menandakan bahwa komponen yang ada di dalam setiap fraksi memiliki fungsi bioaktif yang berbeda. Tujuh fraksi yang dihasilkan tidak semua memiliki senyawa bioaktif sebagai antibakteri, melainkan terdapat 3 fraksi yang aktif sebagai antibakteri. Hasil yang sama juga dilaporkan oleh Sugijanto et al. (2014) dari 17 fraksi yang didapatkan pada pemisahan ekstrak etil asetat endofit AgOt hanya 5 fraksi yang aktif sebagai antibakteri.
Fraksi Tunggal
Tiga fraksi antibakteri yang ditunjukkan pada KLTP walaupun sudah sesuai dengan ketentuan fraksi aktif yang dituju, tetapi perlu dilakukan pengujian kembali. Sarker et al. (2006) menyatakan bahwa untuk mendapatkan komponen tunggal dari pemisahan ekstrak kasar sangat sulit untuk dilakukan, sehingga dibutuhkan fraksinasi komponen dari persamaan polaritasnya, oleh karena itu pada penelitian ini walaupun telah dilakukan fraksinasi dari persamaan polaritasnya, fraksi yang diperoleh dari KLTP tetap diuji untuk memastikan bahwa fraksi yang diperoleh adalah fraksi tunggal. Fraksi yang tidak tunggal atau tercampur fraksi lain sangat dapat dimungkinkan terjadi pada saat proses pengambilan di KLTP terutama pada antar fraksi yang memiiki jarak berdekatan.
Pengujian fraksi tunggal dilakukan di KLT. Hasil pengujian fraksi tunggal terhadap 3 fraksi antibakteri dalam penelitian ini dapat dilihat pada Gambar 4. Tiga fraksi antibakteri pada KLT yang diamati di bawah UV 366 nm memperlihatkan adanya satu noda tunggal di setiap fraksi yang dujikan. Sapar et al. (2004) menyatakan bahwa KLT dilakukan untuk memastikan bahwa fraksi tunggal yang diperoleh ditunjukkan dengan adanya satu noda tunggal yang terlihat di bawah UV.
12
Gambar 4 Kromatogram fraksi antibakteri isolat kapang endofit BAR1.5 (A) F1, (B) F2, (C) F3
Noda tunggal yang ditunjukkan pada KLT dalam penelitian ini juga berada di sekitar nilai Rf hasil fraksinasi di KLT. F1 pada Rf 0,25; F2 pada Rf 0,35 dan F3 pada Rf 0,85. Nilai Rf pada hasil fraksinasi di KLT dapat dijadikan landasan tepat tidaknya fraksi tunggal yang diperoleh. Hal tersebut dikarenakan jenis eluen, ketebalan, kerapatan lapisan penyerap atau jenis plat silica gel yang digunakan sama. Nilai Rf pada F1 dan F2 fraksi tunggal tidak sama persis dengan nilai Rf F1 (0,27), dan F2 (0,34) pada hasil fraksinasi. Hal tersebut dimungkinkan karena jumlah totolan yang diberikan sedikit berbeda. Perbedan nilai Rf tersebut tidak memiliki rentang yang jauh, karenanya dapat dipastikan bahwa fraksi yang diperoleh pada penelitian ini bukan hanya tunggal tetapi juga fraksi aktif yang tepat dituju. Touchstone (1992) menyatakan bahwa faktor-faktor yang mempengaruhi nilai Rf pada KLT yaitu kerapatan lapisan penyerap, sifat penyerap atau jenis silica gel, kemurnian eluen, struktur kimia senyawa, ditambahkan Sastrohamidjojo (1991) faktor lain yang mempengaruhi adalah derajat kejenuhan sampel dan jumlah sampel yang digunakan.
Aktivitas Atibakteri Fraksi Semi-Murni
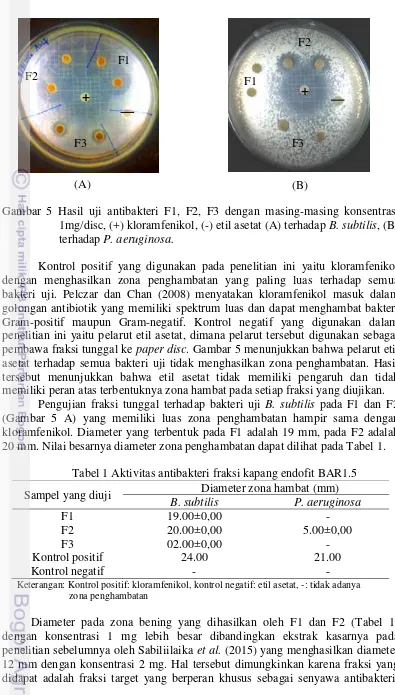
Pengujian aktivitas antibakteri dilakukan pada semua fraksi yang telah diperoleh (F1, F2, dan F3) terhadap B. subtiilis, P. aeruginosa. Hasil uji aktivitas antibakteri 3 fraksi kapang endofit BAR1.5 menggunakan metode paper disk diffusion dengan konsentrasi 1 mg (Gambar 5). Hasil uji aktivitas antibakteri terhadap B. subtiilis menunjukkan adanya zona bening yang lebih besar dibandingkan dengan zona bening yang terbentuk pada bakteri uji P. aeruginosa. Hal tersebut menunujukkan bahwa aktivitas penghambatan terhadap B. subtiilis
lebih besar daripada P. aeruginosa.
(A) (B) (C)
F1 Rf 0,25
F2 Rf 0,35
13
Gambar 5 Hasil uji antibakteri F1, F2, F3 dengan masing-masing konsentrasi 1mg/disc, (+) kloramfenikol, (-) etil asetat (A) terhadap B. subtilis, (B) terhadap P. aeruginosa.
Kontrol positif yang digunakan pada penelitian ini yaitu kloramfenikol dengan menghasilkan zona penghambatan yang paling luas terhadap semua bakteri uji. Pelczar dan Chan (2008) menyatakan kloramfenikol masuk dalam golongan antibiotik yang memiliki spektrum luas dan dapat menghambat bakteri Gram-positif maupun Gram-negatif. Kontrol negatif yang digunakan dalam penelitian ini yaitu pelarut etil asetat, dimana pelarut tersebut digunakan sebagai pembawa fraksi tunggal ke paper disc. Gambar 5 menunjukkan bahwa pelarut etil asetat terhadap semua bakteri uji tidak menghasilkan zona penghambatan. Hasil tersebut menunjukkan bahwa etil asetat tidak memiliki pengaruh dan tidak memiliki peran atas terbentuknya zona hambat pada setiap fraksi yang diujikan.
Pengujian fraksi tunggal terhadap bakteri uji B. subtilis pada F1 dan F2 (Gambar 5 A) yang memiliki luas zona penghambatan hampir sama dengan kloramfenikol. Diameter yang terbentuk pada F1 adalah 19 mm, pada F2 adalah 20 mm. Nilai besarnya diameter zona penghambatan dapat dilihat pada Tabel 1.
Tabel 1 Aktivitas antibakteri fraksi kapang endofit BAR1.5 Sampel yang diuji Diameter zona hambat (mm)
B. subtilis P. aeruginosa
Keterangan: Kontrol positif: kloramfenikol, kontrol negatif: etil asetat, -: tidak adanya zona penghambatan
Diameter pada zona bening yang dihasilkan oleh F1 dan F2 (Tabel 1) dengan konsentrasi 1 mg lebih besar dibandingkan ekstrak kasarnya pada penelitian sebelumnya oleh Sabiliilaika et al. (2015) yang menghasilkan diameter 12 mm dengan konsentrasi 2 mg. Hal tersebut dimungkinkan karena fraksi yang didapat adalah fraksi target yang berperan khusus sebagai senyawa antibakteri.
14
Senyawa di dalam fraksi tersebut semakin besar aktivitasnya ketika berperan sendiri karena tidak bersinergi dengan senyawa yang ada di dalam fraksi lain yang belum tentu memiliki aktivitas antibakteri. Hasil penelitian ini menunjukkan bahwa senyawa antibakteri di dalam F1 dan F2 lebih besar aktivitasnya dalam bentuk fraksi tunggal, sehingga berpeluang untuk dimurnikan. Beberapa penelitian juga telah melaporkan bahwa dengan dimurnikannya senyawa antibakteri yang terkandung dalam bahan alami, maka akan semakin besar efektifitasnya. Komponen atau golongan senyawa apa yang ada di dalam fraksi tunggal tersebut menjadi sangat penting untuk diketahui.
Silva et al. (2013) mengisolasi senyawa murni antibakteri dari kapang endofit mangrove Paecilomyces variotii yaitu senyawa viriditoxin dengan spektrum yang sangat luas. Konsentrasi terendah untuk menghambat S. aureus
yang resisten methicilin adalah 0,5 μg/mL dan 2 μg/mL untuk menghambat
Enterococcus sp. yang resisten vancomicine. Hussain et al. (2015) melaporkan pada pencarian komponen fitokimia dari kapang endofit Phoma sp. diperoleh senyawa murni atrovenetione dan sclerodione. Senyawa tersebut menghasilkan aktivitas antijamur dengan diameter zona hambat sebesar 15 mm dengan konsentrasi minimal 10 mg/mL. Jouda et al. (2014) telah menemukan tiga senyawa baru yang spesifik dengan aktivitas antibakteri yang kuat pada
konsentrasi minimal 10 μg/mL dan 5 μg/mL.
Fraksi tunggal pada F3 memiliki aktivitas yang lebih rendah dibandingkan dengan ekstrak kasar. Hal tersebut dimungkinkan karena F3 memiliki jarak yang sangat dekat dengan fraksi lain, dimana fraksi lain di sekitar F3 tidak ikut diisolasi. F3 yang diisolasi menjadi fraksi tunggal dimungkinkan kehilangan sinergitas dengan senyawa lain, sehingga mengakibatkan luas daya hambatnya lebih rendah. Senyawa antibakteri di dalam F3 dimungkinkan akan lebih kuat aktivitas antibakterinya apabila bersinergi dengan senyawa yang ada di dalam fraksi terdekatnya.
Aires et al. (2009) melaporkan bahwa hidrolisis glucosinolate memiliki aktivitas antibakteri yang signifikan dalam melawan bakteri Gram-positif, bakteri Gram-negatif dan jamur karena pengaruh sinergitas dari kombinasi komponen lain. Tafesh et al. (2011) juga telah melaporkan kombinasi dari komponen fenolik dapat membuat pengaruh antibakteri dalam sinergitas yang berkontribusi untuk membuat reaksi antibakteri lebih baik dibandingkan dengan reaksi dari komponen tunggal. Paiva et al. (2010) telah menyatakan sejumlah publikasi walaupun telah difokuskan pada isolasi dan identifikasi bioaktif, namun senyawa tunggal yang didapatkan mungkin tidak bertanggung jawab atas aktivitas yang diamati, tetapi dapat disebabkan karena kombinasi dari senyawa yang berinteraksi secara sinergis atau aditif.
Hasil tiga fraksi semi-murni antibakteri yang didapatkan dari penelitian ini menunjukkan bahwa F1 dan F2 memiliki aktivitas antibakteri yang lebih besar dibanding ekstrak kasarnya terhadap B. subtilis. Fraksi 3 (F3) memiliki aktivitas antibakteri yang lebih rendah dibanding ekstrak kasarnya.
15
B. subtilis. Kapang endofit BAR1.5 diduga memiliki senyawa antibakteri yang aktif berperan dalam menghambat bakteri B. subtilis yang merupakan bakteri Gram-positif. Paiva et al. (2010) menjelaskan bahwa sensitivitas bakteri terkait dengan tingkatan lapisan luar peptidoglikan. Arias et al. (2004) menyatakan bahwa bakteri Gram-positif memiliki satu lapisan luar peptidoglikan yang bukan merupakan penghalang permeabilitas yang efektif. Hal tersebut membuat bakteri Gram-positif lebih rentan daripada bakteri Gram-negatif. Bakteri Gram-negatif memiliki lapisan luar yang lebih dari satu, seperti membran fosfolipid, komponen lipopolisakarida dan protein. Lapisan luar tersebut merupakan penghalang yang selektif.
Faktor lain yang dimungkinkan berpengaruh pada besarnya aktivitas antibakteri terhadap B. subtilis yaitu karena komponen bioaktif yang bertanggung jawab sebagai antibakteri. Senyawa bioaktif yang paling berperan sebagai antibakteri di dalam kapang endofit BAR1.5 adalah senyawa bioaktif yang ada di dalam F1 dan F2, karena kedua fraksi tersebut memiliki zona penghambatan paling besar dibanding fraksi lain dan ektrak kasarnya. Campos et al. (2009) telah melaporkan bahwa kerusakan membran sel bakteri asam laktat karena adanya pengaruh komponen bioaktif asam fenolik. Rauha et al. (2000) juga melaporkan bahwa kandungan bioaktif flavonoid yang ada di dalam ekstrak tanaman bilberry dapat menghambat semua bakteri uji positif sedangkan pada bakteri Gram-negatif tidak ada aktivitas penghambatan.
Komponen Bioaktif Fraksi Semi-Murni
Komponen bioaktif yang terdekteksi pada ketiga fraksi memiliki komponen bioaktif dari golongan senyawa yang berbeda-beda. Perbedaan komponen bioaktif tersebut dimungkinkan sebagai salah satu faktor yang ikut berperan dalam perbedaan aktivitas antibakteri dari setiap fraksi yang dihasilkan, dan juga akan mempengaruhi penghambatannya secara morfologi. Sabiliilaika et al. (2015) melaporkan bahwa dari hasil uji fitokimia, diduga senyawa yang paling dominan dalam ekstrak kasar kapang endofit mangrove BAR1.5 adalah terpenoid, polifenol dan flavonoid.
Komponen F1
16
Tabel 2. Hasil pengujian komponen bioaktif F1
Jenis Fraksi Flavonoid Polifenol Triterpenoid
F1
Keterangan: + : menunjukkan positif adanya komponen bioaktif uji, - : menunjukkan tidak adanya komponen bioaktif uji.
Keberadaan flavonoid pada F1 semakin dikuatkan dengan hubungan letak kenampakkan noda yang berada di daerah bawah pada KLT. Noda kuning-orange berada pada Rf 0,26, dimana nilai Rf tersebut berada di sekitar ketentuan nilai Rf F1. Letak munculnya noda tersebut menegaskan bahwa flavonoid yang dihasilkan bukan hanya saja positif keberadaanya, tetapi juga tepat milik F1. Terdeteksinya letak noda kunig-orange pada KLT yang berada di bawah juga menunjukkan bahwa komponen bioaktif yang terdeteksi harus polar. Spangenberg et al. (2011) menyatakan bahwa senyawa polar pada KLT memiliki Rf yang dekat dengan angka 0 atau bercak yang ditampakkan pada KLT berada di daerah bawah. Rijke (2005) melaporkan bahwa flavonoid merupakan senyawa polar karena memiliki sejumlah gugus hidroksil yang tidak tersubtitusi.
Flavonoid merupakan zat fitokimia yang paling besar ditemukan di jaringan tanaman (Carlo et al. 1999). Banyak kajian yang telah melaporkan bahwa adanya aktivitas antibakteri karena ketersediaan senyawa flavonoid dalam suatu ekstrak (Xu dan lee 2001; Ogundipe et al. 2001), bahkan flavonoid dalam kandungaan antibakteri dari Ouratea sulcata dilaporkan aktif dalam melawan S. aureus, B. subtilis, Vibrio anguillarium dan E. coli yang keefektifannya hampir sama dengan standar antibiotik streptomycin (Souza et al. 2010).
Komponen flavonoid dari suatu ekstrak tanaman tertentu juga telah dilaporkan sebagai bioaktif yang paling mendominasi dalam aktivitas antibakteri melawan bakteri Gram-positif dibandingkan pada bakteri Gram-negatif (Contini et al. 2003). Flavonoid dalam mekanisme antibakteri dilaporkan sebagai penyebab terganggunya integeritas dinding sel dan membran sel bakteri (Jalil dan Ismail 2008). Penelitian lain yang mengisolasi flavonoid dari tanaman obat juga melaporkan bahwa kandungan flavonoid efektif sebagai antibakteri dengan mekanisme merusak fungsi membran atau dinding sel bakteri (Sohn et al. 2004). Komponen F2
Fraksi 2 (F2) menampakkan adanya noda hitam setelah dilakukan penyemprotan FeCl3 yang menunjukkan positif terdapat kandungan polifenol.
17
Hasil pengujian yang lain yaitu pada flavonoid tidak ditemukan adanya noda kuning atau orange, sedangkan pada pengujian triterpenoid tidak ditemukan adanya noda biru atau ungu. Hal tersebut menunjukkan bahwa pada F2 dimungkinkan hanya memiliki satu jenis komponen bioaktif yaitu dari golongan senyawa polifenol. Hasil pengujian komponen bioaktif F2 dapat dilihat pada Tabel 3.
Tabel 3. Hasil pengujian komponen bioaktif F2
Jenis Fraksi Flavonoid Polifenol Triterpenoid
F2
Keterangan: + : menunjukkan positif adanya komponen bioaktif uji, - : menunjukkan tidak adanya komponen bioaktif uji.
Polifenol yang ditunjukkan adalah benar komponen bioaktif yang ada pada F2 bukan pada fraksi lain. Indikator hal tersebut adalah noda polifenol yang ditampakkan berada pada daerah sekitar nilai ketentuan Rf F2 yaitu 0,37. Hasil ini menunjukkan bahwa kandungan komponen bioaktif yang berperan sebagai
antibakteri pada F2, dengan zona penghambatan terluas terhadap bakteri
B. subtilis (Gram-positif) adalah dari golongan polifenol. Taguri et al. (2006) melaporkan bahwa potensi polifenol sebagai antibakteri tergantung pada jenis bakteri, polifenol yang diperoleh aktif dalam melawan bakteri Gram-positif
S. aureus yang resisten metichilin dan penicilin, sementara terhadap bakteri Gram-negatif E. coli ATCC 25922 tidak aktif. Penelitian lain Koech et al. (2013) menyebutkan bahwa sifat polifenol yang kurang efektif dalam melawan bakteri Gram-negatif disebabkan rendahnya daya tarik menarik antara polifenol dengan lipopolisakarida yang menjadi salah satu komponen utama bakteri Gram-negatif yang tidak dimiliki oleh bakteri Gram-positif.
Polifenol merupakan metabolit sekunder yang memegang peranan penting sebagai pertahanan terhadap tanaman patogen dan hewan herbivora agresif serta sebagai respon terhadap berbagai kondisi stres abiotik. Secara umum polifenol dibagi dalam flavonoid dan nonflavonoid, namun kelompok terbesarnya yaitu flavonoid (Daglia, 2012). Data penelitian ini menunjukkan bahwa zona penghambatan terluas yaitu pada F1 sebesar 19 mm dan F2 sebesar 20 mm terhadap B.subtilis, dimana terlihat bahwa perbedaan nilai zona hambat yang tidak terlalu besar diantara keduanya dimungkinkan karena F1 yang terdeteksi flavonoid merupakan salah satu jenis kelompok dari senyawa polifenol. Hal
+
18
tersebut menjadi petunjuk dalam hasil penelitian ini, bahwa komponen bioaktif dari kapang endofit mangrove BAR1.5 yang paling berperan sebagai antibakteri yaitu dari golongan polifenol.
Komponen F3
Fraksi 3 (F3) menunjukkan positif triterpenoid dengan adanya noda warna ungu kebiruan setelah dialakukan penyemprotan anisaldehid asam sulfat. Hasil pengujian komponen F3 dapat dilihat pada Tabel 4.
Tabel 4. Hasil pengujian komponen bioaktif F3 Jenis Fraksi Flavonoid Polifenol Triterpenoid
F3
Keterangan: + : menunjukkan positif adanya komponen bioaktif uji, - : menunjukkan tidak adanya komponen bioaktif uji.
Triterpenoid yang dihasilkan tepat ada di F3 dengan indikator ketentuan nilai Rf F3 yaitu 0,85. Fraksi 3 juga dimungkinkan memiliki satu jenis komponen bioaktif yang berasal dari golongan senyawa triterpenoid. Hal tersebut dikarenakan tidak adanya komponen bioaktif yang lain seperti flavonoid dan polifenol. Noda yang menunjukkan komponen bioaktif pada F3 adalah triterpenoid, juga diperkuat dengan letak noda pada KLT yang berada di atas. Noda yang berada di atas menunjukkan bahwa senyawa yang membentuk noda tersebut adalah senyawa non polar. Harborne (1987) menyatakan bahwa senyawa triterpenoid dapat dibagi menjadi empat golongan yaitu triterpen, saponin, glikosida jantung, dan steroid. Firdiyani et al. (2015)melaporkan bahwa hasil uji steroid menunjukkan hasil positif ditandai dengan adanya perubahan menjadi ungu. Steroid merupakan senyawa bioaktif yang tergolong non polar.
Koch el al. (2003); Basyuni et al. (2007) menyatakan bahwa mangrove terkenal kaya sebagai sumber senyawa triterpenoid. Widiyaiti (2006) melaporkan bahwa triterpenoid pada tumbuhan memiliki peran ekologi karena dapat bekerja sebagai antifungus, insektisida, antipemangsa, antibakteri dan antivirus. Oku et al. (2003) juga melaporkan bahwa triterpenoid memainkan peran penting dalam melindungi mangrove dari faktor salinitas garam yang mengancam. Hasil penelitian dari Nassar et al. (2010) bahwa senyawa golongan triterpenoid
+
19
menunjukkan aktivitas farmakologi yang signifikan, seperti antiviral, antibakteri, antiinflamasi, sebagai inhibisi terhadap sintesis kolestrol dan sebagai antikanker.
Fraksi 3 memiliki aktivitas yang rendah pada hasil penelitian ini. Hal tersebut selain dikarenakan tidak adanya efek sinergi, juga dapat dimungkinkan karena keberadaan triterpenoid dalam kapang endofit mangrove BAR1.5 memiliki fungsi biologis lain yang bukan sebagai antibakteri. Penelitian Bandaranayake (2002) melaporkan bahwa keberadaan triterpenoid dalam mangrove Clerodendron inerm tidak memiliki aktivitas antibakteri tetapi efektif sebagai antivirus. Kokpol et al. (1986) juga menyatakan bahwa triterpenoid yang diisolasi dari mangrove Acanthus illicifolius memiliki aktivitas antileukimia yang efektif.
Pengaruh Ekstrak terhadap Morfologi Sel Bakteri
Hasil penelitan ini menunjukkan bahwa pemberian ekstrak kapang endofit
BAR1.5 dengan konsentrasi 1mg terhadap bakteri B. subtilis dan bakteri
P. aerogenosa terlihat adanya kerusakan pada dinding sel dengan ditandainya sel yang lisis atau pecah. Madigan et al. (2000) menyatakan bahwa senyawa antibakteri mempunyai beberapa macam efek terhadap pertumbuhan bakteri, diantaranya memberikan efek dengan cara membunuh sel tetapi tidak terjadi lisis atau pecah, tetapi ada yang menyebabkan sel lisis atau pecah.
Pengaruh Ekstrak terhadap Morfologi Bakteri B. subtilis
Sel bakteri B. subtilis (Gram-positif) normal terlihat memiliki permukaan sel yang rata (Gambar 6 A). Permukaan sel bakteri mengalami perubahan setelah pemberian ekstrak (Gambar 6 B). Perubahan tersebut yaitu sel mengalami pembengkakan (Gambar 6 B panah warna merah). Pembengkakan nampak berada pada bagian tengah sel dan bagian ujung sel. Hal ini menyebabkan permukaan bakteri tidak rata dan sel terlihat lebih besar dari sel normal.
20
Hasil penelitian ini pada sel yang ditandai panah merah adalah bentuk penampakan saat dinding sel tidak dapat menahan tekanan dari senyawa hipotonik yang terkandung di dalam ekstrak yang masuk ke dalam sel, sehingga terlihat mengalami pembesaran. Pratiwi (2008) menyatakan pembesaran sel disebabkan karena sel berada pada medium yang hipotonik, air akan berdifusi ke dalam sel, mengencerkan cairan intrasel dan memekatkan cairan ekstra sel hingga mencapai pada tekanan yang sama. Azrifitria et al. (2010) melaporkan bahwa senyawa yang bersifat hipotonik akan menyebabkan peningkatan permeabilitas membran sehingga tekanan di dalam sel meningkat, mengakibatkan peptidoglikan dinding sel tidak mampu menahan tekanan yang tinggi. Ketidakmampuan peptidoglikan menahan tekanan intraseluler yang tinggi menyebabkan sitoplasma dan membran sitoplasma terdesak keluar ke arah dinding sel.
Hasil pengujian komponen bioaktif fraksi pada penelitian ini juga menunjukkan adanya pengaruh terhadap morfologi sel yang dihasilkan. Fraksi yang paling berperan dalam menghambat B.subtilis yaitu F1 dan F2. Dua fraksi tersebut memiliki komponen bioaktif yang berasal dari golongan senyawa polifenol. Polifenol dalam beberapa penelitian telah dilaporkan bahwa memiliki sifat yang hipotonik sehingga dapat menyebabkan pembesaran sel bakteri. Ultee
et al. (2002) menyatakan bahwa kerusakan sel bakteri oleh senyawa antibakteri polifenol menyebabkan pembesaran sel akibat adanya akumulasi dari senyawa polifenol. Asriani et al. (2007) juga melaporkan bahwa polifenol yang berinteraksi dengan membran menyebabkan permeabilitas meningkat dan sel membesar. Campbell dan Reece (2002) menyatakan bahwa sel yang membesar atau mengembang lama kelamaan akan pecah atau lisis.
Sel yang pecah atau lisis dalam penelitian ini ditunjukkan pada panah warna biru. Mangoni et al. (2004) melaporkan sel yang lisis pada pengamatan morfologi menggunakan SEM adalah sel yang terlihat seperti pecah atau sobek dan seperti mengeluarkan molekul-molekul penyusun bakteri. Asriani et al. (2007) menyatakan bahwa dinding sel yang lisis mengakibatkan keluarnya cairan dalam jumlah besar dan menyebabkan sel mengerut dan mati.
Perubahan permukaan sel yang ditandai dengan adanya pengkerutan juga terlihat pada penelitian ini, yaitu yang ditunjukkan oleh panah berwarna kuning. Pengerutan ini dimungkinkan terjadi setelah akibat kerusakan dinding sel berupa pembesaran sel yang kemudian diikuti lisis dan akhirnya mengerut. Rustanti dan Elly (2009) melaporkan bahwa kerusakan dinding sel akan menyebabkan kerusakan membran sel sehingga bahan makanan untuk menghasilkan energi menjadi terganggu dan akibatnya akan mengganggu pertumbuhan sel bakteri. Campos et al. (2004) menjelaskan bahwa kerusakan membran sel membuat kebocoran molekul-molekul penting di dalam sel. Kebocoran tersebut menyebabkan sel bakteri mengerut.
Pengaruh Ekstrak terhadap Morfologi Bakteri P. aeruginosa
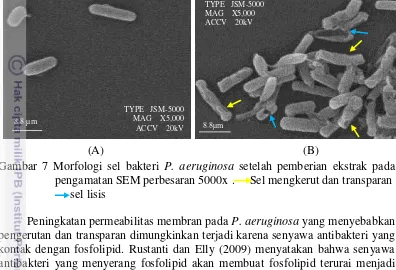
21
membuat banyak sel yang mengalami pengerutan dan terlihat transparan. Mangoni et al. (2004) menyatakan bahwa kerusakan membran sel yang mengakibatkan peningkatan permeabilitas membran dapat menyebabkan pembentukan ghost cell. Ghost cell adalah struktur sel yang terlihat transparan, tipis, dan terlihat kosong.
Gambar 7 Morfologi sel bakteri P. aeruginosa setelah pemberian ekstrak pada pengamatan SEM perbesaran 5000x . Sel mengkerut dan transparan
sel lisis
Peningkatan permeabilitas membran pada P. aeruginosa yang menyebabkan pengerutan dan transparan dimungkinkan terjadi karena senyawa antibakteri yang kontak dengan fosfolipid. Rustanti dan Elly (2009) menyatakan bahwa senyawa antibakteri yang menyerang fosfolipid akan membuat fosfolipid terurai menjadi beberapa senyawa seperti gliserol dan asam fosfat. Hal tersebut membuat fosfolipid tidak mampu mempertahankan bentuk membran sel, akibatnya akan terjadi kebocoran membran sel bakteri. Kebocoran tersebut terlihat secara morfologi berbentuk ghost cell.
Pengerutan sel P. aeruginosa ini kemudian dimungkinkan akan membuat sel menjadi lisis. Sel yang lisis terlihat pada panah warna biru, dimana secara morfologi terlihat bahwa sel yang pecah ada yang nampak secara keseluruahan dan ada yang sebagian. Davidson dan Branen (1980) menyatakan senyawa antibakteri dapat bereaksi dengan komponen fosfolipid dari sel bakteri Gram-negatif yang dapat mengakibaktkan lisis pada sel. Dinding sel yang lisis dapat menyebabkan dinding sel terlepas semua atau sebagaian disebut dengan sferoplas.
(A) (B)
TYPE JSM-5000 MAG X5,000 ACCV 20kV
8.8µm TYPE JSM-5000
22
4 SIMPULAN DAN SARAN
Simpulan
Fraksi antibakteri dari kapang endofit BAR1.5 dapat diperoleh dengan menggunakan KLTP. Fraksi antibakteri yang diperoleh sebanyak tiga fraksi (F1, F2, dan F3). Aktivitas antibakteri F1 dan F2 lebih besar dibandingkan dengan ekstrak kasar yang memiliki zona hambat masing-masing 19 mm dan 20 mm terhadap B. subtilis. F3 tidak memiliki aktivitas antibakteri yang baik dalam bentuk fraksi tunggal. Komponen bioaktif di dalam F1 adalah flavonoid dan F2 adalah polifenol. Senyawa antibakteri dalam kapang endofit BAR1.5 menyebabkan pembengkakan, pengerutan dan lisis pada morfologi sel B. subtilis, sedangkan pada morfologi sel P. aeruginosa menyebabkan pengerutan, sel transparan dan lisis.
Saran
23
DAFTAR PUSTAKA
Aires A, Mota VR, Saavedra MJ, Rosa EAS, Bennett RN. 2009. The antimicrobial effects of glucosinolates and their respective enzymatic hydrolysis products on bacteria isolated from the human intestinal tract. Journal of Applied Microbiology 106: 1364-5072. doi: 10.1111/j.1365-2672.2009.04180.
Abeysingher PD, D Wijesekara, RN Pathirana. 2003. Inhibition of growth of antibiotic resistant Staphylococcus sp. and Protus sp. by mangrove plant extracts. In the Proceedings of the First Science Symposium, University of Ruhuna, pp: 1-9.
Amudha, Prabuseenivasan, Kumar V. 2013. Antimycobacterial activity of certain mangrove plants against multi-drug resistant. Mycobacterium tuberculosis.
Asian Journal of Medical Sciences. 5(3).
Arias ME, Gomez JG, Cudmani NM, Vattuone MA, Isla MI. 2004. Antibacterial activity of ethanolic and aqueous extracts of Acacia aroma Gill. ex Hook et Arn. Life Sciences. 75: 191–202. doi: 10.1016/j.lfs.2003.12.007.
Asriani, Laksmi BS, Yasni S, Sudirman I. 2007. Mekanisme antibakteri metabolit
Lb. plantarum kik dan monoasilgliserol minyak kelapa terhadap bakteri patogen pangan. Jurnal Teknologi dan IndustriPangan 18 (2): 126-133. Azrifitria, Aziz S, Chairul. 2010. Aktivitas antibakteri etanolik daun dan umbi
Crinum asiaticum L. terhadap bakteri penyebab jerawat. Majalah Farmasi Indonesia. 21 (4): 249-254.
Bai ZQ, Lin X, Wang Y, Wang J, Zhou X. 2014. New phenyl derivatives from endophytic fungus Aspergillus flavipes AIL82 derived of mangrove plant
Acanthus ilicifolius. Fitoterapia. (9): 326-367. doi: 10.1016%2Fj. fitote.2014.03.021.
Bandaranayake WM. 2002 Bioactivities, bioactive compound and chemical constituents of mangrove plants. Wetlands Ecology and Management. 10: 421-452. doi: 10.1023/ A:1021397624349.
Basyuni M, Oku H, Tsujimoto E, Kinjo K, Baba S, Takara K. 2007. Triterpene synthases from the Okinawan mangrove tribe, Rhizophoraceae. Federation of European Biochemical Societies. 274: 5028-5042. doi:10.1111/j.1742-4658.2007.06025.
Betina V. 1972. Bioautography in paper and thin layer chromatography and its scope in the antibiotic field. Journal of Chromatoghrapy. 78:41-51.
Bharathidsan R and Panneerselvam A. 2015. Antibacterial activity of endophytic fungi extracts from the mangrove plant Avicennia marina (Forsk) vierh. International Journal of Advanced Research in Biological Sciences. 2 (9): 145-148.
Breidenstein EBM, de la Fuente-N_u~nez C, Hancock REW. 2011. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol. 8: 419–426. Burt SA, Reinders RD. 2003. Antibacterial activity of selected plant essential oils
against Escherichia coli O157:H7. Letters in Applied Microbiology. 36(3): 162-167. doi: 10.1046/j.1472-765X.2003.01285.x.
24
Campos FM, Couto JA, IV Figueiredo, Tóth, Rangel AOSS, Hogg TA. 2009. Cell membrane damage induced by phenolic acids on wine lactic acid bacteria.
International Journal of Food Microbiology. 135(2):144-51. doi: 10.1016/j.ijfoodmicro.2009.07.031.
Carlo GD, Mascolo N, Izzo AA, Capasso F. 1999. Flavonoids: old and new aspects of a class of natural therapeutic drugs. Life Science. 64 (4): 337-353. doi: 10.1016/S0024-3205(99)00120-4.
Collins NF, LAM Kirshner, A von Holy. 1991. A characterisation of Bacillus isolates from ropy bread, bakery equipment and raw materials. South African Journal of Science. 87: 62–66.
Constantin CA, Mikkola R, Andersson MA, Teplova V, Suominen I, Johansson T, Salonen MS. 2008. Journal of Applied Microbiology. 106: 1976-1985. Contini SHT, Salvador MJ, Watanabe E, Ito IY, Rodrigues DCR Olivera. 2003.
Antimicrobial activity of flavonoids and steroids isolated from two Chromolaena species. Brazilian Journal of Pharmaceutical Sciences. 39 (4): 403-408. doi: 10.1590/S1516-93322003000400007.
Daglia M. 2012. Polyphenols as antimicrobial agents. Current Opinion in Biotechnology. 23: 174-181. doi: 10.1016/j.copbio.2011.08.007.
Davidson PM and Branen AL. 1980. Antimicrobial mechanism of butylated hydroxyanisole against two Pseudomonas species. Journal of Food Science. 45: 1607-1613.
Dennis E, Ohman, Robert PB. 1980. Corneal Infections in Mice with Toxin A and Elastase Mutants of Pseudomonas aeruginosa. The Journal of Infectious Diseases. 142 (2): 548-555.
Devmurari V P, Ghodasara T J, Jivani N P. 2010. Phytochemical screening and antibacterial activity of ethanolic extract of Triumfetta rhomboidea jacq.
Archives of Applied Science Research. 2 (1): 318-323.
Elias BC, Said S, Albuquerque S, Pupo MT. 2006. The influence of culture conditions on the biosynthesis of secondary metabolites by Penicillium verrucosum Dierck. Microbioogical Research Sciencedirect. 161: 273-280. Firdiyani F, Agustini TW, Ma’ruf WF. 2015. Ekstraksi senyawa bioaktif sebagai
antioksidan alami Spirulina platensis segar dengan pelarut yang berbeda.
Jurnal Pengolahan Hasil Perikanan Indonesia. 18 (1): 28-37. doi: 10.17844/jphpi.2015.18.1.28.
Gritter RJ, Bobbit JM, Schwarting AE. 1991. Pengantar Kromatografi. Terbitan Kedua. Diterjemahkan oleh Kosasih Padmawinata. Bandung (ID): Penerbit ITB. Halaman 108-109.
Gunawan H. 2004. Ancaman dan Harapan Bagi Masyarakat Adat Studi Kasus Masyarakat Adat Cerekang di Kabupaten Luwu Timur, Propinsi Sulawesi Selatan. Jakarta (ID): Center for International Forestry Research. Halaman 5.
Harborne JB. 1987. Phytochemical Methods. London (UK): Chapman & Hall. Page 129.
25
Jalil MM, Ismail A. 2008. Polyphenols in cocoa and cocoa products: is there a link between antioxidant properties and health. Review Molecules. 13: 2190-2219. doi: 10.3390/ molecules13092190.
Jeol. 1995. Specimen preparation method for scanning electron microscope. JEOL Application Note. Tokyo. Page 188.
Jouda JB, Kusari S, Lamshoft M, Talontsi FM, Meli CD, Wandji J, Spiteller M. 2014. Penialidins A-C with strong antibacterial activities from Penicillium sp., an endophytic fungus harboring leaves of Garcinia nobilis. Fitoterapia, 98, 209-214. doi: 10.1016/j.fitote.2014.08.011.
Koch BP, Rullko¨ tter J & Lara RJ. 2003. Evaluation of triterpenols and sterols as organic matter biomarkers in a mangrove ecosystem in northern Brazil. Wetl Ecol Manag. 11: 257–263.
Koech KR, Wachira FN, Ngure RM, Wanyoko JK, Bii CC, Kerio LC. 2013. Antimicrobial, synergistic and antioxidant activities of tea polyphenols.
Formatex Research Center. 971-981.
Kokpol U, Chittawong V, Miles DH. 1986. Chemical constituents of the roots of
Acanthus illicifolius. Journal of Natural Products. 49 (2): 355-356.
Kowti R, R Harsha, Ahmed MG, AR Hareesh, SS Gowda T, R Dinesha, BP Kumar S, M Ali I. 2010. Antimicrobial activity of ethanol extract of leaf and flower of Spathodea campanulata P. Beauv. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 1 (3): 691-698.
Madigan MT, Martinko JM, Brock TD. 2000. Brock Biology of Microorgnisms. New Jersey (US): Pearson Prentice Hall. Page 268.
Mangoni ML, Papo N, Barra D, Simmaco M, Bozzi A, Giulio A, Rinaldi C. 2004. Effects of antimicrobial peptide temporin L on cell morphology, membrane permeability and viability of Escherichia coli. Biochemical Journal. 380: 859-865.
Nassar Z, Abdalrahim A, Amin AM. 2010. The Pharmacological Properties of terpenoid from Sandoricum Koetjape. Journal Medcentral. 1-11.
Nursid M, Pratitis A, Chasanah E. 2010. Kultivasi kapang MFW-01-08 yang diisolasi dari ascidia Aplidium longithorax dan uji aktivitas sitotoksiknya terhadap sel kanker payudara T47D. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 5 (2): 103-110.
Ogundipe OO, Moody JO, Houghton PJ, Odelola HA. 2001. Bioactive chemical constituents from Alchormea laxiflora (benth) pax and hoffman. Journal Ethnopharmacol. 74 (3): 275-280.
Oku H, Baba S, Koga H, Takara K, Iwasaki H. 2003. Lipid composition of mangroves and its relevance to salt tolerance. Journal of Plant Research. 116: 37–45. doi: 10.1007/s10265-002-0069-z.
Paiva PMG, Gomes FS, Napoleao TH, Correia MTS, Coelho LCBB. 2010. Antimicrobial activity of secondary metabolites and lectins from plants.
Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology. 396-406.
Pelczar MJ, Chan ESC. 2008. Dasar-Dasar Mikrobiologi 2. Hadioetomo, Penerjemah. Jakarta (ID): UI-Press. Terjemahan dari: Elements of Microbiology. Halaman 177.