SKRIPSI
KAJIAN AKTIVITAS ANTIMIKROBA EKSTRAK JINTAN HITAM (Nigella sativa L.)
TERHADAP BAKTERI PATOGEN DAN PERUSAK PANGAN
Oleh EVA H. DIREJA
F 24102097
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Eva H. Direja. F24102097. Kajian aktivitas antimikroba ekstrak jintan hitam (Nigella sativa L.) terhadap bakteri patogen dan perusak pangan. Dibawah bimbingan : Dr. Ir. Sedarnawati Yasni, M. Agr. dan Ir. Elvira Syamsir, MSi.
ABSTRAK
Seiring dengan banyaknya kasus keracunan pangan oleh mikroba yang menyebabkan penyakit dan kematian serta kerugian ekonomi, perlu dilakukan usaha-usaha untuk menguranginya. Salah satu usaha tersebut adalah dengan mengaplikasikan bahan yang berpotensi sebagai antimikroba pada proses pengolahan pangan. Jintan hitam yang umumnya digunakan sebagai obat-obatan diduga memiliki aktivitas antimikroba dan berpeluang untuk digunakan sebagai pengawet bahan pangan. Penelitian ini bertujuan untuk mempelajari aktivitas antimikroba beberapa jenis ekstrak jintan hitam terhadap bakteri patogen dan bakteri perusak makanan.
Tahapan penelitian ini meliputi penelitian pendahuluan dan penelitian lanjutan. Tahapan penelitian pendahuluan mencakup persiapan kultur mikroba,
ekstraksi tunggal biji jintan hitam dengan metode refluks menggunakan air dan
etanol, serta penyulingan minyak atsiri. Penelitian lanjutan mencakup ekstraksi bertingkat pada ampas penyulingan minyak atsiri jintan hitam, dengan metode
refluks menggunakan beberapa pelarut organik dengan polaritas yang berbeda,
yaitu heksan, etil asetat dan metanol secara berurutan. Dari keseluruhan proses
ekstraksi akan diperoleh ekstrak air, ekstrak etanol, minyak atsiri, ekstrak heksan, ekstrak etil asetat, dan ekstrak metanol. Efektivitas senyawa antimikroba dari masing-masing ekstrak jintan hitam diuji menggunakan metode difusi agar. Pada minyak atsiri, ekstrak etanol, ekstrak etil asetat, dan ekstrak metanol selanjutnya
dilakukan pengujian nilai Minimum Inhibitory Concentration (MIC) terhadap satu
jenis bakteri. Selain itu, dilakukan juga identifikasi kualitatif komponen fitokimia terhadap ekstrak yang menunjukkan aktivitas antimikroba yang baik, yaitu minyak atsiri, ekstrak etanol, dan ekstrak etil asetat jintan hitam.
Minyak atsiri, ekstrak etanol dan ekstrak etil asetat dapat menghambat semua bakteri uji sehingga dianggap memiliki spektrum yang luas. Ekstrak air dan ekstrak heksan kurang efektif dalam menghambat pertumbuhan bakteri uji. Ekstrak air dan ekstrak heksan tidak dapat menghambat pertumbuhan bakteri
Escherichia coli dan Salmonella Typhimurium. Ekstrak metanol tidak dapat
menghambat pertumbuhan Escherichia coli.
Nilai MIC ekstrak etanol terhadap Salmonella Typhimurium adalah 0.084 %
(w/w), nilai MIC minyak atsiri terhadap Bacillus cereus adalah 1.72% (w/w), nilai
MIC ekstrak etil asetat terhadap Staphylococcus aureus adalah 1.88 % (w/w), dan
nilai MIC ekstrak metanol terhadap Pseudomonas aeruginosa adalah 1.88 %
KAJIAN AKTIVITAS ANTIMIKROBA EKSTRAK JINTAN HITAM (Nigella sativa L.)
TERHADAP BAKTERI PATOGEN DAN PERUSAK PANGAN
SKRIPSI
Sebagai salah satu syarat memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh EVA H. DIREJA
F 24102097
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
KAJIAN AKTIVITAS ANTIMIKROBA EKSTRAK JINTAN HITAM (Nigella sativa L.)
TERHADAP BAKTERI PATOGEN DAN PERUSAK PANGAN
SKRIPSI
Sebagai salah satu syarat memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh EVA H. DIREJA
F 24102097
Dilahirkan pada tanggal 28 Oktober 1984
Di Bandung, Jawa Barat
Tanggal lulus : 19 Desember 2006
Menyetujui,
Dr. Ir. Sedarnawati Yasni, M. Agr. Ir. Elvira Syamsir, MSi. Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 28 Oktober
1984, sebagai anak pertama dari 3 bersaudara, dari pasangan
Bapak Sortamin Purba dan Ibu Tiaman Manik. Masa kecil
penulis hingga Sekolah Menengah Umum (SMU) dilalui di
Kota Bandung. Penulis menempuh pendidikan di Taman
Kanak-Kanak Harapan Ibu (1989-1990), Sekolah Dasar ST Melania (1990-1996),
Sekolah Lanjutan Tingkat Pertama Providentia (1996-1999) dan penulis
merupakan alumni Sekolah Menengah Umum Negeri 5 Bandung (1999-2002).
Penulis diterima di Departemen Ilmu dan Teknologi Pangan melalui jalur
Saringan Penerimaan Mahasiswa Baru (SPMB) pada tahun 2002.
Selama menjadi mahasiswa, penulis aktif mengikuti berbagai kegiatan
organisasi, di antaranya Pemuda Gereja Kristen Protestan Simalungun (Pemuda
GKPS) Bogor, Parsadaan Mahasiswa Simalungun (Parmasi) IPB, Komisi
Pelayanan Anak Persekutuan Mahasiswa Kristen IPB, Koran Kampus IPB
(reporter), serta pernah menjadi Asisten Mata Kuliah Agama Kristen Protestan.
Selain itu, penulis aktif mengikuti berbagai seminar yang memperluas wawasan,
di antaranya Seminar Anak Bermasalah : Apa itu autis? (2003), Seminar
Pemantapan Road Map Penganekaragaman Pangan dan Bogasari Nugraha VII
(2004), IDF International Conference of fgW Student Forum for Milk and Milk
Product (2005) serta Seminar dan Pelatihan HACCP (2005).
Pada pertengahan tahun 2005, penulis melakukan Praktek Lapangan di PT
Indomilk Jakarta dengan topik “Mempelajari proses pengolahan dan pengawasan
mutu susu bubuk di PT Indomilk”. Sebagai syarat untuk memperoleh gelar
Sarjana Teknologi Pertanian, penulis melakukan penelitian dan menyusun laporan
penelitian tersebut sebagai skripsi dengan judul “Kajian aktivitas antimikroba
ekstrak jintan hitam (Nigella sativa L.) terhadap bakteri patogen dan perusak
KATA PENGANTAR
Puji syukur kepada Tuhan Yesus Kristus yang telah melimpahkan
anugerah-Nya sehingga penulis dapat melaksanakan dan menyelesaikan penelitian yang
berjudul “Kajian aktivitas antimikroba ekstrak jintan hitam (Nigella sativa L.)
terhadap bakteri patogen dan perusak pangan”. Skripsi ini berisi hasil penelitian
tentang aktivitas antimikroba dari beberapa ekstrak jintan hitam. Dari penelitian
ini, dapat diketahui ekstrak biji jintan hitam yang memiliki spektrum luas dalam
menghambat bakteri uji serta nilai Minimum Inhibitory Concentration (MIC) dari
beberapa ekstrak jintan hitam terhadap bakteri tertentu. Selain itu, diketahui juga
komponen fitokimia yang terdapat dalam beberapa ekstrak jintan hitam.
Banyak pihak telah terlibat dalam pelaksanaan dan penyelesaian penelitian
dan penulisan skripsi ini. Penulis mengucapkan terima kasih dan penghargaan
yang setinggi-tingginya kepada :
1. Dr. Sedarnawati. Yasni, M. Agr. selaku Dosen Pembimbing Akademik I
dan Ir. Elvira Syamsir, M.Si. selaku Dosen Pembimbing Akademik II yang
telah banyak memberi arahan dan bimbingan sejak awal perencanaan
penelitian, penyelesaian penelitian hingga penyelesaian skripsi ini.
2. Ir. Budi Nurtama, M. Agr. selaku Dosen Penguji yang juga turut
membantu dalam pengolahan data hasil penelitian ini.
3. “DEIDENG CENTER” yang telah memberikan bantuan dana untuk
pelaksanaan penelitian ini.
4. Bapatua Sudiman Purba, Bapaanggi Pandapotan Purba, Tulang Sabarman
Damanik, Oppung Dj. F. Sinaga dan Bapatua Mulia Purba atas dukungan
moril dan materiil.
5. Mama, Papa, Daus “Uus”, Ledi “Dodot”, Tante Rus dan Uda Butar, Tante
Loisi dan Uda Pea, atas kasih sayang dan dukungan moril serta materiil.
6. Dora-ku dan Deddy, untuk kerjasama kita yang menyenangkan.
7. Mba Ari, Pak Taufik, Pak Yahya, Pak Sobirin, Bu Rubiyah, Bi Entin, Bi
Sari, Pa Udin, Pak Karna/Abah, Pak Mulyono/Pak Mul, Pak Rojak, Pak
Koko, Teh Ida dan Mas Edi, atas bantuan selama penulis bekerja di
8. Bu Yuspi, atas bantuan selama penulis bekerja di laboratorium dan atas
peminjaman jurnal-jurnal yang terkait dengan penelitian ini. Mba Tri, Mba
Lala, Mba Hon, dan Mba Era, atas bantuan sebagai rekan kerja di
laboratorium serta Mba Santy dan Bu Asriani, atas diskusi “2 sks” kita.
9. Inda, untuk peminjaman inkubatornya. Manginar, Olga, Christ, Icha,
Mumust, Novi, Tina untuk kebersamaan di TPG.
10.Kenot, Prasna, Samsul, buat kebersamaan sebagai kelompok C6 yang
sangat berkesan.
11.Meilina, yang setia mendengar ceritaku dan anak mie lainnya..(Tukep dll).
12.Hana Bona yang baik dan Mba Agnani Marlis.
13.Eko-TPG 39 dan Yanty-Statistik 39, atas bantuan dalam pengolahan data.
14.Elma, Evrin, Fiona, Melissa, buat persahabatan yang sehat sejak kita SMA
15.Bang Apri Girsang, Bang Pirma Girsang, Bang Bruly Tarigan, Bang Jubel
Girsang, dan Bang Kristiansen Purba, atas dukungan dan bantuan selama
kuliah dan penelitian, yang juga sudah seperti abang sendiri bagi penulis.
16.Warga Wisma Jo, Mba Lia-LP, dan anak-anak Parmasi. Simalungun Jaya!
17.Pemuda GKPS Bogor, terima kasih untuk akhir yang menyenangkan di
Pesparawi Pemuda walaupun kita kalah.
18.Teman-teman Golongan C, terima kasih untuk kebersamaan yang ceria.
19.Semua yang telah bersedia mendengarkan keluh kesah dan bersedia untuk
diganggu saat menerima sms berisi keluhan penulis selama penelitian.
20. Someone who ever loved me so deep and spent time just for supported me in my hard times.
21.Semua pihak yang belum tersebut tetapi turut membantu hingga penelitian
ini dapat terlaksana dengan baik.
Penulis menyadari bahwa tulisan ini masih jauh dari sempurna, walaupun
demikian penulis berharap semoga skripsi ini dapat bermanfaat bagi yang
membaca.
Bogor, Desember 2006
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR GAMBAR ... iv
DAFTAR TABEL ... v
DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN DAN SASARAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. JINTAN HITAM ... 3
B. EKSTRAKSI ... 6
C. KARAKTERISTIK BAKTERI PATOGEN DAN PERUSAK ... 12
D. SENYAWA ANTIMIKROBA ... 16
E. UJI AKTIVITAS ANTIMIKROBA ... 19
F. SENYAWA FITOKIMIA ... 21
III.BAHAN DAN METODE ... 25
A. BAHAN DAN ALAT ... 25
B. TEMPAT DAN WAKTU ... 25
C. METODE PENELITIAN ... 26
D. METODE ANALISIS ... 32
E. RANCANGAN PERCOBAAN ... 37
IV.HASIL DAN PEMBAHASAN ... 38
A. PENGHITUNGAN JUMLAH MIKROBA UMUR 24 JAM ... 38
B. KARAKTERISTIK BAHAN BAKU ... 39
C. KARAKTERISTIK EKSTRAK ... 39
D. AKTIVITAS ANTIMIKROBA ... 44
E. IDENTIFIKASI KUALITATIF SENYAWA FITOKIMIA ... 58
F. MINIMUM INHIBITORY CONCENTRATION (MIC) ... 60
V. KESIMPULAN DAN SARAN ... 63
A. KESIMPULAN ... 63
B. SARAN ... 64
DAFTAR GAMBAR
Halaman
Gambar 1. Biji jintan hitam ... 3
Gambar 2. Bunga jintan hitam ... 3
Gambar 3. Tanaman jintan hitam ... 3
Gambar 4. Susunan alat penyulingan uap ... 8
Gambar 5. Susunan alat ekstraksi refluks ... 12
Gambar 6. Struktur DMSO [(CH3)2SO] ... 20
Gambar 7. Penggolongan senyawa terpenoid ... 23
Gambar 8. Diagram proses ekstraksi tunggal menggunakan pelarut air ... 29
Gambar 9. Diagram proses ekstraksi tunggal menggunakan pelarut etanol ... 29
Gambar 10. Diagram proses ekstraksi bertingkat dengan metode refluks ... 31
Gambar 11. Pengaruh berbagai ekstrak jintan hitam terhadap bakteri uji ... 46
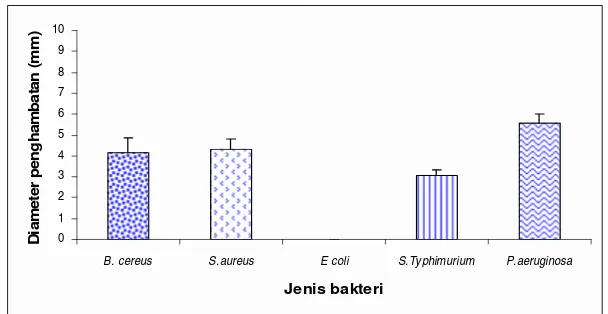
Gambar 12. Pengaruh ekstrak air terhadap bakteri uji ... 47
Gambar 13. Pengaruh ekstrak metanol terhadap bakteri uji ... 49
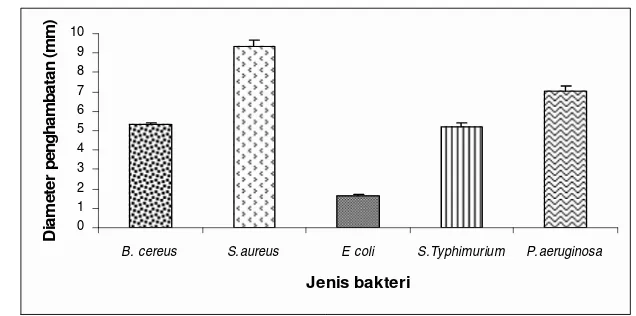
Gambar 14. Pengaruh ekstrak etanol terhadap bakteri uji ... 50
Gambar 15. Zona penghambatan ekstrak etanol jintan hitam terhadap Staphylococcus aureus ... 50
Gambar 16. Pengaruh ekstrak etil asetat terhadap bakteri uji ... 51
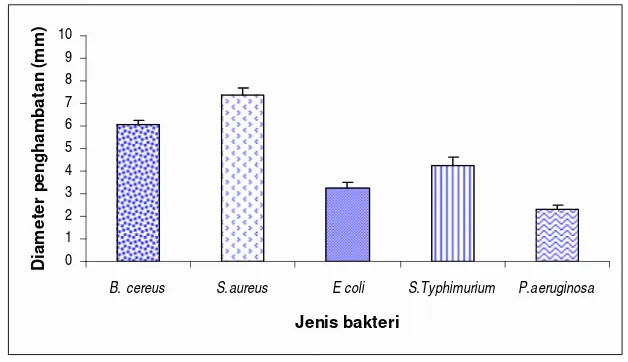
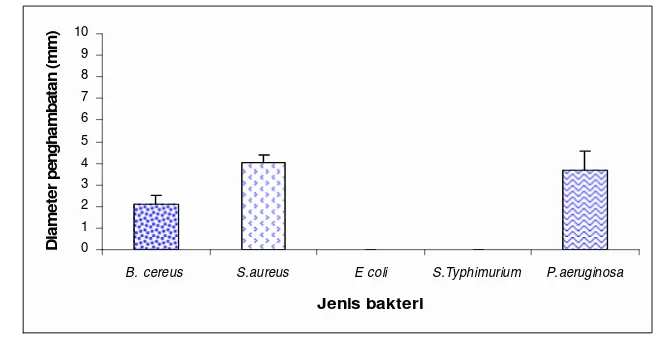
Gambar 17. Pengaruh minyak atsiri terhadap bakteri uji ... 52
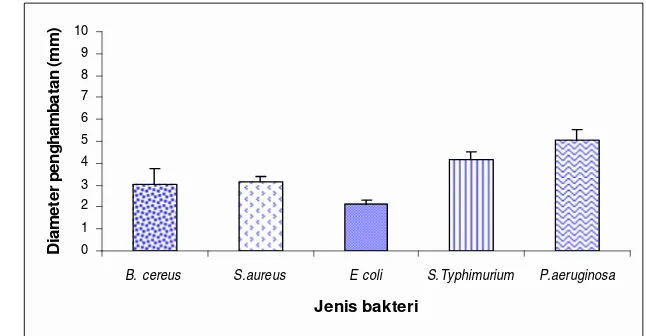
Gambar 18. Pengaruh ekstrak heksan terhadap bakteri uji ... 54
DAFTAR TABEL
Halaman
Tabel 1. Komposisi minyak atsiri jintan hitam ... 5
Tabel 2. Komposisi asam amino biji jintan hitam ... 6
Tabel 3. Komposisi asam lemak biji jintan hitam ... 6
Tabel 4. Pelarut yang umum digunakan untuk ektraksi ... 10
Tabel 5. Nilai polaritas beberapa pelarut ... 11
Tabel 6. Mekanisme aksi antibiotik ... 18
Tabel 7. Jumlah sel mikroba pada umur 24 jam ... 39
Tabel 8. Hasil analisis proksimat biji jintan hitam ... 39
Tabel 9. Hasil penyulingan minyak atsiri biji jintan hitam ... 41
Tabel 10. Karakteristik ekstrak jintan hitam ... 43
Tabel 11. Hasil analisis ragam ... 45
Tabel 12. Jenis senyawa fitokimia yang terekstrak pada berbagai pelarut ... 58
Tabel 13. Hasil identifikasi kualitatif senyawa fitokimia ... 59
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Skema tahapan penelitian secara keseluruhan ... 70
Lampiran 2. Diagram alir persiapan kultur bakteri dan uji konfirmasi jumlah mikroba ... 71
Lampiran 3. Diagram alir uji difusi sumur ... 72
Lampiran 4. Contoh perhitungan penentuan jumlah mikroba ... 73
Lampiran 5. Hasil uji konfirmasi jumlah sel bakteri dengan metode hitungan cawan ... 74
Lampiran 6. Hasil analisis minyak atsiri tanpa penghalusan bahan ... 75
Lampiran 7. Hasil analisis minyak atsiri dengan penghalusan bahan ... 76
Lampiran 8. Contoh perhitungan rendemen ... 77
Lampiran 9. Hasil perhitungan standar eror ... 78
Lampiran 10. Hasil analisis ragam ... 79
Lampiran 11. Hasil uji lanjut Duncan ... 80
Lampiran 12. Zona penghambatan ekstrak-ekstrak jintan hitam terhadap bakteri uji (Mean ± SE) ... 81
Lampiran 13. Penentuan nilai MIC ekstrak etanol jintan hitam terhadap bakteri Salmonella Typhimurium ... 82
Lampiran 14. Penentuan nilai MIC minyak atsiri jintan hitam terhadap bakteri Bacillus cereus ... 83
Lampiran 15. Penentuan nilai MIC ekstrak etil asetat jintan hitam terhadap bakteri Staphylococcus aureus ... 84
I. PENDAHULUAN
A. LATAR BELAKANG
Penyakit infeksi yang disebabkan oleh makanan dan air merupakan penyebab utama penyakit dan kematian di negara berkembang (Roller, 2003). Menurut WHO (2005), diperkirakan 2.1 juta orang meninggal sepanjang tahun 2000 yang disebabkan oleh penyakit diare karena kontaminasi pada makanan dan air minum. Di Indonesia, terdapat 7343 kasus keracunan pangan yang dilaporkan sepanjang tahun 2004, termasuk di dalamnya 45 kasus yang menyebabkan kematian (Badan POM, 2005).
Penyakit infeksi yang disebabkan oleh keracunan bahan pangan menyebabkan kerugian ekonomi, berupa biaya pengobatan dan kehilangan produktivitas. Kerusakan pangan juga memegang peranan penting terhadap kerugian ekonomi, tetapi sulit untuk diketahui jumlahnya (Roller, 2003). Di USA, kerugian ekonomi yang disebabkan oleh bakteri patogen diperkirakan mencapai $ 35 milyar pada tahun 1997 (WHO, 2005). Kasus penyakit infeksi oleh bakteri patogen dan kasus kerusakan pangan, keduanya diakibatkan oleh pertumbuhan mikroba yang tidak diinginkan dalam bahan pangan. Oleh karena itu, penting dilakukan pengendalian terhadap pertumbuhan mikroba dalam pangan.
Menurut Thongson et. al. (2004), salah satu strategi untuk mengurangi
jumlah kasus food-borne illnesses dapat dilakukan dengan mengaplikasikan
antimikroba pada saat proses pengolahan pangan untuk menginaktifkan ataupun untuk mencegah pertumbuhan mikroba. Penggunaan rempah-rempah dalam makanan, tidak hanya memberi karakteristik rasa, kepedasan, dan warna, melainkan juga memberikan aktivitas antioksidan dan antimikroba, farmaseutikal, dan nilai gizi.
Aktivitas antimikroba adalah kemampuan untuk menghambat pertumbuhan mikroba, baik berupa bakteriostatik maupun fungistatik (Hirasa
antimikroba sudah mengalami perkembangan yang pesat karena negara-negara industri mulai menghidupkan kembali pendekatan secara tradisional untuk melindungi ternak dan makanannya dari penyakit, binatang perusak,
dan kebusukan (Dorman et. al., 2000). Menurut Singh et. al. (2004), sifat
antimikroba pada bahan yang ditambahkan pada makanan sangat penting untuk meningkatkan umur simpan makanan dan untuk memberikan rasa aman pada konsumen.
Jintan hitam atau yang dikenal dengan nama black cumin (Nigella sativa
L.) merupakan tanaman yang umumnya digunakan di Timur Tengah sebagai obat tradisional untuk memperbaiki berbagai kondisi kesehatan manusia. Di Indonesia, biji jintan hitam digunakan untuk mengobati sakit perut (Heyne, 1987). Sakit perut merupakan salah satu gejala yang disebabkan oleh
keracunan akibat mikroba, seperti Staphylococcus aureus. Oleh karena itu,
diduga biji jintan hitam memiliki aktivitas antimikroba dan perlu dilakukan analisis untuk mengetahui aktivitas antimikroba jintan hitam terhadap beberapa bakteri patogen ataupun bakteri perusak pangan.
B. TUJUAN DAN SASARAN
II.TINJAUAN PUSTAKA
A. JINTAN HITAM (Nigella sativa L.)
Jintan hitam atau yang dikenal dengan nama black cumin (Nigella sativa
L.) merupakan tanaman asli dari Eropa Selatan dan banyak ditemukan di India. Jintan hitam yang ada di Indonesia berasal dari Bombay (Heyne, 1987). Tanaman penghasil jintan hitam merupakan tanaman yang tumbuh liar sampai pada ketinggian 1100 m dari permukaan laut. Biasanya ditanam di daerah pegunungan ataupun sengaja ditanam di halaman atau ladang sebagai tanaman
rempah-rempah (Achyad et. al., 2000). Berikut ini adalah gambar biji, bunga
dan tanaman jintan hitam.
Gambar 1. Biji jintan hitam
Gambar 2. Bunga jintan hitam Gambar 3. Tanaman jintan hitam
(Sumber : Anonim, 2006a)
lima (Anonim, 2006a). Taksonomi jintan hitam menurut Hutapea (1994) yang dikutip oleh Syamani (2001) :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Ranunculales
Suku : Ranunculaceae
Marga : Nigella
Spesies : Nigella sativa L.
Selain jintan hitam, dikenal juga jintan putih (Cuminum cyminum L. dari suku Apiaceae) yang lebih sering dipakai dalam masakan walaupun dipakai
juga untuk jamu-jamu tertentu, dan dalam bahasa lnggris disebut cummin.
Jintan hitam juga berbeda dengan jintan manis (Pimpinella anisum L. dari
suku Apiaceae) yang lebih dikenal sebagai adas manis (Inggris : anise ;
Belanda : anijs). Bahkan juga berbeda dengan jintan (Carum carvi L. dari
suku Apiaceae) yang dalam bahasa Inggris disebut caraway dan dalam bahasa
Belanda disebut karwijzaad (Achyad, et. al., 2000). Beberapa nama daerah
untuk jintan hitam adalah zwarte komijn, nigelle cultivee, schwarzkummel,
black cumin (Heyne, 1987).
Jintan hitam umumnya digunakan di Timur Tengah sebagai obat tradisional untuk memperbaiki berbagai kondisi kesehatan manusia (Al-Saleh
et. al., 2006). Biji jintan hitam biasanya ditambahkan pada makanan tradisional dan dicampur dengan roti ataupun madu sebagai pemberi citarasa
(Al-Saleh et. al., 2006 dan Al-Jabre et. al., 2003). Menurut Baytop yang
Komposisi kimia jintan hitam sangat beragam. Menurut El-Alfy yang dikutip oleh Al-Saleh et. al. (2006), berdasarkan berat keringnya, jintan hitam mengandung 0,4 % minyak atsiri yang terdiri dari carvon, limonene,
p-cymene, trans-anethole. Jintan hitan juga mengandung selenium, DL-α
-tokoferol, DL- -tokoferol, all-trans-retinol, thymoquinone, dan thymol
(Al-Saleh, 2006). Berikut ini adalah komposisi minyak atsiri jintan hitam.
Tabel 1. Komposisi minyak atsiri jintan hitam
Komposisi Persentase
Carvone 21.1% Alfa-Pinene 7.4%
Sabinene 5.5% beta-pinene 7.7%
p-cymene 46.8% Lain-lain 11.5%
(Sumber : Anonim, 2006b)
Menurut Achyad et. al. (2000), kandungan biji jintan hitam antara lain minyak atsiri, minyak lemak, dan saponin melantin, zat pahit nigelin, nigelon, dan timokuinon. Minyak atsiri pada umumnya bersifat bakteri,
anti-peradangan dan dapat menghangatkan perut. Menurut Achyad et. al. (2000),
buah dan biji jintan hitam memiliki kegunaan untuk mengatasi radang pada selaput lendir mata penyebab penglihatan berkabut, batuk rejan, keputihan pada gadis remaja, lepra, radang hidung, sembelit, encok, digigit serangga/ular, dan influensa. Saat ini, beberapa komponen aktif jintan hitam yang telah berhasil diisolasi adalah thymoquinone, thymohydroquinone, dithymoquinone, thymol, carvacrol, nigellicine, nigellidine, nigellimine-N-oxide and alpha-hedrin(Al-Jabre et. al., 2003).
Tabel 2. Komposisi asam amino biji jintan hitam
Asam amino Persentase Asam amino Persentase
Alanin Valin Glisin Isoleusin Leusin Prolin Treonin 3.77 3.06 4.17 4.03 10.88 5.34 1.23 Serin Asam aspartat Metionin Fenilalanin Asam glutamat Tirosin Lisin arginin 1.98 5.02 6.16 7.93 13.21 6.08 7.62 19.52 (Sumber : Babayan et. al., 1978)
Komposisi asam lemak biji jintan hitam juga cukup beragam. Selain itu
mengandung juga asam lemak esensial (essential fatty acid) yaitu asam
linoleat dan asam linolenat. Komposisi asam lemak jintan hitam dapat dilihat pada Tabel 3 berikut ini.
Tabel 3. Komposisi asam lemak biji jintan hitam
Asam lemak Persentase (%)
Miristat (C14:0) Palmitat (C16:0) Stearat (C18:0) Oleat (C18:1)
Linoleat (C18:2)(Omega-6) Linolenat (18:3n-3) (Omega-3) Arakidonat (C20:0) 0.5 13.7 12.6 23.7 57.9 2.0 1.3
(Sumber : Anonim, 2006b)
Kandungan gizi yang tinggi menyebabkan jintan hitam cepat rusak pada kadar air yang cukup tinggi. Kerusakan umumnya disebabkan oleh kapang karena kapang dapat memanfaatkan berbagai komponen makanan yang
kompleks seperti lipida (Fardiaz, 1992). Oleh karena itu, jintan hitam harus
ditangani secepat mungkin agar tidak mengalami kerusakan.
B. EKSTRAKSI
Ekstraksi adalah proses memisahkan komponen tertentu dari dalam suatu bahan atau campuran baik dengan cara kimia, fisika, ataupun mekanis
metode ekstraksi adalah tujuan ekstraksi, skala ekstraksi, sifat komponen yang akan diekstrak, sifat pelarut yang akan digunakan, penggunaan ekstrak, serta penggunaan ulang pelarut (Houghton dan Raman, 1998). Jika telah diketahui sifat senyawa yang akan diekstrak, ekstraksi dilakukan mengikuti prosedur yang sudah ada dengan modifikasi seperlunya. Namun, jika bahan yang akan diekstrak belum diketahui sifatnya, ekstraksi dilakukan untuk memperoleh senyawa kimia pada kisaran yang luas. Hal ini dapat dicapai dengan menggunakan pelarut yang berbeda-beda.
Pemilihan metode ekstraksi harus mempertimbangkan sifat komponen yang akan diekstrak. Sifat komponen yang akan diekstrak meliputi polaritas, termostabilitas, dan pengaruh pH (Houghton dan Raman, 1998). Polaritas pelarut yang akan digunakan harus disesuaikan dengan polaritas komponen yang akan diekstrak. Termostabilitas komponen berkaitan dengan kestabilan komponen terhadap pengaruh panas. Hal lain yang harus dipertimbangkan adalah pH. Jika komponen yang akan diekstrak bersifat asam seperti asam lemak, pelarut yang bersifat basa dapat digunakan untuk mengekstraknya.
Sifat pelarut berkaitan dengan polaritas, toksisitas, kemudahan terbakar, reaktivitas, ketersediaan dan harga. Polaritas pelarut berkaitan dengan senyawa yang diharapkan terekstrak bersama pelarut. Toksisitas pelarut berkaitan dengan penggunaan ekstrak lebih lanjut, jika akan diaplikasikan pada manusia, keamanan residu pelarut yang tertinggal terhadap kesehatan manusia harus diperhitungkan. Kemudahan pelarut untuk terbakar berkaitan dengan suhu dan sumber panas yang akan digunakan saat ekstraksi. Reaktivitas pelarut berkaitan dengan terjadinya pembentukan senyawa baru selama ekstraksi berlangsung. Penggunaan kembali pelarut dan harga pelarut berkaitan dengan nilai ekonomis pelarut.
Metode ekstraksi yang paling umum dilakukan adalah ekstraksi menggunakan pelarut pada tekanan atmosfer dan dapat disertai aplikasi panas (Houghton dan Raman, 1998). Namun, ada beberapa metode ekstraksi lain
yang dapat dilakukan seperti distilasi uap, Supercritical Fluid Extraction
1. Distilasi uap (penyulingan uap)
Penyulingan uap adalah metode paling umum digunakan untuk memperoleh minyak atsiri. Selain dengan penyulingan, minyak atsiri dapat juga diperoleh dengan enflurasi, maserasi dan dengan pelarut menguap. Penyulingan merupakan cara untuk memurnikan cairan (Koster, 2001). Pada saat penyulingan akan terjadi pemisahan komponen-komponen suatu campuran dari dua jenis campuran atau lebih berdasarkan perbedaan tekanan uap dari masing-masing zat tersebut. Ada 3 metode penyulingan yang dikenal dalam industri minyak atsiri, yaitu penyulingan dengan air, penyulingan dengan air dan uap, serta penyulingan dengan uap langsung. Perbedaan ketiga metode tersebut hanya pada cara penanganan bahan olahannya.
Sebagian besar minyak atsiri diperoleh dengan cara penyulingan uap. Pada proses penyulingan dengan uap langsung, bahan yang akan disuling diletakkan di dalam rak-rak atau saringan berlubang. Uap lewat panas bertekanan lebih dari 1 atmosfir dilewatkan melalui pipa uap melingkar yang berpori, yang terletak di bawah bahan dan uap bergerak ke atas melalui bahan yang terletak di atas saringan. Susunan alat penyulingan uap dapat dilihat pada Gambar 4.
Sebelum disuling, bahan dirajang terlebih dahulu. Bila bahan dibiarkan utuh, minyak atsiri hanya dapat diekstraksi jika uap air berhasil melalui jaringan tanaman dan mendesaknya ke permukaan. Hal ini terjadi secara difusi. Jika bahan dirajang, ukuran ketebalan untuk terjadinya proses difusi akan berkurang sehingga saat penyulingan, laju penguapan minyak atsiri dari bahan menjadi lebih cepat. Namun, perajangan memiliki kelemahan, yaitu jumlah rendemen minyak atsiri akan berkurang seimbang dengan laju penguapan yang terjadi selama perajangan dan setelah perajangan serta komposisi minyak akan berubah dan akan mempengaruhi baunya (Ketaren, 1987).
Minyak atsiri adalah konsentrat berupa cairan bersifat hidrofobik yang
mengandung komponen volatil dari tanaman (Anonim, 2006c). Minyak atsiri
dikenal juga sebagai minyak eteris. Minyak atsiri terutama terdiri dari persenyawaan kimia mudah menguap, termasuk golongan hidrokarbon asiklik dan hidrokarbon isosiklik serta turunan hidrokarbon yang telah mengikat oksigen. Beberapa persenyawaan mengandung nitrogen dan belerang. Senyawa-senyawa dalam minyak atsiri tersebut dapat digolongkan ke dalam 4 kelompok besar yang dominan menentukan sifat minyak atsiri, yaitu terpen, persenyawaan berantai lurus, tidak mengandung rantai cabang, turunan benzena, dan bermacam-macam persenyawaan lainnya (Ketaren, 1987).
Bagian utama minyak atsiri adalah terpenoid, biasanya terpenoid terdapat pada fraksi atsiri yang tersuling uap. Zat inilah yang menyebabkan timbulnya wangi, harum, atau bau yang khas pada banyak tumbuhan (Harborne, 1996). Beberapa komponen terpenoid yang terdapat dalam minyak atsiri jintan hitam adalah carvone, alfa-pinene, sabinene,
beta-pinene, p-cymene (Anonim, 2006b).
Secara kimia, terpene minyak atsiri dapat dipilah menjadi dua golongan yaitu monoterpene dan seskuiterpena. Monoterpene dan seskuiterpen adalah isoprenoid, perbedaannya terletak pada titik didihnya.
Monoterpena memiliki titik didih 140-180 oC, sedangkan seskuiterpena
2. Ekstraksi dengan pelarut
Ekstraksi menggunakan pelarut dilakukan dengan mengkontakkan bahan baku pada pelarut selama periode waktu tertentu, kemudian dilanjutkan dengan pemisahan larutan dari ampas. Pelarut yang digunakan dalam ekstraksi disesuaikan dengan sifat komponen yang ingin diekstrak.
Hal ini berdasarkan prinsip like dissolve like. Oleh karena itu, komponen
yang terekstrak akan memiliki kepolaran yang mirip dengan pelarut yang digunakan dalam ekstraksi. Jika telah diketahui kepolaran senyawa yang akan diekstrak, akan lebih mudah menentukan metode ekstraksi dan pelarut yang digunakan. Namun, jika belum diketahui kepolaran senyawa yang akan diekstrak, umumnya dilakukan ekstraksi bertingkat dengan beberapa pelarut yang memiliki kepolaran yang berbeda-beda. Beberapa pelarut yang umum digunakan untuk ekstraksi dapat dilihat pada Tabel 4.
Tabel 4. Pelarut yang umum digunakan untuk ekstraksi Heksan
Benzen, toluene
Dietileter Kloroform, diklorometan Etil asetat Butanon Aseton
Butanol Etanol Metanol Air
Larutan asam, larutan basa
(Sumber : Houghton dan Raman, 1998)
Pelarut yang digunakan dalam penelitian ini adalah heksan, etil asetat, etanol, metanol, dan air. Berdasarkan perbandingan nilai polaritasnya, dalam penelitian ini heksan digolongkan sebagai pelarut yang bersifat non polar, etil asetat dan etanol digolongkan sebagai pelarut yang bersifat semi polar, serta air dan metanol digolongkan sebagai pelarut yang bersifat polar. Nilai polaritas beberapa pelarut dapat dilihat pada Tabel 5.
Tabel 5. Nilai polaritas beberapa pelarut
Pelarut Polaritas (ε) Pelarut Polaritas (ε)
Karbondioksida 0.00 Etil asetat 0.38
Pentana 0.00 Aseton 0.47
Heksan 0.00 Etanol 0.68
Toluen 0.29 Metanol 0.73
Benzen 0.32 Air 0.90
(Sumber : Moyler, 1995 dalam Ardiansyah, 2001)
Metode yang sederhana dari ekstraksi dengan pelarut adalah perkolasi. Pada perkolasi, bahan dikontakkan langsung dengan pelarut pada suhu ruang ataupun di atas suhu ruang. Bahan yang akan diekstrak dimasukkan ke dalam tabung yang memiliki keran dan saringan di bagian bawahnya, kemudian pelarut dituang di atas bahan tersebut. Pada saat keran dibuka, pelarut akan mengalir melewati bahan dan menetes sedikit demi sedikit. Oleh karena adanya saringan, bahan tidak ikut terbawa oleh pelarut, tetapi senyawa kimia yang diinginkan akan ikut terbawa dalam pelarut.
Hal yang menjadi kelebihan metode perkolasi adalah tidak perlu dilakukan proses penyaringan. Kelemahan metode perkolasi adalah waktu kontak antara bahan dan pelarut terbatas serta suhu yang digunakan rendah sehingga komponen tidak terekstrak sempurna. Selain itu, suhu pelarut yang digunakan kemungkinan sudah berkurang sehingga kurang efektif dalam mengekstrak komponen.
Selain dengan cara perkolasi, ekstraksi dapat dilakukan dengan cara
refluks. Pada ekstraksi refluks, bahan yang akan diekstrak dikontakkan langsung dengan pelarut, yaitu dengan direndam selama waktu tertentu.
Gambar 5. Susunan alat ekstraksi refluks
Jika pelarut yang digunakan adalah air, asam, ataupun basa, sumber panas dapat berasal dari nyala api. Namun, jika digunakan pelarut yang memiliki titik didih kurang dari 100 oC, digunakan penangas air (water bath) sebagai sumber panas.
C. KARAKTERISTIK BAKTERI PATOGEN DAN BAKTERI PERUSAK PANGAN
Bahan pangan mengandung bakteri dengan jumlah dan jenis yang berbeda-beda. Jumlah dan jenis bakteri yang terdapat dalam bahan pangan akan menentukan umur simpan dan keamanan bahan pangan tersebut jika dikonsumsi. Umur simpan bahan pangan cenderung dipengaruhi oleh keberadaan bakteri pembusuk, sedangkan keamanan bahan pangan dipengaruhi oleh keberadaan bakteri patogen. Bakteri pembusuk/perusak pangan adalah bakteri yang dapat memecah komponen-komponen yang ada dalam bahan pangan menjadi senyawa yang lebih sederhana dan menyebabkan perubahan citarasa, penampakan, rasa ataupun aroma yang tidak dapat diterima oleh konsumen. Bakteri patogen adalah bakteri yang dapat menyebabkan penyakit pada manusia, baik secara infeksi ataupun intoksikasi.
Berdasarkan susunan dinding sel-nya, bakteri dapat digolongkan menjadi bakteri Gram positif dan bakteri Gram negatif. Perbedaan susunan dinding sel tersebut paling menyolok terlihat pada komposisi lapisan peptidoglikan. Dinding sel bakteri Gram positif terdiri dari 90% lapisan peptidoglikan dan lapisan tipisnya adalah asam teikoat, sedangkan dinding
Sumber
Kondens
Tetesan
bakteri Gram negatif, hanya 5-20% terdiri dari lapisan peptidoglikan dan lapisan lainnya terdiri dari protein, lipopolisakarida, dan lipoprotein (Fardiaz, 1992). Perbedaan susunan dinding sel ini akan menyebabkan perbedaan kesensitifan bakteri terhadap senyawa tertentu, seperti antibiotik penisilin. Penisilin adalah senyawa antimikroba/antibiotik yang yang bekerja dengan mencegah sintesis peptidoglikan pada sel yang sedang tumbuh. Oleh karena bagian yang dipengaruhi adalah peptidoglikan, bakteri Gram positif akan menjadi lebih sensitif terhadap penisilin daripada bakteri Gram negatif karena kandungan peptidoglikannya lebih banyak.
1. Bacillus cereus
Bacillus cereus merupakan bakteri Gram positif, bersifat anaerobik fakultatif, dan bersifat motil karena memiliki flagela peritrik. Secara
mikroskopik, Bacillus cereus berbentuk batang, mempunyai ukuran sel yang
besar, sekitar 1.0-1.2 µm dengan panjang 3.0-5.0 µm. Sebagian besar strain
Bacillus cereus bersifat mesofilik dan mampu tumbuh pada pangan berasam
rendah pada suhu 15 oC hingga 55 oC. Bacillus cereus bersifat patogen
meskipun sebagian besar golongan Bacillus bersifat non-patogen.
Bacillus cereus dapat membentuk spora yang tahan terhadap
pemanasan sehingga pemanasantidak dapat menghilangkan Bacillus cereus
secara maksimum. Bacillus cereus ditemukan pada susu pasteurisasi, daging
beku, dan sayur-sayuran (Granum et. al., 2000). Selain itu, Bacillus cereus
sering menyebabkan masalah pada nasi dan nasi goreng dan menyebabkan
keracunan pangan. Keracunan pangan oleh Bacillus cereus terjadi secara
intoksikasi, yaitu masuknya enterotoksin yang diproduksi oleh Bacillus
cereus ke dalam tubuh manusia. Gejala yang muncul adalah diare atau muntah dalam jangka waktu 2-16 jam setelah makanan dikonsumsi (Brooks
et. al. dalam Prescott et. al., 2003).
2. Staphylococus aureus
Staphylococus aureus merupakan bakteri Gram positif, non-motil, tidak membentuk spora dan bersifat katalase positif. Sebagian besar galur
dengan suhu optimum 35-40 oC. Dinding sel Staphylococus aureus
mengandung 3 komponen utama, yaitu peptidoglikan, asam teikoat, dan protein A yang berikatan secara kovalen dengan peptidoglikan
(Baird-Parker, 2000). Staphylococus aureus ditemukan pada kulit dan membran
mukous hewan berdarah panas. Selain itu ditemukan juga pada permukaan kulit manusia (Baird-Parker, 2000).
Staphylococus aureus bersifat patogen, yaitu dengan memproduksi enterotoksin yang akan menyebabkan penyakit jika dikonsumsi manusia. Enterotoksin diproduksi pada suhu antara 10-46 oC, optimum pada 40-45 oC (Jay, 2005). Gejala keracunan enterotoksin meliputi mual, muntah-muntah, keram perut, dan diare. Gejala tersebut muncul 1 hingga 8 jam setelah enterotoksin masuk ke dalam tubuh (Brooks et. al. dalam Prescott et. al.,
2003). Staphylococus aureus ditemukan pada daging sapi mentah, daging
ayam mentah, seafood, dan produk bakery (Baird-Parker, 2000).
Staphylococus aureus dapat bertahan dalam debu sehingga dapat
ditemukan pada siklon ataupun ventilasi. Secara umum, Staphylococus
aureus tidak mampu berkompetisi dengan biota normal yang banyak
terdapat pada pangan. Staphylococus aureus tidak kuat bersaing dengan
bakteri lainnya, sehingga tidak memberikan efek yang cukup berarti pada
makanan yang telah dimasak. Sel Staphylococus aureus lebih sensitif
terhadap panas dibandingkan dengan toksinnya. Bakteri yang diketahui antagonis terhadap Staphylococus aureus adalah Acinetobacter, Aeromonas,
Baccili, Enterobacteriaceae, Pseudomonas, dan Lactobaccilaceae (Jay, 2005).
3. Escherichia coli
Escherichia coli merupakan bakteri Gram negatif yang berbentuk batang, termasuk famili Enterobacteriaceae. Enterobacteriaceae merupakan
bagian dari flora usus manusia dan Escherichia coli merupakan
predominannya. Panjang sel Escherichia coli adalah sekitar 2.0-6.0 µm dan
Keberadaan Escherichia coli dalam bahan pangan mengindikasikan bahwa telah terjadi kontaminasi dari feses/kotoran manusia atau hewan
karena Escherichia coli secara normal ditemukan sebagai bagian dari flora
usus manusia segera setelah manusia dilahirkan (Willshaw et. al., 2000).
Kontaminasi bakteri Escherichia coli pada makanan biasanya berasal dari
kontaminasi air yang digunakan.
Tidak semua Escherichia coli mampu memproduksi toksin yang dapat
menyebabkan penyakit, hanya galur Enteropatogenik Escherichia coli
(EEC) saja yang dapat menyebabkan penyakit. Dosis yang dapat menimbulkan gejala infeksi Escherichia coli berkisar antara 108-109 sel.
Berdasarkan karakteristik penyakitnya, Escherichia coli dapat dibedakan
menjadi Enteropatogenik Escherichia coli, Enteroinvasive Escherichia coli,
Enterotoxigenic Escherichia coli, Vero Cytotoxin-Producing (Shiga Toxin
producing) Escherichia coli (VTEC) (STEC), Enteroaggregative and
Diffusely Adherent Escherichia coli (Willshaw et. al., 2000). Gejala yang terjadi umumnya adalah diare yang kadang-kadang disertai muntah dalam
jangka waktu 24-72 jam setelah makanan dikonsumsi (Brooks et. al. dalam
Prescott et. al., 2003).
4. Salmonella enterica serovar Typhimurium
Salmonella merupakan bakteri Gram negatif, fakultatif anaerob,
berbentuk batang, berukuran kecil, dan tidak membentuk spora. Salmonella
sulit dibedakan dengan Esherichia coli di bawah mikroskop ataupun pada
media pertumbuhan yang tidak selektif (umum). Salmonella digolongkan
menjadi dua spesies, yaitu Salmonella enterica dan Salmonella bongori
(D’Aoust, 2000). Kedua spesies tersebut dikelompokkan lagi menjadi subspecies-subspesies dan subspesies dikelompokkan lagi menjadi serovar.
Salmonella Typhimurium tergolong dalam spesies enterica serovar
Typhimurium. Suhu minimum untuk pertumbuhan Salmonella
Typhimurium adalah 6-20 oC, sedangkan suhu maksimum untuk
pertumbuhan Salmonella Typhimurium adalah 45oC. Suhu pertumbuhan
Bakteri dari genus Salmonella merupakan bakteri penyebab infeksi yang jika tertelan dan masuk ke dalam tubuh akan menimbulkan gejala yang
disebut salmonellosis. Salmonellosis yang paling sering terjadi adalah
gastroenteritis yang disebabkan oleh Salmonella Typhimurium. Makanan
yang sering terkontaminasi oleh Salmonella adalah telur dan hasil
olahannya, ikan dan hasil olahannya, daging ayam, daging sapi, susu dan
hasil olahannya. Keracunan pangan oleh Salmonella disebabkan karena
makanan mengandung jumlah Salmonella dalam jumlah yang signifikan
yaitu 107 sel.
5. Pseudomonas aeruginosa
Pseudomonas merupakan bakteri Gram negatif dari famili
Pseudomonadaceae. Pseudomonas secara alami terdapat pada tanah dan air.
Menurut Madigan et. al. (2000), secara ekologi Pseudomonas penting untuk mendegradasi sisa-sisa komponen dari hewan ataupun tanaman. Pseudomonas banyak ditemukan pada bahan pangan segar seperti sayuran,
daging, unggas, dan seafood (Jay, 2005) dansering menimbulkan kebusukan
makanan (Fardiaz, 1992). Bakteri ini bersifat motil dengan flagela polar.
Pseudomonas aeruginosa tumbuh dengan baik pada suhu 37 oC.
Pseudomonas aeruginosa ditemukan pada telur dan memproduksi senyawa-senyawa yang menimbulkan bau busuk dan pigmen piosianin yang berwarna
biru (Fardiaz, 1992). Pseudomonas spp. menyebabkan perubahan warna
pada keju dan ditemukan juga pada susu.
D. SENYAWA ANTIMIKROBA
Zat-zat yang digunakan sebagai antimikroba harus mempunyai beberapa kriteria ideal, antara lain aman, ekonomis, tidak menyebabkan perubahan citarasa dan aroma pada makanan, tidak mengalami penurunan aktivitas karena adanya komponen makanan, tidak menyebabkan timbulnya galur resisten, sebaiknya bersifat membunuh daripada hanya menghambat pertumbuhan mikroba serta memiliki spektrum yang luas karena jenis mikroba dalam pangan umumnya beragam jenis.
Menurut Branen dan Davidson (1993), senyawa kimia yang memiliki sifat sebagai antimikroba adalah sodium benzoat, asam benzoat, asam sorbat, sorbat, asam organik, sulfit, sulfur dioksida, nitrit, paraben, komponen fenolik, asam lemak rantai sedang/medium, ester, dimetil dikarbonat, dietil dikarbonat, nisin, natamisin, bakteriosin, halogen, senyawa surfaktan dan peroksida. Selain itu, senyawa fitokimia yang terdapat dalam tumbuhan seperti golongan fenolik, alkaloid, dan terpenoid juga memiliki aktivitas antimikroba.
Masing-masing senyawa antimikroba memiliki mekanisme yang berbeda-beda. Sebagian besar mekanisme senyawa fenolik sebagai antimikroba adalah dengan mempengaruhi membran sel (Branen dan Davidson, 1993). Hal ini didukung juga oleh pernyataan Sikkema dalam Lambert (2001) yang menyebutkan bahwa komponen fenol dapat mempengaruhi membran sel bakteri. Menurut Vas dalam Branen dan Davidson (1993), komponen fenol dapat merusak membran sitoplasma mikroba dan menyebabkan kehilangan komponen sitoplasma. Judi dalam Branen dan Davidson (1993) juga menyebutkan bahwa komponen fenolik dapat menyebabkan kerusakan fisik pada membran sel ataupun pada penahan permeabilitas. Komponen fenol juga dapat mendenaturasi enzim yang bertanggung jawab terhadap germinasi spora atau berpengaruh terhadap asam amino yang terlibat dalam proses germinasi (Nychas dalam Ardiansyah, 2001). Senyawa fenolik bermolekul besar mampu menginaktifkan enzim esensial di dalam sel mikroba meskipun pada konsentrasi yang sangat rendah.
dengan komponen nitrogen seperti asam amino dan protein, sehingga dapat
menghambat pertumbuhan sel. Menurut Knobloch et. al. dalam Dorman et. al.
(2000), komponen terpenoid dapat mempengaruhi mekanisme biokimia, seperti penghambatan transpor elektron, penghambatan translokasi protein, penghambatan fosforilasi ataupun penghambatan reaksi yang terkait dengan enzim.
Menurut Helander dalam Lambert (2001), senyawa thymol dan carvacrol dapat menghancurkan plasma membran sel. Selain itu, senyawa
thymol dan carvacrol dapat memecahkan membran luar Escherichia coli dan
Salmonella Typhimurium pada konsentrasi mendekati nilai MIC. Menurut Tranter et. al., Gonzalez et. al., Ultee et. al., dan Tassou et. al. dalam Lambert
et. al., (2001), minyak atsiri, komponen fenol, dan bakteriosin dapat menyebabkan kebocoran sel sehingga akan kehilangan berbagai komponen seperti ion, ATP, asam nukleat, dan asam amino.
Antibiotik adalah senyawa yang diproduksi oleh mikroba dan mempunyai kemampuan untuk menghambat atau membunuh bakteri dan mikroba lainnya, digunakan terutama untuk mengobati penyakit infeksi pada manusia, hewan dan tanaman. Antibiotik adalah suatu senyawa kimia yang diturunkan dari atau diproduksi oleh organisme hidup, yang dalam kadar kecil mampu menghambat proses hidup mikroorganisme. Suatu senyawa dapat digolongkan sebagai antibiotik jika merupakan produk metabolisme (walaupun dapat dibuat secara sintetis), suatu produk sintetik dengan struktur serupa dengan antibiotik yang terdapat di alam, mengantagoniskan pertumbuhan dan atau kelangsungan hidup satu atau lebih jenis mikroorganisme, serta efektif dalam kadar rendah. Beberapa mekanisme aksi antibiotik yang umum dapat dilihat pada Tabel 7 berikut ini.
Tabel 7. Mekanisme aksi beberapa antibiotik
Tempat aksi Antibiotik Proses yang diganggu Tipe aktivitas
Dinding sel Basitrasin
Sikloserin Penisilin
Sintesis mukopeptida Sintesis peptid dinding sel Ikatan silang dinding sel
Bakterisidal Bakterisidal Bakterisidal
Antibiotik yang mengganggu sistem metabolik mikroorganisme dan tidak pada sel mamalia merupakan zat antiinfeksi yang paling berhasil, misalnya zat yang mengganggu sintesis dinding sel bakteri akan berpotensi tinggi untuk toksisitas selektif. Sifat sidal dan statik penting untuk pengobatan infeksi yang serius, terutama jika mekanisme pertahanan penderita menjadi berkurang atau meluap-luap oleh infeksi.
Antibiotik beta-laktam merupakan antibiotik yang mengandung cincin beta-laktam dalam strukturnya. Antibiotik beta-laktam terbagi menjadi dua golongan yaitu penisilin dan sefalosforin. Antibiotik beta-laktam memiliki spektrum antimikroba yang luas, memiliki aksi sidal yang kuat dan cepat melawan bakteri dalam fase pertumbuhan serta sangat rendah kejadian toksik dan reaksi buruk lainnya pada inang. Mekanisme aksi letal zat ini adalah dengan menghambat sintesis dinding sel bakteri. Hambatan terhadap biosintesis peptidoglikan, yang dibutuhkan untuk membuat dinding sel bakteri menjadi tegar, merupakan mekanisme dasar. Dengan tidak terbentuknya peptidoglikan, ketegaran dinding sel tidak terbentuk penuh dan terjadi lisis karena naiknya tekanan osmosis internal yang merupakan efek perkembangan sel bakteri.
E. UJI AKTIVITAS ANTIMIKROBA
Aktivitas antimikroba adalah kemampuan untuk menghambat
pertumbuhan mikroba, termasuk bakteriostatik maupun fungistatik (Hirasa et.
al., 1998). Metode untuk menganalisis aktivitas antimikroba dipengaruhi oleh
media analisis, senyawa antimikroba, prosedur analisis. Komponen antimikroba dapat saja berhasil pada kondisi pengujian, tetapi tidak menunjukkan aktivitas yang cukup baik saat diaplikasikan pada produk pangan. Sel vegetatif yang sedang tumbuh lebih sensitif daripada spora terhadap tekanan lingkungan dari senyawa antimikroba.
Metode untuk menganalisis aktivitas antimikroba dapat dibedakan
menjadi dua, yaitu in vitro dan aplikasi pada produk pangan (Branen dan
Davidson, 1993). Metode in vitro tidak mengaplikasikan senyawa antimikroba
CH3
CH3
bahan. Metode in vitro dapat dibedakan lagi menjadi 3, yaitu metode
pengenceran (dilution methods), metode difusi agar, dan metode turbidimetri. Masing-masing metode tersebut memiliki kekurangan dan kelebihan.
Metode difusi agar memiliki kelebihan yaitu sederhana untuk dilakukan, kekurangannya adalah senyawa antimikroba yang akan diuji harus bersifat hidrofilik agar dapat berdifusi dengan baik ke dalam agar. Metode pengenceran memiliki keunggulan, yaitu dapat diketahui terjadinya kontaminasi, dan dapat dilakukan untuk bahan yang warnanya keruh (Barry dalam Branen dan Davidson, 1993). Metode turbidimetri memiliki kelebihan, yaitu cepat, tidak destruktif dan tidak mahal, sedangkan kekurangannya, yaitu sensitivitasnya rendah. Metode yang digunakan dalam penelitian ini adalah metode in vitro, yaitu dengan difusi agar.
Metode difusi agar dilakukan dengan memasukkan komponen antimikroba ke dalam agar baik dengan kertas saring ataupun dalam sumur. Komponen akan berdifusi ke dalam agar dan akan menghambat pertumbuhan mikroba yang terkandung dalam agar. Namun, untuk komponen antimikroba yang hidrofobik, akan sulit berdifusi ke dalam agar karena agar bersifat polar / hidrofilik. Oleh karena itu digunakan DMSO yang bersifat seperti emulsifier, memiliki gugus hidrofilik dan hidrofobik agar senyawa yang bersifat hidrofobik dapat larut dalam agar. Sruktur DMSO dapat dilihat pada Gambar 6 berikut ini.
Gambar 6. Struktur DMSO [(CH3)2SO]
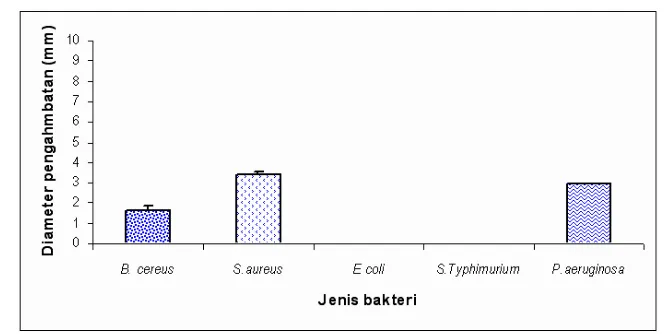
Hasil analisis menggunakan metode difusi agar bersifat kualitatif. Menurut Branen dan Davidson (1993), jika diameter penghambatan lebih besar dari 30 mm, aktivitas antimikroba digolongkan besar. Jika diameter penghambatan antara 20 mm-30 mm, aktivitas antimikroba digolongkan sedang dan jika diameter penghambatan kurang dari 20 mm, aktivitas
antimikrobanya digolongkan kecil. Namun, menurut Harris et. al. dan
dengan difusi agar biasanya banyak memberikan kesalahan negatif. Selain untuk uji bersifat kualitatif, metode difusi agar dapat dilakukan untuk memperoleh data kuantitatif, misalnya untuk menentukan nilai konsentrasi minimum dari senyawa antimikroba.
F. SENYAWA FITOKIMIA
Fitokimia merupakan suatu disiplin ilmu yang mempelajari struktur kimia, biosintesis, perubahan dan metabolisme, penyebaran secara ilmiah dan fungsi dari ragam senyawa organik yang dibentuk oleh tumbuhan. Berdasarkan biogenesisnya, yaitu sumber bahan baku dan jalur biosintesisnya, senyawa kimia dapat dibedakan menjadi metabolit primer dan metabolit sekunder. Metabolit primer adalah senyawa yang merupakan penyusun utama makhluk hidup, seperti polisakarida, protein, lemak, dan asam nukleat. Metabolit sekunder adalah senyawa yang tidak berperan sebagai penyusun utama makhluk hidup, tetapi memiliki peranan lain misalnya untuk pertahanan
diri. Croteau et. al. (2000) dalam Still (2002) mendefinisikan senyawa
fitokimia sebagai metabolit sekunder dari tumbuhan. Berdasarkan biosintesisnya, Still (2002) mengelompokkan metabolit sekunder menjadi 3 golongan, yaitu golongan terpen dan terpenoid, golongan alkaloid dan golongan fenilpropanoid.
1. Fenol
Senyawa fenol tumbuhan dapat menimbulkan gangguan besar karena mampu membentuk kompleks dengan protein melalui ikatan hidrogen. Akibatnya kerja enzim dapat terganggu (Harborne, 1996). Jika dikelilingi oleh oksidator, komponen fenolik umumnya bertindak sebagai ligan untuk ion logam. Dengan demikian, saat ditambahkan ion feri pada larutan yang mengandung fenol akan terbentuk kompleks berwarna hijau tua, biru atau biru kehitaman (Houghton dan Raman, 1998). Komponen fenolik dapat melignifikasi dinding sel bakteri sehingga keberadaan komponen fenolik dapat menghambat pertumbuhan bakteri.
Flavonoid merupakan golongan terbesar dari senyawa fenol. Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan aglikon flavonoid. Dalam satu tumbuhan mungkin terdapat dalam beberapa kombinasi glikosida (Harborne, 1996). Flavonoid terdapat dalam tumbuhan sebagai campuran. Jarang ditemukan flavonoid tunggal dalam jaringan tumbuhan.
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat khusus dalam jaringan kayu. Tanin dapat bereaksi dengan protein membentuk kopolimer mantap yang tidak larut dalam air (Harborne, 1996). Dalam tumbuhan, letak tanin terpisah dari protein dan enzim sitoplasma tetapi jika jaringan rusak, misalnya dimakan oleh hewan, terjadi reaksi penyamakan.
2. Terpenoid
Terpenoid mencakup sejumlah besar senyawa tumbuhan. Terpenoid terdiri atas beberapa macam senyawa mulai dari komponen minyak atsiri, yaitu monoterpena dan seskuiterpena yang mudah menguap, diterpena yang lebih sukar menguap serta senyawa yang tidak menguap, yaitu triterpenoid dan sterol serta pigmen karotenoid.
Mudah menguap
Sulit menguap
Tidak menguap
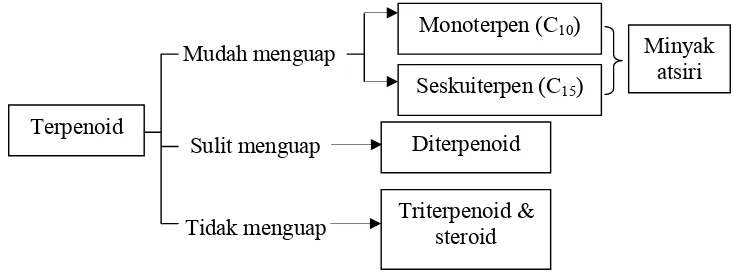
Terpenoid merupakan bagian utama minyak atsiri. Secara kimia, terpena minyak atsiri dapat dipilah menjadi dua golongan, yaitu monoterpena dan seskuiterpena. Monoterpena dapat dipilah lagi menjadi tiga golongan yaitu asiklik (misalnya geraniol), monosiklik (misalnya limonena) dan bisiklik (misalnya alfa pinena dan beta pinena). Monoterpena sederhana tersebar luas dan cenderung merupakan bagian dari kebanyakan minyak atsiri. Secara lebih sederhana, penggolongan senyawa terpenoid dapat dilihat pada Gambar 7 berikut ini.
[image:34.612.137.504.247.383.2]
Gambar 7. Penggolongan senyawa terpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon asiklik, yaitu skualena. Triterpenoid merupakan senyawa tidak berwarna, berbentuk kristal, seringkali bertitik didih tinggi dan aktif optik. Triterpenoid dapat dipilah menjadi empat golongan senyawa, yaitu triterpena, steroid, saponin, dan glikosida jantung. Saponin dan glikosida jantung merupakan triterpena atau steroid yang terdapat sebagai glikosida. Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana penhidrofenantrena. Tiga senyawa yang umum disebut sebagai fitosterol mungkin terdapat di setiap tumbuhan tinggi yaitu sitosterol, stigmasterol, dan kampesterol.
Saponin adalah glikosida triterpena dan sterol, merupakan senyawa aktif permukaan dan bersifat seperti sabun serta dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis darah. Pembentukan busa yang mantap (tahan lama) sewaktu mengekstraksi tumbuhan atau Terpenoid
Diterpenoid Monoterpen (C10)
Triterpenoid & steroid
Seskuiterpen (C15)
sewaktu memekatkan tumbuhan. Saponin, baik triterpen maupun steroidal,
memiliki sifat antimikroba (Naidu, 2000). Menurut Zablotowicz et. al. dan
Hoagland et. al. seperti dikutip oleh Naidu (2000), efek yang umum dari
aktivitas saponin pada bakteri adalah kebocoran sel sehingga terjadi kehilangan protein dan enzim dari sel.
3. Alkaloid
III. BAHAN DAN METODE PENELITIAN
A. BAHAN DAN ALAT
Bahan baku berupa biji jintan hitam kering diperoleh dari Pasar Tanah Abang, Jakarta. Pelarut yang digunakan untuk proses ekstraksi meliputi aquades, heksana teknis, etil asetat teknis, metanol teknis, etanol teknis 96 %
diperoleh dari CV. Panca Pratama Bogor. Kultur bakteri Staphylococus
aureus, Escherichia coli, Salmonella Typhimurium, Pseudomonas aeruginosa, dan Bacillus cereus diperoleh dari Laboratorium Mikrobiologi Pangan, Departemen Ilmu dan Teknologi Pangan IPB. Bahan-bahan yang dibutuhkan untuk uji aktivitas antimikroba dan uji fitokimia meliputi media
Nutrient Broth (NB), media Nutrient Agar (NA), antibiotik amoxycillin, NaCl, Dimetil Sulfoksida (DMSO), HgCl2, Kalium Iodida, asam sulfat pekat, larutan
FeCl3, kloroform, amoniak, gelatin, aquades, eter, asam asetat glasial.
Bahan-bahan lain yang dibutuhkan adalah parafilm, spiritus, alkohol 70 %, kertas saring Whatman No 1, aluminium foil, kapas, korek api, kertas label, gas N2,
es batu, tissue, aluminium foil, dan plastik tahan panas (High Density
Polietilen / HDPE).
Peralatan yang digunakan meliputi alat refluks (tabung refluks, penangas
air dan kondensor), alat penyaring vakum, alat rotavapor, oven vakum, oven,
otoklaf, inkubator, refrigerator, hot plate, blender kering, neraca analitik, alat
vorteks, gelas ukur, gelas piala, labu erlenmeyer, labu lemak, cawan petri, tabung reaksi tanpa tutup, tabung reaksi bertutup, botol berwarna gelap ukuran 150 ml, botol kecil berwarna gelap ukuran 10-25 ml, pipet mikron, pipet Mohr, pipet tetes, jangka sorong, sudip, sendok, bunsen, bulb, ose, mangkok, baskom, keranjang, loyang, dan spidol waterproof.
B. TEMPAT DAN WAKTU
C. METODE PENELITIAN
Dalam pelaksanaannya, penelitian ini dibagi dalam dua tahapan, yaitu penelitian pendahuluan dan penelitian lanjutan. Tahapan penelitian secara keseluruhan dapat dilihat pada Lampiran 1.
1. Penelitian pendahuluan
a. Penghitungan jumlah mikroba uji pada umur 24 jam (Metode Hitungan Cawan)
Penghitungan jumlah mikroba uji pada umur 24 jambertujuan untuk
mengetahui jumlah sel dari satu ose kultur mikroba, setelah ditumbuhkan selama 24 jam dalam 10 ml Nutrient Broth. Setelah diketahui jumlah sel mikroba dalam 10 ml Nutrien Broth, dapat ditentukan pengenceran yang perlu dilakukan untuk memperoleh sekitar 105 sel per ml media agar.
Kultur dari agar miring digores sebanyak satu ose dan dimasukkan ke dalam 10 ml NB steril, kemudian diinkubasi selama 24 jam pada suhu 37 ºC. Setelah waktu inkubasi tercapai, diambil 1 ml dan dipindahkan ke dalam 9 ml NB steril kemudian diinkubasi selama 24 jam pada suhu 37 ºC. Setelah waktu inkubasi tercapai, diambil 1 ml dan dipindahkan ke dalam 9 ml larutan pengencer steril.
Seri pengenceran dibuat dari 1:101, 1:102, 1:103 hingga 1 : 108. Pada pengenceran ke-5, pengenceran ke-6, pengenceran ke-7 dan pengenceran ke-8, diambil 1 ml dan dimasukkan ke dalam cawan petri steril kemudian dituang agar. Agar digoyang pelan supaya sel mikroba menyebar rata di dalam agar. Setelah agar membeku, diinkubasi pada suhu 37 ºC selama 48 jam. Setelah waktu inkubasi tercapai, dilakukan penghitungan jumlah mikroba. Proses persiapan kultur mikroba secara rinci dapat dilihat pada Lampiran 2.
b. Ekstraksi komponen antimikroba secara ekstraksi tunggal
menggunakan pelarut dengan metode refluks, sedangkan minyak atsiri akan diperoleh dari proses distilasi uap. Proses ekstraksi menggunakan pelarut air dan pelarut etanol dilakukan di Laboratorium Kimia Pangan, Pusat Antar Universitas, Institut Pertanian Bogor, sedangkan destilasi uap dilakukan di Balai Tanaman Rempah dan Obat (Balitro), Bogor.
Setelah diperoleh ekstrak air, ekstrak etanol dan minyak atsiri, masing-masing ekstrak akan diuji aktivitas antimikrobanya dengan metode
difusi agar terhadap bakteri Staphylococus aureus, Escherichia coli,
Salmonella Typhimurium, Pseudomonas aeruginosa, dan Bacillus cereus. Ekstrak yang menunjukkan aktivitas antimikroba yang baik, yaitu memiliki spektrum yang luas dan nilai diameter penghambatan yang besar,
akan diuji lanjut dengan penentuan nilai Minimum Inhibitory
Concentration (MIC) dan diidentifikasi komponen fitokimianya.
Metode refluks dilakukan dengan mengkontakkan bahan secara
langsung dengan pelarut, yaitu dengan memasukkan bahan dan pelarut ke
dalam tabung refluks. Sebelum tabung refluks yang berisi bahan dan
pelarut dipasang pada alat refluks, alat refluks dipanaskan mendekati suhu
titik didih pelarut. Untuk pelarut air, alat refluks dipanaskan hingga
mendekati suhu 100 oC (98-99 oC), sedangkan untuk pelarut etanol alat
refluks dipanaskan hingga mendekati suhu 70 oC (68-69 oC).
Pada saat suhu yang diinginkan sudah tercapai, tabung refluks yang
berisi bahan dan pelarut dipasang pada alat refluks. Pelarut akan
mengekstrak komponen antimikroba dari bahan. Pada saat titik didih pelarut tercapai, pelarut akan menguap. Untuk mengurangi kehilangan pelarut, kondensor dipasang di atas tabung refluks. Dengan demikian, saat pelarut yang menguap melewati kondensor yang dingin, pelarut tersebut akan jatuh kembali ke dalam tabung refluks.
Ekstraksi dengan metode refluks ini dilakukan dua kali. Ekstraksi
pertama dilakukan selama 3 jam, sedangkan ekstraksi kedua dilakukan selama 2 jam. Setelah waktu ekstraksi pertama tercapai (3 jam), tabung
refluks untuk diekstrak kedua kalinya. Ampas ditambah pelarut dengan jumlah yang sama seperti pada ekstraksi pertama. Tabung refluks dipasang
kembali pada alat refluks dan dioperasikan selama 2 jam. Setelah waktu
refluks tercapai, cairan yang diperoleh disaring dan digabungkan dengan filtrat pertama.
Bahan yang digunakan dalam ekstraksi pertama dalam keadaan kering, sedangkan bahan yang digunakan pada ekstraksi kedua masih mengandung sebagian pelarut yang tersisa setelah ekstraksi pertama. Ratio bahan dan pelarut pada ekstraksi pertama adalah 1:3. Jumlah pelarut yang ditambahkan pada ekstraksi kedua sama dengan jumlah pelarut yang ditambahkan pada ekstraksi pertama sehingga ratio bahan dan pelarut pada ekstraksi kedua tidak tepat 1:3.
Setelah proses refluks selesai dilakukan dua kali, filtrat yang
diperoleh dikurangi jumlah pelarutnya dengan cara diuapkan
menggunakan rotavapor. Untuk filtrat air, penguapan pelarut dilakukan
pada suhu 50 oC, sedangkan untuk filtrat etanol, penguapan pelarut
dilakukan pada suhu 40-45 oC. Setelah di-rotavapor, sebagian pelarut
masih tertinggal dalam ekstrak sehingga dilakukan penghembusan gas N2
untuk menguapkan seluruh pelarut. Penghembusan gas N2 dilakukan
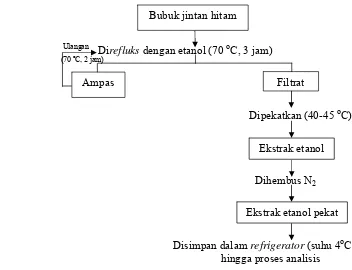
hingga ekstrak mencapai berat stabil, yaitu pengurangan bobot ekstrak kurang dari 0,001 g. Ekstrak yang diperoleh kemudian disimpan pada suhu kurang dari 4 oC (suhu refrigerator).
Air sangat sulit diuapkan seluruhnya dari ekstrak. Walaupun telah
di-rotavapor pada suhu 50 oC dan dihembus gas N2, belum semua kandungan
air dalam ekstrak menguap. Setelah dihembus gas N2 selama kurang lebih
Ulangan
Direfluks dengan air (100 oC, 3 jam)
(100 ºC, 2 jam)
`
Dipekatkan (50 oC)
Dihembus N2
[image:40.612.199.502.73.307.2]Disimpan dalam refrigerator (suhu 4oC) hingga proses analisis
Gambar 8. Diagram proses ekstraksi tunggal menggunakan pelarut air
Ulangan
Direfluks dengan etanol (70 oC, 3 jam)
(70 ºC, 2 jam)
`
Dipekatkan (40-45 oC)
Dihembus N2
Disimpan dalam refrigerator (suhu 4oC) hingga proses analisis
Gambar 9. Diagram proses ekstraksi tunggal menggunakan pelarut etanol
Ampas Filtrat
Ekstrak etanol Bubuk jintan hitam
Ampas Filtrat
Ekstrak air Bubuk jintan hitam
[image:40.612.149.501.367.637.2]2. Penelitian Lanjutan
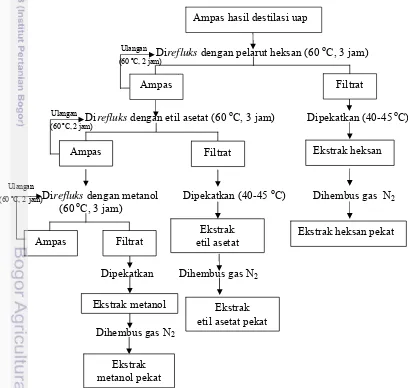
Penelitian lanjutan dilakukan dengan mengekstraksi komponen antimikroba secara ekstraksi bertingkat. Ekstraksi bertingkat dengan pelarut organik akan memisahkan komponen antimikroba dalam jintan hitam secara lebih spesifik dan komponen antimikroba akan lebih terkonsentrasi. Dengan ekstraksi secara bertingkat, diharapkan diperoleh konsentrasi komponen antimikroba yang lebih tinggi lagi pada masing-masing ekstrak.
Proses ekstraksi bertingkat dilakukan terhadap biji jintan hitam yang telah dihilangkan/diambil minyak atsirinya. Ampas hasil destilasi uap minyak atsiri diekstrak bertingkat secara refluks menggunakan tiga pelarut yang kepolarannya berbeda yaitu heksan, etil asetat dan metanol secara berurutan sehingga diperoleh ekstrak heksan, ekstrak heksan-etil asetat, dan ekstrak heksan-etil asetat-metanol. Selanjutnya, ekstrak heksan-etil asetat akan disebut sebagai ekstrak etil asetat dan ekstrak heksan-etil asetat-metanol akan disebut ekstrak asetat-metanol.
Teknik refluks secara ekstraksi bertingkat pada dasarnya sama dengan teknik refluks yang dilakukan secara ekstraksi tunggal. Untuk setiap pelarut, ekstraksi dilakukan dua kali. Ekstraksi pertama dilakukan selama 3 jam dan ekstraksi kedua dilakukan selama 2 jam. Bahan yang digunakan dalam ekstraksi pertama dalam keadaan kering, sedangkan bahan yang digunakan pada ekstraksi kedua masih mengandung sebagian pelarut yang tersisa setelah ekstraksi pertama. Ratio bahan dan pelarut pada ekstraksi pertama adalah 1:3. Jumlah pelarut yang ditambahkan pada ekstraksi kedua sama dengan jumlah pelarut yang ditambahkan pada ekstraksi pertama sehingga ratio bahan dan pelarut pada ekstraksi kedua tidak tepat 1:3. Setelah proses
refluks selesai dilakukan dua kali, filtrat yang diperoleh di-rotavapor untuk
mengurangi jumlah pelarutnya. Setelah di-rotavapor, filtrat dihembus gas
N2 untuk menguapkan seluruh pelarut. Ekstrak disimpan pada suhu 4 oC
(suhu refrigerator) sampai proses analisis. Ekstrak siap diuji aktivitas
Ulangan
(60 ºC, 2jam)
Perbedaan antara proses refluks secara tunggal dan proses refluks
secara bertingkat terletak pada suhu yang digunakan saat refluks, suhu yang
digunakan saat rotavapor dan perlakuan terhadap bahan. Suhu yang
digunakan saat refluks adalah 60 oC dan suhu yang digunakan saat
rotavapor adalah 40 oC. Perbedaan perlakuan pada ekstraksi bertingkat adalah ampas bahan setelah ekstraksi tidak dibuang melainkan digunakan kembali untuk ekstraksi menggunakan pelarut yang lain. Setelah ekstraksi kedua, ampas dikering-anginkan minimal selama satu malam dan di-oven
vakum minimal selama 30 menit pada suhu 40 oC sebelum diekstrak
kembali menggunakan pelarut yang berbeda. Gambaran lebih sederhana mengenai proses ekstraksi bertingkat dapat dilihat pada Gambar 10.
Ulangan
Direfluks dengan pelarut heksan (60 oC, 3 jam)
(60 ºC, 2 jam)
`
Ulangan
Direfluks dengan etil asetat (60 oC, 3 jam) Dipekatkan (40-45 oC)
(60 ºC, 2 jam)
Direfluks dengan metanol Dipekatkan (40-45 oC) Dihembus gas N2
(60 oC, 3 jam)
Dipekatkan Dihembus gas N2
Dihembus gas N2
Ampas Filtrat
Ekstrak heksan
Ampas Filtrat
Ampas Filtrat
Ekstrak etil asetat
Ekstrak metanol
Ampas hasil destilasi uap
Ekstrak etil asetat pekat
Ekstrak heksan pekat
[image:42.612.91.499.300.688.2]Ekstrak metanol pekat
Suhu yang digunakan pada saat refluks menggunakan heksan adalah
60 oC dan suhu rotavapor yang digunakan untuk memekatkan ekstrak
tersebut adalah 40 oC. Ampas sisa ekstraksi menggunakan heksan tidak
dibuang, melainkan dikering-anginkan minimal selama semalam dan
di-oven vakum minimal selama 30 menit pada suhu 40 oC sebelum diekstrak
kembali menggunakan pelarut etil asetat. Ampas dikering-anginkan untuk menguapkan heksan dari ampas. Ampas di-oven vakum untuk benar-benar memastikan bahwa seluruh heksan sudah menguap dari ampas.
Suhu yang digunakan pada saat refluks menggunakan etil asetat adalah
60 oC dan suhu rotavapor yang digunakan untuk memekatkan ekstrak
tersebut adalah 40 oC. Ampas sisa ekstraksi menggunakan heksan tidak
dibuang, melainkan dikering-anginkan minimal selama semalam dan
di-oven vakum minimal selama 30 menit pada suhu 40 oC sebelum diekstrak
kembali menggunakan pelarut metanol. Tujuan ampas dikering-anginkan dan dioven vakum adalah untuk menguapkan etil asetat dari ampas. Suhu
yang digunakan pada saat refluks menggunakan metanol adalah 60 oC dan
suhu rotavapor yang digunakan untuk memekatkan ekstrak tersebut adalah
40 oC.
D. METODE ANALISIS
1. Analisis kadar air pada ekstrak air jintan hitam (Metode distilasi azeotropik) (Apriantono et. al., 1989)
Analisis kadar air dilakukan dengan metode azeotropik karena sampel mengandung senyawa yang mudah menguap. Air akan dikeluarkan dari sampel dengan cara distilasi azeotropik kontinyu menggunakan pelarut immicible. Air akan terkumpul dalam labu Bidwel-Sterling dan akan selalu berada pada bagian bawah karena berat jenisnya lebih berat dari berat jenis pelarut.
Pemanas berjaket, tabung penerima “Bidwel Sterling”, kondensor tipe “cold finger” dirangkai. Setelah alat selesai dirangkai, sebanyak 2 gram sampel dimasukkan ke dalam labu didih ataupun erlenmeyer yang sudah
(toluena, silena ataupun pelarut lain). Labu didih ataupun erlenmeyer dirangkaikan pada alat distilasi azeotropik.
Campuran bahan dan pelarut tersebut dipanaskan dengan pemanas
listrik dan refluks perlahan-lahan dengan suhu rendah selama 45 menit.
Setelah itu, dilanjutkan pada suhu yang lebih tinggi selama 1-1.5 jam. Setelah waktu distilsi tercapai, baca volume air yang terdistilasi pada Labu Bidwel-Sterling. Kadar air adalah perbandingan volume air yang diperoleh dengan jumlah sampel yang diambil, kemudian dikalikan 100.
2. Pengujian aktivitas antimikroba (Garriga et. al., 1993 yang dimodifikasi)
Sebelum diuji aktivitas antimikrobanya, ekstrak pekat diencerkan terlebih dahulu menggunakan DMSO hingga konsentrasinya sebesar 28 % (w/w). Kultur uji yang telah disiapkan, yaitu yang telah disegarkan dalam NB selama 24 jam, diinokulasikan sejumlah A (sesuai hasil yang didapat pada persiapan kultur pada Lampiran 2) ke dalam media NA. Campuran antara media dan kultur tersebut kemudian dituang ke dalam cawan petri dan ditunggu hingga membeku. Setelah agar membeku, dibuat lubang-lubang sumur dengan diameter sekitar 6 mm. Setiap cawan petri dibuat 6 sumur, 2 sumur diisi kontrol negatif (DMSO), 2 sumur diisi kontrol positif (Amoxycillin 0.01% w/v) dan 2 sumur lagi diisi ekstrak rempah,
masing-masing sebanyak 50 µl. Cawan kemudian dimasukkan ke dalam refrigerator
selama kurang lebih satu jam untuk memberi kesempatan agar ekstrak meresap terlebih dahulu ke dalam agar. Setelah itu, diinkubasikan pada suhu
37 oC selama 24 jam. Pengukuran uji aktivitas antimikroba dilakukan
sebanyak dua kali ulangan dan duplo. Dua kali ulangan dengan pengertian ekstrak yang sama diuji aktivitas antimikrobanya pada 2 cawan yang berbeda, sedangkan duplo dengan pengertian dalam 1 cawan terdapat 2 lubang yang berisi sampel yang sama.
satu lubang yang hanya berisi DMSO sebagai kontrol negatif. Tahapan difusi agar secara lebih jelas dapat dilihat pada Lampiran 3. Pada saat melakukan difusi agar, dilakukan juga penghitungan jumlah mikroba seperti pada persiapan kultur (pada Lampiran 2) sebagai uji konfirmasi untuk mengetahui jumlah mikroba yang benar-benar dimasukkan ke dalam media agar.
3. Penentuan nilai Minimum Inhibitory Concentration (modifikasi metode Bloomfield, 1991)
Penentuan nilai MIC dengan metode Bloomfield (1991) dilakukan seperti uji aktivitas antimikroba dengan metode difusi agar. Jumlah mikroba yang harus berada dalam agar, penghitungan zona bening/zona penghambatan dan cara pengerjaannya sama dengan ketentuan pada metode difusi agar. Perbedaannya hanya terletak pada konsentrasi ekstrak yang dimasukkan ke dalam sumur. Jika hanya ingin mengetahui aktivitas antimikroba, ekstrak yang dimasukkan ke dalam sumur terdiri dari satu konsentrasi. Jika ingin mengetahui nilai MIC, ekstrak yang dimasukkan ke dalam sumur terdiri dari beberapa konsentrasi. Pada penelitian ini dibuat konsentrasi, yaitu 10 %, 20 %, 30 %, 40 %, dan 50 %. Pengecualian untuk ekstrak metanol, hanya dibuat 3 konsentrasi yaitu 10 %, 20 % dan 28 %.
Kultur uji yang telah disiapkan, yaitu yang telah disegarkan dalam NB selama 24 jam, diinokulasikan sejumlah A (sesuai hasil yang didapat pada persiapan kultur pada Lampiran 2) ke dalam media NA. Campuran antara media dan kultur tersebut kemudian dituang ke dalam cawan petri dan ditunggu hingga membeku. Setelah agar membeku, dibuat lubang-lubang sumur dengan diameter sekitar 6 mm. Setiap cawan petri dibuat 6 sumur, 2 sumur diisi ko