STUDI HISTOPATOLOGI
PENGARUH INFEKSI Enterobacter sakazakii
PADA MENCIT (Mus musculus) NEONATUS
DORDIA ANINDITA ROTINSULU
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi “Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus)
Neonatus” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun pada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, September 2008
ABSTRAK
DORDIA ANINDITA ROTINSULU. Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus) Neonatus. Dibimbing oleh SRI ESTUNINGSIH dan HERNOMOADI HUMINTO.
Penelitian ini bertujuan untuk mengetahui perubahan histopatologis akibat infeksi Enterobacter sakazakii secara per oral pada mencit (Mus musculus) neonatus sebagai hewan coba. Sebanyak 30 ekor mencit neonatus dibagi menjadi 6 kelompok yaitu kontrol (diberi NaCl fisiologis), kelompok I (dosis infeksi 103 cfu/ml), kelompok II (dosis infeksi 104 cfu/ml), kelompok III (dosis infeksi 105 cfu/ml), kelompok IV (dosis infeksi 106 cfu/ml), dan kelompok V (dosis infeksi 107 cfu/ml). Setiap kelompok terdiri atas lima ekor mencit dan pemberian suspensi dilakukan sebanyak 0,1 ml/ekor. Mencit kontrol dieuthanasi pada hari ketiga pasca pemberian NaCl fisiologis per oral, sedangkan mencit yang diinfeksikan suspensi bakteri E. sakazakii diamati hingga mencit mati. Apabila sampai pada hari ketiga mencit yang diinfeksi E. sakazakii tidak mati, maka mencit tersebut dieuthanasi dan dinekropsi untuk dikumpulkan sebagai sampel. Sampel difiksasi dalam Buffered Neutral Formaline (BNF) 10%.
Pengamatan dilakukan secara histopatologi pada usus halus, usus besar, otak besar (cerebrum), medula spinalis, dan limpa dengan pewarnaan Hematoksilin-Eosin (HE). Perubahan histopatologis yang dapat diamati pada mencit neonatus yang diinfeksi E. sakazakii yaitu peningkatan jumlah sel radang di usus, deskuamasi epitel usus, peningkatan jumlah mikroglia di sistem saraf pusat, deplesi folikel limfoid limpa, infiltrasi sel radang, dan deposisi protein radang di limpa. Data kuantitatif, yang terdiri atas jumlah sel radang usus halus dan usus besar, jumlah sel mikroglia cerebrum dan medula spinalis, serta jumlah folikel limfoid dan jumlah megakaryosit limpa diolah dengan uji ANOVA dan dilanjutkan dengan uji Duncan dengan tingkat kepercayaan 95%. Sedangkan data kualitatitif berupa skoring yang terdiri atas kerusakan epitel usus halus, kerusakan epitel usus besar, deplesi folikel limfoid limpa, infiltasi sel radang dan protein radang di limpa, diolah menggunakan analisis statistik nonparametrik melalui uji Kruskal-Wallis. Hasil pengolahan data dan pengamatan histopatologi menunjukkan bahwa E. sakazakii berpotensi menyebabkan enterokolitis nekrotikan, meningoencephalitis, splenitis, dan sepsis. Virulensi E. sakazakii dipengaruhi oleh potensi bakteri dalam memproduksi toksin. Infeksi E. sakazakii pada usus mencit neonatus terjadi mulai dosis 104 cfu/ml, sedangkan infeksi pada sistem saraf pusat terjadi pada dosis 106 cfu/ml yang terjadi secara signifikan (P<0,05) dengan kontrol.
ABSTRACT
DORDIA ANINDITA ROTINSULU. Histopathology Study of The Influence of Enterobacter sakazakii Infection in Neonates Mice (Mus musculus). Under direction of SRI ESTUNINGSIH and HERNOMOADI HUMINTO.
This research was aimed to observe histopathological changes affected by Enterobacter sakazakii which was infected per oral to neonates’ mice (Mus musculus) as the experimental animal. Thirty neonates’ mice were divided into six groups: control (applied orally with physiologic NaCl), group I (infection dose 103 cfu/ml), group II (infection dose 104 cfu/ml), group III (infection dose 105 cfu/ml), group IV (infection dose 106 cfu/ml), and group V (infection dose 107 cfu/ml). Each group consists of 5 neonates’ mice and the bacterial suspension was given 0.1 ml/mice. Mice’ in control group were euthanized 3 days after the application of physiologic NaCl. Whereas mice’ which were infected by E. sakazakii were observed until they die. If the mice’ didn’t die until the third day after infection, those mice’ were euthanized and then necropzied followed by sample collection in Buffered Neutral Formaline (BNF) 10% for sample fixation. Samples then were processed to become Histopathological slides.
The study was done through histopathology examination at small intestine, large intestine, brain (cerebrum), medulla spinalis, and spleen with Hematoxilin-Eosin staining. Histopathology changes observed the increasing of inflammatory cell in intestine, the increasing of microglia cell in central nervous system, the depletion of lymphhpoid follicle of the spleen, infiltration of inflammatory cells and deposition of inflammatory protein in spleen. Qualitative data’s consist of the amount of inflammatory cells in small and large intestine, microglia cells in cerebrum and medulla spinalis, lymphoid follicles and megakaryocites in spleen, were analyzed with ANOVA test and followed by Duncan test. On the other side, qualitative data’s which are the scoring of epithelia desquamation of the small and large intestine, depletion of lymphoid follicles of the spleen, infiltration of inflammatory cell and deposition of inflammatory protein of the spleen, were analyzed with Nonparametric Kruskal-Wallis test. Based on evaluation on those data’s and histopathology observation, E. sakazakii causes enterocolitis necrotican, meningoencephalitis, splenitis and sepsis. Enterobacter sakakzaii’s
infection is influenced by its potency to produce toxin. The infection of E. sakazakii to the intestine of neonates’ mice was started at infection dose 104
cfu/ml, whereas the infection of E. sakazakii to the center nervous system of neonates’ mice was started at infection dose 106 cfu/ml which are significant (P<0,05) with the control group.
STUDI HISTOPATOLOGI
PENGARUH INFEKSI Enterobacter sakazakii
PADA MENCIT (Mus musculus) NEONATUS
DORDIA ANINDITA ROTINSULU
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul Skripsi : Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus) Neonatus
Nama : Dordia Anindita Rotinsulu
NRP : B04104003
Disetujui,
Pembimbing I
Dr. drh. Sri Estuningsih, MSi NIP. 131 878 929
Pembimbing II
drh. Hernomoadi Huminto, MVS NIP. 130 354 144
Diketahui, Wakil Dekan FKH IPB
Dr. Nastiti Kusumorini NIP 131 669 942
PRAKATA
Puji syukur ke hadirat Tuhan Yang Maha Kuasa atas berkat, rahmat, dan karuniaNya sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus) Neonatus. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Proses penulisan skripsi ini tidak terlepas dari dukungan berbagai pihak. Oleh karena itu, dengan rasa tulus dan hormat, Penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Papa dan Mama tersayang selaku orang tua penulis, atas kasih sayang, doa, motivasi, nasihat, dan dorongan yang luar biasa dan tidak henti-hentinya kepada Penulis.
2. Dr. drh. Sri Estuningsih, MSi, selaku dosen pembimbing utama atas bimbingan, arahan, motivasi, waktu dan pemikiran selama proses penelitian dan penyelesaian skripsi ini.
3. drh. Hernomoadi Huminto, MVS selaku dosen pembimbing kedua atas bimbingan, arahan, dan bantuan dalam penyelesaian skripsi ini.
4. Dr. drh. Wiwin Winarsih, MSi selaku dosen penguji atas saran dan masukan yang sangat membantu dalam penyempurnaan skripsi ini.
5. drh. R. Ipin R. Manggung selaku dosen pembimbing akademik.
6. Dungdang Panahatan Hutapea atas kasih sayang, dukungan, doa, dan motivasi kepada Penulis.
7. Mbah, Tante Anti, Tante Iwiek sekeluarga, dan Om Yon sekeluarga atas doa dan dukungannya.
8. Tim sakazakii (Mungky Wardanela, Laorizia F. D., dan Getri Grecilia) atas kerjasama, bantuan, dan dukungan selama penelitian.
10. Dosen Bagian Patologi atas ilmunya, Laboran dan Teknisi Patologi FKH IPB (Pak Kasnadi, Pak Endang, Pak Soleh, Ibu Melli, Bibi, dan Mbak Kiki) atas segala bantuannya.
11. Teman-teman yang tergabung dalam Asteroidea FKH 41 ”terbaik dan teristimewa”, Komisi Pelayanan Siswa Persekutuan Mahasiswa Kristen IPB, Persekutuan FKH, HIMPRO HKSA, IMAKAHI, Mahasiswa Berprestasi 2008, serta teman-teman Mahasiswa yang tidak dapat disebutkan satu per satu. Terima kasih atas kebersamaan yang telah kita lalui.
Terakhir Penulis mengucapkan terima kasih banyak kepada seluruh Civitas Akademika Fakultas Kedokteran Hewan IPB. Tidak cukup kata bagi pihak-pihak yang tidak dapat disebutkan satu per satu. Terima kasih atas segala doa, dukungan, dan bantuan kepada Penulis. Segala sesuatu tidak ada yang sempurna, semoga skripsi ini dapat bermanfaat bagi semua pihak.
Bogor, September 2008
RIWAYAT HIDUP
Penulis bernama lengkap Dordia Anindita Rotinsulu, dilahirkan di Manado pada tanggal 29 September 1986. Penulis merupakan anak tunggal dari Ayah yang bernama Dr. drh. Fredrik Dotulung Rotinsulu dan Ibu yang bernama Dr. drh. Sri Adiani.
Pada tahun 1992-1995, penulis menempuh pendidikan sekolah dasar di Ludwig Uhland Schule, Giessen, Jerman. Penulis menyelesaikan pendidikan sekolah dasar di SD Eben Haezar 02 Manado pada tahun 1998. Pendidikan tingkat pertama diselesaikan di SLTP Negeri 1 Manado pada tahun 2001, sedangkan pendidikan tingkat atas diselesaikan di SMA Negeri 1 Manado pada tahun 2004. Pada tahun yang sama Penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan penulis aktif dalam berbagai organisasi dan kegiatan. Penulis pernah menjadi Kepala Divisi Pendidikan HIMPRO Hewan Kesayangan dan Satwa Akuatik (2005-2006), Kepala Departemen Zoonosis dan Keamanan Pangan Ikatan Mahasiswa Kedokteran Hewan Indonesia (IMAKAHI) FKH IPB (2005-2007), dan anggota Komisi Pelayanan Siswa Persekutuan Mahasiswa Kristen IPB (2005-2008). Selain itu, Penulis pernah menjadi asisten dosen agama Kristen Protestan IPB (2005-2006) dan pengajar di SMA Kornita Dramaga (2005-2007).
DAFTAR ISI
1.2 Tujuan dan Manfaat Penelitian ……… 2
1.3 Hipotesis ………... 2
2. TINJAUAN PUSTAKA 2.1 Mencit ……….. 3
2.2 Enterobacter sakazakii ………. 4
2.2.1 Karakteristik Enterobacter sakazakii ……….. 4
2.2.2 Habitat dan Sumber Penyebaran ………. 6
2.2.3 Kejadian Infeksi Enterobacter sakazakii ……… 7
2.3 Usus ……….. 9
2.3.1 Anatomi dan Histologi Usus ………... 9
2.3.2 Patologi Peradangan pada Usus ……….. 12
2.4 Cerebrum dan Medula Spinalis ……… 14
2.4.1 Anatomi dan Histologi Cerebrum dan Medula Spinalis …. 14 2.4.2 Patologi Cerebrum dan Medula Spinalis ……… 18
2.5 Limpa ………... 20
2.5.1 Anatomi dan Histologi Limpa ………. 20
2.5.2 Patologi Limpa ……… 21
3. METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ……….. 23
3.2 Materi ………... 23
3.2.1 Hewan Coba ……… 23
3.2.2 Isolat Enterobacter sakazakii ……….. 23
3.2.3 Bahan dan Alat ……… 23
3.3 Prosedur Penelitian ……….. 24
3.3.1 Adaptasi, Pre-Treatment, dan Perkawinan Mencit Parental 24 3.3.2 Pembuatan Suspensi Enterobacter sakazakii ……….. 25
3.3.3 Infeksi Enterobacter sakazakii pada Mencit Neonatus …... 26
3.3.4 Pembuatan Sediaan Histopatologi ……….. 27
3.3.5 Pengamatan Histopatologi ……….. 28
STUDI HISTOPATOLOGI
PENGARUH INFEKSI Enterobacter sakazakii
PADA MENCIT (Mus musculus) NEONATUS
DORDIA ANINDITA ROTINSULU
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi “Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus)
Neonatus” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun pada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, September 2008
ABSTRAK
DORDIA ANINDITA ROTINSULU. Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus) Neonatus. Dibimbing oleh SRI ESTUNINGSIH dan HERNOMOADI HUMINTO.
Penelitian ini bertujuan untuk mengetahui perubahan histopatologis akibat infeksi Enterobacter sakazakii secara per oral pada mencit (Mus musculus) neonatus sebagai hewan coba. Sebanyak 30 ekor mencit neonatus dibagi menjadi 6 kelompok yaitu kontrol (diberi NaCl fisiologis), kelompok I (dosis infeksi 103 cfu/ml), kelompok II (dosis infeksi 104 cfu/ml), kelompok III (dosis infeksi 105 cfu/ml), kelompok IV (dosis infeksi 106 cfu/ml), dan kelompok V (dosis infeksi 107 cfu/ml). Setiap kelompok terdiri atas lima ekor mencit dan pemberian suspensi dilakukan sebanyak 0,1 ml/ekor. Mencit kontrol dieuthanasi pada hari ketiga pasca pemberian NaCl fisiologis per oral, sedangkan mencit yang diinfeksikan suspensi bakteri E. sakazakii diamati hingga mencit mati. Apabila sampai pada hari ketiga mencit yang diinfeksi E. sakazakii tidak mati, maka mencit tersebut dieuthanasi dan dinekropsi untuk dikumpulkan sebagai sampel. Sampel difiksasi dalam Buffered Neutral Formaline (BNF) 10%.
Pengamatan dilakukan secara histopatologi pada usus halus, usus besar, otak besar (cerebrum), medula spinalis, dan limpa dengan pewarnaan Hematoksilin-Eosin (HE). Perubahan histopatologis yang dapat diamati pada mencit neonatus yang diinfeksi E. sakazakii yaitu peningkatan jumlah sel radang di usus, deskuamasi epitel usus, peningkatan jumlah mikroglia di sistem saraf pusat, deplesi folikel limfoid limpa, infiltrasi sel radang, dan deposisi protein radang di limpa. Data kuantitatif, yang terdiri atas jumlah sel radang usus halus dan usus besar, jumlah sel mikroglia cerebrum dan medula spinalis, serta jumlah folikel limfoid dan jumlah megakaryosit limpa diolah dengan uji ANOVA dan dilanjutkan dengan uji Duncan dengan tingkat kepercayaan 95%. Sedangkan data kualitatitif berupa skoring yang terdiri atas kerusakan epitel usus halus, kerusakan epitel usus besar, deplesi folikel limfoid limpa, infiltasi sel radang dan protein radang di limpa, diolah menggunakan analisis statistik nonparametrik melalui uji Kruskal-Wallis. Hasil pengolahan data dan pengamatan histopatologi menunjukkan bahwa E. sakazakii berpotensi menyebabkan enterokolitis nekrotikan, meningoencephalitis, splenitis, dan sepsis. Virulensi E. sakazakii dipengaruhi oleh potensi bakteri dalam memproduksi toksin. Infeksi E. sakazakii pada usus mencit neonatus terjadi mulai dosis 104 cfu/ml, sedangkan infeksi pada sistem saraf pusat terjadi pada dosis 106 cfu/ml yang terjadi secara signifikan (P<0,05) dengan kontrol.
ABSTRACT
DORDIA ANINDITA ROTINSULU. Histopathology Study of The Influence of Enterobacter sakazakii Infection in Neonates Mice (Mus musculus). Under direction of SRI ESTUNINGSIH and HERNOMOADI HUMINTO.
This research was aimed to observe histopathological changes affected by Enterobacter sakazakii which was infected per oral to neonates’ mice (Mus musculus) as the experimental animal. Thirty neonates’ mice were divided into six groups: control (applied orally with physiologic NaCl), group I (infection dose 103 cfu/ml), group II (infection dose 104 cfu/ml), group III (infection dose 105 cfu/ml), group IV (infection dose 106 cfu/ml), and group V (infection dose 107 cfu/ml). Each group consists of 5 neonates’ mice and the bacterial suspension was given 0.1 ml/mice. Mice’ in control group were euthanized 3 days after the application of physiologic NaCl. Whereas mice’ which were infected by E. sakazakii were observed until they die. If the mice’ didn’t die until the third day after infection, those mice’ were euthanized and then necropzied followed by sample collection in Buffered Neutral Formaline (BNF) 10% for sample fixation. Samples then were processed to become Histopathological slides.
The study was done through histopathology examination at small intestine, large intestine, brain (cerebrum), medulla spinalis, and spleen with Hematoxilin-Eosin staining. Histopathology changes observed the increasing of inflammatory cell in intestine, the increasing of microglia cell in central nervous system, the depletion of lymphhpoid follicle of the spleen, infiltration of inflammatory cells and deposition of inflammatory protein in spleen. Qualitative data’s consist of the amount of inflammatory cells in small and large intestine, microglia cells in cerebrum and medulla spinalis, lymphoid follicles and megakaryocites in spleen, were analyzed with ANOVA test and followed by Duncan test. On the other side, qualitative data’s which are the scoring of epithelia desquamation of the small and large intestine, depletion of lymphoid follicles of the spleen, infiltration of inflammatory cell and deposition of inflammatory protein of the spleen, were analyzed with Nonparametric Kruskal-Wallis test. Based on evaluation on those data’s and histopathology observation, E. sakazakii causes enterocolitis necrotican, meningoencephalitis, splenitis and sepsis. Enterobacter sakakzaii’s
infection is influenced by its potency to produce toxin. The infection of E. sakazakii to the intestine of neonates’ mice was started at infection dose 104
cfu/ml, whereas the infection of E. sakazakii to the center nervous system of neonates’ mice was started at infection dose 106 cfu/ml which are significant (P<0,05) with the control group.
STUDI HISTOPATOLOGI
PENGARUH INFEKSI Enterobacter sakazakii
PADA MENCIT (Mus musculus) NEONATUS
DORDIA ANINDITA ROTINSULU
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul Skripsi : Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus) Neonatus
Nama : Dordia Anindita Rotinsulu
NRP : B04104003
Disetujui,
Pembimbing I
Dr. drh. Sri Estuningsih, MSi NIP. 131 878 929
Pembimbing II
drh. Hernomoadi Huminto, MVS NIP. 130 354 144
Diketahui, Wakil Dekan FKH IPB
Dr. Nastiti Kusumorini NIP 131 669 942
PRAKATA
Puji syukur ke hadirat Tuhan Yang Maha Kuasa atas berkat, rahmat, dan karuniaNya sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Studi Histopatologi Pengaruh Infeksi Enterobacter sakazakii pada Mencit (Mus musculus) Neonatus. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Proses penulisan skripsi ini tidak terlepas dari dukungan berbagai pihak. Oleh karena itu, dengan rasa tulus dan hormat, Penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Papa dan Mama tersayang selaku orang tua penulis, atas kasih sayang, doa, motivasi, nasihat, dan dorongan yang luar biasa dan tidak henti-hentinya kepada Penulis.
2. Dr. drh. Sri Estuningsih, MSi, selaku dosen pembimbing utama atas bimbingan, arahan, motivasi, waktu dan pemikiran selama proses penelitian dan penyelesaian skripsi ini.
3. drh. Hernomoadi Huminto, MVS selaku dosen pembimbing kedua atas bimbingan, arahan, dan bantuan dalam penyelesaian skripsi ini.
4. Dr. drh. Wiwin Winarsih, MSi selaku dosen penguji atas saran dan masukan yang sangat membantu dalam penyempurnaan skripsi ini.
5. drh. R. Ipin R. Manggung selaku dosen pembimbing akademik.
6. Dungdang Panahatan Hutapea atas kasih sayang, dukungan, doa, dan motivasi kepada Penulis.
7. Mbah, Tante Anti, Tante Iwiek sekeluarga, dan Om Yon sekeluarga atas doa dan dukungannya.
8. Tim sakazakii (Mungky Wardanela, Laorizia F. D., dan Getri Grecilia) atas kerjasama, bantuan, dan dukungan selama penelitian.
10. Dosen Bagian Patologi atas ilmunya, Laboran dan Teknisi Patologi FKH IPB (Pak Kasnadi, Pak Endang, Pak Soleh, Ibu Melli, Bibi, dan Mbak Kiki) atas segala bantuannya.
11. Teman-teman yang tergabung dalam Asteroidea FKH 41 ”terbaik dan teristimewa”, Komisi Pelayanan Siswa Persekutuan Mahasiswa Kristen IPB, Persekutuan FKH, HIMPRO HKSA, IMAKAHI, Mahasiswa Berprestasi 2008, serta teman-teman Mahasiswa yang tidak dapat disebutkan satu per satu. Terima kasih atas kebersamaan yang telah kita lalui.
Terakhir Penulis mengucapkan terima kasih banyak kepada seluruh Civitas Akademika Fakultas Kedokteran Hewan IPB. Tidak cukup kata bagi pihak-pihak yang tidak dapat disebutkan satu per satu. Terima kasih atas segala doa, dukungan, dan bantuan kepada Penulis. Segala sesuatu tidak ada yang sempurna, semoga skripsi ini dapat bermanfaat bagi semua pihak.
Bogor, September 2008
RIWAYAT HIDUP
Penulis bernama lengkap Dordia Anindita Rotinsulu, dilahirkan di Manado pada tanggal 29 September 1986. Penulis merupakan anak tunggal dari Ayah yang bernama Dr. drh. Fredrik Dotulung Rotinsulu dan Ibu yang bernama Dr. drh. Sri Adiani.
Pada tahun 1992-1995, penulis menempuh pendidikan sekolah dasar di Ludwig Uhland Schule, Giessen, Jerman. Penulis menyelesaikan pendidikan sekolah dasar di SD Eben Haezar 02 Manado pada tahun 1998. Pendidikan tingkat pertama diselesaikan di SLTP Negeri 1 Manado pada tahun 2001, sedangkan pendidikan tingkat atas diselesaikan di SMA Negeri 1 Manado pada tahun 2004. Pada tahun yang sama Penulis diterima sebagai mahasiswa Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan penulis aktif dalam berbagai organisasi dan kegiatan. Penulis pernah menjadi Kepala Divisi Pendidikan HIMPRO Hewan Kesayangan dan Satwa Akuatik (2005-2006), Kepala Departemen Zoonosis dan Keamanan Pangan Ikatan Mahasiswa Kedokteran Hewan Indonesia (IMAKAHI) FKH IPB (2005-2007), dan anggota Komisi Pelayanan Siswa Persekutuan Mahasiswa Kristen IPB (2005-2008). Selain itu, Penulis pernah menjadi asisten dosen agama Kristen Protestan IPB (2005-2006) dan pengajar di SMA Kornita Dramaga (2005-2007).
DAFTAR ISI
1.2 Tujuan dan Manfaat Penelitian ……… 2
1.3 Hipotesis ………... 2
2. TINJAUAN PUSTAKA 2.1 Mencit ……….. 3
2.2 Enterobacter sakazakii ………. 4
2.2.1 Karakteristik Enterobacter sakazakii ……….. 4
2.2.2 Habitat dan Sumber Penyebaran ………. 6
2.2.3 Kejadian Infeksi Enterobacter sakazakii ……… 7
2.3 Usus ……….. 9
2.3.1 Anatomi dan Histologi Usus ………... 9
2.3.2 Patologi Peradangan pada Usus ……….. 12
2.4 Cerebrum dan Medula Spinalis ……… 14
2.4.1 Anatomi dan Histologi Cerebrum dan Medula Spinalis …. 14 2.4.2 Patologi Cerebrum dan Medula Spinalis ……… 18
2.5 Limpa ………... 20
2.5.1 Anatomi dan Histologi Limpa ………. 20
2.5.2 Patologi Limpa ……… 21
3. METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ……….. 23
3.2 Materi ………... 23
3.2.1 Hewan Coba ……… 23
3.2.2 Isolat Enterobacter sakazakii ……….. 23
3.2.3 Bahan dan Alat ……… 23
3.3 Prosedur Penelitian ……….. 24
3.3.1 Adaptasi, Pre-Treatment, dan Perkawinan Mencit Parental 24 3.3.2 Pembuatan Suspensi Enterobacter sakazakii ……….. 25
3.3.3 Infeksi Enterobacter sakazakii pada Mencit Neonatus …... 26
3.3.4 Pembuatan Sediaan Histopatologi ……….. 27
3.3.5 Pengamatan Histopatologi ……….. 28
4. HASIL DAN PEMBAHASAN
4.1 Morbiditas dan Mortalitas ……… 31
4.2 Perubahan Histopatologis Usus ………... 33
4.2.1 Deskuamasi Epitel dan Udema Lamina propria ………….. 33
4.2.2 Sel Radang ……….. 36
4.3 Perubahan Histopatologis Cerebrum dan Medula Spinalis …….. 38
4.4 Perubahan Histopatologis Limpa ………. 44
4.5 Gambaran Umum Pengamatan Histopatologi Akibat Infeksi Enterobacter sakazakii ………. 47
5. PENUTUP 5.1 Kesimpulan ……….. 51
5.2 Saran ………. 51
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
Nomor Halaman
1 Sumber penyebaran Enterobacter sakazakii ………. 6 2 Laporan kejadian Enterobacter sakazakii dalam makanan dan
susu bayi ………... 7
3 Laporan kejadian akibat infeksi E. sakazakii ……… 8 4 Perlakuan terhadap enam kelompok anak mencit usia satu
minggu ……….. 26
5 Hasil pengamatan jumlah kematian dan perubahan patologi anatomi mencit neonatus yang diinfeksikan E. sakazakii
dengan berbagai dosis infeksi secara per oral ………... 32 6 Rataan jumlah skoring berdasarkan peringkat dengan uji
Kruskal-Wallis untuk deskuamasi epitel pada usus halus dan usus besar mencit neonatus akibat infeksi E. sakazakii dengan
berbagai dosis infeksi secara per oral ………... 34 7 Rataan jumlah sel radang pada usus halus dan usus besar
mencit neonatus akibat infeksi E. sakazakii dengan berbagai
dosis infeksi secara per oral ……….. 36 8 Rataan jumlah mikroglia pada cerebrum dan medula spinalis
mencit neonatus akibat infeksi E. sakazakii dengan berbagai
dosis infeksi secara per oral ……….. 41 9 Rataan jumlah limfoid folikel dan megakaryosit pada limpa
mencit neonatus akibat infeksi E. sakazakii dengan berbagai
dosis infeksi secara per oral ……….. 44 10 Rataan jumlah skoring berdasarkan uji Kruskal-Wallis untuk
deplesi folikel limfoid, infiltrasi sel radang, dan deposisi protein radang pada limpa mencit neonatus akibat infeksi
DAFTAR GAMBAR
Nomor Halaman
1 Induk mencit dan mencit neonatus usia tujuh hari …….. 3
2 Enterobacter sakazakii ……… 5
3 Histologi usus halus (duodenum) mamalia (babi) ……... 10 4 Histologi usus halus dan usus besar secara skematis …... 10 5 Cerebrum dan medula spinalis ………. 14 6 Lapisan pembentuk cortex cerebri secara skematis …… 15
7 Meningen ………. 16
8 Neuron dan neuroglia pada sistem saraf pusat dengan pewarnaan luxol blue dan hematoksilin ………...
17 9 Neuron dan neuroglia secara skematis ………. 18
10 Limpa ………... 20
11 Teknik pemotongan mencit neonatus secara skematis … 27 12 Penimbunan cairan di otak pada mecit neonatus yang
diinfeksikan Enterobacter sakazakii ……… 31 13 Usus halus dan usus besar mencit neonatus kontrol …… 35 14 Usus halus mencit neonatus yang diberi E. sakazakii
dengan dosis infeksi 107 cfu/ml ………... 35 15 Grafik rataan jumlah sel radang pada usus halus dan
usus besar mencit neonatus akibat infeksi E. sakazakii
dengan berbagai dosis infeksi secara per oral ………….. 36 16 Meningen cerebrum mencit kontrol yang normal, dan
meningitis pada mencit yang diberi E. sakazakii dengan
dosis infeksi 107 cfu/ml ……… 39 17 Medula spinalis mencit neonatus kontrol dan yang
diberi E. sakazakii dengan dosis infeksi 107 cfu/ml …… 39 18 Grafik rataan jumlah sel mikroglia pada cerebrum dan
medula spinalis mencit neonatus akibat infeksi E.
sakazakii dengan berbagai dosis infeksi secara per oral 42 19 Limpa normal pada mencit kontrol (kiri) dan splenitis
sepsis pada mencit yang diinfeksikan E. sakazakii
dengan dosis infeksi 107 cfu/ml ………... 46 20 Splenitis pada mencit yang diinfeksikan E. sakazakii
DAFTAR LAMPIRAN
Nomor Halaman
1 Pemberian Obat pada Mencit ……….. 60 2 Sidik Ragam (Anova:single factor) pada Berbagai
Pengamatan dengan Perlakuan yang Berbeda ……… 62 3 Uji Wilayah-Berganda Duncan pada Berbagai
Pengamatan dengan Perlakuan yang Berbeda ……… 66 4 Uji Kruskal-Wallis pada Berbagai Pengamatan dengan
1. PENDAHULUAN
1.1Latar Belakang
Enterobacter sakazakii merupakan emerging pathogen yang lebih dari dua puluh tahun terakhir ini dilaporkan menyebabkan beberapa kasus kematian serta penyakit pada bayi. Pada umumnya, laporan mengenai infeksi E. sakazakii menunjukkan bahwa E. sakazakii menyebabkan meningitis, enterokolitis nekrotikan dan sepsis pada neonatus (Lai 2001; Bar-Oz et al. 2001; Taylor 2002; Iversen dan Forsythe 2003). Kelompok bayi yang memiliki resiko tertinggi terinfeksi E. sakazakii yaitu neonatus (still birth hingga umur 28 hari), bayi immunocompromised, bayi dengan berat badan lahir rendah (BBLR), bayi prematur dan bayi yang lahir dari ibu yang mengidap Human Immunodeficiency Virus (HIV) (Kane 2004).
Sampai saat ini kasus E. sakazakii yang tercatat dan dilaporkan relatif sedikit. Walaupun demikian, E. sakazakii harus mendapatkan perhatian yang serius karena dapat menyebabkan gangguan fungsi sistem saraf, fisik dan mental pada bayi yang terinfeksi (Lai 2001) dan angka mortalitasnya tinggi yaitu 40-80% (Pagotto et al. 2003).
Habitat alami E. sakazakii sampai saat ini belum diketahui secara pasti. Enterobacter sakazakii sering ditemukan sebagi salah satu kontaminan dalam 9-35% susu bubuk formula , 44% sereal, 27% tepung kentang, 23% produk pasta, 31 % peralatan dapur dan tidak ditemukan dalam bubuk rempah-rempah (Kandhai 2004).
minimnya pengetahuan mengenai bahaya E. sakazakii, maka kepedulian terhadap emerging pathogen ini di Indonesia belum tinggi.
Penelitian mengenai E. sakazakii yang telah dilakukan umumnya menyangkut aspek mikrobiologi sedangkan patogenitas dan kerusakan jaringan yang terjadi belum dipelajari. Hasil penelitian Pagotto et al. (2003), menunjukkan bahwa faktor virulensi E. sakazakii adalah enterotoksinnya. Namun, studi mengenai perubahan histopatologis jaringan atau organ belum diketahui dengan terperinci. Mengingat hal tersebut, perlu dilakukan studi mengenai perubahan histopatologis akibat infeksi akut E. sakazakii, yang antara lain dapat dilakukan dengan menggunakan mencit neonatus sebagai hewan model.
1.2Tujuan dan Manfaat Penelitian
Tujuan penelitian ini yaitu mempelajari histopatologi beberapa organ yaitu usus, otak (khususnya cerebrum), medula spinalis, dan limpa pada mencit neonatus yang diduga mengalami perubahan patologis yang masih akut akibat infeksi E. sakazakii.
Manfaat penelitian ini yaitu memberikan gambaran kerusakan organ akibat infeksi E. sakazakii. Hasil penelitian ini bermanfaat untuk menyediakan basis data mengenai E. sakazakii sehingga dapat membantu pengembangan penelitian lebih lanjut dalam mengurangi resiko dan menanggulangi patogenitas bakteri ini.
1.3Hipotesis
H0 : Tidak terdapat perbedaan gambaran histopatologis pada usus, sistem
saraf pusat (cerebrum dan medula spinalis), dan limpa antara mencit neonatus kontrol (tidak diinfeksi oleh E. sakazakii) dengan mencit neonatus yang diberi perlakuan (diinfeksi oleh E. sakazakii).
H1 : Terdapat perbedaan gambaran histopatologis pada usus, sistem saraf pusat
2. TINJAUAN PUSTAKA
2.1Mencit
Hewan coba yang digunakan dalam penelitian ini yaitu mencit neonatus (Gambar 1). Mencit (Mus musculus) merupakan hewan rodensia yang cepat berbiak, mudah dipelihara dalam jumlah banyak, variasi genetiknya cukup besar, serta sifat anatomis dan fisiologis terkarakterisasi dengan baik (Malole dan Pramono 1989). Mencit telah digunakan sebagai subyek penelitian sejak abad ke-19. Hingga kini, mencit menjadi hewan penelitian yang paling banyak dipakai untuk mempelajari teratologi, genetik, gerontologi, toksikologi, dan karsinogenitas. Alasan penggunaan mencit sebagai hewan coba yaitu memiliki potensial reproduksi yang tinggi, masa kebuntingan yang singkat, jangka hidup yang pendek, berukuran kecil, harganya relatif murah, dan mudah dipelihara (Sirois 2005).
Gambar 1 Induk mencit dan mencit neonatus usia tujuh hari.
Sistem taksonomi mencit adalah sebagai berikut (Besselsen 2004): kingdom : Animalia
ordo : Rodensia
Smith dan Mangkoewidjojo (1988) menyatakan bahwa mencit laboratorium merupakan hewan yang semarga dengan mencit liar atau mencit rumah (domestik). Semua galur mencit laboratorium yang ada pada waktu ini merupakan turunan dari mencit liar sesudah melalui pengembangbiakan selektif. Mencit dimasukkan dalam ordo rodensia karena memiliki sepasang gigi insisivus yang berbentuk seperti pahat dan dapat menajam dengan sendirinya. Mencit adalah hewan crepuscular yang akan lebih aktif pada senja dan malam hari.
Mencit memiliki lama hidup sekitar satu hingga dua tahun, bahkan beberapa bisa mencapai usia tiga tahun dengan masa produksi ekonomisnya selama sembilan bulan. Mencit mencapai usia dewasa pada hari ke-35. Setelah usia delapan minggu mencit sudah dapat dikawinkan. Lama kebuntingan mencit adalah 19-21 hari dengan jumlah anak rata-rata enam ekor. Bobot mencit jantan dewasa adalah 20-40 gram dan mencit betina adalah 18-35 gram. Mencit laboratorium dapat dikandangkan pada kotak sebesar kotak sepatu yang dapat terbuat dari berbagai macam bahan, misalnya plastik (polipropilen atau polikarbonat), aluminium atau baja tahan karat (Smith dan Mangkoewidjojo 1988).
2.2 Enterobacter sakazaki
2.2.1 Karakteristik Enterobacter sakazakii
Farmer et al. (1980) mengukuhkan bakteri ini dalam genus Enterobacter sebagai suatu spesies baru yang diberi nama Enterobacter sakazakii untuk menghargai seorang bakteriolog Jepang bernama Riichi Sakazakii. Reklasifikasi ini dilakukan berdasarkan studi DNA hibridisasi yang menunjukkan kemiripan 41% dengan Citrobacter freundii dan 51% dengan Enterobacter cloacae.
Gambar 2 Enterobacter sakazakii (http://www.marlerblog.com).
Iversen et al. (2004) melakukan penelitian mengenai hubungan yang filogenetik dari E. sakazakii mengunakan 16S ribosomal DNA (rDNA) dan peruntunan hsp60. Masing-masing analisa membagi strain E. sakazakii menjadi empat kluster yang menandakan heterogenitas substansiil secara taksonomi. Strain E. sakazakii tipe 16S rDNA menunjukkan 97.8% kesamaan urutan DNA dengan Citrobacter koseri namun juga 97.0% kesamaan urutan dengan E. cloacae.
Mekanisme spesifik patogenitas yang menjelaskan tentang sifat virulen E. sakazakii belum dapat teridentifikasi, namun diketahui bahwa bakteri ini memiliki kesamaan respon imunologi dengan Escherichia coli dan coliform lain. Berdasarkan uji DNA hibridisasi, ternyata terdapat kesamaan DNA hingga 50% antara E. sakazakii dengan Citrobacter diversus (Farmer et al. 1980).
Enterobacter sakazakii memiliki kapsul polisakarida yang bersifat antifagositik sehingga mengurangi kemampuan eliminasi oleh tubuh.
Beberapa faktor yang mungkin menyebabkan E. sakazakii mampu bertahan dalam proses lingkungan yaitu respon terhadap pengeringan, toleransi terhadap pemanasan, menghasilkan suatu bentuk polisakarida yang memungkinkan terjadinya perlekatan, dan membentuk sebuah biofilm yang menyebabkan resisten terhadap bahan pembersih dan disinfektan (Hassel 2004).
Farmer et al.(1980) menemukan bahwa seluruh galur E. sakazakii rentan terhadap gentamycin, kanamycin, chloramphenicol, dan ampicilin; lebih dari 87% E. sakazakii bersifat rentan terhadap nalidixic acid, streptomycin, tetracycline, dan carbenicilin; 71 dan 67% bersifat rentan terhadap sulfadiazine dan colistin; hanya 13% yang bersifat rentan terhadap cephalothin. Seluruh galur bersifat resisten terhadap penicillin; hanya satu dari lebih dari 100 galur yang diuji menunjukkan resistensi terhadap antibiotik berganda.
2.2.2 Habitat dan Sumber Penyebaran
Berdasarkan temuan para peneliti diketahui bahwa E. sakazakii dapat bersumber dari lingkungan dan berbagai makanan (Tabel 1). Enterobacter sakazakii bukan merupakan mikroorganisme normal pada saluran pencernaan hewan dan manusia, sehingga disinyalir bahwa tanah, air, sayuran, tikus dan lalat merupakan sumber infeksi (Iversen dan Forsythe 2003). Enterobacter sakazakii juga ditemukan sebagai salah satu kontaminan dalam berbagai produk makanan (Hassel 2004).
Tabel 1 Sumber penyebaran Enterobacter sakazakii
Lingkungan Sumber makanan dan peralatan
Minyak mentah Daging mentah
Lalat Gelas bir
Peralatan pembuatan makanan Susu bayi (susu sapi dan kedelai) Peralatan rumah sakit Beras
Tanah Tahu
Air Susu bubuk
Enterobacter sakazakii ditemukan sebesar 9-35% dalam susu bubuk formula, 44% dalam sereal, 27% dalam tepung kentang, 23% dalam produk pasta, 31% dalam peralatan dapur dan tidak ditemukan dalam rempah-rempah (Kandhai et al. 2004). Organisme ini telah diisolasi dari berbagai makanan termasuk keju, roti, tahu, teh asam, daging yang dikuring, dan sosis. Enterobacter sakazakii juga ditemukan pada khamir roti karena organisme ini merupakan bagian dari flora permukaan biji sorghum (Gassem 1999 dalam Iversen dan Forsythe 2003). Selain itu, organisme ini ditemukan pada biji padi (Cottyn et al. 2001 dalam Iversen dan Forsythe 2003).
Hasil penelitian menunjukkan bahwa tingkat pencemaran E. sakazakii dalam makanan bayi di Indonesia pada tahun 2003 sebesar 13.5% (Estuningsih et al. 2006) dan pada susu formula sebesar 6.52% (Estuningsih 2004). Pada tahun 2006, sebanyak 5 dari 22 atau 22.73% susu formula dan 6 dari 15 atau 40% produk makanan bayi di Indonesia positif terkontaminasi E. sakazakii (Estuningsih et al. 2007). Adapun laporan kejadian E. Sakazakii dalam makanan dan susu bayi di beberapa negara disajikan pada Tabel 2.
Tabel 2 Laporan kejadian Enterobacter sakazakii dalam makanan dan susu bayi Negara Produk terkontaminasi Referensi
USA Susu bubuk Farmer et al. (1980)
Netherlands Susu bubuk rekonstitusi, susu bubuk formula
Muytjens et al. (1983) Czechia Susu bubuk formula Postupa and Aldova (1984) 35 negara Susu bubuk pengganti ASI Muytjens et al. (1988) Canada Susu bubuk rekonstitusi, susu bubuk
formula
Nazarowec-White dan Farber (1997)
USA Susu bubuk formula Simmons et al. (1989) Israel Susu bubuk formula, blender Bar-Oz et al. (2001);
Block et al. (2002)
2.2.3 Kejadian Infeksi Enterobacter sakazakii
Virus (HIV). Berdasarkan 31 literatur, kasus E. sakazakii di Inggris (1960-1999) terjadi pada kisaran umur 3 hari hingga 4 tahun. Tingkat infeksi pada umur ≤ 1 minggu mencapai 50%, < 1 bulan mencapai 75%. Sebanyak 55% infan yang terinfeksi E. sakazakii memiliki berat badan ≤ 2,5kg, sedangkan 75% merupakan bayi prematur atau bayi yang mengalami komplikasi peripartum (Lai 2001).
Laporan mengenai infeksi E. sakazakii menunjukkan bahwa bakteri ini dapat menyebabkan meningitis dan enterokolitis nekrotikan pada neonatus (Taylor 2002). Sebanyak enam dari dua belas neonatus yang mengalami enterokolitis nekrotikan positif terhadap kultur E. sakazakii (van Acker et al. 2001). Gangguan sistem saraf akibat E. sakazakii antara lain meningitis (khususnya ventrikulitis), abses otak, pembentukan kiste, dan hidrosephalus (Lai 2001; Bar-Oz et al. 2001). Enterobacter sakazakii merupakan agen kausatif meningoensephalitis pada bayi yang berusia lima minggu (Kleimen et al 1981 dalam Pagotto et al. 2003). Semua pasien yang mengalami infeksi sistem saraf pusat akibat E. sakazakii akan mengalami hambatan dalam perkembangan fisik dan mental (Lai 2001). Selain gangguan pada sistem saraf dan peradangan pada usus, E. sakazakii juga menyebabkan sepsis (Muytjens et al. 1983; Muytjens dan Kollee 1990; Bar-Oz et al. 2001; Kane 2004). Adapun beberapa laporan kejadian akibat infeksi E. sakazakii dapat dilihat pada Tabel 3.
Tabel 3 Laporan kejadian akibat infeksi E. sakazakii Negara Jumlah
urinarius, infeksi intra-abdominal, endokarditis, artritis sepsis, osteomyelitis, dan infeksi optalmik. Menurut Iversen dan Forsythe (2003), secara umum bakteri pada genus Enterobacter merupakan penyebab 50% kasus infeksi nosocomial. Faktor-faktor predisposisi infeksi-infeksi tersebut adalah waktu perawatan di rumah sakit yang lama, terutama dalam ruang Unit Gawat Darurat; perlakuan lebih dahulu dengan antibiotik, kelemahan yang umum, dan imunosupresi (Sinave 2003).
Mortalitas akibat infeksi E. sakazakii mencapai 40-80% (Pagotto et al. 2003). Sebanyak 50% pasien yang dilaporkan menderita infeksi E. sakazakii meninggal dalam waktu satu minggu setelah diagnosa (Lai 2001). Hingga kini belum ada penentuan dosis infeksi E. sakazakii, namun sebesar 3 cfu/100 gram dapat digunakan sebagai perkiraan awal dosis infeksi (Iversen dan Forsythe 2003).
2.3Usus
2.3.1 Anatomi dan Histologi Usus
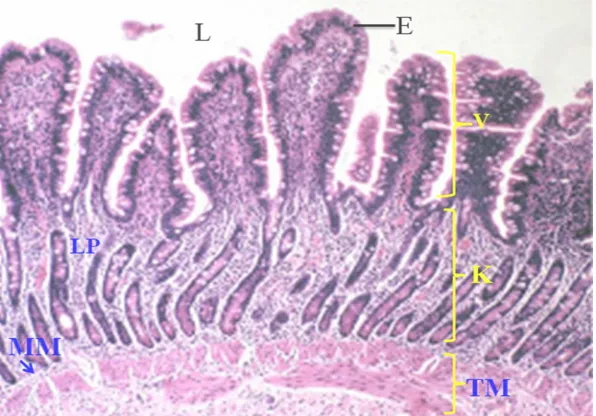
Gambar 3 Histologi usus halus (duodenum) mamalia (babi) (Eurell dan Frapier 2006).
Keterangan: (L) lumen, (E) epitel, (LP) propria mukosa utuh, (MM) muskularis mukosa, (V) vili usus, (K) kripta usus, (TM) tunika muskularis.
Gambar 4 Histologi usus halus (1) dan usus besar (2) secara skematis (Eurell dan Frapier 2006).
Keterangan: (E) epitel, (F) lamina propria, (G) lamina muskularis, (H) Tela submukosa, (I) tunika muskularis lapis sirkuler, (J) tunika muskularis lapis longitudinal, (K) serosa, (PP) Daun Payer.
Menurut Dellmann dan Brown (1992), pencernaan di usus halus ditunjang oleh bentuk khusus pada tunika mukosa, yakni vili. Vili merupakan penjuluran mukosa yang berbentuk jari dan merupakan ciri khas usus halus. Tinggi vili ini bervariasi tergantung pada daerah dan jenis hewannya. Pada karnivora, vili langsing dan panjang, sedangkan pada sapi vili pendek dan lebar. Panjang vili usus halus pada mencit neonatus lebih pendek dibandingkan mencit dewasa (Shackelford dan Elwell 1999). Akhirnya, permukaan penyebaran ditingkatkan oleh mikrovili. Mikrovili merupakan penjuluran sitoplasma pada permukaan bebas epitel vili. Vili dan mikrovili berfungsi memperluas permukaan usus halus sehingga penyerapan lebih efisien (Dellmann dan Brown 1992).
Di antara dasar-dasar vili terdapat kelenjar-kelenjar yang meluas ke dalam bagian bawah mukosa yang disebut kripta. Sel-sel kripta menyediakan sel-sel baru untuk menggantikan sel-sel permukaan vili yang terbuang ke dalam lumen usus (Bevelander dan Ramaley 1988). Pada mencit dewasa, sel kripta epitel usus membagi setiap 10-14 jam dan waktu transit sel dari kripta ke ujung vili terjadi selama 48 jam (Shackelford dan Elwell 1999).
Tunika submukosa terdiri atas jaringan ikat longgar, pembuluh darah dan pembuluh limfe yang lebih besar. Pada duodenum terdapat kelenjar Brunner (Genesser 1994). Pada hewan dewasa, di lapisan ini ditemukan banyak limfosit, sel plasma, makrofag, eosinofil, dan sel mast (Shackelford dan Elwell 1999).
Tunika muskularis terdiri atas lapisan eksterna yang mempunyai serabut otot longitudinal dan lapisan interna yang mempunyai serabut otot halus berbentuk sirkuler (Shackelford dan Elwell 1999). Kedua lapisan ini dipisahkan oleh suatu jaringan ikat berisi pleksus saraf parasimpatis yang disebut plexus Mienterikus atau Auerbach’s (Genesser 1994). Suplai darah untuk usus halus diberikan melalui cabang-cabang dari arteri mesenterica celiaca dan cranialis yang menembus tunika muskularis kemudian tunika submukosa (Frappier 2006). Lapisan terluar usus halus atau tunika serosa terdiri atas lapis mesotel dengan jaringan ikat subserosa di bawahnya (Genesser 1994; Frappier 2006).
(2) menjaga keseimbangan cairan dan elektrolit, dan (3) mendegradasi bakteri. Secara makroskopis usus besar dapat dibagi menjadi enam bagian, yaitu sekum, kolon asenden, kolon transversus, kolon desenden, sigmoid, dan rektum (Underwood 1992). Keenam bagian ini sulit dibedakan secara histologis. Karakteristik utama pada sekum, kolon, dan rektum yaitu tidak membentuk vili seperti usus halus, memiliki kelenjar yang panjang dan berbentuk tubuli sederhana, tidak memiliki sel granuler asidofilik (sel Panneth), dan memiliki jumlah nodul limfatik yang banyak (Frappier 2006).
Menurut Genesser (1994), gambaran histologis usus besar secara umum yaitu mengandung kripta Lieberkuhn yang lebih panjang dan lebih lurus pada tunika mukosa dibandingkan dengan usus halus. Epitel usus besar berbentuk silinder dan mengandung jauh lebih banyak sel Goblet dibandingkan usus halus. Lamina propria usus besar terdiri atas jaringan ikat retikuler dan nodulus limfatikus. Seperti pada usus halus, tunika muskularis mukosa pada usus besar terdiri atas lapisan sirkular sebelah dalam dan lapisan longitudinal sebelah luar. Tunika mukosa terdiri atas jaringan ikat longgar, lemak, dan pleksus Meissner. Di sebelah luar tunika mukosa terdapat tunika muskularis eksterna dan tunika serosa. Tunika serosa ini terdiri atas mesotelium dan jaringan ikat subserosa.
Suplai pembuluh darah untuk usus besar berasal dari arteri mesenterica inferior dan superior. Pembagian suplai darah usus besar yaitu sebagai berikut: (1) sekum, kolon asenden, dan kolon transversus proksimal disuplai oleh cabang dari arteri mesenterica superior, (2) kolon transversus distalis, kolon desenden, colon sigmoid dan rektum bagian atas disuplai oleh cabang dari arteri mesenterica inferior, sedangkan (3) sisa rektum disuplai oleh arteri rektalis tengah dan inferior yang merupakan cabang dari arteri iliaca interna dan arteri pudenda interna (Underwood 1992). Pengetahuan mengenai suplai darah ini penting untuk mengetahui bagian dan konsekuensi dari iskemia.
2.3.2 Patologi Peradangan pada Usus
merupakan salah satu penyakit yang dapat disebabkan oleh E. sakazakii (Taylor 2002). Enterokolitis nekrotikan akibat E. sakazakii dipengaruhi oleh tiga hal, yaitu iskemia usus, kolonisasi mikroba di usus, dan kelebihan substrat protein di dalam lumen usus (van Acker et al. 2001).
Enterokolitis nekrotikan dikenal sebagai penyakit gastrointestinal yang paling banyak diderita oleh neonatus. Tingkat mortalitas akibat enterokolitis nekrotikan pada bayi manusia yang prematur antara 40-100%, pada bayi yang memiliki berat badan kurang dari 1.500 gram berkisar antara 10-44%, dan bayi yang memiliki berat badan lebih dari 2.500 gram antara 0-20%. Beberapa gejala yang dapat diamati akibat enterokolitis nekrotikan yaitu intoleransi makanan, penundaan pengosongan lambung, pembesaran abdomen, dan eritrema dinding abdomen (Springer dan Annibale 2006).
Beberapa indikator terjadinya peradangan pada usus yaitu vili usus menjadi lebih panjang, dinding usus menebal, dan jumlah jaringan limfatik menjadi lebih banyak (Shackelford dan Elwell 1999). Berdasarkan gambaran histopatologi, pada inflamasi akut terjadi edema di lamina propia disertai infiltrasi leukosit dalam jumlah yang ringan dan didominasi neutrofil. Selain itu, ruang antar vili dan kripta menjadi lebih lebar. Pada infeksi kronis, infiltrasi sel radang didominasi limfosit dan sel plasma, serta penyebaran kripta menjadi lebih lebar karena berisi leukosit dan sel debris. Dalam beberapa kasus, dapat terjadi inflamasi akut dan kronis secara bersamaan disertai nekrosa, trombosis, dan mineralisasi (Shackelford dan Elwell 1999).
Peradangan dapat menyebabkan terjadinya erosi dan ulcer di usus. Istilah erosi digunakan untuk menggambarkan hilangnya epitel usus pada fokus tertentu tanpa disertai hilangnya muskularis mukosa. Sedangkan ulcer digunakan untuk menggambarkan kerusakan epitel sampai muskularis mukosa atau bahkan lebih dalam lagi. Lesi ulcer biasanya terjadi pada lapisan submukosa atau mukosa dan kadangkala disertai adanya edema. Pada tepi ulcer biasanya terjadi hiperplasia epitel mukosa (Shackelford dan Elwell 1999). Selain akibat bakteri, peradangan usus dapat disebabkan oleh parasit, jamur (kapang dan khamir), virus, sistem autoimun, atau bahan toksik.
2.4. Cerebrum dan Medula Spinalis
2.4.1 Anatomi dan Histologi Cerebrum dan Medula Spinalis
Sistem saraf dapat dibedakan menjadi sistem saraf pusat (otak dan medula spinalis) dan sistem saraf tepi (nervus cranialis, spinalis termasuk ganglia, dan serabut saraf) (Beitz dan Fletcher 2006). Otak dapat dibagi menjadi batang otak, cerebellum (otak kecil) dan cerebrum (otak besar) (Aughey dan Frye 2001; Beitz dan Fletcher 2006). Otak mencit divaskularisasi oleh arteri carotis interna (Radovsky dan Mahler 1999).
Apabila otak disayat, dapat dibedakan adanya bagian substansia putih, substansia abu-abu, dan campuran substansia putih dan abu-abu (Gambar 5). Substansia putih mengandung banyak akson bermyelin, sedangkan substansia abu-abu mengandung badan sel saraf, neurofil dan neuroglia (Beitz dan Fletcher 2006). Neurofil merupakan bagian non-anatomik otak pada pewarnaan Hematoksilin-Eosin (HE) yang mencakup bagian otak selain badan neuron dan inti sel-sel neuroglia.
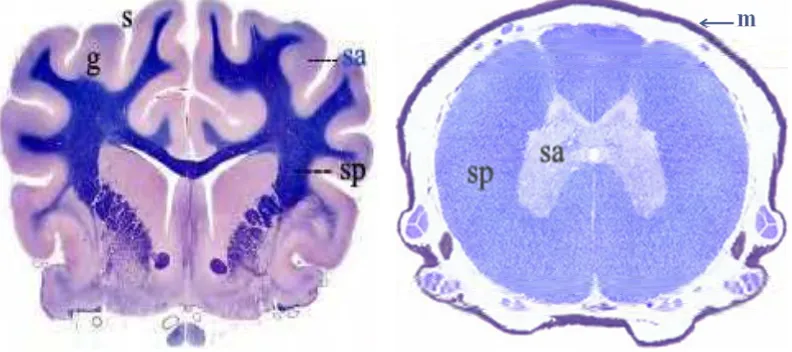
Gambar 5 Cerebrum (kiri) dan medula spinalis (kanan) (Eurell dan Frappier 2006).
Keterangan: (g) girus, (s) sulcus, (sp) substansia putih, (sa) substansia abu-abu, (m) meningen.
superfisial cerebrum berupa substansia abu-abu, yang disebut juga cortex cerebri, sedangkan lapisan profundal berupa substansia putih (Aughey dan Frye 2001).
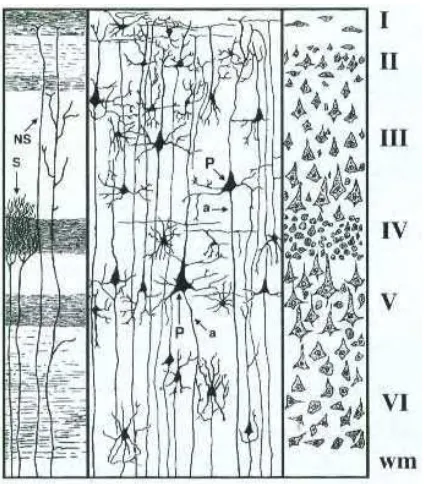
Adapun keenam lapisan pembentuk cortex cerebri berdasarkan morfologi dari sel neuron yang membentuknya (Gambar 6) dari lapisan superfisial sampai profundal yaitu (1) lapisan molekuler, (2) lapisan granuler eksternal, (3) lapisan piramidal eksternal, (4) lapisan granuler internal, (5) lapisan piramidal internal, dan (6) lapisan multiform (Beitz dan Fletcher 2006). Berbeda dengan cerebrum, lapisan superfisial medula spinalis berupa substansia putih, sedangkan lapisan profundalnya berupa substansia abu-abu (Aughey dan Frye 2001).
Gambar 6 Lapisan pembentuk cortex cerebri secara skematis (Eurell dan Frappier 2006).
Keterangan: (I) lapisan molekuler, (II) lapisan granuler eksternal, (III) lapisan piramidal eksternal, (IV) lapisan granuler internal, (V) lapisan piramidal internal, (VI) lapisan multiform, (wm) substansia putih.
Gambar 7 Meningen (Eurell dan Frappier 2006).
Keterangan: (a) tulang, (b) dura mater, (c) arachnoid, (d) sub arachnoid, (e) pia mater, (f) pembuluh darah, (g) otak.
Dura mater kadangkala disebut pachimeningen karena tebal, kuat, dan mengandung serabut kolagen. Pada dura mater dapat diamati adanya serabut elastis, fibrosit, saraf, pembuluh darah, dan limfe. Lapisan dalam dura mater terdiri dari beberapa lapis fibrosit pipih dan sel-sel luar dari lapisan arachnoid.
Lapisan arachnoid terdiri atas fibrosit berbentuk pipih dan serabut kolagen (Beitz dan Fletcher 2006). Lapisan arachnoid mempunyai dua komponen, yaitu suatu lapisan yang berhubungan dengan dura mater dan suatu sistem trabekula yang menghubungkan lapisan tersebut dengan pia mater. Ruangan di antara trabekula membentuk ruang subarachnoid yang berisi cairan serebrospinal dan sama sekali dipisahkan dari ruang subdural (Junquera dan Carneiro 1988). Pada beberapa daerah, arachnoid melubangi dura mater, dengan membentuk penonjolan yang membentuk trabekula di dalam sinus venous dura mater. Bagian ini dikenal dengan vilus arachnoidalis yang berfungsi memindahkan cairan cerebrospinal ke darah sinus venous (Junquera dan Carneiro 1988; Bevelander dan Ramaley 1988). Pia mater mengandung sedikit serabut kolagen dan membungkus seluruh permukaan sistem saraf pusat dan vaskula besar yang menembus otak (Beitz dan Fletcher 2006).
cenderung eukromatik. Akson merupakan awal segmen saraf dan berakhir di cabang terminal atau dendrit neuron yang lain. Akson berbentuk silinder, panjang, diselubungi myelin dan mengandung sel Schwann dan Nodus Ranvier. Dendrit lebih pendek daripada akson namun berjumlah lebih banyak. Dendrit akan menerima stimulus elektris dari ujung akson dari neuron yang lain. Pada pewarnaan Hematoksilin Eosin (HE), hanya dapat dilihat badan sel dengan inti sel neuron (Aughey dan Frye 2001).
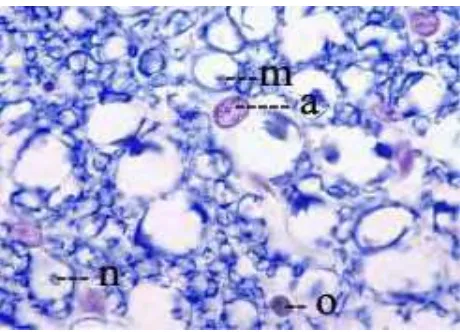
Neuroglia(Gambar 8, Gambar 9)merupakan jaringan penyokong susunan saraf yang memiliki banyak penjuluran (serabut) dan terdiri atas astrosit, oligodendrosit, mikroglia, sel ependimal, sel Schwann, sel satelit dan kapsula (Beitz dan Fletcher 2006). Astrosit berwarna pucat, bernukleus ovoid dan merupakan jenis neuroglia terbanyak. Dengan pewarnaan HE astrosit hanya tampak intinya saja dengan kromatin halus tanpa nukleolus. Oligodendrosit berinti bulat, piknotik, bercabang banyak dan lebih kecil daripada astrosit (Radovsky dan Mahler 1999). Mikroglia memiliki inti kromofilik berukuran kecil berbentuk bulat atau lonjong. Sel ependim berbentuk silinder atau kubus dan memiliki silia yang motil. Sel Schwan merupakan pembungkus akson dan pembentuk mielin. Sel satelit dan kapsula nengelilingi badan sel ganglion (Beitz dan Fletcher 2006).
Gambar 8 Neuron dan neuroglia pada sistem saraf pusat dengan pewarnaan luxol blue dan hematoksilin (Eurell dan Frappier 2006).
Gambar 9 Neuron dan neuroglia secara skematis (Fox 2004).
2.4.2 Patologi Cerebrum dan Medula Spinalis
Dalam kondisi normal, sistem saraf pusat (SSP) steril. Apabila SSP terinfeksi suatu agen maka infeksi akan menyebar dan antara lain mengakibatkan peradangan pada meningen (meningitis). Meningitis terutama terjadi pada bagian subarachinoid yang melibatkan arachnoid dan pia mater. Namun tidak menutup kemungkinan bila meningitis juga terjadi di dura mater (Ironside 1994).
Cairan serebrospinal pada meningitis bakterial mengandung banyak netrofil, bakteri, protein dalam konsentrasi tinggi, namun glukosa dalam konsentrasi rendah (Ironside 1994). Komplikasi bakterial meningitis berupa infark otak, hidrosephalus obstruktif, subdural empyema, epilepsi, serebral tromboplebitis dan abses. Pus tergenang pada sulkus serebralis dan di sekitar dasar otak maupun di medula spinalis. Pembuluh darah pada meningen mengalami kongesti disertai hemoragi perivaskular. Patologi otak manusia pada neonatal manusia akibat infeksi E. sakazakii menunjukkan abses pada serebral, infark, formasi kiste dengan berbagai gangguan saraf (Lai 2001).
Selain pengamatan terhadap meningen, kondisi patologis pada otak dapat dilakukan dengan mengamati neuron dan neuroglia yang memiliki hubungan yang sangat kompleks dan vital. Seringkali reaksi pada neuroglia memberikan gambaran terbaik mengenai kondisi patologis sistem saraf (Radovsky dan Mahler 1999).
Encephalitis adalah peradangan substansi otak dengan ciri adanya infiltrasi sel-sel radang perivaskuler (perivasculer cuffing) dan gliosis. Gliosis merupakan peningkatan jumlah sel glia yang biasanya mencakup respon astrosit yang mencolok. Gliosis dapat terfokus atau difus. Selain itu, bila terjadi infeksi SSP maka sel glia akan berkumpul di tempat terjadinya lesi atau mengubah bentuk dan fungsinya (Damjanov 2000). Menurut Damjanov (2000), kerusakan SSP akibat infeksi mikroorganisme menyebabkan sel mikroglia memfagosit sel-sel mati atau rusak pada SSP melalui pembentukan nodulus glia. Sel mikroglia yang dijumpai di sekitar infark atau abses otak memfagosit myelin kaya lemak sehingga sitoplasmanya bervakuol dan tampak berbusa. Sel ini disebut sel gitter.
2.5. Limpa
2.5.1 Anatomi dan Histologi Limpa
Limpa termasuk salah satu organ sistem limfoid, selain timus, tonsil, dan kelenjar limfe (Aughey dan Frye 2001). Sistem limfoid berfungsi untuk melindungi tubuh dari invasi dan kerusakan akibat zat asing. Sel-sel pada sistem ini dikenal dengan sel imunokompeten yaitu sel yang mampu membedakan sel tubuh dengan zat asing dan menyelenggarakan inaktivasi atau destruksi benda-benda asing. Sel imunokompeten terdiri atas (1) sel utama bergerak, yakni sel limfosit dan makrofag, dan (2) sel utama menetap, yakni retikuloendotel dan sel plasma (Junqueira dan Carneiro 1982).
Limpa merupakan ogan limfoid terbesar dan terletak di bagian dorso-cranial rongga abdomen di antara diafragma dan lambung (Geneser 1994). Secara anatomis, tepi limpa yang normal berbentuk pipih. Fungsi limpa yaitu mengakumulasi limfosit dan makrofag, degradasi eritrosit, tempat cadangan darah, dan sebagai organ pertahanan terhadap infeksi partikel asing yang masuk ke dalam darah (Junqueira dan Carneiro 1982).
Gambar 10 Limpa (Eurell dan Frappier 2006).
Keterangan: (c) kapsula, (t) trabekula, (m) pulpa merah, (p) pulpa putih.
disebut pulpa yang terdiri atas pulpa merah dan pulpa putih (Gambar 10). Pulpa merah berwarna merah gelap pada potongan limpa segar. Pulpa merah terdiri atas sinusoid limpa (Genesser 1994). Pulpa putih tersebar dalam pulpa merah, berbentuk oval dan berwarna putih kelabu. Pulpa putih terdiri atas pariarteriolar limphoid sheats (PALS), folikel limfoid, dan zona marginal. Folikel limfoid umumnya tersusun atas sel limfosit B, makrofag, dan sel debri (Ward et al. 1999).
2.5.2 Patologi Limpa
Peradangan limpa disebut splenitis. Patologi limpa akibat inflamasi dapat bersifat akut, kronis, granulomatous, atau abses. Hal ini biasanya dapat diamati di pulpa merah. Selain itu, inflamasi limpa sekunder dapat terjadi akibat tumor. Hemoragi dapat terjadi akibat paparan bahan kimia atau iradiasi. Metode euthanasi dapat menyebabkan kongesti. Secara histologis, terdapat kesulitan untuk membedakan hemoragi, kongesti, atau angiektasis dari kondisi fisiologis limpa karena organ ini memiliki banyak sel eritrosit (Ward et al. 1999).
Peradangan yang sistemik akan menimbulkan respon limpa. Pada kondisi sepsis dan injeksi endotoksin atau bakteri gram negatif akan terjadi peningkatan akumulasi neutrofil di zona mantel dan sinus limpa. Pada area ini terjadi destruksi bakteri dan pengolahan antigen. Splenitis dan sepsis ditandai dengan pembesaran limpa, hiperemi akut, degenerasi dan aktivasi folikel limfoid, hiperplasia dan mobilisasi sel retikulum (Valli dan Parry 1993).
Pada hewan muda, histopatologi splenitis akibat toksin yang akut yaitu adanya pusat germinal epiteloid. Selain itu, infeksi bakteri gram negative yang parah di saluran pencernaan pada hewan muda dapat menyebabkan terbentuknya fokus kolonisasi bakteri di limpa (Valli dan Parry 1993).
dan leukosit. Endotel yang teraktivasi meningkatkan permeabilitas vaskuler sehingga terjadi aliran protein plasma dan eksudat dari leukosit dari lumen pembuluh darah ke jaringan interstisial. Albumin, fibrinogen, dan protein plasma lainnya mengalir ke dalam jaringan dan dikenal dengan deposisi protein radang.
3. METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB) pada bulan Januari 2007 sampai Mei 2008.
3.2 Materi
3.2.1 Hewan Coba
Penelitian ini bersifat eksperimental menggunakan hewan coba sebagai model. Hewan coba yang digunakan dalam penelitian ini yaitu tiga puluh mencit neonatus (Mus musculus albinus) berumur satu minggu dengan bobot awal 3-4,5 gram. Mencit neonatus tersebut diperoleh dari hasil perkawinan mencit parental (F1) dengan anak mencit F1 (in breeding).
3.2.2 Isolat Enterobacter sakazakii
Penelitian ini menggunakan suspensi bakteri Enterobacter sakazakii koleksi Sri Estuningsih dari Bagian Patologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Isolat Enterobacter sakazakii tersebut telah teruji melalui penelitian sebelumnya sebagai isolat yang dapat menghasilkan enterotoksin tahan panas melalui uji in vitro untuk sitotoksik mengikuti Pagotto et al. (2003) (Grecilia 2008). Suspensi bakteri Enterobacter sakazakii yang digunakan diencerkan menggunakan Phosphate Buffer Saline (PBS) secara bertingkat sehingga diperoleh dosis 103colony forming unit (cfu)/ml, 104 cfu/ml, 105 cfu/ml, 106 cfu/ml, dan 107 cfu/ml mengikuti metode Mc Farlane.
3.2.3 Bahan dan Alat
mencit hasil formulasi Bagian Non Ruminansia dan Satwa Harapan (NRSH) Fakultas Peternakan IPB, air mineral AQUA® untuk minum mencit, NaCl fisiologis, anthelmentik (Albendazol®), antibiotik (Amoxicilin® dan Ciprofloxacin®), dan akuades. Bahan-bahan yang digunakan untuk pewarnaan histopatologis yaitu sebagai berikut: larutan Mayers Hematoksilin, larutan Eosin, alkohol dengan konsentrasi bertingkat (70%, 80%, 90%, 100%), xilol, eter, Buffered Neutral Formalin (BNF) 10%, parafin cair, albumin dan metanol.
Alat-alat yang digunakan dalam penelitian ini yaitu ose, sentrifus, tabung reaksi, kandang mencit, kertas label, sekam kering, timbangan digital, kapas, syringe, sonde lambung Knopfkanüle buatan Jerman, kulkas, aluminium foil, anaerobic jar, stiroform, jarum pentul, cawan petri, dan peralatan bedah (gunting, pinset, dan skalpel). Peralatan untuk pembuatan dan pengamatan sediaan histopatologi terdiri atas tissue casset, automatic tissue processor, mikrotom, pencetak parafin, gelas objek, gelas penutup, mikroskop cahaya, dan alat mikrofotografi.
3.3 Prosedur Penelitian
3.3.1 Adaptasi, Pre-Treatment, dan Perkawinan Mencit Parental
Mencit neonatus yang digunakan dalam penelitian ini diperoleh dari hasil perkawinan mencit jantan dan mencit betina dewasa (mencit parental) yang telah dipelihara sebelumnya. Mencit parental yang digunakan berjumlah sepuluh ekor mencit betina dan dua ekor mencit jantan. Pemeliharaan mencit parental dilakukan dalam kandang plastik beralaskan sekam yang ditutup kawat untuk sirkulasi udara. Sebelum diberikan pre-treatment dan dikawinkan, dilakukan proses adaptasi mencit dalam kandang selama satu minggu. Selama masa adaptasi dan pre-treatment, pemeliharaan mencit jantan dan betina dilakukan secara terpisah sehingga perkawinan tidak terjadi.
Mencit parental yang digunakan merupakan mencit Non-specificPathogen
Free (NSPF) dan diberi pre-treatment sebelum dikawinkan. Sebagai pre-treatment diberikan Amoxicilin® dengan dosis 125 mg/kgBB selama lima hari
berturut-turut, kemudian mencit diistirahatkan selama tiga hari. Setelah itu, mencit diberi Ciprofloxacin® dengan dosis 100 mg/kgBB selama tiga hari berturut-turut. Selain itu, sebagai anthelmentik diberikan Albendazole® 5% dengan dosis tunggal 10 mg/kg BB dengan 3 kali pengulangan berjarak satu minggu.
Perkawinan mencit parental dilakukan dengan cara membagi mencit ke dalam dua kandang yang masing-masing berisi lima ekor mencit betina dan satu ekor mencit jantan. Apabila mencit betina menunjukkan tanda telah bunting, maka mencit betina tersebut ditempatkan di kandang terpisah. Kurang lebih 21 hari setelah dikawinkan, mencit betina melahirkan mencit neonatus yang tetap disatukan dengan induknya sampai akan diinfeksikan bakteri E. sakazakii.
3.3.2 Pembuatan Suspensi Enterobacter sakazakii
Kultur Enterobacter sakazakii yang telah ada dibuat menjadi kultur baru dengan cara mengisolasi bakteri tersebut pada Tripsic Soy Agar (TSA) selama 24 jam. Selanjutnya hasil kultur E. sakazakii di TSA diisolasikan pada Brain Heart Infusion Broth (BHI Broth) selama 24 jam. Kemudian, kultur E. sakazakii dalam BHI Broth disentrifus dengan kecepatan 5.000 rpm selama 15 menit. Supernatan yang terbentuk dibuang sedangkan pelet dicuci menggunakan Phospate Buffer Saline (PBS) sebanyak tiga kali. Pada proses pencucian, larutan disentrifus dengan kecepatan 5.000 rpm selama 15 menit. Supernatan pada proses pencucian ketiga dibuang. Selanjutnya pada pelet ditambahkan PBS dengan jumlah tertentu sehingga kekeruhannya sama dengan larutan standar Mc Farlane I yang memiliki
densitas bakteri sebanyak 3,0 x 108 cfu/ml. Dengan demikian, suspensi E. sakazakii yang terbentuk mengandung 108 cfu/ml. Untuk membuat suspensi
3.3.3 Infeksi Enterobacter sakazakii pada Mencit Neonatus
Sebanyak tiga puluh mencit neonatus berumur satu minggu dibagi menjadi enam kelompok yang masing-masing terdiri atas lima ekor mencit. Setiap kelompok diberi perlakuan yang berbeda. Adapun perlakuan yang diberikan pada setiap kelompok dapat dilihat pada Tabel 4.
Tabel 4 Perlakuan terhadap enam kelompok anak mencit usia satu minggu
No. Kelompok Perlakuan
1. Kontrol NaCl fisiologis secara per oral sebanyak 0,1 ml/ekor 2. I 103 cfu/ml suspensi bakteri E. sakazakii PBS secara per
oral sebanyak 0,1 ml/ekor
3. II 104 cfu /ml suspensi bakteri E. sakazakii dalam PBS secara per oral sebanyak 0,1 ml/ekor
4. III 105 cfu /ml suspensi bakteri E. sakazakii dalam PBS secara per oral sebanyak 0,1 ml/ekor
5. IV 106 cfu /ml suspensi bakteri E. sakazakii dalam PBS secara per oral sebanyak 0,1 ml/ekor
6. V 107 cfu /ml suspensi bakteri E. sakazakii dalam PBS secara per oral sebanyak 0,1 ml/ekor
Mencit kontrol dieuthanasi menggunakan eter pada hari ketiga pasca pemberian NaCl fisiologis per oral, sedangkan mencit yang diinfeksikan suspensi bakteri Enterobacter sakazakii diamati hingga mencit mati. Apabila sampai pada hari ketiga mencit yang diinfeksi E. sakazakii tidak mati, maka mencit tersebut dieuthanasi menggunakan eter dalam anaerobic jar.
3.3.4 Pembuatan sediaan Histopatologi
Mencit neonatus yang telah diawetkan dalam larutan BNF 10% dipotong dengan ketebalan ± 3 mm secara melintang dalam lima bagian (Gambar 11). Bagian pertama, yaitu kepala, diperoleh dengan cara memotong mencit tepat di sendi yang memisahkan tulang tengkorak dengan os vertebrae cerivicalis I, kemudian menyayat sulcus cerebri secara longitudinal sehingga otak kiri dan otak kanan terpisah. Bagian mulut dipotong agar tidak menyulitkan sewaktu pemotongan dalam parafin. Potongan kedua dilakukan tepat di belakang tangan, potongan ketiga dilakukan di bagian epigastrium, potongan keempat dilakukan di bagian mesogastrium, dan potongan kelima dilakukan di bagian hipogastrium, sebelum kaki belakang.
Potongan ke- 1 2 3 4 5
Gambar 11 Teknik pemotongan mencit neonatus secara skematis
Potongan organ mencit neonatus dimasukkan ke dalam tissue casset. Untuk setiap mencit neonatus digunakan dua tissue casset. Selanjutnya dilakukan dehidrasi dengan cara merendam sediaan tersebut secara berturut-turut ke dalam alkohol 70%, 80%, 90%, alkohol absolut I, alkohol absolut II, xilol I, xilol II, parafin I dan parafin II. Masing-masing proses perendaman pada setiap bahan dilakukan selama dua jam dan berjalan secara otomatis dalam alat tissue processor.
hangat (45oC) dengan tujuan untuk menghilangkan lipatan akibat pemotongan. Sediaan diangkat dari permukaan air dengan gelas objek yang telah diulasi larutan albumin yang berfungsi sebagai perekat. Selanjutnya sediaan dikeringkan dalam inkubator suhu 60oC selama satu malam.
Sediaan dimasukkan ke dalam xilol untuk dideparafinisasi sebanyak dua kali, masing-masing selama dua menit. Selanjutnya sediaan melalui proses rehidrasi. Proses rehidrasi dimulai dari alkohol absolut sampai ke alkohol 80%, yang masing-masing lamanya dua menit. Setelah itu, sediaan dicuci dengan air mengalir dan dikeringkan. Sediaan yang telah kering diwarnai dengan pewarnaan Mayer’s Hematoksilin selama 8 menit, dibilas dengan air mengalir, dicuci dengan lithium karbonat selama 15-30 detik, dibilas dengan air, dan diwarnai dengan pewarna Eosin selama dua menit. Selanjutnya, sediaan dicuci dengan air mengalir untuk menghilangkan warna Eosin yang berlebih sebelum akhirnya dikeringkan.
Setelah kering, sediaan dicelupkan ke dalam alkohol 90% sebanyak 10 kali celupan, alkohol absolut I sebanyak 10 kali celupan, alkohol absolut II selama 2 menit, xilol I selama satu menit dan xilol II selama dua menit. Sediaan ditetesi perekat permount, ditutup dengan gelas penutup, dan dibiarkan kering sesuai dengan metode Bagian Patologi Fakultas Kedokteran Hewan IPB. Sediaan siap dilihat dan setelah perekat kering diamati menggunakan mikroskop cahaya.
3.3.5 Pengamatan Histopatologi
Pengamatan histopatologi dilakukan secara deskriptif maupun kuantitatif menggunakan mikroskop dengan perbesaran 400 kali (40x objektif dan 10x okuler). Organ-organ yang diamati terdiri atas usus halus, usus besar, otak besar (cerebrum), medula spinalis, dan limpa.