ENDAH MULIA NINGSIH. Studi Histopatologi Potensi Radioprotektif Ekstrak Kelopak Rosela (Hibiscus sabdariffa L.) terhadap Duodenum Mencit (Mus musculus) dengan Radiasi Ionisasi Radiodiagnostik Berulang. Dibimbing oleh SRI ESTUNINGSIH dan DENI NOVIANA.
Penelitian ini bertujuan untuk mengetahui potensi radioprotektif ekstrak kelopak rosela (Hibiscus sabdariffa L.) dalam radiasi ionisasi radiodiagnostik berulang terhadap duodenum mencit (Mus musculus). Mencit yang digunakan pada penelitian ini berjumlah 24 ekor yang dibagi ke dalam 4 kelompok, yaitu; kelompok kontrol (K), kelompok perlakuan primer (P), kelompok perlakuan rosela (R), dan kelompok perlakuan radiasi rosela (RP). Pemberian NaCl fisiologis 0.9 untuk kelompok kontrol (K), NaCl fisiologis 0.9 untuk kelompok primer (P), ekstrak kelopak rosela untuk kelompok rosela (R), dan ekstrak kelopak rosela untuk kelompok radiasi-rosela (RP). NaCl fisiologis dan ekstrak kelopak rosela diberikan per oral setiap 2 hari sekali selama 8 minggu. Paparan radiasi diberikan khusus pada kelompok primer (P) dan kelompok radiasi rosela (RP). Pada kesemua kelompok diberi 4 minggu masa pemulihan setelah 8 minggu perlakuan. Gambaran histologi duodenum mencit dilihat pada preparat yang diwarnai dengan hematoksilin-eosin, sedangkan jumlah sel goblet dilihat pada preparat duodenum yang diwarnai dengan periodic acid Schiff. Hasilnya menunjukkan bahwa rosela memiliki keutuhan vili yang lebih tinggi dan jumlah sel goblet yang lebih rendah dibandingkan mencit kelompok perlakuan kontrol. Rosela (Hibiscus sabdariffa L.) menunjukkan adanya potensi radioprotektif
terhadap radiasi ionisasi radiodiagnostik berulang terhadap duodenum mencit (Mus musculus).
ENDAH MULIA NINGSIH. Histopathology Study of Radioprotective Roselle Calyx Extract (Hibiscus sabdariffa L) Potency Against Recurrent Effect of Radiodiagnostic Radiation on Duodenum of Mice (Mus musculus). Under direction of SRI ESTUNINGSIH and DENI NOVIANA.
This study was conducted to find out the potency of Roselle (Hibiscus sabdariffa L.) as radioprotective against recurrent effect of radiodiagnostic radiation on duodenum of mice (Mus musculus). This research was to observed histophatological changes on duodenum of mice treated with roselle calyx extracts and radiation. Twenty four male mice were used in this study. They were divided into 4 groups namely control group (K) treated with 0.2 ml of NaCl 0.9 % (saline); primary radiation group (P) treated with 0.2 ml of NaCl 0.9 % (saline) and radiation 0.2 mSv; roselle group (R) treated with 0.2 ml roselle calyx extract; and primary radiation-roselle group (RP) treated with 0.2 ml roselle calyx extract and radiation 0.2 mSv. All treatments were done orally every two days for 8 weeks. Afterwards, 3 mice from each group were euthanized for organ sampling. The rest of mice were took 4 weeks of recovery. Afterwards, all mice were euthanized for organ sampling. Duodenum were fixed in Buffered Neutral Formaline (BNF) 10%, embedded in paraffin, then stained with hematoxyline and eosin (HE) and periodic-acid schiff (PAS). The result showed that RP group had lower demage of intestinal villi and numbers of goblet cell than P group. Lieberkühn crypt number of P group was increased, whereas intestinal villi height was decreased compared to R and RP groups. Roselle calyx extract (Hibiscus sabdariffa L.) showed radioprotective potency after radiation treatment on duodenum of mice.
TERHADAP DUODENUM MENCIT (
Mus musculus
) DENGAN
RADIASI IONISASI RADIODIAGNOSTIK BERULANG
ENDAH MULIA NINGSIH
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ENDAH MULIA NINGSIH. Studi Histopatologi Potensi Radioprotektif Ekstrak Kelopak Rosela (Hibiscus sabdariffa L.) terhadap Duodenum Mencit (Mus musculus) dengan Radiasi Ionisasi Radiodiagnostik Berulang. Dibimbing oleh SRI ESTUNINGSIH dan DENI NOVIANA.
Penelitian ini bertujuan untuk mengetahui potensi radioprotektif ekstrak kelopak rosela (Hibiscus sabdariffa L.) dalam radiasi ionisasi radiodiagnostik berulang terhadap duodenum mencit (Mus musculus). Mencit yang digunakan pada penelitian ini berjumlah 24 ekor yang dibagi ke dalam 4 kelompok, yaitu; kelompok kontrol (K), kelompok perlakuan primer (P), kelompok perlakuan rosela (R), dan kelompok perlakuan radiasi rosela (RP). Pemberian NaCl fisiologis 0.9 untuk kelompok kontrol (K), NaCl fisiologis 0.9 untuk kelompok primer (P), ekstrak kelopak rosela untuk kelompok rosela (R), dan ekstrak kelopak rosela untuk kelompok radiasi-rosela (RP). NaCl fisiologis dan ekstrak kelopak rosela diberikan per oral setiap 2 hari sekali selama 8 minggu. Paparan radiasi diberikan khusus pada kelompok primer (P) dan kelompok radiasi rosela (RP). Pada kesemua kelompok diberi 4 minggu masa pemulihan setelah 8 minggu perlakuan. Gambaran histologi duodenum mencit dilihat pada preparat yang diwarnai dengan hematoksilin-eosin, sedangkan jumlah sel goblet dilihat pada preparat duodenum yang diwarnai dengan periodic acid Schiff. Hasilnya menunjukkan bahwa rosela memiliki keutuhan vili yang lebih tinggi dan jumlah sel goblet yang lebih rendah dibandingkan mencit kelompok perlakuan kontrol. Rosela (Hibiscus sabdariffa L.) menunjukkan adanya potensi radioprotektif
terhadap radiasi ionisasi radiodiagnostik berulang terhadap duodenum mencit (Mus musculus).
ENDAH MULIA NINGSIH. Histopathology Study of Radioprotective Roselle Calyx Extract (Hibiscus sabdariffa L) Potency Against Recurrent Effect of Radiodiagnostic Radiation on Duodenum of Mice (Mus musculus). Under direction of SRI ESTUNINGSIH and DENI NOVIANA.
This study was conducted to find out the potency of Roselle (Hibiscus sabdariffa L.) as radioprotective against recurrent effect of radiodiagnostic radiation on duodenum of mice (Mus musculus). This research was to observed histophatological changes on duodenum of mice treated with roselle calyx extracts and radiation. Twenty four male mice were used in this study. They were divided into 4 groups namely control group (K) treated with 0.2 ml of NaCl 0.9 % (saline); primary radiation group (P) treated with 0.2 ml of NaCl 0.9 % (saline) and radiation 0.2 mSv; roselle group (R) treated with 0.2 ml roselle calyx extract; and primary radiation-roselle group (RP) treated with 0.2 ml roselle calyx extract and radiation 0.2 mSv. All treatments were done orally every two days for 8 weeks. Afterwards, 3 mice from each group were euthanized for organ sampling. The rest of mice were took 4 weeks of recovery. Afterwards, all mice were euthanized for organ sampling. Duodenum were fixed in Buffered Neutral Formaline (BNF) 10%, embedded in paraffin, then stained with hematoxyline and eosin (HE) and periodic-acid schiff (PAS). The result showed that RP group had lower demage of intestinal villi and numbers of goblet cell than P group. Lieberkühn crypt number of P group was increased, whereas intestinal villi height was decreased compared to R and RP groups. Roselle calyx extract (Hibiscus sabdariffa L.) showed radioprotective potency after radiation treatment on duodenum of mice.
EKSTRAK KELOPAK ROSELA (
Hibiscus sabdariffa
L
)
TERHADAP DUODENUM MENCIT (
Mus musculus
) DENGAN
RADIASI IONISASI RADIODIAGNOSTIK BERULANG
ENDAH MULIA NINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi dengan judul Studi Histopatologi Potensi Radioprotektif Tanaman Rosela (Hibiscus sabdariffa L)
terhadap Duodenum Mencit (Mus musculus) dengan Radiasi Ionisasi Radiodiagnostik Berulang adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2012
Endah Mulia Ningsih
© Hak Cipta milik IPB, Tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah: dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Judul skripsi : Studi Histopatologi Potensi Radioprotektif Ekstrak Kelopak Rosela (Hibiscus sabdariffa L) terhadap Duodenum Mencit (Mus musculus) dengan Radiasi Ionisasi Radiodiagnostik Berulang
Nama : Endah Mulia Ningsih
NIM : B04070064
Disetujui
Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. drh. Sri Estuningsih, M.Si, AP Vet drh. Deni Noviana, PhD NIP : 19600629 199002 2 001 NIP : 19721116 199512 2 003
Diketahui : a.n Dekan Wakil Dekan FKH IPB
Drh. Agus Setiyono, Msi, PhD APVet NIP : 19630810 198803 1 004
Segala puji dan syukur sebesar-besarnya penulis ucapkan kepada Allah SWT atas segala rahmat dan hidayah-Nya berupa kekuatan lahir dan batin sehingga skripsi ini dapat diselesaikan. Judul skripsi ini ialah Studi Histopatologi pada Duodenum Mencit (Mus musculus) terhadap Potensi Radioprotektif Ekstrak
Kelopak Rosela (Hibiscus sabdariffa L.) dalam Radiasi Radiodiagnostik Berulang
yang dilaksanakan di Bagian Patologi dan Bagian Klinik Bedah FKH IPB pada bulan juni sampai mei 2011.
Terima kasih penulis sampaikan kepada Dr.drh. Sri Estuningsih, M.Si dan drh.Deni Noviana, PhD selaku dosen pembimbing atas waktu, arahan, kritik dan saran yang mendukung terselesaikannya skripsi ini dengan baik. Terima kasih kepada Direktorat Penelitian dan Pengabdian Masyarakat, Direktorat Jendral Pendidikan Tinggi, Kementrian Pendidikan Nasional RI, yang telah memberikan dana penelitian melalui Hibah Kompetensi, atas nama Dr .drh. Sri Estuningsih, MSi, drh. Deni Noviana, PhD dan drh. M. Fakhrul Ulum MSi. Penulis juga menyampaikan terima kasih kepada drh. Vetnizah Juniantito PhD, dan drh. Mawar Subangkit atas saran dalam penulisan skripsi ini. Bapak Endang, Bapak Kasnadi, Bapak Sholeh dan Bapak Katim serta teman-teman satu penelitian (Griv, Bambang, Windy, dan Abas) yang telah banyak membantu penelitian ini.
Ucapan terima kasih juga disampaikan kepada Bapak, Mom, Kakak, Ayu’, dan keponakan (H. Patar, Hj. Partini, Wahyudi, Elina Malau, Evi Dwi Yanti, ST, A. Snurin, SPt, Bayu Triono, ST, Putra, Raisha, Fairuz, & Aisyah), serta keluarga besar atas doa, semangat, cinta, dan kesabaran yang telah diberikan. Selanjutnya terima kasih penulis ucapkan kepada drh. Supratikno, MSi, keluarga Iffah, Al-afkar circle, drh Devi Paramitha, dan angkatan 44 Gianuzzi FKH IPB.
Penulis menyadari penulisan skripsi ini tidak luput dari kekurangan, untuk itu penulis sangat berterima kasih atas kritik dan saran-saran yang membangun dari semua pihak demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat.
Bogor, Agustus 2012
Penulis dilahirkan di Palembang – Sumatera Selatan, 18 Maret 1990, dari pasangan H. Patar dan Hj. Partini. Penulis merupakan bungsu dari empat bersaudara. Penulis menyelesaikan pendidikannya di SMAN 4 Palembang pada tahun 2007. Pada tahun yang sama penulis diterima di IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dan tercatat sebagai mahasiswa Kedokteran Hewan Institut Pertanian Bogor pada tahun 2008.
Selama menjadi mahasiswa, penulis aktif dalam FORCES IPB sebagai staf club study (2007-2009), BEM FKH IPB sebagai sekertaris Departemen Kebijakan Publik (2008-2009), menjadi anggota Departemen Keputrian DKM An-Nahl FKH IPB (2008-2009), anggota biasa HIMPRO HKSA FKH IPB (2008-2010) dan sebagai tim Program & Fund Raising Program Kakak Asuh (Pro KA)
(2010-sekarang). Menjadi delegasi Indonesia dalam ajang IVSA South Korea 2011,
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR. ... iv
DAFTAR LAMPIRAN ... vi
1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan. ... 2
1.3 Manfaat ... 3
2. TINJAUAN PUSTAKA ... 4
2.1 Radiasi ... 4
2.1.1 Sinar- X ... 4
2.1.2 Pemanfaatan Sinar-X Dalam Dunia Medis ... 5
2.1.3 Efek Radiasi Ionisasi... 6
2.2 Rosela (Hibiscus sabdariffa L.) ... 7
2.2.1 Karakteristik Rosela ... 7
2.2.2 Pemanfaatan Rosela di Masyarakat ... 8
2.2.3 Komposisi Kimia Rosela... 9
2.3 Mencit (Mus musculus) ... 11
2.4 Duodenum... 13
2.4.1 Anatomi Dan Histologi Duodenum ... 13
2.5 Kondisi Patologis Pada Sel Usus ... 18
2.5.1 Apoptosis Epitel Usus ... 18
2.5.2 Degenerasi Epitel Dan Atrofi Vili Usus ... 21
3. METODE PENELITIAN ... 24
3.1 Waktu Dan Tempat Penelitian ... 24
3.2 Materi ... 24
3.2.1 Hewan Percobaan ... 24
3.2.3 Bahan Dan Alat ... 25
3.3 Prosedur Penelitian ... 26
3.3.1 Aklimatisasi dan pre- treatment Mencit ... 26
3.3.2 Perlakuan Terhadap Hewan Percobaan ... 27
3.3.3 Pemberian Radiasi ... 28
3.3.4 Pemberian Ekstrak Rosela ... 28
3.3.5 Nekropsi ... 28
3.3.6 Pembuatan Sediaan Histopatologi ... 29
3.3.7 Pengamatan Histopatologi ... 30
3.3.8 Analisis Data ... 31
4. HASIL DAN PEMBAHASAN ... 33
4.1 Kerusakan Vili Duodenum ... 34
4.2 Rataan Jumlah Kripta Duodenum ... 40
4.3 Rataan Jumlah Sel Goblet Duodenum... 45
4.4 Rataan Jumlah Sel Radang ... 49
4.5 Rataan Tinggi Vili Duodenum ... 54
4.6 Gambaran Umum Pengamatan Histopatologi Duodenum Mencit ... 58
5. SIMPULAN DAN SARAN ... 61
5.1 Simpulan ... 61
5.2 Saran ... 61
DAFTAR PUSTAKA ... 62
DAFTAR TABEL
Halaman
1. Kandungan gizi dalam 100 g kelopak segar bunga rosela ... 9
2. Hasil uji fisikokimia dalam 100 g kelopak segar bunga rosela ... 9
3. Hasil uji fitokimia ekstrak kelopak bunga rosela ... 10
4. Kelompok mencit perlakuan ... 27
5. Rataan persentase kerusakan vili duodenum(%) ... 34
6. Rataan jumlah kripta pada duodenum (sel) ... 40
7. Rataan jumlah sel goblet pada duodenum (sel) ... 45
8. Rataan jumlah sel radang pada duodenum (sel) ... 49
9. Rataan tinggi vili duodenum (µ m2) ... 55
DAFTAR GAMBAR
Halaman
1. Daya tembus radiasi ionisasi ... 4
2. Tanaman rosela ... 7
3. Mencit ... 11
4. Struktur mikroskopis usus mencit ... 13
5. Struktur histologi duodenum ... 14
6. Gambaran mikroskopis vili duodenum ... 16
7. Histologi submukosa usus ... 17
8. Gambaran sel apoptosis pada kripta duodenum ... 20
9. Mekanisme apoptosis sel ... 21
10. Diagram alur kemungkinan paparan sinar-X seluler pada sel normal ... 21
11. Gambaran vili usus halus yang mengalami degenerasi ... 22
12. Gambaran histologi vili duodenum mencit yang atrofi ... 23
13. Kandang mencit dengan alas kandang berupa serbuk gergaji ... 26
14. Pencekokan bahan perlakuan (NaCl dan ekstrak kelopak bunga rosela) pada mencit ... 28
15. Alur penelitian ... 32
16. Mekanisme kerusakan sel akibat radiasi ... 35
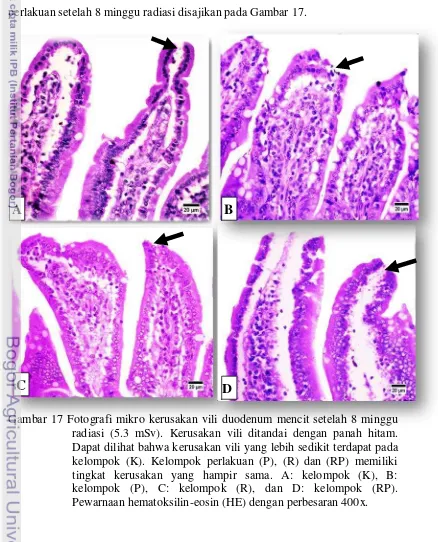
17. Fotografi mikro kerusakan vili duodenum mencit setelah 8 minggu radiasi (5.3 mSv) ... 37
18. Fotografi mikro kerusakan vili duodenum mencit setelah 4 minggu pemulihan dari radiasi ... 38
19. Fotografi mikro kripta Lieberkuhn pada duodenum mencit setelah 8 minggu radiasi (5.3 mSv) ... 42
20. Fotografi mikro kripta Lieberkuhn pada duodenum mencit setelah 4 minggu pemulihan dari radiasi ... 44
21. Fotografi mikro sel goblet pada duodenum mencit setelah 8 minggu radiasi (5.3 mSv) ... 46
23. Mekanisme akibat yang terjadi karena hadirnya ROS (Reactive
Oxygen Species) pada sel ... 51
24. Fotografi mikro sel radang di submukosa duodenum mencit
setelah 8 minggu radiasi (5.3 mSv) ... 52 25. Fotografi mikro sel radang pada submukosa duodenum setelah
4 minggu pemulihan dari radiasi ... 53 26. Fotografi mikro tinggi vili duodenum mencit setelah 8 minggu
radiasi(5.3 mSv)... 55 27. Fotografi mikro tinggi vili pada duodenum setelah 4 minggu
LAMPIRAN
Halaman 1. Diagram alir pembuatan sediaan (preparat) histopatologi organ
usus halsus mencit percobaan ... 70 2. Diagram alir pewarnaan Hematoksilin-eosin (HE) pada sediaan
(preparat) duodenum mencit percobaan ... 71 3. Diagram alir pewarnaan Periodic acid Schiff (PAS) pada sediaan
(preparat) duodenum mencit percobaan ... 72 4. Uji statistik(ANOVA) dengan SAS 9.1 terhadap % kerusakan vili
duodenum pada kelompok mencit yang diberi total radiasi 5.3 mSv
dan masa pemulihan ... 73 5. Uji statistik (ANOVA) dengan SAS 9.1 terhadap jumlah sel goblet
di duodenum pada kelompok mencit yang diberi total radiasi 5.3 mSv
dan masa pemulihan ... 75 6. Uji statistik (ANOVA) dengan SAS 9.1 terhadap jumlah kripta di
duodenum pada kelompok mencit yang diberi total radiasi 5.3 mSv
dan masa pemulihan ... 77 7. Uji statistik (ANOVA) dengan SAS 9.1 terhadap jumlah sel radang
di duodenum pada kelompok mencit yang diberi total radiasi 5.3 mSv
dan masa pemulihan ... 79 8. Uji statistik (ANOVA) dengan SAS 9.1 terhadap tinggi vili di duo-
denum pada kelompok mencit yang diberi total radiasi 5.3 mSv
1.
PENDAHULUAN
1.1 Latar Belakang
Radiasi sinar-X pertama kali ditemukan oleh Wilhelm Conrad Roentgen di Jerman pada November 1895 (Turner 2007). Menurut Thrall (2002), energi yang dihasilkan oleh sinar-X merupakan energi radiasi ionisasi yang berbahaya bagi kesehatan jika penggunaanya tidak memenuhi aturan baik secara prosedur maupun besaran dosis. Kerusakan yang disebabkan oleh energi radiasi sinar-X dapat berupa kerusakan langsung terjadi yang disebut dengan deterministic effect
dan kerusakan tertunda untuk kurun waktu tertentu berupa stockastick effect
(Little 2003). Kerusakan oleh radiasi ionisasi akan menyebabkan terjadinya apoptosis pada sel (Wahl dan Carr 2001; Bratton dan Cohen 2001).
Menurut Thrall (2002), apoptosis pada sel disebabkan oleh terbentuknya pasangan elektron bebas dengan sel tubuh berupa radikal bebas sehingga terjadi efek ionisasi pada jaringan. Penyebab lainnya ialah adanya reaksi antara sinar-X dengan DNA dalam sel yang mengakibatkan kerusakan basa nukleotida dan DNA
cross linkage. Jika efek tersebut tidak dapat diminimalisir dan diperbaiki secara
enzimatis, maka akan mengakibatkan kematian sel atau apoptosis. Beberapa organ yang peka terhadap sinar-X diantaranya organ hematopoiesis, gastrointestinal, limfoid atau imun dan testis atau sel spermatozoa (Smirnova 2011; Brooks 2005). Radiasi sinar-X pada beberapa dekade terakhir digunakan sebagai sarana penunjang radiodiagnostik dan radioterapi baik di dunia kedokteran manusia pun kedokteran hewan (Smirnova 2011). Penunjang radiodiagnostik yang sering diaplikasikan dalam bidang medis ialah roentgen. Roentgen sangat menunjang dalam penegakkan diagnosa, treatment yang akan dilakukan terhadap pasien dan
Radiodiagnostik maupun radioterapi tidak selalu memberi efek baik akan tetapi juga terdapat efek buruk pada sel atau jaringan. Jaringan yang terpapar sinar-X akan mengalami efek langsung berupa kerusakan DNA dalam sel maupun efek tidak langsung berupa dekomposisi radiolisis pada sel. Efek yang terjadi pada sel atau jaringan akan berbeda-beda sesuai dengan sensitivitasnya terhadap radiasi sinar-X. Organ gastrointestinal atau usus merupakan salah satu organ yang sangat sensitif terhadap paparan radiasi sinar-X (USNRC 2000). Menurut Thrall (2002), organ gastrointestinal atau usus yang tersusun atas sel-sel yang aktif membelah, seperti epitel silindris selapis yang terdapat pada permukaan mukosa organ. Efek sinar-X terhadap sel-sel yang aktif membelah memiliki probabilitas kerusakan yang lebih besar dari pada sel-sel yang tidak aktif membelah.
Dengan adanya efek buruk dari paparan radiasi sinar-X tersebut maka dibutuhkan adanya senyawa radioprotektif berupa antioksidan untuk mengoptimalkan manfaat pengaplikasian sinar-X di dunia kedokteran. Kini pemanfaatan antioksidan dari tanaman tradisional atau herbal banyak diminati masyarakat. Salah satunya ialah rosela (Hibiscus sabdariffa L.). Rosela merupakan tanaman tropis yang banyak ditemukan di Indonesia. Penelitian tentang rosela sebagai tanaman obat tradisional dalam bentuk sediaan teh merah untuk pengobatan berbagai jenis penyakit sudah dilaporkan oleh Khosravi et al.
(2009). Namun penelitian mengenai potensi tanaman rosela (Hibiscus sabdariffa
L.) dalam radiasi ionisasi diagnostik dosis rendah secara berulang belum pernah dilaporkan.
1.2 Tujuan Penelitian
Mengetahui potensi radioprotektif ekstrak kelopak rosela (Hibiscus sabdariffa L.) terhadap duodenum mencit (Mus musculus) dengan radiasi ionisasi
radiodiagnostik berulang.
1.3 Manfaat
2. TINJAUAN PUSTAKA
2.1 Radiasi
Radiasi adalah pemancaran atau pengeluaran dan perambatan energi menembus ruang atau sebuah substansi dalam gelombang atau partikel. Partikel radiasi terdiri dari atom atau sub-atom yang mempunyai massa dan bergerak, menyebar dengan kecepatan tinggi menggunakan energi kinetik (Anonimous 2011). Berdasarkan kemampuan dalam ionisasi, radiasi terbagi dalam dua jenis yaitu radiasi ionisasi dan radiasi non-ionisasi.
Radiasi ionisasi didefinisikan sebagai suatu radiasi yang memiliki energi yang cukup untuk memindahkan elektron dari molekulnya serta mampu merusak ikatan kimia. Radiasi ionisasi merupakan radiasi elektromagnetik berupa sinar-x dan sinar-ɤ atau partikel sub-atom berupa proton, neutron, dan partikel-α dan (NCR 2006) (Gambar 1). Menurut Fajardo et al. (2001), radiasi ionisasi dapat
merusak keutuhan ikatan molekul dan perubahan partikel atau ion. Konsekuensi proses ini pada tubuh meliputi perubahan kimiawi sel berupa inisiasi kematian sel dan potensi berbahaya lainnya.
Gambar 1 Daya tembus radiasi ionisasi (partikel radiasi alpha, beta, gamma, x-ray, dan neutron) (Anonimous 2012).
2.1.1 Sinar- X
Volt. Gelombang ini lebih pendek dari panjang gelombang sinar ultra violet (Thrall 2002).
2.1.2 Pemanfaatan Sinar-X dalam Dunia Medis
Sejak pertama kali sinar-X ditemukan sudah berkembang sangat pesat sebagai sarana radiodiagnostik untuk menghasilkan gambaran medis. Dunia kedokteran hewan memanfaatkan sinar-X sejak tahun 1970 di Eropa. Ilmu yang mempelajari berbagai hal yang berkaitan dengan pemanfaatan energi radiasi disebut dengan radiologi. Pemanfaatan energi radiasi ini dapat dimanfaatkan sebagai sarana radiodiagnostik dan radioterapi. Radiografer memanfaatkan sinar-X untuk menghasilkan gambaran diagnostik yang dapat membantu mendeteksi berbagai kelainan baik pada jaringan lunak maupun jaringan keras seperti tulang (Thrall 2002; McCurnin dan Bassert 2006).
RÖntgen merupakan sarana radiodiagnostik yang sudah berkembang
dengan pesat dalam menunjang diagnosa. RÖntgen atau sinar-X menghasilkan
energi radiasi ionisasi yang berbahaya bagi kesehatan. Sejak tahun 2005 pemerintah Amerika Serikat memasukan sinar-X dalam daftar penyebab terjadinya kanker. Penggunaan sarana radiodiagnostik sinar-X di Indonesia diawasi oleh Badan Pengawas Tenaga Nuklir (BAPETEN) (Ulum dan Noviana 2008).
Menurut Nicholas dan Robert (2007) radioterapi ialah pemanfaatan radiasi sinar-X atau sinar-Gamma yang dipajankan terhadap sel-sel malignan. Pada masing-masing penyakit malignan digunakan dosis dan frekuensi paparan yang berbeda. Menurut Tjokronagoro (2001) dalam Riyatun (2011), radioterapi didefinisikan sebagai pemanfaatan sinar-X untuk memberikan efek terapi terhadap sel-sel yang mengalami mitosis berlebihan atau sel kanker. Radiasi akan merusak sel-sel kanker sehingga proses multiplikasi atau pembelahan sel-sel kanker akan terhambat.
2.1.3 Efek Radiasi Ionisasi
radiasi ionisasi sinar-X dapat menyebabkan kerusakan luar biasa pada jaringan tubuh yang terpapar. Jumlah radiasi ionisasi terendah yang mampu menginisiasi terbentuknya kanker adalah 50 mSv. Badan pengawas Nuklir Amerika Serikat atau disebut NCR (Nuclear Regulatory Commision) membatasi jumlah dosis okupasional pada orang dewasa tidak boleh melebihi 0.05 Sv (5 rem/tahun) (Thrall 2002).
BAPETEN sebagai badan pengawas tenaga nuklir nasional di Indonesia mengatur bahwa dosis maksimum pekerja radiasi adalah 20 mSv rata-rata dalam 5 tahun (Ulum dan Noviana 2008). Dosis 50 mSv/tahun yang diterima dari radiasi alam di berbagai bagian bumi tidak berbahaya bagi penduduk setempat. Akan tetapi pada dosis 100 mSv/tahun memacu terjadinya kanker dengan semakin meningkatnya dosis yang diterima. Kejadian kanker terjadi pada 5 dari 100 orang atau sekitar 5% dengan dosis 1000 mSv. Kejadian umum berupa kanker pada dosis tersebut sekitar 25% dan mampu meningkat menjadi 30%.
Semua jaringan baik hewan maupun manusia sangat sensitif terhadap radiasi. Penyerapan radiasi dosis rendah dari sinar RÖntgen oleh jaringan akan
2.2 Rosela (Hibiscus sabdariffa L.)
2.2.1 Karakteristik Rosela (Hibiscus sabdariffa L.)
Tanaman rosela (Hibiscus sabdariffa L.) merupakan tanaman dari genus hibiscus yang banyak ditemukan di wilayah tropis. Rosela termasuk ke dalam anggota famili Malvaceae yang dapat tumbuh baik di daerah beriklim tropis dan subtropis. Habitat asli rosela terbentang dari India hingga Malaysia (Maryani dan Kristiana 2005). Gambar 2 dapat dilihat gambar rosela yang tumbuh di Indonesia.
Gambar 2 Tanaman rosela (Maryani dan Kristiana 2005).
Klasifikasi ilmiah rosela (Hibiscus sabdariffa L.) menurut Widyanto dan Nelistya 2009:
kelas : Plantae ordo : Malvales famili : Malvaceae genus : Hibiscus
spesies : H. sabdariffa L.
cm dan lebar 5-8 cm. Akar yang menopang batangnya berupa akar tunggang (Widyanto dan Nelistya 2009).
2.2.2 Pemanfaatan Rosela (Hibiscus sabdariffa L.) dalam Masyarakat
Penelitian tentang rosela sebagai tanaman obat tradisional dalam bentuk sediaan teh merah untuk pengobatan berbagai jenis penyakit sudah dilaporkan oleh Khosravi et al. (2009). Sedangkan efek rosela dalam melawan tetra-butyl hydroperoxide yang memiliki toksisitas pada hati juga sudah dilaporkan
sebelumnya oleh Wang et al. (2000).
Tanaman Rosela (Hibiscus sabdariffa L.) dimanfaatkan sebagai bahan
obat tradisional untuk mengobati berbagai kasus penyakit seperti hipertensi, infeksi saluran perkemihan, dan kardioprotektif (Wang et al. 2000; Odigie et al.
2003; Olaleye 2007), sebagai antioksidan dan memiliki efek hepatoprotektif pada berbagai hewan (Amin dan Hamza 2005). Berdasarkan penelitian yang dilakukan oleh Rostinawati (2008), ekstrak etanol rosela mempunyai aktivitas terhadap
Mycobacterium tuberculosis galur H37Rv dan Mycobacterium tuberculosis galur Labkes-026 (multi-drug resisten).
Rosela masih belum banyak dimanfaatkan di bidang kedokteran Indonesia. Minuman berbahan rosela beberapa tahun terakhir mulai banyak dikenal sebagai minuman kesehatan. Bahan minuman dari rosela seperti sirup dan teh juga sudah dapat diperoleh di pasar swalayan. Pemanfaatan dan khasiat rosela dalam dunia pengobatan sudah tidak asing lagi di negara-negara lain (Maryani dan Kristiana 2005). Penduduk di Meksiko termasuk juga Afrika dan Asia, telah memanfaatkan tanaman ini untuk berbagai keperluan pengobatan herbal dengan memanfaatkan berbagai bagian dari tanaman ini (Khosravi et al. 2009).
2.2.3 Komposisi Kimia Rosela (Hibiscus sabdariffa L.)
Tanaman Rosela (Hibiscus sabdariffa L.) banyak mengandung anthocyanin dan vitamin C. Sediaan kering dari ekstrak bunga rosela mengandung
flavonoid seperti gesypetin, hibiscetine, dan sabdaretine. Pigmen dari bunga
sebagian besar terdiri atas hibiscin yang telah diidentifikasi sebagai
(chrysanthenin) dan delphnidin juga teridentifikasi dalam jumlah kecil (Wang et al. 2000). Menurut Maryani dan Kristiana (2005), secara umum komposisi
kelopak bunga rosela dapat dilihat pada Tabel 1 yang disajikan sebagai berikut.
Tabel 1 Kandungan gizi dalam 100 g kelopak segar bunga rosela
Zat Jumlah Zat Jumlah
Kalori 44 kal Besi 3.8 mg
Air 86.2 % Betakaroten 285 mg
Protein 1.6 g Asam askorbat 14 mg
Lemak 0.1 g Tiamin 0.04 mg
Karbohidrat 1.1 g Riboflavin 0.6 mg
Serat 2.5 g Niasin 0.5 mg
Abu 1.0 g Sufida -
Kalsium 160 mg Nitrogen -
Fosfor 60 mg
Sumber: Maryani dan Kristiana (2005)
Berdasarkan Tabel 1 diketahui bahwa rosela memiliki kadar air yang tinggi dan 2.5 % kandungannya ialah serat yang sangat dibutuhkan tubuh dalam proses pencernaan. Sedangkan hasil pengujian fisikokimia kelopak bunga rosela dapat dilihat pada Tabel 2 di bawah ini.
Tabel 2 Hasil uji fisikokimia dalam 100 g kelopak segar bunga rosela
Nama Senyawa Jumlah
Campuran asam sitrat dan asam malat 13%
Antosianin yaitu gossypetin dan hisbiscin 2%
Vitamin C 0.004-0.005%
Protein 14.6%
Sumber: Maryani dan Kristiana (2005)
Tabel 3 Hasil uji fitokimia ekstrak kelopak bunga rosela
Nama sampel Parameter uji Hasil Satuan Teknik analisa
Ekstrak kelopak bunga Rosela
Fitokimia
Alkaloid
Wagner positif - kualitatif
Meyer positif - kualitatif
Dragendorf positif - kualitatif
Hidroquinon negatif - kualitatif
Tanin positif - kualitatif
Flavonoid positif - kualitatif
Saponin positif - kualitatif
Steroid negatif - kualitatif
Triterpenoid negatif - kualitatif
Ket: Hasil pengujian fitokimia ekstrak kelopak bunga Rosela, Pusat Studi Biofarmaka LPPM IPB No. sertifikat 008/I3.11.8/LUB-CA/XI/2010 [18 November 2010].
Berdasarkan Tabel 3 yang disajikan di atas dapat diketahui senyawa aktif yang paling berpengaruh dalam penelitian. Fitokonstituen yang ditemukan dalam ekstrak bunga rosela berupa flavonoid, polisakarida, dan asam organik, berpengaruh terhadap aktivitas farmakologinya (Husaini et al. 2004). Bunga
rosela diketahui memiliki asam sitrat, tanin, dan glukosida seperti delfinidin-3-monoglukosida dan delfinidin yang pada konsentrasi tinggi bersifat toksik bagi
jaringan hewan dan manusia (Ojokoh 2002). Tanin merupakan senyawa fenol dimana derajat hidroksilasi dan ukuran molekulnya dapat membentuk komplek dengan protein (Ojokoh 2006). Menurut Aletor (1993), asam sitrat memiliki kemampuan mengikat logam, membentuk komplek dengan protein. Penelitian sebelumnya dilaporkan bahwa glukosida sianogenik secara umum bersifat menghambat proses katalisis enzim.
2.3 Mencit (Mus musculus)
memiliki potensial reproduksi yang tinggi, masa kebuntingan yang singkat, jangka hidup yang pendek, berukuran kecil, dan harga relatif murah (Sirois 2005). Gambar mencit disajikan pada Gambar 2.
Gambar 3 Mencit strain DDY (Laboratorium Patologi FKH IPB).
Mencit di atas memiliki sistem taksonomi sebagai berikut (Besselsen 2004) :
kingdom : Animalia filum : Chordata subfilum : Vertebrata kelas : Mamalia subkelas : Theria ordo : Rodensia famili : Muridae genus : Mus
spesies : Mus musculus
Mus musculus sering dijadikan sebagai hewan percobaan. Berbagai macam strain mencit yang dapat digunakan inbred maupun outbred dengan karyotipnya yang telah diketahui. Pada kenyataannya, susunan genom mencit telah banyak diketahui dari pada spesies lain. Oleh karena itu mencit banyak digunakan sebagai hewan coba mengenai genom mencit (Wolfensohn dan Lloyd 1998).
fisiologisnya. Diagnosis penyakit yang disebabkan oleh antraks dan rabies sebaiknya menggunakan hewan coba mencit, sedangkan diagnosis penyakit akibat
enterobaktericeae dapat menggunakan hewan coba mencit maupun tikus. Hewan
percobaan kelinci baik digunakan pada penelitian mengenai hiperkolesterolemia karena peka terhadap kolesterol dan dapat menyimpan lemak tubuh dalam jumlah yang besar. Berbeda dengan anjing, kucing, dan tikus yang resisten terhadap pakan yang mengandung kolesterol (Sirois 2005).
Mus musculus memiliki ciri ukuran tubuh yang kecil sehingga mudah
ditangani dan dikembangbiakkan. Ekor mencit hanya ditutupi oleh rambut-rambut halus. Berbeda dengan tikus dan mamalia lain, sumsum dari tulang panjang mencit selalu aktif seumur hidupnya. Sama halnya dengan tikus, mencit memiliki beberapa kelenjar diantaranya, saliva, paratoid (serous), submaxillary, dan sublingual. Ditemukan pula kelenjar Harderian. Mencit memiliki sinus orbitalis sedangkan tikus memiliki plexus orbitalis. Rata-rata umur Mus musculus 1 sampai 3 tahun dengan berat badan umum mencit jantan dewasa berkisar 20 sampai 40 gram dan betina 22 sampai 63 gram. Mencit memasuki usia dewasa pada umur 6 minggu, masa bunting selama 19 sampai 21 hari (Sirois 2005).
Penelitian ini menggunakan Mus musculus dengan strain DDY (Deutch Democratic Yokohama) yang sering digunakan dalam banyak penelitian tentang malformasi dan imunologi. Strain ini sangat baik untuk penelitian mengenai malformasi hewan yakni sensitifitas terhadap efek letal radiasi embrio mencit pada tahap preimplantasi, sehingga dapat mempengaruhi hereditas. Sedangkan dalam penelitian imunologi, timbulnya penyakit pada strain ini tidak tinggi, kemungkinan disebabkan oleh latar belakang genetik yang heterogen. Selain itu strain DDY juga dilaporkan mempunyai perkembangan yang cepat, berumur panjang, dan memproduksi immunoglobulin A (Ig A) yang mirip dengan manusia (Gu et al. 2002; Miyawaki et al. 1997).
seperti kucing dan anjing; (3) primata, seperti Macaca dan babon, (4) hewan domestik besar, seperti domba, sapi, dan (5) kelompok hewan lainnya, seperti unggas.
2.4 Duodenum
2.4.1 Anatomi dan Histologi Duodenum
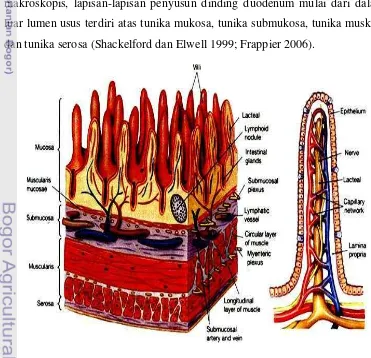
[image:30.595.109.480.379.737.2]Duodenum merupakan bagian dari usus halus yang berperan dalam sistem pencernaan. Fungsi utama saluran pencernaan yaitu mencerna dan memecah makanan di dalam lumennya menjadi molekul yang lebih kecil dan sederhana yang bisa diserap oleh sirkulasi tubuh untuk menunjang kehidupan organisme (Frappier 2006). Duodenum merupakan organ tubular yang terbentang dari pilorus ke usus besar (Genesser 1994). Panjang usus halus mulai pilorus sampai ileum mencit dewasa kira-kira 35 cm, sedangkan panjang usus besar mulai kolon sampai sekum mencit dewasa kira-kira 14 cm (Shackelford dan Elwell 1999). Secara makroskopis, lapisan-lapisan penyusun dinding duodenum mulai dari dalam ke luar lumen usus terdiri atas tunika mukosa, tunika submukosa, tunika muskularis, dan tunika serosa (Shackelford dan Elwell 1999; Frappier 2006).
Secara mikroskopis, lapisan-lapisan penyusun dinding duodenum (usus halus) mulai dari dalam ke luar terdiri atas tunika mukosa, tunika submukosa, tunika muskularis, dan tunika serosa (Gambar 4) (Shackelford dan Elwell 1999; Frappier 2006). Dinding duodenum kaya akan pembuluh darah yang mengangkut zat-zat nutrisi menuju hati melalui vena porta. Di dinding duodenum melepaskan lendir, air dan sejumlah kecil enzim. Lendir yang dihasilkan b e r f u ng s i u nt u k me lumasi isi usus, air untuk membantu melarutkan molekul-molekul makanan yang dicerna, dan sejumlah kecil enzim yang membantu proses pencernaan (Guyton dan Hall 1997). Struktur histologi duodenum disajikan pada Gambar 5.
Gambar 5 Struktur histologi duodenum. (S) serosa, (ME) muskularis eksterna, (L) longitudinal, (C) sirkular, (SubM) submukosa, (BGI) kelenjar Brunner, (D) duktus kelenjar Burner, (MM) muskularis mukosa, (Muc) mukosa, dan (V) vili (Ross et al. 2002).
Tunika mukosa terdiri atas epitel, kelenjar intestinal, dan lamina propria. Bagian tunika submukosa dapat dilihat adanya kelenjar Brunner atau elenjar submukosa yang hanya terdapat pada bagian pangkal duodenum (Frappier 2006). Epitel usus halus berbentuk epitel kolumnar selapis yang terdiri atas sel absortif, sel goblet, sel endokrin dan sel peaneth (Genesser 1994). Lamina propria terdiri atas jaringan ikat retikuler dan fibroplastik yang longgar dan kaya pembuluh darah, buluh khil (lacteal), saraf maupun otot licin (Shackelford dan Elwell 1999).
khas usus halus. Vili tersusun atas kumpulan sel epitel silindris sebaris yang berjejer dan jaringan ikat longgar lamina propria (Junqueira dan Carneiro 2005).
Tinggi vili ini bervariasi bergantung pada daerah dan jenis hewannya. Pada karnivora, vili langsing dan panjang, sedangkan pada sapi vili pendek dan lebar. Panjang vili usus halus pada mencit dewasa lebih panjang dari pada mencit neonatus (Shackelford dan Elwell 1999). Sehingga luas permukaan ditingkatkan oleh mikrovili. Mikrovili merupakan penjuluran sitoplasma pada permukaan bebas epitel vili. Vili dan mikrovili berfungsi memperluas permukaan usus halus sehingga penyerapan lebih efisien (Dellmann dan Brown 1992). Kerusakan mikrovili dan atrofi vili usus halus dapat mengganggu penyerapan nutrisi (malabsorbtion syndrome) (Junqueira dan Carneiro 2005).
Secara histologis, duodenum pada manusia maupun hewan memiliki jumlah vili yang banyak, tinggi, dan berbentuk seperti lembaran daun. Duodenum juga memiliki kripta dan kelenjar Lieberkühn dengan jumlah dan keadaan yang paling baik. Selain itu, terdapat kelenjar submukosa (Brunner). Jejenum hampir mirip dengan duodenum tetapi vilinya lebih kecil dan lebih banyak. Jejenum tidak terlalu tampak adanya kelenjar submukosa (Brunner) namun jejenum memiliki banyak sel goblet pada permukaan vilinya. Ileum adalah bagian akhir dari usus halus, bentuk vilinya seperti ibu jari dengan jumlah kelenjar Liberkhün yang sedikit. Ileum memiliki lebih sedikit sel goblet namun dilengkapi dengan jaringan limfatik yang lebih besar yaitu daun Peyer (Junqueira dan Carneiro 2005; Samuelson 2007).
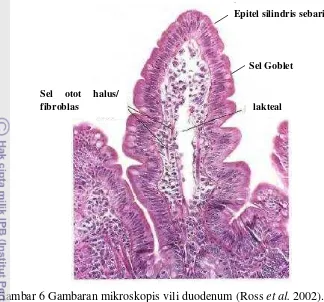
Selain struktur lapis penutupnya, vili memiliki struktur jaringan lunak pada bagian dalam yakni lamina propria. Menurut Ross et al. (2002), lamina propria
Gambar 6 Gambaran mikroskopis vili duodenum (Ross et al. 2002).
Daerah mukosa (Gambar 5), diantara dasar-dasar vili terdapat kelenjar-kelenjar yang meluas ke bagian bawah mukosa yang disebut kripta Lieberkühn. Kripta Lieberkühn memiliki struktur tubular sederhana yang meluas dari daerah muskularis mukosa menuju ke lamina propria. Sel-sel kripta menyediakan sel-sel baru untuk menggantikan sel-sel permukaan vili yang terbuang ke dalam lumen usus (Bevelender dan Ramaley 1988). Menurut Samuelson (2007), di bagian bawah vili baik pada manusia maupun hewan (mamalia dan unggas) terdapat kripta dan kelenjar Lieberkühn yang terdiri atas stem sel atau sel punca, sel goblet, sel Panet dan sel enteroendokrin. Pada mencit dewasa, sel kripta epitel usus bermitosis setiap 10-14 jam dan waktu transit sel dari kripta ke ujung vili terjadi selama 48 jam (Shackelford dan Elwell 1999).
lacteal Sel Goblet
Epitel silindris sebaris
Sel otot halus/
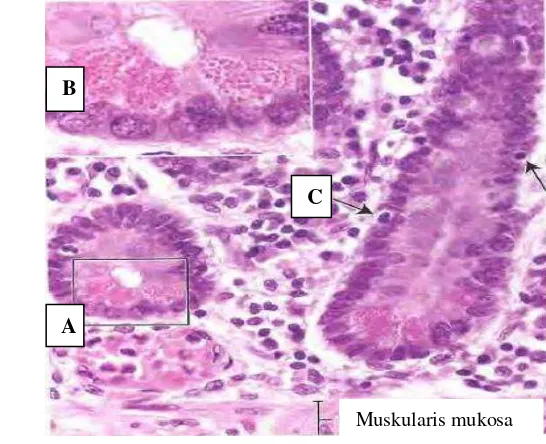
Gambar 7 Histologi submukosa usus A) kripta Lieberkühn, B) sel Paneth usus dan C) limfosit (Ross et al. 2002).
Epitel usus halus berbentuk epitel silindris selapis (Gambar 6) yang terdiri atas sel absortif, sel goblet, sel endokrin dan sel paneth (Genesser 1994). Lamina propria terdiri atas jaringan ikat retikuler dan fibroplastik yang longgar dan kaya pembuluh darah, buluh khil (lacteal), saraf maupun otot licin (Shackelford dan
Elwell 1999). Tunika submukosa (Gambar 5 (SubM)) terdiri atas jaringan ikat longgar, pembuluh darah dan pembuluh limfe yang lebih besar. Duodenum memiliki kelenjar Brunner (Genesser 1994). Pada hewan dewasa lapisan ini ditemukan banyak limfosit, sel plasma, makrofag, eosinofil, dan sel mast (Schackelford dan Elwell 1999).
Tunika muskularis terdiri atas lapisan eksterna yang mempunyai serabut otot longitudinal dan lapisan interna yang mempunyai serabut otot halus berbentuk sirkuler (Schackelford dan Elwell 1999). Kedua lapisan ini dipisahkan oleh suatu jaringan ikat berisi pleksus saraf parasimpatis yang disebut pleksus Mesenterikus atau Auerbach’s (Genesser 1994). Suplai darah untuk usus halus diberikan melalui cabang-cabang dari arteri mesenterica celiaca dan cranialis
yang menembus tunika muskularis kemudian tunika submukosa (Frappier 2006). Lapisan terluar usus halus atau tunika serosa (Gambar 5 (S)) terdiri atas lapisan mesotel dengan jaringan ikat subserosa di bawahnya (Genesser 1994; Frappier 2006).
Muskularis mukosa
B
A
2.5 Kondisi Patologis Pada Sel Usus 2.5.1 Apoptosis Epitel Usus
Apoptosis adalah suatu proses kematian sel terprogram, diatur secara genetik, bersifat aktif, ditandai dengan adanya kondensasi kromatin, fragmentasi sel dan fagositosis sel tersebut oleh sel tetangganya (Cotran et al.1999; D’amico
dan McKenna 1994). Menurut Kresno (2001), apoptosis merupakan proses penting dalam pengaturan homeostasis normal, proses ini menghasilkan keseimbangan dalam jumlah sel jaringan tertentu melalui eliminasi sel yang rusak dan proliferasi fisiologis sehingga mampu memelihara agar fungsi jaringan normal. Kejadian apoptosis memiliki tujuan untuk menjaga homeostasis sel di jaringan selain itu pula sebagai suatu mekanisme pertahanan seperti reaksi imun. Deregulasi apoptosis mengakibatkan keadaan patologis, termasuk proliferasi sel secara tidak terkontrol seperti dijumpai pada kanker (Cotran et al. 1999).
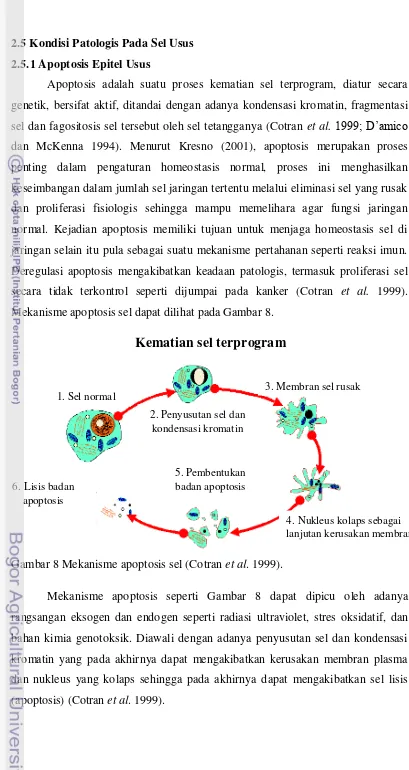
[image:35.595.102.511.49.819.2]Mekanisme apoptosis sel dapat dilihat pada Gambar 8.
Gambar 8 Mekanisme apoptosis sel (Cotran et al. 1999).
Mekanisme apoptosis seperti Gambar 8 dapat dipicu oleh adanya rangsangan eksogen dan endogen seperti radiasi ultraviolet, stres oksidatif, dan bahan kimia genotoksik. Diawali dengan adanya penyusutan sel dan kondensasi kromatin yang pada akhirnya dapat mengakibatkan kerusakan membran plasma dan nukleus yang kolaps sehingga pada akhirnya dapat mengakibatkan sel lisis (apoptosis) (Cotran et al. 1999).
2. Penyusutan sel dan kondensasi kromatin
Kematian sel terprogram
1. Sel normal 3. Membran sel rusak
5. Pembentukan badan apoptosis
4. Nukleus kolaps sebagai lanjutan kerusakan membran 6. Lisis badan
Menurut Brooks (2005), terdapat tiga prosedur pengaturan sel sebagai respon sel terhadap paparan sinar-X dosis adaptasi (akut). Tiga prosedur tersebut yakni perbaikan DNA, kematian sel melalui mekanisme apoptosis sehingga dapat menurunkan jumlah sel abnormal dan peningkatan fungsi imun, dimana ketiganya berperan potensial untuk mereduksi kejadian kanker pada organisme.
Apoptosis adalah fenomena penting dalam sistem biologi (Rajesh et al.
2009). Paparan radiasi ionisasi menghasilkan efek yang cepat, terjadi kematian sel secara apoptosis (Gambar 9) dari stem cell atau sel punca (Potten 1977). Stem cell
usus bertanggung jawab terhadap repopulasi epitel permukaan pada usus. Jika ada gangguan pada stem sel usus maka akan terjadi perubahan bentuk kripta pada
usus. Dosis yang besar dapat menyebabkan kerusakan kripta disertai dengan adanya gangguan fungsional usus terlihat secara klinis sebagai gangguan akut. Apoptosis dapat terjadi akibat dari adanya induksi iradiasi terhadap usus (Mann 1991; Potten et al. 1994). Apoptosis pada stem sel pada bagian kripta kolon tikus dapat dilihat pada Gambar 9.
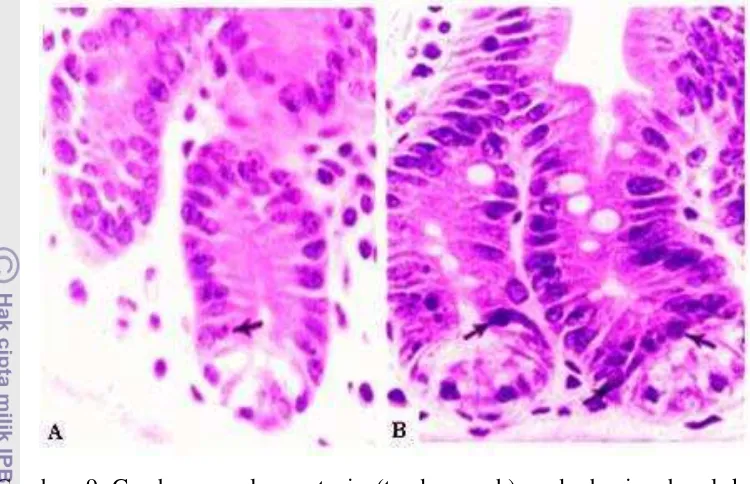
Gambar 9 Gambaran sel apoptosis (tanda panah) pada bagian basal kripta duodenum mencit dengan pewarnaan hematoksilin-eosin (HE) perbesaran 900x (Merritt et al. 1994).
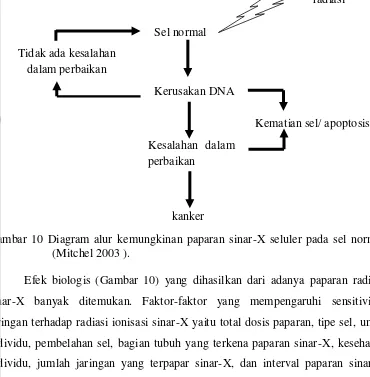
Organ usus dan organ yang memproduksi darah merah sangat sensitif dengan adanya paparan sinar-X dan dapat menimbulkan efek biologis. Efek biologi yang terjadi pada tubuh individu dibagi menjadi dua golongan utama yakni efek biologis yang terjadi secara akut dengan paparan sinar-X dengan dosis tinggi dengan lama paparan yang pendek atau sebentar dan efek biologis yang terjadi secara kronis dengan paparan sinar-X dengan dosis rendah namun lama paparan yang panjang. Paparan sinar-X dengan dosis yang tinggi dapat mengakibatkan kematian sel sedangkan dengan dosis yang rendah dapat mengakibatkan kerusakan sel sehingga banyak jaringan bahkan organ menjadi rusak. Hal ini dapat mempengaruhi respon keseluruhan tubuh secara cepat dan sering dikaitkan dengan Acute Radiation Syndrome (ARS) (USNRC 2000).
[image:37.595.116.491.80.322.2]Gambar 10 Diagram alur kemungkinan paparan sinar-X seluler pada sel normal (Mitchel 2003 ).
Efek biologis (Gambar 10) yang dihasilkan dari adanya paparan radiasi sinar-X banyak ditemukan. Faktor-faktor yang mempengaruhi sensitivitas jaringan terhadap radiasi ionisasi sinar-X yaitu total dosis paparan, tipe sel, umur individu, pembelahan sel, bagian tubuh yang terkena paparan sinar-X, kesehatan individu, jumlah jaringan yang terpapar sinar-X, dan interval paparan sinar-X yang diterima (USNRC 1999).
2.5.2 Degenerasi Epitel dan Atrofi Vili Usus
Degenerasi diartikan sebagai perubahan-perbahan morfologik akibat kerusakan-kerusakan yang bersifat non fatal. Perubahan-perubahan tersebut masih dapat pulih kembali (reversible). Perubahan-perubahan tersebut hanya
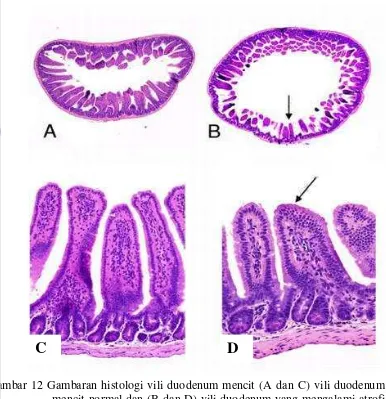
mencerminkan adanya lesio biomolekuler yang telah berjalan lama dan baru kemudian dapat dilihat. Setiap sel memiliki resiko mengalami kerusakan baik dari faktor internal atau eksternal setiap saat. Oleh karena itu sel memiliki kemampuan untuk menanggulangi tingkat perbaikan tergantung pada besar kecilnya pengaruh lesio yang terjadi serta kemampuan sel akan mengakibatkan sel menjadi sakit atau tetap normal. Lesio-lesio yang terjadi mengakibatkan gangguan metabolisme karbohidrat, protein, dan lemak pada sel. (Himawan 1990). Gambaran vili usus halus yang mengalami degenerasi disajikan pada Gambar 12.
Kesalahan dalam perbaikan
kanker Tidak ada kesalahan
dalam perbaikan
Sel normal
radiasi
Kerusakan DNA
[image:38.595.125.495.93.470.2]Gambar 11 Gambaran histologi duodenum mencit yang mengalami atrofi (tanda panah tipis) dan degenerasi (tanda panah tebal) dengan pewarnaan hematoksilin-eosin (HE) perbesaran 400x (Hummdi LA dan Habash SH 2012).
Gambar 12 Gambaran histologi vili duodenum mencit (A dan C) vili duodenum mencit normal dan (B dan D) vili duodenum yang mengalami atrofi dan dilatasi lumen usus yang ditunjukan dengan tanda panah hitam. Pewarnaan hematoksilin-eosin (HE) perbesaran 200x (Uzal et al.
2009).
[image:40.595.125.511.81.480.2]3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Bagian Bedah dan Radiologi serta Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor (IPB) pada bulan Maret 2010 sampai September 2011.
3.2 Materi
3.2.1 Hewan Coba
Penelitian ini bersifat eksperimental menggunakan hewan coba sebagai model. Hewan coba yang digunakan dalam penelitian ini yaitu 24 ekor mencit jantan (Mus musculus) dengan rata-rata umur 4 minggu dengan bobot awal 18-20
gram. Mencit yang digunakan merupakan mencit strain ddy dan diberi pre-treatment sebelum dikawinkan. Mencit jantan tersebut diperoleh dari pembiakan di Fakultas Kedokteran Hewan IPB.
3.2.2 Ekstrak kelopak bunga Rosela
Penelitian ini menggunakan ekstrak kelopak bunga rosela dari petani rosela di Dramaga, Bogor, Jawa Barat. Ekstraksi kelopak bunga rosela dilakukan di Balitro (Balai Penelitian Tanaman Obat) Cimanggu, Bogor. Bunga dikeringkan di bawah sinar matahari dan dihaluskan. Tahapan selanjutnya, sebanyak 200 gram serbuk bunga diekstrak dengan etanol 96% pada suhu 40°C.
Pembuatan ekstrak tanaman rosela meliputi proses maserasi dan evaporasi. Maserasi adalah proses perendaman simplisia menggunakan pelarut untuk memperoleh zat aktif dari simplisia tersebut. Proses maserasi dilakukan menggunakan pelarut etanol. Maserat yang telah diperoleh dipisahkan kemudian dievaporasi. Evaporasi merupakan proses pemekatan dengan cara menguapkan pelarut tanpa menjadi kering.
dan pelarut diganti dengan yang baru. Setelah tiga hari, ekstrak yang telah diproses kemudian dipekatkan sehingga diperoleh ekstrak kental dengan bobot tetap. Kemudian diuapkan dengan rotary evaporator hingga didapat ekstrak
kental seberat 125.51 gram dengan rendemen 37.84%. Ekstraksi yang dilakukan dengan maserasi yang merupakan ekstraksi dengan cara dingin. Proses ekstraksi dengan cara dingin relatif lebih aman terhadap zat -zat yang terkandung di dalam simplisia jika dibandingkan dengan penggunaan ekstraksi cara panas karena kemungkinan zat yang terkandung dalam simplisia tersebut bersifat termolabil. Kemudian dilanjutkan dengan freeze drier agar hasil yang didapat konstan sesuai
dengan hasil yang diinginkan (Rostinawati 2009). Maserasi dilakukan oleh Balai Penelitian Tanaman Obat Bogor dan evaporasi dilakukan oleh Laboratorium Bioteknologi di Fakultas Perikanan IPB.
3.2.3 Bahan dan Alat
Bahan yang digunakan dalam pemeliharaan mencit pada penelitian ini yaitu pelet (pakan mencit komersial), air mineral untuk minum mencit, NaCl fisiologis, anthelmentik (Albendazol®), antibiotik (Clavamox®), antifungal (Metronidazol®), dan akuades. Bahan-bahan yang digunakan untuk pewarnaaan histopatologis yaitu sebagai berikut: Larutan Mayers Hematoksilin, Larutan Eosin, alkohol dengan konsentrasi bertingkat (70%, 80%, 90%, 96%), xylol, eter, Buffered Neutral Formalin (BNF) 10%, parafin cair, albumin, metanol dan
permount.
percessor, mikrotom, pencetak parafin, gelas objek, gelas penutup, mikroskop
cahaya, dan alat fotografi mikro.
3.3 Prosedur Penelitian
3.3.1 Aklimatisasi dan Pre- treatment Mencit
Sebelum perlakuan semua mencit diaklimasi untuk menyesuaikan kondisi laboratorium penelitian selama 2 minggu. Mencit tersebut dikelompokkan menjadi 4 kelompok, setiap kelompok terdiri atas 6 ekor mencit. Setiap kelompok mencit dikandangkan dalam kandang yang dimodifikasi (Box plastik dengan ukuran panjang 30 cm, lebar 20 cm, dan tinggi 15 cm dengan tutup yang terbuat dari anyaman kawat untuk tempat pemeliharaan mencit selama penelitian berlangsung; botol yang dilengkapi dengan saluran air sebagai tempat minum mencit). Bentuk dan kondisi kandang dapat dilihat pada Gambar 13 berikut.
Gambar 13 Kandang mencit dengan alas kandang berupa serbuk gergaji.
Mencit jantan diberi pakan komersial dan minum secara ad libitum. Pakan
komersial yang diberikan berbentuk pelet yang dibeli dari tempat penjualan pakan terdekat. Untuk menjaga kebersihan dan kesehatan mencit maka kandang dan alas sekam dibersihkan dan diganti setiap tiga hari sekali.
Pre-treatment yang diberikan pada mencit berupa pencekokan
3.3.2 Perlakuan Terhadap Hewan Percobaan
Mencit dibagi menjadi 4 kelompok perlakuan, yaitu, 1) kelompok kontrol (NaCl fisiologis 0.9 % atau saline) (K), 2) kelompok perlakuan primer (P), 3)
kelompok perlakuan rosela (R), dan 4) kelompok perlakuan rosela primer (RP). Di bawah ini disajikan Tabel 4, pembagian kelompok mencit perlakuan.
Tabel 4 Kelompok mencit perlakuan yang digunakan dalam penelitian ini
Kelompok
mencit Perlakuan
K Mencit kontrol yakni mencit yang tidak diberi radiasi dan NaCl fisiologis 0.9 % (saline) (n=6)
P Mencit primer yakni mencit yang diberi radiasi dan NaCl fisiologis 0.9 % (saline) (n=6)
R Mencit Rosela yakni mencit yang tidak diberi radiasi tetapi diberi ekstrak kelopak rosela (n=6)
RP Mencit rosela primer yakni mencit yang diberi radiasi dan ekstrak kelopak rosela (n=6)
Ket: cekok NaCl fisiologis 0.9 % (saline) pada kelompok kontrol dan ekstrak kelopak rosela dengan dosis 0.2 ml/ekor/ 2 hari. NaCl fisiologis 0.9 % (saline) dan ekstrak kelopak rosela diberikan secara per oral menggunakan sonde lambung.
Semua kelompok diberi perlakuan berdasarkan pembagian kelompok di atas. Masa perlakuan berupa pencekokan rosela dan pemberian paparan radiasi selama 8 minggu. Setelah 8 minggu dilakukan nekropsi pada 3 ekor mencit dari masing-masing kelompok. Tiga ekor sisanya kemudian diberi masa pemulihan tanpa radiasi dan rosella selama 30 hari untuk kemudian dinekropsi. Hasil nekropsi dari masing-masing masa perlakuan akan dibandingkan secara histopatologinya.
3.3.3 Paparan Radiasi
Kelompok mencit yang mendapat radiasi X primer dari mesin sinar-X VR-1020 Medical Corp. Japan, dengan jarak sumber radiasi terhadap mencit dalam kandang 100 cm pada berkas sinar utama. Pemaparan radiasi dilakukan 2 hari sekali dengan dosis perlakuan 0.2 mSv/paparan, waktu paparan per detik selama delapan minggu dengan besar total paparan diukur dengan menggunakan
pen dose MyDrseTM ALOKA CO. LTD Tokyo Japan.
minggu ke-9 sampai minggu ke-12 kelompok mencit perlakuan tidak diberi paparan radiasi dan tanpa pencekokan.
3.3.4 Pemberian Ekstrak Rosela
Mencit yang diterapi dengan ekstrak rosela adalah mencit kelompok R dan RP. Sebelum pemberian ekstrak rosela, mencit direstrain terlebih dahulu secara manual mulai dari belakang telinga sampai dengan dorsal punggung. Ekstrak rosela diencerkan dengan akuadest dengan komposisi 1.5 gram ekstrak dalam 200 ml aquadest, sehingga konsentrasi adalah 7.5 g/ml. Dosis yang digunakan adalah
50 mg/ml/berat badan atau 0.2 ml/ekor/dua hari dengan menggunakan sonde lambung (Akindahunsi dan Olelaye 2003; Ali et al. 2005). Sonde lambung digunakan secara hati-hati sehingga larutan ekstrak rosela tidak masuk ke dalam saluran pernapasan. Pemberian ekstrak rosela dilakukan setiap dua hari sebelum diradiasi dengan sinar-X. Cara pencekokan ekstrak kelopak bunga rosela dapat dilihat pada Gambar 14.
Gambar 14 Pencekokan bahan perlakuan (NaCl dan ekstrak kelopak bunga rosela) pada mencit.
3.3.5 Nekropsi
Setelah mencit kelompok perlakuan 8 minggu dan 12 minggu diberi perlakuan kemudian dilakukan nekropsi pada mencit. Pertama dilakukan penimbangan mencit lalu dianastesi dengan menggunakan kombinasi Ketamin 30 mg/Kg dan Xylazine 5 mg/Kg BBintra peritoneal. Mencit diberi anastesi dengan
usus yang telah diambil dibuka lumennya, setelah itu bagian ujung-ujung usus tersebut disteples pada kertas karton dengan pemukaan dalam dibagian atasnya. Fiksasi kesemua bagian usus yang telah diambil ke dalam larutan Buffer Neutral Formalin atau BNF 10% selama dua hari.
3.3.6 Pembuatan Sediaan Histopatologi
Pembuatan sediaan histopatologi diawali dengan pemotongan tipis pada bagian usus yang telah diawetkan dalam larutan Buffer Neutral Formalin atau
BNF 10% selama dua hari. Bagian usus dipotong dengan lebar 0.5 cm sehingga
dapat dimasukkan kedalam Tissue Casset dan dikelompokkan sesuai kelompoknya. Dehidrasi dilakukan dengan cara merendam sediaan tersebut secara berturut-turut kedalam alkohol 70%, 80%, 90%, alkohol absolut II, xylol I, xylol
II, parafin I dan parafin II. Proses perendaman pada setiap bahan dilakukan selama 2 jam dan berjalan secara otomatis dalam alat automatic tissue processor.
Proses dilanjutkan dengan pencetakkan sampel organ dalam paraffin agar membentuk blok jaringan sehingga dapat dipotong menggunakan mikrotom setebal 5 µm. Potongan blok paraffin berbentuk pita (ribbon), diletakan di atas permukaan air hangat 45°C dengan tujuan untuk menghilangkan lipatan akibat pemotongan. Sediaan diangkat dari permukaan air dengan gelas objek yang telah diulasi larutan albumin yang berfungsi sebagai perekat. Sediaan selanjutnya dikeringkan dalam inkubator suhu 60°C selama 24 jam.
Proses pewarnaan diawali dengan deparafinisasi ke dalam xylol sebanyak dua kali, masing-masing selama dua menit. Sediaan selanjutnya melalui proses rehidrasi. Proses rehidrasi dimulai dari alkohol absolut sampai ke alkohol 80%, yang masing-masing lamanya 2 menit. Sediaan selanjutnya dicuci dengan air mengalir dan dikeringkan. Sediaan yang telah kering diwarnai dengan pewarnaan Mayer’s Hemaktosilin selama 8 menit, dibilas dengan air mengalir, dicuci dengan pewarna Eosin selama dua menit. Sediaan kemudian dicuci dengan air mengalir untuk menghilangkan warna Eosin yang berlebih sebelum akhirnya dikeringkan.
permount, ditutup dengan gelas penutup, dan dibiarkan kering sesuai dengan
metode Bagian Patologi Fakultas Kedokteran Hewan IPB. Sediaan siap dilihat dan setelah perekat kering diamati menggunakan mikroskop cahaya.
Selain pewarnaan Hematoksilin-eosin (HE) seperti yang dijelaskan di atas, dilakukan pula pewarnaan Periodic Acid Schiff (PAS) untuk melihat sel goblet
lebih jelas. Pewarnaan Periodic Acid Schiff (PAS) diawali dengan deparafinisasi,
kemudian preparat dibilas dengan akuades lalu direndam kedalam larutan asam asetat 1% selama 5 menit dan dibilas kembali dengan akuades. Preparat selanjutnya dioksidasi dalam periodc acid 1% selama 5-10 menit, lalu bilas
dengan akuades tiga kali masing-masing 5 menit. Preparat dimasukkan kedalam
schiff reagent selama 15-30 menit, dibilas lagi dengan air sulfit (10 % sodium bisulfat (NaHSO3) 10 ml, 1 N HCl 10 ml dan akuadesilata 200 ml) dengan masing-masing 2 menit selama bilasan pada masing-masing larutan. Setelah itu preparat dibilas dengan air kran mengalir selama 10-15 menit lalu dibilas dengan akuades. Terakhir dilakukan dehidrasi dengan xylol kemudian ditetesi perekat
permount, ditutup dengan gelas penutup, dan dibiarkan kering sesuai dengan
metode Bagian Patologi Fakultas Kedokteran Hewan IPB. Sediaan siap dilihat dan setelah perekat kering diamati menggunakan mikroskop cahaya.
3.3.7 Pengamatan Histopatologi
Pengamatan histopatologi dilakukan secara deskriptif maupun kuantitatif menggunakan mikroskop dengan perbesaran 200 kali (20x objektif dan 10x okuler) dan 400 kali (40x objektif dan 10x okuler) serta dibuat foto menggunakan
digital eyepiece camera. Pengambilan foto dilakukan sebanyak 10 lapangan
pandang pada masing-masing kelompok dengan tiga kali perulangan. Rata-rata luas lapang pandang pada foto dengan perbesaran 200 kali ialah 58 987 µm2 sedangkan pada foto dengan perbesaran 400 kali ialah 243 044 µm2. Pengamatan pada bagian usus tersebut ialah untuk melihat a) persentase kerusakan vili usus b) jumlah kripta usus c) jumlah sel goblet, dan d) tinggi vili usus. Untuk perhitungan jumlah sel goblet maka preparat histopatologi usus diberi pewarnaan khusus yakni
3.3.8 Analisis Data
Dalam penelitian ini akan diperoleh data dalam bentuk foto, nilai hasil perhitungan kuantitatif perubahan histopatologi dari bagian usus. Nilai data kuantitatif, yang terdiri atas persentase kerusakan vili usus, jumlah kripta usus, jumlah sel goblet dan tinggi vili usus pada mukosa usus halus sebanyak 10 lapangan pandang, yang ditampilkan dalam bentuk Mean +/- Standar Deviation
dan dilanjutkan dengan Ducan test untuk membandingkan antara kelompok. Kesimpulan dalam perbedaan hasil didapatkan dengan metode one-way ANOVA
untuk menilai multi kelompok. Nilai P<0.05, ditetapkan hasilnya bermakna atau signifikan berbeda nyata.
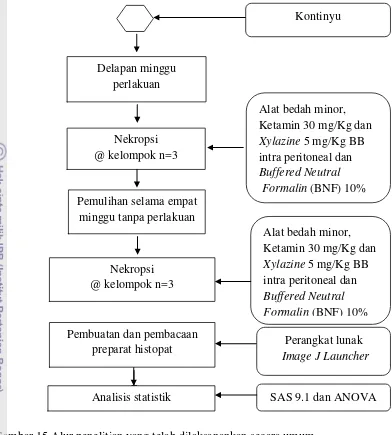
Secara singkat metode penelitian ini dapat digambarkan seperti diagram alur pada Gambar 15.
Ekstraksi kelopak bunga rosela
Persiapan dan aklimatisasi hewan coba
Pengelompokan hewan coba
Kelompok K (Kontrol), n=6 Kelompok P (Primer), n=6 Kelompok R (Rosela), n=6
Kelompok RP (Radiasi rosela), n=6
Pretreatment
selama 2 minggu
Albendazole® 10 mg/kg Clavamox® 125 mg/kg Metronidazole®50 mg/kg
Perlakuan; pencekokan dan radiasi
NaCl fisiologis, sinar- X dan ekstrak kelopak bunga rosela
Gambar 15 Alur penelitian yang telah dilaksanankan secara umum. Delapan minggu
perlakuan
Nekropsi @ kelompok n=3
Pemulihan selama empat minggu tanpa perlakuan
Alat bedah minor, Ketamin 30 mg/Kg dan
Xylazine 5 mg/Kg BB
intra peritoneal dan
Buffered Neutral Formalin (BNF) 10%
Nekropsi @ kelompok n=3
Pembuatan dan pembacaan
preparat histopat Perangkat lunak
Image J Launcher
SAS 9.1 dan ANOVA Analisis statistik
Alat bedah minor, Ketamin 30 mg/Kg dan
Xylazine 5 mg/Kg BB intra peritoneal dan
Buffered Neutral Formalin (BNF) 10%
Radiasi ionisasi memiliki efek yang dikumulasikan dari setiap paparan yang diterima sehingga diperoleh besar dosis total dan hubunganya dengan efek yang terjadi (Hall 2000). Menurut Gorbunov et al. (2010), radiasi ionisasi dapat menyebabkan kerusakan baik fungsi maupun struktur dari suatu sistem tubuh yang peka terhadap radiasi. Sistem tubuh yang peka adalah sistem pencernaan atau gastrointestinal salah satunya usus halus (duodenum). Usus halus merupakan pusat pencernaan makanan, penyerapan nutrisi, dan sekresi endokrin. Menurut Hall (2000), efek akut radiasi terhadap usus halus dapat menimbulkan kerusakan permukaan epitel mukosa usus serta gangguan pencernaan (Gutfeld et al. 2007). Pada penelitian ini dilakukan pengamatan terhadap duodenum usus halus. Parameter yang diamati diantaranya: kerusakan vili, jumlah kripta, jumlah sel goblet, jumlah sel radang, dan tinggi vili.
4.1 Kerusakan Vili Duodenum
Proses pencernaan terjadi pada usus halus yakni berupa penyerapan nutrisi atau produk dari pencernaan yang dilakukan oleh sel-sel epitel atau sel absorptif pada vili (Mescher 2010). Menurut Schiller dan Sellin (2006), keberadaan vili berpengaruh terhadap penyerapan makanan dan kondisi kesehatan saluran pencernaan. Vili yang rusak tidak bisa menyerap makanan secara baik, sehingga asupan nutrisi bagi individu akan berkurang dan kondisi kesehatan menurun. Rataan persentase kerusakan vili usus duodenum dapat dilihat pada Tabel 5.
Tabel 5 Hasil analisis rataan persentase kerusakan vili duodenum (%) dihitung dalam luas lapang pandang 243 044 µm2
Kelompok
Persentase kerusakan vili duodenum (Mean± SD)
Setelah 8 minggu radiasi (5.3 mSv)*
Setelah 4 minggu pemulihan dari radiasi
(tanpa perlakuan)
Kontrol (K) 10.00 ± 0.07b 3.00 ± 0.02c
Primer (P)* 22.67 ± 0.12a 9.67 ± 0.07b
Rosela (R) 18.33 ± 0.11a 11.67 ± 0.09b
Radiasi-Rosela(RP)* 19.00 ± 0.10a 9.00 ± 0.09b
Ket:1. angka yang diikuti dengan huruf superskrip yang sama pada satu kolom pada masing-masing minggu menunjukkan tidak berbeda nyata pada taraf 5%
Analisis statistik rataan persentase kerusakan vili duodenum setelah 8 minggu radiasi menunjukkan hasil berbeda nyata (p<0.05) terhadap kelompok (K) pada seluruh kelompok perlakuan. Namun demikian secara umum rataan persentase kerusakan epitel vili duodenum menunjukkan trend yang meningkat dimulai pada kelompok (K), (R), (RP), dan (P). Rataan persentase kerusakan vili duodenum pada kelompok (P) dan (RP) lebih tinggi dibandingkan dengan kelompok (K). Hal ini diduga karena pemberian radiasi dapat menimbulkan kerusakan pada sel-sel epitel vili. Menurut Somosy Z (2000), sinar radiasi dapat berpenetrasi ke dalam jaringan atau sel tubuh dan mengakibatkan adanya transfer energi radiasi menjadi material biologis. Energi tersebut yang dapat mengakibatkan putusnya ikatan kimia dan menyebabkan proses ionisasi pada atom berbeda pada molekul, termasuk air dan makromolekul biologis essensial seperti DNA, membran lipid, dan protein (Schulte-Forhlinde dan Bothe 1991; Lett 1992). Ini yang mendasari tingginya rataan persentase kerusakan vili pada duodenum mencit pada kelompok perlakuan Primer (P).
Menurut Durovic, Selakovic, dan Spasic-Jokic (2004), pemberian radiasi kronis dosis rendah lebih berbahaya karena dapat menginisiasi peroksidasi lipid dan menghancurkan lapis luar sel. Pemberian radiasi dosis rendah akan menginduksi pembentukan reactive oxygen species (ROS) dan stres oksidatif. Membran sel dan organel-organel sel merupakan target utama yang dapat rusak akibat radikal bebas. Peroksidasi membran sel akan meningkat sejalan dengan penuruan dose rate (efek Petkau). Berdasarkan penelitian Petkau (1999), peroksidasi lipid diproduksi baik karena efek radiasi lingkungan dengan dosis
0.18 μGy/h atau 1.8 x 10-3 mSv hingga dosis total 19 μGy. Petkau berkesimpulan bahwa pemberian radiasi dapat mengganggu mekanisme perbaikan DNA sehingga menyebabkan kerusakan membran sel.
Mekanisme kerusakan sel diawali dari sinar-X yang berpenetrasi ke dalam sel sehingga terjadi reaksi pembentukan radikal bebas dan ROS (reactive oxygen species) di dalam sel. ROS (reactive oxygen species) kemudian
-) bersama dengan radikal hidroksil (OH) akan mengakibatkan peroksidasi lipid dan kerusakan DNA sehingga sel menjadi rusak (Wood, Gibson, dan Garg 2003). Mekanisme kerusakan sel dapat dilihat pada Gambar 16.
Gambar 16 Mekanisme kerusakan sel akibat radiasi (www.vetmed.vt.edu [8 Mei 2012]).
Kelompok (K) tidak memiliki persentase keutuhan vili 100%, diduga disebabkan oleh faktor fisiologis saluran pencernaan. Faktor tersebut yakni adanya makanan (chyme) dari lambung (kondisi asam) yang melewati lumen usus
dan enzim pencernaan atau enterokinase (Dellmann dan Brown 1992). Terlepasnya epitel vili usus halus diartikan sebagai proses deskuamasi epitel vili. Deskuamasi epitel vili usus merupakan kondisi fisiologis dimana epitel vili yang deskuamasi akan digantikan oleh sel-sel epitel dari bagian basal kripta dengan periode 5-7 hari. Kondisi akan berubah patologis apabila ditemukan banyaknya infestasi sel-sel radang pada bagian mukosa vili (Price dan Wilson 1995).
Menurut Yang et al. (2006), hasil penelitian beberapa tahun terakhir
IBS, jaringan usus akan menjadi lebih sensitif terhadap antigen yang berada pada lumen usus dan selanjutnya hadirnya antigen ini akan mengakibatkan respon inflamasi yang berkembang sejalan dengan patofisiologi penyakit. Deskuamisi sel epitel vili menjadi salah satu resiko kondisi sensitifitas ini. Faktor genetik pula memainkan peran dalam proses peradangan namun dapat pula proses sensitifitas ini terjadi tanpa adanya latar be